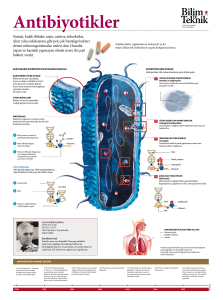
laktik asit bakterileri ve bakteriyofajlarının çeşitli kaynaklardan
advertisement

TÜRKİYE CUMHURİYETİ ANKARA ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ LAKTİK ASİT BAKTERİLERİ VE BAKTERİYOFAJLARININ ÇEŞİTLİ KAYNAKLARDAN İZOLASYONU VE KARAKTERİZASYONU Ayşen GÜMÜŞTAŞ FARMASÖTİK MİKROBİYOLOJİ ANABİLİM DALI YÜKSEK LİSANS TEZİ DANIŞMAN Prof. Dr. Ahmet AKIN 2015- ANKARA TÜRKİYE CUMHURİYETİ ANKARA ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ LAKTİK ASİT BAKTERİLERİ VE BAKTERİYOFAJLARININ ÇEŞİTLİ KAYNAKLARDAN İZOLASYONU VE KARAKTERİZASYONU Ayşen GÜMÜŞTAŞ FARMASÖTİK MİKROBİYOLOJİ ANABİLİM DALI YÜKSEK LİSANS TEZİ DANIŞMAN Prof. Dr. Ahmet AKIN 2015- ANKARA Ankara Üniversitesi Sağlık Bilimleri Enstitüsü Farmasötik Mikrobiyoloji Yüksek Lisans Programı çerçevesinde yürütülmüş olan bu çalışma aşağıdaki jüri tarafından Yüksek Lisans Tezi olarak kabul edilmiştir. Tez Savunma Tarihi: 09/01/2015 Prof. Dr. Ahmet AKIN Ankara Üniversitesi Jüri B~k ı Prof. Dr. Sulhiye YILDIZ Ankara Üniversitesi Prof. Dr. Meral SAOIROOLU Hacettepe Üniversitesi iii İÇİNDEKİLER Kabul ve Onay ii İçindekiler iii Önsöz v Simgeler ve Kısaltmalar vi Şekiller Çizelgeler 1. GİRİŞ viii x 1 1.1. Laktik Asit Bakterilerinin Genel Özellikleri 2 1.1.1. Laktik Asit Bakterilerinin Önemi 5 1.2. Bakteriyofajlar 8 1.2.1. Bakteriyofajların Keşfi 9 1.2.2. Bakteriyofajların Yapısı 10 1.2.3. Bakteriyofajların Konakçı Enfeksiyonu 12 1.2.4. Bakteriyofajların Yaşam Şekilleri 15 1.3. Laktik Asit Bakteri Fajları 19 1.3.1. Laktik Asit Bakterilerinin Fajlara Karşı Direnç Mekanizmaları 20 2. GEREÇ VE YÖNTEM 2.1. Gereç 22 22 2.1.1. Araştırmada Kullanılan Laktik Asit Bakteri ve Bakteriyofaj Kaynakları 22 2.1.2. Bakteri Kaynakları 23 2.1.3. Kullanılan Besiyerleri 26 2.1.4. Kullanılan Kimyasallar ve Çözeltiler 30 2.1.5. Kullanılan Cihazlar 32 2.2. Yöntem 32 2.2.1. Laktik Asit Bakterilerinin Farklı Kaynaklardan İzolasyonu 32 2.2.2. Laktik Asit Bakterilerinin Tiplendirilmesi 33 2.2.3. Laktik Asit Bakterilerinin Patojen Bakterilere Karşı Antagonistik Aktiviteleri 35 2.2.4. Bakteriyofajların Farklı Kaynaklardan İzolasyonu 37 iv 2.2.5. Laktik Asit Bakterilerine Karşı Bakteriyofaj Varlığının Belirlenmesi 39 2.2.6. Bakteriyofajların Saflaştırılması 39 2.2.7. Çift Tabaka Agar Yöntemi ile Bakteriyofaj Titresinin Belirlenmesi 41 2.2.8. Bakteriyofaj Zenginleştirme 42 2.2.9. Geçirimli Elektron Mikroskobu (Transmission Electron Microscope) 44 3. BULGULAR 3.1. Laktik Asit Bakterilerinin İzolasyonu ve Karakterizasyonu 46 46 3.2. Laktik Asit Bakterilerinin Patojen Bakterilere Karşı Antagonist Aktiviteleri 49 3.3. Bakteriyofaj İzolasyonu ve Karakterizasyonu 49 4. TARTIŞMA 63 5. SONUÇ VE ÖNERİLER 68 ÖZET 70 SUMMARY 71 KAYNAKLAR 72 ÖZGEÇMİŞ 75 v ÖNSÖZ Tez konumun seçiminden, tezimin son aşamalarına kadar bana sabır, itina ve hoşgörü ile yardımcı olan değerli danışman hocalarım Prof. Dr. Ahmet AKIN ve Dr. Nina CHANISHVILI’ ye, Yüksek lisans eğitimim boyunca bilimsel birikimlerini paylaşan, desteklerini hiç esirgemeyen sevgili bölüm hocalarım Prof. Dr. Sulhiye YILDIZ, Prof. Dr. Nurten ALTANLAR, Yard. Doç. Dr. Müjde ERYILMAZ’ a, Her zaman yanımda olan, beni cesaretlendiren, çalışmalarım boyunca desteğini hep hissettiğim canım arkadaşım Merve Eylül KIYMACI’ ya, Tez çalışmalarım boyunca benden yardımlarını hiç esirgemeyen, her konuda destek olan, bana hiç yabancılık çektirmeyen sevgili arkadaşlarım Irakli JANASHIA, Elene KAKABADZE, Khatuna MAKALATIA, Nata BAKURADZE’ ye ve tüm Eliava Bakteriyofaj, Mikrobiyoloji ve Viroloji Enstitüsü çalışanlarına, Desteklerini hep hissettiğim sevgili hocalarım Prof. Dr. Sibel A. ÖZKAN, Prof. Dr. Bengi USLU, Prof. Dr. Bezhan CHANKVETADZE’ ye, Tüm eğitim hayatım boyunca benden maddi ve manevi desteğini hiç esirgemeyen, her çıkmazda yanımda olup destekleriyle beni cesaretlendiren canım kardeşim, annem ve babama, yüksek lisans eğitimimde ve tezimin tüm aşamalarında bana olan desteğiyle cesaretlendiren, hep yanımda olan sevgili eşim Mehmet GÜMÜŞTAŞ’a En içten teşekkürlerimi sunarım. vi SİMGELER VE KISALTMALAR Å Bir santimetrenin yüz milyonda biridir. AS Atık su ATP Adenozin trifosfat o Celsius Ca Kalsiyum ÇS Çiğ süt dv Devir dk. Dakika DNA Deoksiribo Nükleik Asit FAO Food and Agriculture Organisation (Gıda ve tarım örgütü) h Hacim IBMV Institute of Bacteriophages, Microbiology and Virology (Bakteriyofaj, Mikrobiyoloji ve Viroloji Enstitüsü) KH2PO4 Potasyum hidrojen ortofosfat M Molar Ma Matsoni MC Mitomisin C Mg Magnezyum µL Mikrolitre mL Mililitre µm Mikrometre (milimetrenin binde biri) mm Milimetre mM Milimolar Na2HPO4 Disodyum hidrojen ortofosfat NAD Nikotinamid Adenin Dinükleotit nm Bir milimetrenin milyarda biridir. PAS Peynir altı suyu C vii RNA Ribo Nükleik Asit rpm Revolutions Per Minute (dakikadaki devir sayısı) sa. Saat TEM Transmission Electron Microscope (Geçirimli elektron mikroskobu) UV Ultraviyole WHO World Health Organization (Dünya sağlık örgütü) viii ŞEKİLLER Şekil 1.1. Laktik asit fermantasyonu. Şekil 1.2. Kuyruklu fajın yapısı. 1, baş; 2, nükleik asit; 3, kapsomer; 4, boyun; 5, kuyruk kını; 6, kuyruk iplikçikleri; 7, kuyruk dikeni; 8, taban plakası; 9, kuyruk. Şekil 1.3. Bakteriyofajın konakçıya adsorbsiyonu. Şekil 1.4. Fajın hücreye penetrasyonu. Şekil 1.5. Fajın bakteri içinde üreme ve gelişme dönemi. Şekil 1.6. Fajın bakteri hücresini lizise uğratması. Şekil 1.7. Faj replikasyonunun tek basamaklı büyüme eğrisi Şekil 1.8. Bakteriyofa yaşam şekilleri. A, litik yaşam döngüsü; B, lizojenik yaşam döngüsü. Şekil 2.1. Gram boyama. Şekil 2.2. Paralel çizgi metodu. a, çizgi şeklinde inokule edilen test bakterisi (laktik asit bakterisi); b, test bakterisine dikey çizgi şeklinde inoküle edilen patojen ya da diğer laktik asit bakterileri; c, inkübasyondan sonra gözlemlenen sonuçlar. Şekil 2.3. Kuyu-difüzyon yöntemi. A, Laktik asit bakterilerinin petri kabı içine inokülasyonu; B, agar üzerine kuyuların açılması; C, kuyuların içerisine indikatör bakterilerin ilavesi; D, oluşan inhibisyon zonlarının ölçümü. Şekil 2.4. Çift tabaka agar yöntemi. Şekil 2.5. Faj zenginleştirme. Şekil 3.1. Bile Esculin Testi sonucunda pozitif sonuç veren bir petri görünümü. Şekil 3.2. Lactobacillus 59 suşu üzerinde SR3 fajının plak morfolojisinin görünümü. Şekil 3.3. Çift tabaka agar yöntemi sonuçlarının görünümü. A, Lactobacillus 59 üzerine ekilen MR3 fajı (faj seyreltmesi 10-5); B, Lactobacillus 59 üzerine ekilen SR3 (faj seyreltmesi 10-10) fajı. Şekil 3.4. Spot test sonucunu gösteren bir petri kabı. Şekil 3.5. MC test sonuçlarını gösteren fotoğraflar; her üç resim için sağ tarafta bulunanlar test tüpleri, soldakiler ise kontrol gruplarıdır. a, Lactobacillus 59; b, Lactobacillus 53S; c, Lactobacillus 58B. ix Şekil 3.6. Spot test sonuçlarının görünümü. A, Lactobacillus 53S ve 58B’ ye karşı Lactobacillus SR3 fajı; Lactobacillus 53S ve 58B’ ye karşı Lactobacillus MR3 fajı; B, Lactobacillus Kd3’ e karşı Lactobacillus MC 59 fajı. Şekil 3.7. SR3 fajına dirençli mutant Lactobacillus 53S' suşu. Şekil 3.8. TEM görüntüleri. (1), 53S' suşunun 32000x’ lik büyütmede görünümü; (2) 53S' suşunun 30000x’ lik büyütmede görünümü. x ÇİZELGELER Çizelge 1.1. Bazı peynir ve yoğurt türlerinde kullanılan starter kültürler. Çizelge 2.1. Kullanılan Lactobacillus sp. bakterilerin kodları ve alındıkları ya da izole edildikleri kaynaklar. Çizelge 2.2. Kullanılan Streptococcus sp. bakterilerin kodları ve alındıkları ya da izole edildikleri kaynaklar. Çizelge 2.3. Kullanılan Enterococcus sp. bakterilerin kodları ve alındıkları ya da izole edildikleri kaynaklar. Çizelge 2.4. Çalışmada kullanılan cihazlar, marka ve firma bilgileri Çizelge 3.1. Laktik asit bakterilerinin izolasyonu ve karakterizasyonu. Çizelge 3.2. Kullanılan faj kaynaklarına verilen kodlar ve izolasyonda kullanılan potansiyel konakçı bakteriler- Lactobacillus sp. Çizelge 3.3. Kullanılan faj kaynaklarına verilen kodlar ve izolasyonda kullanılan potansiyel konakçı bakteriler-Streptococcus sp., Enterococcus sp. Çizelge 3.4. Konakçı olarak Lactobacillus sp. suşlarının kullanıldığı spot test sonuçları. Çizelge 3.5. Konakçı olarak Streptococcus sp. ve Enterococcus sp suşlarının kullanıldığı spot test sonuçları Çizelge 3.6. İzole edilen fajların plak morfolojisi. Çizelge 3.7. Çift tabaka agar yöntemi için denenmiş olan optimizasyon koşulları. Çizelge 3.8. Çift tabaka agar yönteminin sonuçları. Çizelge 3.9. Mitomisin C testi sonuçları. Çizelge 3.10. Spot test sonuçları. 1 1. GİRİŞ Gıdalar besin içerikleri bakımından mikroorganizmaların gelişmeleri için uygun ortamlardır. Bu nedenle gıdaların bazıları kolay bozulabilen, mikrobiyal faaliyet açısından riskli gıdalar grubunda yer almaktadır. Gıda güvenliğini arttırmak ve raf ömrünü uzatmak amacıyla doğal mikroflora ve antimikrobiyal metabolitlerinin gıdalara ilavesi “biyokoruma” olarak adlandırılmaktadır. Biyokoruma yöntemi ile antagonistik mikroorganizmaların ve metabolitlerinin kullanımıyla patojen ve bozulma etmeni mikroorganizmaların inaktivasyonu sağlanmaktadır. Bu amaçla kullanılan mikroorganizmalar arasında laktik asit bakterileri önemli bir yer tutmaktadır (Schnürer ve Magnusson, 2005; Gürsel ve ark., 2004). Laktik asit bakterileri, fermantasyon neticesinde laktik asit üreten bakteriler olarak tanımlanırlar. Bu yetenekleri sayesinde de çok uzun yıllardır gıda güvenliğini ve dayanıklılığını geliştirmek için kullanılmaktadırlar. Laktik asit bakterilerinin süt ürünlerinin fermantasyonundaki rolü ise 19. yüzyılın sonlarında keşfedilmiştir. Keşiflerinden bu yana laktik asit bakterileri starter kültür olarak süt ürünlerine ilave edilmekte ve böylece üründe asit üretiminin kontrolü yanında yapısal ve aromatik özelliklerin kazandırılmasını sağlamaktadırlar (Lacroix, 2011). Starter kültürlerin aktivasyonunu olumsuz yönde etkileyen çok sayıda etmen vardır. Bunların içinde en önemli ve çözümü en güç olanı bakteriyofaj (faj) kontaminasyonlarıdır. Faj kontaminasyonu; üretimde kullanılan hammadde, alet ve ekipman yüzeyleri, fabrika havası gibi dış çevre koşullarından kaynaklanabildiği gibi, doğrudan starter kültür suşlarından da kaynaklanabilmektedir. Fermantasyon sırasında 2 karşılaşılan bu sorun starter kültürlerin fajlar tarafından enfekte edilmesi ve dolayısıyla fermantasyonun gerçekleşememesi ile sonuçlanmaktadır. Fermente süt endüstrisinde faj kontaminasyonlarının % 15-20 oranına varan ürün kayıplarına neden olduğu bilinmektedir (Sanders, 1988). 1.1. Laktik Asit Bakterilerinin Genel Özellikleri 19. Yüzyılın sonlarında ‘laktik asit bakterileri’ sütü ekşiten organizmalar olarak adlandırılmaktaydı. İlerleyen dönemlerde sütü ekşiten organizmalar ve diğer laktik asit üreten bakteriler arasındaki benzerlik gözlemlenmiş ve 1919 yılında Orla-Jensen tarafından laktik asit bakterilerinin temel sınıflandırılmasına ilişkin ilk monograf düzenlenmiştir. Orla-Jensen tarafından kullanılan bu kriterler (hücre morfolojisi, glukoz fermantasyonu şekli, üreme sıcaklık aralıkları ve şeker kullanım biçimleri) laktik asit bakterilerinin sınıflandırılması için günümüzde de kullanılmaya devam etmektedir (Lahtinen ve ark., 2012). Laktik asit bakterilerinin taksonomik olarak bilinen 20 cinsi bulunmaktadır. En çok bilinen türler arasında Aerococcus, Bifidobacterium, Carnobacterium, Enterococcus, Leuconostoc, Melisococcus, Oenococcus, Lactobacillus, Pediococcus, Lactococcus, Streptococcus, Tetragenococcus, Vagococcus ve Weisella yer almaktadır (Salminen ve ark., 2004). Laktik asit bakterileri geleneksel olarak gıda ve yem fermantasyonunda görev alırlar. Bazı cinsleri sağlık için oldukça yararlı probiyotik özellik gösterir ve genellikle faydalı mikroorganizmalar olarak bilinirler. Bununla birlikte Streptococcus, Lactococcus, Enterococcus, Carnobacterium gibi bazı cinslerin suşları insan ya da hayvanlar için patojen özellik gösterirler (Giraffa ve ark., 2010). 3 Laktik asit bakterileri morfolojik, metabolik ve fizyolojik özelliklerine göre gruplandırıldıklarında Gram-pozitif, karbonhidrat fermantasyonu neticesinde son ürün olarak laktik asit oluşturan, çubuk (Lactobacillus, Carnobacterium, Bifidobacterium) ya da kok (Lactococcus, Vagococcus, Leuconostoc, Pediococcus, Aerococcus, Tetragenococcus, Streptococcus, Enterococcus) şeklinde, spor oluşturmayan, birkaç üye dışında hareketsiz, fakültatif anaerob ve katalaz negatif bakteri grubu içinde yer alırlar. Süt ve süt ürünleri başta olmak üzere doğada (bitki ve bitki atıkları, et ve et ürünleri, insan ve hayvan barsak sistemi) yaygın olarak bulunmaktadırlar. Endüstriyel açıdan önem arz eden, patojen olmayan altı cins bulunmaktadır. Bu cinsler ve kullanıldıkları ürünler; Lactococcus süt ürünleri, Lactobacillus sebzeler, tahıl, süt ve et ürünleri, Leuconostoc sebzeler ve süt ürünleri, Pediococcus sebzeler ve et ürünleri, Oenococcus şarap, Streptococcus süt ürünleri şeklinde sıralanabilir (Salminen ve ark., 2004; Lahtinen ve ark., 2012). Laktik asit bakterileri karbonhidrat metabolizmaları göz önüne alındığında homofermantatif ve heterofermantatif olarak iki gruba ayrılırlar. Homolaktik fermantasyon ya da homofermantatif yol temel olarak glikolize dayanmaktadır ve sadece laktik asit üretilir. Heterofermantatif ya da heterolaktik fermantasyonda laktik asite ek olarak CO2 ve etanol ya da asetat üretilir. Teorik olarak homolaktik fermantasyonda her glikoz kullanımında 2 mol laktik asit ve her 1 mol glikoz tüketimi için net 2 ATP açığa çıkarken, heterolaktik fermantasyonda laktik asit, etanol ve CO2’nin her birinden 1 mol ve her bir mol glikoz tüketimi için 1 mol ATP açığa çıkar. Her iki fermantasyon çeşidinde de glikoliz aşaması ortaktır (Şekil 1.1). Fermantasyon çeşidi laktik asit bakterileri için önemli bir taksonomik kriterdir. Genel olarak 4 Lactobacillus, Leuconostoc, Oenococcus, Weissellas cinsleri heterofermantatif, diğer laktik asit bakterileri ve laktokoklar ise homofermantatiftir (Salminen ve ark., 2004). Glikoz 2 ATP Glikoliz 2 NADH2 Pirüvat Pirüvat NADH + H NADH + H NAD+ NAD+ Laktik asit Laktik asit Şekil 1.1. Laktik asit fermantasyonu. 5 1.1.1. Laktik Asit Bakterilerinin Önemi Laktik asit bakterilerinin birçok suşu gıda ve yem sanayiinde kullanılan mikroorganizmaların önemli bir grubunu oluşturmaktadır. En önemli karakteristik özelliklerinden biri olan fermantasyon yetenekleri sayesinde gıdaların korunması, tat ve koku gibi yapısal özelliklerin geliştirilmesi için kullanılırlar. Çeşitli suşları süt ürünleri (yoğurt, peynir), fermente et ürünleri (salam, sosis), fermente sebzeler (zeytin, turşu), ekmek gibi gıdalarda bulunmaktadır. Ayrıca, günümüzde laktik asit bakterileri endüstride kimyasalların, farmasötiklerin ve diğer faydalı ürünlerin sentezlenmesinde çok önemli bir rol oynamaktadır (Florou-Paneri ve ark., 2013). Gıda ve Yem Sanayi İlaç Kimya Laktik Asit Bakterileri Fonksiyonel Girdiler Probiyotikler Starter kültürler Antimikrobiyal ajanlar Biyokoruyucular İlaç sektörü Düşük kalorili tatlandırıcılar Eksopolisakkaritler Vitaminler Fermantasyon, en eski gıda muhafaza yöntemlerinden biridir. Binlerce yıl öncesinde peynir, yoğurt, şarap, ekmek, turşu gibi gıdaların muhafazası için kullanılmış olsa da fermantasyondan mikroorganizmaların sorumlu olduğu ancak 1861’ de Louis Pasteur’ ün pastörizasyonu keşfinden sonra anlaşılmıştır (Ross ve ark., 2002). Laktik asit 6 bakterileri fermantasyonla karbonhidratı β-galaktosidaz enziminin etkisiyle glukoz ve galaktoza parçalar, daha sonra glukoz laktik asite çevrilir. Bu sayede pH 5’in altına düşer ve ürüne istenilen tat ve aroma kazandırılmış olur. Ayrıca gıda kaynaklı patojenler ve patojen olmayan kontaminantların büyük bir kısmı bu asitlere ve dolayısıyla pH düşüşüne karşı hassastır (Aşkar ve ark., 1999). Laktik asit bakterileri fermantasyonda izledikleri metabolik yollardaki farklılıktan dolayı homofermantatif ve heterofermantatif olmak üzere iki gruba ayrılırlar. Homofermantatif laktik asit bakterileri Embden-Meyerhof-Parnas früktoz-1,6 difosfat metabolik yolunu izlerlerler ve 6 karbonlu glukoz molekülünü, 3 karbonlu piruvata ve daha sonra da laktik asite dönüştürürler. C6H12O6 2(CH3-CHOH-COOH) Heterofermantatif ya da heterolaktik fermantasyonda ise fosfoketolaz glikolitik yolu kullanırlar. Fermantasyon sonunda laktik asitin yanı sıra etil alkol, asetik asit ve CO2, ayrıca iz miktarda asetaldehit, diasetil, formik asit, propiyonik asit gibi ürünler oluşabilir (Lahtinen ve ark., 2012; Üçüncü, 2005). C6H12O6 CH3 -CHOH-COOH + CH3-CH2OH + CO2 ve / veya C6H12O6 CH3-CHOH-COOH + CH3-COOH + CO2 Laktik asit bakterileri fermantasyon özelliklerinden dolayı süt endüstrisinde starter kültür olarak kullanılmaktadır. Starter kültürler, sütte bulunan zararlı mikroorganizmaların gelişimini sınırlamak, ürüne özgü standart tat, aroma ve yapının kazandırılması için süte katılan yararlı mikroorganizmalardır. Aynı zamanda ürüne bulaşan patojen bakterilere karşı inhibisyon özellik gösterebilirler (Bacus ve Brown, 1981). Starter kültürlerin yanı sıra, starter kültür olarak kullanılmayan bakteriler olan Non-Starter laktik asit bakterileri starter kültürler ile birlikte fermantasyonda aroma gelişiminde rol oynamaktadır. Birlikte laktozu fermente ederek, süt proteinlerini peptitlere ve serbest amino asitlere dönüştürürler, sitratı; ester, lipit ve uçucu 7 metabolitlere parçalayarak aroma maddelerinin oluşumunu sağlarlar. Peynirden, sosisten ve yoğurttan non-starter laktik asit bakterilerinin Lactobacilli, Enterococci, Pediococci ve Leuconostoc türleri izole edilebilmektedir. Lactobacillus casei suşları izolasyonda en çok elde edilen suşlardır (Fitzsimons ve ark., 1999). Bazı peynir ve yoğurt türlerinde kullanılan starter kültürler Çizelge 1.1’ de özetlenmiştir. Çizelge 1.1. Bazı peynir ve yoğurt türlerinde kullanılan starter kültürler. No 1 Ürün Kamember Mikroorganizma Lactococcus spp., Penicillium camemberti S. thermophilus + Lactobacillus delbrueckii ssp. bulgaricusactococcus, Lactobacillus lactis ssp. lactis + 2 Kaşkaval Streptococcus thermophilus + Lactobacillus casei ssp. casei Lactococcus lactis subsp. lactis; Lactococcus lactis subsp. Cottage peyniri, cremoris; Lactococcus lactis subsp. lactis + Lactococcus 3 krem peyniri lactis subsp. cremoris + Cit(+)Lactococcus lactis subsp. lactis var. diacetylactis 4 Matsoni Lactobacillis lactis subsp. cremoris, 5 Yoğurt Streptococcus thermophilus, Lactobacillus bulgaricus Laktik asit bakterileri tarafından üretilen organik asitler, karbondioksit, diasetil, biyosürfaktan maddeler, H2O2, bakteriyosin ve benzeri protein yapısındaki metabolitlerin birçoğu antimikrobiyel etki göstermektedir (Mishra ve Lambert, 1996). Laktik asit bakterilerinin en önemli özelliklerinden biri de probiyotik olarak kullanılabilmeleridir. Probiyotik, Yunanca’ da ‘yaşam için’ anlamına gelen bir 8 kelimedir (Gomes ve Malcata, 1999). Probiyotikler, Birleşik Sağlık ve Beslenme Uzman Danışma Kurulu (FAO/WHO)’ nun yapmış olduğu tanıma göre “Uygun miktarlarda alındıklarında konak canlının sağlığı üzerinde olumlu etkiler sağlayan canlı mikroorganizmalar” olarak ifade edilmiştir. Fuller (1989) ise probiyotikler için “tüketici sağlığına bireylerin intestinal mikrobiyal dengesini koruyarak veya geliştirerek yararlı olan canlı mikrobiyal gıda katkılarıdır” tanımını kullanmıştır. Probiyotiklerin; İntestinal mukoza yüzeyindeki reseptörlere bağlanabilme, Patojenlerin reseptörlere tutunmasını önleme, İmmün modülasyonu (bağırsaklar bağışıklık sisteminin en önemli unsurlarından biridir), Hasar görmüş mukozanın iyileştirilmesi gibi insan sağlığı için oldukça önemli özellikleri vardır. Probiyotik olarak kullanılan laktik asit bakterileri genellikle Lactobacillus ve Bifidobacterium cinslerine ait türlerdir (Gürsoy ve Kınık, 2006). 1.2. Bakteriyofajlar Bakteriyofajlar (faj) bakterileri enfekte ederek onların kaynaklarını kullanan viruslardır. Tıpkı diğer viruslar gibi yaşamlarını sürdürebilmek için bir konakçıya ihtiyaçları vardır. Bakteriyofaj kelimesi antik Yunanca’ da bakteri ve yemek fiillerinden türemiş olup ‘bakteri yiyen’ anlamına gelmektedir. Fajlar yeryüzünde her yerde mevcuttur; okyanuslar, toprak, denizler, içme suları, yediğimiz yiyeceklerde bulunmaktadırlar. Yeryüzündeki yaklaşık 1032’ lik üye ile fajlar dünyanın en kalabalık yaşam formunu oluşturmaktadır (Wommack ve Colwell, 2000; Kutter ve Sulakvelidze, 2005). 9 1.2.1. Bakteriyofajların Keşfi Fajların keşfi yüzyıllar öncesine dayanmaktadır. İlk olarak 1896 yılında İngiliz bakteriyolog Ernest Hanbury Hankin Hindistan’ ın Yamuna ve Ganj nehir sularının birçok bakteri türüne özellikle de Vibrio cholerae’ ya karşı antiseptik aktivitesi olduğunu rapor etmiştir. Bu etkinin filtreden geçirildiğinde devam ettiğini, ancak kaynayınca yok olduğunu görmüştür. Edindiği bilgilere dayanarak antiseptik aktivitenin nedeninin buharlaşabilen kimyasal bir madde olduğu sonucuna varmıştır. Emmerich ve Löw ise 1901 yılında bir maddenin bakteri kültürlerinde lizislere neden olduğunu rapor etmiştir (Kutter ve Sulakvelidze, 2005). 1915 yılında İngiliz bakteriyolog Frederick Twort katı besiyerinde bakteri kültürlerinde erimelere neden olan küçük bir ajan keşfetmiştir. Elde ettiği bulguları yayınlamış, ancak 1. Dünya Savaşının başlamasıyla çalışmalara ara verilmiştir. 1917 yılında Felix d'Herelle Fransa Pasteur Enstitüsü’ nde bakterileri öldüren bir ajan keşfetmiştir. D'Herelle yaptığı çalışmalarda atıksulardan aldığı bakteriden arındırılmış filtratlar eklemiş ve dizanteri bakteri kültürlerinin yok olduğunu gözlemlemiştir. D’Herelle bu olaya neden olan şeyin ultraviruslar olduğunu öne sürmüş ve bunları ‘bakteriyofaj’ olarak adlandırmıştır. Fajlarla ilgili ilk ciddi çalışma da d’Herelle tarafından aynı yıl yapılmıştır. D’Herelle fajları dizanteriye yakalanan bir çocuğu iyileştirmek için kullanmış ve faj uygulamasından sonra çocuğun iyileştiğini görmüştür. 1923 yılında ise D’Herelle’ ın yakın çalışma arkadaşlarından biri olan George Eliava tarafından bakteriyofaj çalışmaları ve faj tedavisinin geliştirilmesi için Tiflis, Gürcistan’ da Eliava Enstitüsü açılmıştır. Böylece enstitüde çalışan birçok bilim insanı faj çalışmaları için çeşitli yöntemler geliştirmiş ve bu yöntemleri tedaviye yönelik amaçlar için kullanmışlardır (Kurtboke, 2012). Halen Eliava Bakteriyofaj, Mikrobiyoloji ve Viroloji Enstitüsü faaliyetlerine devam etmekte ve özellikle açık, iltihaplı, irinli yaralar için faj tedavisi başarıyla uygulanmaktadır. Gürcistan’ ın yanı sıra Rusya, Polonya gibi ülkeler de bakteriyofaj tedavisini kullanmaktadır. 10 1.2.2. Bakteriyofajların Yapısı Fajların yapısı protein ve nükleik asitten oluşmaktadır. Bütün faj partikülleri (virion) nükleik asit genomlarını (DNA ya da RNA) protein ya da lipoprotein bir kılıf (kapsit) içinde taşır. Fajların kuru ağırlığının yaklaşık %60’ı protein, %40’ı nükleik asittir. Enerji üretmek için mekanizmaları, protein sentezlemek için ribozomları yoktur. Bu nedenle diğer tüm viruslar gibi parazittirler, ancak bir konakçı hücreyi enfekte ederek çoğalabilirler. Bakterilere göre oldukça küçük varlıklardır. Büyüklükleri milimikron (nanometre: nm) ya da Angström (Å) (angström= 0.1 nm) ile ölçülebilir ve ancak elektron mikroskobunda görülebilirler. Fajlar, içinde genetik malzemenin yer aldığı bir baş (kapsit), bir kuyruk ve yapışkan kuyruk liflerinden oluşmuşlardır. Nükleik asit moleküllerinin yumak şeklinde bir yapı oluşturduğu protein bir kılıf ile kaplı olan kısım baş kısmını oluşturmaktadır. Birbirine benzer alt birimlerden oluşan prizma şeklindeki bu protein kılıf ‘kapsit’ adını almaktadır. Kapsit genellikle bir altıgen gibi şekillenmiştir. Nükleik asit ve kapsidin oluşturduğu kompleks ‘nükleokapsid’ olarak adlandırılır. Kapsid birden fazla polipeptitten oluşan yapısal ünitelerden oluşur ve bu ünitelerin her biri ‘kapsomer’ adını alır. Kapsomerler ise ‘protomer’ adı verilen yapısal alt ünitelerin (polipeptit zincirleri) simetrik şekilde diziliminden oluşurlar. Fajlarda baş kısmını kuyruk kısmına bağlayan kısa bir boyun kısmı bulunur. Kuyruk protein yapıdan oluşur ve uzunluğu genellikle 50-100 nm arasındadır. Kuyruk yapısı bakteriyofaj tiplerine göre farklılıklar gösterir. Bazı faj türlerinde hiç kuyruk bulunmazken, bazılarında çok kısa ve basit yapılar şeklinde, bazılarında ise oldukça kompleks görünümde olabilirler. Örneğin, RNA fajlarında ve bazı DNA fajlarında kuyruk bulunmaz, sadece kapsidden oluşurlar. Kuyruk kısmı fajlarda yapışma veya adsorbsiyon organeli olarak görev yapar. Kuyruk içinde öz yapı adı verilen bir yapı bulunur. Bu yapı nükleik asidin bakteriye aktarılması sırasında iletim yolu olarak görev yapmaktadır. Öz yapısını saran protein yapı ise kuyruk kını adını alır. Kuyruk 11 kını enfeksiyon esnasında kasılabilir ve bu sayede genetik materyal öz yapısından geçerek konakçıya aktarılır. Kuyruğun ucunda altıgen bir taban plakası yer alır. Kuyruk dikenleri ve iplikçikleri bu levhaya bağlıdır. Taban plakası faj-bakteri özgüllüğünü taşıyan, fajın konakçıya tutunmasında ve adsorbsiyonunda önemli rolleri olan kısımdır. Kuyruk iplikçikleri ve dikenleri de kuyrukta olduğu gibi faja göre farklılık gösterir. Bazı fajlarda hem iplikçik, hem diken bulunurken, bazılarında her ikisi de bulunmayabilir ya da yalnız biri bulunabilir. Kuyruk iplikçiklerinin uç yapıları da yine fajlara göre farklılık gösterir. Bazı fajlarda topuz şeklinde uç yapısı görülebilir. Kuyruk iplikçiklerinde bulunan lizozim enzimi konakçı hücre duvarını eritir ve böylece genetik materyal direkt olarak sitoplazma içine enjekte edilir (Ergüllü, 1982; Kutter ve Sulakvelidze, 2005; Ustaçelebi ve Us, 2008). Şekil 1.2’ de tipik bir fajın yapısı verilmiştir. 2 1 4 3 5 2 9 6 7 8 Şekil 1.2. Kuyruklu fajın yapısı. 1, baş; 2, nükleik asit; 3, kapsomer; 4, boyun; 5, kuyruk kını; 6, kuyruk iplikçikleri; 7, kuyruk dikeni; 8, taban plakası; 9, kuyruk. 12 Diğer tüm canlılar gibi fajların da antijenik özellikleri yapılarında bulunan proteinlere bağlıdır. Fajların baş, boyun ve kuyruk iplikçileri protein yapıdadır. Bu yapıları oluşturan proteinler antijenik özellikler bakımından birbirlerinden farklıdırlar. Baş proteinlerine karşı elde edilen antiserumlar fajın konakçıya adsorbsiyonunu engellemezken, kuyruklara karşı hazırlanan antikorların fajın konakçıya andsorbsiyonunu engellediği bilinmektedir (Kılıç, 2008). 1.2.3. Bakteriyofajların Konakçı Enfeksiyonu Fajlar tüm viruslar gibi zorunlu parazitlerdir. Çoğalmak için replike olabilecekleri bir hücreye girmek zorundadırlar. Bu olaya ‘enfeksiyon’, enfekte olmuş hücreye ise ‘konakçı’ denir. Her fajın içinde çoğalabileceği spesifik bir bakteri konağı bulunur. Fajların konakçılarında enfeksiyon oluşturmaları 4 aşamada gerçekleşir (Şekil 1.3); 1. Adsorbsiyon: Kuyruklu fajlar tarafından meydana gelen enfeksiyon, kuyruk lifleri gibi ‘özellişmiş adsorbsiyon yapılarının’ hedef bakterinin molekül ya da kapsül yüzeyine bağlanmasıyla başlar (Şekil 1.3). Kuyruksuz fajlarda ise bu olay özgül reseptörlere kapsomerlerinin tutunmasıyla gerçekleşir. Enfeksiyonun en önemli aşaması adsorbsiyondur. Çünkü fajın konakçı bakteriye özgüllüğünün belirlendiği aşamadır. Gram-negatif bakterilerde bağlanma; proteinler, oligosakkaritler, lipopolisakkaritler gibi özgül reseptörlerle sağlanır. Gram-pozitif bakterilerde ise murein tabakasının kompleks yapısından dolayı çok farklı bağlanma bölgeleri (teikoik asit gibi) vardır. Çoğu faj kuyruğun yüzeye penetrasyonu için yüksek konsantrasyonda bulunan spesifik bir moleküle ihtiyaç duyar. 13 Konak kromozomu Şekil 1.3. Bakteriyofajın konakçıya adsorbsiyonu. Birçok faj bağlanma için Ca2+, Mg2+ gibi spesifik kofaktörlere ihtiyaç duyar. Bu maddeler, bakteri ve faj parçacıklarının negatif elektrik yüklerini nötralize ederek adsorbsiyonu kolaylaştırmaktadır. Adsorbsiyon, fajla bakterinin birbirine temasından ortalama 5 dakika sonra tamamlanmış olur. 2. Penetrasyon: Fajın hücreye adsorbsiyonundan sonra genetik materyalini bakteriye aktardığı aşamadır. Genetik metaryelin aktarımını sağlayan mekanizma her faj için spesifiktir. Ancak, genel olarak fajların genetik malzemelerini hücrenin içine enjekte etmek için kuyruk lifleri kasılır, böylece kuyruğun bakteri hücre duvarına penetrasyonun sağlanır (Şekil 1.4). Penetrasyon için faj kuyruğu enzimatik bir mekanizmaya sahiptir. Temastan sonra hücre duvarında küçük bir delik oluşur. Kuyruk gerilir ve faj genetik materyali direkt olarak bu delikten hücre içine salınır. Aynı zamanda konakçıda uygun bir pozisyon bulana kadar genetik materyalin kapsitten dışarı çıkmasını engelleyen bir mekanizma da hücre içine salınır. Salınımdan sonra konakçının hücre duvarında kalan faj kılıfı ‘hayalet faj’, hücre içine giren fajın nükleik asidi ise ‘vejetatif faj’ olarak isimlendirilir. Şekil 1.4. Fajın hücreye penetrasyonu. 14 3. Biyosentez: Fajların bakteri içinde üreme ve gelişme dönemidir (Şekil 1.5). Faj genetik materyali bakteri hücresine girdikten sonra bakteri ribozomları protein sentezine başlar. Konakçının kendi protein ve nükleik asit sentezi de bozularak viral ürünlerin sentezine yönelir. Oluşan yeni ürünler yeni virionların oluşmasına yardımcı olacaklardır. Şekil 1.5. Fajın bakteri içinde üreme ve gelişme dönemidir. 4. Lizis: Hücre içerisinde olgun fajların meydana geldiği ve hücre erimesi ile dışarı salınması safhalarıdır (Şekil 1.6). Salınma işlemi, hücre duvarındaki peptidoglikanı parçalayan endolizin enzimi sayesinde gerçekleşir. Şekil 1.6. Fajın bakteri hücresini lizise uğratması. Kuyruklu fajların tamamı lizis için 2 bileşen kullanır; Lisin: Peptidoglikan tabakayı oluşturan bağları kırmak için kullanılan bir enzimdir. Holin: İç membranda porlar açarak lisin enziminin peptidoglikan tabakaya ulaşmasını sağlayarak lizisi hızlandıran bir proteindir (Kutter ve Sulakvelidze, 2005; Ustaçelebi ve Us, 2008). 15 100 10 Penetrasyon Virus sayısı (pfu) 1000 1 Latent dönem Adsorbsiyon Zaman Biyosentez Olgun virusların hücreden salınımı Şekil 1.7. Faj replikasyonunun tek basamaklı büyüme eğrisi 1.2.4. Bakteriyofajların Yaşam Şekilleri Fajlarda litik ve lizojenik yaşam döngüleri olmak üzere başlıca iki yaşam şekli görülmektedir (Şekil 1.8). Litik yaşam döngüsünü izleyen fajlar virulan (litik) fajlar, lizojenik yaşam döngüsünü izleyen fajlar ise ılımlı (lizojenik) fajlar olarak adlandırılırlar. Virulan ve ılımlı fajların her ikisi de enfeksiyonu gerçekleştirebilmek için bakterinin dış yüzeyinde bulunan spesifik reseptörlere ihtiyaç duyarlar. Enfeksiyon bakteriyel adsorbsiyon, faj genomunun replikasyonu, viral bileşenlerin sentezi ve olgun faj partiküllerinin hücre lizisi ile ortama salınımıyla gerçekleşir (Abedon, 2008; Lacroix, 2011). Litik yaşam döngüsü, virulan fajın konakçı hücresinin yüzeyine adsorbsiyonu ile başlar. Faj, taban plakasında bulunan proteinden oluşmuş kuyruk iplikçiklerini konakçı hücre yüzeyinde bulunan reseptör bölgelerini tanımak için kullanır. Kendisine spesifik bu reseptörleri tanıyan faj konakçıya tutunur ve genomunu doğrudan konakçı bakterinin sitoplazmasına enjekte eder. Bu aşamadan sonra konakçı metabolizmasını 16 ele geçirir ve böylece bakteri metabolizması durur. Daha fazla faj yapmak için moleküler mekanizmayı başlatır ve böylece yeni faj DNA sentezi gerçekleşir. Daha sonra DNA’ yı çevreleyen, kapsid, kuyruk ve kuyruk iplikçikleri gibi kısımlar meydana gelerek faj oluşumu tamamlanır. Konakçı hücre içerindeki faj yoğunluğu artar ve sonunda hücrenin lizisi ile yeni oluşan fajlar serbest kalır. Lizojenik döngü, faj çoğalması için alternatif bir yoldur. Fajın konakçı hücreye adsorbsiyonundan ve onun DNA’sına penetrasyonundan sonra, yeni sentezlenmiş faj partiküllerinin oluşumu bastırılmaktadır. Bu aşamalar tüm fajlar için ortaktır ancak lizojenik yaşam döngüsünde faj DNA’sı bakteri kromozomuna rekombinasyon yolu ile girmektedir. Bu olay ‘lizojeni’, konakçı DNA’ sına bağlanan faj genetik materyali de ‘profaj’ olarak adlandırılır. Böylece konakçı hücrede fajın sebep olduğu lizis meydana gelmez. Faj DNA’sı, lizojenik hücrelerin karakterini oluşturmak üzere, bakteriyel DNA ile eşzamanlı olarak replike olmaktadır. Kromozomunda bu şekilde faj taşıyan bakteri ‘lizojenik bakteri’ olarak adlandırılır. Koşullar uygun olduğu sürece konak hücrede faj varlığını sürdürür. Ancak ortam şartları konak için uygunsuz hale gelirse, örneğin besin kaynaklarının tükenmesi durumunda, profajlar etkinleşirler. Konak hücrede çoğalmaya başlayan profajlar uygun sayıya ulaştıklarında hücreyi lizise uğratır ve serbest kalırlar. Lizojenik döngü uygun koşullar altında konak hücrenin çoğalmasına izin verdiği için hücrenin yavrularında da faj varlığını devam ettirir (Lacroix, 2011). Bazen profajlar inaktif oldukları dönemde bakteri genomuna yeni işlevler kazandırarak konak bakteriye fayda sağlarlar, bu olguya ‘lizojenik dönüşüm’ (lysogenic conversion) denir. Lizojenik dönüşümün etkisi kolera hastalığında rahatlıkla görülebilir. Kolera, Gram negatif, virgül şeklinde bir bakteri olan Vibrio cholerae’ nın neden olduğu, bağırsak enfeksiyonuna bağlı olarak, akut ve şiddetli ishal ile seyreden, kaybedilen su ve elektrolit kaybının yerine konulmasıyla tedavi edilen bir hastalıktır. Vibrio cholerae her zaman hastalığa neden olmaz. Ancak, CTX fajı ile enfekte olduğunda faj toksijenisitesini bakteriye aktarır. Faj, bakteri üzerinde bir piliyi 17 tanır ve hücre içine girmek için kullanır. Hücre içine girdikten sonra bakteri kromozomuna entegre olur ve lizogen kolera toksinini eksprese eder (sentezler). (Waldor ve Mekalanos, 1996). Lizojenik bakterilerin bazı fiziksel ya da kimyasal ajanlarla muamele edilmesiyle profaj dışarı çıkarılarak virulan faja dönüşmektedir. Bu olaya ‘faj indüksiyonu’ adı verilir. Faj indüksiyonu için kullanılan yöntemler: Mitomisin C antibiyotiği uygulaması, UV ile muamele, Azot gazı uygulaması, İnkübasyon sıcaklığındaki değişim olarak sıralanabilir (Lacroix, 2011; Kılıç, 2008). 18 Faj DNA’ sı A Faj Bakteri kromozomu Litik yaşam döngüsü Faj DNA’ sı B Faj Bakteri kromozomu Profaj Lizojenik yaşam döngüsü Profaj taşıyan yavru hücreler Çoğalan bakteri hücreleri ile profaj yeni hücrelere taşınır Şekil 1.8. Bakteriyofaj yaşam şekilleri. A, litik yaşam döngüsü; B, lizojenik yaşam döngüsü. 19 1.3. Laktik Asit Bakteri Fajları Süt teknolojisinde, süt ürünlerinde standart bir kalite ve arzu edilen tat, aromanın sağlanabilmesi için starter kültürler kullanılmaktadır. Ancak starter kültür kullanımının yaygınlaşmasından sonra ortaya bakteriyofaj sorunu çıkmıştır. Steril olmayan işletme koşulları ya da steril olmayan ortamlardan elde edilen çiğ sütlerin kullanılması gibi nedenlerle starter kültürler fajlarla kontamine olmaktadır. Sütte çok düşük miktarda faj olsa bile, ortamda bulunan starter kültürde faja duyarlı hücrelerin olması durumunda faj popülasyonu çok hızlı şekilde artabilir. Enfeksiyonu takiben hücrelerde meydana gelen lizisle süt fermantasyonu yavaşlayacak veya tamamen duracak, bu da düşük kalitede ürünlerin üretimine neden olacaktır. Bu durum süt endüstrisinde çok büyük ekonomik kayıplara neden olmaktadır (Garneau ve Moineau, 2011). Starter kültürlerde yaşanan bakteriyofaj sorununa ilk olarak 1935 yılında Whitehead ve Cox yaptıkları çalışmada dikkat çekmişlerdir. Whitehead 1953’ te yaptığı başka bir çalışmada da peynir üretiminde starter kültür olarak kullanılan Streptococcus cremoris’ in asit üretme aktivitesindeki bozulmanın sebebinin bakteriyofajlar olduğunu öne sürmüştür. O zamandan beri bilimsel camia süt teknolojisinde faj kontaminasyonunun kontrol altına alınabilmesi için stratejiler geliştirmeye odaklanmıştır. Bu stratejiler, suş seçimleri, fajdan etkilenmeyen mutantların kullanımı, antifaj direnç mekanizmaları gibi temellere dayanmaktadır. Lactococcus lactis ve Streptococcus thermophilus suşları faj enfeksiyonundan en çok etkilenen suşlardır. Bu nedenle faj biyolojisiyle ilgili ilk çalışmalar da bu suşlara dayanmaktadır. Süt endüstrisinde çok sorun yaratmadıkları için Lactobacillus türlerini enfekte eden fajlarla ilgili yapılmış çok az çalışma vardır. Ancak, laktobasillerin probiyotik olarak rollerinin artmasıyla laktobasil fajlarıyla ilgili yapılan araştırmalar hız kazanmıştır. Hatta Lactobacillus casei, Lactobacillus acidophilus, Lactobacillus delbrueckii subsp. lactis ve Lactobacillus helveticus gibi süt endüstrisinde fermantasyonda kullanılan büyük bir grup suşun faj kontaminasyonundan etkilendiği rapor edilmiştir (Mozzi ve ark., 2010). 20 Laktik asit bakteri fajları çiğ süt, yoğurt, peynir, atık su, salya, vajina gibi çok farklı kaynaklardan, lizojen fajlar ise konakçı hücreden izole edilebilir. İzole edilen fajların çoğu, aynı türe ait bir ya da birkaç starter suş ile sınırlı konakçı aralığına sahiptir. Birçok lizojen için uygun konkçıyı bulmak ya da litik çoğalma için koşulları sağlamak kolay değildir ve TEM’de görüntülenmeleri oldukça zordur (Mozzi ve ark., 2010). 1.3.1. Laktik Asit Bakterilerinin Fajlara Karşı Direnç Mekanizmaları Laktik asit bakterileri hem litik, hem de ılımlı fajlar tarafından enfekte edilebilmektedir. Ancak laktik asit bakterilerinin da farklı fajlara karşı bir savunma mekanizması geliştirdikleri bilinmektedir. (Kılıç, 2008). Laktik asit bakterileri tarafından geliştirilen faj direnç mekanizmaları faj enfeksiyonun çeşitli aşamalarıyla ilişkilendirilmektedir (Sanders, 1988). Tanımlanmış dört faj direnç mekanizması vardır: 1. Adsorbsiyon: Faja dirençli suşlar mutasyona uğramış hücre duvarı yapısına sahiptir. Faj hücre duvarındaki reseptörleri tanır. Ancak, hücre yüzeyine adsorbe olamaz ve bu nedenle suşu enfekte edemez. 2. Restriksiyon-Modifikasyon Sistemleri: Restriksiyon-modifikasyon sistemleri restriksiyon enzimi ile modifikasyon enziminin birleşiminden oluşur. Laktik asit bakterilerinin çoğunda bu sistem bulunmaktadır. Restriksiyon enzimi yabancı faj DNA’ sını hücre içine girer girmez hidrolize eder ve DNA parçalanır. Modifikasyon enzimi ise faj DNA’larının bu savunma mekanizmasından kurtulabilmelerini sağlamaktadır. 21 3. Sonuçsuz Enfeksiyon: Sonuçsuz enfeksiyon durumunda enfeksiyonun tüm aşamaları etkilenmektedir. Dirençli suş faj DNA’sını hücre içine almakta ancak yeni faj oluşumunu sağlayan tüm aşamalar bu sistemden etkilenmektedir. Laktik asit bakterilerinde bu mekanizma halen tam olarak anlaşılamamıştır. 4. Lizojenik Bağışıklık: Bu durum, bakteri kromozomu lizojenik bir faj DNA’ sı taşıdığında gözlemlenmektedir. Profaj, diğer fajların gelişimini engelleyen ve suşu dirençli hale getiren moleküller kodlar (Salminen, 2004; Allison ve Klaenhammer, 1998). Tez kapsamında fermantasyonda oldukça büyük öneme sahip olan laktik asit bakterilerinin ve bu bakterilere karşı etkili fajlarının çeşitli çevresel kaynaklardan ve süt ürünlerinden izolasyonu yapılarak izole edilen laktik asit bakteri fajlarının fajkonakçı etkisine bakılıp hangi bakterilere karşı etkili olduklarının, etkili fajların konakçı üzerinde oluşturdukları koloni morfolojilerinin ve hangi yaşam döngüsüne sahip olduğunun anlaşılabilmesi amaçlanmıştır. Böylelikle laktik asit bakteri fajlarının özelliklerinin anlaşılması ve endüstride çok büyük ekonomik kayıplara neden olan bu sorunun çözümü için yol gösterir nitelikte olması beklenmektedir. 22 2. GEREÇ VE YÖNTEM 2.1. Gereç 2.1.1. Araştırmada Kullanılan Laktik Asit Bakteri ve Bakteriyofaj Kaynakları Çalışmada bakteri ve bakteriyofaj izolasyon kaynağı olarak; Gürcistan’ ın çeşitli bölgelerinden temin edilen 3 ev yapımı matsoni (Gürcistan’ da üretilen yoğurt benzeri fermente bir süt ürünü), 4 çiğ süt örneği, Varşova (Polonya)’ dan temin edilen 1 adet lor peyniri, 1 adet İtalyan tipi süzme peynir, Budapeşte (Macaristan)’den temin edilen 1 adet kaşkaval peyniri, 1 adet Kamember peyniri ve Tiflis (Gürcistan)’dan temin edilen 1 adet tuzlu sert köy peyniri (immeruli) olmak üzere 5 çeşit peynir örneği, Tiflis (Gürcistan)’ te bulunan bir süt fabrikasından alınan atık su örneği ve Kura nehri (Tiflis, Gürcistan)’ nin 3 farklı bölgesinden alınan atık su örnekleri olmak üzere toplamda 16 farklı örnek kullanılmıştır. Peynir, matsoni ve çiğ süt örnekleri alındıkları paketler içerisinde +4 oC’ de saklanarak, Kura nehri ve süt fabrikasından alınan atık su örnekleri ise steril örnek toplama kapları içerisinde laboratuvara getirilmiştir. Tüm örnekler kullanımlarına kadar +4’ oC’ de muhafaza edilmişlerdir. 23 2.1.2. Bakteri Kaynakları Bu çalışmada çeşitli kaynaklardan izole edilen ve Eliava Bakteriyofaj, Mikrobiyoloji ve Viroloji Enstitüsü (IBMV) kültür kolleksiyonundan temin edilen 59 laktik asit bakterisi kullanılmıştır. Bunlardan 31’ i Lactobacillus, 14’ ü Streptococcus, 14’ ü Enterococcus cinslerine ait laktik asit bakterileridir. Bu suşlardan 4’ ü Eliava IBMV kültür koleksiyonundan: K4, 31, B7 2-4, I3; 37 izolat George Eliava Enstitüsü Araştırma&Geliştirme bölümünden: 7BX, Tg 1-3, Tg 1-4, Al 2-3, 34, 50B, 51B, 52, 53S, 53R, 55B, 58B, 59, Kd3, Bj 2-3, Kr, Go3, B1, 43B, 47B, 48B, 2S, 2B, 4S, 5AS, 6AX, 6B, 7B, 1AS, 6AB, 8, 8AB, 9, 9A, 9AS, 47S, 49S temin edilmiştir. 18 suş çeşitli ev yapımı matsoni, çiğ süt ve peynir örneklerinden izole edilmiştir: ZI, 100C, 100S, 100B, 101S, 101B, 102S, 102M, 102B, 103S, 103B, 104S, 104M, 104B, Ma1S, Ma1M, M1S, M1M. Çizelge 2.1 - 2.3’ te kullanılan bakteriler ve izolasyon kaynakları verilmiştir. 24 Çizelge 2.1. Kullanılan Lactobacillus sp. bakterilerin kodları ve alındıkları ya da izole edildikleri kaynaklar. No Bakteri Kodu Alındığı Yer Kaynak 1 K4 Tiflis (Gürcistan) IBMV Kültür kolleksiyonu 2 31 Teleti (Gürcistan) IBMV Kültür kolleksiyonu 3 B7 2-4 Tiflis (Gürcistan) IBMV Kültür kolleksiyonu 4 I3 Tiflis (Gürcistan) IBMV Kültür kolleksiyonu 5 ZI Senaki (Gürcistan) Süt 6 7BX Tiflis (Gürcistan) Süt 7 Tg 1-3 Teguti (Ermenistan) Yoğurt 8 Tg 1-4 Teguti (Ermenistan) Yoğurt 9 Al 2-3 Alaverdi (Ermenistan) Yoğurt 10 100C Budapeşte (Macaristan) Kaşkaval peyniri 11 100S Budapeşte (Macaristan) Kaşkaval peyniri 12 100B Budapeşte (Macaristan) Kaşkaval peyniri 13 102S Varşova (Polonya) Lor peyniri 14 102M Varşova (Polonya) Lor peyniri 15 102B Varşova (Polonya) Lor peyniri 16 34 Tiflis (Gürcistan) Matsoni 17 50B Tiflis (Gürcistan) Matsoni 18 51B Mtskneti (Gürcistan) Matsoni 19 52 Axalsopeli (Gürcistan) Matsoni 20 53S Axalsopeli (Gürcistan) Matsoni 21 53R Axalsopeli (Gürcistan) Matsoni 22 55B Axalsopeli (Gürcistan) Matsoni 23 58B Mtskneti (Gürcistan) Matsoni 24 59 Mtskneti (Gürcistan) Matsoni 25 Kd3 Kurdgelauri (Gürcistan) Matsoni 26 Bj 2-3 Borjomi (Gürcistan) Matsoni 27 Kr Kaspi bölgesi (Qetvi Xevi) Matsoni 28 Go3 Gori (Xidistavi) Matsoni 29 B1 Batum (Axalsheni) Matsoni 30 Ma1S Tiflis (Gürcistan) Matsoni 31 Ma1M Tiflis (Gürcistan) Matsoni 25 Çizelge 2.2. Kullanılan Streptococcus sp. bakterilerin kodları ve alındıkları ya da izole edildikleri kaynaklar. No Bakteri Kodu Alındığı Yer Kaynak 1 43B Senaki (Gürcistan) Matsoni 2 47B Axalsopeli (Gürcistan) Matsoni 3 48B Tiflis (Gürcistan) Matsoni 4 2S Senaki (Gürcistan) Süt 5 2B Senaki (Gürcistan) Süt 6 4S Senaki (Gürcistan) Süt 7 5AS Senaki (Gürcistan) Süt 8 6AX Asureti (Gürcistan) Süt 9 6B Asureti (Gürcistan) Süt 10 7B Tiflis (Gürcistan) Süt 11 M1 S Tiflis (Gürcistan) Süt 12 M1 M Tiflis (Gürcistan) Süt 13 101S Budapeşte (Macaristan) Kamember peyniri 14 101B Budapeşte (Macaristan) Kamember peyniri Çizelge 2.3. Kullanılan Enterococcus sp. bakterilerin kodları ve alındıkları ya da izole edildikleri kaynaklar. No Bakteri Kodu Alındığı Yer Kaynak 1 103S Varşova (Polonya) Süzme peynir 2 103B Varşova (Polonya) Süzme peynir 3 104S Tiflis (Gürcistan) İmmeruli peyniri 4 104M Tiflis (Gürcistan) İmmeruli peyniri 5 104B Tiflis (Gürcistan) İmmeruli peyniri 6 1AS Senaki (Gürcistan) Süt 7 6AB Asureti (Gürcistan) Süt 8 8 Senaki (Gürcistan) Süt 9 8AB Senaki (Gürcistan) Süt 10 9 Gori (Gürcistan) Süt 11 9A Gori (Gürcistan) Süt 12 9AS Gori (Gürcistan) Süt 13 47S Axalsapeli (Gürcistan) Matsoni 14 49S Tiflis (Gürcistan) Matsoni 26 2.1.3. Kullanılan Besiyerleri Tamponlanmış Yağsız Süt İçerik Kaymağı alınmış süt tozu g/L 100,00 Disodyum hidrojen ortofosfat (Na2HPO4) 5,00 Potasyum hidrojen ortofosfat (KH2PO4) 2,50 Son pH (25 oC de): 6,7±0,1 Ticari olarak elde edilen besiyerinin (HiMedia Lab., Mumbai, Hindistan) 100 g’ ı 1000 mL distile suya eklenip çözülmüş ve otoklavda 121 oC’ de 15 dk. sterilize edilerek hazırlanmıştır. Hazırlanan bu besiyeri kazeinin koagülasyonu ve proteolizine bağlı olarak laktik asit bakterilerinin aktifleştirilmesi için kullanılmıştır. M17 (Terzaghi ve Sandine, 1975) Agar İçerik g/L Hayvan dokularının peptik dijesti 5,00 Soya fasülyesi küspesi papaik dijesti 5,00 Maya özütü 2,50 Sığır eti özütü 5,00 Askorbik asit 0,50 Disodyum--gliserofosfat 19,00 Magnezyum sülfat 0,25 Laktoz 5,00 Agar 10,00 Son pH (25 oC’de): 7,1±0,1 27 Ticari olarak elde edilen besiyerinin (HiMedia Lab., Mumbai, Hindistan) 33,25 g’ ı 1000 mL distile suya eklenmiş, tamamının çözülmesi için kaynayana kadar ısıtılarak hazırlanmıştır. Çözüldükten sonra otoklavda 121 oC’ de 15 dk. sterilize edilmiştir. 45 C’ ye kadar soğutulup petri kaplarına dökülmüştür. Hazırlanan bu besiyeri laktik o Streptokokların izolasyonu için kullanılmıştır. M17 (Terzaghi ve Sandine, 1975) Sıvı Besiyeri İçerik g/L Hayvan dokularının peptik dijesti 2,50 Kazein hidrolizat 2,50 Soya fasülyesi küspesi papaik dijesti 5,00 Maya özütü 2,50 Sığır eti özütü 5,00 Laktoz 5,00 Askorbik asit 0,50 Disodyum--gliserofosfat 19,00 Magnezyum sülfat 0,25 Son pH (25 oC’de): 7,1±0,1 Ticari olarak elde edilen besiyerinin (HiMedia Lab., Mumbai, Hindistan) 42,25 g’ ı 1000 mL distile suya eklenmiş, tamamının çözülmesi için kaynayana kadar ısıtılarak hazırlanmıştır. Çözüldükten sonra otoklavda 121 oC’ de 15 dk. sterilize edilmiştir. Hazırlanan bu besiyeri laktik Streptokokların aktifleştirilmesi için kullanılmıştır. Lactobacillus MRS (De Man ve ark., 1960) Agar İçerik g/L Proteoz pepton 10,00 Sığır eti özütü 10,00 Maya özütü 5,00 28 Dekstroz 20,00 Polisorbat 80 1,00 Amonyum sitrat 2,00 Sodyum asetat 5,00 Magnezyum sülfat 0,10 Mangan sülfat 0,05 Dipotasyum fosfat 2,00 Agar 12,00 Son pH (25 oC’ de): 6,5±0,2 Ticari olarak elde edilen besiyerinin (HiMedia Lab., Mumbai, Hindistan) 67,15 g’ ı 1000 mL distile suya eklenmiş, tamamının çözülmesi için kaynayana kadar ısıtılarak hazırlanmıştır. Çözüldükten sonra otoklavda 121 oC’ de 15 dk. sterilize edilmiştir. 45 C’ ye kadar soğutulup petri kaplarına dökülmüştür. Hazırlanan bu besiyeri tüm o Lactobacillus cinslerinin üremesi için kullanılmıştır. Lactobacillus MRS (De Man ve ark., 1960) Sıvı Besiyeri İçerik g/L Proteoz pepton 10,00 Sığır eti özütü 10,00 Maya özütü 5,00 Dekstroz 20,00 Polisorbat 80 1,00 Amonyum sitrat 2,00 Sodyum asetat 5,00 Magnezyum sülfat 0,10 Mangan sülfat 0,05 Dipotasyum fosfat 2,00 Son pH (25 oC’ de): 6,5±0,2 29 Ticari olarak elde edilen besiyerinin (HiMedia Lab., Mumbai, Hindistan) 55,15 g’ ı 1000 mL distile suya eklenmiş, tamamının çözülmesi için kaynayana kadar ısıtılarak hazırlanmıştır. Çözüldükten sonra otoklavda 121 oC’ de 15 dk. sterilize edilmiştir. Hazırlanan bu besiyeri tüm Lactobacillus cinslerinin aktifleştirilmesi için kullanılmıştır. Bile Esculin Azide Agar (BEAA) İçerik g/L Kazein hidrolizat 17,00 Hayvan dokularının peptik dijesti 3,00 Maya özütü 5,00 Oxgall 10,00 Sodyum klorür 5,00 Eskulin 1,00 Ferrik amonyum sitrat 0,50 Sodyum azid 0,25 Sodyum sitrat 1,00 Agar 13,50 Son pH (25 oC’ de): 7,1±0,2 Ticari olarak elde edilen besiyerinin (HiMedia Lab., Mumbai, Hindistan) 56,25 g’ ı 1000 mL distile suya eklenmiş, tamamının çözülmesi için kaynayana kadar ısıtılarak hazırlanmıştır. Çözüldükten sonra otoklavda 121 oC’ de 15 dk. sterilize edilmiştir. 45 C2 ye kadar soğutulup petri kaplarına dökülmüştür. Hazırlanan bu besiyeri o Enterokokların belirlenmesi için kullanılmıştır. Bakteriyofaj izolasyonu için; Derişik M17 sıvı besiyeri (HiMedia Lab., Mumbai, Hindistan) (x10), Derişik MRS sıvı besiyeri (HiMedia Lab., Mumbai, Hindistan) (x10) kullanılmıştır. 30 2.1.4. Kullanılan Kimyasallar ve Çözeltiler Fizyolojik tuzlu su çözeltisi (Serum fizyolojik) Sodyum klorür (NaCl) 8,50 g Distile su 1000 mL 8,50 g NaCl 1000 mL distile suda çözülerek hazırlanmış ve otoklavda 121 oC’ de 15 dk. sterilize edilmiştir. 0,1 M Magnezyum sülfat (MgSO4) çözeltisi Susuz MgSO4 12,00 g Distile su 100 mL 100 mL distile suya 12,00 g susuz MgSO4 eklenerek çözülmüş ve otoklavda 121 oC’ de 15 dk. sterilize edilmiştir. Mitomisin C (MC) stok çözeltisi MC 2 mg Steril 0,1 M MgSO4 4 mL 4 mL steril 0,1 M’ lik MgSO4 çözeltisine 2 mg MC eklenerek hazırlanmıştır. 1 M Kalsiyum klorür (CaCl2) çözeltisi Susuz CaCl2 11,1 g Distile su 100 mL 11,1 g susuz CaCl2 100 mL distile suda çözülerek hazırlanmış ve otoklavda 121 oC de’ 15 dk. sterilize edilmiştir. 31 Kristal viyole çözeltisi Kristal viyole 1g Asit – Fenik kristali (fenol kristali) 2g Etil alkol (% 96) 10 mL Distile su 100 mL Kristal viyole ve fenol kristali porselen havanda ezilip üzerine yavaşça etil alkol eklenerek hazırlanmıştır. Lugol çözeltisi İyot 1g Potasyum iyodür (KI) 2g Distile su 300 mL İyot ile KI havanda iyice ezilip üzerine yavaş yavaş distile su ilave edilmiş ve iyice karıştırılarak hazırlanmıştır. Safranin çözeltisi Safranin 0,5 g Etil alkol (%95) 10 mL Distile su 100 mL Safranin etil alkol içinde çözündürüldükten sonra distile su ile karıştırılarak hazırlanmıştır. Anaerobik koşulların sağlanması için; Anaerogas Pack 3,5 L (HiMedia Lab. Pvt. Ltd., Mumbai, Hindistan) kullanılmıştır. 32 2.1.5. Kullanılan Cihazlar Tez kapsamında kullanılan cihazlar Çizelge 2.4’ te belirtilmiştir. Çizelge 2.4. Çalışmada kullanılan cihazlar, marka ve firma bilgileri. Cihaz Marka-Model Firma Su banyosu Precision LabMechanics, Winchester, Virjinya Mini Vorteks VWR VM-3000 VWR International, ABD Santrifüj Thermo IEC MultiRF Thermo Scientific, ABD İnkübatör VWR Signature VWR International, ABD Hasas terazi VWR VWR International, ABD Işık mikroskobu VWR VWR International, ABD Elektron mikroskobu 100CX II TEM 100kV JOEL Ltd., Akishima, Tokyo,Japonya 2.2. Yöntem 2.2.1. Laktik Asit Bakterilerinin Farklı Kaynaklardan İzolasyonu Laktik asit bakterilerinin izolasyonu için peynir örnekleri steril kabinde steril mikropipet ucu yardımıyla bir miktar alınarak, matsoni ve çiğ süt örnekleri ise direkt mikropipet ile tamponlanmış yağsız süt içerisine aktarılmış ve 37 oC’ de bir gece inkübasyona bırakılmıştır. Ertesi gün üreme gözlenen tüplerden MRS ve M17 sıvı besiyerine inokule edilmiş, 37 oC’ de bir gece inkübasyona bırakılmıştır. Daha sonra M17 sıvı besiyerinden alınan örnekler M17 agara, MRS sıvı besiyerinden alınan örnekler MRS agara ekilmiş, 37 oC’ de anaerobik koşullar altında bir gece inkübasyona bırakılmıştır. MRS besiyeri Lactobacillus cinslerinin, M17 besiyeri Streptococcus ve Enterococcus cinslerinin izolasyonu için kullanılmıştır. Bakterilerin saflaştırılması için birçok kez bakterilerden M17 ve MRS agara tek koloni ekimi yapılmıştır. Daha 33 sonra MRS ve M17 agardan alınan kolonilere Gram boyama yapılmış ve mikroskoptaki görünümleri incelenerek MRS agarda üreyen bakterilerin basil, M17 agarda üreyen bakterilerin kok oldukları teyit edilmiştir. 2.2.2. Laktik Asit Bakterilerinin Tiplendirilmesi İzole edilen laktik asit bakterilerinin tiplendirilmesi için fizyolojik ve biyokimyasal testler uygulanmıştır. Morfolojik testler; Koloni morfolojilerinin incelenmesi için 24 saatlik taze kültürler kullanılmıştır. Katı besi ortamında farklı tipteki kolonilerden ayrılmış tek tip koloniler kullanılarak inceleme yapılmıştır. Petride oluşan kolonilerin şekil, renk, büyüklük, kenar yapısı gibi morfolojik özellikleri çıplak gözle incelenmiştir. Gram boyama: Gram boyama suşların hücre şekilleri ve hücre duvar yapılarını incelemek için kullanılmıştır. 24 saatlik kültürlerden hazırlanan preparatlar Gram boyama metodu (Şekil 2.1) kullanılarak boyanmıştır. Metoda göre, sıvı ve katı kültür ortamından öze ile alınıp lam üzerine yayılan bakteri kültürünün havada kuruması sağlanmış ve 3 defa alevden geçirilerek fiziksel tesbit yapılmıştır. Lam (preparat) üzerine Kristal viyole damlatılıp 1-2 dakika boyanmıştır. Daha sonra boya dökülmüş ve lugol çözeltisi damlatılıp 1-2 dakika daha beklenmiştir. % 95' lik Etil Alkol ve su ile boya akmayıncaya kadar yıkama yapılmış ve sonra lam üzerine (preparat) safranin dökülerek 15-20 saniye beklenmiştir. Boya dökülüp lam yıkanarak kurulanmıştur. 34 Kristal viyole Lugol çözeltisi Etil alkol Safranin Gram(+) Gram(-) Şekil 2.1. Gram boyama Daha sonra bir damla immersiyon yağı damlatılarak mikroskopla incelenmiştir. Mavimor renkli bakteriler Gram pozitif, pembe-kırmızı renkli bakteriler ise Gram negatif olarak değerlendirilmiştir. Biyokimyasal testler; Bile Eskulin testi: Kok oldukları tespit edilen bakteriler Bile Esculin Azide Agar (ayırt edici besiyeri)’ a ekilmiş ve 35 oC’ de 24 saat anaerobik koşullar altında inkübe edilmiştir. Çevresinde siyah-kahverengi haleler gözlenen koloniler Enterokok olarak değerlendirilmiştir. Bile Esculin Azide Agar içerisindeki safra Gram-pozitif streptokokların gelişimini, sodyum azid ise Gram-negatif bakteri gelişimini inhibe eder. Besin kaynağı olarak esculin ve pepton, renk indikatörü olarak ferrik sitrat içerir. Eskulin alkole bağlanan bir karbonhidrattır. Enterokoklar esculini hidroliz edebilirler ve yan ürün olarak eskulatine dönüştürürler. Eskulatin ferrik sitratla reaksiyona girerek siyah renk oluşturur. 35 2.2.3. Laktik Asit Bakterilerinin Patojen Bakterilere Karşı Antagonistik Aktiviteleri Birçok laktik asit bakterisi patojenlere karşı antagonistik aktivite gösterir. Süt endüstrisinde kullanılan starter kültürlerin antagonistik aktivite yoluyla birbirine karşı rekabet etmemesi ve birbirlerinin gelişimini baskılamaması önemlidir. Tez kapsamında kullanılan bazı laktik asit bakterilerinin patojen bakterilere karşı antagonistik aktiviteleri test edilmiştir. Bu amaçla 2 yöntem kullanılmıştır. Bunlardan ilki katı besiyerinde paralel çizgi metodu (Moore T. ve ark., 2013) yöntemi, ikincisi ise agar difüzyon yöntemi (Lertcanawanichakul ve Sawangnop, 2008) dir. Paralel-çizgi metoduna göre, test edilecek laktik asit bakterilerinin ve patojen bakterilerin bir gecelik taze kültürleri hazırlanmıştır. Test edilecek laktik asit bakterileri için uygun katı besiyeri petri kaplarına 18-25 ml dökülüp dondurulmuştur. Hazırlanan taze kültürlerin her biri bir besiyeri yüzeyine çizgi şeklinde ekilmiştir. Daha sonra patojen bakteri kültürleri laktik asit bakterilerine dikey çizgiler şeklinde besiyeri yüzeyine ekilmiş ve 37 oC’ de 24 saat anaerobik koşullar altında inkübasyona bırakılmıştır. İnkübasyon sonunda sonuçlar patojen bakterilerinin üremesini inhibe eden bölgeler ölçülerek değerlendirme yapılmıştır. Şekil 2.2’ de yöntem özetlenmiştir. 36 Test bakterisi Patojen bakteridiğer laktik asit bakterileri Şekil 2.2. Paralel çizgi metodu. a, çizgi şeklinde inokule edilen test bakterisi (laktik asit bakterisi); b, test bakterisine dikey çizgi şeklinde inoküle edilen patojenler ya da diğer laktik asit bakterileri; c, inkübasyondan sonra gözlemlenen sonuçlar. Agar-difüzyon yöntemine göre, laktik asit bakterileri (test bakterileri) ve patojenlerin ya da diğer laktik asit bakterilerinin (indikatör bakteri) taze kültürleri hazırlanmıştır. İndikatör bakteriler hücre parçalarının uzaklaştırılması için 5000 rpm’ de 20 dk. santrifüj edilmiş ve süpernatant toplanmıştır. Kullanılan bakteriye uygun agardan 2025 mL petri kutularına dökülmüş ve kullanılan bakteriye uygun yumuşak agarın (%0,7) sıcaklığı su banyosunda 48 oC’ de sabitlenmiştir. Sıcaklığı sabitlenen 3 mL yumuşak agar ve 100 µL test bakterisi karıştırılmış, daha önce dökülüp dondurulmuş olan uygun agar üzerine dökülmüştür. Dökülen karışım hızlıca petri kabına yayılmış ve steril kabinde kurumaya bırakılmıştır. Kuruduktan sonra petri üzerinde 6 mm çapında kuyular açılmış ve her kuyu içerisine 100 µL indikatör bakteri koyulmuştur. Petriler 37 oC’ de 24-48 saat anaerobik koşullar altında inkübasyona bırakılmıştır. İnkübasyondan sonra kuyucuklar etrafında oluşan inhibisyon zonlarının çapları ölçülmüştür. Şekil 2.3’ te yöntem özetlenmiştir. Her iki yöntem için de ölçülen değerler10-20 mm arasında ise pozitif, <10 mm ise negatif olarak değerlendirilmiştir (Fauzi ve ark., 2013; Kıvanç ve ark., 2011). 37 Test bakterisinin inokülasyonu İndikatör bakteri İnhibisyon zonu Şekil 2.3. Agar-difüzyon yöntemi. A, laktik asit bakterilerinin petri kabı içine inokülasyonu; B, agar üzerine kuyuların açılması; C, kuyuların içerisine indikatör bakterilerin ilavesi; D, oluşan inhibisyon zonlarının ölçümü. 2.2.4. Bakteriyofajların Farklı Kaynaklardan İzolasyonu Laktik asit bakterilerinin birçoğu bakteriyofaj taşır. Bu durum, süt endüstrisinde süt ürünlerinin üretiminde kullanılan starter kültürlerde ani lizislere neden olarak büyük ürün kayıplarına sebebiyet vermektedir. Bu nedenden dolayı bakteriyofaj taşımayan starter kültürlerin endüstride kullanılması önemlidir. Bakteriyofaj taşıyan laktik asit bakterileri suşlarının tespiti için Tiflis, Gürcistan’ ın yerel market ve pazarlarından toplanan çiğ süt ve matsoni (Gürcistan’ ın geleneksel süt ürünü) örnekleri ile Kura nehri ve peynir fabrikalarından (Tiflis, Gürcistan) toplanan atık su örnekleri kullanılmıştır. Toplanan örnekler kullanımlarına kadar +4 C’ de muhafaza edilmiştir. o 38 Atık su örnekleri için önce bakteriyel besiyeri ile zenginleştirme yapılmıştır. Bu amaçla, test bakterileri: derişik besiyeri (x10): nehir ya da işletmelerden alınan atık su örneği; 1:1:10 (h/h/h) oranında steril santrifüj tüpüne aktarılmış ve 37 oC de 24 saat inkübe edilmiştir. İnkübasyondan sonra 6000 rpm 15 dk. santrifüj edilip süpernatantı (santrifüjden sonra çökeleğin üstünde kalan sıvı kısım) alınarak 0,45 m’ lik membran filtreden (Acrodisc 13 mm şırınga filtre, New York, ABD) geçirilmiştir. Elde edilen süzüntü faj kaynağı olarak kullanılmıştır. Benzer şekilde çiğ süt ve matsoni örnekleri de öncelikle partiküllerinin uzaklaştırılması amacıyla 6000 rpm (dv/dk)’ de 15 dk. santrifüj edilmiş, süpernatantı alınarak 0,45 m lik membran filtreden (Acrodisc 13 mm şırınga filtre, New York, ABD) geçirilmiştir. Elde edilen filtrat: derişik sıvı besiyeri (x10) (konakçı bakterinin ürediği uygun besi ortamı seçilmiştir): konakçı bakteri olarak test edilecek olan bir gecelik taze kültür; 10: 1: 1 oranında steril santrifüj tüpüne aktarılmış ve 37 oC de 24 saat inkübasyona bırakılmıştır. İnkübasyondan sonra, oluşan hücre artıklarını uzaklaştırılması amacıyla 6000 rpm’ de 15 dk. santrifüj edilmiş ve süpernatant 0,45 m membran filtreden geçirilerek süzüntünün bakterilerden arındırılması sağlanmıştır. Elde edilen süzüntü faj kaynağı olarak kullanılmış ve kullanımına kadar +4 oC’ de muhafaza edilmiştir (Clokie ve Kropinski, 2009). Lizojenik bakteriyofaj izolasyonu için çeşitli kaynaklardan izole edilen suşlara Mitomisin C testi uygulanmıştır. Bu amaçla kullanılacak sıvı besiyerine son konsantrasyonu 0.1 g/mL (h/h) olacak şekilde Mitomisin C ilave edilmiştir. Mitomisin C içeren sıvı besiyeri her tüpte 5 er mL olacak şekilde steril tüplere aktarılmıştır. Bu tüpler içerisine test edilecek olan bakterilerin bir gecelik taze kültürlerinden 200 l eklenmiştir. Kontrol için ise Mitomisin C içermeyen sıvı besiyeri kullanılmıştır. Tüpler 37 oC de inkübasyona bırakılmış ve 24 saat sonra sonuçlar değerlendirilmiştir. Üreme görülmeyen tüpler 0.45 L’ lik membran filtreden 39 geçirilmiş ve bakteriyofaj içeriğini test etmek için spot test uygulanmıştır. Filtratlar faj kaynağı olarak kullanılmış ve kullanımına kadar +4 oC de muhafaza edilmiştir (Clokie ve Kropinski, 2009). 2.2.5. Laktik Asit Bakterilerine Karşı Bakteriyofaj Varlığının Belirlenmesi İzolasyondan sonra faj varlığının belirlenmesi için spot test (Clokie ve Kropinski, 2009) uygulanmıştır. Bu prosedüre göre, öncelikle izolasyonda konakçı olarak kullanılan bakterilerin taze kültürleri hazırlanmıştır. 20-25 mL MRS ya da M17 agar içeren petri kapları, kullanılacak bakteri adedi kadar bölmelere ayrılmıştır. Daha sonra petri kabının üst kısmına bir öze dolusu taze kültür koyulmuş, damlanın inmesi beklenmiştir. Petri kaplarına çizgi şeklinde bakteri ekimi anlatıldığı şekilde tüm bakteriler için uygulandıktan sonra, petri kapları steril kabinde kurumaya bırakılmıştır. Kuruduktan sonra bakteriyofaj kaynaklarından mikropipet yardımıyla 5’ er L alınarak çizgiler üzerine damlatılmış ve tekrar steril kabinde kurumaya bırakılmıştır. Kuruyan petri kapları 37 oC’ de anaerobik koşullar altında 24-48 saat inkübasyona bırakılmıştır. İnkübasyondan sonra faj damlatılan noktalarda meydana gelen lizisler (bakteri ölümleri) faj varlığını göstermiştir. 2.2.6. Bakteriyofajların Saflaştırılması Bakteriyofaj varlığının belirlenmesinden sonra pozitif sonuç veren petrilerden lizisli bölgeler öze yardımıyla kesilerek ya da mikropipet yardımıyla alınmış ve 1-2 mL sıvı 40 besiyeri içerisine koyulmuştur. Bir saat 37 oC’ de inkübasyondan sonra (bu işlemin amacı lizisli bölgeden elde edilen fajın besiyerine aktarılmasıdır) bir saat buzdolabında bekletilmiş ve 0,45 m’ lik membran filtreden geçirilmiştir. Filtrat kullanımına kadar +4 oC’ de muhafaza edilmiştir. Farklı morfolojiye sahip fajların ayrımının yapılabilmesi için Çift Tabaka Agar yöntemi kullanılmış ve bu prosedür aynı morfolojiye sahip faj plakları görülene kadar tekrar edilmiştir. Bu amaçla, elde edilen filtrattan sıvı besiyeri kullanılarak 10-1’ den 10-10’ a kadar seri seyreltmeler hazırlanmış ve her bir seyreltmeden 1 mL alınıp steril tüplere aktarılmıştır. Üzerine konakçı bakterinin bir gecelik taze kültüründen 200 L eklenerek hafifçe karıştırılmış ve 5 dk. faj-konakçı adsorbsiyonu için bekletilmiştir. Daha sonra üzerine sıcaklığı su banyosunda 48 oC’ de sabitlenmiş 3 mL yumuşak agar (% 0,7) ilave edilerek hızlıca karıştırılmıştır. Bu karışım daha önceden 15-20 mL agar (% 1,8) dökülüp dondurulmuş olan petri kaplarına dökülerek homojen bir şekilde yayılmış ve donması için bekletilmiştir. Petri kapları 37 oC’ de anaerobik koşullar altında 24-48 saat inkübasyona bırakılmıştır. İnkübasyondan sonra plak morfolojisi incelenmiştir. Bu amaçla, petrilerde plakların (lizisli bölgeler) tek düştüğü bölgeden tek bir plak öze yardımıyla kesilerek ya da mikropipet yardımıyla alınıp 2-2,5 mL sıvı besiyeri içeren tüpe aktarılıp karıştırılmıştır. Bu tüp 37 oC’ de 1 saat inkübe edilmiş ve inkübasyondan sonra 1 saat buzdolabında bekletilmiştir. Daha sonra 0,45 m’ lik membran filtreden geçirilmiş ve saf faj kaynağı olarak kullanılmıştır. Bu prosedür petride aynı morfolojiye sahip faj plakları görülene kadar tekrar edilmiştir (Clokie ve Kropinski, 2009). 41 2.2.7. Çift Tabaka Agar Yöntemi ile Bakteriyofaj Titresinin Belirlenmesi Faj titresinin belirlenmesi için çift tabaka agar yöntemi (Spencer ve Spencer, 2001) kullanılmıştır (Şekil 2.4). Bu amaçla, öncelikle faj stoğundan 10-1 den 10-10’ a kadar seri seyreltmeler hazırlanmıştır. Hazırlanan her bir seyreltmeden 1 mL alınarak steril tüplere aktarılmış ve üzerine 100 L bir gecelik taze kültürden ilave edilip karıştırılmıştır. Karışım 5 dk. oda sıcaklığında bekletilmiştir. Üzerine su banyosunda sıcaklığı 48 oC’ de sabitlenmiş yumuşak agar (% 0,7) ilave edilip karıştırılmış ve daha önceden 15-20 mL agar (%1,8) koyulup dondurulmuş olan petri kaplarına hızlıca dökülerek yayılmıştır. Steril kabinde yumuşak agarın tamamen donması için bekletilip 37 C’ de anaerobik koşullar altında 24-48 saat inkübasyona bırakılmıştır. o İnkübasyondan sonra lizis (plak) görülen petriler sayılarak faj titresi belirlenmiştir. Yumuşak agar İnkübasyon Şekil 2.4. Çift tabaka agar yöntemi. 42 Titre belirlemek için; Faj Titresi = Plak sayısı x Seyreltme faktörü x Seyreltme oranı pfu/mL (burada kullanılan ‘pfu’ plak oluşturma birimini ifade eder) formülü kullanılmıştır. Örneğin; 10-5’ lik seyreltme kullanılmış petride 50 plak oluşmuşsa faj titresi 50 x 105 x 10 = 5 x 107 pfu/mL olarak belirlenmiştir. Çif tabaka agar yöntemi sadece canlı bakteriyofajlar hakkında bilgi sahibi olmamızı sağlayan bir yöntemdir. Çünkü ancak bakteriyofaj konakçı bakteriyi enfekte ettiğinde lizis görebiliriz. 2.2.8. Bakteriyofaj Zenginleştirme Faj zenginleştirme, yani faj konsantrasyonunu arttırmak için iki yöntem kullanılmıştır; 1. Yöntem: Faj titresinin ilk faj stoğundan belirlenmesinden sonra faj plaklarının miktarını hesaplamak mümkündür. Teorik olarak petride 105 faj plağı vardır ve plak net olarak isimlendirilir. Her plakta 105 faj partikülü olduğu düşünülür. Yani, teorik olarak eğer bu petriyi 1 mL sıvı besiyeri ile yıkarsak, 1010 pfu/mL faj elde etmiş oluruz. Petrileri yıkamadan önce kapağı altta kalacak şekilde ters çevrilip kapağa 1-2 damla kloroform damlatılmış ve bu pozisyonda 0,5 - 1 saat oda sıcaklığında ya da buzdolabında bekletilmiştir. Kloroform bakteri hücrelerinin patlamasını ve fajların dışarı çıkmasını sağlar. Daha sonra petriler kapakları üste gelecek pozisyona getirilmiş ve uygun steril sıvı besiyeri (her plak için 1-2 mL) ile yıkanmıştır. Bu pozisyonda 1 saat buzdolabında 43 bekletilmiş ve sonra üst katmanı toplanmıştır. Toplanan kısım steril santrifüj tüplerine aktarılıp 5000 rpm’ de 15-20 dk. santrifüj edilmiştir (Şekil 2.5) (Adams, 1959). Alternatif olarak sadece üst katmanın üzerinde kalan sıvı besiyeri toplanıp pipet yardımıyla santrifüj tüpüne alınarak aynı şekilde santrifüj edilebilir (Davis ve Sinsheimer, 1963). Her iki yöntemde de süpernatant steril bir tüpe aktarılır ve membran filtreden (por çapı: 0,45 µm) geçirilir. Kullanımına kadar +4 oC’ de saklanır. kloroform +4 oC Sıvı besiyeri 5000 rpm 15-20 dk. Membran filtre Şekil 2.5. Faj zenginleştirme. 44 2. Yöntem: Spencer ve Spencer (2001)’ ın metoduna göre, bir gecelik taze kültürden 100 L alınarak steril bir tüpe aktarılmış ve üzerine 3 mL sıcaklığı su banyosunda sabitlenmiş 48 oC yumuşak agar (% 0,7, kullanılan bakteriye uygun) eklenmiş, hızlıca karıştırılarak daha önceden 15-20 mL agar (%1,8) dökülüp dondurulmuş petri kabına dökülmüştür. Petri kabına homojen bir şekilde yayıldıktan sonra steril kabinde donmaya bırakılmıştır. Tamamen donduktan sonra petri kabı yaklaşık 20-30 bölmeye ayrılmıştır. Saflaştırılmış faj kaynağından 5 L mikropipet yardımıyla alınarak ayrılan bölmelere damlatılmış ve steril kabinde kurumaya bırakılmıştır. Tamamen kuruduktan sonra 37 oC de anaerobik koşullar altında 24-48 saat inkübasyona bırakılmıştır. İnkübasyondan sonra oluşan lizisli bölgeler öze yardımıyla kesilerek alınmış ve 5 mL sıvı besiyeri içeren santrifüj tüpüne aktarılmıştır. 1 saat 37 oC’ de inkübasyondan sonra 1 saat buzdolabında bekletilmiş ve 5000 rpm’ de 15-20 dk. santrifüj edilmiştir. daha sonra santrifüj tüpünden süpernatant kısmı alınarak steril bir tüpe aktarılmış, 0,45 m’ lik membran filtreden geçirilerek +4 oC’ de kullanımına kadar saklanmıştır. 2.2.9. Geçirimli Elektron Mikroskobu (Transmission Electron Microscope) Geçirimli elektron mikroskobunun sıralanmıştır; 1. Örneğin saflaştırılması 2. Sabitleme 3. Gözlemleme 4. Fotoğraflamadır. (TEM) görüntüleme aşamaları aşağıda 45 İlk olarak faj ya da bakteri örnekleri, bakteriler için bölüm 2.2.1 ve fajlar için bölüm 2.2.6’ da bahsedildiği şekilde, saflaştırılmıştır. Saflaştırılan örneklerin süspansiyonları hazırlanmıştır: bakteri için, 4-5 saf bakteri kolonisi 500 µL serum fizyolojik içeren tüplere aktarılmış; faj örneği ise uygun besiyeri içinde zenginleştirilmiştir (bölüm 2.2.8). Hazırlanan örnek süspansiyonundan 1 damla karbon kaplı gride damlatılmıştır. Örneğin kuruması için 1 dk. beklenmiş ve üzerine bir damla boya (% 1 uranil asetat) eklenmiştir. 1 dk. daha beklendikten sonra sıvı, bir filtre kağıdı yardımıyla kurutulmuş ve grid örnek haznesine yerleştirilmiştir. Daha sonra örnek TEM altında incelenmiştir. 46 3. BULGULAR 3.1. Laktik Asit Bakterilerinin İzolasyonu ve Karakterizasyonu Çalışmada laktik asit bakterilerinin izolasyonu için 2 ev yapımı matsoni örneği Tiflis, Gürcistan’ dan, 1 çiğ süt örneği Tiflis, Gürcistan’ dan, 5 peynir örneği; 1’ i Tiflis, Gürcistan’ da bir pazardan, 2’ si Budapeşte, Macaristan’ da bir marketten ve 2’ si Varşova, Polonya’ da bir marketten temin edilen toplam 8 örnek kullanılmıştır. Örneklerden izole edilen bakteriler laktik Streptokoklar ve Laktobasillerin ayrımı için sırasıyla M17, MRS besiyerine ekilmiş daha sonra 37 oC’ de anaerobik koşullar altında 24-48 saat inkübasyona bırakılmıştır. M17 besiyerinde gelişim gösteren bakteriler kok, MRS besiyerinde gelişim gösteren bakteriler basil olarak değerlendirilmiştir. Saf kültür elde etmek için, bakteriler uygun katı besiyerine ekilmiş ve farklı tipteki kolonilerin her birinden tek bir koloni alınıp uygun katı besiyerine tek koloni ekimi yapılmıştır. Katı besiyerinde tek tip koloniler görülünceye kadar bu işlem sürdürülmüştür. Daha sonra Gram boyama yapılıp hücre şekilleri mikroskop altında incelenmiştir. Bakterilerin hücre duvar yapılarını incelemek için, Gram boyama yapılmıştır. Gram boyama yapılan hücreler mikroskop (100 x) altında incelenmiş ve mor-mavi renkli bakteriler Gram-pozitif, kırmızı-pembe renkli bakteriler Gram-negatif olarak değerlendirilmiştir. 47 Koloni morfolojilerinin tespiti için kok olarak değerlendirilen bakteriler M17 agara, basil olarak değerlendirilen bakteriler MRS agara ekilmiş ve çıplak gözle koloni morfolojileri incelenmiştir. Enterokok ların ayrımı için Bile Eskulin Testi yapılmıştır. Bile Esculin Agarda siyah röfle veren koloniler Enterokok olarak değerlendirilmiştir. Şekil 3.1’ de yapılan test sonucunda pozitif sonuç veren bir petri görünümü gösterilmiştir. Şekil 3.1. Bile Esculin Testi sonucunda pozitif sonuç veren bir petri görünümü. Elde edilen sonuçlara göre 18 bakteri morfolojik ve biyokimyasal açıdan karakterize edilmiştir. Sonuçlar Çizelge 3.1’ de özetlenmiştir 48 Çizelge 3.1. Laktik Asit Bakterilerinin İzolasyonu ve Karakterizasyonu. No Bakteri Kodu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 100C 100S 100B 101S 101B 102S 102M 102B 103S 103B 104S 104M 104B ZI Ma1S Ma1M M1S M1M Mikroskobik Hücre Morfolojisi Çubuk Çubuk Çubuk Kok Kok Çubuk Çubuk Çubuk Kok Kok Kok Kok Kok Çubuk Çubuk Çubuk Kok Kok Koloni Morfolojisi Renk Çap ~mm Parlaklık Şekil Kenar yapısı Krem rengi Krem rengi Krem rengi Renksiz Krem rengi Renksiz Krem rengi Krem rengi Krem rengi Krem rengi Krem rengi Krem rengi Krem rengi Krem rengi Krem rengi Krem rengi Renksiz Renksiz 1-2 1 2-3 1 1-2 1 1 1 1 1-2 1 1-2 2-3 2-3 1 1-2 1 1-2 Mat Mat Mat Şeffaf Mat Şeffaf Mat Mat Mat Mat Mat Mat Mat Mat Mat Mat Şeffaf Şeffaf Düzensiz Yuvarlak Düzensiz Yuvarlak Yuvarlak Yuvarlak Yuvarlak Yuvarlak Yuvarlak Yuvarlak Yuvarlak Düzensiz Düzensiz Düzensiz Yuvarlak Yuvarlak Yuvarlak Yuvarlak Girintili Düzgün Girintili Düzgün Düzgün Düzgün Düzgün Düzgün Düzgün Düzgün Düzgün Girintili Girintili Girintili Düzgün Düzgün Düzgün Düzgün * -, test sonucunda siyah röfle vermeyen koloniler; +, test sonucunda siyah röfle veren koloniler. Hücre Duvarı Yapısı Gram-pozitif Gram-pozitif Gram-pozitif Gram-pozitif Gram-pozitif Gram-pozitif Gram-pozitif Gram-pozitif Gram-pozitif Gram-pozitif Gram-pozitif Gram-pozitif Gram-pozitif Gram-pozitif Gram-pozitif Gram-pozitif Gram-pozitif Gram-pozitif *Bile Esculin Testi + + + + + - 49 Bu sonuçlara göre; 6 çubuk ve 7 kok bakteri peynir örneklerinden, 3 çubuk bakteri matsoniden, 2 kok baktrei çiğ sütten izole edilmiştir. 3.2. Laktik Asit Bakterilerinin Patojen Bakterilere Karşı Antagonist Aktiviteleri Tez kapsamında kullanılan Lactobacillus 58B, 53S, 59, Kd3, 102M ve Streptococcus 6AX, 5AS, 101S, 48B suşlarının, Pseudomonas aeruginosa, Staphylococcus aureus ve Enterococcus sp. gibi bazı patojen bakterilere karşı antagonistik aktiviteleri test edilmiştir. Bu amaçla, paralel çizgi ve kuyu difüzyon yöntemi olmak üzere iki yöntem kullanılmıştır. Ancak, her iki yöntemde de kullanılan bakterilere karşı herhangi bir antagonistik aktivite gözlemlenmemiştir. 3.3. Bakteriyofaj İzolasyonu ve Karakterizasyonu Tez kapsamında, 2 matsoni örneği (Tiflis, Gürcistan), 1 peynir altı suyu örneği (Senaki, Gürcistan), 4 çiğ süt örneği (Tiflis, Gürcistan), 1 matsoni fabrikasından alınan atık su örneği (Tiflis, Gürcistan), Kura nehrinden alınan 2 çevresel atık su örneği (Tiflis, Gürcistan) ve Gürcistan, Senaki’ den alınan 1 çevresel atık su örneği bakteriyofaj izolasyon kaynağı olarak kullanılmıştır. Matsoni örnekleri alınış zamanlarına göre matsoni 1 ve matsoni 2 olarak, çiğ süt örnekleri yine alınış zamanlarına göre çiğ süt 1, çiğ süt 2, çiğ süt 3 ve çiğ süt 4 olarak, matsoni fabrikasından alınan atık su örneği atık su 4, Kura nehrinden alınan örnekler alınış zamanına göre 50 atık su 1 ve atık su 3; Senaki’ den alınan atık su örneği atık su 2 olarak isimlendirilmiştir. Fajların izolasyonunun zenginleştirme aşamasında potansiyel konakçı olarak 26 farklı Lactobacillus suşu: K4, 31, Tg1-3, Al 2-3, B7 2-4, 53S, 52σ, 51B, 53R, 50B, 100S, Tg 1-4, 102B, 100C, 34, Kd3, Bj 2-3, Kr, 59, Go, B1, I3, 100B, 55B, 102S, 102M; 12 farklı Streptococcus suşu: 6AX, 43B, 47B, 2S, 48B, 2B, 7B, 4S, 6B, 5AS, 101B, 101S; 8 farklı Enterococcus suşu: 8, 9, 49S, 9Aσ, 6AB, 1AS, 9AS, 47S kullanılmıştır. Sonuç olarak: Lactobacillus suşlarına karşı 19 potansiyel faj karışımı (1R, 2R, 3R, PR1, WR1, PR2, WR2, PR3, WR3, MR1, SR1, RMR1, MR2, SR2, RMR2, MR3, SR3, RMR3, PlR), Streptococcus suşlarına karşı 14 potansiyel faj karışımı (1C, 2C, 3C, PC1, WC1, PC2, WC2, MC1, SC1, RMC1, MC2, SC2, RMC2, PlC) ve Enterococcus suşlarına karşı 2 potansiyel faj karışımı (13E, WE) elde edilmiştir. Çizelge 3.2 ve 3.3’ te kullanılan faj kaynaklarına verilen kodlar ve test edilen konakçı bakteriler özetlenmiştir. 51 31 Tg 1-3 Al 2-3 B7 2-4 53S 52σ 51B 53R 50B 100S Tg 1-4 102B 100C 34 Kd3 Bj 2-3 Kr 59 Go3 B1 I3 100B 55B 102S 102M AS 1 Ma 1 ÇS 1 PAS AS 2 PAS AS 2 PAS AS 2 Ma 2 ÇS 2 ÇS 3 Ma 2 ÇS 2 ÇS 3 Ma 2 ÇS 2 ÇS 3 AS 3 K4 Çizelge 3.2. Kullanılan faj kaynaklarına verilen kodlar ve izolasyonda kullanılan potansiyel konakçı bakteriler- Lactobacillus sp. Potansiyel Konakçı Bakteri (Lactobacillus sp.) Faj Faj Kaynağı Kodu + + + + + + + + - + + + + + + + + + + + + + + + + + + + + + + + + + + - + + + + + + + + - + + + + + + + + - + + + - + + + + + + + + - + + + - + + + + + - + + + + + - + + + + + + + + + + + + + + + + + + + + + + + + + + + + + - + + + + + - - - - - - - - + + + + - - - + + + - - - - - + + + + + - + + + + + - + + + + + + + - +, izolasyonda kullanılan potansiyel konakçı bakteriler; -, izolasyonda kullanılmayan bakteriler. AS, atık su; Ma, matsoni; ÇS, çiğ süt; PAS, peynir altı suyu. 1R 2R 3R PR1 WR1 PR2 WR2 PR3 WR3 MR1 SR1 RMR1 MR2 SR2 RMR2 MR3 SR3 RMR3 PlR 52 Çizelge 3.3. Kullanılan faj kaynaklarına verilen kodlar ve izolasyonda kullanılan potansiyel konakçı bakteriler-Streptococcus sp., Enterococcus sp. Faj Kaynağı Atık su 1 Matsoni 1 Çiğ süt 1 Peynir altı suyu Atık su 2 Peynir altı suyu Atık su 2 Matsoni 2 Çiğ süt 2 Çiğ süt 3 Matsoni 2 Çiğ süt 2 Çiğ süt 3 Atık su 3 6AX + + + + + + + + + 43B + + + + + + + + + 47B + + + + + + + + + 2S + + + - Potansiyel Konakçı Bakteriler Streptococcus sp. 48B 2B 7B 4S 6B 5AS + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + Enterococcus sp. 6AB 1AS 9A 8 9 49S Çiğ süt 4 + + + + + Atık su 4 + + + + + +, izolasyonda kullanılan potansiyel konakçı bakteriler; -, izolasyonda kullanılmayan bakteriler. Faj Kodu 101B + + + + + + 101S + + + + + + + + + 1C 2C 3C PC1 WC1 PC2 WC2 MC1 SC1 RMC1 MC2 SC2 RMC2 PlC 9AS 47S + + + 13E + + + WE 53 Çalışma boyunca en az 6 faj karışımı izole edilmiştir. Örneğin; SR3 faj örneği Lactobacillus 59 suşu üzerinde farklı plak tipleri göstermiştir: a) ~1 mm çapında, net lizis görülen koloniler, b) ~1 mm çapında, net olmayan lizis görülen koloniler, c) ~2 mm çapında, bulanık bir zon içinde net lizis görülen koloniler. Bu sonuçlar da plak morfolojilerine göre bu fajın en az 2 ya da 3 farklı suşu olduğunu göstermektedir (Şekil 3.2). Şekil 3.2. Lactobacillus 59 suşu üzerinde SR3 fajının plak morfolojisinin görünümü İzole edilen fajlara faj-konakçı interaksiyonunun belirlenebilmesi için farklı laktik asit bakteri suşları ile spot test uygulanmıştır. Çizelge 3.4 ve 3.5’ te sonuçlar özetlenmiştir. 54 Çizelge 3.4. Konakçı olarak Lactobacillus sp. suşlarının kullanıldığı spot test sonuçları. Tg 1-3 Al 2-3 B7 2-4 53S 52σ 51B 53R 50B 100S Tg 1-4 102B 100C 34 Kd3 Bj 2-3 Kr 59 Go B1 I3 100B 55B 102S 102M 1R 2R 3R PR1 WR1 PR2 WR2 PR3 WR3 MR1 SR1 RMR1 MR2 SR2 RMR2 MR3 SR3 RMR3 PlR 31 Faj K4 Potansiyel Konakçı Bakteri (Lactobacillus sp.) U U U U U U U U U U U U U - + + U U U U U U - U U U U U U U U U U U U U U U U U U U U + + U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U - U U U U U U U U U - U U U U U U U U U - U U U U U U U U U - U U U U U U U U U U U U U U U U U U U U U U U U U U + + U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U U - U U U U U U U U U U U U U U U U U U - U U U U U U U U U U U U U U U U U U - U U U U U U U U U U U U U U U U U U - ++, net olmayan lizis; +, net lizis; -, lizis görülmeyen; U, test uygulanmayan bakterileri ifade eder. 55 Çizelge 3.5. Konakçı olarak Streptococcus sp. ve Enterococcus sp suşlarının kullanıldığı spot test sonuçları Phages 1C 2C 3C PC1 WC1 PC2 WC2 MC1 SC1 RMC1 MC2 SC2 RMC2 PlC 13E WE 6AX ++ ++ U U U U U 8 - 43B U U U U U - 47B U U U U U 9 - 2S U U U U U U U U U U U 49S - Potansiyel Konakçı Bakteri Streptococcus sp. 48B 2B 7B 4S + U U U U U U U U U U Enterococcus sp. 6AB 9A - ++, net olmayan lizis; +, net lizis; -, lizis görülmeyen; U, test uygulanmayan bakterileri ifade eder. 6B U U U U U U 1AS - 5AS - 101B U U U U U U U U 9AS - 101S U U U U U 47S - 56 Bu çizelgelere göre Lactobacillus Tg 1-3, 53S ve 59 suşlarına karşı etkili 4 faj, Streptococcus 6 AX ve 2B suşlarına karşı etkili 2 faj izole edilmiştir. Bu sonuçlar doğrultusunda fajların plak morfolojisini belirlemek için konakçı bakterileri kullanılarak çift tabaka agar yöntemi uygulanmıştır. Çizelge 3.6’ da sonuçla özetlenmiştir. Çizelge 3.6. İzole edilen fajların plak morfolojisi. Faj Konakçı Bakteri Plak özelliği MR3 SR3 Lactobacillus 59 Bulanık merkezli net lizis 3 Düzensiz kenarlı net plaklar 1 Net plaklar 1 Bulanık merkezli net plaklar 2 Net plaklar 1 Bulanık merkezli net plaklar 2 Net plaklar 1 Lactobacillus 59 2C Streptococcus 6AX 3C Streptococcus 2B Plak çapı (mm) İzolasyondan sonra bu fajlar saflaştırılmış, zenginleştirilmiş ve çift tabaka agar yöntemi kullanılarak titreleri belirlenmiştir. En iyi sonuçların alınabilmesi için çift tabaka agar yönteminin koşulları optimize edilmiştir. Çizelge 3.7’ de optimizasyon için denenmiş olan koşullar kısaca özetlenmiştir. Çizelge 3.7. Çift tabaka agar yöntemi için denenmiş olan optimizasyon koşulları. Değişkenler Koşullar Eklenen bakteri miktarı (L) 100 200 Eklenen faj miktarı (L) 100 1000 5 15 0,4 0,7 Eklenen CaCl2 konsantrasyonu (mM) 0 10 İnkübasyon süresi (sa.) 24 48 Bakteri-faj karıştırıldıktan sonra bekleme süresi1 (dk.) İkinci tabakada kullanılan besiyerinin2 agar miktarı (%) adsorpsiyon süresi, 2 yumuşak agar 1 20 72 57 Çizelgede belirtilen tüm koşullar denendikten sonra sonuçlar değerlendirildiğinde optimize edilen koşullar; Ekelenen bakteri miktarı 100 µL, Eklene faj miktarı 100 µL, Kullanılan yumuşak agardaki agar miktarı % 0,7, Adsorbsiyon süresi 5 dk. Fajın hücre duvarına adsorbsiyonu için CaCl2 kullanılmamış, İnkübasyon süresi 48 saat olarak belirlenmiştir. Optimize edilen koşullar kullanılarak çift tabaka agar yöntemi uygulanmıştır. PR 2 ve WR2 fajları için titrasyon sonuçları elde edilememiştir. Diğer sonuçlar ise Çizelge 3.8’ de özetlenmiştir. 58 Çizelge 3.8. Çif tabaka agar yönteminin sonuçları. Konakçı Bakteri 3C MR3 SR3 10-7 10-8 10-9 10-10 Titre (pfu/mL) - - - - - 1 x 105 1 - - - - - 1,5 x 105 - 4 - - - - - 4 x 105 2 - 1 2 - 1 8 8 x 1010 10-1 10-2 10-3 10-4 Streptococcus sp. 2C Seyreltmeler 10-5 10-6 6AX - - - 10 1 2B - 2 - - Lactobacillus sp. Faj 59 - - 1 59 - 2 - -, lizis görülmeyen. 59 Çizelgeye göre Streptococcus 6AX konakçısı üzerine ekilen 2C fajının titresi 1x105, diğer sonuçlar ise stabil değildir. A B Şekil 3.3. Çift tabaka agar yöntemi sonuçlarının görünümü. A, Lactobacillus 59 üzerine ekilen MR3 fajı (faj seyreltmesi 10-5); B, Lactobacillus 59 üzerine ekilen SR3 (faj seyreltmesi 10-10) fajı. Elektron mikroskop çalışması için net plaklar bir tüp içerisine toplanıp santrifüj edilmiştir. Daha sonra spot test uygulanmıştır (Şekil 3.4). Test sonucunda görülen net plaklar alınarak elektron mikroskop görüntüsü için hazırlanmıştır. Ancak mikroskop görüntüsü alınamamıştır. Bunun üzerine spot test üç kez daha tekrarlanmış ve faj titresini arttırmak için daha fazla plak toplanmıştır. Ancak sonuçta yine görüntü alınamamıştır. Şekil 3.4. Spot test sonucunu gösteren bir petri kabı. 60 Elektron mikroskobunda görüntü alınamaması ve titre sonuçlarının stabil olmaması izole edilen fajların lizojenik hayat döngüsüne sahip olabileceğini düşündürmüştür. Bu doğrultuda, 10 Lactobacillus ve 10 Streptococcus suşuna MC testi uygulanmıştır. Çizelge 3.9 ve Şekil 3.5’ te alınan sonuçlar verilmiştir. Lactobacillus sp. Streptococcus sp. Çizelge 3.9. Mitomisin C testi sonuçları. Test Edilen Bakteriler 101B 2S 4S 101S 5AS 6AX 2B 48B 47B 43B 102M 102B 100C Tg 1-3 Kd3 34 31 59 53R 53S 58B Kontrol tüpleri - MC Testi + + + + + + +, bakteri üremesi görülmeyen tüpler (pozitif test sonucu); -, bakteri üremesi görülen tüpler (negatif test sonucu). a b c Şekil 3.5. MC test sonuçlarını gösteren fotoğraflar; her üç resim için sağ tarafta bulunanlar test tüpleri, soldakiler ise kontrol gruplarıdır. a, Lactobacillus 59; b, Lactobacillus 53S; c, Lactobacillus 58B. 61 Elde edilen test sonuçlarına göre; Streptococcus 101S, 5AS, 2B suşları ile Lactobacillus 59, 53S, 58B suşları profaj taşımaktadır. Bu nedenden dolayı çoğu kez anlaşılmaz titre sonuçları veren MR3 ve SR3 fajının konakçı bakterisini değiştirmeye karar verilmiştir. Bu amaçla uygun konakçı bulunana kadar spot test uygulanmıştır. MR3 fajı için Lactobacillus 58B ve 53S, SR3 fajı için Lactobacillus 58B ve 53S, Lactobacillus MC 59 fajı için Lactobacillus Kd3 konakçıları tanımlanmıştır (Şekil 3.6). A B Şekil 3.6. Spot test sonuçlarının görünümü. A, Lactobacillus 53S ve 58B’ ye karşı Lactobacillus SR3 fajı; Lactobacillus 53S ve 58B’ ye karşı Lactobacillus MR3 fajı; B, Lactobacillus Kd3’ e karşı Lactobacillus MC 59 fajı. Elde edilen sonuçlar doğrultusunda, belirlenen konakçı bakteriler kullanılarak saflaştırma ve titre belirleme işlemleri uygulanmıştır. Fakat, titre sonuçları yine istikrarlı çıkmamıştır. Çalışmanın amaçlarından biri de faj dirençli suşların elde edilmesidir. Bu amaçla zenginleştirilmiş faj (1 mL) steril bir agar plağı üzerine yayılmış ve kurumaya bırakılmıştır. Daha sonra üzerine bir gecelik taze bakteri kültürü ilave edilip yayılmış ve tekrar kurumaya bırakılmıştır. Petri kapları 37 oC’ de anaerobik koşullar altında 48 saat inkübasyona bırakılmıştır. Sonuçlar Şekil 3.7’ de gösterilmektedir. 62 Şekil 3.7. SR3 fajına dirençli mutant Lactobacillus 53S' suşu. Mutant suşlar 53S' ve 58B' olarak isimlendirilmiştir. Mutant Lactobacillus 53S' ve 58B' suşunın faj dirençini değerlendirebilmek için konakçı bakterilerin taze kültürleri ilk stoktan hazırlanmış ve spot test uygulanmıştır. Çizelge 3.10’ de elde edilen sonuçlar özetlenmiştir. Çizelge 3.10. Spot test sonuçları. Faj SR3 MR3 53S + + Potansiyel Konakçı Bakteri 53S' 58B + + 58B' - -, lizis görülmeyen; +, net lizis görülen. Elde edilen sonuçlar değerlendirildiğinde vahşi suşların fajlara karşı duyarlı, mutantların ise fajlara karşı dirençli olduğu görülmektedir. Mutant suşlar geçirimli elektron mikroskobuyla (TEM) incelenmiş ancak vahşi suşlarından farklı bir morfoloji gözlemlenmemiştir (Şekil 3.8). (1) (2) Şekil 3.8. TEM görüntüleri. (1), 53S' suşunun 32000x’ lik büyütmede görünümü; (2) 53S' suşunun 30000x’ lik büyütmede görünümü. 63 4.TARTIŞMA Laktik asit bakterilerinin gıda üretimi ve insan sağlığı üzerine yararlı etkileri çok uzun yıllar önce anlaşılmıştır. Fermantasyondaki önemleri, sütü çok hızlı asitlendirmeleri ve ana ürün olarak laktik asit üretmeleriyle açıklanmaktadır. Bazı suşlar asetik asit, etanol, aroma bileşenleri, bakteriyosinler, eksopolisakkaritler ve önemli enzimler (proteaz gibi) üretirler. Bu sayede fermente ürünlerin raf ömrü ve mikrobiyel kalitesini önemli ölçüde arttırırlar. Buna ek olarak, ürünlere yapısal ve duyusal özelliklerini kazandırarak istenilen tat ve aromada standart ürün eldesini sağlarlar (Mozzi ve ark., 2010). Fermantasyonda bu denli önemli olan laktik asit bakterilerinin en büyük düşmanları bakteriyofajlardır. Faj enfeksiyonu, peynir ve fermente süt ürünleri sektöründe starter aktivitesini azaltıp fermantasyon sonunda asit üretimini önemli derecede azaltarak ya da tamamen bloke ederek ürün kalitesinin olumsuz yönde etkilenmesine neden olur. Çiğ süt, içinde bulundurduğu serbest faj partikülleri ya da içindeki laktik asit bakterilerinde bulunan profajlar ile fajların ana kaynağını oluşturmaktadır. Fajları yok etmek oldukça güçtür, çünkü süt işletmelerinde çok hızlı yayılırlar. Dolayısıyla, faj enfeksiyonu süt endüstrisinde oldukça büyük ekonomik kayıplara neden olmaktadır. Bu konuda yapılan çalışmalar fajların kontrol altına alınabilmesi yönündedir ve geliştirilen yöntemler endüstri açısından çok büyük önem taşımaktadır (Guglielmotti ve ark., 2012). Tez kapsamında laktik asit bakteri fajlarının tercih edilmesindeki en büyük etken, bahsedilen nedenlerden dolayı yaşanan ekonomik kayıpların en aza indirilmesi veya 64 tamamen yok edilmesi adına yeni yöntemlerin geliştirilmesi için yol gösterir nitelikte olabileceği düşüncesidir. Bu konuda, Ishnaiwer ve Al-Razem (2013) birçok laktik asit bakteri kültür karışımı kullanılarak yapılan kurutulmuş tuzlu bir fermente süt ürünü olan Laban jameed ile çalışmışlardır. Laban jameed birçok doğu Akdeniz ülkesinde tüketilen, genellikle koyun ya da inek sütü kullanılarak yapılan geleneksel bir üründür. Çalışmalarında üründe faj kontaminasyonunu belirlemeyi amaçlamışlardır. Biri koyun sütü kullanılarak yapılan jameed (PPUDV), diğeri ise inek sütü kullanılarak yapılan jameed (PPURV)’ den elde ettikleri fajlar olmak üzere iki faj izole etmişlerdir. Daha sonra spot test yöntemi ile faj-konakçı interaksiyonunu belirlemişler ve sonuçta PPUDV fajı için Lactobacillus helveticus, PPURV fajı için ise Bacillus amyloliquefaciens suşlarını konakçı olarak saptamışlardır. Capra, ve ark. (2010) ise çalışmalarında faj izolasyonu için Lactobacillus paracasei ve Lactobacillus casei suşlarını kullanmışlardır. Toplam üç faj izole etmişler ve CL1, CL2 ve iA2 olarak adlandırmışlardır. Faj-konakçı ilişkisini belirlemek için spot test yöntemini kullanmışlardır. CL1, CL2 fajları için 16 L. paracasei suşu, iA2 fajı için 13 L. casei suşunu test etmişler, sonuçta CL1, CL2 fajları için 9 L. paracasei suşu, iA2 fajı için 11 L. casei suşunu konakçı olarak belirlemişlerdir. Biz de yaptığımız çalışmada peynir, yoğurt, matsoni ve çiğ süt örneklerinden izole edilen ve IBMW kültür koleksiyonundan temin edilen 59 farklı laktik asit bakteri suşu kullandık. Bu suşlardan 18’ i çeşitli ev yapımı matsoni, çiğ süt ve peynir örneklerinden izole edildi, 4’ ü IBMV kültür koleksiyonundan, 37 izolat ise George Eliava Enstitüsü Araştırma&Geliştirme bölümünden temin edildi. Faj izolasyonu için ise atık su, peynir 65 altı suyu, matsoni ve çiğ süt kullandık, ancak sadece matsoni ve çiğ sütten faj izolasyonu yapabildik. Matsoniden izole edilen fajları MR3 ve 2C olarak, çiğ sütten izole edilen fajları ise SR3, 3C olarak isimlendirdik. 2C ve 3C fajlarının konakçılarının bulunabilmesi için spot test uyguladık ve sonuçta 2C fajı için Streptococcus 6AX ve 3C fajı için Streptococcus 2B konakçılarını tespit ettik. Tayland’ da Phumkhachorn ve Rattanachaikunsopon (2012) yaptıkları bir çalışmada ülkede geleneksel bir fermente gıda olan kem-buk-nud’ un yapımında starter kültür olarak kullanılan Lactococcus lactis RP359’ u enfekte eden bir fajın izolasyonu ve karakterizasyonunu belirlemeyi amaçlamışlardır. 30 kem-buk-nud örneğinden Lactococcus lactis RP359 suşuna karşı etkili bir litik faj izole etmişler ve RP359 olarak adlandırmışlardır. Spot test için 21 farklı suş kullanmışlardır. Fajın konakçısını belirledikten sonra çift tabaka agar yöntemini uygulamışlar ve sonuçta petride yaklaşık 1- 1,5 mm çapa sahip net plaklar gözlemlemişlerdir. Bir başka çalışmada ise Parada ve ark. (1984) Arjantin’ de fabrikalardan topladıkları peynir altı suyu örneklerinden Streptococcus lactis subsp. lactis C2 suşuna spesifik üç bakteriyofaj izole etmişlerdir. İzole ettikleri tüm fajların oluşturdukları plak boyutlarının birbirine çok yakın, benzer morfolojide olduğunu tespit etmişlerdir. Dahi (yoğurt benzeri fermente bir ürün) suyundan izole ettikleri Lactococcus lactis ssp. diacetylactis suşuna karşı etkili dört litik faj ile çalışan Masud ve ark. (2009) çalışmalarında bu fajları karakterize etmeyi amaçlamışlardır. Bu amaçla konakçıları spot testle belirlenen fajlara çif tabaka agar yöntemi uygulamışlardır. Sonuçta fajların konakçı bakterileri üzerinde net plaklar oluşturduklarını ve bu plakların 1-3 mm 66 arasında değişen çaplara sahip olduğunu gözlemlemişlerdir. Plak boyutlarındaki çeşitliliği farklı tipte fajlar olarak değerlendirmişlerdir. Biz de konakçıları belirlenen fajların çift tabaka agar yöntemi kullanarak plak morfolojilerini belirledik. 2C fajı Streptococcus 6AX konakçısı üzerinde ~1 mm çapında net plaklar ve ~2 mm çapında bulanık merkezli net plaklar oluşturdu. 3C fajı ise Streptococcus 2B konakçısı üzerinde ~1 mm çapında net plaklar oluşturdu. Plak boyutlarındaki ve özelliklerindeki çeşitliliğe dayanarak elde edilen fajları farklı tipte fajlar olarak değerlendirdik. Polonya’ nın çeşitli bölgelerindeki süt fabrikalarından topladıkları süt örneklerinde faj varlığını araştırmak amacıyla Szczepańska ve ark. (2007) on yedi bölgeden topladıkları otuz üç örneği analiz etmişler ve sonuçta Lactococcus lactis suşuna karşı etkili fajlar bulmuşlardır. Elde ettikleri fajların titresini belirlemek için çift tabaka agar yöntemini kullanmışlar ve sonuçta 103-1012 pfu/mL arasında değişen değerler elde etmişlerdir. Yine çift tabaka agar yöntemiyle belirledikleri plak morfolojilerini değerlendirdiklerinde 200 faj izole etmiş ve saflaştırmışlardır. Biz de çalışmamızda konakçılarını belirlediğimiz fajların titrelerinin belirleyebilmek için çift tabaka agar yöntemini uyguladık ve sonuçta 2C fajı-Streptococcus 6AX suşuna ait petrilerde titre değerini 1x10-5 pfu/mL olarak bulduk. 67 Çalışmalarında İtalya ve Arjantin’ deki fabrikalardan temin etiikleri peynir altı suyu, yoğurt ve peynir örneklerinden elde edilen 16 starter kültür örneğini kullanan Suarez ve ark. (2007) yaptıkları araştırmada bu starterlerden Lactobacillus delbrueckii suşundan izole edilen ılımlı fajların karakterizasyonunu belirlemeyi amaçlamışlardır. Bu amaçla, örneklerde lizojeni tespiti için MC testini uygulamışlardır. Sonuçta işlem görmüş tüplerin %37’ sinde faj partiküllerini görmüş ya da bakteri hücrelerinin ölümünü gözlemlemişlerdir. Ancak, Lactobacillus delbrueckii suşuna karşı etkili sadece iki aktif faj izole etmişlerdir. Biz de yaptığımız çalışmada profaj varlığının belirleyebilmek için peynir, çiğ süt ve matsoni örneklerinden elde edilen 10 Streptococcus, 10 Lactobacillus suşunu kullandık. Bu suşlardaki lizojeni varlığını belirlemek için MC testi yaptık ve sonuçta Lactobacillus 59, Lactobacillus 53S, Lactobacillus 58B suşlarında profaj varlığını tespit ettik. Daha sonra konakçı tespiti için tekrar spot test uyguladık. Testin sonucunda Lactobacillus 58B ve 53S suşlarına karşı MR3 ve SR3 fajlarının, Lactobacillus Kd3 suşuna karşı, MC testi sonucunda Lactobacillus 59 suşundan izole edilen Lactobacillus MC 59 fajının etkili olduğunu tespit ettik. Laktik asit bakterileri süt endüstrisinde ürüne özgü özelliklerin kazandırılması için starter kültür olarak kullanılan bakterilerdir. Bu baktreilerin fajlar tarafından enfekte edilmesi ya da profaj içeren suşların kullanımı ürün kalitesini etkilemekte ve ekonomik kayıplara neden olmaktadır. Bu nedenle laktik asit bakterileri ve laktik asit bakteri fajları, üzerinde daha kapsamlı çalışmalar gerektiren bir alandır. 68 5. SONUÇ VE ÖNERİLER Tez kapsamında elde edilen tüm sonuçlar değerlendirildiğinde matsoniden ve çiğ sütten sırasıyla MR3, 2C ve SR3, 3C fajları izole edilmiştir. Elde edilen fajların karakterizasyonu için çeşitli kaynaklardan izole edilen veya temin edilen laktik asit bakteri izolatlarıyla olan özgüllüğü araştırılmıştır. Bu amaçla yapılan spot test sonuçları dikkate alındığında sadece üç laktik asit bakteri izolatının fajlardan etkilendiği görülmüştür. Spot test sonuçlarına göre, matsoniden izole edilen MR3, 2C fajları ve sütten izole edilen SR3, 3C fajlarının peynirlerden elde edilen izolatlar üzerine etkisinin olmadığı gözlemlenmiştir. Bunu peynir teknolojisinde kullanılan kültürlerinin genellikle faj dirençli olmasına bağlayabiliriz. Ancak, Eliava IBMV kültür koleksiyonundan temin edilen ve matsoniden izole edilmiş olan; Streptococcus 6AX, Streptococcus 2B suşlarına karşı sırasıyla 2C ve 3C fajlarının etkili olduğu tespit edilmiştir. Konakçıları tespit edilen fajlara titre belirlemek için Çift Tabaka Agar Yöntemi uygulandığında 2C fajı (Streptococcus 6AX suşuna ait petrilerde) için titre değeri 1x10-5 pfu/mL olarak bulunmuştur. Laktik asit bakterilerinde lizojeninin oldukça yaygın olması (Davidson ve ark., 1990), titre sonuçlarının stabil olmaması gibi nedenlerden dolayı fajların lizojenik yaşam döngüsüne sahip olabileceği düşünülmüş ve daha önce konakçı olarak belirlenmiş bakterilerle birlikte diğer bazı bakterilere MC testi uygulanmıştır. Sonuçta Eliava IBMV kültür koleksiyonundan temin edilen, Lactobacillus 59, Lactobacillus 53S, Lactobacillus 58B suşlarında profaj varlığı tespit edilmiştir. Konakçı tespiti için yapılan spot test sonucunda; 69 Lactobacillus 58B ve 53S suşlarına karşı MR3 ve SR3 fajlarının, Lactobacillus Kd3 suşuna karşı, MC testi sonucunda Lactobacillus 59 suşundan izole edilen Lactobacillus MC 59 fajının etkili olduğu tespit edilmiştir. Ayrıca, Lactobacillus 53S' ve 58B' mutant suşlarının MR3 ve SR3 fajlarına karşı dirençli, Lactobacillus 53S ve 58B vahşi suşlarının ise duyarlı oldukları gözlemlenmiştir. Gelecekte mutant ve vahşi suşlar arasında genetik açıdan ne gibi farklar meydana geldiğini görmek için moleküler düzeyde çalışmaların yapılması, laktik asit bakterilerinin direnç mekanizmalarının anlaşılması açısından önemlidir. Ayrıca, izole edilmiş olan fajların ve konakçılarının genetik yapısının incelenmesi uzun vadeli hedefler arasındadır. Yapılacak olan çalışmaların, faj-konakçı ilişkisi hakkında kapsamlı bilgiler edinilmesini sağlayarak anti-faj stratejilerinin geliştirilmesinde temel oluşturacağı düşünülmektedir. Bu çalışmalar, endüstride yaşanan faj kaynaklı sorunlara çözüm olması açısından çok büyük önem taşımaktadır. 70 ÖZET Laktik Asit Bakterileri ve Bakteriyofajlarının Çeşitli Kaynaklardan İzolasyonu ve Karakterizasyonu Laktik asit bakterileri; Gram pozitif, prokaryot, heterotrof, fermantasyon neticesinde laktik asit üreten bakteriler olarak tanımlanırlar. Süt endüstrisinde fermantasyon özelliklerinden dolayı starter kültür olarak kullanılmaktadırlar. Starter kültürlerin en önemli özellikleri laktozu fermente ederek laktik asit üretmeleridir. Asit, fermente süt ürünün tat, aroma, yapısal özelliklerinin kazandırılmasından ve raf ömrünün arttırılmasından sorumludur. Ancak, endüstride starter kültür kullanımının yaygınlaşması bakteriyofaj (faj) sorununu da beraberinde getirmiştir. Fajlarla kontamine olan starter kültürler ürünün düşük kalitede olmasına neden olmaktadır. Tez kapsamında, laktik asit bakterilerinin ve laktik asit bakteri fajlarının çeşitli çevresel kaynaklardan ve süt ürünlerinden izolasyonu, izole edilen laktik asit bakteri fajlarının faj-konakçı etkilerinin araştırılması, belirlenen konakçılar kullanılarak fajların koloni morfolojileri ve yaşam döngülerinin incelenmesi amaçlanmıştır. Yapılan çalışmada, 18’ i çeşitli ev yapımı matsoni, çiğ süt ve peynir örneklerinden izole edilen, 4’ ü Eliava Bakteriyofaj, Mikrobiyoloji ve Viroloji Enstitüsü (IBMV) kültür koleksiyonundan, 37’ si George Eliava Enstitüsü Araştırma&Geliştirme bölümünden temin edilen 59 farklı laktik asit bakteri suşu kullanılmıştır. Faj izolasyonu için ise atık su, peynir altı suyu, matsoni ve çiğ süt kullanılmıştır. Kullanılan örneklerden matsoni ve çiğ sütten sırasıyla MR3, 2C ve SR3, 3C olarak isimlendirilen litik yaşam döngüsüne sahip fajlar izole edilmiştir. Fajların konakçı tespiti için yapılan spot test sonucunda 2C ve 3C fajlarının konakçılarının sırasıyla Streptococcus 6AX, Streptococcus 2B suşları olduğu tespit edilmiştir. Daha sonra fajlar zenginleştirilmiş ve titre belirlemek için çift tabaka agar yöntemi uygulanmıştır. Sonuçta 2C fajının titre değeri 1x10-5 pfu/mL olarak bulunmuştur. Profaj tespiti için yapılan MC testi Lactobacillus 59, Lactobacillus 53S, Lactobacillus 58B suşlarında profaj varlığını göstermiştir. Bunun üzerine ilgili suşlar için spot testler tekrarlanmıştır. Sonuç olarak, MR3 ve SR3 fajlarının konakçılarının Lactobacillus 58B ve 53S suşları, MC testi sonucunda Lactobacillus 59 suşundan izole edilen Lactobacillus MC 59 fajının konakçısının Lactobacillus Kd3 suşu olduğu tespit edilmiştir. Lactobacillus 53S' ve 58B' mutant suşlarının ise MR3 ve SR3 fajlarına karşı dirençli oldukları gözlemlenmiştir. Anahtar Sözcükler: Bakteriyofaj, çift tabaka agar yöntemi, laktik asit bakterileri, spot test, süt ürünleri. 71 SUMMARY Isolation of Lactic Acid Bacteria and Bacteriophages from Different Sources and Their Characterization Lactic acid bacteria that produce lactic acid as the end-product of carbohydrate fermentation are characterized as Gram positive, procaryote and heterotroph. Because of their fermentetion properties lactic acid bacteria have been used as starter cultures in dairy industry. The production of lactic acid by fermenting lactose is the most important feature of starter cultures. The acid is responsible for development of characteristic body and texture of the fermented milk products, contributes to the overall flavour of the products, and enhances preservation. However, using starter culturs in dairy industry bring about phage problem. Phage contamination in starter cultures cause low-quality products. Whitin this thesis, isolation of lactic acid bacteria and their phages from different environmental sources and dairy products, investigation of phage-host interactions using these isolates, examination of colony morphologies and life cycles of these phages with using their hosts were purposed. In this research, 59 different lactic acid bacteria strains; 18 of these bacteria isolated from different homemade matsoni, raw milk and cheese samples, 4 of them were kindly supplied by Eliava Institute of Bacteriophage, Microbiology and Virology (IBMV) culture collection, 37 of them kindly supplied by Research & Development department of IBMV were used. Waste water, whey, matsoni and raw milk samples were used for isolation of phages. Phages which named as MR3, 2C ve SR3, 3C were isolated from matsoni and raw milk samples respectively. As a result of spot test which have been done for phage-host range, 2C and 3C phages’ hosts were determined as Streptococcus 6AX and Streptococcus 2B respectively. Then phages were concentrated and double layer agar method was used for titration of phages. In conclusion, the titer of 2C phage was found as 1x10-5 pfu/mL. The results of MC test which was performed for determination of prophage, were demonstrated that Lactobacillus 59, Lactobacillus 53S, Lactobacillus 58B strains carry the prophage. After that spot test was repeated again with related strains. Consequently, Lactobacillus phage MR3 and SR3 were active against Lactobacillus 58B and 53S strains, Lactobacillus phage MC 59 was active against Lactobacillus Kd3 strain. The mutant strain Lactobacillus 53S' and 58B' were observed as resistant against MR3 ve SR3 phages. Key Words: Bacteriophages, dairy product, double layer agar method, lactic acid bacteria, spot test. 72 KAYNAKLAR ABEDON, S.T. (2008). Bacteriophage Ecology: Population Growth, Evolution, and Impact of Bacterial Viruses. New York, USA. Cambridge University Press. ADAMS, M. H., (1959). Bacteriophages. New York: Interscience Publishers, Inc. p.:450-451 ALLISON, G. E. ve KLAENHAMMER, T. R. (1998). Phage resistance mechanisms in Lactic Acid Bacteria. Int. Dairy J. 8: 207-226. AŞKAR, M., ASLIM, B., BEYATLI, Y. (1999). Et ürünlerinden izole edilen Pediococcus acidilactici suşlarının bazı metabolik ve antimikrobiyal aktivitelerinin incelenmesi. Turkish Journal of Veterinary and Animal Sciences. 23 (3): 467-474. BACUS, J.N. ve BROWN, W.L. (1981). Use of microbial culture; meat products. Food Technology. 35(1): 74-8. CAPRA, M.L., MERCANTI, D.J., REINHEIMER, J.A. ve QUIBERONI, A.L. (2010). Characterisation of Three Temperate Phages Released from The Same Lactobacillus paracasei Commercial Strain. Society of Dairy Technology. 63: 396-405. CLOKIE, M. R. J., KROPINSKI, A. M. (2009). Bacteriophages: Methods and Protocols, Isolation, Characterization, and Interactions. Vol. I. New York, USA: Humana Press, Chapter 2. DAVIDSON, B.E., POWELL, I.B., HILLIER, A.J. (1990). Temperate Bacteriophages and Lysogeny in Lactic Acid Bacteria. FEMS Microbiology Letters. 87(1-2): 79-90. DAVIS, J.E. ve SINSHEIMER, R.L. (1963). The Replication of Bacteriophage MS2:1. Transfer of Parental Nucleic Acid to Progeny Phage. Journel of Moleculer Biology. 6: 203-207. DE MAN, J., ROGOSA, M., SHARPE, M. (1960). A medium for the cultivation of Lactobacilli. J. Appl. Bacteriol. 23: 130-135. ERGÜLLÜ, E. (1982). Bakteriyofaj ve süt teknolojisinde yarattığı sorunlar. Gıda, 5: 239-245. FITZSIMONS, N. A., COGAN, T. M., CONDON, S., BERESFORD, T. (1999). Phenotypic and genotypic characterization of non-starter lactic acid bacteria in mature cheddar cheese. Applied and Enrivonmental Microbiology. 65: 3418- 3426. FLOROU-PANERI, P., CHRISTAKI, E., BONOS, E. (2013). Lactic Acid Bacteria - R & D for Food, Health and Livestock Purposes: Lactic Acid Bacteria as Source of Functional Ingredients, Dr. J. Marcelino Kongo (Ed.), ISBN: 978-953-51-0955-6, InTech, DOI: 10.5772/47766. FULLER, R. (1989). A review. Probiotics in man and animals. Journal of Applied Bacteriology. 66: 365-78. GARNEAU, J.E., MOINEAU, S. (2011). Bacteriophages of Lactic Acid Bacteria and Their Impact on Milk Fermentations. Microbial Cell Factories. 10(1): S20. GIRAFFA, G., CHANISHVILI, N., WIDYASTUTI, Y. (2010). Importance of Lactobacilli in Food and Feed Biotechnology. Research in Microbiology. 161: 480-487. GOMES A. M. P., MALCATA F. X. (1999). Bifidobacterium spp. and Lactobacillus acidophilus: biological, biochemical, technological and therapeutical properties relevant for use as probiotics. Trends in Food Science & Technology. 10: 139-157 GUGLIELMOTTI, D.M., MERCANTI, D.J., REINHEIMER J.A. ve QUIBERONI, A.L. (2012). Review: Efficiency of Physical and Chemical Treatments on the Inactivation of Dairy Bacteriophages. Frontiers in Microbiology. 2(282): 1-11 73 GÜRSEL, A., ŞENEL, E., YAMAN, Ş. (2004). Use of a Biopreservative Culture against Yeast and Mould Growth in Set-Type Yoghurt. Gıda. 29: 283–289. GÜRSOY, O., KINIK, Ö. (2006). Peynir Üretiminde Probiyotik Bakterilerin Kullanımı: Probiyotik Peynir. Mühendislik Bilimleri Dergisi.12: 105-116. ISHNAIWER, M.M., AL-RAZEM, F. (2013). Isolation and Characterization of Bacteriophages from Laban Jameed. Food and Nutrition Sciences, 4: 56-66. KILIÇ, S. (2008) Süt Endüstrisinde Laktik Asit Bakterileri, Ege Üniversitesi Basımevi, Bornova, İzmir, 451. KURTBOKE, I. (2012). Bacteriophages. [www.intechopen.com]. KUTTER, E., SULAKVELIDZE, A. (2005) Bacteriophages: Biology and Applications. New York, USA. CRC Press. LACROIX, C. (2011). Protective cultures, antimicrobial metabolites and bacteriophages for food and beverage biopreservation. Cambridge, UK: Woodhead Publishing Limited. LAHTINEN, S., OUWEHAND, A.C., SALMINEN, S., WRIGHT, A.V. (2012). Lactic Acid Bacteria, Microbiological and Functional Aspects. New York, USA CRC Press: Fourth ed. LERTCANAWANICHAKUL, M. ve SAWANGNOP, S. (2008) A comparison of two methods used for measuring the antagonistic activity of Bacillus Species. Walailak J Sci & Tech. 5(2): 161171. MAHONY, J. ve SINDEREN, D.V. (2015). Novel Strategies to Prevent or Exploit Phages in Fermentations, Insights from Phage–Host Interactions. Current Opinion in Biotechnology. 32: 8-13. MASUD, T., LATIF, A., HAMEED, A. (2009). Characterization of Four New Lactococcus lactis Bacteriophages Isolated from Dahi Whey. Society of Dairy Technology. 62: 107-111. MISHRA, C., LAMBERT, J. (1996). Production of Anti-Microbial Substances by Probiotics. Asia Pacific J. Clin. Nutr. Vol. 5. 20-24. MOORE, T., GLOBA, L., BARBAREE, J , VODYANOY, V., SOROKULOVA, I. (2013). Antagonistic activity of Bacillus bacteria against food-borne pathogens. J. Prob. Health. 1: 3. MOZZI, F., RAYA R.R., VIGNOLO, G.M. (2010). Biotechnology of Lactic Acid Bacteria: Novel Applications. Iowa, USA. John Wiley & Sons, Inc. PARADA, J.L., LA VIA, M.I. ve SOLARI, A.J. (1984). Isolation of Streptococcus lactis Bacteriophages and Their Interaction with the Host Cell. Applied and Envıronmental Microbiology. 47: 1352-1354. PHUMKHACHORN, P. ve RATTANACHAIKUNSOPON, P. (2012). Isolation and Characterization of Lytic Phage against Lactococcus lactis RP359, kem-buk-nud Starter Culture. African Journal of Microbiology. 6(37): 6678-6684. ROSS, R. P., MORGAN, S., HILL, C. (2002). Preservation and Fermentation: Past, Present and Future. International Journal of Food Microbiology. 79: 3- 16. SALMINEN, S., WRIGHT, A. V., OUWEHAND, A. (2004). Lactic Acid Bakteria: Microbiological and Functional Aspects. New York, Marcel Dekker, Inc: Third Ed. SANDERS, M. E. (1988). Phage Resistance in Lactic Acid Bacteria. Biochimie. 70: 411-421. SCHNÜRER, J., MAGNUSSON, J. (2005). Antifungal Lactic Acid Bacteria as Biopreservatives. Trends in Food Science & Technology. 16: 70–78. SPENCER, J. F. T., SPENCER, A. L. R. (2001). Methods in Biotechnology: Food Microbiology Protocols. Totowa, New Jersey: Humana Press Inc., Part 3. 74 SUAREZ, V., ZAGO, M., QUIBERONI, A., CARMINATI, D., GIRAFFA, G. ve REINHEIMER, J. (2007). Lysogeny in Lactobacillus delbrueckii Strains and Characterization of Two New Temperate Prolate-Headed Bacteriophages. Journal of Applied Microbiology. 105: 1402–1411. SZCZEPAŃSKA, A.K., HEJNOWICZ, M.S., KOŁAKOWSKI, P. ve BARDOWSKI, J. (2007). Biodiversity of Lactococcus lactis Bacteriophages in Polish Dairy Environment. Acta Biochimica Polonica. 54: 151–158. TERZAGHI, B. E., SANDINE, W. E. (1975). Improved medium for lactic streptococci and their bacteriophages. Appl. Microbiol. Jun; 29(6): 807-13 ÜÇÜNCÜ, M., (2005). Süt ve Mamülleri Teknolojisi. Bornova, İzmir. Meta Basım Matbaacılık Hizmetleri. USTAÇELEBİ, Ş., US, A.D. (2008). Genel Viroloji. Ankara. Pelikan Yayıncılık Ltd. Şti. WHITEHEAD, H.R. (1953). Bacteriophage in cheese manufacture. Bacterial Rev. 17(2): 109-123. WOMMACK, K.E. ve COLWELL, R.R. (2000). Virioplankton, pp. viruses in aquatic ecosystems. Microbiology and Molecular Biology Reviews. 64: 69–114. WALDOR, M. K. ve MEKALANOS, J. J. (1996). Lysogenic conversion by a filamentous phage encoding cholera toxin. Science. 272(5270):1910-4. FAUZI, A. A., SHAFIEI, Z., BAHARIN, B. ve MOHD, N. (2013). Activity against Periodontal Pathogens Isolation of Lactobacillus from Periodontally Healthy Subjects and its Antimicrobial. Sains Malaysiana. 42(1): 19–24. 75 ÖZGEÇMİŞ I- Bireysel Bilgiler Adı: Ayşen Soyadı: GÜMÜŞTAŞ Doğum yeri ve tarihi: Afyon / 08.01.1986 Uyruğu: TC. Medeni durumu: Evli İletişim adresi: aysengumustas@gmail.com II- Eğitim 2012 - Ankara Üniversitesi Eczacılık Fakültesi Farmasötik Mikrobiyoloji ABD Yüksek Lisans 2004 - 2008 Süleyman Demirel Üniversitesi Mühendislik Mimarlık Fakültesi Gıda Müh. Bölümü Lisans 2000-2004 Uşak Orhan Dengiz Anadolu Lisesi 1997-2000 Elbistan Anadolu Lisesi Yabancı dili: İngilizce III- Ünvanlar Gıda Mühendisi 2008 IV- Mesleki Deneyim Stajyer: Mikrobiyoloji Lab./Kalite Kontrol Lab. ETİ Gıda Sanayi ve Tic. A.Ş. ESKİŞEHİR (2007) Kalite Sorumlusu/Sorumlu Yönetici: Bahar Tavukçuluk Ltd. Şti. ANTALYA (2009) Sorumlu Yönetici: Aydeniz Yemek Ltd. Şti. ANKARA (2010-2012) 76 V- Bilimsel İlgi Alanları Poster Sunumları: Aysen Gumustas, Merve Eylul Bozkurt, Mehmet Gumustas, Ahmet Akin, Sibel A. Ozkan, Comparative Study for the Determination of Gemifloxacin by HPLC and Microbiological Methods from Pharmaceutical Preparations and Biological Samples, 2nd International Conference on Analytical Chemistry, 17-21 Eylül 2014, Targoviste, Romanya. Seminer: Proteomik Analizler ve Mikrobiyolojide Uygulamaları. Ankara Üniversitesi Eczacılık Fakültesi, Farmasötik Mikrobiyoloji ABD, 31 Ocak 2014. Yurtdışı Deneyim: Laktik asit bakterileri ve bakteriyofajlarının araştırma yöntemleri üzerine çalışma. Eliava Bakteriyofaj, Mikrobiyoloji ve Viroloji Enstitüsü Ar-Ge Bölümü, Tiflis, Gürcistan (24 Şubat 2014-31 Ağustos 2014). VI- Diğer Bilgiler Eğitim sertifikaları: HACCP Gıda Güvenliği Yönetim Sistemi Eğitimi (Aralık 2006 ISPARTA) İyi Üretim Uygulamaları ( GMP ) ( Aralık 2007 ISPARTA ) Gıda İşletmelerinde Sorumlu Müdürlük ( Aralık 2007 İZMİR ) Diğer üyelikler: Gıda Mühendisleri Odası Üyesi (2009- )