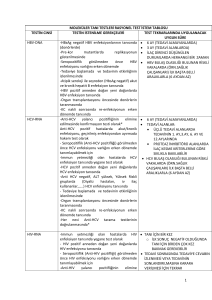
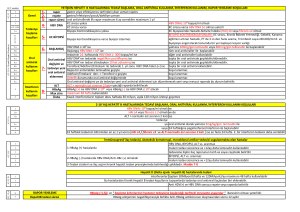
SİROZLU, HBV ve HCV POZİTİF HASTALARDA GELİŞEN
advertisement

BAŞKENT ÜNİVERSİTESİ TIP FAKÜLTESİ İÇ HASTALIKLARI ANABİLİM DALI GASTROENTEROLOJİ BİLİM DALI SİROZLU, HBV ve HCV POZİTİF HASTALARDA GELİŞEN KARACİĞER DIŞI KANSERLERİN ÖZELLİKLERİ YANDAL UZMANLIK TEZİ Dr. Enver AKBAŞ Ankara, 2012 1 BAŞKENT ÜNİVERSİTESİ TIP FAKÜLTESİ İÇ HASTALIKLARI ANABİLİM DALI GASTROENTEROLOJİ BİLİM DALI SİROZLU, HBV ve HCV POZİTİF HASTALARDA GELİŞEN KARACİĞER DIŞI KANSERLERİN ÖZELLİKLERİ YANDAL UZMANLIK TEZİ Dr. Enver AKBAŞ Tez Danışmanı Doç. Dr. Murat KORKMAZ Ankara, 2012 Bu çalışma (Proje no: KA 12/ 52) Başkent Üniversitesi Araştırma Fonunca desteklenmiştir. 2 TEŞEKKÜR Başkent Üniversitesinin kurucu rektörü Sayın Prof. Dr. Mehmet Haberal’a bana ve tüm Başkent Üniversitesi çalışanlarına sağladığı imkânlardan dolayı teşekkür ederim. İhtisasımın bir kısmında birlikte çalıştığımız her anlamda yetişmemde çok önemli katkıları olan ve şimdi ebediyete intikal etmiş olan değerli hocamız Prof. Dr. Uğur Yılmaz’a tanrıdan rahmet diliyor aziz hatırasını saygıyla anıyorum. İhtisas eğitimim boyunca gösterdikleri yakın ilgi ve destek nedeni ile Gastroenteroloji Bilim Dalı öğretim üyesi Doç. Dr. Haldun Selçuk ve tez hocam Doç. Dr. Murat Korkmaz’a, asistanlığım boyunca bilimsel ve manevi anlamda önemli desteklerini gördüğüm değerli arkadaşlarım Dr. Serkan Öcal, Dr. A. Emre Yıldırım ve Dr. Reskan Altun’a teşekkürü bir borç bilirim. Başkent Üniversitesi’ne bağlı diğer hastanelerde çalışan gastroenteroloji bilim dalı öğretim üyesi hocalarıma ve Gastroenteroloji Bilim Dalı Başkanı Prof. Dr. Ender Serin’e eğitimimize katkılarından dolayı teşekkür ederim. Birlikte geçirdiğimiz üç yıl boyunca uyumlu ve verimli çalışmamızda önemli paya sahip endoskopi ünitesi hemşireleri Yeşim Bilici, Hülya Öncüden, Tülay Erbaş, Esen Hekim, Serap Polat ile endoskopi teknisyeni Huriye Doğan ve ünitede çalışan tüm personele teşekkür ederim. Bana desteğini esirgemeyen sevgili eşim Rabia ve çocuklarım Berke ve Arda’ya sevgilerimle… i ÖZET Sirozlu hastalarda hepatosellüler karsinom görülme sıklığı artmasına rağmen bazı karaciğer dışı kanserlerin de görülme sıklığının arttığını bildiren yayınlar vardır. Hepatit B ve C pozitif hastalarda karaciğer dışı kanserlerin sıklığını araştıran sınırlı sayıda araştırma mevcuttur. Türkiye’de siroz, kronik hepatit B ve kronik hepatit C’li hastalarda karaciğer dışı kanserlerin sıklığı bilinmemektedir. Bu çalışmanın amacı Ocak 1995 ile Kasım 2011 yılları arasında hastanemize başvuran siroz, hepatit B ve C tanısı almış hastalarda karaciğer dışı kanser sıklığının tayin edilmesidir. Ocak 1995 ile Kasım 2011 yılları arasında hastanemize başvuran 1076 sirozlu, 792 HBV ve 768 HCV pozitif hastanın verileri retrospektif olarak incelendi. Sirozlu hastalarda 46, hepatit B pozitif hastalarda 37 ve hepatit C pozitif hastalarda 41 vakada karaciğer dışı kanser tesbit edildi. Bu hastalara ait kanser insidans oranları hastanemizin 2005 ve 2006 yılı genel kanser insidans oranları ile karşılaştırıldı. Sirozlu hastalarda erkeklerde yaklaşık olarak 4.5 kat, kadınlarda ise 11 kat, toplamda ise 7 kat karaciğer dışı kanser görülme sıklığı artmış idi. Sirozlu hastalarda kanser adlarına göre bakıldığında akciğer kanserlerinde 8.5 kat, kolon kanserlerinde 2.5 kat, pankreas kanserlerinde 6 kat, mide kanserlerinde 15.5 kat, meme kanserlerinde 12 kat, renal hücreli karsinomlarda 12 kat, safra kesesi kanserlerinde 32 kat, mesane kanserlerinde 9 kat, lenfomalarda 32 kat atış söz konusu idi. HBV pozitif hastalarda karaciğer dışı kanserlede erkeklerde 5.6 kat, kadınlarda 9.4 kat, toplamda ise 8 kat risk artışı mevcuttu. Kanser bölgelerine göre bakıldığında hematolojik maligniteler yaklaşık 50 kat, GİS maligniteleri ve baş-boyun maligniteleri yaklaşık 9 kat, toraks-meme maligniteleri 6,5 kat, genitoüriner sistem maligniteleri ise yaklaşık 2,5 kat artmış idi. Kanser adlarına göre bakıldığında HBV pozitif hastalarda lenfomalar yaklaşık 30 kat, akciğer kanserleri 17 kat, pankreas kanserleri 16 kat, kolon ve mide kanserleri 8,5 kat artmış idi HCV pozitif hastalarda karaciğer dışı kanserler erkeklerde 6.5 kat, kadınlarda 11.8 kat, toplamda ise 9.3 kat artmış idi. Kanser bölgelerine göre bakıldığında baş-boyun kanserlerinde 7 kat, toraks-meme kanserlerinde 5.6 kat, GİS kanserlerinde 7.5 kat, hematolojik kanserlerde 65 kat, GÜS kanserlerinde 5.4 kat artış mevcuttu. Kanser adlarına göre bakıldığında ise akciğer kanserlerinde 11.8 kat, kolon kanserlerinde 5.4 kat, mide kanserlerinde 4.3 kat, meme kanserlerinde 3.3 kat, böbrek kanserlerinde 11.3 kat, NHL’da ii 23 kat artış mevcuttu. Bu artmış insidans oranlarına siroz, HBV ve HCV dışında bazı hastalarımızın kronik renal yetmezlikli, bazılarının da transplantasyon nedeniyle immünsüpressif tedavi alıyor olmasının kısmen katkısı olduğu olduğu kanaatine varıldı. Sonuç olarak siroz, HBV ve HCV’li hastalarda karaciğer dışı kanserlerin görülme sıklığı önemli oranda artmış olarak bulundu. Anahtar kelimeler: Siroz, kronik hepatit B, kronik hepatit C, karaciğer dışı kanserler iii ABSTRACT (Characteristics of extrahepatic cancers developed in Cirrhosis, HBV and HCVpositive patients) While incidence rate of hepatocellular carcinoma in patients with cirrhosis increasing, some studies also indicate increased incidences of some extrahepatic cancers. There are only a small number of studies on incidence rates of extrahepatic cancers in Hepatitis B and Hepatitis C-positive patients. The incidence rates of extrahepatic cancers in cirrhosis, chronic hepatitis B and chronic hepatitis C patients in Turkey are unknown. The aim of this study is to determine incidence rates of extrahepatic cancers in cirrhosis, hepatitis B and hepatitis C patients registered in our hospital between January 1995 and November 2011. The data of 1076 patients with cirrhosis, 792 HBV-positive patients and 768 HCV-positive patients registered in our hospital between January 1995 and November 2011 were examined retrospectively. Forthysix, 37 and 41 extrahepatic cancer incidences were detected among cirrhosis, HBV-positive and HCV-positive patients, respectively. Extrahepatic cancer incidence rates for these patients were compared with the overall cancer incidence rates for the years 2005 and 2006 recorded in our hospital. The findings indicated that incidence rates of extrahepatic cancer increased by about 4.5 times in male patients with cirrhosis, by 11 times in female patients with cirrhosis and by 7 times overall. Analysis of incidence rates by types of cancer among patients with cirrhosis revealed that lung cancer incidences increased by 8.5 times, colon cancer incidences increased by 2.5 times, pancreas cancer incidences increased by 6 times, gastric cancer incidences increased by 15.5 times, breast cancer incidences increased by 12 times, renal cell carcinoma incidences increased by 12 times, bile duct cancer incidences increased by 32 times, bladder cancer incidences increased by 9 times and lymphoma incidences increased by 32 times. Among HBV-positive patients, incidence rates of extrahepatic cancer increased by 5.6 times in males, by 9.4 times in females and by 8 times overall. Analysis with respect to cancerous zones indicated that hematological malignancies increased by about 50 times, GIS and head-neck malignancies increased by about 9 times, thorax-breast malignancies increased by 6.5 times and genitourinary system malignancies increased by about 2.5 times. Analysis of incidence rates by types of cancer among HBV-positive patients revealed that lymphoma incidences increased by about 30 times, lung cancer incidences iv increased by 17 times, pancreas cancer incidences increased by 16 times and colon and gastric cancer incidences increased by 8.5 times. For HCV-positive patients, incidence rates of extrahepatic cancer increased by 6.5 times in males, by 11.8 times in females and by 9.3 times overall. Analysis with respect to cancerous zones indicated that head-neck malignancies increased by 7 times, thorax-breast malignancies increased by 5.6 times, GIS malignancies increased by 7.5 times, hematological malignancies increased by 65 times and genitourinary system malignities increased by 5.4 times. Analysis of incidence rates by types of cancer among HCVpositive patients revealed that lung cancer incidences increased by 11.8 times, colon cancer incidences increased by 5.4 times, gastric cancer incidences increased by 4.3 times, breast cancer incidences increased by 3.3 times, kidney cancer incidences increased by 11.3 and Non-Hodgkin's lymphoma (NHL) incidences increased by 23 times. These increased incidence rates were also partially attributed to the immunosuppressive treatments received by some of these patients due to transplantation and due to chronic renal failure. As a result, incidence rates of extrahepatic cancer were found to have significantly increased in patients with cirrhosis, HBV and HCV-positive patients. Key words: Cirrhosis, chronic hepatitis B, chronic hepatitis C, extrahepatic cancers v İÇİNDEKİLER TEŞEKKÜR ........................................................................................................................... i ÖZET ..................................................................................................................................... ii ABSTRACT ......................................................................................................................... iv İÇİNDEKİLER ..................................................................................................................... vi KISALTMALAR ve SİMGELER DİZİNİ ......................................................................... vii ŞEKİLLER DİZİNİ .............................................................................................................. ix TABLOLAR DİZİNİ............................................................................................................. x 1. GİRİŞ ................................................................................................................................. 1 2. GENEL BİLGİLER ........................................................................................................... 3 2.1. SİROZ ve KANSER ................................................................................................... 3 2.2. HBV ve KANSER ..................................................................................................... 5 2.3. HCV ve KANSER ...................................................................................................... 9 3. HASTALAR ve YÖNTEM ............................................................................................. 14 4. BULGULAR ................................................................................................................... 16 5. TARTIŞMA ..................................................................................................................... 32 6. SONUÇLAR ve ÖNERİLER .......................................................................................... 38 7. KAYNAKLAR ................................................................................................................ 39 vi KISALTMALAR ve SİMGELER DİZİNİ HBV Hepatit B Virusu HCV Hepatit C Virusu EBV Ebstein-Barr Virusu HIV Human İmmundeficiency Virus HSK Hepatosellüler Karsinom KDK Karaciğer Dışı Kanserler HL Hodgkin Lenfoma NHL Non-Hodgkin Lenfoma NAYK Non-Alkolik Yağlı Karaciğer NASH Non-Alkolik Steatohepatit GİS Gastrointestinal Sistem ÜS Üriner Sistem KVH Kronik Viral Hepatit AKH Alkolik Karaciğer Hastalığı PBS Primer Biliyer Siroz PSK Primer Sklerozan Kolanjit DNA Deoksiribonükleik Asit RNA Ribonükleik Asit KS Kaposi Sarkomu HPV Human Papiloma Virüsü AIDS Akkiz İmmün Yetmezlik Sendromu KLL Kronik Lenfostik Lösemi RF Romotoid Faktör GOR HCV pozitif insan serumuyla çapraz reaksiyon veren, şempanze cDNA’sından izole edilmiş gen İST İmmünsüpressif Tedavi vii KHF Konjenital Hepatik Fibrozis BHK Bazal Hücreli Kanser SHK Skuamöz Hücreli Kanser MM Multiple Myeloma MHC Majör Histokompatabilite ER Endoplazmik Retikulum viii ŞEKİLLER DİZİNİ Şekil 1. HCV ve onkogenez ............................................................................................ 10 Şekil 2. KDK tanılı hastaların cinsiyet, siroz, HBV ve HCV gruplarına dağlımı grafiği ................................................................................................................. 17 Şekil 3. Sirozlu ve KDK’li hastaların siroz etyolojisine göre dağılım grafiği ................ 20 Şekil 4. HBV, HCV pozitif ve sirozlu olup KDK gelişen hastaların kanser bölgelerine göre dağılım grafiği ........................................................................ 26 Şekil 5. HBV, HCV pozitif ve sirozlu olup KDK gelişen hastaların kanser adlarına göre dağılım grafiği ............................................................................. 28 ix TABLOLAR DİZİNİ Tablo 1. İnsan tümör virüslerinin ana özellikleri .............................................................. 6 Tablo 2. Kronik HCV infeksiyonunun karaciğer dışı bulguları ....................................... 9 Tablo 3. Çalışmada incelenen HBV, HCV ve sirozlu hastaların dağılım tablosu .......... 16 Tablo 4. HBV, HCV ve sirozlu olup KDK tanısı alan hastaların dağılım tablosu ......... 16 Tablo 5. Ortalama izlem süreleri .................................................................................... 18 Tablo 6. HBV pozitifliğinin durumuna göre KDK hastalarının dağılımı ....................... 18 Tablo 7. HCV pozitifliğinin durumuna göre KDK hastalarının dağılımı ....................... 18 Tablo 8. Sirozlu hastalarda Child evresine göre KDK dağılımı ..................................... 19 Tablo 9. Sirozlu hastalarda KDK’lerin siroz etyolojisine göre dağılımı ........................ 19 Tablo 10. HBV pozitif hastalarda KDK bölgesine göre hastaların dağılımı .................... 20 Tablo 11. HBV pozitif hastalarda KDK’lerin adlarına göre dağılımı .............................. 21 Tablo 12. HCV pozitif hastalarda KDK bölgesine göre hastaların dağılımı .................... 22 Tablo 13. HCV pozitif hastalarda KDK’lerin adlarına göre dağılımı .............................. 22 Tablo 14. Sirozlu hastalarda KDK bölgesine göre hastaların dağılımı ............................ 23 Tablo 15. Sirozlu hastalarda KDK adlarına göre hastaların dağılımı ............................... 23 Tablo16. HBV pozitif ve KDK’li hastalarda risk faktörleri ............................................ 24 Tablo 17. HCV grubunda immünsüpressif tedavi altında KDK gelişen hastalar ............. 24 Tablo 18. HBV, HCV pozitif ve sirozlu olup KDK gelişen hastaların kanser gelişim bölgelerine göre insidans oranları ........................................................ 25 Tablo 19. Sirozlu ve KDK’li hastaların kanser adlarına göre insidans oranları ............... 26 Tablo 20. 2005 ve 2006 yılı siroz, HBV, HCV pozitif hastalarda KDK tanılı hastalar .............................................................................................................. 28 Tablo 21. HBV pozitif hastalarda 2005-2006’tanı konan KDK’li hastaların oranları .............................................................................................................. 29 x Tablo 22. HCV pozitif hastalarda 2005-2006’da tanı konan KDK’li hastaların oranları .............................................................................................................. 29 Tablo 23. Siroz’lu hastalarda 2005-2006’da tanı konan KDK’li hastaların oranları .............................................................................................................. 29 Tablo 24. Kanser bölgelerine göre hastanemizin 2005 ve 2006 yıllarına ait kanser insidans oranları .................................................................................... 30 Tablo 25. Kanser adlarına göre hastanemiz 2005 ve 2006 yıllarına ait kanser insidans oranları................................................................................................ 31 xi 1. GİRİŞ Siroz; ilerleyici karaciğer fibrozunun, karaciğer mimarisinin bozulması ve rejeneratif nodüllerin oluşumuyla karakterize geç evresi olarak tanımlanabilir. Erken evrede karaciğer hastalığının altta yatan nedenine yönelik spesifik tedavilerle siroz düzelebilir veya geri dönebilir. Fakat ileri evrelerde siroz genellikle geri dönüşümsüz olarak kabul edilir ve bu durumda tedavide tek seçenek karaciğer transplantasyonu olabilir. Sirozlu hastalar değişik komplikasyonlara yatkınlık gösterirler ve bu kompikasyonlar onların yaşam süresini belirgin olarak kısaltır (1). Sirozlu hastalarda hepatosellüler karsinom (HSK) gelişme riski belirgin olarak artmaktadır. Kronik hepatitlerin çoğu formunda da HSK gelişim riski siroz kadar olmasa da bir miktar artmaktadır. Kronik hepatit B virüs (HBV) ve kronik hepatit C virüs (HCV) infeksiyonu olan hastalarda siroz yokluğunda da HSK gelişebilir. Etyolojik açıdan bazı tip sirozlarda HSK gelişimi için nisbeten daha artmış bir risk söz konusudur. HBV, HCV, nonalkolik yağlı karaciğer (NAYK) ve hemokromatozis nedenli sirozlarda en yüksek risk söz konusu iken otoimmün hepatit ve Wilson Hastalığı nedenli sirozlarda daha az oranda bir risk mevcuttur (2). Son zamanalarda yapılan birkaç araştırmada sirozlu hastalarda karaciğer dışı kanserler (KDK)’in de arttığı ileri sürülmektedir. Fakat sirotik olmayan değişik formdaki HBV ve HCV pozitif hastalarda KDK’lerin artıp artmadığı bilinmemektedir. Berman ve arkadaşlarının 952 sirotik hastada karaciğer ve karaciğer dışı kanserleri araştıran kohort çalışmasında 1,3 ve 5 yıllık izlemde HSK’in isidans oranları sırasıyla %1.2, 4.4, ve 7.8 iken, KDK isidans oranları 1, 3 ve 5 yıllık izlemde sırasıyla %2.2, 4.5, ve 6.8 oranlarında idi. Burada KDK insidans oranlarının HSK insidans oranlarına yakın olduğu göze çarpmaktadır. En sık görülen karaciğer dışı kanserler sırasıyla meme, akciğer ve lenfoma idi. HSK ve KDK’in insidans oranları sirozun etyolojisine göre belirgin olarak farklılık göstermekteydi (3). Kalaitzakis ve arkadaşlarının 1019 sirozlu hastada yaptığı çalışmada ise sirozlu hastalarda normal popülasyona kıyasla kolanjiokarsinoma 13 kez, özofagus kanserleri 8 kez, pankreatik kanserler 5 kez, kolorektal ve akciğer kanserleri ise 4 kez daha sık görülmekteydi. Kolanjiokarsinoma görülme oranı non-alkolik sirozlularda artmış iken diğer KDK’ler alkolik sirozlularda daha fazla oranda görülmekte idi (4). 1 Kronik HBV ve HCV infeksiyonu formlarında normal popülasyona göre HSK görülme sıklığının artmakta olduğu bilinmesine rağmen KDK sıklığının artıp artmadığı bilinmemektedir. Hepatit virüslerinin karaciğere özel ilgisi olduğu bilinmesine rağmen dolaşan kan ile vücuttaki tüm organlara ulaştıkları da bir gerçektir. Kronik HBV ve HCV’nin HSK dışındaki diğer vücut kanserlerini tetikleyip tetiklemediği net değildir. Bu çalışma ile siroz, HBV, HCV pozitif hastalarda tesbit edilen baş-boyun, toraks, GİS, genitoüriner sistem ve hematolojik vb. kanserlerin verilerinin değerlendirilmesi planlandı. Sirozlu hastalarda KDK’lerin ülkemiz için ilgili kanser insidans oranlarına göre artıp artmadığının ortaya konması amaçlandı. Ayrıca bu çalışmanın verileri doğrultusunda sirozun evresi, etyolojisi, süresi, transplantasyon yapılıp yapılmadığı, eşlik eden HSK’nın varlığı değerlendirip sirotik hastalarda KDK için hastanemiz ve ülkemize ait veriler elde edilmiş olacaktır. HBV ve HCV pozitif hastalarda da aynı değerlendirmelerin yapılıp HBV ve HCV’nin taşıyıcı, kronik hepatit ve siroz olmasına göre verilerin değerlendirilmesi amaçlandı. 2 2. GENEL BİLGİLER 2.1. SİROZ ve KANSER Hepatosellüler karsinom (HSK) dünya üzerinde en sık görülen beşinci kanser olup, kanserden ölümlerde ise üçüncü sırayı almaktadır. Hepatosellüler karsinoma (HSK) insidansı giderek artmaktadır. Siroz HSK için bilinen bir risk faktörüdür ve vakaların yaklaşık %80 kadarı sirotik zeminde gelişir (5). Mevcut kılavuzlarda hali hazırda sirozlu hastalarda HSK gelişimi açısından tarama ve yakın takip önerilmektedir. Daha önce yapılan çalışmalar sirozlu hastalarda HSK için özellikle ilk taramanın en önemli adım olduğunu ortaya koymaktadır (6,7). Ancak negatif bir tarama sonucundan sonra izlemin değerli olup olmadığı tam net değildir. Negatif bir tarama koruyucu değer taşır ve en azından kısa dönemde HSK gelişim riskininin önemli ölçüde azalmış olduğunu gösterir. Kronik viral hepatit (KVH), alkolik karaciğer hastalığı (AKH) ve herediter hemokromatozis HSK gelişimi açısından iyi bilinen risk faktörleridir (8,9). Son araştırmalarda otoimmün hepatit ve non-alkolik steatohepatit (NASH)’e bağlı sirozlarda HSK gelişimi açısından artmış risk olduğunu ortaya koymaktadır (10-14). Fakat primer biliyer siroz (PBS), primer sklerozan kolanjit (PSK) ve alfa-1 antitripsin eksikliği nedeniyle gelişen sirozlarda HSK gelişim insidansı daha düşüktür. Genel olarak farklı etyolojilere bağlı sirozlarda HSK açısından izlem klinik pratikte aynıdır, fakat altta yatan nedene göre farklı izlem de söz konusu olabilir. HSK dışında, sirozlular karaciğer dışı kanserler (KDK) açısından da risk altında olabilirler. Child B alkolik sirozlularda yapılan yeni bir çalışmada ortalama 4 yıllık bir izlemde %10 karaciğer dışı kanser gelişme insidansı olduğu ortaya konmuştur (15). Bazı çelişkili sonuçlar olmasına rağmen önceki çalışmalarda da PBS hastalarında KDK açısından artmış bir risk olduğu saptanmıştır (16-19). Sirotik hastalarda yapılan büyük kohortlu iki Avrupa çalışmasında KDK açısından 2 kat artmış risk bulunmuştur (20,21). Sirozlu hastalarda kanser riski hormonal seviyelerdeki değişimler, karsinojenlerin azalmış metabolizması ve immün yanıttaki değişmeler gibi farklı nedenlere bağlı olabilir. Sirozun HSK dışında ayrıca KDK açısından bir risk faktörü olup olmadığı PBS dışında iyi araştırılmış bir konu değildir (22, 23, 24). Sirozun östrojen metabolizmasını değiştirdiği ve sirozlu erkek hastalarda hiperöstrojenizm sonucu jinekomasti ve testiküler atrofiye yol açtığı bilinmektedir. Kadınlarda yapılan yeni çalışmalar sirozun menstrüel düzensizlik, artmış spontan abortus sıklığı ve erken menapoza yol açtığını ortaya koymuştur (25). 3 Bununla birlikte karaciğer lipid ve suda çözünen ilaçların metabolizmasında ve öteki kimyasalların eliminasyonunda majör rol oynar. Sirozlu hastalarda immün fonksiyonlardaki değişiklikler ile artmış infeksiyon riski de bilinmektedir (26). Primer biliyer siroz (PBS) otoimmün etyolojili olduğu düşünülen kronik kolestatik bir karaciğer hastalığıdır ve portal ve periportal inflamasyon yoluyla ilerleyici safra duktus hasarı yapar. Sonuçta ilerleyici fibrozisle birlikte siroz gelişir. Öteki otoimmün hastalıklarla ilişkili olduğu bilinmesine rağmen karaciğer dışı kanserlerle ilişkisi hala tartışmalı bir konudur. 1980’lerde Avrupa ve Amerika’dan yapılan çalışmalarda PBS ve meme kanseri arasında kuvvetli bir ilişki olduğu bildirilmiştir (27,28,29). Bozulmuş immün sistem dahil farklı muhtemel mekanizmaların bu hastalarda meme kanseri gelişiminde rol oynadığı ileri sürülmüştür (28,30). 1990’larda yapılan çalışmalar bu sonuçları tam olarak doğrulamamıştır (31,32,33,34). Primer biliyer siroz ile bir veya birden fazla malignite arasındaki ilişkinin gösterilmesi veya reddedilmesi bu hastaların yönetimini de etkileyecektir. Bu riski arttığı belirtilen malignite veya maligniteler için riskli gruplardaki kişilerin fazladan izlenmesi anlamına gelecektir. Deutsch ve ark. tarfından yapılan 212 hastalık bir kohort çalışmada sirozlu (PBS evre 4) hastalarda erken evre PBS (PBS evre 1-3) olanlara göre 6 yıllık izlemde HSK riski belirgin olarak yüksek bulunmuştur. KDK için HSK kadar olmasa da artmış bir risk bildirilirken PBS evresi ile KDK gelişim riski arasında bir ilişki yoktur. Bu çalışma PBS’li hastalarda KDK gelişim riski açısından açık bir sonuç ortaya koymamıştır (35). KDK’lerin sirozlu ve özellikle de alkolik sirozlulardaki insidansı genel popülasyonla kıyaslandğında oldukça yüksek bulunmuştur. 120 adet alkole bağlı Child B sirozlu hastada yapılan yeni bir çalışmada 4 yıllık izlemde KDK gelişme oranları hayli yüksek bulunmuştur (36). Alkolik sirozlu hastaların üçte ikisinde karaciğer dışı maligniteler; baş-boyun, akciğer ve özofagus yerleşimli bulunmuştur. Bu alkol kullanımın sigara kullanımı ile beraber artmış KDK oranlarından sorumlu olabileceğini düşündürmektedir. Berman ve arkadaşlarının 952 sirozlu hastada yapıkları bir kohort çalışmanın sonuçlarına göre negatif bir tomografi taramasından sonra kolon kanseri açısından 7-10 yıllık sürelerle tarama yapmak ve sadece riskli grupları kolonoskopiyle taramak önerirlerken HSK için ise böyle uzun aralıklı güvenli sürelerin söz konusu olmadığını ileri sürmüşlerdir (3). Başka bir çalışmada ise alkol kullanımı artmış rektal kanser insidansı ile ilişkili bulunurken, alkolik sirozlularda artmış meme kanseri oranlarının artmış östrojen 4 seviyesinden ziyade alkolün direkt karsinojenik etkisiyle olduğu ileri sürülmüştür. Sirozlu hastalarda diğer karaciğer dışı kanserlerin de arttığı belirtilip buna alkol ve sigara kullanımının katkısına dikkat çekilmiştir (37). 2.2. HBV ve KANSER Hepatit B virüsü (HBV) dünya üzerine 300 milyondan fazla insanı infekte etmiştir ve dünyada karaciğer hastalıklarının ve karaciğer kanserlerinin en sık nedenidir. HBV küçük bir DNA virusudur ve bazı özellikleri retrovirüs ailesine benzer (38, 39). Hepadnaviridae ailesinin prototip virusudur. Sekanslarına göre HBV, A’dan H’ye kadar sekiz genotipe ayrılır. Her bir genotipin farklı coğrafik bir dağılımı vardır. Bu yüzyılın başlarında yapılan ilk araştırmalardan sonra viral ajanların hayvanlardaki onkojenik rolleri ortaya konmuştur (40,41). Virusların insan kanserlerinin etyopatogenezindeki rolleri de uzun zamandan beri ileri sürülen hipotezlerdendir. Fakat geçen on yılda rekombinant DNA teknolojisindeki ilerlemeler ve neoplastik dokulardaki viral sekansların saptanması ile ilgili teknik gelişmeler bu alanda önemli keşiflerin yapılmasına olanak sağlamıştır. Artan sayıda kliniko-epidemiyolojik ve virolojik çalışmalarda spesifik virusların insan kanserlerindeki muhtemel rolleri en azından kanser vakalarının %15’inde ortaya konmuştur (42). Virusların potansiyel onkojenik aktiviteleri iki kısımda incelenebilir; adenovirus, Simian virüs 40 ve polyoma virüs gibi insanları infekte edebilen ama sadece laboratuvar ortamında kanser oluşturabilen viruslar ve insan kanser dokularından izole edilebilen kansere yol açan viruslar. Son zamanlarda tümör virolojisi gibi geniş bir bilim alanında bazı olayları anlamamıza neden olan önemli gelişmeler oldu. Hepsinin başında onkogenezin hücre yapısında çok sayıda genetik değişikliklere ihtiyaç duyan çok basamaklı bir süreç olduğu ortaya çıktı (42, 43, 44). Bunlar iki önemli fenomenin sonucunda oluşmaktaydı; ras familyası gibi hücresel çoğalmayı tetikleyen onkogenlerin aktivasyonu ve neoplastik dokuların ‘’growth deregülasyonu’’na yol açan tümör süpressör genlerin inhibisyonu. p53 ve retinablastom genleri en önemli ve en fazla araştırılmış tümör süpressör genleridir (45, 46, 47, 48). Bu genlerin negatif regülatör etkilerinin bozulması devamlı olarak kanser gelişimine yol açmaktadır. Neoplastik hücrelerdeki öteki değişliklikler de, örneğin anjiyogenez regülatör proteinleri ile matriks metalloproteinaz ve katepsinler gibi enzimlerin aşırı ekspresyonu neoplastik hücrelerin yayılımı yoluyla kanserin diğer dokulara yayılımına neden olabilirler (44). Viruslar insan kanserlerinin patogenezinde infeksiyöz ajanlar arasında en sık rol alan sınıftır. Fakat bu virüs ilişkili bütün tümörlerin genel özelliği virusla infekte olmanın malignite gelişiminde tek başına yeterli olmamasıdır. 5 Öteki çevresel, infeksiyöz ve/veya konak-genetik faktörler, hormanal ve immünolojik faktörler de malign transformasyon için gereklidirler. Sonuç olarak infekte kişlilerin çok az bir kısmında bir malignite gelişir ve bu çoğunlukla uzun bir latent periyod sonucunda olur. Muhtemelen çoğu virusların onkojenik potansiyelleri normal hayat sikluslarını sürdürmelerinin bir yan etkisi olarak ortaya çıkar. Bu viral proteinlerin indirekt etkisi olarak konak hücrelerinin replikasyonunu uyarması ve virüs replikasyonunu kolaylaştırarak viral infeksiyonun devamı için apopitozun baskılanması yoluyla olur (41). Tablo 1’de insan kanserlerinin gelişiminde sıklıkla rol oynayan virusların özellikleri verilmiştir. Tablo 1. İnsan tümör virüslerinin ana özellikleri Viruslar Hepatit B virusu Virus Familyası Genom İlgili İnsan Kanserleri Hepadnavirdae DNA Hepatosellüler karsinoma, hematolojik maligniteler Hepatit C virusu Flavivirdae RNA Hepatosellüler karsinoma, B-hücreli NHL Ebstein-Barr Virusu Herpesviridae DNA Burrkit lenfoma, nazofaringeal karsinoma, immünoblastik lenfoma, HL, NHL KS-ilgili İnsan Herpes Herpesviridae DNA Kaposi sarkomu Retroviridae RNA Erişkin T-hücreli lösemi Retroviridae DNA EBV ilişkili immünoblastik lenfoma, Virusu İnsan T-hücreli Lösemi 1 Virusu HIV virusu NHL, HPV ilişkili anogenital kanserler Human Papilloma Papovaviridae DNA Anogenital ve oral kanseler, konjoktiva kanseri, cilt yassı hücreli kanseri Virusu Human papilloma virus (HPV) geniş bir gruba sahip bir DNA virusudur ve bazı HPV tipleri (tip 16, 18) anogenital kanserlere yol açarlar. İlave olarak HPV, oral kavite ile ilişkili karsinomlar, üst solunum ve sindirim sistemi kanserleri, konjuktiva tümörleri ve cildin yassı hücreli kanserlerinin gelişimine de katkıda bulunabilirer (49, 50,51). Herpes viruslar insan vücudunda her yerde bulunan patojenlerdir ve bunların bazı tipleri belirgin lenfotropizm ile karakterizedir ve sıklıkla lenfoproliferatif hastalıklarla 6 ilişkilidirler (52,53). Primer infeksiyondan sonra herpes viruslar infekte hücrelerde latent olarak kalırlar; bu özellikleri herpes virusların yüksek prevalansına katkıda bulunur. Herpes viruslar immün baskılı konaklarda veya sağlıklı kişilerde reaktive olabilir ve sekonder infeksiyonlara yol açabilirler. İn vitro Ebstein Barr virüsü insan ve primat B lenfositlerini infekte edebilir ve bu onu bu hücre ortamında ölümsüzleştirir. Oysa ki in vivo lenfoid ve epitelyal hücreler onun öncelikli dokularıdır. Bu özel tropizm EBV’nin Afrika Burkitt Lenfoması ve nazofaringeal lenfoma gibi öteki lenfomalardaki rolünü açıklar (52, 54,55,56). AIDS’le ilişkili ve ilişkisiz neoplazilere yol açan Kaposi sarkomu ilişkili human herpes viruslar insanlarda tümör-virus ilişkisinin bir diğer önemli örneğidir (57). Retroviruslar sıklıkla hayvanlardaki kanserlerden sorumludurlar, fakat yalnızca ikisi (insan T hücreli lösemi virüsü ve HIV) insanlardaki kanserlerle ilişkilidir. İnsan T hücreli lösemi virüsü, infekte kişilerin yalnızca %1-4’ünde gelişen akut hematolojik bir malignite olan ve her zaman kötü bir prognoza sahip olan erişkin T-hücreli lösemiye neden olur (58). HIV ile infekte kişilerde virusun direkt onkojenik aktivitesinden ziyade kronik immün süpresyona bağlı kanserler gelişebilir (59). HIV infekte kişilerde EBV ilişkili lenfoma, Kaposi sarkomu ve HPV ilişkili anogenital kanserler gelişebilir. HBV ilişkili kronik hepatit veya siroz hepatosellüler karsinoma için artmış bir risk taşır (60,61). Siroz karaciğer kanseri gelişimi için predispozan bir faktör olmasına rağmen bazı klinik araştırmalar HBV’nin direkt onkojenik etkisini ortaya koymuştur. Özellikle sirotik olmayan kronik HBV’li hastalarda HSK riskinin artmış olarak tesbit edilmesi bunu düşündürmektedir (44,61). HBV genomu konak genomuna integre olur, böylece insersiyon mutasyonları meydana gelebilir ve bu HSK gelişiminde önemli bir faktördür. Diğer yandan viral HBx antijeni ve p53 arasındaki etkileşme ile bazı p53 bağımlı hücresel fonksiyonların ortadan kalkması onkojenik süreçte önemli faktörlerden biridir (62). Heimann ve ark 1971’de ilk defa karaciğer sirozu ile lenfoproliferatif hastalıklar arasında yakın bir ilişki buldular. Patogenezde rol alan hepatotropik viruslardan HBV ve HCV’nin muhtemel rolü olduğu ileri sürülmüştür (63). Virusun hematopoetik hücrelere olan ilgisine bakarak HBV’ye bağlı hepatit ve sirozlu hastalarda gelişen bazı hematolojik malignitelerin patogenezinde HBV’nin rolü olduğu söylenebilir (64). HBV adından da anlaşıldığı üzere hepatotropik virüstür ve hepatositler içerisinde çoğalır. Günümüzdeki mevcut bilgiler ışığında HBV’nin lenfoma gelişimindeki muhtemel rolü düşünüldüğünde virusun hemotopoetik ve lenfoid hücreleri infekte edip buralarda da replike olduğunu bilmek önemlidir. Çok sayıdaki deneysel çalışmalar bunu ortaya koymuştur. HBV’nin karaciğer dışında da bulunduğu yerler vardır ve HBV nükleik asitlerinin lenf nodu, dalak, 7 gonadlar, tiroid bezi, böbrek, pankreas ve sürrenal bez gibi dokularda akut infeksiyon esnasında varlığı gösterilmiştir (131,132). Lenfositler ve ilgili lenfoid hücre tipleri göz önüne alındığında HBV periferik kandaki mononükleer hücrelere bağlanır (133) ve ayrıca hemopoetik hücreleri ve bunların öncülerini de infekte edebilir (134,135). Akut ve kronik HBV infeksiyonu esnasında HBV DNA periferik kan mononükleer hücrelerinin bütün majör subgruplarında tesbit edilmiştir (136,137). HBs Ag ve HBc Ag periferik kan mononükleer öncü hücrelerinde de saptanmıştır (138, 139). Bu bulgular lenfoid sistemin HBV için önemli bir rezervuar olduğunu ortaya koymaktadır (140). Gizli hepatit kavramı konusunda tam bir görüş birliği yoktur. Hepatit B yüzey antijeni (HBs Ag) negatif hastalarda HBV DNA’nın pozitif saptanması olarak tanımlanabilir. Bu durumda çoğu zaman anti-HBc pozitif olarak bulunur. Fakat bazen de HBV için diğer bütün serolojik markerlerin negatif olduğu hastalarda anti-HBc ve/veya anti-HBs pozitifliği olarak tanımlanmaktadır. Gerçekte ise gizli HBV infeksiyonu viral geçişten de sorumlu olan düşük dereceli viral replikasyonu gösterir. Bu durumda HBV DNA serum ve periferik kan mononükleer öncü hücrelerinde, akut viral hepatitten sonra klinik, biyokimyasal ve serolojik tam bir iyileşme oluncaya kadar 70 ay boyunca saptanabilir (141). Bu sürekli düşük dereceli viral replikasyon bazı kanser tiplerinin onkogenezine kısmen de olsa katkı sağlıyor olabilir. HBV non-Hodgkin lenfoma ilişkisi HCV kadar iyi araştırılmamış bir konu olsa da yapılan çalışmaların büyük çoğunluğunda HBV infeksiyonu ile NHL arasında pozitif ilişki gösterilmiştir. Sadece iki çalışmada bunun aksi iddia edilmektedir. Anderson ve arkadaşlarının Amerikan toplumunda yaptığı geniş katılımlı bir epidemiyoloji çalışmasında ise HBV infeksiyonu ile hiçbir hematolojik malignite arasında pozitif ilişki gösterilememiştir (142). Buna benzer şekilde sekiz Avrupa ülkesinin hastalarında yapılan bir vaka-kontrol çalışmasında HBs Ag pozitifliği ile NHL, HL ve multiple myeloma arasında önemli bir ilişki ortaya konamamıştır (143). Fakat unutmamak gerekir ki HBV infeksiyonu prevalansı Amerika ve Avupa toplumlarında çok düşüktür ve bu da sonuçları etkileyecek bir faktördür. Başka ilginç bir çalışmada ise Marcucci ve arkadaşları NHL hastaları arasında normal kontrollere göre çok daha yüksek ve istatistiksel olarak anlamlı oranda anti-HBc-pozitif ve anti-HBs-negatif hasta saptadılar (144). HBV infeksiyonu esnasında virusun kan yoluyla bütün vücuda yayılıyor olması, akut ve kronik infeksiyon esnasında bir çok organ ve dokuda HBV DNA ve viral DNA partiküllerinin sapatanabilir olması HBV’nin hematolojik malignitelere ek olarak bir çok solid organ kanserinin gelişiminde de katkı sağlıyor oabileceğini akla getirmektedir. Yeterince iyi araştırılmamış 8 olan bu konuda yapılacak prospektif vaka-kontrol çalışmaları, epidemiyolojik çalışmalar ve moleküler çalışmalar HBV infeksiyonunun solid organ kanserlerinin gelişimindeki muhtemel rolüne de ışık tutacaktır. 2.3. HCV ve KANSER Dünya üzerinde 180 milyondan fazla insan HCV ile infektedir ve bu toplam dünya nüfusunun %3’ünü oluşturur. HCV transfüzyon sonrası gelişen hepatit ve sporadik olarak parenteral yolla geçen hepatitlerin en sık nedenidir (65). Yapısal virüs proteinlerinin tanısı için ikinci kuşak ELİSA ve RİA teslerinin geliştirilmesi ile tanısal amaçlı HCV antikorlarının saptanmasında önemli gelişmeler olmuştur. İlaveten PCR metodu ile HCV infeksiyonu esnasında viral RNA sinyallerinin kan ürünlerinden tayin edilmesi sağlanmıştır (66).HCV tek zincirli bir RNA virüsü olup belirgin bir genetik değişkenliğe sahiptir. Viral genom “quasispecies” denilen heterojen HCV RNA moleküllerinden oluşan karışık bir popülasyondur (67,68). Bu özelliği viral infeksiyonun modülasyonuna ve belirgin olarak kalıcı olmasına neden olur. Kronik HCV infeksiyonu dünyada giderek yaygınlaşmaktadır. HCV pozitif kişilerin %50-75’inde gizli bir seyre sahip olan kronik infeksiyon gelişir ve bu klinik durum yavaşça ilerleyerek kronik hepatit ve siroza neden olur (69). Bu özelliklerine ilaveten kronik HCV infeksiyonu, virusa karşı bir aşı olmaması ve radikal bir tedavisinin de bulunmaması nedeniyle çok sayıda infekte kişinin de varlığı göz önüne alındığında ciddi bir hastalıktır. Bunların yanında HCV infeksiyonunun geniş bir immün-lenfoproliferatif hastalık grubuyla da muhtemelen ilgisi vardır (70,71,72,73). Tablo 2’de kronik HCV infeksiyonuna eşlik eden immün aracılıklı ve/veya lenfoproliferatif hastalıklardan oluşan karaciğer dışı bulgular özetlenmiştir. Tablo 2. Kronik HCV infeksiyonunun karaciğer dışı bulguları Kronik HVC İnfeksiyonuna Eşlik Eden Karaciğer Dışı Bulgular -Mikst kriyoglobülinemi -Membranoproliferatif glomerülonefrit -B hücreli NHL -İdyopatik B hücreli NHL -Akciğer fibrozisi -Porfiria kutanea tarda -Otoimmün tiroiditis -Liken planus -Mooren korneal ülserler -İnsülin direnci ve diyabetes mellitus gelişimi -Otoantikor gelişimi 9 HCV hepatotropik ve lenfotropik virüstür. Bu yüzden infekte T ve B lenfositlerin kronik infekte kişilerde görülen hastalığın en azından bir kısmından sorumlu olduğu düşünülmektedir (74,75,76). HCV yalnız başına veya öteki (infeksiyon, çevresel ve genetik) faktörlerle beraber bazı farklı immünolojik değişiklikleri tetikleyebilir. Viral antijenler moleküler taklit veya otoantijenlerin değiştirilmesi yoluyla immün sistem için kronik stimuluslar oluşturabilirler. Şekil 1’de kronik HCV ile tetiklendiği düşünülen insan kanserleri arasındaki mekanizmalar özetlenmektedir. Şekil 1. HCV ve onkogenez Yukarıda bahsedilen lenfotropizm ve hepatotropizme göre HCV onkojenik potansiyelini iki farklı yolla, B hücreli neoplazilere ve karaciğer kanserine yol açarak göstermektedir (74,75,76). Virusun 1987’de izole edilmesinden beri HCV ile ilişkili karaciğer hastalığı HSK’a yatkınlık oluşturan en sık etken haline geldi (77,78). Genellikle HSK gelişimi için HCV infeksiyonunun üzerinden uzun bir zaman geçmesi gereklidir (79). HCV’nin kendisi, HBV ko-infeksiyonu, alkol kullanımı, yaş ve cinsiyetten bağımsız olarak HSK gelişimi için bir risk faktörüdür (80). HCV ile ilgili HSK’un onkogenezi tam olarak anlaşılamamıştır; tümör süpressör genlerin kaybı, proto-onkogenlerin veya spesifik büyüme faktörlerinin aktivasyonu gibi değişik hipotezler ileri sürülmüştür. Uzamış karaciğer nekrozu ve siroza yol açan rejenerasyon gelişimi, hepatik karsinogenezde çok adımlı süreçte en önemli olay gibi görünmektedir (79). Fakat son araştırmalar göstermiştir ki HCV ile infekte kişilerde sirozun ara basamağı olmaksızın da HSK gelişebilir ki bu 10 hastaların bazılarında sadece biyopsiyle gösterilebilen hafif inflamatuar değişiklikler mevcuttur (81,82). HCV genotiplerinin analizinde tip 1b’nin HSK gelişen hastaların büyük bir kısmında var olduğu görülmüştür (81). Genotip 1b hepatitin daha şiddetli klinik seyri ve alfa-interferona daha az cevap ile ilgilidir. İnterferon tedavisinin HSK gelişiminde muhtemel önleyici etkisi nedeniyle siroz olmayan hastalarda mutlaka tedavi verilmelidir. Özellikle sitopatojenik HCV mutantlarının öteki eksojen ve/veya konakçı faktörlerinin de katkısıyla uzun zaman periyodunda siroz gelişmemiş zeminde HSK oluşumunda rol aldığı düşünülmektedir. İlginç olarak HCV-pozitif mikst kriyoglobülinemi nadir olarak HSK ile komplike olmaktadır (83). Özellikle tip 2a‘da olduğu gibi bazı spesifik genotipe sahip HCV’li hastalarda HSK’ın düşük prevalansı özellikle genetik ve eksojen faktörlerin kombinasyonuyla ilgili olabilir (84,85). HCV virusunun lenfotropizmi virusla bazı immün-lenfoproliferatif hastalıklar arasındaki ilişkiyi açıklayabilir. Dolaşan immün komplekslerin ve antikorların varlığı sıklıkla monoklonal gammapatiler, kronik lenfositik lösemi (KLL) ve düşük grade’li NHL’larda görülen otoimmün bulguları açıklar. B hücreli neoplazilerde serum monoklonal romatoid faktör (Ig M RF) pozitif saptanabilir. Çok sayıda klinik araştırma HCV‘nin otoimmün ve B hücreli lenfoproliteratif hastalıklarla yakından ilişkili olabileceğini ortaya koymuştur. Mikst kriyoglobülinemi tip 2 bu tip kompleks kombinasyonları için bir model sayılabilir (72,86,87). Değişik toplumlarda yapılan çok sayıda çalışmalarda mikst kriyoglobülinemi ile HCV infeksiyonu arasında %80 ile %90 arasında değişen oranlarda güçlü bir ilişki saptanmıştır (71,87). Dahası NHL ile komplike olsun yada olmasın, mikst kriyoglobülinemi hastalarında periferik lenfositlerde, kemik iliğinde ve lenf nodlarında viral repliklasyonun saptanması, HCV’nin bu hastalıklardaki muhtemel rolü ile ilgili hipotezi güçlendirmektedir. Mikst kriyoglobülinemide HCV‘nin tetikleyici faktör olarak identifikasyonu virusun bu hastalığa eşlik eden hematolojik maligniteler ve muhtemelen de idyopatik lenfomadaki rolünü akla getirmektedir (75,87). İlk defa 1994 yılında bir İtalyan çalışmasında değişik grade’li B hücreli lenfomalı hastaların üçte birinde serum ve periferik lenfositlerde replikasyona uğrayan HCV tesbit edildi (88,89). Bu bulgular özellikle HCV infeksiyonunun HL’lardaki prevalansının (%3) normal sağlıklı popülasyona (%1,5) kıyaslandığında iki misli fazla olması nedeniyle önemliydi. Yapılan çalışmalarda ilginç olarak HCV genomik sekanslarının varlığı, hem idyopatik B hücreli lenfomalalarda hem de HCV ile ilişkili malign lenfomalarda serum ve neoplastik dokular (kemik iliği ve lenf nodu) da tesbit edilmişti (90,91,92). Son zamanlarda değişik ülkelerde yapılan bir çok 11 çalışmada HCV ile ilişkili lenfomaların yaygın olarak bulunması HCV’nin dağılımındaki coğrafik heterojeniteden kaynaklanmaktadır. İngiltere’de yapılan çalışmalarda ise HCV lenfoma yakın ilişkisi gösterilememiştir. İskoçya’da aynı coğrafik alanda yapılan iki NHL serisinde HCV markerleri tamamen negatif iken (93,94), Brind ve arkadaşlarının yaptığı çalışmada ise HCV ve hematolojik maligniteler arasında sporadik bir ilişki tesbit edilmişti (95,96). Benzer sonuçlar diğer Avrupa ülkelerinden yapılan yayınlarda da bildirilmiştir (97,98). Heimann ve ark. nın Belçika’da yaptığı patoloji çalışmalarında hepatotropik viruslardan özellikle HBV ve HCV’nin NHL ‘da rolü olduğu ileri sürülmüştür (99). Benzer sonuçlar Japon çalışmalarından da bildirilmiştir (100). HCV infeksiyonu daha sık olarak kronikleştiği ve lenfositlerde latent infeksiyon olarak kaldığı için lenfoma oluşumunda diğer hepatotropik viruslardan daha fazla rol alıyor olabilir. HCV ve NHL arasında ilişki geniş katılımlı bir çalışmada İtalyan hastalarında da gösterilmiştir. Benzer tarzda Amerikan ve Japon çalışmalarında da B hücreli lenfoma hastalarında öteki hematolojik malignitelerden (HL, T hücreli lenfoma, KLL, multiple myeloma) daha yüksek HCV prevalansı gösterilmiştir (101,102,103). Tanaka ve arkadaşlarının yaptığı 592 hastayı içeren geniş serili yeni bir epidemiyolojik çalışmada NHL hastalarında HSK gelişimi için artmış bir risk söz konusu idi; ilginç olarak bu hastalardan HCV seropozitifliği saptanmış %88’lik büyük bir kısmında NHL’yı takiben HSK gelişmiş idi (104). HCV hepatotropizmi nedeniyle HCV pozitif NHL hastalarının çoğunda karaciğer tutulumu gözlenmektedir. Aslında kronik hepatit veya siroz NHL ile komplike mikst kriyoglobülinemi hastalarının %80 gibi büyük bir kısmında gözlenmektedir. Oysa ki idyopatik HCV pozitif NHL hastalarında karaciğer hastalığının görülme sıklığı %16-50 arasında değişmektedir. HCV tek zincirli bir RNA virüsü olup replikasyonunda DNA aracılığı yoktur ve bu yüzden HCV nükleik asit sekanslarının konak DNA’sına integrasyonu HBV’nin aksine yoktur. Bu yüzden HCV’nin onkogenik potansiyeli indirekt mekanizmalar ile olur. Bu durumda HCV lenfositlerde latent infeksiyon halindeki DNA herpetik virusları (EBV ve human herpetik virüs gibi) reaktive ediyor ve bu yolla lenfomageneziste rol oynuyor olabilir (105). Fakat son zamanlarda yapılan sınırlı sayıda çalışma bu hipotezi desteklememektedir; NHL hastalarında lenfotropik viruslarla ko-infeksiyon tam olarak açıklanamamış bir durumdur (106). Bir başka muhtemel mekanizma da HCV infeksiyonu virüs epitopları ile moleküler benzerlik yoluyla konağın immün mekanizmalarını harekete geçiriyor olabilir. Bu ihtimal HCV pozitif kişilerde anti-GOR antikorlarının saptanması nedeniyle ileri sürülmüştür, ki bu antikorlar HCV ve konak nükleer antijenlerinin her ikisi 12 için de spesifiktir. GOR sadece kanser hücrelerinin nükleuslarında saptanan bir nükleer antijen olup aşırı ekspresse edilir ve GOR geni bir onkogen olabilir. GOR geninin ekspresyonunda HCV’nin muhtemel rolü yeterince araştırılmamış bir konudur (107,108,109). HCV ilişkili mikst kriyoglobülinemi tip 2, B hücreli monoklonal aşırı çoğalma ile karakterizedir ve gerçek bir lenfomaya dönüşebilir. Virüs nedenli benign lenfoprolifersyon ve maliginite arasındaki bağlantının önemli bir örneğidir. Ellis ve arkadaşlarınınnın bildirdiği bir vakada mikst kriyoglobülinemi tip 2’li ve bcl-2 gen mutasyonu gösteren bir hastada 7 yıllık izlemden sonra Ig M romatoid faktörde ani bir yükseliş gözlenmiş olup bu yükselme hastada lenfoma olmaksızın gelişen sekonder bir genetik kırılma olan “myc onkogen”e bağlıydı (110). Mikst kriyoglobülinemide gözlenen benign monoklonal proliferasyon hastalığın belirleyici özelliğidir. Spesifik gen, lenfositlerin proliferasyon ve/veya ölümüne neden olarak B hücre aşırı çoğalmasına yol açıyor olabilir. Bu durumda, bcl-2 apopitozisi inhibe edebilir ve bu da sıklıkla benign ve malign B hücre neoplazilerine yol açar (111,112,113). Bcl-2 genindeki bu kırılma uzamış hücre ömrüne yol açmak suretiyle lenfositleri, ‘’myc onkogen’’inin translokasyonu gibi bir başka genetik kırılmaya maruz bırakabilir ve sonuç olarak yüksek grade’li lenfomalarda olduğu gibi lenfositlerin daha malign karakter kazanmasına neden olabilir (114). Böylece HCV infeksiyonunun malignitelerin çok basamaklı patogenezinde rol alan bir çok faktörden biri olduğu söylenebilir (115). 13 3. HASTALAR ve YÖNTEM Bu çalışma Başkent Üniversitesi Tıp ve Sağlık Bilimleri Araştırma Kurulu tarafından onaylanmış (Proje no: KA12/ 52) tır. Ocak 1995 ile Kasım 2011 tarihleri arasında Başkent Üniversitesi Tıp Fakültesi Ankara Hastanesi’ne başvuran 19 yaşından büyük erişkin hastalardan siroz, HBV veya HCV pozitifliği nedeniyle takip ve tedavileri yapılanlar çalışmaya alındı. Çalışma retrospektif bir çalışma olup değerlendirme için bu hastaların geriye dönük verilerinden faydalanıldı. Ocak 1995 ile Kasım 2011 tarihleri arasında hastanemize başvuran 1076 sirozlu, 792 HBV ve 768 HCV pozitif hastanın kayıtları düzeni olarak tutulmuş arşiv dosyaları incelendi. Takip boyunca elektronik ortamda kaydedilmiş laboratuvar kan tetkikleri, radyolojik inceleme sonuçları, patoloji örneklerinin kayıtları değerlendirildi. Kayıtları düzenli olarak tutulmamış veya bir süre takip edildikten sonra merkezimizin takibinden çıkmış vakalar değerlendirilmeye alınmadı. Dış merkezlerde düzenli olarak takip edildikten sonra merkezimize başvurup takip ve tedaviye alınan hastalardan geçmiş tarihli verilerine ulaşılabilenler de çalışmaya ve değerlendirilmeye alındılar. Siroz, HBV ve HCV tanısı almadan önce kanser tanısı alanlar çalışmanın dışında tutuldular. Hastalara siroz, HBV, HCV ve karaciğer dışı kanser (KDK) tanıları; serolojik tetkikler, biyokimyasal tetkikler, radyolojik incelemeler, patolojik değerlendirmeler ile konuldu. Sirozun etyolojisi, Child evresi, siroz tanı yaşı, sirozun kaçıncı yılında KDK tesbit edildiği, izlem süresi, KDK bölgesi ve adı, yapılan tedavi şekli, ilgili kanser gelişimi için risk faktörlerinin varlığı, hastaya transplantasyon yapılıp yapılmadığı, immün süpressif tedavi (İST) alıp almadığı ve eşlik eden hepatosellüler kanser (HSK) varlığı kayıt altına alındı. HBV ve HCV pozitif hastalarda taşıyıcı, kronik hepatit ve siroz olma durumu değerlendirilerek HBV ve HCV’nin tanı yaşı, infeksiyonun kaçıncı yılında KDK tesbit edildiği, izlem süresi, KDK bölgesi ve adı, yapılan tedavi şekli, ilgili kanser gelişimi için risk faktörlerinin varlığı, hastaya transplantasyon yapılıp yapılmadığı, immün süpressif tedavi alıp almadığı ve eşlik eden hepatosellüler kanser (HSK) varlığı kaydedildi ve değerlendirildi. Sirozlu, HBV ve HCV pozitif hastalarda KDK insidansının artıp artmadığı değerlendirilmek istediğimizden dolayı hastanemize ait bir kontrol grubu oluşturmayı planladık. 2005 ve 2006 yıllarında hastanemize başvuran, sirotik olmayan, HBV ve HCV negatif olan 18 yaşından büyük bütün hastalar arasında kanser tanısı konulan ve Türk Kanser Araştırmaları Derneği’ne bildirimi yapılan hastaların verilerini değerlendirerek hastanemizin ilgili kanser 14 türleri için insidans oranlarını hesapladık ve bu oranları sirozlu, HBV ve HCV pozitif olup KDK tesbit edilen hastaların kanser insidansları ile karşılaştırdık. Kontrol grubu olarak ayrıca T.C. Sağlık Bakanlığı Kanserle Savaş Dairesi Başkanlığı ve Kanser Erken Teşhis, Tarama ve Eğitim Merkezi (KETEM)’in Ankara ve Türkiye için yayımladığı yıllık kanser insidans oranlarını da kullandık. İstatistiki analizler için SPSS for Windows 15.0 programı kullanıldı. Veriler sayı, yüzde ve insidans olarak değerlendirilip karşılaştırmalar yapıldı. 15 4. BULGULAR Çalışmada 1995-2011 tarihleri arasında hastanemize başvuran 19 yaş ile 90 yaş arasında 689 erkek ve 387 kadın olmak üzere toplam 1076 sirozlu hastanın retrospektif verileri değerlendirildi ve bu hastalar arasında 29 erkek (%63) ve 17 (%37) kadın olmak üzere toplam 46 hastada karaciğer dışı (KDK) tesbit edildi. HBV grubunda ise 563 erkek ve 229 kadın omak üzere toplam 792 hasta arasından 29 erkek (%78) ve 8 kadın (%21) olmak üzere toplam 37 hastada KDK tesbit edildi. HCV grunundaki hastalarda ise 449 erkek ve 319 kadın olmak üzere toplam 768 hastanın verileri incelendi ve 27 erkek (%65) ve 14 kadın (%35) olmak üzere toplam 41 hastada KDK tesbit edildi. Bu veriler aşağıda tablo 3 ve tablo 4 de özetlenmektedir. Aşağıdaki şekil-2’de ise KDK tesbit edilen hastaları cinsiyet, siroz, HBV ve HCV gruplarına dağılımı grafiksel olarak gösterilmektedir. Tablo 3. Çalışmada incelenen HBV, HCV ve sirozlu hastaların dağılım tablosu Tanısı Erkek Kadın Genel Toplam HBV pozitif 563 229 792 HCV pozitif 449 319 768 Siroz 689 387 1076 Genel Toplam 1701 935 2636 Tablo 4. HBV, HCV ve sirozlu olup KDK tanısı alan hastaların dağılım tablosu Sayı Yüzde (%) Toplam 37 HBV pozitif Erkek 29 78.4 Kadın 8 21.6 41 HCV pozitif Erkek 27 65.9 Kadın 14 34.1 SİROZ 46 Erkek 29 63 Kadın 17 37 16 Yüzde Erkek Kadın Şekil 2. KDK tanılı hastaların cinsiyet, siroz, HBV ve HCV gruplarına dağlımı grafiği Hastaların HBV, HCV ve siroz tanı yaşları ile ilgili kanserlerin tanı yaşları ve ortalama izlem süreleri ile ilgili veriler aşağıdaki gibidir; HBV’li olup KDK tanısı konan hastalarda HBV tanı yaşı 19 ile 66 arasında değişmekte olup ortalama 52.5±16.6 idi. KDK tanı yaşı 22 ile 85 arasında değişmekte olup ortalama 57.4± 13.9 idi. HCV’li olup KDK tesit edilen hastalarda HCV tanı yaşı 19 ile 73 arasında değişmekte olup ortalama 50.5±14 idi. Bu grupta KDK tanı yaşı 24 ile 85 arasında değişmekte olup ortalama 55.3±14.6 idi. Sirozlu olup KDK tanısı konan hastalarda yaş 19 ile 91 arasında değişmekte olup ortalama 57.5±16.6 idi. Bu grupa yer alan hastalarda kanser tanı yaşları 22 ile 91 arasında değişmekte olup ortalama 60.3±14.8 idi. Ortalama izlem süreleri ve ilgili tanı konduktan sonra KDK gelişinceye kadar geçen süreler göz önüne alındığında ise HBV’li hastalarda ortalama izlem süresi 1 ile 31 yıl arasında değişmekte olup ortalama 8.1 yıldı. Bu hastalarda HBV tanısından sonra KDK gelişmesi için geçen süre 1 ile 31 yıl arasında değişmekte olup ortalama ise 5,2 yıl idi. HCV’li hastalarda ortalama izlem süresi 1 ile 31 yıl arasında değişmekte olup ortalama 8,4 yıl idi. Bu hastalarda HCV tanısından sonra KDK gelişmesi için geçen süre 1 ile 30 yıl arasında değişmekte olup ortalama ise 4,9 yıl idi. 17 Sirozlu hastalarda ortalama izlem süreleri 1 ile 30 yıl arasında değişmekte olup ortalama 6.4 yıl idi. Siroz tanısı konduktan sonra KDK gelişimi için geçen süre 1 ile 16 yıl arasında değişmekte ortalama 3,2 yıl idi. İzlem süreleri aşağıda tablo 5’te gösterilmektedir. Tablo 5. Ortalama izlem süreleri Grup Ortalama izlem süresi (yıl) KDK gelişinceye kadar geçen ortalama süre (yıl) HBV 8.1 5.2 HCV 8.4 4.9 Siroz 6.4 3.2 HBV pozitif olup KDK tesbit edilen hastalarda taşıyıcılık %37,8, kronik HBV infeksiyonu %29.7 ve siroz %32.4 oranında idi. Bu dağılım aşağıda tablo 6’da gösterilmektedir. Tablo 6. HBV pozitifliğinin durumuna göre KDK hastalarının dağılımı Sayı Oran (%) Gerçek oran (%) Toplam oran (%) Kronik HBV 11 29,7 29,7 29,7 Taşıyıcı 14 37,8 37,8 67,6 Siroz 12 32,4 32,4 100,0 Toplam 37 100,0 100,0 HCV pozitif olup KDK tesbit edilen hastalarda taşıyıcılık %39 kronik HCV infeksiyonu %31.7 ve siroz %29.3 oranında idi. Bu dağılım aşağıda tablo-7’de gösterilmektedir. Tablo 7. HCV pozitifliğinin durumuna göre KDK hastalarının dağılımı Sayı Oran (%) Taşıyıcı 16 39,0 39,0 39,0 Siroz 12 29,3 29,3 68,3 Kronik HCV İnfeksiyonu 13 31,7 31,7 100,0 Toplam 41 100,0 100,0 18 Gerçek oran (%) Toplam oran (%) Sirozlu olup KDK tesbit edilen hastalarda Child evresine göre hastaların dağılımı, Child A %32.6, Child B %30.4 ve Child C %37 şeklinde idi. Bu aşağıda tablo-8’de gösterilmektedir. Tablo 8. Sirozlu hastalarda Child evresine göre KDK dağılımı Sayı Oran (%) Gerçek oran (%) Toplam oran (%) Child A 15 32,6 32,6 32,6 Child B 14 30,4 30,4 63,0 Child C 17 37,0 37,0 100,0 Toplam 46 100,0 100,0 KDK tesbit edilen hastalarda sirozun etyolojisi gözönüne alındığında dağılım %32.6 kriptojenik, %2.2 konjenital hepatik fibrozis, %2.2 NAYK, %21.7 HCV, %26.1 HBV, %6.5 alkol, %2.2 Wilson Hastalığı, %4.3 primer biliyer siroz ve %2.2 kist hidatiğe sekonder gelişmiş siroz idi. Bu veriler aşağıda tablo-9 da gösterilmektedir. Tablo 9. Sirozlu hastalarda KDK’lerin siroz etyolojisine göre dağılımı Sayı Oran Gerçek oran (%) (%) Toplam oran (%) Kriptojenik 15 32,6 32,6 32,6 Konjenital Hepatik Fibrozis 1 2,2 2,2 34,8 Non-Alkolik Yağlı Karaciğer 1 2,2 2,2 37,0 HCV 10 21,7 21,7 58,7 Alkol 3 6,5 6,5 65,2 Wilson Hastalığı 1 2,2 2,2 67,4 HBV 12 26,1 26,1 93,5 Primer Biliyer Siroz 2 4,3 4,3 97,8 Kist Hidatik 1 2,2 2,2 100,0 Toplam 46 100,0 100,0 19 Sirozlu hastalarda KDK’lerin siroz etyolojisine göre dağılım grafiği aşağıda şekil Yüzde 3’te görülmektedir. Siroz etyolojisi Şekil 3. Sirozlu ve KDK’li hastaların siroz etyolojisine göre dağılım grafiği HBV pozitif olup KDK tesbit edilen hastalarda kanserlerin gelişim bölgelerine göre dağılımı aşağıdaki tablo 10’daki gibidir. Tablo 10. HBV pozitif hastalarda KDK bölgesine göre hastaların dağılımı Sayı Oran (%) Ekstremite 4 10,8 10,8 10,8 Baş-boyun 4 10,8 10,8 21,6 Toraks-Meme 7 18,9 18,9 40,5 GİS 10 27,0 27,0 67,6 Hematolojik 7 18,9 18,9 86,5 ÜS 3 8,1 8,1 94,6 Primeri Bilinmeyen 1 2,7 2,7 97,3 Jinekolojik 1 2,7 2,7 100,0 Toplam 37 100,0 100,0 20 Gerçek oran (%) Toplam oran (%) HBV pozitif olup KDK tesbit edilen hastalarda kanserlerin adlarına göre dağılımı yukarıda tablo 11’de gösterilmektedir. Tablo 11. HBV pozitif hastalarda KDK’lerin adlarına göre dağılımı Sayı Oran (%) Gerçek oran Toplam oran (%) (%) Sarkom 2 5,4 5,4 5,4 Tiroid Ca 2 5,4 5,4 10,8 Akciğer Ca 6 16,2 16,2 27,0 Melanom 1 2,7 2,7 29,7 Kolon Ca 5 13,5 13,5 43,2 Pankreas Ca 2 5,4 5,4 48,6 Non-Hodgkin Lenfoma 1 2,7 2,7 51,4 Mide Ca 2 5,4 5,4 56,8 Multiple Myeloma 2 5,4 5,4 62,2 Bazal Hücreli Ca 1 2,7 2,7 64,9 Skuamöz Hücreli Ca 1 2,7 2,7 67,6 Hodgkin Lenfoma 3 8,1 8,1 75,7 Prostat Ca 1 2,7 2,7 78,4 Kemik Ca 1 2,7 2,7 81,1 Meme Ca 1 2,7 2,7 83,8 Böbrek Ca 1 2,7 2,7 86,5 Larinks Ca 1 2,7 2,7 89,2 Endometrium Ca 1 2,7 2,7 91,9 Lösemi 1 2,7 2,7 94,6 Safra Kesesi Ca 1 2,7 2,7 97,3 Mesane Ca 1 2,7 2,7 100,0 Toplam 37 100,0 100,0 21 HCV pozitif olup KDK tesbit edilen hastalarda kanserlerin gelişim bölgesine göre dağılımı aşağıdaki tablo 12’de gösterilmektedir. Tablo 12. HCV pozitif hastalarda KDK bölgesine göre hastaların dağılımı Sayı Oran (%) Gerçek oran (%) Toplam oran (%) Ekstremite 2 4,9 4,9 4,9 Baş-boyun 3 7,3 7,3 12,2 Toraks-meme 6 14,6 14,6 26,8 GİS 8 19,5 19,5 46,3 Hematolojik 9 22,0 22,0 68,3 ÜS 6 14,6 14,6 82,9 Jinekolojik 2 4,9 4,9 87,8 Cilt Ca 5 12,2 12,2 100,0 Toplam 41 100,0 100,0 HCV pozitif olup KDK tesbit edilen hastalarda kanserlerin adlarına göre dağılımı aşağıdaki gibidir. Bu veriler aşağıda tablo 13’de gösterilmektedir. Tablo 13. HCV pozitif hastalarda KDK’lerin adlarına göre dağılımı Sayı Oran (%) Gerçek oran (%) Toplam oran (%) Sarkom 2 4,9 4,9 4,9 Tiroid Ca 3 7,3 7,3 12,2 Akciğer Ca 4 9,8 9,8 22,0 Kolon Ca 3 7,3 7,3 29,3 Non- Hodgkin Lenfoma 3 7,3 7,3 36,6 Mide Ca 1 2,4 2,4 39,0 Multiple Myeloma 2 4,9 4,9 43,9 Skumöz Hücreli Ca 5 12,2 12,2 56,1 Hodgkin Lenfoma 1 2,4 2,4 58,5 Prostat Ca 2 4,9 4,9 63,4 Meme Ca 2 4,9 4,9 68,3 Böbrek Ca 3 7,3 7,3 75,6 Endometrium Ca 1 2,4 2,4 78,0 Lösemi 3 7,3 7,3 85,4 Safra Kesesi Ca 1 2,4 2,4 87,8 Mesane Ca 1 2,4 2,4 90,2 Kolanjiyosellüler Ca 3 7,3 7,3 97,6 Serviks Ca 1 2,4 2,4 100,0 Toplam 41 100,0 100,0 22 Sirozlu olup KDK tesbit edilen hastalarda kanserlerin gelişim göre dağılımı aşağıdaki gibidir. Bu tablo 14’de gösterilmektedir. Tablo 14. Sirozlu hastalarda KDK bölgesine göre hastaların dağılımı Sayı Oran (%) Gerçek oran (%) Ekstremite Baş-boyun Toraks-meme GİS Hematolojik ÜS Jinekolojik Cilt Ca 2 3 6 9 12 8 2 4 4,3 6,5 13,0 19,6 26,1 17,4 4,3 8,7 4,3 6,5 13,0 19,6 26,1 17,4 4,3 8,7 Toplam 46 100,0 100,0 Toplam oran (%) 4,3 10,9 23,9 43,5 69,6 87,0 91,3 100,0 Sirozlu olup KDK tesbit edilen hastalarda kanserlerin adlarına göre dağılımı aşağıdaki gibidir. Bu tablo 15’de gösterilmektedir. Tablo 15. Sirozlu hastalarda KDK adlarına göre hastaların dağılımı Sayı Oran (%) Gerçek oran (%) Toplam oran (%) 2,2 6,5 15,2 19,6 21,7 32,6 43,5 50,0 56,5 58,7 65,2 67,4 69,6 71,7 73,9 80,4 82,6 95,7 97,8 100,0 Sarkom Tiroid Ca Akciğer Ca Kolon Ca Pankreas Ca Mide Ca Multiple Myeloma Bazal Hücreli Ca Prostat Ca Meme Ca Böbrek Ca Larinks Ca Endometrium Ca Lösemi Safra Kesesi Ca Mesane Ca Skuamöz Hücreli Ca Lenfoma Over Ca Primeri bilinmeyen Ca 1 2 4 2 1 5 5 3 3 1 3 1 1 1 1 3 1 6 1 1 2,2 4,3 8,7 4,3 2,2 10,9 10,9 6,5 6,5 2,2 6,5 2,2 2,2 2,2 2,2 6,5 2,2 13,0 2,2 2,2 2,2 4,3 8,7 4,3 2,2 10,9 10,9 6,5 6,5 2,2 6,5 2,2 2,2 2,2 2,2 6,5 2,2 13,0 2,2 2,2 Toplam 46 100,0 100,0 23 HBV pozitif olup KDK gelişen hastalarda kanser gelişiminde katkısı olabilecek bazı risk faktörleri mevcuttu. İki hastada (%5.4) kolon kanseri gelişimi açısından risk olarak kolon polibi mevcuttu. Hastaların 5 tanesine (%13.5) transplantasyon yapılmış ve immün süpressif tedavi almakta olup KDK bu zeminde gelişmişti. Transplantasyon yapılmış hastaların 4 tanesi karaciğer, 1 tanesi ise böbrek nakli olmuştu. Bir hastada (%2.7) ise risk faktörü olarak kronik böbrek yetmezliği mevcuttu. Bunların dışında kayıt altına alınmış ve tesbit edilebilen risk faktörü yoktu. Bu veriler aşağıda tablo 16’da gösterilmektedir. Tablo16. HBV pozitif ve KDK’li hastalarda risk faktörleri Sayı Yüzde (%) Kolon polibi 2 5,4 Sigara 5 13,5 Transplantasyon+ İmmün süpressif tedavi 5 13,5 Kronik Böbrek Yetmezliği 1 2,7 Risk yok 24 64,9 Toplam 37 100,0 HCV’li olup KDK gelişen hastalarda kanser gelişiminde katkısı olabilecek risk faktörleri aşağıdaki gibiydi. Kolon kanseri gelişen hastalardan 2’sinde (%4,9) risk faktörü olarak kolon polibi mevcuttu. Bir hasta sigara içmekteydi ve bu hastada akciğer kanseri gelişmişti. 18 hasta (%43,9) kronik böbrek yetmezliği tanısı almış idi. Bunlardan 4 hasta (%9.8) böbrek yetmezliği nedeniyle hemodiyalize girmekteydi. 15 hastada (%36,6) renal transplantasyon veya karaciğer transplantasyonu nedeniyle immünsüpresif tedavi altındayken malignite gelişmişti. Bunlaradan biri karaciğer 14 tanesi ise böbrek nakli idi. İmmünsüpresif alan hastaların oranları aşağıda tablo 17’de gösterilmektedir. Tablo 17. HCV grubunda immünsüpressif tedavi altında KDK gelişen hastalar Sayı Oran (%) Gerçek oran (%) Toplam oran (%) İmmünsüpressif tedavi almayanlar 26 63,4 63,4 63,4 İmmünsüpressif tedavi alanlar 15 36,6 36,6 100,0 Toplam 41 100,0 100,0 24 HBV pozitif hastalarda 37 hastanın 5’inde (%13.5), HCV pozitif hastalarda 41 hastanın 1’inde (%2.4), sirozlu hastalarda ise 46 hastanın 5 tanesinde (%10.9) KDK’e eşlik eden değişik evrelerde HSK mevcuttu. HBV, HCV ve siroz grubunda KDK’li hastalarda kanser bölgelerine göre insidans oranları aşağıdaki aşağıda tablo 18’de görüldüğü gibidir. Tablo 18. HBV, HCV pozitif ve sirozlu olup KDK gelişen hastaların kanser gelişme bölgelerine göre insidans oranları HBV KDK BÖLGESİ Sayı/ İnsidans/ Sayı/ İnsidans/ Sayı/ İnsidans/ erkek erkek kadın kadın total total Ekstremite 3 0,00533 1 0,00437 4 0,00505 Baş-boyun 3 0,00533 1 0,00437 4 0,00505 Toraks-meme 6 0,01066 1 0,00437 7 0,00884 GiS 8 0,01421 2 0,00873 10 0,01263 Hematolojik 5 0,00888 2 0,00873 7 0,00884 ÜS 3 0,00533 0 0,00000 3 0,00379 Primeri bilinmeyen 1 0,00178 0 0,00000 1 0,00126 Jinekolojik 0 0,00000 1 0,00437 1 0,00126 29/563 0,05151 8/229 0,03493 37/792 0,04672 Ekstremite 1 0,00223 1 0,00313 2 0,00260 Baş-boyun 1 0,00223 2 0,00627 3 0,00391 Toraks-meme 4 0,00891 2 0,00627 6 0,00781 GiS 4 0,00891 4 0,01254 8 0,01042 Hematolojik 7 0,01559 2 0,00627 9 0,01172 ÜS 5 0,01114 1 0,00313 6 0,00781 Jinekolojik 0 0,00000 2 0,00627 2 0,00260 Cilt Ca 5 0,01114 0 0,00000 5 0,00651 27/443 0,06013 14/319 0,04389 41/768 0,05339 Ekstremite 2 0,00290 0 0,00000 2 0,00186 Baş-boyun 1 0,00145 2 0,00517 3 0,00279 Toraks-meme 4 0,00581 2 0,00517 6 0,00558 GiS 4 0,00581 5 0,01292 9 0,00836 Hematolojik 7 0,01016 5 0,01292 12 0,01115 ÜS 8 0,01161 0 0,00000 8 0,00743 Jinekolojik 0 0,00000 2 0,00517 2 0,00186 Cilt Ca 3 0,00435 1 0,00258 4 0,00372 29/689 0,04209 17/387 0,04393 46/1076 0,04275 Toplam HCV KDK BÖLGESİ Toplam SİROZ KDK BÖLGESİ Toplam 25 Aşağıda şekil 4’de HBV, HCV pozitif ve sirozlu hastalarda tesbit edilen KDK’lerin gelişim bölgelerine dağılımı grafiksel olarak gösterilmektedir. 0,016 0,014 0,012 0,01 0,008 0,006 0,004 0,002 0 erkek kadın ekstremite başboyun toraks m gis hematolojik güs primer ? jinekolojik ekstremite başboyun toraks m gis hematolojik güs jinekolojik cild ca ekstremite başboyun toraks m gis hematolojik güs jinekolojik cild ca total hbv hcv siroz Şekil 4. HBV, HCV pozitif ve sirozlu olup KDK gelişen hastaların kanser bölgelerine göre dağılım grafiği HBV, HCV ve siroz grubunda KDK’li hastaların kanser adlarına göre insidans oranları aşağıda tablo 19’da görüldüğü gibidir. Tablo 19. Sirozlu ve KDK’li hastaların kanser adlarına göre insidans oranları HBV KDK ADI Toplam Sarkom Tiroid Ca Akciğer Ca Melanom Kolon Ca Pankreas Ca Non-Hodgkin Lenfoma Mide Ca Multiple Myelom Bazal Hücreli Ca Skuamöz Hücreli Ca Hodgkin Lenfoma Prostat Ca Kemik Ca Meme Ca Böbrek Ca Larinks Ca Endometrium Ca Lösemi Safra Kesesi Ca Mesane Ca Sayı/e 2 1 6 0 3 2 1 2 1 1 1 2 1 1 0 1 1 0 1 1 1 29/563 İnsidans/erkek 0,00355 0,00178 0,01066 0,00000 0,00533 0,00355 0,00178 0,00355 0,00178 0,00178 0,00178 0,00355 0,00178 0,00178 0,00000 0,00178 0,00178 0,00000 0,00178 0,00178 0,00178 0,05151 26 Sayı/k 0 1 0 1 2 0 0 0 1 0 0 1 0 0 1 0 0 1 0 0 0 8/229 İnsidans/kadın 0,00000 0,00437 0,00000 0,00437 0,00873 0,00000 0,00000 0,00000 0,00437 0,00000 0,00000 0,00437 0,00000 0,00000 0,00437 0,00000 0,00000 0,00437 0,00000 0,00000 0,00000 0,03493 Sayı/t 2 2 6 1 5 2 1 2 2 1 1 3 1 1 1 1 1 1 1 1 1 37/792 İnsidans/total 0,00253 0,00253 0,00758 0,00126 0,00631 0,00253 0,00126 0,00253 0,00253 0,00126 0,00126 0,00379 0,00126 0,00126 0,00126 0,00126 0,00126 0,00126 0,00126 0,00126 0,00126 0,04672 HCV KDK ADI Sayı/e İnsidans/erkek Sayı/k İnsidans/kadın Sayı/t İnsidans/total Sarkom 2 0,00445 1 0,00313 3 0,00391 Tiroid Ca 1 0,00223 2 0,00627 3 0,00391 Akc Ca 4 0,00891 0 0,00000 4 0,00521 Kolon Ca 1 0,00223 2 0,00627 3 0,00391 Non-Hodgkin Lenfoma 3 0,00668 0 0,00000 3 0,00391 Mide Ca 1 0,00223 0 0,00000 1 0,00130 Multiple Myeloma 1 0,00223 1 0,00313 2 0,00260 Hodgkin Lenfoma 0 0,00000 1 0,00313 1 0,00130 Prostat Ca 2 0,00445 0 0,00000 2 0,00260 Meme Ca 0 0,00000 2 0,00627 2 0,00260 Böbrek Ca 2 0,00445 0 0,00000 2 0,00260 Endometrium Ca 0 0,00000 1 0,00313 1 0,00130 Lösemi 3 0,00668 0 0,00000 3 0,00391 Safra Kesesi Ca 1 0,00223 0 0,00000 1 0,00130 Mesane Ca 0 0,00000 1 0,00313 1 0,00130 Kolanjiyosellüler Ca 1 0,00223 2 0,00627 3 0,00391 Skuamöz Hücreli Ca 5 0,00891 0 0,00000 5 0,00651 Serviks Ca 0 0,00000 1 0,00313 1 0,00130 27/449 0,06013 14/319 0,04389 41/768 0,05339 Sayı/e İnsidans/erkek Sayı/k İnsidans/kadın Sayı/t İnsidans/total Tiroid Ca 0 0,00000 2 0,00517 2 0,00186 Akciğer Ca 4 0,00581 0 0,00000 4 0,00372 Kolon Ca 0 0,00000 2 0,00517 2 0,00186 Pankreas Ca 0 0,00000 1 0,00258 1 0,00093 Mide Ca 3 0,00435 2 0,00517 5 0,00465 Multiple Myeloma 2 0,00290 3 0,00775 5 0,00465 Bazal Hücreli Ca 2 0,00290 1 0,00258 3 0,00279 Prostat Ca 3 0,00435 0 0,00000 3 0,00279 Meme Ca 0 0,00000 1 0,00258 1 0,00093 Böbrek Ca 3 0,00435 0 0,00000 3 0,00279 Larinks Ca 1 0,00145 0 0,00000 1 0,00093 Lösemi 1 0,00145 0 0,00000 1 0,00093 Safra Kesesi Ca 1 0,00145 0 0,00000 1 0,00093 Mesane Ca 2 0,00290 1 0,00258 3 0,00279 Skuamöz Hücreli Ca 1 0,00145 0 0,00000 1 0,00093 Lenfoma 4 0,00581 2 0,00517 6 0,00558 Over Ca 0 0,00000 1 0,00258 1 0,00093 Primeri Bilinmeyen Ca 1 0,00145 0 0,00000 1 0,00093 Endometrium Ca 0 0,00000 1 0,00258 1 0,00093 Sarkom 1 0,00145 0 0,00000 1 0,00093 29/689 0,04209 17/387 0,04393 46/1076 0,04275 Toplam SİROZ KDK ADI Toplam 27 Aşağıda şekil 5’te HBV, HCV ve sirozlu hastalarda tesbit edilen KDK’lerin adlarına göre dağılımı grafiksel olarak gösterilmektedir. 0,008 0,007 0,006 0,005 0,004 0,003 0,002 0,001 0 erkek sarkomh m.fibröz endomet ca primer ?ca over ca lenfoma cc skuamoz h.li ca skuamöz siroz mesane ca safra k ca lösemi larinks böbrek ca meme ca prostat ca ca bazal h.libcc myelom mm mide ca pankreas ca kolon ca akc ca tiroid ca kadın total Şekil 5. HBV, HCV pozitif ve sirozlu olup KDK gelişen hastaların kanser adlarına göre dağılım grafiği HBV, HCV ve sirozlu hastalarda 2005 ve 2006 yılında tanı konulan KDK tesbit edilip bu kanserlerin insidans oranları hastanemizin bu yıllara ait total kanser isidans oranları oranları ile karşılaştırma yapılacağı için önemlidir. 2005 ve 2006 yıllarında tanı konmuş KDK’ler aşağıda tablo 20’de gösterilmektedir. Tablo 20. 2005 ve 2006 yılı siroz, HBV, HCV pozitif hastalarda KDK tanılı hastalar 2005 yılı toplam hasta sayıları Tanı Kodu Erkek Kadın Genel Toplam HBV 41 8 49 HCV 58 29 87 Siroz 122 59 181 Genel Toplam 221 96 317 2006 yılı toplam hasta sayıları Tanı Kodu Erkek Kadın Genel Toplam HBV 49 14 63 HCV 56 36 92 Siroz 135 64 199 Genel Toplam 240 114 354 28 HBV’li hastalarda 2005 yılında 4 hastada, 2006 yılında ise 3 hastada KDK gelişmişti. Veriler aşağıda tablo 21’de gösterilmektedir. Tablo 21. HBV pozitif hastalarda 2005-2006’tanı konan KDK’li hastaların oranları Sayı Oran (%) 2005 4 10,8 57,1 57,1 2006 3 8,1 42,9 100,0 37 100,0 HBV Pozitif Toplam KDK Sayısı Gerçek oran (%) Toplam oran (%) HCV’li hastalarda 2005 yılında 6 hastaya, 2006 yılında ise 5 hastaya KDK tanısı konmuş idi. Bu veriler aşağıda tablo 22 ‘de gösterilmektedir. Tablo 22. HCV pozitif hastalarda 2005-2006’da tanı konan KDK’li hastaların oranları Sayı Oran (%) 2005 6 14,6 54,5 54,5 2006 5 12,2 45,5 100,0 41 100,0 HCV Pozitif Toplam KDK Sayısı Gerçek oran (%) Toplam oran (%) Siroz’lu hastalarda 2005 yılında 9 hastaya, 2006 yılında ise 5 hastaya KDK tanısı konmuş idi. Bu veriler aşağıda tablo 23’de gösterilmektedir. Tablo 23. Siroz’lu hastalarda 2005-2006’da tanı konan KDK’li hastaların oranları Sayı Oran (%) Gerçek oran (%) Toplam oran (%) 2005 9 19,6 64,3 64,3 2006 5 10,9 35,7 100,0 46 100,0 Sirozlu Toplam KDK Sayısı 29 HBV, HCV ve siroz grubunda KDK’li hastaların kanser insidans oranlarının 2005 ve 2006 yılı hastanemize ait kanser insidans oranları ile karşılaştırılması planlanmıştı. 2005 ve 2006 hastanemiz kanser insidans oranları kanser gelişim bölgesi ve kanser adı için aşağıda tablo 24’te görüldüğü gibidir. Tablo 24. Kanser bölgelerine göre hastanemizin 2005 ve 2006 yıllarına ait kanser insidans oranları Sayı/ erkek İnsidans/ Sayı/ İnsidans/ Sayı erkek kadın kadın /total İnsidans total Ekstremite 4 0,000119 4 0,00007 8 0,00009 Baş-boyun 22 0,000652 28 0,00049 50 0,00055 Toraks-meme 50 0,001481 75 0,00132 125 0,00138 GİS KANSER Hematolojik 2005 BÖLGESİ Üriner Sistem 82 0,002430 44 0,00078 126 0,00139 9 0,000267 7 0,00012 16 0,00018 102 0,003022 30 0,00053 132 0,00146 1 0,000030 1 0,00002 2 0,00002 36 0,001067 21 0,00037 57 0,00063 306/33750 0,009067 210/56630 0,00371 516/90380 0,00571 Ekstremite 4 0,000091 0 0,00000 4 0,00004 Baş-boyun 13 0,000297 22 0,00036 35 0,00033 Toraks- meme 17 0,000388 40 0,00065 57 0,00054 GİS KANSER Hematolojik 2006 BÖLGESİ Üriner Sistem 42 0,000959 24 0,00039 66 0,00062 4 0,000091 7 0,00011 11 0,00010 122 0,002786 26 0,00042 148 0,00140 0 0,000000 1 0,00002 1 0,00001 29 0,000662 15 0,00024 44 0,00042 231/43787 0,005276 135/61918 Primeri bilinmeyen Cilt Toplam Primeri bilinmeyen Cilt Toplam 0,00218 366/105705 0,00346 HBV, HCV ve siroz grubunda KDK’li hastaların kanser insidans oranlarını karşılaştıracağımız hastanemiz 2005 ve 2006 yıllarına ait kanser insidans oranları kanser adlarına göre aşağıdaki tablo 25’de görüldüğü gibidir. 30 Tablo 25. Kanser adlarına göre hastanemiz 2005 ve 2006 yıllarına ait kanser insidans oranları 2005 KANSER ADI Toplam 2006 Sayı/ erkek İnsidans/ Sayı/ kadın İnsidans/ Sayı/ Total/ Sayı/ İnsidans/ Sayı/ İnsidans/ Sayı/ erkek kadın total insidans erkek erkek kadın kadın total 4 0,00012 4 0,00007 8 0,00009 4 0,00009 0 0,00000 4 0,00004 Tiroid Ca 5 0,00015 20 0,00035 25 0,00028 6 0,00014 12 0,00019 18 0,00017 Akciğer Ca 34 0,00101 6 0,00011 40 0,00044 7 0,00016 3 0,00005 10 0,00009 Melanom 2 0,00006 3 0,00005 5 0,00006 1 0,00002 0 0,00000 1 0,00001 Kolon Ca 39 0,00116 26 0,00046 65 0,00072 23 0,00053 14 0,00023 37 0,00035 Pankreas Ca 9 0,00027 5 0,00009 14 0,00015 3 0,00007 2 0,00003 5 0,00005 Non-Hodgkin Lenfoma 8 0,00024 7 0,00012 15 0,00017 1 0,00002 4 0,00006 5 0,00005 Mide Ca 19 0,00056 8 0,00014 27 0,00030 12 0,00027 3 0,00005 15 0,00014 Bazal Hücreli Ca 30 0,00089 18 0,00032 48 0,00053 23 0,00053 18 0,00029 41 0,00039 Skuamöz Hücreli Ca 14 0,00041 4 0,00007 18 0,00020 10 0,00023 2 0,00003 12 0,00011 Prostat Ca 62 0,00184 0 0,00000 62 0,00069 70 0,00160 1 0,00002 71 0,00067 Meme Ca 3 0,00009 67 0,00118 70 0,00077 0 0,00000 36 0,00058 36 0,00034 Böbrek Ca 17 0,00050 4 0,00007 21 0,00023 16 0,00037 9 0,00015 25 0,00024 Larinks Ca 13 0,00039 0 0,00000 13 0,00014 10 0,00023 4 0,00006 14 0,00013 Endometrium Ca 1 0,00003 12 0,00021 13 0,00014 0 0,00000 5 0,00008 5 0,00005 Lösemi 1 0,00003 0 0,00000 1 0,00001 1 0,00002 1 0,00002 2 0,00002 Safra Kesesi Ca 2 0,00006 1 0,00002 3 0,00003 0 0,00000 1 0,00002 1 0,00001 Mesane Ca 19 0,00056 9 0,00016 28 0,00031 35 0,00080 6 0,00010 41 0,00039 Serviks Ca 1 0,00003 3 0,00005 4 0,00004 0 0,00000 1 0,00002 1 0,00001 Over Ca 0 0,00000 2 0,00004 2 0,00002 2 0,00005 2 0,00003 4 0,00004 Primeri bilinmeyen Ca 5 0,00015 4 0,00007 9 0,00010 0 0,00000 3 0,00005 3 0,00003 Testis Ca 2 0,00006 0 0,00000 2 0,00002 2 0,00005 3 0,00005 5 0,00005 İnce Barsak Ca 6 0,00018 3 0,00005 9 0,00010 1 0,00002 0 0,00000 1 0,00001 Dil Ca 2 0,00006 2 0,00004 4 0,00004 1 0,00002 2 0,00003 3 0,00003 Beyin Ca 4 0,00012 0 0,00000 4 0,00004 1 0,00002 0 0,00000 1 0,00001 Tükrük Bezi Ca 2 0,00006 2 0,00004 4 0,00004 2 0,00005 0 0,00000 2 0,00002 Sürrenal Bez Ca 2 0,00006 0 0,00000 2 0,00002 0 0,00000 3 0,00005 3 0,00003 306/33750 0,00907 210/56630 0,00371 516/90380 0,00571 231/43787 0,00528 135/61918 0,00218 366/105705 0,00346 Sarkom 31 İnsidans/ total 5. TARTIŞMA Sirozlu hastalarda HSK gelişiminde artma olduğu gibi KDK görülme sıklığı da artmaktadır. Sirozun kendisi mi, siroz etyolojisinde rol oynayan etkene maruziyet mi yoksa siroz sonucu oluşan hormonal ve metabolik değişikliklerin mi onkogenez sürecinde asıl rolü oynadığı tam olarak açıklanabilmiş değildir. Berman ve arkadaşları 952 sirotik hastada yaptıkları çalışmada sirozlu hastalarda, özellikle alkolik sirozlularda KDK gelişimi açısından önemi oranda armış risk tesbit ettiler. Sirozun etyolojisi göz önüne alındığında ise viral etyolojili sirozlarda HSK gelişimi açısından yüksek risk, KDK gelişimi açısından ise düşük risk artışı buldular. Alkolik sirozlularda ise tam tersine KDK açısından artmış bir risk fakat HSK açısından ise daha düşük risk artışı sözkonusu idi. Ayrıca NAYK ve otoimmün hepatite bağlı sirozlarda da daha önce bildirilen artmış HSK riskini doğruladılar (3). Sorensen ve arkadaşlarının Danimarka toplumundaki sirozlularda yaptığı çalışmada HSK riskinde 25 kat artış tesbit edilirken kolanjiokarsinoma riski 10 kat artmış idi. Alkolik sirozlularda alkol ve tütün kullanımı ile de ilgili olarak akciğer, larinks, farinks, oral kavite, pankreas, mesane ve böbrek kanserlerinde artış tesbit edilirken kolon ve meme kanserlerinde hafif bir artış söz konusu idi (21). Bizim sirozlu hastalarımızda total kanser insidansı 0,04275 iken hastanemize ait kontrol grubunda ise 2005 yılı için 0,00571 ve 2006 yılı için ise 0,00346 idi. Bu, sirozlu hastalarda 2005 yılına göre kıyaslandığında yaklaşık 7 kat, 2006 yılında göre kıyaslandığında ise 12 kat artmış KDK görülme sıklığı demekti. Bu oran erkeklerde 0.04209 kadınlarda 0.04393 olup kontrol grubunda ise 2005 ylı için erkeklerde 0.00907, kadınlarda ise 0.00371 idi. Bu erkeklerde yaklaşık 4.5 kat, kadınlarda ise yaklaşık 11 kat artmış KDK sıklığı anlamına gelmekte idi. 2006 yılı verileri ile kıyaslandığında ise erkeklerde 8 kat, kadınlarda 20 kat KDK görülme sıklığı artmış idi. Kanser gelişim bölgelerine göre değerlendirme yapıldığında sirozlu hastalarda görülen insidans oranları hematolojik maligniteler için 0,01115, GİS maligniteleri için 0,00836, ÜS maligniteleri için 0,00743, toraks-meme maligniteleri için 0,00558 idi. 2005 yılı hastanemiz kanser insidans oranları hematolojik maligniteler için 0,00018, GİS maligniteleri için 0,00139, ÜS maligniteleri için 0,00146, toraks-meme maligniteleri için 0,00138 oranında olup bu malignite grupları için sırasıyla 61, 6, 5 ve 4 kat artış söz konusu idi. Bizim sirozlu hastalarımızın çoğunda etyolojik neden olarak HBV veya HCV 32 infeksiyonunu olduğu göz önüne alınırsa hematolojik malignitelerin sıklığında bu derece artışta bu virusların katkısının olduğu ön görülebilir. Transplantasyon nedeniyle immünsüpressif kullanan hastalarda hemotolojik malignitelerde bir artış olduğu literatürde bildirilmektedir. Siroz tanısı alıp ve karaciğer transplantasyonu yapılmış ve sonrasında immünsüpressif tedavi almakta olan sekiz hasta bu yüksek hematolojik malignite görüme sıklığına katkıda bulunuyor olabilir. Sirozlu hastalarda kanser adlarına göre bakıldığında ve 2005 hastanemiz kanser insidansları ile karşılaştırıldığında ise tiroid kanserlerinde 6.5 kat, akciğer kanserlerinde 8.5 kat, kolon kanserlerinde 2.5 kat, pankreas kanserlerinde 6 kat, mide kanserlerinde 15.5 kat, meme kanserlerinde 12 kat, renal hücreli karsinomlarda 12 kat, safra kesesi kanserlerinde 32 kat, mesane kanserlerinde 9 kat, lenfomalarda 32 kat atış söz konusu idi. Safra kesesi kanserlerinin sıkığındaki artış literatürde bildirilen artmış safra sistemi kanserleri ile uyumlu olarak viral etyolojilere bağlanabilirken sadece mide kanserlerindeki artmış görülme sıklığını bildiren bir yayına rastlamadık. Fakat kronik HBV ve HCV infeksiyonlarında GİS malignitelerine bir yatkınlık olduğu literatürde bildirilmektedir ve bu durum bizim verilerimizle çelişkili değildir. Çoğu NHL vakası olmak üzere genel olarak lenfomalarda tesbit edilen 32 kat artışta HBV ve HCV infeksiyonunun katkısı olduğu kanaatindeyiz. Bizim hastalarımızın %32’sinde siroz nedeni kriptojenik, %26 sında HBV ve %21’inde HCV iken sadece %6’sında etken alkol kullanımı idi. Bu nedenle alkolik sirozlu hastalarda özellikle artan bir KDK türü tesbit edemedik. HBV, HCV ve kriptojenik nedenlerin üçü hastalarda %80 oranında etyolojiden sorumlu idi. Bazı kanser türleri çok az sayıda tesbit edildiği için istatistiksel değerlendirme sağlıklı olmayacağından değerlendirmeye alınmadılar. HBV ile infekte kişilerde ister taşıyıcı, ister kronik hepatit, isterse siroz olsun HSK gelişme riskinde bir artış mevcuttur. Fakat kanında HBV taşıyan kişilerde KDK ’lerin artıp artmadığına dair elimizde kesin bilgiler yoktur. HBV pozitif hastalarda KDK’lerin arttığını bildiren bir takım yayınlar mevcuttur. Ann W. Hsing ve arkadaşları Çin toplumunda kronik hepatit ve karaciğer sirozu öyküsü olan hastalarda ekstrahepatik safra yolu kanserlerinin arttığını bildirmişlerdir (116). Kronik HBV infeksiyonu Çin toplumunda kronik hepatit, siroz ve karaciğer kanserinin en sık nedenidir. HBV infeksiyonu safra yolu kanserlerinin patogenezinde rol oynuyor olabilir. Yapılan son çalışmalarda ekstrahepatik safra yolu kanserlerinin patolojik doku örneklerinde HBV DNA ve HCV RNA saptanması bu yönde kuşku uyandırmaktadır (117,118,119). Fakat 2007 yılında Amerika’dan bildirilen bir çalışmada ise kronik HBV infeksiyonu olan hastalarda ekstrahepatik biliyer kanserler için 33 %0.4 gibi düşük bir prevalans bildirilirken, HBs Ag pozitifliği ile bu kanserler arasında bir ilişki gösterilememiştir (120). Ann W. Hsing ve arkadaşları Şangay’da safra yolları (safra kesesi, kolekok ve ampulla wateri) kanseri olan 417 hastada yaptıkları başka bir çalışmada kronik HVB infeksiyonu ile ekstrahepatik safra yolu kanserleri için 2-4 kat risk artışı olduğunu ortaya koydular. Safra kesesi ve ampulla wateri tümörü için ise bir risk artışı söz konusu değildi. Kronik HCV infeksiyonunda ise böyle bir risk artışı gösteremediler (121). Hepatit B virusunun hematopoetik hücrelere olan ilgisi bilinen bir gerçektir. HBV’ye bağlı kronik hepatit ve sirozlu hastalarda gelişen bazı hematolojik malignitelerin patogenezinde HBV ‘nin rolü olabileceği söylenebilir (64). Bizim çalışmamızda HBV grubunda 563 erkek ve 229 kadın olmak üzere toplam 792 hastanın takibi süresince 29 erkek ve 8 kadın olmak üzere 37 hastada KDK tesbit edilmişti. Bu veriler 2005 yılı hastanemiz kanser insidansları ile karşılaştırldığında HBV pozitif hastalarda KDK için erkeklerde 5.6 kat, kadınlarda 9.4 kat, toplamda ise 8 kat risk artışı mevcuttu. HBV pozitif olup KDK tanısı alan 37 hasta taşıyıcı, kronik hepatit ve siroz olarak gruplara ayrılmış idi. Bu hastaların 14 tanesi taşıyıcı, 11’i kronik HBV, 12’si ise siroz idi. Bu durumda KDK insidansı taşıyıcılarda 0.01767, kronik hepatitlilerde 0.01388 ve sirozlularda ise 0.01515 idi. Bizim çalışmamızda siroz ve kronik hepatit hastalarında olduğu gibi inaktif HBsAg taşıyıcılarında da KDK riski armıştı bu risk artışı yaklaşık 3 kat idi. Sadece HBs Ag pozitif veya anti-HBc pozitif hastalarda bile hematolojik malignite sıklığında artış olduğunu bildiren çok sayıda araştırma vardır. HBs Ag pozitifliğinin özellikle safra yolu olmak üzere GİS malignitelerinin sıklığında artış ile ilişkisi gösterilmiştir. Literatürle uyumlu olarak bizim hastalarımızda da HBs Ag taşıyıcılarında KDK görülme sıklığı artmış idi. HBV pozitif hastalarda tanı koyduğumuz KDK’ler arasında sayı olarak en fazla olanı GİS maligniteleri, sonra sırasıyla hematolojik maligniteler, toraks-meme maligniteleri, baş-boyun ve ekstremite maligniteleri ve üriner sistem maligniteler idi. 2005 yılı kontrol insidans verileri ile kıyaslanlandığında ise hematolojik maligniteler yaklaşık 50 kat, GİS maligniteleri ve baş-boyun maligniteleri yaklaşık 9 kat, toraks-meme maligniteleri 6,5 kat, üriner sistem maligniteleri ise yaklaşık 2,5 kat artmış idi. HBV pozitif hastalarda lenfomalar yaklaşık 30 kat, akciğer kanserleri 17 kat, pankreas kanserleri 16 kat, kolon ve mide kanserleri 8,5 kat artmış idi. Bu durumda HBV infeksiyonunun daha çok hematolojik maligiteleri, GİS malignitelerini ve akciğer 34 malignitelerinini daha yüksek sıklıkta etkilediğini söyleyebiliriz. Bu daha önce literatürde bildirilen verilerle uyumlu olarak bulundu. Kronik HCV infeksiyonunun HSK’a ilaveten diğer sistem malignitelerini de tetiklediği uzun zamandır bilinen bir gerçektir. Lenfoma patogenezi ile HCV infeksiyonu arasında yakın bir ilişki vardır. HCV ile B-hücreli NHL’lar arasında epidemiyolojik veriler ve klinik gözlemlere dayanan biyolojik temelli nedensel bir ilişki tesbit edilmiştir. HCV infeksiyonu varlığı B hücreli lenfoma vakalarının %5-8’inde bildirimştir (122). Bir çalışmada mikst kriyoglobülinemi, Waldenstrom makroglobülinemisi ve B-hücreli NHL’lar gibi benzer patogenezleri olan hastalıklarda HCV ile infekte hastaların hepsinde oligoklonal ve monoklonal B hücre aşırı çoğalması bulguları vardı. Bununla birlikte, HCV infeksiyonu hangi mekanizma ile B-NHL yol açar hala tam net değildir (123). HCV infeksiyonu oksidatif stresin bir belirteci olarak serum tiyoredoksin ve plazma lipid peroksidasyon ürünlerinin artmış seviyeleri ile karakterizedir (124,125). Ayrıca HCV ile infekte hastalarda bir DNA oksidasyon markeri olan 8-hidroksideoksiguanozin hem karaciğer dokusunda hem de dolaşan lökositlerde yüksek bulunmuştur (126). Buna ilaveten periferik kan mononükleer hücrelerinde de artmış süperoksit dismutaz aktivitesi gösterilmiştir (127). HCV ile infekte kişilerde HCV RNA gastrik mukoza ilişkili lenfoid dokuda saptanmıştır ve bu doku gastrik mukoza ilişkili lenfoid doku lenfoması (MALToma) gelişimi ile ilişkilidir (128). HCV’nin bu merak uyandırıcı anatomik yeri sadece lenfoid proliferasyon için uyarıcıdır ve karsinom gelişimine yol açmaz. HCV ile infekte hastaların mide mukozasındaki proteomik değşiklikler, bir takım proteinlerin (antijen-MHC 1 kompleks matürasyon proteinleri, antijen sunumu ve ER stres proteinleri) down-regülasyonu ve ilave olarak antioksidan savunma mekanizmalarının aktivasyonu yoluyla olur. Sonuç olarak mitokondrial değişiklikler (ER stres) ve reaktif oksijen ürünlerinin (ROS) üretimi kanser gelişim ile ilgili bir takım olaylar zincirini tetikler (129). H.B Serag ve arkadaşlarının Amerikan askerlerinde yaptığı geniş bir kohort çalışmada HCV infekte kişilerde intrahepatik kolanjiyokarsinoma riski 2,5 kat atmış idi. HSK riski 15 kat armış iken ekstrahepatik kolanjiyokarsinoma riskinde artış tesbit edilmedi. Pankreatik kanserlerde ise hafif bir risk artışı söz konusu idi. Bir kaç vakakontrol çalışmasında da intrahepatik kolanjiyokarsinoma tanısı almış hastalarda HCV prevalansı %36 gibi yüksek bir oranda bulunmuştur (130). Bizim çalışmamızda HCV pozitif 449 erkek ve 319 kadın olmak üzere toplam 768 hastanın 41 tanesinde KDK tesbit edildi. Bu hastaların 27 tanesi kadın 14 tanesi ise erkek 35 idi. Bu hastaların KDK insidans oranları erkeklerde 0,06013, kadınlarda 0,04389 ve toplamda ise 0,05339 idi. 2005 insidans verileri ile kıyaslandığında KDK’ler erkeklerde 6.5 kat, kadınlarda 11.8 kat, toplamda ise 9.3 kat armış idi. Baş-boyun kanserlerinde 7 kat, toraks-meme kanserlerinde 5.6 kat, GİS kanserlerinde 7.5 kat, hematolojik kanserlerde 65 kat, ÜS kanserlerinde 5.4 kat, ekstremite kanserlerinde ise 28.8 kat artış mevcuttu. Baş-boyun ve ekstermite kanserlerinde vaka sayıları yetersiz olduğu için oranlar gerçeği tam yansıtmayabilir. KDK’ler tek tek düşünüldüğünde ise akciğer kanserlerinde 11.8 kat, kolon kanserlerinde 5.4 kat, mide kanserlerinde 4.3 kat, meme kanserlerinde 3.3 kat, böbrek kanserlerinde 11.3 kat, NHL’da 23 kat artış, skuamöz hücreli karsinomlarda 26 kat artış mevcuttu. HCV’nin taşıyıcı, kronik hepatit ve siroz olma durumuna göre değerlendirildiğinde KDK insidans oranları sırasıyla 0.02083, 0.01692 ve 0.05625 idi. 2005 kanser insidans oranları ile kıyaslandığında taşıyıcılarda 3.6 kat, kronik hepatitlerde 2.9 kat ve sirozlularda ise 9.8 kat KDK riski artmış idi. Hematolojik maligniteler ve lenfomalardaki artış yine HCV infeksiyonunun varlığına bağlanabilirken HCV grubunda 15 hasta transplantasyon nedeniyle immünsüpressif tedavi almaktaydı. İmmünsüpressif tedavi alıyor olmalarının HCV pozitif hastalardaki yükek hematolojik malignite görülme sıklığına ve diğer solid organ kanserlerine katkısı olduğunu kanaatindeyiz. Ekstremite kanserleri, böbrek kanserleri, skuamöz hücreli kanserler ve akciğer kanserlerindeki artışta hastalardan 18 tanesinin kronik renal yetmezlikli olması ve 5 tanesinin sürekli hemodiyalize girmesinin kısmen katkısı olduğunu düşünüyoruz. Beslenme problemleri, genel vücut düşkünlüğü, üremik, karsinojenik ve toksik metabolitlerin vücuttan uzaklaştırılmasındaki zorluklar, infeksiyöz ajanlara daha fazla maruziyet, çok sayıda ilaç kullanımı ve diyaliz prosedürünün kendisi kronik renal yemezlikli hastalarda daha fazla sıklıkta malignite görülmesine katkıda bulunuyor olabilir. Karşılaştırılan insidans verilerinin tamamen benzer yapıda ve aynı yıllara ait olması açısından 2005 ve 2006 yılında tanı konan HBV, HCV pozitif ve sirozlu hastalardan KDK tanısı almış olanların verileri ayrı olarak değerlendirildi. Bu hastalarında total KDK insidans oranları HBV, HCV ve siroz için sırasıyla 0.08163, 0.06896, 0.04972 idi. Buna göre HBV pozitif hastalarda 14 kat, HCV pozitif hastalarda 12 kat ve sirozlu hastalarda ise yaklaşık 8 kat KDK gelişme riski artmıştı. 2006 yılında HBV, HCV siroz hastalarında total KDK insidans oranları sırasıyla 0.04761, 0.05434 ve 0.02512 idi. Buna göre HBV pozitif 36 hastalarda 13 kat, HCV pozitif hastalarda 15 kat ve sirozlu hastalarda ise yaklaşık 7 kat KDK gelişme riski artmıştı. Sonuç olarak 1995 ve 2011 yılları arasında hastaların tamamı değerlendirildiğinde global olarak KDK gelişme riskindeki artışı hastanemiz insidans verileri ile kıyaslandığında sirozlularda 7 kat, HBV pozitif hastalarda 8 kat ve HCV pozitif hastalarda ise yaklaşık 9.5 kat olarak bulunmuştur. Kanser Erken Teşhis, Tarama ve Eğitim Merkezi (KETEM)’nin 2005 yılı Ankara için bildirdiği resmi kanser iststistikleri ile karşılaştırma yapılırsa sirozlularda erkeklerde 27.5 kat, kadınlarda 37.8 kat ve toplamda ise 32 kat KDK riskinde artışı söz konsu idi. HBV grubunda ise erkeklerde 33 kat, kadınlarda 30 kat ve toplamda ise 34 kat KDK riski artmış idi. HCV grubunda ise KDK riski erkeklerde 39 kat, kadınlarda 37 kat ve toplamda ise 39.5 kat artmış olarak bulundu. Kanser türleri ile ilgili insidans verileri ve risk artışları kanserler alt gruplara ayrıldığında vaka sayıları çok düşük olduğu için değerlendirme yapmanın sağlıklı olmayacağı kanaatindeyiz. Bu nedenle herhangi bir kanser türü ile ilgili risk artışının sağlıklı olarak yapılabilmesi için bütün Türkiye çapındaki siroz, HBV ve HCV pozitif hastaları ele alarak KDK taraması yapmak sağlıklı verilere ulaşmak için daha uygun olacaktır. Ayrıca ülkemizde bu hasta grupları için malignite gelişiminin bir ilk taramadan sonra prospektif olarak yapıldığı çalışmalara ihtiyaç vardır. Buradaki insidans oranları hastanemiz ve Ankara bölgesi hastaları için bir kesit niteliğinde olmasına rağmen KDK’lerde görülen önemli oranlarda artışları da ortaya koyduğu için önemlidir. Ayrıca çalışmamız sirotik olmayan HBV ve HCV’li hastalarda KDK’leri araştıran ve de artış olduğunu bildiren sınırlı sayıdaki çalışmadan birisi niteliğindedir. 37 6. SONUÇLAR ve ÖNERİLER 1. Sirozlu hastalarda HSK riskinin artttığı bilinmesine rağmen KDK riskinin arttığını gösteren az sayıda çalışma vardır. Bizim sirozlu hastalarımızda KDK riski ortalama 7 kat daha artmış idi. Sirozlu hastalarımızda HBV ve HCV daha sık etyolojik neden olduğu için hematolojik malignite görülme sıklığı daha fazla idi. 2. HBV pozitif hastalarda ister sirozlu, ister kronik hepatit isterse inaktif taşıyıcı olsun KDK görülme sıklığı artmış idi. HBV pozitif hastalarda KDK için risk artışı kontrollere göre 8 kat daha fazla idi. 3. HCV pozitif hastalarda da KDK artş riski yaklaşık 9.5 kat idi. Hematolojik malignitelerdeki belirgin artmış görülme sıklığı HCV’nin NHL gelişimine katkısına ve hastaların üçte birinin transplantasyon nedeniyle immünsüpressif tedavi alıyor olmasına bağlı idi 4. Bir çok kanser türü için risk artışı tesbit edilmesine rağmen alt gruplardaki sayı yetersizliğinden dolayı kanser türleri için risk artşlarını rakamsal olarak ifade etmek sağlıklı olmayacaktır. 5. Karaciğer ve böbrek nakli nedeniye immünsüpressif tedavi alan hastalarda özellikle hematolojik malignitelerde artış saptanmıştır. 6. Sirozlu, HBV ve HCV pozitif hastaların hastalığın hangi evresinde olursa olsun KDK gelişimi yönünden de risk altında olduğu bilinmeli ve ona göre takip edilmelidirler. 38 7. KAYNAKLAR 1. Eric Goldberg, Sanjiv Chopra, Bruce A Runyon. Overview of the complications, prognosis, and management of cirrhosis. UpToDate 2012. 2. Conn H, Atterbury C. Cirrhosis. In: Diseases of the Liver, 7th edition, Schiff L, Schiff E (Eds), Lippencott Company, Philadelphia 1993. p.875. 3. Berman K, Tandra S, Vuppalanchi R, Ghabril M, Sandrasegaran K, Nguyen J, Caffrey H, Liangpunsakul S, Lumeng L, Kwo P, Chalasani N. Hepatic and extrahepatic cancer in cirrhosis: a longitudinal cohortstudy. Am J Gastroenterol. 2011 May;106 (5):899-906. Epub 2010 Dec 21. 4. Kalaitzakis E, Gunnarsdottir SA, Josefsson A, Björnsson E. Increased risk for malignant neoplasms among patients with cirrhosis. Clin Gastroenterol Hepatol. 2011 Feb;9 (2):168-74. Epub 2010 Oct 26. 5. Simonetti R G, Camma C, Fiorello F et al. Hepatocellular carcinoma. A worldwide problem and the major risk factors. Dig Dis Sci 1991; 36 :962-72. 6. Chalasani N, Horlander JC Sr, Said A e t al. Screening for hepatocellular carcinoma in patients with advanced cirrhosis. Am J Gastroenterol 4 : 2988 – 93. 7. Colombo M, de Franchis R, Del Ninno E et al. Hepatocellular carcinoma in Italian patients with cirrhosis. N Engl J Med 1991; 325 : 675 – 80. 8. Kaklamani E, Trichopoulos D, Tzonou A et al. Hepatitis B and C viruses and their interaction in the origin of hepatocellular carcinoma. JAMA 1991; 265 : 1974 – 6. 9. Bruix J, Sherman M. Management of hepatocellular carcinoma. Hepatology 2005;42:1208-36.10. Montano-Loza AJ, Carpenter HA, Czaja AJ. Predictive factors for hepatocellular carcinoma in type 1 autoimmune hepatitis. Am J Gastroenterol 2008; 103 : 1944 – 51. 11. Yeoman AD, Al-Chalabi T, Karani JB et al. Evaluation of risk factors in the development of hepatocellular carcinoma in autoimmune hepatitis: implications for follow-up and screening. Hepatology 2008; 48 : 863 – 70. 39 12. Sanyal A J, Banas C, Sargeant C et al. Similarities and diff erences in outcomes of cirrhosis due to nonalcoholic steatohepatitis and hepatitis C. Hepatology 2006; 43: 682 – 9. 13. Yatsuji S, Hashimoto E, Tobari M et al. Clinical features and outcomes of cirrhosis due to non-alcoholic steatohepatitis compared with cirrhosis caused by chronic hepatitis C. J Gastroenterol Hepatol4: 248 – 54. 14. Malik SM, Gupte PA, de Vera ME et al. Liver transplantation in patients with nonalcoholic steatohepatitis-related hepatocellular carcinoma. Clin Gastroenterol Hepatol 2009; 7: 800 – 6. 15. Vanlemmens C, Di Martino V, Milan C et al. Immediate listing for liver transplantation versus standard care for Child-Pugh stage B alcoholic cirrhosis: a randomized trial. Ann Intern Med 2009; 150: 153 – 61. 16. Floreani A, Baragiotta A, Baldo V et al. Hepatic and extrahepatic malignancies in primary biliary cirrhosis. Hepatology 1999; 29: 1425 – 8. 17. Nijhawan PK, Th erneau TM, Dickson ER et al. Incidence of cancer in primary biliary cirrhosis: the Mayo experience. Hepatology 1999; 29: 1396 – 8. 18. Deutsch M, Papatheodoridis GV, Tzakou A et al. Risk of hepatocellular carcinoma and extrahepatic malignancies in primary biliary cirrhosis. Eur J Gastroenterol Hepatol 2008; 20: 5 – 9. 19. Howel D, Metcalf JV, Gray J et al. Cancer risk in primary biliary cirrhosis: a study in northern England. Gut 1999; 45: 756 – 60. 20. Goldacre MJ, Wotton CJ, Yeates D et al. Liver cirrhosis, other liver diseases, pancreatitis and subsequent cancer: record linkage study. Eur J Gastroenterol Hepatol 2008; 20: 384 – 92. 21. Sorensen HT, Friis S, Olsen JH, Thulstrup AM, Mellemkjaer L, Linet M, Trichopoulos D, Vilstrup H, Olsen J.Risk of Liver and Other Types of Cancer in PatientsWith Cirrhosis: A Nationwide Cohort Study in Denmark. Hepatology. 1998 Oct;28 (4):921-5. 40 22. Lo o f L, Adami H-O, Spare´n P, Eriksson LS, Hultcrantz R, Lindgren S, et al. Cancer risk in primary biliary cirrhosis: a population-based study from Sweden. Hepatology 1994; 20:101-104. 23. Floreani A, Biagini MR, Chiaramonte M, Milani S, Surrenti C, Nacca ratoR. Incidence of hepatic and extra-hepatic malignancies in primary biliary cirrhosis (PBC). Ital J Gastroenterol 1993;25:473-476. 24. Dam GM Van, Gips CH. Primary biliary cirrhosis in the Netherlands. Scand J Gastroenterol 1997;32:77-82. 25. Becker U, Tønnesen H, Kaas-Claesson N, Gluud C. Menstrual disturbances and fertility in chronic alcoholic women. Drug Alcohol Depend 1989;24:75-78. 26. Hara K, Kohno S, Koga H, Kaku M, Tomono K, Sakata S, Komatsu K, et al. Infections in patients with liver cirrhosis and hepatocellular carcinoma. Intern Med 1995;34: 491-495. 27. Wolke AM, Schaffner F, Kapelman B, Sacks HS. Malignancy in primary biliary cirrhosis. High incidence of breast cancer in affected women. Am J Med 1984; 76:1075–1078. 28. Goudie BM, Burt AD, Boyle P, Macfarlane G, Birnie GG, Mills PR, et al. Breast cancer in women with primary biliary cirrhosis. Br Med J (Clin Res Ed) 1985; 291:1597–1598. 29. Mills PR, Boyle P, Quigley EM, Birnie GG, Jarrett F, Watkinson G, MacSween RN. Primary biliary cirrhosis: an increased incidence of extrahepatic malignancies? J Clin Pathol 1982; 35:541–543. 30. Bergasa NV. Primary biliary cirrhosis in patients with breast cancer: studying the link. Med Hypotheses 1998; 50:465–472. 31. Nijhawan PK, Therneau TM, Dickson ER, Boynton J, Lindor KD. Incidence of cancer in primary biliary cirrhosis: the Mayo experience. Hepatology 1999; 29:1396– 1398. 41 32. Floreani A, Baragiotta A, Baldo V, Menegon T, Farinati F, Naccarato R. Hepatic and extrahepatic malignancies in primary biliary cirrhosis. Hepatology 1999; 29:1425– 1428. 33. Howel D, Metcalf JV, Gray J, Newman WL, Jones DE, James OF. Cancer risk in primary biliary cirrhosis: a study in northern England. Gut 1999; 45:756–760. 34. Loof L, Adami HO, Sparen P, Danielsson A, Eriksson LS, Hultcrantz R, et al. Cancer risk in primary biliary cirrhosis: a population-based study from Sweden. Hepatology 1994; 20:101–104. 35. Deutsch M, Papatheodoridis G, Tzakou A, Hadziyannis S. Risk of hepatocellular carcinoma and extrahepatic malignancy in primary biliary cirrhosis. Eur J Gastro Hep 2007; 20:5–9. 36. Vanlemmens C, Di Martino V, Milan C et al. Immediate listing for liver transplantation versus standard care for Child-Pugh stage B alcoholic cirrhosis: a randomized trial. Ann Intern Med 2009; 150 : 153 – 61. 37. Sorensen HT, Friis S, Olsen JH, Thulstrup AM, Mellemkjaer L, Linet M, Trichopoulos D, Vilstrup H, Olsen J.Risk of liver and other types of cancer in patients with cirrhosis: a nationwide cohort study in Denmark. Hepatology. 1998 Oct;28 (4):921-5. 38. Ganem D, Schneider RJ. Hepadnaviridae and their replication. In: Knipe DM, Howley PM, Griffin DE, Martin MA, Lamb RA, Roizman B, et al, eds. Fields Virology. 4th ed. Philadelphia, PA: Lippincott-Raven Publishers; 2001. 39. Hollinger FB, Liang TJ. Hepatitis B virus. In: Knipe DM, Howley PM, Griffin DE, Lamb RA, Martin MA, Roizman B, et al, eds. Fields Virology. 4th ed. Philadelphia, PA: Lippincott-Raven Publishers; 2001:2971-3036. 40. llermann V, Bang O. Experimentelle leukamie beihuhnern. Zentralbl Bakteriol 1908; 46:595609. 41. Rous P. A sarcoma of the fowl transmissible by an agent Separable from the tumor cells. J ExpMed 1911;13:97411. 42 42. Hoppe-Seyler F,Butz K.Molecular mechanism of virüs induced carcinogenesis: the interaction of viral factors with cellular tumor suppressor proteins. J Mol Med 1995;73: 2938. 43. Klein G, Klein E.Evolution of tumours and the impact of Molecular oncology. Nature 1985;315:1905. 44. Morris JDH, Eddleston ALWF, Crook T.Viral infection and cancer. Lancet1995;346:548. 45. Greenblatt MS, Bennet WP, Holstein M, Harris CC. Mutations in the p53 tumor suppressor gene: clues to cancer etiology and molecular pathogenesis. Cancer Res1994;54: 85578. 46. Levine AJ. The p53 tumor-suppressor gene.N Engl J Med 1992;326:3502. 47. Yokota J, Sugimura T. Multiple steps in carcinogenesis involving alterations of multiple tumor suppresso rgenes. FASEBJ 1993;7:205. 48. Harris CC, Hollstein M. Clinical implications of the p53 tumor-suppressor gene.N Engl J Med 1993;329:11827. 49. zur Hausen H. Molecular pathogenesis of cancer of the cervix and its causation by specifc HPV types. Curr Topics Microbiol Immunol1994;186:3156. 50. de Villiers EM. Heterogeneity of the human papilloma virüs group.J Virol1991;63:898903. 51. Snijders PJF, vanden Brule AJC, Meijer CJLM, Walboomers JMM. Papilloma viruses and cancer of the upper digestive and Respiratory tracts. Curr Topics Microbiol Immunol 1994;186:17798. 52. Gulley M, Raphael M,Lutz CT, Ross DW, Raab-Traub N. Epstein Barr virüs integration in human lymphomas and lymphoid cell lines. Cancer 1992;70:1859. 53. Lozanode Leon F, Gutierrez Fernandez J, Martin Mazuelos E, Garcia-Bragado F. Infection by human herpes virüs type 6: epidemiology, immunopathology and clinical implications. Rev Clin Esp 1992;190:3742. 43 54. Flamand L, StefanescuI, Ablashi DV, Menezes J.Activation of the Epstein Barr virüs replicative cycle by human herpes virus-6. JVirol1993;67: 676877. 55. Henle G, Henle W.The virüs as the etiologic agent of infectious mononucleosis;in theEpstein Barr Virus. Berlin, Springer-Verlag,1979:197307. 56. zu rHausen H,Schulte-Holthausen H,Klein G et al. EBV DNA in biopsies of Burkitt tumours and anaplastic carcinomas or the nasopharynx. Nature 1970;228:10568. 57. Chang Y,Cesarman E,Pessin MS. Identification of Herpes virus-like DNA sequences in AIDS-associated Kaposi’s sarcoma. Science1994;266:18659. 58. Yoshida M, MiyoshiI, Hinuma Y.Isolation and characterisation of retro virüs from cell lines of human adult T-cell leukaemia and its implication in the disease. Proc Natl Acad Sci USA 1982;79:20315. 59. Pantaleo G, Graziosi C,Fauci AS. The immuno pathogenesis of human immuno deficiency virüs infection. N Engl J Med 1993;328:32735. 60. Beasly RP, Lin CC, Hwang LY, Chien CS.Hepatocellular carcinoma and hepatitis B virus: a prospective study of 22707 men inTaiwan.Lancet 1981;ii:112933. 61. Buenidia MA. Hepatitis B viruses and hepatocellular carcinoma. Adv cancer Res 1992;59: 167226. 62. Truant T, Antunovic J,Greenblatt J,Prives C,Cromlish J A. Direct interaction of the hepatitis B virüs HBx protein with p53 leads to inhibition by HBx of p53 response element-directed trans activation. J Virol 995;69:18519. 63. Heimann R. Cirrhosis and lymphoproliferative disorders. Lancet 1971;ii:101. 64. Galun E, Ilan Y,Livni N. Hepatitis B virüs infection associated with hematopoietic tumors. Am J Pathol 1994; 145: 10017. 65. Hollinger FB. NANBH viruses. In Hollinger FB, Robinson WS, Purcell RH, Garin JL, Ticehurst J,eds. Viral Hepatitis, Biological and Clinical Features, Specifc Diagnosis and Prophylaxis. NewYork: RavenPress, 1991:13973. 44 66. Garson JA, Tedder RS, Briggs M. Detection of HCV sequences in blood donations by nested PCR and predictionof infectivity. Lancet1990;335:141922. 67. Martell M, Esteban JI, Quer J. Hepatitis Cvirus (HCV) circulates as a population of different but closely related genomes: quasispecies natüre of HCVgenome distribution. J Virol 1992; 66:32259. 68. Bukh J, Mille rRH, Purcell RH. Genetic heterogeneity of hepatitis C virüs: quasispecies and genotypes. Semin Liver Dis 1995;15:4163. 69. Gumber S, Chopra S. Hepatitis C:a multifaceted disease. Review of extrahepatic manifestations. Ann Intern Med 1995; 123:61520. 70. Monteverde A, Sabattini E,Poggi S et al. Bone marrow findings further support the hypothesis that essential mixed cryoglobulinemia type II is characterized by a monoclonalB-cell proliferation. Leukemia-Lymphoma 1995;20:11924. 71. Ferri C, La Civita L, Longombardo G, Greco F, Bombardieri S. Hepatitis C virüs and mixed cryoglobulinemia (review). Eur J Clin Inves t1993; 23: 399405. 72. Ferri C, Zignego AL, Bombardieri S et al. Etiopathogenetic role of hepatitis C virüs in mixed cryoglobulinemia, chronic liver diseases and lymphomas. Clin Exp Rheumatol 1995;13 (S13):13540. 73. Martin P. Hepatitis C:more than just a liver disease. Gastroenterology 1993; 104: 3203. 74. Ferri C, Monti M, La Civita L et al. Infection of peripheral blood mononuclear cells by hepatitis C virüs in mixed cryoglobulinemia. Blood1993;82:37014. 75. Gabrielli A, Manzin A, Candela M et al. Active hepatitis C virüs infection in bone marrow and peripheral blood mononuclear cells from patients with mixed cryoglobulinemia. Clin Exp Immunol 1994;97:8793. 76. Sansonno D, De Vita S, Cornacchiulo V, Carbone A, Baiocchi M, Dammacco F. Detection and distribution of hepatitis C-related proteins in lymph nodes of patients with type II cryoglobulinemia and neoplastic or non-neoplastic lymphoproliferation. Blood 1996; 88:463845. 45 77. Colombo M, Choo QL, Del Ninno et al. Prevalence of antibodies to hepatitis C virüs in Italian patients with hepatocellular carcinoma. Lancet 1989;334:10068. 78. Tsukuma H, Hiyama T, Tanaka S et al. Risk factors for hepatocellular carcinoma among patients with chronic liver disease. N Engl J Med 1993;328:1797801. 79. Simonetti RG, Camma C,Fiorello F et al. HepatitisC virüs infection as a risk for hepatocellular carcinoma in patients with cirrhosis. A case control study. Ann Intern Med 1992; 116:97102. 80. Gupta S, Shafritz DA. Viral mechanisms in hepatic oncogenesis. In: IM Arias, JLBoyer, N Fausto, WB Jacoby, DAS chachter, DA Shafritz, eds. The Liver: Biology and Pathobiology,3rdedn, New York: Raven press, 1994:142953. 81. De Mitri MS, Poussin K, Baccarini P et al. HCV-associated liver cancer without cirrhosis. Lancet 1995;345: 4135. 82. Elrefaie A, Savage K, Bhattacharya S et al. HCV-associated Hepatocellular carcinoma without cirrhosis. J Hepatol 1996; 24:27785. 83. Ferri C, La CivitaL, Zignego AL et al. Hepatocellular carcinoma in mixed cryoglobulinemia patients. Clin Exp Rheumatol 1996; 14:11112. 84. Zignego AL, Ferri C, Giannini C et al. Hepatitis C virüs genotype analysis in patients with type II mixed cryoglobulinemia. Ann Intern Med1996;124:314. 85. Zignego AL, Ferri C, Monti M et al. Hepatitis C virüs as a lymphotropic agent: evidence and pathogenetic implications. Clin Exp Rheumatol1995;3 (S13):3-37. 86. Gorevic PD, Frangione B. Mixed cryoglobulinemia cross-reactive idiotypes: implication for relationship of mixed cryoglobulinemia to rheumatic and lymphoproliferative diseases. Semin Hematol 1991;28: 7994. 87. Abel G, Zhang Q-X, Agnello V. Hepatitis C virüs infection in type II mixed cryoglobulinemia. Arthritis Rheum 1993;36: 1341-9. 88. Ferri C,La Civita L,Caracciolo F,Zignego AL. Non-Hodgkins lymphoma: a possible role of hepatitis C virüs infection. JAMA 1994;272:3556. 46 89. Ferri C, Caracciolo F, Zignego AL et al. Hepatitis C Virus Infection in Patients with non-Hodgkins Lymphoma. Br J Haematol1994;88:3924. 90. Luppi M, Ferrari MG, Bonaccorsi G et al. Hepatitis C virüs infection in subsets of neoplastic lymphoproliferations not associated with cryoglobulinemia. Leukemia 1996;10:3515. 91. Ferri C, La Civita L, Monti M et al. Can type C hepatitis be complicated by B-cell malignant lymphoma? Lancet 1995;34614267. 92. Ferri C, La Civita L, Monti M et al. B-cell non-Hodgkins lymphoma complicating type C chronic hepatitis. Q J Med 1996;89:11722. 93. Mc Coll MD, Tait RC, Ferri C,La Civita L, Zignego AL. Hepatitis C virüs in patients with lymphoproliferative disorders. BrJHaematol1996;92:7713. 94. Hanley J, Jarvis L, Simmonds P,Parker A, Ludlam C. HCV and non-Hodgkin lymphoma. Lancet 1996;347:1339. 95. Brind AM, Watson JP, James, Bassendine MF. Hepatitis Cvirus infection in the elderly. Q J Med 1996; 89: 2916. 96. Brind AM, Watson JP, Burt A et al. Non-Hodgkins lymphoma and Hepatitis C virüs infection. Leuk Lymphoma 1996; 21: 12730. 97. Ellenrieder V, Beckh K, Muller D, Klatt S, Adler G. Intrahepatic high-grade malignant non-Hodgkin lymphoma in a patient with chronic hepatitis C infection. Z Gastroenterol 1996; 34: 2835. 98. Fink FM, Hocker-Schulz S,Mor W et al. Association of hepatitis C virüs infection with chronic liver disease in paediatric cancer patients. Eur JPediatr 1993; 152:4902. 99. Heimann R, Lespagnard L, Dargent JL, Desmet VJ. Is there a link between viral hepatitis and lymphoproliferative disorders? From the autopsy room to the PCR thermal cycler. (Review).Curr DiagnPathol 1996; 3: 17781. 47 100. Murakami Y, Hotei H,Tsumura H et al. A case of primary splenic malignant lymphoma and a review of 98 cases reported in Japan. J Jpn Soc Clin Surg 1988; 49: 1622. 101. Zuckerman E, Zuckerman T, Levine AM, Doner D,Gutekunst K, Fong TL. Prevalence of hepatitis C virüs infection in patients with B-cell non-Hodgkins lymphoma (abs1004). Hepatology 1996; 24: 277. 102. Izumi T,Sasaki R, Miura Y, Okamoto H.Primary hepato-splenic lymphoma: association with hepatitis C virüs infection. Blood 1996; 87: 53801. 103. Izumi T,Sasaki R, Miura MT, Yokamoto H.B-cell malignancy and hepatitis C virüs infection. Leukemia 1997; 11: 5168. 104. Tanaka H, Tsukuma H, Teshima H et al. Second primary cancers following nonHodgkins lymphoma in Japan: increased risk of Hepatocellular carcinoma. Jpn JC ancer Res 1997;88: 53742. 105. Luppi M, Torelli G.The new lymphotropic herpes viruses (HHV-6, HHV-7, HHV-8) and hepatitis C virüs (HCV) in human lymphoproliferative diseases: an overview. Haematologica 1996; 81: 26581. 106. Ferri C, Lo Jacono F,Monti M et al. Lymphotropic virüs İnfection of peripheral blood mononuclear cells in B-cell non-Hodgkins lymphoma. Acta Haematol 1997; 98: 8994. 107. Mishiro S, Takeda K,Hoshi Y,Yoshikawa A, Gotanda T, Itoh Y. An auto antibody cross reactive to hepatitiis C virüs core and a Host nuclear antigen. Autoimmunity 1991; 10: 26973. 108. Michel G, Ritter A, Gerken G et al. Anti-GOR and hepatitis C virüs in autoimmune liver disease. Lancet 1992;i:2679. 109. Ferri C, Longombardo G, La Civita L et al. Hepatitis C virüs as common cause of mixed cryoglobulinemia and chronic liver disease. J Intern Med 1994; 36:316. 48 110. Ellis M, Rathaus M, Amiel A, Manor Y,Klein A, Lishner M. Monoclonal lymphocyte proliferation and bcl-2 rearrangement in essential mixed cryoglobulinaemia. Eur J Clin Invest 1995; 25: 8337. 111. Korsmeyer SJ. Bcl-2: a repressor of lymphocyte death. Immunol Today 1992; 13: 2857. 112. Ngan BY, Chen LZ, Weiss LM, Warnike RA, Cleary ML. Expression in nonHodgkins lymphoma of the bcl-2 protein sssociated with the t (14: 18) translocation. N Engl J Med 1988; 318: 163844. 113. Delia D, Aiello A, Soligo D. Bcl-2 proto-oncogene expression in normal and neoplastic human myeloid cells. Blood 1992; 79: 12918. 114. Strasser A, Harris AW, Bath ML, Cory S.Novel primitive lymphoid tumors induced intrangenic mice by cooperation between myc and bcl2 Nature 1990;348:3314. 115. Klein G. Oncogenes and tumor suppressor genes. Rev Oncol 1988;27:42737. 116. Hsing AW, Gao YT, McGlynn KA, Niwa S, Zhang M, Han TQ, Wang BS, Chen J, Sakoda LC, Shen MC, Zhang BH, Deng J, et al. Biliary tract cancer and stones in relation to chronic liver conditions: a population-based study in Shanghai, China. Int J Cancer 2007;120: 1981–5. 117. Chen R, Zou S, Zhao X. The expression of hepatitis C virus in hilar cholangiocarcinoma and implication. Chin J Exp Surg 2000; 17: 223–5. 118. Yin F, Chen B. Detection of hepatitis C virus RNA sequences in hepatic portal cholangiocarcinoma tissue by reverse transcription polymerase chain reaction. Chin Med J 1998;111:1068–70. 119. Wang WL, Gu GY, Hu M. Expression and significance of HBV genes and their antigens in human primary intrahepatic cholangiocarcinoma. World J Gastroenterol 1998; 4: 392–6. 120. Shaib YH, El-Serag HB, Nooka AK, Thomas M, Brown TD, Patt YZ, Hassan MM. Risk factors for intrahepatic and extrahepatic cholangiocarcinoma: a hospital-based case-control study. Am J Gastroenterol 2007; 102: 1016–21. 49 121. Ann W. Hsing, Mingdong Zhang, Asif Rashid, Katherine A. McGlynn, Bing-Shen Wang, Shelley Niwa, Betty A. Ortiz-Conde, James J. Goedert, Joseph F. Fraumeni Jr., Thomas R. O’Brien, Yu-Tang Gao. Hepatitis B and C virus infection and the risk of biliary tract cancer: A population-based study in China. Int. J. Cancer: 122, 1849– 1853 (2008) 122. Zigneco AL, Giannini C, Ferri C: Hepatitis C virus-related lymphoproliferative disorders: an overview. World J Gastroenterol 2007,13:2467-2478. 123. Franzin F, Efremov DG, Pozzato G, Tulissi P, Batista F, Burrone OR. Clonal B-cell expansions in peripheral blood of HCV-infected patients. Br J Haematol 1995; 90: 548-552. 124. Sumida, Y., Nakashima, T., Yoh, T., Nakajima, Y. et al.,Serum thioredoxin levels as an indicator of oxidative stress in patients with hepatitis C virus infection. J. Hepatol. 2000, 33, 616–622. 125. Paradis, V., Kollinger, M., Fabre, M., Holstege, A. et al.,In situ detection of lipid peroxidation by-products in chronic liver diseases. Hepatology 1997, 26, 135–142. 126. Farinati, F., Cardin, R., Degan, P., De Maria, N. et al.,Oxidative DNA damage in circulating leukocytes occurs as an early event in chronic HCV infection. Free Radic. Biol. Med. 1999, 27, 1284–1291. 127. Larrea, E., Beloqui, O., Munoz-Navas, M. A., Civeira, M. P.,Prieto, J., Superoxide dismutase in patients with chronic hepatitis C virus infection. Free Radic. Biol. Med. 1998, 24, 1235–1241. 128. De Vita, S., De Re, V., Sansonno, D., Sorrentino, D. et al.,Gastric mucosa as an additional extrahepatic localization of hepatitis C virus: viral detection in gastric lowgrade lymphoma associated with autoimmune disease and in chronic gastritis. Hepatology 2000, 31, 182–189. 129. Kim, H. K., Park, W. S., Kang, S. H., Warda, M. et al.,Mitochondrial alterations in human gastric carcinoma cell line. Am. J. Physiol. Cell. Physiol. 2007, 293,C761– C771. 50 130. Hashem B. El-Serag, Eric A. Engels, Ola Landgren, Elizabeth Chiao, Louise Henderson, Harshinie C. Amaratunge, Thomas P. Giordano. Risk of hepatobiliary and pancreatic cancers afterhepatitis C virus infection: a population-based studyof U.S. veterans. Hepatology; Vol. 49, No. 1, 2009 131. Ciesek S, Helfritz FA, Lehmann U, Becker T, Strassburg CP, Neipp M, Ciner A, Fytili P, Tillmann HL, Manns MP, Wedemeyer H. Persistence of occult hepatitis B after removal of the hepatitis B virus-infected liver. J Infect Dis 2008; 197: 355-360. 132. Yoffe B, Burns DK, Bhatt HS, Combes B. Extrahepatic hepatitis B virus DNA sequences in patients with acute hepatitis B infection. Hepatology 1990; 12: 187-192. 133. Neurath AR, Strick N, Sproul P, Ralph HE, Valinsky J. Detection of receptors for hepatitis B virus on cells of extrahepatic origin. Virology 1990; 176: 448-457. 134. Romet-Lemonne JL, McLane MF, Elfassi E, Haseltine WA, Azocar J, Essex M. Hepatitis B virus infection in cultured human lymphoblastoid cells. Science 1983; 221: 667-669. 135. Zeldis JB, Mugishima H, Steinberg HN, Nir E, Gale RP. In vitro hepatitis B virus infection of human bone marrow cells. J Clin Invest 1986; 78: 411-417. 136. Pontisso P, Poon MC, Tiollais P, Brechot C. Detection of hepatitis B virus DNA in mononuclear blood cells. Br Med J 1984; 288:1563-1566. 137. Bouffard P, Lamelin JP, Zoulim F, Lepot D, Trepo C. Phytohemagglutinin and concanavalin A activate hepatitis B virus in peripheral blood mononuclear cells of patients with chronic hepatitis B virus infection. J Med Virol 1992; 138. [14] Yoffe B, Noonan CA, Melnick JL, Hollinger FB. Hepatitis B virus DNA in mononuclear cells and analysis of cell subsets for the presence of replicative intermediates of viral DNA. J Infect Dis 1986; 153: 471-477. 139. Stoll-Becker S, Repp R, Glebe D, Schaefer S, Kreuder J, Kann M, Lampert F, Gerlich WH. Transcription of hepatitis B virus in peripheral blood mononuclear cells from persistently infected patients. J Virol 1997; 71: 5399-5407. 51 140. Pontisso P, Vidalino L, Quarta S, Gatta A. Biological and clinical implications of HBV infection in peripheral blood mononuclear cells. Autoimmun Rev 2008; 8: 1317. 141. Michalak TI, Pasquinelli C, Guilhot S, Chisari FV. Hepatitis B virus persistnce after recovery from acute viral hepatitis. J Clin Invest 1994; 93:230-239. 142. Anderson LA, Pfeiffer R, Warren JL, Landgren O, Gadalla S, Berndt SI, Ricker W, Parsons R, Wheeler W, Engels EA. Hematopoietic malignancies associated with viral and alcoholic hepatitis. Cancer Epidemiol Biomarkers Prev 2008; 17: 3069-3075. 143. Franceschi S, Lise M, Trépo C, Berthillon P, Chuang SC, Nieters A, Travis RC, Vermeulen R, Overvad K, Tjønneland A, Olsen A, Bergmann MM, Boeing H, Kaaks R, Becker N, Trichopoulou A, Lagiou P, Bamia C, Palli D, Sieri S, Panico S, Tumino R, Sacerdote C, Bueno-de-Mesquita B, Peeters PH, Rodríguez L, Barroso LL, Dorronsoro M, Sánchez MJ, Navarro C, Barricarte A, Regnér S, Borgquist S, Melin B, Hallmans G, Khaw KT, Wareham N, Rinaldi S, Hainaut P, Riboli E, Vineis P. Infection with Hepatitis B and C Viruses and Risk of Lymphoid Malignancies in the European Prospective Investigation into Cancer and Nutrition (EPIC). Cancer Epidemiol Biomarkers Prev 2011; 20: 208-214. 52