KÝMYASAL TERMODÝNAMÝK VE BÝYOENERJETÝKLER
advertisement

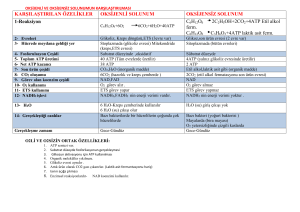
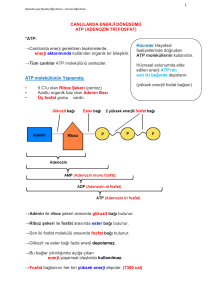
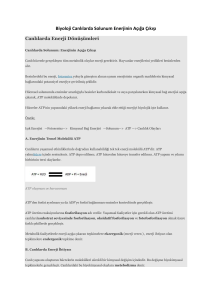
KİMYASAL TERMODİNAMİK VE BİYOENERJETİKLER Biyokimyasal olarak önemli reaksiyon türleri Canlı hücredeki reaksiyonların çoğu, beş genel kategoriden birine uyar: 1) Fonksiyonel grup transferi 2) Oksidasyon ve redüksiyon 3) Bir veya daha fazla karbon atomu çevresindeki bağ yapısının yeniden düzenlenmesi 4) CC bağlarını oluşturan veya yıkan reaksiyonlar. 5) Bir molekül su çıkışıyla iki molekülün kondensasyonu reaksiyonları. Biyokimyasal reaksiyonların mekanizması, temel olarak diğer kimyasal reaksiyonlardan farklı değildir. Birçok biyokimyasal reaksiyon, nükleofiller ile elektrofiller arasındaki etkileşimi kapsar. Nükleofiller, elektrondan zengin ve bunları verme yeteneğinde olan atom veya atom gruplarıdır; oksijen, azot, kükürt ve bunları içeren fonksiyonel gruplar önemli biyolojik nükleofillerdir. Elektrofiller, elektronları eksik ve elektron elde etmeye çalışan atom veya 1 atom gruplarıdır; pozitif yüklü hidrojen atomları yani protonlar ve pozitif yüklü metaller, hücrelerde sıklıkla elektrofil olarak etki ederler. Bir karbon atomu, bağlarına ve kendisini saran fonksiyonel gruplara bağlı olarak ya nükleofil ya da elektrofil merkez olarak davranabilir. Genel olarak biyokimyasal reaksiyonlarda, nükleofiller ile elektrofiller arasındaki etkileşimden kimyasal bağlar oluşur veya mevcut bağlar yıkılarak yenileri oluşturulur. İki atom arasında kimyasal bağların oluşması veya mevcut bağların yıkılması, olaya katılan maddelerin termodinamik özellikler denen bazı özelliklerinde de değişmelere neden olur. Bir maddenin termodinamik özellikleri; enerji (E), entalpi (H), entropi (S) ve serbest enerjidir (G). Bu özellikler ve aralarındaki ilişkiler, termodinamik adı verilen ayrı bir bilim dalında incelenir. Termodinamik tanımlar Termodinamikte bir organizma, bir hücre veya birbiri ile reaksiyona giren iki madde, sistem olarak tanımlanır. Bir sistem, bir çevre içinde yer almaktadır. Sistem ve çevrenin ikisi birlikte de evreni oluştururlar: Enerji (E) Enerji (E), iş yapma kabiliyetidir; birimi jouledür (J); kalori (cal) de enerji birimi olarak kullanılır (1 cal=4,187 J). Bir molekülün enerjisi, nükleus içi enerjileri ve moleküler elektronik, translasyonal, rotasyonal, vibrasyonal enerjileri kapsar ki bunu ölçmek ve değerlendirmek güçtür. Kimyasal reaksiyonlar sırasında reaksiyona katılan maddeler (reaktantlar, substratlar) ve reaksiyon sonunda oluşan maddelerin (ürünler) enerjilerinde değişimler olmaktadır. Reaktantların ve ürünlerin mutlak enerjileri yerine kısaca ∆E olarak ifade edilen enerji değişimini değerlendirmek daha kolaydır. Entalpi (H) Entalpi (H), enerji ile ilişkili bir durum fonksiyonudur. Entalpi değişikliği (∆H) de enerji değişikliği (∆E) ile ilişkilidir. Sistemin basıncı (P) ve volümünün (V) ürünlerde oluşturduğu değişiklik ∆(PV) olarak ifade edilirse, ∆H = ∆E + ∆(PV) Bir reaksiyon sabit basınç altında gerçekleşir ve sistemin volüm artışı veya volüm azalmasından başka iş yapılmazsa ∆H, çevreden alınan veya çevreye verilen ısı miktarıdır. ∆H pozitif (+) ise yani sistem çevreden ısı alıyorsa, reaksiyon endotermik reaksiyondur; ∆H negatif (−) ise yani sistem çevreye ısı yayıyorsa, reaksiyon ekzotermik reaksiyondur. 2 Entropi (S) Entropi (S) kimyasal bir sistemin komponentlerinin rasgelelik veya düzensizliğidir. Sistemin düzensizliğinde herhangi bir değişiklik entropi değişikliği (∆S) olarak ifade edilir. Sistemin düzensizliğinin artması veya düzenliliğin azalması durumunda ∆S’nin değeri pozitifdir (+). Sistemin düzensizliğinin azalması veya düzenliliğin artması durumunda ise ∆S’nin değeri negatifdir (−). Serbest enerji (G) Serbest enerji (G) sistemin iş yapmak için kullanılabilir enerjisidir. Sistemin serbest enerjisinde değişiklik bir iş yapılmasıyla birlikte olur. Bu iş kimyasal iş veya kimyasal enerji şeklinde olabilir. Serbest enerji değişikliği de ∆G sembolü ile ifade edilir. Gibbs serbest enerjisi olarak da bilinen serbest enerji, entalpi (H) ve entropinin (S) bir fonksiyonu olarak ifade edilebilir. T mutlak sıcaklık (oK) olduğuna göre: G = H − T⋅S ∆G = ∆H − T⋅∆S Biyolojik olmayan sistemler ısı enerjisini iş yapmada kullanabilirken biyolojik sistemler aslında izotermiktirler ve yaşamlarını sürdürebilmek için kimyasal enerjiyi kullanırlar. Canlılarda biyokimyasal olayların devamlılığının sağlanabilmesi için enerji gereklidir ve bu enerji uygun yakıt moleküllerinden sağlanmaktadır. Organizmanın yiyeceklerden bu enerjiyi elde etmesi, normal beslenme ve metabolizmayı anlamaya temel oluşturur. Bazı malnütrisyon tipleri enerji dengesizliği (marasmus) ile ilişkilidir ve mevcut enerji depoları boşaldığında açlıkta ölüm gerçekleşir. Fazla enerjinin depolanması şişmanlık ile sonuçlanır ki bu durum batı toplumlarının sık rastlanılan bir hastalığıdır. Enerjinin salınım hızı, metabolik hız ile ölçülür ve memelilerde tiroit hormonları ile kontrol edilir ki tiroit işlevlerinin bozulması hastalıklara neden olmaktadır. Biyokimyasal reaksiyonlara eşlik eden enerji değişimleri biyokimyasal termodinamikler veya biyoenerjetikler yardımıyla incelenir. Böylece bazı reaksiyonlar gerçekleşebilirken diğerlerinin neden gerçekleşmediğini açıklayan temel prensipler ortaya çıkar. Canlılarda enerji dönüşümü ve bu dönüşümün gerçekleşmesini sağlayan biyokimyasal olayların tümü de biyoenerjetikler olarak adlandırılmaktadır. Bu bağlamda biyolojik 3 sistemlerde enerjinin açığa çıkması, depolanması ve kullanılmasında biyoenerjetikler rol oynamaktadır. Termodinamiğin birinci kanunu Bir sistemin enerjisinde herhangi bir değişiklik çevrede eşit ve zıt bir değişikliği gerektirir. “Evrendeki total enerji miktarı sabittir.” Enerji bir şekilden başka bir şekle dönüşebilir. Örneğin bir molekülün kimyasal enerjisi ısı, elektrik veya mekanik enerji şekline dönüşebilir. Fakat evrenin bir bölümündeki enerji değişikliği bir başka bölümdeki eşit ve zıt bir değişiklikle birlikte olur. Termodinamiğin ikinci kanunu Kendiliğinden gerçekleşen herhangi bir süreçte sistem ve çevrenin total entropisi artar. “Evren kaçınılmaz olarak düzenli durumdan daha düzensiz duruma gider.” Bir sistem en düşük entalpi ve en yüksek entropiye sahip olmak eğilimindedir. Standart serbest enerji değişikliği Bir kimyasal reaksiyon denklemi, reaksiyona giren maddeler veya reaktantlar A ve B, reaksiyon sonunda oluşan maddeler veya ürünler C ve D olmak üzere genellikle şu şekilde yazılabilir: aA + bB cC +dD ∆G Bu denklemde a, b, c, ve d, sırasıyla A, B, C ve D’nin mol miktarları, ∆G de reaksiyon sırasındaki serbest enerji değişikliğidir: ∆G = Gson durum − Gbaşlangıç durumu Bir sistemin en düşük entalpi ve en yüksek entropiye sahip olmak eğilimi nedeniyle, ∆G negatif (−) ise reaksiyon ürünlere doğru (sağa doğru) spontan olarak gerçekleşir. ∆G sıfır ise sistem dengededir. ∆G pozitif (+) ise reaksiyon ürünlere doğru spontan olarak gerçekleşmeyecektir. Serbest enerji değişikliği (∆G) bir kimyasal reaksiyonun kendiliğinden gerçekleşip gerçekleşmeyeceği hakkında en yararlı bilgiyi sağlar. Serbest enerji değişikliği için ∆G = ∆H − T⋅∆S eşitliğini bildiğimize göre, bir biyokimyasal tepkimenin gerçekleşme olasılığı ve boyutunu entalpi (H) ve entropi (S) belirlemektedir. Sabit sıcaklık ve basınç altında kimyasal reaksiyonla oluşan ürünlerin toplam serbest enerjisi reaksiyona giren maddelerin toplam serbest enerjisinden küçük ise ∆G negatifdir (∆G<0); reaksiyon ekzergonik’tir. Sabit sıcaklık ve basınç altında kimyasal reaksiyonla oluşan ürünlerin toplam serbest enerjisi reaksiyona giren maddelerin toplam serbest enerjisinden büyük ise ∆G pozitifdir (∆G>0); reaksiyon endergonik’tir. Sabit sıcaklık ve basınç altında kimyasal reaksiyonla oluşan ürünlerin toplam serbest enerjisi reaksiyona giren maddelerin toplam serbest enerjisine eşit ise ∆G sıfırdır (∆G=0); sistem dengededir, sistemde herhangi bir değişiklik olmamaktadır: 4 Dengeye doğru spontan olarak ilerleyen herhangi bir reaksiyon için negatif (−) olan serbest enerji değişikliği (∆G), reaksiyon ilerlerken gittikçe daha az negatif olur; reaksiyon tarafından hiç bir iş yapılamayacağı denge noktasında da sıfır olur. Serbest enerji değişikliği (∆G ), bir reaksiyonu denge durumuna itici güç olarak etkilidir. Kimyasal reaksiyonlar için 298oK (25oC) sıcaklık, 1 atmosfer basınç, pH=0 ([H+]=1M) ve her komponent için 1 M konsantrasyon şartları, standart şartlar olarak belirlenmiştir. Bir reaksiyon için standart şartlar altında serbest enerji değişikliği de standart serbest enerji değişikliği olarak tanımlanır ve bu, ∆Go sembolü ile gösterilir. Yukarıda denklemi yazılı olan bir reaksiyon için serbest enerji değişikliği (∆G) ile standart serbest enerji değişikliği (∆Go) arasında şu şekilde bir bağıntı bulunmuştur: Bu eşitlikte R, gaz sabiti (25oC=298oK için yaklaşık 8,315 J/mol) ; T, mutlak sıcaklıktır (oK). Reaksiyon dengeye ulaştığında, olacaktır ki burada Keq, reaksiyon için denge sabitidir. Dengede ∆G=0 olduğunu bildiğimize göre, standart serbest enerji değişikliği (∆Go) için de ∆Go = −RT ln Keq ∆Go = −2,303RT log Keq eşitliği bulunur. Biyokimyasal reaksiyonların çoğu, pH=7’ye yakın olacak şekilde iyi tamponlanmış sulu çözeltilerde meydana gelir; hem pH, hem de suyun konsantrasyonu sabit kalır. Bu nedenle biyokimyacılar, hesaplamaların uygunluğu için biraz farklı bir standart durum belirlerler. Biyokimyacılar tarafından belirlenen standart durumda pH=7 ([H+]=10−7M) ve suyun konsantrasyonu 55,5 M’dır. Biyokimyasal standart duruma dayanan fiziksel değerler de kimyacılar ve fizikçiler tarafından kullanılanlardan ayırtetmek için üs işareti ile yazılırlar. Örneğin, biyokimyasal standart duruma dayanan standart serbest enerji değişikliği, ∆Goi şeklinde gösterilir; reaksiyonun denge sabiti de Kieq şeklinde gösterilir. 5 Bir reaksiyon için ∆Goi pozitif (+) olsa bile ∆G negatif (−) ise, reaksiyon ürünlere doğru eşitliğine gerçekleşebilir. göre bu durum, değeri negatif (−) ise ve ∆Goi değerinden daha büyük bir mutlak değere sahipse mümkündür. ∆G değeri negatif (−) ve büyük olan reaksiyonlar, termodinamik olarak elverişli reaksiyonlar olarak tanımlanırlar; bu reaksiyonlar, ürünlere doğru (sağa doğru) spontan olarak gerçekleşirler. Yine de termodinamik olarak elverişli bazı reaksiyonlar, ölçülebilecek hızda gerçekleşmez. Örneğin yakacak odun, yanma suretiyle, termodinamik olarak çok elverişli bir reaksiyonda CO2 ve H2O’ya dönüştürülebilir. Buna rağmen yakacak odun, yıllarca stabildir; tutuşması yani yanma reaksiyonunun başlaması için aktivasyon enerjisi diye tanımlanan bir miktar enerji gereklidir. Standart serbest enerji değişikliklerinin toplanabilirliği A↔B ve B↔C gibi art arda gelen iki kimyasal reaksiyonun her biri kendi denge sabitine ve karakteristik standart serbest enerji değişikliğine sahiptir: ∆GoiA→B ∆GoiB→C A↔B B↔C Art arda olan bu iki reaksiyon sonunda A reaktantından (substrat) C ürünü oluştuğundan, B iptal edilir ve toplam reaksiyon A↔C şeklinde yazılabilir; bu reaksiyonun da kendi denge sabiti ve standart serbest enerji değişikliği vardır: ∆GoiA→C A↔C A↔C toplu reaksiyonu için ∆GoiA→C standart serbest enerji değişikliği, iki alt basamak reaksiyonun standart serbest enerji değişikliklerinin toplamına eşittir: ∆GoiA→C = ∆GoiA→B + ∆GoiB→C Buna göre tüm reaksiyonların denklemle gösterilişi şu şekilde olur: 6 ∆GoiA→B ∆GoiB→C A↔B B↔C A↔C ∆GoiA→C= ∆GoiA→B + ∆GoiB→C Standart serbest enerji değişikliklerinin toplanabilme özelliği, termodinamik olarak elverişsiz (∆Goi pozitif; endergonik) bir reaksiyonun yüksek olarak ekzergonik bir reaksiyona ortak bir ara madde vasıtasıyla bağlanarak ileri yönde yürüyebilmesini açıklar. Örneğin; Glukoz-6fosfat sentezi, birçok organizma tarafından glukozun kullanılmasında ilk basamaktır: Glukoz + Pi →Glukoz-6-fosfat + H2O ∆Goi= 13, 8 kJ/mol reaksiyonunda ∆Goi>0 olması, standart şartlarda, bu reaksiyonun endergonik olduğunu, yazıldığı yönde kendiliğinden ilerleyemeyeceğini belirtir. Bir başka hücresel reaksiyon olan adenozin trifosfatın (ATP) adenozin difosfat (ADP) ve inorganik fosfata (Pi) hidrolizi, çok ekzergoniktir: ∆Goi= −30, 5 kJ/mol ATP + H2O → ADP + Pi Biri endergonik diğeri ekzergonik olan bu iki reaksiyon, Pi ve H2O ortak ara maddelerini birlikte kullanırlar ve art arda gelen reaksiyonlar olarak ifade edilebilirler; toplam reaksiyonun standart serbest enerji değişikliği, art arda gelen iki reaksiyonun serbest enerji değişikliklerinin cebirsel toplamı kadardır: Glukoz + Pi →Glukoz-6-fosfat + H2O ∆Goi= 13, 8 kJ/mol ∆Goi= −30, 5 kJ/mol ATP + H2O → ADP + Pi Glukoz + ATP →Glukoz-6-fosfat + ADP ∆Goi= −16, 7 kJ/mol Toplam reaksiyon ekzergoniktir; ATP’nin bağlarında depolanmış olan enerji, glukoz ve fosfattan oluşumu endergonik olan Glukoz-6-fosfatın sentezini sürdürmek için kullanılabilmektedir. Hücrelerde Glukoz-6-fosfatın ATP’den fosfat transferi vasıtasıyla oluşmasının yolu, yukarıda anlatılan art arda gelen reaksiyonlar gibi değildir; fakat net sonuç, toplam reaksiyonun aynısıdır. Termodinamik hesaplamalarda önemli olan, başlangıç ve son durumlardır; bunların arasındaki yolun biçimi önemli değildir. Glukozdan glukoz-6-fosfatın oluşmasındaki gibi bir strateji, bütün canlı hücreler tarafından, metabolik ara ürünler ve hücresel komponentlerin sentezinde kullanılır. Bellidir ki bu strateji, hücrede ATP gibi bileşikler devamlı olarak varsa işler. ATP ve fosfat grubu transferi Genellikle yakıt moleküllerinin parçalanması veya yıkılımının olduğu ekzergonik tepkimeler katabolizma olarak adlandırılmaktadır. Yeni bileşiklerin yapıldığı sentez tepkimeleri ise anabolizma olarak adlandırılmaktadır. Anabolik ve katabolik olaylar birlikte metabolizmayı oluşturmaktadırlar. Bütün canlılarda ekzergonik ve endergonik olaylar arasında biyolojik enerjinin taşınmasında, yüksek enerjili fosfat bileşiği olan adenozin trifosfat (ATP) molekülü rol oynamaktadır. 7 Heterotrofik hücreler, besleyici moleküllerin yıkılması vasıtasıyla bir kimyasal formdan serbest enerji elde ederler ve bu enerjiyi, ADP ile Pi’tan ATP yapmak için kullanırlar. ADP ve Pi’tan ATP oluşumu, fosforilasyon olayıdır. Mitokondride gerçekleşen oksidatif fosforilasyon için gerekli serbest enerji, solunum zincirinde elektronların moleküler oksijene aktarılması sırasında sağlanmaktadır. ADP ile Pi’tan oluşturulan ATP, daha sonra kimyasal enerjisinin bir kısmını metabolik ara maddeler ve küçük önmaddelerden makromoleküllerin sentezi, konsantrasyon gradientine karşı membranların bir tarafından diğer tarafına maddelerin taşınması ve mekanik hareket gibi endergonik süreçler için bağışlar. ATP’den bu enerji bağışı, genellikle ATP’nin ADP ve Pi’ta veya AMP ile 2Pi’ta dönüşümü ile sonuçlanarak yürüyen reaksiyonda ATP’nin kovalent katılımını gerektirir. ATP’nin hidrolizi ile ilişkili büyük serbest enerji değişikliği için kimyasal temel, şu şekilde özetlenebilir: 8 ATP, hidrolizi yüksek derecede ekzergonik olduğu halde, pH=7’de nonenzimatik yıkılmaya karşı kinetik olarak stabildir; çünkü, ATP’nin hidrolizi için aktivasyon enerjisi nispeten yüksektir. Fosforik asit anhidrit bağlarının hızlı yıkılımı, yalnızca bir enzim tarafından katalizlendiğinde gerçekleşir. ATP’nin hidrolizi için standart serbest enerji değişikliği (∆Goi) −30,5kJ/mol olduğu halde, canlı hücrelerde ATP’nin hidrolizinin gerçek serbest enerji değişikliği çok farklıdır. Bunun nedeni, canlı hücrelerdeki ATP, ADP ve Pi konsantrasyonlarının aynı olmaması ve standart 1,0 M değerinden çok düşük olmasıdır: Bundan başka sitozol, ATP ve ADP’ye bağlı Mg2+ içerir: 9 Fosforil vericisi olarak ATP’nin katıldığı çoğu enzimatik reaksiyonda doğru substrat, MgATP2−dir ve ilgili standart serbest enerji değişikliği (∆Goi), MgATP2−’in hidrolizi içindir. Sağlam hücrelerde ATP’nin hidrolizi için serbest enerji değişikliği, genellikle ∆Gp şeklinde gösterilir; ∆Goi’den daha çok negatiftir (çoğu hücrede −50kJ/mol ile −60kJ/mol arasındadır); sıklıkla fosforilasyon potansiyeli olarak adlandırılır. ATP, basit hidroliz yoluyla değil, grup transferi yoluyla enerji sağlar. Bir reaksiyon için ATP’nin katkısı, sıklıkla tek basamaklı olarak gösterilir; fakat hemen her zaman iki basamaklı bir süreçtir: Yüksek enerjili bileşikler Canlı organizmada, hidroliz standart serbest enerji değişimi yüksek, ATP’den başka bileşikler de vardır. Bu bileşikler, ya ATP gibi yüksek enerjili fosfat bileşikleridir ya da asetil-CoA gibi tiyoesterlerdir: 10 Açil taşıyıcı protein, protein sentezinde görevli amino asit esterleri, S-adenozil metiyonin (SAM), üridin difosfat glukoz (UDPGlc) ve 5-fosforibozil-1-pirofosfat (PRPP) da biyolojik önemi olan yüksek enerjili bileşikler arasında yer alırlar. Yüksek derecede negatif (−) hidroliz standart serbest enerjili bileşikler, reaktantlardan daha stabil ürünler vermektedirler. Bunun nedeni şu şekilde açıklanabilir: 1) Reaktantlarda elektrostatik itmenin neden olduğu bağ gerginliği, yük ayrılması vasıtasıyla giderilir. 2) Ürünler, iyonizasyon vasıtasıyla stabilize edilirler. 3) Ürünler, izomerizasyon vasıtasıyla stabilize edilirler. 4) Ürünler, rezonans vasıtasıyla stabilize edilirler. Canlı organizmadaki fosfat bileşikleri, hidroliz standart serbest enerjilerine göre keyfi olarak iki gruba ayrılabilirler: Hidroliz standart serbest enerjisi ∆Goi, −25kJ/mol’den daha çok negatif olanlar yüksek enerjili fosfat bileşikleridirler; hidroliz standart serbest enerjisi ∆Goi, −25kJ/mol’den daha az negatif olanlar düşük enerjili fosfat bileşikleridirler. 11 Art arda gelen reaksiyonların standart serbest enerji değişiklikleri toplanabildiğine göre; herhangi bir fosfat bileşiğinin sentezi, daha fazla negatif hidroliz standart serbest enerji değişikliğine sahip bir başka fosfat bileşiğinin yıkılmasına kenetlenme suretiyle başarılabilir. Bu nedenle de fosfat bileşiklerinin yüksek ve düşük fosfat grubu transfer potansiyeline sahip oldukları ifade edilir. Fosfoenolpiruvatın (PEP) fosfat grubu transfer potansiyeli çok yüksektir; ATP’ninki yüksektir; glukoz-6-fosfatınki düşüktür: ADP ve Pi’tan ATP oluşumu, fosforilasyon olayıdır ve endergonik bir reaksiyondur. Mitokondride gerçekleşen oksidatif fosforilasyon için gerekli serbest enerji, solunum zincirinde elektronların moleküler oksijene aktarılması sırasında sağlanmaktadır. Ayrıca fosfat grubu transfer potansiyeli çok yüksek 1,3-bisfosfogliserat, fosfoenolpirüvat, kreatin fosfat gibi bileşiklerin enerjisi, ATP oluşumu için kullanılabilir. Canlı hücrelerde kimyasal, osmotik ve mekanik işin gerçekleşmesi endergondur; bunlar, ancak ekzergon bir reaksiyonla kenetlenme suretiyle gerçekleşir. Bu kenetlenmede de bağlantı faktörü ve biyolojik enerjinin moleküler taşıyıcısı ATP’dir: 12