İ.Ü. Cerrahpaşa Tıp Fakültesi Sürekli Tıp Eğitimi Etkinlikleri
Güncel Bilgiler Işığında Sepsis
Sempozyum Dizisi No: 51 ● Mayıs 2006; s. 83 - 87
Sepsiste Nöroendokrin Değişiklikler
Dr. Tuğhan Utku
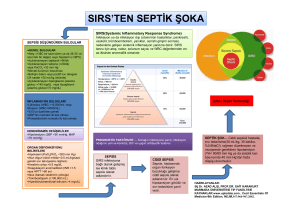
Ciddi enfeksiyonlarda metabolik durum önemli şekilde etkilenmektedir.
Metabolik durumdaki değişiklik, basitçe açlıkta oluşan tablodan farklılık
gösterir. Sepsiste hızla protein, karbonhidrat ve yağ yıkıma uğrar. Sepsiste en
belirgin metabolik özellikler; insulin direncine bağlı hiperglisemi, negatif azot
bilançosu, proteinlerin iskelet kaslarından splanknik dokulara kaymasıdır1.
Sepsis hastalarında görülen metabolik değişiklikler “septik otokanibalizm”
(dokuların kendi kendisini yemesi) olarak ifade edilir. Bu metabolik değişiklikler
başlıca, inflamatuvar sitokinler ve katekolaminlerin, kortizolün ve glukagonun
sitokinler tarafından uyarılması sonucu gelişir2. Bu tablonun sonucunda
beslenme bozukluğu gelişir ve mortaliteye ilave katkıda bulunabilir.
Sepsisin kötüleşmesi sonrasında, kan akımının bozulması sonucunda hücresel
enerji girdisi bozulur. Oksijen sunumunun azalması ve doku hipoksisi, anaerobik
glikolizis ve laktik asid artışına neden olur3. Enerji girdisinin azalması,
mitokondride işlev bozukluğuna neden olur4. Bu tablo sitopatik hipoksi olarak
tanımlanır. Genel anlamda iskemi olarak tanımlanabilecek bu durum,
reperfüzyon ve iskemi-reperfüzyon hasarı ile ileri organ yetersizliklerine neden
olacaktır5.
Sepsiste gelişen metabolik bozukluklar Tablo 1’de özetlenmiştir3.
Tablo 1. Sepsiste gelişen metabolik bozukluklar
Karbonhidrat
metabolizması
Glukoz alımı↑
Glikoliz↑
İnsulin direnci↑
Glikoneogenez↑
Hiperlaktatemi
Metabolik asidoz
Lipid metabolizması
Protein metabolizması
Lipolitik aktivite↑
Hipertrigliseridemi
KC yağlanması↑
Ketogenez↓
Protein katabolizması↑
Akut faz proteinlerinin üretimi↑
Visseral protein üretimi↓
Uzun süredir nöroendokrin sistem ile bağışıklık sistemi arasındaki ilişki
tanımlanmıştır. Bu ilişkiyi tanımlamada en iyi bilinen örnek kortikosteroidlerin
bağışıklık baskılayıcı etkileridir. Nöroendokrin ve bağışıklık sistemleri
arasındaki ilişki çift yönlüdür. Bunun anlamı her iki sistem de birbirini
etkileyebilmektedir6.
Bu konuda elde edilen kıymetli bilgiler özellikle endokrinoloji biliminin
yoğun bakıma uyarlanması ile elde edildiği bir gerçektir. Özellikle kritik
hastalarda endokrin sistemin yaygın olarak etkilendiği söylenebilir. Sepsis gibi
83
Dr. Tuğhan Utku
yoğun bakım pratiğinin ve bilgi dinamiğinin en önemli bileşenlerinden biri olan
konuda nöroendokrin etkilenme kaçınılmazdır.
Bağışıklık sistemi ile MSS arasındaki iki yönlü ilişki iki sistemi de daha iyi
çalışır durumda tutar7,8. Afferent uyarıların beyine ulaşması ile devamlı olarak
son koşula uyum oluşturulmaya çalışılır. Lokal inflamatuvar mediatörlerin
salgılanması oluşan durum ile ilişkili bilgiler, humoral yol veya vagus siniri ve
nosiseptif lifler aracılığı ile MSS’ne iletilir. Bu ileti, duruma uygun yanıt
oluşturulması süreci için bir ilk aşamadır9.
Bağışıklık yanıtını düzenleyecek MSS yönetimli uyarılar başlıca 3 mekanizma
ile oluşur9;
1- Hipotalamo-hipofizer hormonların ve sitokinlerin salınımı
2- Sempatik sinir sisteminin aktivasyonu
3- Kolinerjik anti-inflamatuvar yolak
Ağır sepsis ile beraber çoğunlukla MSS işlev bozukluğu da mevcuttur9.
Hipotalamo-hipofizo-adrenal (HPA) aks, kritik hastalarda, homeostazın
sağlanması ve uyumun sürdürülebilmesi açısından, adrenal glanddan kortizolün
salgılanması için büyük öneme sahiptir. Kritik hastalarda ilk yanıt; kortizol ve
ACTH’nın beraber yükselmesidir. Bu durum ile birlikte sirkadyen ritm bozulur,
kortikotropinin pulsatilitesi kaybolur ve hipofizin geri besleme duyarlılığı
bozulur11. Daha sonraki aşamada ise kortizol düzeyi yüksek kalsa da ACTH
seviyesi düşer (Şekil 1).
Akut dönemde; sitokinler, noradrenerjik sistem ve kortikotropin salgılatıcı
hormon (CRH) tarafından uyarılan ACTH artışı ile birlikte kortizol miktarı artar.
Kortizol düzeyinin yüksek olmasına karşın dehidroepiandrosteron sülfat
(DHEAS) düşüktür10. Kortizolün farmakokinetiği de değişir. Kortizolün kandan
karaciğere ekstraksiyonu azalır ve plazma yarı ömrü uzar10. Glikokortikoid
reseptörlerinin kortizole duyarlılığı artar10.
Kritik hastalığın uzayan dönemlerinde ACTH’nın azalmasına karşın
kortizolün yüksek kalması, ACTH dışında bir uyarı sisteminin olduğunu akla
getirmektedir. Bu durumun kesin açıklaması bilinmese de çeşitli hormonlar
(nöropeptid Y, P maddesi, Vazopresin, atrial natriüretik hormon) ve sitokinler
(TNF-α, IL-1, IL-6) neden olarak düşünülmektedir. Aldosteron düşük, renin
yüksek ve DHEAS düşüktür. Kortikotropin bağlayan globulin yükselmeye
başlar.
Kritik hastalarda kesin adrenal yetersizlik düşük sıklıkta görülen bir durum
olmasına karşın (%2-3), göreli adrenal yetersizliğin çok daha fazla olduğu
farzedilmektedir. Önceden varolan bazı koşullar (eşlik eden kastalıklar, ilaç
kullanımı, kanama, glukokortikoid kullanımı vb) tablonun daha sık görülmesine
neden olabilir.
84
Sepsiste Nöroendokrin Değişiklikler
Şekil 1. Ağır sepsis olgusunda, YBÜ’ne alındıktan sonra ilk 14 gün içindeki
kortizol (siyah daire) ve kortikotropin (siyah kare) kan düzeyleri11
Hastalarda göreli adrenal yetersizlikten şüphe etmek açısından olasılığı artıran
semptom ve bulgular Tablo 2’de özetlenmiştir.
Tablo 2. Göreli adrenal yetersizlik şüphesini artıran semptomlar ve bulgular12
Genel semptom ve bulgular
Mental semptom ve bulgular
Gastrointestinal semptom ve
bulgular
Hemodinamik semptom ve
bulgular
Laboratuvar bulgular
Nedensiz ateş, antibiyotiğe yanıtsız
Güçsüzlük, halsizlik, letarji, huzursuzluk,
apati, depresyon, deliryum, koma
İştahsızlık, bulantı, kusma, diare, karın ve
böğür ağrısı
Açıklanamayan dolaşım dengesizliği,
hipovolemik şok, hiperdinamik şok
Hipoglisemi, hyponatremi, hiperkalemi,
hiperkalsemi, nötropeni, eozinofili,
hiperprolaktinemi, hipotiroidi
Şiddetli bir uyarıdan sonra T3 azalırken, T4 ve TSH kısa bir süre yükselmeye
devam eder13. Bu durumun en önemli nedeni periferik olarak T4’ün T3’ye
çevriminin azalmasıdır. Zaman içerisinde TSH ve T4 normale dönerken T3
düşük kalır. Nöroendokrin uyumun bir bileşeni olduğu düşünülen bu tablo
“euthyroid sick syndrome” olarak tanımlanır. Tiroid hormon üretiminde akut ve
kronik kritik hastalık değişiklikleri Şekil 2’de gösterilmiştir.
85
Dr. Tuğhan Utku
Hipofizden vazopresin salınımının azalmasının hipotansiyon ile ilişkili
olabileceği düşünülmektedir13. Büyüme hormonunun pulsatil salınımı korunsa da
amplitüd azalmıştır14. Aynı şekilde leptinin sirkadyen salınımı da bozulur.
Bağışıklığı uyardığı kabul edilen bazı hormonların ( PRL, GH, IGF-I vb)
azaldığı bununla ilişkili bağışıklık baskılanması durumunun olduğu
bildirilmektedirP1.
Şekil 2. Akut ve Kronik kritik hastalıklarda Tiroid hormon hattı değişiklikleri15
AKUT DEĞİŞİKLİKLER
KRONİK DEĞİŞİKLİKLER
Sonuç olarak, kritik hastalarda ve özellikle sepsis gibi oluş ve etkileri son
derece karmaşık olan hastalık grubunda nöroendokrin etkilenme ve bu etkilenme
sonucunda da klinik seyirde farklılıklar yaşanmaktadır. Genel anlamda tüm
yaşamsal endokrin sistemin sepsisten etkilenmesi ve buna bağlı da klinik seyirde
kötüleşmeler yaşanması beklenebilir. Asıl soru bozulduğu ön görülen endokrin
bileşenlerine müdahale etmek klinik sonuca ne kadar etki etmektedir. Bu ifade
ile ilgili son yıllarda gelinen kimi noktalar söz konusudur. Bu yaklaşımlar
sonucu sepsis tedavi uygulamalarında yeni tedavi seçenekleri yer almıştır
(insulin uygulaması ve steroid tedavisi gibi). Önümüzdeki yıllarda yeni bilimsel
bilgiler ışığında, nöroendokrin değişiklikler ve bu değişikliklere uygulanabilecek
tedavi seçenekleri daha netlik kazanacaktır.
KAYNAKLAR
1. Tsiotou AG, Sakorafas GH, Anagnostopoulos G et al. Septic shock: current pathogenetic
concepts from a clinical perspective Med Sci Monit 2005:11(3):76-85
86
Sepsiste Nöroendokrin Değişiklikler
2. Mickie HR metabolism of sepsis and multiple organ failure World J Surg 1996:20:460464
3. Mizock BA Metabolic derangements in sepsis and sertic shock Crit Care Clin
2000:16:319-336
4. Fink M Cytopathic hypoxia in sepsis Acta Anaesth Scand 1997:100(3):87-115
5. Sakorafas GH, Tsiotou AG, Sarr MG Ischemia/reperfusion induced pancreatitis Dig Surg
2000:17:3-14
6. Besedosky HO, Del Rey A Immune-neuro-endocrine interactions:facts and hypotheses
Endocr Rev 1996:17:64-102
7. Blalock JE The syntax of immune-neuroendocrine communication Immunol Today
1999:15:504-511
8. Besedovsky HO, del Rey AE, Sorkin E Immune-neuroendocrine interactions J Immunol
1985:135-750s-754s
9. Munford RS, Tracey KJ Is sever sepsis a neuroendocrine disease? Molecular Medicine
2002:8(8):437-442
10. Vermes I, Beishuizen A The hypothalamic-pituitary-adrenal respone to critical illness
Best Pract Res Clin Endocrinol Metab 2001:15:495-511
11. Beishuizen A, Thijs LG, Haanen C et al. Macrophage migration inhibitory factor and
hypothalamo-pituitary-adrenal function during critical illness J Clin Endocrinol Metab
2001:86:2811-2816
12. Gürlek A, Dağdelen S, Atmaca A et al. Glucose homeostasis and neuroendocrine
regulation in critical illness Turkish J Endoc Met 2002:2:57-58
13. Landry DW, Levin HR, Gallant EM et al. Vasopressin deficiency contributes to the
vasodilation of septic shock Circulation 1997:95:1122-1125
14. Gudmundsson A, Carnes M Pulsatile adrenocorticotropic hormone:an overview Biol
Psychiatry 1992:41:342-365
15. Van den Berghe G Novel insights into the neuroendocrinology of critical illness
European J End 2000:143:1-13
87