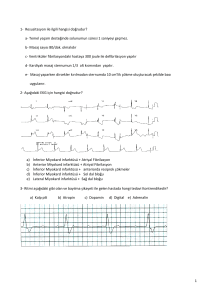
koroner arter by-pass cerrahġsġ geçġren hastalarda preoperatġf
advertisement

1 T.C. SAĞLIK BAKANLIĞI DR.SĠYAMĠ ERSEK GÖĞÜS KALP VE DAMAR CERRAHĠSĠ EĞĠTĠM VE ARAġTIRMA HASTANESĠ, KARDĠYOLOJĠ KLĠNĠĞĠ BAġHEKĠM: PROF.DR.ĠBRAHĠM YEKELER KLĠNĠK ġEFĠ: DOÇ.DR.NEġE ÇAM KORONER ARTER BY-PASS CERRAHĠSĠ GEÇĠREN HASTALARDA PREOPERATĠF PERĠODONTĠTĠS VE OPERASYON SONRASI ATRĠAL FĠBRĠLASYON SIKLIĞININ KARġILAġTIRILMASI KARDĠYOLOJĠ UZMANLIK TEZĠ DR.FAHRĠ FATĠH TĠPĠ Tez DanıĢmanı: DOÇ.DR NEġE ÇAM ĠSTANBUL 2008 2 TEŞEKKÜR Öncelikle hastanemiz kuruluşunda ve gelişmesinde büyük katkıları olmuş, ülkemize kalp hastalıkları tanı ve tedavisinin araştırma ve geliştirmesine çok büyük emeği bulunmuş olan hocamız merhum Prof.Dr Siyami Ersek’e saygıyla anıyorum. Eğitimimde bilgi, tecrübe ve yetenekleriyle büyük emekleri bulunan, asistanlık eğitimim için gerekli tüm koşulları sağlamakta hiçbir yardımı esirgemeyen klinik şefim sayın Doç.Dr. Neşe Çam ve önceki klinik şefim, şu an emekli olan sayın Dr. Birsen Ersek’e sonsuz teşekkürlerimi sunarım. Ayrıca bilgi ve birikimini benimle paylaşan ve eğitimimde bana büyük yardımları olan klinik şef muavinim sayın Dr.Recep Öztürk’e de sonsuz teşekkürlerimi sunarım Hastanemiz başhekimi sayın hocam Prof.Dr. İbrahim Yekeler’e asistanlık yıllarım boyunca gösterdiği emek ve katkılardan dolayı en içten teşekkürlerimi sunarım. Aynı şekilde birlikte çalışmaktan onur duyduğum, bilgi ve tecrübeleri ile eğitimimde sonsuz katkıları olan kardiyoloji klinik şeflerim, Doç. Dr. Ahmet Narin, Doç. Dr. Kemal Yeşilçimen, Doç. Dr. Neşe Çam, Doç. Dr. Kadir Gürkan, Doç. Dr. Mehmet Eren, Doç. Dr. Osman Bolca ve Doç. Dr. Gülşah Tayyareci’ye, Kardiyoloji klinik şef yardımcılarım Doç. Dr. İzzet Celal Erdinler, Dr. Öner Engin, Dr. Hasan Sunay, Dr. Recep Öztürk, Doç. Dr. Seden Erten Çelik’e saygı ve teşekkürlerimi sunmayı bir borç bilirim. Başta tezimi hazırlamamda büyük desteğini gördüğüm Doç.Dr. Hüseyin Uyarel olmak üzere ekibimizde beraber çalıştığım uzmanlarım, Dr. Nihat Özer, Doç.Dr. Zeynep Tartan, Doç.Dr. Hülya Kaşıkçıoğlu’na eğitimimdeki bütün emeklerinden dolayı sonsuz teşekkürlerimi sunarım. Ayrıca hastanemizdeki diğer tüm kardiyoloji bölümü şef muavini ve uzmanlarıma da en içten teşekkürlerimi sunarım. Ekibimizde beraber çalıştığımız arkadaşlarım Dr. Erdal Belen, Dr. Azmi Sungur, Dr. Hamdi Püşüroğlu ve Dr.Deniz Demirci’ye ve hastanemizde görev yapan ya da yapmış bulunan diğer tüm kardiyoloji asistan arkadaşlarıma sonsuz teşekkürlerimi sunarım. Hastanemizde beraber çalışmaktan büyük gurur duyduğum kardiyovasküler cerrahi, göğüs cerrahisi, radyoloji, anestezi, çocuk kardiyolojisi klinikleri şef ve şef muavinlerine teşekkürlerimi sunarım, aynı şekilde birlikte çalışmaktan büyük mutluluk duyduğum kardiyovasküler cerrahi, göğüs cerrahisi, radyoloji, anestezi, çocuk kardiyolojisi kliniklerinde çalışan uzman abi ve ablalarım, asistan arkadaşlarıma teşekkürlerimi sunarım. Başta tezimin hazırlanmasında katkıları bulunan ikinci cerrahi hemşireleri olmak üzere hastanemizin tüm birimlerinde çalışmakta olan hemşirelerimize teşekkürlerimi sunarım, hastanemiz birimlerinde çalışan diğer tüm görevlilere de teşekkürü bir borç bilirim. Sonsuz sevgi ve desteklerini benden hiç esirgemeyen aileme de en içten teşekkürlerimi sunarım... 3 İçindekiler: KAPAK……………………………………………………………….………………1 TEŞEKKÜR…………………………………………………………….……………2 GİRİŞ………………………………………………………………….……………..4 GENEL BİLGİLER…………………………………………………………………6 ATRİAL FİBRİLASYON……………………………………………………...6 EPİDEMİYOLOJİ…………………….………………………………..6 PROGNOZ……………………………………………………………..8 ETYOLOJİ…………………………………………………………….9 PATOFİZYOLOJİ……………………………………………………..12 KLİNİK BULGULAR…………………………….……………………16 KLİNİK DEĞERLENDİRME…………………………………………..17 SINIFLAMA…………………………………………...……………..18 TEDAVİ………………………………………………..…………….19 KORNER ARTER BY-PASS CERRAHİSİ VE ATRİL FİBRİLASYON..……..27 PERİODONTİTİS………………………………………………..…………30 ATRİAL FİBRİLASYON VE İNFLAMASYON…………………..………….32 MATARYEL METOD………………………………………………………….....34 AMAÇ………………………………………………………….…………..34 HASTA SEÇİMİ………………………………………………...………….34 OPERASYON VE POSTOPERATİF TAKİP………………………………..37 BULGULAR………………………………………………………………………39 TARTIŞMA………………………………………………………..……………..45 SONUÇ…………………………………………………………………………..48 ÖZET…………………………………………………………………………….49 KAYNAKLAR………………………………………..………………………….50 4 GĠRĠġ Atriyal fibrilasyon(AF), atriyumda etkin kasılma olmaksızın düzensiz, 350-600/dak olan atriyal depolarizasyonla karakterize, elektrokardiyografi(EKG)’ de küçük düzensiz ve değişken atriyal amplitüd ve ritmi gösteren fibrilasyon dalgaları ile karakterize bir aritmidir. Ġlk olarak 1909 yılında Lewis tarafından tanımlanmıştır(1). Koroner arter operasyonları sonrası en sık görülen aritmi çeşididir. Koroner arter bypass cerrahisi(KABG) sonrası görülen AF insidansının geniş serilerde %5 ile %40 arasında olduğu bildirilmektedir(2-4). Bu klinik problem hala önemli morbidite sebeplerinden biridir. Cerrahi ve anestezi tekniklerindeki gelişmeler ile miyokart korumasındaki ilerlemelere rağmen AF sıklığında önemli bir azalma sağlanamamıştır. AF, hemodinamik instabilite, artmış inme riski, uzamış hospitalizasyon süreleri, artmış antiaritmik ilaç ve pacemaker kullanımı, ayrıca artmış tedavi maliyetleri ile ilişkilidir(1,5-7). KABG sonrası görülen AF etiyolojisi tam olarak bilinmemesine rağmen, literatürde birçok risk faktörü ve tetikleyici sebepler öne sürülmüştür. Pek çok yazar, kardiyopulmoner by-pass(KPB)’ın AF’ye neden olduğu görüşündedir. Atrial manipülasyon, kanülasyon, kardiyoplejik arrest, uzamış aortik kros klemp zamanı, atriyum dokusunun iskemiden korunamaması, sistemik mediyatörlerin salınımı gibi faktörler sıkça suçlanmaktadır(1,5,7-9). Atrium kasındaki fibrozis ve dejenerasyon, sinüs nodu ile ilgili problemler, iletim bozukluklar, ileri yaş gibi nedenler hastaların ancak bir kısmındaki AF oluşmasını açıklamaktadır(10). Myokardit ve perikardit gibi inflamatuar olaylarda yüksek oranda AF görülmesi üzerine yapılan bir çalışmada inflamasyon ve AF arasında kuvvetli bir ilişkinin varlığı araştırılmış ve tespit edilmiştir(11). Bu çalışmada inflamatuar yanıtı göstermesi açısından high sensitiv C-reaktif protein(hsCRP) seviyesindeki yükseklik ile AF gelişme sıklığı araştırılmıştır. 5 Periodontitis, dişetinde başlayan iltihabi olayın dişin destek dokularına yayılarak, dentogingival ve dentoalveolar fibrin ataşmanların yıkımı, alveolar kemiğin rezorbsiyonu ve sonrasında diş kaybıyla sonlanan enfeksiyoz bir hastalıktır(12-14). Ayrıca toplumda sık görülmekle beraber kronik ve sistemik bir inflamasyon sebebidir. ÇalıĢmamızın amacı: kronik ve sistemik bir inflamasyon nedeni olan periodontitisin varlığının ve derecesinin, KABG operasyonları sonrası gelişebilecek AF sıklığına etkisini araştırmaktır. 6 GENEL BĠLGĠLER ATRĠAL FĠBRĠLASYON: AF, EKG’de düzenli P dalgaları yerine düşük amplitüdlü ve düzensiz, 350-600/dak olan fibrilasyon dalgaları ile beraber, düzensiz R-R mesafelerinin izlendiği, ventriküler hızın genelde 120-180/dak olduğu sık rastlanan bir aritmi çeşididir. Hastaların nabızlarında yaptığı düzensizlik ile yüzyıllardan beri hekimlerin dikkatini çekmişse de, AF ile ilgili klinik ve deneysel araştırmalar ancak 19. Yüzyılda başlayabilmiş ve ilk kez 1909’da Lewis tarafından EKG ile gösterilmiştir(1). Framingham çalışması ile AF’nin selim bir aritmi olmadığı, mortalite ve morbiditeye olumsuz etkiler yaptığı ortaya çıkmış ve böylece klinik önemi daha iyi anlaşılmıştır(15,16). Sinüs ritmindeki hastalara göre mortalite ve morbiditede önemli bir artışa neden olmaktadır. Ancak AF’nin klinik tablosunun değişkenliği nedeni ile optimal tedavi henüz netleşmemiştir. Epidemiyoloji: AF, klinik uygulamada en sık karşılaşılan aritmi tiplerindendir ve ritim bozukluğu nedeniyle hastaneye yatırılan hastaların üçte birini oluşturur. Amerika’da 2.2 milyon, Avrupa’da 4.5 milyon AF’li hasta olduğu tahmin ediliyor(17). Geçtiğimiz yirmi yıl içerisinde popülasyonun yaş ortalamasının artması, kronik kalp hastalığı prevalansının artması, gelişmiş tanı yöntemleriyle daha sık tanı konulması gibi nedenlerden dolayı AF ile hastaneye başvuru oranında yaklaşık %66 oranında artış olduğu tespit edilmiştir(18,19). ABD’ de yıllık AF’ li yeni hasta sayısının yaklaşık 360000 olup bunların da yaklaşık %50’si acil olmak üzere 227000 tanesinin interne edildiği bildirilmiştir(20). Bu ülkede sağlık harcamalarının 6.6 7 milyar doları AF’nin tetkik ve tedavisi için yapılmaktadır. Bu değerin yaklaşık %52’si hastane masrafları, %23’ü ilaçlar, %9’u konsültasyonlar, %8’i araştırma ücretleri ve %2’si paramedikal prosedürlere harcanmaktadır. AF’nin prevalansı ve insidansı ile ilgili pek çok epidemiyolojik araştırma yapılmıştır(21). AF’nin genel popülasyonda prevalansı %0.4 olup, yaşla birlikte artış göstermektedir(22,23). Cross-sectional çalışmalarda prevalansı 60 yaş altında %1’den az ve 80 yaş üstünde % 6’dan fazla bulunmuştur(24,25). Framingham çalışmasında AF prevalansının yaşla beraber arttığı ve 25-35 yas arası bireylerde %0.05’ten az iken 69 yas üzerinde % 5.75, yaş üzerinde de %10 olduğu saptanmıştır. Yaş düzeltilmiş prevalansı erkeklerde daha sıktır(26,27). AF insidansındaki artış her yaş grubu için erkek kadın oranı ortalama 1.7 olarak hesaplanmıştır(28). Toplum kaynaklı çalışmalarda lone AF’li hastalarda AF sıklığı bütün AF’li vakaların % 12’sinden az olarak bulunmuştur(27,29,30). Bazı serilerde ise lone AF sıklığı %30’un üzerindedir(31). Ülkemizde TEKHARF çalışmasının 2000 yılı verilerine göre erişkinlerde AF sıklığı 1990 yılında binde 3.5 iken 1998 yılında binde 7.1 olarak saptanmıştır(32). Altmış yaş üzerindeki bireylerde ise oran 1990’da binde 12.2 iken 1998’da binde 21.6 olarak bulunmuştur. AF insidansı ile ilgili faktörler: AF insidansı yaşla artmaktadır. AF insidansı 50 yıl boyunca birbirini takip eden her on yılda iki kat artmaktadır ve 80 yaşına ulaşıldığında kişilerin %10’unda AF bulunmaktadır(17). AF gelişen kişiler genellikle yaşlı olup, beraberinde sıklıkla diabetes mellitus, sol ventrikül hipertrofisi, ekokardiyografik bozukluklar, koroner arter hastalığı, kapak hastalığı, kalp yetmezliği(KY) ve inme bulunmaktadır(33,34). 8 Kadınların üçte biri ve erkeklerin %20’si valvüler kapak hastalığı, erkeklerin %28’i ve kadınların yarısı koroner arter hastalığı(KAH), her iki cinsin %25’inde KY vardır. Çok değişkenli analizler AF gelişimi için, yaş, kapak hastalığı, konjestif kalp yetmezliği(KKY), hipertansiyonHT ve diabetes mellitusun(DM) bağımsız risk faktörleri olduğunu ortaya koymuştur(35). Erkeklerde kadınlara göre AF prevalansı daha fazladır. Erkeklerin AF eğiliminin daha fazla olmasının sebebi ise belli değildir. Atriyal dokuyu etkileyen inflamasyon, infiltrasyon, skar dokusu oluşumu veya gerilme gibi her tür patolojik süreç AF gelişimine neden olabilir. Epidemiyolojik çalışmalarda AF’nin en sık nedeni iskemik kalp hastalığıdır (36). Prognoz: AF, uzun vadede kadın cinsiyette daha belirgin(37) olmak üzere artmış inme, kalp yetmezliği ve tüm nedenlere bağlı mortalite riski ile ilişkilidir(38). Sinüs ritmindeki hastalara göre AF’li hastaların mortalitesi altta yatan hastalığın ciddiyet seviyesi ile de ilişkili olarak yaklaşık iki kata kadar artmıştır(39,40,41). AF, büyük kalp yetmezliği çalışmalarında, mortalite ve morbidite için bağımsız bir risk faktörü olarak saptanmıştır. COMET çalışmasında, izlem sırasında AF gelişenlerde mortalitenin arttığı belirlenmiştir(42). Benzer şekilde Val-HeFT çalışmasında da kronik KY hastalarında AF gelişiminin klinik sonuçları daha kötü yönde değiştirdiği izlenmiştir(43). Non-valvuler AF’li hastalarda iskemik inme sıklığı, AF’siz popülasyona göre 2 ila 7 kat fazladır (yılda %5) (38,39,41,43-45). Gelişen her 6 inmeden birinin AF’li hastalarda geliştiği bilinmektedir(46). Geçici iskemik atak ve kranial görüntüleme yöntemleriyle 9 saptanmış klinik olarak sessiz inmeler de değerlendirildiğinde non-valvüler AF’ye bağlı serebral iskemi sıklığı, yıllık %7 seviyelerine ulaşmaktadır(47-49). Uzun dönemde persiste eden AF’ye bağlı artmış ventiküler hız (>130/dak), dilate kardiyomiyopati(KMP)’ye neden olabilir (taşikardinin indüklediği KMP) (50-52). KY’nin AF’ye sebep olmayıp AF’nin KMP’ye neden olduğu bu durumda, KMP’nin sebebini bulmak oldukça önemlidir. Ventrikül hızının kontrolü böyle bir durumda myopati gelişimini geriye çevirebilir. Bir çalışmada hız kontrolü ile ortalama sol ventrikül ejeksiyon fraksiyonun %25’den %52’ye yükseldiği izlenmiştir (53). Etyoloji: Elektrofizyolojık anomaliler: -Artmış Otomatisite (fokal AF) -Ġleti anomalileri (reentry) Atriyal basınç artışı: -Mitral ve triküspit kapak hastalığı -Koroner arter hastalığı -Semilunar kapak anomalileri -Sistemik veya pulmoner hipertansiyon (pulmoner emboli) -Ġntrakardiak tümör veya trombüs Atriyal iskemi: -Koroner arter hastalığı Ġnflamatuar veya infiltratif atriyal patoloji: -Perikardit -Amiloidoz 10 -Myokardit -Yaşla indüklenen atriyal fibrotik değişiklikler Ġlaçlar: -Alkol - Kafein Endokrin Bozukluklar: -Hipertroidizm -Feokromositoma Otonomik tonus değişiklikleri: -Artmış parasempatik aktivite -Artmış sempatik aktivite Postoperatif: -Kardiyak, Pulmoner, Osefageal Norojenik konjenital kalp hastalığı: -Subaraknoid hemoraji -Nonhemorajik major stroke Ġdiopatik(lone AF) Familial AF’nin geri dönüşümlü nedenleri: AF, alkol alımı, cerrahi müdahale, elektrik çarpması, miyokart infaktüsü(MI), perikardit, miyokardit, pulmoner emboli ve ya diğer pulmoner hastalıklar, hipertiroidi ve diğer bazı metabolik bozukluklar gibi akut ve geçici durumlara bağlı gelişebilir. Bu gibi durumlarda altta yatan bozukluğun uygun tedavisi genellikle AF’yi de tedavi eder. Akut miyokart infaktüsü(AMI) sırasında oluşan AF, infakt öncesi AF ve ya sinüs ritminde gelişen 11 MI’ya göre daha kötü prognoz göstergesidir(54,55). AF ayrıca WPW sendromu ve ya A-V nodal reentran taşikardiler ile de ilişkili olabilir ve primer aritminin tedavisi AF görülme sıklığını da azaltacaktır(56). AF, torasik ve ya kardiyak cerrahi sonrası sık rastlanan bir komplikasyondur. Kardiyak patoloji ile ilişkili olmayan AF: Paroksismal AF’nin yaklaşık %30 ila %45’i ve persistan AF’nin %20 ila %25’i, altta yatan herhangi bir kardiyak anomali olmadan genelde genç hastalarda görülür(lone AF) ( 44,57). Bununla birlikte AF, altta yatan kardiyak patoloji olmadan yaşlı popülasyonda da görülebilir. Ġleri yaşta görülen miyokardial stiffness artışı gibi kalbin yapı ve fonksiyonunu değiştiren durumlar, AF ile ilişkili olabilir AF ile ilişkili medikal durumlar: Obezite, AF için önemli bir risk faktörüdür(58-60). Klinik risk faktörleri göz önüne alındığında, AF için en belirgin riskin sol atrial boyutla ilişkili olduğu söylenebilir, çünkü sol atrium boyutu arayışı ile VKĠ artışı arasında kademeli bir ilişki vardır(58,61). Kalp hastalıklarıyla ilişkili AF: AF ile özellikle ilişkili kardiyak durumlar, kapak hastalıkları, kalp yetmezliği(KY), KAH ve HT (özellikle LV hipertrofisinin derecesine göre artmış ilişki)’dir. Bununla birlikte AF, hipertrofik KMP, dilate KMP, konjenital kalp hastalığı ki özellikle yetişkinlerde atrial septal defekt ile ilişkilidir. Potansiyel ilişkili durumlar arasında ayrıca, restriktif KMP, kardiyak tümörler ve konstrüktif perikardit yer alır. Mitral yetmezliğin eşlik ettiği ve ya etmediği mitral kapak prolapsusu, mitral kapak annulus kalsifikasyonu, idiyopatik sağ atrium genişlemesi ve kor pulmonale de AF’nin yüksek görülme sıklığı ile ilişkilidir. 12 Ailesel (genetik) AF: Ailesel AF’den sorumlu moleküler defektlerin çoğu bilinmemektedir. Kısa atrial refrakterliğe yol açan iki adet gen mutasyonu Çinli aileler üzerinde yapılan bir çalışmada saptanmıştır(62,63). AF’nin otonom fonksiyonlarla ilişkisi: AF’nin başlamasında otonomik fonksiyonlar önemli bir rol oynar. Tek başına vagal ve ya sempatik etkinliğin AF için başlatıcı olduğundan, vagal ve sempatik etkinliklerin arasındaki denge çok önemlidir. Kalp hızı değişkenliği ile ölçülen otonomik dalgalanmalar AF’nin başlamasında rol oynamaktadır. Vagal tonusa bağlı olduğu düşünülen AF genellikle gece saatlerinde ve ya yemek sonrası görülürken, sempatik aktiviteye bağlı gelişen AF ise organik kalp hastalığı bulunan hastalarda gün içinde gelişir(64). Vagal kökenli AF genellikle daha sık görülüp, beta bloker ve digital türevi ilaçlarla klinik semptomlar bazen kötüleşirken, disopiramid gibi antikolinerjik ilaçlarla tekrarlar engellenebilir. Ancak AF’yi vagal ve ya adrenerjik şeklinde sınıflamanın tedavi üzerine etkisi sınırlıdır. Adrenerjik tipteki AF’de ise beta blokerler(b-bloker) ilk seçenek ilaçlardır. Patofizyoloji: AF’de izlenen en sık patolojik değişiklik, atrial fibrozis ve atrial kas kitlesi kaybıdır. AF’ye ve ya altta yatan hastalığa bağlı değişikliklerin ayrımı zordur, fakat fibrozis AF’nin öncü lezyonu olabilir(65). Atrial dokusunda az ve ya orta seviyede fibrozis saptanan hastaların kardiyoversiyona yanıtı atrial dokularında fazla fibrozis saptanan hastalara göre daha iyi bulunmuştur(66). Atrial fibrozis, birçok hastalık ve AF’ye yatkınlık oluşturan hastalıkta saptanmıştır ancak, fibrozisin mi AF’yi yoksa AF’nin fibrozisi tetiklediği bilinmemektedir. 13 AF, interatrial ileti gecikmesi ve refrakter periodun değişkenlik göstermesi ile ilişkilidir(67). Ve buna bağlı olarak AF, atrial remodeling ve aritminin devamlılığını sağlayan değişikliklere neden olan sürece sebep olmaktadır. Atrial yapısal remodeling ile ilgili bilgiler sınırlıdır(68,69) ve yaşla ve ya kalp hastalığında görülen dejeneratif değişikliklerden ayrımı zordur(68). AF mekanizması: Bir taşiaritminin oluşum ve idamesi başlatıcı bir olay ve anatomik bir substrat gerektirir. AF’de ise durum genellikle karmaşıktır ve mevcut bilgiler otomatisiteyi ve ya multipl reentran dalgalarını desteklemektedir. Otomatik odak teorisi, AF’nin fokal odağının bulunup ablate edilmesiyle AF’nin sonlandırılabileceği keşfedilene kadar pek ilgi çekmemiştir(70). Bu odaklardan en bilineni pulmoner ven ağızlarında iken, suprerior vena cava, Marshall ligamanı, sol posterior serbest duvar, krista terminalis ven koroner sinüsde de odaklar saptanmıştır(70,71,72). AF’li hastaların pulmoner venlerindeki atrial dokunun refrakter periodlarının, diğer atrial bölge dokularından daha kısa olduğu saptanmıştır(73,74). Ayrıca AF’nin, pulmoner venlere verilen uyarı ile diğer atrial dokulardan daha kolay uyarıldığı görülmüştür. Fraksiyone dalgaların artium boyunca yayılarak, yeni ‘yavru dalgalar’ı oluşturduğunu ileri süren multipl dalgalar hipotezini Moe arkadaşları geliştirmiştir(75). Burada, dalgaların çeşitliliğini ve sayısını atrial dokuların kütlesi, refrakter periyodu ve ileti hızı belirler. Dalgaların sayısını arttıran ve dolayısıyla AF gelişimini kolaylaştıran faktörler, atrial kitlenin artışı, kısa refrakter period ve gecikmiş iletidir. Bu hipotez, uzun yıllar AF’nin ana oluşum mekanizması olarak kabul edilmiştir. Ancak deneysel ve klinik çalışmalar bu düşünceye karşı veriler sunmaktadır. Birçok gözlem, anormal atrial substratın önemini vurgulamaktadır. 14 Atrial elektriksel remodeling: 24 saatten kısa süreli AF’lerde farmakolojik ve ya elektriksel kardiyoversiyon, uzun süreli AF’ye göre daha başarılıdır(76). Bu gözlem, AF’nin kendi kendini kuvvetlendirdiği düşüncesini oluşturmuştur. Yapılan bir hayvan deneyinde verilen atrial elektriksel uyarıyla oluşturulan AF’lerden önceleri oluşanların spontan, kendiliğinden sonlandığı, daha sonralarda oluşanların ise daha persiste ettiği görülmüştür(77). Elektrofizyolojik remodeling olarak adlandırılan bu durum, artmış AF süresiyle kısalan efektif refrakter periyodun yol açtığı AF’ye yatkınlık ile ilişkilidir(78). Taşikardinin indüklediği AF ise, A-V nod reentran taşikardi, aksesuar yol, atrial taşikardi veya atrial flutter nedeniyle oluşabilir(79,80,81). Atrioventriküler iletim: A-V nod, aksesuar yol veya HĠS-pürkinje disfonksiyonu gibi bir patoloji yoksa atriumdan ventriküle iletimi sınırlar(81). A-V noda gelen atrial impulslar A-V nodal refrakterlikte değişkenlik oluşturur, bu durum da ventriküler cevabın değişkenliğini açıklayabilir. Atrial hız göreceli olarak düşük olduğunda ventriküler yanıt hızlı olma eğilimindedir, bunun tersi olarak da yüksek hızlardaki atrial hızlarda düşük bir ventriküler yanıtı oluşma eğilimi oluşur(82). Artmış parasempatik ve baskılanmış sempatik tonus, A-V nodal ileti üzerine negatif dromotropik etki oluştururken, bunun tam tersi de doğrudur(83-85). Otonomik tonusdaki fluktuasyonlar, AF’deki değişken ventriküler yanıta neden olurlar, örneğin uyku halinde düşük ventriküler hıza karşın egzersizde artan ventrikül hızı gibi. Daha çok vagal uyarılarla artan ventriküler hızı kontrol altına alabilen dijital türevi ilaçlar aktivite sırasındaki kalp hızını kontrol altına almada daha etkisizdirler. Otonomik tonusdaki bu geniş çaplı değişimler tedavi yaklaşımlarını zorlaştırmaktadır. 15 AF’de miyokardial ve hemodinamik sonuçlar: AF sırasında, senkron atrial aktivite kaybı, düzensiz ventriküler yanıt, artmış kalp hızı ve azalmış koroner kan akımı gibi hemodinamik etkiler oluşur. Atrial kontraksiyon kaybı özellikle mitral stenoz, HT, restriktif KMP ve ya hipertrofik KMP gibi diyastolik dolumun bozulduğu durumlarda kardiyak çıktıyı oldukça düşürür. A-V nod ablasyonu uygulanmış vakalarda, düzensiz sağ ventriküler uyarı verlenlerde aynı ventriküler hızda olacak şekilde düzenli uyarı verilenlere göre kardiyak çıktıda %15’lik düşüş izlenmiştir(86). Myokardial kan akımını belirleyen faktörler, tıkayıcı koroner arter hastalığının olup olmaması, aortik diyastolik basıncı ve diyastol sonu sol ventrikül basıncı arasındaki fark(miyokardial perfüzyon basıncı), koroner vasküler rezistans ve diyastol süresidir. AF, bu faktörlerin hepsini birden etkileyebilir. AF’de azalmış koroner kan akımı özellikle, kompansatuar koroner vazodilatasyon yeteneğini sınırlayan koroner arter hastalığına sahip hastalarda önemlidir. Bu durum, ilk kez AF ile başvuran hastalardaki göğüs ağrısı semptomunu açıklayabilir. Persistan AF’li hastalarda sol atrium volümü 45cm3’den 64cm3’e, sağ atrial volümü 49cm3’den 66cm3’e zamanla çıkabilir(87). Bu durum ise geri dönüşü ve sinüs ritmini zorlaştırır(88). Atrial etkilerin dışında, devamlı yüksek hızlarda seyreden ventriküler hız(130/dak ve üzeri) dilate KMP nedeni olabilir(taşikardinin indüklediği KMP)( 51). Ventriküler hızın kontrol altına alınmasıyla miyopati gri dönebilir, bu yüzden bu klinik durumun tanınması çok önemlidir. Ayrıca AF’de sol atrial ve ventriküler basınçların arasındaki ilişkinin bozulmasıyla mitral kapak fonksiyonu da bozulabilir ve durum ventriküler dolumu da bozabilir. Ventriküler hız kontrolü bu durumun da düzelmesini sağlayabilir. 16 Tromboembolizm: Ġskemik inme ve ya sistemik arteriel embolizm genellikle atrial trombüse bağlı düşünülse de tromboembolizm patogenezi karmaşık bir konudur. AF’li hastalarda oluşan inmenin %25’i, serebrovasküler hastalık, diğer kardiyak emboli kaynakları ve ya aortadaki ateromatöz patolojiden kaynaklanır(89,90). Ġlişkili risk faktörlerine bağlı olarak AF’de yıllık inme riski %3 ila %8 arasındadır(43). AF’de görülen trombotik olay genellikle sol atrial apandagede(LAA) oluşur ve trans torasik ekokardiyografi(TTE) ile nadiren görülebilir(91). Transözafagial ekokardiyografi(TEE) LAA’yı değerlendirmek için daha elverişlidir(92). Genel klinik görüş, LAA trombüs oluşumu için AF’nin 48 saat ve ya daha uzun süredir olması gerektiği yönünde olsa da, TEE ile daha kısa süre oluşmuş trombüs formasyonları tespit edilmiştir(93,94). Trombüs oluşumu Virchow triadı (hiperkoagülabilite, staz, endotel disfonksiyonu) ile başlar. TEE ile yapılan çalışmalar göstermiştir ki, azalmış LAA akımı, sol atrial mekanik kontraksiyon kaybı ile ilişkilidir. Başarılı bir elektriksel ve ya farmakolojik kardiyoversiyon ardından oluşabilen tromboembolik olaylardan sorumlu durumun da LAA’da oluşan stunning olduğu düşünülmektedir(95). Ayrıca CRP seviyeleri de AF’li hastalarda normale göre yüksektir ve bu durum artmış inme riski ile de ilişkilidir(96,-98). Klinik bulgular: AF’nin klinik sunusu altta yatak kardiyak hastalık olup olmamasına göre değişkenlik gösterir. AF atakları kendiliğinden sonlanabildiği gibi tıbbi müdahaleyi de gerektirebilir. AF kendini, çarpıntı hissi, hemodinamik ve ya tromboembolik bulgularla gösterebilir ve ya tesadüfen takiplerde yakalanabilir. Bazı hastalarda ilk bulgu KY semptomlarının ağırlaşması şeklinde de olabilir. Atrial natriüretik peptid(ANP) salınımındaki artışa bağlı 17 olarak özellikle AF atağının başlangıç ve sonlanma dönemlerine poliüri ortaya çıkabilir. AF için nadir bir bulgu olan senkop ise özellikle hemodinamiyi bozan hızlı ventrikül yanıtında, hipertrofik KMP’de, aort stenozunda ve ya aksesuar iletim yolu olan hastalarda görülebilir. Klinik değerlendirme: AF tanısı anamnez ve fizik muayeneye dayanır ve EKG ile desteklenir, bazı durumlarda ise telemetri ve ya ambulatuar EKG kaydına başvurulur. Hastanın öncelikli değerlendirmesinde AF’nin persistan mı paroksismal mi olduğu, herhangi bir etkenle tetiklenip tetiklenmediği ve altta yatabilecek kardiyak patolojiye yönelik olmalıdır. Fizik muayene ile saptanabilecek bulgular ise, düzensiz nabız, düzensiz juguler venöz dalgalar, birinci kalp sesinin değişken sertliği ve ya sinüs ritminde iken duyulup sonradan kaybolan dördüncü kalp sesidir. Muayene ayrıca ilgili kapak hastalığı, KY veya KMP ile ilgili ipuçları verebilir. Tanısal testler: AF’nin tanısı en az bir kere dökümante edilmiş AF’li EKG kaydı gerektirir. Göğüs rontgenogramı kalp gölgesinin büyüklüğünü tespit edebilir ancak, pulmoner patoloji ve ya pulmoner arter yapılarıyla ilgili daha değerli bilgiler sağlayabilir. Ancak öncelikli olarak AF’li hastaların ekokardiyografik değerlendirilmesi gerekir. Sol ventrikül sistolik ve diastolik fonksiyonların değerlendirilmesi antiaritmik veya antitrombotik tedavinin seçimi için ayrıca önemlidir. Rutin biyokimyasal testler içinde özellikle karaciğer, böbrek ve tiroid fonksiyonları, serum elektrolitleri ve hemogram mutlaka değerlendirilmelidir. 18 Sınıflama: AF sınıflaması altta yatan kalp hastalığı, ventrikül hızı, elektrofizyolojik özellikler ve aritmi süresine göre yapılabilir (99). AF’nin farklı klinik özelliklerini tanımlayan terminolojilerin çokluğu ve tanımlamalar arasındaki uyumsuzluklar iletişimi ve klinik çalışmaların sonuçlarını karşılaştırmayı güçleştirmektedir. Bu sorunu çözümlemek amacı ile Avrupa Kardiyoloji Cemiyeti Aritmi Çalışma grubu ve Kuzey Amerika Pacing ve Elektrofizyoloji Cemiyeti bir çalışma grubu kurmuş ve AF terminolojisi ile sınıflaması hakkında bir fikir birliği oluşturmaya çalışmışlardır (100). Bu grubun oluşturduğu terminolojiler 30 saniyeden uzun süren ve reversible bir nedene bağlı olmayan AF atakları için geçerlidir. Reversible nedenlere bağlı olan ‘sekonder AF’ akut miyokart enfarktüsü, kalp cerrahisi, perikardit, myokardit, hipertiroidi, pulmoner emboli, pnömoni veya akut pulmoner akciğer hastalığına bağlı AF’dir. Genellikle de neden ortadan kaldırılınca AF atağı tekrarlamaz. Bu durumların dışında olan AF heterojen bir kliniğe sahiptir. Belirlenebilir bir kalp hastalığı veya klinik semptomlar bulunabilir veya olmayabilir. AF atağı kendiliğinden sonlanabilir veya sonlandırılması için tıbbi müdahale gerekebilir. Her hastada uygun tedaviye karar verebilmek için AF’nin klinik tipini sınıflamak gerekmektedir. Eğer hastada iki kez veya daha fazla atak meydana gelmişse AF’nin rekürran AF olduğunu söylemek mümkündür. Paroksismal AF atakları genellikle 48 saat içerisinde veya tanıma göre 7 günden kısa sürede kendiliğinden sonlanır. Eğer AF atağı 7 günden uzun sebat ettiyse persistan AF olduğu belirtilir. Bu durumda farmakolojik tedavi veya elektriksel kardiyoversiyon ile AF’yi sonlandırmak gerekebilir. Eğer AF bir süredir devam ediyorsa ve kardiyoversiyon ile sonlanmazsa ya da sonlandıktan sonra 24 saat içinde tekrarlarsa kalıcı veya permenant AF’den bahsedilir. Kardiyoversiyon endikasyonu bulunmayan ve/veya 19 denenmemiş ve/veya hasta tarafından istenmeyen uzun süreli AF olguları da permenant AF grubuna girer. Tedavi: AF’nin kendiliğinden sonlanması sık rastlanan bir durumdur. Ġlk kez AF atağı gelişen hastaların %70’inde ritim sinüs ritmine döner. Spontan dönüşlerin sıklığı atriyal remodeling nedeni ile sonraki ataklarda giderek azalır. Ritim Kontrolü: AF’nin kardiyak hemodinami üzerinde çeşitli etkileri vardır; ventrikül doluşuna atriyal katkının ortadan kalkması, sol ve sağ ventrikülde diyastol sonu basıncının ve hacmin düşmesi, atriyumlarda ortalama diyastolik basıncın artması, pasif diyastolik doluş süresinin kısalması ve muhtemelen atriyoventriküler kapaklarda yetersizlik gelişmesidir (101). R-R intervalinin düzensizleşmesi kalp debisini belirgin derecede azaltabilir, pulmoner kapiller wedge basıncını ve sağ atriyum basıncını arttırarak kalp hızından bağımsız, olumsuz hemodinamik sonuçları oluşturur. Bu nedenle sinüs ritminin sağlanması özellikle geçmiş yıllarda yaygın şekilde desteklenmiştir. Ancak AF kronik bir hastalık olduğundan, ister paroksismal ister persistan AF olsun hastaların çoğunda tekrarlama riski yüksektir. Sinüs ritminin sağlanması ve korunmasına karar verilen hastalarda antiaritmik ilaçların başlanması yakın takip ve hastaneye yatış gerektirir. Bunun nedeni torsades de pointes gibi proaritmilerin riskinin farklı ilaçlar arasında değişmesi, özellikle yapısal kalp hastalığı olan hastalarda antiaritmik ilaçlardan kaynaklanan proaritmi ve ani kardiyak ölüm riskinin göz önünde bulundurulması gereğidir. AFFIRM çalışması sıklıkla sinüs ritminin AF ritmine göre avantajı olmadığı şeklinde yorumlanmaktadır. Bu yanlış anlaşılmayı gidermek için çalışmadaki 3677 hastanın verisi retrospektif olarak değerlendirilmiş ve sağ kalım ile belirleyicileri arasındaki ilişki intention- 20 to-treat analizi yerine on-treatment analiz kullanılarak incelenmiştir (102). Bu analizde düşük mortalite ile bağımsız olarak ilişki bulunan iki değişken sinüs ritmi ve warfarin kullanımıdır. Yüksek mortalite ile ilişkili belirleyiciler ise KAH, KKY, DM, sol ventrikül disfonksiyonu, inme, geçici iskemik atak ve ritim kontrol edici ilaç kullanımıdır. Bu bulgular günümüzde kullanılan antiaritmik ilaçların olumsuz etkilerinin sinüs ritminin getirdiği avantajları ortadan kaldırdığını göstermektedir. Klas-1: 1) Persistan ve ya permenant AF’si olan hastalarda kalp hızı ölçümü yapılmalı ve b-bloker veya nondihidropiridin kalsiyum kanal antagonistlerinin kullanımı ile hız kontrolü tavsiye edilir. 2) Akut başlangıçlı ve preeksitasyonun eşlik etmediği hastalarda AF’nin ventriküler hızını kontrol altına almak için, intravenöz(ĠV) b-bloker (esmolol, metaprolol veya propranolol) veya nondihidropiridin kalsiyum kanal antagonistleri (verapamil, diltiazem) uygulanması tavsiye edilir. 3) AF’si ve KKY olan hastalarda hız kontrolü için ĠV digoksin veya amiodarone tavsiye edilir. 4) AF’si, KKY, sol ventrikül disfonksiyonu olan ve sedanter bireylerde kalp hızını kontrol etmekte oral digoksin oldukça etkilidir. Klas-2a: 1) AF’li hastalarda hem egzersiz hem de istirahatte kalp hızı kontrolü için digoksin ile bbloker veya nondihidropiridin kalsiyum kanal antagonistleri kombinasyonu kullanılabilir. Doza bağlı bradikardiye dikkat etmek gerekir. 2) Diğer uygulamaların başarısız veya kontrendike olduğu AF’li hastalarda ĠV amiodarone hız kontrolünde AF’li hastalarda oldukça etkilidir. 21 3) Aksesuar yolu olan AF’li hastalarda elektriksel kardiyoversiyon uygulanması gerekmiyorsa ĠV prokainamide ve ya ubitilide alternatif tedavidir. 4) Farmakolojik tedavinin başarısız olduğu ve ya yan etkiler nedeniyle kullanılamadığı durumlarda A-V nod ablasyonu kabul edilebilir bir yöntemdir. Klas-2b: 1) Eğer kalp hızı egzersiz ve ya istirahatte, b-bloker, nondihidropiridin kalsiyum kanal antagonisti veya digoksinin tek başlarına veya kombine kullanımlarına rağmen düşürülemezse, oral amiodarone kalp hızı kontrolünde faydalı olabilir. 2) Ġ.V prokainamide, disopramide, ubitilide veya amiodarone aksesuar yolu olan AF’li hastalarda hemodinamik bozulma yoksa uygulanabilir. 3) Eğer kalp hızı farmakolojik ajanlarla kontrol altına alınamıyorsa ve taşikardinin indüklediği kardiyomiyopatiden şüpheleniliyorsa A-V nodun kateter ablasyonu uygulanabilir. Klas-3: 1)Hızlı ventriküler cevaplı paroksismal AF’de dijitaller tek ajan olarak kullanılmamalıdır. 2)AF’si olan ve dekompanse KY’deki olgularda nondihidropiridin kalsiyum kanal antagonistleri hemodinamiyi bozacağı için kullanılmaları tavsiye edilmemektedir. 3)Preeksitasyon sendromu ve AF’si olan hastalarda ĠV digital ve nondihidropiridin kalsiyum antagonistleri paradoksik olarak ventriküler cevabı arttıracakları için kullanımları tavsiye edilmez. 4)A-V nodun kateter ablasyonu, medikal tedavi ile hız kontrolü denenmeden yapılmamalıdır. ACC/AHA/ESC Guidelines 22 B-blokerler: Hızlı ventriküler cevaplı AF’nin hız kontrolünde intravenöz b-blokerler (propranolol, atenolol, metoprolol, esmolol) etkilidirler. Bu ajanlar özellikle yüksek adrenerjik deşarjın olduğu post operatif(post-op) AF gibi durumlarda etkilidir. Non kardiyak cerrahiden sonra intravenöz esmololün AF’yi sinüs ritmine çevirmede diltiazeme göre daha etkili olduğu gösterilmiştir. (103) Nadolol ve atenolol test edilen b-blokerler arasında en etkili olanlar olarak gösterilmiştir. B-bloker alan hastaların istirahat halindeki ve egzersiz sırasındaki kalp hızlarının normale göre yavaşladığı gösterilmiştir.( 104). Sotalol, non selektif bir b-blokerdir ve grup-III antiaritmik sınıfındadır. Özellikle AF’nin tekrarladığı durumlarda endikasyonu güçlüdür(99). Egzersiz sırasında metaprololden daha düşük bir kalp hızı sağlar. Egzersizin indüklediği taşikardide atenolol, metaprolol ve satolol digoksine göre daha iyi bir hız kontrolü sağlayıcısıdır. The atrial fibrillation follow-up investigation of rhythm management (AFFIRM) çalışmasına göre digoksin kullanılsın veya kullanılmasın kalp hızı kontrolünde bblokerler %70 başarı sağlamış ve %54 başarı sağlayan kalsiyum kanal blokerlerine üstünlüğü gösterilmiştir(100). Konjestif kalp yetmezliği ve düşük ejeksiyon fraksiyonu (EF) olan AF’li hastalarda b-blokerler başlangıç tedavisinde dikkatli kullanılmalıdır. Nondihidropiridin kalsiyum kanal antagonistleri: Nondihidropiridin kalsiyum kanal antagonistleri verapamil ve diltiazem AF’de yaşam kalitesini ve egzersiz toleransını düzeltmek amacıyla çok yaygın olarak kullanılmaktadır. Her iki ilacın ĠV bolus enjeksiyonları ventriküler hız kontrolünde oldukça etkilidir(101,104). Bu ilaçların kısa etki süreleri nedeniyle hız kontrolünün devamını sağlamak amacıyla sürekli ĠV infüzyon tedavisi gerekebilir. 23 Bu ilaçların negatif inotropik etkileri nedeniyle sistolik disfonksiyonu ve KKY olan hastalarda kullanımında dikkatli olunması ve kullanımından kaçınılması gerekmektedir. Sekiz randomize çalışmada kalsiyum kanal antagonistleri ile plasebo karsılaştırılmış ve kalsiyum kanal antagonistlerinin belirgin bir şekilde kalp hızını azalttığı gösterilmiştir(102). Verapamil kullanımının istirahat halindeki kalp hızını dakikada 8-23, egzersiz sırasında ise dakikada 20-33 atım azalttığı gösterilmiştir. Verapamil ile diltiazem karşılaştırılmasında ise benzer etkinlik gösterdikleri kanıtlanmıştır(105). Verapamil ve diltiazem kronik obstriktif akciğer hastalığı (KOAH) ve bronkospazmı olan hastaların uzun süreli tedavilerinde hız kontrolünde tercih edilen ajanlardır. Digoksin: Na-K ATP’az enzimini inhibe eder. Bu enzim repolarizasyon sırasında Na+’u dışarı, K+’u içeri taşır. Enzim inhibisyonuyla Na+ ve K+’un aktif transportu durur. Hücre içi K+ azalır, daha az negatif istirahat potansiyeli oluşur. Faz-4 depolarizasyonun eğimini arttırır ve iletim hızını düşürür. Terapotik dozlarda sinüs uyarısını azaltır, atriyum, ventrikül ve purkinje liflerinin uyarılabilirliğini ve iletim hızını azaltır. Atriyum ve A-V düğümde refrakter periyodu azaltır. Aksesuar yolda antegrad iletimi arttırır. Toksik dozlarda A-V bloğa neden olabilir. Klinikte AF ve atrial flutterde hızlı ventriküler cevabı inhibe etmek için kullanılır. Egzersiz ve sempatik tonusu artmış hastalarda digoksin tek başına ventrikül cevabını kontrol edemeyebilir, b-blokerlerle kombine edilebilir. Digoksinin ana dezavantajı etki başlangıcının nispeten yavaş olması ve yan etkileridir. Gastrointestinal sistem ve santral sinir sistemi belirtileri yanı sıra en önemli yan etkisi taşikardi ve iletim blokları oluşturması, ventriküler taşikardi (VT) ve ventriküler fibrilasyona (VF) gibi aritmilere neden olabilmesidir. 24 Amiodarone: Amiodarorone’nun sempatolitik ve kalsiyum antagonistik özellikleri mevcuttur. A-V ileti sistemini deprese eder. AF’li hastalarda ventriküler hızı kontrol etmekte oldukça etkindir. Bilinen tedavi rejimlerine dirençli hızlı atrial taşiaritmilerde intravenöz amiodarone, iyi tolere edilen bir ajandır(106). Yapılan bir çalışmada, oral amiodarone egzersiz kapasitesini, yaşam kalitesini ve AF’nin semptomlarını etkilemeksizin AF’de ventriküler cevabı azaltmıştır(107). Yüksek doz oral amiodarone tedavisi KKY ve hipotansiyonlu hastada hemodinamiyi bozup kalp yetmezliğini dekompanse hale getirebilmektedir(108). Amiodaronun pulmoner fibrozis, hepatik hasar ve proaritmi gibi fatal seyredebilecek yan etkileri olabilir. Kardiyoversiyon: Kardiyoversiyon farmakolojik veya elektriksel yöntemlerle AF’nin sinüs ritmine döndürülmesidir. Medikal tedaviye yanıt vermeyen, miyokardiyal iskemiye, semptomatik hipotansiyona, anjinaya veya kalp yetmezliğine yol açan hızlı ventrikül yanıtlı AF durumlarında R dalgasıyla senkronize direkt kardiyoversiyon uygulanması endikedir. Aksesuar yol varlığında gelişen ve hemodinamiyi etkileyen hızlı ventrikül yanıtlı AF durumunda da kardiyoversiyon yapılmalıdır. Kardiyoversiyon öncesi uygulanan amiodarone, flekainid, ibutilide ve propafenon tedavileri kardiyoversiyon başarısını arttırmada ve reküren AF gelişimini önlemede etkili olabilir. Dijital intoksikasyonu ve hipokalemi durumlarında elektiriki kardiyoversiyon kontrendikedir. Hastaların uygun dozlarda antikoagulan tedavisi en kısa sürede başlanmalıdır. Özellikle 7 günden uzun süren AF durumunda kardiyoversiyonun başarı şansı belirgin olarak azalmaktadır. Genel olarak farmakolojik kardiyoversiyonun başarısı elektiriki kardiyoversiyona göre daha düşüktür. AF ataklarının %70’lik bir bölümünün 3 gün içinde 25 kendiliğinden sinüs ritmine dönmesi farmakolojik ajanlarının kardiyoversiyon başarısının değerlendirilmesini zorlaştırmaktadır. Flekainid, dofetilid, propafenon ve ibutilide tedavisi farmakolojik kardiyoversiyonda ilk tercih ilaçlardır. Amiodarone tedavisi de etkilidir. Digoksin ve sotalol kardiyoversiyon için uygun değildir. Oral propafenon, flekainid veya amiodarone tedavisi, etkinliği ve güvenilirliği saptanmış bireylerde hastane dışında da uygulanabilir. Bu ilaçlar b-bloker veya kalsiyum kanal blokerleriyle kombine edilmelidir. AF’de Antikoagülasyon: Tromboemboli riski AF atağı başladıktan 48 saat sonra artar. Eğer bu süre içerisinde sinüs ritmi sağlanamamışsa antikoagülan tedavi başlanmalıdır. Tedavi yaklaşımı olarak ritim kontrolüne karar verilmişse sinüs ritmine döndürülen hastalarda antikoagülan tedaviye 4 hafta süreyle devam edilmelidir. Birçok büyük çalışmada oral antikoagülan tedavinin plasebo ile karşılaştırıldığında inme riskini %61 azalttığı bulunmuştur (106). Kanama riski yılda %0,52,8’dir. Warfarinin 2,0-3,0’lık bir INR değeri oluşturulacak şekilde verilmesi inmeye karşı koruma sağlar. Warfarin kullanan hastaların diğer hastalıkları da varsa beraber kullandıkları ilaçlara da dikkat etmek gereklidir. Hastaların tedaviye uyumu çok ama çok önemlidir. Atriyal Fibrilasyonda Ġlaç DıĢı Tedavi: AF’li hastaların birçoğunda farmakolojik tedavinin yetersiz olması sonucu ortaya çıkan cesaret kırıcı bulgulardan hareketle, AF’yi tamamen ortadan kaldırmaya yönelik alternatif arayışlar artmış ve cerrahi tedavi yöntemleri araştırılmaya başlanmıştır. Bunlar: o Atriyal pacing o Endokardiyal kateter ablasyonu ve o Cerrahidir. 26 Atriyal pacing: AF ataklarının kronik AF’ye dönüşümünün engellenmesinde pacing yöntemi, yalnız bradikardisi olan hastalarda etkili olabilmektedir. Endokardiyal kateter ablasyonu: Diğer kardiyak aritmilerin ve özellikle aksesuar iletim yollarının tedavisinde yaygın olarak kullanılmaktadır. Bu yöntemde prensip aritmi devresi ve kaynağının ablasyonudur. Ancak kateterle uzun çizgisel lezyonlar yaratılmasındaki zorluklar, pulmoner ven stenozu ve işleme bağlı tromboembolik komplikasyonlar bu işlemin AF tedavisinde yaygın kullanımını şimdilik sınırlamıştır. Gelişmekte olan teknoloji ile kateter ablasyonu ileride tek başına AF’li olguların tedavisinde önemli rol oynayabilir. Cerrahi Tedavi: Birçok cerrahi tedavi yöntemi uygulanmış olmasına rağmen günümüzde uygulanan ve AF tedavisinde en başarılı yöntem olarak kabul edilen işlem modifiye Maze prosedürü‘dür. 27 KORONER ARTER BY-PASS CERRAHĠSĠ VE ATRĠAL FĠBRĠLASYON AF kalp cerrahisi sonrasında sık görülen bir aritmi olmakla birlikte mortalite ve morbiditede artışa sebep olmaktadır. Cerrahi ve anestezideki gelişmeler sonrası miyokard korunmasındaki ilerlemelere karşın AF sıklığında önemli bir azalma olmamıştır. Post-op dönemde AF gelişen hastalarda peroperatif MI, KKY ve solunum yetmezliği gelişme sıklığı artmıştır (107). Post-op AF, uzamış yoğun bakım süresi, uzamış hospitalizasyon ve maliyet artışına sebep olmaktadır (108). Kardiyak cerrahi sonrası gelişen AF kesin insidansı bilinmemekle birlikte değişik yayınlarda %5 ile %40 arasında değiştiği bildirilmiştir (2-4). Bu rapor edilen insidans aralığının geniş olmasının sebebi, çalışmalarda değerlendirilmiş olan hasta dağılımı, cerrahi tipi ve AF’nin tanım ve tespitinin çok farklı olmasından kaynaklanmaktadır. Ġzole koroner cerrahi sonrasında görülen AF insidansı, izole kapak cerrahisi ya da kombine koroner cerrahi+kapak operasyonlarına göre daha azdır. Post-op AF sıklıkla ilk 5 günde ortaya çıkar. Post-op 2. ve 3. günlerde görülme sıklığı en yüksektir (108,109). Klasik bilgi olarak AF bir veya birkaç hızlı depolarizan odaktaki artmış otomatisiteye ve bir ve ya daha fazla döngü içeren reentran akımlara bağlanmıştır (110,111). Koroner cerrahi sonrası AF görülmesinin sebebi net olmamakla birlikte multifaktöriyel olduğu düşünülmektedir. Muhtemelen anormal atrial dokudaki belirli uyarı epizodlarının öncü olduğu düşünülmektedir. Birçok hasta yaşa bağlı olarak atriyum dokusunda dejeneratif değişiklikler göstermektedir. Post-op periyotta elektrofizyolojik paremetrelerde değişikliğe neden olabilecek bu öncü uyarılar AF gelişimine neden olabilir (112). Özellikle post-op dönemde görülen artmış katekolamin seviyesinin anahtar rol oynadığı düşünülmektedir (113). Koroner cerrahi sonrasındaki AF yüksek oranda spontan olarak normale dönmesi nedeni ile 28 çok spesifiktir. Çoğu hasta ilk 24 saatte, %90’dan fazlası ise 6-8 hafta içinde normal sinüs ritmine döner (114). Kalp cerrahisi ile ilişkili olmayan AF’nin normal sinüs ritmine dönme olasılığı çok düşüktür. Kalp cerrahisi sonrasında AF’nin gelişiminde rol oynayan risk faktörleri çeşitli çalışmalarda değerlendirilmiştir. En belirgin bulunan risk faktörleri ileri yaş, kapak hastalığı, dilate atriyum, (preoperatif)pre-op dönemde atriyal aritmi olması ve kronik akciğer hastalığıdır (109,111). Ayrıca fonksiyonel ileti bloklarının varlığı, atriyum duvarındaki cerrahi travmaya bağlı steril inflamasyon, KAH’ın yaygınlığı, sinoatrial ve A-V nod arterlerinin tutulumu ve yapılan bypass sayısı da risk faktörleridir (115). Post-op Atriyal Fibrilasyon Riskini Arttıran Faktörler: *Ġleri Yaş Grubu -Kapak hastalığı -Sol atriyumda dilatasyon -Preoperatif atriyal taşiaritmi -Geçirilmiş kalp cerrahisi -Preoperatif digoksin kullanımı *Kronik Akciğer Hastalık Grubu -Artmış post-op adrenerjik tonus 29 -Beta blokerlerin kesilmesi -Perikardit -Hipokalemi -Hipomagnezemi Postoperatif Atriyal Fibrilasyonun Önlenmesindeki Öneriler(ACC/AHA/ESC Guidelines): Klas 1: 1-Kontrendike değil ise b-bloker kullanılması 2-Post-op AF’de hız kontrolünün A-V nodu bloke eden ajanlarla sağlanması Klas 2 Öneriler: 1-Riskli hastalarda profilaktik sotalol ve amiodarone kullanımı 2-Sinüs ritmine döndükten sonra sinüs ritminin korunması amacıyla ibutilide kullanılması ya da kardiyoversiyon 3-Reküren ya da refrakter post-op AF’de, koroner arter hastalığında AF gelişmiş gibi tedavi 4-Antitrombotik tedavi mutlaka eklenmelidir (115). 30 PERĠODOTĠTĠS Periodontitis, diş çevresi dokularda bakteriyel birikme ve ya diş plağı oluşumu nedeniyle gelişen inflamatuar bir süreçtir. Bakteriyel birikim ise vücutta inflamatuar bir yanıta neden olur. Dişetinin kronik ve progressif bakteriyel infeksiyonu, alveolar kemik yıkımına ve doku ataşman kaybına neden olur. Perodontal hastalık, kolayca tedavi edilebilen gingivitten geri dönüşümsüz periodontitise kadar değişen birçok evre ve klinik duruma ayrılır. Sigara kullanımı, sistemik hastalıklar, bazı ilaçların kullanımı (steroidler, antiepileptikler, bazı kemoteröpatikler, oral kontraseptifler gibi), dişlerdeki kırıklar ve hamilelik gibi bazı faktörler periodontal hastalığın ilerlemesine yol açabilir. Ayrıca hastada immün sistemi etkileyen DM, nötrofil bozuklukları ve HIV infeksiyonu durumlar da hastalığın ilerlemesine katkıda bulunur. Ülkemizde periodontal hastalık sıklığıyla ilgili geniş çaplı epidemiyolojik bir çalışma bulunmamaktadır. Amerika Birleşik Devletleri’nde yapılan çalışmalarda popülasyonun %75’inde gingivitis görülmüştür(136). Ayrıca bu ülkede orta seviyede hastalığın %30, ilerlemiş hastalığın oranının ise %10 civarında olduğu saptanmıştır(137). Orta ve ileri seviyedeki hastalıkta semptomlar gingivitis ile benzerdir fakat bakteri toplanması ve belirgin inflamatuar yanıt oldukça baskındır. Cep kaybı derinliği ölçümü, periodontal hastalığın yaygınlığını belirlemede iyi bir belirteçtir. Sağlıklı bir periodontiyumda epiteliyal ataşman kaybı görülmez ve periodontal cep derinliği 2mm’yi geçmez(138). Periodontal cep derinliği, 4 ile 12mm arasında değişebilir. Klinik olarak cep derinliği 4 veya daha üzeri değerler periodontitis tanısı alır. 6mm’den fazla derinliğe sahip hastalara ise ileri veya ciddi periodontitis tanısı konur. Dişeti kanaması veya ataşman kaybının minimal semptomları çoğu hasta tarafından önemsenmez ve tedaviye 31 gereksinim duymazlar. Ancak tedavi edilmemiş gingivit geri dönüşümsüz periodontitise ve hatta diş kaybına yol açabilir. Tanı konduktan sonra birçok periodontal hastalık tedavi edilebilir. Tedavideki amaçlar ise, bakteriyel kaynağı bulmak ve elimine etmek, risk faktörlerini eğer mümkünse kontrol altına almak ve böylece hastalığın ilerlemesini engelleyip, periodontal dokuların sağlıklı kalmasını sağlamaktır. Bundan sonraki adım ise, rekürrensleri önlemektir. Son olarak ciddi seviyedeki vakalarda periodontal ataşman rejenerasyonunu sağlamaya uğraşılmalıdır. Cerrahi dışı tedavilerde ilk adım özel temizleme yöntemleri, antiseptiklerle ağız gargarası gibi yardımcı yöntemlerin kullanılmasını içerir. Çoğu durumda antibiyotik tedavisi de gereklidir. Tetrasiklin veya amoksislin metronidazol kombinasyonu antibiyoterapide birçok defa geniş bir spektrum sağlar. Antibiyoterapi ile beraber cerrahi tedavi periodontal hastalığın tedavisinde oldukça yarar sağlar. Periodontal cep derinleşmesi veya alveolar kemik kaybı kontrol altına alınamıyorsa cerrahi tedavi genelde gereklidir. Cerrahi tedavinin esasını alveolar kemik kaybını önlemek için inflamatuar dokuların uzaklaştırılması oluşturur. Bakteriyel plağı oluşturan komponentler, lenfosit, makrofaj ve polimorfonükleer lökosit gibi inflamatuar hücrelerin infiltrasyonuna neden olurlar. Bakteriyel komponentlerden özellikle lipopolisakkaridler makrofajları aktive ederek IL-1, TNF-α, prostoglandinler hidrolik enzimlerin sentezine neden olurlar. Benzer şekilde bakteriyel ürünler T lnfositlerini aktive ederek IL-1 ve lenfotoksin gibi mediyatörlerin salınımına yol açarlar. Bu sitokinler proinflamatuar katabolik etkileri oluştururlar ayrıca, metalloproteinazlar gibi kollojenolitik enzimlerle periodontal doku yıkımında önemli rol oynarlar(139). Geçtiğimiz 3 dekad boyunca periodontal hastalığın etyopatogenezine yönelik birçok bilgi edinilmiştir. 500’den fazla bakteri ve virüs çeşidinin hastalıkla ilişkisi saptanmıştır. 32 Son yıllarda pek çok hastalık ve sistemik bozuklukların peiodontitis ile ilişkisi araştırılmıştır. KAH, DM, düşük doğum ağırlığı ve osteoporoz gibi durumlarla periodontitis arasında güçlü ilişki olduğu saptanmıştır. Periodontal infeksiyondan sorumlu infeksiyöz ve fırsatçı mikroorganizmaların vücudun geri kalanına da belirgin bir etki bıraktıkları görülmektedir. Ayrıca bu mikroorganizmalar inflamatuar bir yanıta neden olabilen en önemli sebeptir. Periodontal lezyonlar bakteriyel antijenler, gram negatif bakteriler, sitokinler ve diğer proinflamatuar mediyatörlerin sistemik yayılımına yol açan devamlı yenilenen rezervuarları gibi hareket etmektedirler(140,141). ATRĠAL FĠBRĠLASYON VE ĠNFLAMASYON AF gelişiminde inflamasyonun rol oynayabileceği fikri, ilk olarak kardiyak operasyon sonrasında AF gelişen hastalarda CRP ve diğer inflamasyon markerlarının yüksek saptanması üzerine ortaya çıkmıştır (116). Persistan AF’si olan hastalarda paroksismal AF’lilere göre daha yüksek CRP seviyesi saptanırken (0,34 mg/dl’ye 0.18 mg/dl); bu iki gruptaki değerlerin kontrol grubuna göre daha yüksek olduğu görülmüştür (0.096 mg/dl) (117). Ronnier ve ark. 5806 kişi üzerinde yaptıkları ortalama 7 senelik takip sonucunda CRP değerleri yüksek olan hastalarda AF gelişme riskinin 1.3 kat daha fazla olduğunu bildirmişlerdir(118). Yine inflamasyon göstergeleri olan CRP ve IL-6 düzeyleri yüksek olan hastalarda daha sık olarak AF atağı geliştiği bildirilmiştir(119). Kardiyak cerrahi geçiren hastalarda IL-6 geninin 174G/C polimorfizminin AF gelişme riskini arttığı belirtilmiştir(120). Maixent ve arkadaşları paroksismal AF’li hastaların serumlarında myosin ağır zincirine karşı antikorlar saptanmışlar ve AF gelişiminde otoimmunitenin önemli olabileceğini bildirmişlerdir(121). AF’li hastalardan alınan atriyum biyopsilerinde de inflamasyon ve oksidatif zedelenme uyumlu bulgular saptanmıştır. Frustaci ve arkadaşlarının yaptığı çalışmada lone AF’li 12 33 hastanın tamamında atriyum dokusu histolojik olarak anormal saptanmış ve %66’sında subklinik myokardit gösterilmiştir(122). Renin-Anjiyotensin Sisteminin (RAS) de AF gelişimine katkısı olduğu gösterilmiştir. Özellikle anjiyotensin-II, sitokinlerin, adezyon moleküllerinin ve selektinlerin sentezini arttırır. Atriyal dokudaki anjiyotensin-II reseptörlerinin artışı hücre ölümü ve lökosit infiltrasyonuna yol açmaktadır(123). RAS gen polimorfizminin de AF gelişiminde etkili olduğu gösterilmiştir(124). Inflamasyon markırlarının hastalarda embolik hadiseleri belirlemede etkili olabileceğini ilk olarak Conway ve ark. bildirmişlerdir. Yüksek IL-6 seviyesinin AF’li hastalarda SVO ve ölüm için bağımsız belirleyici olduğunu saptamışlardır(125). RAS’ı etkileyen ACE inhibitörleri ve anjiyotensin reseptör blokerlerinin (ARB) AF gelişimini ve rekürensleri etkileyebileceği hipotezine dayalı çalışmalar yapılmıştır. Healey ve ark. 11 çalışmanın alındığı bir meta-analiz yayınlamışlar ve ARB/ACE inhibitörü tedavisinin AF gelişme riskini %28 azalttığını yazmışlardır(126). Yine anti-inflamatuvar özellikleri ile dikkat çeken HMG-CoA redüktaz inhibitörlerinin persistan lone AF’si olan hastalarda kardiyoversiyon sonrası kontrol grubuna göre rekürensleri azalttığı saptanmıştır(127). AF ve inflamasyon ilişkisinin inceleyen çalışmaların büyük çoğunluğu inflamasyon düzeyini göstermede serum (CRP) ve yüksek duyarlıklı CRP (hs-CRP) düzeylerini kullanmışlardır. 34 MATERYAL METOD Amaç: Çalışmamızda toplumda sık olarak görülen ve kronik inflamasyon nedeni olan periodontitisin, inflamasyonla ilişkisi bilinen post-op AF ile ilişkisini değerlendirmektir. Hasta seçimi: Çalışmamıza Dr. Siyami Ersek Göğüs Kalp Cerrahisi Merkezi’ne şubat 2008 ve ekim 2008 koroner arter cerrahisi uygulanmak üzere başvuran hastalardan belirlediğimiz kriterlere uyan 96 hasta dahil edildi ve hastalar prospektif olarak izlendi. Hastaların çalışmaya dahil edilmeme kriterleri: Daha önce kardiyak cerrahi uygulanmış hastalar Organik kalp hastalığı olanlar(KMP, miyokardit, perikardit, endokardit, tümör) Daha öncesinde aritmi hikayesi olanlar(AF, ventriküler taşikardi, ventriküler fibrilasyon,A-V blok) Ġmmün sistem hastalığı veya malignitesi olanlar Metabolik hastalığı olanlar(hiper-hipotiroidi, elektrolit bozukluğu,kronik böbrek yetmezliği, romatoid artrit, sistemik lupus eritematozus, cushing, vs..) Kalp kapak hastalığı olanlar Kalıcı pil veya ICD’si olanlar Kronik obstrüktif akciğer hastalığı olanlar 35 Sol atrium çapı>4,5cm olanlar Beating heart tekniği ile opere edilenler. Hastaların operasyon öncesi değerlendirmesinde ayrıntılı anamnez alındı ve fizik muayene uygulandı. Hastalara rutin biyokimyasal laboratuar testler uygulandı, ekokardiyografi ve anjiyografi bulguları değerlendirildi. Post operatif dönemde hastalar, günde en az iki kere elektrokardiyografik olarak ve ayrıca yoğun bakımda monitörize olarak değerlendirildi, seyirde gelişen komplikasyonlar kaydedildi. Tüm hastalardan yazılı olarak aydınlatılmış onam alındı ve bu çalışma hastanemizin etik komitesi tarafından uygun görüldü. Değerlendirilen veriler: Hipertansiyon Diabetes mellitus Geçirilmiş miyokart infarktüsü öyküsü Geçirilmiş inme öyküsü Sigara, alkol kullanım öyküsü, kullandığı ilaçlar Ailede koroner arter hastalığı öyküsü(erkekler için <55 yaş, kadınlar için <65 yaş) Fizik muayenede, boy, ağırlık, bel çevresi, vücut-kitle indeksi, tansiyon arteriel, kalp tepe atımı, kardiyak oskültasyon bulguları Fonksiyonel kapasite Elektrokardiyografik bulgular: pre-op en az 1 kere, post-op günde en az 2 kere ve yoğun bakım monitörizasyonu ile 36 Anjiyografik bulgular: hasta damar sayısı, ventrikülografide duvar hareket kusuru Pre-op ekokardiyografik bulgular Pre-op biyokimyasal laboratuar testleri(12 saat süren açlık sonrası alınan kan örneklerinde değerlendirilmiştir): total kolesterol, LDL kolesterol, HDL kolesterol, VLDL kolesterol, trigliserit, BUN, kreatinin, açlık kan şekeri, SGOT, LDH, sodyum, potasyum, klorür, protrombin zamanı, yüksek duyarlıklı CRP (hs-CRP) Pre operatif dönemde periodontal muayene uygulandı (Dünya sağlık örgütü tarafından belirlenen The Community Periodontal Indeks of Needs (CPITN) sınıflamasına göre periodontitis sınıflandırıldı; skor 0: Herhangi bir tedaviye ihtiyaç yok, skor 1: Kişisel dental ve oral hijyen geliştirilmesi gerekli, skor 2: Profesyonel diş temizliği ve kişisel oral hijyenin geliştirilmesi gerekli, skor 3: Profesyonel diş, diş taşı temizliği ve kişisel oral hijyenin geliştirilmesi gerekli, skor 4: Daha kompleks tedaviden, infekte dokuların çıkarılmasına kadar giden tedavi uygulaması gerekli. Ciddi inflamasyonun izlendiği bu hastalar ileri periodontitis olarak adlandırıldı Post operatif yoğun bakımda kalış süresi Post operatif infeksiyon gelişimi Post-op MI ve ya inme Post-op 30 günlük mortalite 37 Operasyon ve post operatif takip: Tüm hastalara operasyondan 12 saat önce 10 mg diazepam oral ve operasyondan 30 dakika önce ameliyathaneye gelmeden 0,3 mg/kg midazolam ve 0,5 mg atropin sülfat intramusküler uygulanarak premedikasyon yapıldı. Hastalar ameliyathaneye alındıktan sonra elektrokardiyografi elektrodları takılarak V5 göğüs derivasyonu ve D II standart derivasyonu izlenecek şekilde monitörize edildi. Ardından arteryel oksijen satürasyonunun izlenmesi amacıyla pulse oksimetre probu sol el işaret parmağa takıldı. Uygun görülen bir periferik vene 16 veya 18 gauge kanül ile venöz, dominant olmayan üst extremitedeki (genelde sol üst extremite) radial artere 20 gauge kanül ile arteryel kateterizasyon yapıldı. Hasta genel anestezi aldıktan sonra steril şartlarda sağ internal juguler vene Seldinger metoduyla santral venöz kateterizasyon uygulandı. Anestezi indüksiyonunda 2 µg/kg fentanil sitrat, 3-5 mg/kg penthotal sodyum ve 0,1mg/kg pankuronyum bromür olarak i.v. yoldan verildi. Hastalar daha sonra entübe edildi (7,5–8-8,5 endotrakeal tüp ile) , ve ventilatöre bağlandı. Anestezi idamesi için KPB kullanılan hastalarda yüksek doz fentanil sitrat ve panküronyum bromid 1 saat aralıklarla verildi. Ġnhaler anestezik olarak gereğinde sevofluran kullanıldı. Hastanın ısı takibini yapmak üzere rektal ve özofageal ısı probları yerleştirildi. Median sternotomi yapıldı. Safen ven grefti ve kullanılacaksa LĠMA flebi hazırlandı. Perikard açılıp yapışık olmadığı görüldükten sonra tüm hastalar activated clothing time (ACT) 450 saniyenin üzerinde olacak şekilde heparinize edildi (300-400 U/Kg). ACT 15 dakikada bir kontrol edildi ve gerektiğinde ilave heparin (3000 ĠU) yapıldı. Aort ve sağ atriyum kanülasyonunu takiben KPB’ye girildi. Roller pump(COBE COX III, LAKEWOOD, CO 80215, USA) ve membran oksijenatörler (MEDTRONĠC TRĠLLĠUM, AFFĠNĠTY NT 541T, MĠNEAPOLĠS, USA) kullanıldı. Pompa prime içeriği; 20cc/kg Laktatlı Ringer solüsyonu, 38 2.5cc/kg %20 mannitol, 1cc heparin, prednol gerekirse 30mg/kg ve gerektiğinde aprotininden oluşuyordu. Pompa flowu 2,2 -2,4 L/m2/dakika idi. Hastalar 28-30°C’ye soğutuldu. Miyokart koruması için başlangıçta antegrad ve sonrasında devamlı olarak retrograd kan kardiyopleji uygulandı. Hastalar ameliyathaneden yoğun bakıma alındılar. Klinik olarak uygun kriterlere oluştuğunda ekstübe edildiler. Hastalara yoğun bakım ünitesinde 5 leadli monitör ile standart D-II derivasyonlarıyla sürekli EKG takibi yapıldı. Yoğun bakım süresince kan gazı, biyokimyasal testler klinik bulgular değerlendirilerek kontrollerde göre gerekli müdahale ve medikasyonlar uygulandı. Klinik seyri normal olan hastalar post-op çoğunlukla birinci veya ikinci gün drenleri alınarak servise çıkarıldı. Servise alınan hastalara ilk 5 gün iki kez ritim EKG izlemi yapıldı ve maksimum 6 saatlik aralıklarla nabız ve arteriyel tansiyon takibi yapıldı. Post-op dönemde yoğun bakımda EKG monitörden izlendi ve rutin takip sırasında aritmi saptanan veya çarpıntı şikayeti olan hastalara standart 12 derivasyonlu EKG çekildi. Hastada elektrokardiyografik olarak AF’nin saptandığı gün, atriyal fibrilasyonun başlangıç günü saati olarak kabul edildi. Ġstatitiksel analiz Ġstatistiksel analiz için SPSS 15.0 program kullanıldı. Parametrik veriler ortalama ± standart sapma, nonparametrik veriler sıklık (%) olarak sunuldu. Ġki grup arasında demografik verilerden parametrik olanlar Student t-testi, nonparametrik olanlar ki-kare testiyle incelendi. Normal dağılım olmaması üzerine hsCRP için log-transformasyonlu (geometrik) ortalamalar kulanıldı. Post-op AF ve diğer parametreler arasındaki bağıntı ilişkisi Pearson ve Spearman korelasyon testi ile değerlendirildi. Post-op AF ile anlamlı veya sınırda anlamlı (p≤0.1) ilişki içinde olan değişkenlerin seçimi backward logistic regresyon analizi ile yapıldı. p<0.05 olan değerler istatistiksel olarak anlamlı kabul edildi. 39 BULGULAR Çalışmamızda toplam 96 hasta(15 kadın, 81 erkek) değerlendirildi, tüm hasta grubunun yaş ortalaması 59,9±9,9(aralık:39-80 yıl)’ idi. 96 hastanın 25’inde(%26) post-op AF gelişti. Hastaların demografik ve klinik özellikleri tablo 1a ve 1b’de görülmektedir. Çalışmamızdaki hastalar post-op AF görülenler ve görülmeyenler olarak iki gruba ayrıldığında yaş, cinsiyet, boy, ağırlık, VKĠ, sistolik ve diyastolik tansiyon değerleri, kronik HT, diyabet varlığı, geçirilmiş miyokart infaktüsü, geçirilmiş inme, ACE inhibitörü, nitrat, kalsiyum kanal blokeri, statin veya diüretik kullanımı, sigara, alkol kullanımı, aile anamnezinde koroner arter hastalığı olup olmaması, EKG’de iskemik değişim olup olmaması, fonksiyonel kapasite, hasta damar sayısı, post-op dönemde ise yoğun bakım süresi, infeksiyon ve ya mortalite gibi faktörler arasında istatistiksel anlamlılık saptanmamıştır. Beklenenin aksine post-op AF olanlarda bel çevresi ortalama 4cm daha dar idi. Post-op AF gelişiminde asetil salisilik asit(ASA) ve özellikle beta bloker kullanım sıklığı daha azdı. Dikkat çekici diğer bir bulgu post-op AF’li hastalarda pre-op ileri periodontitis sıklığının daha fazla olmasıydı(tablo 1a ve 1b, şekil 2 ve 3). Post-op AF gelişenlerde CPITN skoru anlamlılığı daha fazlaydı. 40 TABLO 1a HASTALARIN KLĠNĠK VE DEMOGRAFĠK ÖZELLĠKLERĠ POSTOPERATĠF POSTOPERATĠF AF(-)OLANLAR AF(+)OLANLAR 59.7±10.1 60.8±9.6 YAġ, yıl n=71 n=25 169.3±7.9 16.7±8.8 BOY, cm 80.2±10.4 77.4±9.9 AĞIRLIK, kg 106.8±11.3 102.3±11.1 BEL ÇEVRESĠ, cm 28.1±4.2 27.9±3.6 VKĠ, kg/m2 132.8±18.1 129.6±18.9 SĠSTOLĠK TA, mmHG 83.5±12.6 83.2±16.4 DĠASTOLĠK TA, mmHG 59, %83 22, %88 CĠNSĠYET, erkek 37, %52,1 9, %36 HĠPERTANSĠYON 21, %29,6 8, %32 DĠABETES MELLĠTUS 35, %49.3 9, %36 MI ÖYKÜSÜ 1, %1.4 0, %0 ĠNME ÖYKÜSÜ 61, %85.9 17, %68 PRE-OP ASA 50, %70.4 10, %40 PRE-OP B-BLOKER 39, %54.9 11, %44 PRE-OP ACE ĠNHĠBĠTÖRÜ 22, %31 4, %16 PRE-OP NĠTRAT 17, %23.9 5, %20 PRE-OP CA KANAL BLOKER 30, %42.2 7, %28 PRE-OP STATĠN 6, %8.4 2, %8 PRE-PO DĠÜRETĠK 33%46.5 11, %44 SĠGARA ÖYKÜSÜ 19, %26.8 8, %32 ALKOL ÖYKÜSÜ 26, %36.6 5, %20 AĠLE ÖYKÜSÜ 14, %19.7 5, %20 70 YAġ ÜZERĠ HASTALAR *MI:miyokard infaktüsü,TA:tansiyon arteriel A.D.:anlamlı değil TABLO 1b HASTALARIN KLĠNĠK VE p DEĞERĠ A.D. A.D. A.D. 0.08 A.D. A.D. A.D. A.D. A.D. A.D. A.D. A.D. 0.05 0.007 A.D. A.D. A.D. A.D. A.D. A.D. A.D. A.D. A.D. DEMOGRAFĠK ÖZELLĠKLERĠ POSTOPERATĠF AF(-) OLANLAR ĠLERĠ PERĠODONTĠTĠS 20, %28.2 n=71 19, %26.8 VENTRĠKÜLOGRAFĠDE VARLIĞI DUVAR HAREKET KUSURU EKG’DE ĠSKEMĠK DEĞĠġĠM 22, %31 VARLIĞI 15 POSTOP ĠNFEKSĠYON 1 POSTOP MORTALĠTE 8 POSTOP REVĠZYON 2.3±1.5 CPITN SKORU 1.3±0.5 FONK. KAPASĠTE(NYHA) 2.4±0.8 HASTA DAMAR SAYISI POSTOP YOĞUN BAKIM 1.8±1.2 SÜRESĠ, gün POSTOPERATĠF p AF(+)OLANLAR 13, %52 n=25 7, %28 DEĞERĠ 0.03 A.D. 15, %60 4 2 5 3±1.5 1.2±0.4 2.5±0.8 1.8±0.9 0.01 A.D. A.D. A.D. 0.08 A.D. A.D. A.D. 41 Şekil 1 60 post-op AF sıklığı 50 40 30 20 10 0 ileri periodontitis(+) ileri periodontitis(-) Şekil 2 60 post-op AF sıklığı 50 40 30 20 10 0 b-bloker kullanımı(+) b-bloker kullanımı(-) Şekil 3 100 post-op AF sıklığı 80 60 40 20 0 ASA kullanımı(+) ASA kullanımı(-) 42 Pre-op dönemde değerlendirilen laboratuar bulguları tablo 2’deki gibidir. Post-op AF görülen ve görülmeyen gruplar karşılaştırıldığında trigliserit, glukoz, HDL kolesterol ve kreatinin değerleri için istatistiksel anlamlılık bulunmamış, total kolesterol, LDL kolesterol ve önemli bir inflamatuar belirteç olan hsCRP değerleri post-op AF görülen hastalarda daha yüksek bulunmuştur. TABLO 2 LABORATUAR BULGULARININ DEĞERLENDĠRĠLMESĠ POSTOPERATĠF POSTOPERATĠF p DEĞERĠ AF(-)OLANLAR AF(+)OLANLAR 199.8±54.8 230.6±63.1 0.02 TOTAL KOLESTEROL, mg/dl n=71 n=25 117.4±41.3 144.4±45.8 0.008 LDL KOLESTEROL, mg/dl 38.1±8.2 41.3±8.04 0.09 HDL KOLESTEROL, mg/dl 172±115.8 183.5±95.4 A.D. TRĠGLĠSERĠT, mg/dl 125.9±53.2 135±36.9 A.D. GLUKOZ, mg/dl 1.02±0.22 1.11±0.23 0.09 KREATĠNĠN, mg/dl 0.26±0.42 0.52±0.55 0.02 hsCRP*, mg/dl hsCRP:yüksek duyarlıklı C reactif protein. A.D.:anlamlı değil, *logaritmik transformasyonlu Post-op AF’nin diğer faktörlerle yapılan korelasyon analizinde bulunan sonuçlar tablo 3’tedir. Bu bulgulara göre post-op AF varlığı en fazla pre-op dönemde beta bloker ve ASA kullanımı ile ters yönde orta derecede doğrusal bağıntı sergilerken, total kolesterol, LDL kolesterol ve hsCRP ile doğru yönde orta derecede doğrusal bağıntı göstermektedir. Ayrıca pre-op ileri periodontitis ve post-op AF görülme sıklığı arasında doğrusal orta derecede bağıntı mevcuttur. 43 TABLO 3 POSTOP AF’NĠN KORELASYON ANALĠZĠ r P -0.2 0.04 PRE-OP ASA -0.276 0.007 PRE-OP B-BLOKER -0.176 0.08 BEL ÇEVRESĠ, cm 0.262 0.01 EKG’DE ĠSKEMĠK DEĞĠġĠM 0.233 0.02 TOTAL KOLESTEROL mg/dl 0.271 0.008 LDL KOLESTEROL mg/dl 0.171 0.09 HDL KOLESTEROL mg/dl 0.174 0.09 KREATĠNĠN mg/dl 0.259 0.01 hsCRP*, mg/dl 0.179 0.08 CPITN SKORU 0.22 0.03 ĠLERĠ PERĠODONTĠTĠS VARLIĞI ASA:asetil salisilik asit, hsCRP:yüksek duyarlıklı C reactif protein, b-bloker:beta bloker, *logaritmik transformasyonlu Tablo 4’te post-op AF gelişimine etki eden faktörler tek değişkenli analizi ile incelenmiştir. Dikkatle incelenecek olursa pre-op bete bloker kullanımının post-op AF’yi azalttığı, pre-op ileri periodontitis varlığının da arttırdığı gözden kaçmamalıdır. Ayrıca, önceki bilgilerimizi doğrular şekilde inflamasyon belirteci olan hsCRP de post-op AF ile ilişkilidir. TABLO 4 POSTOP AF GELĠġĠMĠNE ETKĠ EDEN FAKTÖRLERĠN TEK DEĞĠġKEN ANALĠZĠ WALD KĠ-KARE p ODDS %95GA 3.704 0.05 0.348 0.119-1.020 PRE-OP ASA 6.91 0.09 0.28 0.108-0.723 PRE-OP B-BLOKER 4.95 0.03 1.009 1.001-1.019 TOTAL KOLESTEROL, mg/dl 6.6 0.01 1.015 1.004-1.027 LDL KOLESTEROL, mg/dl 4.5 0.034 2.76 1.079-7.07 ĠLERĠ PERĠODONTĠTĠS VARLIĞI 5.061 0.024 3.108 1.157-8.345 HsCRP*, mg/dl ASA:asetil salisilik asit, hsCRP:yüksek duyarlıklı C reactif protein, b-bloker:beta bloker, *logaritmik transformasyonlu 44 Tablo 5’de post-op AF gelişimine etki eden faktörler çok değişkenli analizi ile incelenmiştir. Bu bulgulara dayanarak pre-op ileri periodontitisin post-op AF gelişim sıklığını bağımsız olarak arttırdığını söyleyebiliriz. TABLO 5 POSTOP AF’YE ETKĠ EDEN FAKTÖRLERĠN ÇOK DEĞĠġKENLĠ ANALĠZĠ WALD KĠ-KARE p 4.147 0.04 PRE-OP B-BLOKER 5.785 0.016 LDL KOLESTEROL, mg/dl 5.135 0.023 hsCRP*, mg/dl 5.211 0.022 ĠLERĠ PERĠODONTĠTĠS VARLIĞI b-bloker:beta bloker, *logaritmik transformasyonlu, hsCRP:yüksek protein ODDS %95GA 0.336 0.117-0.98 1.016 1.003-1.029 3.783 1.197-11.95 3.494 1.194-10.23 duyarlıklı C reactif 45 TARTIġMA Koroner arter cerrahisi sonrası en sık görülen aritmi olan AF(%5-40)(2-4), post-op dönemdeki önemli komplikasyonlardan biridir. Bu alandaki tüm ilerleme ve teknolojik gelişmelere rağmen AF sıklığında önemli bir azalma sağlanamamıştır ve önemli bir morbidite nedeni olmaya devam etmektedir. Sol ventrikül performansı, ileri yaş, HT, geçirilmiş MI, önceden geçirilmiş kardiyak cerrahi, koroner lezyonların derecesi ve yaygınlığı gibi pre-op faktörler incelenmiş ancak tam bir görüş birliğine varılamamıştır(128-131). Bazı inflamatuar kardiyak hastalıklarda AF’nin sık görülmesi üzerine, inflamatuar bir etyoloji(IL-6, hsCRP, ICAM gibi) saptamaya yönelik çalışmalar da geliştirilmiştir. Lo ve arkadaşları koroner arter cerrahisi geçiren hastalarda gelişen AF ile inflamasyon arasındaki ilişkiyi ilk kez göstermişlerdir(132). Sonrasında yapılan birçok histolojik çalışmada AF görülen hastalarda oksidatif stres ve inflamatuar inflitratlar saptanmıştır. Yapılan birçok çalışmada inflamasyonun göstergesi olarak sıklıkla hsCRP kullanılmıştır. 3mg/l’den düşük değerlerdeki CRP miktarını saptamak için geliştirilen bir yöntemle ölçülen hsCRP’nin kronik zemindeki vasküler patolojilerle de ilişkili olduğu düşünülmektedir. Hernandez ve arkadaşlarının yaptığı bir çalışmada postop AF’yi öngören bir belirteç olarak hsCRP’nin kullanılması önerilmiştir(10). CRP’nin aritmi patogenezindeki rolünü ise hücre membranı disfonksiyonuna yol açarak oluşturduğu düşünülmektedir. Ancak yapılan birçok çalışmada yazarlar CRP’yi yükseltecek birçok durumun bulunduğunu ve AF’li hastalarda saptanan CRP yüksekliğinin sekonder bir sebepten olmuş olabileceğinin altını çizmiştir. HT ve KAH’ın da yapılan epidemiyolojik çalışmalarda CRP yüksekliğine yol açtığının gösterilmesi AF hastalarında inflamasyonun değerlendirilmesini daha da zorlaştırmıştır. Bu durum, CRP’den başka inflamatuar markerların da değerlendirmede önemli olabileceğini de düşündürmüştür. Bizim çalışmamızda hsCRP düzeyleri ve postop AF gelişimi arasında istatistiksel anlamlı bir ilişki bulunmuştur. 46 Salamon ve arkadaşlarının yaptığı bir çalışmada ise post-op AF’nin en önemli nedenlerinden biri olarak KPB gösterilmiştir(133). Benzer şekilde Kilger ve arkadaşları da KPB’nin post-op AF sıklığını arttırdığını göstermişlerdir(24). Bunun gibi birçok çalışma, KPB kullanılarak yapılan ve off-pump tekniğiyle yapılan operasyonlar sonrası gelişen AF sıklığını incelemiş fakat birbiriyle çelişkili sonuçlar elde edilmiştir. Bizim çalışmamızda bu durum nedeniyle off-pump tekniği kullanılan hastalar çalışma dışı bırakılmıştır. Post-op AF gelişimi ile ilgili olarak obezitenin de rolü araştırılmış ve obesitenin AF gelişimini arttırdığı izlenmiştir(58-60). Ancak bizim çalışmamızda VKĠ ve ya vücut ağırlığı ile post-op AF sıklığı arasında istatistiksel olarak anlamlı bir ilişki saptanmamıştır. Post-op AF gelişmesinde yaşlanma ve onunla ilgili olarak atriyumlardaki dilatasyon, nodal liflerin kaybı, kas atrofisi, sinüs düğümünde fibröz doku ve yağ dokusunun artması ve atriyumlarda lokal interstisyel amiloid birikmesi gibi yaşla ilgili yapısal değişiklikler post-op AF’ye olan yatkınlığı artırır. Zangrillo ve arkadaşları, ileri yaş ve reoperasyonun koroner cerrahi sonrası post-op AF gelişiminde risk faktörü olduklarını göstermişlerdir (134). Bizim çalışmamızda ise reopererasyona uygulanan hastalar(n=13) ve 70 yaş üzeri hastalarda(n=19) post-op AF sıklığı açısından anlamlı fark bulunamamıştır. Post-op AF’nin tetiklenmesinde dolaşımdaki katekolamin artışının önemli bir patojen olabileceği öne sürülmüştür(135). Post-op AF’nin en sık görüldüğü operasyon sonrası 2. ve 3. günlerde dolaşımdaki katekolamin miktarının da en yüksek seviyede olduğu dönem olması, aralarındaki ilişkiyi düşündüren en önemli nedendir. Operasyon hazırlığı döneminde b-bloker tedavisinin kesilmesinin de bu nedene bağlı olarak post-op AF sıklığını arttırdığı düşünülmektedir. Yazıcıoğlu ve arkadaşları tarafından yapılan çalışmada, post-op AF sıklığına digoksin ve atenololün etkisi incelenmiş ve beta blokajın AF sıklığını düşürdüğü 47 görülmüştür. Buna benzer olarak bizim çalışmamızda da b-bloker kulanımı post-op AF gelişim sıklığını belirgin olarak düşürdüğü izlenmiştir. Daha önce yayınlanmış çalışmalardan oluşan bir meta analizde statin kullanımının bütün diğer inflamatuar süreçler üzerinde görüldüğü gibi post-op AF gelişiminde de iyi yönde etkili olabildiği görülmüş, ancak daha fazla çalışmaya ihtiyaç duyulduğu da vurgulanmıştır(142). Bizim çalışmamızda ise statin kullanımı ile post-op AF sıklığı arasında anlamlı bir ilişki saptanmamış ancak kolesterol değerleri, özellikle de LDL kolesterol değeri ile post-op AF sıklığı artışı arasındaki ilişki istatistiksel anlamlı bulunmuştur KAH ve kronik inflamasyon arasınaki ilişkiden yola çıkarak yapılmış bir çalışmada periodontal hastalık ve KAH arasında ilişki olduğu saptanmış ve periodontitis tedavisi sayesinde KAH riskinde düşme sağlanabileceği öne sürülmüştür(143). Biz de çalışmamızda benzer bir amaç güderek post-op AF sıklığını düşürmek için kronik bir inflamasyon kaynağı olan periodontitis ile ilişkisini araştırdık. ÇalıĢmanın kısıtlılıkları: Hasta sayısının göreceli olarak az olması çalışmamızın başlıca kısıtlılığıdır. Çalışmamızda kros-klemp süresi, KPB süresi, operasyon sırasında gelişebilen komplikasyonlar gibi peroperatif etkenlerin değerlendirilmemiş olması da çalışmamızın değerlendirilmesinde ayrıca kısıtlılığa yol açmıştır. Benzer şekilde post-op dönemde trakeostomi, solunum problemleri, psikolojik etmenler gibi sempatik tonus artışına neden olup post-op AF sıklığına etki edebilecek faktörler de çalışmamızda değerlendirilmemiştir. Post-op dönemde yoğun bakım sonrası servisde EKG takiplerinin günde iki kere veya hastanın şikayetine göre yapılıp, telemetri veya ambulatuar holter EKG tetkiklerin kullanılamaması, şikayet oluşturmayıp kısa süren AF ataklarının gözden kaçmasına neden olmuş olabilir. 48 SONUÇ Sonuç olarak çalışmamızda periodotitis varlığının koroner arter cerrahisi sonrası gelişen AF sıklığını arttırdığına ilişkin sonuçlarla karşılaştık. Bu sonuç, operasyon sonrası dönemdebirçok morbidite nedeni olabilen, hastanede yatış süresini uzatan ve tedavi masraflarını arttıran bir komplikasyon olan AF’nin sıklığının azaltılabilmesine imkan veren ipuçları oluşturmuştur. Bilindiği gibi, kalp kapak cerrahisi operasyonları öncesi ağız diş muayenesi rutin olarak uygulanmaktadır. Çalışmamızın sonuçlarına dayanarak koroner arter cerrahisi öncesi yapılabilecek ağız diş muayenesinin ve sonuçlarına göre planlanacak olan tedavi ve ağız diş bakımının da kapak cerrahisi sonrası gelişebilen infektif endokardit sıklığını azalttığı gibi, koroner arter cerrahisi sonrası post-op AF sıklığının azaltılmasında faydalı olabileceğini düşünmekteyiz. Artık inflamatuar süreçlerle sıklığının arttığı bilinen AF’nin inflamasyon ile olan ilişkisinin aydınlanmasına yönelik daha birçok araştırmaya da ihtiyaç duyulduğunu düşünmekteyiz. 49 Amaç: Yapılmış birçok çalışma göstermiştir ki koroner cerrahi uygulanan hastalarda önemli bir komplikasyon olan post-op AF’nin gelişiminde inflamasyon önemli bir yer tutmaktadır. Bilindiği gibi periodontitis de önemli bir kronik ve sistemik inflamasyon nedenidir. Çalışmamızı da pre-op periodontitisin oluşturduğu inflamasyonun post-op AF sıklığı üzerine etkisini araştırmak üzere planladık. Metod: Prof.Dr. Siyami Ersek Hastanesi’ne koroner cerrahi uygulanmak üzere başvuran hastalardan belirlediğimiz kriterlere uygun olan 96 hastayı çalışmamıza dahil ettik. Pre-op dönemde hastaların demografik, laboratuvar, kardiyak ve dental muayene bilgilerini kaydettik. Post-op dönemde de AF gelişimi ve bazı komplikasyonların gelişimi için takip ettik Bulgular: çalışmamızda toplam 96 hasta (15 kadın, 81 erkek) değerlendirildi. Tüm hasta grubunun yaş ortalaması 59±9.9 (aralık 39.85 yıl) idi. 25 hastada (%26) post-op AF gelişirken, geriye kalan 71 hastada post-op AF gözlenmedi. Post-op AF olan hastalarda ileri periodontitis varlığı, AF gelişmeyen hastalara göre yaklaşık iki kat idi (%52 vs %28,2, p=0.03). Gruplar arasında klinik ve demografik özellikler bakımından farklılık yokken postop AF gelişen hastalarda pre-op ASA ve özellikle b-bloker kullanımının daha az sıklıkta olduğu gözlemlendi (p=0.05, p=0.007). Yapılan çok-değişkenli lojistik regresyon analizinde ileri periodontitis varlığı (OO 3.494, %95GA 1.194-10.23, p=0.022), hsCRP (OO 3.783, %95GA 1.197-11.95, p=0.023) ve LDL kolesterol (OO 1.016, %95GA 1.003-1.029, p=0.016) post-op AF’yi arttırırken, pre-op b-bloker kullanımı (OO 0.336, %95GA 0.117-0.98, p=0.04) post-op AF gelişimini azaltmaktaydı. Sonuç: Çalışmamızın verileri göz önüne alındığında by-pass cerrahisi öncesi, ileri periodontitis varlığının post-op AF sıklığını arttırdığı sonucuna vardık ve buna dayanarak preop dönemde yapılacak ağız, diş muayene ve tedavisinin post-op AF sıklığını düşürme yönünde olumlu sonuçlar doğurabileceği yorumunda bulunduk. 50 KAYNAKLAR 1. Silverman ME. From rebellious palpitations to the discovery of auricular fibrillation: contributions of Mackenzie, Lewis and Eindhoven. Am J Cardiol 1994;73:384-9. 2. Ducceshi V,D’Andrea A, Liccardo B, et al. Perioperative clinical predictors of atrial fibrillation occurence fallowing coronary arter sugery. Eur J Cardiothorac Surg 1999;16:435-9. 3. Aranki SF, Shaw DP, Adams DH, et al. Prediktors of atrial fibrillation after coronary arter surgary current and impact on hospital resources. Circulation 1996; 94:390-7 4. Stamou SC, Dangas G, Hill PC, et al. Atrial fibrillation after beating heart surgery. Am J Cardiol 2000; 86:64-7. 5. Sibert J, Anisimowitz L, Lango R ve ark. Atrial fibrillation after coronary artery surgery bypass grafting: Does the type of procedure influence the early postoperative incidence? Eur J Cardiothorac Surg 2001; 19(4): 455-59. 6. Aranki SF, Shaw DP, Adams DH, et al. Predictors of atrial fibrillation after coronary artery graft surgery: Current trends and impacts on hospital resources. Circulation 1996;94:390-7. 7. Almassi GH, Schowalter T, Nicolosi AC, Aggarwald A. Atrial fibrillation after cardiac surgery: A major morbid event? Ann Surg 1997; 226:501-13. 8. Dixon FE, Genton E, Vacek JL, Moore CB, Landry J. Factors predisposing to supraventricular arrhythmias after coronary artery bypass grafting. Am J Cardiol 1986; 58:476-8. 51 9. Ad N, Snir E, Vidne BA, Golomb E. Potential preoperative markers for the risk of developing atrial fibrillation after cardiac surgery. Semin Thorac and Cardiovasc Surg 1999; 117:298-301. 10. Hernandez Madrid A. C-Reactive Protein and atrial fibrillation. An old marker looking for a new target. Nev esp Cardiol 2006;59:94-8. 11. Boos CJ, Anderson RA, Lip GY. Is atrial fibrillation aninflammatory disorder? Eur Heart J 2006;27:136-49. 12. Genco RJ, Goldman HM, Cohen DW. 1990:Contemporary Periodontics1. Edition C.V Mosby Co, Philedelphia. 13. Lindhe J. 1983: Textbook of clinikal periodontology, 1. Ed Munksgraad, Cophenhagen 14. Page RC. Periodontal therapy:Prospects fort he future. J. Periodontol 1993;64:744753. 15. Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation:a major contributor to stroke in the elderly. The Framingham Study. Arch Intern Med 1987;147:1561-4. 16. Benjamin EJ, Levy D, D Agustino RB, Balenger AJ, Wolf PA. Impact of atrial fibrillation on the risk of death: The Framingham Study (abstract). J Am Coll Cardiol 1995;Feb:230 A. 17. Freinberg WM, Cornell ES, Nightingale, et al. Relationship between prothrombin activation fragment F1.2 and international normalized ratio in patients with atrial fibrillation. Stroke Prevention in Atrial Fibrillation Investigators.Stroke 1997;28:1101-6. 18. Freiberg J, Buch P, Scharling H, Gadsbphioll N et al. Rising rates of hospital admission for atrial fibrillation. Epidemiology 2003;14:666-72. 52 19. Steward S, Macintyre K, Maclead MM, et al. Trends in hospital activity, morbidity and case fatality related to atrial fibrillation in scotland, 1986-1996. Eur Heart J 001;22:693- 701. 20. Khairallah F, Ezzedine R, Ganz LI, London B, Saba S. Epidemiology and determinants of outcome of admissions for atrial fibrillation in the US from 1996 to 2001. Am J Cardiology 2004;94:500-4 21. Le Heuzey JY, Paziaud O, Piot O, et al. Cost of care distribution in atrial fibrillation patients: the COCAF study. Am Heart J 2004;147:121-6. 22. Go AS, Hylek EM, Phillips KA, et al. Prevelance of diagnosed atrial fibrillatin in adults: national implications for rhythm management and stroke prevention: The anticougulation and risk factors in atrial fibrillation (ATRIA) Study. JAMA 2001;285:2370-5. 23. Feinberg WM, Blackshear JL, Laupacis A, et al. Prevelance, age distribution, and gender of patients with atrial fibrillation. Analysis and implications. Arch Intern Med 1995;155:469-73. 24. Flegel KM, Shipley MJ, Rose G, Risk of stroke in non-rheumatic atrial fibrillation (published erratum appears in Lancet1987;1:878). Lancet 1987;1:526-9. 25. Furberg CD, Psaty BM, Manolio TA, et al. Prevelance of atrial fibrillation in elderly subjects. Am J Cardiaol 1994;74:236-41. 26. Evans W, and Swann P.(1954). Lone auricular fibrillation. Br Heart J 16:189-94. 27. Levy S, Maarek M, Coumel P, et al. Charecterization of different subsets of atrial fibrillation in general practice in France: the ALFA study. The College of French Cardiolojıst. Circulation 1999;99:3028-35. 53 28. Wolf P, Benjamin E, Belanger A, Kannel W, Levy D, D Agustino R. Secular trendsin the prevelanceof atrial fibrillation : Framingham study. Am Heart J 1996;131:790-5. 29. Furberg C.D, Psaty BM, Manolio TA, Gadrin JM, Smith VE, and Rautanharju PM. Prevelance of atrial fibrillation in elderly subjects. Am J Cardiol 1994;74:236-41. 30. Hart RG, Halpelin JL. Atrial fibrillation and tromboembolism: a decade of progressin stroke prevention. Ann Intern Med 1999;131:688-95. 31. Feinberg WM, Seeger JF, Carmody RF, Anderson DC, Hart RG, Pearce LA. Epidemiologic features of asymptomatic infarction in patients with nonvalvular atrial fibrillation. Arc Intern Med 1990;150:2340-44. 32. Adalet K, Onat A, Keleş Ġ, Sansoy V. Türk erişkinlerinde elektrokardiografik bulgularla aritmilerin prevalansı: sekiz yıllık takip sonuçları. Türk kardiyoloji derneği arşivi 2000;28:560-7 33. Cameron A, Schwartz MJ, Khronmal RA, et al. Prevention and significance of atrial fibrillation in coronary artery disease. Cardiol 1988;61:714-17. 34. Goldberg RJ, Sieley D, Becker RC, et al. Impact of atrial fibrillation on the hospital and long term survival of patients with an acute myokardial infarction: A comminity-wide perspective. Am Heart J 1990;119:991-1001. 35. Kannell W, Abbott R, Savage D. Mc Namara P.Epidemiologic features of chronic atrial fibrillation. The fremingham study. N Engl J Med 1982;306:1018. 36. Ruigomez A, Johansson S, Wallander MA, Rodriguez LAG. Ġncidence of chronic atrial fibrilation in general practice and its treatment pattern, Journal of clinical epidemiology 2002;55:358-63 54 37. Stewart S, Hart CL, Hole DJ, et al. A population-based study of the long-term risks associated with atrial fibrillation: 20-year follow-up of the Renfrew/Paisley study. Am J Med 2002;113:359–64. 38. Risk factors for stroke and efficacy of antithrombotic therapy in atrial fibrillation. Analysis of pooled data from five randomized controlled trials [published erratum appears in Arch Intern Med 1994;154: 2254]. Arch Intern Med 1994;154:1449–57. 39. Flegel KM, Shipley MJ, Rose G. Risk of stroke in non-rheumatic atrial fibrillation [published erratum appears in Lancet 1987;1:878]. Lancet 1987;1:526–9. 40. Kannel WB, Abbott RD, Savage DD, et al. Coronary heart disease and atrial fibrillation: the Framingham Study. Am Heart J 1983; 106:389–96. 41. Krahn AD, Manfreda J, Tate RB, et al. The natural history of atrial fibrillation: incidence, risk factors, and prognosis in the Manitoba Follow-Up Study. Am J Med 1995;98:476–84. 42. Poole-Wilson PA, Swedberg K, Cleland JG, et al. Comparison of carvedilol and metoprolol on clinical outcomes in patients with chronic heart failure in the Carvedilol Or Metoprolol European Trial (COMET): randomised controlled trial. Lancet 2003;362:7–13. 43. Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke 1991;22:983–8. 44. Levy S, Maarek M, Coumel P, et al. Characterization of different subsets of atrial fibrillation in general practice in France: the ALFA study. The College of French Cardiologists. Circulation 1999;99:3028–35. 45. Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation: a major contributor to stroke in the elderly. The Framingham Study. Arch Intern Med 1987;147:1561–4. 55 46. Hart RG, Halperin JL. Atrial fibrillation and thromboembolism: a decade of progress in stroke prevention. Ann Intern Med 1999;131: 688–95. 47. Benjamin EJ, Levy D, Vaziri SM, et al. Independent risk factors for atrial fibrillation in a population-based cohort. The Framingham Heart Study. JAMA 1994;271:840–4. 48. Feinberg WM, Seeger JF, Carmody RF, et al. Epidemiologic features of asymptomatic cerebral infarction in patients with nonvalvular atrial fibrillation. Arch Intern Med 1990;150:2340–4. 49. Petersen P, Madsen EB, Brun B, et al. Silent cerebral infarction in chronic atrial fibrillation. Stroke 1987;18:1098–100. 50. Prystowsky EN, Katz AM. Atrial fibrillation. In: Textbook of Cardiovascular Medicine. Philadelphia: Lippincott-Raven; 1998. p1661. 51. Packer DL, Bardy GH, Worley SJ, et al. Tachycardia-induced cardiomyopathy: a reversible form of left ventricular dysfunction. Am J Cardiol 1986;57:563–70. 52. Kieny JR, Sacrez A, Facello A, et al. Increase in radionuclide left ventricular ejection fraction after cardioversion of chronic atrial fibrillation in idiopathic dilated cardiomyopathy. Eur Heart J 1992; 13:1290–5. 53. Grogan M, Smith HC, Gersh BJ, et al. Left ventricular dysfunction due to atrial fibrillation in patients initially believed to have idiopathic dilated cardiomyopathy. Am J Cardiol 1992;69:1570–3. 54. Rathore SS, Berger AK, Weinfurt KP, et al. Acute myocardial infarction complicated by atrial fibrillation in the elderly: prevalence and outcomes. Circulation 2000;101:969–74. 56 55. Goldberg RJ, Yarzebski J, Lessard D, et al. Recent trends in the incidence rates of and death rates from atrial fibrillation complicating initial acute myocardial infarction: a community-wide perspective. Am Heart J 2002;143:519–27. 56. Prystowsky EN. Tachycardia-induced-tachycardia: a mechanism of initiation of atrial fibrillation. In: DiMarco JP, Prystowsky EN, eds. Atrial Arrhythmias: State of the Art. Armonk, NY: Futura; 1995. 57. Evans W, Swann P. Lone auricular fibrillation. Br Heart J 1954;16:194. 58. Wang TJ, Parise H, Levy D, et al. Obesity and the risk of new-onset atrial fibrillation. JAMA 2004;292:2471–7. 59. Coromilas J. Obesity and atrial fibrillation: is one epidemic feeding the other? JAMA 2004;292:2519–20. 60. Frost L, Hune LJ, Vestergaard P. Overweight and obesity as risk factors for atrial fibrillation or flutter: the Danish Diet, Cancer, and Health Study. Am J Med 2005;118:489–95. 61. Alaud-din A, Meterissian S, Lisbona R, et al. Assessment of cardiac function in patients who were morbidly obese. Surgery 1990;108: 809–18. 62. Chen YH, Xu SJ, Bendahhou S, et al. KCNQ1 gain-of-function mutation in familial atrial fibrillation. Science 2003;299:251–4. 63. Yang Y, Xia M, Jin Q, et al. Identification of a KCNE2 gain-of-function mutation in patients with familial atrial fibrillation. Am J Hum Genet 2004;75:899–905. 64. Maisel WH. Autonomic modulation preceding the onset of atrial fibrillation. J Am Coll Cardiol 2003;42:1269–70. 65. Bharti S, Lev M. Histology of the normal and diseased atrium. In: Fall RH, Podrid PJ, eds. Atrial Fibrillation: Mechanism and Management. New York: Raven Press; 1992. p15–39. 57 66. Bailey GW, Braniff BA, Hancock EW, et al. Relation of left atrial pathology to atrial fibrillation in mitral valvular disease. Ann Intern Med 1968;69:13–20. 67. Tai CT, Chen SA, Tzeng JW, et al. Prolonged fractionation of paced right atrial electrograms in patients with atrial flutter and fibrillation. J Am Coll Cardiol 2001;37:1651–7. 68. Ausma J, Wijffels M, Thone F, et al. Structural changes of atrial myocardium due to sustained atrial fibrillation in the goat. Circulation 1997;96:3157–63. 69. Gulamhusein S, Ko P, Klein GJ. Ventricular fibrillation following verapamil in the Wolff-Parkinson-White syndrome. Am Heart J 1983; 106:145–7. 70. Jais P, Haissaguerre M, Shah DC, et al. A focal source of atrial fibrillation treated by discrete radiofrequency ablation. Circulation 1997;95:572–6. 71. Tsai CF, Tai CT, Hsieh MH, et al. Initiation of atrial fibrillation by ectopic beats originating from the superior vena cava: electrophysiological characteristics and results of radiofrequency ablation. Circulation 2000;102:67–74. 72. Schmitt C, Ndrepepa G, Weber S, et al. Biatrial multisite mapping of atrial premature complexes triggering onset of atrial fibrillation. Am J Cardiol 2002;89:1381–7. 73. Jais P, Hocini M, Macle L, et al. Distinctive electrophysiological properties of pulmonary veins in patients with atrial fibrillation. Circulation 2002;106:2479–85. 74. Shah D, Haissaguerre M, Jais P, et al. Nonpulmonary vein foci: do they exist? Pacing Clin Electrophysiol 2003;26:1631–5. 75. Moe GK, Abildskov JA. Atrial fibrillation as a self sustaining arrhythmia independent of focal discharge. Am Heart J 1959;58:59–70. 58 76. Ricard P, Levy S, Trigano J, et al. Prospective assessment of the minimum energy needed for external electrical cardioversion of atrial fibrillation. Am J Cardiol 1997;79:815–6. 77. Wijffels MC, Kirchhof CJ, Dorland R, et al. Atrial fibrillation begets atrial fibrillation. A study in awake chronically instrumented goats. Circulation 1995;92:1954–68. 78. Attuel P, Pellerin D, Gaston J. Latent atrial vulnerability: new means of electrophysiologic investigations in paroxysmal atrial arrhythmias. In: Attuel P, Coumel P, Janse MJ, eds. The Atrium in Health and Disease. Mount Kisco, NY: Futura; 1989. p81–94. 79. Hurwitz JL, German LD, Packer DL, et al. Occurrence of atrial fibrillation in patients with paroxysmal supraventricular tachycardia due to atrioventricular nodal reentry. Pacing Clin Electrophysiol 1990;13:705–10. 80. Brugada J, Mont L, Matas M, et al. Atrial fibrillation induced by atrioventricular nodal reentrant tachycardia. Am J Cardiol 1997;79:681–2. 81. Prystowsky EN. Atrioventricular node reentry: physiology and radiofrequency ablation. Pacing Clin Electrophysiol 1997;20:552–71. 82. Moe GK, Abildskov JA. Observations on the ventricular dysrhythmia associated with atrial fibrillation in the dog heart. Circ Res 1964; 4:447–60. 83. Page RL, Wharton JM, Prystowsky EN. Effect of continuous vagal enhancement on concealed conduction and refractoriness within the atrioventricular node. Am J Cardiol 1996;77:260–5. 84. Page RL, Tang AS, Prystowsky EN. Effect of continuous enhanced vagal tone on atrioventricular nodal and sinoatrial nodal function in humans. Circ Res 1991;68:1614–20. 59 85. Van Den Berg MP, Crijns HJ, Haaksma J, et al. Analysis of vagal effects on ventricular rhythm in patients with atrial fibrillation. Clin Sci (Colch) 1994;86:531–5. 86. Clark DM, Plumb VJ, Epstein AE, et al. Hemodynamic effects of an irregular sequence of ventricular cycle lengths during atrial fibrillation. J Am Coll Cardiol 1997;30:1039–45. 87. Sanfilippo AJ, Abascal VM, Sheehan M, et al. Atrial enlargement as a consequence of atrial fibrillation. A prospective echocardiographic study. Circulation 1990;82:792–7. 88. Gosselink AT, Crijns HJ, Hamer HP, et al. Changes in left and right atrial size after cardioversion of atrial fibrillation: role of mitral valve disease. J Am Coll Cardiol 1993;22:1666–72. 89. Bogousslavsky J, Van Melle G, Regli F, et al. Pathogenesis of anterior circulation stroke in patients with nonvalvular atrial fibrillation: the Lausanne Stroke Registry. Neurology 1990;40:1046–50. 90. Miller VT, Rothrock JF, Pearce LA, et al. Ischemic stroke in patients with atrial fibrillation: effect of aspirin according to stroke mechanism. Stroke Prevention in Atrial Fibrillation Investigators. Neurology 1993;43:32–6. 91. Aschenberg W, Schluter M, Kremer P, et al. Transesophageal twodimensional echocardiography for the detection of left atrial appendage hrombus. J Am Coll Cardiol 1986;7:163–6. 92. Mugge A, Kuhn H, Nikutta P, et al. Assessment of left atrial appendage function by biplane transesophageal echocardiography in patients with nonrheumatic atrial fibrillation: identification of a subgroup of patients at increased embolic risk. J Am Coll Cardiol 1994;23:599–607. 60 93. Stoddard MF, Dawkins PR, Prince CR, et al. Left atrial appendage thrombus is not uncommon in patients with acute atrial fibrillation and a recent embolic event: a transesophageal echocardiographic study. J Am Coll Cardiol 1995;25:452–9. 94. Manning WJ, Silverman DI, Waksmonski CA, et al. Prevalence of residual left atrial thrombi among patients with acute thromboembolism and newly recognized atrial fibrillation. Arch Intern Med 1995;155:2193–8. 95. Khan IA. Atrial stunning: determinants and cellular mechanisms. Am Heart J 2003;145:787–94. 96. Chung MK, Martin DO, Sprecher D, et al. C-reactive protein elevation in patients with atrial arrhythmias: inflammatory mechanisms and persistence of atrial fibrillation. Circulation 2001;104:2886–91. 97. Dernellis J, Panaretou M. C-reactive protein and paroxysmal atrial fibrillation: evidence of the implication of an inflammatory process in paroxysmal atrial fibrillation. Acta Cardiol 2001;56:375–80. 98. Thambidorai SK, Parakh K, Martin DO, et al. Relation of C-reactive protein correlates with risk of thromboembolism in patients with atrial fibrillation. Am J Cardiol 2004;94:805–7. 99. Gallagher MM, Camm J. Classifications of atrial fibrillation. Am J Cardiology 1998;82:18-28. 100. Levy S, Camm AJ, Saksena S, Aliot E, Breithardt G, Crijns H, Davies W, Kay N, Prytowsky E, Sutton R, Waldo A, Wyse DG. Ġnternational consensus on momenclature and classification of atrial fibrillation. Eurospace 2003;5:119-22. 101. Clark DM, Plumb VJ, Epstein AE, Kay GN. Hemodynamic effects of an irregular sequence of ventricular cycle lengths during atrial fibrillation. J Am Coll Cardiology 1997;30:1039-45. 61 102. The AFFĠRM investigators. Relationships between sinus rhytim, treatment, and survival in the atrial fibrillation follow up investigation of rhytim management ( AFFĠRM ) study. Circulation 2004;109:1509-13. 103. Dries DL, Exner DV, Gersh BJ, Domanski MJ, Waclawiw MA, Stevenson LW. Atrial fibrillation is associated with an increased risk for mortality and heart failure progression in patients with asymptomatic and symptomatic left ventricular systolic dysfunction: a retrospective analysis of the SOLVD trials. J Am Coll Cardiology 1998;32:695-703. 104. Cleland JGF, Swedberg K, Follath F, et al. For the study group on diagnosis of the working group on heart failure of the european society of cardiology.The EuroHeart failure survey programme: a survey on the quality of care among patients with heart failure in Europe.Part 1: patient characteristics and diagnosis. Eur Heart Journal 2003;24:442-63. 105. Olshansky B, Rosenfeld LE, Warner AL, et al.The atrial fibrillation follow up investigations of rhytim management ( AFFĠRM ) study.Approaches to control rate in atrial fibrillation. J Am Coll Cardiology 2004;43:1201-8. 106. Fuster V, Ryden LE, ACC/AHA/ESC guidelines for the management of patients with atrial fibrillation:executive summary. J Am Coll Cardiology 2001;38:1231-65. 107. Almassi GH, Schowalter T, Nicolosi AC, Aggarwal A, Moritz TE, Henderson WG, et al. Atrial fibrillation after cardiac surgery: A major morbid event? Ann Surg 1997;226:501-11. 108. Aranski SF, ShawDP, Adams DH, Rizzo RJ, Couper GS, VanderVliet M. Predictors of atrial fibrillation after coronary artery surgery. Current trends and impact on hospital resources. Circulation 1996;94:390-7. 62 109. Maisel WH, Rawn J, Stevenson WG. Atrial fibrillation after cardiac surgery. Ann Intern Med 2001;135:1061-73. 110. Braunwald, E. (2001). Heart Disease: A textbook of cardiovascular medicine (6th edition). Philadelphia: W.B. Saunders Company. 111. Fuster V, Ryden LE. ACC/AHA/ESC Guidelines for the Management of patients with atrial fibrillation. J Am Coll Cardiol 2001;38(4):1-69. 112. Cox, JL. A perspective of postoperative atrial fibrillation in cardiac operations. Ann Thorac Surg 1993;56:405. 113. Thompson AE, Hirsch GM, Pearson GJ. Assessment of new onset postcoronary artery bypass surgery atrial fibrillation: Current practice pattern review and the development of treatment guidelines. J Clin Pharm Ther 2002;27:21-37. 114. Stebbins D, Igidbashian L, Goldman SM, et al. Clinical outcome of patients who develop atrial fibrillation after coronary artery bypass graft surgery. PACE 1995;18:798. 115. Suat Canbaz. Kororoner arter cerrahisi sonrası AF gelişimindeki belirleyicilerin irdelenmesi. TKDC Dergisi; Ekim, 2000, cilt 8, sayı 4,767-770. 116. Bruins P, te Velthuis H, Yazdanbakhsh AP, Jansen PG, van Hardevelt FW, de Beaumont EM, Wildevuur CR, Eijsman L, Trouwborst A, Hack CE. Activation of the complement system during and after cardiopulmonary bypass surgery: postsurgery activation involves C-reactive protein and is associated with postoperative arrhythmia. Circulation 1997;96: 3542–3548. 117. Chung MK, Martin DO, Sprecher D, Wazni O, Kanderian A, Carnes CA, Bauer JA, Tchou PJ, Niebauer MJ, Natale A, Van Wagoner DR. C-reactive protein 63 elevation in patients with atrial arrhythmias: inflammatory mechanisms and persistence of atrial fibrillation. Circulation. 2001 Dec 11;104(24):2886-91. 118. Ronnier J. Aviles, MD; David O. Martin, MD, MPH; Carolyn Apperson- Hansen, MS;Penny L. Houghtaling, MS; Pentti Rautaharju, MD; Richard A. Kronmal, PhD; Russell P. Tracy, PhD; David R. Van Wagoner, PhD; Bruce M. Psaty, MD, PhD; Michael S. Lauer, MD; Mina K. Chung, MD Inflammation as a Risk Factor for Atrial Fibrillation Circulation. 2003;108:3006-3010. 119. Psychari SN, Apostolou TS, Sinos L, Hamodraka E, Liakos G, Kremastino DT. Relation of elevated C-reactive protein and interleukin-6 levels to left atrial size and duration of episodes in patients with atrial fibrillation. Am J Cardiol. 2005;95:764–767. 120. Gaudino M, Andreotti F, Zamparelli R, Di Castelnuovo A, Nasso G, Burzotta F, Iacoviello L, Donati MB, Schiavello R, Maseri A, Possati G. 174G/C interleukin-6 polymorphism influences postoperative interleukin-6 levels and postoperative atrial fibrillation. Is atrial fibrillation an inflammatory complication? Circulation 2003;108(Suppl. 1):II195–II199. 121. Maixent JM, Paganelli F, Scaglione J, Levy S. Antibodies against myosin in sera of patients with idiopathic paroxysmal atrial fibrillation. J Cardiovasc Electrophysiol 1998;9:612–617. 122. Frustaci A, Chimenti C, Bellocci F, Morgante E, Russo MA, Maseri A. Histological substrate of atrial biopsies in patients with lone atrial fibrillation. Circulation 1997;96:1180–1184. 123. Cardin S, Li D, Thorin-Trescases N, Leung TK, Thorin E, Nattel S. Evolution of the atrial fibrillation substrate in experimental congestive heart failure: 64 angiotensin-dependent and -independent pathways. Cardiovasc Res 2003;60:315– 325. 124. Tsai CT, Lai LP, Lin JL, Chiang FT, Hwang JJ, Ritchie MD, Moore JH, Hsu KL, Tseng CD, Liau CS, Tseng YZ. Renin–angiotensin system gene polymorphisms and atrial fibrillation. Circulation 2004;109:1640–1646. 125. Conway DS, Buggins P, Hughes E, Lip GY. Prognostic significance of raised plasma levels of interleukin-6 and C-reactive protein in atrial fibrillation. Am Heart J 2004;148:462–466. 126. Healey JS, Baranchuk A, Crystal E, Morillo CA, Garfinkle M, Yusuf S, Connolly SJ. Prevention of atrial fibrillation with angiotensin-converting enzyme inhibitors and angiotensin receptor blockers: a meta-analysis. J Am Coll Cardiol 2005;45:1832–1839. 127. Chung-Wah Siu, MBBS, Chu-Pak Lau, MD, and Hung-Fat Tse, MD Prevention of Atrial Fibrillation Recurrence by Statin Therapy in Patients With Lone Atrial Fibrillation After Successful Cardioversion Am J Cardiol 2003;92:1343–1345. 128. Rubin DA, Hieminski KE, Reed GE, Herman MY. Predictors, prevention and longterm prognosis of atrial fibrillation after coronary arter surgery. J Thorac Cardiovascular Surgery. 1987:94:331-335. 129. Dimerod OJM, McGregor CGA,Stone DE. Arrhytmias after coronary bypass surgery. Br.Heart j. 1984:51:618-621. 130. Vecht RJ, Nicolaide EP, Ikwenka JK, Liassider CH. Incidence and prevention of supraventricular tachyarrhytmia after coronary arter surgery. Int J Cardiolaogy 1986:13:125-134. 65 131. Groves PH,Hall RJC.Atrial tachyarrhytmia after cardiac surgery. European Heart J. 1991:12:458-463. 132. Lo B, Fijnheer R, Nierich AP, Bruins P, Kalkman CJ. C-reaktive protein in a risk indicator for atrial fibrillation in myocardial revascularization. Ann Thorac Surg 2005;79: 1530-5. 133. Salamon T, Michler RE, Knott KM, et al. Offpump coronary artery bypass grafting does not decrease the incidence of atrial fibrillation. Ann Thorac Surg ;75:505- 07,2003. 134. Predictors of atrial fibrillation after off-pump coronary artery bypass graft surgery.Zangrillo A, Landoni G, Sparicio D, Benussi S, Aletti G, Pappalardo F, Fracasso G, Fano G, Crescenzi G. J Cardiothorac Vasc Anesth. 2004 Dec;18(6):704-8. 135. Kalman JM, Munawar M, Howes LG, et al. Atrial fibrillation after coronary artery bypass grafting is associated with symptomatic activation. Ann Thorac Surg ;60:1709-1715,1995. 136. Amar S, Gökçe N, Morgan S, Loukideli M, Van Dyke TE, Vita JA. Periodontal disiease in associatiod with brachial artery endothelial dysfunction and systemic inflammation. Arterioscler Thromb Vasc Biol 2003;23: 1245-9 137. Fuster V, Badimon L, Badimon JJ, et al. The pathogenesis of coronary artery disiease and acute coronry syndromes. N Eng J Med 1992;326:242-50. 138. Angeli F, Verdecchia P, pellegrino C, Pellegrino RG, pellegrino G, Prosciutti L, Giannoni C, Cianetti S, Bentivoglio M. Assciation between periodontal disease and left ventrikle mass in essential hypertention. Hypertention 2003;488-92. 139. Sors T, Ingman T, Haapasalo M, Konttinen YT, Lindy O, Saari H. Identification of proteases from periodanto pathogenic bacteria as activators of 66 latent human neutrophil and fibroblast-type interstitial collagenases. Infect ımmun 1992;60:4491-5. 140. Levadaros E, van der Velden U, Bizzaro S, ten Heggeler JM, Gerdes VE. A pilot study intomeasurements of markers of aterosclerosis in periodontitis. J Periodontal 2005;76:121-8. 141. Prabhu A, Mathur A. Detection of local systemic cytokines in adult periodontitis. J Periodontal 1996;67:515-22. 142. Patricia A, Brain J. The Annals of Pharmacotherapy: 2008;10: 253-258. 143. Kim J, Amar S. Periodontal disease and systemic conditions: a bidirectionel relationship. Odontoloji 2006;94:10-21.