proteinlerin genel özellikleri
advertisement

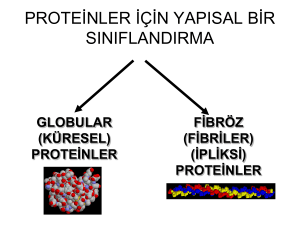
PROTEİNLERİN GENEL ÖZELLİKLERİ VE FONKSİYONLARI • Yapılarında C, H, O, N ve S atomları bulunur. • Yaşayan sistemler içerisinde, en fazla bulunan ve en fazla fonksiyona sahip olan organik molekül grubudur. • Hayatla ilgili birçok işlev bu molekül grubuna bağımlıdır. -Yapı ve destek elemanıdırlar. -Transport ve depo görevleri vardır. Transport görevi olan proteinler: hemoglobin, transferrin, albumin Depo görevi olan proteinler: ferritin, miyoglobin -Biyolojik katalizörlerdir. Enzimler protein yapısındadır. -Metabolik düzenleyicidirler. Birçok hormon, protein yapısındadır. -Savunma elemanıdırlar. Antikorlar, pıhtılaşma proteinleri, çeşitli toksinler. -Kasılma ve hareket fonksiyonları vardır. Aktin, miyozin, tubulin. -Genetik özelliklerin belirlenmesi. Aminoasitler • Proteinlerin yapıtaşı (monomeri) aminoasitlerdir. • Proteinler, amino asitlerin belirli sayıda ve belirli diziliş sırasında, peptid bağı ile birbirine bağlanmasıyla oluşur. • Protein yapısı oluşurken; bir aminoasitin –COOH grubu ile bir başka aminoasitin –NH2 grubu aralarında peptid bağı oluşarak birleşirler. • Doğada 300 kadar farklı amino asit bulunmaktadır. • Bu amino asitlerin 20 tanesi, DNA tarafından kodlanıyor. Bunlara standart aminoasitler denir. • 20 standart amino asit, protein yapısının dilinin yazıldığı bir alfabe gibi düşünülebilir. • Standart amino asitler, üç harfli kısaltmalar ve tek harfli sembollerle gösterilirler. Standart Aminoasitlerin Özellikleri Prolin dışındaki tüm standart aminoasitler; fonksiyonel grup olarak, α-karbon atomuna bağlanmış bir amino grubu(-NH2), bir karboksil grubu(COOH) ve bir de R ile gösterilen yan gruplar içerirler. COOH grubuna en yakın olan C atomuna α-karbon denir. • Prolin, halkasal bir yapıya sahiptir ve amino grubu yerine imino grubu(NH) taşır. Bu nedenle iminoasitte denir. • -NH2 ve -COOH grupları bütün aminoasitlerde aynıdır. Ancak, R grupları farklıdır. • • R grupları değişerek, farklı aminoasit çeşitleri meydana gelir. Standart Aminoasitlerin Sınıflandırılması • Standart amino asitler, R yan gruplarının özelliklerine göre dört sınıfa ayrılırlar. • • • • Nonpolar R gruplu amino asitler Polar R gruplu amino asitler Asidik R gruplu amino asitler Bazik R gruplu amino asitler • Nonpolar R gruplu amino asitler: • Glisin, alanin, valin, lösin, izolösin, alifatik yan zincirli; • Metionin, kükürt içeren; • Prolin, siklik(halkasal); • Fenilalanin ve triptofan aromatik yan zincirlidir. • • • • Polar R gruplu amino asitler: Asparajin ve glutamin, Serin, treonin ve tirozin hidroksil gruplu; Sistein kükürt içeren amino asittir. • Asidik R gruplu amino asitler: • Aspartik asit ve glutamik asittir. • Bazik R gruplu amino asitler: • Lizin, arjinin ve histidindir. Nonpolar R gruplu amino asitler: Glisin, alanin, valin, lösin, izolösin, alifatik yan zincirli; Metionin, kükürt içeren; Prolin, siklik; Fenilalanin ve triptofan aromatik yan zincirlidir. Polar R gruplu amino asitler: Asparajin ve glutamin, sırasıyla aspartik asit ve glutamik asidin amidi; Serin, treonin ve tirozin hidroksil gruplu; Sistein kükürt içeren amino asittir. Asidik R gruplu amino asitler • Aspartik asit(Aspartat) pozisyonunda ikinci bir karboksil grubu içeren amino asittir • Glutamik asit(Glutamat) pozisyonunda ikinci bir karboksil grubu içeren amino asittir • Bazik R gruplu aminoasitler • Lizin (Lys, K), alifatik zincirde -pozisyonunda ikinci bir amino grubu içeren amino asittir. • Arjinin (Arg, R), pozitif olarak yüklü guanidino grubu içeren amino asittir. • Histidin (His, H), imidazol grubu içeren amino asittir. Standart amino asitlerin özellikleri Glisinden (Gly, G) başka bütün standart amino asitlerde -karbon atomu asimetriktir. Yani glisin dışındaki bütün aminoasitlerin, α-karbonu 4 farklı kimyasal gruba bağlıdır. Bu yüzden optikçe aktiftirler. Glisin ise en basit ve asimetrik C atomu ihtiva etmeyen (optikçe inaktif) olan tek aminoasittir.(glisinde R grubunun yerinde H var.) • Aminoasitler, hem asidik(COOH), hem de bazik gruplar(NH2) taşıdıklarından amfoterik maddelerdir. • Fizyolojik pH’da(nötre yakın pH), zwitterion şeklinde bulunurlar. Alfa karboksil grubundan, proton ayrılmış ve negatif yüklü; alfa amino grubu ise, protonlanmış ve pozitif yüklüdür. Yani molekül nötrdür. • Asidik ortamda, karboksil grubu bir proton alarak molekül pozitif yüklü olur. Bazik ortamda ise, amino grubu proton kaybederek molekül negatif yüklenir. Nonstandart (Modifiye) Amino asitler • Bir standart amino asit, bir polipeptid yapısına girdikten sonra bir modifikasyona uğrarsa(hidroksillenme, metillenme vb..) nonstandart amino asitler diye bilinen bazı aminoasitler oluşabilir. • Hidroksiprolin (kollajenin yapısında) • Hidroksilizin (kollajenin yapısında) • Metillizin(miyozinin yapısında) • -karboksi glutamat(protrombin ve osteokalsin yapısında) • Desmozin (elastin yasısında) • Selenosistein (glutatyon peroksidazın yapısında) Non-Protein (Proteinlerin Yapısında Bulunmayan Aminoasitler Proteinlerin yapısına katılmayıp, serbest olarak bulunan ve hücrede çeşitli biyolojik fonksiyonlara sahip amino asitler de vardır. Bunlara non-protein aminoasitler denir. Bunlar 2 gruba ayrılırlar: 1--amino asitler Ornitin Üre döngüsünde ve arjinin biyosentezinde ara madde Sitrülin: Üre döngüsünde ara madde Arjinino süksinik asit .Üre döngüsünde ara madde Homosistein: Metiyonin metabolizmasında ara madde Homoserin: Metiyonin metabolizmasında ara madde Sistein sülfinik asit: Sistein metabolizmasında ara madde Dihidroksifenilalanin (DOPA). Katekolaminler ve melaninin ön maddesi 5-Hidroksi triptofan: Serotoninin ön maddesi 2-Amino grubu -karbonda olmayan amino asitler • -alanin: bazı dipeptitlerin yapısında bulunur. • -aminobutirik asit (GABA): Beyin dokusunda glutamik asitten oluşan bir nörotransmitterdir. • Taurin: Sisteinin yıkılışı sırasında oluşur; safra asitleri ile konjugat oluşturur. • -aminoizobutirik asit: Pirimidinlerin yıkılışı sırasında oluşur. Peptitler Peptitler, amino asitlerin polimerleridirler. Kuramsal olarak, bir amino asidin -karboksil grubunun OH’i ile, diğer amino asidin amino grubu arasından su ayrılarak peptit bağı oluşur İki amino asitten dipeptit, Üç amino asitten tripeptit,… oluşur ki 10’a kadar olan amino asitten oligopeptit, daha çok amino asitten ise polipeptit meydana gelir Bir peptitteki amino asit üniteleri, sıklıkla amino asit kalıntıları olarak adlandırılırlar. Peptidin bir ucunda, serbest -amino grubuna sahip amino asit kalıntısı bulunur ki bu uca amino-terminal uç veya N-terminal uç denir. Peptidin diğer ucunda ise, serbest -karboksil grubuna sahip amino asit kalıntısı bulunur ki bu uca da karboksil-terminal uç veya Cterminal uç denir. Fizyolojik etkiye sahip peptitler Dipeptitler: Karnozin (alanil histidin), anserin (metil karnozin)(kaslarda) Tripeptitler: Glutatyon (GSH; GSSG, -glutamil sisteinil glisin)(antioksidan özelliği var. ) Pentapeptitler: Metiyonin enkefalin, (Tyr-Gly-Gly-Phe-Met), Lösin enkefalin, (Tyr-Gly-Gly-PheLeu)(beyinde) Nonapeptitler: Oksitosin ve vazopressin (antidiüretik hormon, ADH) Proteinler Amino asitlerin belirli türde, belirli sayıda ve belirli diziliş sırasında karakteristik düz zincirde birbirlerine kovalent bağlanmasıyla oluşmuş polipeptitlerdir. Amino asitlerin polimerleridirler. Proteinlerin Yapısal Organizasyonu (3 Boyutlu Yapıları • Proteinlerin yapısal organizasyonu 4 aşamada gerçekleşir. • Her aşama belli kurallar çerçevesinde meydana gelir. • Bu aşamalarda oluşan yapılar: • • • • 1-Primer yapı 2-Sekonder yapı 3-Tersiyer yapı 4-Kuaterner yapı Protein Moleküllerinin 3 Boyutlu Yapısı Peptit bağlarıyla Tüm bağlarla Polipeptit omurganın özelliği ve özellikle hidrojen bağlarıyla Molekül ağırlığı 100000’in üzerinde olan proteinlerde • PRİMER YAPI: Proteinlerdeki polipeptid zincirlerindeki aminoasitlerin dizilişine, o proteinin primer yapısı denir. • Proteindeki aminoasitler, bir aminoasitin alfa karboksil grubuyla, diğer bir aminoasitin alfa amino grubu arasında oluşan peptid bağlarıyla bağlanırlar. • SEKONDER YAPI: Bu yapıda polipeptid zincirlerinin, bükülmeler ve katlanmalarla oluşturduğu özgün yapıdır. • Aminoasitlerin kurallı bir şekilde düzenlenmesiyle oluşan bir yapıdır. Bu yapının çeşitleri vardır. • Bunlar: • 1-α (alfa) heliks • 2-β (beta) tabaka •α-heliks düzeni: bir polipeptid zincirinin bir çubuk etrafında dolanmış şekline benzer. Bu spiral şeklindeki yapıda, yan zincirler bir merkez eksenden dışarı doğru uzanır. •Bu yapı ana zincirdeki karbonil grupları(C=O) ile imid(N-H) grupları arasında meydana gelen H bağları tarafından kurulur. •H bağları, bir aminoasitin karbonil grubunun oksijeninden, ondan 4 bakiye aşağıdaki aminoasitin imid grubunun H’ine doğru uzanır. • β-Tabaka Düzeni: Bu düzende alfa heliksin aksine, 2 veya daha fazla polipeptid parçası yer alır. • Bu zincirler birbirine paralel(N uçları aynı yönde) veya antiparalel(N ve C uçları farklı yönlerde) olabilirler. • Ana zincirler arasındaki karbonil(C=O) grupları ile imid grupları arasında oluşan H bağları molekülün akordeona benzer bir şekilde kıvrılmasına yol açar. Beta tabaka düzeni β- Tabaka Düzeni • TERSİYER YAPI: Tersiyer yapılar, sadece α-heliksler ve sadece β-zincirlerden oluşabilirler. Veya α-heliksler ve β-zincirlerin bir kombinasyonu olabilirler. • Bu yapı α-heliks ve β-tabakanın daha ileri bir organizasyonudur. Yani sekonder yapı oluştuktan sonra, polipeptid zincirinin daha ileri katlanmalar halinde düzenlenmesiyle oluşur. • Bu yapının oluşmasında görev alan bağlar (disülfit, hidrojen bağları) aminoasitlerin R grupları arasında oluşur. • KUATERNER YAPI: primer, sekonder ve tersiyer yapılanmasını tamamlamış birçoğu yapısal olarak benzer veya tamamen ilgisiz olan birden fazla polipeptid zincirlerinin bir araya gelmesiyle oluşur. • Eğer 2 subünitesi varsa proteine dimer, 3 tane subünitesi varsa trimer, 4 tane subünitesi varsa tetramer denir. • Bu yapının oluşmasında görev alan bağlar (H bağı, disülfit bağı, iyonik bağlar) R grupları arasında oluşur. Proteinlerin Özellikleri • Proteinler, çeşitli etkilerle denatüre olurlar. • Proteinler, amfoter maddelerdir. • Proteinler, polipeptit zincirindeki peptit bağlarının su girişi ile yıkılması sonucu hidroliz olurlar Proteinlerin Denatürasyonu • Proteinin peptid bağları bozulmadan, protein yapısının çözülüp disorganize olmasına DENATÜRASYON denir. ( tersiyer, sekonder ve kuaterner yapısının bozulması) • Proteinin tersiyer yapısının bozulması, sekonder ve primer yapısının korunması biçiminde olursa reversibl (geri dönüşümlü)’dür.(RENATÜRASYON) Proteinin tersiyer ve sekonder yapısının bozulması, yalnızca primer yapısının korunması biçiminde olursa irreversibl (geri dönüşümsüz)’dür. • Denatüre edici ajanlar: ısı, organik çözücüler, mekanik karıştırma, kuvvetli asitler ve bazlar, deterjanlar, ağır metaller yer alır. Proteinlerin Yapılarına Göre Sınıflandırılmaları • Basit proteinler • Bileşik proteinler Basit proteinler: Sadece polipeptid zincirlerinden oluşurlar. 2 gruba ayrılırlar. • 1-Globüler proteinler: -Albüminler (kandaki albumin) -Globülinler (kandaki globülinler ) -Globinler (Hemoglobin ve miyoglobin yapısında) -Glutelinler (Bitkisel proteinlerdir. Ör:buğdaydaki glutein) -Prolaminler (Bitkisel proteinlerdir.ör. Buğdayda gliyadin, mısırda zein) -Protaminler (Hayvansal proteinlerdir.ör: balıklardaki salmin, skombrin) -Histonlar (Ör: nükleik asitlerin yapısındaki H1, H2, H3, H4 proteinleri) • 2-Fibriler proteinler: -Keratin (Kıl, saç ve tırnaklarda bulunur.) -Elastin (Ligament ve diğer destek dokularda bulunur.) -Kollajen ( Bağ doku, kemik, kıkırdak ve tendonlarda bulunur.) -Fibrinojen (Kan plazması içinde çözünmüş olarak bulunur; kanın pıhtılaşmasında görev alır.) -Miyozin ( Kasta bulunur; kasın kasılmasında görev alır. ) Bileşik proteinler: aminoasitlerin yanısıra, aminoasitlere bağlı protein olmayan kısım taşıyan proteinlerdir. Bunlar: • 1-Glikoproteinler ve Glikozaminoglikanlar: Tükürükteki müsin, immunglobulinler glikoproteinlerdir. Kondroitin sülfat, heparin, heparan sülfat, hiyalüronik asit glikozaminogikanlardır. • 2-Proteoglikanlar: Agrekan, versikan, biglikan, lumikan. (kıkırdak, kan damarları, deri) • 3-Lipoproteinler: Proteinlerin oluşturdukları bileşik proteinlerdir. lipidlerle • 4-Fosfoproteinler: Fosfat içeren proteinlerdir. Ör: sütteki kazein, yumurtadaki vitellin. • 5-Nükleoproteinler: proteinlerin nükleik asitlerle bağlanması sonucu oluşmuş bileşik proteinlerdir. Ör: nükleohistonlar • 6-Metalloproteinler: Fe, Cu, Zn gibi metalleri içeren proteinlerdir. Ör:Fe içeren Ferritin ve transferrin, Cu içeren seruloplazmin. • 7-Hemoproteinler: Hem grubu içeren proteinlerdir. Hemoglobin, miyoglobin, sitokromlar, peroksidaz Proteinlerin Biyolojik Rollerine Göre veya • • • • • • • Fonksiyonel Olarak Sınıflandırılmaları Katalitik proteinler(enzimler): Amilaz, pepsin, lipaz Taşıyıcı proteinler (transport proteinleri): Kandaki albümin, hemoglobin, lipoproteinler, transferrin Besleyici ve depo proteinler: Ovalbümin, kazein, ferritin Kontraktil proteinler: Miyozin, aktin Yapısal proteinler: Kollajen, elastin, keratin Savunma (defans) proteinleri: İmmünoglobülinler, kan pıhtılaşma proteinleri Düzenleyici proteinler: İnsülin, büyüme hormonu • Serum albümin, en iyi bilinen taşıyıcı proteindir; bilirubin, kalsiyum, yağ asitleri ve birçok ilaç serum albümine bağlanarak taşınır. • Hemoglobin, oksijen taşıyan; • Lipoproteinler, lipid taşıyan; • Transferrin, demir taşıyan önemli taşıyıcı protein örnekleridirler. • Ferritin, demir depolayan proteindir. • Miyozin ve aktin, iskelet kaslarının kontraktil sisteminde ve aynı zamanda bir çok kas olmayan hücrede işlev görür. • Tubulin, mikrotubilleri oluşturan proteindir. • İmmünoglobülinler, omurgalıların lenfositleri tarafından yapılan, spesialize (özgülleşmiş) proteinlerdir; organizmayı istila eden bakterileri, virüsleri veya başka türe ait yabancı proteinleri (antijenler) tanıyabilirler ve presipite edebilirler (çöktürebilirler) veya nötralize edebilirler. • Fibrinojen ve trombin gibi kan pıhtılaşma proteinleri, vasküler sistem yaralandığında yaralanan yerin kan pıhtısı ile kapatılarak kan kaybının önlenmesini sağlarlar. HEMOPROTEİNLER • Prostetik grup olarak “HEM” taşıyan özelleşmiş bir grup proteindir. • İnsanlar için en önemli hemoproteinler, hemoglobin ve miyoglobindir. HEM’İN YAPISI • “HEM”, bir protoporfirin IX ve +2 değerlikli Fe(demir) kompleksidir. • Fe+2, porfirin halkasının 4 azotuyla bağlanarak, hem molekülünün ortasında bulunur. • Hem’in Fe+2’si, her biri düzlemsel porfirin halkasının ayrı tarafında olan 2 tane daha bağ yapar. • Hemoglobin ve miyoglobinde, bu pozisyonlardan biri globin proteininin histidin aminoasitinin bir yan zincirine bağlanırken, diğeri oksijen(O) bağlar. HEMOGLOBİNİN YAPISI • Prostetik grubu HEM, proteini ise globindir. • Hemoglobin biyosentezi için 3 bileşene ihtiyaç vardır. • 1-Protoporfirin IX • 2-Globin • 3-Fe+2 • Hemoglobinin büyük bölümü(% 99) globin proteininden oluşur. • Hemoglobinin globini 4 polipeptid zincirinden oluşur. Bu zincirlere α ve β zincirleri adı verilir. • • Globinin 4 polipeptid zincirinin her biri, birer tane HEM grubu ile birleşmiştir. Yani bir hemoglobin molekülünde 4 tane HEM grubu bulunur. Hemoglobin, her hem grubuna bir oksijen bağlayabilir. Hemoglobinin organizmadaki fonksiyonu, oksijeni akciğerlerden vücut hücrelerine ve karbondioksiti dokulardan akciğere taşımaktır. • İnsan kanında çeşitli hemoglobin tipleri vardır. Bunlar: • 1-Hb A: insan kanındaki hemoglobinin % 97’sini oluşturur.yapısındaki polipeptid zincirleri α1,α2, β1, β2 olarak adlandırılır. • 2-Hb A2: insan kanındaki hemoglobini %2’sini oluşturur.Hb A’nın bileşenidir. • 3-Hb F: Sadece fetal gelişim sırasında sentezlenir. Gebeliğin sonlarına doğru Hb A, Hb F’nin yerini alır. • 4-Hb A1c: Hb A’nın glikozillenmesiyle(glukoz eklenmesiyle) oluşur. HEMOGLOBİNOPATİLER • Yapısal olarak anormal üretimine bağlı olarak bir hemoglobin molekülünün veya • Yapısal olarak normal olan hemoglobinin yetersiz miktarda sentezlenmesine bağlı olarak gelişen genetik geçişli hastalık ailesidir. • Bu gruptaki önemli hastalıklar: -Orak hücre anemisi -Talasemiler • 1-ORAK HÜCRE ANEMİSİ(HB S HASTALIĞI): Hemoglobinin A’nın yapısındaki globin proteininin yapısındaki veya sentezindeki genetik farklılık nedeniyle meydana gelen bir hastalıktır.(aminoasit dizisi değişik globin moleküllerinin üretimi sonucu meydana gelir.) • Bu farklılık sonucu meydana gelen hemoglobin Hb S’dir. Hb S’nin çözünürlüğü azdır. Buna bağlı olarak Hb S’ler eritrositler içerisinde bir araya gelerek, eritrosit zarının yapısını bozarlar ve eritrositlerin şeklini deforme ederler.(hemolitik anemi) • Bunun sonucunda eritrositler hilal veya orak şeklini alırlar. Oraklaşmış hücreler, küçük çaplı damarlarda kan akımını bloke ederler. Bu durumda, dokulara oksijen sağlanması kesintiye uğrar ve hücre ölümüne(infarktüs) neden olur. • 2-TALASEMİLER: Hemoglobin A molekülünün yapısındaki globin zincirlerinin DNA’daki bir defektten dolayı, sentezinin olmadığı veya azalmış olduğu bozukluklardır. MİYOGLOBİNİN YAPISI • Prostetik grubu proteini globindir. HEM, • Miyoglobin sadece bir polipeptid zincirinden meydana gelir. Bu nedenle bir tane HEM grubu taşır. Yani, sadece bir tane oksijen molekülünü bağlayabilir. • Miyoglobin, kalp ve iskelet kasında bulunan bir hemoproteindir. Kas hücresi içinde, oksijen transport hızını arttıran bir oksijen taşıyıcısı ve oksijen deposu olarak iş görürler. YAPISAL PROTEİNLER • Vücutta yapısal fonksiyonlara sahiptirler. • Bu gruba giren proteinler: • Kollajen • Elastin • Keratin KOLLAJEN: • Vücutta en fazla bulunan proteindir. • Sert ve çözünmez bir proteindir. • Tipleri ve organizasyonları, kollajenin belirli bir organda üstlendiği role bağlıdır. • Ör: ekstrasellüler matrikste ve göz sıvısında yapıyı güçlendirecek şekilde bir jel gibi yayılmıştır. • Tendonlarda, büyük kuvvet sağlayacak sıkı paralel demetler şeklinde bulunur. • Gözün korneasında, ışığın çok az bir şekilde kırılmasını sağlayacak şekilde istiflenmiştir. • Kemikte, lifler halinde bulunur ve herhangi bir mekanik etkiye karşı direnç sağlar. KOLLAJENİN YAPISI • Kollajen molekülleri, birbiri etrafında bir üçlü heliks şeklinde sarılarak ip benzeri bir yapı oluşturan α zincirleri adı verilen 3 polipeptitden oluşur. • 3 polipeptid zinciri, zincirler arasındaki H bağlarıyla bir arada tutulur. • Alfa zincirlerindeki aminoasit dizisindeki farklılıklar, farlı özellikteki kollejen tiplerinin oluşmasına neden olur. Tip Temsil eden doku I Deri, kemik, tendon II Kan damarları, kornea, kıkırdak III Kan damarları, fetal cilt IV Bazal membran ELASTİN • Lastik benzeri özellikleri olan bir bağ doku proteinidir. • Elastin lifleri normal uzunluklarının birkaç katına kadar uzayabilirler ve geren kuvvet ortadan kalktığında tekrar eski orijinal şekillerine geri dönerler. • Akciğerler alveollerinde ve damarların duvarlarında bulunan bir proteindir. ELASTİNİN YAPISI • Elastin lifleri, düzensiz bir yapıya sahip çapraz bağlı polipeptidlerden oluşan ağsı bir yapıya sahiptir. KERATİN • Saç, tırnak ve epidermal tabakada bulunurlar. • Her biri α-helikslerden oluşan protofibriller mikrofibrilleri, mikrofibriller bir araya gelerek makrofibrilleri oluştururlar.