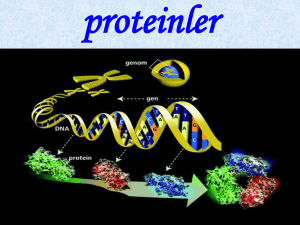
Amino Asitler, Peptidler ve Proteinler Proteinler
advertisement

Biyokimyaya Giriş Yrd. Doç. Dr. Ahmet GENÇ Adıyaman Üniversitesi Sağlık Hizmetleri Meslek Yüksekokulu Kaynaklar 1. 2. 3. Lehninger Biyokimyanın İlkeleri, Çeviri Editörü: Prof.Dr. Necdet Kılıç, Palme Yayıncılık, 3. Baskı, 2005 Harper’ın Biyokimyası, Çeviri Editörü: Prof. Dr. Nurten Dikmen, Prof. Dr. Tuncay Özgünen, 26. Baskı, 2004 Lippincott Biyokimya, Çeviri Editörü: Doç. Dr. Engin Ulukaya, 3. Baskı, 2007 Yaşamın Moleküler Anlamı Canlı organizmalar cansız moleküllerden oluşur. Bu moleküller birbirinden ayrılıp tek başlarına incelendiğinde, cansız maddenin davranışını tanımlayan tüm fiziksel ve kimyasal kurallara uydukları görülür. Ayrıca canlı organizmalar gelişigüzel bir araya getirilmiş herhangi bir molekül topluluğunca sergilenmeyen olağanüstü niteliklere sahiptir. Canlı organizmalar kendini-eşleme ve kendini oluşturma özellikleri vardır. Biyokimya Yaşamın Farklı Biçimlerini Birleştirici Kimyasal Terimlerle Açıklar Canlı organizmalar cansız moleküllerden oluşuyorsa, bu moleküller yaşam birlikteliği nasıl sağlanmaktadır? Biyokimya tüm organizmalarda ortak olan yapıları, mekanizmaları ve kimyasal süreçleri moleküler anlamda tanımlar ve bütünüyle yaşamın moleküler anlamını diyebileceğimiz yaşamın tüm değişik formlarının, ilkelerinin yaşamla bağdaşan düzenleyici ilkelerini açıklar. Biyokimya tüm organizmalarda ortak olan yapıları, mekanizmaları ve kimyasal süreçleri moleküler anlamda tanımlar Monomerik altbirimler Tüm Makromoleküller Birkaç Basit Bileşikten Oluşur Deoksiribonükleotidler (4 farklı çeşit) Amino asitler (20 farklı çeşit) Canlı sistemlerin moleküler yapıtaşlarının pek çoğu, H, O, N ve diğer C atomlarıyla yada kovalent şekilde bağlı karbon atomlarından oluşur. Amino asitler, nükleotidler ve monosakkaritler gibi organik bileşikler olan makromoleküllerin (proteinler, nükleik asitler ve polisakkaritlerin) monomerik alt birimleri olarak işlev görürler DNA; 4 çeşit deoksiribonükleotidlerden RNA; 4 çeşit ribonükleotidlerden İngilizce alfabesinin harflari (26 farklı çeşit) Proteinler; 20 farklı aminoasitlerden oluşmaktadır Düzenli doğrusal diziler 8 altbirimden oluşan bir parça için olası dizi çeşitlerinin sayısı Bütün monomerler organizmalarda aynıdır. Bu monomerlerin üç boyutlu düzenlenmeleri,genler, katalizörler, hormonlar ve diğerleri gibi özel biyolojik işlevlerini belirler. Tüm makromoleküllern monomerlerin birçoğu hücrelerde birden fazla işlev görmektedir. Nükleotidler: enerji-taşıyıcı moleküller Amino asitler: hormonlar, nörotransmitörler, pigmentler.. 1. 2. 3. Tüm canlılar moleküllerini aynı çeşit monomerik altbirimlerden oluşurlar Bir makromolekülün yapısı ona özel biyolojik işlevini belirler. Her cins ve tür, belirleyici makromolekül dizisiyle tanımlanır Kimyasal Bileşim ve Bağlanma Doğal olarak bulunan 90’dan fazla kimyasal elementten sadece 30 kadarı canlı organizmalar için esastır. Canlı organizmalarda bulunan elementlerin çoğu nispeten düşük atom numaralarına sahiptir; sadece 5 tanesinin atom numarası 34’ten büyüktür. Canlı organizmalarda, bütün atomların yüzdesi olarak, en fazla bulunan element H, O, N ve C’dur, hepsi hücrenin %99’undan fazlasını oluşturur. Bunlar, sırasıyla bir, iki, üç ve dört bağ yapabilmektedir Moleküler Bileşim Dinamik Kararlı Durumu Yansıtır Enzimler Kimyasal Tepkime Dizilerini Başlatır Birkaçı dışında metabolik katalizörler, proteinlerdir (Birkaç RNA molekülünün katalitik rolü vardır). Birkaçı dışında her enzim, özgül bir tepkime katalizler ve hücrede her bir tepkime farklı bir enzim tarafından katalizlenir Enzimlerin çokluğu, özgüllükleri ve düzene duyarlılıkları, hücrelere aktivasyon engellerini seçici şekilde düşürme yeteneği sağlar. Hücrelerde enzim-katalizli binlerce kimyasal tepkime, yol adı verilen, bir tepkimenin ürününün bir sonrakinde reaktan (tepken) olduğu, birçok farklı ardışık tepkime dizininde işlevsel olarak düzenlenmiştir Enzimler Kimyasal Tepkime Dizilerini Başlatır Bazı yollar organik besinleri kimyasal enerjiye özütlemek ve hücre için yararlı biçime çevirmek üzere basit son ürünlere dönüştürür. Bu yıkan, serbest enerji oluşturan tepkimelere katabolizma adı verilir Diğer yollar küçük öncül moleküllerle başlar; proteinler, nükleik asit gibi daha büyük ve karmaşık moleküllere çevrilir. Enzimkatalizli yolları değişmez bir şekilde enerji alınmasını gerektirir ve buna anabolizma adı verilir Katabolizma ve anabolizma yolları hücresel metabolizmayı oluşturur. ATP bu yollarda katabolik ve anabolik bileşenleri arasında başlıca bağlayıcı halkadır Metabolizma Denge ve Ekonomi Sağlamak Üzere Düzenlenir Canlı hücreler aynı anda karbohidrat, yağ, protein ve nükleik asit moleküllerinin binlerce çeşidini ve onların basit altbirimlerini sentezlemekle birlikte sadece hücrenin gereksinim duyduğu miktarlarda sentezlenmesini sağlar Ör, hücre çoğalmasında proteinler ve nükleik asitlerin öncülleri yüksek oranda bulunurken, çoğalmayan hücrede gereksinim duyduğu miktar kadar bulunur. Her metabolik yoldaki anahtar enzimler öyle düzenlenir ki, öncül molekülünün her tipi, hücrenin o andaki gereksinimlerine uygun miktarda oluşturulur. İzolösin Sentezi Eğer hücre protein sentezi için gerektiğinden fazla izolösin sentezlemeye başlarsa, kullanılmayan izolösin molekülleri birikir. İzolösinin yüksek derişimleri, sentezine ait yolun ilk enziminin aktivitesini inhibe eder; izolösin amino asidinin üretimi yavaşlar. Bu şekilde geribeslemeli (feedback) inhibisyon her metabolik araürünün üretimi ve kullanımı dengede tutmaktadır. Depo besinler Diğer hücresel iş Karmaşık Sindirilmiş besinler biyomoleküller Solar fotonlar Mekanik iş Osmotik iş Katabolik tepkime yolları (egzergonik) Anabolik tepkime yolları (endergonik ) Metabolizma Denge ve Ekonomi Sağlamak Üzere Düzenlenir Canlı hücreler kendi katalizörleri olan enzimlerin sentezlerini de düzenler. Böylece bir hücre, bir ürünün yeterince sağlandığı durumda, bu ürünü yapmak için gereken enzimin sentezini durdurabilir. Canlı hücreler sürekli olarak en ekonomik duruma ayarlanmak üzere kendini düzenleme özellikleri vardır Biyomoleküller Çok bulunan elementler: H, C, N, O, Na, P, S, Cl, K, Ca Bunlar hücre ve dokuların yapısal bileşenleridir ve gram düzeyinde bulunması gerekir Diğer elementler ise eser (iz) elementler olup gereksinimleri insanlar için çok azdır: insanlar için birkaç miligram Fe, Cu ve Zn, diğerleri ise çok az daha miktarda kullanılmaktadır İz (eser) elementler insan vücut ağırlığının çok küçük kısmını temsil eder anacak tümü genellikle enzimleri de içeren özgül proteinlerin işlevleri için şart olduklarından, yaşam için vazgeçilmezdir. Fe, I, P, S, Cu, Zn vb. Ör, hemoglobin molekülünün oksijen-taşıma kapasitesi kesinlikle, kütlesinin sadece %0.3’ünü oluşturan dört demir iyonuna bağlıdır. Biyomoleküller Karbon Moleküllerdir Canlı organizmanın kimyası, hücrelerin kuru ağırlığının yarısından fazlasına karşılık gelen karbonun çevresinde düzenlenmiştir. Karbon, hidrojen atomlarıyla tek bağ, oksijen ve azot atomlarıyla hem tek, hem de çift bağ yapabilir. Karbon atomlarının biyolojideki en büyük önemi, çok dayanıklı olan karbonkarbon tek bağlarını oluşturmak amacıyla elektron çiftlerini diğer karbon atomlarıyla paylaşabilmesidir Kimyasal bağlar Kovalent bağlar Hidrojen bağları İyonik bağlar Van der Waals bağları Kovalent bağlar İki ametal arasında elektronların ortaklaşa kullanımıyla oluşan bağa kovalent bağ denir. Farklı cins iki ametâl arasında oluşan bağa polar kovalent bağ denir. Son yörüngelerdeki elektronlar ortaklaşa kullanılır. Polar kovalent bağ sonucunda oluşan molekül bileşik molekülüdür. Ör, H2O Negatif yüklü elektronun bağa katılan iki atom tarafından eşit kuvvette çekildiği kovalent bağa non-polar (apolar) kovalent bağ denir. Aynı cins iki ametâl atomu arasında oluşan bağa denir Ör, H2 Polar Kovalent Bağ Apolar Kovalent Bağ Hidrojen bağları Bir hidrojen (H) atomunun oksijen (O) ve azot (N) gibi bir elektronegatif atoma kovalent bağlanması halinde sonucunda oluşur İyonik bağlar İyonik bağ, zıt ve eş yüklü iyonlar arasındaki elektrostatik kuvvetlere dayanan bir kimyasal bağ türüdür. Ör, NaCl Wan der Waals Bağ Bir molekülün pozitif diğerinin de negatif yüklü kısımları arasında kısa süreli zayıf çekim kuvvetleri oluşur. Bu kuvvetlerin etkisi ile moleküller arasında oluşan bağlara Wan der Waals bağları denir. Oldukça zayıf olan bu bağ çeşidinin kuvveti molekül büyüklüğü arttıkça artar. Kovalent bağlı apolar moleküllerde (H2, CO2, N2 gibi) ve soygazlarda yoğun fazlarda sadece kütlelerinden kaynaklanan bir çekim kuvvetine denilmektedir Amino Asitler, Peptidler ve Proteinler Proteinler Tüm hücrelerde ve hücrelerin de tüm bölümlerinde en çok bulunan biyolojik makromoleküllerdir. Tek bir hücrede bile binlerce farklı çeşitte ve büyüklükte bulunur. Genetik bilginin ifadelendiği moleküler araçlardır. Tüm proteinler 20 aminoasidin doğrusal diziler halinde kovalent olarak bağlanmasıyla oluşur. Farklı organizmalar bu 20 amino asidin farklı dizilimleri sonucunda enzimler, hormonlar, antikorlar, taşıyıcılar, kas, tüyler, örümcek ağları, boynuz, mantar zehirleri, gibi sayısız faklı biyolojik aktiviteye sahip ürünler oluşturmaktadır. Lusiferaz enziminin katalizlediği, lusiferin proteini ve ATP’nin tepkimesi sonucu ışık oluşur Kreatin proteini tüm omurgalılarda; saç, pul, boynuz, yün, tırnak ve tüyün başlıca yapısal elemanıdır Proteinler Aminoasitlerin dehidrate (su kaybetmiş) polimerleridir, her bir amino asit kalıntısı (rezidüsü; bir amino asidin diğeriyle bağlanırken su kaybetmesini yansıtır) yanındakine özel bir tip kovalent bağla bağlanmaktadır. Proteinler çok çeşitli yöntemlerle yapısal amino asitlerine yıkılabilir (hidrolizlenebilir) Proteinlerin yapı taşı olan amino asitlerin isimleri, bazen ilk izole edildiği kaynaktan türetilmiştir. Asparajin Asparagus (kuşkonmaz) Tirozin peynir (tyros) Glisin (glykos, tatlı) Amino Asitler Ortak Yapısal Özellikleri Doğada 300 den fazla amino asit tanımlanmış olmasına rağmen bunlardan sadece 20 tanesi memelilerin proteinlerinin yapısında bulunmaktadır. Proteinlerde bulunan 20 standart amino asidin hepsi de α-amino asittir. Aynı karbon atomuna bağlı (α-karbon) bir karboksil grubu (COO-), bir amino grubu (NH3+) ve yan gruba (R-Grubu) sahiptir Aminoasitlerin sudaki çözünürlüğünü etkileyen elektrik yükü, büyüklük ve yapısal yönden farklı olan yan zincirleri veya Rgruplarıyla birbirlerinden ayrılırlar Bu yapı bir α-amino asit hariç hepsinin ortak yapısıdır Amino Asitler Ortak Yapısal Özellikleri Standart amino asitler proteindeki kompozisyon ve dizilimlerini belirlemek amacıyla 3-harfli kısaltma veya tek harfli sembol olarak gösterilmektedir. Ör, Alanin-Ala-A; Glisin-Gly-G; Glutamin-Gln-Q Glisin dışındaki tüm standart amino asitlerde α-karbon atomu 4 farklı grupla bağ yapar: Karboksil grubu Amino grubu R grubu H atomu Amino Asitler Ortak Yapısal Özellikleri Proteinlerde bu karboksil ve amino gruplarının hemen tamamı peptid bağının yapısında yer alır ve genellikle (hidrojen bağı oluşumu hariç) kimyasal reaksiyonlara girmez Bu nedenle, bir amino asidin proteindeki rolünü belirleyen yan zincirlerin yapısıdır. Amino Asitler R Gruplarına Göre Sınıflandırılırlar Amino asitler R gruplarının özelliklerine göre, özellikle polariteleri veya biyolojik pH’ta suyla tepkimeye girme eğilimlerine göre 5 ana sınıfta gruplandırılırlar. R gruplarının polaritesi, tamamen polar olmayan ve hidrofobik, yüksek oranda polar veya hidrofiliğe kadar çeşitlidir Polar olmayan (nonpolar), Alifatik R grupları Aromatik R Grupları Polar, Yüksüz R Grupları Pozitif Yüklü (Bazik) R Grupları Negatif Yüklü (Asidik) R Grupları 1. Polar Olmayan, Alifatik R Grupları Bu amino asitlerin yan zincirleri (R grupları) polar olmayan ve hidrofobiktir. Glisin Alanin Valin Proteinlerde alanin, valin, lösin ve izolösinin yan grupları bir araya gelip kümeleşerek, hidrofobik etkileşimlerle protein yapısını sabitler. Lösin Metiyonin İzolösin 2. Aromatik R Grupları Aromatik (halkasal) yan zincirli fenilalanin, tirozin ve triptofan polar olmayan (hidrofobik) aminositlerdir Hepsi hidrofobik etkileşimle katılabilir. Triptofan ve tirozin, bir dereceye kadar da fenilalanin ultraviyole ışığını absorblar. Bu özellik proteinlerin tanımlanmasında kullanılmaktadır. Fenilalanin Tirozin Triptofan Ör, Aromatik R Grupları olan triptofan ve tirozin 280 nm Absorbans Birçok molekül ışığı belirli dalga boyunda absorblar. Dalgaboyu (nm) 3. Polar Yüksüz R Grupları Polar olmayan amino asitlere göre suda daha fazla çözünebilir ve hidrofiliktir Serin Treonin Sistein Asparjin Glutamin Bu amino asitler: serin, treonin, sistein, prolin, asparajin ve glutamindir. Prolin 4. Pozitif Yüklü (Bazik) R Grupları R gruplarında ikinci bir amino grubuna sahip olan lizin, arjinin ve histidin pH 7’de pozitif yüklü R grubu içeren amino asitlerdir. Lizin Arjinin Histidin 5. Negatif Yüklü (Asidik) R Grupları R gruplarında ikinci bir karboksil grubuna sahip aspartat ve glutamat pH 7’de negatif yüke sahip R grubu içeren amino asitlerdir. Aspartat Glutamat Lambert-Beer Yasası: Işığın Moleküller Tarafından Emilimi (Absorbsiyonu) Işık absorbansının spektrofotometreyle ölçümü moleküllerin saptanması, tanımlanması ve çözelti içerisindeki derişimlerinin ölçümünde kullanılır. Belli bir dalga boyunda bir çözelti tarafından absorblanan ışığın miktarı; ışığın katettiği mesafenin uzunluğuna ve absorblayan maddenin derişimine bağlıdır. Gelen ışığın yoğunluğu Io Işık Geçen ışığın yoğunluğu I Monokromatör C mol/litre absorblayan türleri içeren örnek küveti Dedektör I0: Gelen ışığın yoğunluğu, I: geçen ışığın yoğunluğu, Є: molar ekstinksiyon katsayısı (mol-cm başına litredeki birim), c: absorblayan maddenin derişimi (litre başına mol cinsinden) ve l: ışığı abroblayan örneğin yolunun uzunluğu (cm cinsinden) Absorbans = A = Işığın katettiği yolu 1.0 cm ve sabit olduğunda absorbans çözeltinin derişimiyle doğru orantılıdır Gelen ışığın yoğunluğu Io Işık Monokromatör Geçen ışığın yoğunluğu I Dedektör C mol/litre absorblayan türleri içeren örnek küveti Standart Dışı Amino Asitler Önemli İşlevlere Sahiptir Proteinler, 20 standart amino asit dışında polipeptidlerde yer alan ve standart amino asit kalıntılarının modifikasyonuyla oluşan standart dışı amino asit kalıntıları da içerebilir. Standart dışı amino asitlerden 4-hidroksiprolin prolinin, 4hidroksilizin lizinin türevidir. 4-hidroksiprolin bitki hücre duvarı proteinlerinde ve her ikisi de bağ dokunun fibröz proteini olan kollajende bulunurlar. 6-N-Metillizin kas dokusunun kontraktil proteini olan miyozinin yapısal elemanıdır. γ-karboksiglutamat pıhtılaşma proteinlerinde protrombinde ve biyolojik işlevi Ca2+ bağlayan diğer proteinlerde bulunur Standart Dışı Amino Asitler Önemli İşlevlere Sahiptir Standart Dışı Amino Asitler Önemli İşlevlere Sahiptir Ornitin ve sitrülin arjinin biyosentezinde ve üre döngüsünde anahtar ürünlerdir. Peptitler Amino Asit Zincirleridir İki amino asit molekülü peptit bağı adı verilen bir amit bağıyla kovalent bağlanabilir ve sonuçta dipeptit oluşur. Peptit bağı bir amin asitin α-karboksil grubu ile diğerinin αamino grubu arasında suyun uzaklaşmasıyla oluşur. Dipeptit Bağı Üç amino asit, iki peptit bağıyla bağlanırsa tripeptit oluşur. Benzer şekilde tetrapeptitler, pentapeptitler ve çok sayıda amino asidin bağlanmasıyla polipeptitler oluşur. Çoğu zaman “protein” ve “polipeptit” birbirlerine benzer anlamda kullanılmaktadır Amino-terminal uç Karboksi-terminal uç AlanilGlutamilglisillizin Biyolojik Olarak Aktif Peptitler ve Polipeptitler Çok Geniş Bir Büyüklük Sınırına Sahiptir Doğadaki peptitler iki amino asitten birkaç bin amino asit kalıntısına kadar uzunlukta olabilir. Birçok ufak peptit çok düşük derişimlerde etkisini gösterir. Örneğin çok sayıda omurga hormonu küçük peptitlerdir. Oksitosin (9 amino asit kalıntısı) arka hipofizden salınan uterus kasılmasını uyaran bir hormondur Küçük polipeptitler ve oligopeptidlere örnek ise biri 30 diğeri 21 amino asit kalıntısı olan iki polipeptit zincirinden oluşmuş pankreatik hormon insülindir Glukagon ise insüline zıt etki gösteren bir diğer pankreatik hormondur (29 amino asit). Ticari olarak sentezlenen Aspartam olarak bilinen yapay tatlandırıcı, küçük amino asitlere örnektir. Proteinlerdeki polipeptit zincirinin uzunluğu ne kadardır? Biyolojik Olarak Aktif Peptitler ve Polipeptitler Çok Geniş Bir Büyüklük Sınırına Sahiptir Bazı proteinler tek polipeptit zinciri içerirler, bazıları ise iki veya daha fazla sayıda nonkovalent birleşmiş polipeptitten oluşurlar ve bunlara çoklualtbirimli proteinler denir Örnek olarak Hemoglobin iki benzer alfa ve iki benzer beta zinciri olarak dört polipeptit alt birimi içerir ve dördü birbirine nonkovalent etkileşimlerle bağlıdır. Bu çoklualtbirimli protein yapısında her bir alfa alt birimi bir beta altbirimiyle eşleşmiştir. Bazı Proteinler Amino Asitler Dışında Kimyasal Gruplar İçerir Pek çok protein, örneğin ribonükleaz enzimi ve kimotripsinojen, sadece amino asit kalıntıları içerir ve basit proteinler olarak adlandırılır. Bazı proteinler ise amino asitlere ek kalıcı bir kimyasal kısım içerir ve bunlara konjuge (birleşik) proteinler denir. Konjuge proteinin amino asit olmayan kısmına prostetik grup denir Konjuge proteinler prostetik grubun kimyasal yapısı temel alınarak sınıflandırılır, ÖR, Lipoproteinler, glikoproteinler, metaloproteinler Protein Yapısının Birkaç Düzeyi Vardır Proteinlerin yapısını tanımlamak için ve anlamak için dört gruba ayrılmıştır. Kovalent bağlarla (başlıca peptit bağları ve disülfit bağları) bağlanmış amino asit kalıntılarının oluşturduğu polipeptit zinciri birincil yapıdır (primer yapıdır). Birincil yapının en önemli yanı amino asit kalıntılarının dizisidir. Protein Yapısının Birkaç Düzeyi Vardır İkincil yapıda ise amino asit kalıntıları kısmen kararlı düzenlemelerle tekrarlayan yapısal modeller oluşturur. Üçüncül yapıda polipeptitin tüm üç boyutlu katlanmalarının bir görüntüsüdür. Bir protein iki veya daha çok sayıda polipeptit altbirimi içerdiğinde uzaysal düzeni dördüncül yapı olarak adlandırılır Proteinler Ayrılabilir ve Saflaştırılabilir Bir proteinin özelliklerini, amino asit birleşimini ve dizisini tanımlayabilmek için önce saf olarak elde edilmesi esastır. Hücreler binlerce farklı çeşit protein içermektedir ve bunlardan sadece bir tanesi nasıl saflaştırılabilir? Bir proteinin diğerinden farklı özeliklerinin olması saflaştırma için avantaj sağlar Ör, pek çok protein özgül olarak başka biyomoleküllerle bağlanır ve bu bağlanma özellikleriyle proteinler saflaştırılabilir. Proteinler Ayrılabilir ve Saflaştırılabilir Protein kaynağı genellikle doku veya mikrobiyal hücrelerdir. Protein saflaştırmadaki ilk basamak bu hücreleri parçalamaktır. Çoğunlukla proteinlerin büyüklük, yük gibi bazı özelliklerine göre farklı fraksiyonlara ayrılma işlemine tabi tutulur. Saflaştırmada en önce gelen proteinlerin pH, ısı, tuz derişimi ve diğer etkenlerden etkilenen bir kompleks işlevi olan çözünürlüklerindeki farklılıktan faydalanılır. Proteinler Ayrılabilir ve Saflaştırılabilir Genel olarak yüksek tuz derişimlerinde proteinlerin çözünürlüğü düşüktür ve bu etki tuzla çöktürme olarak adlandırılır. Uygun miktarda tuz ilavesiyle çözelti içerisindeki bazı proteinler çöktürülürken, diğerleri çözeltide kalır. Amonyum sülfat [(NH4)2SO4] suda yüksek çözünür olduğu için bu amaçla sıklıkla kullanılır. Büyük proteinler diyaliz işleminde protein çözücüden ayrıştırılabilir. Protein ayrıştırılmasında en çok kullanılan metot kolon kromatografisidir ve proteinleri yük, büyüklük, bağlanma affinitesi ve diğer özelliklerine göre ayrılır. Kromatografi-1 Bir karışımdaki kimyasal yapıları çok az farklılık gösteren maddeleri, birbirinden ayrıştırmak veya saflaştırmak amacıyla kullanılan yöntemlerden birisidir. Yöntemi ilk kez geliştiren Rus botanikçi Mikhail Tsweet, bitki pigmentini kalsiyum karbonat (tebeşir) kolonundan geçirerek çeşitli renk bantları elde etmiş ve 1906'da yayınladığı makalesinde bu ayrışmanın kimyasalların adsorbsiyonuna bağlı olduğunu belirtmiştir. Beyaz tebeşir kolonda renkli bantların görülmesi üzerine chroma=renk ve graphe=yazı anlamında kromatografi terimini kullanmıştır. Kromatografi-2 1941 yılında Martin ve Synge partisyon (partition) kromatografiyi geliştirerek suyla kaplı silika jel kolonunda monoamino monokarboksilik asitleri ayrıştırmayı başarmışlardır. Silika jelin istenilen performansı göstermemesi üzerine, bunun yerine kağıt kullanmışlar ve kağıt kromatografisini oluşturmuşlardır. Kromatografik sistemde, durgun ve hareketli faz olmak üzere iki faz bulunur. Durgun faz (katı veya sıvı) sabit, hareketli faz (sıvı veya gaz) ise akışkan haldedir. Kromatografi-3 Ayrıştırılmak istenen moleküller durgun ve hareketli fazlar arasında dağılıp bir dengeye ulaşırlar. Hareketli faz içinde daha iyi çözünen ve durgun faza daha az ilgi gösteren bir molekül; hareketli fazda daha az çözünen ve durgun faza daha fazla ilgi gösteren bir başka moleküle oranla daha hızlı hareket edecek ve bu iki molekül birbirlerinden farklı alanlara göç ederek ayrışmış olacaktır. Eğer bu moleküller renkli maddeler ise doğrudan görüldükleri halde, renksiz maddeler ikinci bir boyama işlemini takiben görülebilirler. Kromatografi-4 Değişik çalışma prensipleri içeren kromatografik yöntemler geliştirilmiştir. Bu yöntemleri mekanizmalarına göre sınıflamak mümkünse de, aynı kromatografik sistem içinde birden fazla mekanizmadan yararlanmak da mümkündür. Başlıca kromatografi yöntemleri: Adsorbsiyon İyon Değiştirici Kromatografi Affinite Kromatografi Moleküler Eleme Adsorbsiyon Durgun fazı oluşturan destek madde ile molekül arasındaki elektrostatik etkileşim, hidrojen bağları veya destek madde içinde molekülün dağılması gibi özellikler adsorpsiyon kromatografisinin temelini oluşturur. Moleküllerin hareket hızları, hareketli faz içinde çözülme oranlarına ve durgun faza olan ilgi derecelerine bağlı olarak değişkenlik gösterir ve kimyasal olarak farklı özellik içeren moleküller birbirlerinden farklı alanlara göç ederler. Durgun ve hareketli fazı oluşturan maddeler ayrıştırılmak istenen moleküllerin özelliklerine göre seçilir. İyon Değiştirici Kromatografisi Bu tip kromatografide moleküllerin iyonik yüklerinin yönü ve kuvveti ayrışmanın temelini oluşturur. İnorganik iyonlar, amino asitler, nükleik asitler ve proteinler bu tip ayrıştırma için ideal moleküllerdir. Katyonları ayrıştırmak için negatif yüklü gruplardan oluşan katyon-değiştirici reçineler (sülfonat veya karboksilat iyonları gibi); anyonları ayrıştırmak için ise pozitif yüklü gruplardan oluşan anyon-değiştirici reçineler (trietilaminoetil) kullanılır. İyon Değiştirici Kromatografisi Karışım halindeki numune kolona uygulandıktan sonra hareketli fazın pH'sı veya iyonik gücü değiştirilerek istenen özellikteki moleküllerin akışkanlığı sağlanır. Numune içindeki diğer madde ise kolonda kalır. pH veya iyonik gücü biraz daha değiştirilerek ikinci fraksiyonun da kolondan alınması mümkündür. Affinite Kromatografisi ve Moleküler Eleme Affinite Kromatografi: Ayrıştırılmak istenen molekülün biyokimyasal özelliğine göre, durgun fazda onu bağlayabilecek özel yapıların kullanılması prensibine dayanır. En sık olarak enzim-substrat, hormon-reseptör veya antijen-antikor etkileşimleri kullanılır. Moleküler Eleme: Her ne kadar şekil ve hidrasyon durumları etken olsa da, temel olarak molekülleri büyüklüklerine göre ayrışmasını sağlayan bir kromatografi türüdür. Kolon kromatogrofisi Uygun kimyasal özelliğe sahip delikli katı maddeyle kolon kaplanır (duran faz) ve tampon çözelti (hareketli veya mobil faz) buradan filtre edilir. Protein içeren çözelti kolonun tepesinden bırakılır, katı matriks üzerinden bu çözelti filtre olur. Her bir protein özelliğine göre hızlı veya yavaş olarak kolon boyunca hareket eder. Kolon uzunluğu artıkça ayrılma daha iyi olur, çözünürlük artar fakat her protein bandı zamanla düfüzyonel yayılma nedeniyle genişler ve bu olay proteinlerin saf elde edilmesini engeller. İyon değiştirme Kromatografisi Negatif yüklü işlevsel grup içeren polimer yatak Katyon değiştiriciler içeren kolona protein karışımı ilave edilmiştir Uygulanan pH’daki net yüklerine göre proteinlerin kolondan ayrılış hızları tayin edilir. Katyon değiştiriciler uygulandığında net negatif yükü fazla olan proteinler daha hızlı ve çabuk ayrışır Moleküler eleme veya Boyut ayırma kromatografisi Affinite kromatografisi Yüksek Basınçlı Sıvı Kromatogrofisi (HPLC) Yüksek basınçlı pompalar kullanılır ve protein molekülleri kolonunun aşağısına doğru hızla itilir HPLC’de kolondan geçiş süresi oldukça azaltılmış ve yüksek çözünürlükte ayrışma sağlamaktadır Proteinler Elektroforezle Ayrıştırılabilir ve Tanımlanabilir Yüklü proteinler elektrik alanında göçleri sonucunda birbirinden ayrıştırılabilir ve tanımlanabilir. Elektroforez, proteinlerin izoelektrik noktaları ve yaklaşık molekül ağırlıkları gibi çok önemli özelliklerini de tanımlamaya olanak sağlar Örnek Göçün yönü