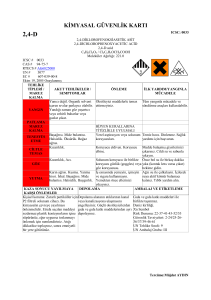
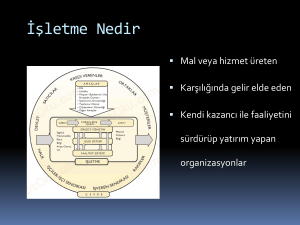
BAZI SENTETİK OKSİNLERİN BUĞDAYDA (Triticum aestivum L
advertisement

BAZI SENTETİK OKSİNLERİN BUĞDAYDA (Triticum aestivum L.) MEYDANA GETİRMİŞ OLDUĞU RETROTRANSPOZON POLİMORFİZMİNİN BELİRLENMESİ Muhammet YAPRAK Yüksek Lisans Tezi Biyoloji Anabilim Dalı Moleküler Biyoloji Bilim Dalı Prof. Dr. Güleray AĞAR 2015 Her hakkı saklıdır ATATÜRK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ YÜKSEK LİSANS TEZİ BAZI SENTETİK OKSİNLERİN BUĞDAYDA (Triticum aestivum L.) MEYDANA GETİRMİŞ OLDUĞU RETROTRANSPOZON POLİMORFİZMİNİN BELİRLENMESİ Muhammet YAPRAK BİYOLOJİ ANABİLİM DALI Moleküler Biyoloji Bilim Dalı ERZURUM 2015 Her hakkı saklıdır T.C. ATATÜRK ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ TEZ ONAY FORMU BAZI SENTETİK OKSİNLERİN BUĞDAYDA (Triticum aestivum L.) MEYDANA GETİRMİŞ OLDUĞU RETROTRANSPOZON POLİMORFİZMİNİN BELİRLENMESİ Prof. Dr. Güleray AĞAR danışmanlığında, Muhammet YAPRAK tarafından hazırlanan bu çalışma 09/07/2015 tarihinde aşağıdaki jüri tarafından Biyoloji Anabilim Dalı – Moleküler Biyoloji Bilim Dalı’nda Yüksek Lisans tezi olarak oybirliği/oy çokluğu (…/…) ile kabul edilmiştir. Başkan : Prof. Dr. Güleray AĞAR İmza : Üye : Doç. Dr. Mahmut Sinan TAŞPINAR İmza : Üye : Doç.Dr. Hasan Türkez İmza : Yukarıdaki sonuç; Enstitü Yönetim Kurulu ........./......../…….. tarih ve . . . . . ./ . . . . . . . . . . . . . . nolu kararı ile onaylanmıştır. Prof. Dr. Ertan YILDIRIM Enstitü Müdürü Not: Bu tezde kullanılan özgün ve başka kaynaklardan yapılan bildirişlerin, çizelge, şekil ve fotoğrafların kaynak olarak kullanımı, 5846 sayılı Fikir ve Sanat Eserleri Kanunundaki hükümlere tabidir. ÖZET Yüksek Lisans Tezi BAZI SENTETİK OKSİNLERİN BUĞDAYDA (Triticum aestivum L.) MEYDANA GETİRMİŞ OLDUĞU RETROTRANSPOZON POLİMORFİZMİNİN BELİRLENMESİ Muhammet YAPRAK Atatürk Üniversitesi Fen Bilimleri Enstitüsü Biyoloji Anabilim Dalı Moleküler Biyoloji Bilim Dalı Danışman: Prof. Dr. Güleray AĞAR Bu araştırmada, sentetik oksinlerden 2,4-D ve dikambanın 4 farklı konsantrasyonunun (250, 500, 750 ve 1000 ppm) stresi ile aktive olan bazı retrotranspozonların (WLTR2105, N-57 (Nikita57), Sukkula, Nikita E2647, Stowaway, BARE 1(0)) polimorfizmi ve oluşan DNA hasarları araştırılmıştır. Retrotranspozonların polimorfizminin ve DNA hasarının belirlenmesi için IRAP ve REMAP teknikleri kullanılmıştır. Araştırma sonucunda, sentetik oksin uygulamasında retrotranspozon polimorfizminin yüksek olduğu ve DNA hasarının meydana geldiği gözlenmiştir. Ayrıca polimorfizmin göstergesi olan GTS oranının artan sentetik konsantrasyonuna bağlı olarak azaldığı tespit edilmiştir. 2015, 97 sayfa Anahtar Kelimeler: Buğday, Sentetik Oksin, 2,4-D, Dikamba, IRAP, REMAP, Retrotranspozon. i oksin ABSTRACT Master Thesis DETERMINATION OF SOME SYNTHETIC AUXINS EFFECT ON RETROTRANSPOSON POLYMORPHISM IN WHEAT (Triticum aestivum L.) Muhammet YAPRAK Ataturk University Graduate School of Natural and Applied Sciences Department of Biology Branch of Molecular Biology Supervisor: Prof. Dr. Güleray AGAR In this study, retrotransposon polymorphisms (WLTR2105, N-57 (Nikita 57), Sukkula, Nikita E2647, Stowaway, BARE 1(0)) and DNA damages have been studied to understand effects of stress that are activated by four different concentrations of 2,4-D and dicamba (250, 500, 750 and 1000 ppm) applications. IRAP and REMAP assays have been used for determination of retrotransposon based polymorphisms and DNA damages. The results show that, retrotransposon polymorphisms was high level and also DNA damage observed in synthetic auxins treatments. Additionally, GTS value that is an indicator of polymorphism has been determined that it has been decreased by increasing synthetic auxins concentrations. 2015, 97 pages Keywords: Wheat, Synthetic Auxin, Retrotransposon. ii 2,4-D, Dikamba, IRAP, REMAP, TEŞEKKÜR Yüksek Lisans tezi olarak sunduğum bu çalışmanın konusunun seçiminde ve tezin hazırlanmasında çok değerli fikirlerini bana aktararak bilimsel çalışmalarımda bana her alanda yol gösteren ve beni çalışmak için teşvik eden, lisansüstü eğitimim boyunca değerli görüş, eleştiri ve düşüncelerinden yararlandığım, değerli sevgisini, yardım ve katkılarını hiçbir zaman esirgemeyen saygı değer tez danışmanım Sayın Prof. Dr. Güleray AĞAR’a sonsuz teşekkür ve şükranlarımı sunarım. Bu çalışma Atatürk Üniversitesi Fen Fakültesi Biyoloji Bölümü Moleküler Biyoloji ve Bakteriyoloji Laboratuarı’nda yapılmıştır. Tez çalışmalarım süresince maddi-manevi destek ve yardımlarını esirgemeyerek yanımda olan Sayın Yrd. Doç. Dr. Murat AYDIN’a, Sayın Arş. Gör. Esra ARSLAN’a, Sayın Arş. Gör. Gökçe KARADAYI’ya, Sayın Biyolog Burcu SIĞMAZ’a, Sayın Biyolog Semra YAĞCI’ya ve Sayın Biyolog Ceyda BOZOĞLU’na; ayrıca Moleküler Biyoloji ve Bakteriyoloji Laboratuarı’nda çalışan değerli hocalarıma ve arkadaşlarıma desteklerinden dolayı çok teşekkür ederim. Hayatımın her döneminde maddi ve manevi desteklerini, eşsiz sevgilerini, çok kıymetli emeklerini ve sabırlarını esirgemeyen, bana değerli olduğumu hissettiren aileme hep yanımda oldukları ve bana güvendikleri için en içten sevgi, saygı ve teşekkürlerimi sunarım. Muhammet YAPRAK Temmuz, 2015 iii İÇİNDEKİLER ÖZET.................................................................................................................................. i ABSTRACT ...................................................................................................................... ii TEŞEKKÜR .....................................................................................................................iii SİMGELER ve KISALTMALAR DİZİNİ ...................................................................... vi ŞEKİLLER DİZİNİ........................................................................................................... x ÇİZELGELER DİZİNİ .................................................................................................... xi 1. GİRİŞ ....................................................................................................................... 1 2. KURAMSAL TEMELLER ................................................................................. 13 2.1. Pestisitler ............................................................................................................. 13 2.1.1. Pestisit tanımı ................................................................................................... 13 2.1.2. Pestisitlerin genel özellikleri ............................................................................ 13 2.1.3. Pestisitlerin sınıflandırılması ............................................................................ 14 2.1.4. Pestisitlerin kullanım alanları ........................................................................... 16 2.2. Herbisitler ............................................................................................................ 16 2.2.1. Herbisitlerin tanımı ve tarihçesi ....................................................................... 16 2.2.2. Herbisitlerin sınıflandırılması........................................................................... 18 2.2.3. Herbisitlerin kullanımı ve bitkiler üzerindeki etkileri ...................................... 21 2.3. Sentetik Oksinler ................................................................................................. 23 2.3.1. 2,4-D (2,4-diklorofenoksiasetik asit)................................................................ 26 2.3.2. Dikamba (3,6-dikloro-2-metoksibenzoik asit) ................................................. 32 2.4. Transpozonlar ...................................................................................................... 37 2.4.1. Transpozonların keşfi ve sınıflandırılması ....................................................... 37 2.4.1.a. Retrotranspozonlar......................................................................................... 40 2.5. Retrotranspozonların Belirlenmesinde Kullanılan Moleküler Markırlar ............ 43 2.5.1. IRAP (Inter-Retrotransposon Amplified Polymorphism) ................................ 44 2.5.2. REMAP (Retrotransposon-Microsatellite Amplified Polymorphism) ............. 45 2.5.3. SSAP (Sequence-Specific Amplification Polymorphism) ............................... 46 2.5.4. RBIP (Retrotansposon Based Insertional Polymorphism) ............................... 47 2.5.5. iPBS (Inter-Primer Binding Site Amplification) .............................................. 48 iv 2.5.6. ISAP (Inter-SINE Amplified Polymorphism) .................................................. 49 2.6. Epigenetik ve Transpozon İlişkisi ....................................................................... 49 3. MATERYAL ve YÖNTEM ................................................................................. 51 3.1. Materyal............................................................................................................... 51 3.1.1. Kullanılan bitkisel materyal ............................................................................. 51 3.1.2. Yararlanılan alet ve cihazlar ............................................................................. 51 3.1.3. Kullanılan çözelti ve solüsyonlar ..................................................................... 52 3.1.3.a. Kullanılan 2,4 –D çözeltisinin hazırlanışı ..................................................... 52 3.1.3.b. Kullanılan dikamba çözeltisinin hazırlanışı .................................................. 52 3.1.3.c. DNA izolasyonu için kullanılan çözeltiler .................................................... 52 3.1.3.d. PCR ve elektroforez işlemleri için kullanılan çözeltiler ............................... 55 3.1.3.e. Sterilizasyon işlemleri için kullanılan çözeltiler ........................................... 57 3.2. Yöntem ................................................................................................................ 57 3.2.1. 2,4 D ve dikamba çözeltilerinin bitkiye uygulanması ...................................... 57 3.2.2. DNA izolasyonu ............................................................................................... 58 3.2.3. IRAP-REMAP .................................................................................................. 59 3.2.3.a. IRAP-REMAP primerleri .............................................................................. 59 3.2.3.b IRAP-REMAP PCR protokolü ....................................................................... 60 3.2.4. Agaroz jel elektroforezi .................................................................................... 61 3.2.5. IRAP-REMAP analizleri ve genomik kararlılık sabitliğinin (%GTS) belirlenmesi ...................................................................................................... 62 4. ARAŞTIRMA BULGULARI .............................................................................. 63 4.1. IRAP Analizleri ve Genomik Kararlılık Sabitliliği (Genomik Template Stability; %GTS) ................................................................................................. 63 4.2. IRAP Jel Görüntüleri ........................................................................................... 67 4.3. REMAP Analizleri ve Genomik Kararlılık Sabitliliği (Genomik Template Stability; %GTS) ................................................................................................. 68 4.4. REMAP Jel Görüntüleri ...................................................................................... 73 5. TARTIŞMA ve SONUÇ ....................................................................................... 75 5.1. Sonuç ve Öneriler ................................................................................................ 82 KAYNAKLAR ............................................................................................................... 83 ÖZGEÇMİŞ .................................................................................................................. 988 v SİMGELER ve KISALTMALAR DİZİNİ µg Mikromolar °C Derece Celcius (Sıcaklık) 2,3,6 –TBA Trikloro benzoik asit 2,4,5-T 2,4,5-trikloro fenoksiasetik asit 2,4-D 2,4-diklorofenoksiasetik asit 4-CPA 4-kloro-indol asetik asit A →G Adenin → Guanin ABA Absisik asit ABD Amerika Birleşik Devletleri ABRE Absisik Asite Duyarlı Element ACCase Acetyl-Coenzyme A Carboxylase (Asetil-Koenzim A Karboksilaz) AFLP Amplified Fragment Length Polymorphism (Çoğaltılmış Parça Uzunluk Polimorfizmi) AP Aspartik proteinaz AzaC 5-Azasitidin bç Baz çifti BNOA β-Naftoksiasetik asit CG Guanin-Sitozin CHO Chinese Hamster Ovary (Çin Hamster Ovaryum) CO2 Karbondioksit CTAB Setil trimetil amonyum bromür DGA Diglisoamin dH2O Distile su Dikamba 3,6-dikloro-2-metoksibenzoik asit dk Dakika DMA Dimetilamin DNA Deoksiribonükleik asit DNBP 2,4-dinitro-6-sekonderbütil fenol DNOC 4,6 dinitro-o-cresol vi dNTP Deoksiribonükleotid trifosfat EDTA Etilendiamintetraasetik asit FAO Food and Agriculture Organization of the United Nations (Birleşmiş Milletler Gıda ve Tarım Örgütü) GAA Glasiyel asetik asit gag/GAG GAG geni/Protein gr Gram GTS Genomik Template Stability (Genomik Kararlılık Sabitliği) H2O2 Hidrojen peroksit HCI Hidroklorik asit Hg Cıva HMG High Mobility Group (Yüksek Mobil Grup) IAA İndol asetik asit IBA İndol butyrik asit INT DDE İntegraz IPA İzopropilamin IRAP Inter-Retrotransposon Amplified Polymorphism (İç-Retrotranspozon Çoğaltma Polimorfizmi) ISAP Inter-SINE Amplified Polymorphism (İç- Kısa Serpiştirilmiş Nükleotid Elementleri Çoğaltma Polimorfizmi) ISSR Inter-Simple Sequence Repeat (İç-Basit Dizi Tekrarı) IUPAC Uluslararası The International Union of Pure and Applied Chemistry (Temel ve Uygulamalı Kimya Birliği) iPBS Inter-Primer Binding Site Amplification (İç-Primer Bağlanma Bölgelerine Dayalı Çoğaltma) JA Jasmonik Asit K Kelvin (Sıcaklık) kb Kilo baz çifti LD50 Letal Doz (Test Hayvanlarının %50’sini Öldürmek İçin Gerekli Doz) LINEs Long Interspersed Nuclear Elements (Uzun Serpiştirilmiş Nükleer Elementler) LTR Long Terminal Repeats (Uzun Uç Tekrarlar) vii M Molar MCPA 4-kloro-2-methilfenoksi asetik asit mg Miligram mg/L Miligram/Litre MgCl2 Magnezyum klorür MITE Miniature Inverted Repeat Transposable Element (Minyatür Evrik Ters Tekrarlar) ml Mililitre mM Milimolar MS Murashige ve Skoog besiyeri Na2S2O5 Sodyum metabisülfit NAA Naftelen asetik asit NaCl Sodyum klorür NaHSO3 Sodyum bisülfit NaOCl Sodyum hipoklorit NaOH Sodyum hidroksit ng Nanogram nt Nükleotid OD Okuma Değeri OD260 260nm’de Okuma Değeri PBS Primer Binding Site (Primer Bağlanma Bölgesi) PCR Polymerase Chain Reaction (Polimeraz Zincir Reaksiyonu) pH Power of Hydrogen (Hidrojenin Gücü) Pikloram 4-amino- 3,5,6-trikloropikolonik asit pol/Pol Polimeraz Geni/Protein ppm Parts Per Milion mg/l (Miligram Çözünen/Litre Çözelti) RAPD Randomly Amplified Polymorphic DNA (Rasgele Çoğaltılmış Polimorfik DNA) RED Reregistration Eligibility Decision REMAP Retrotransposon-Microsatellite Amplified Polymorphism (Retrotranspozon-Mikrosatellit Çoğaltma Polimorfizmi) RNA Ribonükleik asit viii RIBP Retrotansposon Based Insertional Polymorphizm (Retrotransopon Temelli İnsersiyonel Polimorfizm) RNAi RNA-interferaz RNaz H Ribonükleaz H RNaz Ribonükleaz ROS Reactive Oxygen Species (Reaktif Oksijen Türleri) RT Ters Transkriptaz SA Salisilik Asit SCE Sister Chromatid Exchange (Kardeş Kromatid Değişimi) SINEs Short Interspersed Nuclear Elements (Kısa Serpiştirilmiş Nükleer Elementler) siRNA Small Interfering RNA (Küçük Engelleyici RNA) sRNA Small RNA (Küçük Kodlanmayan RNA) S-SAP Sequence-Spesific Amplified Polymorphism (Sekansa Özgü Çoğaltma Polimorfizmi) SSR Simple Sequence Repeat (Basit Dizi Tekrarı) Ta Primerin Bağlanma Sıcaklığı Taq Thermus aquaticus TBE Tris- Borat-EDTA TCA Trikloro asetik asit TE Tris-EDTA TEs Transpoze Elementler TIR Terminal Inverted Repeats (Terminal Ters Tekrarlar) Tm Erime Sıcaklığı TPase Transpozaz Tris-HCI Hidroksimetilaminomethan hidroklorit tRNA Transfer Ribonucleic Acid (Taşıyıcı Ribonükleik Asit) UV Ultraviyole Işık v/v Hacim/Hacim WHO World Health Organization (Dünya Sağlık Örgütü) μl Mikrolitre μM Mikromolar ix ŞEKİLLER DİZİNİ Şekil 2.1. 2,4-D’nin kimyasal yapısı ............................................................................... 28 Şekil 2.2. Dikambanın kimyasal yapısı........................................................................... 33 Şekil 2.3. Ty1-copia ve Ty3-Gypsy elemanlarının yapısı .............................................. 41 Şekil 2.4. Sınıf I ve Sınıf II retrotranspozonlarının yapısı .............................................. 42 Şekil 2.5. IRAP çalışma prensibi .................................................................................... 45 Şekil 2.6. REMAP çalışma prensibi ............................................................................... 46 Şekil 2.7. S-SAP çalışma prensibi .................................................................................. 47 Şekil 2.8. RBIP çalışma prensibi .................................................................................... 48 Şekil 2.9. iPBS çalışma prensibi .................................................................................... 49 Şekil 4.1. N-57 (Nikita57) primerine karşı oluşan amplifikasyon ürünleri .................... 67 Şekil 4.2. Nikita E2647 primerine karşı oluşan amplifikasyon ürünleri ......................... 67 Şekil 4.3. Sukkula primerine karşı oluşan amplifikasyon ürünleri ................................. 68 Şekil.4.4. N-57 (Nikita57)+8081 primerine karşı oluşan amplifikasyon ürünleri .......... 73 Şekil 4.5. N-57 (Nikita57)+8082 primerine karşı oluşan amplifikasyon ürünleri .......... 73 Şekil 4.6. Bare 1(0)+8082 primerine karşı oluşan amplifikasyon ürünleri .................... 74 x ÇİZELGELER DİZİNİ Çizelge 3.1. IRAP-PCR’da kullanılan primer dizileri, erime (Tm) ve bağlanma (Ta) sıcaklıkları ......................................................................... 59 Çizelge 3.2. REMAP-PCR’da kullanılan primer dizileri, erime (Tm) ve bağlanma (Ta) sıcaklıkları ......................................................................... 60 Çizelge 3.3. IRAP- REMAP PCR bileşenleri ve konsantrasyonları ............................... 60 Çizelge 4.1. 2,4-D ve dikamba genomik kararlılık sabitliliği (%GTS) ve % polimorfizm (IRAP) .............................................................................. 65 Çizelge 4.2. 2,4-D ve dikambanın farklı konsantrasyonlarda hazırlanan çözeltilerinin buğday tohumlarının üzerine etkisiyle değişen bantların moleküler ağırlığı (IRAP) ........................................................... 66 Çizelge 4.3. 2,4-D ve dikamba genomik kararlılık sabitliliği (%GTS) ve % polimorfizm (REMAP) .......................................................................... 71 Çizelge 4.4. 2,4-D ve dikambanın farklı konsantrasyonlarda hazırlanan çözeltilerinin buğday tohumlarının üzerine etkisiyle değişen bantların moleküler ağırlığı (REMAP) ...................................................... 72 xi 1 1. GİRİŞ Hızla artan dünya nüfusu, gelişen sanayi ve bunların bir sonucu olarak ortaya çıkan kentleşme olgusu; insanları daha iyi yaşam koşullarına kavuşma arzusuna, aşırı ve bilinçsiz doğal kaynak kullanımına ve enerji tüketimine yöneltmiştir (Giray Kurt 2007). Artan dünya nüfusunun gıda talebini karşılamak amacıyla bitkisel üretiminde paralel olarak artırılması gerekmektedir. Anakaranın yüzölçümü değişmemekle birlikte erozyon, yeni yerleşim alanlarının kurulması, yeni fabrikaların ve yolların yapılması gibi etmenlerden dolayı tarıma elverişli topraklar kaybedilmektedir. Bu yüzden artan nüfusun besin ihtiyacının karşılanabilmesi için birim alandan elde edilecek ürün miktarının artırılması gerekmektedir (Akbulut 2008). Bitkisel üretimde yüksek verimli ve kaliteli tohum kullanılması, uygun toprak işleme, uygun gübreleme ve sulama gibi verimi artıran tüm uygulamalar yapılmış olsa da, kaliteli ve bol ürün elde etmek için hastalık etmenleri, zararlılar ve yabancı otlar ile de etkili bir şekilde mücadele edilmesi gerekmektedir (Erik 2007). Bu tür etmenlerle mücadele edilmediği takdirde %100’e varan ürün kayıpları meydana gelmektedir (Kaymak ve Serim 2015). Tarımsal savaş; bitkilerin hastalık, zararlı ve yabancı otların etkilerinden ekonomik ölçüler çerçevesinde korunması, verimin ve kalitenin artırılması için gerçekleştirilen çalışmaları kapsamaktadır. Tarımsal mücadele; tarım ilaçlarının kullanıldığı kimyasal, çapalama ve toprak işleme gibi yöntemleri içeren mekaniksel, ısı ve ışınlardan yararlanılarak yapılan fiziksel mücadele yöntemleriyle yapılmaktadır (Akbulut 2008). Uygulanmasının kolay olması, zararlılarla mücadelede daha fazla etkinlik göstermesinin yanı sıra ekonomik olmasından dolayı kimyasal mücadele bu yöntemler içerisinde daha çok tercih edilmektedir. Kimyasal mücadelede kullanılan pestisitler binlerce yıldır bilinmesine ve kullanılmasına rağmen günümüzde kullanılan birçok pestisit ürünü 2. Dünya Savaşı’ndan sonra kullanılmaya başlamıştır. Tarımsal üretimde beklenen verimin ve kalitenin artmasına 2 öncülük eden bu maddelerin kullanımı 1980’li yıllardan itibaren giderek artmıştır (Kaymak ve Serim 2015). Pestisitler; tarımsal üretimde verimin ve kalitenin düşmesine sebep olan böcekler, kemirgenler, kuşlar, yabancı otlar, küfler, mantarlar, bakteriler ve virüsler gibi zararlıları öldürmek veya kontrol altına almak amacıyla kullanılan kimyasal maddelerdir (Öner 2010). Zararlılarla mücadelede kullanılmalarına rağmen hedef dışı diğer organizmalar üzerinde de toksik etkiler oluşturdukları için genel anlamda canlı öldüren ‘biyositler’ olarak da isimlendirilmektedirler (Güler ve Çobanoğlu 1997). Pestisitler kullanımlarında; toz, suda çözünen tozlar, sulu çözeltiler, emülsiyon konsantre ilaçlar, tanecikler, aerosol ve zehirli yemler gibi çeşitli şekillerde bulunurlar (Ketenoğlu vd 2000). Pestisitler, etki maddelerine (doğal, sentetik, inorganik vb.), etki mekanizmalarına (solunum sistemini etkileyen, sindirim sistemini etkileyen, kontak etkili olanlar vb.), kontrolü hedef alınan biyolojik etmenlere (insektisit, herbisit, fungusit, avisit vb.) ve dayanıklılık sürelerine (kalıcı olmayan, kalıcı vb.) göre çeşitli şekillerde sınıflandırılmaktadır (Babayiğit vd 2014). Pestisitler tarımsal uygulamaların haricinde; evler, park ve bahçeler, oyun alanları gibi farklı alanlarda da zararlılarla mücadelede kullanılmaktadır. Pestisit kullanımı; hızlı ve etkili sonuçlar vermesi, ekonomik ve uygulamasının kolay olması gibi nedenlerden dolayı dünya üzerinde en çok tercih edilen kimyasal mücadele yöntemidir. Tarım arazilerinin ve yeraltı sularının giderek artan pestisit kullanımı ile kirlenmesi önemli bir çevre sorunu haline gelmektedir. Bu kimyasal maddelerin faydalarının yanı sıra çeşitli nedenlerle doğrudan maruz kalma veya yanlış kullanımları sonucu çevrede toksik seviyelerde birikmesi tüm ekosistemde olumsuz etkilere neden olmaktadır. Ekosistemin su, hava, toprak ve canlılar gibi bütün öğeleri birbiriyle ilişkili olduğundan dolayı, tarımda kullanılan pestisitler su ve toprak başta olmak üzere bütün abiyotik ortamı kirletmektedir (Bozdağ 2009). 3 Pestisitler sadece istenmeyen canlılar için değil diğer organizmalar ve insanlar için de toksik etkiye sahip olabilmektedir. Bazı pestisitlerin oldukça yavaş parçalanmaları bunların çevrede birikmelerine neden olmakta, bu da pestisitlerin kullanıldığı bölgelerde çevreyle ilgili sorunların ortaya çıkmasına yol açmaktadır. Pestisitlerin yüzey ve yeraltı sularının yanı sıra rüzgâr ile uzak mesafelere taşınmaları, çevre kirliliğine sebep olmaktadır (Erik 2007). Pestisitlerin uygulanması gereken miktarlardan daha az dozlarda uygulanması sonucu hedef zararlılar ölmemekte ve uygulama amacına ulaşamamaktadır. Ancak aşırı miktarda uygulanması sonucu ürün zarar görebilmekte, üründe ve toprakta pestisit kalıntısı oluşabilmektedir. Kontrolsüz kullanılan pestisitler fiziksel ve biyolojik yollarla çevreye yayılmakta, tüm canlıların çeşitli şekillerde etkilenmesine yol açmaktadır. Pestisitler ve kalıntıları çeşitli yerlerde ve zamanlarda biyolojik besin zincirine girebilmektedir (Çiçek 2005). Çevre sağlığı açısından pestisitlerin yapılarında bulunan etken madde önemlidir. Çünkü canlılarda akut veya kronik etkiler ve onların ölümüne neden olan pestisitin yapısındaki etken maddedir (Öner 2010). Zehirli kimyasal maddeler olan pestisitlerin; akut zehirlenme, kanser, doğum kusurları, kısırlık ve sinir sistemi bozukluklarına yol açtığı bildirilmiştir (Kaplan 2009). Ayrıca bu kimyasalların çok düşük miktarlarda olsa dahi temas edilmeleri durumunda; vücut tarafından üretilen hormonların sentez, salınım, taşınma, bağlanma ve eliminasyonunu değiştirerek endokrin sistemde bozukluklar (Yılmaz 2014) ve şeker hastalığı (diyabet) gibi pek çok geri dönüşümsüz kronik hastalığa sebep olabildikleri ya da bu hastalıkların oluşumuna katkı sağladıkları belirtilmektedir (Bronstein et al. 2011). Gelişmiş ülkelerde, tarım alanlarında kullanılmak üzere piyasaya sürülen pestisitlerin %60-70’ini herbisitler oluşturmaktadır (Sökmen 2005). Türkiye’de kullanılan pestisitlerin %16,1’ini fungusitler, %18,4’ünü insektisitler, %30,3’ünü ise herbisitler oluşturmaktadır (Delen vd 2005). 4 Pestisitlerin önemli bir grubunu oluşturan herbisitler, zararlı bitki hücrelerinde genellikle fotosentezde görev yapan protein bileşiklerine bağlanarak fotosentezi inhibe eden ve yabani ot olarak isimlendirilen istenmeyen bitki türlerinin büyüme ve gelişmesini engelleyen toksik maddeler olarak tanımlanmaktadır (Yeşilbaş 2010). Yabancı ot; tarım yapılan alanlarda yetişerek, arzu edilmeyen bir şekilde kültür bitkisinde ve kültür bitkisiyle yapılan bir takım faaliyetlere zarar veren bitkiler olarak tanımlanmaktadır (Aldrich and Kremer 1997). Yabancı otlara karşı herbisit kullanımı ilk olarak 1896 yılında bağlardaki fungal hastalık etmenlerine karşı kullanılan Bordo Bulamacının, bağlarda yetişen yabancı otları da öldürdüğü fark edilmiş ve o günden itibaren kullanılmaya başlamıştır. Bordo Bulamacı ile başlayan yabancı otlara karşı kimyasal madde kullanımı; 1900 yılından itibaren demir sülfat, sülfürik asit, bakır nitrat, amonyak ve bazı potasyum tuzlarının kullanımıyla devam etmiştir. Özellikle 2. Dünya Savaşı’ndan sonra hormon tabiatlı kimyasalların geliştirilmesiyle herbisit kullanımında önemli ilerlemeler kaydedilmiştir (Özbay 2014). Herbisitler bitkilerdeki meydana getirdikleri etkilere göre; seçici olmayan (non-selektif) herbisitler ve seçici herbisitler (selektif) olmak üzere ikiye ayrılırlar. Seçici olmayan herbisitler bütün bitki türlerine etki ederken, seçici herbisitler ise belirli bir bitki türü için toksik etki oluşturan, diğerleri için toksik etki meydana getirmeyen herbisitlerdir (Ecevit vd 1999). Yabancı otlarla mücadelede kimyasal mücadelenin öne çıkmasının ana nedenlerinden bazıları; uygulamanın kolay olması, kısa sürede sonuç vermesi, olumsuz tarla koşullarında uygulanabilmesi, mücadelesi zor olan çok yıllık bitkilerde uygulanabilmesi, istenilen bitkilerin kontrolü, maliyetinin diğer mücadele yöntemlerine göre daha düşük olması, seçiciliği fakat daha da önemlisi doğru zaman ve kontrollü bir ilaçlama ile kesin sonuç vermesi şeklinde sıralanabilir (Özer vd 2001). 5 Soya fasulyesi, mısır, ayçiçeği, pirinç ve pamuk ekimi yapılan hemen hemen bütün arazilerde en az bir herbisit kullanılmaktadır. Ancak herbisit kullanımı sadece tarımsal alanlarla sınırlı değildir. Herbisitlerin bir kısmı halka açık alanlarda, yol kenarlarında, demiryollarının bulunduğu alanlarda, sulama kanallarının çevresinde, elektrik hatlarında, golf sahalarında ve evlerin bahçelerinde yabancı otların temizlenmesi amacıyla kullanılmaktadır (Yüzbaşıoğlu 2001). Herbisitlerin uygulanması esnasında veya sonrasında kültür bitkilerinde ortaya çıkan bir takım üretim sorunu, herbisit kullanımının artışına bağlı olarak artmıştır. Bu sorunlar kültür bitkisinde fitotoksite, toprağa uygulanan bazı herbisitlerin bir sonraki ürüne zarar vermesi, ürünlerde kalıntı, çevre kirliliği, aşırı kullanılmasından dolayı kültür bitkisinin büyümesinde ve gelişiminde zayıflama ve ciddi verim kayıpları şeklinde ortaya çıkmaktadır (Torun 2011). Herbisitler, hedef olarak kullanıldıkları bitkiye zarar verdiklerinden dolayı bitki üzerinde beslenen ve barınan tüm organizmaları da olumsuz bir şekilde etkilemektedirler. Bundan dolayı herbisitler, tüketilen pestisitler içerisinde tabiata en fazla zarar veren grup olarak nitelendirilmektedir. Herbisitlerin canlılar üzerinde toksik etki yaptığı bilinmektedir. Bu nedenle son yıllarda herbisitlerin meydana getirdiği etkileri ve bu etkilere karşı hücrelerin verdiği cevaplar üzerinde yoğun olarak araştırmalar yapılmaktadır. Bu çevre kirleticilerine maruz bırakılma sonucu, canlı organizma hücrelerinde bulunan detoksifikasyon enzim mekanizmaları ve proteinler çeşitli şekillerde etkilenmektedir (Giray Kurt 2007). Herbisitler aynı zamanda dolaylı olarak serbest oksijen radikallerinin üretimine neden olmaktadır. Oluşan serbest oksijen radikalleri de hücrenin nükleik asitlerine, proteinlerine, lipidlerine ve karbonhidratlarına saldırıda bulunarak canlının savunma sistemini harekete geçirmektedir (Paul et al. 1999). Herbisitler genellikle bitkilere özgün biyokimyasal yolları (örneğin fotosentez) etkilemektedir. Bunun dışında değişik şekillerde etki mekanizmaları gösteren farklı herbisitler grupları da mevcuttur (Singh et al. 2003). 6 Etki mekanizmalarına göre yapılan sınıflandırmada bitkide büyüme hormonu etkisi meydana getiren sentetik oksinler karşımıza çıkmaktadır. Sentetik oksinler 1940’lı yılların başında İngiltere’deki Rothamsted Araştırma Merkezi’nce geliştirildikten sonra ticari olarak piyasaya sürülmüştür. Bu grupta yer alan herbisitler oksin yapısındaki bitkisel hormonlardır. Sentetik oksinler; yüksek dozda hormon kullanımında olduğu gibi aşırı hücre bölünmesine bağlı olarak yapraklarda kıvrılma ve uzamaya, köklerde ise birleşmeye sebep olarak bitkinin ölümüne neden olurlar (Serim 2010). Hücre zarı üzerinde pek çok etkileri vardır ve çift çenekli bitkilerin kontrolünde önemlidirler. Bitkide hormon dengesini ve protein sentezini bozarak, büyüme ve gelişmeyi engellerler. Etki mekanizmaları henüz tam olarak anlaşılamamakla birlikte birçok etki bölgelerinin olduğuna inanılmaktadır (Loux and Dobbels 2007). Sentetik oksin tabiatındaki herbisitlerden 2,4-D (2,4-diklorofenoksiasetik asit) ve dikamba (3,6-dikloro-2-metoksibenzoik asit), geniş yapraklı otlar ve ağaçlarla beraber büyümesi istenilmeyen bitkilerin kontrol edilmesi veya öldürülmesi amacıyla kullanılmaktadır (Ateeq et al. 2005). 2,4-D zirai ve zirai olmayan alanlarda kullanılan bir herbisit olup Türkiye’de de yaygın bir şekilde kullanılmaktadır. Tüm dünyada 300 milyon doları aşan, oldukça büyük bir pazara sahip olduğu bildirilmiştir. Halka açık alanlardaki çimlerde ve tarım arazilerinde, yol kenarlarında bulunan geniş yapraklı bitkilerle, akuatik bitkilerin kontrolünde sıkça tercih edilmektedir. Çok geniş bir yayılım gösterdiği için insan sağlığı ve çevre kirliliği açısından önemli tehditler oluşturmaktadır (Hansoy 2010). 2,4-D ticari olarak piyasaya sürülen ilk herbisitlerden biridir. 1940’ların sonlarına doğru ABD’de satışa sunulmuştur. ‘Agent Orange’ adıyla bilinen ve Vietnam Savaşı’nda görüşü mesafesini sınırlayan geniş yapraklı bitkileri yok etmek amacıyla kullanılan karışımın içerisinde yer almıştır. Ancak savaşa katılan askerlerde görülen çeşitli sağlık sorunları sebebiyle, karışımdaki 2,4,5-T’nin formülden çıkarılması ve bir herbisit olarak satılmasının engellenmesi yoluna gidilmiştir (Wolfe et al. 1990). 7 2,4-D kısmen kalıcı bir kimyasal madde olup yarılanma ömrü 20-200 gün arasındadır. 2,4-D sadece geniş yapraklı otları hedef almayıp; hedefi olmayan türlerde de büyüme ve gelişmenin gerilemesine, davranış değişikliklerine, üreme problemlerine veya ölümlere sebep olabilmektedir (Garabrant and Philbert 2002). 2,4-D’nin 1999-2002 yılları arasında ülkemizde kullanım miktarlarının ortalamasına bakıldığında, yıllara göre herbisit tüketimindeki payının %42,68 olduğu görülmektedir (Delen vd 2005). 2,4-D’nin maliyetinin ucuz olması yaygın bir şekilde kullanılmasına neden olmaktadır. Ülkemizde en çok tüketilen herbisitlerden biri olan 2,4-D’nin sentezlenmesi sırasında dioksinlerin de bulaşma riski vardır. Bilindiği üzere dioksinlerin hem toksik hem de kanserojen etkisi bulunmaktadır (Delen vd 2005). Ayrıca immün sistemin zayıflamasına, doğurganlığın azalmasına ve cinsiyet hormonlarında değişikliklere sebep olurlar (Washington State Departmanet of Ecology 2001). Bundan dolayı birçok ülke, kullanılacak 2,4-D’li ürünlerin dioksinden arındırılmış olması şartını getirmiştir (Ware 1994; Delen vd 2005). Maalesef ülkemizde böyle bir şart yoktur. Bu yüzden, kullanılan 2,4- D’li ürünlerin dioksinle kirlenmiş olabileceği şüphesi de ortaya çıkmaktadır (Alpöz et al. 2001). Diğer bir önemli sentetik oksin dikamba, benzoik asit ailesine ait bir herbisit olup yabancı otlarla mücadelede kullanılmaktadır. Dikambanın etki mekanizması, yapı ve fonksiyonu 2,4-D ile benzerlik göstermektedir. Birçok kimyasal formülasyonları bulunmaktadır. Ayrıca kimyasal formülasyonları diğer herbisitlerle kombine bir şekilde piyasaya sürülmektedir. Daha pahalı olması nedeniyle 2,4-D’ye göre daha az kullanımı olsa da, 2,4-D ile baş edilemeyen zararlılarla mücadelede tercih edilmektedir (Filkowski et al. 2003). Dikamba kullanımı 2001 yılından itibaren %157 oranında artış göstermiştir (Benbrook 2005). Son yıllarda, bahsettiğimiz sentetik oksin tabiatlı herbisitlerin kullanım alanlarının önemli derecede arttığı gözlenmiştir. Tarımsal üretimde, verimin ve kalitenin arttırılması amacıyla piyasaya sürülen herbisitler, bilinçsiz ve kontrolsüz bir şekilde kullanıldığında; biyolojik dengenin bozulması, akut ve kronik zehirlenme, insanlara ve 8 hayvan türlerine yönelik teratojenik, mutajenik ve karsinojenik etkiler, çevre ve besin kirlenmesi gibi birçok açıdan evrensel nitelikli çevre sorunlarına neden olmaktadır (Özdaş vd 2006; Turan 2012). Ayrıca bu herbisitlerin çevrede yüksek miktardaki birikimi bitki, hayvan ve dolayısıyla insan gibi birçok organizmanın genetik materyalinde de bir takım olumsuz etkilere sebep olabilmektedir. Yeryüzündeki mevcut su kaynaklarında 2,4-D ve dikambanın bulunması bu herbisitlere maruz kalan organizmaların genetik materyalleri için potansiyel bir tehdit oluşturmaktadır (Filkowski et al. 2003). 2,4-D ve dikamba serbest radikaller üreterek oksidatif strese ve lipid peroksidasyonuna sebep olmaktadır. Oksidatif stres ve lipid peroksidasyonundaki artış, ROS (Reactive Oxygen Species/Reaktif Oksijen Türleri) ve koruyucu antioksidan enzimleri arasındaki dengenin bozulmasına neden olmaktadır. Ayrıca serbest radikallerin artışı DNA’nın yapısında hasarlar meydana getirmektedir (Balague et al. 2001; Duchnowicz and Koter 2003). Ayrıca yapılan çalışmalarda, 2,4-D ve dikambanın artan konsantrasyonlarına bağlı olarak mutasyon sıklığının arttığı, mutajenik ve genotoksik etkilerin gözlendiği rapor edilmiştir (Pavlica et al. 1991; Enan 2009). Yildirim et al. (2014), yaptıkları çalışmada Phaseolus vulgaris bitkisinde dikambanın artan konsantrasyonuna bağlı olarak DNA hasarının arttığını RAPD (Randomly Amplified Polymorphic DNA/Rasgele Çoğaltılmış Polimorfik DNA) tekniği kullanarak ortaya koymuşlardır. Filkowski et al. (2003), transgenik Arabidopsis thaliana bitkisinde nokta mutasyonları ve rekombinasyonu belirlemek üzere yaptıkları çalışmada 2,4-D ve dikambanın genotoksik etkilerini gözlemiş, homolog rekombinasyon (A→G mutasyonu) sıklığında önemli bir etkiye sahip olduklarını ayrıca bu sentetik oksinlerin DNA hasarına neden olduklarını belirlemişlerdir. González et al. (2006), insan lenfosit kültürlerinde yaptıkları çalışmada farklı dozlarda uygulanan dikambanın SCE (Sister Chromatid Exchange/Kardeş Kromatid Değişimi) 9 sıklığında önemli bir artışa sebep olduğunu belirlemişlerdir. İnsan lenfositleri üzerinde yapılan bir diğer çalışmada ise 2,4-D’nin SCE sıklığında artışa ve kromozomal anomalilere sebep olduğu ortaya konulmuştur (Turkala and Jalal 1985). De Moliner et al. (2002), beyincik granül hücrelerinde yaptıkları çalışmada 2,4-D’nin toksik konsantrasyonlarının hücre apoptozisine yol açtığını belirlemişlerdir. Cenkci et al. (2010), Phaseolus vulgaris bitkisinde 2,4-D ve dikambanın farklı konsantrasyonlarını kullanarak yaptıkları çalışmada; RAPD ve comet assaylerle bu sentetik oksinlerin genotoksik etkilerini araştırmışlardır. Yapılan çalışmada 2,4-D ve dikambanın kök hücrelerinde büyümeyi inhibe ettiğini, hücrelerde ki protein içeriğini artırdığını bildirmişlerdir. Ayrıca comet assay bulguları; sentetik oksin uygulamasının kök meristem hücrelerinde DNA hasarlarına sebep olduğunu, RAPD bulguları ise DNA hasarı sonucu GTS (Genomik Template Stability/Genomik Kararlılık Sabitliği) oranın azaldığını ortaya koymuştur. 2,4–D, doku kültürlerinde kallus teşviği için en çok tercih edilen hormonlardan biridir. Ancak bu sentetik oksin genetik değişikliklere ilaveten bazı epigenetik değişikliklerde meydana getirmektedir. Rabinowicz et al. (2005), 2,4-D’nin sitozin metilasyonunda önemli artışa sebep olarak gen işleyişini değiştirdiğini rapor etmişlerdir. Temel and Gozukirmizi (2013), yaptıkları çalışmada dikambanın epigenetik mekanizmaları etkileyerek DNA metilasyonuna sebep olduğunu belirlemişlerdir. Fraga et al. (2012), yaptıkları çalışmada kombine oluşturularak Acca sellowiana bitkisine uygulanan 2,4-D ve AzaC maddelerinin DNA metilasyon seviyelerinde önemli bir artışa sebep olduklarını göstermişlerdir. Yildirim et al. (2014), yaptıkları çalışmada Phaseolus vulgaris bitkisinde dikambanın DNA hipermetilasyonuna sebep olduğunu belirlemişlerdir. Stresin bitkide oluşturduğu genetik değişimlerden biri de normal büyüme ve gelişme boyunca inaktif durumda bulunan ve çeşitli stres faktörleri aracılığıyla aktif duruma 10 geçen bitki retrotranspozonlarıdır. Retrotranspozonlar, diğer bir ifadeyle genetik hareketli elemanlar, bitkiler âlemi boyunca geniş yayılım göstermekte ve bol miktarda bulunmaktadırlar (Sığmaz 2014). Transpozonlar genom içinde yer değiştirebilme yeteneğine sahip olan DNA dizileri olarak tanımlanmaktadır. Bu yer değiştirebilen tekrarlı DNA dizileri, transpozisyon olarak adlandırılan hareket mekanizmalarıyla bir kromozomal bölgeden diğerine hareket ederler. Bu hareketleri sonucunda genomda delesyon, insersiyon ve duplikasyon gibi olayları uyarabilir ve yeni gen alellerinin oluşmasına neden olabilirler. Transpozonların sahip oldukları bu potansiyelden dolayı evrimsel süreç içerisinde yeni türlerin oluşmasında etkili bir mekanizma olarak işlediği düşünülmektedir (Kazazian 2004; Feschotte and Pritham 2007). Plasmodium cinsinin bir kaç türü hariç bütün ökaryotlarda ve hemen hemen tüm prokaryotlarda bulunan transpozonlar, ökaryotik genomların büyük bir kısmını oluştururlar (Wicker et al. 2007; Jurka 2008; Huang et al. 2009). Neredeyse bilinen tüm bitki retrotranspozonları normal büyüme ve gelişme boyunca inaktif durumdadır. Ancak farklı abiyotik ve biyotik stres faktörleri altında aktive olabilir ve harekete geçebilirler (Kumar and Bennetzen 1999). Retrotranspozonların meydana getirdiği bu hareketlilik mutasyon oranını artırmakta ve yeni genetik kombinasyonları ortaya çıkarmaktadır (Sığmaz 2014). Retrotranspozonlar birçok genomik lokus içine girebilmekte ve böylelikle mutasyonları ve yeni özellikleri bünyesinde barındıran genomlar arasında insersiyonel polimorfizme sebep olurlar (Kumar and Bennetzen 1999). Bu durum yaralanma, patojen saldırıları, melezleme, protoplast izolasyonu ya da in vitro hücre veya doku kültürü gibi faktörler tarafından uyarılmaktadır (Grandbastien 1998; Grandbastien et al. 2005). Tütün doku kültüründe meydana gelen yaralanmalara bağlı olarak oluşan stresle ilk kez 1993 yılında Hirochika (1993), Tto1, Tto2 ve Tnt1 retrotranspozonlarının hareket ederek 11 genom üzerinde yeni yerlere lokalize olduklarını ve mutajenik etki meydana getirdiklerini ortaya koymuştur. Salazar et al. (2007), Solanum chilense bitkisinde TLC1.1 retrotranspozonunun stresle ilgili çeşitli sinyal molekülleri (SA, ABA, JA, H2O2 ve sentetik oksin 2,4-D) tarafından aktive edildiğini bildirmişlerdir. 2,4-D’nin bitki doku kültürü çalışmalarında kallus oluşumunu teşvik etmek için en çok tercih edilen hormon olduğu ve sitozin metilasyonunda belirgin bir değişikliğe yol açtığı bilinmektedir (LoSchiavo et al. 1989). Daha önceki çalışmalarda çeşitli stres faktörleri (örneğin protoplast kültürü) ile aktivasyonu artan bazı retrotranspozonların inaktivasyonu için bitkilerde sitozin metilasyonunun meydana geldiği ortaya çıkarılmıştır (Hirochika 1993;Bennetzen 1996). Yılmaz and Gozukirmizi (2013), yaptıkları çalışmada kallus oluşumu için 2,4-D kullanmış ve meydana gelen metilasyon değişimlerinin kallus kültüründe BARE-1 retrotranspozonunun aktivasyonu sonucu oluşabileceği sonucuna varmışlardır. Evrensel et al. (2011), tarafından yapılan çalışmada farklı yaşlardaki (30, 45 ve 60 günlük) arpa kallus kültürlerinde yaşa bağlı olarak meydana gelen BARE-1 retrotranspozonunun hareketleri IRAP (Inter-Retrotransposon Amplified Polymorphism/İç-Retrotranspozon Çoğaltma Polimorfizmi) markır tekniği kullanılarak belirlenmeye çalışılmış ve araştırma sonucunda, BARE-1 retrotranspozonunun kallus kültürünün yaşına bağlı olarak %14-25 oranında polimorfizme sebep olduğu belirlenmiştir. Evrensel (2011), Nikita retrotranspozonunun hareketliliğini arpa doku kültürlerinde IRAP moleküler markır tekniği kullanarak incelemiş ve farklı yaşlardaki kalluslarda meydana gelen polimorfizmin Nikita retrotranspozonun hareketine bağlı olduğunu bildirmiştir. Sığmaz (2014), tuzluluk stresine maruz kalan buğday bitkisinde retrotranspozon hareketlerinin belirlenmesinde IRAP tekniğini kullanmış ve stresin retrotranspozon polimorfizmine yol açtığını belirlemiştir. 12 Transpozonlar; ökaryotlarda gen klonlama, insersiyon mutasyonları, transgenik organizmaların elde edilmesi, haritalama ve prokaryot organizmalarda klasik antibiyotik-direnç markırı gibi amaçlarla moleküler genetik uygulamalarında yaygın olarak kullanılmaktadırlar (Bergman and Quesneville 2007). Retrotranspozon hareketlerine belirlenmesinde IRAP bağlı olarak (Inter-Retrotransposon meydana gelen Amplified polimorfizmin Polymorphism/İç- Retrotranspozon Çoğaltma Polimorfizmi), REMAP (Retrotransposon-Microsatellite Amplified Polymorphism/Retrotranspozon-Mikrosatellit Çoğaltma Polimorfizmi), RIBP (Retrotansposon Based Insertional Polymorphizm/Retrotransopon Temelli İnsersiyonel Polimorfizm) ve S-SAP (Sequence-Spesific Amplified Polymorphism/Sekansa Özgü Çoğaltma Polimorfizmi) gibi moleküler markır teknikleri yaygın bir şekilde kullanılmaktadırlar (Kalendar et al. 2011). Bu çalışmada iki komşu retrotranspozon arasında kalan intergenomik bölgenin PCR (Polymerase Chain Reaction/Polimeraz Zincir Reaksiyonu) ile çoğaltılmasına dayanan ve retrotranspozon polimorfizmin belirlenmesinde yaygın olarak kullanılan IRAP tekniği ile SSR (Simple Sequence Repeat/Basit Dizi Tekrarı) ve retrotranspozon arasındaki bir segmentin çoğalmasının polimorfik ürünlerini tanımlamak amacıyla, bağlantılı ISSR primerleriyle kombin oluşturularak hem retrotranspozon polimorfizminin hem de DNA hasarının tayininde kullanılan REMAP markır teknikleri kullanılarak, Kırik buğday çeşidinde sentetik oksin uygulamalarına bağlı olarak meydana gelen retrotranspozon polimorfizminin, DNA hasarının ve genomik kararlılık sabitliğinin belirlenmesi amaçlanmıştır. 13 2. KURAMSAL TEMELLER 2.1. Pestisitler 2.1.1. Pestisit tanımı Günümüzde, giderek artmakta olan dünya nüfusunun gıda talebinin karşılanması önemli bir sorun haline gelmiştir. Artan besin talebinin karşılanmasının yolu ekim yapılan tarım arazilerinin artırılması ve tarım arazilerinde birim alandan elde edilen ürünün kalitesinin ve veriminin artırılmasından geçmektedir. Ancak tarım alanlarında ürünün kalitesini ve verimini azaltan birçok unsur bulunmaktadır. Bu unsurlardan biri de pest adı verilen doğal zararlılardır. Çeşitli şekillerde hareket eden ve beslenen her türlü zararlı hayvana genel olarak ‘pest’ adı verilir (Issa ve Çiftçioğlu 2006). Pestisitler, pest adı verilen canlılar (mantar, kemirici, çekirge, toprak kurtları, sinek, bit, pire, hamam böceği vs.) ve yabani ot gibi tarım zararlılarının ölmesini ya da davranışlarının değişmesini sağlayan biyolojik olarak aktif maddelerdir. FAO (Food and Agriculture Organization of the United Nations/Birleşmiş Milletler Gıda ve Tarım Örgütü) ve WHO (World Health Organization/Dünya Sağlık Örgütü) pestisiti, istenmeyen bitki ve canlıları kontrol altına almak veya gelişmelerini önlemek amacıyla kullanılan maddelerle, bitki büyümesini düzenleyici, yaprak dökülmesini sağlayıcı (defoliant) ve nem çekici kimyasal maddeler karışımı olarak tanımlamaktadır (Erik 2007). 2.1.2. Pestisitlerin genel özellikleri Pestisitler; zehirli kimyasal maddeler oldukları için zararlılarla mücadelede daha güvenli, daha ekonomik bir kullanım sağlamak ayrıca insan sağlığı ve çevre kirliliği açısından oluşacak zararları azaltmak amacıyla bazı yardımcı maddelerle birlikte kullanılırlar. Geliştirilen yeni fiziksel karışıma formülasyon ismi verilir. İlaç formülasyonunun içinde; 14 Etken madde veya aktif madde, Yardımcı maddeler, Emülgatörler, Dolgu maddeleri bulunmaktadır (Erik 2007). Bu maddeler; katı ve sıvı ilaç formülasyonları için farklı özelliklere sahiptirler. Toksik etkiye sahip kimyasal bir maddenin pestisit olarak kullanılabilmesi için; Biyolojik olarak aktif olması, Etkili olması, Düşük maliyetli olması, İnsan ve çevre sağlığı açısından güvenilir olması, Uygulamasının kolay olması, Yeterli derecede kararlı olması, Hedef organizma üzerinde toksik etkiye sahip olması, Kimyasal özelliklerinin, yaban hayatı ve faydalı organizmalar için zararlı olmaması gerekmektedir (Yıldız vd 2006). Bir formülasyonda bulunması gereken özellikler WHO ve FAO tarafından belirli kıstaslara göre düzenlenmiş ve bu özelliklerin belirlenmesi için de standart metotlar geliştirilmiştir. 2.1.3. Pestisitlerin sınıflandırılması Pestisitler; görünüm, fiziksel yapı ve formülasyon şekillerine göre, etkiledikleri zararlı ve hastalık grubu ile bunların biyolojik dönemine göre, içerdikleri aktif maddenin cins ve grubuna göre, zehirlilik derecesine ve kullanım tekniğine göre çok değişik şekillerde sınıflandırılırlar. Bunlardan en çok kullanılan sınıflandırma şekilleri ise kullanıldıkları zararlı gruplarına ve yapısındaki aktif madde grubuna göre yapılan sınıflandırmalardır (Tiryaki vd 2010). 15 Kullanıldıkları zararlı grubuna göre sınıflandırma • Böcekleri öldürenler (İnsektisit) • Fungusları (Mantarları) öldürenler (Fungusit) • Fungusların faaliyetini durduranlar (Fungustatik) • Yabancı otları öldürenler (Herbisit) • Örümcekleri öldürenler (Akarisit) • Bakterileri öldürenler (Bakterisit) • Yaprak bitlerini öldürenler (Afisit) • Kemirgenleri öldürenler (Rodentisit) • Nematodları öldürenler (Nematosit) • Salyangozları öldürenler (Mollussisit) • Algleri öldürenler (Algisit) • Kuşları öldüren veya kaçıranlar (Auensit) • Kaçırıcılar (Repellent) • Çekiciler (Atrakant) olarak sınıflandırılmaktadır. Aktif madde grubuna göre sınıflandırma • İnorganik maddeler • Doğal Organik maddeler - Bitkisel maddeler - Petrol yağları • Sentetik organik maddeler - Organik fosforlu maddeler - Organik klorlu maddeler - Diğer sentetik organik maddelerdir. 16 2.1.4. Pestisitlerin kullanım alanları Pestisitler sadece tarımsal üretim yapan deneyimli insanlara değil aynı zamanda küçük paketler halinde ihtiyacı olan normal toplum bireylerinin kullanımına da sunulmaktadır. Pestisitler: Tarımsal üretim Bahçecilik Balık yetiştiriciliği Ormancılık Süs amaçlı bölgelerde (parklar, bahçeler, oyun alanları) Tütsüleme ve kereste korumacılığı Endüstriyel böcek kontrolü İnşaat (duvar kâğıdı yapıştırıcıları, boyalar, sıvacılık vb.) Ev ve bahçelerde Deniz böcek kontrolü Sucul böcek kontrolü Gıda saklanması Hayvancılık Toplum sağlığı Beşeri ilaç gibi amaçlarla çeşitli alanlarda kullanılmaktadır (Güler ve Çobanoğlu 1997). 2.2. Herbisitler 2.2.1. Herbisitlerin tanımı ve tarihçesi Tarımsal alanlardan elde edilecek ürün miktarı, birim alandaki verimliliğe bağlı olarak değişmektedir. İklim, hastalıklar, zararlılar ve yabancı otlar ürün verimliliğini etkileyen en önemli etmenler olarak karşımıza çıkmaktadır. Yabancı otlar; kültür bitkileriyle su, mineral maddeler ve ışık gibi temel ihtiyaçlar yönünden rekabete girerek verim 17 kayıplarına yol açmaktadır (Bükün 2012). Yabancı otlar ürün kayıplarının yanı sıra kültürel faaliyetlerin zamanında ve istenilen nitelikte yapılmasını önlemektedir. Aynı zamanda kültür bitkisine karışan zehirli tohumları, insan ve hayvan sağlığı açsından tehdit oluşturmakta, hastalık ve zararlılara da konukçuluk etmektedir (Giray Kurt 2007). Yabancı otları öldürmede veya onların büyümelerini önlemek amacıyla kullanılan kimyasal maddelere herbisit adı verilmektedir. Herbisit ürünlerinin içinde etkinlik gösteren kimyasal maddeler ‘aktif madde’ olarak adlandırılmaktadır ve ticari ürünlerde ‘dolgu maddesi’ ile karışık halde bulunmaktadır. İçerdikleri aktif maddelerin formülasyonuna bakılarak herbisitin etkinliği hakkında fikir sahibi olabilmek mümkündür. Günümüzde kullanılan herbisitlerin tamamına yakını organik maddelerden meydana gelmiştir. Karbonların sıralanışı ya aromatik (halka) ya da alifatik (zincir) şeklindedir (Güncan 1985). Yabani otlarla mekaniksel mücadele yöntemlerinin kullanılması çok eskiye dayanmaktadır. Yabancı otlarla mücadele elle yolarak, çapalayarak veya yakarak yapılmaktaydı. Ancak tarım arazilerinin genişlemesi ve işçilik masraflarının artmasıyla birlikte insanlar daha ekonomik mücadele yöntemleri bulmaya yönelmişlerdir. Yabancı otlarla mücadelede kimyasal maddelerin kullanılmaya başlanması bu gereksinimden doğmuştur. Yabancı otlara karşı herbisit kullanımı ilk olarak 1896 yılında bağlardaki fungal hastalık etmenlerine karşı kullanılan Bordo Bulamacının, bağlarda yetişen yabancı otları da öldürdüğü fark edilmiş ve o günden itibaren kullanılmaya başlanmıştır. Bordo Bulamacı ile başlayan yabancı otlara karşı kimyasal madde kullanımı; 1900 yılından itibaren demir sülfat, sülfürik asit, bakır nitrat, amonyak ve bazı potasyum tuzlarının kullanımıyla devam etmiştir. Özellikle 2. Dünya Savaşı’ndan sonra hormon tabiatlı kimyasalların geliştirilmesiyle herbisit kullanımında önemli ilerlemeler kaydedilmiştir (Özbay 2014). 18 Birbirinden habersiz olarak Rothamsted Araştırma İstasyonu ve Jealett’s Hill Araştırma İstasyonu fenoksiasetik asitlerin klor tuzları üzerinde çalışmalar yapmışlar ve her ikisi de bu maddelerden bazılarının herbisit etkilerini 1942 yılında Tarımsal Araştırma Kongresi’nde açıklamışlardır. 1950 yılından itibaren ise İngiltere ve Amerika başta olmak üzere tahıl bitkileri dışında birçok kültür bitkisi için de herbisit bileşikler geliştirilmeye başlamıştır (Aydın 2001). Yabancı ot mücadelesinde devrim niteliğindeki olay ise ilk defa 1947 yılında 2,4-D ve MCPA etkili maddeli herbisitlerin kullanılmaya başlamasıdır. Bu maddelerin üretilmesiyle birlikte herbisitler yabancı ot mücadelesinde en başarılı yöntem olmuştur (Tursun 2012). Ülkemizde yabancı otlara karşı ilk kimyasal mücadele 1960’ların başlarında hormon tabiatlı (2,4-D Amin ve MCPA) herbisitlerin geniş yapraklı yabancı otlara karşı kullanımı ile başlamıştır. Dar yapraklı yabancı otlara karşı mücadele ise ilk olarak 1984’de ruhsatlanan bir ACCase (Acetyl-Coenzyme A Carboxylase/Asetil-Koenzim A Karboksilaz) enzim engelleyicisi olan Diklofob metil kullanılmaya başlanmıştır. Bunu sonraki yıllarda aynı kimyasal gruba ait Fenoksaprop-p-etil (1989), Tralkoksidim, Klodinafop proparjil (1996), Pinoksaden (2007) etkili maddeli herbisitler takip etmiştir (Topuz 2007; Aksoy 2009). 2.2.2. Herbisitlerin sınıflandırılması Herbisitler; aktivitelerine, kullanım alanlarına, kullanım şekillerine, kimyasal özelliklerine ve etki mekanizmalarına göre çeşitli şekillerde sınıflandırılmaktadır. Bitkilerde etkilerine göre sınıflandırma • Total herbisitler (Seçici olmayan): Ayrım göstermeden uygulandığı alandaki bütün bitki türlerini etkileyen herbisitlerdir. Tarım alanlarından ziyade daha çok hava 19 alanları, demir ile karayolları kenarlarında ve endüstri alanlarında bulunan bitki topluluğunu ortadan kaldırmak amacıyla kullanılmaktadır. • Selektif herbisitler (Seçici): Kullanıldığı ortamdaki belirli bitki türleri için toksik özellik taşıyan, diğerleri için toksik özellik taşımayan herbisitlerdir. Tarım arazilerinde üretimi yapılan kültür bitkilerine zarar vermeden, orada bulunan yabancı otları öldüren veya gelişimlerini engellemek amacıyla kullanılan kimyasal maddelerdir (Yalçınkaya 2006). Bitkilerde etki yeri ve kullanma şekillerine göre sınıflandırma • Kontakt (Temas) herbisitler: Sadece temas ettikleri bitki doku ve organlara zarar veren herbisitlerdir. Örnek olarak Bipiridil grubu herbisitler gösterilebilir. • Sistematik (Bütüncül) herbisitler: Bitkinin taşıma sistemi aracılığıyla yayılarak bitkinin tamamına zarar veren herbisitlerdir. Bu tür herbisitler bitkinin yaprak ve köküyle temas halinde olduğundan hızlı bir şekilde bitkinin vasküler sistemi tarafından absorbe edilir. Kolorofenoksiasetik asit türevleri bu gruba örnektir. • Bitkinin kök sistemini veya çimlenmeyi etkileyen herbisitler: Toprağa karıştırılan herbisit buradaki istenmeyen bitki tohumlarını yok eder. Arsenik asit, pentaklorofenol (PCB) örnek olarak verilebilir (Vural 2005). Uygulama dönemlerine göre sınıflandırma • Ekim öncesi (Pre-sowing): Bu grupta yer alan herbisitler kültür bitkisi ekilmeden önce uygulanmaktadır. • Çıkış öncesi (Pre-emergence): Bu grupta yer alan herbisitler kültür bitkisi ekildikten sonra fakat kültür bitkisi çimlenip toprak yüzeyine çıkmadan önce uygulanmaktadır. • Çıkış sonrası (Post-emergence): Bu grupta yer alan herbisitler kültür bitkisi ve yabancı ot çimlenip toprak yüzeyine çıktıktan sonra uygulanmaktadır (Özbay 2014). 20 Etki mekanizmalarına göre sınıflandırma • Büyüme düzenleyici herbisitler • Fotosentezi önleyen herbisitler • Solunumu önleyen herbisitler • Pigment engelleyiciler • Tohum büyümesini önleyen herbisitler • Hücre membranını bozucular • Yağ sentezini önleyen herbisitler • Amino asit sentezini önleyen herbisitler • Mitoz bölünmeyi engelleyen herbisitler olarak sınıflandırılmaktadır (Yılmaz 2011). Kimyasal yapılarına göre sınıflandırma • Fenoksi bileşikleri (2,4- D, 2,4,5 –T, MCPA vb.) • Alifatik asitler (TCA, Dalapon, Glifosat vb.) • Amidler ve tiyoamidler grubu (Propanil, Difenamit, Alaklor vb.) • Benzoik asitler grubu (2,3,6 –TBA, Dikamba, Kloramben vb.) • Bipiridil grubu (Dikuat, Parakuat, Morfamkuat vb.) • Karbamatlar grubu (Profam, Klorprofam, Asulam, Barban vb.) • Dinitroanilin grubu (Benefin, Trifluralin, Perdimethalin vb.) • Nitril grubu (Diklorbenil, Bromoksinil, İyoksinil vb.) • Dinitrofenol grubu (DNOC, DNBP, Dinoseb asetat vb.) • Triazin grubu (Simazin, Propazin, İsomethiozin, Metribuzin vb.) • Diazin grubu (Pirazon, Maleik, Hidrazid vb.) • Urasil grubu (Bromasil, Termasil, Lenasil vb.) • Üre bileşikleri (Buturon, Fenuron, Linuron, Monuron vb.) • Diğer organik herbisit bileşikleri (Amitrol, Nitrofen, Pikloram vb.) • İnorganik herbisit bileşikleri (Sodyum Klorat, Boratlar, Arsenikler vb.) olarak sınıflandırılmaktadır (Karaarslan 2000; Yeşilbaş 2010). 21 2.2.3. Herbisitlerin kullanımı ve bitkiler üzerindeki etkileri Herbisitlerin kullanımı, yabani otlar ile mücadelede büyük ölçüde mekanik yöntemlerin yerini almış olup diğer yöntemlere göre oldukça pratik ve ekonomiktir. Bunun yanı sıra, bitki türlerinin iyileştirilmesinde ve verimin arttırılmasında önemli katkılar sağlamaktadır. Buğday, mısır, ayçiçeği, pamuk, soya fasulyesi ve pirinç ekimi yapılan tarım arazilerinde en az bir herbisit kullanılmaktadır. Herbisitlerin bir kısmı tarım arazileri dışında; pek çok yapılandırılmanın gerçekleştirileceği sahaların açılmasında, endüstriyel alanlarda, halka açık alanlarda, demiryollarının bulunduğu alanlarda, yol kenarlarında, sulama kanallarında, golf sahalarında, elektrik hatlarında ve evlerin bahçelerinde yabancı otların temizlenmesi için kullanılmaktadır (Timur 2001; Yüzbaşıoğlu 2001). Yabancı otlara karşı kültürel, biyolojik, fiziksel mücadele gibi birçok mücadele yöntemi olmasına rağmen, herbisit kullanımı genellikle daha kolay ve hızlı sonuç vermesinden dolayı daha çok tercih edilmektedir. Yararlı etkilerinin yanı sıra kimyasal mücadelede kullanılan herbisitlerin birçok yan etkisi çeşitli sorunlara neden olmaktadır. Tarımsal alanlarda verimin arttırılması amacıyla piyasaya sürülen herbisitlerin bilinçsiz ve kontrolsüz kullanımı; çevre ve besin kirlenmesi, biyolojik dengenin bozulması, akut ve kronik zehirlenme, insanlara ve hayvan türlerine yönelik teratojenik, mutajenik ve karsinojenik etkiler gibi birçok açıdan evrensel nitelikli çevre sorunlarına neden olmaktadır (Özdaş vd 2006; Turan 2012). Herbisitler, hedef araziler dışındaki bitkilere zarar verebilecekleri gibi toprağa uygulandıklarında veya uygulanma sonrasında çeşitli şekillerde toprağa karıştıkları zaman, toprakta uzun süre kalarak bitkilerde önemli kayıplara neden olmaktadır (Başaran ve Serim 2010). Herbisitlerde birim alana uygulanacak doz miktarı çok önemli olduğundan düşük dozların etkisizlik, yüksek dozların ise bitkiler için fitotoksite oluşturabileceği bilinmektedir (Topal 2011). 22 Herbisitler bitkilerin toprak üstü organlarına veya toprağa uygulanırlar. Herbisitler yaprak yüzeyine uygulandıklarında kütikula ve stoma aracılığıyla sitoplazma zarına ulaşırlar. Bundan sonrada pasif difüzyon ve aktif taşıyıcılar aracılığıyla hücre içerisine geçiş yaparlar. Absorbe olan herbisitler hücre içerisinde bulunan organellerin yapılarını ve işlevlerini bozarlar. Bitkilere uygulanan herbisitler; bitkilerin morfolojik yapılarını, fizyolojik ve biyokimyasal süreçlerin normal seyrini değiştirerek ya ölümlerine ya da büyüme ve gelişmelerinin durmasına neden olmaktadır. Öncelikle organellere ulaşan herbisitlerin çoğu organel zarının yapısını bozarak etkili olmaktadır. Herbisitlerin bitkiler üzerindeki etkileri aşağıda verilmiştir. Fotosentez üzerine etkisi: Herbisitlerin bir kısmı fotosentez esnasında meydana gelen ışık reaksiyonlarını bozarak etkili olmaktadır. 2,4-D’nin yer aldığı fenoksi bileşikler fotosentez üzerine etkili olan herbisitler grubunda yer almaktadır. Solunum üzerine etkisi: Bilindiği üzere hücrede solunum olayı mitokondriler içerisinde meydana gelmektedir. Herbisitlerin birçoğu; elektron taşınması, elektronların bağlanması, mitokondri içerisinde gerçekleşen ATP formasyonu ve oksidatif fosforilasyon gibi olayları etkilemektedir. Bitkilerde solunum sistemini etkileyen herbisitlerin düşük dozlardaki kullanımları; elektron bağlanmasını, yüksek dozlardaki kullanımları ise oksidatif fosforilasyonu inhibe etmektedir. Yine oksidatif fosforilasyonu önleyen herbisitlere fenoksi bileşikler örnek olarak gösterilebilir. Lipit sentezi üzerine etkisi: Herbisitlerin bazıları hücre ve organel zarlarının geçirgenliğini bozarak lipit sentezinin önlenmesine neden olmaktadır. Protein sentezi ve nükleik asitler üzerine etkisi: Nükleik asitler, DNA ve RNA’nın yapısında bulunan genetik bilgiyi taşımaktadır. Gelişmiş organizmalarda olduğu gibi bitkilerde de protein sentezi RNA aracılığıyla meydana gelmektedir. Nükleik asitlerin yapısını bozarak etkili olan herbisitler, dolayısıyla RNA’nın da yapısını bozarak protein sentez mekanizmasının bozulmasına sebep olmaktadır. Ayrıca bazı herbisitler bitkilerde gen aktivitesini bozarak bitkide gelişim bozuklukları meydana getirmektedir. 23 Herbisitler; hücre bölünmesi, hücre uzaması, protein sentezi ve solunum gibi bitki metabolizmasını düzenleyen hormonal dengeyi bozarlar (Özdaş vd 2006). Bu alanlarda yapılan çalışmalar, herbisitlerin; hormonları etkileyerek, özellikle bitkilerle beslenen böcek türlerinin bıraktıkları yumurta sayısını, gelişimlerini ve eşey oranını etkilediğini, ayrıca glikojen seviyesinde azalmaya ve kromozom bozukluklarında artmaya neden olduklarını göstermiştir (Kaya ve Yanıkoğlu 1999). Bu maddelerin bitkilerde özellikle Calvin Çemberini etkileyerek CO2 absorbsiyonunu inhibe ettiği belirtilmektedir (Ketenoğlu vd 2000). Ayrıca bu kimyasal maddeler; enzim ve karbonhidrat metabolizması, tohumların çimlenmesi, yapraklarda klorofil oluşumu, yaprak şekli, gövdenin kıvrılması ve köklerin uzaması gibi bitkinin çeşitli morfolojik ve fizyolojik yapılarını etkilemektedir. Herbisitler yabancı otların yanı sıra çoğu zaman kültür bitkilerinde de geçici olarak büyüme ve gelişmeyi inhibe edebilmektedir. Bu yüzden belirli süre zarfında kültür bitkilerinde strese neden olabilmektedirler (Deme 2007). Herbisitlerin etkisiyle tarım ürünlerinde meydana gelen birtakım fizyolojik, metabolik ve genetik değişimler ürünlerin yaşamlarını optimum koşullarda sürdürebilmelerini engelleyen bir takım olumsuz şartlar oluşturur. Bitkilerde büyüme ve gelişmeyi, üründe verim ve kaliteyi olumsuz yönde etkileyen, bitkinin veya organların ölümüne yol açabilen, bitkinin biyolojik sistem veya fonksiyonuna zarar veren durum veya madde stres olarak tanımlanmaktadır (Mahajan and Tuteja 2005). Stres ekonomik önemi olan tahıllar dâhil, tüm bitkilerin normal fizyolojik işlevlerinde değişikliklere yol açmaktadır. Bitkilerin yaşamları süresince maruz kalabileceği farklı stresler; bitkilerin biyosentetik kapasitelerini azaltır, normal fonksiyonlarını değiştirir ve bitkinin ölümüne yol açabilecek zararlara neden olabilir (Gong et al. 2005). 2.3. Sentetik Oksinler Büyüme ve gelişme bitkilerin hayat döngüsü içeresinde yer alan en önemli fizyolojik olaylardan birisidir. Uzun yıllar boyunca, bitkilerin büyüme ve gelişimi hakkında 24 detaylı bilgiler elde edilememiş, büyüme fizyolojisi bilinmekle birlikte büyümeyi sağlayan maddelerin neler olduğu bulunamamıştır. Yapılan çalışmalar neticesinde bitki bünyesinde büyümeyi teşvik eden bazı maddelerin sentezlendiği tespit edilmiş ve bunlara hormonlar ya da fitohormonlar adı verilmiştir. Bu alandaki çalışmalar sayesinde bitki bünyesinde büyümeyi teşvik eden maddelerin yanı sıra büyümeyi önleyen maddelerin de sentezlendiği tespit edilmiştir. Bu maddeler bitkilerde çok düşük konsantrasyonlarda bulunmakta ve bitkilerde önemli görevleri yerine getirmektedirler. Ayrıca, kimyasal yapıları bitki bünyesinde bulunan doğal hormonlara benzeyen sentetik düzenleyiciler de üretilmiştir. Üretilen bu sentetik maddeler bitkilerde büyüme ve gelişme düzenleyicileri olarak görev yapmaktadırlar. Bu maddelerden bazıları büyüme ve gelişmeyi teşvik ederken bazıları da önlemektedir. Aynı sentetik düzenleyici madde farklı zamanlarda ve dozlarda uyguladığında, farklı sonuçlar gözlenmektedir (Westwood 1993). 1929 yılında Hollandalı bilim adamı Frit Went tarafından izole edilen, bitkilerde doğal olarak bulunan büyüme düzenleyicisi olan oksinler IAA (İndol Asetik Asit) olarak da adlandırılmaktadır. ‘Auxin’ kavramı Yunanca’da büyümek veya artmak anlamlarına gelmektedir. Oksinler bitkilerde büyüme ve gelişmeyi etkileyen en önemli hormonlardan biridir. Oksinler bitki meristemlerinde, genç yapraklarda, gelişmekte olan meyve ve tohumlarda üretildikten sonra etki göstereceği bitki doku ve organlarına taşınırlar. Genellikle bitkilerin büyüme gösteren uç kısımlarında (kök, tomurcuk, yaprak vb.) yüksek miktarda bulunan oksinler, hücre büyüme ve bölünmesini teşvik ederek bitkilerde uzamayı sağlarlar. Oksinin hücre büyümesini artırması, hücrenin ozmotik sisteminde oluşturduğu bazı değişikliklerden kaynaklanmaktadır. Oksinler, hücrede ozmotik basıncı artırarak, hücrenin su geçirgenliğinin artmasına ve hücre çeperinin basıncının düşmesine neden olurlar. Meydana gelen bu değişiklikler hücre çeperi sentezini artırarak ayrıca hücre çeperi esnekliğini ve genişliğini artıran protein yapısındaki özel enzimlerin sentezini teşvik ederek hücre büyümesini sağlamaktadır (Westwood 1993; Doğan 2010). Düşük 25 oksin konsantrasyonları sürgün morfogenesisini, köklenmeyi, hücre gelişimini ve kallus oluşumunu desteklemektedir (Özgen et al. 1998; Doğan 2010). Doğal bitki büyüme düzenleyicileri olan oksinler, doğal ve sentetik olmak üzere ikiye ayrılırlar. Doğal oksinler; IAA, 4-CPA (4-kloro-indol asetik asit) ve fenil asetik asittir. Sentetik oksinlere ise NAA (Naftelen asetik asit), BNOA (β-naftoksiasetik asit), IBA (İndol butyrik asit), pikloram (4-amino- 3,5,6-trikloropikolonik asit), 2,4,5-T (2,4,5trikloro fenoksi asetik asit), 2,4-D ve dikamba gibi maddeler örnek olarak verilebilir (George 2008; Doğan 2010; Çabuk 2010). IAA’nın bitkilerde çok az miktarda bulunması, izolasyon sonrası ışık gibi farklı çevresel faktörler tarafından hızlıca bozunması, IAA oksidaz enzimi ile bitkilerde doğal olarak parçalanabilmesi gibi etmenlerden dolayı sentetik oksinlerin kimyasal olarak sentezlenmesi gereksinimini ortaya çıkarmıştır. Sentetik oksinler 1940’lı yılların başında İngiltere’deki Rothamsted Araştırma Merkezi’nce geliştirildikten daha sonra ticari olarak piyasaya sürülmeye başlamıştır. Sentetik oksinlerden ilk olarak 2,4 D ve MCPA 1942’de sırasıyla Amerika ve Büyük Britanya’da geliştirilmiştir. Bu maddelerin üretilmesi 2. Dünya Savaşı’ndan kısa bir süre sonra, yabancı otların kontrolünde bir devrim olarak nitelendirilmiş ve pestisit endüstrisinin gelişmesine ivme kazandırmıştır. Bu herbisitlerin ucuz olması ve düşük su hacimlerinde kolayca uygulanabilmesi, bu maddelerin yetiştiriciler tarafından hızlı bir şekilde kabul görmesine sebep olmuştur. Bu grupta yer alan herbisitler oksin yapısındaki bitkisel hormonları taklit ederek etki göstermektedir. Bitkideki doğal hormon dengesini bozduklarından dolayı çoğu kez bitki büyüme düzenleyicileri olarak isimlendirilirler. Sentetik oksinler; tarla çayır ve mera gibi alanlarda geniş yapraklı yabani otların kontrolünde ayrıca bitki doku kültürü çalışmalarında bitki rejenerasyonunu ve kallus oluşumunu teşvik etmek amacıyla kullanılmaktadır (Sterling and Hall 1997; Babaoğlu vd 2004). Birçok sentetik oksin yaprak ve kök aracılığıyla kolayca absorbe edilerek floem ve ksilem aracılığıyla bitki doku ve organlarına taşınmaktadır. Bununla birlikte esas olarak 26 yapraklara uygulanan sentetik oksinlerin taşınımı simplastik olarak gerçekleşmektedir. Bu maddeler toprağa uygulanabilir ancak kökteki simplastik hareketleri oldukça sınırlıdır ve genellikle bu bileşikler toprak uygulamalarında daha az etki gösterirler. Yaprağa yapılan uygulamalarda taşınım, çimlerde geniş yapraklılara nazaran daha sınırlı bir şekilde gerçekleşmektedir. Sentetik oksinlerin aktiviteleri oldukça düşüktür. Bu maddelerin aktif olabilmesi için bütün bağlantı yerlerinin bazı moleküllerle, özellikle proteinlerle tutulmuş olması gerekmektedir (Bengisu 1994). Sentetik oksinlerin yüksek konsantrasyonları hedef organizmada aşırı hücre bölünmesini teşvik ederek, yapraklarda kıvrılma ve uzamaya, köklerde ise birleşmeye sebep olarak bitkinin ölümüne yol açmaktadır (Öztürkmen 2005; Serim 2010). Hücre zarının birçok noktasını etkileyen sentetik oksinler, dikotil bitkilerin kontrolünde önemli bir yere sahiptir. Özellikle bitkide hormon dengesini ve protein sentez mekanizmasını bozarak bitki gelişimini önleyen bu maddelerin etki mekanizmaları tam olarak bilinmemekle birlikte birçok etki bölgelerinin olduğuna inanılmaktadır (Loux and Dobbles 2007). Sentetik oksinlerin, doğal oksin seviyelerindeki konsantrasyonları bitki tarafından kontrol edilebilir ancak yüksek dozlarda uygulandıkları zaman bitki bu konsantrasyonları kontrol edemez ve bu durum bitkide çeşitli hasarların meydana gelmesine neden olur. 2.3.1. 2,4-D (2,4-diklorofenoksiasetik asit) Genel Adı: 2,4-D Kimyasal Adı (IUPAC): 2,4-diklorofenoksiasetik asit Zehirlilik Sınıfı (WHO): 2 Cas Number: 94-75-7 Kapalı Formülü: C8H6Cl2O3 Moleküler Ağırlığı: 221,0 g/mol Suda Çözünürlük: 0.031 g/100 ml (25°C’de) Özkütle:1,56 Erime Noktası: 140,5°C (413,5 K) 27 Kaynama Noktası:160°C (0,4 mm Hg) Fiziksel Durum: Katı LD50 Akut Toksisite Değeri: 639 mg/kg (Ratlarda) (Lerda and Rizzi 1991). Geniş yapraklı bitkilerde seçici etki gösteren ve yaygın bir kullanım alanına sahip olan 2,4-D, klorofenoksi bileşikleri grubunda yer almaktır (Vroumsia et al. 2005; Güngör 2007). ‘Agent Orange’ adıyla bilinen ve Vietnam Savaşı’nda görüşü mesafesini sınırlayan geniş yapraklı bitkileri yok etmek amacıyla kullanılan karışımın içerisinde yer almıştır. Ancak savaşa katılan askerlerde görülen çeşitli sağlık sorunları sebebiyle, karışımdaki 2,4,5-T’nin formülden çıkarılması ve bir herbisit olarak satılmasının engellenmesi yoluna gidilmiştir (Wolfe et al. 1990). Sarı-beyaz pudra, toz, kristal ve katı madde halinde bulunabilir (Şekil 2.1). Fenolik aromaya sahip olan 2,4-D’nin farklı kimyasal özellik ve çevre davranışları gösteren tuz, ester ve asit formları bulunmaktadır. Tuz ve ester formları asit formunun türevleridir. Bununla beraber etkin maddesi serbest asit formudur (Sota-Grabinska et al. 2003; Güngör 2007). 2,4-D’nin ester formu, buharlaşma ile kaybedileceğinden amin tuzları daha yaygın olarak kullanılmaktadır. Ester formlarının yabancı otlara karşı daha etkili olduğu bilinmektedir (Tepe 1997). 2,4-D kısmen kalıcı bir kimyasaldır ve yarılanma ömrü 20-200 gün arasında değişmektedir (Garabrant and Philbert 2002). 28 Şekil 2.1. 2,4-D’nin kimyasal yapısı 2,4-D ve türevleri; halka açık alanlardaki (evler, bahçeler, parklar vs.) çimlerde, tarım arazilerinde, yol kenarlarında, çayırlarda ve ormanlarda geniş yapraklı bitkilerle, akuatik bitkilerin kontrolünde kullanılmaktadır. Genellikle buğday, mısır, soya fasulyesi, pirinç, yulaf ve şeker pancarı gibi kültür bitkilerinin ekildiği alanlarda zararlı otlara karşı mücadele amacıyla sıkça tercih edilmektedir (Kalıpcı 2011). 2,4-D’nin düşük dozları olgunlaşmamış meyveleri düşürmede, patates bitkisinin kırmızı varyetelerinin rengini artırmada ya da orta büyüklükteki yumruların sayısını artırmada kullanılır. Turunçgillerde depolama süresini artırdığı da bilinmektedir (Bowey and Young 1980; Bristol et al. 1982). 2,4-D bitki yapraklarına püskürtme yöntemiyle uygulanır ve stomalardan yaprak dokusu içine emilir. Bitki yapraklarına alınmış olan 2,4-D iletim boruları aracılığıyla tüm bitkiye yayılarak bütüncül bir etki gösterir (Fairchild et al. 1997). Ayrıca 2,4-D bitkiler tarafından kök ve gövdeden de absorbe edilebilir. Bitkiler, 2,4-D’yi uygulamadan sonraki 4-6 saat içerisinde absorbe ederler. 2,4-D yabani otların kök ve sürgün büyüme bölgelerinde birikerek büyümeyi ve gelişmeyi inhibe etmektedir (Kwan and Chu 2004; Güngör 2007). 2,4-D, protein ve DNA sentezini engelleyen ve meristematik dokuların kontrolsüz gelişimine neden olan doğal oluşumlu bitki büyüme hormonu olan oksinler gibi hareket 29 ederek bitki dokularında uzun süre kalabilmektedir. Oksin konsantrasyonları bitki büyümesi sırasında değişkenlik göstermektedir. Ancak 2,4-D, oksinlere göre daha kararlı ve kalıcı yapıda olduğu için 2,4-D’ye maruz kalmış bitkilerde bu konsantrasyon yüksek düzeydedir. 2,4-D’nin etki mekanizması tam olarak anlaşılamamıştır. 2,4-D’nin düşük konsantrasyonlarının hücre bölünmesi ve büyümesini yöneten nükleik asit ve protein sentezini uyararak normal olmayan büyüme neden olduğu, yüksek konsantrasyonlarının ise hücre bölünmesi ve büyümesini inhibe ettiği bilinmektedir (Journal of Pesticide Reform 1999). Etkili dozlar verildiğinde, bitkilerin iletim sistemlerinde kontrolsüz hücre büyümesine yol açarak bitkinin ölümüne sebep olmaktadır. Uygulamadan sonraki 3-5 hafta içerisinde bitki ölümü gerçekleşmektedir (Hess 1993). Monokotil bitkilere göre dikotil bitkiler 2,4-D gibi sentetik oksinlere karşı daha hassastırlar. Oksinik herbisitler bu özelliklerinden dolayı, monokotil bitkilerinin yetiştirildiği tarım alanlarında zararlı dikotil bitkilerin mücadelesinde yaygın olarak kullanılmaktadır. Dikotil ve monokotil bitkiler arasında morfolojik ve herbisit metabolizması bakımından bir takım farklılıkların bulunması hassaslık ve toleranslılığı ortaya çıkarmaktadır (Sterling and Hall 1997). Ayrıca hücresel yapı bileşenlerinin fenoksi herbisit türevleriyle reaksiyon verebilme özelliklerinden dolayı monokotil bitkiler fenoksi herbisitlere karşı daha dirençlidir (Sota-Grabinska et al. 2003). 2,4 D genellikle düşük konsantrasyonlarda; hücre gelişimi, hücre bölünmesi, meyve gelişimi ve köklendirme amacıyla doku kültürü çalışmalarında yaygın olarak kullanılmaktadır (Holt et al. 1993). 2,4-D çok geniş bir yayılım gösterdiği için insan ve çevre sağlığı açısından tehdit oluşturmaktadır (Reregistration Eligibility Decision 2005). Birçok araştırmada 2,4D’nin uygulandığı bitkilerin anatomileri, morfolojileri ve fizyolojileri üzerine olumsuz etkilerinin olduğu rapor edilmiştir (Al-Najjar and Soliman 1982; Ateeq et al. 2002). 2,4D’nin bitkilerde süperoksit radikallerinde artışa neden olduğu (Romero-Puertas et al. 30 2004) ayrıca hayvan hücrelerinde oksidatif strese yol açtığı (Mi et al. 2007) bildirilmiştir. 2,4 D ve 2,4,5-T herbisitlerinin farklı buğday türlerinin mayotik hücreleri üzerinde sitolojik etkilerini araştırmak amacıyla yapılan bir çalışmada; uygulama yapılan gruplar kontrol grupları ile karşılaştırıldığında bu herbisitlerin doz artışına bağlı olarak buğday türlerinde anormal hücrelerin sayısını artırdığı görülmüştür (Al-Najjar and Soliman 1982). Allium cepa ve Oryza sativa bitkilerinde çeşitli testler kullanılarak 2,4-D’nin mutajenik aktivitesi değerlendirilmiştir. Yapılan çalışma sonucunda 2,4-D’nin genotoksik potansiyele sahip olduğu belirlenmiştir (Kumari and Vaidyanath 1989). 2,4-D’nin yüksek konsantrasyonlarının; rejenaratif bitkilerin kromozomlarında yapısal ve sayısal değişikliklere neden olduğu ayrıca kromatid ve kromozom kırıklıklarını artırdığı bilinmektedir (Zeljezic and Garaj-Vrhovac 2004). Bitki hücrelerinde, in vitro ve in vivo ortamlarda 2,4-D’nin, mitotik ve mayotik düzensizliklere sebep olduğu bildirilmiştir (Khalatkar and Bhargava 1982). Bitki doku kültüründe, 5 mg/l 2,4-D konsantrasyonundan daha yüksek konsantrasyonların bitkiye uygulanması sonucunda, kromozomal mutasyonların ve kromozomal anomalilerin meydana geldiği bildirilmiştir (Bayliss 1980). Butaklor ve 2,4-D herbisitlerinin Allium cepa üzerine etkisini araştıran bir çalışmada ise bu herbisitlerin mitotik indeksin azalmasına ve kromozomlarda anomalilere neden olduğu belirlenmiştir (Ateeq et al. 2002). 2,4-D ve dikamba gibi sentetik oksin herbisitlerinin ökaryotik hücrelerde peroksizom içeriğini önemli oranda arttırdığı rapor edilmiştir (Espandiari et al. 1995). Topraklarda, sularda ve bu kimyasal maddeyi üreten fabrika atıklarında bol miktarda bulunan 2,4-D, çevredeki çeşitli organizmalarda mutasyonlara sebep olmaktadır (Köksoy ve Dönmez 2012). 2,4-D’nin farelerde doğum oranını azalttığı ve gerçekleşen doğumlarda anormal yavruların oluştuğu bildirilmiştir (Duffard et al. 1993). 31 2,4-D’nin de içerisinde bulunduğu klorofenoksiasetik asit grubu herbisitlerin başlıca akut toksik etkileri; kas sistemi ve merkezi sinir sisteminde görülmektedir. 2,4-D’nin yüksek konsantrasyonları, hayvanlarda ventriküler fibrilasyonla ölüme sebebiyet vermektedir. Tek dozla, birkaç saat içinde kaslarda zayıflık ve sertlik, vücut hareketlerinde düzensizlik, konvülziyon ve koma görülmektedir. Bunların yanı sıra böbrek yetmezliği ve pulmoner ödem de oluşturabilmektedir. İnsanlarda akut zehirlenme belirtileri hayvanlardakine benzemekte ve 3-4 gramla semptomlar ortaya çıkmaktadır. Klorofenoksiasetik asitlerle akut zehirlenmelerde ölüm oranı oldukça yüksektir. Mesleki maruziyet sonucunda deri ve inhalasyon yolu ile absorbe edilen 2,4D’nin nörolojik semptomlarla karakterize edilen polinevrite sebep olduğu bilinmektedir (Vural 2005). Klorofenoksi bileşikleri içerisinde yer alan herbisitlerin insanlarda sistematik toksisite oluşturmasıyla ilgili başlıca belirti iştah kaybıdır. 2,4-D toksisitesinin ölümle sonuçlandığı birçok raporda böbreklerin bozulması, idrar asitliği, elektrolit dengesizliği ve bunların sonucunda oluşan doku ve organ bozukluklarının meydana geldiği bildirilmiştir (Keller et al. 1994). 2,4-D yutan kişilerde birkaç saat içinde kusma, ishal, baş ağrısı, zihin karışıklığı ve agresif davranışlar görüldüğü rapor edilmiştir (Ftiesen et al. 1990). Zehirlenmenin göze çarpan bir özelliği de vücut sıcaklığının ve solunum hızının artmasıdır. Bu semptomlar sonrası kaslarda zayıflama ve merkezi sinir sisteminde bozukluklar ortaya çıktığı da rapor edilmiştir (Flanagan et al. 1990). 2,4-D uygulanan insan hücre kültürleri çalışmalarında, bu bileşiğin düşük konsantrasyonlarda bile DNA hasarına sebep olduğu ve dolayısıyla 2,4- D’nin genetik hasar oluşturma potansiyeline sahip olduğu bildirilmiştir. 2,4-D ile yapılan kanserojenite testlerinde bu etkinin değerlendirilebilmesinin yetersiz olduğu, ancak bu maddenin ko-kanserojenik etkiye sahip olduğu ileri sürülmektedir. Bazı çalışmalara göre de tümör oluşumunu hızlandırdığı belirtilmektedir (Burgaz 1982). Yapılan başka bir araştırmada, 2,4-D ve diğer klorofenoksi herbisitlerin toksisite mekanizmalarının insanlar ve memeliler üzerinde hücre zarlarının yapı ve fonksiyonunu 32 bozduğunu, hücresel metabolizmaya katıldığını, bunun bir sonucu olarak oksidatif fosforilasyon reaksiyonlarını bozduğu belirtilmiştir (Bradberry et al. 2000). 2.3.2. Dikamba (3,6-dikloro-2-metoksibenzoik asit) Genel Adı: Dikamba Kimyasal Adı (IUPAC): 3,6-dikloro-2-metoksibenzoik asit Zehirlilik Sınıfı (WHO): 3 Cas Number: 1918-00-9 Kapalı Formülü: C8H6Cl2O3 Moleküler Ağırlığı: 221,0 g/mol Suda Çözünürlük: 0.79 g/100 ml (25°C’de) Özkütle: 1.57 Erime Noktası: 114-116°C Kaynama Noktası: 230°C Fiziksel Durum: Katı LD50 Akut Toksisite Değeri: 757-1707 mg/kg (Ratlarda) (Stevens and Sumner 1991). Dikamba, benzoik asit kimyasal grubunda yer alan seçici bir herbisittir. Uluslararası Temel ve Uygulamalı Kimya Birliği (IUPAC) tarafından 3,6-dikloro-2-metoksibenzoik asit olarak isimlendirilmiştir (Şekil 2.2). Dikambanın ilk kullanımı 1967 yılında Amerika Birleşik Devletleri'nde kayıt edilmiştir. Formülasyonları; dikamba asit, DMA (dimetilamin) tuzu, sodyum tuzu, DGA (diglisoamin) tuzu, IPA (izopropilamin) tuzu ve potasyum tuzu şeklindedir (RED 2009). Dikamba geniş yapraklı yabancı otların ve odunsu bitkilerin geniş yayılımını kontrol etmek için kullanılan, çimlenme öncesi veya sonrası uygulanan ve sentetik oksinler gibi hareket eden bir herbisittir. Tarımsal veya diğer uygulamalarda kullanılmaktadır. Tarımsal uygulamalarda, dikamba; çavdar, kuşkonmaz, arpa, mısır, yulaf, soya fasulyesi, şeker kamışı ve buğday gibi hububatların üretiminin yapıldığı alanlarda 33 yaygın olarak kullanılmaktadır. Topraktaki yarılanma ömrü 30-60 gün arasında değişmektedir (RED 2009). Şekil 2.2. Dikambanın kimyasal yapısı Dikamba, asit veya tuz formda farklı şekillerde piyasaya sürülen, beyaz-kahverengi renkleri arasında, suda çözünebilen, oksitlenmeye karşı dayanıklı ve uçucu özellik göstermeyen bir herbisittir (Ahrens 1994). Dikamba, su veya ışık tarafından kolayca etkilenen bir madde değildir. Mikrobiyal metabolizma ve UV ışık dikambanın sudaki dağılımını artırabilmektedir (Roberts and Dorough 1998). Düşük dozlarda dikamba, doğal oksinler benzeri hormonsal özelliklere sahiptir. Dikambanın yüksek konsantrasyonları bitki dokularında anormal ve kontrolsüz büyümeyi uyarır, normal bitki fonksiyonlarını bozarak bitkiyi ölüme sürükler (Caux et al. 1993). Ayrıca yüksek dozda uygulanan dikambanın bitkilerde hücre bölünmesi ve büyümesi faaliyetlerini inhibe ettiği rapor edilmiştir (Ahrens 1994). Bitkiler tarafından kök, gövde ve yapraklar aracılığıyla absorbe edilen dikamba, taşınım sistemleriyle birlikte tüm bitkiye dağılmaktadır (Caux et al. 1993). Bitki içindeki emilim ve dağıtım oranı bitki türlerine bağlı olarak değişmektedir. Bitki içerisindeki 34 dağılım dikamba herbisitine karşı dirençli olan bitkilerde daha yavaş bir şekilde gerçekleşmektedir (Ahrens 1994). Dikambanın, yapraktan alınımının topraktan alınımına göre daha sınırlı olduğu görülmektedir. Ayrıca dikamba bitkilerin genç yapraklarında birikme eğilimi göstermektedir. Dikamba, 2,4-D ve MCPA gibi diğer sentetik oksinlerin etki mekanizmasına benzer bir şekilde bitkiye zarar vermektedir. Bu yüzden, literatürde 2,4-D ile yapılan çalışmalara nazaran dikamba ile ilgili daha az çalışma yer almaktadır. Daha pahalı olması sebebiyle 2,4-D’ye nazaran daha az kullanımı olsa da, 2,4-D’nin yetersiz kaldığı durumlarda zararlılarla mücadelede kullanılmaktadır (Filkowski et al. 2003). Kanada’da yapılan bazı çalısmalara göre, tarım alanları çevresinde bulunan nehir ve göl sularında önemli ölçüde dikamba kalıntısına rastlanması, bu kimyasal maddenin çevresel kirliliğe neden olduğunu göstermektedir (Filkowski et al. 2003) Köpek, fare ve tavşanlar gibi deney hayvanları üzerinde yapılan toksikolojik çalışmalarda dikambanın düşük toksisite gösterdiği belirtilmiştir. Dikambanın tavşanlarda orta dereceli deri ve göz tahrişine neden olduğu bildirilmiştir (RED 2009). Dikambanın cilt yoluyla emilimi oldukça düşüktür. Yutulduğu zaman, dikamba hızlıca emilir ve idrarla atılır. Dikamba alınımı sonrası zehirlenme belirtileri; kusma, nefes darlığı, kalp hızı, iştahsızlık, siyanöz ve kas spazmları kaybı şeklinde gözlenmiştir. Ayrıca gastrointestinal kanama meydana gelebilmektedir. Çok ağır zehirlenme vakalarında, kusma, ishal ve karın ağrısı koma ile sonlanabilmektedir (Kamrin 1997; Bradberry et al. 2004). Geniş inhalasyona maruz kalma sonucunda öksürüğe, baş dönmesine ayrıca burun, yutak ve göğüs tahrişine neden olmaktadır (Reigart and Roberts 1999). Dikamba alımından sonra görülen diğer sağlık etkileri; hipertermi, metabolik asidoz, böbrek yetmezliği ve bazı karaciğer enzimlerinin yükselmesi gibi semptomları içermektedir (Bradberry et al. 2004). 35 Dikamba ile ilgili yapılan karsinojenite çalışmaları sonucunda, dikambanın farklı dozlarının uygulandığı erkek farelerde, malign lenfomalar ve tiroid parafoliküler hücreli karsinomlarda hafif bir artış olduğu saptanmıştır (RED 2009). İnsanlar üzerinde yapılan araştırmalarda dikambanın kanser oranında önemli bir ölçüde artış meydana getirmediği gözlenmiştir. Ancak akciğer ve kolon kanseriyle ilgili zayıf bulguların olduğu bildirilmiştir (Samanic et al. 2006). Farelerin radyoaktif olarak işaretlenmiş dikamba ile beslendiği bir çalışmada, dikambanın karaciğer, böbrek, kan, kas ve yağ dâhil olmak üzere incelenen tüm dokularda görüldüğü tespit edilmiştir. Genel olarak, su oranı yüksek olan dokularda, yağ dokusuna göre daha yüksek dikamba birikimi gözlenmiştir. Doku analiz sonuçları dikamba birikmesinin daha çok böbrekte sonra kanda ardından da karaciğerde olduğunu göstermiştir. Dikambanın eser miktarda olmak üzere, çoğu dokudan temizlendiği belirlenmiştir (Oehler and Ivie 1980). 2,4-D gibi dikamba da doku kültürlerinde kallus teşviki ve bitki rejenerasyonu çalışmalarında yaygın olarak kullanılan bir herbisittir. Yapılan birçok çalışmada kallus teşviki ve bitki rejenerasyonu bakımından dikambanın 2,4-D’ye nazaran daha iyi olduğu belirlenmiştir (Aydın vd 2011). Dikamba ve 2,4-D gibi herbisitlere veya ağır metal (kurşun, kadmiyum, cıva vb.) gibi toksik kimyasallara maruz kalmış bitkilerde kök gelişiminin önemli düzeyde azaldığı bildirilmiştir (Yildiz and Arikan 2008; Cenkci et al. 2009; Bozdağ 2009). Rinella et al. (2001), dikambanın uygulandığı buğday bitkisinde; olgun tohum gelişiminin baskılandığını, tohum ağırlıklarının kontrol grubuna göre azaldığını ve sera koşullarında bu etkinin tarla koşullarına göre daha fazla olduğunu bildirmişlerdir. Everitt and Keeling (2009), tarafından yapılan bir çalışmada; pamuk bitkisinin farklı gelişim evrelerinde dikamba ve 2,4-D herbisitleri uygulanmıştır. Bu herbisitlerin bitki gelişimi, verimi ve lif ağırlığı üzerindeki etkilerini araştıran bilim adamları gelişim 36 dönemlerinin ilerleyen safhalarında pamuk bitkisinin yapraklarında karşılıklı olarak kıvrılmaların ve yapraklarda renk açılmalarının meydana geldiğini gözlemişlerdir. Kelley et al. (2005), tarafından yapılan bir çalışmada; soya ekimi yapılan alanlarda bulunan yabancı otlarda büyümeyi inhibe eden dikamba, 2,4-D ve klopiralid herbisitleri uygulanmıştır. Sprey halinde uygulanan bu herbisitlerin, ekimi yapılan soya bitkisinin yapraklarında kıvrılmalara ve sararmalara neden olduğu rapor edilmiştir. Bununla birlikte, dikamba ve 2,4-D gibi herbisitlerin bitkilerde protein sentez mekanizmasını etkileyerek hücre içerisinde bulunan protein içeriğini arttırabildiği veya azaltabildiği bildirilmiştir (Bozdağ 2009). Protein içeriğinde meydana gelen azalma ve artışların uygulanan herbisitin çeşidine, oranına ve uygulandığı bitki dokusuna bağlı olabileceği öngörülmüştür (Fonseca et al. 2008; Peixoto et al. 2008). Dikamba gibi sentetik oksin herbisitlerin bitki ve hayvan hücrelerindeki genotoksik etki mekanizmaları tam olarak bilinmemektedir. Bununla birlikte dikamba gibi sentetik oksinlerin ökaryotik hücrelerde peroksizom içeriğini önemli oranda arttırdığı belirlenmiştir (Espandiari et al. 1995). Ayrıca Peixoto et al. (2003), tarafından ratlar üzerinde yapılan bir çalışmada; deney hayvanlarının karaciğerlerinden izole edilen mitokondride, dikambanın fotofosforilasyon kapasitesini etkileyerek, hücrelerin enerji üretim verimliliğini azalttığı belirlenmiştir. González et al. (2006), tarafından insan lenfosit hücre kültürlerinde dikambanın çeşitli konsantrasyonlarının kullanılarak yapıldığı genotoksik çalışmada; dikambanın SCE frekansını önemli ölçüde arttığı ve yüksek dozlarda uygulanan dikambanın hücre kültürü sitotoksisitesine neden olduğu rapor edilmiştir. Ayrıca dikambanın hücre döngüsü kinetiğini etkilediği ve hücre döngüsünün ilerlemesinde önemli bir gecikmeye sebep olduğu gözlenmiştir. Uygulama yapılan hücrelerde, çoğalma hızı indeksinin 37 önemli bir ölçüde azaldığı ve doza bağımlı olarak mitotik aktivite inhibisyonunun gerçekleştiği bildirilmiştir. González et al. (2009), tarafından yapılan bir çalışmada; saf dikamba ve ticari formu olan Banvel’in genotoksik ve sitogenetik etkileri araştırılmıştır. Uygulama yapılan CHO (Chinese Hamster Ovary/Çin Hamster Ovaryum) hücrelerinde hücre döngüsü süreci, SCE frekansı ve hücre canlılık analizleri yapılmıştır. Araştırma sonuçlarına göre, dikambanın reaktif oksijen türlerinin oluşumunu arttırarak DNA hasarına sebep olduğu tespit edilmiştir. Özellikle DNA hasarıyla ilgili yapılan çalışmalarda, dikambanın kemik iliği hücrelerinde yapısal kromozom anomalilerine sebep olduğu bildirilmiştir (Hrelia et al. 1994). Ayrıca Drosophila melanogaster üzerinde yapılan çalışmalarda dikamba herbisitinin eşeye bağlı resesif letal mutasyonlara neden olduğu saptanmıştır (Waters et al. 1981). 2.4. Transpozonlar Transpozonlar, genom içerisinde hareket eden ve genomdaki dizilişi değiştiren mobil elementler olarak tanımlanmaktadır. Bu hareketli elementler translokasyon, insersiyon, duplikasyon veya delesyonla farklı kromozomların etkileşmesini sağlamaktadır. Plasmodium cinsinin birkaç türü hariç tüm ökaryotlarda ve neredeyse tüm prokaryotlarda bulunan transpozonlar, ökaryotik organizmalardan bitki genomlarının ortalama %50-90, hayvan genomlarının da %3-45 kadarını oluşturmaktadır (Grzebelus 2006; Jurka 2008; Huang et al. 2009). 2.4.1. Transpozonların keşfi ve sınıflandırılması Transpozonlar, ilk olarak Barbara McClintock tarafından 1948 yılında mısır bitkisinde keşfedilmiştir (McClintock 1948). Transpozon elementlerinin, bitki türleri arasındaki benzerliklere rağmen analiz edilmiş tüm genomlarda olduğu rapor edilmiştir (Feschotte 38 et al. 2002). Prokaryotların çoğunluğunda %1-3 oranında, mayada (Saccharomyces cerevisiae) %3, memelilerde %25-45, insanda %45 ve Graminaceae’de ve Liliaceae’de %90-98 kadar transpozon elementleri bulunmaktadır (Schulman and Kalendar 2005; Mansour 2007; Lerat 2009). Transpozon elementleri, bir konakçı genomdaki hareket eden ya da çoklu halde bulunabilen ayrık diziler olabilirler (Sabot et al. 2004). LTR (Long Terminal Repeats/Uzun Uç Tekrarlar) retrotranspozonlarını ve LTR’siz transpozonları içeren Sınıf I transpozon elementleri önce mRNA’ya ardından da bir ters transkriptaz aracılığıyla DNA’ya transkribe edilmektedir. Sınıf II transpozon elementleri; TIR (Terminal Inverted Repeats/Terminal Ters Tekrarlar), MITE (Miniature Inverted Repeat Transposable Element/Minyatür Evrik Ters Tekrarlar) ve helitronları içeren DNA transpozonları, genomik konumundan kesilmiş ve başka bir yere entegre olmuş DNA molekülleri olarak hareket etmektedirler (Wicker et al. 2007). DNA transpozonları genelde otonom elementler olup basit bir yapıya sahiptirler. Birçoğunun gövde kısmında TPase (Transpozaz) enzimini kodlayan tek bir gen ve bu genin iki ucunda TIR’lar mevcuttur. TPase enziminin rekombinasyonu için gerekli olan bu kısa tekrarlar genelde 10-40 bç uzunluğunda olmakla beraber, 200 bç uzunluğunda da olabilmektedir. Otonom olmayan elementler TPase kodlayan geni içermezler ancak içerdikleri TIR dizileri ve otonom bir transpozonun üretmiş olduğu TPase sayesinde genomda hareket edebilirler. DNA transpozonlarının transpozisyonu sırasında gerekli olan bir diğer enzim ise rezolvazdır ve bu enzim transpozonun insersiyon yapmasına olanak sağlamaktadır (Smitt and Riggs 1996; Feschotte 2008). Transpozon elementlerinin genomik organizasyona katkıda bulunduğu ve genom evriminin gerçekleşmesinde önemli bir yere sahip oldukları kabul edilmektedir. Sentromerik stabilitede ve heterokromatinin korunmasında önemli rol oynayabilen (Slotkin and Martienssen 2007), özellikle sentromerik ve perisentromerik bölgeler transpozon elementlerinden oluşmaktadır (Kishii et al. 2001). Transpozon elementlerinin aktif hale gelmesiyle; farelerde farklılaşmış kromozom ayrılması ve mayoz bölünmede aksaklıklar, maya da kardeş kromatid uyumunun kaybı ve 39 Arabidopsis thaliana’da sentromer uyumunun bozulduğu tespit edilmiştir (Volpe et al. 2002; Bourchis and Bestor 2004; Lippman and Martienssen 2004). Genomda meydana gelen mutasyonların birçoğunun aktif transpozon elementleri sayesinde gerçekleştiği bilinmektedir. Transpozon elementlerinin transpozisyonu; gen ifadesinde değişme (Zhang and Saier 2009), yeni düzenlemelerin meydana gelmesi (Naito et al. 2009), gen delesyonları (Chopra et al. 1999), gen duplikasyonları (Akhunov et al. 2007), genom boyutunda artış (Kalendar et al. 2000; SanMiguel et al. 2002), rekombinasyon (Lönnig and Saedler 2003), kromozom kırıkları ve yeniden çerçevelenmelerle sonuçlanabilir (McClintock 1984). Aktif transpozon elementlerinin potansiyel zararlı etkilerinden dolayı genomdaki çoğu transpozon elementlerinin ifadesi baskılanmıştır. Böylece tümünün otonom transpozisyon yeteneği olsa bile transpozon elementlerinin çoğu bitkinin yaşam döngüsü boyunca sessiz kalmaktadır (Slotkin and Martienssen 2007). Biyotik ve abiyotik stres koşulları altında transpozon elementlerinin aktivasyonu gözlenmiştir (Wendel and Wessler 2000).Transpozon elementlerinin ifadesi hem transkripsiyonda hem de transkripsiyon sonrasındaki epigenetik mekanizmalarla susturulmaktadır (Slotkin and Martienssen 2007). Transpozon elementleri; histon kuyruklarının modifikasyonlarını ve değiştirilmiş kromatin paketlerini içeren; DNA metilasyonu ve baskılayıcı kromatin oluşumlarıyla transkripsiyonel olarak susturulabilmektedir (Feschotte et al. 2002; Tompa et al. 2002). Transpozon elementlerinin transkripsiyon sonrası susturulması RNA kompleksinin yıkılarak transpozon elementlerinin kopyalarının bozulmasıyla elde edilmektedir (WuScharf et al. 2000; Feschotte et al 2002). sRNA (Small RNA/Küçük Kodlanmayan RNA)’lar çift zincirli RNA’yı oluşturduğunda, transkripsiyon sonrası susturmaya kılavuzluk eden özel diziler, dicer ailesine ait proteinler tarafından ayrılmaktadır (Baulcombe 2004). 40 sRNA’lar nükleustaki homolog DNA dizisinin metilasyonunda (RNA’dan direk DNA metilasyonu) ve heterokromatinin oluşumunda görev almaktadırlar. Aynı zamanda sRNA’lar transkripsiyon seviyesinde transpozon elementlerinin susturulmasını da teşvik etmektedir (Qi et al. 2006; Schwach et al. 2009). sRNA’ların fonksiyonları uzunlukları ile de ilişkilidir. 21 nt uzunluğundaki sRNA transkripsiyon sonrası susturmada, 24 nt uzunluğundaki sRNA ise RNA’ya bağımlı DNA metilasyonu ve heterokromatini koruma aracılığıyla gerçekleşen susturma ile alakalıdır (Slotkin and Martienssen 2007; Schwach et al. 2009). Caenorhabditis elegans mutantlarında RNAi (RNA-interferaz) mekanizmasının kusurlu olması; transpozon elementlerinin hareketlenmesine (Ketting et al. 1999; Tabara et al. 1999), A. thaliana mutantlarında ise DNA metilasyonunda ve kromatin yapı düzenlenmesinde eksikliklere sebep olmaktadır (Miura 2001; Tompa et al. 2002; Tsukahara et al. 2009). Son yıllardaki transpozon transkripsiyonunu ve hareket kontrolünü içeren epigenetiksel çalışmalar, gelişim biyolojisindeki ilerlemelere yeni bir ışık tutmuştur. Aynı zamanda transpozonların çeşitli biyolojik yönleri, evrim ve konakçı genomun düzenlenmesi üzerine etkileri de ele alınmıştır (Weil and Martienssen 2008; Feng et al. 2010) 2.4.1.a. Retrotranspozonlar Retrotranspozonlar gen anlatımını değiştiren, mutasyonları uyaran ve genom büyümesine sebep olan en önemli epigenetik değişimlerden biri olarak görülmektedir. Gelişme aşamasında çoğunlukla etkisiz olmakta, fakat stres şartlarında aktif duruma geçmektedirler (Kumar and Bennetzen 1999). Retrotranspozonlar, ökaryotik transpozon elementlerinin en yaygın sınıfıdır. Retrotranspozonlar genelde, uzun uç tekrarları (LTR) içerip içermemelerine göre sınıflandırılırlar. LTR’li ve LTR’siz olmak üzere iki temel gruba ayrılmışlardır. LTR retrotranspozonları; Ty1-copia ve Ty3-gypsy alt gruplarına ayrılırken (Şekil 2.3), LTR’siz retrotranspozonlar; LINEs (Long Interspersed Nuclear Elements/Uzun 41 Serpiştirilmiş Nükleer Elementler) ve SINEs (Short Interspersed Nuclear Elements/Kısa Serpiştirilmiş Nükleer Elementler) alt gruplarına ayrılmıştır. LTR retrotranspozonları, iç kodlayan bölgelere yakın olan 100 bç-1 kb uzunluğunda değişen uzun uç tekrarlarına sahiptir. Hem Ty1-copia hem de Ty3-gypsy grupları iki büyük gendeki proteinlerin sayısını kodlamaktadır. Gag ve pol, kodlanan bir proteaz elementi tarafından fonksiyonel peptidlere bağlanan bir poliprotein olarak sentezlenmektedir. Şekil 2.3. Ty1-copia ve Ty3-Gypsy elemanlarının yapısı (Kalendar et al. 2011) Gag, RNA retrotranspozonlarının paketlenmesi için önemli protein (kılıf yapısında bir proteini) yapılarını kodlarken; pol geni, retrotranspozon yaşam döngüsü için ihtiyaç duyulan enzimatik aktiviteleri kodlamaktadır. Bu polipeptid, AP (aspartik proteinaz), RT (ters transkriptaz), RNaz H (ribonükleaz H) ve INT (DDE integraz) aktivitelerine sahiptir. Ayrıca bu enzimatik aktiviteleri yapmak için Ty1-copia ve Ty3-gyspsy elementleri arasında pol geni farklılıklarını da kodlamaktadır. Ty1-copia elemanları proteaz kodlama kapasitesinin hemen alt akışında konumlanır. Ty3- gypsy elemanları ise pol geninin ucunda yer almaktadır. LTR retrotranspozonlarının transkripsiyonu, 5’ LTR ile başlar ve 3' LTR ile biter. LTR’ler genellikle elementlerin hem promotor hem de terminatör transkripsiyonu için düzenleyici sekanslar içermektedir. LTR’li retrotranspozonlar bitkilerde bol miktarda bulunurken, bu oran hayvanlarda düşüktür ve insan genomunun %8’ini oluşturmaktadır. Uzunlukları bir kaç yüz baz çiftinden, 25 kilobaza kadar değişiklik göstermektedir. LTR’siz retrotranspozonlar, LTR’lerden 42 yoksundur ve iç promotorlerden transkribe edilirler. LTR’siz retrotranspozonlara örnek olarak LINEs ve SINEs dizileri verilebilir (Şekil 2.4). LINE dizileri LTR retrotranspozonlarına benzemektedir. Yapısal ve enzimatik aktiviteleri kodlayan gag ve pol genlerine sahiptirler ve yaklaşık olarak 6500 bç uzunluğundadırlar. LINE dizileri ters transkriptaz ve entegraz (transpozaz) adı verilen iki geni şifrelemektedir. İnsan genomunda mevcut olan 900.000 LINE dizisi, insan genomunun yaklaşık %21'ini oluşturmaktadır (Xiong and Eickbush 1990). Şekil 2.4. Sınıf I ve Sınıf II retrotranspozonlarının yapısı (Wicker et al. 2007) Bunların aksine SINE olarak adlandırılan küçük retrotranspozonlar diğerlerinden çok farklıdır ve onlar herhangi bir kodlama yeteneğine sahip değildirler. SINEs, tRNAs ya da 7SL RNAs gibi polimeraz III transkriptlerinden türetilmiştir ve yerini değiştirmek için özel LINEs fonksiyonlarını kullanırlar. Yaklaşık olarak 100-400 bç uzunluğunda olan bu diziler, RNA polimeraz III vasıtasıyla çevri yazılmış bazı hücresel RNA’ların 43 ters transkripsiyonu sonucu genoma dâhil olmuşlardır. Bunların en iyi bilinen örnekleri Alu elemanlarıdır. İnsan genomunda bulunan 1 milyon SINE dizisi, insan genomunun yaklaşık olarak %13’ünü oluşturmaktadır (Kajikawa and Okada 2002). Hem prokaryot hem de ökaryotlarda bulunan, MITE gibi RNA aracılığı olmadan kopyala-yapıştır mekanizmasıyla hareket edebilen transpozonların keşfedilmesi, ikili sisteme meydan okumuştur. Bazı araştırıcılar, bu tarz transpozisyon yapan grupları tamamen ayrı bir sınıf olarak kabul etmiştir. Bazı araştırmacılar ise MITE gibi dizilerin keşfinden sonra, transpozonları transpozisyon aracına göre sınıflandırmayı reddederek, tamamen enzimolojik sınıflandırmalar geliştirmişlerdir. MITE’ler DNA transpozonlarına (Sınıf II transpozonları) benzemektedirler ancak daha küçüktürler; yaklaşık olarak 100-500 bç uzunluğundadırlar ve transpozisyonları için gerekli genlere sahip değildirler. Genomda mevcut olan diğer transpozonların transpozazları vasıtasıyla hareket ettikleri düşünülmektedir. MITE’ler retrotranspozonlarla kıyaslandığında çok kısa elementlerdir. MITE’ler bitki genomunun önemli bir kısmını; örneğin pirinç genomunun yaklaşık %6’sını, pirinçteki Stowaway grubunun ise %2’sini oluşturmaktadırlar (Mao et al. 2000). İlk olarak bitki genomlarında tespit edilmişler, ardından insan ve çeşitli canlı türlerinde de mevcut oldukları belirlenmiştir. İnsan genomundaki 100.000 MITE ise, insan genomunun neredeyse %1'ini oluşturmaktadır. MITE’lerin çoğu normal genomun kodlanmayan bölgelerinde bulunduğu, transkripsiyonun başlangıç ve poliadenilasyonuna katılan düzenleyici sekansları sağladığı görülmüştür. Normalde MITE’lerin gen ekspresyonuna katkısı vardır fakat gen ekspresyonunun ilk çıkışını değiştirip değiştirmedikleri tam olarak belirlenememiştir (Bureau and Wessler 1994). 2.5. Retrotranspozonların Belirlenmesinde Kullanılan Moleküler Markırlar Genom üzerinde belli bir bölgeyi tanımlamak için kullanılan genetik belirteçler olan moleküler markırlar, DNA’nın büyük bir kısmının veya tek bir özel nükleotidin simgesi olabilmektedirler. Son yıllarda bilim adamları tarafından yaygın olarak kullanılan 44 moleküler markırlar, kaynağını bitki hücrelerinde mevcut olan DNA’lardan aldığı için, bitki çeşitliliğinde veya populasyondaki bitki genotiplerinin yakınlık derecelerinin belirlenmesinde %100’e yakın güvenilirlikle değerlendirilmektedir. Moleküler markır teknolojisi; genetik çeşitlilik, adli tıp, genetik bağlantılı haritalama, filogenetik ilişkiler ve moleküler ıslahı içeren bitki biyolojisinde önemli bir rol oynamaktadır. Genomdaki farklılık dağılımının analizine dayalı birkaç markır sistemi vardır. Retrotranspozonların integrasyonları, genomik DNA ve korunmuş uçları arasında yeni ek yerleri oluşturduğundan, markır olarak kullanılabilmektedir. Retrotranspozon insersiyonu ile oluşan polimorfizmi belirlemekte kullanılan markır sistemleri; genelde bu uçlar arasındaki ve bitişik DNA bölgelerinin bazı bileşenlerinin PCR yoluyla çoğaltılmasına dayanmaktadır. LTR retrotranspozonlarının değişik PCR parmak izi teknikleri tarafından, tek bir türe ait analiz formlarının polimorfizmini tespit etmek için; IRAP, REMAP ve SSAP gibi moleküler markır teknikleri kullanılmaktadır (Kalendar et al. 2011). 2.5.1. IRAP (Inter-Retrotransposon Amplified Polymorphism) IRAP tekniği iki LTR dizisi arasındaki DNA segmentlerini çoğaltmakta ve primerler bu bölgelere bağlanmaktadır. LTR için özel olarak tasarlanmış ya bir ya da iki primer aynı PCR’da kullanılabilmekte fakat sonuçlar bu bölgelerin yönlendirmesiyle belirlenmektedir. Hedeflenen Sınıf I elemanları (5' 3' veya 3' 5') her iki yönde gerçekleşebilen transpozisyonun ‘kopyala-yapıştır’ yöntemini kullanmaktadır. Bu genomik bolluğun yanı sıra baştanbaşa, kuyruktan kuyruğa ya da baştan kuyruğa yönlendirmede; gen kopyalama amaçlı kümelerde farklılığa yol açar (Şekil 2.5). Baştanbaşa ve kuyruktan kuyruğa düzenlemelerde, IRAP ürünlerini oluşturmak için yalnızca basit bir primer yeterlidir. Baştan kuyruğa yönlendirmede; genomik DNA’nın arasına girip çoğaltma işlemi yapmak için hem 5' hem de 3' LTR primerlerine ihtiyaç vardır. IRAP tekniği basittir ve genomdaki tüm hedef bölgelerin taranması tek bir primerle gerçekleşir. 45 Ayrıca SSAP ve REMAP’tan daha ekonomik ve elverişlidir. SSR bölgelerinin taranmasına ve genomun kesilmesine gerek yoktur. IRAP ve REMAP, DNA parmak izlerini oluşturmak için Kalendar ve arkadaşları tarafından ortaya çıkarılan mobil elementelere dayalı bir markır sistemidir (Kalendar et al. 1999). Her ikisi de, 100-5,000 bç büyüklüğüne kadar değişen doğrudan LTR’ler içeren retrotranspozonların bir grubunu hedef almaktadır (Kumar and Bennetzen 1999). Şekil 2.5. IRAP çalışma prensibi (Poczai et al. 2013) a) Baştanbaşa b) Kuyruktan kuyruğa, c) Baştan kuyruğa 2.5.2. REMAP (Retrotransposon-Microsatellite Amplified Polymorphism) REMAP tekniği IRAP’tan farklıdır. REMAP primerleri, mikrosatellit dizileri ve LTR retrotranspozonları arasındaki bir segmentin çoğalmasının polimorfik ürünlerini tanımlamak amacıyla bağlantılı ISSR primerleriyle kombinlenir (Şekil 2.6). Bu teknik, REMAP reaksiyonundaki primerlerden birinin IRAP primeriyle kombinlenen ISSR’lere bağlı olmasından dolayı ISSR tekniğinin uzatılmış ya da modifiye edilmiş bir versiyonu olarak kabul edilmektedir. REMAP metodu BARE 1 retrotranspozonunun LTR’lerinin dış yüzündeki primerlerinden dizayn edilmektedir. Bunu elde etmek için, özel olarak tasarlanmış tek bir LTR primeri basit bir tekrar içeren örneğin, (CA)n (GA)n isteğe bağlı olarak seçilen bir diğer primer ile karıştırılmaktadır. 46 IRAP ve REMAP teknikleri güvenilir ve tekrarlanabilir bantlama profilleri oluşturdukları için çok sayıda bitki türünde genetik çeşitlilik çalışmalarında, kombinasyon oluşturarak ve ya bireysel bir şekilde kullanılmaktadır (Carvalho et al. 2011). Şekil 2.6. REMAP çalışma prensibi (Kalendar et al. 2011) 2.5.3. SSAP (Sequence-Specific Amplification Polymorphism) Waugh ve arkadaşları tarafından geliştirilen SSAP tekniği büyük oranda AFLP’ye (Amplified Fragment Length Polymorphism/Çoğaltılmış Parça Uzunluk Polimorfizmi) benzemekte ancak AFLP tekniğinden daha yüksek seviyede polimorfizm göstermektedir (Vos et al. 1995). Tipik bir AFLP prosedürü için ön bir dizi bilgisi gerekli değilken, SSAP için dikkatli bir planlama ve ön transpozon dizisi bilgisi tavsiye edilmektedir (Waugh et al. 1997). SSAP’taki genomik DNA bir restriksiyon enzimi (MseI veya PstI) ile kesilmektedir. Kesimden sonra sekansları bilinen kısa çift zincirli adaptörler kesilmiş DNA fragmentlerine bağlanmaktadır. Adaptör homolog primerlerle ön seçici bir PCR amplifikasyonu yapılmaktadır (Şekil 2.7). Ön amplifikasyon adımı genom karmaşıklığını azaltmak ve daha yüksek bir tekrarlanabilirlik sağlamak için gerçekleştirilmektedir. Bir sonraki adım; adaptör primer yerine nadiren ya da sıklıkla eşleşen transpozona özgü bir primerle seçici bir amplifikasyondur. Primerler genellikle retrotranspozonların LTR bölgelerine veya iç kısımlarına bağlanır. Fragmentlerin büyüklükleri genellikle transpozisyon insersiyon alanı ve komşu restriksiyon kesim alanları arasındaki uzaklığa bağlı olarak değişmektedir (Syed and Flavell 2006). S-SAP 47 amplifikasyonları için Ty1-copia veya Ty3-gypsy retrotranspozonları yaygın olarak kullanılmaktadır (Poczai et al. 2013). Şekil 2.7. S-SAP çalışma prensibi (Poczai et al. 2013) DNA’nın restriksiyon enzimi ile kesimi (‘R’ ile gösterilen dikey kırmızı hatlar). Adaptörlerin(mavi kutucuklar) kesilen uçlara takılması ve ön seçici PCR işlemi. Seçici PCR amplifikasyonu LTR (kırmızı ok) ve adaptöre özgü (mavi ok) primerler ile yürütülür. Her iki primer, özel amplifikasyon sağlamak ve yönetilebilir bir düzeyde üretilen bant sayısını azaltmak için seçici nükleotidler (okların renkli başlıkları) içerir. Primerin 3'ucunda seçici bir nükleotid bulunduğundan transpozon amplifikasyonu sadece solda gösterilen yapıdan gerçekleştirilebilir. Değişken uzunlukta oluşturulmuş PCR ürünleri kahverengi çubuklarla gösterilmiştir. 2.5.4. RBIP (Retrotansposon Based Insertional Polymorphism) İnsersiyon sekans temelli polimorfizm tekniği, kendi insersiyonundan primerler ve insersiyon bölgelerine yakın primerler arasında PCR kullanarak, retrotranspozon insersiyonlarının basit bir PCR işlemine dayandırılarak tespit edilmesine dayanmaktadır (Şekil 2.8). Temel RBIP metodu bir filtre hibridizasyonuyla elektroforez jelin yerini alarak yüksek uygulamalar için geliştirilmiştir (Flavell et al. 1998). RBIP pirinçte Vitte et al. (2004), tarafından Indika ve Japonika pirinç çeşitlerinin evrim sorununu gidermek için kullanılmıştır. Bu teknik tüm sekans bilgisine ihtiyaç duyduğu için diğer tekniklerden daha pahalı ve karmaşıktır (Kalendar et al. 2011). 48 Şekil 2.8. RBIP çalışma prensibi (Kalendar et al. 2011) 2.5.5. iPBS (Inter-Primer Binding Site Amplification) Son zamanlarda Kalendar et al. (2010), LTR retrotranspozonlarının belirli primer bağlanma bölgeleri arasındaki iPBS’ye (Inter-Primer Binding Site Amplification/İçPrimer Bağlanma Bölgelerine Dayalı Çoğaltma) dayalı olan DNA parmak izi için yeni bir evrensel yöntem geliştirmişlerdir. Bu tekniklerin çoğunun kısıtlayıcı oluşu her bir bitki türü için özel retrotranspozon dizilerine dayalı moleküler markır sistemlerini gerektirmektedir. iPBS moleküler markırının kullanımı için LTR sekansının bilinmesinin gerekli olması sınırlayıcı faktörlerden biridir. Fakat eğer ön bilgi yoksa LTR’ler klonlanıp dizilerek veya tRNA’ların sınırlı setine tamamlayıcı 18 nükleotidle LTR transpozonları tarafından paylaşılan retrotranspozonların PBS (Primer Binding Site/Primer Bağlanma Bölgesi) bölgeleri kullanılarak bu sorunun üstesinden gelinmektedir (Mak and Kleiman 1997). Bu bölgelere bağlanması için tasarlanan primerlerin uzunluğu 12-18 bç uzunluğu arasında değişmektedir. iPBS için retrotranspozonların ters yönlü olması ve intergenik bölgeleri amplifiye etmek için birbirine yeterince yakın olması gerekmektedir (Şekil 2.9). Bu metod PBS elementlerine sahip retrotranspozonlarda ve çoğu organizma üzerinde transfer edilebilir gibi görünmektedir (Gailite and Rungis 2012). 49 Şekil 2.9. iPBS çalışma prensibi (Kalendar et al. 2011) 2.5.6. ISAP (Inter-SINE Amplified Polymorphism) Seibt ve arkadaşları tarafından geliştirilen ISAP (Inter-SINE Amplified Polymorphism/ İç-Kısa Serpiştirilmiş Nükleotid Elementleri Çoğaltma Polimorfizmi) tekniği; eksik LTR motifleri olan retrotranspozonlara dayalı bir tekniktir (Seibt et al. 2012). Bu teknik özellikle patates için geliştirilmiştir. ISAP markırları bitişik SINE elemanları arasındaki genom dizilerinin amplifikasyonuna dayanmaktadır. Primerlerin, SINE elementlerinde farklı pozisyonlarda bağlanması için her biri dış ya da iç tarafa yönlendirilir. Özel primer tasarımı farklı Solanaceae SINE elemanlarının konsensus dizileri karşılaştırılarak elde edilmektedir. Son zamanlarda yapılan bir çalışmada biyoinformatik araçlar kullanılarak belirlenen Solanaceae familya ve alt familyalarına özgü SINE elementlerinin yaklaşık 6500 kopyasının olduğu belirlenmiştir (Wenke et al. 2011). Bu elementlerin, Solanaceae familyası bitkilerin de yaygın olarak bulunduğu ayrıca bu tür ve cinsler için kolaylıkla uygulanabilir olduğu öne sürülmüştür. 2.6. Epigenetik ve Transpozon İlişkisi Epigenetik modifikasyonlar, orijinal DNA sekansında değişim olmaksızın gen aktivitesindeki değişikliğin, mayoz ya da mitoz esnasında hücrenin ürününe dönüşen değişimleri olarak tanımlanırlar (Chen et al. 2010). Birkaç hücre bölünmesi ve stres hafızasının sürdürülme potansiyeliyle, geri dönüşümlü aynı zamanda hızlı bir şekilde meydana gelen bu değişimler, çevresel koşullara karşı oluşturulan tepkilerde bitkinin 50 esnekliğini tarif etmek için potansiyel bir mekanizma olabilmektedir (Bruce et al. 2007). Aynı zamanda bitki stres toleransını geliştirmede kullanılabilirler. Fizyolojik ve gelişimsel uyarıcıların yanı sıra çevresel stres koşulları da epigenetik değişikliklere neden olabilmektedir (Boyko and Kovalchuk 2008). Birçok çalışma, gen ekspresyonundaki değişikliklerin, bitki stres tepkileri esnasındaki epigenetik statüde meydana gelen değişmeler ile koordineli olduğunu ortaya koymuştur. Genelde nükleozom doluluk oranı transkripsiyonel aktivasyonla negatif ilişkilidir. Bu nedenle, bir genomik bölge transkripsiyonel olarak aktive edildiğinde, bu bölgede nükleozom yoğunluğu azalır ve kromatin yapısı rahatlatılır (Kim et al. 2010). Epigenetik değişiklikler nedeniyle oluşan kromatin yapısındaki değişimler, kromatin ilişkili çeşitli proteinlerin katılmasına bağlıdır (Verbsky and Richards 2001). Bağlayıcı histon I HMG (High Mobility Group/Yüksek Mobil Grup) proteinleri, histon modifikasyon enzimleri gibi kromatin ilişkili proteinler ve kromatin yeniden şekillenme kompleksi bileşenleri, ilgili genleri düzenlemek amacıyla kromatin montaj ve nükleozom ambalaj ile kromatinin üst düzey yapısını değiştirmektedir (Grasser et al. 2007; Jerzmanowski 2007). Epigenetik düzenleme, transpozon hareketleri sonucunda oluşabilecek olası zararlı etkileri önleyen bir mekanizma olarak işlemektedir. DNA metilasyonu, histon asetilasyonu ve metilasyonu, RNAi ile transkripsiyon sonrası sessizleştirme, kromatin paketleme ve yoğunlaşmasındaki değişimler transpozonları baskılayan mekanizmalar olarak işlemektedir (Goldberg et al. 2007). Bu baskılayıcı mekanizmalar sayesinde transpozonların yüksek mutasyon özellikleri engellenmektedir. 51 3. MATERYAL ve YÖNTEM 3.1. Materyal 3.1.1. Kullanılan bitkisel materyal Çalışmamızda bitkisel materyal olarak, Atatürk Üniversitesi Ziraat Fakültesi’nden temin edilen Triticum aestivum cv. Kırik çeşidi kullanılmıştır. Tohumların çimlendirilmesiyle elde edilen bitkilerden yararlanılmıştır. 3.1.2. Yararlanılan alet ve cihazlar Çalışma esnasında aşağıdaki alet ve cihazlar kullanılmıştır. Otoklav (Hirayama, JAPAN, HVE 50, SN 030787253) Soğutmalı Santrifüj (Hettich, Mikro 22R, M10, SN 0001279–03–00) Santrifüj (Hettich, GERMANY, EBA–20) PCR (Corbett Research CG1–96, AUSTRALIA) Elektroforez Tankı (Yatay) (OWL B2, U.S.A.) Elektroforez Akım Sağlayıcı (OWL OSP300-2Q, U.S.A.) Jel Görüntüleme Sistemi (DNR BioImaging Systems MiniBis Pro, ISRAEL) Su Banyosu (Memmert WNB14, GERMANY) Otomatik Pipetler (Eppendorf, GERMANY) Spektrofotometre (Cecil, CE 5502) Magnetik Karıştırıcı (Daihan Scientific MSH 20A, KOREA) pH Metre (InoLab pH730 wtw Series, GERMANY) Derin Dondurucu (Nuarie, U.S.A., -86 Ultralow Freezer, SN P07K–476316-PK) Hassas Terazi (Mettler Toledo AL204, CHINA) Buzdolabı (Arçelik, TÜRKİYE, 8190NF) Saf Su Cihazı (GFL 2004, GERMANY) 52 Steril Kabin (Esco AC2-4E1, SINGAPORE) Mikrodalga Fırın (Arçelik, TÜRKİYE, MD 592) Kar makinesi (Scotsman, U.S.A., AH 19828 5) 3.1.3. Kullanılan çözelti ve solüsyonlar Araştırma süresince kullanılan çözeltilerin kimyasal içerikleri aşağıda verilmiştir: 3.1.3.a. Kullanılan 2,4 –D çözeltisinin hazırlanışı Konsantrasyon Miktar (g/l) 250 ppm 0,25 gr 2,4 –D 500 ppm 0,50 gr 2,4 –D 750 ppm 0,75 gr 2,4 –D 1000 ppm 1 gr 2,4 –D 3.1.3.b. Kullanılan dikamba çözeltisinin hazırlanışı Konsantrasyon Miktar (g/l) 250 ppm 0,25 gr Dikamba 500 ppm 0,50 gr Dikamba 750 ppm 0,75 gr Dikamba 1000 ppm 1 gr Dikamba 3.1.3.c. DNA izolasyonu için kullanılan çözeltiler 1M Tris-HCI (1000 ml) 121,1 gr Tris-base 700 ml dH2O 53 42 ml konsantre HCI (%37,2-12,1 M) 700 ml su içerisine 121,1 gr Tris-base karıştırıldı. Üzerine 42 ml konsantre HCl eklenerek toplam hacim 1 litreye tamamlandı ve otoklavlandı. 0.5 M EDTA PH=0.8 (1000 ml) 136,1 gr EDTA 20 gr NaOH 800 ml dH2O 800 ml su içerisine 136,1 gr EDTA çözüldü, üzerine 20 gr NaOH eklenerek pH=8.0 olarak ayarlandı. Filtreden geçirildi ve otoklavlandı. 5 M NaCl (500 ml) 146,1 gr NaCl 450 ml dH2O 146,1 gr NaCl 450 ml suda çözüldü. Toplam hacim 500 ml’ye tamamlanıp oda sıcaklığında saklandı (otoklavlanmadı). 10X TE Tamponu (1000 ml) 100 ml 1 M Tris-HCI pH=8.0 20 ml 0.5 M EDTA 880 ml dH2O kullanılarak hazırlanmıştır. 54 1X TE Tamponu (1000 ml) 10X TE tamponun’dan 100 ml alınıp 900 ml saf suyla 1000 ml’ye tamamlandı. (DNA 1X TE’de çözülür.) 3 M Sodyum Asetat (Ph= 5.2)(100 ml) 40,8 gr Sodyum asetat (Na0Ac.3H2O) 80 ml ultra saf suda iyice çözülür. pH= 5.2 oluncaya kadar glasiyel asetik asit (GAA) eklenir ve toplam hacim 100 ml’ye tamamlanır. 10 M Amonyum Asetat 77 gr Amonyum asetat 800 ml dH2O 77 gr Amonyum asetat 800 ml distile su içerisinde çözüldü. Distile su kullanarak hacmi 1 litreye tamamlanarak stok hazırlandı. Çalışmada 250 mM olacak şekilde seyreltilerek +4°C’de muhafaza edildi. DNA Ekstraksiyon Tamponu (50 örnek için) 1 gr toz CTAB (Setil trimetil amonyum bromür) 0,5 gr (%0,1) Sodyum bisülfit (NaHS3 ve Na2S2O5 karışımı)(Sigma, 243973) 5 ml Tris-HCI (1 M) 14 ml NaCl (5 M) 2 ml EDTA (0.5 M) 0,1 ml (%0.2) β-merkaptoetanol (v/v) 55 Kloroform: İzoamil Alkol 24: 1 oranında hazır olarak kullanıldı (Fluka, 25666). 2-Propanol (İzopropanol) Hazır olarak kullanıldı (Sigma, I9516). Proteinaz K Mililitrede 10 mg olacak şekilde hazırlandı (Sigma, P2308). Ribonükleaz (RNaz) Mililitrede 10 mg olacak şekilde hazırlandı (Sigma, R6513). %70’lik Etil Alkol 70 ml saf etil alkolün hacmi steril distile su ile 100 ml’ye tamamlandı. 3.1.3.d. PCR ve elektroforez işlemleri için kullanılan çözeltiler Etidyum Bromür Çözeltisi 500 ml 0,5X TBE tamponu içerisine 300 µl etidyum bromür ilave edilerek hazırlandı. Karanlık ortamda oda sıcaklığında muhafaza edildi. 56 Bromfenol Blue Çözeltisi 0,25 gr bromfenol blue ve 30 ml gliserol’ün toplam hacminin 100 ml’ye tamamlanmasıyla hazırlandı. Çözelti otoklavda steril edildikten sonra +4°C’de muhafaza edildi. 10X TBE Tamponu 108 gr Tris-base 55 gr Borik asit 40 ml 0,5 M EDTA 700 ml dH2O 700 ml distile su içerisinde 108 gr Tris-base, 55 gr Borik asit ve 40 ml 0,5 M EDTA çözüldü. Toplam hacim 1000 ml’ye tamamlandı ve otoklavlandı. 0,5X TBE Tamponu Bu araştırmada kullanılan TBE tamponu 10X TBE olarak hazırlandı ve seyreltilerek (50 ml 10X TBE Tamponu + 950 ml saf su) 0,5X TBE tamponu hazırlandı. Primerlerin Hazırlanması Kullanılan primerler firmanın önerdiği miktarda sulandırılarak stok solüsyonu, daha sonra da uygun hesaplamalar ile 1 μM olacak şekilde çalışma solüsyonları hazırlandı. 57 3.1.3.e. Sterilizasyon işlemleri için kullanılan çözeltiler %1’lik NaOCl (Sodyum hipoklorit) %5 NaOCl (sodyum hipoklorit) içeren ticari Domestos® marka çamaşır suyundan 200 ml alınarak hacim 1000 ml’ye tamamlandı. %75’lik Etil Alkol 75 ml etil alkolün hacmi steril distile su ile 100 ml’ye tamamlandı. 3.2. Yöntem 3.2.1. 2,4 D ve dikamba çözeltilerinin bitkiye uygulanması Eşit boyutlarda ve yeterli miktarda seçilen Triticum aestivum cv. Kırik çeşidine ait tohumlar musluk suyunda yıkandıktan sonra %75’lik etil alkolde 5 dk karıştırılıp 3 kez steril saf sudan geçirilmiş ardından %1’lik NaOCl’de 10 dakika steril edilmiştir. Tohumlar 6-7 kez saf su ile durulanmış ve steril filtre kağıdı ile kurutulmuştur. Steril edilen tohumlar 15’şer adet olmak üzere içerisinde torf ve kum karışımı bulanan saksılara ekilmiş ve bitkilerin 2-3 yapraklı döneme kadar büyümesi beklenmiştir. Bitkiler 2-3 yapraklı döneme geldiğinde uygulama gruplarına göre ayrılarak 2,4-D ve dikamba çözeltileri, 3 günlük arayla 2 kez püskürtülme işlemi ile uygulanmıştır. Uygulama sonunda saksılardaki ve kontrol grubunda ki bitki örneklerinden yeterli miktarda alınarak DNA izolasyonu yapılmıştır. 58 3.2.2. DNA izolasyonu DNA izolasyon protokolü aşağıdaki gibi yapılmıştır. a. Taze olarak hazırlanmış DNA Ekstraksiyon tamponu önceden 65°C’ye ısıtılmış su banyosunda bekletilmiştir. Bitki materyaline ilave edilmeden önce ekstraksiyon tamponuna %0.2 (v/v) oranında β-merkaptoetanol ilave edilmiştir. b. Önceden sıvı azotta parçalanıp 2ml’lik tüplere alınan 0,3 gr bitki materyali üzerine 1000 µl DNA ekstraksiyon tamponu eklenmiş ve alt üst ederek karıştırılmış ve önceden 65°C’ye ısıtılmış su banyosunda her 10 dk’da alt üst edilip karıştırılarak 60 dk bekletilmiştir. c. Su banyosu aşamasından sonra 10 dk oda sıcaklığında soğumaya bırakılmıştır ve bu süre sonunda her örneğe 750 µl kloroform izoamil alkol eklenip tüm örnekler 15 dk yavaşça alt üst ederek karıştırılmıştır. d. 14000 g ve 24°C’de 20 dk santrifüjlendirilip sonra üst faz yeni bir tüpe aktarılmıştır. e. 1000 µl kloroform izoamil alkol eklenerek birkaç kez alt üst ederek karıştırılmıştır. 14000 g ve 4°C’de 20 dk santrifüjlenip üst faz dikkatli bir şekilde yeni bir tüpe aktarılmıştır. f. Üst faza 2,5 µl RNaz ve 8 µl proteinaz K eklenmiş ve 45 dk 37°C’de bekletilmiştir. g. DNA’yı çöktürmek için her tüpe 100 µl amonyum asetat, 100 µl sodyum asetat (3M), 800 µl soğuk izopropanol eklenmiştir. h.14000 g ve 4°C’de 20 dk santrifüjlenip üst faz atılmıştır. i. Pelet önce %100’lük sonra %70’lik soğuk etanol ile yıkanmıştır. j. Yıkanan pelet 37°C’de 15 dk bekletilerek kurutulmuştur. k. Kurutulan DNA 100 µl TE tamponunda fingerprint yapılarak çözülmüştür. l. 24 saat +4°C’de dinlendirildikten sonra kullanılıncaya kadar -20°C’de saklanmıştır. Elde edilen DNA 250 kat (3 µl DNA+747 µl TE tamponu) seyreltilerek spektrofotometrede 260nm ve 280nm dalga boylarında absorbans (A) değerleri okunmuştur. OD (okuma değeri) 260/280 değeri 1,1-1,8 arasında olması DNA’nın saf olduğunu göstermektedir. 50 (DNA için multifikasyon katsayısı) x 250 (seyreltme 59 katsayısı) x OD260 (260nm’de okuma değeri) formülünden faydalanılarak stoktaki DNA miktarı hesaplanmıştır. Stok DNA’dan 50ng/µl DNA içeren çalışma solüsyonu hazırlanmıştır. 3.2.3. IRAP-REMAP 3.2.3.a. IRAP-REMAP primerleri Çalışmada 6 IRAP primeri (Metabion İnternational AG Lena-Christ-Strasse 44/I D82152 Martinsried, Deutschland) kullanılmıştır. Kullanılan primerlerin baz dizileri Çizelge 3.1’de verilmiştir. Ayrıca Çizelge 3.2’de verilen 6 IRAP ve 2 ISSR primeri kombinlenerek REMAP primerleri oluşturulmuştur. Çizelge 3.1. IRAP-PCR’da kullanılan primer dizileri, erime (Tm) ve bağlanma (Ta) sıcaklıkları No Primer adı Dizisi (5' 1 WLTR2105 3') Tm(°C) Ta(°C) ACTCCATAGATGGATCTTGGTGA 61,0 56,0 2 N-57(Nikita57) CGCATTTGTTCAAGCCTAAACC 60,0 55,0 3 Sukkula GATAGGGTCGCATCTTGGGCGTGAC 71,0 65,0 4 Nikita E2647 ACCCCTCTAGGCGACATCC 62,0 58,0 5 Stowaway CTTATATTTAGGAACGGAGGGAGT 62,0 58,0 6 Bare1(0) CTAGGGCATAATTCCAACA 53,0 52,0 *Ta sıcaklıkları Gradient PCR ile belirlenmiştir. 60 Çizelge 3.2. REMAP-PCR’da kullanılan primer dizileri, erime (Tm) ve bağlanma (Ta) sıcaklıkları No Primer adı Dizisi (5' 3') Tm(°C) Ta(°C) 1 WLTR2105 ACTCCATAGATGGATCTTGGTGA 61,0 56,0 2 N-57(Nikita57) CGCATTTGTTCAAGCCTAAACC 60,0 55,0 3 Sukkula GATAGGGTCGCATCTTGGGCGTGAC 71,0 65,0 4 Nikita E2647 ACCCCTCTAGGCGACATCC 62,0 58,0 5 Stowaway CTTATATTTAGGAACGGAGGGAGT 62,0 58,0 6 Bare1(0) CTAGGGCATAATTCCAACA 53,0 52,0 7 8081 GAGAGAGAGAGAGAGAGAC 57,0 54,0 8 8082 CTCTCTCTCTCTCTCTCTG 57,0 54,0 *Ta sıcaklıkları Gradient PCR ile belirlenmiştir. 3.2.3.b IRAP- REMAP PCR protokolü IRAP-PCR işlemi için gerekli olan bileşenler ve miktarları Çizelge 3.3’te verilmiştir. Çizelge 3.3. IRAP- REMAP PCR bileşenleri ve konsantrasyonları Bileşenin Adı Miktarı (µl) Steril distile su 10X PCR tamponu(MgCl2 içermeyen) 25 mM MgCl2 5 µM primer 10 mM dNTP 50 ng/µl Kalıp DNA 5 U/µl Taq-DNA polimeraz (Sigma, D6677) Toplam 13µl 2µl 2µl 1µl 0,5µl 1µl 0,3µl 20µl Son Konsantrasyonu 1X 2,5mM 0,25μM 0,25mM 50ng 1,5 U Çizelge 3.3’te verilen standart değerlere göre her bir örnekten izole edilen genomik DNA ve Çizelge 3.1’de ve Çizelge 3.2’de verilen IRAP ve REMAP primerleri ile her bir örnek için ayrı PCR tüpü hazırlanmıştır. 61 Bu işlemlerin ardından örnekler PCR otomatik termodöngü aletine (Corbatt Mastercycler Gradient Authorized Thermal Cycle) yerleştirilmiş ve aşağıdaki döngüye tabi tutulmuştur. 1) PCR aleti otomatik olarak 5 dk 95°C tutmuş, 2) 42 döngü olacak şekilde sırasıyla, a. 1 dk 94°C b. 1 dk bağlanma sıcaklığı (Değişken) c. 2 dk 72°C 3) 15 dk 72°C 4) Son olarak 10 dk 4°C tutulmuş, PCR aletinden çıkarılan örnekler +4°C’de saklanmıştır. 3.2.4. Agaroz jel elektroforezi PCR işleminden sonra örnekler agaroz jel elektroforezinde yürütülmüş ve oluşan bantlara göre primerlerin hibridize olup olmadığı tespit edilmeye çalışılmıştır. İşlem sırası aşağıdaki gibidir; a. Jel içerisinde agarozun konsantrasyonu %2,5 konsantrasyon olacak şekilde agaroz tartılıp 0,5X TBE tamponu içerisinde mikrodalga fırında hazırlanmıştır. b. Mikrodalga fırından çıkarılan 0,5X TBE + agaroz çözeltisi içerisine 0,75µg/ml olacak miktarda etidyum bromür eklenmiştir. c. Hazırlanan jel katılaşmadan elektroforez tankına dökülmüş ve donmadan önce jel üzerine tarak konularak örneklerin yükleneceği kuyucuklar oluşturulmuştur. d. Jel donduktan sonra her bir kuyucuğa ayrı bir örnek (4 µl bromfenol mavisi +8 µl PCR ürünü) yüklenmiştir. e. Elektrik akımı verilerek 80V-180 dk süre ile PCR ürünleri elektroforez işlemine tabi tutulmuştur. Süre sonunda elektrik akımı kesilmiştir. 62 f. Elektroforez tankından çıkarılan jel UV ışık altında incelenmiş ve değerlendirilmek üzere fotoğrafları çekilmiştir. 3.2.5. IRAP-REMAP analizleri ve genomik kararlılık sabitliğinin (%GTS) belirlenmesi Her bir primer için tüm örneklerde amplifiye olan DNA bantlarının varlığı ve yokluğu, negatif kontrol IRAP ve REMAP profillerine göre bant yoğunluklarındaki azalma ve artmalar temin edilmiş olan agaroz jel görüntüleme cihazı ile belirlenmiştir. Elde edilen jel görüntüleri TotalLab TL120 programı ile değerlendirilmiştir. Genomik kararlılık sabitliliği (%GTS) her bir primer ürünü için Erturk et al. (2014)’e göre 100-(100*a/n) formülünden yararlanılarak hesaplanmıştır. Formüldeki a her bir uygulama örneği için tespit edilen IRAP ve REMAP polimorfik profillerini, n ise ilgili primerle negatif kontrol grubunda elde edilen DNA toplam bandı sayısını göstermektedir. Uygulama gruplarına ait IRAP ve REMAP profillerinde gözlenen polimorfizm, negatif kontrol grubuna göre yeni bir bandın ortaya çıkması veya mevcut bir bandın kaybolmasını kapsamıştır. 63 4. ARAŞTIRMA BULGULARI 4.1. IRAP Analizleri ve Genomik Kararlılık Sabitliliği (Genomik Template Stability; %GTS) 2,4-D ve dikamba dozları Triticum aestivum cv. Kırik çeşidi üzerine uygulandıktan sonra genomdaki retrotranspozon polimorfizmini ortaya çıkarmak için 11 IRAP primeri denenmiş bunların içinden en iyi amplifikasyon veren 6 primer (WLTR2105, N-57 (Nikita57), Sukkula, Nikita E2647, Stowaway, BARE 1(0)) seçilerek değerlendirmeye alınmıştır. Polimorfizm oranı 2,4-D ve dikamba konsantrasyonlarının artan dozlarına bağlı olarak artış göstermiştir. Çizelge 4.1’de görüldüğü gibi 2,4-D uygulamasında en yüksek GTS oranı (%83,9) 250 ppm 2,4-D dozunda iken en düşük GTS oranı ise (%72,4) 1000 ppm 2,4-D dozunda olup doz artışına bağlı olarak GTS oranının düştüğü belirlenmiştir. Dikamba uygulamasında ise en yüksek GTS oranı (%71,4) 250 ppm dikamba dozunda iken en düşük GTS oranı ise (%63,2) 1000 ppm dikamba dozunda olup doz artışına bağlı olarak GTS oranının düştüğü belirlenmiştir. GTS oranı üzerine dozların temel etkileri karşılaştırıldığında; sentetik oksinlerin dozlarının artışına bağlı olarak GTS oranında bir azalış meydana geldiği görülmüştür. WLTR 2105 priminde 2,4-D konsantrasyonları arttıkça bant kayıplarının arttığı buna bağlı olarak GTS oranının azaldığı gözlenirken; dikamba konsantrasyonlarında GTS oranının %46,6 ve %40,0’lık oranlar arasında genel itibariyle korunduğu görülmektedir (Çizelge 4.2). N-57 (Nikita57) primerinde 2,4-D ve dikamba konsantrasyonlarında genel itibariyle GTS oranında %85,7’den %78,5’lik değere doğru bir düşüş meydana geldiği görülmektedir (Şekil 4.1). 64 Nikita E2647 primerinde 2,4-D ve dikamba konsantrasyonlarında GTS oranının genel olarak %92,3’lük bir değerle sabit kaldığı görülmektedir (Şekil 4.2). Sukkula primerinde herhangi bir bant oluşumu veya bant kaybı gözlenmemiştir. Buna bağlı olarak GTS ve polimorfizm oranında bir değişiklik söz konusu olmamıştır (Şekil 4.3). Stowaway primerinde 2,4-D konsantrasyonlarında artışa bağlı olarak hem polimorfik bantların oluştuğu hem de bant kayıplarının meydana geldiği görülmektedir. GTS değeri 2,4-D konsantrasyonları için %71,4’ten %42,8’e doğru bir azalış gösterirken, dikamba konsantrasyonlarında yeni bantların oluşmasına ve bazı bantların kaybolmasına bağlı olarak %57,1’den %14,2’ye kadar düştüğü görülmektedir. BARE 1(0) primerinde her iki sentetik oksin dozlarında bant kayıplarının meydana geldiği gözlenmiştir. GTS oranının %54,5’lik bir değerle genel itibariyle korunduğu söylenebilir. Çalışma primerleri dikkate alındığında en yüksek polimorfizm oranı Stowaway primerinde gözlenirken, en düşük polimorfizm oranı Sukkula primerinde gözlenmiştir. Çizelge 4.1. 2,4-D ve dikamba genomik kararlılık sabitliliği (%GTS) ve % polimorfizm (IRAP) 2,4 D Dikamba Retrotranspozon Primerleri (5'→3') 250 ppm 500 ppm 750 ppm 1000 ppm 250 ppm 500 ppm 750 ppm 1000 ppm WLTR2105 100 93,3 73,3 66,6 46,6 40,0 46,6 40,0 85,7 78,5 92,8 78,5 85,7 85,7 78,5 78,5 92,3 92,3 92,3 92,3 84,6 92,3 92,3 92,3 100 100 100 100 100 100 100 100 71,4 71,4 57,1 42,8 57,1 42,8 28,5 14,2 54,5 54,5 63,6 54,5 54,5 54,5 54,5 54,5 %GTS 83,9 81,6 79,8 72,4 71,4 69,2 66,7 63,2 %Polimorfizm 16,1 18,4 20,2 27,6 28,6 30,8 33,3 36,8 (ACTCCATAGATGGATCTTGGTGA) N-57 (Nikita57) (CGCATTTGTTCAAGCCTAAACC) Nikita E2647 (ACCCCTCTAGGCGACATCC) 65 Sukkula (GATAGGGTCGCATCTTGGGCGTGAC) Stowaway (CTTATATTTAGGAACGGAGGGAGT) BARE 1(0) (CTAGGGCATAATTCCAACA) Çizelge 4.2. 2,4-D ve dikambanın farklı konsantrasyonlarda hazırlanan çözeltilerinin buğday tohumlarının üzerine etkisiyle değişen bantların moleküler ağırlığı (IRAP) Retrotranspozon Primerleri (5'→3') WLTR2105 (ACTCCATAGATGGATCTTGGTGA) N-57 (Nikita57) (CGCATTTGTTCAAGCCTAAACC) Nikita E2647 Sukkula (GATAGGGTCGCATCTTGGGCGTGAC) Stowaway (CTTATATTTAGGAACGGAGGGAGT) BARE 1(0) (CTAGGGCATAATTCCAACA) 250 ppm + - 14 + - 13 + - 11 + - 750 ppm 250 ppm 500 ppm 750 ppm 1498;1117; 834;579;541; 467;355;312 1498;1117; 624;541;467; 355;312 1498;1348;1117; 695;541;467; 355;312 1000 ppm - - 1498;1348; 1117 1498;1117; 579;541 - 774 834 834 834 911 1278 1237 1618;1538 1618;1538 1917 1626;1563 1893;1551 1917;1570 3600;1917; 1538 3687;1827; 1538 - 1291 - 1291 - - - - - - - - 502 502 502 502 502;986 502 - - - - - - - - - - - - - - - - 15428 15428 1183;1191 13714;1183; 429 1183;425 13714;1165; 427 4715;1156; 427 14000;5192; 1156;422 14285 14285 14285 14285 14285 14285 14285;5530 14285;5530 1469;1135; 495;400 1469;1135; 495;400 1469;1135; 495 1469;1135; 495 1469;1135; 495 1469;1135; 495 1469;1135; 495 1469;1135; 495 297 297 400 400;297 400;297 400;297 7 11 1000 ppm 1498;1117; 579;541;427; 355;312 15 + - + - 500 ppm Dikamba - - - 502 400;297 502 400;297 66 (ACCCCTCTAGGCGACATCC) 2,4 D +/- Kontrol 67 4.2. IRAP Jel Görüntüleri Şekil 4.1. N-57 (Nikita57) primerine karşı oluşan amplifikasyon ürünleri * (M. Markır; 1.Kontrol; 2. 250 ppm 2,4-D; 3. 500 ppm 2,4-D; 4. 750 ppm 2,4-D; 5. 1000 ppm 2,4-D; 6. 250 ppm dikamba; 7. 500 ppm dikamba; 8. 750 ppm dikamba; 9. 1000 ppm dikamba) Şekil 4.2. Nikita E2647 primerine karşı oluşan amplifikasyon ürünleri *(M. Markır; 1.Kontrol; 2. 250 ppm 2,4-D; 3. 500 ppm 2,4-D; 4. 750 ppm 2,4-D; 5. 1000 ppm 2,4-D; 6. 250 ppm dikamba; 7. 500 ppm dikamba; 8. 750 ppm dikamba; 9. 1000 ppm dikamba) 68 Şekil 4.3. Sukkula primerine karşı oluşan amplifikasyon ürünleri * (M. Markır; 1.Kontrol; 2. 250 ppm 2,4-D; 3. 500 ppm 2,4-D; 4. 750 ppm 2,4-D; 5. 1000 ppm 2,4-D; 6. 250 ppm dikamba; 7. 500 ppm dikamba; 8. 750 ppm dikamba; 9. 1000 ppm dikamba) 4.3. REMAP Analizleri ve Genomik Kararlılık Sabitliliği (Genomik Template Stability; %GTS) REMAP tekniği için ise IRAP primerlerinden seçilen N-57 (Nikita57), Sukkula, Nikita E2647, Stowaway, BARE 1(0) primerleri ISSR’nin 8081 ve 8082 primerleriyle kombinlenerek 8 tane primer oluşturulmuş ve oluşan kombinasyonların amplifikasyonları dikkate alınarak değerlendirme yapılmıştır. Çizelge 4.3’de görüldüğü gibi 2,4-D ve dikambanın artan konsantrasyonlarının GTS değerinde azalışa sebep olduğu gözlenmiştir. Polimorfizm oranı 2,4-D ve dikamba konsantrasyonlarının artan dozlarına bağlı olarak artış göstermiştir. Çizelge 4.3’de görüldüğü gibi 2,4-D uygulamasında en yüksek GTS oranı (%93,1) 250 ppm 2,4-D dozunda iken en düşük GTS oranı ise (%79,1) 1000 ppm 2,4-D dozunda olup doz artışına bağlı olarak GTS oranının düştüğü belirlenmiştir. Dikamba uygulamasında ise en yüksek GTS oranı (%80,3) 250 ppm dikamba dozunda iken en düşük GTS oranı ise (%71,6) 1000 ppm dikamba dozunda olup doz artışına bağlı olarak GTS oranının düştüğü belirlenmiştir. 69 N-57 (Nikita57)+8081 primerinde 2,4-D konsantrasyonlarında GTS oranı %91,6’dan %83,3’e düşerken, dikamba konsantrasyonlarında %83,3’lük bir değerle GTS oranının korunduğu görülmektedir (Şekil 4.4). Sukkula+8081 primerinde GTS oranının %75,0’lık bir oranla tüm sentetik oksin dozları için korunduğu görülmektedir. Nikita E2647+8081 primerinde 2,4-D konsantrasyonlarında %100’den %80,0’a azalan GTS oranı dikamba konsantrasyonları boyunca %60,0’lık bir değerle kararlılığını sürdürmüştür. Stowaway+8081 primerinde bant kayıplarına bağlı olarak 2,4-D ve dikamba dozlarında GTS oranının %88,8’den %44,4’e kadar düştüğü görülmektedir. N-57 (Nikita57)+8082 primerinde 2,4-D dozlarında %100’den %75,0’a düşen GTS oranının dikamba dozlarında da aynı şekilde %100’den %75,0’a düştüğü görülmektedir (Şekil 4.5). Sukkula+8082 REMAP primerinde 2,4-D dozlarında %100’den %84,6’ya düşen GTS oranının dikamba dozlarında ise %100’den %76,9’a kadar düştüğü görülmektedir. Nikita E2647+8082 primerinde gözlenen bant kayıplarına bağlı olarak GTS oranının 2,4-D konsantrasyonlarında %100’den %77,7’ye düştüğü dikamba dozlarında ise %88,8 ve %77,7’lik değerler arasında iniş-çıkış yaptığı görülmektedir (Çizelge 4.4). Bare 1(0)+8082 primerinde 2,4-D konsantrasyonlarında %90,0’dan %80,0’a düşen GTS oranının, dikamba konsantrasyonlarında ise %80,0’dan %70,0’a düştüğü görülmektedir (Şekil 4.6). 70 Çalışma primerleri dikkate alındığında en yüksek polimorfizm oranı Stowaway+8081 primerinde gözlenirken, en düşük polimorfizm oranı Sukkula+8082 primerinde gözlenmiştir. Sonuç olarak REMAP tekniğinde, kullanılan sentetik oksin dozlarının hem DNA hasarına hem de retrotranspozon hareketliliğine sebep olduğu gözlenmiştir. Çizelge 4.3. 2,4-D ve dikamba genomik kararlılık sabitliliği (%GTS) ve % polimorfizm (REMAP) REMAP Primerleri (5'→3') N-57 (Nikita57) + 250 ppm 2,4 D 500 ppm 750 ppm 1000 ppm 250 ppm Dikamba 500 ppm 750 ppm 1000 ppm 83,3 83,3 83,3 83,3 83,3 83,3 83,3 Sukkula + 8081(GAGAGAGAGAGAGAGAGAC) 75,0 75,0 75,0 75,0 75,0 75,0 75,0 75,0 Nikita E2647 + 8081(GAGAGAGAGAGAGAGAGAC) 100 80,0 80,0 80,0 60,0 60,0 60,0 60,0 Stowaway + 8081(GAGAGAGAGAGAGAGAGAC) 88,8 77,7 77,7 77,7 66,6 66,6 66,6 44,4 100 100 75,0 75,0 100 75,0 75,0 75,0 100 100 84,6 84,6 100 100 92,3 76,9 Nikita E2647 + 8082(CTCTCTCTCTCTCTCTCTG) 100 77,7 88,8 77,7 77,7 88,8 77,7 88,8 Bare 1(0) + 8082(CTCTCTCTCTCTCTCTCTG) 90,0 90,0 80,0 80,0 80,0 80,0 80,0 70,0 %GTS 93,1 85,4 80,5 79,1 80,3 78,6 76,2 71,6 %Polimorfizm 6,9 14,6 19,5 20,9 19,7 21,4 23,8 28,4 N-57 (Nikita57) + 8082(CTCTCTCTCTCTCTCTCTG) Sukkula + 8082(CTCTCTCTCTCTCTCTCTG) 71 91,6 8081(GAGAGAGAGAGAGAGAGAC) Çizelge 4.4. 2,4-D ve dikambanın farklı konsantrasyonlarda hazırlanan çözeltilerinin buğday tohumlarının üzerine etkisiyle değişen bantların moleküler ağırlığı (REMAP) REMAP Primerleri (5'→3') + / Kontrol + - 12 Sukkula + 8081(GAGAGAGAGAGAGAGAGAC) + - 8 Nikita E2647 + + - 10 + - 9 + - 8 + - 13 8082(CTCTCTCTCTCTCTCTCTG) + - 9 Bare 1(0) + 8082(CTCTCTCTCTCTCTCTCTG) + - 10 8081(GAGAGAGAGAGAGAGAGAC) Stowaway + 8081(GAGAGAGAGAGAGAGAGAC) N-57 (Nikita57) + 8082(CTCTCTCTCTCTCTCTCTG) Sukkula + 8082(CTCTCTCTCTCTCTCTCTG) Nikita E2647 + 250 ppm 500 ppm 446 Dikamba 750 ppm 1000 ppm 250 ppm 500 ppm 750 ppm 1000 ppm 451;357 446;355 449;355 451;367 449;357 451;365 977;830 977;830 977;830 977;830 977;830 977;830 320 905;606; 428 318 905;804; 428 318 905;804; 428 975;695; 640 - 975;695; 640 2893;800 975;695; 640 2892;791 320 905;804; 428 225 975;695; 640 2893;790 873;761 977;830 977;830 - 905;804; 905;804 905;804 975 975;838 838;695 695;448 - - 3515;790 3515;786 - - - - 6946 7485 - - - 7485 - - 7749 7749 - - 723 7749;723 938;853 938 938;853 938;853 853 938;853 938 1495 1495 1485 1485 1485 1484 838 838 838 835 521 269;230 - - 1528 838 72 N-57 (Nikita 57) + 8081(GAGAGAGAGAGAGAGAGAC) 2,4 D 73 4.4. REMAP Jel Görüntüleri Şekil 4.4. N-57 (Nikita57)+8081 primerine karşı oluşan amplifikasyon ürünleri * (M. Markır; 1.Kontrol; 2. 250 ppm 2,4-D; 3. 500 ppm 2,4-D; 4. 750 ppm 2,4-D; 5. 1000 ppm 2,4-D; 6. 250 ppm dikamba; 7. 500 ppm dikamba; 8. 750 ppm dikamba; 9. 1000 ppm dikamba) Şekil 4.5. N-57 (Nikita57)+8082 primerine karşı oluşan amplifikasyon ürünleri * (M. Markır; 1.Kontrol; 2. 250 ppm 2,4-D; 3. 500 ppm 2,4-D; 4. 750 ppm 2,4-D; 5. 1000 ppm 2,4-D; 6. 250 ppm dikamba; 7. 500 ppm dikamba; 8. 750 ppm dikamba; 9. 1000 ppm dikamba) 74 Şekil 4.6. Bare 1(0)+8082 primerine karşı oluşan amplifikasyon ürünleri * (M. Markır; 1.Kontrol; 2. 250 ppm 2,4-D; 3. 500 ppm 2,4-D; 4. 750 ppm 2,4-D; 5. 1000 ppm 2,4-D; 6. 250 ppm dikamba; 7. 500 ppm dikamba; 8. 750 ppm dikamba; 9. 1000 ppm dikamba) 75 5. TARTIŞMA ve SONUÇ Sanayileşme amacıyla, doğal kaynakların ve çevrenin bilinçsizce kullanılması sebebiyle dünyada tarımsal üretim yapılan alanlar azalmaktadır. Bitkisel üretim ve bu üretime bağlı olarak gelişen hayvansal üretimin devamlığının sağlanabilmesi için bitkisel üretimde verimi azaltan bitki hastalıkları, zararlıları ve yabancı otlarının etkili bir şekilde kontrol edilmesi gerekmektedir. Bu etmenlerle mücadelede; kültürel önlemler alınmakta, fiziksel ve kimyasal mücadele imkânları uygulanmaktadır. Yapılan bu uygulamaların en önemlisi ve en çok başvurulanı hiç şüphesiz ki kimyasal olarak yapılan mücadeledir. Kimyasal mücadelede kullanılan pestisitler binlerce yıldır bilinmesine ve kullanılmasına rağmen günümüzde kullanılan birçok pestisit ürünü 2. Dünya Savaşı’ndan sonra kullanılmaya başlamıştır. Pestisitlerin önemli bir grubunu oluşturan herbisitler, zararlı bitki hücrelerinde genellikle fotosentezde görev yapan protein bileşiklerine bağlanarak fotosentezi inhibe eden ve yabani ot olarak isimlendirilen istenmeyen bitki türlerinin büyüme ve gelişmesini engelleyen toksik maddeler olarak tanımlanmaktadır (Yeşilbaş 2010). Sentetik oksin tabiatındaki herbisitlerden 2,4-D ve dikamba, geniş yapraklı otlar ve ağaçlarla beraber büyümesi istenilmeyen bitkilerin kontrol edilmesi veya öldürülmesi amacıyla kullanılmaktadır (Ateeq et al. 2005). Herbisitler, hedef olarak kullanıldıkları bitkiye zarar verdiklerinden dolayı bitki üzerinde beslenen ve barınan tüm organizmaları da olumsuz bir şekilde etkilemektedir. Bunan dolayı herbisitler, tüketilen pestisitler içerisinde tabiata en fazla zarar veren grup olarak nitelendirilmektedir. Herbisitlerin canlılar üzerinde toksik etki yaptığı bilinmektedir. Herbisitler yabancı otların yanı sıra çoğu zaman kültür bitkilerinde de geçici olarak büyüme ve gelişmeyi inhibe edebilmektedir. Bu yüzden belirli süre zarfında kültür bitkilerinde strese neden olabilmektedirler (Deme 2007). 76 Stres bir bitkinin büyüme, gelişme ve verimliliği üzerine negatif etkiye sahiptir. Çeşitli bölgelerde bitki türlerinin dağılımını kısıtlamakta ayrıca bitki popülasyonu üzerine güçlü bir evrimsel baskı uygulamaktadır (Boyko and Kovalchuk 2008).Abiyotik stres faktörleri bitkilerde moleküler, fizyolojik, biyokimyasal ve morfolojik değişmelerin karmaşık bir serisine yol açmaktadır (Wang et al. 2001). Bu yüzden herbisitlere, hastalıklara ve abiyotik stres gibi kompleks bir özelliğe karşı toleranslı bitki üretmek için, genetik modifikasyon uygulanmıştır (Wang et al. 2003). Yüksek dozlarda uygulanan herbisitler sonucu bitkiler strese maruz kalmaktadır. Strese giren bitkiler, elektron transport zincirinin aşırı indirgenmesi sonucu ROS’ları üretmeye başlarlar ki buda bitkinin oksidatif strese girmesine neden olur. Üretilen reaktif oksijen türleri hücre içerisinde bulunan membran lipitleri, fotosentetik pigmentler, proteinler ve nükleik asitlerin yapısını bozarak hücrede hasarlar meydana getirirler ve böylelikle hücre ölümüne neden olurlar (Ghorbanli et al. 2004). Bazı araştırıcılarda uygun olmayan çevresel koşullar altında bitkilerde ROS’ların üretiminin önemli ölçüde arttığını belirtmişlerdir (Mittler et al. 2004; Verma and Mishra 2005). Ayrıca ROS’ların artışının DNA’nın yapısında hasarlar meydana getirdiği belirlenmiştir (Balague et al. 2001; Duchnowicz and Koter 2003). 2,4-D’nin bitkilerde süperoksit radikalinde artışa neden olduğu (Romero-Puertas et al. 2004) ayrıca hayvan hücrelerinde oksidatif strese yol açtığı (Mi et al. 2007) bildirilmiştir. Bununla birlikte 2,4-D ve dikamba ile ilgili yapılan birçok çalışmada, bu sentetik oksinlerin DNA hasarına neden olduğu bildirilmiştir (Filkowski et al. 2003; Cenkci et al. 2010; Yildirim et al. 2014). González et al. (2009), tarafından yapılan bir çalışmada; saf dikamba ve ticari formu olan Banvel’in genotoksik ve sitogenetik etkileri araştırılmıştır. Uygulama yapılan CHO hücrelerinde hücre döngüsü süreci, SCE frekansı ve hücre canlılık analizleri yapılmıştır. Araştırma sonuçlarına göre, dikambanın ROS’ların oluşumunu arttırarak DNA hasarına sebep olduğu tespit edilmiştir. Allium cepa ve Oryza sativa bitkilerinde çeşitli genotoksik testler kullanılarak 2,4-D’nin mutajenik aktivitesi değerlendirilmiştir. Yapılan çalışma sonucunda 2,4-D’nin 77 genotoksik potansiyele sahip olduğu belirlenmiştir (Kumari and Vaidyanath 1989). 2,4D’nin, bitki doku kültürü ortamında yaygın olarak kullanılmasının yanı sıra yüksek konsantrasyonlarının; rejenaratif bitkilerin kromozomlarında yapısal ve sayısal değişikliklere neden olduğu ayrıca kromatid ve kromozom kırıklıklarını artırdığı tespit edilmiştir (Zeljezic and Garaj-Vrhovac 2004). Bitki doku kültüründe, 5 mg/l 2,4-D konsantrasyonundan daha yüksek konsantrasyonların bitkiye uygulanması sonucunda, kromozomal mutasyonlar ve kromozomal sapmaların meydana geldiği bildirilmiştir (Bayliss 1980). Butaklor ve 2,4-D herbisitlerinin Allium cepa üzerine etkisini araştıran bir çalışmada ise bu herbisitlerin mitotik indeksin azalmasına ve kromozomlarda anomalilere neden olduğu belirlenmiştir (Ateeq et al. 2002). González et al. (2006), tarafından insan lenfosit hücre kültürlerinde dikambanın çeşitli konsantrasyonlarının kullanılarak yapıldığı genotoksik çalışmada; dikambanın SCE frekansını önemli ölçüde arttığı, hücre döngüsü kinetiğini etkilediği ve hücre döngüsünün ilerlemesinde önemli bir gecikmeye sebep olduğu rapor edilmiştir. Literatürde yer alan çalışmalara bakıldığında, 2,4-D ve dikambanın önemli bir genotoksik potansiyele sahip olduğu görülmektedir. Çalışmamızdaki sentetik oksin uygulamasında; REMAP sonuçlarındaki polimorfizmin yüksek ve GTS’nin düşük olmasının sebebi DNA hasarının bir gösteresi olarak kabul edilmektedir ve bu hasara üretilmiş olan ROS’ların aktif hale geçerek sebep olduğu sonucuna varılmıştır. Çalışmada; Sukkula primerinin IRAP tekniğinde hareket etmediği ancak REMAP tekniğinde ISSR primeri ile kombinasyonunda polimorfizm gösterdiği tespit edilmiştir. Buda oluşan DNA hasarının ortaya çıktığını ve ayrıca REMAP’ın hem DNA hasarının hem de transpozon hareketlerinin belirlenmesinde kullanılabilecek bir teknik olduğunu göstermektedir. ROS üretiminin yanı sıra bitkilerde strese yanıtta; siRNA(Small Interfering RNA)’ları üreten bölgeler, heterokromatin, TEs (transpoze elementler) ve psödogenler ağır bir şekilde metillenmektedirler (Zhang et al. 2006). 78 Transpozon elementleri gibi tekrar dizilerindeki metilasyon, normal genom işleyişiyle araya giren bu dizileri önlemektedir (Chan et al. 2005). Genlerdeki metilsitozinlerin yoğunluğu; tekrar dizilerinden daha düşük olmasına rağmen Arabidopsis’in ifade edilen genlerinin üçte birinden fazlası onların transkribe edildiği bölgelerde özellikle CG (Guanin-Sitozin) bölgelerindeki metilasyonu içermektedir. İfade edilen genlerin yalnızca %5’i kendi promotör bölgelerindeki metilasyonu içermektedir (Zhang et al. 2006). Metillenen genler, promotör bölgelerinde dokuya özgü ifade gösterirken; transkribe edilen bölgelerdeki metilasyon gen ifadesini orta derecede baskılamaktadır (Zilberman et al. 2007). Bitki genomlarının önemli bir bölümünü oluşturan ve DNA metilasyonu ile inaktif durumda tutulan transpozon elementleri, DNA demetilasyon yoluyla çevresel faktörler tarafından aktive edilebilmektedir (Chinnusamy and Zhu 2009). 2,4-D gibi sentetik oksinler sitozin metilasyonunda önemli artışa neden olmaktadır (LoSchiavo et al. 1989). Metillenmiş sitozinler bitki genomunda düzensiz bir şekilde dağılırlar ve transpozonlar yüksek oranda metillenmiş bölgelerdir (Rabinowicz et al. 2005). Bitki doku kültüründe kullanılan hormon ve büyüme düzenleyicilerin metillenme düzeylerini etkilediği; 2,4-D gibi sentetik oksinlerin metillenmeyi arttırdığı tespit edilmiştir (LoSchiavo et al. 1989; Phillips et al. 1994). Metillenmedeki artışın kromozom kırıklarının bir sonucu olabileceği ön görülmüştür. Heterokromatin, neredeyse tüm bitki dokularında metillenmiş bir halde bulunmaktadır (Bennetzen et al. 1994). Metillenmedeki artışın DNA replikasyonunu geciktirebileceği ve bu durumun, kromozom kırıkları gibi anomalilere yol açabileceği düşünülmüştür (Phillips et al. 1994). Mısır ve yulaf doku kültürlerinde yapılan çalımalar neticesinde, kromozom kırıklarının çoğunlukla heterokromatinde meydana geldiği bildirilmiştir (Johnson et al. 1987). Buğday gibi tahıl bitkilerinde, heterokromatinin büyük bir kısmın retrotranspozonlardan oluşmaktadır (Bennetzen 2000). Sitozin metillenmelerinin, transpozon hareketleri ile doğrudan ilişkili oluşu (Chomet et al. 1987; Banks et al. 79 1988); doku kültüründe meydana gelen metillenmedeki azalmanın, transpozonların hareketlerini artırabileceği şeklinde yorumlanmıştır (Kaeppler et al. 2000). Retrotranspozonların; genom büyümesi, genomun transkripsiyonel, post transkripsiyonel ve epigenetik düzenlenmesi, meydana gelen rekombinasyon ile yeni genlerin ve gen ailelerinin oluşumuna neden olması gibi birçok rolü bulunmaktadır. Ökaryotik organizmalarda sentromerler, telomerler ve kromozomların diğer heterokromatik bölgeleri büyük oranda retrotranspozon taşımaktadır. Bu durum bitkilerin işlevsel ve yapısal rolleri için retrotranpozonların gerekli olduklarını göstermektedir (Pardue and Danilevskaya 1997). LTR retrotranspozonları, bitki genomunda en çok bulunan hareketli elementlerdir. Bitkilerde genomunun yaklaşık %15 ile %90’nını oluşturmaktadırlar (Sabot and Schulman 2006). Biyotik ve abiyotik stres faktörleri, bitki ve alglerde LTR retrotranspozonlarını uyarmada epigenetik reaktivatör olarak etki etmektedir (Mansour 2009; Alzohairy et al. 2013). Tütünde ve pirinçte protoplast ya da hücre kültüründen sonra kodlama dizilerinin içine retrotranspozonların yerleştidiği belirtilmiştir (Hirochika et al. 1996). Bu durum retrotranspozisyonun somaklonal varyasyona önemli bir katkı yapabileceğini göstermiştir. Tütün yaprağı dokusundan izole edilen protoplastlarda yüksek bir şekilde uyarılan Tnt1A’nın ifadesinin artması strese karşı bitki retrotranspozonunun aktivasyonunun ilk kanıtıdır (Pouteau et al. 1991). LTR retrotranspozonları, streslerin şiddetini ayırmak için farklı tepkiler verebilmektedirler (Sánchez-Luque et al. 2012). Bu durum, transpozisyon aktivitesinin seviyesindeki farklılıklarla (Jiang et al. 2011), genomun yeniden yapılanması ve çeşitliliğindeki farklılıklarla (Alzohairy et al. 2013) açıklanabilmektedir. Nitekim yapılan bu araştırma da sentetik oksin konsantrasyonlarının artışına bağlı olarak LTR retrotranspozonlarının aktivitesindeki artışa paralel olarak GTS oranlarında azalma görülmüştür. LTR retrotranspozonlarının; abiyotik ve biyotik streslere, bitkilerin 80 adaptasyonunu düzenleyen farklı sinyallere yanıt veren promotörleri bulunmaktadır. Özellikle retrotraspozonların uzun uç tekrar dizilerine (LTR) sahip olan çeşitlerinin (LTR retrotranspozonları) sekansları çevresel strese yanıt elementleri içermektedir (Niinemets and Valladares 2004). Bu transpozonlarda bulunan cis-düzenleyici elementlerin bitki stres yanıt genleriyle benzerlik gösterdiği ve aktivitelerinin bu nedenle arttığı bildirilmiş ayrıca LTR’ler ile benzer sekanslara sahip çok sayıda stres indükleyici gen promotörü belirlenmiştir (Dunn et al. 2006). Yine, bu hareketli elementlerin yer değiştirmeleri sonucunda genomda meydana gelen değişime bağlı olarak organizmanın strese olan tepkisinde yararlı etkiler sağlayabileceği bildirilmiştir (Capy et al. 2000). Nitekim, Woodrow et al. (2010), makarnalık buğdayda tuz stresinde Ttd1a retrotranspozonunun direnç geninin yakınına yeni bir insersiyon gerçekleştirdiğini ve bunun sonucu olarak Ttd1a retrotranspozon hareketinin çevresel streslere karşı savunma yanıtında önemli bir rol oynadığını bildirmişlerdir. Bu araştırmamızda çalışmış olduğumuz Stowaway, WLTR2105, BARE 1(0) hareketlerinin daha yüksek olmasının sebebini destekler niteliktedir. Bayram et al. (2012), 3 mg/L 2,4-D bulunan MS (Murashige ve Skoog) besiyerinde yaptıkları arpa doku kültürü çalışmasında, IRAP moleküler markırı ile Nikita retrotranspozonunun hareketini incelemiş ve Nikita retrotranspozonunun doku kültürü şartları altında hareket ettiğini bildirmişlerdir. Yilmaz et al. (2014), içerisinde 4 mg/L dikamba bulunan MS besiyerinde yetiştirdikleri olgun arpa embriyolarında, IRAP moleküler markır tekniği ile BAGY2 retrotranspozonunun hareketini incelemek için yaptıkları çalışma sonucunda; 45 ve 90 günlük arpa kalluslarında, kontrol grupları ile uygulama yapılan kültürler arasında polimorfik bantların bulunduğunu ve BAGY2 retrotranspozonunun hareket ettiğini gözlemişlerdir. Kartal-Alacam et al. (2014), içerisinde 3 mg/L dikamba bulunan MS besiyeri ortamında kültüre ettikleri olgun arpa embriyolarında, IRAP ve iPBS moleküler markır tekniklerini kullanarak Sukkula retrotranspozonunun hareketlerini incelemiş, çalışma sonucunda Sukkula retrotranspozonunun hareket ederek polimorfik bantlar oluşturduğunu bildirmişlerdir. Yaptığımız çalışmada uygulanan sentetik oksin konsantrasyonuna bağlı olarak retrotranspozon hareketinin arttığı ve buna bağlı olarak GTS oranının azaldığı 81 gözlenmiştir. Yapılan arpa doku kültürü çalışmaları, elde ettiğimiz bulguları destekler niteliktedir. Araştırmamızda sentetik oksin uygulamasına bağlı olarak meydana gelen retrotranspozon hareketlerinin oluşan stres sonucunda uyarılan sinyal moleküllerinden kaynaklanabileceği düşünülmektedir. Nitekim Salazar et al. (2007), TLC1.1 retrotranspozonunun stresle ilgili çeşitli sinyal molekülleri (SA, ABA, JA, H2O2 ve sentetik oksin 2,4-D) tarafından aktive edildiğini bildirmişlerdir. Yine, aktif retrotranspozonların karakterlerinden biri olarak promotörlerinde bulunan cis-düzenleyici elementlerin (5' LTR’nin U3 bölgesi), bitki savunmasında görevli olan sinyal yayılım yoluyla olan ilişkisi gösterilmiştir. Örneğin, BARE-1 retrotranspozonu, 5' LTR bölgesinde ABA (Absisik Asit)’ya duyarlı cis-düzenleyici elementlerden biri olan ABRE elementlerini içermektedir (Salazar et al. 2007). Ancak çalışmamızda, Nikita E2647 ve Sukkula retrotranspozonlarının polimorfizminin az olduğu gözlenmiştir. Bu durum, strese bağlı olarak retrotranspozon hareketliliğini önlemek için genel olarak DNA hipermetilasyonu ile açıklanabilmektedir. Temel and Gozukirmizi (2013), yaptıkları çalışmada dikambanın epigenetik mekanizmaları etkileyerek DNA metilasyonuna sebep olduğunu belirlemişlerdir. Fraga et al. (2012) yaptıkları çalışmada kombine oluşturularak Acca sellowiana bitkisine uygulanan 2,4-D ve AzaC maddelerinin DNA metilasyon seviyelerinde önemli bir artışa sebep olduklarını göstermişlerdir. Yildirim et al. (2014), yaptıkları çalışmada Phaseolus vulgaris bitkisinde dikambanın DNA hipermetilasyonuna sebep olduğunu belirlemişlerdir. Çoğu bitkide mevcut olan LTR’ler transkripsiyonda görev alan LTR sekansındaki yüksek değişim oranı ile tarif edilmektedir. Biyotik ve abiyotik strese yanıtta bitkilerdeki LTR retrotranspozonlarının çoğu, daha büyük transkript havuzları oluşturmaktadır. Kısa süre önce, aktif LTR elementlerinin epigenetik aktivitedeki bitişik genlerin ifadesini değiştirdiği ayrıca genomu yapısal ve niteliksel olarak farklı bir 82 şekilde yapılandırarak mutasyonlara neden olduğu gözlenmiştir. Dolayısıyla IRAP ve REMAP sonuçlarındaki polimorfizmin yüksek oluşu, LTR retrotranspozonlarının hareketini arttığının, hareketin strese karşı bitkiyi koruma amaçlı olsa bile mutasyona sebep olarak GTS oranını düşürdüğünün bir göstergesidir. Bundan dolayı LTR retrotranspozlarının aktivitesi bitkilerin çeşitlenmesi ve evrimsel süreci açısından hayati öneme sahiptir. 5.1. Sonuç ve Öneriler Bu çalışma sonucunda normalde inaktif halde bulunan retrotranspozonların sentetik oksin uygulaması sonucunda oluşan stres altında aktif hale gelmesiyle, retrotranspozon hareketinin arttığı ve DNA hasarının meydana geldiği gözlenmiştir. Araştırmada retrotranspozon kaynaklı polimorfizmi belirlemede IRAP ve REMAP tekniklerinin başarılı bir şekilde kullanılabileceği belirlenmiştir. Ayrıca REMAP tekniğinin hem DNA hasarını hem de retrotranspozon hareketini tespit ettiği için genetik toksikolojide kullanılabileceği sonucuna varılmıştır. Fakat çalışılan retrotranspozon elementlerinin hareket etme nedeninin moleküler mekanizmasının açıklanabilmesi için ilave çalışmalara ihtiyaç vardır. 83 KAYNAKLAR Ahrens, W.H., 1994. Herbicide handbook. Weed Society of America, Champaign IL, 91-94. Akbulut, G.B., 2008. Atrazin ve Asetoklor Herbisitlerinin Zea mays L. (Mısır) ve Pisum sativum L. (Bezelye) bitkilerinde Biyokimyasal ve Fizyolojik Parametreler Üzerine Etkileri. Doktora Tezi, İnönü Üniversitesi, Fen Bilimleri Enstitüsü, Malatya. Akhunov, E.D., Akhunova, A.R. and Dvorak, J., 2007. Mechanisms and rates of birth and death of dispersed duplicated genes during the evolution of a multigene family in diploid and tetraploid wheats. Mol Biol Evol, 24, 539-550. Aksoy, A., 2009. Buğday Ekim Alanlarında Kullanılan Bazı Herbisitlerin Buğday Sonrası Ekilen Kültür Bitkilerine Yan Etkilerinin Araştırılması. Doktora Tezi, Çukurova Üniversitesi, Fen Bilimleri Enstitüsü, Adana. Aldrich, R.J. and Kremer, R.J., 1997. Principles İn Weed Management 2nd ed, Iowa State University, Ames / Iowa, 455. Al-Najjar, N. R. and Soliman, A. S., 1982. Cytological effects of herbicides I. Effect of 2,4-D and 2, 4, 5-T on meiotic cells of wheat and two related species. Cytologia, 47, 53-61. Alpöz, A.R., Tosun, N., Eronat, C., Delen, N. and Sen, B.H., 2001. Effects of 2,4 dichlorophenoxy acetic acid dimethyl amine salt o dental hand tissue formation in rats. Environmental International, 27, 137-142. Alzohairy, A.M., Gyulai, G., Jansen, R.K. and Bahieldin, A., 2013. Transposable elements domesticated and neofunctionalized by eukaryotic genomes. Plasmid, 69(1), 1-15. Ateeq, B., Farah, M.A. and Ahmad, W., 2005. Detection of DNA damage by alkaline single cell gel electrophoresis in 2,4-dichlorophenoxiacetic acid and butachlor exposed erythrocytes of Clarias batrachus. Ecotoxicology and Environmental Safety, 62, 348-354. Ateeq, B., Farah, M.A., Ali, M.N. and Ahmad, W., 2002. Clastogenicity of pentachlorophenol, 2,4-D and butachlor evaluated by Allium root tip test. Mutation Research, 514, 105-113. Aydın, H.,2001. Tarım Alanlarında Kullanılan Herbisit Grubu İlaçların Kalıntılarının Toprakta Ve Oligochaeta Sınıfı Toprak Solucanlarında Araştırılması. Doktora Tezi, İstanbul Üniversitesi, Sağlık Bilimleri Enstitüsü, İstanbul. Aydın, M., Sağsöz, S., Haliloğlu, K. ve Tosun, M., 2011. Buğdayda olgun embriyo kültürünü etkileyen faktörler. Atatürk Üniv Ziraat Fak Derg, 42(1), 1-10. Babaoğlu, M., Gürel, M. ve Özcan, S., 2004. Bitki Biyoteknolojisi, I. Doku Kültürü ve Uygulamaları. S.Ü. Vakfı Yayınları, 374 p, Konya, Türkiye. Babayiğit, M.A., Tekbaş, Ö.F. ve Çetin, H., 2014. Zararlılarla mücadelede kullanılan pestisitlerin halk sağlığına etkileri ve korumaya yönelik önlemler. TAF Preventive Medicine Bulletin, 13(5), 405-412. Balague, C., Stürtz, N., Duffard, R. and Evangelista de Duffard, A.M., 2001. Effect of 2,4 dichlorophenoxyacetic acid herbicide on Escherichia coli growth, chemical composition and cellular envelope. Environ Toxicol, 16, 43-53. 84 Banks, J.A., Masson, P. and Federoff, N., 1988. Molecular mechanisms in the developmental regulation of the maize Suppressormutator transposable element. Genes and Dev, 2, 1364-1380. Başaran, M.S. ve Serim A.T., 2010. Herbisitlerin toprakta parçalanması. Selçuk Tarım ve Gıda Bilimleri Dergisi, 24 (2), 54-61. Baulcombe, D., 2004. RNA silencing in plants. Nature, 431, 356-363. Bayliss, M.W., 1980. Chromosomal variation in plant tissue culture. Int Rev Cytol Suppl, 11A. Bayram, E., Yilmaz, S., Hamad-Mecbur, H., Kartal, G. and Gozukirmizi, N., 2012. Nikita retrotransposon movements in barley (Hordeum vulgare L.) callus culture. Plant Omics, 5, 211-215. Benbrook, C.N., 2005. Rust, resistance, run down soils, and rising cost-problems facing soybean producers in Argentina. Technical Reports, 8. Bengisu, A., 1994. 2,4-D’nin İnsan Kromozomları Üzerine İnvitro Etkisi. Y. Lisans Tezi, Dicle Üniversitesi, Fen Bilimleri Enstitüsü, Diyarbakır. Bennetzen, J.L., 1996. The contributions of retroelements to plant genome organization, function and evolution. Trends Microbiology, 4, 347-353. Bennetzen, J.L., 2000. Transposable elements contributions to plant gene and genom evolution. Plant Molecular Biology, 42(1), 251-269. Bennetzen, J.L., Schrick, K., Springer, P.S., Brown, W.E. and San-Miguel, P., 1994. Active maize genes are unmodified and flanked by diverse classes of modified, highly repetitive DNA. Genome, 37, 565-576. Bergman, C.M. and Quesneville, H., 2007. Discovering and detecting transposable elements in genome sequences. Briefing in Bioinformatics, 8(6), 382-392. Bourchis, D. and Bestor, T.H., 2004. Meiotic catastrophe and retrotransposon reactivation in male germ cells lacking Dnmt3L. Nature, 431, 96-99. Bowey, R.W. and Young, A.L., 1980. Science of 2,4,5-T and associated phenoxy herbicides. New York, Chinester, Barbistone Toronto, John Willey, Sons, 462. Boyko, A. and Kovalchuk, I., 2008. Epigenetic control of plant stress response. Environ Mol Mutagen, 49, 61-72. Bozdağ, A., 2009. 2,4-D ve Dikamba Herbisitlerinin Fasulye (Phaseolus vulgaris L.) Köklerindeki Genotoksik Etkilerinin RAPD ve Comet Assaylerle Belirlenmesi. Y. Lisans Tezi, Afyon Kocatepe Üniversitesi, Fen Bilimleri Enstitüsü, Afyon. Bradberry, S. M., Proudfoot, A. T. and Vale, J.A., 2004. Poisoning due to chlorophenoxy herbicides. Toxicol Rev, 23(2), 65-73. Bradberry, S.M., Watt, B.E., Proudfoot, A.T. and Vale, J.A., 2000. Mechanisms of toxicity, clinical features and management of acute chlorophenoxy herbicide poisoning: A review. Clinical Toxicology, 38(2),111-122. Bristol, D.W., Cook, L.W., Koterba, M.T. and Nelson, D.C., 1982. Determination of free and hydrolyzable residues of 2,4-D and 2,4-Dichlorophenol in potatoes. J Agric Food Chemb, 30, 137-144. Bronstein, A.C., Spyker, D.A., Cantilena, L.R., Rumack, B.H. and Dart, R.C., 2011. Annual report of the american association of poison control centers. National th Poison Data System (NPDS): 29 Annual Report. Clinical Toxicology, 50, 9111164. Bruce, T.J.A., Matthes, M.C., Napier, J.A. and Pickett, J.A., 2007. Stressful ‘memories’ of plants: Evidence and possible mechanisms. Plant Science, 173, 603-608. 85 Bureao, T.E. and Wessler S.R., 1994. Mobile inverted-repeat elements of the Tourist familya are associated with the genes of many cereal grasses. Proc Natl Acad Sci USA, 91, 1411-1415. Burgaz, S., 1982. Türkiye’de Kullanılan Dipidril Grubu ve Klorlu Fenoksiasetik Asit Grubu Herbisitlerin Analitik Toksikoloji Açısından İncelenmesi. Doktora Tezi, Ankara Üniversitesi Eczacılık Fakültesi, Farmasötik Toksikoloji Anabilim Dalı, Ankara. Bükün, B., 2012. Enerji bitkilerinde yabancı ot sorunları ve neden oldukları kayıplar. Tarım Makinaları Bilimi Dergisi, 8(3), 279-285. Capy, P., Gasperià, G., Bieâmont, C. and Bazin, C., 2000. Stress and transposable elements:co-evolution or useful parasites ?. Heredity, 85, 101-106. Carvalho, A., Guedes-Pinto, H. and Lima-Brito, J.E., 2011. Genetic diversity in old Portuguese durum wheat cultivars assessed by retrotransposon-based markers. Plant Mol Biol Rep, 30, 578-589. Caux, P.Y., Kent, R.A., Tache, M., Grande, C., Fan, G.T. and MacDonald, D.D., 1993. Environmental fate and effects of dicamba: a Canadian perspective. Rev Environ Contam Toxicol, 133, 1-58. Cenkci, S., Yıldız, M., Ciğerci, I.H., Bozdağ, A., Terzi, H. and Arıkan Terzi, E.V., 2010. Evaluation of 2,4-D and dicamba genotoxicity in bean seedlings using comet and RAPD assays. Ecotoxicology and Environmental Safety, 73,15581564. Cenkci, S., Yıldız, M., Ciğerci, I.H., Konuk, M. and Bozdağ, A., 2009. Toxic chemicals-induced genotoxicity detected by random amplified polymorphic DNA (RAPD) in bean (Phaseolus vulgaris L.) seedlings. Chemosphere, 76, 900906. Chan, S.W., Henderson, I.R., and Jacobsen, S.E., 2005. Gardening the genome: DNA methylation in Arabidopsis thaliana. Nat Rev Genet 6, 351-360. Chen, Y., Cunningham, F., Rios, D., M McLaren, W., Smith, J., Pritchard, B., Spudich, G.M., Brent, S., Kulesha, E., Marin-Garcia, P., Smedley, D., Birney, E. and Flicek, P., 2010. Ensembl variation resources. BMC Genomics, 11, 293. Chinnusamy, V. and Zhu, J.K., 2009. Epigenetic regulation of stress responses in plants. Curr Opin Plant Biol, 12, 133-139. Chomet, P.S., Wessler, W. and Dellaporta, S.L., 1987. Inactivation of the maize transposable element Activator (Ac) associated with DNA modification. EMBO J, 6, 295-302. Chopra, S., Brendel, V., Zhang, J., Axtell, J.D. and Peterson, T., 1999. Molecular characterization of a mutable pigmentation phenotype and isolation of the first active transposable element from Sorghum bicolor. Proc Natl Acad Sci USA, 96, 15330-15335. Çabuk, B., 2010. Mısırda (Zea mays L.) Farklı 2,4-D Dozlarının Kallus Oluşumu Ve Kromozomal Yapıya Etkisi. Doktora Tezi, Ankara Üniversitesi, Biyoteknoloji Enstitüsü, Ankara. Çiçek, N., 2005. Toprağa Adsorbe Haldeki Karbamatlı Pestisitlerin Güneş Işığı Etkisi Altında Bozunma Süreçlerinin İncelenmesi. Y. Lisans Tezi, Çukurova Üniversitesi, Fen Bilimleri Enstitüsü, Adana. 86 De Moliner, K.L., Evangelista De Duffard, A.M., Soto, E., Duffard, R. and Adamo, A.M., 2002. Induction of apoptosis in cerebellar granule cells by 2,4dichlorophenoxyacetic acid. Neurochem Res, 27, 1439. Delen, N., Durmuşoğlu, E., Güncan, A., Güngör, N., Turgut, C. ve Burçak, A., 2005. Türkiye’de pestisit kullanımı, kalıntı ve organizmalarda duyarlılık azalışı sorunları. Türkiye Ziraat Mühendisliği 6. Teknik Kongresi. 3-7 Ocak 2005, Ankara, 629-648. Deme, M., 2007. Tuz, Herbisit Ve Bazı Yabancı Otların Pamuk ve Buğday Bitkilerinde Klorofil ve Bazı Enzim Aktiviteleri Üzerine Etkileri. Y. Lisans Tezi, Harran Üniversitesi, Fen Bilimleri Enstitüsü, Şanlıurfa. Doğan, E., 2010. Makarnalık Buğdayda (Triticum durum Desf.) Farklı 2,4-D ve Pikloram Dozlarının Kallus Oluşumuna ve Kromozom Yapısına Etkisi. Y. Lisans Tezi, Ankara Üniversitesi, Biyoteknoloji Enstitüsü, Ankara. Duchnowicz, P. and Koter, M., 2003. Damage to the erythrocyte membrane caused by chlorophenoxyacetic herbicides. Cell Mol Biol Lett, 8, 25-30. Duffard, A.M.E., Peretti, A.F., Cantarini, S.C. and Duffard, R., 1993. Effects of 2,4dichlorophenoxyacetic acid butyl ester on chick liver. Archives of Environmental Contamination and Toxicology, 25, 204-211. Dunn, C.A., Romanish, M.T., Gutierrez, L.E., Lagemaat, L.N. and Mager, D.L., 2006. Transcription of two human genes from a bidirectional endogenous retrovirus promoter. Gene, 366(2), 335-342. Ecevit, O., Mennan, H., Aksoy, H.M. ve Akça, İ., 1999. Tarımsal mücadele ilaçları ve çevreye olan etkileri. O.M.Ü. Ziraat Fakültesi Ders Kitabı, No:32, Samsun. Enan, M.R., 2009. Genotoxicity of the herbicide 2,4-Dichlorophenoxyacetic acid (2,4D): higher plants as monitoring systems. Journal of Forest and Environmental Science, 25(3), 147-155. Erik, E.Z.,2007. Tifensülfüron-Metil Herbisitinin Diferansiyel Puls Polarografisiyle Tayini. Y. Lisans Tezi, Gazi Üniversitesi, Fen Bilimleri Enstitüsü, Ankara. Erturk, F.A., Agar, G., Arslan, E., Nardemir, G., Aydin, M. and Taspinar, M.S., 2014. Effects of lead sulfate on genetic and epigenetic changes and endogenous hormone levels in corn (Zea mays L.). Pol J Environ Stud, 23, 1925-1932. Espandiari, P., Thomas, V.A., Glauert, H.P., O’Brien, M., Noonan, D. and Robertson, L.W., 1995. The herbicide dicamba (2-methoxy-3,6-dichlorobenzoic acid) is a peroxisome proliferator in rats. Fundamental and Applied Toxicology, 26, 8590. Everitt, J.D. and Keeling, J. W., 2009. Cotton growth and yield response to simulated 2,4-D and dicamba drift. Weed Technology, 23(4), 503-506. Evrensel, C., 2011. Arpa (Hordeum vulgare L.) Doku Kültürlerinde Nikita Retrotranspozonunun Hareketleri. Y. Lisans Tezi, İstanbul Üniversitesi, Fen Fakültesi, İstanbul. Evrensel, C., Yılmaz, S., Temel, A. and Gozukirmizi, N., 2011. Variations in BARE-1 insertion patterns in barley callus cultures. Department of Molecular Biology and Genetics Faculty of Science, 10 (2), 980-987. Fairchild, J.F., Ruessler, D.S., Haverland, P.S. and Carlson, A.R., 1997. Comparative sensitivity of Selenastrum capricornutum and Lemna minor to sixteen herbicides. Archives of Environmental Contamination and Toxicology, 32, 353357. 87 Feng, S., Jacobsen, S.E. and Reik, W., 2010. Epigenetic reprogramming in plant and animal development. Science, 330, 622-627. Feschotte, C. and Pritham, E.J., 2007. DNA transposons and the evolution of eukaryotic genomes. Annual Review of Genetics, 41, 331-368. Feschotte, C., 2008. Transposable elements and the evolution of regulatory networks. Nat Rev Genet, 9, 397-405. Feschotte, C., Jiang, N. and Wessler, S.R., 2002. Plant transposable elements: where genetics meets genomics. Nat Genet, 3, 329-341. Filkowski, J., Besplug, J., Burke, P., Kovalchuk, I. and Kovalchuk, O., 2003.Genotoxicity of 2,4-D and dicamba revealed by transgenic Arabidopsis thaliana plants harboring recombination and point mutation markers. Mutat Res, 542, 23-32. Flanagan, R.J., Meredith, T.J. and Ruprah, M., 1990. Alkaline diuresis for acute poisoning with chlorophenoxy herbicidesand ioxynil. Lancet, 335, 454-8. Flavell, A.J., Knox, M.R., Pearce, S.R., Ellis, T.H.N., 1998. Retrotransposon-based insertion polymorphisms (RBIP) for high through put marker analysis. Plant J, 16, 643-650. Fonseca, M.B., Glusczak, L., Moraes, B.S., Menezes, C.C., Pretto, A., Tierno, M.A., Zanella, R., Gonçalves, F.F. and Loro, V.L., 2008. The 2,4-D herbicide effects on acetylcholinesterase activity and metabolic parameters of piava freshwater fish (Leporinus obtusidens). Ecotoxicology and Environmental Safety, 69, 416420. Fraga H.P. F., Vieira, L.N., Caprestano, C.A., Steinmacher, D.A., Micke, G.A., Spudeit, D.A., Pescador, R. and Guerra M.P., 2012. 5-Azacytidine combined with 2,4-D improves somatic embryogenesis of Acca sellowiana (O. Berg) Burret by means of changes in global DNA methylation levels. Plant Cell Rep, 31, 2165-2176. Ftiesen, E.G., Jones, G.R. and Vaughan, D., 1990. Clinical presentation and management of acute 2,4-D oral ingestion. Drug safety: An International Journal of Medical Toxicology and Drug Experience, 5 (2), 55-90. Gailite, A. and Rungis, D., 2012. An initial investigation of the taxonomic status of Saussurea esthonica Baer ex Rupr. utilising DNA markers and sequencing. Plant Syst Evol, 298, 913-919. Garabrant, D.H. and Philbert, M.A., 2002. Review of 2,4- dichlorophenoxyacetic acid (2,4-D) epidemiology and toxicology. Crit Rev Toxicol, 32(4), 233-57. George, E.F., 2008. Plant growth regulators, I. Introduction; auxins, their analogues and inhibitors, Plant Propagation by Tissue Culture 3rd ed, Ed: E.F. George, M.A. Hall, Geert-Jan De Klerk. The Netherlands, 175-204. Ghorbanli, M., Ebrahimzadeh, H. and Sharifi, M., 2004. Effects of NaCl and mycorrizal fungi on antioxidative enzymes in soybean. Biologia Plantarum, 48, 575-581. Giray Kurt, A., 2007. Callisto Herbisitinin Zea mays L. (Mısır)’ın Martha F1 Kültür Formunda Total Glutatyon, Glutatyon Redüktaz, Glutatyon-S-Transferaz ve Pigment İçeriği Üzerine Etkileri. Y. Lisans Tezi, İnönü Üniversitesi, Fen Bilimleri Enstitüsü, Malatya. Goldberg, A.D., Allis, C.D. and Bernstein, E., 2007. Epigenetics: A landscape takes shape. Cell 128, 635-638. Gong, H., Zhu, X., Chen, K., Wang, S. and Zhang, C., 2005. Silicon alleviates oxidative damage of wheat plants in pots under drought. Plant Science, 169, 313-321. 88 González, N.V., Soloneski, S. and Larramendy, M.L., 2006. Genotoxicity analysis of the phenoxy herbicide dicamba in mammalian cells invitro. Toxicol In Vitro 20,1481-1487. González, N.V., Soloneski, S. and Larramendy, M.L., 2009. Dicamba-induced genotoxicity in Chinese hamster ovary (CHO) cells is prevented by vitamin E. Journal of Hazardous Materials, 163, 337-343. Grandbastien, M.A., 1998. Activation of plant retrotransposons under stress conditions, Trends Plant Science and Review, 3, 181-187. Grandbastien, M.A., Audeon, C.E., Bonnivard, J.M., Casacuberta, B., Chalhoub, A.P. and Costa, A.P.P., 2005. Stress activation and genomic impact of Tnt1 retrotransposons in Solanaceae. Cytogenetic and Genome Research, 110(1-4), 229-241. Grasser, K.D., Launholt, D. and Grasser, M., 2007. High mobility group proteins of the plant HMGB family: dynamic chromatin modulators. Biochimica et Biophysica Acta, 1769, 346-357. Grzebelus, D., 2006. Transposon insertion polymorphism as a new source of molecular markers. Journal of Fruit and Ornamental Plant Research, 14(1), 21-29. Güler, Ç. ve Çobanoğlu, Z., 1997. Pestisitler. Çevre Sağlığı Temel Kaynak Dizisi No:52. T.C. Sağlık Bakanlığı Temel Sağlık Hizmetleri Genel Müdürlüğü, Ankara. Güncan, A., 1985. Yabancı otlar ve mücadelesi ders notları. Yüzüncü Yıl Üniversitesi Ziraat Fakültesi, Bitki Koruma Bölümü, Van. Güngör, B., 2007, 2,4-diklorofenoksiasetik Asitin (2,4-D) İmmobilize Pseudomonas Putida ile Biyokimyasal Yıkımının İncelenmesi. Y. Lisans Tezi, Ege Üniversitesi, Fen Bilimleri Enstitüsü, İzmir. Hansoy, Z., 2010. Bir Herbisit Olan 2,4-D (2,4-diklorofenoksiasetik asit)’nin Poecilia reticulata (Teleostei, Poeciliidae)’da Testis Dokusu Üzerine Etkisi. Y. Lisans Tezi, Ege Üniversitesi, Fen Bilimleri Enstitüsü, İzmir. Hess, F.D., 1993. Herbicide effects on plant structure, physiology and biochemistry, in: pesticide interactions in crop production: beneficial and deleterious effects. Boca Raton: CRC Press, 198-207 p, Florida. Hirochika, H., 1993. Activation of tobacco retrotransposons during tissue culture. The EMBO Journal, 12, 2521-2528. Hirochika, H., Sugimoto, K., Otsuki, Y., Tsugawa, H. and Kanda, M., 1996. Retrotransposons of rice involved in mutations induced by tissue culture. Proc Natl Acad Sci USA, 93, 7783-7788. Holt, J.S., Powles, S.B. and Holtum, J.A.M., 1993. Mechanisms and agronomic aspects of herbicide resistance. Annu Rev Plant Physiol Plant Mol Biol, 44, 203-229. Hrelia, P., Vigagni, F., MaVei, F., Morotti, M., Colacci, A., Perocco, P., Grilli, S. and Cantelli-Forti, G., 1994. Genetic safety evaluation of pesticides in diVerent short-term tests. Mutation Research, 321, 219-228. Huang, J., Zhang, K., Shen, Y., Huang, Z., Li, M., Tang, D., Gu, M. and Cheng, Z., 2009. Identification of a high frequency transposon induced by tissue culture, ndaiz, a member of the hat family in rice. Genomics, 93, 274-281. Issa, G. ve Çiftçioğlu G., 2006. Çevre ve gıdalardaki pestisit kalıntıları. İstanbul Üniv Vet Fak Derg, 32(3), 81-90. 89 Jerzmanowski, A., 2007. SWI/SNF chromatin remodeling and linker histones in plants. Biochimica et Biophysica Acta, 1769, 330-345. Jiang, B., Lou, Q., Wu, Z., Zhang, W., Wang, D., Mbira, K.G., Weng, Y. and Chen, J., 2011. Retrotransposon and microsatellite sequence-associated genomic changes in early generations of a newly synthesized allotetraploid Cucumis hytivus Chen and Kirkbride. Plant Molecular Biology, 77(3), 225-233. Johnson, S.S., Phillips, R.L. and Rines, H.W., 1987. Possible role of heterochromatin in chromosome breakage induced by tissue culture in oats (Avena sativa L.). Genome, 29, 439-446. Journal of Pesticide Reform.,1999. 19,1. Jurka, J., 2008. Conserved eukaryotic transposable elements and the evolution of gene regulation. Cellular and Molecular Life Sciences, 65, 201-204. Kaeppler, S.M., Kaeppler, H.F. and Rhee, Y., 2000. Epigenetic aspects of somaclonal variation in plants. Plant Mol Biol, 43, 179-188. Kajikawa, M. and Okada, N., 2002. LINEs mobilize SINEs in the eel through a shared 30 sequence. Cell, 111, 433-444. Kalendar, R., Antonius, K., Sm´ykal, P. And Schulman, A.H., 2010. iPBS: a universal method for DNA fingerprinting and retrotransposon isolation. Theor Appl Genet, 121, 1419-1430. Kalendar, R., Flavell, A.J., Ellis, T.H.N., Sjakste, T., Moisy, C. and Schulman, A.H., 2011. Analysis of plant diversity with retrotransposon-based molecular markers. Heredity, 106, 520-530. Kalendar, R., Grob, T., Regina, M., Suoniemi, A. and Schulman, A., 1999. IRAP and REMAP: two new retrotransposon-based DNA fingerprinting techniques. Theor Appl Genet, 98, 704-711. Kalendar, R., Tanskanen, J., Immonen, S., Nevo., E, Schulman, A.H., 2000. Genome evolution of wild barley (Hordeum spontaneum) by BARE-1 retrotransposon dynamics in response to sharp microclimatic divergence. Proc Natl Acad Sci USA, 97, 6603-6607. Kalıpcı, E., 2011. 2,4-D Herbisitleri ve Endüstriyel Atık Sularının Ekotoksik Etkilerinin Azaserin-Sıçan Modelinde Karaciğer Ve Pankreasta Araştırılması. Doktora Tezi, Selçuk Üniversitesi, Fen Bilimleri Enstitüsü, Konya. Kamrin, M.A., 1997. Phenoxy and benzoic acid herbicides. Pesticide Profiles: Toxicity, Environmental Impact, and Fate; CRC Press, 319-334 p, Boca Raton. Kaplan, M., 2009. Organik gıdalar neden tercih edilmeli?. Bilim Teknik Dergisi, 501, 30-33. Karaarslan, E., 2000. Bazı Herbisitlerin Toprağın Mikrobiyal Nifrifikasyon ve Solunumu Üzerine Etkisi. Y. Lisans Tezi, Selçuk Üniversitesi, Fen Bilimleri Enstitüsü, Konya. Kartal-Alacam, G., Yilmaz, S., Marakli, S. and Gozukirmizi, N., 2014. Sukkula retrotransposon insertion polymorphisms in barley. Russian Journal of Plant Physiology, 61(6), 828-833. Kaya, B. ve Yanıkoğlu, A., 1999. 2,4-D ve 4-CPA’nın Drosophila melanogaster’in F1, F2 ve F3 kuşaklarında gelişim süresi ve ergin birey sayılarına etkisi. Tr J of Zoology, 23(1), 297-301. Kaymak, S. ve Serim, A.T., 2015. Pestisit sektöründe araştırma ve geliştirme. Meyve Bilimi, 2(1), 27-34. 90 Kazazian, H.H., 2004. Mobile elements: drivers of genome evolution. Science, 303, 5664. Keller, T., Skopp, G. and Wu, M., 1994. Fatal overdose of 2,4-diclorophenoxyacetic acid (2,4-D). Forensic Science International, 65, 13-18. Kelley, K.B,, Wax, L.M., Hager, A.G. and Riechers, D.E., 2005. Soybean response to plant growth regulator herbicides is affected by other post emergence herbicide. Weed Science, 53(1),101-112. Ketenoğlu, O., Evren, H., Kurt, L. ve Düzenli, S., 2000. Çevre Kirliliği (Çevre Biyolojisi). Palme Yayıncılık No 166, 145-155 s, Ankara. Ketting, R.F., Haverkamp, T.H., Van Luenen, H.G. and Plasterk, R.H., 1999. Mut-7 of C. elegans, required for transposon silencing and RNA interference, is a homolog of Werner syndrome helicase and RNaseD. Cell, 99, 133-141. Khalatkar, A.S. and Bhargava, Y.R., 1982. 2,4-Dichlorophenoxyacetic acid- a new environmental mutagen. Mutation Res, 130, 11-114. Kim, K., Doi, A., Wen, B., Ng, K., Zhao, R., Cahan, P., Kim, J., Aryee, M.J., Ji, H., Ehrlich, L.I.R., Yabuuchi, A., Takeuchi, A., Cunniff, K.C., Hongguang, H., Mckinney-Freeman, S., Naveiras, O., Yoon, T.J., Irizarry, R.A., Jung, N., Seita, J., Hanna, J., Murakami, P., Jaenisch, R., R. Weissleder, S. H. O., Weissman, I.L., Feinberg, A.P. and Daley, G.Q., 2010. Epigenetic memory in induced pluripotent stem cells. Nature, 467, 285-290. Kishii, M., Nagaki, K. and Tsujimoto, H., 2001. A tandem repetitive sequence located in the centromeric region of common wheat (Triticum aestivum) chromosomes. Chromosome Res, 9, 417-428. Köksoy, H. ve Dönmez G., 2012. 2,4-diklorofenoksiasetik (2,4-D) asiti kullanabilen anoksijenik fotosentetik bakterilerin izolasyonu. Biyoloji Bilimleri Araştırma Dergisi, 5 (2), 95-100. Kumar, A. and Bennetzen, J.L., 1999. Plant retrotransposons. Annual Review of Genetics, 33, 479-532. Kumari, T.S. and Vaidyanath, K., 1989. Testing of Genotoxic effects of 2,4dichlorophenoxyacetic acid (2,4-D) using multiple genetic assay systems of plants. Mutation Reseach, 226, 235-238. Kwan, C.Y. and Chu, W., 2004. A study of the reaction mechanisms of the degradation of 2,4-dichlorophenoxyacetic acid by oxalate-mediated photooxidation. Water Research, 38, 4213-4221. Lerat, E., 2009. Identifying repeats and transposable elements in sequenced genomes: How to find your way through the dense forest of programs. Heredity, 104, 520523. Lerda, D. and Rizzi, R., 1991. Study of reproductive function in persons occupationally exposed to 2,4-dichlorophenoxyacetic acid (2.,4-D). Mutation Research, 262(1), 47-50. Lippman, Z. and Martienssen, R., 2004. The role of RNA interference in heterochromatic silencing. Nature, 431, 364-370. LoSchiavo, F., Pitto, L., Giuliano, G., Torti, G., Nuti-Ronchi, V., Marazziti, D., Vergara, R., Orselli, S. and Terzi, M., 1989. DNA methylation of embryogenic carrot cell cultures and its variations as caused by mutation, differentiation, hormones and hypomethylating drugs. Theoretical and Applied Genetics, 77, 325-331. 91 Loux, M.M. and Dobbels, A.F., 2007. Weed control guide for ohio and Indiana. Department of Horticulture and Crop Science, Ohio State University Extension & Johnson, W.G., Nice, G.R.W., Jordan, T.N. and Bauman, T.T., Department of Botany and Plant Pathology Purdue Extension, The Ohio State University Press. Lönnig, W.E. and Saedler, H., 2003. Chromosome rearrangements and transposable elements. Annu Rev Genet, 36, 389-410. Mahajan, S. and Tuteja, N., 2005. Cold, salinity and drought stresses: an overview. Archives of Biochemistry and Biophysics, 444, 139-158. Mak, J. and Kleiman, L., 1997. Primer tRNAs for reverse transcription. J Virol, 71, 8087-8095. Mansour, A., 2007. Epigenetic activation of genomic retrotransposons. Journal of Cell and Molecular Biology, 6(2), 99-107. Mansour, A., 2009. Water deficit induction of Copia and Gypsy genomic retrotransposons. Plant Stress, 3, 33-39. Mao, L., Wood, T.C., Yu, Y., Budiman, M.A., Tomkins, J., Woo, S., Sasinowski, M., Presting, G., Frisch, D., Goff, S., Dean, R.A. and Wing, R.A., 2000. Rice transposable elements: a survey of 73,000 sequencetagged- connectors. Genome Res, 10, 982-990. McClintock B.,1984. The significance of responses of the genome to challenge. Science, 226, 792-801. McClintock, B., 1948. The origin and behavior of mutable loci in maize. Proceedings of the National Academy of Science, 36(1), 344-355. Mi, Y., Zhang, C. and Taya, K., 2007. Quercetin protects spermatogonial cells from 2,4D-induced oxidative damage in embryonic chichkens. J Reprod Develop, 53(4), 749-754. Mittler, R., Vanderauwera, S., Gollery, M. and Van Breusegem, F., 2004. Recative oxygen gene network of plants. Trends Plant Sci, 9, 490-498. Miura, A., 2001. Mobilization of transposons by a mutation abolishing full DNA methylation in Arabidopsis. Nature, 411, 212-214. Naito, K., Zhang, F., Tsukiyama, T., Saito, H., Hancock, C.N., Richardson, A.O., Okumoto, Y., Tanisaka, T. and Wessler, S.R., 2009. Unexpected consequences of a sudden and massive transposon amplification on rice gene expression. Nature, 461, 1130-1134. Niinemets, U. and Valladares, F., 2004. Photosynthetic acclimation to simultaneous and interacting environmental stresses along natural light gradients:optimality and constraints. Plant Biol, 6, 254-268. Oehler, D.D. and Ivie, G.W., 1980. Metabolic fate of the herbicide dicamba in a lactating cow. J Agric Food Chem, 28(4), 685-689. Öner, H.D., 2010. Melanogryllus desertus (Pallas, 1771) (Orthoptera: Gryllidae) Hemositleri Üzerine 2,4-D (2,4-diklorofenoksiasetik asit)’nin Etkileri. Y. Lisans Tezi, Ege Üniversitesi, Fen Bilimleri Enstitüsü, İzmir. Özbay, R., 2014. Uygulama Sırasındaki Toprak Neminin Ve Uygulamadan Sonra Yapılan Farklı Sulama Zamanlarının; Toprak Herbisitlerinin Performansına Olan Etkisinin Belirlenmesi. Y. Lisans Tezi, Adnan Menderes Üniversitesi, Fen Bilimleri Enstitüsü, Aydın. 92 Özdaş, E., Ateş, U., Uyanıkgil, Y., Baka, M., Yavaşoğlu, A., Biçer, S. ve Ergen, G., 2006. Bir herbisit olan 2,4-D (2,4-diklorofenoksi asetik asit)’in sıçanlarda testis dokusu üzerine etkisi. Ege Tıp Dergisi, 45(3), 169-174. Özer, Z., Tursun, N. ve Önen, H., 2001. Yabancı otlarla sağlıklı yaşam (Gıda ve Tedavi). 4 Renk Yayın ve Tanıtım Matbaacılık Ltd. Şti, 308 s, Ankara. Özgen, M., Türet, M., Altinok, S. and Sancak, C., 1998. Efficient callus induction and plant regeneration from mature embryo culture of winter wheat (Triticum aestivum L.) genotypes. Plant Cell Reports, 18, 331-335. Öztürkmen, Ö., 2005. Pestisitlerin Alcaligenes denitrificans ve Alcaligenes xylosoxidans ile Mikrobiyal Bozunmasının Spektrofotometrik Tespiti. Y. Lisans Tezi, Çukurova Üniversitesi, Fen Bilimleri Enstitüsü, Adana. Pardue, M.L. and Danilevskaya, O.N., 1997. Evolutionary links between telomeres and transposable elements. Genetica, 100, 73-84. Paul, A.B., Peter, A.D. and Eric, P.P., 1999. Herbicides (How they work and the symptoms they cause). The Texas A&M University System, B6081. Pavlica, M., Papes, D. and Nagy, B., 1991. 2,4-Dichlorophenoxyacetic acid causes chromatin and chromosome abnormalities in plant cells and mutation in cultured mammalian cells. Mutation Research Letters, 263(2), 77-81. Peixoto, F., Vicente, J.A. F., and Madeira, V.M. C., 2003. The herbicide dicamba (2methoxy-3,6-dichlorobenzoic acid) interacts with mitochondrial bioenergetic functions. Arch Toxicol, 77(7), 403-409. Peixoto, F.P., Gomes-Laranjo, J., Vicente, J.A. and Madeira, V.M.C., 2008. Comparative effects of the herbicides dicamba, 2,4-D and paraquat on non-green potato tuber calli. Journal of Plant Physiology, 165, 1125-1133. Phillips, R.L., Kaeppler, S.M. and Olhoft, P., 1994. Genetic instability of plant tissue cultures: Breakdown of normal controls, P Natl Acad Sci, USA, 91, 5222-5226. Poczai, P., Varga, I., Laos, M., Cseh, A., Bell, N., Valkonen, J.P.T. and Hyvönen, J., 2013. Advances in plant gene-targeted and functional markers: A review. Plant Methods, 9(6), 1-31. Pouteau, S., Huttner, E., Grandbastien, M.A. and Caboche, M., 1991. Specific expression of the tobacco Tnt1 retrotransposon in protoplasts. EMBO J, 10, 1911-1918. Qi, Y., He, X., Wang, X.J., Kohany, O., Jurka, J. and Hannon, G.J., 2006. Distinct catalytic and non-catalytic roles of ARGONAUTE4 in RNA-directed DNA methylation. Nature, 443, 1008-1012. Rabinowicz, P.D., Citek, R., Budiman, M.A., Nunberg, A., Bedell, J.A., Lakey, N., O’shaughnessy, A.L., Nascimento, L.U., McCombie, W.R. and Martienssen, R.A., 2005. Differential methylation of genes and repeats in land plants. Genome Research, 15(10), 1431-1440. Reigart, J.R. and Roberts, J.R., 1999. Recognition and management of pesticide th poisoning. 5 U.S. Environmental Protection Agency, Office of Prevention, Pesticides and Toxic Substances, Office of Pesticide Programs, U.S. Government Printing Office: Washington, DC, 94-96. Reregistration Eligibility Decision (RED)., 2005. 2,4-D; EPA 738-R-05-002; U.S. Environmental Protection Agency, Office of Prevention, Pesticides and Toxic Substances, Office of Pesticide Programs, U.S. Government Printing Office: Washington, DC. 93 Reregistration Eligibility Decision (RED)., 2009. Correction to the amendments to the dicamba .U.S. Environmental Protection Agency, Office of Prevention, Pesticides and Toxic Substances, Office of Pesticide Programs, U.S. Government Printing Office: Washington, DC. Rinella, M.J., Kells, J.J. and Ward, R.W., 2001. Response of ‘Wakefield’ winter wheat (Triticum aestivum) to dicamba. Weed Technology, 15(3), 523-529. Roberts, B. L. and Dorough, H.W., 1998. Relative toxicity of chemicals to the earthworm. Environmental Toxicology and Chemistry, 3, 67-78. Romero-Puertas, M.C., McCarthy, I., Gomez, M., Sandalio, L.M., Corpas, F.J., Del Rio, L.A., Palma, J.M., 2004. Reactive oxygen species-mediated enzymatic systems involved in the oxidative action of 2,4-dichlorophenoxyacetic acid. Plant Cell Environ, 27(9), 1135-1148. Sabot, F. and Schulman, A.H., 2006. Parasitism and the retrotransposon life cycle in plants: a hitchhiker’s guide to the genome. Heredity, 97, 381-388. Sabot, F., Simon, D. and Bernard, M., 2004. Plant transposable elements, with an emphasis on grass species. Euphytica, 139, 227-247. Salazar, M., González, E., Casaretto, J.A., Casacuberta, J.M. and Ruiz-Lara, S., 2007. The promoter of the TLC1.1 retrotransposon from Solanum chilense is activated by multiple stress-related signaling molecules. Plant Cell Reports, 26(10), 18611868. Samanic, C., Rusiecki, J., Dosemeci, M., Hou, L., Hoppin, J. A., Sandler, D.P., Lubin, J., Blair, A. and Alavanja, M.C.R., 2006. Cancer incidence among pesticide applicators exposed to dicamba in the agricultural health study. Environ Health Perspect, 114 (10), 1521-1526. Sánchez-Luque, F., López, M.C., Macias, F., Alonso, C. and Thomas, M.C., 2012. Pr77 and L1TcRz: a dual system within the 50-end of L1Tc retrotransposon, internal promoter and HDV-like ribozyme. Mobile Genetic Elements, 2(1), 1-7. SanMiguel, P., Ramakrishna, W., Bennetzen, J., Busso, C. and Dubcovsky, J., 2002. Transposable elements, genes and recombination in a 215-kb contig from wheat chromosome 5A m. Funct Integr Genomics, 2, 70-80. Schulman, A.H. and Kalendar, R., 2005. A movable feast: diverse retrotransposons and their contribution to barley genome dynamics. Cytogenetic and Genome Research, 110, 598-605. Schwach, F., Moxon, S., Moulton, V. and Dalmay, T., 2009. Deciphering the diversity of small RNAs in plants: the long and short of it. Brief Funct Genomic Proteomic, 8, 472-481. Seibt, K.M., Wenke, T., Wollrab, C., Junghans, H., Muders, K., Dehmer, K.J., Diekmann, K. and Schmidt, T., 2012. Development and application of SINEbased markers for genotyping of potato varieties. Theor Appl Genet, 125, 185196. Serim A.T., 2010. Buğday Ekiliş Alanlarında Kullanılan Yeni Bazı Sulphonylurea Grubu Herbisitlerin Topraktaki Kalıntılarının Ayçiçeğine Etkileri Üzerinde Araştırmalar. Doktora Tezi, Ankara Üniversitesi, Fen Bilimleri Enstitüsü, Ankara. Sığmaz, B., 2014. Tuzluluk Stresinin Buğdayda (Triticum aestivum L.) Meydana Getirmiş Olduğu Retrotranspozon Polimorfizmi Üzerine Putresinin Etkisinin 94 Belirlenmesi. Y. Lisans Tezi, Atatürk Üniversitesi, Fen Bilimleri Enstitüsü, Erzurum. Singh, H.P., Batish, D.R. and Kohli, R.K., 2003. Allelopathic interactions and allelochemicals: new possibilites for sustainable weed management. Critical Reviews in Plant Sciences, 22(3-4), 240. Slotkin, R.K. and Martienssen R., 2007. Transposable elements and the epigenetic regulation of the genome. Nature Rev Genet, 8, 272-285. Smitt, A.F.A. and Riggs, A.D., 1996. Tiggers and other DNA transposon fossils in the human genome. Proceedings of the National Academy of Sciences of the United States of America, 93, 1443-1448. Sota-Grabinska, E., Wisniowska, E. and Kalka, J., 2003. Toxicity of selected synthetic auxines-2,4-D, MCPA derivatives to broadleaved and cereal plants. Crop Protection, 22, 355-360. Sökmen, M.A., 2005. Genetik yapısı değiştirilmiş bitkiler ve bitki koruma amaçlı kullanımı. OMÜ Zir Fak Dergisi, 20(3), 105-109. Sterling, T.M. and Hall, J.C., 1997. Mechanism of action of natural auxins and the auxinic herbicides. Herbicide Activity: Toxicology, Biochemistry and Molecular Biology, Ed: R.M. Roe, J.D. Burton, and R.J. Kuhr, IOS Press, 111-141 p, Burke, VA. Stevens, J.T. and Sumner, D.D., 1991. Herbicides. In Handbook of Pesticide Toxicology. Ed: W.J. Hayes and E.R Laws. Academic Press, 7-20 p, New York. Syed, N.H. and Flavell, A.J., 2006. Sequence-specific amplification polymorphisms (SSAPs): a multi-locus approach for analyzing transposon insertions. Nat Protoc, 1, 2746-2752. Tabara, H., Sarkissian, M., Kelly, W.G., Fleenor, J., Grishok, A., Timmons, L., Fire, A. and Mello, C.C., 1999. The rde-1 gene, RNA interference, and transposon silencing in C. elegans. Cell, 99, 123-132. Temel, A. and Gozukirmizi, N., 2013. Analysis of retrotransposition and DNA methylation in barley callus culture. Acta Biol Hung, 64(1), 90-99. Tepe, I., 1997. Türkiye’de tarım ve tarım dışı alanlarda sorun olan yabancı otlar ve mücadeleleri. Yüzüncü Yıl Ün Yay No:32,16 s, Van. Timur, S., 2001. Pestisit Tayinine Yönelik Biyosensör Geliştirilmesi ve Karakterizasyonu. Doktora Tezi, Ege Üniversitesi, Fen Bilimleri Enstitüsü, İzmir. Tiryaki, O., Canhilal, R. ve Horuz, S., 2010. Tarım ilaçları kullanımı ve riskleri. Erciyes Üniversitesi Fen Bilimleri Enstitüsü Dergisi, 26(2),154-169. Tompa, R., McCallum, C.M., Delrow, J., Henikoff, J.G., Van Steensel, B. and Henikoff, S., 2002. Genome-wide profiling of DNA methylation reveals transposon targets of CHROMOMETHYLASE3. Curr Biol, 12, 65-68. Topal, S., 2011. Allelokimyasalların herbisit etkileri. Dumlupınar Üniversitesi Fen Bilimleri Enstitüsü Dergisi, 25. Topuz, M., 2007. Marmara Bölgesinde Buğday Tarlalarında Bulunan Sinapis arvensis L.(Yabani hardal)’ın Sulfonylüre grubu Herbisitlere Karşı Oluşturduğu Dayanıklılık Üzerinde Araştırmalar. Doktora Tezi, Ege Üniversitesi, Fen Bilimleri Enstitüsü, İzmir. 95 Torun, H., 2011. Yüksek Doz Herbisit Uygulamalarının Hedef Dışı Bitkilerdeki Oluşturduğu Zararlanmalar. Y. Lisans Tezi, Çukurova Üniversitesi, Fen Bilimleri Enstitüsü, Adana. Tsukahara, S., Kobayashi, A., Kawabe, A., Mathieu, O., Miura, A. and Kakutani, T., 2009. Bursts of retrotransposition reproduced in Arabidopsis. Nature, 461, 423426. Turan, G.T., 2012. 2,4-Diklorofenoksiasetik Asitin (2,4-D) Kılıçkuyruk (Xiphophorus hellerii) Balıklarının Bazı Dokularında Asetiklorinesteraz (Ache) Aktivitesi Üzerine Etkileri. Y. Lisans Tezi, Marmara Üniversitesi, Fen Bilimleri Enstitüsü, İstanbul. Turkala, E. and Jalal, M., 1985. Increased rates of sister chromatid exchanges induced by the herbicide 2,4-D. Journal of Heredity, 76, 213. Tursun, N., 2012. Buğday ekim alanlarında görülen kısır yabani yulaf (Avena sterilis L.)’ın Fenoxaprop-p-ethyl etkili maddeli herbisitlere karşı dayanıklılığının hızlı test yöntemi ile belirlenmesine yönelik araştırmalar. Tarım Bilimleri Araştırma Dergisi, 5(2), 161-166. Verbsky, M.L. and Richards, E.J., 2001. Chromatin remodeling in plants. Curr Opin Plant Biol, 4, 494-500. Verma, S. and Mishra, S.M., 2005. Putrescine alleviation of growth in salt stressed Brassica juncea by inducing antioxidative defense system. J Plant Physiol, 162, 669-677. Vitte, C., Ishii, T., Lamy, F., Brar, D. and Panaud, O., 2004. Genomic paleontology provides evidence for two distinct origins of Asian rice (Oryza sativa L). Mol Genet Genomics, 272, 504-511. Volpe, T.A., Kidner, C., Hall, I.M., Teng, G., Grewal, S.I.S. and Martienssen, R.A., 2002. Regulation of heterochromatic silencing and histone H3 lysine-9 methylation by RNAi. Science, 297, 1833-1837. Vos, P., Hogers, R., Bleeker, M., Reijans, M., Lee, T., Van de Hornes, M., Friters, A., Pot, J., Paleman, J., Kuiper, M. and Zabeau, M., 1995. AFLP: a new technique for DNA fingerprinting. Nucleic Acids Res, 23, 4407-4414. Vroumsia, T., Steiman, R., Seigle-Murandi, F. and Benoit-guyod, J.L., 2005. Groupe pour l’Etude du Devenir des Xenobiotiques dans l’Environnement (GEDEXE), Fungal bioconversion of 2,4-dichlorophenoxyacetic acid (2,4-D) and 2,4dichlorophenol (2,4-DCP). Chemosphere, 60, 1471-1480. Vural, N., 2005. Toksikoloji. Ankara Üniversitesi Eczacılık Fakültesi Yayınları No: 73, 381 s, Ankara. Wang, W., Vinocur, B. and Altman, A., 2003. Plant responses to drougth, salinity and extreme temperatures: towards genetic engineering for stress tolerance. Planta, 218, 1-14. Wang, W.X., Vinocur, B., Shoseyov, O. and Altman, A., 2001. Biotechnology of plant osmotic stress tolerance: physiological and molecular considerations. Acta Horticulturae, 560, 285-292. th Ware, G.W., 1994. The pesticide book. 4 edition, Thomsan Publication, 386 p, Colifornia. Washington State Department of Ecology., 2001. Herbicide risk assessment for the aquatic plant management final supplemental enviromental impact statement. Appendix C, 3,Publication number: 00-10-043. 96 Waters, M.D., Nesnow, S., Simmon, V.F., Mitchell, A.D., Jorgenson, T.A. and Valencia, R., 1981. Pesticide chemist and modern toxicology. American Chemical Society, Washington, DC. Waugh, R., McLean, K., Flavell, A.J., Pearce, S.R., Kumar, A., Thomas, B.B. and Powell, W., 1997. Genetic distribution of BARE-1-like retrotransposable elements in the barley genome revaled by sequence-specific amplification polymorphisms (S-SAP). Mol Gen Genet, 253, 687-694. Weil, C. and Martienssen, R.A., 2008. Epigenetic interactions between transposons and genes: lessons from plants. Curr Opin Genet Dev, 18, 188-192. Wendel, J.F. and Wessler, S.R., 2000. Retrotransposon-mediated genome evolution on a local ecological scale. Proc Natl Acad Sci USA, 97, 6250-6252. Wenke, T., Döbel, T., Sörensen, T.R., Junghans, H., Weisshaar, B. and Schmidt, T., 2011. Targeted identification of short interspersed nuclear element families shows their widespread existence and extreme heterogeneity in plant genomes. Plant Cell, 23, 3117-3128. Westwood, M.N., 1993. Hormones and growth regulators, temperate zone pomology: physiology and culture. Timber Press, Inc. 9999 S.W. Wilshire, Suite 124, Portland, Oregon, 97225. Wicker, T., Sabot, F., Hua-Van, A., Bennetzen, J.L., Capy, P., Chalhoub, B., Flavell, A., Leroy, P., Morgante, M., Panaund, O., Paux, E., Sanmiguel, P. and Schulman, A.H., 2007. A unified classified classification system for eukaryotic transposable elements. Nature Reviews Genetics, 8, 973-982. Wolfe, W.H., Michalek, J.E. and Miner, J.C., 1990. Vietnam: I. Physical Health, II. Mortality. J Am Med Ass, 264,1824-1836. Woodrow, P., Pontecorvo, G., Fantaccione, S., Fuggi, A., Kafantaris, I. and Carillo, P., 2010. Polymorphism of a new Ty1-copia retrotransposon in durum wheat under salt and light stresses. Theor Appl Genet, 121(2), 311-322. Wu-Scharf, D., Jeong, B.R., Zhang, C. and Cerutti, H., 2000. Transgene and transposon silencing in Chlamydomonas reinhardtii by a DEAH-Box RNA helicase. Science, 290, 1159-1162. Xiong, Y. and Eickbush, T.H., 1990. Origin and evolution of retroelements based upon their reverse transcriptase sequences. EMBO J, 9, 3353-3362. Yalçınkaya, M., 2006. Bir Herbisit Olan 2,4-D (Diklorofenoksi asetik asit)’nin Poecilia reticulata P.,1859’da Medulla spinalis Üzerine Etkileri. Y. Lisans Tezi, Ege Üniversitesi, Fen Bilimleri Enstitüsü, İzmir. Yeşilbaş, S., 2010. Quizalofop-P-Etil Herbisitinin Soğan (Allium cepa L.) Köklerindeki Genotoksik Etkilerinin RAPD ve Comet Assaylerle Belirlenmesi. Y. Lisans Tezi, Afyon Kocatepe Üniversitesi, Fen Bilimleri Enstitüsü, Afyon. Yıldız, M., Gürkan, O. ve Turgut, C., 2006. Tarımsal savaşımda kullanılan pestisitlerin yol açtığı çevre sorunları. Ziraat Mühendisleri Odası, , 6-8, Ankara. Yılmaz, B.,2014. Endokrin bozucular (EDC) ve biyosidal ürünler. Uluslararası Katılımlı Ulusal Biyosidal Kongresi (19-22 Mart 2014) Konuşma-Bildiri Özetleri Kitabı, 55 s, Antalya. Yılmaz, N., 2011. Herbisit Bileşik Pendimetalinin Olası Genotoksik Etkilerinin İncelenmesi. Y. Lisans Tezi, Hacettepe Üniversitesi, Sağlık Bilimleri Enstitüsü, Ankara. 97 Yılmaz, S. and Gozukirmizi, N., 2013. Variation of retrotransposon movement in callus culture and regenerated shoots of barley. Biotechnology and Biotechnological Equipment, 27, 4227-4230. Yildirim, N., Agar, G., Taspinar, M.S., Turan, M., Aydin, M. and Arslan, E., 2014. Protective role of humic acids against dicamba induced genotoxicity and DNA methylation in Phaseolus vulgaris L. Acta Agriculturae Scandinavica, Section B-Soil &Plant Science, 64(2), 141-148. Yildiz, M. and Arikan, E.S., 2008. Genotoxicity testing of quizalofop-P-ethyl herbicide using the Allium cepa anaphase-telophase chromosome aberration assay. Caryologia, 61, 45-52. Yilmaz, S., Marakli, S. and Gozukirmizi, N., 2014. BAGY2 retrotransposon analyses in barley calli cultures and regenerated plantlets. Biochem Genet, 52, 233-244. Yüzbaşıoğlu, D., 2001. Illoxan ve Racer Herbisitlerinin Allium cepa L. Kök Ucu Hücrelerinde Mitoz Bölünmeye Ve Kromozomlara Etkileri. Doktora Tezi, Gazi Üniversitesi, Fen Bilimleri Enstitüsü, Ankara. Zeljezic D. and Garaj-Vrhovac V., 2004. Chromosomal aberrations, micronuclei and nuclear buds induced in human lymphocytes by 2,4-dichlorophenoxyacetic acid pesticide formulation. Toxicology, 200, 39-44. Zhang, X., Yazaki, J., Sundaresan, A., Cokus, S., Chan, S.W., Chen, H., Henderson, I.R., Shinn, P., Pellegrini, M., Jacobsen, S.E. and Ecker, J.R., 2006. Genomewide high-resolution mapping and functional analysis of DNA methylation in Arabidopsis. Cell, 126, 1189-1201. Zhang, Z.G. and Saier, M.H., 2009. A novel mechanism of transposon-mediated gene activation. Plos Genetics, 5:e1000689. Zilberman, D., Gehring, M., Tran, R.K., Ballinger, T. and Henikoff, S., 2007. Genomewide analysis of Arabidopsis thaliana DNA methylation uncovers an interdependence between methylation and transcription. Nat Genet, 39, 61-69. 98 ÖZGEÇMİŞ 1989 yılında Erzurum’da doğdu. İlk, orta ve lise öğrenimini Erzurum’da tamamladı. 2008 yılında girdiği Atatürk Üniversitesi Fen Fakültesi Biyoloji Bölümü’nden 2012 yılında mezun oldu. 2013 yılında Atatürk Üniversitesi Fen Bilimleri Enstitüsü Biyoloji Bölümü Moleküler Biyoloji Anabilim Dalı’nda yüksek lisans öğrenimine başladı.