ANKARA ÜNİVERSİTESİ
BİLİMSEL ARAŞTIRMA PROJESİ
KESİN RAPORU
Proje Başlığı
Antioksidan gen polimorfizmlerinin baş ve boyun kanserinde
araştırılması
Proje Yürütücüsünün İsmi
Prof Dr. Sinan Süzen
Yardımcı Araştırmacıların İsmi
Doç. Dr. Mehmet Turanlı
Dr. Gülçin Köse
Uzm. Emel Güçyener
Proje Numarası
08B3336002
Başlama Tarihi
Ekim 2008
Bitiş Tarihi
Mart 2012
Rapor Tarihi
Ağustos 2012
Ankara Üniversitesi Bilimsel Araştırma Projeleri
Ankara - 2012
I. Projenin Türkçe ve İngilizce Adı ve Özetleri
Projenin Türkçe adı: Antioksidan Gen Polimorfizmlerinin Baş ve Boyun Kanserinde
Araştırılması
Projenin İngilizce adı: Investigation of Antioxidan Gene Polymorphisms in Head and neck
Cancer
Projenin Özeti:
Yassı hücreli baş ve boyun kanseri (YHBBK) ciddi bir sağlık problemidir ve dünyada
en sık görülen kanser türlerinden biridir. Bu kanser türünün etiyolojisinde ana faktör olarak
tütün kullanımı yer almaktadır. Duman karsinojenleri ve serbest radikaller DNA, RNA,
lipitler ve proteinler gibi biyomoleküllere zarar verebilir. Karsinojenik bileşiklere maruziyetin
etkilerine ilave olarak, kanser gelişimi, bireylerin kanser yatkınlığına bağlı olabilir.
Bu çalışmanın birincil amacı katalaz (KAT, -262C/T), mangan-süperoksit dismütaz
(SOD2, Val16Ala), ve glutatiyon peroksidaz-1 (GPX1, Pro198Leu) genlerindeki kalıtsal
farklılıkları olan bireylerin baş boyun kanser riskinin arttığı hipotezini test etmektir.
Bu çalışmada KAT -262 C/T değişimi 205 sağlıklı bireyle 113 YHBB kanserli hasta
arasında polimeraz zincir reaksiyonu (PZR) ve restriksiyon parça uzunluk polimorfizmi
(RPUP) yöntemi kullanılarak analiz edilmiştir. GPX1 ve SOD2 polimorfizm analizleri aynı
teknikler kullanılarak 139 YHBB kanser hastası ve 265 sağlıklı bireyde yürütülmüştür.
Çalışmamız sonucunda katalaz geninin araştırılan polimorfizmde sırasıyla CC, CT ve
TT genotipine ait 138 (% 67,32), 54 (% 26,34), 13 (% 6,34) kontrol grubunda, CC genotipine
ait 64 (% 56,6), CT genotipine ait 44 (% 39), TT genotipine ait 5 (% 4,4) hasta örneği sonucu
elde edilmiştir. BBK kanserinde araştırılan polimorfizmin hastalık gelişme risk oranı CT
genotipi için OR: 1,75 [%95 CI 1.06- 2,88] ve TT genotipi için OR: 0,82 [%95 CI 0,28-2,42]
‘dir. Çalışmanın sonucunda katalaz -262 C/T değişimi BBK gelişiminde öenmli bir rolünün
olmayabileceği gözlenmiştir. Genler teker teker incelendiklerinde tüm numuneleri içeren
genel grupta, erkekler grubunda ve sigarayı halen içen ve bırakmış kişilerin bulunduğu sigara
içenler grubunda SOD2 heterozigot genotiplerini taşıyan kişiler kontrol grubuna göre riskli
bulunmuştur. OR değerleri bu gruplar için sırasıyla verilmiştir OR: 1,902; %95 CI 1,1003,284, OR:2,062; %95 CI 1,116-3,811, OR:2,126; %95 CI 1,130-3,997. GPX1 Leu/Leu
allelini taşıyan kişiler, erkekler grubunda ve sigara içenler grubunda YHBB kanseri için riskli
bulunmuştur. OR değerleri sırasıyla verilmiştir OR: 2,148; %95 CI 1,001-4,611, OR: 2,380;
%95 CI 1,079-5,249. Sonuçlarımıza göre GPX1 Leu/Leu ve SOD2 Val/Ala genotiplerini
taşıyan kişilerde kanser risk artışı gözlenmiştir.
Potansiyel olarak genotoksik bileşiklerin detoksifikasyonunda önemli rol oynayan
KAT, GPX1 ve SOD2 enzimlerinin savunma sisteminde önemli rolleri vardır. Bu genlerdeki
polimorfizmlerin araştırılması kanser gelişiminde rol oynayan genetik faktörlerin
anlaşılmasına katkı sağlamaktadır.
1
Projenin İngilizce özeti:
Squamous cell carcinoma of head and neck cancer (SCCHN) is one of the most
common type of cancer and is a serious health problem around the world. The main factor in
the aetiology of this type of cancer is using tobacco. Smoke, carcinogens and free radicals can
damage biomolecules such as DNA, RNA, lipids and proteins. In addition to influences of
exposure to carcinogenic compounds, the development of cancer may depend on individual
intrinsic cancer susceptibility.
The primary objective of this study was to test the hypothesis that individuals with
inherited differences of the genes catalase (CAT, -262C/T), manganese superoxide dismutase
(SOD2 (Val16Ala), and glutathione peroxidise-1 (GPX1, Pro198Leu) are at an increased risk
of head and neck cancer.
In this study CAT -262 C/T polymorphism was analysed in 113 SCCHN cases and 205
healthy individuals using polymerase chain reaction-restriction fragment length
polymorphism (PCR-RFLP). GPX1 and SOD2 polymorphisms analyses were carried out in
139 SCCHN patients and 265 controls using the same techniques.
The CC genotype was found in 138 (% 67,32), the heterozygous CT genotype in 54 (% 26,3),
and there were 13 (% 6,3) individuals homozygous for mutant T-allele in the control group.
Catalase CC, CT, and TT genotypes were 56,6%, 39%, and 4,4% respectively, in the cases.
There was not a significant association in genotype of CAT (CT, OR: 1,75 [%95 CI 1.062,88]; TT, OR: 0,82 [%95 CI 0,28-2,42]). Our preliminary findings suggest that the CAT -262
C/T variant allele may not play a major role in the aetiology of HNC. When genes were
examined one by one, in the general group that contains all the samples, in men's group and
those with smokers group including current and ex-smokers, individuals who carry SOD2
heterozygote genotypes compared to control group was found at risk. OR values are given
respectively for these groups; OR: 1,902; 95% CI 1,100-3, 284, OR: 2,062; 95% CI 1,1163,811, OR:2,126; 95%CI 1,130-3,997. Individuals who carry GPX1 Leu/Leu allele were
found at risk for SCCHN in men’s group and smokers group. OR values are given
respectively; OR: 2,148; 95% CI 1,001-4,611, OR:2, 380; 95%CI1,079-5,249. According to
our results, individuals who carry GPX1 Leu/Leu and SOD2 Val/Ala genotypes have
increased risk of cancer.
CAT, SOD2, GPX1 that have a potentially important role in detoxification of
genotoxic compounds all have an important role in defence system. Investigation of
polymorphisms in these genes contribute to understanding the role of genetic factors in
development of cancer.
2
II. Amaç ve Kapsam
Serbest radikaller, oluştukları yerde kimyasal özelliklerinden dolayı çok hızlı ve kolay
bir şekilde hücredeki makromoleküllerle reaksiyona girebilmektedirler. Bu reaksiyonlar
sonucunda hücrede çeşitli hasarlar oluşmaktadır (Mena ve ark., 2004). Bu hasarlar genetik
materyalide içine alan çeşitli biyomoleküllerde meydana gelebilir ve sonuçta birçok hastalığın
gelişimine zemin oluşturur (Valko ve ark., 2007). Serbest radikallerin neden olabildiği
hastalıklar arasında kanser de yer almaktadır (Karihtala ve Soini, 2007). Oksidatif hasara karşı
görev yapan enzimler ile bu hastalık arasında yapılan çalışmalarda antioksidan enzimlerin
rolü hakkında bilgi sahibi olunmuştur. Son yıllarda ise antioksidan enzimleri kodlayan
genlerdeki farklılıkların, kanser ve genetik yatkınlık arasında bir ilişki olabileceğini ortaya
koymaktadır (Forsberg ve ark., 2001). Bu araştırma projesinde, baş ve boyun kanseri (BBK)
gelişmiş bireylerde serbest radikallere karşı savunma görevini yürüten enzimlerdeki genetik
farklılıkları araştırılmıştır. Bu amaçla araştırılan genler oksidan molekülleri detoksifiye eden
mangan-süperoksit dismütaz (SOD2, Mn-SOD), katalaz (KAT) ve glutatiyon peroksidaz
(GPX1) genleridir. Bu genlerdeki fonksiyonel genetik değişiklikler polimeraz zincir
reaksiyonu-restriksiyon parça uzunluk polimorfizmi (PZR-RPUP) teknikleriyle saptanmış
olup, BBK gelişimindeki etkileri araştırılmıştır.
İnsanlar kaçınılmaksızın reaktif oksijen türevlerine (ROT) maruz kalmaktadırlar. Bu
bileşikler ayrıca endojen yolla hücre içinde de oluşmaktadır. Hücrelerde enzimatik ve
enzimatik olmayan sistemler ROT’lara karşı savunma görevini yürütürler. Savunma
sistemlerinin daha az çalışması ve ROT seviyesinin hücre içinde artması veya her iki olayın
birlikte gelişmesi sonucunda hücre içindeki denge ROT’lar yönünde gelişebilir. Böylece
oksidatif stres sonucunda kanseri de içine alan birçok hastalık gelişebilir. BBK bütün dünyada
önemli bir sağlık problemi olup bu hastalığın gelişiminde ana faktör olarak sigara kullanımı
yer almaktadır (Forastiere ve ark., 2008). Sigara dumanında bulunan serbest radikalller de
BBK hastalığının oluşumunda önemli bir nedensel faktörü oluşturmaktadır (Valavanidis ve
ark., 2009). Son yıllarda giderek artan genomik alandaki gelişmeler ve sigara kullanan
bireylerin hepsinde değil de bir bölümünde BBK görülmesi, bu hastalığın gelişiminde genetik
yatkınlığın da diğer etkenlerle birlikte önemli bir faktör olabileceğini ortaya koymuştur
(Indulski ve Lutz, 2000). Genomik alandaki ilerlemeler ile ROT’lara karşı savunma görevini
yürüten SOD2, KAT ve GPX1 genlerinde bireyler arasında çeşitli fonksiyonel genetik
farklılıklar olduğu bulunmuştur. Daha sonra da bu farklılıkların bir çok hastalığın gelişiminde
oynadığı roller araştırılmıştır. Elde edilen bulgulara göre, tam bir sonuca ulaşılamasa da, bu
genlerde ROT’lara karşı genetik yapılarından dolayı daha az savunmaya sahip bireylerin
hastalık gelişiminde risk altında olabileceği ortaya konmuştur. Kanser, etiyolojisinde yer alan
faktörlerden kaçınılarak ve bireysel genetik yapının açığa çıkarılması ile risk altında olan
bireylerin yaşam şeklinin ve diyetinin belirlenmesi ile önlenebilir bir hastalık olma
potansiyeline sahiptir. Böylece, bu projede yer alan genlerdeki değişiklerin saptanması
ROT’ların neden olduğu hastalık gelişiminde riskli bireylerin ortaya çıkarılmasında toplum
sağlığının korunması açısından öneme sahiptir.
III. Materyal ve Yöntem
Materyal
Bu araştırmada biyolojik materyal olarak hasta ve kontrol grubundan alınan kan
örnekleri ile çalışılmıştır. Hastalara ait kan numuneleri histopatolojik olarak konfirme edilmiş,
primer yassı hücre karsinomalı baş boyun bölgesi hastalarından, Ankara Onkoloji
Hastanesi’nin Kulak Burun Boğaz Bölümü’nden, kontrol grubu kan örnekleri de bu
hastanenin Kulak Burun Boğaz Polikliniği’ne gelen sağlıklı, kanser ve akraba olmayan
3
bireylerden sağlanmıştır. Her iki grubu oluşturan bireylerden alınan 3 ml venöz kan edtalı
tüplere konarak DNA izolasyonu yapılana kadar + 4 º C de saklanmıştır.
Bu çalışmaya ait Etik Kurul Raporu 68 nolu karar ile TC. Sağlık Bakanlığı Dr. Abdurrahman
Yurtaslan Ankara Onkoloji Eğitim ve Araştırma Hastanesi Başhekimliği İlaç Araştırmaları
Etik Kurulu tarafından onaylanmıştır.
Yöntem
Çalışma planı
Bu araştırmada kan numuneleri hastaneden sağlanmıştır. İlk aşamada (1) akyuvarlar tüm
kandan ayrılarak hücre çekirdeklerinden DNA izole edilmiştir. DNA numuneleri analizler
yapılana kadar – 20 º C’de saklanmıştır. İkinci aşamada (2) hedeflenen genler, PZR ile
çoğaltılmıştır. Çoğaltılan numuneler, etidiyum bromür (EtBr2) ile boyanmış agaroz jelde
yürütülerek ultraviyole ışığı ile görünür hale getirilmiştir. Görünür hale gelen bantların
fotoğrafları jel görüntüleme sisteminde çekilmiştir. Üçüncü aşamada ise hedeflenen baz
değişiklikleri (3) restriksiyon parça uzunluk polimorfizmi (RPUP) tekniği ile saptanmıştır
1. Tam kandan DNA izolasyonu
Hasta ve kontrol grubundan alınan kan numuneleri rotatöre yerleştirilerek 10 dakika
beklenmiştir. Kan numuneleri tamamen homojen hale geldikten sonra DNA izolasyonuna
başlanmıştır.
Deneyin Yapılışı:
1. Homojen kan numunesinden beş yüz 500 µl alınıp 1.9 ml ‘lik mikrosantrifüj tüpüne
konulmuştur.
2. 1200 µl Hücre Lizis Solüsyonu kan içeren tüpe eklenip, tüpün içeriğinin karışması için
pipetle 2-3 kez çekilip geri bırakılmıştır.
3. Tüp rotatöre yerleştirilerek oda sıcaklığında 10 dakika alyuvarların parçalanması
beklendikten sonra oda sıcaklığında 13 000-16 000 x g’ de 25 saniye santrifüj edilmiştir.
4. Görünür haldeki beyaz pellete zarar vermeden olabildiğince süpernatan tüpten
uzaklaştırılmıştır.
5. Akyuvarlar (beyaz pellet) dağılana kadar tüp vortekslenmiştir (10-15 saniye).
6. Tüpe 500 µl Çekirdek Lizis Solüsyonu ilave edilip, akyuvarların iyice parçalanması için
beş-altı kez pipetlenmiştir.
7. Çekirdek Lizis Solusyonlu lizat üzerine 170 µl Protein Çöktürme Solüsyonu eklendikten
sonra, 10-20 sn vortekslenmiştir.
8. Oda sıcaklığında 13 000-16 000 x g’de 3 dakika santrifüj yapıldıktan sonra koyu
kahverengi protein pellet çöktürülüp süpernatant kısım 1.5 µl’lik temiz mikrosantrifüj bir tüpe
aktarılmıştır.
9. Süpernatant içeren tüpe 700 µl izopropanol konulmuştur.
10. Solüsyon yavaş ve hassas şekilde ters düz edilmek yoluyla karıştırılarak DNA, beyaz
iplikler şeklinde görünür hale getirilmiştir.
11. Süpernatant alındıktan sonra tüpe 600 µl %70’lik etanol eklendi. Tüp dikkatlice birkaç kez
ters düz edilerek DNA pelleti ve mikrosantrifüj tüpü çeperleri yıkanmıştır.
12. Oda sıcaklığında 13 000- 16 000 x g’de 1.5 dakika santrifüj edilip süpernatan dikkatlice
alınmıştır.
13. Etanol uzaklaştırıldıktan sonra tüp süzgeç kâğıdının üzerine ters çevrilerek yerleştirilmiş
10-15 dakika boyunca DNA pelletinin hava ile kuruması beklenmiştir.
14. Tüp kuruduktan sonra 100 µl DNA Rehidratasyon Solüsyonu ilave edilip bir gece
boyunca oda sıcaklığında inkübe edilmiştir.
4
DNA miktar tayini
Kan numunelerinde izole edilmiş DNA’ların miktarlarının tayini spektrofotometre ile
yapılmıştır. DNA solüsyonlarından 5 µl alınarak temiz bir tüpe konulup üzerine 95 µl distile
su ilave edilerek 1/ 20 oranında seyreltilmiştir.
DNA numunelerinin 260 nm de absorbansları ölçülerek DNA miktarı aşağıdaki formülle
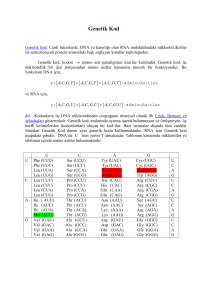
hesaplanmıştır:
DNA (µg/ml) = A260 × d × l × 50
Bu formülde:
A260: Spektrofotometrede 260 nm’de okunan değer,
d: Seyreltme faktörü (dilüsyon),
l: Spektrofotometre küvetinin uzunluğu,
50: Çift iplik DNA miktar tayininde kullanılan sabit değer. A260 değerini nükleik asitin µg/ml
verisine dönüştürme katsayısıdır.
2. Hedeflenen gen bölgelerinin PZR ile analizi
2.1 Katalaz gen analizi:
Katalaz -262 C/T polimorfizminin belirlenmesinde kullanılan polimeraz zincir reaksiyonu
yönteminde toplam hacim 25 µl olacak şekilde 2.5 µl PZR tamponu (100 mM Tris-HCl (25º
C’de pH 9.0), 500 mM KCl), 1.1 µl 25 mM MgCl2, 0.2 mM 1 µl dNTPs, 2.5 pmol 1.2 µl
forward ve reverse primerlerinden, 0.5 U / 0.1µl Taq polimeraz enzimi ve 2 µl DNA
içermektedir
Primer dizilim:
F: 5’- AGAGCCTCGCCCCGCCGGACCG-3’
R: 5’-TAAGAGCTGAGAAAGKATAGCT-3’(Forsberg ve ark.2001)
PZR Programı;
İlk döngü 94o C 30 sn, 68o C 45 sn, 72o C 60 sn olarak başlatılmış ve bundan sonraki
siklusların hibridizasyon sıcaklığı her bir döngüde 0.5o C düşürülerek 17 kez devam
edilmiştir. Onyedi döngü tekrardan sonra 94o C 30 sn, 60o C 45 sn, 72o C 60 sn olmak üzere
25 döngü, son olarak 72o C’de 1 dakika tek döngü gerçekleştirimiştir.
Amplifikasyon sonrasında oluşan katalaz geni etidiyum bromür (EtBr2) ile boyanmış %2’lik
agaroz jelde analiz edilmiştir. Katalaz geninin 185 bazçifti (bç) bandının varlığı ile PZR
reaksiyonunun başarısı kontrol edilmiştir.
2.2 Glutatiyon peroksidaz-1 (GPX1) gen analizi:
GPX1 geni C → T polimorfizminin belirlenmesinde kullanılan polimeraz zincir
reaksiyonu yönteminde toplam hacim 25 µl olacak şekilde 2.5 µl PZR tamponu (100 mM
Tris-HCl (25º C’de pH 9.0), 500 mM KCl), 1.6 µl 25 mM MgCl2, 0.15 mM 1 µl dNTPs, 7
pmol 1.2 µl forward ve reverse primerlerinden, 0.125 µl Taq polimeraz enzimi ve 2 µl DNA
içermektedir
Primer dizilim:
F: 5’- TGT GCC CCT ACG CAG GTA CA-3’
R: 5’-GGA CAC AGT AAC AGT AAA CC-3’(Ratnasinghe ve ark.2000)
5
PZR Programı;
İlk döngü 95o C’de 3 dk, tutulmasının ardından 95o C’de 30 sn denatürasyon, 58o C’de
1 dk eşleşme, 72o C’de 1.5 dk sentezden oluşan 35 döngü gerçekleştirilmiştir. Bu döngülerin
bitiminde 72o C’de 10 dk tutularak en son sentez basamağı ile işlem sonlandırılmıştır.
Amplifikasyon sonrasında oluşan katalaz geni etidiyum bromür (EtBr2) ile boyanmış %2’lik
agaroz jelde analiz edilmiştir. SOD2 geninin 338 bç bandının varlığı ile PZR reaksiyonunun
başarısı kontrol edilmiştir.
2.3 Mangan-süperoksit dismütaz (SOD2)gen analizi:
SOD2 geni T/C polimorfizminin belirlenmesinde kullanılan polimeraz zincir reaksiyonu
yönteminde toplam hacim 25 µl olacak şekilde 2.5 µl PZR tamponu (100 mM Tris-HCl (25º
C’de pH 9.0), 500 mM KCl), 2 µl 25 mM MgCl2, 0.15 mM 1 µl dNTPs, 25 pmol forward ve
reverse primerlerinden, 0.2 µl Taq polimeraz enzimi ve 5 µl DNA içermektedir
Primer dizilim:
F: 5’- AGC CCA GCC TGC GTA GAC-3’
R: 5’-TAC TTC TCC TCG GTG ACG-3’(Frasbon-Frodl ve ark.1999)
PZR Programı;
İlk döngü 95o C’de 3 dk, tutulmasının ardından 95o C’de 30 sn denatürasyon, 58o C’de
1 dk eşleşme, 72o C’de 1.5 dk sentezden oluşan 35 döngü gerçekleştirilmiştir. Bu döngülerin
bitiminde 72o C’de 10 dk tutularak en son sentez basamağı ile işlem sonlandırılmıştır.
Amplifikasyon sonrasında oluşan katalaz geni etidiyum bromür (EtBr2) ile boyanmış %2’lik
agaroz jelde analiz edilmiştir. SOD2 geninin 246 bç bandının varlığı ile PZR reaksiyonunun
başarısı kontrol edilmiştir.
3. Hedeflenen baz değişiklerinin RPUP tekniği ile analizi
3. 1. Katalaz gen analizi:
Kontrol ve hasta grubunda -262 C/ T polimorfizminin belirlenmesinde RPUP
yönteminde toplam hacim 20 µl olacak şekilde 10 µl PZR ürünü, 2 µl RE tamponu, 1 µl Sma I
içeren karışım hazırlanmıştır. Reaksiyon karışımı 1 gece 30 ºC’de inkübasyona bırakılmış ve
%2’lik agoroz jele 10 µl RPUP ürünü + 4 µl yükleme tamponu yüklenip 45 dakika
yürütülerek çalışılan bireyin (yabanıl/heterezigot/mutant) genotip analizi yapılmıştır.
Sma I tanıma bölgesi: CCC↓ GGG
Genotip aydınlatılması aşağıda yer alan kesim ürünlerine göre yapılmıştır:
Yabanıl tip (Wild-type): 155-30 bç
Heterozigot
: 185 – 155 – 30 bç
Mutant
: 185 bç
3. 2. Glutatiyon peroksidaz-1 (GPX1) gen analizi:
Kontrol ve hasta grubunda GPX1 geni C → T polimorfizminin belirlenmesinde RPUP
yönteminde toplam hacim 20 µl olacak şekilde 7.5 µl PZR ürünü, 2 µl RE tamponu, 1 µl Apa I
içeren karışım hazırlanmıştır. Reaksiyon karışımı 1 gece 37 ºC’de inkübasyona bırakılmış ve
%2’lik agoroz jele 10 µl RPUP ürünü + 4 µl yükleme tamponu yüklenip 45 dakika
yürütülerek çalışılan bireyin (yabanıl/heterezigot/mutant) genotip analizi yapılmıştır.
Apa I tanıma bölgesi: GGG CC ↓C
Genotip aydınlatılması aşağıda yer alan kesim ürünlerine göre yapılmıştır:
Yabanıl tip (Wild-type): 257-81 bç
Heterozigot
: 338-257-81 bç
Mutant
: 338 bç
6
2.4 3. 3. Mangan-süperoksit dismütaz (SOD2)gen analizi:
Kontrol ve hasta grubunda SOD2 geni T/C polimorfizminin belirlenmesinde RPUP
yönteminde toplam hacim 20 µl olacak şekilde 15 µl PZR ürünü, 2 µl RE tamponu, 1 µl BsaW
I içeren karışım hazırlanmıştır. Reaksiyon karışımı 1 gece 60 ºC’de inkübasyona bırakılmış ve
%2’lik agoroz jele 10 µl RPUP ürünü + 4 µl yükleme tamponu yüklenip 45 dakika
yürütülerek çalışılan bireyin (yabanıl/heterezigot/mutant) genotip analizi yapılmıştır.
Apa I tanıma bölgesi: W↓CCGGW
Genotip aydınlatılması aşağıda yer alan kesim ürünlerine göre yapılmıştır:
Yabanıl tip (Wild-type): 164-82 bç
Heterozigot
: 246-164-82 bç
Mutant
: 246 bç
SOD2 geni polimorfizm aydınlatılmasında poliakrilamid jel elektroforez (PAGE)
tekniğini de, PZR ürünün yetersiz olduğu numunelerde genotip aydınlatılmasında
kullanılmıştır.
Bu araştırmada çalışılan hasta ve kontrol grubunun demografik karakterlerdeki farklılıklar
ki-kare ve t-testi kullanılarak hesaplanmıştır. Genotiplerin odd ratio oranı yaş cinsiyet, sigara
ve alkol tüketimi ayarlamasına göre çoklu lojistik regresyon programı kullanılarak
hesaplanılmıştır. Tüm istatiksel hesaplar ve p değerleri çift kuyruklu ve p< 0,05 olması
durumunda anlamlı olacak şekilde sonuçlandırılmıştır. İstatiksel hesaplar Excel 2003 ve SPSS
programı kullanılarak yürütülmüştür.
IV. Analiz ve Bulgular
Katalaz (KAT) geni -262C/T polimorfizmi analizleri PZR ve/veya RPUP başarılı olan
toplam 205 kontrol ve 113 hasta üzerinden elde edilmiştir.
Yapılan araştırmada kontrol grubu olarak seçilmiş hiçbir kanser belirtisi olmayan 205
bireyin 72’si kadın (% 35.1), 133’i (% 64.9) erkektir. Bu bireylerden elde edilen genomik
DNA touchdown PZR yöntemi kullanılarak katalaz genotipleri belirlenmiştir. Yapılan
analizler sonucunda 138 yabanıl, 54 heterozigot ve 13 mutant genotip sonucu elde edilmiştir.
Kontrol grubu yaş ortalaması 47.21±13.63 olarak bulunmuştur.
Ankara Onkoloji Hastanesi kulak burun boğaz bölümünde kanser tanısı konmuş yatan
hastalardan alınan kanlardan izole edilmiş DNA numuneleri üzerinde katalaz - 262 C/T gen
polimorfizmi incelenmiştir. Hasta grubunda larenks ve oral kanser olmak üzere 113 kişi
çalışılmış ve bunun 11’i kadın (% 9,7) 102’si (% 90,3) erkektir. Yapılan RPUP analizlerinde
64’i yabanıl, 44’ı heterezigot ve 5’i mutant genotipe sahiptir. Bu grubuın yaş ortalaması
54.95±11.77 olarak hesaplanmıştır.
Çalışmamız sonucunda katalaz geninin araştırılan polimorfizmde sırasıyla CC, CT ve
TT genotipine ait 138 (%67,3), 54 (%26,4), 13 (%6,3) kontrol grubunda, CC genotipine ait 64
(%56,7), CT genotipine ait 44 (%39), TT genotipine ait 5 (%4,4) hasta örneği sonucu elde
edilmiştir. Alellik dağılımları çalışılan iki grupta da birbirine oldukça yakın oranlar
bulunmuştur (Kontrol; C: 0,8; T: 0,2; Hasta; C: 0,76 T: 0,24).
Hasta ve kontrol grubu katalaz -262 C/T kanser riski üzerine etkisi yönünden
karşılaştırıldığında CT ve TT genotipine sahip bireylerin hastalık taşıma riski bakımından
istatiksel olarak anlamlı bir sonuç getirmediği görülmüştür (CT, OR: 1,75 [%95 CI 1.062,88]; TT, OR: 0,82 [%95 CI 0,28-2,42]). Tablo 1’de hasta ve kontrol gruplarının KAT -262
C/T polimorfizmi bakımından OR hesapları yer almaktadır.
7
Tablo 1. Hasta ve kontrol gruplarının katalaz gen polimorfizmi bakımından OR hesapları
Gen
KAT CC
Hasta
n (%)
64 (56,7)
KAT CT
44 (39)
KAT TT
5 (4,4)
Kontrol
n (%)
138
(67,3)
54
(26,4)
13
(6,3)
%95 CI
Adjusted
OR
1
% 95 CI
P değeri
1,75
1,06-2,88
1,702
0,60
0,82
0,28-2,42
0,840
0,9772,965
0,2242,443
Ham OR
1
0.621
Ayrıca hasta ve kontrol grubunda yaş, cinsiyet, sigara ve alkolün birlikte etkisi
incelenmiş ve sonuçlar çoklu regresyon analizi ile hesaplanmıştır. Elde edilen sonuçlara göre;
55 yaş ve üzeri kişilerin hastalığa yakalanma riski bakımından yaklaşık 4 kat; erkeklerin
bayanlara göre yaklaşık 3 kat, sigara kullanan bireylerin ise 3 kat daha riskli olduğu
gözlenmiştir.
Daha önceki verilerden de anlaşılacağı gibi hastalar içinde erkek sayısı belirgin olarak
kadın sayısından fazladır. Bu yüzden hastalık üzerinde yaş, sigara alkol ve incelediğimiz
polimorfizm açısından etkisi incelenmiş ve erkekler arasında kanser gelişimi bakımından yaş
(55 yaş ve üzeri) ve sigaranın risk taşıdığı, (OR: 3,922 %95 CI 2,172-7,083; OR: 6,602 %95
CI 2,304-18,921) alkol ve katalaz -262 C/T polimorfizmi bakımından ise istatiksel olarak
herhangi bir risk taşımadığı yönünde bulgular elde edilmiştir (Hasta erkek sayısı: 102; kontrol
erkek sayısı: 133).
Glutatiyon peroksidaz-1 (GPX1) geni Pro198Leu (C → T) polimorfizmi ve SOD2
geni (T/C) polimorfizmleri analizleri PZR ve/veya RPUP başarılı olan toplam 265 kontrol
ve 139 hasta üzerinden elde edilmiştir.
Kontrol grubu olarak seçilmiş hiçbir kanser belirtisi olmayan 265 bireyin 86’sı kadın,
179’u erkektir. DNA numunelerinde PZR ve RPUP kullanılarak GPX1 genotipleri
belirlenmiştir. Yapılan analizler sonucunda kontrol grubunda 129 (% 48.67) kişinin
(Pro/Pro) yabanıl tip, 104 (% 39.24) kişinin (Pro/Leu) heterozigot, 32 (% 12.07) kişinin
(Leu/Leu) mutant olduğu bulunmuştur.
Sağlık Bakanlığı A.Y. Ankara Onkoloji Eğitim ve Araştırma Hastanesi Kulak Burun
Boğaz Kliniği’nde kanser tanısı konmuş yatan hastalardan alınan kanlardan izole edilmiş
DNA numuneleri üzerinde de GPX1 genotiplemesi yapılmıştır. Kan alınmasına izin veren
139 hastadan 121 kişi erkek, 18 kişi ise kadındır. Yapılan genotipleme analizleri sonucu
65 (% 46.76) kişinin GPX1 (Pro/Pro) yabanıl tip, 50 (% 35.97) kişi (Pro/Leu) heterozigot,
24 (% 17.26) kişi (Leu/Leu ) mutant allel taşıdığı gözlenmiştir.
SOD2 geni içim yapılan analizlerde ise 265 kişi içinde, 59 (% 22.26) kişinin (Ala/Ala)
mutant, 123 (% 46.41) kişinin (Val/Ala) heterozigot, 83 (%31.32) kişinin (Val/Val) yabanıl
tip, olduğu bulunmuştur. Hastalardan izole edilmiş DNA numuneleri üzerinde SOD2
genotiplemesi de yapılmıştır. Yapılan genotipleme çalışması ile 139 kişi içinde, 26 (% 18.70)
kişinin (Ala/Ala) mutant, 79 (% 56.83) kişinin (Val/Ala) heterozigot, 34 (% 24.46) kişinin
(Val/Val) yabanıl tip, olduğu gösterilmiştir.
Kanser ve kontrol grubu arasında, erkekler kadınlara göre, sigara kullananlar ve hiç sigara
içmemiş kişiler arasında belirgin fark vardır. Sigara kullananlar grubunu sigarayı halen içenler
ve sigarayı bırakmış olanlar oluşturmaktadır. Kanser ve kontrol grubumuzun yaş ortalamaları
arasında da fark gözlenmesi nedeniyle hesaplamalar yapılırken logistik regresyon analizi ile
bu değişkenler modele dahil edilerek yaş farkından gelebilecek hataların önüne geçilmek
istenmiştir.
8
GPX1 ve SOD2 gen polimorfizmlerinin allel frekansları Tablo 2’de verilmiştir. Tablodan
da anlaşılacağı gibi GPX1 Pro198Leu ve SOD2 Val16Ala polimorfizm bölgeleri için yabanıl
tipe karşı mutant alleller karşılaştırıldığında istatistiksel anlamlı bir fark bulunmamıştır.
Kontrol ve kanser grupları arasında allel frekansları arası fark yoktur.
Tablo 2. GPX1 ve SOD2 genlerinin incelenen polimorfizm bölgelerinin allel frekanslarının
karşılaştırılması.
GEN
KONTROL
KANSER
X2
OR (% 95 CI)
P
GPX1 PRO
362 (68,3)
180 (64,7)
GPX1 LEU
SOD2 VAL
168 (31,7)
289 (54,5)
98 (35,3)
147 (52,9)
1,043
1,173 (0,863-1,594)
1
0,307
SOD2 ALA
241 (45,5)
131 (47,1)
0,200
1,069 (0,799-1,430)
0,655
Her iki gene ait genotip frekanslarının hasta ve kontrol grubu ile karşılaştırılmasına ait
veriler Tablo 3’de verilmiştir. Genlerin tek başlarına kanser riski üzerine etkisi ki-kare
testi ile araştırıldığında istatistiksel anlamlı bir sonuç bulunamamıştır.
Tablo 3. GPX1 ve SOD2 genleri incelenen polimorfizm bölgelerinin ki-kare test
sonuçları.
Kanser
Genler
Kontrol
n (%)
GPX1 YT
129
(48,67)
65 (46,76)
GPX1 HET
104
(39,24)
50 (35,97)
0,042
0,954 (0,61,497)
0,838
GPX1
MUT
32
(12,07)
24 (17,26)
1,658
1,488
(0,81-2,73)
0,199
GPX1
HET+MUT
136
(51,32)
74 (53,23)
0,134
1,080(0,716
-1,629)
0,714
SOD2 YT
83
(31,32)
34 (24,46)
SOD2 HET
123
(46,41)
79 (56,83)
3,271
1,568
(0,96-2,55)
0,071
SOD2
MUT
59
(22,26)
26 (18,70)
0,055
1,076
(0,58-1,98)
0,814
n (%)
X2
OR
p
1
1
9
Araştırmamızda incelenen bu üç gen bölgesi logistik regresyon analizi ile her bir
gen bölgesi için yaş, cinsiyet ve sigara değişkenlerinin kanser riski üzerine etkisi
birlikte incelendiğinde ise SOD2 geni heterozigot genotipini taşıyanların yassı hücreli
baş ve boyun (YHBB) kanseri için 1,9 kez riskli oldukları görülmüştür (OR:1,902;
%95 CI 1,100-3,284; p:0,021). Bu genlerin üçü bir arada iken yapılan testlerde üç gen
bölgesini de mutant olarak taşıyan hiçbir birey olmadığı için üçlü gen kombinasyonu
yapılamamıştır.
YHBBK hastalarında yaş, cinsiyet ve sigara kullanımı alışkanlıklarının kanser riski
artışında etkili oldukları gözlenmiştir. Bu nedenle çalışma grubumuz 45 yaş altı, 45-59
yaş arası, 60 yaş üstü, sigara alışkanlığı olanlar, hiç sigara içmemiş kişiler, erkek ve
kadınlar için alt gruplara ayrılıp ki-kare testi yapılmıştır (Tablo 4).
Tablo 4. Yaş, cinsiyet, sigara ve alkol alışkanlıkları için ki-kare test sonuçları.
Kontrol (n)
Hasta (n)
X2
OR (%95 CI)
p
Toplam
265
139
<45
114 (43,01)
33 (23,74)
45-59
112 (42,26)
43 (30,93)
1,1
1,3 (0,7-2,2)
0,29
>60
39 (14,71)
63 (45,32)
39,2
5,58 (3,1-9,7)
<0,001
Erkek
179 (67,54)
121 (87,05)
18,1
3,230 (1,8-5,6)
<0.001
Kadın
86 (32,45)
18(12,94)
Evet
173(65,28)
117 (84,17)
Hiç
içmemiş
92 (34,71)
22 (15,82)
1
Cinsiyet
1
Sigara
alışkanl.
16
2,828 (1,6804,762)
<0,001
1
Alkol
Hayır
212 (80)
107 (76,97)
Evet
53 (20)
32 (23,02)
1
0,5
1,19 (0,7-1,9)
0,479
Elde edilen sonuçlara göre, erkekler kadınlara göre YHBB kanser gelişimi için 3,2
kat, sigara kullananlar 2,8 kat, 60 yaş üstü kişiler 5,5 kat riskli bulunmuştur. Erkekler alt
grubunda değişkenlerin tek başlarına YHBB kanser riski üzerindeki etkilerine ki-kare testi
ile bakıldığında incelediğimiz genlerden SOD2 geni Val/Ala genotipini taşıyan
heterozigot bireyler 1,8 kez (OR: 1,829; %95 CI 1,061-3,151), SOD2 geni heterozigot ve
mutant genotiplerini taşıyan bireyler yabanıl tip ile karşılaştırıldığında 1,6 kez (OR: 1,688;
%95 CI 1,010-2,821) riskli bulunmuştur.
Yaş ve sigara değişkenlerinin etkisi ile genlerin tek başlarına YHBB kanseri riski
üzerine etkileri logistik regresyon analizi ile incelendiğinde SOD2 heterozigot genotipini
taşıyanlar ve SOD2 heterozigot ve mutant genotipli bireyler beraber iken yabanıl tiple
10
karşılaştırıldığında anlamlı sonuçlar elde edilmiştir. SOD2 heterozigot genotipini
taşıyanlar 2 kez riskli ve SOD2 heterozigot ve mutant genotiplerini taşıyanlar beraber
gruplandırıldığında 1,7 kez riskli çıkmıştır. OR değerleri sırasıyla 2,062; %95 CI 1,1163,811 ve OR:1,798; % 95 CI 1,010-3,201 (p<0,05). GPX1 mutant genotipini taşıyan
erkekler yabanıl tipi taşıyanlara göre p değeri tam sınırda çıkmıştır. Bu genotipi
taşıyanlarda yabanıl tipi taşıyanlara göre YHBB kanseri riski 2,1 kez artmaktadır;
OR:2,148; %95 CI 1,001-4,611.
Sigara içenler grubunda ise yaş ve cinsiyetin etkisi de eklenerek logistik regresyon
analizi yapıldığında incelediğimiz genlerden GPX1 mutant ve SOD2 heterozigot
genotipini taşıyan kişiler için kanser grubu kontrol grubuna göre istatistiksel anlamlı
olarak risklidir. OR değerleri sırasıyla 2,380; %95 CI 1,079-5,249 ve 2,126; % 95 CI
1,130-3,997’dir.
V. Sonuç ve Öneriler
Yassı hücreli baş boyun (YHBB) kanseri riski, alkol ve sigara kullanımına bağlı olarak,
yaşamda kalım oranları, yaş, cinsiyet, etnik kökene ve yaşanan coğrafik alan gibi pek çok
faktöre bağlıdır. Bu risk, sigara içimi, alkol kullanımı, viral enfeksiyonlar ve genetik
faktörlerden etkilenir. Bununla beraber sigara içilmesi ve alkol kullanılması YHBB
kanserlerinde majör faktörlerdir. Fakat sigara ve alkol kullananların bir bölümünde kanser
gelişir. Yassı hücreli baş boyun kanseri olan kişilerin % 15-20 kadarı sigara veya alkole
maruz kalmamıştır (Rigström ve ark., 2002). YHBB kanseri olmuş kişilerin %10-20 sinde
ikinci kez birincil tümör oluşma riski bulunmaktadır. Birinci derece akrabalarda kanser
gelişme riskinin iki birincil tümörü olanlarda arttığı gösterilmiştir (Jefferies ve ark., 2005).
Buna göre çevresel faktörlerin yanında kişilerin genetik farklılığının da kanser üzerine etkili
olduğu düşünülmektedir. Hücresel tüm fonksiyonların yerine getirilmesi için kullanılan
genetik bilgi DNA’da kodlanmıştır. Kimyasal maddeler veya oksidatif stres kaynaklı DNA
hasarlarının onarılamadığı durumlarda yaşamsal genetik bilgi etkilenir. DNA hasarı birikimi
ile karsinojenezis eğiliminde yatkınlık söz konusu olur. YHBB kanserine yatkınlıkta; hücre
organelleri ve DNA’yı oksidatif stresten koruyan antioksidan savunma sistemindeki ve DNA
onarım yeteneğindeki farklılıklar karsinojen metabolizmasında tütün ile indüklenen tümör
oluşumunda önemlidir. Genetik faktörleri tanımlanan toplumda yüksek riskli kişilerin
belirlenmesi yeteneği gelecekte kanserin önlenmesinde ve önceden söylenebilecek hasta
sonuçlarının yönetiminde anlam getirebilir (Sturgis ve Wei., 2002).
Yapılan birçok çalışmada hastalık türü ve çalışılan etnik ırka göre sonuçlar değişiklik
göstermektedir. Bizim araştırmamızda ise katalaz -262 C/T değişimi ve baş boyun bölgesi
kanseri gelişme riski arasında herhangi anlamlı bir sonuç elde edilememesine karşın; sigara,
yaş ve cinsiyet arasındaki farklılıkların hastalık gelişiminde etkili olduğu ve diğer çalışmalarla
da uyum gösterdiği gözlenmiştir. Ayrıca Türk populasyonunda elde ettiğimiz genotip ve allel
frekansı sonuçları diğer ülkelerde çalışılmış beyaz ırk sonuçlarıyla da benzer oranda
seyretmiştir.
Katalaz -262 C/T polimorfizmi genotip ve allel frekansı dağılımı bakımından diğer
yapılan çalışmalarda gözlenen Avrupa Beyaz ırkı ile farklılık göstermediği, Katalaz -262 C/T
polimorfizminin baş boyun bölgesi kanseri gelişiminde önemli bir rolünün olmayabileceği
gözlenmiştir.
Reaktif oksijen türevi (ROT) kaynaklı oksidatif stres, hücresel ve DNA hasarlarına neden
olur. Oksidatif hasara karşı hücresel koruyucular karsinojnezise karşı mekanizmalarla DNA
onarımına benzerler. Antioksidan savunma enzimi genlerinden olan SOD2’nin
polimorfizmlerine bağlı kişisel değişkenlerin karsinojeneziste önemi artan bir şekilde açığa
11
çıkmaktadır. SOD2 polimorfizmleri pek çok yayında incelenmiştir. Bu yayınların çoğunluğu
SOD2’nin sinyal sekansındaki polimorfizme odaklanmıştır. Bu sekans doğru transport ve
SOD2’nin mitokondri tarafından işlenmesinde etkilidir. SOD2 mitokondriyal hedef sekansı (9T>C) Valin–Alanin polimorfizminin kanser riski ile ilişkisi için farklı sonuçlar rapor
edilmiştir. Ambrosone ve arkadaşlarının (1999), Mitrunen ve arkadaşlarının (2001)
çalışmalarında meme kanseri riski için belirgin gen doz-cevap ilişkisi gözlenirken Knight
(2004) ve Egan (2003) çalışmalarında meme kanseri için risk gözlemlememişlerdir. Bazı
kanserlerde Val/Val genotipi riskli, bazılarında Ala/Ala genotipi riskli bulunmuştur.
Ala genotipini istatistiksel anlamlı olarak riskli bulanlardan, Ambrosone ve arkadaşlarının
Amerika’da yaptığı çalışmada polimorfizm ile meme kanseri ilişkili bulunmuştur. Ala alleli
homozigot olan premenepozlu kadınlarda Val alleli ile karşılaştırıldığında 4 kat daha fazla
risk taşıdığı gösterilmiştir (OR: 4,3; % 95 CI 1,710,8) (Ambrosone ve ark., 1999). Meme
kanseri için Finli’lerde yapılmış bir diğer çalışmada da Ala genotipi 1,4 kez riskli çıkmıştır
(OR: 1,4; %95 CI 0,9-2) (Mitrunen ve ark., 2001). Bica ve arkadaşlarının Brezilya’da steroid
bağımlı kanserler üzerine yaptıkları çalışmada Ala/Ala genotipi 2,5 kez riskli olarak kanserle
ilişkili bulunmuştur (OR: 2,515; % 95 CI 1,393-4,541). Steroid bağımlı kanserler olarak
meme kanseri ve prostat kanseri birlikte incelenmiştir (Bica ve ark., 2009). Prostat kanseri
için Japonya’da yapılmış başka bir çalışmada da Ala genotipi için ilişki bulunması (OR: 2,41;
%95 CI 1-5,75) (Iguchi ve ark., 2008) SOD2 Val16Ala polimorfizminin bu kanser bölgeleri
için anlamlı olabileceğini düşündürmektedir. Bu ilişkinin kaynağının, östrojen metabolizması
sırasında kateşol redoks döngüsünde ROT oluşumu olduğu hipotezlenmiştir (Bica ve ark.,
2009).
Ala genotipinin riskli olması SOD2 enziminin mitokondriye transportunda Ala
genotipinin daha aktif olmasına bağlanmaktadır. Aktif enzim ile fazla H2O2 üretilmesi, bunun
ortamdan yeterince uzaklaştırılamamasıyla O2 radikali oluşumu ve sitokin ekspresyonu, hücre
hasarı ve mitokondriyal geçirgenliğin artışı sonucu hücre ölümü veya karsinojenezisin olduğu
düşünülmektedir (Ezzikouri ve ark., 2008). Val genotipini riskli bulan farklı organ
bölgelerinde oluşan kanser tiplerinde yapılmış çalışmalar da vardır. İsveç’te meme kanseri
için yapılan bir çalışmada Val/Val genotipi 2,75 kez riskli iken Val/Val genotipli kişilere
heterozigot bireyler de eklendiğinde risk 2,9’a ulaşmıştır (Val/Val OR:2,75; %95 CI 1,185,51), (Val/Val+ Val/Ala OR: 2,9; %95 CI 1,39-6,14) (Bergman ve ark. 2005). Hung ve
arkadaşları, İtalyan’larda idrar kesesi kanseri ve SOD2 Val16Ala polimorfizmi ilişkisini
araştırmışlardır. Val/Val genotipinin idrar kesesi kanseri riskini 1,8 kez arttırdığını
bulmuşlardır (OR:1,82; % 95 CI 1,02-3,26) (Hung ve ark., 2004). Yine beyaz ırktan kişiler ile
yapılan çalışmada, akciğer kanseri ile ilişkisini inceleyen Liu ve arkadaşları Val/Val genotipi
için OR değerini 1,73 olarak vermişlerdir (OR:1,73; %95 CI 1,29-2,31) (Liu ve ark., 2004).
Val allelinin farklı kanser tiplerinde riskli oluşu Val allelinin ß tabakalı yapısı nedeniyle
aktivitesinin azlığına bağlanmaktadır. Düşük aktiviteli enzim ile ROT’lara karşı yeterince
savunma sağlanamadığından hücrelerin mutasyonlara ve kansere açık olduğu
düşünülmektedir (Hung ve ark., 2004). Yapılan bir çalışmanın gösterdiğine göre malignant
hücre dizilerinde SOD2 aktivitesi sağlam hücrelerden azdır. (Weydert ve ark., 2006).
Bununla beraber kanser riskini Ala veya Val genotipi için istatistiksel anlamlı bulmayan
çalışmalarda mevcuttur. Prostat kanseri ile SOD2 polimorfizm ilişkisini araştıran çeşitli
çalışmalarda da istatistiksel anlamlı sonuç bulunmamıştır (Arsova-Sarafinovska ve ark., 2008,
Woodson ve ark., 2003).
Farklı organ kanserleri içinde SOD2 polimorfizim ilişkisine bakılmış. Yumurtalık kanseri
(Johnatty ve ark., 2007), idrar kesesi kanseri (Terry ve ark., 2005), özofagal kanser (Murphy
ve ark., 2007), kolorektal adenom (Levine ve ark., 2002), akciğer kanseri (Lin ve ark., 2003)
için yapılmış çalışmalarda anlamlı sonuç gösterilmemiştir.
12
Türkiye’de SOD2 polimorfizmi ile çeşitli hastalıklar için yapılmış çalışmaların sonuçları
da farklılık göstermektedir. Meme kanseri için yapılmış iki çalışmada (Kocabaş ve ark., 2005,
Eras-Erdoğan ve ark., 2009), Barret’s özofagus hastalığı için yapılan çalışmada (Kadıoğlu ve
ark., 2010) ve pseudoexfoliation sendromu hastalığı ile polimorfizmin ilişkisinin araştırıldığı
(Yüce ve ark., 2007) çalışmalarda istatistiksel anlamlı sonuç bulunamazken, Akyol ve
arkadaşları şizofreni hastalığında Val/Ala genotipini 1,3 kez kontrol grubunda fazla (Akyol ve
ark., 2005), Tuğcu ve arkadaşları üriner sistemde taş oluşması (Urolithiasis) hastalığında Val
genotipini 2,25 kez riskli bulmuşlardır (OR:2,25; %95 CI 1,26-4,528). Bu çalışmada Val/Val
ve Ala/Val genotipleri birlikte Ala/Ala genotipine karşı incelendiğinde Urolithiasis hastalığı
riskinin 3,65 kez arttığı gösterilmiştir (OR:3,65; %95 CI 0,527-5,170) (Tuğcu ve ark., 2007).
Çalışmalarda çıkan farklılık, bölgelere göre değişiklik gösteren frekansın bir sonucu olabilir.
Çalışmamızda SOD2 Val16Ala genotipi tek başına, baş boyun kanseri hastaları ve kontrol
grubu karşılaştırıldığında yaş, cinsiyet ve sigara değişkenlerinin etkilerine bakılmaksızın
incelendiğinde istatistiksel anlamlı bir sonuç elde edilememiştir. Fakat yaş, cinsiyet ve sigara
kullanımı alışkanlıkları hesaplamalara eklendiğinde SOD2 Val/Ala genotipi 1,9 kez riskli
çıkmıştır (OR: 1,902; %95 CI 1,100-3,284). Mutant genotipin riskli çıkması beklenirken
heterozigot genotipin anlamlı sonuç vermesi Türk populasyonunda heterozigot sıklığının
fazlalığından olabilir.
Diğer bir antioksidan savunma sistemi geni de GPX1’dir. GPX1 geni kodlama
bölgesindeki genetik değişim ya da polimorfizm kanser riskini etkileyebilir (Jefferies ve ark.,
2005). GPX1 geni Pro198Leu polimorfizimi için yapılmış çalışmaların sonuçları Leu allelinin
koruyucu ya da riskli olduğu konusunda tartışmalıdır. Leu allelini riskli olarak belirten
çalışmalarda selenyum bağımlı bir enzim olan GPX1’in Leu alleli taşıyanlarda %10
aktivitesinin düşük olduğu ve selenyum konsantrasyonu arttırıldığında da stimulasyona az
cevap verdiği üzerinde durulmaktadır (Ravn Haren ve ark., 2006). Akciğer kanseri ile GPX1
Pro198Leu polimorfizmi ilişkisi incelendiğinde Amerika’da yapılmış çalışmada [(Yang ve
ark., 2004, (OR değerleri 1,3; %95 CI 0,6-2,6)] ve Çin’de yapılmış bir çalışmada (Lee ve ark.,
2006) Leu alleli riskli bulunmuştur. Lee ve arkadaşları Pro/Leu veya Leu/Leu GPX1
taşıyanların akciğer kanseri riskinin 2 kat fazla olduğunu belirtmiştir (OR: 2,29; %95 CI 1,443,62) p<0.001) (Lee ve ark., 2006).
Amerika’da, meme kanseri için yapılan çalışmada Leu/Leu alleli taşıyanların meme
kanseri grubunda artmış olduğu gözlenmiştir (OR:1,9; %95 CI 1,01-3,57; p<0,05) (Hu ve
Diamond, 2003). Meme kanseri için Danimarkalı kadınlarla yapılmış çalışmada da Leu/Leu
genotipli kişiler 1,4 kez riskli bulunmuştur (Ravn-Haren ve ark., 2006) (OR: 1,43; %95 CI
1,07-1,92) .
Non hodkin lenfoma kanseri üzerine İngiltere’de yapılan, 1446 kontrol ve 928 hasta
içeren geniş örnek sayısına sahip çalışmada Leu/Leu genotipinin 1,2 kez riski arttırdığı
gösterilmiştir (OR: 1,28; %95 CI 0,94-1,75). Daha önce yapılmış bir çalışmada
lenfoproliferatif bozukluklarda GPX aktivitesinin düştüğünün belirtilmesi bu sonucu
açıklamaya yardımcı bir veridir (Lightfoot ve ark., 2006).
Amerika’da, Hu ve arkadaşları, Beyaz ırk ve Afrika kökenli Amerikalı etnik grubundan
kişiler ile yaptıkları çalışmada, baş boyun kanseri ile GPX1 Pro198Leu polimorfizmi arası
ilişkiyi araştırmışlardır. Baş boyun kanserleri içinden, ağız kanseri, farenks ve larinks
kanserlerini incelemişlerdir. Sonuç olarak Leu/Leu genotipini taşıyanları 1,8 kez riskli
bulmuşlardır (OR:1,879; %95 CI 1,14-3,08) (Hu ve ark., 2004). Bu çalışmaların aksine Leu
allelinin çeşitli kanserler için koruyucu olduğunu belirten yayınlar da vardır.
Projemizden elde edilen sonuçlara göre, genel grupta tüm kanserli kişilere karşı kontrol
grubu genlerin teker teker kanser riski üzerine etkisi için karşılaştırıldığında, yaş cinsiyet ve
sigaranın etkisi ile birlikte SOD2 heterozigot genotipli bireyler 1,9 kez riskli çıkmıştır (OR:
1,902; %95 CI 1,100-3,284). Genel grupta çıkan bu değerin sigara içenler ve erkekler
13
gruplarından düşük çıkmasının nedeni cinsiyet ve sigaranın riski arttırıcı değişkenler
olmasından kaynaklanabilir.
Çalışmaya katılan kişileri erkekler ve kadınlar olarak iki grupta incelediğimizde erkek
grubunda Leu/Leu genotipi taşımak baş boyun kanseri için 2,1 kat fazla risk oluşturmaktadır
(OR:2,148; %95 CI 1,001- 4,611; p:0,05). Kadınlar için GPX1 polimorfizminin anlamlı bir
sonuç vermemesi kadın numune sayısının az olmasından kaynaklanabilir. Erkekler ayrı
incelendiğinde GPX1 mutant genotipi için anlamlı sonuç çıkarken kadınlarda çalışma grubuna
eklendiğinde anlamsız çıkması, hasta ve kontroller arası frekans farklarının azalıyor olması ile
de açıklanabilir.
Erkekler grubunda genler tek başına incelendiğinde kontrol grubu ile karşılaştırmada
SOD2 heterozigot genotipli bireyler 1,8 kez (OR: 1,829; %95 CI 1,061-3,151), SOD2
heterozigot ve mutant bireyler birlikte kontrol grubuna karşı karşılaştırıldığında 1,6 kez
(OR:1,688; %95 CI 1,010-2,821) YHBB kanseri için riskli çıkmıştır. SOD2 heterozigot
genotipli bireyler için risk, yaş ve sigara etkisi eklendiğinde 2 kata, SOD2 heterozigot ve
mutant bireyler birlikte gruplandığında yaş, sigara etkisi ile risk 1,79 kat çıkmaktadır. OR
değerleri sırasıyla 2,062; %95 CI 1,116-3,811) ve 1,798; %95 CI 1,010-3,201) dir. Yaş ve
sigaranın erkekler grubunda risk arttırıcı değişkenler oldukları görülmektedir.
Bolzan ve arkadaşlarının yaptıkları çalışmaya göre SOD2 enzim aktivitesi kadınlarda
erkeklere göre yüksek seviyelerde bulunmuştur (Bolzan ve ark., 1997). Erkeklerde düşük
enzim aktivitesine sahip olması kanser riskinde artışa sebep olmuş olabilir. SOD2 enzimi
sağlıklı insanlarda düşük aktivite ile yüksek aktivite değerleri arasında 56 kat fark olduğu ve
kadınlarda erkeklere göre enzim aktivitesinin %15 daha fazla olduğu belirtilmiştir (Bastaki ve
ark., 2006). Bu verilere göre SOD2 heterozigot genotipli kişilerin yabanıl tip taşıyanlara göre
kanser riskinin yüksek olması açıklanabilir.
Sigara içenler grubunda yaş ve cinsiyet değişkenlerinin etkisi eklenerek genlerin teker
teker kanser riski için incelendiği durumda SOD2 heterozigot genotipli bireyler erkekler
grubundan biraz daha yüksek çıkmıştır. Risk 2 kattan 2,1’e yükselmiştir. SOD2 heterozigot
genotipinin, sigaranın içerdiği oksidan maddelere karşı antioksidan savunmadaki eksikliği,
sigaranın kullanımıyla birlikte riskin artışıyla görülmektedir. Sigara içenler grubunda GPX1
mutant genotipinin kanser riskine etkisi erkekler grubundan fazladır. Erkeklerde 2,1 kat iken
risk sigara içenlerde 2,3 kat bulunmuştur.
Genlerin etkileri teker teker incelendiğinde antioksidan savunma sisteminde yer alan
SOD2 heterozigot ve GPX1 mutant genotiplerinin kanser riski değerlerinin sigara içenlerde
fazla çıkması, sigarada yer alan reaktif oksijen bileşiklerinin insan sağlığı üzerine zararlı
etkilerini göstermesi açısından dikkat çekicidir.
GPX1 Leu varyantının her allel için GPX1 aktivitesini %5 düşürdüğü gözlenmiştir. Ve
sigara içilmesi GPX1 aktivitesini azaltır (Ravn-Haren ve ark., 2006). Dolayısıyla GPX1
mutantın etkinliği iyice azalmıştır. H2O2’yi yeterince ortamdan uzaklaştıramadığından OH•
radikali üretimi fazlalığı ile oluşan ROT’ler, DNA ve diğer moleküllere bağlanır. Oluşan
mutasyonlar kanserin oluşması için başlangıç aşamasını meydana getirirler. Bu nedenle sigara
içen GPX1 mutant genotipini taşıyan kişilerde kanser riski yüksek çıkmış olabilir.
Çizelgelerde görüldüğü üzere kanser riski için tüm gruplarımız incelemeye alındığında
genlerin ikili ve üçlü birlikteliklerinde elde edilen değerler artmaktadır. Yaşın artışı ile
vücutta birikmiş kanserojen maddelerin artışı, sigara kullanımı ile yaşam sırasında maruz
kalınan kimyasal maddelere kişinin kendi isteği ile fazladan kanserojen maddelerin ilavesi ve
erkeklerin kanserojen maddelere mesleksel maruziyetlerinin daha fazla olması nedeniyle; bu
değişkenler, YHBB kanseri riski için bulunan sonuçları etkilemektedir.
Çalışmamızda incelediğimiz, GPX1 Pro198Leu, SOD2 Val16Ala polimorfizmlerinin
kontrol grubundaki dağılımlarının yapılmış diğer çalışmalarda Avrupa beyaz ırkı ile benzerlik
gösterdiği görülmüştür.
14
Elde edilen sonuçlara göre;
Genlerin kanser üzerine etkisi teker teker incelendiğinde GPX1 mutant ve SOD2
heterozigot genotipli bireylerin kanser riskinin kontrol grubuna yüksek olduğu gözlenmiştir.
Antioksidan savunma mekanizmasında yer alan bu genlerdeki polimorfizmlerin enzim
aktivitelerini azalttığını göstermiş yayınlar mevcuttur. Bu sonuçlara göre kanser riskinde
gözlenen artış anlamlıdır.
Genlerin teker teker incelenmesinde riskli gözlenen genotiplerin ikili ve üçlü
birlikteliklerinde farklı sonuçlar göstermesi kanser gelişiminin ne kadar karmaşık bir
mekanizmaya sahip olduğunu göstermektedir. Antioksidan savunma genlerinin ve DNA
onarım genlerinin polimorfizmlerinin kanserle ilişkilerinin incelenmesi kanser gelişiminde
hangi metabolik yolakların etkili olduğunun anlaşılmasında ve uygun tedavi şekillerinin
geliştirilmesinde yardımcı olacaktır.
Hücrelerde oluşan serbest oksijen radikallerinin toksik etkilerini ortadan kaldırmak için
çalışan antioksidan enzimler ve bu enzimleri kodlayan genlerdeki genetik polimorfizmler
çeşitli hastalıkların gelişiminde önemli rol oynamaktadır. Çalışmamızda incelediğimiz
polimorfizm ve baş boyun bölgesi kanseri gelişiminde önemli bir rolünün olamayabileceği
bulunsa da hastalık gelişiminde rol oynayabilecek diğer metabolik yolaklardaki ya da
antioksidan enzimleri kodlayan genlerdeki değişikliklerin araştırılmasında yarar vardır.
VI. Kaynaklar
Akyol O, Yanik M (2005) Association between Ala–9Val polymorphism of Mn-SOD gene
and schizophrenia. Progress in Neuro-Psychopharmacology & Biological Psychiatry, 29:
123-131.
Ambrosone CB, Freudenheim JL, Thompson PA, Bowman E (1999) Manganese superoxide
dismutase (MnSOD) genetic polymorphisms, dietary antioxidants, and risk of breast cancer.
Cancer Research, 59: 602-606.
Arsova-sarafinovska Z, Matevska N, Eken A, Petrovski (2009) Glutathione peroxidase 1
(GPX1) genetic polymorphism, erythrocyte GPX activity, and prostate cancer risk. Int. Urol.
Nephrol, 41: 63-70.
Bastaki M, Huen K, Manzanillo P, Chande N, Chen C, Balmes JR, Tager IB, Holland N
(2006) Genotype- aktivity relationship for Mnsuperoxide dismutase, glutathione peroxide 1
and catalase in humans. Pharmacogenet Genomics, 16: 279-286.
Bergman M, Ahnström M, Wegman PP, Wingren S (2005) Polymorphism in the manganese
superoxide dismutase (MnSOD) gene and risk of breast cancer in young women. J. Cancer
Res. Clin. Oncol., 131: 439-444.
Bica CG, de moura DS, Toscani NV, da cruz IBM (2009) MnSOD gene polymorphism
association with steroid-dependent cancer. Pathol. Oncol. Res., 15: 19-24.
Bolzan AD, Bıanchı MS, Stor N, Bıanchı O (1997) Superoxide dismutase, catalase and
glutathione peroxidase activities in human blood: influence of sex, age and cigarette smoking.
Clinical Biochemistry, 30: 449–454.
Egan KM, Thompson PA, Titus-ernstoff L, Moored JH, Ambrosone CB (2003) MnSOD
polymorphism and breast cancer in a population-based case–control study. Cancer Letters,
199: 27-33.
Eras-erdogan N, Akbas E, Senli H, Kul S, Çolak T (2009) Relationship between
polymorphism in the manganese superoxide dismutase gene and breast cancer. Mutation
Research, 680: 7-11.
15
Ezzikouri S, El feydi AE, Chafik A (2008) Genetic polymorphism in the manganese
superoxide dismutase gene is associated with an increased risk for hepatocellular carcinoma
in HCV-infected Moroccan patients. Mutation Research, 649: 1-6.
Forastiere AA ve ark (2008) Head and neck cancers. J Natl Compr Canc Netw., 6(7): 646-95.
Forsberg L, de Faire U, Morgenstern R (2001) Oxidative Stress, Human Genetic Variation,
and Disease. Archives of Biochemistry and Biophysics, 389: 84-93.
Forsberg L, Lyren L, de Faire U, Morgenstern RA (2001) Common functional C-T
substitution polymorphism in the promoter region of the human catalase gene influences
transcription factor binding, reporter gene transcription and is correlated to blood catalase
levels. Free Radic Biol Med., 30(5): 500-5.
Grasbon-Frodl EM, Riess O, Mller U, Mehraein P, Graeber MB(1999) Analysis of
mitochondrial targeting sequence and coding region polymorphisms of the manganese
superoxide dismutase gene in German Parkinson disease patients. Biochem Biophys Res
Commun., 255(3): 749-52.
Hu YJ, Dolan ME (2004) Allelic loss at the GPX-1 locus in cancer of the head and neck.
Biological Trace Element Research, 101: 97-106.
Hung RJ, Boffetta P, Brennan P (2004) Genetic polymorphisms of MPO, COMT, MnSOD,
NQO1, interactions with environmental exposures and bladder cancer risk. Carcinogenesis,
25: 973-978.
Iguchi T, Wang CY, Delongchamps NB, Sunheimer R, Nakatani T, RozaG, Haas GP (2008).
Association of prostate cancer and manganese superoxide dismutase AA genotype ınfluenced
by presence of occult cancer in control group. Urology, 72: 238-242.
Indulski JA, Lutz W (2000) Metabolic genotypes in relation to individual susceptibility to
environmental carcinogens. Int. Arch. Occup. Environ. Health, 73: 71-85.
Jefferies S ve ark., (2005) Association between polymorphisms of the GPX1 gene and second
primary tumours after index squamous cell cancer of the head and neck. Oral Oncology, 41:
455-461.
Johnatty SE, Nagle CM, Spurdle AB, Chen X (2007) The MnSOD Val9Ala polymorphism,
dietary antioxidant intake, risk and survival in ovarian cancer (Australia). Gynecologic
Oncology, 107: 388-391.
Kadıoğlu E, Sardaş S, Ergün M, Ünal S, Karakaya AE (2010) The role of oxidative DNA
damage, DNA repair, GSTM1, SOD2 and OGG1 polymorphisms in individual susceptibility
to Barret’s esophagus. Toxicol. Ind. Health, 26: 67-79.
Karihtala P, Soini Y (2007) Reactive oxygen species and antioxidant mechanisms in human
tissues and their relation to malignancies. APMIS, 115(2):81-103.
Knight JA, Onay UV, Wells S, Ozcelik H ( 2004). Genetic variants of GPX1 and SOD2 and
breast cancer risk at the Ontario site of the Breast Cancer Family Registry. Cancer
Epidemiology, Biomarkers & Prevention, 13: 146-149.
Kocabaş NA, Şardas S, Cholerton S, Daly AK, Elhan AH, Karakaya AE (2005) Genetic
polymorphism of manganese superoxide dismutase (MnSOD) and breast cancer susceptibility
cell biochemistry and function. Cell Biochem Funct, 23: 73-76.
Lee C, Lee KY, Choe K, Hong Y (2006) Effects of oxidative DNA damage and genetic
polymorphism of the glutathione peroxidase 1 (GPX1) and 8-oxoguanin glycosylase 1
(hOGG1) on lung cancer. J.Prev. Med. Public Health, 39: 130-134.
Levine AJ, Elkhouly E, Diep AT, Lee ER, Frankl H, Haile RW (2002) The MnSOD A16V
mitochondrial targeting sequence polymorphism is not associated with increased risk of distal
colorectal adenomas: data from a sigmoidoscopy based case control study. Cancer
Epidemiology, Biomarkers & Prevention, 11: 1140–1141.
16
Lightfoot TJ, Skibola CF, Smith AG, Forrest MS (2006) Polymorphisms in the oxidative
stress genes, superoxide dismutase, glutathione peroxidase and catalase and risk of nonHodgkin’s lymphoma. Haematologica, 91: 1222-1227.
Lin P, Hsueh Y, Ko J, Liang Y, Tsai K, Chen C (2003) Analysis of NQO1, GSTP1, and
MnSOD genetic polymorphisms on lung cancer risk in Taiwan. Lung Cancer, 40: 123-129.
Liu G, Zhou W, Park S, Wang LI, Miller DP (2004) The SOD2 Val/Val genotype enhances
the risk of nonsmall cell lung carcinoma by p53 and XRCC1 polymorphisms. Cancer, 101:
2802–2808.
Mena, S, Ortega A, Estrela JM (2009) Oxidative stress in environmental- induced
carcinogenesis. Mutation Research, 674: 36-44.
Mitrunen K., Sillanpaa P, Kataja V (2001) Association between manganese superoxide
dismutase (MnSOD) gene polymorphism and breast cancer risk. Carcinogenesis, 22: 827829.
Murphy SJ, Hughes AE, Patterson CC, Anderson LA (2007) A population-based association
study of SNPs of GSTP1, MnSOD, GPX2 and Barrett’s esophagus and esophageal
adenocarcinoma. Carcinogenesis, 28: 1323-1328.
Ratnasinghe D, Tangrea JA, Andersen MR, Barrett MJ, Virtamo J, Taylor PR, Albanes D
(2000) Glutathione peroxidase codon 198 polymorphism variant increases lung cancer risk.
Cancer Res., 60(22): 6381-3.
Ravn-haren G, Olsen A (2006) Associations between GPX1 Pro198Leu polymorphism,
erythrocyte GPX activity, alcohol consumption and breast cancer risk in a prospective cohort
study. Carcinogenesis, 27: 820-825.
Ringström E, Peters E, Hasegawa M, Posner M, Liu M, Kelsey KT (2002) Human
papillomavirus type 16 and squamous cell carcinoma of the head and neck. Clin Cancer Res.,
8(10):3187-92.
Sturgis EM., Wei Q (2002) Genetic susceptibility molecular epidemiology of head and neck
cancer. Current Opinion in Oncology,14: 310-317.
Terry PD, Umbach DM, Taylor JA (2005) No association between sod2 or nqo1 Genotypes
and Risk of Bladder Cancer. Cancer Epidemiology, Biomarkers & Prevention; 14: 753-754.
Tuğcu V, Özbek E, Aras B, Arisan S, Çaskurlu T, Tascı Aİ (2007) Manganese superoxide
dismutase (Mn-SOD) gene polymorphisms in urolithiasis. Urol. Res., 5:219-224.
Valavanidis A, Vlachogianni T, Fiotakis K (2009) Tobacco smoke: involvement of reactive
oxygen species and stable free radicals in mechanisms of oxidative damage, carcinogenesis
and synergistic effects with other respirable particles. Int J Environ Res Public Health.,
6(2):445-62.
Valko M, Leibfritz D, Moncol J, Cronin MT, Mazur M, Telser J (2007) Free radicals and
antioxidants
in
normal
physiological
functions
and
human
disease.
Int J Biochem Cell Biol., 39(1):44-84
Weydert CJ, Waugh TA, Ritchie JM, Iyer KS, Smith JL (2006) Overexpression of manganese
or copper–zinc superoxide dismutase inhibits breast cancer growth. Free Radical Biology &
Medicine, 41: 226-237.
Woodson K, Tangrea JA, Lehman TA (2003) Manganese superoxide dismutase (MnSOD)
polymorphism, a-tocopherol supplementation and prostate cancer risk in the AlphaTocopherol, Beta-Carotene Cancer Prevention Study (Finland). Cancer Causes and Control,
14: 513-518.
Yang P, Bamlet WR, Ebbert JO, Taylor WR, de andrade M (2004) Glutathione pathway
genes and lung cancer risk in young and old populations. Carcinogenesis, 25: 1935-1944.
Yüce H, Hepsen IF, Tekedereli I, Keskin U, Elyas H, Akyol O (2007) Lack of association
between pseudoexfoliation syndrome and manganese superoxide dismutase polymorphism.
Current Eye Research, 32: 387-391.
17
VII. Ekler
a) Mali Bilanço ve Açıklamaları
Bu araştırma projesinde makine ve donanım (03.7+06.1+06.3) için 3250
YTL+KDV ve sarf malzemesi (03.2) için 26600YTL+KDV olmak üzere toplam
29850 YTL bütçe sunulmuştur. Satın alımlar Bilimsel Araştırma Projeleri
Koordinasyon Birimi tarafından gerçekleştirilmiştir. Satın alımlarda projede yer
alan kalemlerin hepsi sağlanmıştır.
b) Makine ve Teçhizatın Konumu ve İlerideki Kullanımına Dair Açıklamalar
Proje ile satın alınan makine ve teçhizat, mini ve midi yatay jel elektroforez seti,
masa üstü mini santrifüj ve mini manyetik karıştırıcıdır. Bunlar şu anda Ankara
Üniversitesi Eczacılık Fakültesi Farmasötik Toksikoloji araştırma laboratuvarında
bulunup, fakülte demirbaş listesinde yer almaktadır. Şu anda aktif durumda olup
anabilim dalı ve fakülte araştırıcıları tarafından gerekli deneylerde
kullanılmaktadırlar.
c) Teknik ve Bilimsel Ayrıntılar (varsa Kesim III'de yer almayan analiz ayrıntıları)
d) Sunumlar (bildiriler ve teknik raporlar) (Altyapı Projeleri için uygulanmaz)
Sakallı, Ö., Duydu, Y., Süzen, HS. Glutathione Peroxidase (GPX1) Polymorphism in a
Turkish Population 8th International Symposium on Pharmaceutical Sciences (ISOPS-8), June
13-16, 2006, Ankara, Turkey.
Suzen S, Gucyener E, Turanli M, Kilic C, Kose G. CAT gene C(-262)T Polymorphism in
Oral Cancer. 45th Congress of the European Societies of Toxicology, October 5-8, 2008,
Rhodes, Greece.
Suzen HS, Gucyener E, Kilic C, Kose G, Duydu Y. Polymorphism of the antioxidant gene
CAT in laryngeal cancer. 10th ICEM Firenze, Italy, August 20-25, 2009.
e) Yayınlar (hakemli bilimsel dergiler) ve tezler (Altyapı Projeleri için
uygulanmaz)
Suzen HS, Gucyener E, Sakalli O, Uckun Z, Kose G, Ustel D, Duydu Y. CAT C-262T and
GPX1 Pro198Leu polymorphisms in a Turkish population. Molecular Biology Reports, 37
(1): 87-92, 2010 (DOI: 10.1007/s11033-009-9540-4).
18