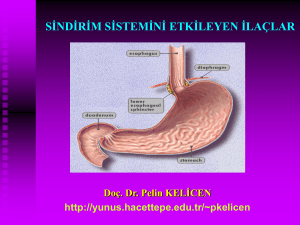
tc sağlık bakanlığı okmeydanı eğđtđm araştırma hastanesđ 3. đç
advertisement

T. C. SAĞLIK BAKANLIĞI OKMEYDANI EĞĐTĐM ARAŞTIRMA HASTANESĐ 3. ĐÇ HASTALIKLARI KLĐNĐĞĐ ŞEF: DOÇ. DR. NECATĐ YENĐCE RAMAZAN AYINDA ÜST GASTROĐNTESTĐNAL SĐSTEM KANAMALARI SIKLIĞI NASIL DEĞĐŞĐR? (UZMANLIK TEZĐ) DR. M. HANĐFĐ KILIÇASLAN ĐSTANBUL 2007 ÖNSÖZ Sağlık Bakanlığı Okmeydanı Eğitim Araştırma Hastanesi Başatabibi sayın Dr.Hayri Özgüzel’e teşekkür ederim. Uzmanlık eğitimim boyunca bana her türlü maddi ve manevi desteği sunan, iyi bir klinisyen olmam için bilgi ve deneyimlerini paylaşan ve sabırla öğretmeye çalışan saygıdeğer hocam; 3.Đç Hastalıları Klinik Şefi Doç.Dr. Necati Yenice’ye saygı ve teşekkürlerimi sunarım. Asistan dönemimde büyük katkıları olan Klinik Biyokimya Şefi Doç.Dr. Sembol Yıldırmak’a ve Enfeksiyon Hastalıkları Klinik Şefi Uz.Dr. Taner Yıldırmak’a teşekkür ederim. Engin tecrübeleri ve klinik deneyimleri ile her zaman bana yol gösteren klinik şef yardımcımız Uzm.Dr.Kemal Kutoğlu’na, yakınlık ve desteklerini esirgemeyen servisimizin çok değerli uzman doktorları, Dr.Đsmail Arıkoğlu, Dr.Nevzat Aksoy, Dr.Nurten Arıcan, Dr.Yasemin Gökten, Dr.M.Mübeccel Aras ve Dr.Özgür Mehtap’a her alandaki katkılarından dolayı teşekkür ederim. Değerli dostlarım; Dr.Servet Yoılbaş , Dr.Cumali Karatoprak, Dr.Mustafa Oran ve Dr.Mahmut Altındal’a katkı ve yardımlarından dolayı teşekkürlerimi sunarım. Birlikte çalışmaktan mutluluk duyduğum asistan doktor arkadaşlarıma, hemşire hanımlara ve servisimizin yardımcı personellerine teşekkürlerimi sunarım. Eğitimim boyunca her türlü fedakarlıktan kaçınmayan babama ve tüm aileme, son olarak her zaman yanımda olan eşim Fatma’ya ve biricik kızım Mihrimah Zehra’ya sonsuz sevgi ve teşekkürler. Dr.M.Hanifi Kılıçaslan 2 ĐÇĐNDEKĐLER Sayfa no 1-ÖNSÖZ 2 2-GĐRĐŞ ve AMAÇ 4 3-GENEL BĐLGĐLER 6 4-MATERYAL VE METOD 45 5-BULGULAR 46 6-TARTIŞMA 50 7-SONUÇ 56 8-KAYNAKLAR 57 3 2.GĐRĐŞ ve AMAÇ Üst gastrointestinal sistem kanamaları; intraluminal gastrointestinal traktusun, özofagus üst kısmı ile duodenumda Treitz ligamenti seviyesi arasındaki herhangi bir lokalizasyonundan olan kan kaybıdır(1). Gastrointestinal sistem kanamaları ciddi morbidite, mortalite, iş gücü kaybı ve hastane masrafına yol açan klinik bir sorundur. Gastrointestinal sistem kanamalrının genellikle %80-85 i üst gastrointestinal sistem kaynaklıdır. Vakaların %80’ni kendiliğinden durmakla beraber %20’lik bir kısmı ağır seyreder. ABD’de her yıl yaklaşık 300 000 kişi bu tanı ile hospitalize edilmektedir(2). Üst gastrointestinal sistem kanaması nedeniyle her yıl ABD’de 20 000 kişi hayatını kaybetmektedir, yani mortalite oranı hala yüksek olup tüm yeni tıbbi gelişmelere rağmen, ortalama %2-10 civarındadır, mortalite oranı yaşla yakından ilişkilidir, öyleki 60 yaşın altında mortalite oranı %8 iken, 60 yaşın üstünde bu aran %13’e çıkmaktadır. Son 50 yıl içerisinde yoğun bakım uygulamalarındaki ilerlemelere, güçlü antisekretuar ilaçların gelşitirilmesine ve akut gastrointestinal kanamada yeni tanısal ve terapötik teknolojilere rağmen, mortalite oranları 1945’ten bu yana önemli ölçüde değişmemiştir(3). Gastrointestinal sistem kanamalarının ortalama sıklığı 100 binde 50100 civarında olup, Avrupa ve ABD ortalaması %0,1 civarındadır.(1,4). Üst gastroinestinal sistem (GĐS) kanamaları geleneksel olarak , varis kaynaklı kanama ve varis dışı kanama olarak sınıflandırılır. Gastroözofagial varisler, portal hipertansiyon sonucu genişlemiş venöz kollaterallerdir. Varisler tedricen genişler ve rüptüre olarak masif üst gastrointestinal hemorajiye neden olurlar. Varis dışı kanamalar, özofagial veya gastrodoudenal mukozanın ülserasyonu ya da alttaki damarın erozyonu sonucu ortaya çıkar. Gastroduodenal ülserler, gastrik ve duodenal erozyonlar veya maligniteler, Mallory-Weiss yırtıkları ve Dieulafoy lezyonları üst gastronitestinal kanamadan sorumlu varis dışı bazı örneklerdir. Gastrointestinal sistem kanamalarının çoğunluğunu; en sık duodenal ülser olmak üzere, mukozal lezyon kaynaklı patolojiler oluşturur(5). Biz bu araştırmamızda beslenme alışkanlığı değişikliği ve açlığın olası etkilerinin üst GĐS kanamalırı sıklığı üzerinde nasıl bir değişiklik yaptığını inceledik. Müslüman toplumlarda ve ülkemizde her yıl ortalama 30 gün kesintisiz süren, mevsimsel değişikliklerle birlikte günlük 11-18 saatlik açlığın olduğu ramazan ayında, toplumun özellikle erişkin kesiminin çoğunluğunun bu ibadeti yerine getirdiği çeşitli sosyolojik saha araştırmalarıyla ortaya konmuştur(6). Bu beslenme alışkanlığı değişikliklerinin yol açabileceği medikal 4 problemler var mı? Varsa, bu medikal problemlerden kaynaklanabilecek; insan sağlığı, ekonomik ve sosyal durum, iş gücü kayılpları, yaşam kalitesi vs.gibi durumlar nasıl değişir? gibi bir takım sorulardan yola çıkarak biz de yaşadığımız toplumu yakından ilgilendiren bir araştırma planladık. 5 3.GENEL BĐLGĐLER I-ÜST GASTROĐNTESTĐNAL SĐSTEM FĐZYOLOJĐSĐ Gastrointestina kanalın tamamı bazı genel yapısal özellikler gösterir. Ortasında değişen çaplarda bir lümen içerir. Bu lümen dört ana tabakadan oluşan bir duvarla çevrilidir. Đçten dışa doğru sırasıyla, mukoza, submukoza, muscularis ve seroza. Mukoza; Epitelyal örtü, lamina propria ve muscularis mukozadan oluşmuştur. Lamina propria, kan ve lenf damarlarından zengin gevşek bağ dokusudur. Düz kas hücreleri, bazen de bezler lenfoid doku içerier. Muscularis mukoza ise mukozayı submukozadan ayıran içte ince sirküler, dışta longitudinal düz kas hücrelerinin oluşturduğu tabakalardan ibarettir. Mukoza sıklıkla mukoz membran olarak isimlendirilir. Submukoza; Çok sayıda kan ve lenf damarları ve submukozal bir sinir plexusu (ya da Meissner plexusu olarak isimlendirilen) içeren gevşek bağ dokusudur. Aynı zamanda bezler ve lenfoid doku da içerir. Muscularis; Muscularis tabakası sipiral olarak düzenlenme gösteren ve asıl yönü kas hücrelerinin yönüne göre düzenlenen 2 tabakadan oluşmuştur. Lümene yakın iç tabakada kasların yönü genellikle sirküler, dış tabakada ise longitudinaldir. Bu iki kas tabakası arasında myenterik ( ya da Auerbach) sinir plexusu ile kan ver lenf damarları içeren bağ dokusu bulunur. Seroza; Seroza ince bir gevşek bağ dokusu tabakasıdır. Kan ve lenf damarları ve yağ dokusundan zengindir. Tek katlı yassı epitelle yani mezoteliumla örtülüdür. Özofagus histolojisi Gastrointestinal kanalın bu parçası musculer bir borudur ve fonksiyonu yiyecekleri ağızdan mideye taşımaktır. Keratinleşmemiş çok katlı yassı epitelle örtülüdür. Genellikle, sindirim kanalının geri kalan parçalarıyla aynı tabakları taşır. Submukaozada mukus salgılayan küçük bez grupları özofagus bezleri vardır. Mideye yakın bölümünün lamina propriasında gruplar halinde mukus salgılayan özofagial kardia bezleri bulunur. Özofagusun distal ucunda musculer tabaka sadece düz kas hücrelerinden oluşur; orta parçada çizgili ve düz kas hücreleri, proksimal uçta ise yine sadece çizgili kas hücreleri vardır. Özofagusun sadece periton boşluğundaki kısmı seroza ile kaplıdır. Geri kalan gevşek bağ dokusu tabakası ile örtülüdür. Adventitia adı verilen bu tabaka çevre doku ile karışır. 6 Mide Histolojisi Mide, yiyecekleri sisndiren ve hormon salgılayan hem eksokrin hemde endokrin birorgandır. Ana fonksiyonları; ağızda başlayan karbonhidrat sindirimini devam ettirmek, sindirilmiş yiyeceklere asidik bir sıvı eklemek, bunları musculer aktivite ile viskoz bir kitle haline dönüştürmek, pepsin enzimi ile protein sindirimini başlatmaktır. Makroskopik olarak 4 bölgede ayırdedilir; kardia, fundus, corpus, pylor. Fundus ve corpus histolojik yapı olarak aynıdır. Midenin luminal yüzeyi küçük büyütme ile incelendiğinde, çok sayıda küçük sirküler ya da ovoid epitel invaginasyonları gözlenir. Yüzeyi ve gastrik çukurcukları örten epitel tek katlı prizmaitik epiteldir ve hücrelerin hepsi mukus salgılar, salgılanan mukus kalın bir tabaka oluşturarak hücreleri mide tarafından salgılanan kuvvetli asidin etkisinden korur. a-Kardiak bölge; Kardiya 1,5-3 cm genişliğinde, dar sirkuler bir şerittir. Özofagus ile mide arasında geçit oluşturur. Lamina propriası basit ya da dallanmış kardiak bezler içerir,salgı yapan hücrelerin çoğu mukus ve lizozim salgılar, ancak HCl salgılayan birkaç pariyetal hücrede bulunabilir. b-Fundus ve Corpus; Bu bölümlerin lamina propriası dallanmış, tubuler gastrik(fundic) bezlerle doludur. Bunların 3-7’si birlikte bir gastrik çukurcuğa açılır. Gastrik bezlerdeki epitelyal hücrelerin dağılımı düzenli değildir. Bezlerin boyun parçasında; farklılaşmamış hücreler, parietal hücreler ve mukoz boyun hücreleri, tabanında ise parietal hücreler, asıl (zymogen) hücreler ve enteroendokrin hücreler bulunur. 1. Farklılaşmamış hücreler: Boyun bölgesinde az sayıda bulunur. Kısa silindirik hücrelerdir. Nucleusları oval ve hücre tabanına yakındır. Bu hücreler yüksek mitotik aktiviteye sahiptir, turnover süresi 3-7 gündür, bazı farklılaşmamış hücreler bezlerin derin kısmına göç ederek , mukuz boyun hücreleri, pariaetal, asıl ve enteroendokrin hücrelere farklılaşırlar. 2. Müköz boyun hücreleri: Bu hücreler gastrik bezlerin boyun parçalarındaki parietal hücreler arasında kümeler halinde ya da tek olarak bulunur. 3. Parietal(Oxynitic) hücreler: Parietal hücreler daha çok gastrik bezlerin üst yarısında bulunur, tabanında çok seyrektir. Yuvarlak ya da pyramidal hücrelerdir. Parital hücreler gastrik sıvıda bulunan hidroklorik asit sentezini yapar. Bu hücreler 0,16 mol/L HCl asit, 0,07 mo/L KCl, eser miktarda diğer elektrolitler ve gastrik intrinsik faktör salgılar. Salgılanan asit kanda bulunan kloridlere karbonik anhidarz enziminin etkisiyle oluşan bir katyonun (H+) eklenmesiyle oluşur. Karbonik anhidraz CO2 7 üzerine etki ederek , karbonik asidi oluşturur, bu da bikarbonat ve hidrojene ayrışır. Katyon ve klorid iyonu hücre membranından aktif transportla geçer, su pasif olarak difuze olur. 4. Esas (Zymogenic) hücreler: Esas hücreler protein sentezi yapan ve salgılayan hücrelerin bütün özelliklerine sahiptir. Sitoplazmalarındaki granüllerde inaktif pepsinojen bulunur. Đnsanda bu hücreler pepsin ve lipaz enzimlerinin sentezini yapar. 5. Enteroendokrin hücreler: Serotonin salgılarlar c-Pilor Gastrin salgılayan gastrin(G) hücreleri pilor bezlerinin müköz hücreleri arasında bulunur. Gastrin, gastrik bezlerin parietal hücreleri tarafından sentezlenen asidin salgılanmasını uyarır. Diğer enteroendokrin hücreler( D hücreleri), somatostatin salgılar ve gastrin dahil diğer hormonların salınımını inhibe eder.(7) ÜST GASTROĐNTESTĐNAL SĐSTEMDE SĐNDĐRĐM MEKANĐZMALARI Gastrointestinal tarctus; elektrolitler, su ve besinleri sürekli olarak vücudun kullanımına verir. Bunu gerçekleştirmek için 1. Gıdaların sindirim kanalında hareketi, 2. Sindirim salgılarının salgılanması ve besin sindirimi, 3. Sindirim ürünleri, su ve çeşitli elektrolitlerin emilimi, 4. Emilen maddeleri uzaklaştırmak için gastrointestinal organlarda kanın dolaşımı, 5. Tüm bu fonksiyonların sinirsel ve hormonal mekanizmalarla kontrolü gerekmektedir. MĐDE SEKRESYONU Midenin tüm yüzeyini kaplayan mukus salgılayan hücrelere ek olarak mide mukozasında iki önemli tip tubuler bez bulunur. Bunlar oksinitik(gastrik) bezler ve pilorik bezlerdir. Osinitik(asit oluşturan) bezler; HCl, pepsinojen, intrensek faktör ve mukus salgılarlar. Pilorik bezler esas olarak pilor mukozasını koruyan mukus ve bir miktar pepsinojen ve çok önemlisi de gastrin hormonu salgılarlar. 8 1.Oksintik Bezlerin sekresyonları, Oksinitik bezler üç tip hücreden oluşmuştur. Esas olarak mukus ve bir miktar pepsinojen salgılayan mukoz boyun hücreleri, büyük miktarda pepsinojen salgılayan peptik(esas) hücreler ve hidroklorik asit ve intrensek faktör salgılayan paryetal(oksinitik) hücrelerdir. 2.HCl asit sekresyonunun ana mekanizması; Pariyetal hücreler uyarıldıkları zaman litresinde yaklaşık 160 mmol HCl içeren ve hemen tamamen vücut sıvıları ile izotonik olan bir asit solusyon sağlarlar. Bu asidin pH sı yaklaşık 0,8 dir ve bu da sıvının aşırı dercede asidik olduğunu gösterir. Hidrojen iyon konsantrasyonu bu pH düzeyinde arteriyel kandakinden yaklaşık 3 milyon kez daha fazladır. Hidrojen iyonlarını konsanter etmek için gastrik sıvının her litresi için 1500 kaloriden daha fazla enerji gerekmektedir. 3.Pepsinojen sekresyonu ve aktivasyonu; Gastrik bezlerin peptik ve mukoz hücrelerden, farklı tiplerde pepsinojen salgılanır. Buna karşın pepsinojenlerin tümü aynı fonksiyonlara sahiptir. Pepsinojenler ilk salgılandıklarında sindirim aktiviteleri yoktur. Ancak HCl ile temasa geçtiklerinde aktif şekli olan pepsini oluştururlar. Pepsin yüksek derecede asit ortamda (optimun pH 1,8-3,5) aktif bir proteolitik enzimdir. Ancak pH 5 ten yüksek olduğunda proteolitik etkisi çok düşüktür ve kısa sürede tamamem in aktif hale gelir. 4.Pilor bezleri mukus ve gastrin sekresyonu Pilor bezleri yapısal olarak oksinitik bezlere benzemekle birlikte, daha az miktarda peptik hücre içerirler ve hemen hemen hiç paryetal hücre içermezler. Bunun yerine, esas olarak gastrik bezlerin mukoz boyun hücreleri ile aynı olan mukoz hücreler içerirler. Asit Sekresyonunun Uyarılması Mide bezlerini direkt olarak uyaran nörotransmiter ve hormonların başlıcaları; asetilkolin, gastrin ve histamindir. a.Sinirsel yarı: Midede sekresyona yol açan sinirsel uyarıların yaklaşık yarısı vagusun dorsal motor nukleuslarından kaynaklanır ve vagus sinirleri yoluyla önce mide duvarındaki enterik sinir 9 sistemine daha sonrada mide bezlerine gelirler. Diğer yarısı ise, tamamen mide duvarındaki enterik sinir sisteminden doğan lokal reflekslerden kaynaklanır. Sekresyona yol açan sinirlerin tümü glanduler hücreler üzerindeki uçlardan nörotransmiter olarak asetilkolin salgılarlar. Bunun bir istisnası vardır, pilor bezlerindeki gastrin salgılayan hücrelere giden uyarılar için bir ara nöron görev yapar. Bu nöron nörotaransmiter olarak muhtemelen bombesin olan gastrin serbestletici peptid salgılar. Mide sekresyonunun sinirsel olarak uyarılması ya beyinden, özelliklede limbik sistemden ya da midenin içinden kaynaklanan uyarılar ile başlatılabilir. Mide kaynaklı uayrılar 2 tip refleksi aktive edebilir. 1. Uzun vagovagal refleksler; mide mukozasından beyin sapına ve ordan da tekrar mideye vagus sinirleri ile taşınırlar. 2. Kısa refleksler; lokal olarak kaynaklanırlar ve tamamen lokal enterik sinir sistemi yoluyla taşınırlar. Bu refleksleri başlatan uyarılar; midenin distansiyonu, mide mukozası yüzeyinde dokunma uyaranları ve kimyasal uyaranlardır. Kimyasal uyaranlar arasında özellikle proteinli besinlerden türeyen aminoasitler ile peptidler ve mide bezlerinden salgılanan asit yer alır. b.Asit sekresyonunun Gastrin ile uyarılması: Gerek vagus sinirlerinden gerekse lokal enterik reflekslerden gelen sinirsel uyarılar mide sıvılarının salınımını direkt olarak uyarmalarının yanısıra, antrum mukozasından gastrin hormonu salgılanmasına da yol açarlar. Bu hormon G hücreleri denilen ve pilor bezlerinde bulunan gastrin hücrelerinden salgılanır. Gastrin iki şekilde salgılanan büyük bir peptiddir. Büyük şekli G-34, 34 aminoasit içerirken, küçük şekli G-17 ise 17 aminoasit içerir. Đkisi de önemli olmakla birlikte, küçük şekli daha fazla bulunur. Gasrin kana emildikten sonra mide corpusundaki oksinitik bezlere taşınır. Burada paryetal hücreleri güçlü bir şekilde, peptik hücreleri de daha zayıf olarak uyarır. Böylece, en önemli etkisi paryetal hücrelerden HCl asit sekresyonu hızının 8 kez daha fazla olacak şekilde artırmaktadır. Daha sonra HCl asit, daha fazla enterik refleks aktivitesini uyararak hem HCl asit salgısını daha da arttırır, hemde peptik hücrelerden enzimlerin salgısını iki veya dört kez arttırır. Gastrik asit sekresyonu kontrolünde Histamin’in rolü; Bir aminoasit türevi olan histamin aynı zamanda paryetal hücrelerden asit salgısını da uyarır. Mide mukozasında, midede asit bulunmasına cevap olarak veya başka nedenlerle sürekli olarak az miktarda histamin yapımı vardır. Bu miktar tek başına çok az asit salgısına yola açar. Ancak asetilkolin ve gastrin paryetal hücreleri aynı zamanda uyardıklarında, 10 normal düzeyde histamin asit salgısını güçlü şekilde arttırır. Histaminin etkisi uygun bir antihistaminik ilaçla, örneğin simetidin ile engelliğinde ne asetilkolin ne de gastrin asit sekresyonuna yol açmazlar. Paryetal hücreler üzerindeki histamin reseptörleri H1 tipinde olmayıp, H2 tipindedir. Asetilkolin, gastrin veya histamin gibi asit salgılayan paryetal hücrelerin primer uyarıcıları, tek başına asit salgısını arttırmada çok az etkili olmaları nedeniyle gastrik asit sekresyonunda gerçek anlamda etkili olabilmeleri için bu farklı transmiter-hormon yapısındaki reseptörlerin aynı anda aktive olmaları gerektiği öne sürülmektedir. Histamin normal koşullarda daima az miktarda mevcut gibi gözükmektedir. Vaguslar uyarıldığında, parasempatik sinir uçlarından asetilkolin salgılanmakta ve gastrin serbestletici peptid nöronları eş zamanda gastrin hücrelerinden gastrin serbestlemesine yol açmaktadır. Böylece, üç tip uyarı biraraya gelerek bol miktarda asit sekresyonu gerçekleştirmektedir. Midedeki besin enterik refleksleri başlattığında, bu da hem gastrin hem de asetilkolin salgısına yol açar ve tekrar aşırı miktarda asit akışına neden olur. c.Pepsinojen Sekresyonunun Düzenlenmesi Pepsinojen salgılanmasının düzenlenmesi, asit salgısının düzenlenmesinden daha az karmaşıktır. Bu olay iki tip uyarı ile başlatılır, vagus sinirlerinden veya diğer enterik sinirlerden serbest salınan asetilkolin tarafından peptik hücrelerin uyarılması ve midedeki aside bağlı olarak peptik sekresyonun uyarılması. Asit muhtemelen peptik hücreleri direkt olarak uyarmamakta ancak ilave sinirsel uyarıları desteklemektedir. Asit salgısı sırasında salınan gastrin de peptik hücreleri uyarıcı zayıf direkt bir etkiye sahip olabilir.Pepsinojen sekresyon hızı, midedeki asit miktarından güçlü bir şekilde etkilenir. Normal miktarlarda asit salgılama yetenekleri kaybolmuş kişilerde, peptik hücreler sağlam olabilmelerine rağmen pepsinojen sekresyonu çok düşüktür. Aşırı miktarda asit tarafından gastrik sekresyonun fedback inhibisyonu, mide sıvılarının asit pH 3,0’den aşağıya doğru arttığında, gastrik sekresyonu uyaran gastrin mekanizması bloke olur. Bu etki iki faktörden kaynaklanır. Birincisi, ileri derecede artmış asidite tek başına G hücrelerinden gastrin salgısını baskılar veya bloke eder. Đkincisi, asit muhtemelen gastrik sekresyonu inhibe eden inhibitör bir sinirsel reflekse yol açar. Mide Sekresyonunun Fazları Mide sekresyonunun; sefalik, gastrik ve intestinal olmak üzere 3 fazda gerçekleştiği kabul edilmektedir. 11 1.Sefalik faz: Mide sekresyonunun sefalik fazı, besin mideye girmeden önce veya yenildiği sırada besinin görüntüsü, kokusu, düşünülmesi veya tadı ile ortaya çıkar. Đştah ne derece fazlaysa uyarılma da o derece fazla olur. Sekresyonun sefalik fazını oluşturan sinirsel uyaranlar serebral korteksten veya amigdala ya da hipotalamustaki iştah merkezlerinden kaynaklanır. Daha sonra vagusların dorsal motor nukleusları yolu ile mideye ulaşırlar. Sekresyonun bu fazı besin yenilmesi ile ilgili gastrik sekresyonun yaklaşık %20’sini oluşturur. 2.Gastrik faz: Besin maddesi mideye girer girmez, uzun bir vagovagal refleksi, lokal enterik refleksleri ve gastrin mekanizmasını başlatır. Bunlar da besin midede bulunduğu sürece saatlerce devam eden mide sıvısı sekresyonuna yol açarlar. Sekrseyonun gastrik fazı toplam gastrik sekresyonun yaklaşık %70’nden sorumludur. Böylece, yaklaşık 1500 ml olan gastrik sekresyonun büyük bir bölümünü oluşturur. 3.Đntestinal faz: Besin maddesinin ince barsağın üst kısmında özellikle duodenumda bulunması, mideden az miktarda mide sıvılarının sağlanmasına neden olur. Bu kısımen mideden gastrin salgısını uyaran distansiyon ya da kimyasal uyarılara bağlı duodenal mukozadan salgılanan az miktarlardaki gastrine bağlıdır. Buna ek olarak, kana absorbe olan aminoasitler ve diğer çeşitli hormonlar veya refleksler mide sıvılarının salgılanmasında daha az önemlidirler(8). 12 II. ÜST GASTROĐNTESTĐNAL SĐSTEM KANAMALARI 1.Tanım ve Giriş: Üst gastrointestinal sistem kanamaları; Treitz ligamentine kadar olan proksimal duodenum ile üst özofagus sifinkteri arasında lümen içine olan kanamayı ifade eder(9,10). Genellikle tüm gastrointestinal sistem kanamalarının %85’i üst gastrointestinal sistem kaynaklıdır. Bu kanamaların da %70-80’i kendiliğinden durur (11,12,13). %20 si iie devam etmekte veya tekrarlamaktadır, bu gruptaki hastaların %15-30 lara ulaşabilen cerrahi girişim ihtiyacı ve %30-40 lara varan mortalite oranları görülmektedir. 1957’de fleksibl endoskopinin kullanıma girmesi, üst gastrointestinal sistem kanamalarında tanı ve tedavi yaklaşımlarını köklü bir değişikliğe uğratmıştır. Endoskopinin tanı ve tedavide kullanımından önceki dönemlerde körlemesine yapılan cerrahi girişimler artık geride kalmıştır (11). Üst gastrointestinal sistem kanamaları acil ünitelerine başvuran hastaların önemli bir bölümünü oluşturur. Üst gastrointestinal sistem kanamasının görülme sıklığı; her 100.000 kişide yaklaşık 40-150 kişidir ve hastalığa bağlı mortalite %6-10 arasında değişir.(14,15). Üst gastrointestinal sistem kanaması sebebiyle hastaneye başvuranlar içinde, altmış yaş üstü gruptakilerin oranı 1920’lerde %10 iken günümüzde bu oran %60’tır (16,17,18). Mortalite oranları, en yüksekten en düşüğe; kanayan özefagus varisleri, gastrik ülser, duodenal ülser şeklinde sıralanır (11). Yoğun bakım tedavisinde, tanısal ve terapötik işlemlerde olan gelişmelere ve güçlü antisekretuar ilaçların bulunmasına rağmen, üst gastrointestinal sistem kanamalarının %10 olan mortalite oranı, 1945’den beri pek değişmemiştir. Yine H2 reseptör blokörleri ve proton pompa inhibitörlerinin yaygın olarak kullanılmaya başlanması ile duodenal ülserler için yapılan elektif gastrik cerrahi sayısındaki azalmaya rağmen, kanayan duodenal ülserler nedeniyle yapılan acil operasyonların insidansı değişmemiştir. Ölümlerin çoğu 60 yaş üzeri yaşlı hastalarda ve ciddi kalp hastalığı, kanser, böbrek yetmezliği gibi ek ağır hastalığı bulunanlarda olmaktadır. Başka bir sebeple hastanede yatmakta olan hastalarda kanama geliştiğinde mortalite %40 olarak bulunurken, 60 yaş altında olup da birlikte başka ciddi bir hastalığı veya malignitesi olmayanlarda ise bu oran %0.6 olarak tespit edilmektedir. (16,17,18). Üst gis kanama tanısıyla ABD de yıllık 300 bine yakın hastane başvurusuyla 2.5 milyon dolar sağlık harcamasına neden olmaktadır (19,20). Đngiltere’de ise yıllık 100.000 13 hastanın 100’ünde üst gastrointestinal sistem kanaması gözlenmektedir (21).1991 yılındaki verilere göre üst gastrointestinal sistem kanama atağı ile hastaneye başvuran her hasta için tedavi giderleri 3180 $ olarak bildirilmişti(14). 2.Etyolojik Sınflandırma Akut üst gastrointestinal sistem kanamaları nedenleri 1-Ülseratif, erozif ve infalamatuar hastalıkalar a. Peptik ülser hastalığı -Gastrik veya duodenal ülserler -Zolinger-Ellison hastalığı -Gastroözofagial reflü hastalığı b. Stres ülserleri; multiorgan yetmezliği, sepsis, hipotansiyon, travma, yanık(Curling), uzamış mekanik ventilasyon, major cerrahi girişim, miyokard infarktüsü, serebrovasküler hadiseler(Cushing) c.Đnfeksiyöz nedenler -Helicobacter pylori -Citomegalovirus -Herpes siplex virus d. Đlaca bağlı erozyonlar, ülserler veya kanama -Aspirin -Nonsteroid antiinflamatuar ilaçlar(NSAĐD) -Diğer ilaçlarala indüklenen ülserler( tetrasiklin, kinidin, KCl tabletleri) -Antikoagülan tedavi 2.Travma -Malory-Weiss yırtıkları -Yabancı cisim 3.Vasküler lezyonlar -Varsiler -Angioma ve Osler-Weber-Rendau sendromu -Dieulafoy lezyonu -Watermelon stomach (gastrik antral vasküler ektazi) -Portal hipertansif gastropati -Aortoenterik fistül 14 -Radyasyon ile indüklenen telenjektazi 3.Tümörler a.Bening tümörler -Liomiyoma -Lipoma -Polip ( hiperplastirk, adenomatöz, hamartomatöz) -Blue rubber belb nevus sendromu b.Maling tümörler -Adenokarsinoma -Leiomiyosarkoma -Lenfoma -Kaposi sarkomu -Karsinoid tümör -Melanom -Metastatik tümör 4.Diğer -Hemobilia -Hemosuccus pankreaticus Tablo-1 : Üst gastrointestinal sistem kanaması nedenleri. Nedenler Görülme sıklığı Gastroduodenal Ülserler Akut gastrik mukozal lezyonlar Gastrik-özefagus varisleri Mallory-Weiss yırtıkları Watermelon Stomach Anjiyodisplazi Dieulafoy hastalığı Hiatus hernileri, özefajitler Mide tümör ve polipleri Aortaduodenal fistüller Damar lezyonları Đnce barsak lezyonları (Crohn %50 %15-30 %20 %8 %3-5 %1-2 %2 Hemobilia hastalığı) %5 15 3.Klinik Bulgular Üst gastrointestinal kanamalar; gizli veya aşikar kanama şeklinde olabilir. Aşikar kanamalar, hematemez, melena veya hematokezya şeklinde belirti verirler.(22) Hematemez: Kanlı kusmadır. Kusulan kan, parlak kırmızı, taze kan şeklinde veya kahve telvesi gibidir. Kan midede bir süre kaldığında, HCl etkisi ile hemoglobin, hematine çevrilir ve renk koyulaşarak kahve telvesi, hatta siyahımsı renge dönüşür. Hematemez, Treitz ligamenti sevyesi üzerindeki kanamalarda görülür. Nasofaringeal veya pulmoner alandan kaynaklanan kanamalar da mideye ulaştıktan sonra kusulursa hematemez şeklinde görülür. Nadiren pankreatiko biliyer kanaldan gelen kan mideye reflü olabilir ve hematemez şeklinde karşımıza çıkabilir. Hematemez bulunuşu hemen daima üst gastrointestinal kanamaya işaret eder. Hematemez olmayışı üst gastrointestinal kanamayı ekarte ettirmez. Kanama durmuşsa; inflamasyon, ödem, veya spazm nedeniyle kapalı bir halde bulunan pilorun ya da deforme hale gelmiş bulbusun ötesinden kaynaklanan kanamalarda, kan mideye geri kaçmayacağı için lavaj temiz gelebilir. Lavajda saralı sıvının görülmesi pilorun açık olduğunu gösterir ve büyük ölçüde üst gastrointestinal kanamayı ekarte ettirir.(22) Melena: HCl, barsak bakterileri ve enzimlerin etkisiyle sindirilmiş kan içeren, katran gibi siyah, cıvık, pis kokulu gaitadır. Melena şeklinde dışkılama genellikle üst gastrointestinal kanamalarda görülür. Ancak ince barsaklar, hatta kolonun proksimal düzeylerinden olan kanamalarda da melena görülebilir. 50-100 ml kan melena yapabilir. Duodenal ülser kanamalarında 8 saat içinde kan tamamen siyahlaşır ve gaita melena haline gelir. Kanama durduktan 1-3 gün melena şeklinde dışkılama devam eder ve sonra dışkı rengi düzelir. 7-10 gün gaitada gizli kan pozitifliği görülür. Gaitada gizli kan nadiren 4.-5. günler negatifleşirken, bazen 3 haftaya kadar pozitif devam edebilir. Demir, bizmut, multivitamin içeren preparatlar ve aşırı bitkisel besinler de gaita rengini siyahlaştırabileceği unutulmamalıdır.(22) Hematokeziya: Rektumdan taze, parlak kırmızı kan şeklinde veya vişne çürüğü renginde olan pasajdır. Genellikle iloçekal valvden daha alt düzeydeki kanamalarda görülür. Yoğun üst gastrointestinal kanamalarda da barsak pasajı süratleneceği için kan sindirilmeden rektuma ulaşır ve hematokezya şeklinde görülebilir. Bu nedenle aşırı hematokezya ile müracat eden hastaların %10 kadarında kanama nedeni alt değil, üst kanaldadır.(22) 16 4.Gastrointestinal hasta nasıl takip ve tedavi edilmelidir? Gastrointestinal kanama geçiren hastanın takip ve tedavisindeki amaç -Hemodinamik stabilizasyonun sağlanması, -Kanama yerinin bulunması ve kanamanın durdurulması, -Kanama tekrarının önlenmesi, olmalıdır.(23) Öncelikle hasta genel tedbirlerle hayatta tutulmaya çalışılmalı, hemodinamik stabilizasyon sağlanmalıdır. Bu amaçla alınması gereken tedbirler şunlardır. -Yatak istirahati -Sıcak tutma, gerekirse O2 inhalasyonu -Kalın iğne ile damar yolu açılması -Fizik muayene, arteryel kan basıcı ve nabız dakika sayısı -Labaratuvar tetkikleri için kan alınması -Yaşlı hastada EKG -Nasogastrik sonda -Santral venöz kateter -Parenteral sıvı, gerekiyorsa volüm genişleticiler veya transfüzyon -Đdrar miktarı takibi *Kanama miktarını gösteren işaretler nelerdir? Toplam kan volümü 5 litre kabul edildiğinde, kanın %10’unu, yani 500 ml sini kaybeden hastada bazan vagal senkop görülebilir. Yüzde 20 kayıpta efor sonrası taşikardi, %30 kayıpta ayağa kalkınca hipotansiyon, %40 kayıpta sırtüstü yatarken hipotansiyon ve taşikardi, %50 kayıpta ise ciddi şok ve ölüm görülür. Genel bir kural olarak; sistolik kan basıncı 100 mmHg’nin altında ve nabız dakika sayısı 100 den fazla ise volüm kaybı %20 den fazladır. Tilt testinin pozitif olması; yani yatan hastayı ayağa kaldırmakla sistolik kan basıncı 10 mmHg’den fazla düşmesi veya nabız dakika sayısının 20 den fazla artması, %20’den fazla volüm kaybına işaret eder.(23) *Hangi hasta risk grubundadır? -60 Yaş üstünde, -Đlk şikayeti hematemez olan, -Đlave hastalığı olan; Diabetes Mellitus, Đskemik kalp hastalığı, Kalp yetmezliği, Kronik börek hastalığı, Karaciğer sirozu, Maligniteler vs.. -Daha önce cerrahi girişim geçiren, -Hipotansiyonu, taşikardisi ve Tilt testi pozitif olan, -Đlk 48 saatte kanaması tekrarlayan, 17 -Kronik mide ülseri olduğu bilinen, -Hematokezya tanımlayan, -Transfüzyon gerektiren, -Endoskopisinde yeni geçirilmiş kanama bulguları olan -Nadir kan grubu (AB-) hastalar, riskli hastalar olarak kabul edilir.(23,24) III. AKUT ÜST GĐS KANAMALARINDA TEDAVĐ YAKLAŞIMLARI Akut Gastrointestinal sistem kanamalarının tedavisinde temel yaklaşımları akut ve uzun dönem tedavileri şeklinde iki kısma ayıracak olursak, genel yaklaşım; hastanın uygun resusitasyonu ve stabilizasyonu, kanam başlangıç ve şiddetinin değerlendirilmesi, kanama alanının lokalizasyonu, üst gastrointestinal kanamanın en olası nedeninin belirlenmesi, acil üst panendoskopi için hazırlık yapılması, aktif kanamanın veya tekrar kanama olasılığı açısından yüksek risk taşıtan lezyonların terapötik endoskopi ile kontrolü, tedaviye bağlı komplikasyonların minimum düzeye indirilmesi ve tekrar eden kanama epizotlarının tedavisidir.(25) 1.Akut tedavi -Hastanın stabilizasyonu (ABC); Solunum stabilizasyonu, eğer solunum bozulmuşsa veya devam eden hematemez varsa endoterakeal entübasyon, -Đntravenöz yol, -Đntravasküler volüm replasmanı, -Transfüzyon; Eritrosit, taze donmuş plazma, trombosit, -Hikaye ve fizik muayene, -Labaratuvar; Tam kan sayımı, trombosit sayısı, koagülasyon testleri,PT, aPTT, karaciğer enzimleri, biokimya, -Radyoloji, Direk grafiler, USG -EKG -Kanama bölgesinin lokalizasyonu -Cerrahi konsultasyon, -Üst panendoskopi için gastroenteroloji konsultasyonu; Tanısal: Kanama odağının lokalizasyonu, kanama şiddetinin saptanması, tekrar kanama açısından risk stratifikasyonu, Terapötik: Aktif kanamanın durdurulması, rekürren kanama riskinin azaltılması 18 2.Uzun dönem tedavi -Rekürren kanam tedavisi, Tanısal ve terapötik endoskopi tekrarı, Angiografi, Cerrahi girişim -Peptik ülser kanaması için koruyucu önlemler; Đdame antisekretuar tedavi, Helicobacter pylori eradikasyonu, ASA/NASĐD ilaç kontrolü, Misoprostol, Cerrahi -Varis kanamsı için koruyucu önlemler; B-bloker, Oblitertif endoskopik tedavi Şant Karaciğer tarnsplantasyonu Endoskopik Girişim ve Forrest klasifikasyonu Girişimsel endoskopinin hedefleri, kanamnın durdurulması ,tekrarının önlenmesi, transfüzyon ihtiyacının azaltılması ve cerrahi girişim gereksiniminin azaltılmasıdır(12,20). Peptik ülsere bağlı üst gastrointestinal sistem kanaması olan hastaya yaklaşım açısından temel yönlendirici, endoskopik olarak ülserin görünümüdür. Forrest sınıflamasında kanayan ülserler görünümlerine göre şu şekilde sınıflanır; Forrest 1a, fışkırır tarzda aktif kanama, Forrest 1b, sızıntı tarzında aktif kanama, Forrest 2a, kanamayan görünür damar, Forrest 2b, yapışık pıhtı, Forrest 2c, düz pigmente lezyon, Forrest 3, kanama bulgusu yok. (Tablo-2) (18,26). Tablo - 2: Forrest sınıflamasına göre ülserlerde tekrar kanama riski. Forrest sınıflaması Tanım Tekrar kanama riski Ia Ib II a II b II c III Aktif kanama (pulsatil) Aktif kanama (sızma) Görünen damar + pıhtı Yapışık pıhtı Siyah zemin (kahverengi leke) Kanama bulgusu yok %90-100 %80-85 %40-50 %20-30 %5 %1-2 19 Akut gastrointestinal hemoraji için tedavi seçenekleri;(25) 1.Medikal tedavi: -Peptik ülser hastalığı; Antisekretuar tedavi, H2- reseptör antagonistleri, Proton pompa inhibitörleri, Antiasitler, Sukralfat, Misoprostol, -Gastroözofagial varisler; Đntravenöz vasopressin+/- nitrogliserin Đntravenöz okterotid Balon tamponadı 2.Endoskopik tedavi: (27) a.Peptik ülser hastalığı -Termal koagülasyon; .Multipar elektrokoagülasyon (bicap veya altın prob), .Isıtıcı prob (Hearter prob), .Lazer tedavi -Enjeksiyon tedavisi; Epinefrin, alkol - Kombinasyon tedavisi; Termal koagülasyon ve enjeksiyon b.Gastroözofagial varisler Enjeksiyon skleroterapisi, Varisyel bant ligasyonu, Siyanoakrilat enjeksiyonu, Kombinasyon tedavisi; Skleroterapi ve band ligasyonu c.Tümörler Termal prob, tümör endoskopik bipolar veya ısıtıcı prob Lazer ablasyon Termal balon kateter 3.Cerrahi tedavi -Varis dışı; ülser, tümür veya Mallory-Weiss yırtığı -Varis; Portosistemik şant, Özofagial transeksiyon ve devaskülarizasyon Karaciğer transplantasyonu 20 4.Radyolojik tedavi -Peptik ülser hastalığı; Arter embolizasyon, Đntraarteryel vasopressin nfüzyonu, -Gastroozofagial varisler, Embolizasyon, Transjuguler.intrahepatik.portosistemik.şant(TĐPS) 21 ÜST GASTROĐNTESTĐNAL SĐSTEM KANAMALARI ETYOLOJĐSĐ 1.Özofagial Laserasyonlar-Mallory-Weiss Sendromu: Özofagial laserasyonlar üst gastrointestinal sistem kanamalarının %5-10’nunu oluşturur. Genellikle kanama şiddetli değildir ve cerrahi müdahale gerektirmeden durur.Ancak masif hematemez de meydana gelebilir. Ağır kan kaybı olsa bile, vasokonstruktif ilaçlar, transfüzyonlar, bazen balon tamponadı gibi destek tedavileri genelde yeterli olmaktadır. Đyileşme sıklıkla minimal sekel ile ya da seklesiz tam olarak gerçekleşir.(28) Özofagusta, özofagogastrik bileşke bölgesindeki uzunlamasına yırtılmalar, MalloryWeiss yırtıkları olarak adlandırılırlar. Bu durum, sıklıkla kronik alkoliklerde şiddetli bir öğürme ya da kusma sonrasında meydana gelir. Ancak şiddetli kusma ile giden akut hastalıklarda da görülebilir. Varsayılan patogenez; kusma sırasında alt özofagial sfinkterin yetersiz gevşemesi ve mide içeriğinin dışarı atılması sırasında özofagogastrik bileşke bölgesinin gerilip yırtılmasıdır. Mallory-Weiss yırtığı bulunan hastaların %75’inden fazlasında hiatus hernisi bulunması, bu düşünceyi desteklemektedir. Đlginç bir özellik olarak, Mllory-Weiss yırtığı nedeniyle üst gastrointestinal kanama ile başvuran hastaların yaklaşık yarısında daha önceden bulantı, öğürme, karın ağrısı ya da kusma hikayesi yoktur. Normal bir intraabdominal basıç değişikliğinin hiatus hernisi yoluyla yayılarak Mallory-Weiss yırtığına yolaçabileceği hipotezi de ortaya atılabilir. Yırtıklar sadece mukozada sınırlı olabileceği gibi, tüm duvarı penetre edebilir. Ortaya çıkan defektin enfekte olması, iltihabi bir ülsere ya da mediastinite neden olabilir(28,29,30). 2.Özofajit: Özofagus mukozasının yaralanması ve buna bağlı olarak iltihabı, dünyada oldukça sık rastlanan bir durumdur. Đltihabın bir çok kaynağı olabilir; uzun süreli gastrik entubasyon, üremi, korozif ya da irritan maddelerin içilmesi, radyasyon yada kemoterapi gibi. Batı ülkelerindeki özofajit nedenlerinin başında , mide içeriğinin reflüsü gelir. Klinikte anıldığı adıyla gastroozofagial reflü hastalığı ABD erişkin nüfusunun %0,5’ini etkilemektedir(28,29,30). En sık semptomu tekrarlayıcı yanma hissidir. Bu hastalığa neden olan diğer faktörler; -Özofagial antireflü mekanizmalarının azalmış etkisi, -Reflü olan içeriğn özofagustan temizlenme mekanizmalarının yavaşlaması veya yetersizliği, -Sliding tipte hiatal herni, -Artmış gastrik hacminnin reflü meteryalinin hacminin artışına neden olması, 22 -Uzun süreli mide içeriğine maruz kalması nedeniyle özofagus mukozasının tamir kapasitesinin azalması, Bu faktörlerin herhangi birinin etkisi, hastadan hastaya değişebilir, anack vakaların çoğunda bir faktör diğerlerinden daha etkilidir. Klinik olarak, reflünün ön planda olan semptomu klap yanması-pirozis-(heartburn) olarak tarif edilen retrosternal yanmadır. Buna bazen acı bir suyun reguritasyonu eşlik edebilir. Ender olarak, miyokard infarktüsünü taklit eden şiddetli göğüs ağrısı atakları da kronik semptomların yanında kendini gösterebilir. Semptomların şiddeti, anatomik özofajitin varlığına ya da derecesine bağlı değildir. Reflü özofajit, genelde 40 yaşından yaşlı yetişkinlerin hastalığı olmasına rağmen, seyrek olarak infantlarda ve çocuklarda da görülebilir. Ağır reflü özofajitin potansiyel sonuçları, kanama, striktür oluşumu, baret özefagusu ve malignite riskinin artışıdır(28,29,30). Normal özofagus duvarı, düz, pürüssüz, ve hafif beyaz pembemsi muoza ile kaplı olarak kardiyaya uzanır. Kardiyada düzgün bir sınırla yukarıdan bakılınca görülebilen ya da bazen seçilemeyen skuamokolumnar epitel bileşkesi vardır. Buna Z çizgisi denir. Gastroözefagial reflüde başlıca patolojik sayılan endoskopik görünümler; Z çizgisi düzensizliği, distal özofagusta ödem, eritem, frajilite, eksuda, erozyon, ülser, Baret özofagus,ve striktürdür. Reflü özofajitin endoskopik sınıflaması için Savary-Miller yaygın olarak kullanılmış ise de bugün daha çok MUSE sınıflaması daha kesin ve açık tanımlamaları ve endoskopiste sağladığı kolaylıklar sebebiyle tercih edilmektedir. Yine Los Angeles klasifikasyonu da bugün için gastroözofagial reflü hastalığının tüm lezyonlarını tarif etmediğinden terk edilmiştir. Hastaların %40-60’ında tipik reflü hastalı semptomları olduğu halde özofagial erozyonlar bulunmaz. Bu durumda endoskopi negatif reflü hastalığı denir, ve diğer tanı yöntemlerine, asit pH monitorizasyon, asit testeler, manomeri vs. yapılabilir(31,32,33). Tablo 3:MUSE sınflaması; M:Metaplazi, U:ulserasyon, S:Strüktür, E:Erozyonlar Grade 0 Grade 1 (hafif) Grade 2 (orta) Grade3 (şiddetli) Metaplazi Yok Đzole adacıklar şeklinde Non-sirküler Çepeçevre Ülser Yok 1 adet bileşkede Baret ülseri 2 ya da daha çok Strüktür Yok >9 mm <9 mm Darlık ve kısa özofagus Erozyon Yok Sadece bir hatta(longitudina) 2 den fazla hatta çepeçevre 23 3.Gastrit Gastrit, gastrik mukozanın infamasyonudur. Histolojik bir terim olup, biyopsi ile doğrulanması gerekir. Akut gastrit, kısa süreli infamasyona işaret ederken, kronik gastrit tedricen gelişir. Akut gastritte nötrofilik infiltrasyon mevcut iken, kronik gastritte ise mononükleer hücre; başlıca lenfositler, plazma hücreleri ve makrofajların infiltrasyonu söz konusudur. Đnfalamsyonun olmadığı epitelyal hücre hasarı ve rejenerasyona ise Gastropati denmektedir(34,35). Gastropati genellikle ilaçlar, alkol, kimyasal maddeler, safra reflüsü, hipovolemi, ve kronik konjesyon gibi irritanlara bağlı olabilir. Gastrit ise sıklıkla infeksiyöz ajanlar, Helicobacter pylori, otoimmunite ve hipersensiviteye bağlıdır. Gastrit ve gastropati hakkında çok farklı sınıflamalar önerilmiştir. Sydney sınıflandırması; akut, kronik ve özel gastrit formları arasında ayrım yapmakta, histolojik ve endoskopik bölümleme sağlamakatadır. Histolojik bölümleme; inflamasyon (kronik infalamatuar hücreler), aktivite (nötrofiller), atrofi, intestinal metaplazi ve helicobacter pylori varlığını kapsamaktadır. Endoskopik bölümleme, mukozanın endoskopik bütünlüğünü ve görüntüsünü kapsar. a. Akut Gastrit: Ülser varlığında ya da ülser olmaksızın akut bir infamasyona neden olan mide mukoz hasarıdır. Đnfalamsyonun beraberinde mukoza içinde kanama olabilir, ya da ağır durumlarda mukozanın yüzeyel epiteli kaybedilebilir. Erozyona yol açan bu tip gastrit, akut gastrointestinal kanamanın önemli nedenlerinden biridir. Gastrik mukozanın kendini koruma mekanizmaları henüz tam olarak analaşılamadığından, akut gastrit patogenezi henüz açıklık kazanamamıştır. Akut gastrit sıklıkla aşağıdaki faktörler ile ilişkilidir. -Aspirin de dahil olamak üzere, nonsteroid antiinfalamatuar ilaçların yoğun kullanımı, -Yoğun alkol alımı, -Yoğun sigara içilmesi, -Kanser kemoterapi ajanları -Üremi, -Sistemik infeksiyonlar, örn salmonella, -Ağır stres, travma. yanıklar cerahi vb, -Đskemi ve şok, -Asidik ya da alkali madde alımı veya intihar girişimi, -Mekanik tarvma, nasogastrik entubasyon, -Distal gastrektomi sonrası safra reflüsü Yukarıdaki faktörlerden biri ya da daha fazlası akut gastrite yol açan ortamlara neden olmaktadır. Mukus tabakasının bozulması, yüzeyel epitel içerisine hidrojen iyonlarının geri diffüzyonu ile asit sekresyonun arttırılması, yüzeyel epitel hücrelerinde bikarbonat tampon üretiminin azalması, mukozadaki kan akımının azalması ve epitele direkt hasar. Mukozaya 24 zarar veren faktörler, sinerjik olarak etkili olurlar. Son olarak, akut h.pylori infeksiyonu gastrik mukozada nötrofilik inflamasyonu başlatır, fakat genelde bu olay hastanın dikkatinden kaçar. Akut gastrit, anatomik değişikliklerin ağırlığına bağlı olarak, tamamen asemptomatik olabileceği gibi, epigastrik ağrı, mide bulantısı ve kusmaya ya da belirgin hematemez, melena ya da ölümcül olabilecek derecede ağır kan kaybına neden olabilir. Özellikle alkoliklerde, hematemezin en başta gelen nedenidir. Akut gastrit, diğer nedenlerle meydana geldiğinde de oldukça sıktır. Hergün aspirin kullanan romatoid artritli hastaların %25 inde gizli ya da belirgin kanamaya neden olan akut gastrit ortaya çıkar. NSAĐD nedenli gastritte mide kanaması riski doz ile ilişkilidir. Bu nedenle, bu ilaçları uzun süre kullanması gereken hastalarda bu komplikasyonun gelişme riski daha yüksektir. b.Kronik Gastrit: Kronik gastrit,mide mukozasının kronik infamasyonu olup, sonuçta mukozal atrofi ve epitelde metaplaziye yol açan kronik iltihabi değişiklikler olarak tanımlanabilir(36). Dünyanın çeşitli yerlerinde farklı etkenlere bağlı alt grupların ve histolojik alterasyonların varlığı dikkat çekicidir. Batı ülkelerinde kronik gastrite yönelik histolojik değişikliklerin sıklığı, yetişkinlik çağının geç dönemlerinde %50’yi geçer. Kronik gastrit patogenezinde şimdiye kadar bilinenlerin arasında en önemli etyolojik faktör, kronik helicobacter pylori infeksiyonudur. Bu organizmaya bütün dünyada rastlanır ve gelişmekte olan ülkelerde en yüksek enfeksiyon aranına sahip olan patojendir. Bakteriyel enzimlerin ve toksinlerin kombine bir etkisi ile nötrofillerden salınan zaralı kimyasal maddelerin etkisi , kronik gastritte etkilidir. Kronik gastritin diğerleri dah az görülmekle beraber, diğer önemli bir gastrit tipi olan otoimmun gastrit, gastrik guddelerdeki parietal hücrelere, özellikle de asit üreten H+K+ATPaz enzimine yönelik otoantikorlardan kaynaklanır. Otoimmun hasar, asit ve intrinsik faktör üretiminin azalması ile sonuçlanan gudde harabiyetine ve mukozal atrofiye yolaçar. Kronik gastrit genelde çok az semptoma yol açar ya da asemptomatiktir. Üst abdominal rahatsızlık, mide bulantısı ve kusma meydana gelebilir. Otoimmun gastrit nedeniyle ağır parietal hücre kaybı oluştuğunda, hastada hipoklorhidri ya da aklorhidri (gastrik lümende HCl asit düzeyleri) ve hipergastrinemi karektersitik olarak mevcuttur. Diğer nedenlerle kronik gastriti olan bireylerde hipoklorhidri bazen görülebilir. Fakat bu hastalarda parietal hücreler tamamen yok olmadığından, aklorhidri ya da pernisyöz anemi hiçbir zaman görülmez. Serum gastrin düzeyleri genelde normal sınırlar içerisindedir, ya da hafif olarak yükselmiştir. Kronik gastritin peptik ülser ve gastrik karsinom gelişimi ile olan ilşkisi de önemli noktalardan biridir. Duodenal ya da gastrik peptik ülserli birçok hastada h.pilori enfeksiyonu mevcuttur. H.pylori nedenli kronik gastritte uzun vadede gastrik karsinom normal populasyona göre 5 kat artmıştır, otoimmun gastritte gastrik kanser riski 25 artmış olup normal populasyona göre %2-4 arasındadır. Gastrit ve gastropati hakkında çok farklı sınıflamalar (Sydney sistemi gibi) önerilmiştir(37,38,39). Tablo-4: Gastrit sınıflaması(39,40). I.Akut Gastrit a.Akut Helicobacter pylori infeksiyonu b.Diğer akut infeksiyöz gastritler 1.Bakteriyel (h.pylori dışındakiler) 2.Helicobacter heilmanni 3.Flagmentöz 4.Sifiliz 5.Milobakteriyel 6.Viral 7.Parazitik 8.Fungal II.Kronik Atrofik Gastrit a.Tip A: Otoimmun, korpus baskın b.Tip B: H.Pylori ilişkili, antrum baskın c.Đntermediate: TipAB III. Gastritin Nadir Tipleri a.Lenfositik b.Eozinofilik c.Crohn hastalığı d.Sarkoidoz e.Đzole granulomatöz gastrit SYDNEY GASTRĐT KLASĐFĐKASYONU I-Endoskopik Kriterler. 1.Eritematöz/eksüdatif gastrit 2.Süperfisyal erozif gastrit 3.Erozyone polipoid gastrit 4.Atrofik gastrit 5.Hemorajik gastrit 6.Safra-Alkalen Reflü gastrit 7.Yabancı cisme bağlı gastrit II-Etyolojiye göre klasifikasyon 1.Otoimmun gastrit-TipA 2.Bakteri ile ilişkili gastrit-TipB 26 3.Kemotoksik ajanlara bağlı gastit-TipC 4.Farklı gastrit formları III-Lokalizasyona bağlı gastrit 1.Pangastrit 2.Antal gastrit 3.Corpus gastriti IV-Gastritin derecelendirilmesi; Hp, aktivite, infalamasyon, atrofi, intestinal metaplazi varlığına göre 1.Hafif 2.Orta 3.Şiddetli, derecede gastrit V-Histomorfolojik kriterler. 1.Akut 2.Kronik 3.Kronik-aktif gastrit 4.Zolinger Ellison Sendromu Zolinger ve Ellison 1955 yılında pankreasın non-beta adacık hücre tümörü gastrinomayı, gastrik asit hipersekresyonunu, ciddi ve komplike peptik ülser hastalığını içeren kendi adlarıyla anılan bu sendromu tanımladılar(39,40). Daha sonra gastrinomanın erken tanınmasına izin veren ve hastalığın belirtilerinden sorumlu olan gastrinin radioimmunuassy ile tespiti gerçekleşti. Başlangıçta cerrahi olarak tedavi edilen ZolingerEllison sendromu günümüzde H+K+ATPaz inhibitörlerinin kullanıma girmesi ile daha kolay tedavi edilebilir hale gelmiştir. Bu hastalık nadirdir, genelde 40 yaşından sonra, yılda 10 milyonda 1 vaka tespit edilir, tüm peptik ülserli vakaların %0,1’inde Zolinger-Ellison sendromu mevcuttur, %75’i sporadik olarak ya da multipl endokrin neoplazi (MEN) tip1’in bir parçası olarak rtaya çıkabilir(43). Gastrinomalar, genellikle pankreas ya da proksimal duodenumdan köken alan gastrin salgılayan tümörlerdir. Gastrin bir çok dokuda etkili olmasına rağmen, Zolinger-Ellison sendromunun belirtileri gastrinin gastrik asit hipersekresyonunu stimüle etmesiyle ve paryetal hücre kitlesinin artmasıyla oluşur(40,42). Gastrinin otonom salınması gastrik mukozanın hipertrofisine, parietal hücre sayısının artmasına yol açar ve maksimal asit outputu artar. Gastrin, asit sekresyonunu stimüle ederk bazal asit sekresyonunu da arttırır, bu hastalar günde 10 litreye kadar asit sekrete edebilirler. Bu da muozanın koruyucu mekanizmalarını yenerek, duodenum, mide, özofagus ve jenumda ülserlere neden olur. Massif asit sekresyonu , sekteruar daire ya da malabsorbsiyona neden olur. 27 Diare ve malabsorbsiyon; -Đnce barsağın absorbsiyon kapasitesini aşan masif sekresyona, -Duodenal lümendeki asit pH da pankreatik sindirim enzimlerinin inaktivasyonu ve safra asitlerinin prespitasyonuna, -Proksimal ince barsağıa ualşan nötralize olamuş gastrik asitin mukozal ülserasyon ya da inflamasyona sebep olmasına , -Đnce barsak mukozasından gastrin indüklü sıvı sekresyonuna, bağlı olduğu düşünülmektedir. Major klinik belirtiler, abdominal ağrı, diare, dsifaji ve pirozis, kanam ya da perforasyon şeklinde ülser komplikasyonlarıdır. Peptik ülserli hastalarının tümünün Zolinger-Ellison sendromu açısından araştırılması uygun değildir. Eğer; diare ile birlikte peptik ülser hastalığı varsa, alışılmamış lokalizasyonda multipl ülser varlığı, standart dozlarda antisekretuar ilaçlarla semptomlar düzelmiyorsa, uygun tedavi ve etkili cerrahi sonrası ciddi ülser hastalığı olanlar, ailevi peptik ülser hastalığı olanlar, hiperkalsemi ve böbrek taşları olan ülserli hatalar ve MEN Tip-1 ailevi hikayesi olan, bu hastalar ZolingerEllison açısından araştırılmalıdır. Gastrin yüksekliği yapan birçok durum olamsına rağmen. yine de gastrinomadan şüphelenilen tüm hastalarda açlık gastrin düzeyine bakılmalıdır. Normal kişilerde açlık serum ghastrin düzeyi 150-160 pg/ml altındadır. Zolinger-Ellison sendromunda açlık serum gastrin düzeyi 150 pg/ml üstünde olup, genellikle hastaların 1/3’nde 1000 pg/ml üzerindedir. Gastrinomalı hastaların %99’nda serum gastrin düzeyleri yüksektir ve bu durum gastrin asit hipersekresyonuyla birliktedir. Açlık serum gastrin düzeyi 1000 pg/ml ve gastrik asit pHsı 3’ün altında ise Zolinger-Ellison tanısı konabilir. Hastaların 2/3’ünde ise açlık serum gastrin düzeyi 100-1000 pg/ml arasında olup bunlarda, hipergastrineminin diğer sebeplerini ekarte etmek için provakatif testlere ihtiyaç vardır(42). Açlık Hipergastrinemisinin Sebepleri I.Aklorhidri: gastrik asit yokluğunda, 1.Atrofik gastrit 2.Pernisyöz anemi 3.Vagotomi ve gastrik rezeksiyon sonrası 4.H2 reseptör blokerleri veya H+K+ATPaz inhibitörleri gibi ilaçlar 5.Kronik böbrek yetmezliği II.Gastrik asit üretimiyel birlikte olduğu tablolar, 1.Retained gastrik antrum sendromu 2.Đnce barsak rezeksiyonu 3.Kronik gastrit outlet obstruksiyonu 4.Kronik böbrek yetmezliği 5.Antarl G hücre hiperplazisi ve hiperfonksiyonu 28 6.Romatoid artrit 7.Diabetes mellitus 8.Feokromasitoma 9.Tirotoksikoz 10.Zolinger Ellison sendromu(42). Zolinger-Ellison sendromu tanısında gastrin yüksekliği ile birlikte gastrik asit sekresyonunun ölçümü de önemlidir. Gastrik asit sekresyon çalışmaları volüm ölçümlerini, aynı zamanda bazal ve pentagastrinle stimüle asit sekresyonu çalışmalarını içerir. Antisekretuar medikasyonlar çalışmadan en azından 24 saat önce kesilmelidir. Gastrinomada gastrik sekresyon volümü sıklıkla 24 saatte 10 liternin üzerindedir. Normal bireylerde Bazal Asit Outputu (BAO) erkeklerde 10mEq/saatten, kadınlarda 5,6 mEq/saatten daha azdır. Zolinger-Ellison sendromunda BAO 15 mEq/saatten fazladır, yalnız bu hastalar önceden gastrik asit azaltıcı cerrahi geçirmemiş olmalıdırlar. Maksimal Asit Outputu (MAO) ise, 6 mikrogram/kg pentagastrin subkutan verilmesinden sonra ölçülen testtir. MAO, parietal hücre kitlesi ile yakından korelasyon gösterir ve kronik hipergastrinemiden kaynaklanan parietal hücre hipertrofisinin göstergesidir, dolayısıyla Zolinger-ellison sendromunda yüksek bulunur. BAO/MAO oranı 0,6’dan yüksek ise bu, Zolinger-Ellison sendromunun bir göstergesi olarak kabul ediler. BAO/MAO oranı, BAO’nun tek başına ölçümünden daha değerlidir. Gastrin provakasyon testleri: 1.Sekretin stimulasyon testi: En kullanışlı olanı bu testtir. 2 bazal gastrin düzeyi ölçtükten sonra, 2 Ü/kg sekretin injekte edilir ve 2, 5, 10, 15 ve 20. dakikalarda gastrin cevabı ölçülür. Serum gastrin düzeylerinde 200 pg/ml den daha fazla artış testin pozitif olduğunu gözterir, Zolinger-Ellisonlu hastaların %87’sinde görülür. Bu testin false pozitif tek sebebi aklorhidridir, o da gastrik asit pHsı ölçülerek ekarte edilir. 2.Kasiyum infüzyon testi: Kalsiyum infüzyon testi 2 bazal gastrin ölçümünden sonra 3 saat süre ile %10’luk kalsiyum Glukonattın 54 mg/kg/saat dozda infüzyonu ile yapılır, 120, 150 ve 180. dakikalarda serum gastrini ölçülür, serum gastrin düzeyi 394 pg/ml’den yüksekse test pozitiftir. Testin geçerli olabilmesi için serum kalsyumunun 1,5 mEq/L veya daha fazla artış göstermesi gerekir. Hiperkalsemi ve kardiak aritmi hikayesi olan hastalarda kontrindikedir. Negatif sekretin stimulasyon hastalarının ancak 1/3’ünde pozitiftir. Gastrinomalı hastaların %9’unda her iki test negatiftir. 29 3.Standart yemek testi: Sekretin ve kalsiyum infüzyon testi negatif olduğunda, 30 gr protein, 25 gr yağ içeren standart yemek testi uygulanır. 2 bazal gastrin düzeyi ölçümünden sonra test yemeği verilir ve 30, 60 ve 90. dakikalarda gastrin cevabı ölçülür. Serum gastrin düzeylerinde %100 den fazla artış testin pozitif olduğunu gösterir, Zolinger-Ellisonlu hastaların %30’nda pozitiftir(40,42). 30 5.Peptik Ülser Hastalığı a.Giriş ve Epidemiyoloji Peptik ülser hastalığı çok sık rastlanan tanı ve tedavinin oluşturduğu direkt maliyeti yanında işgücü kaybı ve yaşam kalitesine olumsuz etkisi ile indirekt maliyeti de çok yüksek bir organik bozukluktur. Tarihsel veriler semptomatik ülserlerin toplumun yaşam buyu %10’unu etkilediğini göstermiştir(43). Histolojik olarak, sadece mukozayı tutan çapı 5 mm’den küçük, derinliği 1 mm’den yüzeyel defektler erozyon olarak tanımlanmakta, defektin muskularis mukozayı aşarak submukoza veya muskularis propria tabakasını da içerecek şekilde ilerlemesiyle ülser oluşmaktadır. Ülserler genellikle kronik bir süreçte gelişmekte ve histolojik olarak; yüzeyel fibrin ve eksuda, fibrinoid nekroz, granulasyon dokusu ve fibrozis olmak üzere 4 ayrı bileşeni içermektedir. Buna karşın aspirine bağlı veya stres ülserlerinde olduğu gibi sıklıkla akut gelişen ülserlerde inflamasyon ve fibrozis minimal düzeyde veya yoktur. Peptik ülser tanımı ise, peptik sıvıya (asit-pepsin) maruz kalmış bölgelerde oluşan ülserleri tanımlamaktadır. Peptik ülser en sık duodenum ve midede görülmektedir. Ayrıca özofagus alt ucu, jejunum, mide cerrahisi sonrası anostomoz yerinde veya nadiren heterotropik mide mukozası içeren (ileumda bulunan Meckel divertikülünde olduğu gibi) herhangi bir yerde de peptik ülser görülebilir(44). Peptik ülsere ömür boyunca yakalanma riski erkeklerde %11-14, kadınlarda ise %811’dir. Aktif ülser sıklığı ise ortalama %1 civarındadır. Duodenum ülseri mide ülserine göre 3-4 kat daha sıktır. Genel olarak yaş ilerledikçe peptik ülser insidansı artmaktadır. Ülkemizde duodenal ülser en sık 20-50 yaş grubunda, gastrik ülser ise 30-60 yaş grubunda görülmektedir. Önceki yıllarda duodenal ülserde erkek/kadın oranı 5/1 iken, son yıllarda bu oran 1,3/1’e kadar düşmüştür. Gastrik ülser ise erkek ve kadınlarda eşit oranda görülmektedir(44,45) Eskiden peptik ülser etyolojisinin multifaktöryel olduğuna inanılırdı. Bu hastalıkta bir veya iki faktörün değişmesinin mukozadaki direnç ve iyileşme için olumsuz etki yaptığı sanılırdı. Günümüzde ise peptik ülseri oluşturan koşulların yaşam boyu sürdüğü düşünülmektedir. Peptik ülserli hastalarda bu durumu değiştirecek iki çevresel faktörün varlığı düşünülmektedir. Bunlar Helicobacter pylori, aspirin ve nonsteroid antiinflamatuar drug (NSAĐD) kullanımıdır(43). Geçen yüzyılın başında en önemli faktör olarak pepsin suçlandığı için peptik ulser tanımı kullanılmış, daha sonra asitin de önemi anlaşılmıştır. 1980’li yıllardan sonra yapılan yoğun klinik ve laburatuar çalışmalar, klasik ‘no acid/pepsin-no ulcer; asit/pepsin yoksa ülser yok’ görüşünde önemli değişikliklere neden olmuştur. Özellikle etyolojide, helicobacter pylori ve NSAĐD’lerin en sık etkenler olduğunun ortaya konması, peptik ülser hastalığının tedavisinde çığır açan gelişmelerle sonuçlanmıştır(46). Peptik ülser hastalığı 1950’li yıllara kadar çok değişik diyetler, stresten 31 sakınılması, süt-antiasit diyetleri (Sippy diyeti) gibi etkisiz yöntemlerle tedavi edilmeye çalışılmış; 1950’lerden 1976’ya kadar modern antiasitler ve atropin ile kısmi başarı sağlanmış; 1976’da simetidin ve takiben diğer H2-reseptör antagonistlerinin bulunması ile iyileşme sağlanmış fakat nüks sorunu devam etmiştir. 1980’de omeprazol’ün bulunmasıyla iyileşme oranları artmış fakat nüks ve komplikasyonlar nedeniyle cerrahi girişimler devam etmiştir. 1983’te Avustralyalı iki araştırmacının (Robin Warren-Barry Marshall), Helicobacter- peptik ülser ilişkisini tanımlaması ile yeni bir devir açılmış, peptik ülserin büyük oranda enfeksiyöz bir hastalık olduğu anlaşılmıştır. 1994 yılında ABD’de düzenlenen uzlaşma toplantısı ile (NIH consensus) Helicobacter pozitif saptanan peptik ülser olgularında eradikasyon tedavisi zorunlu kılınmıştır. Başarılı Helicobacter eradikasyonu yapılan olgularda peptik ülserde kür sağlanmakta, nüks oranı %1’in altına inmektedir. Geçen yüzyıl boyunca peptik ülser veya komplikasyonları için çok yaygın kullanılmış cerrahi tedaviler, bugün artık dirençli kanama, perforasyon, kronik obstruksiyon gibi komplikasyonlara sınırlı hale gelmiştir(44,45,46,47). b.Klinik Özellikler. Çoğu peptik ülser, epigastrik yanmaya ve ağrıya neden olur, fakat az sayıdaki bir kısım hasta, kanama ya da perforasyon gibi komplikasyonlar ile başvurur. Ağrı geceleri ve gündüz saatlerinde, yemekleri izleyen 1-3 saat içinde daha şiddetli olmaya meyillidir. Klasik olarak, alkaliler ile ya da yiyecekler ile azalır, fakat bu durumun bir çok istisnası vardır. Bulantı, kusma, şişkinlik, geğirme dispeptik diğer semptomlardır. Kavram kargaşası olan bir konu ise epigastrik ağrı ve dispepsi ilişkisidir. Tanım olarak dispepsi; epigastrik ağrı da dahil, hazımsızlık, şişkinlik, yanma, kazınma, bulantı, erken doyma gibi üst abdomen semptomlarının bir veya birden fazlasını içeren kronik rahatsızlık hissidir. Ülserli hastalarda çoğunlukla epigastrik ağrı ve/veya dispepsinin diğer semptomları izlenir. Buna karşın, dispepsili hastaların sadece %20’sinde neden peptik ülserdir, %50’sinden fazlasında peptik ülser, reflü, kanser gibi organik bir patoloji saptanmaz, buna fonksiyonel- nonülser dispepsi denir. Başta gelen komplikasyon kanamadır. Hastaların üçte birinde görülür ve hayatı tehlikeye sokucu şiddette olabilir. Perforasyon, çok daha az sayıda hastada meydana gelir, fakat ABD’de yılda bu hastalık sonucu ölen 3000 hasta da başta gelen ölüm nedenidir. Pilorik kanal tılanıklığı enderdir. Duodenal ülserlerin maling transformasyonu bilinmemektedir. Gastrik ülserlerde ise malign transformasyon çok ender görülür. Gastrik ülserlerin malign transformasyonu söz konusu olduğunda, her zaman önceden karsinomun varlığı olasılığı düşünülmelidir. Peptik ülserlerin kronik ve tekrarlayıcı lezyonlar olduğu yaygın olarak bilinmektedir. Hayatı kısaltmaktan çok hayat kalitesini azaltıcı etkisi vardır. 32 Tedavi edilmediğinde, bir peptik ülserin iyileşmesi ortalama 15 yıl sürer. Günümüzde uygulanan etkin medikal tedavi ve Helicobacter pylori eradikasyonu ile çoğu hastada klinik başarı sağlanmaktadır. Yine de çoğu ülser hastası için cerrahi tedavi ihtiyacı azalmışsa da bazen cerrahi tedavi son seçenek olabilir(28,29) c.Peptik Ülser Patogenezi: Ülser oluşumunda temel patogenez, gastroduodenal mukozanın bütünlüğünün, agresif ve koruyucu/onarıcı faktörler arasındaki dengenin değişmesine bağlı olarak bozulmasıdır. En önemli agresif faktörler olan asit ve pepsin, gastroduodenal mukozanın koruyucu/onarıcı mekanizmalarını; genetik, çevresel ve enfeksiyöz kökenli agresif faktörlerin yardımıyla bozmakta ve sonuçta ülser oluşmaktadır. Mide ülserinin oluşmasında koruyucu faktörlerin azalması, duodenal ülser oluşumunda ise agresif faktörlerin artması daha önemlidir. Helicobacter pylori ve NSAĐD gibi yagın faktörlerin işlevi, diğer agresif faktörlerin (asitpepsin) arttırmaktan çok, koruyucu ve onarıcı mekanizmaları bozmak yoluyla olmaktadır. Schwartz’ın daha 1910 larda öne sürdüğü ‘no acid, no peptic ulcer’ aforizması uzun süre peptik ülser hastalığı için ağırlıklı sebep olarak düşünüldü(48). Ancak 1983 yılında Helicobacter pylorinin bulunuşu ile başlayan süreçte mide hastalıklarının etiyopatogenez ve tedavisi alanında ikinci devrim yaşanmıştır. Yapılan çalışmalarda peptik ülserlerin %8995’inin Helicobacter ve NSAĐD kullanımı ile ilişkli olduğu gösterilmiş olup diğer etkenlerin peptik ülser oluşumunda çok az rolü olduğu belirtilmiştir(49). Peptik ülserasyon nihayetinde asit ve pepsinin kostik etkilerinin, mukozanın bu etkilere karşı direncine üstün gelmesi sonucunda gerçekleşir. Mukozanın asit peptik atağa karşı savunma mekanizmaları; preepitelyal, epitelyal ve postepitelyal düzeyde koruyucu ve onarıcı mekanizma olmak üzere ikiye ayrılır. A-Koruyucu mekanizmalar 1.Preepitelyal mekanizma: Mukus ve Bikarbonat Mide ve duodenumu döşeyen silindirik epitel hücrelerinden salgılanan koruyucu mukus tabakası, asit ve pepsinin lümenden mukozaya geçmesini engeller. 100 mikron kalınlığındaki bu tabakanın %95’i su, %5’i glikoproteindir. Ülserli hastalarda mukusun heterojen ve zayıf yapıda olduğu gösterilmiştir. NSAĐD’ler mukus sentezini azaltmakta, Helicobacter pylori ise proteaz enzimleri ile mukus yıkımına neden olmaktadır. Epitel hücrelerinden salgılanan bikarbonat ise pH gradyenti yaratarak, mukoza tabakasının luminal yüzeyinde asidik(pH:2) ve alttaki epitele bakan yüzeyde nötral (pH:7) ortamın oluşmasını sağlar. Bu durumun mukozal bütünlüğün devamında rolü büyüktür. Bikarbonat sekresyonunun regülasyonu, motilite ve nöral bileşenlerin yer aldığı kompleks bir süreçle sağlanmaktadır. NSAĐD ve Helicobacter bikarbonat sekresyonunu azaltmaktadır. 33 2.Epitelyal mekanizma: a. Apikal bariyer: Mide mukozası hücrelerinin özelleşmiş apikal yüzey membranı, asidin geri diffuzyonuna dirençlidir. Ayrıca, hücreler sıkı bileşenlerle birbirine tutunarak asit geçişini engellerler. Helicobacterin salgıladığı ‘diffusable toksin’ bu sıkı bileşenleri yıkmaktadır. b.Diffuzyonla giren H+ iyonlarının dışarı atılması: Epitel hücrelerinin bazolateral membranındaki fazla H+ iyonlarını artan taşıyıcı sistemler özellikle mukozal kan akımında azalma durumunda bozulmaktadır. c.Epitelin antioksidan özellikleri: Çeşitli nedenlere bağlı akut inflamasyonda marginasyona uğramış lökositler ve doku makrofajları serbest oksijen radikalleri salgılarlar. Epitelin bu maddelere bağlı hasarı önleyici sitoproteksiyon özelliği mevcuttur. 3.Postepitelyal mekanizma: Mukozal kan akımı Yüzey epitelinin altında yer alan kapiller ağ, epiteli aşan maddeleri hızla ortamdan uzaklaştırırken, aynı zamanda dokulara oksijen ve besin maddeleri sağlar. Mukozal kan akımında azalma kronikleşme sürecine katkıda bulunur. B-Onarıcı mekanizmalar a.Epitel hücre göçü: Epitel hücre hasarı oluştuğunda devreye giren onarıcı mekanizmaların ilk aşaması epitel hücre göçüdür (restitusyon). Çevredeki sağlam epitel hücreleri dakiklar içinde bazal membran üzerinden kayarak, boşluk olan bölgeye göç ederler ve birbirleriyle sıkı bileşkeler oluşturarak epitel bütünlüğünü sağlarlar. b.Hücre replikasyonu: Restitusyondan sonra hücrelerin yerine yeni epitel hücreleri hızla rejenere olurlar (2-4 gün). Bu olay, endokrin, nöral ve lokal faktörlerin rol aldığı karmaşık bir süreçte olur. c.Yara iyileşmesi: Restitusyon ve epitel hücre replikasyonu için sağlam bir bazal membran gereklidir. Koruyucu mekanizmlar hücre yıkımıyla başedemeyince, bazal membranda da yıkım oluşur. Bu tür lezyonlar sık olarak gelişir ve hızla yenilenir. Mukozal yara iyileşmesi klasik yara iyileşmesine benzer ve ‘fibrinoid nekroz, inflamatuar hücre infiltrasyonu hücresel debrisin rezorbsiyonu, yeni damar oluşumu, ekstraseluler matriks rejenerasyonu, epitel hücre göçü ve doku remodelingi’ aşamalarını içerir. Mukozal lezyonların, kronik ülsere dönüşmesi ancak bu aşamalar bozulursa gerçekleşir(29,50) Mide ve duodenal ülser gelişiminde farklı faktörler farklı oranlarda etkili olabilir. Genel olarak koruyucu ve zararlı faktörlerin etkisi vardır. Bu noktada iki anahtar faktör vardır. Bunladan birincisi, peptik ülserasyonun meydana gelmesi için mukozanın gastrik asit ve pepsine mutlaka maruz kalması gerekliliğidir. Đkincisi, H.pylori enfeksiyonunun çok güçlü bir etken olduğudur. Bugünkü bilgilerimize göre mukozayı duyarlı hale getiren ve peptik ülser etyolojisinde rol oynayan üç ana etyolojik faktör vardır. 34 1-Helicobacter pylori 2-Nonsteroid antiinflamatuar druglar 3-Aşırı asit sekresyonuna yol açan durumlar, Zollinger-Ellison sendromu vb.. Bu ana etyolojik faktörlerin peptik ülser gelişiminin büyük bir kısmından sorumlu olduğunu yapılan çalışmalarda gösterilmiş ve bunların dışında peptik ülsere yol açan diğer sebeplerin çok nadir olduğu bildirilmiştir. Bu etyolojik faktör ya da faktörlere sahip kişilerin tümünde peptik ülser gelişmez. Burada kişiye ait genetik yapı, herediter faktörler, beslenme, alışkanlıklar (alkol, sigara vs), vitamin ve antioksidan yetersizliğinin rölünün yanısıra bakteriye ait özelliklerinde devreye girme olasılığı vardır. Helicobacter pylori ile enfekte olanların %100’nde kronik gastritis varken. %15-20’sinde peptik ülser, %1-3’üde mide kanseri, %0,1’inde mide lenfoması gelişme riski vardır. Bu enfekte kişilerde midede sırasıyla, akut nötrofilik gastritis, kronik superfisiel gastritis, kronik atrofik gastritis ve gastrik atrofiye giden değişimler izlenir. Bu süreçte bir kısım olguda peptik ülser gelişirken bazı olgularda atrofik gastritis evresinde gelişen intestinal metaplaziyi takiben distal tip mide kanseri gelişir(51). Duodenum ülseri, prepilorik kanal ülseri ve gastrik ülserin duodenum ülseri ile birlikte olduğu durumlarda, aşırı asit salgılanması peptik ülser oluşmasında önemli bir rol oynar. Bu hastalıkların %40’ında normalden fazla asit salgılanır. Duodenum ülserinde bazal serum gastrin sevyesi, normal olmakla birlikte yemekten sonra salgılanması artmıştır. Paryetal hücrelerin gastrine duyarlılığı da artmıştır. Paryetal hücre kitlesindeki artış muhtemelen gastrinin trofik etkisinden ileri gelmektedir. Pepsinojen salgılanması genellikle asit salgılanmasına paralel gittiğinden asit salgılanmasının arttığı durumlarda pepsinojen salgısı da artmıştır. Mide ülserli kişiler normal ya da normalden daha az asit salgılarlar. Hiposekresyonun paryetal hücre kütlesinin azlığına, paryetal hücrenin fonksiyon bozukluğuna ve salgılanan asidin mukoza içine geri diffüzyonuna bağlı olabileceği düşünülmüştür. Mide ülseri oluşumunda mukozanın savunma sistemindeki bozuklukların ön planda rol oynadığı kabul edilmektedir. Peptik ülserler gastroduodenal mukozanın savunma mekanizması ile saldırgan güçler arasındaki dengesizlikler sonucunda, savunma mekanizmalarının yenilmesi ile meydana gelir. Gastrik muozanın sindirilmesini engelleyen mekanizmalar şöyle sıralanabilir; -Yüzey epiteli hücrelerinden mukus salgılanması, -Dengelenmiş bir yüzey mikroçevresi yaratmak amacıyla, yüzeydeki mukus içerisine bikarbonat salgılanması, 35 -Gastrik yarıklardan salgılanan asit ve pepsin içeren sıvının yüzey mukus tabakasından geçerken yüzey epitel hcreleri ile direkt kontakt halinde olmaması, -Gastrik epitelin hızlı rejenerasyonu, -Lümenden mukoza içine geriye diffuze olan hidrojen iyonlarını bölgeden uzaklaştıran ve yüksek hücresel metabolik ve rejeneratif aktivitenin devamını sağlayan güçlü kan akımı, -Mukozal kan akımının devamına yardımcı olan prostagandinlerin mukozadaki varlığı(28,50,51,52) Tablo 4: Peptik ülser oluşumunda koruyucu ve zararlı faktörler(53). Koruyucu faktörler Agresif faktörler Mukus bikarbonat bariyeri Asit-pepsin Epitel yüzeyi, sıkı bağlantılar Helicobacter pylori Epitel rejenerasyonu Aspirin ve NSAĐDler Mukozal kan akımı Diğer ilaçlar; steroid, bifosfonatlar,tetrsklinler vb Prostaglandinler Diğer infeksiyonlar; viral, fungal, tbc Büyüme faktörleri ( EGF, TGF, FGF..) Safra asitleri Mukozal immunite Sigara, alkol ve kimyasal irritanlar Nöromüsküler savunma mekanizmaları Stres d.Peptik Ülser Patogenezinde Etkili Faktörler 1.Helicobacter Pyori Saldırgan güçler arasında Helicobacter pylorei önemli bir yer tutmakta olup, dünya popülasyonunun %50’den fazlası bu bakteri ile enfektedir(54). Bu enfeksiyon duodenum ve midenin peptik ülsrasyonu ile kuvvetle ilişkilidir, hatta konuyla ilgili ilk çalışmalarda duodenal ülser vakalarının tamamı ve gastrik ülser vakalarının önemli bir kısmının Helicobacter pylori ile ilişkili olduğu gösterilmiştir(55). Daha yakın zamanda yapılan çalışmalarda bu erken verilerin biraz abartılı olduğu ortaya çıkarılmıştır(56). ABD’de duodenal ülserlerin %80’i, gastrik ülserlerin %60’dan fazlası bu organizma ile enfekte bulunmuş. Helicobacter pylorinin peptik ülser hastalığı ile kuvvetli ilişkisi gösterilmiş olmasına rağmen enfeksiyonun ülserasyona nasıl yol açtığı tam olarak anlaşılamamıştır. Bu organizmaya bütün dünyada rastlanır ve gelişmekte olan ülkelerde en yüksek enfeksiyon oranına sahip patojendir. Enfeksiyonun endemik olduğu bölgelerde ajanın çocukluk dönemlerde alındığı ve yıllar boyunca vücutta bulunduğu düşünülmektedir. Gelişmekte olan ülkelerde 2-8 yaş arası çocuklarda Helicobacter enfeksiyonu her yıl %10 yayılır(55), sonuç olarak ergenlik çağındaki birylerin çoğu bu mikropla enfekte olur(57). Batıda Helicobacter 36 pylori infeksiyonu 40 yaş altı bireylerde %20, 60 yaş üstünde ise %50 civarındadır(58,59). Enfeksiyona sahip kişilerin hemen hepsinde midede inflamasyon bulguları vardır. Tedavi edilmediği taktirde 10 yıllarca sebat eder ve gastrik atrofi ve intestinal metaplaziye yolaçar, enfeksiyonun eradikasyonu ile gastrik inflamasyon kaybolur(60). Helicobacterin kronik infeksiyon yaptığına dair kanıtlar, organizmayı gönüllü olarak alan birkaç araştırmacının yaptığı çalışmalarla saptanmıştır, bu araştırmacılarda kronik superfisial gastrit gelişmiş olup antibioterapi ile Helicobacter enfeksiyonunun ortadan kalktığı gözlemlenmiştir(61). Helicobacter ile kronik enfekte bireylerin %20’den azında peptik ülser gelişir(62). Bu durum enfekte olan bireylerde peptik ülser hastalığı gelişiminin, konağın duyarlılığı ve enfeksiyon yapan bakteri türünün virulansı gibi faktörleri de içeren kompleks ve tam olarak anlaşılamamış etkileşimleri içerdiğini gösterir. Ülser patogenezindeki mekanizmanın ne olduğuna bakılmaksızın uzun süreli çalışmalar, Helicobacter eradikasyonunun ülser nüks oranını yılda %10’un altına indirdiğini göstermiştir(63,64). Helicobacter pylori bazı hastalarda asit hipersekresyonu ve duodenal ülserasyona sebep olurken, diğerlerinde gastrik atrofi, intestinal metaplazi ve kansere yol açması paradoks bir durum olarak gözükmektedir(65). Popüler bir hipoteze görer Helicobacter enfeksiyonunun gidişatını uyardığı gastritin tipi ve şiddeti ile ilişkilendirilmiştir(66). Bu hipoteze göre, midenin asit sekresyonunu yapan kısmını değil, baskın olarak antrumu tutan Helicobacter infeksiyonu, duodenal ülser gelişimini kolaylaştırır. Bunun tersine oksinitik mukozanın yoğun inflamasyonuna sebep olan Helicobacter, gastrik atrofiye ve asit sekresyonunda azalmaya yol açar, ve gastrik ülserasyon ve kanser gelişme riskini arttırır. Helicobacterin uyardığı gastritin şiddeti ve paterni infeksiyona yol açan organizmanın virulansı, konak faktörleri, konağın yaşı ve çevresel faktörler tarafından belirlenir. Bu hipotez konsept olarak ilgi çekici olsa da daha çok spekülasyona dayalı olup kanıtlanması için daha fazla araştırma gereklidir. Helicobacter pylori, noninvazif, spor üretmeyen, S şeklinde, gram negatif, yaklaşık 0,5-3,5 mikron boyutlarında bir basildir. Bu ince noninvazif sipiral şekilli organizmanın, mukozanın savunma sistemlerini bozmasındaki olası mekanizmalara özellikle değinmek gereklidir. Bu mekanizmalardan en olası olanlar şunlardır; -Helicobacter pylori dokuları invaze etmediği halde, şiddetli bir inflamatuar ve immun yanıta neden olur. Đntelökin (ĐL)-1, ĐL-6, tümör nekroz faktör (TNF) ve en önemlisi ĐL-8 gibi proinflamatuar sitokinlerin üretimi artar. ĐL-8 mukoza epitel hücreleri tarafından üretilir, nötrofillerin toplanmalarını ve aktif hale gelmelerini sağlar. -Çeşitli bakteriyel gen ürünleri de epitel hasarına ve inflamasyonun başlamasına neden olarak olaya katılırlar. Helicobacter pylori, üreyi parçalayarak amonyum klorür ve monokloramin gibi toksik maddelerin ortaya çıkmasına neden olan üreaz enzimini salgılar. 37 Organizma ayrıca, yüzey epitel hücrelerine hasar veren fosfolipazları da arttırır. Bakteriyel proteazlar ve fosfolipazlar gastrik mukus içindeki glikoprotein-lipid komplekslerini parçalarlar ve böylece mukozal savunma sistemini zayıflatmada ilk aşamayı geçerler. Vakuolizan toksin (VacA) da epitel hasarına neden olur. Sitotoksin bağlantılı gen A (CagA) tarafından kodlanan başka bir toksinin, epitel hücrelerinde ĐL-8 üretimini arttırıcı etkisi vardır. -H.pylori, gastrik asit salgısını arttırır ve duodenumda bikarbonat üretimini azaltır. Buna bağlı olarak duodenumda lümen içi basınç düşer. Bu bozulmuş ortamın, duodenumun birinci kısmında gastrik metaplazi (gastrik epitel varlığı) olasılığını arttırdığı düşünülmektedir. Bu tip metaplastik odaklar H.pylori kolonizasyonu için ortam sağlamaktadır. -Çeşitli H.pylori proteinleri immunujeniktir. Bunlar mukozada bağışıklık cevabını başlatırlar. H.pylori nedenli kronik gastritte hem aktive T hücreleri, hem de B hüreleri görülür. T ve B hücrelerinin epitel hasarındaki rolü henüz tam olarak aydınlatılamamıştır. Ancak, T hücreleri yardımıyla aktive hale gelen B hücrelerinin gastrik lenfoma patogenezinde rolü olabilir. H.pylori enfeksiyonu olan bireylerin sadece %10-20’sinde peptik ülser gelişir. Enfeksiyona sahip olanların çoğunda neden ülser gelişmediği ve bir kısmının neden ülsere meyilli olduğu bilinmemektedir. H.pylori ile mukoza arasında, ne olduğu bilinmeyen, sadece bazı bireylerde var olan bir ilişkinin olduğu düşünülmektedir. Kanıtlar bazı bakteriyel faktörleri işaret etmektedir. VacA ve CagA üreten suşlar dokuda daha yoğun bir inflamasyona ve sitokin üretimine neden olurlar. Son yıllardaki moleküler analizlerde , farklı suşlar arasında ve bunların patojenliklerinde önemli genetik farklar olduğu ortaya konmuştur. H.pylori enfeksiyonu ile gastrik ve duodenalülserler arasında bağlantı olduğu saptanırken, ülserasyona neden olan konak-patojen ilişkileri henüz aydınlatılamamıştır.(28,45,52,53) 2.Nonsteroid Anti Đnfalamatuar Druglar (NSAĐD) Helicobacter pylori enfeksiyonu olmayan hastalardaki gastrik ülserasyonun ana nedeni NSAĐD’lerdir(55). NSAĐD kullanımına bağlı peptik ülserasyon tipik olarak semptomsuzdur, fakat bazı ülserler semptomatik olabilir ve gastrointestinal kanama, perforasyon ve/veya obsturuksiyon gibi komplikasyonlara yol açabilir. Kronik olarak NSAĐD tüketen bireylerin yaklaşık %50’sinde peteşi ve erozyon gibi superfisiyel gastrik lezyonlar bulunur fakat; bu lezyonlar klinik olarak önemsiz gibi gözükmektedir. Bu hastaların %15-45’inde endoskopik olarak gösterilen asemptomatik ülserasyonlar bulunur(67,68,69,70). Bununla birlikte bir yıl boyunca NSAĐD kullanan hastaların %14’ünde ciddi gastrointestinal komplikasyonlar gelişecektir(70). 38 NSAĐD’e bağlı ülserlerin patofizyolojisi 2 gruba ayrılabilir; 1-Siklooksijenaz (COX) enzim inhibisyonuna bağlı olanlar ve 2- Siklooksijenaz inhibisyonundan bağımsız olanlar. COX enzim inhibisyonundan bağımsız olanlar mukozal toksik olayları içerir, NSAĐD alımı sonrasında akut olarak gözlenen kanamalar ve erozyonlardan sorumlu olen en önemli mekanizma NSAĐD’lerin topikal etkileridir, bu ilaçların alınımını takiben birkaç dakika içinde yüzey epiteinde soyulma ve mukozal geçirgenlikte artış gözlenir(71). NSAĐD’lerin çoğu zayıf organik asit yapıdadır ve bu yüzden asidik gastrik sıvıda iyonize olmazlar böylece serbestçe yağda çözünürler. Yağda çözünen iyonize olmayan NSAĐD’ler gastrik mukozal epitel hücre membranlarından sitoplazmaya difüzyonla geçerek burda nötral pH da iyonize olurlar. Bu yüzden hücre içinde tutulurlar. Hücre içinde yüksek konsantrasyonda NSAĐD bulunması lokal toksik etkilerin meydana gelmesine yol açar. Bu lokal etki mekanizmalarından bir tanesi gastrik mukoz jel tabakanın yüzey hidrofobitesinin ve fosfolipid içeriğinin azalmasıdır(72). Başka bir mekanizma da oksidatif fosforilasyonun bozulması ve mitokondrial enerji azalması, hücresel bütünlükte zayıflama ve hücresel permabilitede artmadır. Safrayla atılan bazı NSAĐD metabolitleri gastrointestinal mukozya zarar verebilmektedir(73). Enterik kaplı NSAĐD’ler kısa dönem (1-2 haftalık) uygulamada enterik kaplı olmayanlarla karşılaştırıldığında daha az akut topikal erozif ve hemorajik hasara yol açarlar(74), ki bu gözlem NSAĐD’lerin topikal etkiler vasıtasıyla hasra verdiğini ıspatlar niteliktedir. Fakat enterik kaplı formülasyonların uzun süre uygulanması muhtemelen sistemik mekanizmalarla hasara verme yoluyla enterik kaplı olmayan ilaçlarla karşılaştırıldığında çok da farklı oranlarda olmayan biçimde kanamalı gastrik ve duodenal ülserlere yol açarlar. Daha da fazlası NSAĐD’ler intravenöz veya rektal suppozutuar yolla verildiğinde gastrik ve duodenal ülserler gelişmektedir. Bu durum topikal değil, sistemik etkiyi yansıtır(75,76) Siklooksijenaz prostaglandin sentezinde hız sınırlayıcı enzimdir ve sistemik olarak NSAĐD’ler tarafından inhibe edilmesi, bu ilaçlara bağlı gastrointestinal toksisite gelişmesinde en temel mekanizmadır. NSAĐD’lere bağlı mukozal hasar gelişiminde COX inhibisyonu net bir biçimde önemli rol oynuyorsa da hasar gelişiminde NSAĐD’lerin muhtemel diğer etkileri de katkıda bulunmaktadır. NSAĐD alımı sonrası gastrik asit sekresyonu artar(77), gastrik mukozal kan akımı azalır(78), gastrointestinal mukus sekresyonu azalır(79), dudenal bikarbonat sekresyonu azalır(80). Bunlar arasında gastrointestinal kan akımının azalması muhtemelen NSAĐD’e bağlı gastrointestinal hasar gelişimine katkıda bulunan majör faktördür. NSAĐD’e bağlı mukozal hasar gelişimiile ilgili şimdiye kadar elde edilen veriler ışığında mukozal hasar gelişimi için prostaglandin supresyonu mutlaka gerekli bir mekanizma olarak görülüyorsa da nötrofilin vasküler 39 adherensi ve gastrointestinal mukozal kan akımındaki değişiklikler de gerekli mekanizmalar olarak görülebilir. Topikal mukozal irritasyon da muhtemelen diğer mukozal fizyolojik değişikliklerin gelişimine katkıda bulunmaktadır. 3.Helicobacter pylori ve NSAĐD kullanımı NSAĐD kullanımı ve Helicobacter pylori genellikle peptik ülser gelişimi açısından bağımsız risk faktörleri olarak algılanırlar(81). Bununla birlikte helicobacter ve NSAĐD kullanımının ülser hastalığı gelişme riskini, beklenenden daha da fazla arttırdığı gözlemlenmiştir. Helicobacter ile enfekte NSAĐD kullanıcıları, Helicobacter negatif kullanıcılarla karşılaştırıldığında kanayan peptik ülser gelişme riski 2 kat artmıştır(82), ve düşük doz aspirin Helicobacter pozitif bireylerde, Helicobacter negatiflere göre daha fazla gastrik hasar oluşturur(83). Çözümlenmemiş sorunlardan biri de NSAĐD alan tüm hastaların Helicobacter açısından test edilip edilmemesi gerekliliğidir. NSAĐD kullanımına bakılmaksızın peptik ülserli ve helicobacter pozitif hastaların hepsinde erradikasyon tedavisi yapılmalıdır. Kronik NSAĐD kullanan ve peptik ülser hikayesi olmayan hastalara da helicobacter için test yapılması ve erradikasyonu, sonraki dönemlerde ülser gelişme riskini azaltıp azaltmadığına dair klinik veriler çelişkilidir. Bir çalışmada ülser öyküsü olmayan hastalara da NSAĐD kullanımı öncesinde helicobacter eradikasyonunun yapılması, 8 haftalık Naproksen kullanımı sonrası NSAĐD’e bağlı endoskopik ülser gelişimini azalltığını göstermiştir(84). Fakat başka bir çalışma peptik ülser hikayesi olan hastalarda eradikasyonun 6 aylık NSAĐD tedavi sonrasında endoskopik ülser oranını azaltmadığını göstermiştir(85). Helicobacter ve aspirinin gastrointestinal sistem üzerinde sinerjistik zararlı etkileri olabilir ve aspirin alan bazı yüksek riskli hastalarda Helicobacter eradikasyonu faydalı olabilir(83,86,87), fakat bu konularda daha fazla araştırma gerekmektedir. NSAĐD’ların gastroduodenal etkileri, akut erozif gastrit ve akut gastrik ülserasyondan peptik ülserasyona kadar geniş bir çeşitliliğe sahiptir. NSAĐD’ler en sık kullanılan ilaçlar arasında yer aldıklarından, bu ajanların neden olduğu gastroduodenal toksisitenin risk faktörleri, ileri yaş, yüksek doz ve uzun süre kullanımdır. Bu nedenle, kronik romatizmal hastalıklar nedeniyle bu ilaçları kullananlar yüksek risk grubunda yer alırlar, Mukozada prostaglandin sentezinin baskılanması NSAĐD nedenli peptik ülserasyonda önemli rol oynar. Prostaglandin sentezinin baskılanması sonucu hidroklorik asit salgısı artar, bikarbonat ve müsin üretimi azalır. Müsin kaybı, normalde asidin epitele ulaşmasını engelleyen mukozal bariyerin aşılmasına neden olur. Bir serbest radikal avcısı olan Glutatyon sentezi de azalmıştır. Bazı NSAĐD’ler henüz tam olarak aydınlatılamamış mekanizmalar ile, angiogenezi de baskılayıp ülserlerin iyileşmesine engel olurlar. Beraberinde Helicobacter pylori enfeksiyonu varlığının NSAĐD nedenli ülserasyonda rolü olup olmadığı henüz bilinmemektedir.NSAĐD lokal ve sistemik etki göstermektedir. Lokal 40 etki enterik kaplı preparatlarla kısmen önlenmektedir. NSAĐD genellikle zayıf asidik ilaçlardır, midenin kuvvetli asidik ortamında iyonlaşmadan kolaylıkla epitel içine geçmekte, epitel içinde NSAĐD+H+ oluşmakta ve hücre içi asidozu sonucu hasar oluşmaktadır. Đndometazin ve sulndak ön ilacı emildikten sonra major gastrointestinal kanamalara yol açmakta, bu bulgu sistemik etkiyi desteklemektedir. Mukoza hasarı ilacın dozu ve kullanım süresiyle orantılı olarak artmaktadır. NSAĐD’ler midede koruyucu etkileri olan prostaglandin sentezini, siklooksijenazı inhibe ederek durdururlar.(28,45,52,53) Prostaglandinler, aşağıdaki mekanizmaları etkilerler; -Bikarbonat sekresyon artışı -Kan akımı artşı -Hücre proliferasyonu artışı -Hücre membran stabilizasyonu -Yüzey aktif fosfolipid stabilizasyonu -Lizozim stabilizasyonu -Mukozal sülfidril bileşiklerinin devamının sağlanması -Đyon transportunda artış, mekanizmalarını etkilerler. NSAĐD’larin gastrointestinal sistemde artmış toksisite risk grupları -Yaşlı hasatalar -Komorbidite -Peptik ülser, kanama, perforasyon anamnezi -Antülser ilaç kullanma anamnezi -Daha önce NSAĐD kullanımında semptomlar -NSAĐD çeşidi, doz ve süresi -Antikoagülan, steroid veya aspirinle kullanımı -Postoperatif kullanma Diğer faktörler, peptik ülserasyona yol açmada tek başına ya da H.pylori ile birlikte etkin olurlar. 4.Sigara içimi: Epidemiyolojik ve klinik çalışmalar sonucunda sigara içme ile peptik ülser arasında sıkı bir ilişki saptanmıştır. Peptik ülser sigara içenlerde içmeyenlerden 2 kat daha sık görülmektedir. Đçilen sigara miktarı ve içme süresiyle orantılı olarak özellikle gastrik ülser riski artmaktadır. Sigara içenlerde ülser boyutu daha büyük, iyileşme hızı daha yavaştır. Ülser relapsı sigara içenlerde daha fazladır. Kadınlarda ülser oranın artması sigara içmeye bağlı olabilir. Sigaraya bağlı ülser gelişme mekanizması; Nikotin duodenumda mukozal kan 41 akımını azaltmaktadır. Prostagalndin E sentezini inhibe etmektedir. Uzun süre nikotin verilmesi sonucu mide parietal hücre kitlesi artmaktadır. Sigara içenlerde pentagastrinle maksimal asit outputu artmaktadır. Sigara içenlerde gündüz mide pHsı içmeyenlerden daha düşüktür. Sigara pankreatik bikarbonat sekresyonunu azaltmakta ve duodenogastrik reflüyü arttırmaktadır. Duodenal ülserli hastalarda antisekretuar ilaçların etkisi baskılanmakta, bulbusta asidite süresi uzamaktadır. Nikotinin gastroduodenal etkileri -Pepsin sekresyonu artar -Mide motilitesi artar -Duodenogastrik reflü artar -Serbest radikaller artar -Platelet activated faktör (PAF), endotelin, vasopressin düzeyi artar -Prostaglandin sentezi azalır -Mide mukozal kan akımı, mukus ve Endotelin growth faktör (EGF) azalır, mukozal kan akımını ve dolayısıyla iyileşmeyi engeller. 5.Alkol: Akolün peptik ülser oluşumuna direkt etkisi kanıtlanmamıştır, fakat alkolik siroz, peptik ülser insidansı artışı ile yakından ilişkilidir. Alkolün akut gastrik mukozal hasar yaptığı gösterilmiştir. Akolün peptik ülserdeki etkisi tartışmalıdır. Orta derecede alkol alımının ülser iyileşmesine faydalı olduğunu bildiren çalışmaların yanısıra tam tersini gözlemleyen çalışmalar da mevcuttur. Bir kadeh şarabın midede potent sekretuar etkisi vardır, şarap gastrin düzeyinde belirgin artışa neden olmaktadır. 6.Stres ve Yaşam tarzı: Stresle peptik ülser ilişkisini saptamak zordur. Stres, kişiliğe, eğitime, zekaya, gelire, işe, yaşa ve geçirilmiş tecrübeler gibi bir çok faktöre bağlı olarak değişebilir. Objektif değerlendirme imkanının olmayışı konuyu zorlaştırmaktadır. Stresle peptik ülser arasında bazı çalışmalarda ilgi saptanmamış, bazı çalışmalar da ise saptanmıştır. Peptik ülser, kişilik bozukluğu, hipokondriak özellikler, pesimist, aşırı bağımlı kişilerde daha sık görülmektedir. Đkinci dünya savaşı sırasında Londra’da perfore peptik ülser sıklığında artış görülmüştür. Ağır ve stresli işlerde çalışanlarda peptik ülser daha sıktır. Psikolojik faktörlerin ülsere yol açma mekanizması bilinmemektedir. Emosyonel faktörler mide sekresyonu ve mide motor fonksiyonlarını etkilemektedir. Mide asit salgısı artmaktadır. Serum gastrin ve pepsinojen düzeylerinde belirgin artış görülmektedir. Stres sonucu duodenal ülserli hastalarda dolaşımda nörotransmiterler ve tromboksan ve lökotrien gibi lokal sitotoksik mediatörler artmaktadır. Deney hayvanlarında strese bağlı mukozal iskemi saptanmıştır. 42 7.Diyetsel faktörler: Kahve içimi dispepsiye neden olur. Kahve ve peptik ülser ilişkisi tartışmalıdır. Kahve kafein içeriğinden bağımsız olarak mide asit sekresyonu ve gastrin salgısını arttırmaktadır. Bunu içerdiği karbonhidrat, aminoasit, protein, yağ ve fenol gibi maddelerle yapmaktadır. Sonuç olarak kahve ülsere neden olmamakta, ancak ülser semptomlarını arttırmaktadır. Diyetin fiber içeriği ile ülser arasında pozitif veya negatif ilişki saptayan çalışmalar vardır. Ratlara hidrofobisiteyi arttıran lamellar cisimcikler içeren muz verildiğinde mide mukozasını asit etkisinden koruduğu saptanmıştır. Kepeğin gastrik ülserli kişilerde mide asit konsantrasyonunu azalttığı, pepsin konsantrasyonunu düşürdüğü saptanmıştır. Diyette bulunan keto aldehitlerin deneysel çalışmalarda gastrik mukozal hasara yol açtığı saptanmış ve bunu intraseluler Glutatyon düzeyini düşürmesine bağlamışlardır. Glutatyon prekürsörü olan sistein, serbest radikal tutucu özelliği olan alfa-tokoferol keto aldehitlerin lipid peroksidasyonu ve mukozal ülser yapıcı etkisini bloke etmektedir. Linoleik asit prostaglandin-E prekürsörüdür, duodenal ülserli hastalarda adipoz doku linoleik asit miktarı düşük bulunmuştur. Bu duodenal ülserli kişilerin linoleik asitten fakir diyetle beslendiğini yansıtmaktadır. Biber ve baharatın ülserojenik olduğunu bildiren çalışmaların yanı sıra tam tersi bildiriler de vardır. Kırmızı biberde capsaicin bulunur, bu madde ince afferent nöronları uyarmakta ve gastrik mukozal kan akımını arttırmaktadır, bu etkinin sitoprotektif olduğu gösterilmiştir. Kortikosteroidler yüksek dozda kullanıldıklarında ülser oluşumuna neden olurlar. Sonuç olarak; Helicobacter pylori varlığında bile, kişiliğin ve psikolojik stresin yan etkenler olduğu konusundaki tartışmalar, neden ve sonuç ilişkileri hakkında yeterli veri bulunmamasına reğmen devam etmektedir.(45,46,51,53) I.Peptik ülserin arttığı hastalıklar -Zolinger-Ellison sendromu -Bazofilik lösemi -Sistemik mastositozis -MEN Tip-1 -Kronik pulmoner hastalık -Kronik renal hastalık -Karaciğer sirozu -Nefrolitiyazis -Alfa-1 antitripsin eksikliği -Crohn hastalığı -Hiperparatiroidi 43 -Koroner arter hastalığı -Polisitemia vera -Kronik pankreatit -Akciğer kanseri II.Peptik ülserin azaldığı hastalıklar -Pernisyöz anemi -Poliglandüler otoimmun yetmezlikler; Addison hastalığı, otoimmun tiroidit, tip-1 daibet ve otoimmun hepatit -Mide kanserinde duodenal ülser görülme sıklığı azdır. III.Peptik ülserle birlikte bulunan nadir genetik sendromlar -MEN Tip-1 -Sistemik mastositozis -Ülser-tremor-nistagmus sendromu -Amiloidoz Tip-4 -Multipl lentigo-ülser sendromu -Lokonischia- kolelityasis-ülser sendromu 44 4.MATERYAL VE METOD Hasta Seçimi ve Đstatistiksel Analiz Sağlık Bakanlığı Okmeydanı Eğitim Araştırma Hasatanesi Acil Dahiliye servisine 2002-2005 yılları arasında üst gastrointestinal sistem kanaması ile başvuran hastalar çalışmaya alındı. Bu hastalar; her yıl, ramazandan bir ay önce, ramazan ayı ve ramazandan sonraki ay olmak üzere üç gruba ayrılarak retrospektif dosya taraması şeklinde incelendi. Acil servsie üst gastrointestinal kanama semptomlarıyla başvuran, endoskopik olarak tanısıs kesinleşen hastalar çalışmaya alındı. Mide ve duodenumu primer olarak ilgilendiren, açlık ve beslenme alışkanlığı değişikliklerinin, mukozal hasar mekanizmalarını etkilemesi ile ortaya çıkabileceği düşünülen tanılar çalışmaya alındı. Etyolojik tanı olarak; duodenal ülser, mide ülseri, erozif gastroduodenit, nonerozif gastroduodenit, özofajitler değerlendirilmeye alındı. Bunlar dışında üst gastrointestinal sistem kanamasına yol açan diğer hastalıklar; özofagus varisleri, maligniteler, malignite şüpheli lezyonlar, AV malformasyonlar, korozif ve toksik madde kullananalar, nonsteroid antiinflamatuar drug kullanımı, herhangi başka bir nedenle hastanede yatarken kanama geçiren hastalar, ileri derece kronik hastalıklar; kronik böbrek yetmezliği, karaciğer sirozu, konjestif kalp yetmezliği, iskemik kalp hastalığı, diabetes mellitus, korpulmonale, serebrovasküler aksedan geçiren hastalar, ileri derece kronik obstruktif akciğer hastalığı ve geçirilmiş gastroduodenal operasyon hikayesi olan hastalar çalışma dışı bırakıldı. 45 5.BULGULAR Hastaların yıllara göre dağılımına baktığımızda; 2002’de 149, 2003’te 95, 2004’te 126 ve 2005’te de 116 olmak üzere toplam 486 üst gastrosistem kanamalı hasta dosyası tarandı. Ayrıca tüm hastaların; Ramazandan önceki ay toplam 171, Ramazan ayında toplam 164 ve Ramazandan sonraki ayda toplam 151 olmak üzere 486 üst GĐS kanamalı hasta tarandı. Tablo 5: hastaların yıllara göre dağılım Tablo 6: hastaların aylara göre dağılımı yıl sayı yüzde % zaman sayı yüzde % 2002 149 30,7 Ramazan öncesi 171 35,2 2003 95 19,5 Ramazan 164 33,7 2004 126 25,9 Ramazan sonrası 151 31,1 2005 116 23,9 total 486 100,0 486 100,0 Grafik1: 2002-2005 yılları Ramazan öncesi, Ramazan ayı ve Ramazan sonrası total tanı sayısını ve yüzdesini gösteren zama-tanı garfiği 2002-2005 90 80 70 60 50 40 30 20 10 0 d.ulser m.ulseri erozif gd. nonerozif gd. özofajit RÖ R RS Tablo 7: 2002-2005 yılları Ramazan öncesi, Ramazan ayı ve Ramazan sonrası total tanı sayısı ve yüzdesi zaman tanılar d.ülser m.ülseri erozif gd. nonerozif gd. özofajit total P<0,05 86 %50,3 28 %16,4 23 %13,5 26 %15,2 8 %4,7 171 %35,2 RÖ 86 %52,4 24 %14,6 13 %7,9 34 %20,7 7 %4,3 164 %33,7 0,642 R 72 %47,7 21 %13,9 20 %13,2 33 %21,9 5 %3,3 151 %31,1 RS 46 Grafik 2: 2002-2005 yılları total tanı sayısı ve yüzdesini gösteren zaman-tanı grafiği 2002-2005 80 70 60 d.ulser 50 m.ulser 40 erozif gd. 30 nonerozif gd. 20 özofajit 10 0 2002 2003 2004 2005 Tablo 8: 2002-2005 yılları total tanı sayısı ve yüzdesi zaman d.ülser 80 48 62 54 2002 2003 2004 2005 %50,7 %50,5 %49,2 %46,6 m.ülseri tanılar erozif gd. nonerozif gd. 22 %14,8 13 %13,7 22 %17,5 16 %13,8 16 9 16 15 %10,7 %9,5 %12,7 %12,9 28 20 23 22 %18,8 %21,1 %18,3 %19,0 özofajit 3 5 3 9 %2,2 %3,9 %2,4 %7,8 total P<0,05 149 %30,7 95 %19,5 126 %25,9 116 %23,9 0,701 Grafik 3: 2002 Ramazan öncesi, Ramazan ayı ve Ramazana sonrası tanı-zaman garfiği 2002 30 25 d.ulser 20 m.ulseri 15 erozif gd. 10 nonerozif gd özofajit 5 0 RÖ R RS Tablo 9: 2002 Ramazan öncesi, Ramazan ayı ve Ramazana sonrası tanı sayısı ve yüzdesi zaman 2002 RÖ R RS tanılar d.ülser 30 %50,8 25 %62,5 25 %50,0 m.ülseri 10 %16,9 4 %10,0 8 %16,0 Erozif gd. 6 %10,2 3 %7,5 7 %14,0 Nonerozif gd. 11 %18,6 8 %20,0 9 %18,0 özofajit 2 %3,4 0 %0 1 %2,0 total 59 40 50 P<0,05 0,860 47 Grafik 4: 2003 Ramazan öncesi, Ramazan ayı ve Ramazana sonrası tanı-zaman garfiği 2003 20 15 d.ulser m.ulseri 10 erozif gd. nonerozif gd. 5 özofajit 0 RÖ R RS Tablo 10: 2003 Ramazan öncesi, Ramazan ayı ve Ramazana sonrası tanı tablosu ve garfiği zaman 2003 RÖ R RS tanılar d.ülser 17 %41,5 19 %59,4 12 %54,5 m.ülseri 6 %14,6 3 %9,4 4 %18,2 Erozif gd. 6 %14,6 1 %3,1 2 %9,1 Nonerozif gd. 11 %26,8 6 %18,8 3 %13,6 özofajit 1 %2,4 3 %9,4 1 %4,5 total 41 32 22 P<0,05 0,482 Grafik 5: 2004 Ramazan öncesi, Ramazan ayı ve Ramazana sonrası tanı-zaman garfiği 2004 25 20 d.ulser 15 m.ulseri erozif gd. 10 nonerozif gd. 5 özofajit 0 RÖ R RS Tablo 11: 2004 Ramazan öncesi, Ramazan ayı ve Ramazana sonrası tanı tablosu ve garfiği zaman RÖ R RS tanılar d.ülser 20 %57,1 25 %50,0 17 %41,5 m.ülseri 6 %17,1 12 %24,0 4 %9,8 Erozif gd. 6 %17,1 3 %6,0 7 %17,1 Nonerozif gd. 2 %5,7 9 %18,0 12 %29,3 özofajit 1 %2,9 1 %2,0 1 %2,4 total 35 50 41 P<0,05 0,138 48 Grafik 6: 2005 Ramazan öncesi, Ramazan ayı ve Ramazana sonrası tanı-zaman garfiği 2005 20 15 d.ulser m.ulseri 10 erozif gd. nonerozif gd. 5 özofajit 0 RÖ R RS Tablo 12: 2005 Ramazan öncesi, Ramazan ayı ve Ramazana sonrası tanı tablosu ve garfiği zaman tanılar d.ülser 19 %52,8 17 %40,5 18 %47,4 RÖ R RS m.ülseri 6 %16,7 5 %11,9 5 %13,2 Erozif gd. 5 %13,9 6 %14,3 4 %10,5 Nonerozif gd. 2 %5,6 11 %26,2 9 %23,7 özofajit 4 %11,1 3 %7,1 2 %5,3 total 36 42 38 P<0,05 0,527 Hastaların 118’i(%24,3) kadın, 368’i(%75,7) erkekti.Yaş ortalaması 50,57, yaş aralığı 15-81 di. Ramazandan önce; duodenal ülser: 86(%50,3), mide ülseri: 28(%16,4), erozif gastroduodenit: 23(%13,5), nonreozif gastroduodenit. 26(%15,2), özofajit: 8 (%4,7) toplam:171 (%35,2). Ramazan ayında; duodenal ülser: 86(%52,4), mide ülseri:24(%14,6), erozif gastroduodenit:13(%7,9), nonerozif gastroduodenit: 34(%20,7) ,özofajit: 7(%4,3), toplam:164(%33,7), Ramazandan sonraki ayda; duodenal ülser: 72(%47,7), mide ülseri: 21(%13,9), erozif gastroduodenit: 20(%13,2), nonreozif gastroduodenit: 33 (%21,9), özofajit: 5(%3,3) toplam: 151(%31,1) saptandı.Yapılan χ² testi değerlendirilmesinde Ramazan ayından önce, Ramazan ayında, Ramazan ayından sonraki üst GĐS kanaması etyolojisi ve sıklığı arsında anlamlı fark bulunmadı. 49 6.TARTIŞMA Ramazan orucu, ülkemizde ve dünyada yaşayan yaklaşık 1,5 milyar müslüman tarafından yaygın olarak yerine getirilen bir ibadettir. Ülkemizde bazı sosyal araştırma merkezlerinin yaptığı anket ve saha çalışmalarında, erişikin insanların büyük bir yüzdesinin ramazan ayında düzenli olarak oruç tutuğunu saptamıştır(6). Bu verilerden yola çıktığımız taktirde ülkemizde her yıl ortalama bir ay boyunca, erişkin nüfus %60 olarak hesaplandığında, 35 milyona yakın insan oruç tutmaktadır. Dünya verileri hakkında sağlıklı bilgiler ve kayıtlar olmasa da, ülkeden ülkeye değişmekle birlikte ortalama 700800 milyon insanın yeryüzünde her yıl bir ay boyunca düzenli olarak oruç tuttuğu düşünülmektedir. Ramazan ayı; hicri takvimine göre hesaplandığından,- bu takvim ayın siklusuna göre hesplanır ve bir yıl 354 gün sürer- gerçek zamana göre her yıl 11 gün geri kalarak, mevsim yönünün tersine ilerleyerek yılın tüm zamanlarında görülür. Bu hesaptan her yıl 11 gün geri kalan ramazan ayı 33 yılda dört mevsimde de görülerek döngüsünü tamamlayıp başladığı zamandan tekrarlar. Yaz aylarında 18 saate kadar çıkan açlık süresi kışın 11 saate kadar geriler. Yazın sıcaktan kaynaklanan sıvı kabının, metobolizma üzerindeki değişikliklerden ortaya çıkabilecek stresler, sistemler ve organlar üzerinde diğer zamanlara göre daha farklı sonuçlar doğurabilir. Bu beslenme alışkanlığı değişikliklerinin yol açabileceği medikal problemler var mı? Varsa, bu medikal problemlerden kaynaklanabilecek; insan sağlığı, ekonomik, sosyal durum, iş gücü , yaşam kalitesi vs.gibi durumlar nasıl değişir? gibi bir takım sorulardan yola çıkarak biz de yaşadığımız toplumu yakından ilgilendiren bir araştırma planladık. Medikal anlamda oruç bir nevi beslenme alışkanlığı değişikliği olduğu için, beklenenbilecek semptom, belirti, bulgu ve hastalıkların da primer olarak beslenme ile ilgili sistemlerden kaynaklanabileceği düşünülebilir. Yaygın kanı; özellikle ramazan ayında oruç tutan insanlarda gastrointestinal sistem kaynaklı şikayetlerin arttığı yönündedir. Ramazan ayındaki beslenme alışkanlığı değişikliklerinin insan sağlığı üzerindeki etkisi, var olan hastalıkların takip ve tedavi rejimleri ile ilgili ülkemizde ve dünya da çeşitli araştırmalar yapımış ve yayınlanmıştır. Ancak bu çalışmalar yapılırken, araştırma metodolojisinde standardizasyon olmadığından dolayı Ramazan orucu ile ilgili veriler çoğunlukla çelişkili olmuştur. Oruç, uyku düzenini değiştirir, fiziksel aktivite ve yeme alışkanlıkları değişikliğine yol açar ki bu durum hem hastalıkta hem de sağlıkta metabolizma üzerinde değişiklikler yapmaktadır. Bu çalışmaların yılın hangi zamanında ve hangi mevsiminde olduğunu de içeren çeşitli değişiklikler ya hiç kaydedilmemiş ya da atlanmıştır, özellikle ramazanın 50 uzun sıcak yaz günlerinde veya kısa soğuk kış günlerine denk geldiği durumlar gözardı edilmiştir(88). Biz çalışmaya başlamadan önce şu soruları kendimize sorduk. Ramazan açlığı gastronitestinal sistem üzerinde ne gibi değişikliklere neden olabilir? Açlık, gastrik asiditeyi etkileyerek gastrik mukozal bütünlük dengesini bozup epitel hasarına yol açabilir mi? Ortaya çıkabilecek mide yüzey hasarı hastaların semptomlarını ve yüzey hasarı kaynaklı hastalık ve komplikasyonları artırıyor mu? Ramazan açlığı istemli bir beslenme değişikliği olduğuna göre bu istemli açlık asidik vagal uyarılarda bir inhibisyona neden olabilir mi? Gastroduodenal mukozal bütünlüğün bozulması ile sonuçlanan birtakım hastalıkların etyolojisi tam olarak aydınlılamamış olsa da, mukozal bütünlüğü sağlayan koruyucu faktörler ile sindirim işlemi için gerekli olan asit-proteolitik mekanizma denge halinin çeşitli nedenlerden dolayı mide mukozasını sindirilmesi yönünde bozulması ile açıklanmaktadır. Ülser oluşumunda temel patogenez, gastroduodenal mukozanın bütünlüğünün, agresif ve koruyucu/onarıcı faktörler arasındaki dengenin değişmesine bağlı olarak bozulmasıdır. En önemli agresif faktörler olan asit ve pepsin, gastroduodenal mukozanın koruyucu/onarıcı mekanizmalarını; genetik, çevresel ve enfeksiyöz kökenli agresif faktörlerin yardımıyla bozmakta ve sonuçta ülser oluşmaktadır. Mide ülserinin oluşmasında koruyucu faktörlerin azalması, duodenal ülser oluşumunda ise agresif faktörlerin artması daha önemlidir. Helicobacter pylori ve NSAĐD gibi yagın faktörlerin işlevi, diğer agresif faktörlerin (asitpepsin) arttırmaktan çok, koruyucu ve onarıcı mekanizmaları bozmak yoluyla olmaktadır. Schwartz’ın daha 1910’larda öne sürdüğü ‘no acid, no peptic ulcer’ aforizması uzun süre peptik ülser hastalığı için ağırlıklı sebep olarak düşünülmüştür(48). Ancak 1983 yılında Helicobacter pylorinin bulunuşu ile başlayan süreçte mide hastalıklarının etiyopatogenez ve tedavisin alanında ikinci devrim yaşanmıştır. Yapılan çalışmalarda peptik ülserlerin %8995’inin helicobacter ve NSAĐD kullanımı ile ilişkli olduğu gösterilmiş olup diğer etkenlerin peptik ülser oluşumunda çok az rolü olduğu belirtilmiştir(49). Açlığın, gastroduodenal mukozal hasara yol açıp açmadığı tam olarak ispatlanmamış olmakla beraber, superfisial epitelyal hasar lehine olan agresif faktörleri aktive ettiği düşünülmüştür, Sönmez ve arkadaşlarının 2005 yılında aç bırakılan sıçanların mide mukoza bütünlüğünün açlık nedeniyle bozulduğunu ve açlık halinin ortadan kaldırılması ile birlikte mide mukozasının tekrar tamir edildiğini bildirmişlerdir(89). Bu durumu her ne kadar ramazan açlığı gibi; kısa, istemli ve ara ara olan açlıkla ilişkilendirmek çok gerçekçi olmasa da biraz fikir verebilmesi açısından değerlendirebilir, zira sıçanlar yedi gün kesintisiz aç bırakılmış olup uzun süreli kesintisiz açlığın etkisi ile bu sonuca ulaşılmıştır. 51 Daha önceden servisimizce yapılan bir çalışmada peptik ülserin artmadığı ancak semptomların arttığı , haliyle semptomların hastalık oluşturacak veya hali hazırdaki bir hastalık tanısı ile uyumlu objektif bulgularına rastlanmamıştı(90). Hakkou F. ve arkadaşları Ramazan açlığının gastrik sekresyon üzerine etkisi ile ilgili yaptıkları araştırmada Ramazan sırasında asit ve pepsin sekresyonun arttığını, Ramazandan sonra ise Ramazan öncesi değerlere gerilediğini saptayarak, bu sonucu Ramazan sırasında artan dispeptik semptomların muhtemel sebebi olarak değerlendirmişlerdir(91). Iraki L. ve arkadaşları, Ramazan açlığının sağlıklı bireylerde 24 saatlik intragastik pH değişiklikleri üzerine etkisi ile ilgili araştırma yapmışlardır, bu çalışmada Ramazan açlığının sağlıklı gönüllülerde pH profili ve proton aktivitesi etkisi Ramazandan 1 hafta önce, Ramazanın 10. günü, Ramazanın 24. günü ve Ramazandan 1 ay sonra olacak şeklide dört döneme ayrılarak gece ve gündüz fazı olarak ölçülmüş. Ramazan öncesinde ortalama pH:2.3, 10. günde pH:1, 24. günde pH:1 ve ramazandan 1 ay sonra pH:1.6 ölçülmüş. 24 saatlik proton aktivitesi, Ramazan öncesi ile karşılaştırıldığında Ramazanın 10. gününde gündüz fazında %122, gece fazında %25 ortalama %45 artmış olduğu saptanmış ve ramazan ayındaki beslenme değişikliklerinin gündüz daha fazla olmak üzere gastrik asiditede artışa yol açtığı bildirilmiştir(92). Yine Iraki L. ve arkadaşlarının yaptığı başka bir çalışmada iyileşmiş duodenal ülser ve sağlıklı kontrol gruplarında ramazan ayında gastrik pH da azalma ve plazma gastrin sevyesinde artma saptanmıştır(93). Bu verilerden yola çıkarak, Ramazan açlığı ve beslenme alışkanlığı değişikliğinin agreve ettiği gastrk asidite ve bozulmuş denge mukozal hasarı tetikler mi sorusu akla getirilebilir? Bu mukozal hasarın klinik karşılığı olan peptik ülser hastalığı ve komplikasyonlarında (yani üst gastrointestinal sistem kanaması ve perforasyonu) artış görülür mü? Al-Kaabi ve arkadaşları; Ekim 2002-Ocak 2003 yıllarında Ramazan öncesi, Ramazan ayı ve Ramazan sonrası şeklinde hastaları gruplandırarak peptik ülser hastalığını prospektif olarak incelemişlerdir. Çalışmada 301’ i kadın total 516 hasta incelenmiş. Ramazan ayında, Ramazan öncesi ve sonrası ile karşılaştırıldığında anlamlı fark bulunmamıştır(94). Bener A. ve arkadaşlarının 1992-2002 yılları arsında Ramazan ayında ve Ramazanı müteakip ayda 470 hastada, peptik ülser hastalığı ve ülser perforasyonu sıklığını araştırdıkları çalışmada, peptik ülser hastalığı ve ülser perforasyonu sıklığı Ramazanda daha fazla saptanmakla beraber istatistiksel olarak anlamlı bulunmamış(95). 52 Dönderici ve arkadaşları 1987-1992 yılları arasında acil servise başvuran peptik ülser hastalığı ve komplikasyonları nedeniyle yatırılan hastalar incelenmiş. Ramazan aylarında yılın geri kalan diğer ayları ile kıyaslandığında peptik ülser hastalığı ve ülser perforasyonu gibi komplikasyonlarında artış saptamışlardır(96). Küçük HF. ve arkadaşları 1998-2003 yılları arasında acil servise duodenal perforasyonla başvuran 260 hasta incelenmişler, Ramazan aylarında ortalama 10 hasta, yılın geri kalan diğer zamanlarında ortalama 3.8 hastanın duodenal ülser nedeniyle opere edildiği rapor edilmiştir. Ramazan aylarında duodenal ülser perforasyonunun daha fazla arttığını ve özellikle de daha önceden dispeptik semptomları olan hastaların Ramazan ayında bu tür komplikasyonlarla daha sık gelebileceği belirtilmiştir(97). Emami MH. ve arkadaşları 2002-2004 yılları arasında Ramazan ayının 10. gününden 1 ay sonrasına kadarki sürede acil servise üst gastrointestinal kanama tanısıyla başvuran 236 hasta dosyası, oruç tutan grup-1:108 ve oruç tutmayan grup-2:128 şeklinde incelenmiş. Duodenal ülser sıklığı grup-1 de %38, grup-2 de %19,5 saptanmış. Ramazan açlığının duodenal ülsere bağlı üst gastrointestinal sistem kanamasını arttırdığı ve öncesinde dispeptik yakınmaları olan hastaların daha riskli olduğu sonucuna varılmıştır(98). Kais M.S. ve arkadaşları, duodenal ülser perforasyonu açısından risk faktörleri değerlendirilmesi çalışmasında ramazan ayında duodenal ülser perforasyonu insidansında artma saptanmış, ayrıca Ramazan ayında duodenal ülser perforasyonu ile başvuran hastaların % 21’i gastroduodenal semptom hikayesi olmayan hastalardan oluştuğu belirtilmiştir(99). Bilal A.B.ve arkadaşları, üst gastrointestinal sistem kanamalarının endoskopik tanısı ve dağlımı ile ilgili çalışmada, 2004 yılı Ramazan ayında, 54’ü kanamalı 105 hastaya endoskopi yapmışlar, en sık sebep özofagus varis kanaması saptanmış ancak yılın geri kalan diğer zamanları ile kıyaslandığında duodenal ülsere bağlı kanamaların ramazan ayında arttığını saptanmışlardır(100). Yukarıda sıraladığımız çalışmalarda, ramazan ayında peptik ülser hastalığı ve komplikasyonlarında genel olarak bir artış gözlendiği ve özellikle dispeptik semptomları ve gastroduodenit anamnezi olanlarda, ramazan açlığı ile birlikte hastalık aktivasyonunda ve komplikasyonlarında daha fazla artış saptanmıştır. Daha önceden peptik ülser hastalığı tanısı olan hastaların tedavi ile değerlendrildiği çalışmalara göz attığımızda, 53 Malik G.M. ve arkadaşları, Ramazan öncesi ve ramazan sonrası endoskopi yapılan, 23 gönüllü peptik ülser tanısı olan hasta değerlendirilmiş. Bu hastaların ilk endoskopisindeki dağılım; 4 aktif akut duodenal ülser, 8 aktif kronik duodenal ülser, 8 iyileşimiş duodenal ülser, 2 erozif duodenit ve 1 kronik gastrik ülser olmuş. Bu hastalardan 18’ne sahur ve iftarda 150 mg 2*1 Ranitidin tedavisi başlanmış, 5 hasta ilaç kullanmamış. Kontrol endoskopisinde, aktif akut duodenal ülserli hastaların hepsinde iyileşme belirtisi saptanmış. Aktif kronik duodenal ülser tanısı olan hastaların hiç birinde iyileşme belirtisi olmadığı gibi 7 hasta üst agstrointestinal sistem kanaması geçirmiş ancak ilaç kullnmayan 5 hastanın da aktif kronik duodenal ülser grubunda olduğu belirtilmiş, ve daha önceden özellikle aktif kronik duodenal ülser tanısı olan hastaların ramazan açlığı ile birlikte hastalık aktivasyonu ve olası komplikasyonları açısından riskli olduğu snucuna varılmış(101). Abdelaziz M. ve arkadaşları, Lansoprozol tedavisi ile iyileşen duodenal ülserli hastalara, ramazan açlığının etkisi adlı prospektif kontrollü çalışmada, duodenal ülser tanısı olan hastalar PPI tedavsisi altında oruç tutabilir mi? tedavi sonuçları nasıl olur? sorularının cevabını aramışlar. Akut duodenal ülser tanısının endoskopik olarak konduğu 57 hasta çalışmaya alınmış, bütün hastalar 4 hafta boyunca 30 mg lansoprozol tedavisi almış. Randomizasyondan sonra hastalar, oruç tutan grup1:27 ve oruç tutmayan grup2:30 şeklinde ayrılmış. Ramzan ayının sonunda yapılan kontol endoskopisinde, gup 1 ve 2 arasında semptomlar açısından anlmalı fark bulunmamış, komplikasyon gelişmemiş. Đyileşme oranları grup1 de %88,8, grup2 de %90,0 bulunmuş. Açlık veya orucun, lansoprozol ile tedavi edilmiş duodenal ülserli hastalar üzerinde herhangi bir etkisinin olmadığı sonucuna varılmış(102). Hosseini K. ve arkadaşları, Aktif duodenal ülseri olan hastalar oruç tutabilirler mi? çalışmasında aşağıdaki kriterlerden bir veya daha fazlasını içeren 50 hasta değerlendirilmiş. Bu kriterler, aktif duodenal ülser, multipl superfisial bulber ülser, pilor kanalı ülseri, aktif gastrik ülser, erozif duodenit, aktif kanayan duodenal veya gastrik ülser. Üreaz testi pozitif olanlara hatalara, Amoksisiklin 1 gr 2*1, metronidazol 500 mg 2*1 ve omeprazol 20 mg 2*1 ile 2 haftalık helicobacter pylori eradikasyon tedadvisi, üreaz testi negatif olanlara da omeprazol 20 mg 1*1 tedavisi başlanmış. Hastaların 18’i oruç tutmuş, 21’i oruç tutmamış, 11 hasta da çalışmayı tamamlayamamış. Ramazandan sonraki 5. günde kontrol endoskopisi yapılmış, oruç tutan grupta %94,4 ve oruç tutmayan grupta %95,5 iyileşme sağlanmış, hastalar da çalışma süresince ve müteakip üç ay boynca takiplerde şikayet gelişmemiş. 54 Böylece aktif dudenal ülserli hastaların ilaçalrını aldıkları taktirde oruç tutabilecekleri gösterilmiş ve açlığın duodenel ülser iyileşmesi üzerinde zaralı etkisinin olmadığı sonucu çıkarılmış(103). Bu sonuçlar; Feldman ve arkadaşlarının yaptığı, akut duodenal ülserli olan kişilerin, oruç tutmaması gerektiği ve asemptomatik olanların da sahur ve iftarda H2 blokeri alarak oruç tutabileceği iddia edilen çalışma sonuçlarına zıttır(104), ayrıca Azizi ve arkadaşları, aktif duodenal ülseri olan hastaların tedavi altında dahi oruç tutmaması gerektiğini gösteren simetidinle yapılan çalışımanın sonuçlarıyla ters düşmektedir(105). 55 7.SONUÇ Yukarıda sıraladığımız literatür bilgileri ve anlatmaya çalıştıgımız üst gastrointestinal sistem fizyopatolojisini değerlendirecek olursak, gastrointestinal tarktusun üst kısmında ortaya çıkan yüzeyel lezyonların akabinde gelişen peptik ülser hastalığı ve komplikasyonlarının mekanizması multipl faktörlere bağlanmaktadır. Mide bir taraftan sindirim vazifesini yerine getirirken, diğer taraftan kendini sindirilmekten korumak için hassas bir denge geliştirmiştir. Bu dengeyi menfi yönde bozan ve ya da müspet yönde düzelten bir çok iç ve dış faktör mevcuttur. Açlığın direkt veya dolaylı olarak gastrik mukoza üzerinde bir strese yol açtığı ve bu stresin mukozal koruma dengesini bozarak peptik ülser hastalığı ve komplikasyonlarına yol açtığı sonucuna varabilmek iddialı ve zor bir değerlendirme olsa gerektir. Zira açlığın ne olduğunu dahi tam olarak tanımlamak oldukça zordur. Coğrafi ve sosyokültürel farklılıklar, mevsimsel ilişki ve açlık süresi, beslenme biçimi ve yeme alışkanlıkları vs gibi bir çok parametre açlık ve oruçla ilgili çalışmalarda ciddi standardizasyon engellerinden bazılarıdır. Belli bir süre açlıktan sonra, hızlı ve aşırı besin yüklenmesinin olumsuzlukları açlıkla nasıl ilşkilendirilebilir? Kişinin istemli açlığa rızası vagal uyarıların periferik etkilerine santral bir inhibisyona yola açar mı? Đstemil ve aralıklı açlık sonrası ani besinsel yüklenmeler ileride daibet veya hepatosteatoz gelişimi üzerinde ne gibi etkileri olabilir? vs, gibi birtakım sorunlar yapılan çalışmalarda objektif sonuçlar elde edilmesine egel teşkil eden external poblemler olarak değerlendirilse de çalışma biçimi yani internal problemler de az değil. Çalışmamızda, direkt açlık ve beslenme biçimi değişikliği ile ilgili olabileceğini düşündüğümüz ve primer olarak mide ve duodenumu ilgilendiren tanıları aldık, bu tanıları etkileyebilecek kronik hastalıkları olanları çalışma dışı bıraktık. Mümkün olduğunca Ramazan açlığının dışında , üst gastrointestinal sistem kanamasına yolaçabilecek diğer faktörleri elimine ettik. Çalışmamızdaki hastalara helicobacter pylori açısından yapılan tanı testleri eksik olduğundan, bu bakterinin kanama üzerine olası etkileri hakkında bir fikir sahibi olamadık. Ancak ülkemizde helicobacter pylori ile ilgili yapılan çalışmalarda bu bakterinin %70-90 arasında değişen sıklıkta saptanmıştır(106). Hastaların yüzde kaçının oruç tutuğu bilinmediğinden, olası toplum yüzdesini değerlendirdik. Sonuç olarak, ramzan orucundan kaynaklanan açlık ve beslenme alışkanlığı değişikliğinin, yapılan istatistiksel analiz ve Chi-Square testi ile üst gastrointestinal sistem kanamaları insidansı üzerinde artma veya azalmaya yol açmadığı sonucu çıkarıldı. 56 8.KAYNAKLAR 1.Current Diagnosis & Treatment in Gastroenterology. Scott L Freidman, Keneth R McQuaid. Lange Medical Books/McGraw-Hill. Güneş kitabevi, çeviri editörü Sivri B, Gönen.2.baskı 2007 bölüm3, sayfa 53. 2. Longstreth GF: Epidemiology and outcome of patients hospitalized with acute lower gastrointestinal hemorrhage: A population- based study. Am J Gastroenterol 1997; 90:206. 3. Longstreh GF: Epidemiology and outcome of patients hospitalizd with acute upper gastrointestinal hemorrhage: A population-based study, Am J Gastroenterol 1995; 90:206. 4. Sleisenger & Fordtran’s Gastrointestinal and Liver Disease: pathophysiology, diagnosis, management / ( edited by) Mark Feldman, Lawrence S. Friedman, Marvin H. Sleisenger. 8th ed. 2006 Volume1 Chapter 13:258. 5. Boonpongmanete S, Fleischer DE, Pezzullo JC, et al: The frequency of peptic ulcer as a cause of upper -GI bleeding is exaggerated. Gastrointest Endosc 2004 59:788. 6.Estima-2006. Hoş geldin ramazan ekim 2006 saha çalışması, Türkiye’de 18 yaş ve üstü ramazanda oruç tutma yüzdesi. www.estima.com.tr. 7. Basic Histology.L.Carlos Junqueira, Jose Carneiro, Robert O Kelley. 11.ed. 2005 McGraw-Hill comp inc: Chapter15; page:287-98 8.Textbook of Medical Physiyology Guyton&Hall.WB.Saunders com. Guyton&Hall Tıbbi Fizyoloji ISBN:9754201293,Nobel-Yüce 2001 9.Yamada T. Handbook of Gastroenterology, Philadelphia, Lippincott Wiliams&Wilkins 2002:16-8 10.ASGE Standards of Practice Committee. ASGE guideline: the role of endoscopy in acute non-variceal upper-GI hemorrhage. Gastrointest Endosc 2004; 60(4):497-504. 11. Alican F. Abdomen: Genel konular. Alican F (ed). Cerrahi Dersleri. 2. baskı. Đstanbul: Avrupa Tıp Kitapçılık; 1998. Cilt 1: 419-491. 12. Memişoğlu K. Akut üst gastrointestinal sistem kanamaları. Türkiye Klinikleri J Surg Med Sci 2005; 1(4):1-6. 13.Barkun A, Bardou M, Marshall JK. Consensus recommendations for managing patients with nonvariceal upper gastrointestinal bleeding. Ann Đntern Med 2003; 139(10):843-857. 14. Oh DS, Pisegna JR. Management of upper gastrointestinal bleeding. Clin Fam Pract 2004; 6(3):631-645. 57 15. British Society of Gastroenterology Endoscopy Committee. Non-variceal upper gastrointestinal haemorrhage: guidelines. Gut 2002; 51:iv1-iv6. 16. Alkım H, Şaşmaz N. Akut üst gastrointestinal sistem kanaması. Özden A, Şahin B, Yılmaz U, Soykan Đ (ed). Gastroenteroloji. 1. baskı. Ankara: Fersa Matbaacılık; 2002. 141148. 17. Törüner M. Gastrointestinal hastalıkların belirtileri. Geçim Đ E (Çeviri ed). Cerrahinin Đlkeleri. 1. baskı. Ankara: Antıp; 2004. 1053-1100. 18. Hamoui N, Docherty SD, Crookes PF. Gastrointestinal hemorrhage: is the surgeon obsolete. Emerg Med Clin North Am 2003; 21(4):1017-1056. 19. Bjorkman DJ, Zaman A, Fennerty MB, Lieberman D, DiSario JA, Guest-Warnick G. Urgent vs. elective endoscopy for acute non-variceal upper GI bleeding: an effectiveness study. Gastrointest Endosc 2004; 60(1): 20. Conrad SA. Acute upper gastrointestinal bleeding in critically ill patients: Causes and treatment modalities. Crit Care Med 2002; 30(6):365-368. 21. Courtney AE, Mitchell RMS, Rocke L, Johnston BT. Proposed risk stratification in upper gastrointestinal haemorrhage: Is hospitalisation essential. Emerg Med J 2004; 21:3940. 22. Đç Hastalıkları . Đliçin, Biberoğlu, Süleymanlar, Ünal. Güneş Kitabevi. 2.Baskı:2005 Cilt 1, Bölüm 9: 1661-62. 23.Acil Dahiliye, Çalangu-Güler 5.baskı Đstanbul Tıp Fakültesi kitaplığı 1997 sayfa 319-20 24. Rockall TA, Logan RF, Devlin HB, et al:Risk assessment after acute upper gastrointestinal hemorrhage, Gut 1996; 38:316. 25. Tözün N, Şimşek H: Klinik gastroenteroloji ve hepatoloji 1.baskı. MN Medical&Nobel tıp kitabevi 2007: bölüm10, sayfa 101-106. 26. Büyükuncu Y. Üst gastrointestinal sistem endoskopisi. Kalaycı G (ed). Genel Cerrahi. 1. baskı. Đstanbul: Nobel Tıp Kitabevleri; 2002. Cilt 2: 1029-1049. 27. Türel Ö. Gastrointestinal kanamalar. Kalaycı G (ed). Genel Cerrahi. 1. baskı. Đstanbul: Nobel Tıp Kitabevleri; 2002. Cilt 1: 271-282. 28. Robbins, Cotaran, Kumar.Bacis Patology .Saunders ed imprinted of Elsevier Đnc.8th ed.2007 Chapter 15, page:591-97 29.Klinik Gastroenterolji ve Hepatoloji. Tözün N, Şimşek H. Birinci baskı 2007.MN Medical&Nobel Tıp Kitabevi Konu 10; sayfa.91-96 30. Đç Hastalıkları. Büyüköztürk K. Atamer T. Dilmener M. Nobel Tıp Kitabevi 2007. Bölüm 10.sayfa 819-831 58 31. Lundell L:Guidelines for management of symptomatic gastro-esophageal reflux disease 1998, Science press ltd, London. 32.Fendrick AM: Management of patients with symtomatic gastroesophageal reflux disease: a primary care perspective. Am J Gastrenterol 2001; 96 (suppl): sayfa 29-33 33. Farhing MJG, Malfertheiner P: Update Gastroenterology 2002. Basic mechanism of digestive disease: the rationale for clinical management and prevention. Eds Jhon Libbey Eurotext, Paris 2002 34. Dixon MF, Genta RM, Yrdley JH, Correa P. Classification and grading of gastritis: The updated Sydney system. Đnternational workshop on the histopatology of gastritis, Houston 1994. Am J Surg Pathol 1996; 20: 1161-81 35.Carpenter HA, Talley NJ, Gastroscopy is incomplete without biopsy: clinical relevance of distinushing gastropathy from gastritis. Gastroenterology 1995; 108:917-24, vol. 13 No:1. 36. Yardley JH, Hendrix TR. Gastritis, duodenitis, and associated ulcerative lesions. Chap 66 Đn: Yamada T, Alpers DH, Owyang C, Powell DW, Silverstein FE, eds. Textbook of Gatroenterology. Lippincott, Philadelphia 1995. 2nd ed. Pgs:1456-93 37.Del Valle J. Peptic ulcer disease and related disorders. Đn:Braunwald E, Kasper DL, Longo DL, Jameson JL(eds): Harrison’s principles of internal medicine 2001, 15th ed. MacGraw-Hill comp.Đnc. 38. Price AB. The Sydney system: Histological division.JGastroenterol Hepatol 1991,6:20922 39. Stabile BE. Gastrinoma before Zolinger and Ellison. Am J Surg. 1997;174:232-6 40. Perry RR, Vinik Al. Diagnosis and mnagement of functioning islet cell. J Clin End Met. 1995;80(8):2273-8. 41. Maton PN. Zollinger Ellison Syndrome. Recognation and management of acid hypersecretion. Drugs. 1996;52(1):33-34. 42. Metz DC, Jensen RT. Endocrin Tumors of pancreas. In Hauprich WS, Schaffner F, Berk JE, eds.Bochus, Gastroenterology. 5th ed. WB Sounders comp. Philedelphia. 1995;3002-34. 43.Current Diagnosis & Treatment in Gastroenterology. Scott L Freidman, Keneth R McQuaid. Lange Medical Books/McGraw-Hill. Güneş kitabevi, çeviri editörü Sivri B, Gönen.2.baskı 2007 bölüm20, sayfa 323-25. 44. Spechler SJ. Peptic Ulcer Disease and Its Complications. In: Sleisenger and Fordtran’s Gastrointestintestinal and Liver Disease, Ed by: Feldman M, Freidman LS, Sleisenger MH. 7th ed. Saunders Company, Philadephia. 2002; Vol 1 (Ch40): 747-781 45. Chan FKL, Leung WK, Peptic Ulcer disease. Lancet 2002;360:933-41. 59 46. Shiotani A, Graham DY. Patogenesis and therapy of gastrik and duodenel ulcer disease. Med Clin N Am 2002; 86.1447-46 47. Peek RM, Blaser MJ. Pathophysiyology of Helicobacter pylori infection-induced gastritis and peptic ulcer disease. Am j Med 1997,1002:200-207 48.Schwartz K:Uber penetreierende magenud jejunalgeschwure.Beitr Klin Chirurgie 1910;5:96. 49.Kurata, Jhon H. Meta-analysis of Risk factors for Peptic Ulcer: NSAĐD, H.Pylori and Smoking. Journal of Clin Gastro-Jun 1997.24(1):2-17 50.Sleisenger & Fordtran’s Gastrointestinal and Liver Disease: pathophysiology, diagnosis, management / ( edited by) Mark Feldman, Lawrence S. Friedman, Marvin H. Sleisenger. 8th ed. 2006 Volume1 Chapter 50:1091-94. 51. Özden A. Mikrop ve Mide Hastalıkları. Türk Gastroenteroloji Vakfı 2004. 1.baskı Ankara. sayfa 142-143 52.GÖRH ve Gasrit-Peptik Ülser hastalığı, Özkan H. Sentez matb. 2006, sayfa 160-161 53.Quan C, Talley NJ. Mnagment of peptic ulcer disease not related to Hlicobacter pylori or NSAĐDs. Am J Gastroenterol 2002;97:2950-61 54. The EUROGAST study group: Epidemiyology of, and risc factors for, Helicobacter pylori among 3194 asymptomatic subjects in 17 populations. Gut 1993; 34:1672. 55. Marshall BJ: Helicobacter pylori. Am J Gastroenterol 1994. 89(suppl):s116 56. Ciociola AA, McSorley DJ, Turner K, et al: Helicobacter pylori infection rates in duodenal ulcer patients in the Unitet States may be lower than previously estimated. Am J Gastroenterol 1999;94:1834. 57. Dwyer B, Kaldor J, Tee W, et al: Antibody response to Campylobacter pylori in diverse ethnic groups. Scand J Đnfect Dis 1988, 20:349. 58. Graham DY, Klein PD, Opekun AR, Boutton TW: Effect of age on the frequency of active Campylobacter pylori infection diagnosed by the 13C urea breath test in normal subjects and patiends with peptic ulcer disease. J Đnfect Dis 1988;157:777. 59. Graham DY, Malaty HM, Evans DG, et al: Epidemiyology of Helicobacter pylori in an asymptomatic population in the United States. Effect of age, race, and socioeconomic status. Gastroenterology 1991;100:1495. 60. Stemmerman GN: Đntestinal metaplasia of the stomach. A status report. Cancer 1994; 74:556. 61. Marshall BJ: Helicobacter pylori in peptic ulcer: Have Koch’s postulates been fulfilled? Ann Med 1995; 27:565. 62. Blaser MJ: Not all Helicobacter pylori strains are created equal: Should all be eliminated? Lancet 1997;349:1020. 60 63. Graham DY, Lew GM, Klein PD, et al: Effect of treatmend of Helicobacter pylori infection on the long-term recudence of gastric or duodenal ulcer. A randomized, controlled study. Ann Đntern Med 1992; 116:705. 64. Hopkins RJ, Girardi LS, Turney EA: Relatonship between Helicobacter pylori eradication and reduced duodenal and gastric ulcer recurrence: A review . Gastroenterology 1996; 110:1244 65. Hansson LE, Nyren O, Hising AW, et al: The risc of stomach cancer in patients with gastric or duodenal ulcer disease. N Eng J Med 1996,335:242. 66. Graham DY, Yamaoka Y: H pylori and cagA: Relatonships with gastric cancer, duodenal ulcer, and reflux esophagitis and its complications. Helicobacter 1998, 3:145. 67. Laine L, Harper S, Simon T, et al: A randomized trial comparing the effect of rofecoxib to ibuprofen on the gastroduodenal mucosa of osteoarthitis patients. Gastroenterology 199;117:776. 68. Hawkey C, Laine L, Simon T, et al: Comparison of the effect of rofecoxib, ibuprofen and placebo on the gastrduodenal mucosa of patients with osteoarhitis. A randomized double-bilind, placebo controled trial. Arthrithis Rhum 2000 43:370. 69. Simon LS, Weaver AL, Graham DY, et al.: Antiinfalamatory and upper gastrointestinal effects of celecoxib in rheumatoid arthritis. A randomized controlled trial. JAMA 1999,282:1921. 70. Laine L: Approaches to nonsteroidal antiinfamatory drug use in the high risc patient. Gastroenterology 2001;120.594. 71.Whittle BJ: Gastrointestinal effect of nonsteroidal anti inflammtory drugs. Fundam Clin Pharmacol 2003;17:301. 72. Darling RL, Romero JJ, Dial EJ, et al: The effect of aspirin on gastric mucosal integrity, surface hydrophobicity, and prostaglandin metabolism in cyclooxigenase knockout mice. Gastroenterology 2004;127:94. 73. Wolfe MM, Lichtenstein DR, Singh G: Gastrointestinal toxicity of nonsteroidal antiinflamtory drugs. N Engl J Med 1999; 340:1888 1999. 74. Banoob DW, McCloskey WW, Webster W: Risk of gastric injury with enteric-versus nonenteric-coated asprin. Ann Pharmacother2002; 36:163. 75. Henry D, Dobson A, Turner C: Varyability in the risk of major gastrointestinal complications form nonaspirin nonsteroidal anti inflamatory drugs. Gastroenterology 1993;105:1078. 61 76. Maliekal J, Elboim CM: Gastrointestinal compications associated with intramuscular ketorolac tromethamine therapy in the elderly. Ann Pharmacorther 1995; 29:698. 77. Levine RA, Nandi J, King RL: Nonsalicylate nonsteroidal antiinflammatory drugs augment pre-stimulated acid secretion in rabbit parietal cells: Đnvestigaton of the mechanisms of action. Gastroenterology 1991; 101:756. 78. Taha AS, Angerson W, Nakshabendi I, et al: Gastric and duodenal mucosal blood flow in patients receiving non-steroidal anti-inflammatory drugs, influence of age, smoking, ulceration and helicobacter pylori. Aliment Pharmachol Ther 1991; 7:41.. 79. Akiba Y, Guth PH, Engel E, et al: Dynamic regulation of mucus gel thickness in rat duodenum. Am J Physiol Gastrointest Liver Physiol 2000; 279:G437. 80. Selling JA, Hogan DL, Aly A, et al: Đndomethacin inhibits duodenal mucosal bicarbonate secretion and endogenous prostaglandin E2 output in human subjects. Ann Đntern Med 1987; 106:386. 81. Graham DY, Lidsky MD, Cox AM, et al: Long-term nonsteroidal anti inflammatory drug use and Hlicobacter pylori infection.Gastroenterology 1991; 100:1653. 82. Alykke C, Lauritsen JM, Hallas J, et al: Hlicobacter pylori and risk of ulcer bleeding among users pf nonsteroidal antiinflammatory drugs. A case-control study: Gastroenterology 1999; 116:1305. 83. Cryer B, Feldman M: Effects of very low dose daily, lon-term aspirin therapy on gastric, duodenal and rectal prostaglandin levels and on mucosal injury in healty humans. Gasroenterology 1999; 117:17. 84. Chan FK, Sung JJ, Chung SC, et al: Randomised trial of eradication of helicobacter pylori before nonsteroidal inati inflammatory drug therapy to prevent peptic ulcers. Lancet 1997; 350:975. 85. Hawkey CJ, Tullasay Z, Szczepanski L: Helicobacter pylori eradication in patients taking nonsteroidal anti infalammatory drugs: The HELP NSAĐDs study. Lancet 1998; 352:1016.. 86. Konturek JW, Dembinski A, Konturek SJ, et al: Đnfection of helicobacter pylori in gastric adaptation to continued administration of aspirin in humans. Gastroenterology 1998; 114:245. 87. Chan FKL, Chung SCS, Suen BY, et al: Preventing reccurent upper gastrointestinal bleeding in patients with helicobacter pylori infection who are taking low-dose asprin or naproxen. N Engl J Med 2001; 344:967. 62 88. Layla Mammo and Jalal Saour, Fasting and physiological parameters: Time for standardization of research methodology,Research Centre Bulletin, A Journal of Bilogical & Medical Research 1967; 79(1&2):34-35. 89.Sönmez MF,Ozan E. Açlık ve Açlık sonrası doyurulmanın sıçan mide mukozası üzerine etkileri: Işık mikroskopik çalışma. Fırat Tıp Dergisi 2005;10(3):96-102 90.Yenice N, Aksoy N. 17. Ulusal Gastroenteroloji kongresi 2000. Yazılı bildiri kitapçığı. 91. Hakkou F, Tazi A. The observance of Ramadan and its repercussion on gastric secretion. Gastroneterol Clin Biol 1994;18(3):190-4 92. Iraki L, Abkari A. Effect of Ramadan fasting on intragastric pH recorded during 24 hours in healthy subjects. Gastroneterol Clin Biol 1997;21(11):813-9. 93. Iraki L, Bogdan A. Ramadan diet restrictions modify the circadian time structure in humans. A study on plasma gastrin, insulin, glucose, and calcium and on gastric pH. J Clin Endocrinol Metab.1997 Apr;82(4):1261-73 94. Al-Kaabi S, Bener A, Butt MT, Taweel M, Samson S, Al-Mosalamani Y, Al-Musleh A. Effect of Ramadan fasting on peptic ulcer disease. Indian J Gastroenterol 2004;23:3535 95. Bener A, Derbala MF. Frequency of peptic ulcer disease during and after Ramadan in a United Arab Emirates hospital.East Mediterr Health J. 2006 Jan-Mar;12(1-2):105-11. 96. Dönderici O.Effect of Ramadan on peptic ulcer complications. Scand J Gastroenterol. 1994 Jul;29(7):603-6 97. Kucuk HF, Censur Z, Kurt N, Ozkan Z, Kement M, Kaptanoglu L, Oncel M. The effect of Ramadan fasting on duodenal ulcer perforation: a retrospective analysis. Indian J Surg 2005;67:195-198 98. Emami MH, Rahimi H. Effect of Ramadan fasting on acute upper gastrointestinal bleeding due to peptic ulcer. JRMS 2006; 11(3);170-75 99.Kais. M. S. Al-Wattar.Risk Factors for Duodenal Ulcer Perforationin Mosul – Iraq.The Middle East Journal of Emergency Medicine 2005; 5(2). 3 100. Bilal Arshed Butt, Endoscopic evaluation of patients with upper GI bleed in holy month of Ramadan. J Rawal Med Coll Dec 2004;8(2):65-8. 101. Malik GM. Endoscopic Evaluation of Peptic Ulcer Disease During Ramadan Fasting. A Preliminary study. Diagnostic and Therapeutic Endoscopy 1996;Vol 2:219-221 102. Mehdi A. Effect of the observance of diurnal fast of Ramadan on duodenal ulcer healing with lansoprazole. Results of a prospective controlled study. Gastroenterol Clin Biol.1997;21(11):820-2 63 103. Hosseini K. Rafieian M. Can Patients With Active Duodenal Ulcer Fast Ramadan? Am J Gastroenterol 2002; 97(9):2471-72 104. Feldman M, Scharschmidt BF, Selesinger MH. Gastrointestinal and Liver disease, 6th ed. Philadephia: WB Saunders, 1998;657-8 105. Azizi F. Medical aspects of Đslamic fasting. Med J IRI 1996;10:241-6 106. Özden A, Bozdayı G, Özkan M, Köse KS. Changes in seroepidemiological pattern of Helicobacter pylori infection over the last ten years in Turkey. Turk J Gastroenterol 2004; 15: 156-8. 64