ARAŞTIRMA/ORIGINAL ARTICLE
Gülhane Tıp Derg 2016;58:389-393
© Gülhane Tıp Fakültesi 2016
doi:10.5455/gulhane.221639
Fareden elde edilen mezenkimal kök hücre hücreler hücre
kültüründe erken dönemde yüksek canlılık ve köklülük özellikleri
gösterirler
Zehra Dilşad Çoban(*), Hüseyin Güzel(**), Akın Demircan(**), Merve Arslan(**), Fatıma Sümeyye Demirhan(**),
Naci Karaağaç(**), Nurullah Babayiğit(**), Melih Öveç(**), Emin Sönmez(**), Mahmut Kaynak(**), Ramazan
Bal(**), Murat Yurdakul(**), Mustafa Satman(**), Muhammed Fatih Ada(**), Tarık Ziya Akyüz(**), Mehmet
Murşit Ceylan(**), Abdülkadir Daştan(**), Nesim Farahmand(**), Şefik Güran(**)
ÖZET
Farklanmamış yapıda hücre olarak kök hücre, farklanma yeteneği ile özel hücrelere
dönerler (pluripotency) ve mitoz ile bölünerek kendi benzeri birçok kök hücre
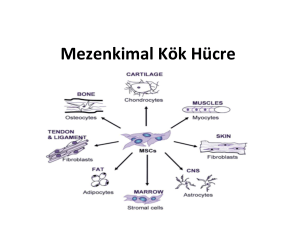
oluştururlar (self renewal). Erişkin organizmada bulunan mezenkimal kök hücreler
multipotent yapıdadır ve birçok hücreye farklanırlar. Genellikle doku tamir
mekanizmasını yönlendirirler. Bu hücrelerin pluripotensi kapasitesine bağlı olarak doku
mühendisliği protokollerinde yaygın kullanımı vardır. Bilindiği gibi doku mühendisliği
yıpranmış dokuların tamir ve rejenerasyonunda yeni tedavi yaklaşımları sağlamaktadır.
Çalışmamızda kemik iliğinden farklanmış fare mezenkimal kök hücrelerin elde edilmesi
amaçlanmıştır. Bu amaçla fareden (mus musculus) kemik iliği örnekleri alınmış, uzun
süreli kemik iliği kültüründe mezenkimal kök hücreler elde edilmiştir. Mikroskopta kök
hücrelere özgün koloni oluşumu (colony forming) takip edilmiştir. Hücrelerin hücre
kültüründe erken dönem (10-12 gün) ve geç dönem (18-20 gün) canlılık oranları tripan
blue yöntemi ve MTT analizi ile incelenmiştir. Mezenkimal kök hücrelere özgün köklülük
özelliklerini göstermek için genetik markır (belirteç) olarak CD73, CD90, CD105, CD34,
CD45, CD11b genleri kullanılmıştır. Bu aşamada tanımlanan genlere ait gen ekspresyon
profilleri “real time polymerase chain reaction” yöntemi ile ortaya konmuştur. Mezenkimal
kök hücrelerin canlılık oranları ve markır genlere ait ekspresyon düzeyleri erken dönem
kültürde geç döneme göre daha yüksek bulunmuştur. Sonuçlar uygulanan yöntem ile
fare kemik iliğinden mezenkimal kök hücre eldesinin mümkün olduğunu göstermektedir.
Hücrelerin en yüksek canlılık ve köklülük özellikleri gösterdiği evre hücre kültüründe
erken dönemdir. Hücreler hücre kültüründe ileri evrelerde canlılık ve köklülük özelliklerini
kaybetmektedir. Bu bulgu erken dönem hücre kültüründen elde edilen mezenkimal kök
hücrelerin ileri kök hücre uygulamalarında kullanılabileceğinin göstergesidir.
Anahtar Kelimeler: Kök hücreler, mezenkimal kök hücreler, hücre yaşamı, hücre yüzey
antijeni, gen ekspresyonu
SUMMARY
Mesenchymal stem cells obtained from mouse represents high viability and
steamness properties in the early phase of cell culture
As an undifferentiated cell, stem cell can differentiate into specialized cells (pluripotency)
and can divide with mitosis to produce more stem cells (self renewal). Mesenchymal stem
cells obtain in adult organisms are multipotent cells that can differentiate into a variety
of cell types. They generally coordinate tissue repair mechanism. So, they use widely in
tissue engineering protocols because of their pluripotency capacity. As known tissue engineering is a promising therapeutic approach to repair or regenerate damaged tissues.
In our study, we aimed to obtain mouse bone marrow derived mesenchymal stem cells
from bone marrow. First, bone marrow samples were obtained from mouse (mus musculus), by using long-term bone marrow culture methodology, mesenchymal stem cells
were obtained. In microscope, colony forming, specific for mesenchymal stem cells were
visualized. The cells in cell culture were analyzed for cell viability with trypan blue and
MTT analyses in early phase of culture and late phase of culture. CD73, CD90, CD105,
CD34, CD45, CD11b genes were used as genetic marker for finding the stemness properties of mesenchymal stem cells. In that step, the expression profiles of these genes
were found by using real time polymerase chain reaction analyses. The cell viability and
the gene expression Results of cultured cells in early phase were found higher than the
Results of cultured cells in late phase. The Results represent that the methodology applied in our study is proper for having mesenchymal stem cells from bone marrow. The
cultured cells have high viability and stemness properties in the early phase of cell culture. The cells lose their vitality and stemness properties in the late phase of cell culture.
This finding represents that mesenchymal stem cells obtained from in the early stages of
culture could be used in the advanced application of stem cells.
Key words: Stem cells, mesenchymal stem cells, cell survival, cell surface antigen, gene
expression
*SBÜ Gülhane Tıp Fakültesi Tıbbi Biyoloji Ad. Etlik-Ankara/Türkiye
**SBÜ Gülhane Tıp Fakültesi Öğrencisi Etlik-Ankara/Türkiye
Ayrı Basım İsteği: Şefik Güran
SBÜ Gülhane Tıp Fakültesi, Öğrencisi Etlik-Ankara/Türkiye
(sefguran@yahoo.com)
Makalenin Geliş Tarihi: 11 Mart 2016 • Kabul Tarihi: 16 Temmuz 2016 • Çevrim İçi Basım Tarihi: 30 Aralık 2016
Giriş
Kök hücre çok hücreli canlılarda bulunan farklanmamış (undifferentiated) hücrelerdir. Birçok özel hücreye farklanma (pluripotency-pluripotensi) ve kendi benzeri hücreleri yapabilme
(self renewal-kendini yenileme) özelliklerine sahiptirler. Farklanmamış kök hücre köklülük (stemness) özellikleri gösterir.
Hücre farklandıkça özellikle gen ekspresyon değişikliklerine
bağlı morfolojisi, davranış karakteri ve fonksiyonları değişir
(1-3). Mezenkimal kök hücreler erişkin dönemde organizmada genellikle tamir mekanizmalarında aktiftir. Doku rejenerasyonunda rol alır. Kemik iliği kökenli mezenkimal kök hücreler
(bone marrow derived stem cells) kemik iliği hücrelerinden
farklı olarak kültür ortamında flaskın tabanına yapışır. Burada
koloni oluşturarak çoğalır (4). Pluripotensi özellikleri nedeni ile
tıpta doku rejenerasyonu çalışmalarında sıklıkla kullanılmaktadır (5). Mezenkimal kök hücrelerin tanınması yüzey markırlarının (belirteç) tespiti ile mümkündür. Bu aşamada mezenkimal kök hücreler için CD73, CD90 ve CD105 molekülleri pozitif
olma özelliği ile temel belirteç olarak kabul edilmektedir (2).
Çalışmamızda fare kemik iliğinden fare mezenkimal kök hücre
elde edilmesi amaçlanmıştır. Uzun süreli hücre kültüründe bu
hücrelerin hücre canlılığı (cell viability) oranları ve kök hücreye
ait köklülük (stemness) özelliklerinin tespiti için özgün genlere
ait gen ekspresyonlarına erken ve geç dönemlerde bakılmıştır. Burada erken dönem için hücre kültürünün 10-12. günleri,
geç dönem için hücre kültürünün 18-20. günleri esas alınmıştır. Sağlanan hücrelerin ileri temel tıp uygulamaları için uygun
olup olmadığı irdelenmiştir.
Çalışmamızda fare (mus. musculus) kemik iliğinden farklanmış (bone marrow-derived) mezenkimal kök hücreler diğer kemik iliği hücrelerinden uzun süreli hücre kültürü yardımı
ile ayrılmış, hücrelerin kültürde koloni oluşturma özelliklerine
bağlı olarak tanınmıştır (6, 7). Fare kemik iliğinden farklanmış
mezenkimal kök hücrelerin canlılık oranlarına bakılmış, özgün
genlere ait (CD73/ecto-5'-nucleotidase, CD90/Thy-1, CD 105/
Endoglin, CD34, CD45 PTPRC, CD11b-ITGAM) ekspresyon
profilleri araştırılmıştır. Sonuçlar bu yöntem ile fare kemik iliği kökenli mezenkimal kök hücre eldesinin mümkün olduğunu
göstermiştir. Erken dönem hücre kültüründen elde edilen hücrelerde hücre canlılığının ve köklülük özelliklerinin geç döneme göre daha iyi olduğu saptanmıştır.
Gereç Yöntem
Fareden kemik iliği eldesi: Çalışmamızda Gülhane Tıp Fakültesi, Sağlık Bilimleri Enstitüsü’ nden alınan Hayvan etik kurulu kararı (GATA-Etik-2012-4) sonucu temin edilen iki adet
erişkin (1 yaşında) Balb-C fare (mus musculus) kullanılmıştır.
Hayvanlar “ketamine” (50-70 mg/kg intraperitoneal) ve “xylaMezenkimal kök hücre özelliği • 389
zin” (10mg/kg intraperitoneal) ile sedasyona alınmış ve anestezi altında iken servikal dislokasyon ile sakrifiye edilmiştir. Her
iki farenin femurları Gülhane Tıp Fakültesi, Deney Hayvanları
Bölümünde operasyon ile çıkarılmıştır (Şekil 1). Eklem yerleri
korunarak femurlar yumuşak dokularından arındırılarak temizlenmiş ve RPMI içerisinde her iki eklem kesilerek kemik iliğine ulaşılmıştır. Uçları kesilen kemiklere dik bir şekilde insülin
enjektörü ile RPMI enjekte edilmiştir. Kemik iliği hücreleri iki
kez 1000 rpm’ de 5 dakika santrifüj edilmiştir. En son işlemden sonra süpernatant atılmış, üzerine 10 ml RPMI medyum
eklenmiştir.
RNA İzolasyonu:
Her örnekten ayrı RNA izolasyonu yapılmıştır. Flasktan tripsinizasyon ile ayrılan hücreler bir tüpte toplanmıştır. Çalışılan
genlere ait ekspresyonun bulunması için her hücre kültürü için
3 kez RNA izolasyonu yapılmıştır (Roche RNA isolation kit).
Elde edilen her bir RNA’ dan ayrı olmak üzere üçer kez c-DNA
elde edilmiştir. c-DNA’ lardan β Aktin gen ekspresyonu (kontrol)
ve CD73/ecto-5'-nucleotidase (OMIM No: 129190), CD90/Thy1 (OMIM No: 188230), CD 105/Endoglin (OMIM No: 131195),
CD34 (OMIM No: 142230), CD45-PTPRC Gene (OMIM No:
151460) ve CD11b-ITGAM Gene (OMIM No: 120980) genlerinin gen ekspresyon değişimine bakılmıştır. c-DNA örneklerinin kalitesi % 2’ lik agaroz jelde yürütülerek ultraviyole altında
kontrol edilmiştir.
Reverse Transkripsiyon Polimeraz Zincir Reaksiyonu
(RT-PCR);
Şekil 1. Bulb C fare (mus musculus) femur diseksiyonu ve kemik iliğinin
alınması.
Uzun süreli kemik iliği kültürü “long-term bone marrow culture”: Kemik iliği hücreleri 25 ml’ lik üç adet kültür flaskına alınmış, üzerine standard kemik iliği ortamı (Fitohemaglutinin-PHA
içermeyen) eklenmiştir (8, 9). Kültür flaskındaki kemik ilikleri 37ºC ve %5 CO2 ve su buharı içeren inkübatöre (Thermo
Scientific Heraeus Incubator) yerleştirilmiştir. Hücre kültürleri
her gün takip edilmiş, yaklaşık 2-3 gün sonra flaska yapışan
hücrelerin varlığı tespit edildiğinde üstte bulunan ve hematopoitek kök hücre kaynaklı hücreleri içeren süpernatan atılarak
ortamdan uzaklaştırılmıştır. Flaska tutunmuş mezenkimal kök
hücre kaynaklı olduğu bilinen hücrelere uygun ortam eklenerek kültüre devam edilmiştir. Hücreler kültür flaskını %70 oranında doldurduğunda tripsinize edilmiştir. Sub-kültür yöntemi
ile üç pasaj yapılarak toplam da altı flaska bölüştürülmüştür.
Tüm bu işlemlerde Zhang ve arkadaşlarının protokolü uygulanmıştır (7).
Hücre canlılığının tespiti “Cell viability assay”: Hücre canlılığının ortaya konması amacı kültürden erken dönem (10-12.
Gün) ve geç dönem (18-20) gün) olmak üzere iki kez ile hücre
alınmıştır. Her iki grup hücre tripan blue (Sigma Aldrich Co.
302643) ile boyanmıştır. Tripan blue boyası 0,8 mM olacak
şekilde PBS’ de dilüe edilmiştir. Hücreler 1:1 oranında karıştırılmış ve hemocytometre de canlı (viable)/canlı olmayan (nonviable) hücre oranına bakılmıştır (10).
MTT Hücre Proliferasyonu Testi “MTT Cell Proliferation Assay”: Hücre yaşam oranlarının bulunması için, hücre kültüründen erken/geç dönem alınan örnekler tripan blue testi ile birlikte
eş zamanlı MTT hücre proliferasyonu testine alınmıştır. Hücre
kültürlerindeki hücre canlılığı “MTT (3-[4,5-dimethylthiazol2-yl]-2,5- diphenyltetrazolium bromide; thiazolyl blue) assay”
yöntemi ile analiz edilmiştir (Sigma-Aldrich/In Vitro Toxicology
Assay Kit, MTT based). Örnek alındığı aşamada en az 3x104
hücre olmasına dikkat edilmiştir (11).
390
• Aralık 2016 • Gülhane Tıp Derg
Tüm c-DNA’ lar PCR için kalıp olarak kullanılmış ve RT-PCR’
a alınmıştır. PCR’ da kullanılan CD73 geni primerleri [5-‘GGACATTTGACCTCGTCCAAT-3’ (forward) ve 5-‘GGGCACTCGACACTTGGTG-3’ (reverse)], CD105 geni primerleri [5'AGG GGT GAG GTG ACG TTT AC-3' (forward) ve 5'-GTG
CCA TTT TGC TTG GAT GC-3' (reverse)], CD90/Thy-1 geni
primerleri [5’-TGCTCTCAGTCTTGCAGGTG-3’ (Forward)
ve 5-‘TGGATGGAGTTATCCTTGGTGTT-3’], CD34 geni primerleri [5’-CTGGGTAGCTCTCTGCCTGAT-3’ (forward) ve
5’-TGGTAGGAACTGATGGGGATATT-3’ (reverse)], CD45PTPRC geni primerleri [5’-GTTTTCGCTACATGACTGCACA-3’
(forward) ve 5’-AGGTTGTCCAACTGACATCTTTC-3’ (reverse)]
CD11B-ITGAM geni primerleri [5’-CCATGACCTTCCAAGAGAATGC-3’ (forward) ve 5’- ACCGGCTTGTGCTGTAGTC-3’
(reverse)] dir. Bu genlere ait bilgiler; http://pga.mgh.harvard.
edu/primerbank/ internet sitesinden alınmıştır. c-DNA fragmentleri (Tm, 61 derece, 30 döngü, PCR ürünü 166 bp) olacak
şekilde RT PCR’ a alınmıştır. İnternal kontrol olarak β-actin
geni kullanılmıştır (12). Her reaksiyon 20µl olacak şekilde [10
µl SYBR, 5 µl c DNA, 1 µl primer, 4 µl dH2O] hazırlanmıştır.
Her reaksiyon 3 kez tekrarlanmıştır. RT-PCR ile elde edilen sonuçlara göre tüm genlere ait ekspresyon profillerine bakılmıştır
(Roche Light Cycler1.5).
İstatistiksel Analiz:
Elde edilen değerlerin aritmetik ortalamaları alınarak standart sapma (standart deviation, SD) değerleri bulunmuştur.
Sonuçlar Student t testi ile değerlendirilerek p değerleri elde
edilmiş, istatistiksel olarak anlamlılık ortaya konmuştur.
Bulgular
Her iki sağlam yetişkin fareye ait kemik ilikleri uzun süreli
hücre kültürüne alınmıştır. Kemik iliği hücre kültürünün uzun
süreli uygulaması yapılmıştır. Bu aşamada hücre kültürünün
altına yapışarak üremelerini sürdürenler mezenkimal kök hücre olarak kabul edilmiştir. Kültürdeki hücrelerin flaskın en az
%70’ lik kısmını dolduracak şekilde üremesi “inverted” mikroskop altında takip edilmiştir (mouse bone marrow derivated mesenchimal stem cells) (2, 6). Mikroskopta hücrelerin çoğalma
aşamasında koloni oluşturma özelliklerine (colony forming) bakılmıştır (2, 13). Kültür ortamında koloni oluşturanlar tripsinize
edilerek kaldırılmış, pasajlar bu hücrelerden yapılarak amaçlanan mezenkimal kök hücrelerin eldesi gerçekleştirilmiştir (Şekil
2) (13).
Uzun süreli kemik iliği kültürünün erken dönemi (10-12 gün)
Çoban ve ark.
Tablo 1. Fare mezenkimal kök hücrelere ait uzun süreli
kemik iliği kültürü erken dönem (10-12 gün) ve geç dönem
(18-20 gün) CD73, CD90 ve CD105 genlerine ait gen
ekspresyon analiz sonuçları
Şekil 2. Bulb C fareye (mus musculus) kemik iliği hücrelerinden uzun süreli
hücre kültürü ile ayrılan mezenkimal kök hücrelere ait özgün koloni oluşumu
(colony forming)
ve geç döneminde (18-20 gün) hücre canlılığı incelenmiştir.
Buna göre erken dönemde tripan blue ile hücrelerin %89’ unun
MTT yöntemi ile %85’ inin canlı olduğu saptanmıştır. Bu oranlar geç dönemde tripan blue ile %66’ ya MTT yönteminde ise
%62’ ye inmiştir. Her iki yöntem ile de geç dönem hücrelerde
saptanan canlılık oranlarındaki düşüklük ilk erken dönem canlılık oranları ile karşılaştırıldığında istatistiksel olarak anlamlıdır (p<0,05).
Mezenkimal kök hücrelerde uzun süreli hücre kültür ortamı
farklanmaları için uygun ortamdır. Farklanan hücrelerin genlerinin aktivasyonlarına göre protein sentezi olmaktadır. Hücrelerde buna bağlı hücre yüzey reseptörleri oluşmaktadır. Hücrelerin yapı ve fonksiyonları değişmektedir (13). Uzun süreli
kemik iliği kültüründen erken ve geç döneminde RNA izolasyonu sonrası RT-PCR ile mezenkimal kök hücrelerinin köklülük özelliklerini gösteren genlerine ait gen ekspresyon analizi
yapılmıştır. Erken dönem CD73 gen ekspresyon analiz sonucu
0,75±0,15 çıkmış, bu bulgu geç dönemde 0,15±0,22’ ye inmiştir. Bu gen için geç döneme ait ekspresyon bulgusundaki düşüş istatistiksel olarak anlamlıdır (p<0,05). Aynı panelde erken
dönem CD90 genine ait ekspresyon değeri 0,08±0,003 iken,
geç dönemde bu değer 0,01±0,013’ e inmiştir. Bu gen için de
geç döneme ait ekspresyon bulgusundaki düşüş istatistiksel
olarak anlamlıdır (p<0,05). CD105 genine ait ekspresyon değerleri erken dönemde 0,9±0,022 çıkarken, geç dönemde bu
değer 0,2±0,015’ e inmiştir. Bu gen için de geç döneme ait ekspresyon bulgusu istatistiksel olarak anlamlı düzeyde azalmıştır
(p<0,05) (Şekil 3) (Tablo 1). CD34, CD45 ve CD11b genlerine
ait gen ekspresyonu hücre kültürünün hem erken hem geç dönemde saptanmamıştır.
Şekil 3. Uzun süreli kemik iliği kültürünün erken döneminde (10-12 gün)
CD73, CD90 ve CD105 genlerine ait RT-PCR sonuçları (Sonuçlar Roche Light
Cycler1.5 ekranından alınmıştır).
Genler
Erken dönem
gen ekspresyonu
Geç
dönem gen
ekspresyonu
P Değeri
CD 73
0.75±0.15
0.15±0.22
p<0.05
CD 90
0.08±0.003
0.01±0.013
p<0.05
Cd 105
0.9±0.022
0.2±0.015
p<0.05
Tartışma
“Mezenkim” terimi epiblastın farklılaşmasından başlayarak
embriyonun gelişmesinde ve daha sonra fetusun yaşamasında önemli yer tutan, gevşek bağ dokusu yapısındaki dokulara
verilen genel addır. Mezenkimal kök hücre, hücrelerin bağ dokularında bulunan, erişkin haldeki kök hücre tipidir. Dokuların
destek bölümü olan stroma hücresinin de temelini oluşturmaktadırlar. Yağ, kemik, kıkırdak, kas, tendon gibi dokulara farklılaşabilirler. Mezenkimal kök hücreler, bulunduğu dokudan,
hasarlı bir dokuya geçebilirler. Bu sayede hasarlı dokuda doku
tamirini sağlarlar (2, 14). Hematopoietik kök hücrenin keşfinden kısa bir süre sonra 1966 yılında Friedenstein ve ark. farede
kemik iliği stromasını başka bir dokuya naklettiklerinde kemik,
yağ ve kıkırdak doku hücrelerine dönüşebileceğini göstermişlerdir (15). Bu kemik iliğinden köken alan mezenkimal yapıda
kök hücrelerin (bone marrow derived mesenchimal stem cell)
ön bulgusudur (2). Bu hücrelerin plastik yüzeye yapışıp “in vitro” olarak çoğalma özellikleri onları hematopoietik kaynaklı kemik iliği hücrelerinden ayrılır (16). Pittenger ve ark.’ ları ilk kez
kemik iliği kaynaklı stromal hücrelerin “in vitro” ortamda koloni
oluşturarak çoğaldıklarını belirtmiştir (4). Kemik iliğinde bulunan hematopoietik kök hücre kaynaklı diğer hücrelerin bu tür
üreme özellikleri olmaması nedeni ile bu bir ayırıcı kriterdir (9,
17). Çalışmamızda fare kemik iliği uzun süreli kültüre alınmış,
hücre kültür flaskına yapışan hücreler ayrılmıştır. Ayrılan bu
hücrelerin çoğalmaları aşamalarında koloni oluşumu izlenmiştir. Bulgularımız hücre kültüründe çoğalan hücrelerimizin fare
mezenkimal kök hücre olduğunu doğrular niteliktedir (Şekil 2).
Yıllar sonra mezenkimal kök hücrelerin tek bir koloniden ayrıştırılarak in vitro ortamda embriyonal üç germ yaprağına ait
hücreleri de oluşturabildiği saptanmıştır (osteoblast, adiposit
ve kondrosit) (2, 4). Mezenkimal kök hücrelerin mutipotensi ve
kendini yenileme özellikleri erişkinde hasarlanmış dokunun tamiri veya yerine koyma (regeneration) çalışmalarında önemini
arttırmıştır (18-20). Günümüzde ikili kültür uygulamaları (coculture) ve hücrelerde organik veya inorganik destek yapıları
(scaffold) kullanılarak destek doku oluşturma çalışmaları vardır. Laboratuar koşullarında oluşturulan dokunun doku tamirinde yaygın kullanımı söz konusudur. Genellikle mezenkimal
kök hücre ile birlikte anjiyogenesis oluşturarak dokunun beslenmesini ve metabolik atıkların uzaklaşmasını sağlayan özel
kök hücreler kullanılmaktadır (HUVEC- Human umbilical vein
endothelial cells). Bu yapılar hücre destek yapılar içinde üç
boyutlu kültür ortamlarında (3D Culture) uygun doku yapımını
sağlamaktadır (21-23). Bu nedenlerle laboratuar koşullarında
saf mezenkimal kök hücre eldesi ve hücrenin işlevselliği önemlidir. Bu aşamada hücre canlılık oranlarının ortaya konması ve
özellikle o hücreye özgün olduğunu bildiğimiz genlerin durumMezenkimal kök hücre özelliği • 391
larının bilinmesi önemlidir. Çalışmamızda uzun süreli kemik iliği kültürü ile ayrılmış mezenkimal kök hücrelerin erken dönem
ve geç dönem hücre canlılık oranlarına iki farklı yöntem ile bakılmıştır. Her iki yöntem ile de özellikle erken dönem hücrelerin
canlılık oranlarının çok yüksek olduğu ortaya konmuştur. Bu
bulgu mezenkimal kök hücre eldesinde uyguladığımız yöntemin etkinliğini gösterir. Ancak kültürün ileri evrelerinde hücre
canlılık oranının düşmesi bu hücreler ile çalışmanın uygun
olmadığını düşündürmektedir. Uzun dönem hücre kültüründe
hücre canlılığındaki hızlı azalma izole ettiğimiz hücrelerin “in
vitro” koşullarda canlılığının sürmesinin oldukça zor olduğunun
bir göstergesidir.
Bu hücrelerin tanınmasında; hücre kültüründe plastik kültür
yüzeyine yapışarak çoğalmaları, CD serisi önemli belirteçlerin
gösterilmesi ve in vitro koşullarda üç seri hücre tipine farklılaşabilmeleri “altın standart” olarak kabul edilir (24). Can A.
kitabında mezenkimal kök hücrelerde CD73, CD90, CD105,
CD9, CD10, w4a5, STRO-1 belirteçlerini pozitif, vWF, CD4,
CD11a, CD11b belirteçleri negatif olarak rapor etmiştir (2).
Uluslararası Hücresel Tedavi Derneği (International Society for
Celluler Therapy-ISCT) tarafından mezenkimal kök hücrenin
CD105, CD73, CD90’ i eksprese etmesi, CD34, CD45, CD14’
ü veya CD11b, CD79α veya CD19, HLA-DR’ i eksprese etmemesi gerekliliği bildirilmiştir (25, 26). Harting M. ve ark. ratlarda
mezenkimal kök hücrelerinin tanımlanmasında CD11b, CD45,
CD49e, CD73, CD90, CD105, CD29 ve Stro1’ i kullanmıştır
(27). ISCT 2008 yılında mezenkimal kaynaklı kök hücrelerde
CD105, CD73, CD90’ ün mutlaka pozitif olması gerekliliğini
rapor etmiştir (2, 25). Hücrelerimiz hücre kültürünün erken
döneminde CD105, CD90, CD105 genlerini yüksek oranda
eksprese etmekte, hücre kültürünün geç döneminde bu belirteçlerin ekspresyonu düşmektedir (Şekil 3) (Tablo 1). Bulgular
mezenkimal kök hücrelerin erken dönemde köklülük özelliklerini daha iyi gösterdiği şeklinde yorumlanmalıdır. Bulgular aynı
dönemde hücrelerdeki yüksek canlılık oranlarını da destekler
niteliktedir. Literatürde çalışmamızı destekleyen birçok çalışma vardır (28, 29). Harting M. ve ark.’ ları ratlardan elde edilen
kemik iliği kökenli mezenkimal kök hücrelerde immünofenotipik
olarak CD73, CD105 ve Stro-1 ekspresyonlarının 10. pasajdan
sonra azaldığını gösterdi (27). Çalışmamızda mezenkimal kök
hücreler için negatif belirteç olarak adlandırılan CD34, CD45
ve CD11b’ de gen ekspresyonu düzeyinde araştırılmış, hücre
kültüründe hem erken hem geç dönemde bu genlere ait ekspresyon saptanmamıştır. Bulgular hücrelerimizin mezenkimal
kök hücre olduğunu destekler niteliktedir (25-27).
Sonuç olarak, kemik kıkırdak, kas, yağ gibi bağ/destek dokularına farklanan mezenkimal kök hücrelerin eldesi önemlidir (30). Bu yöntemle sağlacak hayvan/insan mezenkimal kök
hücreleri özellikle doku yapımı ve doku tamiri ön çalışmalarında rahatlıkla kullanılabilir (31).
Kaynaklar
1. Gardner RL. Stem cells: potency, plasticity and public
perception. Journal of Anatomy 2002; 200: 277–282.
2. Can A. Kök hücre, biyolojisi, türleri ve tedavide kullanımları. Ankara: Akademisyen Tıp Kitabevi, 2014. 149-156.
3. Krieger T, Simons BD. Dynamic stem cell heterogeneity.
Development 2015; 142: 1396-1406.
4. Pittenger MF, Mackay AM, Beck SC et al. Multilineage
potential of adult human mesenchymal stem cells. Sci392
• Aralık 2016 • Gülhane Tıp Derg
ence 1999; 284: 143-147.
5. Hao J, Zhang Y, Jing D, et al. Mechanobiology of mesenchymal stem cells: A new perspective into the mechanically induced MSC fate. Acta Biomater 2015; 20:
1-9.
6. Becker AJ, McCulloch EA, Till JE. Cytological demonstration of the clonal nature of spleen colonies derived
from transplanted mouse marrow cells. Nature 1963;
197: 452-454.
7. Zhang L, Peng LP, Wu N, Li LP. Development of bone
marrow mesenchymal stem cell culture in vitro. Chin
Med J (Engl) 2012; 125: 1650-5.
8. Guran S, Bahçe M, Beyan C, Korkmaz K, Yalçın A: During the progression of chronic myeloid leukemia p53,
p15INK4B, p16 INK4B and p57 KIP2 mutations. Haemotologia 1998; 29; 181-193.
9. Preiyl JA, LeBien TW. Interleukin 7 independent development of human B cells. Proc Natl Acad Sci U S A.
1996; 93: 10348-53.
10. Coco-Martin JM, Oberink JW, van der Velden-de Groot
TA, Beuvery EC. Viability measurements of hybridoma
cells in suspension cultures. Cytotechnology 1992; 8:
57-64.
11. Coban ZD, Avcu F, Ural AU, Kuzhan O, Guran S. The
sitotoxic effect of gemcitabine on multiple myeloma
(RPMI-8226) and Ig G plasma cell leukemia (ARH 77)
cell lines Gulhane Medical Journal 2012; 54: 263-266.
12. Efroni S, Melcer S, Nissim-Rafinia M, Meshorer E.
Stem cells do play with dice: a statistical physics view of
transcription. Cell Cycle 2009; 8: 43-48.
13. Siminovitch L, Mcculloch EA, Till JE. The distribution
of colony-forming cells among spleen colonies. Journal of Cellular and Comparative Physiology 1963; 62:
327–336.
14. Phinney DG, Prockop DJ. Concise review: Mesenchymal stem/multipotent stromal cells: The state of transdifferentiation and modes of tissue repair-current views.
Stem Cells 2007; 25: 2896–2902.
15. Friedenstein AJ, Piatetzky-Shapiro II, Petrakova KV.
Osteogenesis in transplants of bone marrow cells. J
Embryol Exp Morphol 1966; 16: 381-390.
16. Friedenstein AJ, Chailakhjan RK, Lalykina KS. The development of fibroblast colonies in monolayer cultures
of guinea-pig bone marrow and spleen cells. Cell Tissue
Kinet 1970; 3: 393-403.
17. Deans RJ, Moseley AB. Mesenchymal stem cells: Biology and potential clinical uses. Experimental Hematology 2000; 28: 875–884.
18. Karantalis V, Hare JM. Use of mesenchymal stem cells
for therapy of cardiac disease. Circ Res 2015; 116:
1413-1430.
19. Terzi YK, Guran S. Kök hücre biyolojisi ve hematolojik
malignitelerde kök hücrenin rolü. Cumhuriyet Tıp Dergisi 2012; 34: 235-241.
20. Guran S, Çoban ZD. The Use of Induced Pluripotent
Çoban ve ark.
Stem Cells in Medicine. Erciyes Med J 2012; 34: 184187.
International Society for Cellular Therapy position statement. Cytotherapy 2006; 8: 315-317.
21. Ma J, Both SK, Yang F, et al. Concise review: cell-based
strategies in bone tissue engineering and regenerative
medicine. Stem Cells Transl Med 2014; 3: 98-107.
27. Harting M, Jimenez F, Pati S, Baumgartner J, Cox C Jr.
Immunophenotype characterization of rat mesenchymal
stromal cells. Cytotherapy 2008; 10: 243-253.
22. Cassidy JW. Nanotechnology in the regeneration of
complex tissues. Bone and Tissue Regeneration Insights 2014; 5: 25-35
23. Carletti E, Motta A, Migliaresi C. Scaffolds for tissue engineering and 3D cell culture. Methods Mol Biol 2011;
695: 17-39.
24. Horwitz EM, Le Blanc K, Dominici M, Mueller I, SlaperCortenbach I, Marini FC, Deans RJ, Krause DS, Keating A; International Society for Cellular Therapy. Clarification of the nomenclature for MSC: The International
Society for Cellular Therapy position statement. Cytotherapy 2005; 7: 393-395.
25. Gratwohl A, Baldomero H, Frauendorfer K, et al. The
EBMT activity survey 2006 on hematopoietic stem cell
transplantation: focus on the use of cord blood products.
Bone Marrow Transplant 2008; 41: 687-705.
26. Dominici M, Le Blanc K, Mueller I, et al. Minimal criteria
for defining multipotent mesenchymal stromal cells. The
28. Nakamura T, Shiojima S, Hirai Y, et al. Temporal gene
expression changes during adipogenesis in human mesenchymal stem cells. Biochemical and biophysical research communications. 2003; 303: 306-312.
29. Menssen A, Häupl T, Sittinger M, Delorme B, Charbord
P, Ringe J. Differential gene expression profiling of human bone marrow-derived mesenchymal stem cells
during adipogenic development. BMC Genomics. 2011;
12: 461.
30. Haynesworth SE, Goshima J, Goldberg VM, Caplan AI.
Characterization of cells with osteogenic potential from
human marrow. Bone. 1992; 13: 81-88.
31. Li F, Wang X, Niyibizi C. Bone marrow stromal cells
contribute to bone formation following infusion into femoral cavities of a mouse model of osteogenesis imperfecta. Bone. 2010; 47: 546-555.
Mezenkimal kök hücre özelliği • 393