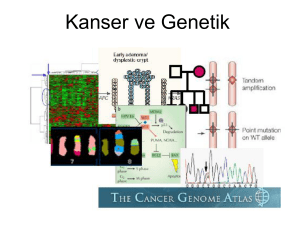
Özlem Dereceli Tez - Erciyes Üniversitesi Eczacılık Fakültesi
advertisement

i T.C. ERCİYES ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ HEREDİTER MEME KANSERİNDE BRCA1 VE BRCA2 GENLERİNİN ROLÜ Hazırlayan Özlem DERECELİ Danışman İlhan DEMİRHAN Biyokimya Anabilim Dalı Bitirme Ödevi Mayıs–2013 KAYSERİ i BİLİMSEL ETİĞE UYGUNLUK Bu çalışmadaki tüm bilgilerin, akademik ve etik kurallara uygun bir şekilde elde edildiğini beyan ederim. Aynı zamanda bu kural ve davranışların gerektirdiği gibi, bu çalışmanın özünde olmayan tüm materyal ve sonuçları tam olarak aktardığımı ve referans gösterdiğimi belirtirim. Özlem DERECELİ ii YÖNERGEYE UYGUNLUK “Herediter Meme Kanserinde BRCA1 ve BRCA2 Genlerinin Rolü” adlı bitirme ödevi Erciyes Üniversitesi Lisansüstü Tez Önerisi ve Tez Yazma Yönergesi’ ne uygun olarak hazırlanmıştır. Hazırlayan Özlem DERECELİ Danışman Prof. Dr. İlhan DEMİRHAN Biyokimya Anabilim Dalı Başkanı Prof. Dr. İlhan DEMİRHAN iii “Herediter Meme Kanserinde BRCA1 ve BRCA2 Genlerinin Rolü” adlı Bitirme Ödevi Erciyes Üniversitesi Lisansüstü Tez Önerisi ve Tez Yazma Yönergesi’ne uygun olarak hazırlanmış ve Biyokimya Anabilim Dalında Bitirme Ödevi olarak kabul edilmiştir. Hazırlayan Özlem DERECELİ Danışman Prof. Dr. İlhan DEMİRHAN Biyokimya Anabilim Dalı Başkanı Prof. Dr. İlhan DEMİRHAN ONAY: Bu bitirme ödevinin kabulü Eczacılık Fakültesi Dekanlığı’ nın................... tarih ve …………..……………sayılı kararı ile onaylanmıştır. …/…/…… Prof. Dr. Müberra KOŞAR Dekan iv TEŞEKKÜR Biyokimya Anabilim Dalı Başkanı ve bitirme ödevi danışma hocam Prof. Dr. Sayın İlhan DEMİRHAN’ a bitirme ödevimi hazırlamam sırasındaki yardımlarından dolayı çok teşekkür ederim. Ayrıca bu süreçte bana destek olan arkadaşım Esra KÖNGÜL’e ve bitirme ödevini hazırlamamdaki yardımlarından dolayı Orhan ER’e çok teşekkür ederim. v HEREDİTER MEME KANSERİNDE BRCA1 VE BRCA2 GENLERİNİN ROLÜ Özlem DERECELİ Erciyes Üniversitesi, Eczacılık Fakültesi Bitirme Tezi, Mayıs 2013 Danışman: Prof. Dr. İlhan DEMİRHAN ÖZET Meme kanseri, memenin yapısında oluşan kötü huylu bir gelişim olarak tanımlanmakta ve tüm dünyada ölümlerin başlıca nedenleri arasında sayılmaktadır. Meme kanserinin en sık karşımız çıkan belirtileri memede kitle, memede anormal büyüme, meme cildinde buruşukluk, meme ucu akıntısı, meme ucunda çökme ve kolda anormal büyüme olmasıdır. Burada unutulmaması gereken nokta, bu değişikliklerin kanseri işaret etmeme ihtimalinin de olmasıdır, bununla birlikte meme kanserinin önemli işaretleri olabilir. Meme kanserinin tanısı temel olarak 3 yolla yapılır; kendi kendine meme muayenesi (KKMM), klinik meme muayenesi (KMM) ve mamografidir. Tanı konulduktan sonra TNM sistemine göre hastalığın evrelemesi yapılır. Tespit edilen evreye göre tedavi yöntemi belirlenir. Tedavide primer yaklaşım cerrahi işlemdir. Cerrahiye ek olarak ya da cerrahi uygulanamadığı durumlarda radyoterapi, kemoterapi ve hormon tedavisi uygulanır. Bunlara ek olarak yeni bir yaklaşım olan gen terapisi de tedavide umut vaat edicidir. Meme kanseri için major risk faktörlerini cinsiyet, yaş, geçirilmiş meme hastalığı, ailede meme kanseri öyküsü ve genetik yatkınlık oluşturur. Oranlara bakıldığında meme kanserlerinin büyük çoğunluğu sporadik vakalar olarak görülürken, tüm olguların % 5–10’u kalıtsal nedenli ailesel meme kanseri karşımıza çıkar. Meme kanseri oluşumuna etki eden genler tümör supresör genler, onkogenler ve DNA tamir genleridir. EGFR, HER-2/neu, Ras, c-Myc, Siklinler, siklin bağımlı kinazlar ve inhibitörleri kanserde etkili onkogenlerdendir. Tümör supresör genlerden P53, ATM, PTEN, BRCA1 ve BRCA2 genleri rol oynar. Kalıtsal meme kanserlerinden sorumlu olarak, özellikle genom devamlılığının koruyuculuğunda iş gören proteinleri üreten bazı genlerin germ hücrelerindeki mutasyonları vi gösterilmiştir. Kalıtsal meme kanserinde gözlenen yüksek penetransa sahip meme kanserine yatkınlık genleri olarak BRCA1 ve BRCA2 genleri bulunmuştur. Kişinin BRCA1 ve BRCA2 gen mutasyonu taşıması meme kanseri olacağını göstermez, ancak mutasyon taşımayan popülasyona göre meme kanseri görülme riskleri artmış durumdadır. Anahtar Kelimeler: Meme Kanseri, Meme Kanseri Genetiği, BRCA, Gen Tedavisi vii THE ROLE OF BRCA1 AND BRCA2 HEREDITARY BREAST CANCER GENES Özlem DERECELİ Erciyes University, Faculty of Pharmacy Thesis, May 2013 Supervisor: Prof. Dr. İlhan DEMİRHAN ABSTRACT Breast cancer is defined as the formation of a malignant structure in the breast and breast cancer is one of the leading causes of death all over the world. The most encountered symptoms of breast cancer are mass breast, abnormal growth of breast, the breast skin creases, nipple discharge, crash of the nipple and abnormal growth of the arm. The point to remember here is that; these modifications sometimes may not indicate breast cancer, however they can be important signs of the cancer. Diagnosis of breast cancer is basically 3 ways; breast self-examination, clinical breast examination and mammography. After the diagnosis, the disease is staged according to TNM system. Method of treatment is determined according to the stage. The primary approach for the treatment is surgical procedure. In addition to surgery or in case of surgery can not be applied, radiotherapy, chemotherapy and hormonetherapy are implemented. Additionally, for treatment gene therapy is a promising. Major risk factors for breast cancer are gender, age, previous breast disease, family history and genetic predisposition to breast cancer. The majority of breast cancer cases are sporadic cases, and 5 to 10% all of case are appeared genetically. Genes that affect the formation of breast cancer are tumor suppressor genes, oncogenes and DNA repair genes. EGFR, HER-2/neu, Ras, c-Myc, cyclins, cyclin-dependent kinases and inhibitors are effective oncogenes in breast cancer. P53, ATM, PTEN, BRCA1 and BRCA2 are tumor suppressor genes which play a role in breast cancer. Responsible for hereditary breast cancers is shown in some of gene that produce proteins which are performed protection of genome continuity of the mutations in germ cells. BRCA1 and BRCA2 genes which have a viii high penetrance have been found effective for hereditary breast cancer and these genes are called breast cancer susceptibility genes. Carrying BRCA1 and BRCA2 genes mutation doesn’t mean that the person will certainly be come breast cancer, but it is shown that BRCA1 and BRCA2 genes mutation carriers have great risk of breast cancer compared to non-carriers. Key Words: Breast Cancer, Genetic of Breast Cancer, BRCA, Gene Therapy ix İÇİNDEKİLER BİLİMSEL ETİĞE UYGUNLUK ............................................................................. i YÖNERGEYE UYGUNLUK.................................................................................... ii KABUL ONAY .......................................................................................................... iii TEŞEKKÜR .............................................................................................................. iv ÖZET........................................................................................................................... v ABSTRACT .............................................................................................................. vii İÇİNDEKİLER ......................................................................................................... ix TABLOLAR LİSTESİ .............................................................................................. xi ŞEKİLLER LİSTESİ ............................................................................................... xii KISALTMALAR .................................................................................................... xiii 1. GİRİŞ VE AMAÇ .................................................................................................. 1 2. GENEL BİLGİLER ............................................................................................... 3 2.1. Meme Kanseri ................................................................................................... 3 2.1.1. Meme Kanseri Tarihçesi ............................................................................. 3 2.1.2 Meme Kanseri Epidemiyolojisi ................................................................... 4 2.1.3. Meme Kanseri Etyolojisi ve Risk Faktörleri .............................................. 6 2.1.4. Meme Kanseri Biyolojisi .......................................................................... 11 2.1.5. Meme Kanseri Sınıflandırılması ............................................................... 11 2.1.6. Meme Kanseri Belirtileri .......................................................................... 12 2.2. Meme Kanseri Genetiği................................................................................... 15 2.2.1. Meme Kanseri Genomu ............................................................................ 16 2.2.2. Meme Kanseri Oluşumunda Etkisi Olan Genler ...................................... 16 2.2.2.1. Meme Kanseri Patogenezinde Rol Oynayan Onkogenler;................. 18 2.2.2.2. Meme Kanseri Patogenezinde Rol Oynayan Tümör Supresör Genler .............................................................................................................. 20 2.2.3. Ailesel Meme Kanseri ve Yatkınlık Genleri............................................. 21 x 2.2.3.1. BRCA1 geni ....................................................................................... 23 2.2.3.2. BRCA2 ............................................................................................... 26 2.2.4. Genetik Test ve BRCA Analizi ................................................................ 28 2.3. Meme Kanseri Evrelemesi .............................................................................. 32 2.4. Meme Kanseri Tanısı ...................................................................................... 34 2.5. Meme Kanseri Tedavisi................................................................................... 39 2.5.1.Cerrahi Tedavi ........................................................................................... 40 2.5.2. Radyoterapi ............................................................................................... 40 2.5.3. Kemoterapi................................................................................................ 40 2.5.4. Hormon Tedavisi ...................................................................................... 42 2.5.5. Gen Tedavisi ............................................................................................. 43 3. TARTIŞMA VE SONUÇ..................................................................................... 45 KAYNAKLAR ......................................................................................................... 48 ÖZ GEÇMİÇ ............................................................................................................ 55 xi TABLOLAR LİSTESİ Tablo 2.1. Meme Kanserinde Risk Faktörleri .................................................................. 7 Tablo 2.2. Herediter meme kanseri sendromları ............................................................ 18 Tablo 2.3. BRCA1/2 mutasyon taşıyıcılarında yaşam boyu kanser gelişme riski.......... 23 Tablo 2.4. BRCA1 Ve BRCA2 Genlerinin Karşılaştırılması ................................................... 27 Tablo 2.5. BRCA mutasyonu taşıyıcılarında koruyucu seçenekler ............................... 31 Tablo 2.6. Meme Kanserinde TNM Sınıflaması ............................................................ 32 Tablo 2.7. Meme Kanserinde Evreleme ......................................................................... 33 Tablo 2.8. Mammografide BIRADS Kategori Sınıflandırılması.................................... 36 Tablo 2.9. Meme Kanserinde ACS Tarafından Önerilen Meme Kanseri Tarama Rehberi ......................................................................................................... 39 xii ŞEKİLLER LİSTESİ Şekil 2.1. Türkiye’de yıllara göre kanser insidanları (Kadın).......................................... 6 Şekil 2.2. Türkiye’de yıllara göre kanser insidansları (Erkek) ........................................ 6 Şekil 2.3. Yaşa göre meme kanseri görülme oranı ......................................................... 7 Şekil 2.4. Meme Kanserinin Uyarıcı Belirtileri ............................................................ 14 Şekil 2.5. Meme Kanserinde Genetik Yaklaşımın Yeri ................................................ 15 Şekil 2.6. BRCA1 geninin kromozomdaki yerleşimi ................................................... 21 Şekil 2.7. BRCA2’nin Kromozomdaki Yerleşimi ........................................................ 21 Şekil 2.8. BRCA1 proteini ............................................................................................. 23 Şekil 2.9. HBOC (Herditer Meme ve Over Kanseri) kriterlerine uyan hastaya yaklaşım algoritması ...................................................................................... 29 xiii KISALTMALAR A_CMF Adriamisin Siklofosfamid Metotreksat 5-Fluorourasil AC_T Adriamisin Siklofosfamid Paklitaksel AC Adriamisin Siklofosfamid ACS Amerikan Kanser Birliği AJCC Amerikan Kanser Komitesi, American Joint Commite on Cancer AK Epirubisin Siklofosfamid ALP Alkalen Fosfataz ATM Mutant Ataksi Telanjiektazi BASC BRCA1 ilişkili genom gözetim kompleksi, BRCA1 associated genom survelliance complex BIRADS Meme Görüntüleme Raporlama ve Veri Sistemi BKI Beden Kitle İndeksi BRCA Meme Kanseri Geni, Breast Cancer Gene BRCT BRCA karboksil terminali CA125 Kanser Antijeni125 CAF Siklofosfamid Adriamisin 5-Fluorourasil CAT Scan Kompüterize aksiyal tomografi CBC Tam kan sayımı CDK Siklin Bağımlı Kinaz xiv CDKI Siklin Bağımlı Kinaz İnhibitörleri CEF Siklofosfamid Epirubisin 5-Fluorourasil CIS Karsinoma in situ CMF Siklofosfamid Metotreksat 5-Fluorourasil DCIS Duktan karsinoma in situ DNA Deoksiribonükleik asit EGF Epidermal Büyüme Faktörü EGFR Epidermal Büyüme Faktör Reseptörü ER Östrojen Reseptörü GDP Guanozin Difosfat GTP Guanozin Trifosfat HBOC Herediter Meme ve Over Kanseri HER İnsan Epidermal Büyüme Hormonu Reseptörü IARC International Agency For Research on Cancer, Uluslararası Kanser Araştırma Ajansı kDa Kilodalton KKMM Kendi Kendine Meme Muayenesi KMM Klinik Meme Muayenesi LDH Laktat Dehidrogenaz MRI Magnetik Rezonans Görüntüleme MYC Myelomatosis virüs onkogeni xv NHEJ Genotoksik homolog olmayan son birleşmesi homologus End-joinig) OD Otozomal Dominant P53 Protein53 pADPr Poli-Adenozin Difosfat-Riboz PGT Preimplantasyon Genetik Tanı PST Preoperatif sistemik tedavi PR Progesteron Reseptörü PTEN Fosfataz ve Tensin Homologları Ras Rat Sarkoma virüsü onkogeni Rb Retinoblastoma Geni RING Really Interesting New Gene, Gerçekten İlginç Yeni Gen RNA Ribonükleik asit SB Sağlık Bakanlığı SGOT Serum Glutamik Oksaloasetik asit Transaminaz SGPT Serum Glutamil Piruvat Transaminaz TAC Dosetaksel Adriamisin Siklofosfamid TC Dosetaksel Siklofosfamid TCH Dosetaksel Karboplatin Herceptin TK Tirozin Kinaz TNM Tümör-Nod-Metastaz (Non- xvi TP53 Tümör Protein53 TVUSG Transvajinal Ultrasonografi UICC Uluslararası Kanser Kontrol Örgütü, Union International Contre Cancer USG Ultrasonagrofi WHO Dünya Sağlık Örgütü 1 1. GİRİŞ VE AMAÇ Meme kanseri memenin yapısında meydana gelen kötü huylu bir gelişim olarak tanımlanmakta, batı ülkeleri başta olmak üzere tüm dünya ülkelerinde ölümlerin başlıca nedenleri arasında sayılmaktadır (1,2). Meme kanserinin gerek hastanın gerekse yakınlarının sağlığı üzerinde fiziksel, sosyal ve ruhsal etkilerinin bulunması ve ilerleyen evrelerinde tedavi edilme şansının azalması; hastalığın erken evrede teşhis edilmesi için, memede görülen olası belirtilerin dikkate alınmasını ve herhangi bir şikayetle karşılaşıldığında zaman kaybedilmeden hekime başvurulmasını gerekli kılmaktadır (1). Dünya Sağlık Örgütü (WHO) ve Uluslararası Kanser Araştırma Ajansı (IARC)’nın verilerine göre 2008 yılında dünya genelinde 12 milyon kişiye kanser teşhisi konulurken, bu rakamın 2030 yılında 26 milyonu aşacağı tahmin edilmektedir, bu kanser teşhisi konulan 12 milyon kişinin de 1.1 milyondan fazlası meme kanseri teşhisi almaktadır (2,3). Dünya’da her yıl bir milyon yeni meme kanseri tanısı konmakta olup meme kanseri tüm kanser olgularının % 18’ini oluşturmaktadır. Dünya’da, her yedi kadından birinin yaşamının her hangi bir döneminde meme kanseri olabileceği öngörülmektedir. Türkiye’de ise meme kanseri insidansı artmakta ve mevcut verilere göre kadınlar arasında görülen kanserler içinde %24.1 ile ilk sırada yer almaktadır (4). Amerika’da ise kadınların ölüm nedenleri arasında meme kanserinin, kalp hastalıkları ve akciğer kanserinden sonra üçüncü sırada olduğu belirtilmektedir (3). Meme kanserinden ölümlerin önlenebilmesi ve hastalığa yakalananların erken evrede teşhis edilip tedavi olanağına kavuşabilmeleri için; memede ortaya çıkan belirtilere dikkat edilmesi önem taşımaktadır. Belirtilerin erken evrede teşhis olanağının yükseltilebilmesi için; Kendi Kendine Meme Muayenesi (KKMM) ve Klinik Meme 2 Muayenesi (KMM) yapılması, mamografi çektirilmesi ve gerekli görüldüğü hallerde de ultrasonografi (USG) ile manyetik rezonans görüntüleme (MRI) gibi ilave tarama yöntemlerinin kullanımına özen gösterilmesi gerekmektedir (1). Tüm kanserlerin %5-10’u meme kanseri eğilimi gen mutasyonundan kaynaklanmaktadır. Bilinenleri BRCA1 (Meme kanseri geni1) ve BRCA2 (Meme kanseri geni2) ’dir; bu genlerin mutasyonu tüm ailesel kanserlerin %40- 50’sinden sorumludur (5). Meme kanseri gelişimi, genetik ve epigenetik mekanizmaları içermektedir (6). Çalışmamızda ülkemiz ve tüm dünya toplumları için önemli bir yere sahip olan herediter meme kanserinin genetiğinde rol oynayan BRCA-1 ve BRCA-2 genleriyle olan ilişkisinin açıklanması amaçlanmıştır. 3 2. GENEL BİLGİLER 2.1. Meme Kanseri 2.1.1. Meme Kanseri Tarihçesi Meme muayene ederken göz ve elle ulaşılması en kolay organlardan biri olduğundan bu organda ortaya çıkan patolojik değişiklikler ilk çağlardan beri insanların ve hekimlerin dikkatini çekmiş dolayısıyla da önemli gözlemlerin yapılmasını sağlamıştır (7). Meme kanserinin tanı ve tedavisinin tarihsel evriminin bilinmesi önemlidir ve gerçekte insanlığın 5000 yıldan beri kanser hastalığı ile yaşadığı maceranın bir özeti gibidir (8). İnsanlık tarihinin bilinen en eski hekimi İmhotep’in yazdığı kabul edilen Mısır’ın tarihi Teb(Luxor) kentinde bulunan Edwin Smith papirüsünde -şuan İngiltere müzesinde yer alan- meme kanseri ile ilgili ilk kayıtlara rastlanmıştır (8,9). Bu meme tümörlerini ayrıntılı olarak tanımlamakta ve özellikle bunların sert ve soğuk olduklarını vurgulayarak, inflamatuvar hastalıklardan ayırt etmeye çalışmaktadır (9). Tarih öncesi dönemlerde yer alan diğer büyük kültürlerde, Hint, Çin, Aztek-Maya-İnka kazıtlarında meme hastalıkları ile ilgili ciddi araştırma yapılmamış veya kayıtlara rastlanmamıştır. Modern tıbbın babası kabul edilen Hippokrat kanlı meme başı akıntısı ile gelen meme kanserli bir hastayı da tanımlamış ve menopoz ile meme kanseri arasındaki ilişkiyi belirlemiştir (8). Hipokrat kanser için ‘’karkinos’’ ya da ‘’karkinoma’’ terimlerini kullanmışsa da meme kanserinin de diğer kanserler gibi cerrahiden yarar görmez düşüncesini savunmuştur (7,9). Hippokrat kanser için ‘’tüm vücudu etkiler, uzaklara gider, iyileşmez ve hasta bu nedenle ölür’’ demiştir ve bu da metastatik meme kanseri hakkındaki ilk bilgidir (10). İlk kez İskenderiyeli Leonides M.S.1O.yıllarda birbirini izleyen kesi ve 4 koterizasyon yaparak sağlam meme dokusu ile tümörü çıkararak mastektomi yapan ilk hekimdir (7,8). Ebu-Kasım (1O.yy), Mondeville (13.yy) ve Lanfranc, Leonides’in tekniğini geliştirmişlerdir (7). Aulus Cornelius Celsus meme kanserinin ilk sınıflandırılmasını yapmış ve cerrahi ile tedavisini olanaklı kanserlere ‘’cacoethes’’ adını vererek bunun dışındaki meme kanserleri çıkarılır, katerize edilir ya da kostik maddelerle yakılırsa daha hızlı büyüdüklerini ve total çıkarıldıktan sonra da nüksettiklerini yazmıştır (9). Celsus karnabahar şeklinde ülserli kanser şeklinde tanımlamış ve adeta bugün TNM (Tümör-Nod-Metastaz) sınıflamasında T1, T2-T3T4 tümörleri tarif etmiştir. Roma imparatorluğunun yıkılmasından rönesansa kadar geçen (MS 476-1500) ortaçağ dönemi Hippokrat ve onun izleyicisi olan Galen’in etkisinde geçmiştir (8). İmparator Justinyen’in hekimi İstanbul’lu Aetius eksizyon ve bunu takip eden koterizasyonu öneren ve yaygın olarak kullananların başında gelmektedir. Razi meme kanserlerinin insize edilmemesini, tümünün çıkarılmasını ve koterizasyon yapılmasını önermekteydi. Ebul-Kasım Ez Zehravi, Endülüs’ün bilim merkezi Kordoba şehri yakınlarında on birinci asırda yaşayan bu alim özellikle küçük meme tümörlerinin eksizyon + koterizasyonla çıkarılmasını önermiş diğer yandan da meslek yaşamında tek bir meme kanseri olgusunu iyileştiremediğini ve bunu başaran bir kişide tanımadığını yazmıştır (9). Meme hastalıkları ile ilgili çalışmalar bu tarihsel sürecin bilimi getirdiği günümüz tıbbında da durmaksızın sürmekte; giderek memeyi koruma, sınırlı rezeksiyon ve aksiller küraj, meme rekonstrüksiyonlanın aynı seansta uygulanması gibi modern görüşleri desteklemektedir (7). Bergamalı Galen kanser için ‘’yengeç’’ terimini ısrarla kullanmış, yazılarında tümörü dairesel bir şekilde ve normal dokulardan geçilerek çıkarılmasını önermiştir (9). Galen kansere ‘humor’ların ve fazla siyah safra salgılanmasının yol açtığı teorisini ortaya atmış, tedavi olarak bundan kurtulma amacıyla diyet, kupa çekme, flebotomi ve kan süzdürme kullanmıştır . Galen’in bu görüşü dünya tıbbını bin yıldan fazla, ondokuzuncu yüzyılın başlarına kadar bir doktrin olarak değişmeden etkisini sürdürmüştür (9,11). 2.1.2 Meme Kanseri Epidemiyolojisi Meme kanseri sanayileşmiş Batı dünyasında insidans ve yıllık mortalite açısından çoktandır birinci sıraya oturmuş, olağanüstü önemde bir hastalık olarak disiplinler 5 arası ilgi odağı haline gelmiştir (12,13). Meme kanseri 1987’e kadar kadınlarda görülen tüm kanserlerin yaklaşık % 20’sini oluşturarak 2. Sırada yer alırken, 1988 – 1990 yıllarında % 24.3 – 35.5 oranları ile 1. sıraya yükselmiştir (11). Özellikle gelişmiş ülkelerde meme kanserinin görülmesi ve meme kanserinden ölüm oranı çok yüksek iken, az gelişmiş ülkelerde bu oran daha azdır, ancak hızla artmaktadır (14). WHO’nun 2002 verilerine göre dünyada kadınlarda görülen kanserlerin başında meme kanseri, erkeklerde görülen kanserlerin başında akciğer kanseri gelmektedir (10). Meme kanseri ABD’de en sık görülen kadın kanseri, kadınlarda kanser ölümlerinin 2. yaygın nedeni ve 40-59 yaş arası kadınların ölümlerinin temel sebebidir (15). Amerika’da yaşamı boyunca her dokuz kadından birinin meme kanserine yakalandığına, üçte ikisinin de bu hastalığa bağlı olarak hayatını kaybetme tehlikesi ile karşı karşıya kaldığına dikkat çekildiği görülmektedir. Avrupa ülkelerinde de, her on kadından birine yaşamı boyunca meme kanseri tanısı konulmaktadır (1,16). Türkiye açısından bakıldığında ise; meme kanseri kadınlarda görülen en yaygın kanser türü olarak ifade edilmekte ve Sağlık Bakanlığı (SB) ’nın 1999 yılı istatistiklerine göre görülme oranının %24.1 olduğuna işaret edilmektedir (1). Türkiye’de kayda geçen kanserler arasında kadınlarda meme kanseri, Akdeniz, Karadeniz ve İç Anadolu Bölgelerinde 1.sırada; Marmara, Doğu ve Güneydoğu Anadolu Bölgelerinde 2.sırada yer almaktadır (9,11). Türkiye’de kadınlarda en çok görülen kanser olan meme kanserinin son yıllardaki artışı Şekil 2.1.de gösterilmiştir, ayrıca Türkiye’de erkek kanserlerine ait istatistik de Şekil 2.2.de gösterilmiştir. Ülkemizde 1982 yılında kanser bildirimi zorunlu hastalıklar listesine alınmış ve bu bildirimin SB bünyesindeki Kanser Savaş Daire Başkanlığı’na yapılması istenmiştir. Ancak yine de Türkiye’de kanser istatistiğinin sınırlı olduğu bir gerçektir (10,12). 6 Şekil 2.1. Türkiye’de yıllara göre kanser insidanları (Kadın) (17) Şekil 2.2. Türkiye’de yıllara göre kanser insidansları (Erkek) (17) 2.1.3. Meme Kanseri Etyolojisi ve Risk Faktörleri Meme kanseri gelişmesinde pek çok risk faktörü bilinmekle beraber hangi nedene bağlı olarak ortaya çıktığı bilinmemektedir (18,19). Meme kanseri etyolojisinde genetik, çevresel, hormonal, sosyal, biyolojik ve psikolojik pek çok faktör rol alır (20). Meme kanserindeki risk faktörleri Tablo 2.1.de gösterilmiştir. 7 Tablo 2.1. Meme Kanserinde Risk Faktörleri (9,21) Meme Kanserinde Risk Faktörleri Major Risk Faktörleri Minör Risk Faktörleri • Cinsiyet (kadın olmak) • Doğurganlık ve menstruasyon öyküsü • Yaş (50 yaş üzerinde olmak) • Laktasyon öyküsü • Meme hastalığı öyküsü • Eksojen östrojen alımı • Ailede meme kanseri öyküsü • Yaşam biçimi (sigara, alkol, diyet, obezite, fiziksel aktivite) • Genetik yatkınlık • Radyasyon • Virüsler • Sosyoekonomik durum • Etnik faktörler Meme kanserindeki risk faktörleri şunlardır; • Yaş; yaş faktörü meme kanseri için önemli bir risktir ve insidans yaş ile artmaktadır (9,18,19,22). Meme kanseri tanısı konan kadınlar üzerinde yapılan çalışmalarda, %70.0’ının yaşının 50 yaş ve üzerinde olduğu ifade edilmektedir (9,19). Yaşa göre kanser görülme oranı Şekil 2.3.’de gösterilmiştir. Şekil 2.3. : Yaşa göre meme kanseri görülme oranı (14) 8 • Cinsiyet; meme kanseri erkeklerde de görülebilmesine rağmen kadınlar daha çok risk altındadır (23). • Meme hastalığı öyküsü; benign meme hastalıkları, diğer major risk faktörlerinin etkisinden bağımsız olarak kabul edilmektedir (9). Daha önce meme kanseri geçirmiş ve tedavi olmuş kadınlarda, diğer memede de kanser gelişme riski 4 kat fazla olur (23,24). Ayrıca kadınlarda over ve endometriyum kanserinin gelişmesi meme kanseri oluşma riskini artırmaktadır (24). • Ailede meme kanseri öyküsü; Meme kanserine ailesel yatkınlık ilk olarak 1866’da Paul Broca tarafından kendi eşinin ailesinde dört nesil süresince 24 kadının 10’unda meme kanserinin ortaya çıkmasından sonra ileri sürülmüştür (3). Meme kanserli bir kadının kız kardeşi ya da kızı hastalık açısından 3 kat risk altındadır. Hem annesi hem kız kardeşi hasta olan bir kadında risk 10 kat artar (20). Batı ülkelerinde yapılan çalışmalarda meme kanserlerinin % 10’undan fazlasının genetik yatkınlıkla ilişkili olduğu belirtilmiştir (22). Meme kanseri gelişiminde genellikle otozomal dominant (OD) kalıtımın söz konusu olduğu, yani bu kalıtım vertikal olarak kansere yatkınlık şeklinde anne ve babadan çocuklara geçmektedir (9,22). Bazen ailelerin kendilerinde kanser gelişimi olmadan anormal geni aktarabileceği bilinmektedir (22). Kalıtsal meme kanserinde otozomal dominant karakterli kalıtımdan sorumlu olan BRCA1 ve BRCA2 mutasyonlarıdır (9). BRCA1 geninin ailevi meme kanseri ve over kanserinin etyolojisinde rol oynadığı belirtilmektedir (24,25). Bu genin mutasyona uğramış şeklini taşıyan kadınlarda meme kanserine yakalanma riski % 85 olarak belirtilmiştir. BRCA2 geni taşıyan kadınlarda ise meme kanseri gelişme riski % 87 olarak kabul edilmektedir (24). P53 (Protein53) geninde mutasyon olması da meme kanseri riskini artırmaktadır (7). • Doğurganlık ve Menstruasyon Öyküsü; meme kanseri riski erken menstrual yaşamın uzunluğu ile ilgilidir (26). Menarşın 12 yaşından önce olması, menopozun 55 yaşından sonra gerçekleşmesi meme kanseri oluşumu açısından birer risk faktörüdür (9,18, 26). Erken yaşta canlı doğum yapma ise riski azaltmaktadır. Evlenmemiş veya hiç doğum yapmayan kadınlarda risk çok daha fazla olmaktadır (25,26). Ancak bu durumlar sadece birinci derece akrabalarında meme kanseri olmayan kadınlar için söz konusudur (9). 9 • Laktasyon öyküsü; Emzirmenin meme kanseri üzerindeki etkisi henüz tam olarak anlaşılamamıştır. Ancak laktasyonla birlikte ovulatuar dönemin kısalmasının meme kanseri riskinin azalmasında rol oynadığı düşünülmektedir (7). • Ekzojen östrojenler; Hayvanlarda yapılan çalışmalarda dışarıdan östrojen verilmesinin kanser riskini artırdığı belirlenmiştir. Östrojenler meme dokusundaki normal ve kanserli hücrelerin büyümesini uyarırlar (7,16). Oral kontraseptifler, uzun süreli kullanıcılarda meme kanseri riskinde hafif bir artışa neden olmaktadır. Ancak bu etkinin kısa süreli olduğu gözlenmiştir (9). WHO’ya göre enjeksiyon yöntemiyle kontraseptif kullanımı meme kanseri riskini ne azaltmakta ne de arttırmaktadır (3). Kadınlarda menapoz semptomlarını ortadan kaldırmak, osteoporozu önlemek ve iskemik kalp hastalığı riskini azaltmak için uygulanan postmenopozal hormon replasman tedavisi ile meme kanseri arasındaki ilişkiyi inceleyen çalışmalar arasında çelişkiler mevcuttur (3,9). Uzun süreli tedavide risk artarken tedavinin kesilmesi ile risk azalır. Kısa süreli tedavilerde ise kanser riski etkilenmez (9). • Radyasyon; Nagasaki ve Hiroshima’daki atom bombası mağdurları, akut postpartum mastit nedeniyle yüksek radyasyon ile tedavi olanlarda ve pulmoner tüberküloz nedeniyle pek çok kez göğüs floroskopik incelemesi yapılanlarda meme kanseri insidansı artmaktadır. Aynı dozun parçalar halinde alınması ile tek doz halinde alınması arasında risk açısından hiçbir fark yoktur. Meme kanseri için uygulanan radyoterapi kontralateral memede kanser riskini arttırmaktadır (3). • Alkol; Orta düzeyde alkol alımı premenpozal ve postmenapozal dönemde östrojen metabolizmasında değişikliklere sebep olur (3,7). Çoğu prospektif çalışmalar göstermiştir ki alkol meme kanseri riskini, özellikle de 30 yaşın altında alınması ile, %30 artırmaktadır (3,27). • Diyet; Diyet ile meme kanseri arasında açık bir ilişki saptanmamıştır. Fakat yağ tüketimi ile meme kanseri arasında belirgin bir ilişki vardır (3). Kızarmış yağ oranı yüksek besinler meme kanseri riskini arttırırken, omega 3 yağ asitlerinin koruyucu olduğu bilinmektedir (28). Ayrıca yapılan çalışmalarda yağın kendisinden çok, et ve süt ürünleri gibi yüksek oranda yağ içeren besinlerin tüketilmesi ile meme kanseri arasında bir ilişki saptanmıştır (27). Liften zengin gıdaların, A, C, E vitaminlerinin ve selenyumun meme kanseri oluşumuna karşı koruyucu etkiye sahip olduğu gösterilmiştir (29). Doğal antioksidanların, vitaminlerin ve diğer fitokimyasalların en 10 önemli kaynağı olan meyve ve sebzelerin yoğun olarak tüketilmesi, meme kanseri riskinde azalmaya neden olmaktadır (7). • Obezite; Çalışmalar meme kanserinin kilo ile direkt ilişkili olduğunu göstermiştir (3). Premenapoz döneminde düşük vücut ağırlığı, post menopoz döneminde ise artmış vücut ağırlığı meme kanseri riskini artırmaktadır (7). Yapılan kohort çalışmalarda beden kitle indeksinin (BKI) 28’den yüksek olmasının postmenopozal meme kanseri riskini 2 kat arttırdığı bildirilmiştir (22). • Sigara tüketimi; sigara içilmesi ve meme kanseri riski arasındaki ilişki tam net olmasa da genel anlamda sağlığı olumsuz etkilediği için bırakılması tavsiye edilmektedir (7,19). • Fiziksel aktivite; Düzenli fizik aktivite yapan kadınlarda meme kanseri riskinin azaldığına yönelik çalışmalar vardır (3,7,27). 40 yaşın altında günde 4 saat ya da daha fazla egzersiz yapan kadınlarda kanser riskinin, yapmayan kadınlara göre % 60 daha az olduğu bildirilmiştir (27). Egzersiz, östrojen hormonunun düzeylerini azaltarak, vücut yağ oranını düşürerek, bağışıklık sistemi ile antioksidan savunma sistemini iyileştirerek ve hücre çoğalmasını uyaran bazı hormonların etkisini azaltarak meme kanseri riskini azaltmaktadır ( 7). • Virüsler; Virüsler birçok kanserlerle yakın ilişkidedir (3,10). Adenovirüsler, C tipi RNA virüsleri, herpes virüslerin etkili olabileceği düşünülmektedir (10). • Sosyoekonomik durum; Varlıklı ve sosyo-ekonomik düzeyi yüksek olan kadınlarda, meme kanseri görülme sıklığının daha fazla olduğu ifade edilmektedir (19). Sosyoekonomik düzeyle meme kanseri arasındaki ilişki etyolojik önemi olan eğitim, emzirme, doğurma, ilk doğumda annenin yaşı gibi diğer faktörlere dayanır (23). • Etnik faktörler; meme kanseri coğrafi bir dağılım göstermektedir, fakat bu gerçekte coğrafi bir dağılım değil ırk dağılımıdır (30). Çoğu Asya ve Afrika ülkesinde hem meme kanseri riski hem de mortalitesi daha düşükken, Kuzey Avrupa ve Kuzey Amerika’da ise yüksek risk ve mortalite söz konusudur (20). 11 2.1.4. Meme Kanseri Biyolojisi Normal meme dokusunun kanser hücresine dönüşmesi çok aşamalı, karmaşık bir süreçtir (24,29). Başlangıçta normal hücrelerde gerçekleşen ve nükleer ya da stoplazmik onkogenleri aktifleştiren, transkripsiyonu düzenleyen mekanizmaları, sinyal moleküllerini etkileyen, büyüme faktörü ve reseptör etkileşimini bozan veya tümör supresör genlerin aktivitesini baskılayan çeşitli değişiklikler bu hücrelere belirli çoğalma avantajı sağlar. Buna paralel olarak ortaya çıkan yeni değişiklikler çok aşamalı meme karsinogenezinde komşu dokulara invaze olabilen, immün denetimden kaçan ve metastaz yapabilen klonlar oluşturur. Bu klonlar normal hücre çoğalmasını düzenleyen doğal sinyallere yanıt verme yeteneğini de kaybederek denetimsiz çoğalmaya başlar (29). Kanser hücrelerinin kaynaklandığı yere lokalize olmasına karsinoma in situ (CIS), çevre doku ve organlara yerleşmesine invaziv karsinom, ana dokuyu terk ederek kan veya lenf yoluyla uzak organ ve dokuya yerleşmesine metastaz denir (10). 2.1.5. Meme Kanseri Sınıflandırılması WHO’nun meme kanseri sınıflaması aşağıdaki şekildedir. 1)Epitelyal tümörler ; İnvaziv Duktal Karsinom, invaziv Kribriform Karsinom, invaziv Lobuler Karsinom, Medüller Karsinom, Tubuler Karsinom, Müsinöz Karsinom, Nöroendokrin Tümörler, Asinik Hücreli Karsinom invaziv Papiller Karsinom, Glikojenden zengin berrak hücreli Karsinom, invaziv Mikropapiller Karsinom, Sebase Karsinom, Apokrin Karsinom, inflamatuar Karsinom, Metaplastik Karsinom, Lobüler Neoplazi, Lipid-rich Karsinom, intraduktal Proliferatif Lezyonlar, Sekretuar Karsinom, Mikroinvaziv Karsinoma, Onkositik Karsinom, intraduktal Papiller Neoplaziler, Adenoid Kistik Karsinom, Benign Epitelyal Proliferasyonlar 2)Myoepitelyal Lezyonlar; myoepiteloz, adenomyoepitelioma, malign myoepitelioma adenomyoepitelyal adenoz, 12 3)Mezenşimal Tümörler; hemanjioma, anjiomatoz, hemanjiyoperisitoma, psödoanjiyomatoz stromal hiperplazi, myofibroblastoma, fibromatoz (agesif), inflamatuar myofibroblastik tümör, lipom, granüler hücre tümörü, nörofibrom, schwannom, anjiosarkoma, liposarkom, rabdomyosarkom, osteosarkom, leiomiyom, leiomyosarkom 4) Fibroepitelyal tümörler; fibroadenoma, phyllodes tümör, periduktal stromal sarkom, meme hamartom 5) Meme Başı Tümörleri; meme başı adenomu, siringomatöz adenom, meme başı için Paget hastalığı 6) Malign Lenfoma; diffüz büyük B hücreli lenfoma, Burkitt lenfoma, ekstranodal marjinal zone B hücreli lenfoma MALT türü, foliküler lenfoma 7) Metastaik Tümörler- Erkek Meme Kanserleri; jinekomasti, karsinoma (31) 2.1.6. Meme Kanseri Belirtileri Meme kanseri en yavaş büyüyen tümörlerdendir ve heterojenite ile karakterizedir (20,29). Teşhis öncesi preklinik periyod ve tanı konulduktan sonraki doğal seyir yıllar ve hatta onyılları bulabilir (20,26). Tümörün “doubling zamanı” çok değişken olabilirken ortalama 100 gündür. Bu tümörün klinik olarak fark edilebilmesi için ortalama 8 yıl geçer ki bu da oldukça uzun bir dönemdir (12). Ancak bu seyir bazı hastalarda daha kötü ve agresiftir (20). Meme kanserinin belirtileri hastalığın vücuttaki yayılım derecesine ve kişiden kişiye göre farklılık göstermektedir (1). Meme kanserli hastalarda ilk bulgu, %70 oranında memede bir kitlenin varlığıdır (27). Bu kitle çoğunlukla ağrısız olsa da ilerleyen safhalarda ağrı belirtiler arasında yer alır, çoğunlukla hastalar tarafından bu kitle tesadüfen saptanır (1,27). Meme kanserinin belirtileri konusunda unutulmaması gereken nokta, memede meydana gelen değişikliklerin birçok nedeni olduğudur. Bu değişikliklerin büyük 13 çoğunluğu zararsız olmakla birlikte küçük bir ihtimalle meme kanserinin ilk işaretleri olabileceği de unutulmamalıdır (1). Meme kanserli hastalarda, memede saptanabilen semptom ve bulgular şöyledir; • Kitle; meme kanserinde en sık rastlanan ilk belirtidir, genellikle ağrısız veya hafif ağrılıdır (23). Kitle sert ve hareketsizdir, kenarları düzensizdir, sınırları zor belirlenir (7,23). KKMM yapan kadınlar, anormalliği hissetmede diğer kadınlara göre daha şanslıdırlar (23). • Ağrı; Ağrı çoğunlukla meme kanserine eşlik eden bir bulgu değildir ve ağrıya daha çok kanserin geç evrelerinde rastlanır (7). Belirleyici değildir (30). • Akıntı; Meme başı akıntısı olan hastaların %12’sinde akıntı kansere bağlıdır, spontan, tek taraflı ve kanlı ya da kanlı-serözdür. Bu bulgu selim meme hastalıklarında kanserden daha sık görülür. Akıntı kanserle ilgili ise çoğu kez bir kitle palpe edilebilir ve bu kitlenin üzerine bastırmakla meme başından akıntı gelebilir ( 7,23). • Portakal kabuğu görünümü; Büyüyen kitle, Cooper ligamentlerini gererek deride portakal kabuğu görünümünün ortaya çıkmasına neden olur. Bu durum bazı vakalarda açıkça görüldüğü halde, bazı vakalarda tümörün bulunduğu kısım parmakla sıkıştırıldığında geçici olarak ortaya çıkar. Portakal kabuğu görünümü, vakaların oldukça gecikmiş olduğunu gösterir (23). • Meme başı retraksiyonu (doğumsal nedenlere bağlı olmaksızın) ; meme başında içe batma ya da bir yana çekilme olmasıdır (1,7). Tümörün yerine göre santral tümörlerde meme başı içe batar, üst dış kadran tümörlerinde yukarı ve dışa döner (7). • Deri ödemi; Derinin lenfatik drenajının tümör tarafından bozulduğunu gösterir ve buna lenfödem adı verilir (7,23,30). • Deride eritem ve ülser; Lenfatik tıkanma ile derinin beslenmesi bozulur ve deride kızarıklık ve ülserler oluşur (7,23). • Memede büyüme, küçülme ya da büzülme (3). • Enflamasyon bulguları; Hastaların %4'ünde kanser kendini enflamasyon bulguları ile ortaya koyar (7). • Lenf bezlerinde şişlik olması (1) 14 • Kolda şişlik ve ödem; Tümör hücrelerinin koltuk altında bulunan lenf nodlarına yerleşmesiyle bölgenin lenfatik drenajının kesilmesi sonucunda ortaya çıkar (1,7). Meme kanserinin ileri belirtilerindendir (30). Meme kanserine ait belirtiler ayrıca, Şekil 2.4.’te gösterilmiştir. Şekil 2.4. Meme Kanserinin Uyarıcı Belirtileri (32) 15 2.2. Meme Kanseri Genetiği Meme kanseri çevresel ve genetik bir grup risk faktörü ile etkileşim halinde ortaya çıkmaktadır. Bu genetik ve çevresel kaynakların etkisi göç eden topluluk ya da ailelerin incelenmesi ile açığa çıkarılmıştır (33). Hücre bölünmesini, farklılaşmasını, DNA tamirini ve apoptozu kontrol eden genlerde meydana gelen mutasyonlar kansere neden olmaktadır (6). Yapılan bazı çalışmalarda, meme kanseri riski yüksek bulunan kadınların annelerinde de meme kanseri varlığı saptanmıştır. Bu kadınlarda meme kanseri menopoz öncesi dönemde ortaya çıkarken aynı zamanda bu durum ovaryum fonksiyonu ile de alakalı bulunmuştur. Meme kanserlerinin ancak % 10-30’unda kalıtımla geçiş görülürken, daha az kalıtsallık gösteren meme kanseri vakaları da vardır (34). Bu ayrımdan dolayı meme kanserleri ailesel olan ve ailesel olmayan meme kanseri diye ayrılmıştır. Meme kanserlerinin yaklaşık % 10 kadarında ailesel geçiş, yani genetik yatkınlıktan bahsedilir ve buna herediter meme kanseri sendromu denilmektedir ki OD olup, menapoz öncesi daha çok bilateral meme kanseri ile ilişkilidir ve aile bireyleri için %50- 85 risk taşımaktadır (3,6). Meme kanserinde genetik yaklaşımın yeri Şekil 2.5.’de gösterilmiştir (35). Şekil 2.5. Meme Kanserinde Genetik Yaklaşımın Yeri (35) 16 2.2.1. Meme Kanseri Genomu Kanser genomlarındaki genetik aberasyonların (mutasyonlar, delesyonlar ve amplifikasyonlar) aydınlatılması kanser patofizyolojisinin daha iyi anlaşılmasını, böylece tedaviye yönelik uygun hedeflerin saptanmasını sağlayacaktır. Normal insan genomunun DNA dizisinin saptanması ile kanser genomlarına yönelik daha ayrıntılı bir analize girişilmiştir. Başlangıçta araştırmalar tirozin kinazlar (TK) üzerine yöneltilmiştir ve sonrasında tüm genomları içine alacak şekilde genişletilmiştir. En iyi çalışılan ve açığa çıkarılan 21.000 insan geninin ayrıntılı sekans analizi sonuçları 2006’ da yayınlanmıştır (36) ve bunların içinde 11 kolon kanseri ve 11 meme kanseri örneği de bulunmaktadır. Bu tarama ile hem daha önceden meme kanseriyle ilişkili olduğu bilinen kanser genleri (p53 ve BRCA1 gibi) yeniden bulunmuş, hem de önceden tespit edilmemiş kanser genleri keşfedilmiştir. Bu araştırma meme kanserinin ortalama 90 mutant gen taşıdığını, ancak bu genlerin küçük bir kısmının (yaklaşık 12 tanesinin) neoplastik sürece yol açtığını göstermiştir. Önemli mutasyonlar fonksiyonel olarak tümörden tümöre değişmektedir, bu da tedavi geliştirilmesini zorlaştırmaktadır. Buna karşın genler fonksiyonel gruplar halinde incelendiğinde neredeyse tüm meme tümörü örneklerinde sinyal ileti yollarında ve transkripsiyon faktör genlerinde mutasyonlar bulunmuştur. Edinilen bilgilerin artması ve tümörlerin genetik karakteristiklerinin daha iyi ortaya konması, yakın gelecekte bireyselleştirilmiş yeni biyolojik ve terapötik bakış açıları gelişimini sağlayacaktır (37). 2.2.2. Meme Kanseri Oluşumunda Etkisi Olan Genler Kanser oluşumunda rol oynayan iki temel gen grubu: onkogenler ve tümör baskılayıcı genlerdir. Onkogenler çoğunlukla proto-onkogen adı verilen normal hücresel genlerin mutant allelleridir. Onkogenlerin fonksiyon kazandıran mutasyon özelliği ve tümör baskılayıcı genlerin fonksiyon-kaybı malign fenotip oluşumuna neden olmaktadır (38). 17 Bunlardan tümör baskılayıcı genler, hücre döngüsünün kontrol noktalarını düzenleyen ve apoptozis başlatan genlerdir. Normal hücrelerde tümör baskılayıcı genler tarafından kodlanan proteinler, DNA hasarına ya da dış çevreden gelen büyümeyi baskılayan sinyallere yanıt olarak hücre döngüsü sürecini durdurabilmektedirler. Tümör baskılayıcı genler mutasyona uğradıklarında ya da inaktive olduklarında hücreler, hücre döngüsü kontrol noktalarına yanıt verme ya da DNA hasarı arttığında hücreyi ölüm programına geçirme yeteneklerini kaybederler. Tümör baskılayıcı genlerin etkisini yitirmesi için her iki allelinin de fonksiyonunu kaybetmesi gerekir. Tümör baskılayıcı bir genin her iki alleli de inaktive olduğunda, hücrenin büyümesi ve bölünmesi devam eder ve hücre kanserleşme sürecine girer (6). Çoğu genetik değişimler sadece kanserli dokudaki kanser hücrelerinde gözlenirken, daha az sıklıkla da olsa germ hücrelerindeki genetik değişimler ile ortaya çıkan maligniteler kalıtsal özellik taşırlar. Genomdaki bu kalıtsal veya kalıtsal olmayan genetik değişimler, belli hücresel genlerin belli özel değişimleri ile ilişkili bulunmuştur. Bunlar onkogenler olarak isimlendirilirler ve normal işlevlere sahip bir diğer gen grubundan (protoonkogenlerden) türevlenirler. Proto-onkogenler normal hücre büyümesi ve farklılaşması için önemli olan bazı proteinlere ait kodlar içerirler. Eğer bir mutasyon sonucu proto-onkogenin yapısı değişirse oluşan hasar, genin dolayısı ile gen ürünün yapısının değişmesine neden olur ve çeşitli yollarla hücre bölünmesinin kontrolü ortadan kalkar ve malignite ortaya çıkar (39). Bu genlerin tek bir allelindeki mutasyon hücre fenotipinin değişmesi için yeterlidir. Hücre bölünmesini uyararak tümör oluşumuna neden olurlar (6). Bunların dışında DNA tamir genleri de vardır ve DNA hasarlarında meydana gelen mutasyonlar da kanser de rol oynar. DNA tamir genlerinde meydana gelen mutasyonlar protoonkogen ve tümör baskılayıcı genlerdeki mutasyon sıklığını arttıracağından, kanserleşmenin biyolojik mekanizmasında çok önemli yer tutmaktadır. Genomda zincirleme mutasyonlarla kansere karşı genetik bir eğilim doğmaktadır (6). Herediter meme kanserleri ve etkili olan genler Tablo 2.2. ‘de gösterilmiştir. 18 Tablo 2.2. : Herediter meme kanseri sendromları (40) Sendrom İsmi Kalıtımsal Yapı Herediter Meme/Over Kanseri (BRCA1) OD Herediter Meme/Kanseri (BRCA2) OD Cowden Sendromu (PTEN) OD Li-Fraumeni sendromu (p53) OD Ataksi-telanjiektazi (ATM) heterozigozite OD Kişisel-Ailevi Öykü Over kanseri Kolorektal kanser Prostat kanseri Fiziksel Muayene Meme kanseri (erkek) Over kanseri Pankreas kanseri İntestinal polip Tiroid kanseri Mental retardasyon Deri lezyonları Progresif makrosefali Serebellar belirtiler Beyin tümörü Sarkom lösemi Adrenokortikal kanser Ailevi AT Gastrointestinal polip, kanser Over, testis, pankreas Peutz-Jeughers sendromu (STK11) OD Dudakta melanosis Gİ kanama 2.2.2.1. Meme Kanseri Patogenezinde Rol Oynayan Onkogenler; 1. Epidermal Büyüme Faktör Reseptörü (EGFR) Hücre membran reseptörü olan EGFR ailesi; EGFR, HER2, HER3 ve HER4’den oluşur. EGFR, TK aktivitesine sahiptir (39). Ligandı olan peptid büyüme faktörleri gelip bağlandığında reseptör homo ya da heterodimerizasyonu gercekleşir ve bunu TK bölgelerindeki otofosforilasyon izler. EGFR’nin otofosforilasyonu diğer hücre içi substratların fosforilasyonuna yol acar. Bu aktivasyon sonucunda nukleusta bulunan transkripsiyon faktörleri uyarılır ve aşırı hücre bölünmesi gerçekleşir (38,39). EGF (Epidermal Büyüme Faktörü) ve EGFR (Epidermal Büyüme Faktör Reseptörü)’ nin meme ve ceşitli karsinom tiplerinin progresyonu ve patogenezinde merkezi bir role 19 sahip olduğu yapılan calışmalarda gösterilmiştir. Meme karsinomlarının %1636’sında EGFR aşırı ifade edilmesi durumu vardır (38). 2. CerbB-2 (HER-2/neu) HER-2/neu (İnsan Büyüme Faktör Reseptörü) veya p185, bir proto-onkogen olup, kromozom 17q21’de lokalize olmuştur ve sinyal iletiminde görevli 185 kDa’luk (p185) bir transmembran proteini kodlamaktadır. HER-2/neu proteini, normal hücre proliferasyonunda önemli bir role sahiptir. HER-2/neu proteininin aşırı ifadelenmesi ya da genin amplifikasyonu meme kanserlerinde kötü prognoz ile ilişkilendirilmiştir (38). Ayrıca bu onkogenin kopya sayısı ile tümör şiddeti arasında da bir orantı bulunmuştur (39). 3. Ras (Rat Sarkoma virüsü onkogeni) Ras bir proto-onkogen ürünüdür. Aktif GTP-bağlı (Guanozin trifosfat) halde ya da inaktif GDP-bağlı (Guanozin difosfat) durumda bulunmaktadır. Plazma membranından, nukleusa sinyal iletiminde önemli bir aracı moleküldür. Ras mutasyonları malign transformasyona öncülük eder (38). 4. c-Myc (Myelomatosis virüs onkogeni) c-Myc proto-onkogeni kromozom 8q24.1’e yerleşmistir. Hücre proliferasyonu ve apoptoziste görevli genlerin transkripsiyonunu düzenler. c-Myc geni meme tümörlerinin %15-25’inde aşırı ifadelenmekte ve kotu prognoz ile ilişkilendirilmektedir (38,39). 5. Siklinler, Siklin Bağımlı Kinazlar ve İnhibitorleri Siklinler, siklin bağımlı kinazlar (CDK) ve inhibitorleri (CDKI) hücre döngüsünü doğrudan kontrol eden proteinlerdir. Meme kanserlerinde siklin D1 ve siklin E’nin aşırı ifadelendiği saptanmış ve prognostik faktör olabileceği ileri sürülmüştür (39). 20 2.2.2.2. Meme Kanseri Patogenezinde Rol Oynayan Tümör Supresör Genler 1. P53 (Protein53, TP53, Tümör Protein53) P53 geni 17. kromozomun p13-1 bandına yerleşmiştir ve moleküler ağırlığı 53 kDa’luk nuklear bir proteini kodlar. UV ışık, karsinojenler ve sitostatiklerin DNA’da oluşturdukları hasarı ortadan kaldırmak üzere aktifleşir. Hasar düzeltilemez ise hücre apoptoza yönlendirilir (39). Meme kanserlerinde, p53 genindeki bozukluklar veya her iki alleldeki kaybı kotu prognoz ile ilişkilendirilmiştir (38,39). 2. ATM (Mutant Ataksi-Telanjiektazi) Kromozom 11’de yerleşmiştir ve resesif olarak kalıtılır (68,75). Meme kanserlerinin %2-7’sinde bu gen sorumludur (38). 3. PTEN (Fosfataz ve Tensin Homologları) Germline mutasyonu 10. Kromozomun 10q23 lokusunda bulunur. Cowden sendromuna neden olur (33). DNA tamirinde de rol alır (6). 4. BRCA1 ve BRCA2 BRCA1 geni kromozom 17q21 kromozomu üzerinde lokalizedir. 24 eksonu vardır. BRCA2, kromozom 13q12.3’te lokalizedir, 27 eksondan oluşmuştur (41,42). Ailesel meme kanseri saptanan olguların çoğunda hastalık, BRCA1 ve BRCA2 tümör baskılayıcı genlerde meydana gelen mutasyon kaynaklıdır (3,38). Bu genlerin aynı zamanda DNA’nın tamirinde de rol aldığı gösterilmiştir, bu yüzden meme kanserinde rolü oldukça fazladır (6). BRCA1 ve BRCA2 proteinleri genomik stabilitenin sağlanmasında, DNA hasarında hücresel cevapta, transkripsiyonel düzenlemede ve hücresel proliferasyonda görev alırlar (43). Birçok meme ve over kanseri sporadiktir (kalıtımsal değildir), ancak kalıtımsal olan meme kanserlerinin üçte birinden BRCA1 ve BRCA2 mutasyonları sorumlu tutulmaktadır (22,41). Birçok çalışmada da BRCA1 ve BRCA2 tümör baskılayıcı genlerindeki mutasyonlarla meme kanseri ve over kanserinin ilişkili olduğu bulunmuştur. (44). BRCA1 ve BRCA2’nin kromozomlardaki yerleşimi Şekil 2.6. ve Şekil 2.7.’de gösterilmiştir (45). 21 Şekil 2.6. BRCA1 geninin kromozomdaki yerleşimi (45) Şekil 2.7. BRCA2’nin Kromozomdaki Yerleşimi (45) 2.2.3. Ailesel Meme Kanseri ve Yatkınlık Genleri Meme kanserlerinin büyük çoğunluğu sporadik vakalar olarak karşımıza çıkarken % 10 – 30 oranında ise kalıtsal nedenli ailesel meme kanseri karşımıza çıkar. Meme kanseri oluşumuna birçok gen etki eder ancak kalıtsal meme kanserlerinden sorumlu olarak, özellikle genom devamlılığının koruyuculuğunda iş gören proteinleri üreten bazı genlerin germ hücrelerindeki mutasyonları gösterilmiştir. Kalıtsal meme kanserinde gözlenen yüksek penetransa sahip meme kanserine yatkınlık genleri olarak BRCA1 ve BRCA2 genleri bulunmuştur (6). Normalde her insanda genetik yapının bir parçası olarak bu genler bulunur, risk altındaki kişiler bu genlerinde 22 mutasyon olan kişilerdir (42). Bu genlerdeki germ hücre soyu mutasyonlarını içeren aile bireylerinde meme kanseri riski % 85 – 90, over kanseri riski % 60’tır (46). BRCA1 ve BRCA2 genlerindeki germ soyu mutasyonları, yüksek penetransa sahip ve hastalık için yüksek risk oluşturan faktörler olarak birçok çalışmada gösterilmiştir. Bu iki kansere yatkınlık genlerinin germ hücrelerindeki mutasyonları ovaryum kanserlerinde %10, meme kanserlerinde %7 oranında dominant olarak kalıtım gösterir. Halen ailesel meme kanseri için en şiddetli etkiye sahip mutasyonları taşıyan bu iki gen, meme kanseri risk tespitinde mutasyon analizlerinin yapılmasında ön sırada yer almaktadır (6,39). Meme kanser genleri olarak bilinen BRCA1 ve BRCA2’nin, 1994 ve 1995’teki keşifleri, herediter meme kanserli hastaların optimal tedavileri konusunda birçok soru ortaya atılmasına sebep olmuş, risk altındaki popülasyon için kanser görüntüleme yöntemlerinin gelişmesinde patlamaya sebep olmuştur. Gerçekte normal genetik yapının bir parçası olarak herkes bu genleri taşır, meme kanseri açısından risk altındaki kişiler ise bu genlerde mutasyona sahiptirler. BRCA1 ve BRCA2 genlerindeki mutasyonlar, heterozigot taşıyıcılar için meme ve over kanseri açısından kuvvetli predispozan faktörlerdir (42,47). Bu BRCA genlerinin 1994 ve 1995’te klonlanmasından sonra birçok ülkede o toplumlara özgü mutasyon belirlemesi ve risk değerlendirmesi çalışmaları başlatılmıştır. İstanbul Üniversitesi Onkoloji Enstitüsü’nde 1997 yılında bu yana bu genlerin mutasyonlarını belirlemeye yönelik bir proje başlatılmıştır (46). Türk toplumuna özgü sayılacak tekrarlayan bir mutasyon bildirilmemiştir (39). Tablo 2.3. ‘de BRCA1/2 mutasyon taşıyıcılarında yaşam boyu kanser gelişme riski gösterilmiştir. Ancak bu rakamların yaşam boyu riski yansıttığı ve taşıyıcılarda kanser gelişim riskinin yaşa bağlı olarak değiştiğini unutmamak gerekir (48). 23 Tablo 2.3. BRCA1/2 mutasyon taşıyıcılarında yaşam boyu kanser gelişme riski (48) 70 Yaşında Kümülatif Risk (%) Kadın BRCA1 Mutasyon Meme Taşıyıcılığı Meme Prostat Kanseri Kanseri 16 – 53 ? 25 27 6 – 14 20 1.5 < 0.1 10 Kanseri 40 -87 BRCA2 Over Kanseri Mutasyon 28 -84 Erkek Taşıyıcılığı Genel Popülasyon 8 – 10 2.2.3.1. BRCA1 geni Bu genin meme kanseri ile ilişkilendirilmesi fikrini ilk Miki ve ark. ortaya atmıştır (6,49). BRCA1 geninin ürünü olan 1863 amino asidin oluşturduğu 220 kDa‟lık BRCA1 proteini, hücre nükleusunda lokalizedir ve hücre döngüsüne bağlı olarak fosforile durumda bulunmaktadır. Çekirdekteki ekspresyonu ve fosforilasyonu, hücre döngüsünün geç G1 ve S fazlarında artar ve mitoz esnasında en yüksek seviyeye ulaşır. BRCA1 ekspresyonu ubikitinasyon yoluyla ve proteazoma bağlı yıkımla azalır. BRCA1 proteini (Şekil 2.5.’te gösterilmiştir.) , N terminalinde çinko bağlayan yaklaşık 100 aminoasitlik özel bir RING (Gerçekten İlginç Yeni Gen) bölgesi ve C terminalinde ise yaklaşık 90 aminoasitlik BRCT (Meme Kanseri Karboksil Terminali) tekrar bölgeleri içermektedir. BRCA1’in tümör baskılayıcı özelliğinde bu iki fonksiyonel bölgenin önemi dikkat çekmektedir (6,42). Santral bölgesinde ise nükleer lokalizasyon sinyalleri içerir (42). Şekil 2.8. BRCA1 proteini (6) 24 Ring Bölgesi; BRCA1 proteinin N terminal bölgesine bitişik çinko parmak (zinc finger) dizisi vardır. Bu dizi sistein ve histidin rezidüleri içerir ve RING domaini olarak bilinir. Tam olarak tanımlanmış bir fonksiyonu olmamasına rağmen bu bölgenin DNA ile etkileşimde olduğu bazı çalışmalarda gösterilmiştir. Ayrıca heterokromatin korunması, spermatogenez ile ilgili görevleri olduğunu gösteren çalışmalar yapılmıştır (6,46). BRCT Bölgesi; BRCA1 C terminal (BRCT) bölgesi DNA hasar cevabında integral sinyal modülüdür. Kanıtlanmış fosfo-peptid bağlanma bölgesi rollerinden başka, BRCT bölgeleri fosforilasyondan bağımsız protein etkileşimleri, DNA bağlanma ve pADPr (poli-ADP-riboz) polimeraz bağlanma görevleri vardır . BRCA1‟in BRCT bölgesindeki kanser oluşturan mutasyonlar ve kötü huylu polimorfizmler, transkripsiyonel aktivasyonunu kaybetmesiyle birlikte RNA polimeraz II bağlama yeteneğinin kaybedilmesine neden olmaktadır (6). BRCA mutasyonlarının çoğu tam sentezlenmemiş protein oluşumu ile sonuçlanır. Bununla ilgili kanser ailelerinde yapılan çalışmada BRCA1’in C-ucunun eksik sentezlenmesine neden olan mutasyonların daha çok meme kanserine, büyük bölümünün eksik kalmasına neden olan 5’-ucuna yakın mutasyonların ise hem meme kanseri hem de over kanserine yol açtığı bildirilmiştir (46). BRCA1 Sendromu: OD geçişli, BRCA1 geninde mutasyonlara bağlı olarak, meme ve over tümörlerine karşı artmış eğilim görülen kalıtımsal tümör sendromlarıdır. Ek organ tutulumları kolon, karaciğer, endometrium, serviks, fallop tüpleri ve peritondur. BRCA1 mutasyonlu hastalarda, epitelyal tümörler en sık verilen histolojik tanıdır (42). BRCA1, DNA tamirinde, transkripsiyonel regülasyondai hücre büyüme kontrolünde ve genomik bütünlüğün sağlanmasında rol oynar. BRCA1, endokrin dokularda eksprese edilir, fakat özellikle erken gelişim sırasında diğer hücrelerde de mevcuttur (42). 25 Hücre büyüme kontrolü ve nükleer fonksiyonlarda çeşitli dokularda görev alan BRCA1 proteini birçok fonksiyonel bölgeye sahiptir. İyonize radyasyon ya da X-ray ışınları ile ortaya çıkabilen çift zincir kırıklarının homolog tamirinde ve genotoksik homolog olmayan son birleşmesi (Non-Homologous End-Joining, NHEJ) tamir yolağında rol alır. Bu çift zincir kırıkları doğal radyasyon veya diğer mutajenik ajanlara maruziyetten kaynaklanacağı gibi kromozomlardaki genetik materyali değişimlerinin olduğu esnalarda da (kross-over, homolog rekombinasyon) gerçekleşebilir. BRCA1 geninin kodladığı protein, diğer tümör baskılayıcılar, DNA hasar sensörleri, sinyal dönüştürücülerle etkileşerek BASC (BRCA1 ilişkili genom gözetim kompleksi, BRCA1 associated genom survelliance compleks) oluşturur. DNA hasarı oluştuğunda BASC kompleksi BRCT bölgesine bağlanır ve DNA tamir edici diğer protein ve enzimler için liman görevi görür. Tamir edildikten sonra ayrılır. BRCA1‟e bağlı homolog tamirin yokluğunda kırık kromozomlar duplikasyonlar, delesyonlar ve translokasyonlar oluşturur. Moleküler düzeyde genomik instabilite fonksiyon kazanım/kayıpları ile hücre büyümesi kontrolünde önemli rol oynar (6). Rekombinasyonel tamir, hasarlı DNA‟nın diğer bir hasarsız moleküle rekombinasyonu temeline dayanır. Bu mekanizma DNA replikasyonu sırasında karşılaşılan ve normal replikatif DNA polimerazlar ile kopyalanamayarak bir replikasyon çatalının ilerlemesini bloke eden, timin dimerlerinin veya çift DNA kırıklıklarının bulunduğu hasarların onarımında sıklıkla kullanılır. Kalıtsal meme kanserinden sorumlu olan genlerin özellikle BRCA1 ve BRCA2‟nin nin kodladığı proteinlerin homolog rekombinasyon ile çift iplik kırıkların onarımında görevli olmaları, bu DNA onarımındaki bozukluğun, kadınlarda en yaygın kanserlerden birisinin gelişimine yol açabileceğini göstermektedir. BRCA1 genom içeriğinin bütünlüğü için gerekli olması nedeniyle “caretaker” tümör baskılayıcı gen olarak sınıflandırılmıştır. Amino asit dizisinin C terminali (BRCT) transkripsiyonu aktive edebilir ve DNA hasarından sonra hücre döngüsünü arreste sokan genlerin transkripsiyonu düzenler. BRCA1 mutasyonları ailesel meme kanserlerinin yarısından sorumluyken sporadik vakalarda da nadiren rastlanmıştır. Bu vakalarda da BRCA1 ekspresyonu belirgin derecede indirgenmiş durumdadır, bunun mekanizmasının da metilasyon olduğu gösterilmiştir (6,49). 26 2.2.3.2. BRCA2 BRCA2 de yüksek geçişli bir gendir (47). İnsan vücudu BRCA1’e çok benzer bir paternde, BRCA2 mRNA eksprese eder fakat en yüksek seviyeler meme ve timusta, daha düsük oranlarda da akciğer, over ve dalakta gözlenir. Normal hücrelerde BRCA2, özellikle hücre siklusunun geç-G1/erken-S fazında eksprese edilen nükleer bir proteindir (42). BRCA2’ye bağlı over kanserlerinin hemen hemen tümünden 11. Eksonun 3.3.kb’lik bir bölümünde yer alan mutasyonlar sorumludur. Bu genin amino veya C-uçlarında yer alan mutasyonlar sadece meme kanserine neden olmaktadır (46). BRCA2; erkek üyelerinde meme kanseri sık görülen ve BRCA1 tespit edilmeyen ailelerde keşfedilmiştir. Erken ortaya çıkan meme kanserine karşı belirgin artmış eğilim ve erkek meme kanseri yanı sıra daha az sıklıkla da pankreatik ve over kanser gelişimi için ek risk faktörü olan, OD geçişli kalıtımsal bir tümör sendromudur. Hem kadın, hem de erkekler BRCA mutasyonları için taşıyıcı olabilirler. Ancak sadece BRCA2 mutasyonlarının erkek meme kanseri riskini arttırdığı gösterilmiştir (33). BRCA2 Sendromu; Erken ortaya çıkan meme kanserine karşı belirgin artmış eğilim ve erkek meme kanseri yanı sıra daha az olarak da pankreas ve over kanseri gelişimi için ek risk faktörü olan, OD geçişli kalıtımsal tümör sendromudur. Nadir olarak da cilt melanomaları, safra kesesi ve bilierduktus tümörleri ve fallop tüp karsinomları için risk taşır. BRCA1’e göre daha az sıklıkla rastlanır. Tanısı BRCA2 gen mutasyonlarının tanımlanması ile konur (42). BRCA1 ve BRCA2 genleri ve sendromlarının karşılaştırılması Tablo 2.4.’de verilmiştir. 27 Tablo 2.4. BRCA1 Ve BRCA2 Genlerinin Karşılaştırılması (42) Karakteristik BRCA1 BRCA2 Kromozom 17q21 13q12.3 Gen Boyutu 81 kb 84 kb Protein Boyutu 1863 amino asit 3418 amino asit Fonksiyon Tümör süpresör Tümör süpresör Transkripsiyonel regülasyon Transkripsiyonel regülasyon DNA tamiri DNA tamiri Mutasyonlar >500 identifikasyon >300 identifikasyon Popülasyondaki Mutasyonlar Yaklasık % 0.1 Yaklasık % 0.1 Meme Kanseri Riski % 60-80 % 60-80 Ortaya Çıkış Yaşı Daha genç yas(40-50) 50 yaş % 52 % 32 % 81 ( %20-40 risk) % 14 (%10-20 risk) <% 20 % 76 Prostat, kolon, pankreas Prostat, Tek gene bağımlı meme kanserli aileler Meme ve over kanserli aileler Erkek ve kadın meme kanserli aileler Diğer tümör riskleri pankreas, mide, melanoma, kolon Sporadik meme kanserindeki Çok ender (<% 5) Çok ender (<% 5) Belli etnik gruplarda spesifik Belli etnik gruplarda spesifik mutasyonlar bulunmus mutasyonlar bulunmus Yüksek, medüller karsinoma Sporadik meme kanserlerine (% benzer mutasyonlar Epidemiyoloji Meme Kanseri Patolojisi 13), kötü diferansiye karsinoma, ER (östrojen reseptörü), PR (Progesteron Reseptörü) ve Her2/neu(-) ve p53 mutasyonlu tümör insidansı BRCA1 ve BRCA2 arasındaki temel fark BRCA2 mutasyonunda artmıs erkek meme kanseri riskidir. Bu kanserler prekanseröz DCIS (Duktal Karsinoma İn Situ) 28 komponenti olmaksızın direkt invaziv hastalığa ilerleme eğilimindedir. Buna bağlı olarak da mamografik görüntüleme ile erken yakalanma şansı daha düşüktür (6). Bu yüzden ailesel meme kanserine yönelik genetik taramalar önem kazanır. Bu genler otozomal dominant biçimde aktarılırlar, yani mutasyon nesilden nesile aktarılır ve her yeni soyun mutasyon taşıma olasılığı % 50’dir. Bu genler, Mendel kanunlarına göre aktarılan tek – gen sendromlarından farklı olarak kanserin ortaya çıkmasında kesin belirteç değildir. Taşıyıcı olanlarda meme kanseri daha erken yaşlarda ve/veya birden fazla farklı bölgede ortaya çıkar (33). Meme kanseri konusunda yapılan epidemiyolojik çalışmalar erken menarş, ilk doğumun geç yaşta yapılması, hiç doğurmama, hormon kullanımı gibi çevresel ve davranışsal bir takım etkilerin BRCA1/2 ile bağlantılı kanserlerin ortaya çıkışını etkilediğini göstermiştir (33). Bu mutasyonlu genlere sahip kadınlarda meme kanseri riski normal popülasyona göre % 80 artar (50). 2.2.4. Genetik Test ve BRCA Analizi Meme kanserinde genetik test, hastanın özgeçmiş/soygeçmiş ve hastalık öyküsü ile riski olduğu düşünülen klinik tabloya uygun olarak BRCA1, BRCA2, P53 veya PTEN için tüm gen DNA analizi yapılmalıdır. Test sonucunda bulunmuş olan mutasyonun hastalıkla ilişkisi referans veri tabanından kontrol edilmelidir ve buna göre bir rapor düzenlenir (35). Bu testler meme kanseri riskini belirlemede kullanılır, ancak burada önemli olan bu testlerin herkese uygulanmaması gerektiğidir (51). Öncelikle ailesel kanser öyküsü bulunan bireylerle görüşülmeli ve kişi hakkında yeterli bilgiler alınmalı, bu bilgilere göre testin yapılıp yapılmayacağına karar verilir. BRCA DNA Analizi önerilen durumlar; 1. 50 yaşından önce meme kanseri gelişmiş kişilerde 2. 2 veya daha fazla akrabasında meme kanseri saptanmış kişilerde 3. Meme kanseri saptanmış erkek akrabası bulunan bireylerde 4. Aynı memede 2 kez kanser gelişimi öyküsü 29 5. Her iki memede kanser saptanması 6. Herhangi bir yaşta saptanan over kanseri öyküsü (51) Bu kriterleri taşıyan hastanın yaklaşımı Şekil 2.9. ‘daki gibi olmalıdır (35). Şekil 2.9. HBOC (Herditer Meme ve Over Kanseri) kriterlerine uyan hastaya yaklaşım algoritması (35) Meme kanseri kalıtsal olarak taşınsa bile ileri yaşlarda ortaya çıkan ve erken tanı ile tedavisi yapılabilen bir hastalıktır. Bu yüzden çocuklarda veya anne karnındaki bebeklerde BRCA gen testi yapılmaz. BRCA testi 18 yaşından sonra yapılmalıdır. Ancak, ileri moleküler genetik yöntemler uygulanarak henüz hamilelik oluşmadan preimplantasyon genetik tanı (PGT) yöntemiyle kalıtsal kanser taşımayan embriyolar seçilerek gebelik oluşturulabilir (52). BRCA mutasyonu bulunan kişilerde bu mutasyonun yavruya aktarılması ihtimali % 50’dir. Tıbbi teknolojiler geliştikçe bu oranın düşürülmesine yönelik çalışmalar artmış ve bu amaçla PGT yöntemi kullanılarak mutasyonlu gen aktarımı azaltılmıştır. Bu yöntem BRCA geninden dolayı meme kanseri olan kadınların çocukları için profilaktik amaçla kullanılabilmektedir (43). Risk altında olduğu saptanan ve bu nedenle BRCA DNA analizinin önerildiği kişilerde incelenen genetik bölgelerin büyük olması nedeniyle teknik sıkıntılar bulunmaktadır. 30 Hastalarda BRCA1 gen bölgesinde bugüne kadar yapılan çalışmalarda 1200'e yakın mutasyon tanımlanmıştır. Bugüne kadar BRCA2 gen bölgesinde 900'ün üzerinde mutasyon tanımlanmıştır (51). Yüzlerce mutasyon tanımlanmış olmasına rağmen yine de bunlar mutasyonların tamamını temsil etmeyebilir, rutin tetkiklerde saptanamayan mutasyonlar da olabilir (42). BRCA genlerinde mutasyon analizi DNA üzerinde gerçekleşen değişikliklere ve aranılan mutasyonun niteliğine bağlı olarak değişik yöntemlerle gerçekleştirilir. Hasta örneklerinde farklılıklar saptandığında bunların niteliği DNA dizi analizi ile belirlenir. Çok uzun süren ve uğraş gerektiren bu yaklaşımda sonuçların elde edilmesi aylarca sürebilir. Ancak mutasyonların büyük bölümü tam sentezlenmemiş bir proteinin oluşumu (kayma mutasyon –frame shift-) ile sonuçlandığından hastaya ait BRCA proteininin laboratuarda in vitro sentezlenerek incelenmesi esasına dayanan Protein Trunkasyon Testi, genetik analizleri kısmen kolaylaştırmıştır (46). DNA dizi analizi testinde bazı olgularda sonuçların kesinleşmesi için kişinin kendisinden tekrar kan örneği veya aile bireylerinden kan örnekleri istenebilmektedir (51). Zahmetli bir test olduğu için doğru bir risk değerlendirmesi sonrasında yapılmalıdır. Mutasyon saptanan hastalarda tekrar yaşam boyu risk değerlendirilmesi yapılmalıdır. Mutasyonun varlığının %100 kanser olacağı ya da mutasyonun çıkmamasının kanser olmayacağı anlamına gelmediği hastaya açıklanmalıdır. Bu sonuç hastaya artmış/azalmış risk olarak yaşıtlarına göre kıyaslanarak sayısal olarak verilmelidir. Mutasyon taşıyıcılarına kanser riskini azaltıcı önlemler anlatılmalıdır. Tüm bu bilgiler danışmanlık raporunda yazılı olarak hastaya sunulmalıdır. Özellikle birinci derece yakınları için mutasyonu taşıma riski raporda yer almalıdır (35). BRCA mutasyonu taşıdığı tespit edilen hastalarda koruyucu önlem olarak uygulanması gerekenler Tablo 2.5. ‘de gösterilmiştir. 31 Tablo 2.5. BRCA mutasyonu taşıyıcılarında koruyucu seçenekler (40) Seçenek Aralık Başlama Yaşı KKMM Aylık 18 KMM Yıllık veya 6 aylık 25 Mamografi Yıllık 25 Pelvik Muayene 6 aylık 25-35 TVUSG ( transvajinal İki yılda bir 25-35 ultrasonografi) ve CA125 (Kanser Antijeni125) Proflaktik mastektomi Proflaktik salpingoooferektomi Mutasyon taşıyıcıları “yönetiminde” değişik seçenekler vardır, ancak her kişinin bireysel olarak değerlendirilmesi gerekir ve kişiye özel bir yaklaşım seçilmelidir. Risk azaltıcı mastektomi ve salpingoooferektomi uygun vakalarda ve ancak genetik danışma ile birlikte önerilmesi gerekir. Ama hastaya bu koruyucu girişimlerin de kanser gelişimini yüzde yüz önleyemediği açıklanmalıdır (48). Genetik testlerle ilgili etik tartışmaları sıkça yapılırken BRCA testlerinin de etik etkileri vardır; • Bilgilendirme ve Bilgilendirme onayı; testlerde mutasyon sonuçları kesin olarak verilirken kanser oluşması sadece risk olarak belirlenmektedir. Sonuçlar sosyal baskıya neden olabilir. • Kişinin test olup olmayacağını seçme hakkı vardır. • Diğerlerinin hakları; bu test bireysel bir test olsa da gen aktarımıyla başkalarına da geçiş söz konusu olduğu için diğerlerinin haklarını da düşünmek gerekir. • Gizlilik ve mahremiyet, genetik testlerde ciddi önem taşır. • Genetik ayrımcılık riski vardır. • Prenatal tanı sonuçlarında bu durum ortaya çıktığında kürtaj, abortus,öjeni gibi etik olarak tartışılan bazı konuların gündeme gelmesidir (53). 32 2.3. Meme Kanseri Evrelemesi Evreleme, kabul edilen bir plan uyarınca hastaları, hastalıklarının yaygınlık derecesine göre gruplara ayırma işlemidir (3). Meme kanserinin yaygınlık derecesinin saptanması ve hastaların daha homojen gruplar halinde değerlendirilmesi, uygulanacak tedavi biçiminin ve hastalığın prognozunun belirlenmesinde yarar sağlayacaktır (30). Tedavi planının yapılması, prognozun tayini, tedavi için uygulanan çeşitli yöntemlerin tedavi gücünün karşılaştırılması için her hastanın kesinlikle evrelenmesi gerekir. Klinik evreleme için kullanılan çeşitli sistemler vardır. Dünyada ve ülkemizde en çok kullanılan (1987) UICC (Uluslararası Kanser Kontrol Örgütü) ve (1988) AJCC (Amerikan Kanser Komitesi) ‘nin biçimlendirdiği TNM sistemidir (3,11,30). Buna göre tümör büyüklüğü T, koltukaltı lenf gangliyonu N, uzak metastazlar M ile temsil edilir (12,29). Meme kanserinde TNM sınıflaması ve evreleme Tablo 2.6. ve Tablo 2.7.’de gösterilmiştir. Tablo 2.6. Meme Kanserinde TNM Sınıflaması (3,11) T Primer Tümör Tx Primer tümör değerlendirilemeyebilir T0 Primer tümör bulgusu yok Tis Tümör bulgusu olmayan Paget hastalığı, insitu tümör T1 Tümör 2 cm veya daha küçük T1a Tümör 0.5 cm veya daha küçük T1b Tümör 0. 5 den büyük, fakat 1 cm yi aşmamış T1c Tümör 1 cm den büyük, fakat 2 cm yi aşmamış T2 Tümör 2 cm den büyük fakat 5 cm yi aşmamış T3 Tümör 5 cm yi aşmış T4a Toraks duvarına ulaşmış 33 T4b Meme derisinde ödem (Peau d’orange dahil ),ülserleşme, tümörlü memede yandaş deri lezyonları T4c T4a+T4b T4d İnflamatuar kanser N Bölgesel lenf gangliyonları Nx Bölgesel lenf gangliyonları değerlendirilemeyebilir N0 Bölgesel lenf bezi metastazı yoktur. N1 Aynı taraf koltukaltında bir ya da fazla mobil lenf gangliyonuna metastaz N2 Aynı taraf koltukaltında bir yada fazla lenf gangliyonunda metastaz; fakat bu lenf gangliyonları birbirlerine ya da dokulara yapışık N3 Tümörün bulunduğu taraftaki iç mamaria lenf ganglion grubuna metastaz M Uzak metastazlar Mx Uzak metastazların varlığı değerlendirilemeyebilir Mo Uzak metastaz yok M1 Uzak metastazlar mevcut Tablo 2.7. Meme Kanserinde Evreleme (11) Evre 0 TisN0M0 Evre 1 T1N0M0 Evre 2a T1N1M0 – T1N1M0 2b T2N1M0 – T3N0M0 Evre 3a T1N2M0 – T2N2M0 – T3N1M0 – T3N2M0 3b T4 herhangi bir NM0 – herhangi bir TN3M0 Evre 4 Herhangi bir T, Herhangi bir NM1 34 • İnflamatuar kanserler Evre 3b olarak kabul edilir. • Aynı memede aynı anda birden fazla tümör varsa, T için en büyüğünün boyutu alınır. • Her iki memede aynı zamanda tümör varsa, her meme ayrı evrelendirilir. • Deri ya da meme başı retraksiyonu olup olmayışı durumu değiştirmez (27). 2.4. Meme Kanseri Tanısı Meme kanserinde mortaliteyi azaltmanın en güvenilir yolu erken tanı ve tedavidir (3). Son yıllarda, moleküler araştırmalar meme kanseri teşhis ve tedavisinde önemli gelişmelere sebep olmuştur (15). Hastaların genellikle ya kendi kendilerine veya rastgele bir muayene sırasında tespit edilen kitle ile başvurduğu bilinmektedir (3,20). Meme kanserinin tanısı temel olarak 3 yolla yapılır; Kendi kendine meme muayenesi (KKMM) Klinik muayenesi Mamografi (11) Diğer bir sınıflamaya göre kanser tanısı fiziksel muayene ve laboratuar muayene teknikleri olarak ikiye ayrılır (23). Fizik muayene: Fiziksel muayenede şu yöntemler izlenir; a) Anamnez; hastanın soy ve özgeçmişinin bilinmesi, kanser riski konusunda bilgi verir. Ailede meme kanseri olup olmadığı, menarş yaşı, ilk doğum yaptığı yaş, hormon preparatı kullanımı hakkında bilgi alınır ve riskli gruplara dahil olup olmadığına bakılır (3,23). Karaciğer büyümesi veya lenfadenopati yönünden batın muayenesinin yapılması; kemik metastazı açısından kemik ağrılarının olup olmadığının sorulması gerekir (20). 35 b) İnspeksiyon; Belden üst kısmı soyunmuş ve kolları yanında olmak üzere dik oturtulan hastanın karşısına geçilir. Memelerin büyüklük ve simetrisine bakılır. Deride renk değişikliği, eritem, ülserasyon, retraksiyon, ödem, çukurluk, biçimde deformasyon olup olmadığına bakılır. Ardından hastanın kolları yukarı kaldırılarak memeler tekrar gözden geçirilir (23). c) Palpasyon; hasta muayene masasına yatırılır ve muayene olacak taraftaki omuzun altına küçük bir yastık konur. Aksiller ve supraklavikular bölge ile başlanır. Bu şekilde hazırlanmış hastada bir elin parmaklarının iç yüzeyiyle sistematik olarak muayene edilir. Meme dokusundaki tümörün mobilitesi ve fiksasyonu, tümörün karakteri hakkında bilgi verir. Tümörün mobil olup parmakların arasından kaçması selim olduğuna işaret eder. Kanser olanlar ise meme dokusu içinde oldukça fiske durumdadır (3,23). Laboratuar Muayene Yöntemleri: a) Mammografi; Tümörün palpe edilemediği dönemde, meydana çıkmasını sağlamak amacıyla kullanılan bir röntgen tekniğidir ve en önemli avantajı, kanserin fiziksel semptomları ortaya çıkmadan önce bulguları ortaya koymasıdır (1,23). Yöntemin esası, memeyi oluşturan yumuşak dokular arasındaki dansite değişikliğinden röntgen ışınının farklı absorbsiyonuna dayanmaktadır (30). Çalışmalara göre düzenli mammografi meme kanseri mortalitesini %25-45 oranında azaltmaktadır (7). Ayrıca, mikrokalsifikasyonlar, mamografilerin büyük çoğunluğunda rastlanan bir bulgu olup mamografi, mikrokalsifikasyonların saptanmasında kullanılan tek tanı yöntemidir. Tüm kanser olgularının %30-40’da mikrokalsifikasyon görülmesi erken tanıda mamografinin önemini vurgulamaktadır (3). Ancak 35 yaş altı için önerilmemektedir. Mammografide Tablo 2.8.’de gösterilen BIRADS (Meme Görüntüleme Raporlama ve Veri Sistemi) kategori sınıflandırılması kullanılır (7). 36 Tablo 2.8. Mammografide BIRADS Kategori Sınıflandırılması (7) Kategori Anlamı 0 İlave görüntüleme yöntemleri gerekir 1 Normal Mamografi 2 Benign bulgular, olağan dışı takip gerekir. 3 Muhtemel benign bulgular, kısa dönem takip gerekir. 4 Şüpheli bulgular, malignitenin ekarte edilemediği bulgular, biyopsi önerilir. 4A Hafif dereceli şüpheli 4B Orta dereceli şüpheli 4C İleri dereceli şüpheli 5 Yüksek olasılık ile malignite düşündürücü bulgular 6 Malign olduğu bilinen (biyopsi ile verifiye), ancak henüz kesin tedavi uygulanmamış olgular b) Kserografi; X ışınları aracılığıyla memenin, elektrikle yüklenmiş selenyumlu, alüminyum plaklarda görüntüsü alınır. c) Termografi; habis urların diğer dokulardan daha fazla kızılötesi ışın yaydığı için farklı görüntü oluşturmasından yararlanılarak görüntü alınır. Bu yöntemle kesin tanı konulamaz. d) Pnomokistografi; meme kistinin ponksiyonla içinin boşaltılmasından sonra hava ile doldurularak röntgenin alınması işlemidir. e) Transillüminasyon; memenin karanlık bir odada bir tarafından verilen kuvvetli bir ışıkta incelenmesidir. f) Sitolojik muayene; memedeki solid bir kitledeki selüler materyalde, kist içindeki sıvıda ya da memebaşı akıntısında kanser hücresi aranmasıdır. g) Ultrasonografi; memenin kistik lezyonlarının ortaya konmasında kullanılır, çok hassas bir yöntem değildir. h) Lenfografi; lenf kanalları ve lenf gangliyonlarının durumlarını incelemek için kullanılır. i) Kompüterize aksiyal tomografi (CAT Scan); memedeki lezyonları belirlemek için uygulanan CAT scanning ilkelerinin uygulandığı deneysel bir tekniktir (23). 37 j) Biyopsi; kanserde kesin tanı biyopsi ile konur (23). Genellikle ince iğne aspirasyon biyopsisi, sınırlı insizyonel biyopsi ya da geniş lokal eksizyontekniklerinden biri veya birkaçı kullanılır (20). Laboratuar testleri içinde tam kan sayımı (CBC) yapılmalı ve kan biyokimyasına (özellikle alkalen fosfataz (ALP), SGOT (Serum Glutamik Oksaloasetik asit Transaminaz), SGPT (Serum Glutamil Piruvat Transaminaz), LDH (Laktat Dehidrogenaz) ve bilirubinler) bakılmalıdır (20). k) Magnetic Resonans Imaging (MRI); mamografik olarak memeleri yoğun olan ve meme koruyucu cerrahi girişim düşünülen hastalarda operasyon öncesi multifokal ve kontrlateral tümör varlığının gösterilmesinde kullanılır (3). Maliyetinin yüksek olması nedeniyle rutinde kullanılmaz (20). Kendi Kendine Meme Muayenesi: KKMM, 20 yaşından sonra, her bayanın ayda bir yapması gereken bir muayenedir. KKMM, bütün kadınlar için uygulaması kolay, ekonomik, özel araç-gereç gerektirmeyen, güvenli ,non-invaziv bir işlem olan ve sadece kişilerin beş dakikasını alan, meme kanseri için etkili bir erken tanı yöntemidir (3). KKMM, meme kanserinin erken tanısı ve tedavisinde faydalı olduğu kadar, yaşam süresinin uzatılmasında da büyük ölçüde etkilidir (23). Araştırmalar, meme kanserinde kadınların kitleyi ilk bulan kişiler olduğunu göstermektedir, bu da KKMM’yi daha da önemli kılmaktadır (1,3,23). Tarama; Meme kanserinin erken tanısında kullanılan tarama yöntemlerinin önem kazanmasının en önemli nedeni; meme kanserinin tarama yöntemlerine ve tedaviden sonra yapılan kontrol programlarına bağlı olarak mortalitesi ve morbiditesi azaltılma olasılığı bulunan birkaç kanser türünden biri olmasıdır (1). Meme kanserinde hastalığın erken ya da geç evrede belirlenmesi yaşam süresi ve kalitesini etkiler, aynı zamanda daha başarılı tedavi şansını da beraberinde getirir (1,24). Meme kanserinde erken evrede tanı konulması mortaliteyi azalttığı gibi memede koruyucu cerrahi müdahale yapılabilme imkanı da sağlar. Erken tanının ciddi getirileri olduğu için tarama çalışmaları önem kazanmaktadır. Tarama yöntemleri ile kadınlarda memedeki 38 normal olmayan bir gelişmenin erken dönemde saptanması, meme kanserinin biyolojik olarak başlamasından sonra, klinik olarak semptom vermeden önce tespit edilmesi hedeflenir. Meme kanserinde kullanılan tarama yöntemleri ‘’KKMM, klinik muayene ve mammografi’’dir (24). Özellikle meme kanseri riski yüksek olan kadınlarda tarama önem kazanmaktadır. Bu taramalar BRCA1 ve BRCA2’nin mutasyonlu varyantlarını taşıyanlar için tarama faaliyetleri yaygınlaştırılmaya çalışılmaktadır. Çünkü “Ailesel ya da kalıtsal meme kanseri için tarama” güç bir iştir. İlk olarak ailesel meme kanseri erken dönemde gelişen bir olgu olduğu için taramaların daha erken yaşlarda başlatılmasını ve daha sık taramayı gerektirir. İkinci olarak, BRCA1 varlığı ile birlikte olan meme kanserleri benign morfolojik özelliklere sahip olma eğilimindedir ve son derece ender olarak kalsifikasyonlarla birliktedirler. BRCA1’in eşlik ettiği kanserlerin fibroadenom ya da kolabe olmuş kistlerle bile ayrımında mamografi ve USG güçlük yaşanabilir (5). Bu yüzden ailesel meme kanserlerinin teşhisinde geç kalınması gibi sorunlar karşımıza çıkabilir. Amerikan Kanser Birliği (ACS)’nin meme kanseri için yüksek risk taşıyan (BRCA mutasyonlarını ya da diğer yüksek riskli genetik sendromları taşıyan ve Hodgkin hastalığının tedavisi için radyasyon tedavisi alan) kadınlara yönelik önerilerde, 30 yaş itibarı ile yılda 2 kez mamografi çektirilmesi ve MRI ile inceleme yapılmasını önermektedir (Risk taşımayanlarda 40 yaşından itibaren mamografi önerilir). Ayrıca kişinin kendisinde BRCA mutasyonu olmasa bile birince derece yakınlarında BRCA mutasyonu varsa ve kişi meme kanseri risk modellerine göre kanser riski yüksek ise mamografi ve MRI önerilir (54). ACS’ye göre meme kanserinin erken evrede tanımlanmasına yönelik olarak, önerilen yaş ve sıklık özellikleri Tablo 2.9. ’da gösterilmiştir (3,24). 39 Tablo 2.9. Meme Kanserinde ACS Tarafından Önerilen Meme Kanseri Tarama Rehberi (7) Yaş 20 - 39 40 - 49 >50 KKMM (Her ay) KMM / Her yıl KMM / Her 3 yılda Mammografi / her yıl (Bir – iki yılda bir) 2.5. Meme Kanseri Tedavisi Meme kanserlerinde tedavi evreye göre değişmektedir (28). • İn situ karsinom: Cerrahi yöntemle tümöral dokunun alınması • Evre 1- Evre 2: Total mastektomi Total mastektomi + Radyoterapi Radikal mastektomi Parsiyel mastektomi + Radyoterapi Parsiyel mastektomi + Radyoterapi + Kemoterapi • Evre 3: Polikemoterapi Radyoterapi Kemoterapi ile tümör çapı küçültülürse mastektomi yapılabilir. • Evre 4: Polikemoterapi + Hormon Tedavisi Genel olarak meme kanserlerinin tedavisinde cerrahi, radyoterapi, kemoterapi ve bu üç tedavi yönteminin kombinasyonları kullanılarak lokal ve sistemik kontrol 40 sağlamak amaçlanır (25,30). Lokal kontrol, cerrahi girişimler ve radyoterapi ile mümkün iken, sistemik kontrol kemoterapi ve hormonal tedavi ile sağlanır (25). 2.5.1.Cerrahi Tedavi Meme kanserinin primer tedavisini cerrahi oluştururken özellikle erken evre meme kanserlerinde ağırlık kazanmaktadır (18,26). Kanserli dokunun rezeksiyonundan ibarettir; ancak organ kaybı, tekrarlama riski ve tüm kanser tiplerine uygulanamaması dezavantajıdır (50). 2.5.2. Radyoterapi İlerlemiş meme kanserinde ve cerrahi tedavi uygulanamayan durumlarda, ameliyattan sonra görülen lokal nükslerde ya da cerrahi tedaviyi destekleyici olarak uygulanmaktadır (10). Bu uygulamada kanserli hücreler, spesifik frekans bandında ve spesifik şiddette yakılır. Ancak kanserli hücrelerin yanı sıra sağlıklı hücreler de zarar görür (50). 2.5.3. Kemoterapi Tek bir ilaç ya da çeşitli kombinasyonlarla tedavi edilmesidir (10). Sıklıkla evre 3 – 4 hastalarının tedavisinde radyoterapi ile birlikte kullanılmaktadır. Erken evre meme kanserinde de cerrahi tedavinin ve radyoterapinin yanı sıra mikrometastazları önlemek amacıyla da kullanılır (28). Kanserli hücreler, kemoterapötik ilaçlarla bu hücrelerin bölünmesini sağlayan mekanizmaları engelleme yoluyla öldürülür. Klasik kemoterapötik ilaçların vücutta hedefe ulaşmaları zordur (50). İn vivo ve in vitro çalışmalarda BRCA1 ve BRCA2 mutasyonu aracılık meme kanserlerinde, sporadik olgulara göre farklı kemosensitivite tespit edilmiştir. Preoperatif sistemik tedavi (PST) in vivo kemosensitivite değerlendirmesine olanak verir. Ancak mutasyon taşıyıcıları için kemoterapi rejimi olarak net öneriler henüz yoktur (55). BRCA mutasyonu taşıyıcıları üzerinde yapılan bir çalışmada ER blokekeri tamoksifenle yapılan kemoprevensiyonun meme kanseri riskini azaltabileceği bildirilmiştir (56). 41 ACS meme kanserinde kemoterapinin kullanımını üç şekilde önermektedir; • Cerrahiden sonra (Adjuvan kemoterapi), cerrahi sonrası antineoplastik ilaçlarla meme kanseri tedavisi adjuvan kemoterapi olarak adlandırılır. Cerrahi girişim ile görülebilen kanserli dokular temizlenirken, sonrasında kemoterapi uygulanarak olası temizlenememiş kanser dokularının öldürülmesi hedeflenir. Bu sayede tümörün nüksetme ihtimali de azaltılmış olmaktadır (57). Aksilla pozitif hastalarda adjuvan kemoterapinin nükssüz yaşam ve toplam sağkalım üzerindeki olumlu etkisi en belirgin olarak premenopozal kadınlarda izlenmektedir, nükssüz yaşamda %10, toplam sağkalımda ise % 20 kadar artış görülmüştür (25). Adjuvan kemoterapinin sağladığı fayda tanı anında hastanın yaşına ve hormon reseptör durumuna göre değişir (12). • Cerrahiden önce (Neoadjuvan kemoterapi), cerrahi öncesi kemoterapötik ilaçlarla tedavi yapılmasıdır, genellikle cerrahi sonrası kullanılan ilaçla aynı kimyasal tercih edilir. Sağkalım açısından adjuvan kemoterapi ile neoadjuvan kemoterapinin getirileri hemen hemen aynıdır (57). Neoadjuvan KT potansiyel pek çok avantajlara sahiptir; Subklinik mikrometastazların sistemik tedavisine erken zamanda başlanmasını sağlamaktadır. Kemoterapi ilaçlarının optimal dozda ve daha az toksisiteyle verilebilmesi sağlanabilmektedir. Operasyon sonrası hastaların üçte birinden fazlasında ciddi sorunlar geliştiği için, hastaların bir kısmı ya hiç adjuvan kemoterapi alamamakta veya uygun doz ve sürelerde kemoterapi alamamaktadır. Bu grup hastaların da sistemik kemoterapiden tam yararlanması sağlanabilmektedir. Tümörün kemoduyarlılığını in vivo değerlendirme şansı vermektedir. Hastalığın prognozu hakkında bilgiler vermektedir. Olgularda daha iyi cerrahi rezektabilite olanağı sağlamaktadır (58). • İlerlemiş meme kanseri olgularında, kemoterapi aynı zamanda kanserin meme dışı dokulara yayıldığı kanser vakalarında da ya teşhis konulduğunda ya da başlangıç tedavilerinden sonra kullanılır. Hasta kemoterapiyi ne kadar tolere eder ve tümör ne kadar küçülürse tedavi süresi de bunlara bağlı olarak kısalır (57). 42 Kemoterapide en yaygın olarak kullanılan ilaçlar şunlardır (57) ; CMF (Siklofosfamid, metotreksat, 5-fluorourasil) CAF (Siklofosfamid, adriamisin, 5-fluorourasil) AC (Adriamisin, siklofosfamid) AK (Epirubisin, siklofosfamid) TAC (Dosetaksel, adriamisin, siklofosfamid) AC_T (Adriamisin ve siklofosfamid, paklitaksel takip) A_CMF (Adriamisin, CMF takip) CEF (Siklofosfamid, epirubisin, 5-fluorourasil) TC (Dosetaksel, siklofosfamid) TCH (Dosetaksel, karboplatin ve HER2/neu tümörler için trastuzumab) 2.5.4. Hormon Tedavisi Hormonoterapinin amacı, endokrin bezleri ortadan kaldırmak veya dışarıdan ek hormon vermek ya da hormonların etkilerini bloke etmektir (10). Hormon tedavisi sistemik bir tedavi yaklaşımıdır ve kemoterapi gibi adjuvan ve neoadjuvan olarak kullanılabilir. Kadın vücudu söz konusu olduğu için de en çok en önemli hormonlar olan östrojen ve progesteron üzerinden etki eden ajanlar karşımıza çıkar (59). • Selektif Östrojen Reseptör (ER) Modifiye Edici Ajanlar, bunlardan karşımıza en çok tamoksifen çıkar, tamoksifen ER ya da PR pozitif olan invaziv meme kanserinde standart olarak kullanılır. Tamoksifenin etkisi hastanın yaşı, tutulan lenf nodu sayısı ve kemoterapi alıp almamasından bağımsız olarak ortaya çıkar (12). Toremifen de bu grup ilaçlardandır, ancak sık kullanılmaz sadece metastatik meme kanserli olgularda kullanım için onay almıştır. Bu antiöstrojenik ilaçlar etkilerini östrojen reseptörlerini geçici olarak bloke ederek gösterirler. Günlük olarak kullanılırlar. Kadınlarda hormon reseptörleri pozitif olan meme kanserli vakalarda ameliyattan sonra 5 yıl tamoksifen kullanımı hem hastalığın nüksünü azaltmaktadır hem de sağkalım süresini uzatmaktadır (59). • Aromataz İnhibitörleri, bunlar androstenedion ve testosteron gibi adrenal androjenlerin estradiol ve estrona dönüşümünü bloke ederler (12). Bu grup 43 ilaçlardan letrozol, anastrozol ve eksemestan’ın menopoz sonrası kadınlarda östrojen üretimini durdurmak için hem erken evre meme kanserlerinde hem de ileri evre meme kanserlerinde kullanımı onaylanmıştır (59). 2.5.5. Gen Tedavisi Meme kanserinde önemli sinyal yollarının ve bu aşamalarda rol oynayan genlerin belirlenmesiyle ilgili yapılan çalışmalar hem hastalığın mekanizmasını aydınlatmakta hem de hastalığın genetik ile olan ilişkisini ortaya koymaktadır. Bundan yola çıkarak da hastalığın tanısı, tedavisi ve izlemine yönelik yeni yaklaşımlar bulunmasına yol açmıştır (46). Şuanki tedavi rejimi cerrahi, kemoterapi, radyoterapi ve hormon tedavisinden oluşmaktadır. Ancak bunların her birinin sınırlamaları ve yan etkileri vardır. Ayrıca bunlar radikal çözüm sunmazken, gen tedavisi tümörün kesin yok edilişi ve sağkalım konusunda umut vaat etmektedir (13). Gen tedavisi, genetik defektlerin düzeltilmesi amacıyla somatik hücrelere nükleotid dizilerinin aktarımı olarak tanımlanmaktadır, ancak germ hücrelerine gen aktarımının etik olarak uygunluğu hala tartışılmaktadır. Bu tanıma göre gen tedavisi, eksik genlerin yerine konması, yanlış veya fazla çalışan genlerin susturulması ve bazı genlerin değiştirilmesini içerir (60). Kanser tedavisinde kullanılan geleneksel yöntemlerin yan etkileri, tedavinin başarısını ve etkinliğini azaltmaktadır. Erken teşhis ve tarama testleri sağ kalım için önemliyken, tedavide de yeni yaklaşımlar denenmektedir (50). Gen tedavisinin pek çok hastalıklarda kullanımına başlandığı gibi kanser de genetik defektler ile ilişkili olduğu için kanserde de denenmesi düşünülmüştür (13). Vücuda gen aktarımında genin terapötik etkisinin oluşması için bu genin direkt ya da indirekt yollarla kanser hücresine girmesi gerekir. Bu da kanserli hücreyi hedefleyen bir taşıyıcı rolünde vektör kullanımını gerektirir (13). Bu amaçla da viral, fiziksel ve kimyasal vektörler tercih edilmektedir (60). Virüslerden retrovirüs, adenovirüs, poxvirüs, herpes simplex virüs kullanılırken, non-viral vektör olarak lipofeksiyon, plazmid DNA, gen pompası ve RNA transferi tercih edilir (13). 44 Meme kanserinde gen tedavisi tümör baskılayıcı genler ve onkogenler üzerinden gerçekleştirilir (60). • Tümör Baskılayıcı Genler; Mutasyonlar veya kromozomal kopmalar, kayıplar sonucu bazı genlerin eksikliği tümör oluşması sürecinde etkili olabilir veya tümörün hızla büyümesine yol açabilir. Tümör baskılayıcı genler çekinik özellik gösterdiği için söz konusu genin her iki kopyasının da kaybı gereklidir. Bu durumda teorik olarak eksik genin yerine konması bu süreci durdurabilir veya yavaşlatabilir. Bir tümör supresör gen olan p53 geninin mutasyonunda Retroviral-p53 vektörleri kullanılarak akciğer tümör hücre dizilerinde büyümenin baskılandığı çalışmalar ve p53-adenoviral vektörler, Rb (Retinoblastoma) genleri veya p16 gibi tümör baskılayıcı genlerin ürünleri kullanılarak tümör büyümesinin baskılandığı gösterilmiştir (60). BRCA-1 geninin, normal kopyasının gen teknolojisi ile transferinin sağlandığı modellerde, tümör büyümesinin baskılandığı veya gerilediği de bildirilmiştir (60). • Aktif Onkogenlerin Baskılanması; Kanserlerin çoğunda ras, myc, fos gibi dominant onkogenlerde mutasyon veya ekspresyon artışı olduğu bilinmektedir. Bu genlerin çalışmaları DNA düzeyinde oligonükleotidlerle üçlü sarmal oluşturularak engellenebilir. Bunun için hedeflenen genlerin regülatör bölgelerine yönelik oligonükletid şeriti çift sarmal DNA ile bu özgül bölgelerde birleşerek DNA yapısını bozar (60). • Gen Tedavisinde Vektörün Hedefe Yönlendirilmesi ve Seçicilik; gen terapisinde en büyük sorun aktarılması planlanan genin hedefe ulaşabilirliği ve seçiciliğidir. Bu sorunu ortadan kaldırabilmek için yoğun çalışmalar vardır, vektörün hedefe yönlendirilmesi, dokuya özgül promoterler kullanılması, vektörün verilme yolu, reseptörlerin modifikasyonu aşamalarında iyileştirme yapılmaya çalışılmaktadır (60). 45 3. TARTIŞMA VE SONUÇ Meme kanserleri sporadik olarak ortaya çıkan ve genetik olarak ortaya çıkan (ailesel) meme kanserleri olmak üzere sınıflandırılabilir. Meme kanseri vakalarının büyük bir çoğunluğu sporadik vakalar olarak karşımıza çıkarken ailesel meme kanserleri ancak % 5 oranında görülür (3,6). Kanser oluşumunda rol oynayan iki temel gen grubu: onkogenler ve tümör baskılayıcı genlerdir. Onkogenler çoğunlukla proto-onkogen adı verilen normal hücresel genlerin mutant allelleridir. Onkogenlerin fonksiyon kazandıran mutasyon özelliği ve tümör baskılayıcı genlerin fonksiyon-kaybı malign fenotip oluşumuna neden olmaktadır (38). Tümör supressör genler olan BRCA1 ve BRCA2 genlerindeki mutasyonlar yüksek penetransa sahip olduğu için meme kanseri yatkınlık genleri olarak adlandırılır ve meme kanseri genetiğinde önemli yere sahiptir. Meme kanserine yatkınlık genlerine ait bilgilerle ilgili son yıllarda pek çok önemli ilerlemeler kaydedilmiş olsa da, yeni bilgiler öğrenilmeye devam edecektir. Kadın meme kanserine yatkınlık genlerinin özellikleri, sayısı, bu genler arası etkileşimler, genlerin çevresel faktörlerle etkileşimine ait soruların cevaplanması meme kanserine yatkınlığı azaltmada işe yarayacaktır (61). BRCA1 ve BRCA2’deki germline mutasyonlar meme kanserlerinin sadece % 15- 20’sini oluşturur (ailesel meme kanseri). Meme kanserlerinde etkili olan genler arasındaki etkileşim ve çevresel maruziyet de önemlidir. Günümüzde yapılan çalışmalar, bu etkileşimleri tanımlamaya yöneliktir, ancak bu çalışmaların oldukça karmaşık olduğu bir gerçektir (61). 46 Günümüzde ailesel meme kanserli kadınlarda BRCA1’deki mutasyonların ancak %15-20’si tanımlanmıştır, ailesel meme ya da over kanseri öyküsü olan kadınlarda ise %60-80’i tanımlanmıştır (61). 17q 12-q21’ de lokalize olan BRCA1 geni tümör supresör bir gendir ve bu genin ürünü olan 1863 amino asidin oluşturduğu 220 kDa‟lık BRCA1 proteini, hücre nükleusunda yerleşmiştir. BRCA1 proteini, N terminalinde çinko bağlayan yaklaşık 100 aminoasitlik özel bir RING bölgesi ve C terminalinde ise yaklaşık 90 aminoasitlik BRCT tekrar bölgeleri içermektedir. BRCA1’in tümör baskılayıcı özelliğinde bu iki fonksiyonel bölgenin önemi dikkat çekmektedir (6,42,62). BRCA1’ in allellerinden biri gen dizisi mutasyonu ile kaybolur ve geriye kalan allelin sonraki kaybı somatik meme dokusunda ortaya çıkar. Bununla ilgili kanser ailelerinde yapılan çalışmada BRCA1’in C-ucunun eksik sentezlenmesine neden olan mutasyonların daha çok meme kanserine, büyük bölümünün eksik kalmasına neden olan 5’-ucuna yakın mutasyonların ise hem meme kanseri hem de over kanserine yol açtığı bildirilmiştir (46,62). BRCA1 ile ilgili meme kanserleri daha erken evrede ve daha genç yas gruplarında görülmektedir (62). BRCA2 de yüksek geçişli bir gendir (33). İnsan vücudu BRCA1’e çok benzer bir paternde, BRCA2 mRNA eksprese eder fakat en yüksek seviyeler meme ve timusta, daha düşük oranlarda da akciğer, over ve dalakta gözlenir. Normal hücrelerde BRCA2, özellikle hücre siklusunun geç-G1/erken-S fazında eksprese edilen nükleer bir proteindir (42). BRCA2’ye bağlı over kanserlerinin hemen hemen tümünden 11. Eksonun 3.3.kb’lik bir bölümünde yer alan mutasyonlar sorumludur. Bu genin amino veya C-uçlarında yer alan mutasyonlar sadece meme kanserine neden olmaktadır (46). BRCA2 gen mutasyonlarının erkek meme kanserleriyle de ilişkili olduğuna dair veriler mevcuttur, erkeklerde BRCA1 mutasyonu ise daha çok prostat kanserine sebep olmaktadır (63,64). Kişilerin bu gen mutasyonlarını taşıması yüzde yüz kanser olacağını göstermezken, mutasyonlu gen taşımayan topluma göre artmış riskleri olduğu unutulmamalıdır. 47 Mutasyon taşıyıcılarının belirlenmesi için gen testleri ve DNA analizleri yapılmaktadır. Bu testler herkese yapılmaz. Ailedeki kanser öyküleri, kişisel kanser öykülerine bakılarak yüksek riskli kişiler belirlenir ve bunlara test uygulanır. Test sonucu kişi mutasyon taşıyıcısı ise çeşitli yaklaşımlarla kanser riskinin azaltılması yoluna gidilir. Bunun için taramalar daha sıklıkla yapılır. Gerekliyse profilaktik cerrahi yapılır (35,40,43,48,51). BRCA ve daha başka gen mutasyonlarının tanımlanmış olmaları ile genetik taşıyıcıların kan testleri yoluyla belirlenmesi ve meme kanseri açısından riskli olan bu bireylere danışmanlık verilerek kanser surveyansı ile ilgili olarak kendi geleceklerini tartışma hakkı verilmelidir (33). Meme kanseri tedavisinde uygulanan cerrahi işlemin organ kaybı, tekrarlama riski ve tüm kanser tiplerine uygulanamaması gibi dezavantajları vardır. Radyoterapide seçicilik olmadığı için sağlıklı hücreler de radyasyondan zarar görür (50). Konvansiyonel tedaviler radikal çözüm sağlayamazlar, nüks ihtimaller her zaman vardır. Bu yüzden köklü çözüm sağlayacağı düşünülen ve diğer pek çok hastalıkta da kullanımına başlanan gen tedavisi meme kanserinde umut verici olmuştur. Gen tedavisi ailesel meme kanseri olgularında kullanılabilir. Meme kanserinde gen tedavisi tümör baskılayıcı genler ve onkogenler üzerinden gerçekleştirilir. BRCA-1 geninin, normal kopyasının gen teknolojisi ile transferinin sağlandığı modellerde, tümör büyümesinin baskılandığı veya gerilediği de bildirilmiştir (60). Gen terapisinde sorun, aktarılması planlanan genin hedefe ulaşabilirliği ve seçiciliğidir. Bu sorunu ortadan kaldırabilmek için çalışmalar vardır, vektörün hedefe yönlendirilmesi, dokuya özgül promoterler kullanılması, vektörün verilme yolu, reseptörlerin modifikasyonu aşamalarında iyileştirme yapılmaya çalışılmaktadır (60). 48 KAYNAKLAR 1) Somunoğlu S. , Meme Kanseri: Belirtileri ve Erken Tanıda Kullanılan Tarama Yöntemleri, Fırat Sağlık Hizmetleri Dergisi 2009, 4 (10), 103- 122. 2) T.C. Sağlık Bakanlığı Dünya ve Türkiye’de Kanser Verileri, 2012 http://www.saglik.gov.tr/TR/belge/1-15486/dunya-ve-turkiyede-kanser.html? vurgu=meme+kanseri Erişim Tarihi: 26.12.2012. 3) İtilli Ö. , Hastanemiz Meme Polikliniğine Başvuran Kadınların Kendi Kendine Meme Muayenesi Uygulama Davranışları ve Mamografi, Meme Ultrasonografi Sonuçlarının Değerlendirilmesi, Sağlık Bakanlığı Dr. Lütfi Kırdar Kartal Eğitim ve Araştırma Hastanesi Aile Hekimliği Uzmanlık Tezi, İstanbul, 2009. 4) Karayurt Ö. , Zorukoş N. S. ; Meme Kanseri Riski Yüksek Olan Kadınların Yaşadıkları Duygular ve Bilgi – Destek Gereksinimlerinin Karşılanması, Meme Sağlığı Dergisi 2008, 4(2), 56-61. 5) Baskan S., Atahan K., Arıbal E., Özaydın N., Balcı P., Yavuz E., Meme Kanserinde Tarama ve Tanı (İstanbul Meme Kanseri Konsensus Konferansı 2010), Meme Sağlığı Dergisi 2012, 8(3), 100-125. 6) Cannazik Y., Meme Kanseri Olgularında BRCA1 Geni Metilasyon Paterninin MS-HRM Yöntemi İle İncelenmesi, Eskişehir Osmangazi Üniversitesi Tıbbi Genetik Anabilim Dalı Yüksek Lisans Tezi, Eskişehir, 2012. 7) Gençay T., Hasta Ve Sağlık Çalışanlarının Kendi Kendine Meme Muayenesi Ve Meme Kanseri Risk Faktörleri Bilgi Düzeyinin Saptanması, Sağlık Bakanlığı Taksim Eğitim Ve Araştırma Hastanesi Aile Hekimliği Koordinatörü Uzmanlık Tezi, İstanbul, 2007. 8) Ünal H., Meme Kanserinin Tan› ve Tedavisinin Tarihsel Gelişimi, Meme Kanseri Sempozyum Dizisi No:54, İ. Ü. Cerrahpaşa Tıp Fakültesi Sürekli Tıp Eğitimi Etkinlikleri, Aralık 2006, 9 – 13. 9) Engin K., Meme Kanserleri, Nobel Tıp Kitabevi, 2005, 75-90. 10) Çevik Gökpınar C., Memede Kitle Şüphesiyle Hastaneye Başvuran Kadınların Meme Kanseri Ve Kendi Kendine Meme Muayenesi İle İlgili Bilgi Düzeyleri Ve Kitlenin Fark Edilmesinde Kendi Kendine Meme Muayenesinin Etkisi, Afyon Kocatepe Üniversitesi Sağlık Bilimleri Enstitüsü Cerrahi Hemşireliği Anabilim Dalı Yüksek Lisans Tezi, Afyon, 2003. Hastalıkları 49 11) Şekeroğlu B., Meme Kanseri Tedavisinde Adjuvan Kemoterapi Maliyetinin Araştırılması, Dokuz Eylül Üniversitesi Tıp Fakültesi İç Hastalıkları Anabilim Dalı Uzmanlık Tezi, İzmir, 1995. 12) Şahan B., Metastatik Meme Kanserinde Adjuvan Antrasiklin Kullanımının Prognostik Önemi, T.C. Genelkurmay Başkanlığı Gükhane Askeri Tıp Akademisi Haydarpaşa Eğitim Hastanesi İç Hastalıkları Servis Şefliği Uzmanlık Tezi, İstanbul, 2004. 13) Abaan D. O., Criss E. W., Gene Therapy in Human Breast Cancer, Turk J Med Sci, 2002, 32, 283-291. 14) Key T. J., Verkasalo P. K., Banks E., Epidemiology Of Breast Cancer, The Lancet, 2001, 2, 133-140. 15) Arango B. A., Rivera C. L., Glück S., Gene Expression Profiling in Breast Cancer, Am J Transl Res, 2013, 5(2), 132-138. 16) Kelsey J. L., Gammon M. D., The Epidemiology of Breast Cancer, Ca-a Cancer Journal For Clinicians, 1991, 41(3), 146-165. 17) Sağlık Bakanlığı Kanser Daire Başkanlığı Türkiye’de Yıllara Göre Kanser İnsidansları, 2013, http://www.kanser.gov.tr/index.php/daire-faaliyetleri/ kanseristatistikleri.html Erişim Tarihi: 20.04.2013. 18) Göcen E., Meme Koruyucu Cerrahi Uygulanmış Meme Kanserli Hastalarda Konvansiyonel Radyoterapi İle Konformal Radyoterapi Tekniğinin Doz Dağılımı Açısından Değerlendirilmesi, Sağlık Bakanlığı Kartal Dr. Lütfi Kırdar Eğitim ve Araştırma Hastanesi Radyoloji Kliniği Uzmanlık Tezi, İstanbul, 2008. 19) Somunoğlu S., Meme Kanserinde Risk Faktörleri, Fırat Sağlık Hizmetleri Dergisi, 2007, 2(5), 2-12. 20) Kaplan B., 1992-1995 Yılları Arasında Erciyes Üniversitesi Tıp Fakültesi Gevher Nesibe Hastanesine Lokal İleri Meme Kanseri Tanısıyla Başvuran Hastaların Tedavi ve Takip Sonuçları, Erciyes Üniversitesi Tıp Fakültesi Radyasyon Onkolojisi Anabilim Dalı Uzmanlık Tezi, Kayseri, 1996. 21) Özen M., HER2 Pozitif Meme Kanseri Hastalarında Adjuvan Tedaviye 9 Haftalık Trastuzumab Eklenmesi: Retrospesifik Analiz, Hacettepe Üniversitesi Tıp Fakültesi İç Hastalıkları Anabilim Dalı Uzmanlık Tezi, Ankara, 2010. 50 22) Seyhan M. F., Detoksifikasyon Enzimlerinden NAT2 Ve CYP1A2 Gen Polimorfizmlerinin Meme Kanseri İle İlişkisinin İncelenmesi, İstanbul Üniversitesi Sağlık Bilimleri Enstitüsü Moleküler Tıp Anabilim Dalı Yüksek Lisans Tezi, İstanbul, 2011. 23) Akyolcu N., Kadınların Meme Kanseri ve Kendi-Kendine Meme Muayenesi Hakkındaki Sağlık Bilgisi Düzeylerinin Ölüçülmesi, İstanbul Üniversitesi Tıp Fakültesi Cerrahi Hastalıkları Anabilim Dalı Doktora Tezi, İstanbul, 1985. 24) Merey S., Kadınlarda Meme Kanseri Tarama Davranışları, İstanbul Üniversitesi Sağlık Bilimleri Enstitüsü Halk Sağlığı Hemşireliği Anabilim Dalı Yüksek Lisans Tezi, İstanbul, 2002. 25) Alptekin Ülgey N., Meme Kanseri Cerrahisinde Meme Koruyucu Girişimler Ve Sonuçları, T.C. Genelkurmay Başkanlığı Gülhane Askeri Tıp Akademisi Askeri Tıp Fakültesi Genel Cerrahi Anabilim Dalı Başkanlığı Uzmanlık Tezi, Ankara, 1999. 26) Dinçol D., Aksilla Pozitif Premenapozal Meme Kanseri Olgularında DNA Ploidi İle Prognoz İlişkisi Ve Tümör İçi Heterojenitenin Değerlendirilmesi, Ankara Üniversitesi Tıp Fakültesi İç Hastalıkları Anabilim Dalı Tıbbi Onkoloji Bilim Dalı Uzmanlık Tezi, Ankara, 1991. 27) Serdar S., Meme Kanserinde CD44 Ekspresyonunun Prognostik Önemi Ve Diğer Prognostik Faktörlerle İlişkisi, T.C. Genelkurmay Başkanlığı Gülhane Askeri Tıp Akademisi Haydarpaşa Eğitim Hastanesi İç Hastalıkları Servis Şefliği Uzmanlık Tezi, İstanbul, 2000. 28) Sertöz Ö. Ö., Meme Kanserinde Ameliyat Tipinin, Beden Algısı, Cinsel İşlevler, Benlik Saygısı Ve Eş Uyumuna Etkileri: Kontrollü Bir Çalışma, Ege Üniversitesi Tıp Fakültesi, Psikiyatri Anabilim Dalı Uzmanlık Tezi, İzmir, 2002 29) Ünver S., Meme Kanserinde Doku Ferritin Düzeyinin Standart Prognostik Parametrelerle Korelasyonu ve Prognostik Önemi, T.C. Genelkurmay Başkanlığı Gülhane Askeri Tıp Akademisi Haydarpaşa Eğitim Hastanesi İç Hastalıkları Servis Şefliği Uzmanlık Tezi, İstanbul, 1998 30) Atılgan H., Meme Kanserlerinde Modifiye Radikal (Subkutan) Mastektomi Ve Eş Zamanlı Meme Rekonstrüksiyonu, T.C. Genelkurmay Başkanlığı Gülhane 51 Askeri Tıp Akademisi Askeri Tıp Fakültesi Genel Cerrahi Anabilim Dalı Başkanlığı Uzmanlık Tezi, Ankara, 1999. 31) Merkezi İllinois Meme Kanseri Bilinçlendirme Derneği, 2013, http://cibcaa.org/who-classification-of-breast-cancer/ Erişim Tarihi: 01.05.2013 32) İzmir İl Sağlık Müdürlüğü Meme Kanseri Uyarıcı Belirtileri, 2013 www.ism.gov.tr/indir/acsap/meme_muayenesi_erken_tani.ppt Erişim Tarihi: 13.04.2013. 33) Ünalan P. C., Ailesel Meme Kanseri Risk Gruplarında Genetik Danışmanlık: Türkiye’de Mevcut Durum Ve Bir Öneri, Marmara Üniversitesi SAĞLIK Bilimleri Enstitüsü TIbbi Biyoloji Ve Genetik ANabilim Dalı Yüksek Lisans Tezi, İstanbul, 2009. 34) Anderson D. E.,Genetic Study Of Breast Cancer: Identification Of A Hıgh Risk Group, Cancer, 1974, 34(4), 1090-1097. 35) Koçak S., Çelik L., Özbaş S., Dizbay Sak S., Tükün A., Yalçın B., Meme Kanserinde Risk Faktörleri, Riskin Değerlendirilmesi Ve Prevansiyon: İstanbul 2010 Konsensus Raporu, Meme Sağlığı Dergisi, 2011, 7(2), 47-67. 36) Sjöblom T., Jones S., Wood L. D., Parsons D. W., Lin J., Barber T. D., Mandelker D., Leary R. J., Ptak J., Silliman N., Szabo S., Buckhaults P., Farrell C., Meeh P., Markowitz S. D., Willis J., Dawson D., Willson J. K. V., Gazdar A. F., Hartigan J., Wu L., Liu C., Parmigiani G., Ho Park B., Bachman K. E., Papadopoulos N., Vogelstein B., Kinzler K. W., Velculescu V. E., The Consensus Coding Sequences of Human Breast and Colorectal Cancers, Sciencexpress , 2006, 314, 5797, 268-274. 37) Okutur S. D., HER2 Pozitif Metastatik Meme Kanserinde PTEN , P27 Ve PI3K Ekspresyonunun Prediktif Ve Prognostik Önemi, İstanbul Bilim Üniversitesi Tıp Fakültesi İç Hastalıkları Anabilim Dalı Tıbbi Onkoloji Bilim Dalı Uzmanlık Tezi, İstanbul, 2011. 38) Sezgin E., PCR-RFLP Yöntemi İle Meme Kanseri Olgularına Ait Parafin Blok Doku Kesitlerinde HER-2/neu Gen Polimorfizminin Belirlenmesi, Başkent Üniversitesi Sağlık Bilimleri Enstitüsü Tıbbi Biyoloji Ve Genetik Anabilim Dalı Yüksek Lisans Tezi, Ankara, 2009. 52 39) Öztürk M., Meme Kanserinin Geneti¤i ve Risk Faktörleri, Meme Kanseri Sempozyum Dizisi No: 54, İ.Ü. Cerrahpaşa Tıp Fakültesi Sürekli Tıp Eğitimi Etkinlikleri, Aralık 2006, 15-26. 40) Haberal A., Meme ve Over Kanserlerinde Genetik Tarama: Yalnız Araştırma Amaçlı mı Yoksa Rutin Tarama mı Olmalıdır ?, TJD Uzmanlık Sonrası Eğitim Dergisi, 2004; 6:26-29. 41) Gür dedeoğlu B., Analysis of Differentıally Expressed Genes In Breast Cancer: BRCA1-Induced Gene Expression Profiles and Metaanalysis Gene Signature, The Department Of Molecular Biology And Genetics And The Institute Of Engineering And Science Of Bilkent University In Partial Fulfillment Of The Requirements For The Degree Of Doctor Of Philosophy, Ankara, 2009. 42) Güveloğlu E., Meme, Over Ve Tuba KArinomlarında BRCA1 VE BRCA2 Protein Ekspresyonlarının Prognostik Önemi İmmünohistokimyasal Ve Klinikopatolojik Çalışma, Çukurova Üniversitesi Tıp Fakültesi Pataloji Anabilim Dalı Uzmanlık Tezi, Adana, 2006. 43) Quinn G. P., Vadaparampil S. T., Tollin S., Miree C. A., Murphy D., Bower B., Silva C., BRCA carriers’ thoughts on risk management in relation to preimplantation genetic diagnosis and childbearing: when too many choices are just as difficult as none, Fertility and Sterility, 2010, 94(6), 2473-2475. 44) Stadler Z. K., Salo-Mullen E., Patil S. M., Pietanza M. C., Vijai J., Saloustros E., Hansen N. A. L., Kauff N. D., Kurtz R. C., Kelsen D. P., Offit K., Robson M. E., Prevalence of BRCA1 and BRCA2 Mutations in Ashkenazi Jewish Families With Breast and Pancreatic Cancer, Cancer, 2012, 15, 493-499. 45) Meindl A., Ditsch N., Kast K., Rhiem K., Schmutzler R. K., Hereditary Breast and Ovarian Cancer, Medicine, 2011, 108(19): 323–330. 46) Dalay N., Meme Kanserlerinde Moleküler Genetik Ve Kalıtsal Meme Knaserleri, Kalıtsal Hastalıklara Moleküler Tıp Açısından Bakış Sempozyumu, İ.Ü. Onkoloji Enstitüsü İstanbul, 2003, 73-86. 47) Heim S., Mitelman F., Cancer Cytogenetics, Wiley-Liss, 1995, 369-375. 48) Çefle K., Kanser Genetiği, Klinik Gelişim, 50-59. 49) Ford D., Easton DF., The genetics of breast and ovarian cancer, Britsh Journal of Cancer, 1995, 72, 805-812. 53 50) Oylar Ö., Tekin İ., Kanserin Teşhis Ve Tedavisinde Nanoteknolojinin Önemi, Uludağ Üniversitesi Mühendislik-Mimarlık Fakültesi Dergisi, 2011, 16(1), 147154. 51) Genetiks Genetik Hastalıklar Tanı Merkezi, 2013 http://www.genetiks. com.tr/tr/meme-kanseri Erişim Traihi: 21.042013. 52) Acıbadem Hastanesi, 2013 http://www.acibademgenetik.com/?sid=26 Erişim Tarihi: 21.04.2013. 53) Surbone A., Ethical implications of genetic testing for breast cancer susceptibility, Critical Re_iews in Oncology/Hematology, 2001, 40, 149-157. 54) Seçginli S., Meme Kanseri Taraması: Son Yenilikler Neler?, TAF Preventive Medicine Bulletin, 2011, 10(2), 193-200. 55) Schott S., Sohn C., Schneeweiss A., Heil J., Preoperative Systemic Treatment in BRCA-Positive Breast Cancer Patients: Case Report and Review of the Literature, Breast Care, 2011;6:395–398. 56) Metcalfe K. A., Snyder C., Seidel J., Hanna D., Lynch H. T., Narod S., The use of preventive measures among healthy women who carry a BRCA1 or BRCA2 mutation, Familial Cancer, 2005, 4: 97–103. 57) Amerikan Kanser Birliği, 2013, http://www.cancer.org/cancer/breastcancer/ detailedguide/breast-cancer-treating-chemotherapy Erişim Tarihi: 25.04.2013. 58) Karaoğlu A., Oflazoğlu U., Demir N., Kas invaziv mesane kanserinde neoadjuvan ve adjuvan kemoterapi, Üroonkoloji Bülteni, 2013, 12(1), 58-63. 59) Amerikan Kanser Birliği, 2013, http://www.cancer.org/cancer/breastcancer/ detailedguide/breast-cancer-treating-hormone-therapy Erişim Tarihi: 25.04.2013 60) Kars A., Gen Tedavisi, XIII. TPOG Ulusal Pediatrik Kanser Kongresi, 18-22 Mayıs 2004, 59-63. 61) Nathanson K. L., Wooster R., Weber B. L., Breast cancer genetics: What we know and what we need, Nature Publishing Group, 2001, 7(5), 552-556. 62) Fındık S., Meme Kanseri Olgularında HER2/neu Tespitinde İmmünohistokimya Ve Floresan İn Situ Hibridizasyon (FISH) Yöntemlerinin Karşılaştırılması, Selçuk Üniversitesi Meram Tıp Fakültesi Patoloji Anabilim Dalı Uzmanlık Tezi, Konya, 2007. 54 63) Mavraki E., Gray, I., Bishop DT., Spurr NK., Germline BRCA2 mutations in men with breast cancer, British Joumal of Cancer, 1997, 76(11), 1428-1431. 64) Hacıbekiroğlu M., Meme Kanserinde Tümör Marker’lar ve Biyokimyasal Değişimler, Meme Kanseri Sempozyum Dizisi No:54, İ.Ü. Cerrahpaşa Tıp Fakültesi Sürekli Tıp Eğitimi Etkinlikleri, Aralık 2006, 35-41. 55 ÖZ GEÇMİÇ Adı – Soyadı : Özlem DERECELİ Doğum Yeri : Kayseri Doğum Tarihi : 22/07/1990 1990 yılında Kayseri’de doğdum. İlköğretimimi Kayseri’de Şükrü Malaz İlköğretim Okulu’nda tamamladım. Lise öğrenimime Nuh Mehmet Küçükçalık Anadolu Lisesi’nde devam ettim. 2008 yılında Erciyes Üniversitesi Eczacılık Fakültesi’ni kazandım. Halen Erciyes Üniversitesi Eczacılık Fakültesi’nde öğrenimimi sürdürmekteyim. Adres : Fatih Mh. Bozantı Cd. No: 6/25 Kocasinan / KAYSERİ E – mail : ozlem.dereceli@gmail.com