moleküler biyoloji 2 - Gene-Cell
advertisement

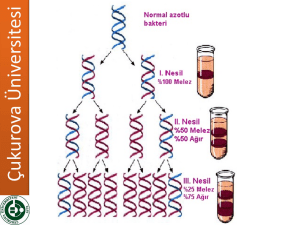
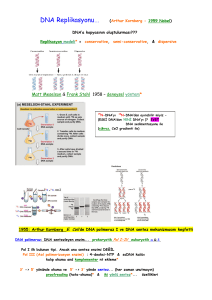
Moleküler Biyoloji (2011-2012) Doç. Dr. Ercan ARICAN Moleküler Biyoloji ve Genetik Bölümü DNA YAPISI VE ANALİZİ Genlerde, bir sonraki kuşağa aktarıldığında soyun biçimini ve özelliklerini etkileyen bilgiye GENETİK BİLGİ denir. 1944’e kadar, kromozomlardaki hangi bileşenin genleri ve genetik materyali oluşturduğu açık değildi. 1944 yılında nukleik asitin (DNA) kalıtıma ait bilgiyi taşıdığı kanıtlanmıştır. James Watson ve Francis Crick’in DNA’nın ikili sarmal yapısıyla ilgili hipotezlerini ortaya çıkaran öncü çalışmaları, 1953’te Nobel Ödülünü almıştır. Genetik Materyal Dört Özellik Göstermelidir… •Kendini eşleme (replikasyon) •Bilgi depolama •Bilgiyi ifade etme •Mutasyonla çeşitlenme (varyasyon) Genetik materyalin “replikasyonu” bütün canlı organizmaların temel bir özelliğidir ve hücre döngüsünün bir bölümünde yer alır. “Depolama” özelliği, bir organizmanın tüm kalıtsal özelliklerinin toplandığı genetik bilgi olarak düşünülebilir. Ancak depolanan bilginin tamamı ifade edilir yada edilmez. Hücrelerin çoğu DNA’nın tamamına sahip olduğu halde belirli bir noktada bu genetik potansiyelinin bir bölümünü ifade ederler. Bakteriler belirli çevre koşulları karşısında birçok geni faaliyete geçirir. Omurgalılarda deri hücrelerinde melanin geni aktiftir ama hemoglobin genleri hiçbir zaman ifade edilmezler. Depolanan bilginin “ifadesi” karmaşık bir işlemdir ve hücrede bilgi akışının temelini oluşturur. İlk işlem, DNA’nın üç tip RNA molekülü; mRNA, tRNA ve rRNA oluşturmak üzere transkripsiyonu (okuma) ile başlar. Bunların içinden sadece mRNA’nın proteine translasyonu yapılır. Translasyon (çeviri), rRNA içeren ribozomlarda tRNA’nın da katılımıyla gerçekleşir. tRNA, mRNA’daki kimyasal bilgiyi, proteinleri oluşturan amino asitlere çevirerek adaptör rolü oynarlar. Bu işlemler “moleküler genetiğin santral dogmasını” oluşturur. “DNA’dan RNA, RNA’dan protein sentezidir. Genetik materyal aynı zamanda, mutasyonlar yoluyla organizmalar arasında ortaya çıkan yeni “çeşitliliğin” de kaynağıdır. Mutasyon eşey hücrelerinde olursa, gelecek kuşaklara aktarılır ve zamanla populasyon içerisinde yayılır. Kromozomların içinde ve kromozomlar arasında yer alan yeniden düzenlenmeleri (rekombinasyon) de kapsayan genetik çeşitlilik evrimin ham maddesidir. 1944’e kadar yapılan gözlemler, genetik materyalin protein olduğunu düşündürmüştür. Bu inanç, üç faktörden kaynaklanmıştır. •Proteinler hücrelerde bol olarak bulunmaktadır (%50) •1900’lerin başından ortalarına kadar nukleik asitlerin kimyasal yapıları ile ilgili olarak kabul edilmiş olan öngörüdür. DNA ilk olarak 1868 yılında İsviçreli kimyacı Friedric Miescher tarafından çalışılmıştır. Miescher sitoplazmadan “nuklein” adını verdiği asidik bir maddeyi izole etmiştir. 1910’larda Phoebus A. Levene, nukleotidlerin nukleik asitlerdeki kimyasal yerleşimini açıklamak için “tetranukleotid hipotezini” önermiştir. Son derece basit dört nukleotid birimi DNA’da devamlı tekrarlanmaktadır. Dört nukleotidin oldukça değişen oranlarda bulunduğunu gösterdiği halde Levene, bu oranın 1:1:1:1 olduğunu varsaymıştır. Genetikçiler, genetik materyalden beklenen büyük miktarda kimyasal farklılığı bu yapının sağlayamayacağı görüşündeydi. Buna karşın proteinler 20 değişik amino asit içeriyordu ve farklılığın temelini oluşturabilirdi. •Üçüncü faktör, genetiğin en aktif araştırma alanları ile ilgilidir. 1940’tan önce genetikçilerin çoğu aktarım (transmisyon) genetiği ve mutasyon çalışmaları ile uğraşmıştır. 1940’lardan sonra, Erwin Chargaff’ın çalışmaları, Levene’nin hipotezinin doğru olmadığının farkına varılmasına yol açmıştır. Chargaff, bir çok organizma için 1:1:1:1 oranının doğru olmadığını göstermiştir. DNA’nın genetik materyal olduğu yönündeki kanıt ilk defa bakteri ve bakteriyofajlarla yapılan çalışmalar sırasında elde edilmiştir. Oswald Avery, Colin MacLeod ve Maclyn McCarty’nin bakterilerde “transformasyon prensibi”nin kimyasal doğası ile ilgili olarak 1944’te yayınlanan makalesi, DNA’nın genetik materyal olarak kabul edilmesinde ilk adım olmuştur. Transformasyon Çalışmaları 1927’de İngiliz Sağlık Bakanlığı’nda sağlık memuru olarak görev yapan Frederic Griffith tarafından başlatılmıştır. Griffith Diplococcus pneumonieae nin değişik suşlarını kullanarak deneyler yapmıştır. Bazı omurgalılarda zatürreye neden olan hastalık oluşturan (virülant) suşlardı, bir kısmı da hastalık oluşturmayan (antivirülant) suşlardı. Virülans etki bakterilerin sahip oldukları polisakkarit kapsül yapıları ile ilgiliydi. Virulant suşlarda kapsül bulunurken, avirulant suşlar kapsülsüzdü. Kapsülsüz bakteriler, hayvanın dolaşım sistemindeki fagositik hücreler tarafından hızla alınıp parçalanıyordu. Polisakkarit kılıflı virulant bakteri kolayca hücre içine alınmadığı için çoğalıp zatürreye neden oluyordu. Diplococcus’un her bir suşu serotipler olarak adlandırılan düzinelerce değişik tipten biri olabilir. Griffith, genetik materyalle ilgili yeni kavramlara yol açan deneylerinde tip II ve III’ü kullanmıştır. Griffith yalnız canlı virulant hücrelerin sıçanda zatürre oluşturabileceğini yapılan çalışmalardan biliyordu. Isıyla etkisiz hale getirilen virulant bakteriler sıçana verildiğinde avirulant bakteriler gibi zatürre oluşturmuyordu. Griffith bu deneyde canlı IIR (avirulant) hücrelerde ısı ile etkisiz hale getirilen IIIS (virulant) hücreleri karıştırarak sıçana verdi. İki hücre tipi tek başına verildiğinde sıçanı öldürmediğine göre, Griffith her iki hücrenin birlikte verilmesinin sıçanı öldürmemesini bekliyordu. Ancak, beş gün sonra çift enjeksiyon yapılan bütün sıçanlar öldü. Ölü sıçanların kan analizlerinde fazla miktarda canlı IIIS tipi (virulant) bulunduğu saptandı. Avirulant ölen sıçanların kanında bulunan IIIS bakteriler, polisakkarit kapsül açısından, ısı ile öldürülmüş hücrelerden elde edilen IIIS suşuna benziyordu. Yalnız canlı, IIR bakterilerin verildiği kontrol sıçan canlıydı ve zatürre olmamıştı. Bu bulgu, ısı ile öldürülmüş IIIS fraksiyonu ortamda yok iken, avirulant IIR hücrelerinin, virulant IIIS hücrelerine dönüşmüş olma (mutasyon) ihtimalini ortadan kaldırıyordu. Bunun yerine canlı IIR ve ısı ile öldürülmüş IIIS hücreleri arasında bir tip etkileşime gereksinim vardı. Griffith ısı ile öldürülmüş IIIS bakterilerinin bir biçimde, canlı avirulent IIR hücrelerinin virulant IIIS’lere dönüşümünden sorumlu olduğu sonucuna ulaştı. Bu olayı TRANSFORMASYON olarak adlandırarak her ne kadar kapsül tek başına zatürreye neden olmuyorsa da transformasyonu gerçekleştiren ana maddenin polisakkarit kapsülün bir kısmı ya da kapsül sentezinde rol alan bir bileşik olabileceğini önerdi. 1931’de Rockefeller Enstitüsünden Henry Dowson transformasyonun in vitro cereyan edebileceğini gösterdi. 1933’e gelindiğinde Lionel J. Alloway, S hücrelerinin kaba özütlerini ve canlı R hücrelerini kullanarak in vitro bir sistem geliştirdi. 1944’te Avery, MacLeod ve McCarty on yıllık bir çalışma sonucunda bugün moleküler genetik alanında klasik sayılan makalelerini yayınladılar. Transformasyon yapan maddeyi saf olarak elde ettiklerini ve transformasyondan sorumlu molekülün DNA olduğunu bidirdiler. DNA’nın genetik materyal olduğunu destekleyen ikinci önemli bulgu, Escherichia coli bakterisinin, konakçısı olduğu viruslardan biri olan T2 bakteriyofaj ile enfeksiyonu çalışmalarından elde edilmiştir. 1952’de Alfred Hershey ve Martha Chase faj proteini ve nukleik asitinin bakteri hücresi ile beraber üreme işlemindeki bağımsız işlevini açıkça ortaya koymuştur. RNA bazı virüslerde genetik materyal olarak görev yapmaktadır. 1956’da tütün mozaik virüsünden (TMV) saflaştırılan RNA, tütün yapraklarına bulaştırıldığında virüsün neden olduğu karakteristik lezyonlar yapraklarda görülmüştür. 1965 ve 1966’da Norman R. Pace ve Sol Spiegelman, QB fajından RNA’nın ayrıştırılıp in vitro olarak replike olabileceğini göstermişlerdir. Replikasyon RNA replikaz denilen bir enzime bağlıdır. Retrovirüslerin replikasyonları olağan dışıdır. Konakçı hücreyi enfekte ettikten sonra RNA’ları tamamlayıcı DNA molekülünün sentezi için kalıp görevi üstlenir. Revers (ters) transkripsiyon olarak bilinen bu işlemi, revers transkriptaz denilen RNA-bağımlı DNA polimeraz enzimi yönlendirir. Sentezlenen bu geçiş DNA’sı viral genetik materyali temsil eder ve konakçının genomuna katılabilir. Polio virüsü ve AIDS hastalığına neden olan insan kazanılmış bağışıklık eksikliği virüsü (human immunodeficiency virus: HIV) retrovirüslere örnektir. DNA’nın yapısını kavramak için nukleik asit kimyasını bilmek gerekir. Nukleotidler: bütün nukleik asit moleküllerinin yapıtaşlarıdır. 3 bileşeni vardır.: 1. Azotlu baz 2. Pentoz şekeri (5-karbonlu şeker) 3. Fosfat grubu Azotlu bazlar iki çeşittir: 1. Dokuz atomlu, iki halkalı purinler 2. Altı atomlu tek halka içeren pirimidinler Nukleik asitlerde yaygın olarak 2 tip purin ve 3 tip pirimidin bulunur. Purinler: Adenin ve guanin (A ve G) Pirimidinler: Sitozin timin ve urasil (S, T ve U) DNA ve RNA’da ortak olarak A, C ve G bulunur; T bazı yalnız DNA’da, U bazı ise yalnız RNA’da vardır. Nukleik asite adını veren taşıdığı pentoz şekeridir. Ribonukleik asitlerde (RNA) riboz, deoksiribonukleik asitlerde (DNA) deoksiriboz bulunur. Deoksiribozda C-2’ pozisyonunda hidroksil gurubu yoktur. C-2’ pozisyonundaki hidroksil gurubunun varlığı RNA’yı DNA’dan ayırır. Azutlu baz + pentoz şekeri = Nukleozit Nukleozit Difosfatlar ve Trifosfatlar Nukleotidler nukleozit monofosfat (NMP) olarak da tanımlanırlar. Bir veya iki fosfat ilavesi ile sırasıyla; nukleozit difosfatlar (NDP) ve nukleozit trifosfatlar (NTP) oluşur. Trifosfat formu çok önemlidir, çünkü hücrede nukleik asit sentezinde öncü molekül olarak rol alır. Hücrede ATP’nin ADP ve inorganik fosfata (Pi), GTP’nin de GDP ve inorganik fosfata hidrolizi ile fazla miktarda enerji açığa çıkar. Sonuç olarak, ATP ve GTP genetik işlemler de dahil birçok hücre faaliyetinde kullanılır. Polinukleotidler İki mononukleotid arasında kurulan bağ yapısında, iki şekere bağlı fosfat grubu yer alır. Oluşan bağ fosfodiester bağıdır. Fosforik asit her iki taraftaki alkol grubu ile ester bağı yapmıştır. Aynı bağ RNA’da da bulunmaktadır. Her iki yapıda da bir C-5’ ucu ve bir C-3’ ucu vardır. İki nukleotit birleştiğinde bir dinukleotit, üç nukleotit birleştiğinde bir trinukleotit oluşturur. 20 ya da daha az sayıda nukleotit içeren zincire oligonukleotit denir. Daha uzunları polinukleotit olarak adlandırılır. Yapıları açık formüllerle çizmek zaman alıcı ve karmaşık olduğu için kısa çizim yöntemi geliştirilmiştir. Dikey olan çizgiler pentoz şekeri temsil eder, azotlu bazlar tepede, C-1’ konumundadır. Ortasında P olan verev çizgi, bir şekerin C-3’ atomu ile komşu şekerin C-5’ atomuna bağlıdır ve bu bağ fosfodiester bağını temsil eder. DNA’da dört bazın mutlaka eş molar miktarlarda bulunması gerekmediği gösterilmiştir. Ayrıca, DNA’nın molekül ağırlığının 106-109 dalton arasında olduğu bulunmuştur. Bu değer, tetranukleotit olamayacak kadar büyüktür. Bugün gerçek olan, DNA’nın çok uzun bir polinukleotit zincirine sahip olduğudur. Uzun polinukleotit zincir yapısı, DNA’nın molekül ağırlığının ve en önemli özelliği olan büyük bir genetik bilgiyi depolayabilme kapasitesini açıklamaktadır. Sadece 1000 nukleotit içeren bir polinukleotit için, her birinin dizilimi diğerinden farklı olan 41000 değişik yapı oluşturulabilir. DNA’nın işlevini kavramanın anahtarı DNA’nın yapısında saklıdır. 1953’de iki genç araştırıcı, James Watson ve Francis Crick, DNA’nın yapısının ikili sarmal şeklinde olduğunu önermiştir (Nature, 302-303). Watson ve Crick’in önerilerini geliştirilmesi için kritik olan bulgular, başlıca iki kaynaktan gelmektedir. Hidroliz edilmiş DNA örneğinin bazı kompozisyon analizi ve DNA’nın X-ışını kırınımı çalışmaları. 1949 ve 1953 arası, Erwin Chargaff ve arkadaşları, birçok organizmadan elde edilen DNA örneklerinden dört bazı ayırmak için kromatografik yöntemleri kullanmıştır. 1. Herhangi bir türde, DNA’daki adenin bazlarının miktarı, timin bazlarının miktarı ile orantılıdır. Guanin bazlarının miktarı ise sitozin bazlarının miktarı ile orantılıdır. 2. Purinlerin (A+G) toplamı pirimidinlerin (C+T) toplamına eşittir. 3. C+G yüzdesinin, A+T yüzdesine eşit olması gerekmez. İki değer arasındaki oran türlere göre büyük değişiklikler gösterir. Bu sonuçlar, DNA molekülünün baz kompozisyonunun kesin profilini göstermektedir. X-Işını Kırınımı Analizi DNA zincirleri X-ışını bombardımanına tutulduğunda molekülün atomik yapısına göre ışınlar saçılır. Saçılım profili fotoğraf filmi üzerinde lekeler halinde belirir ve özellikle moleküldeki düzenli yapılar ve genel görünüm ortaya çıkar. 1938’de William Astbury, bu tekniği DNA üzerinde denemiş ve 1947’de Astbury DNA’da 3.4 Å aralıklarla tekrarlayan düzenli bir yapı saptamıştır. 1950-53 arası, Rosalind Franklin daha saf DNA örneklerinden daha gelişmiş X-ışını verileri elde etmiştir. Rosalind’in çalışmasıda Astbury’nin gördüğü 3.4 Å’luk tekrarlayan yapıların varlığını doğrulamış ve DNA’nın bir çeşit sarmal yapıda bulunduğunu ileri sürmüştür. Watson-Crick Modeli Watson ve Crick 1953’de DNA’nın yapısını aydınlatmışladır. Bu modelin özellikleri: 1. İki uzun polinukleotit zinciri, bir merkez eksen etrafında kıvrılarak, sağ-el ikili sarmal yapısını oluşturur. 2. İki zincir birbirine zıt konumludur, yani iki zincirin C-5’ ucundan C-3’ ucuna doğru olan yönleri birbirine göre tersdir. 3. Her iki zincirin bazları düzlemsel yapıdadır ve dizilimleri eksene dik, bazlar arasında 3.4 Å (0.34 nm) mesafe olacak şekilde birbiri ardına dizilir ve sarmalın içinde yer alır. 4. Karşı zincirdeki azotlu bazlar, hidrojen bağları ile bağlanarak birbirleri ile eşleşirler, DNA’da sadece A=T ve G=C eşleşmesi mümkündür. 5. Sarmalın her bir tam dönümü 34 Å (3.4 nm)’dir. Böylece DNA’nın herbir dönümünde 10 baz yer alır. 6. Molekülün herhangi bir bölümünde eksen üzerinde sıra ile daha geniş olan büyük (majör) oluklar ve daha dar olan küçük (minör) oluklar yer alır. 7. Sarmalın çapı 20 Å (2 nm)’dur. Baz eşleşmesi; modelin genetik açıdan en önemli özelliğidir. Zincirin biri 5’ ucundan 3’ yönüne uzanırken, diğeri 3’ ucundan 5’ yönüne uzanır. Watson ve Crick’in önerdiği modelin anahtarı özgül baz eşleşmesidir. Chargaff’a göre A’nın miktarı T’ye, G’ninki de C’ye eşittir. A=T ve G=C baz eşleşmesi, tamamlayıcılığı (complemantarity) kavramının temelidir. • Neden başka baz eşleşmesi olası değildir? Watson ve Crick A=G ve C=T baz eşleşmesi olasılığını kabul etmemişlerdir. Çünkü bunlar purin-purin ve pirimidin-pirimidin arasındaki eşleşmelerdir. Bu tip bir eşleşmede sarmalın çapı bazı kısımlarda büyük yada 20 Å’dan küçük olacaktır. • Hidrojen bağının önemi nedir ve bu bağ sarmalı dayanıklı kılacak kadar kuvvetli midir? Hidrojen bağı, kovalent bağ ile bağlı bir hidrojen atomu ile çiftleşmemiş bir elektron içeren diğer bir atom arasındaki çok zayıf bir elektrostatik çekimdir. İkili sarmaldaki bazların konumuna göre A, T ile iki H bağı, G, S ile üç H bağı yapar. Tek başına iki yada üç H bağı çok zayıftır, ancak bunların iki bin yada üç bin tanesi arka arkaya geldiğinde sarmala büyük bir dayanıklılık sağlar. Hassas bir ölçümde, DNA’da bir dönüşte Watson ve Crick’in önerdiği gibi 10 değil 10.4 bç bulunduğu gösterilmiştir. Klasik modelde her bir baz çifti sarmal eksen etrafında yanındaki baz çiftine göre 36°° dönüş yaparken yeni ölçümler bunun 34.6°° olduğunu göstermiştir. Sonuçta, her 360°° dönüşte 10 bazdan biraz fazla baz yer almaktadır. Yazarlar 1953’deki yayınlarından 2 ay sonra Nature’da yaptıkları yayında DNA için özgül bir replikayon modeli – semikonservatif modeli (yarı koruyucu) önermişlerdir. Bu ikinci yayında da iki yeni kavram bulunmaktadır: Genetik bilginin DNA’nın baz dizisinde depolandığı ve bazlardaki değişikliğin mutasyona ya da genetik değişikliğe yol açtığıdır. DNA’nın farklı formları bulunur Rosalind Franklin’in X-ışını kırınımı çalışmaları yaptığı DNA’nın B formuna dayanmaktaydı. Bu form düşük tuz derişiminin olduğu sulu ortamda bulunan formdur ve biyolojik olarak önemli olduğuna inanılan yapıdır A-DNA yüksek tuz ya da dehidrasyon koşullarında baskın olan yapıdır. A-DNA, B-DNA’ya göre daha sıkı yapıdadır. Çapı 23 Å olan sarmalın tam bir dönümünde 11 bç yer alır. A-DNA’da sağ el sarmalıdır ancak bazların yönelişleri bir miktar farklıdır. A-DNA’nın biyolojik koşullarda bulunabilmesi şüpheli görünmektedir. Laboratuvar koşullarında incelendiğinde DNA sarmalının sağ el sarmalı gösteren 3 formu daha bulunmuştur. C, D- ve E-DNA. C-DNA, A- ve B-DNA’nın izolasyon koşullarında gözlenenden daha da fazla dehidrasyon koşullarında izolasyon yapıldığında görülür. Samalın tam bir dönüşünde 9.3 baz yer alır dolayısıyla daha sıkıdır. Çapı 19 Å’dur. Diğer iki form olan D- ve E-DNA baz içeriğinde guanin bulunmayan DNA’ların aldığı formdur. Sarmalın tam bir dönüşünde daha az saıda bç bulunmakta olup sırasıyla 8 ve 7.5’dir. Z-DNA olarak adlandırılan DNA’nın bir başka formu da 1979’da keşfedilmiştir. Sadece C-G bç içeren sentetik DNA oligonukleotitleri incelenirken bulunmuştur. Sol el sarmalı özelliğindedir. Çapı 18 Å’dur. Her bir dönüşte 12 bç yer alır ve zikzak konfigürasyonuna sahiptir. B-DNA’da bulunan büyük oluk Z-DNA’da neredeyse kaybolmuştur. Jean-François Allemand ve arkadaşlarının yaptığı son çalışmalar DNA yapay bir şekilde uzatılırsa P-DNA denilen yeni ilginç bir form daha olabileceğini göstermektedir. P-DNA daha uzun, daha incedir ve B-DNA’da yüzeyde bulunan fosfat grupları iç kısımda yer aldığı için oldukça ilginç bir yapıdadır. P-DNA’da her bir dönüşte 2.62 baz yer alır. RNA’nın yapısı kimyasal olarak DNA’ya benzer, ancak RNA tek zincirlidir. RNA’da deoksiriboz yerine riboz şekeri, azotlu baz timin yerine urasil bulunur. RNA çoğunlukla tek zincirli olduğu düşünülmektedir. RNA molekülleri sentezlendikten sonra bazen kendi üzerine katlanarak ikili sarmal bölgeler oluşturur. Genetik materyali RNA olan bazı hayvan virüslerinde RNA ikili sarmal olarak bulunur. Genetik bilginin ifadesinde en az üç hücresel RNA molekülü işlevseldir: Ribozomal RNA (rRNA) Haberci RNA (mRNA) Taşıyıcı RNA (tRNA) Bu moleküller DNA’nın bir zincirinin tamamlayıcı (eşlenik) kopyası olarak transkripsiyon sonucunda sentezlenir. RNA’ların içinde en büyük olanı genelde rRNA’dır ve genellikle hücrede bulunan RNA’ların %80’ini oluşturur. mRNA molekülleri DNA’daki genetik bilgiyi translasyonun meydana geldiği ribozomlara taşır. RNA tiplerinin en küçüğü olan tRNA translasyon sırasında amino asitleri ribozoma taşır. Nukleik Asitlerin Denatürasyonu ve Renatürasyonu İkili sarmal DNA’nın denatürasyonu sonucu H-bağları kopar, çiftli yapı bozulur ve zincirler birbirinden ayrılır. Ancak kovalent bağlar kırılmaz. Isı ya da kimyasal yolla uyarılabilen zincirlerin ayrılması sırasında DNA’nın akışkanlığı azalır, UV absorbsiyonu artar. Isı sonucu oluşan denatürasyon bazen erime (melting) denir. Isıtılan DNA çözeltisinin UV absorbsiyonundaki artışı, hiperkromik kayma olarak adlandırılır ve ölçümü çok kolaydır. G≡C baz çifti, A=T’ye göre bir fazla H bağı içerdiğinden, ısıya karşı daha dayanıklıdır. Bu nedenle, A=T’ye göre daha fazla G≡C çifti içeren DNA’ların tamamen denatüre olması için yüksek sıcaklıklar gereklidir. Eğer erime sırasında, DNA’nın 260 nm’deki absorbsiyonu izlenir ve sıcaklığa karşı grafiğe geçilirse, bir erime profili elde edilir. Bu profilin ya da eğrinin orta noktasına erime sıcaklığı (Tm) denir ve DNA zincirinin %50’sinin açılmış ya da denatüre olduğu noktayı gösterir. Isı ile denatüre edilen DNA yavaşça soğutulursa tamamlayıcı zincirler arasındaki rastgele çarpışmalar sonucu zincirler tekrar bir araya gelir. DNA Replikasyonu ve Rekombinasyonu İnsan genomunu oluşturan 23 kromozomda 3x109 (3 milyar) baz çiftinin yer aldığı bilinmektedir. Bu kromozomların DNA’larının hatasız olarak iki katına çıkartılması için son derece doğru bir mekanizma işlemelidir. Milyonda bir (10-6) hata oranı bile her bir replikasyon döngüsünde 3000 hata demektir ve bu da çok büyük bir rakamdır. Yarı-saklı (semikonservatif) replikasyon olarak bilinen Watson-Crick modeli virüslerde, prokaryotlarda ve ökaryotlarda yapılan çalışmalarla deneysel olarak da desteklenmiştir. DNA, yarı-saklı (semikonservatif) replikasyon modeli ile kendini işler Azotlu bazların yerleşiminden dolayı DNA ikili sarmalının her bir zincirinin tamamlayıcı zincir sentezi için kalıp oluşturabileceğini Watson ve Crick açık olarak kanıtlamışlardır. Eğer T varsa karşısına A çekecektir. G varsa karşısına C çekecektir. Her iki kalıp boyunca bu nukleotidler kovalent bağlarla polinukleotit oluşturduğu taktirde sonuçta birbirine özdeş iki DNA zinciri oluşturacaktır. Kopyalanan her bir DNA molekülünde bir “yeni” bir “eski” zincir bulunacağından bu tip bir çoğalma yarı-saklı (semikonservatif) replikasyon olarak tanımlanır. DNA kopyalanması için, atasal zincirlerin kalıp olarak görev görmesine dayanan iki yol daha düşünülmektedir. Saklı (konservatif) replikasyon tamamlayıcı polinukleotit zincirleri daha önce anlatıldığı gibi sentezlenir, ancak burada iki yeni zincir bir araya gelir ve atasal zincirler tekrar birleşir. Parçalı (dispersif) replikasyon atasal zincirler kopyalama esnasında kırılır ve kırılan DNA parçaları iki yeni çift sarmal içinde dağılır. Böylece herbir zincirde hem eski, hem de yeni DNA bulunur. Meselson-Stahl Deneyi 1958’de Marthew Meselson ve Franklin Stahl, bakteri hücrelerinin yeni DNA moleküllerini yarı-saklı replikasyon ile sentezlediklerine dair kuvvetli kanıtlar ortaya koyan deney sonuçlarını yayınlamışlardır. Azot kaynağı olarak sadece 15NH4Cl (amonyum klorür) içeren ortamda E. coli hücrelerini birçok nesil boyunca üretmişlerdir. Doğal izotopu olan 14N’e göre bir fazla nötron içerir. 15N daha dayanıklıdır. 15N içeren daha yoğun DNA yoğunluk gradient santrifügasyonunda daha alt kısımlarda yer alır. Meselson ve Stahl deneyinde, bir çok nesil sonra E. coli hücrelerinde DNA’daki azotlu bazlar da dahil olmak üzere tüm azot taşıyan moleküller 15N içermiş olur. Daha sonra hücreler yalnız 14NH4Cl içeren ortama aktarılır. Bu ortamda replikasyon sonucu sentezlenen DNA’lar azotun “hafif” izotopunu taşır. Daha sonra hücreler yalnız 14NH4Cl içeren ortama aktarılır. Bu ortamda replikasyon sonucu sentezlenen DNA’lar azotun “hafif” izotopunu taşır. Ökaryotlarda Yarı-Saklı (Semikonservatif) Replikasyon J. Herbert Taylor , Philip Woods ve Walter Hughes 1957’de Meselson ve Stahl’ın çalışmasının yayınlanmasından bir yıl önce ökaryotlarda da replikasyonun yarı-saklı mekanizma ile olduğunu gösteren kanıtı sunmuşlardır. Vicia faba (bakla) bitkisinin kök uçlarını deneylerinde kullanmışlar ve DNA’yı, DNA’nın radyoaktif öncülerinden olan 3H-timidin ile işaretleyerek ve otoradyografisini alarak replikasyonu izlemeyi başarmışlardır. İşaretli izotop ortamında birinci replikasyon döngüsü sonucu kardeş kromatidlerin ikisi de rayoaktivite taşımaktadır, yani her bir kromatitde bir “yeni” sentezlenen radyoaktif işaretli DNA zinciri ve bir de işaretsiz “eski” zincir bulunmaktadır. Replikasyon Orijinleri, Çatalları ve Birimleri Yarı-saklı replikasyon DNA’nın kopyalandığı genel replikasyon modelidir. Kromozom üzerinde DNA’nın replikasyonu nereden başlar? Tek bir orijin mi vardır yoksa sentez birden fazla noktadan mı başlar? Başlangıç noktası rastgele bir yerde mi bulunur yoksa kromozomda özgül bir bölgede mi yer alır? Replikasyon başladıktan sonra tek bir yönde mi yoksa orijinden başlayarak her iki yönde mi ilerler? Başka bir deyişle replikasyon tek yönlü müdür yoksa çift yönlü müdür? Kromozom üzerinde replikasyonun olduğu noktada sarmala ait zincirlerin açılmasıyla ortaya çıkan yapıya replikasyon çatalı adı verilir. Bu çatal önce sentezin orijin noktasında meydana gelir ve replikasyon devam ettikçe ilerler. Replikasyon çift yönlü ise orijinden itibaren zıt yöne doğru ilerleyen iki replikasyon çatalı oluşacaktır. Bir orijinden bir replikasyon başladıktan sonra replike olan DNA’nın uzunluğunun bir birim olduğunu belirtmek için kullanılan terim replikon terimidir. John Cairns, E. coli’de replikasyonun bir orijinden başladığını göstermiştir. oriC olarak adlandırılan bu özgül bölgenin konumu E. coli kromozomu üzerinde haritalanmıştır. Bakteriyofaj ve bakterilerde DNA sentezi bir noktadan başladığı için, kromozomun tümü bir replikondur. Tek bir halkasal kromozoma sahip olan bakterilerde bir orijinin bulunması karakteristiktir. Başka araştırıcılar tarafından ortaya konan çalışmaların sonucuna göre, replikasyon iki yönlüdür ve oriC’nin her iki yönünde hareket eder. Bakterilerdeki DNA sentezinde diğer enzimlerin yanı sıra 3 polimeraz görev alır. DNA Polimeraz I: 1957’de Arthur Kornberg ve arkadaşları E. coli’den in vitro sistemde DNA sentezini yönlendiren bir enzim ayrıştırmışlardır. Bu enzim DNA polimeraz I olarak bilinmektedir. Kornberg DNA polimeraz I’in varlığında in vitro DNA sentezi için başlıca iki gereksinim olduğunu saptamıştır: 1. Dört tip deoksiribonukleozit trifosfat (dATP, dCTP, dGTP, dTTP=dNTP) 2. DNA kalıbı Reaksiyonda 4 dNTP’den herhangi birinin bulunmaması durumunda ölçülebilir bir sentez meydana gelmemiştir. Kalıp DNA ilave edilmezse DNA sentezi gerçekleşmekte ancak büyük oranda azalmaktadır. Uzayan DNA zincirine her bir nukleotitin katılım şekli DNA polimeraz I’in özgüllüğüne bağlıdır. Öncü dNTP’de, d-ribozun 5’-C’una üç adet fosfat grubu bağlıdır. Sentez esnasında uçtaki iki fosfat grubu koparken 5’-C’a bağlı olan fosfat grubu ilave edileceği d-ribozun 3’-OH’ına kovalent bağla bağlanır. Böylece zincir uzaması, uzayan zincirin 3’ ucuna her seferinde bir nukleotit ilavesi ile 5’-3’ yönünde devam eder. DNA sentezi devam ettikçe her basamakta açığa çıkan yeni 3’-OH grubu, DNA sentezi ilerlerken sonraki nukleotitin zincire eklenmesini sağlar. DNA Polimeraz II ve III Peter DeLucia ve John Cairns, DNA polimeraz I aktivitesine sahip olmayan bir mutant E. coli suşu bulmuştur. İşlevsel enzime sahip olmayan bu mutatnt suş DNA’sını kopyalayıp üremeyi başarmış ancak hücreler DNA “onarım” yeteneği bakımından oldukça yetersiz kalmıştır. 1. E. coli’de, in vivo DNA replikasyonu yapabilen başka bie enzim bulunmalıdır. 2. DNA polimeraz I’in in vivo koşullarda ikincil bir işlevi olabilir. DNA polimeraz I’in DNA sentezinin doğru yapılmasından sorumlu olduğu, ancak tamamlayıcı zinciri sentezleyen gerçek enzim olmayabileceği düşünülmüştür. Bu üç enzimin hiçbiri bir kalıptan DNA sentezini başlatamaz, ancak üçü de primer adı verilen (RNA), var olan bir DNA zincirini kalıp boyunca uzatabilir. DNA polimeraz enzimlerinin hepsi molekül ağırlığı 100.000 dalton olan büyük protein kompleksleridir. Her üçünün de 3’-5’ eksonukleaz aktivitesi bulunur. Bu özellik, enzimlerin polimerizasyonu tek yönde gerçekleştirme, bir an duraksayıp geri dönerek ilave edilen nukleotidleri çıkarabilme kapasitelerini ifade etmektedir. DNA polimeraz I, 5’-3’ eksonukleaz aktivitesi de gösterir. Bu sayede enzim, sentezin başladığı uçtan itibaren nukleotidleri kesebilir ve sonra sentez yönünde işlemine devam edebilir. Bu nedenle DNA polimeraz I, RNA primerini de ortamdan uzaklaştırabilir. Hücrede DNA polimeraz I, DNA polimeraz III’e göre daha fazla miktarda bulunur ve daha dayanıklıdır. Polimeraz I, primeri uzaklaştırır ve primerler uzaklaştıkça doğal olarak oluşan boşluklarda DNA sentezleyerek bu bölgeleri doldurur. Eksonukleaz aktivitesi ile, bu işlem esnasında oluşabilecek hataları da onarabilir. Polimeraz II, UV gibi dış etmenler sonucu hasar gören DNA’nın onarımında rol alır. Enzim replikasyon çatalındaki DNA sentezi bozulduğunda aktive olan bir gen tarafından şifrelenmektedir. Replikasyonda gerekli olan ve polimerizasyondan sorumlu asıl enzim olarak Polimeraz III görülmektedir. Enzimin 3’-5’ eksonukleaz aktivitesi, sentez sırasında hata onarımı işlevini görmesini sağlamaktadır. DNA polimeraz III’ün holoenzim olarak adlandırılan aktif formu, 10 farklı polipeptit zincirinden meydana gelmiş bir dimerdir. Molekül ağırlığı 600.000 daltondan fazladır. Molekül ağırlığı 140.000 dalton olan en büyük alt birim olan α, ε, θ (alfa, epsilon ve teta) alt birimleri ile beraber holoenzimin polimerizasyon aktivitesi gösteren “çekirdek” (core) enzim kısmını oluşturur. Kalıp zincirin nukleotit polimerizasyonundan α alt birimi sorumludur. Çekirdek enzimin ε alt birimi, 3’ – 5’ eksonukleaz aktivitesi gösterir. Beş alt birimin (γγ, δ, δ’, x, ψ) oluşturduğu ikinci grup, γ (gama) kompleks olarak adlandırılan bölgeyi oluşturur. Bu γ kompleksi, replikasyon çatalında enzimin kalıba “oturtulmasında” rol alır. Enzimin işlev görmesi için ATP enerjisi gereklidir. β Alt birimi, polimerizasyon sırasında çekirdek enzimin kalıptan kopmasını sağlar. Son olarak, τ (pi) alt birimi, iki çekirdek polimerazın replikasyon çatalında bir arada tutunmasını sağlar. Holoenzim ve diğer çeşitli proteinler, replikasyon çatalında neredeyse ribozom kadar büyük olan replizom olarak bilinen bir kompleks oluşturur. DNA replikasyonu sırasında birçok karmaşık olayın çözülmesi gerekir. Bakteri ve virüslerde replikasyon yarı-saklı ve bir replikonda çift yönlü hareket eder. Sentezin, DNA polimeraz III’ün denetimi altında 5’ den 3’ üne doğru iki replikasyon çatalı oluşturarak gerçekleştiği bilinmektedir. Bu replikasyon çatalları sentezin başladığı noktadan iki zıt yöne doğru hareket etmektedir. 1. Sarmalın yer yer açılması ve her iki zincirde sentezin devam etmesi için bu “açık” konfigürasyonun dayanıklı olmasını sağlayan bir mekanizmanın olması gerekir. 2. Sarmalın açılması ve zincirin daha aşağı kısımlarda tekrar sarılması sonucu ortaya çıkan gerilimi azaltmak için de bir mekanizma bulunmalıdır. 3. DNA polimeraz III’ün polimerizasyonu yönlendirebilmesi için bir çeşit primer sentezlenmelidir. Gerçekten bir primer vardır, ancak primerin DNA değil RNA olması şaşırtıcıdır. 4. RNA primeri sentezlendikten sonra DNA polimeraz III, atasal molekülün her iki zincirinin tamamlayıcısı olan DNA zincirini sentezlemeye başlar. Replikasyon çatalının ilerleme yönünde olan kesintisiz sentez, iki zincirin birbirine antiparalel olduğu için ancak zincirlerden birinde gerçekleşebilir. Diğer zincirdeki sentez zıt yönde ve kesintilidir. 5. Replikasyonun tamamlanmasından önce RNA primerlerinin uzaklaştırılması gerekir. Oluşan geçici boşlukların bulunduğu yerler, kalıp DNA eşlenikliği ile doldurulmalıdır. 6. Boşlukları doldurmak için yeni sentezlenen DNA, yanındaki DNA zinciri ile birleştirilmelidir. 7. Kopyalama sırasında DNA polimerazlar eşlenik bazları doğru biçimde yerleştirmektedir, ancak hata olma olasılığı da vardır. Bazen sentezlenen zincire yanlış bazlar ilave edilebilir. Sentez işleminin bir parçası olan bir hata okuma mekanizması (proofreading) DNA sentezi sırasında oluşan hataları düzeltir. DNA sarmalı açılmalıdır Bakteri ve virüslerin halkasal kromozomlarında, DNA sentezinin başladığı bir orijin noktası bulunur. Bu bölge E. coli kromozomunda çok iyi çalışılmıştır. Replikasyon orijini olan oriC, 9 ve 13 bazdan oluşan (9mer ve 13mer olarak adlandırılır) tekrar dizilerinin bulunduğu 245 baz çifti içerir. DnaA denen özgül bir protein ilk basamakta sarmalın açılmasından sorumludur. DnaA proteininin bazı alt birimleri birçok 9mer dizisine bağlanır. Bu bağlanma, sarmalın daha fazla açılmasında ve kararlılığında rol alan DnaB ve DnaC proteinlerinin bağlanmasını kolaylaştırır. H bağlarını kırıp ikili sarmalı denatüre etmek için normalde ATP hidrolizi ile sağlanan enerjiye gereksinim duyan bu tip proteinler helikazlar olarak adlandırılır. Tek zincire bağlanan proteinler (single-stranded binding proteins, SSBP) olarak bilinen diğer bazı proteinler bu konformasyonu daha da kararlı kılarlar. Sarmalın açılması devam ettikçe, replikasyon çatalının önünde oluşan sarılma gerilimi çoğu kez üstün kıvrılma (super coiling) meydana getirir. Halkasal moleküllerde üstün kıvrılmalar, DNA’daki ek bükülmeler ve dönüşler sonucu oluşturulur. Bu durum aynen bir lastiğin uzatılıp, bir ucundan büküldüğünde ortaya çıkan sarmal yapıya benzer. DNA topoizomerazlar olarak adlandırılan geniş bir enzim ailesinin üyesi olan DNA giraz enzimi, bu tip üstün kıvrılmaları gevşetir. Giraz enzimi tek zincirde ya da her iki zincirde “kırıklar” oluşturur, aynı zamanda üstün kıvrılma oluşumu sırasında meydana gelen bükülmeleri ve düğümleri “açma” hareketleri de katalizler. Oluşan kırıklar sonra tekrar birleştirilir. Bu çeşit replikasyonlarda ATP hidrolizinden açığa çıkan enerji kullanılır. DNA polimeraz kompleksi ve diğer ilgili enzimler hep birlikte, molekülü DNA sentezine katılacak şekilde düzenlerler ve hepsi replizomun bir parçasını oluştururlar. DNA sentezinin başlaması için RNA primerine gereksinim vardır. Sarmalın küçük bir bölümü açıldıktan sonra sentez başlayabilir. DNA polimeraz III’ün polinukleotit zincirini uzatması için, serbest 3’-OH gurubu olan bir primer gereklidir. Önce, kalıp DNA üzerinden DNA’ya eşlenik olan kısa bir RNA parçası sentezlenir. RNA sentezi, primaz denilen RNA polimerazın bir çeşidi tarafından sentezlenir. Primazın sentezi başlatması için serbest 3’ ucu gerekmemektedir. DNA polimeraz III işte bu kısa RNA parçasına 5’-deoksiribonukleotitleri eklemeye başlayarak DNA sentezini başlatır. Daha sonraki bir aşamada, RNA primeri uzaklaştırılmalı ve yerini DNA’ya bırakmalıdır. Bu reaksiyon DNA polimeraz I tarafından katalizlenir. RNA primerinin oluşumu, virüsler bakteriler ve çeşitli ökaryotik organizmalarda tanımlanan, evrensel bir işlemdir. Antiparalel zincirde DNA sentezi kesintili ve kesintisiz olarak gerçekleşir DNA polimeraz III, DNA sentezini yalnız 5’-3’ yönünde gerçekleştirebilir. Sentez, replikasyon çatalı boyunca ve çatalı açarak zincirin birinde bir yönde, diğerinde zıt yönde aynı anda gerçekleşir. Replikasyon çatalı açıldıkça ve aşağı doğru hareket ettikçe, sadece bir zincir sürekli DNA sentezi için kalıp olarak kullanılabilir. Bu zincire kesintisiz DNA zinciri (leading DNA strand) denir. Kesintili DNA zinciri (lagging DNA strand) olarak adlandırılan diğer zincirde, sentez için birçok başlangıç noktası gereklidir ve sonuç olarak bu zincirde kesintili DNA sentezi yapılır. Kesintili DNA sentezini destekleyen kanıtlar, Reiji Okazaki, Tuneko Okazaki ve ark. tarafından elde edilmiştir. E. coli’de bakteriyofaj DNA’sının replikasyonu sırasında yeni sentezlenen DNA’nın bir kısmının, kalıp zincire H bağlarıyla tutunan 1000-2000 nukleotitlik küçük parçalar halinde bulunduğunu göstermişlerdir. RNA primeri bu şekildeki her bir parçanın bir kısmını oluşturmaktadır. Okazaki parçaları (fragmanlar) olarak adlandırılan bu parçacıklar, sentez devam ettikçe, molekül ağırlığı gittikçe artan daha uzun DNA zincirlerine dönüşmektedir. Kesintili DNA sentezinde, RNA primerini uzaklaştıracak ve Okazaki fragmanlarını birleştirecek enzimlere gereksinim vardır. Bilindiği gibi, primerin uzaklaştırılması ve eksik nukleotitlerin yerine konulmasında DNA polimeraz I enzimi sorumludur. Fragmanları birleştirme işi ise DNA Ligaz enzimine aittir. DNA ligaz, fosfodiester bağının oluşumunu katalizleyerek kesintili sentezlenen zincirler arasındaki boşluğu kapatır. Sentez kesintili ve kesintisiz zincirlerde aynı anda yapılır Bu iki zincir aynı replikasyon çatalında aynı anda mı kopyalanır, yoksa bu işlemler enzimin iki ayrı kopyasını içeren farklı olaylar mıdır? Kesintili zincir bir ilmek oluşturduğu taktirde, her iki zincirde birden dimetrik enzimin yönlendirdiği nukleotit polimerizasyonu gerçekleşir. 100-200 baz çiftinin sentezinden sonra enzimin kesintili kol üzerindeki monomeri sentezi tamamlamış bir Okazaki fragmanına rastlar ve o noktada zinciri terk eder. Hemen arkasından kesintili kalıp zincirde yeni bir ilmek oluşur ve işlem tekrarlanır. İşlem oluşumu kalıbın yönünü değiştirir ancak, kesintili zincirde sentezin 5’-3’ olan gerçek yönünü etkilemez. Holoenzimin replikasyon çatalında sentezi kolaylaştıran diğer bir önemli özelliğide, enzimin β alt biriminin yeni oluşan DNA sarmalını saran kıskaç-benzeri dimer yapısıdır. Bu β alt birim kıskacı, çekirdek enzimin (nukleotitlerin ilavesini katalizleyen α, ε ve θ alt birimleri) polimerizasyon süresince kalıptan ayrılmasını engeller. Replikasyon çatalı açılırken, holoenzimin tümü ana sarmal boyunca hareket ettiği için β alt birim dimerine kaygan kıskaç denir. Hata okuma (proofreading) ve düzeltme DNA replikasyonunun ayrılmaz parçasıdır. DNA replikasyonunun temeli, her nukleotiti tamamen kalıp zincirin eşleniği olan yeni bir zincirin sentezlenmesidir. DNA polimeraz, sentezi çok doğru yaptığı halde kusursuz değildir ve zaman zaman eşlenik olmayan bir nukleotit hatalı olarak zincire girebilir. Bu tip hataları gidermek için polimeraz I ve III, 3’ – 5’ eksonukleaz aktivitesi göstererek yanlış eşleşen nukleotiti saptar ve yapıdan çıkarır (3’-5’ yönünde). Yanlış eşleşmiş nukleotit çıkartıldıktan sonra sentez 3’-5’ yönünde yeniden devam eder. Eksonukleaz hata okuması (exonuclease proofreading) denen bu işlem sentezin doğruluğunu arttırır. Holoenzim yapısındaki DNA polimeraz III’ün ε alt birimi, hata onarım basamağına doğrudan katılır. DNA replikasyonu uygun bir model ile açıklanabilir İlerleyen çatalda helikaz enzimi ikili sarmalı açar. Sarmal açılınca, tekrar sarmal oluşmasını engellemek için, açılan zincire tek zincir yapılarına özgül olarak bağlanan proteinler bağlanır. İlerleyen replikasyon çatalında, DNA giraz oluşan üstün kıvrılmaların yarattığı gerilimi azaltma işlevi görür. Polimeraz dimerinin çekirdeğini oluşturan her bir monomer, kalıp zincirlerden birine β-alt birimlerinin oluşturduğu kaygan kıskaç yardımıyla bağlanır. Sentez, kesintisiz zincirde sürekli olarak gerçekleştirilirken, kesintili zincir sentezin her iki zincirde de aynı anda devam etmesini sağlamak için “ilmek” oluşturmalıdır. Kesintili zincirdeki replikasyonda, RNA primerinin yerini DNA’nın alması için DNA polimeraz I ve Okazaki parçalarının birleşmesi için de DNA ligaz işlevi gereklidir. Replikasyon çeşitli genler tarafından kontrol edilir. Ligaz eksikliği ya da hata okuma-eksikliği gibi pekçok mutasyon, kopyalamanın bazı safhalarını engeller ya da ciddi ölçüde bozar. Genetik analizlerde, genellikle bir koşulda kendini gösteren ancak başka bir şekilde gözlenmeyen koşullu mutasyonlar (kondisyonel mutasyonlar) kullanılır. E. coli’de polimeraz I, II ve III’ün alt birimleri, çeşitli genler tarafından şifrelenir. Ökaryotik DNA sentezi prokaryotik DNA sentezine benzer ancak daha karmaşıktır. Bakteri ve ökaryotlarda DNA ikili sarmalı replikasyon orijininde açılarak iki replikasyon çatalı meydana gelir ve DNA polimerazın yönlendirdiği sentez, kesintisiz zincirde ve kesintili zincirde çift yönlü olarak devam eder. Ökaryotik polimerazların DNA sentezi için bakteriyel sistemlerde olduğu gibi; 4 tip deoksiribonuklezit trifosfat Bir kalıp Bir primer’e ihtiyacı vardır. Ancak ökaryotik hücrelerde, hücre başına düşen DNA miktarı daha fazla olduğu için ve bu DNA proteinlerle kompleks yapmış durumda bulunduğu için, bakterilerin karşılaşmadığı sorunlarla yüz yüze gelir. Çoklu Replikasyon Orijini Prokaryotik ve ökaryotik DNA replikasyonu arasındaki en belirgin fark, E. coli kromozomunda bir replikasyon orijini bulunurken, ökaryotik kromozomda birçok replikasyon orijini bulunmasıdır. Birden fazla replikasyon orijininin bulunması; 1. Ökaryotlarda, bakterilere göre daha fazla DNA vardır 2. Ökaryotik DNA polimerazın saniyede 50 nukleotit olan sentez hızı, bakteriyel polimeraza göre 20 kat daha yavaştır. Bu koşullarda, tek bir orijinden başlayan tipik bir ökaryotik replikasyonu ancak bir ayda tamamlanabilecektir. Mayadan elde edilen replikasyon orijinlerine, özerk replike olan diziler (Autonomously replicating sequences, ARS) denir. ARS’ler sentezin etkin olarak başlamasına katkı sağlayan diğer kısa dizilerin yanında yerleşim gösteren 11 bç’lik birimlerden oluşmuştur. Polimerazın bu kadar büyük DNA arasından ARS dizilerini nasıl bulduğu ilişkin açıklama; S fazından önce başlayan bir mekanizmanın bulunmasıdır. Hücre döngüsünün G1 fazı sırasında bütün ARS dizilerine bazı protein grupları bağlanır ve orijin tanıma kompleksi (origin recognition complex, ORC) meydana gelir. ARS dizilerinde yada ORC proteinlerini şifreleyen genlerde her hangi bir mutasyon olursa, DNA sentezinin başlaması gerçekleşmez. Bu tanıma kompleksleri G1 fazında oluştuğu ve S fazından önce sentez başlamadığı için, sentezin gerçek başlama sinyalinde yer alan daha başka proteinler de bulunmalıdır. Bu proteinlerin en önemlileri, özgül kinazlardır. Kinazlar, hücre döngüsünün ayrılmaz bir parçası olan fosforilasyonun kilit enzimleridir. ORC’ye bağlandıklarında, DNA polimerazın bağlanmasına açık olan bir ön replikasyon kompleksi (pre-RC) oluşur. Kinazlar aktive olduklarında, sadece başlama kompleksini tamamlamış olmazlar, aynı zamanda DNA sentezinin tetiğinide çekerler ve her replikasyonda DNA sentezi tamamlana kadar tekrar ön-RC oluşmasını engellerler. Bu mekanizma önemlidir, çünkü kopyalanması tamamlanan DNA parçasını, kopyalanmamış DNA’dan ayırt eder. Böylece kopyala işlemi düzenli ve etkin biçimde sürdürülür. Ökaryotik DNA polimerazlar Enzimin toplam olarak 6 formu saflaştırılıp çalışılmıştır. Polimerazın DNA’ya bağlanabilmesi için, önce sarmalın topolojisinin değişmesi gerekir. Orijin bölgesinde sentezin başlaması tetiklenince, ikili sarmal A=T zengin bir bölgeden açılarak helikaz enziminin girişini sağlar. Helikaz, DNA sarmalını daha da açarak ilerler. Polimerazın sentezi başlatmasından önce, DNA ile kompleks yapmış olan histon proteinlerinin uzaklaştırılması yada modifikasyonu gerekir. DNA sentezi ilerledikçe, histonlar yeni sentezlenen dublekslerle bir araya gelerek, karakteristik nukleozom yapısını yeniden oluşturur. Ökaryotlarda, hücre döngüsünün S fazında yeni histon proteinlerinin sentezi, DNA sentezi ile birlikte gerçekleştirilir. DNA polimerazlardan üçü (α α, δ ve ε) ökaryotik hücrelerde çekirdek DNA’sının replikasyonu için gereklidir. Diğer ikisinin (β β ve ζ) (beta ve zeta) DNA tamirinde rol aldığı düşünülmektedir. Altıncısı ise (γγ) mitokondri DNA’sının sentezinde yer alır. Polimeraz γ, her ne kadar çekirdek genleri tarafından sentezlense de replikasyon işlevi bu organelle sınırlıdır. Çekirdek DNA’sının sentezinin başlatılmasında, polimeraz α ana enzim olarak görülmektedir. Enzimin 4 alt biriminden ikisi, kesintili ve kesintisiz zincir üzerinde RNA primerinin sentezlenmesinden sorumlu olan primaz olarak işlev görür. Diğer bir alt birim, eşlenik deoksiribonukleotitleri RNA primerine takarak primeri uzatır. Böylece, DNA sentezinin ilk evresi başlamıştır. RNA primerine kısa bir DNA dizisi eklendikten sonra, polimeraz değişimi olarak bilinen işlem gerçekleşir. Polimeraz α kalıptan ayrılır, onun yerini pol. δ alır. Bu form, “yüksek işlevselliğe” ve hata düzeltme işlevini yapabilmesini sağlayan 3’-5’ eksonukleaz aktivitesine sahiptir. Ayrıca pol. α’ya göre sentez hızını 100 kez arttırır. Pol. δ’nın yönlendirdiği DNA sentezi devam ederken, zincir uzar ve hata onarımı yapılır. Üçüncü enzim formu olan pol. ε, pol. δ ile aynı özellikleri taşır, ancak değişik hücre koşullarda çalıştığı var sayılmaktadır. Mayada, pol. ε aktivitesini engelleyen mutasyonların ölümcül olması, enzim işlevinin kopyalama sırasında gerekli olduğuna işaret etmektedir. Ökaryotlarda çok fazla replikon olduğu için bakterilere göre çok daha fazla DNA polimeraz molekülü bulunur. Ökaryotlarda, bakteriye göre daha fazla sayıda daha küçük replikon bulunması, ökaryotlardaki daha yavaş sentez hızının yaratabileceği sorunları ortadan kaldırır. Doğrusal kromozomların uçlarının replikasyonu sorunludur. Prokaryotik ve ökaryotik DNA sentezi arasındaki fark, kromozomların yapısı ile ilgilidir. Bakteri ve fajların çoğunda bulunan kapalı halkasal kromozomların tersine, ökaryotlardaki kromozomlar doğrusaldır. Replikasyon sırasında kromozomun telomerik bölgesinin bir parçası olan doğrusal kromozom “uçlarında” özel bir sorunla karşılaşır. Kesintisiz zincirdeki sentez normal olarak kromozom ucuna kadar devam ederken, kesintili zincirde, RNA primeri uzaklaştığında sorun ortaya çıkar. Kesintili sentez sırasında oluşan 3’-OH grubuna nukleotit ilavesi yapılarak yeni oluşan boşluklar doldurulmalıdır. Ancak burası kromozomun ucu olduğu için, 3’-OH grubunu sağlayacak kalıp zincir yoktur. Dolayısıyla, her sentezin sonunda kromozom, teorik olarak, RNA primerinin boyu kadar kısalacaktır. Telomeraz olarak adlandırılan enzimin bulunması, daha karmaşık yapıdaki organizmaların bu problemi nasıl çözdüğünün anlaşılmasına olanak sağlamıştır. Tetrahymena’da telomerlerin çoğu 5’-TTGGGG-3’ dizisi ile sonlanır. Telomeraz, her replikasyon sonrası telomerin kısalmasını önlemek için, TTGGGG tekrar dizilerini yine aynı diziyi içeren kromozom ucuna ilave etmektedir. DNA’nın ucunda TTGGGG dizisi bulunmasa da enzim yinede bu diziyi kromozomun ucuna eklemektedir. O halde, TTGGGG, ne bir sinyal nede telomerazın işlev görmesi için gereklidir. Enzim, yapısında katalitik aktivitesi için gerekli olan kısa bir RNA parçası bulunduran çok özgün yapıda ribonukleoproteindir. Telomerik DNA dizilerinin evrim sürecinde çok sıkı korunmuş diziler olması, telomerlerin işlevlerinin oldukça kritik olduğunu gösterir. Telomerin boyunun kısalmasıyla hücre yaşlanmasının moleküler mekanizması arasında bir bağlantı olduğu bilinmektedir. Ökaryotlarda, somatik hücrelerin çoğunda telomeraz aslında aktif değildir ve bu nedenle, her hücre bölünmesi sonucu kromozomların telomerleri kısalır. Birçok bölünmeden sonra telomerde ciddi aşınmalar olur ve hücre daha fazla bölünme kapasitesini yitirir. Diğer yandan kanser hücrelerinde telomeraz aktivitesi korunmuştur, bu hücreler ölümsüzdür. DNA rekombinasyonu, replikasyonda olduğu gibi özgül enzimler tarafından gerçekleştirilir. Önemli oranda DNA dizi homolojisi içeren iki kromozom boyunca eşdeğer pozisyonlardaki genetik değiş-tokuşa, genel yada homolog rekombinasyon denir. Homolog rekombinasyon, belirli ortak özelliklere sahip çeşitli modellerle açıklanmaya çalışılmıştır. Robin Holliday ve Harold L.K. Whitehouse’un 1964’de, bağımsız olarak ortaya koyduğu modellere dayanmaktadır. Değiş-tokuşun kusursuz olması DNA zincirleri arasındaki eşleniğe bağlıdır. Bütün modellerin temelinde genetik rekombinasyonu gerçekleştirebilmek için bir dizi enzimatik işlemler yer alır. Süreç, iki eşleşmiş DNA dubleksi yada homologları ile başlar. Her bir çiftte, aynı pozisyonda endonukleaz aracılığı tek zincirde kırık oluşur (a). Zincirlerin kesim sonucu ortaya çıkan uçları yer değiştirir ve arkasından diğer dubleksin tamamlayıcı ipliği ile eşleşir (b). Boşta kalan uçlar ligaz ile birleştirilerek heterodubleks DNA molekülleri adı verilen hibrit çiftler oluşturulur (c). Değiş-tokuş sonucu çapraz köprü yapısı ortaya çıkar. Çapraz köprünün pozisyonu, dallanma (branch) göçü olarak adlandırılan işlemle kromozom boyunca hareket eder (d). Bu hareket, fermuarın açılıp kapanmasına benzer biçimde, her bir dubleksin yer değiştiren zincirinin eşlenik bazları arasındaki H bağlarının kırılıp tekrar birleşmesiyle gerçekleşir. Bu hareket sonucu her iki homolog üzerindeki heterodubleks DNA’nın uzunluğu artar. Dubleksler ayrıldığında (f), ve alttaki kısım 180° döndüğünde (g), ki formu (chi form) denilen düzlemsel bir ara yapı oluşur ve karakteristik Holliday yapısı ortaya çıkar. Daha önce değiş-tokuşta yer almamış karşı homologlardaki iki zincir endonukleazla kırılırsa (h), ve tekrar birleşme olursa (i), rekombinant dubleksler meydana gelir. Gen konversiyonu (dönüşümü), DNA’nın rekombinasyonu sonucu ortaya çıkar. Başlangıçta, Carl Lindegren’in mayada ve Mary Mitchell’in Neurospora’da saptadığı gen dönüşümü iki yakın bağlantılı gen arasındaki karşılıklı olmayan (nonresiprokal) genetik değiş-tokuş olarak adlandırılır. Örneğin, her biri değişik mutasyon taşıyan iki Neurospora suşunu çaprazlarsak (a+ X +b), genler arasındaki karşılıklı (resprokal) rekombinasyonla ++ ve ab genotipleri taşıyan spor çiftleri oluşur. Bunun aksine, tek taraflı değiş-tokuşta bu çiftlerden yalnız biri meydana gelir. Bu olayların sıklığı öngörülen mutasyon hızına göre daha yüksektir ve dolayısıyla mutasyondan kaynaklandığı söylenemez. Bunlar, gen konversiyonu olarak isimlendirilir, çünkü, genetik değiştokuşun olduğu yerde bir allel bir şekilde başka bir allele “dönüşmüştür”.