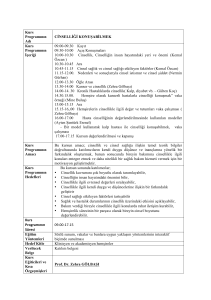
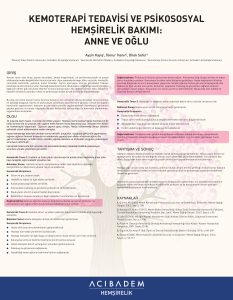
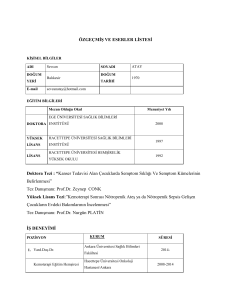
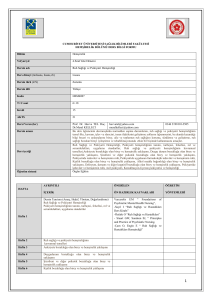
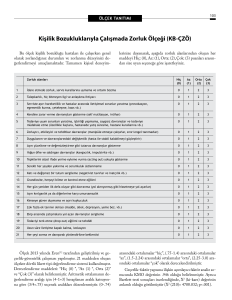
Kanser Biyolojisi
advertisement

ONKOLOJİ HEMŞİRELİĞİ Editör Doç. Dr. Gülbeyaz Can İstanbul Üniversitesi Florence Nightingale Hemşirelik Fakültesi NOBEL TIP KİTABEVLERİ © 2014 Nobel Tıp Kitabevleri Tic. Ltd. Şti. ONKOLOJİ HEMŞİRELİĞİ Editör: Doç. Dr. Gülbeyaz Can ISBN: 978-605-335-068-2 5846 ve 2936 sa­yı­lı Fi­kir ve Sa­nat Eser­le­ri ya­sa­sı hükümleri ge­re­ğince her­han­gi bir bö­lü­mü, res­mi ve­ya ya­zı­sı, ya­zar­la­rın ve ya­yın­la­yı­cı­sı­nın ya­zı­lı iz­ni alın­ma­dan tek­rar­la­na­maz, ba­sı­la­maz, kop­ya­sı çı­ka­rı­la­maz, fo­to­ko­pi­si alı­na­maz ve­ya kop­ya an­la­mı ta­şı­ya­bi­le­cek hiç­bir iş­lem ya­pı­la­maz. Yayımcı : Nobel Tıp Kitabevleri Tic. Ltd. Şti. Millet Cad. No:111 34104 Fatih-İstanbul Yayımcı Sertifika No : 15710 : No-­bel Mat­ba­acı­lık San. Tic. Ltd. Şti. Bas­kı / Cilt Kurtini Mevki, General Şükrü Kanatlı Cad. Ömerli - Hadımköy - İstanbul Matbaa Sertifika No : 12565 Sayfa Tasarımı - Düzenleme : Nobel Tıp Kitabevleri, Özkan Kaya Kapak Tasarım : Özkan Kaya : Ekim 2014 - İstanbul Bas­kı Tarihi ÖNSÖZ Kanser, hem dünyada hem de ülkemizde her geçen gün artış göstermektedir. Nedeni bilinen ölümler sıralamasında kardiyovasküler hastalıklardan sonra ikinci sırada yer alan önemli bir toplum sağlığı problemidir. Kanserin, tedavi ve bakımında multidisipliner bir yaklaşıma gereksinim vardır. Onkoloji hemşireleri, ekibin etkin birer üyesi olarak tedavi sürecinde gerek hastalığın kendisi, gerekse uygulanan tedaviler ve kullanılan ilaçların etkisi ya da bunlara bağlı olmaksızın çeşitli sorunlar ve yan etkiler yaşayan kanser hastalarının bakımını sürdürmektedirler. Kanser tedavisi çoğunlukla karmaşık birkaç tedavinin birlikte kullanımı ile uzun bir süreçte gerçekleştirilmektedir. Değişen ve gelişen sağlık sistemi ile yeni bilimsel gelişmeler kanser bakımına entegre edilmekte ve bu gelişmelere paralel olarak onkoloji hemşireliğinin rolleri de genişlemeye devam etmektedir. Bu doğrultuda onkoloji hemşireliğinde kemik iliği nakli, radyoterapi, cerrahi onkoloji, toplum eğitimi, genetik risk danışmanlığı, önleme programları gibi birçok alt uzmanlık alanları oluşmuştur. Ülkemizde de onkoloji hemşireliği gelişmektedir. İstanbul Üniversitesi, Florence Nightingale Hemşirelik Fakültesi ve İstanbul Üniversitesi Onkoloji Enstitüsü işbirliği ile, 2007, 2010, 2014 yıllarında, onkoloji hemşireliğinde kanıta dayalı uygulamalar, bakım standartları ve bu alanda yapılan araştırmaların klinikte kullanımının değerlendirildiği konsensus toplantıları gerçekleştirilmiştir. Ayrıca son düzenlenen konsensus toplantısı kapsamında, Doç. Dr. Gülbeyaz Can’ın editörlüğünde, ülkemizin ilk ‘’Onkoloji Hemşireliği Kitabı’’ hazırlanmıştır. Onkolojide kanserli birey ve ailesine destek olmak ve bakımı geliştirmek için özelleşmiş bilgi ve beceriye gereksinim vardır. Kitabın bu gereksinimin karşılanmasına ve ülkemiz onkoloji hemşireliğine bilimsel katkı sağlayacağına inanıyor, hazırlanmasında emeği geçen herkese teşekkür ediyor ve saygılar sunuyorum. Prof. Dr. Yunus Söylet İstanbul Üniversitesi Rektörü Haziran, 2014 iii ÖNSÖZ Günümüzde onkolojik hastalıklar giderek artmaktadır. Onkoloji hastalarının tedavi ve bakımı multidisipliner bir ekip yaklaşımı gerektirmektedir ve onkoloji hemşireleri bu ekibin vazgeçilmez, önemli ve bütünleyici üyeleridir. Hemşireliğin uzmanlık alanlarından biri olan onkoloji hemşireliğinin önemi her geçen gün daha da artmaktadır. Son yıllarda onkoloji alanında kanıta dayalı uygulama, kanıta dayalı tıp, kanıta dayalı hemşirelik konularına ilgi hızla artmaktadır. Bu konuya ilişkin toplantılar yapılmakta, araştırma sonuçlarına dayanarak klinik uygulama rehberleri oluşturulmaktadır. Ülkemizde onkoloji hemşireliğinde kanıta dayalı uygulamalar, bakım standartlarının oluşturulduğu konsensus toplantıları İstanbul Üniversitesi Florence Nightingale Hemşirelik Fakültesi İç Hastalıkları Hemşireliği Anabilim Dalı tarafından, Doç.Dr. Gülbeyaz Can’ın öncülüğünde 2007, 2010 yıllarında iki kez yapılmıştır. Bu toplantılarda onkoloji hastalarının semptom yönetiminde etkili girişimler tanımlanmış ve hemşirelik tanıları doğrultusunda kanıta dayalı bakım standartları oluşturulmuştur. 2014 yılında ise, İstanbul Üniversitesi Florence Nightingale Hemşirelik Fakültesi ve İstanbul Üniversitesi Onkoloji Enstitüsü işbirliği ve Florence Nightingale Hemşire Mektepleri ve Hastahaneleri Vakfı’nın desteği ile “Onkoloji Hemşireliğinde Kanıttan Eyleme” temalı üçüncü konsensus toplantısı gerçekleştirilecektir. Onkoloji hemşireliği alanında yapılan araştırmalar, klinikte kullanılabilirliği tartışılacak ve karar kitabı oluşturulacaktır. Bu yılki konsensus toplantısı kapsamında Doç.Dr. Gülbeyaz Can’ın editörlüğünde, ülkemizin ilk Onkoloji Hemşireliği Kitabı hazırlanmıştır. Hemşireliğin profesyonel bir meslek olarak, kendi bilimsel bilgi birikimini oluşturması, hemşirelik bakımını, uygulamalarını bilimsel bilgiye dayalı gerçekleştirmesi son derece önemlidir. Çok kısa bir sürede, büyük bir emek verilerek, zengin bir bilimsel içerik ile, alanlarında yılların birikimine sahip uzman yazarlar tarafından hazırlanan kitap 89 bölüm ve toplam 1126 sayfadan oluşmaktadır. Kitap onkoloji hemşireliği alanına önemli bir bilimsel katkı sağlayacaktır. Onkoloji Hemşireliği kitabının bu konuyla ilgilenen tüm sağlık profesyonellerinin, özellikle bu alanda çalışan hemşirelerin, lisans/lisansüstü hemşirelik öğrencilerin yararlanacağı önemli bir kaynak olacağını düşünüyor ve Doç.Dr. Gülbeyaz Can’ı kutluyorum. Prof. Dr. Nezihe Kızılkaya Beji İstanbul Üniversitesi Florence Nightingale Hemşirelik Fakültesi Dekanı Haziran, 2014 v ÖNSÖZ Kanser, hem dünyada hem de ülkemizde önemli bir sağlık sorunudur. Yönetimi pekçok sağlık uzmanının biraraya gelmesi ile gerçekleşen multidisipliner ekip yaklaşımını gerektirir. Bu ekibin bir üyesi olarak onkoloji hemşiresi kanser bakımının önemli ve bütünleyici bir elemanıdır. Sağlıklı bireyin sağlığın geliştirilmesinden ve korunmasından, kanser tanısı konan bireyin tedavi süreci boyunca çok yönlü desteklenmesinden ve bakımının sürdürülmesinden sorumludur. Günümüzde kanserin tedavisinde cerrahi tedavi, radyoterapi, kemoterapi, immünoterapi, hedefe yönelik tedaviler ve daha pek çok tedavi yaklaşımı tek başına veya birbiri ile kombine edilerek kullanılmaktadır. Ancak son yıllarda moleküler biyoloji ve kanserogenezisle ilgili gelişmeler, kanser tedavisinde de bazı değişimleri beraberinde getirmiştir. Değişen ve gelişen sağlık sistemi de bu alanda yetkin hemşirelerin karmaşık tedavi rejimlerini uygulamasını aynı zamanda hasta ve ailesine bireyselleştirilmiş bakım sunmasını gerekli kılmıştır. Ay- rıca Türk Ceza Kanunun yürürlüğe girmesi ve yeni Hemşirelik Yönetmeliğinin yayınlanması ile sağlık bakım uygulamalarının kanıta dayandırılması gerekliliği artırmıştır. Son on beş yılda onkoloji alanında kanıta dayalı uygulamalara ve bakıma ilgi hızla artmıştır. Bu konuda, onkoloji alanında çalışan klinik hemşireler ve onkoloji alanında uzmanlığını tamamlamış öğretim üyeleri bir araya gelerek toplantılar gerçekleştirilmiş, araştırma sonuçlarına dayanan Ülkemize özgü ortak kararlar alınmış, onkoloji hastasının bakımını planlamada rehber olabilecek klinik rehberler oluşturmuş ve yayınlanmıştır. Bu kaynaklardan biri olan Onkoloji Hemşireliği kitabı da kanser hastasının bakımının planlanmasında bize destek olacak temel kaynaklardan biridir. Çok kısa sürede, Ülkemizin dört bir yanından pek çok sağlık uzmanın desteği ile hazırlanan bu kitabın herkese yararlı olmasını dileyerek, hazırlanmasında emeği geçen tüm hocalarıma ve meslektaşlarıma teşekkür ederim… Doç. Dr. Gülbeyaz Can Editör 16 Haziran 2014 vii İÇİNDEKİLER KISIM I KANSER SORUNU 1 1 Türkiye’de Kanser Kontrolü................................... 3 Ezgi Hacıkamiloğlu, Müjdegül Zayıfoğlu Karaca, Murat Gültekin 2 Kanser Biyolojisi..................................................... 7 Nejat Dalay, Nur Buyru 3 Kanser Epidemiyolojisi........................................ 19 Alptekin Arifoğlu, Nergiz Dağoğlu, Seden Küçücük, Ethem Nezih Oral KISIM II KORUNMA, TARAMA VE TANI 29 4 Kanserden Korunma............................................ 31 Özgül Erol 5 Kanserde Tarama ve Erken Tanı.......................... 41 Nursen O. Nahcivan, Selda Seçginli 6 Kanserde Genetik Risk, Genetik Testler ve Genetik Danışma.................................................. 59 Hülya Yazıcı 7 Kanserde Tanı, Sınıflandırma ve Evrelendirme... 73 Fatma Şen, Adnan Aydıner KISIM III TEDAVİ YAKLAŞIMLARI 93 13 Onkoloji Hastasında Radyoterapi ve Bakım..... 155 Ükke Karabacak, Yasemin Uslu 14 Sitotoksik Kemoterapi Prensipleri..................... 169 İbrahim Yıldız 15 Kemoterapide Tedavinin Planlanması ve Uygulanması....................................................... 191 Fatma Gündoğdu 16 Onkoloji Hastasında Kemoterapi ve Bakım...... 205 Nurcihan Büker, Fatma Şen 17 Hematopoietik Kök Hücre Nakli....................... 215 Yasemin Karacan, Salih Aksu 18 Hematopoietik Kök Hücre Nakli ile İlişkili Komplikasyonlar ve Yönetimi............................ 229 Yasemin Karacan, Salih Aksu 19 Biyoterapi............................................................ 237 Sevgisun Kapucu 20 Hedef Tedaviler................................................... 251 Gülbeyaz Can, Meryem Yıldız 21 Hematopoetik Tedaviler..................................... 267 Leyla Kılıç 22 Onkolojide Kullanılan Tamamlayıcı ve Alternatif Yaklaşımlar........................................ 279 Zeynep Erdoğan, Sezgi Çınar 23 Beslenme ve Kanser............................................ 293 Kader Özcanlı 8 Onkoloji Alanında Sonuç Göstergesi Olarak Yaşam Kalitesinin Kullanımı............................... 95 Rukiye Pınar Bölüktaş KISIM IV SEMPTOM YÖNETİMİ 9 Genel Cerrahi - Güncel Uygulamalar................ 111 Mustafa Hasbahçeci, Mahmut Müslümanoğlu 24 Onkoloji Hemşireliğinde Kanıta Dayalı Yaklaşım.............................................................. 305 Gülseren Kocaman, Havva Arslan Yürümezoğlu 10 Onkoloji Hastasında Cerrahi Tedavi ve Bakım.................................................................. 119 Neriman Akyolcu 303 25 Kanser Ağrısı...................................................... 317 Yasemin Yıldırım 11 Radyoterapinin İlkeleri...................................... 133 Ahmet Kizir, Murat Emin Güveli 26 Yorgunluk........................................................... 335 Öznur Usta Yeşilbalkan 12 Radyoterapide Tedavi Planlaması...................... 147 Şule Karaman, Seden Küçücük, Ethem Nezih Oral 27 Nötropeni ve Enfeksiyon.................................... 347 Sevcan Atay ix x İçindekiler 28 Trombositopeni ve Kanama............................... 355 Ayşin Kayış 47 Özefagus Kanseri................................................ 595 Esra Çıtak, Zeliha Tülek 29 Tat ve Koku Almada Değişim............................. 365 Elif Sözeri 48 Akciğer Kanseri.................................................. 609 Sabire Yurtsever 30 Mukozit............................................................... 371 Ayfer Karadakovan 49 Meme Kanseri..................................................... 619 Özgül Karayurt 31 Bulantı ve Kusma................................................ 385 Mine Buluş 50 Mide Kanseri...................................................... 659 Nuray Akyüz 32 Diyare ve Konstipasyon...................................... 395 Serap Tuna Ünsar 51 Pankreas Kanseri................................................ 669 Yeliz Akkuş 33 Kanser Kaşeksisi................................................. 407 Sevil Özcan, Sezai Vatansever 52 Safra Kesesi ve Kanalı Kanserleri....................... 683 Zeynep Güneş 34 Alopesi................................................................ 421 Hatice Balcı Yangın 35 El-Ayak Sendromu ve Tırnak Değişiklikleri...... 431 Öznur Usta Yeşilbalkan, Ayşe Özkaraman 36 Lenfödem............................................................ 441 Alis Kostanoğlu 37 Radyoterapi Cilt Reaksiyonları.......................... 455 Kenan Ören 38 Ekstravazasyon................................................... 467 Aslı Genç 39 Organ Toksisiteleri............................................. 477 Derya Kaya 40 Periferal Nöropati............................................... 489 Fatma Arıkan, Seda Kurt 41 Cinsellik ve Üreme Sorunları............................. 497 Ümran Oskay 42 Onkolojik Aciller................................................ 517 Semiha Akın 43 Hipersensitivite.................................................. 541 Keziban Özcan 44 Psikososyal Distres............................................. 551 Nihal Bostancı Daştan, Sevim Buzlu KISIM V KANSER HASTASININ BAKIMI 53 Karaciğer Kanseri............................................... 693 Ümmü Yıldız Fındık 54 Kolon, Rektum ve Anal Kanserler...................... 707 İkbal Çavdar 55 Böbrek Kanseri................................................... 719 Tuluha Ayoğlu, Ayfer Özbaş 56 Mesane Kanseri................................................... 731 Ayfer Özbaş 57 Prostat Kanseri................................................... 743 Nevin Kanan 58 Testis Kanseri...................................................... 755 Nevin Kanan 59 Vulva ve Vajina Kanserleri................................. 763 Şule Gökyıldız, Burcu Avcıbay 60 Serviks Kanseri................................................... 783 Nevin Hotun Şahin 61 Endometriyum Kanseri...................................... 797 Ergül Aslan 62 Over Kanseri....................................................... 807 Nezihe Kızılkaya Beji, Dilek Bilgiç 63 Kemik ve Yumuşak Doku Sarkomu................... 841 Öznur Usta Yeşilbalkan, Ayşe Özkaraman 567 64 Lenfomalar.......................................................... 851 Sevinç Kutlutürkan 45 Santral Sinir Sistemi Kanserleri......................... 569 Mukadder Mollaoğlu 65 Multipl Miyelom................................................. 861 Sevinç Kutlutürkan 46 Baş Boyun Kanserleri......................................... 583 Melike Demir Doğan 66 Lösemi ve Myelodisplastik Sendrom................. 867 Sakine Memiş İçindekiler 67 Malign Melanom................................................ 883 Aysel Turan, Berna Şener 68 Endokrin Kanserler............................................ 891 Şeyda Özcan 69 Çocukluk Çağı Kanserleri.................................. 901 Nurseven Karaman, Neriman Sarı KISIM VI KANSER SÜRECİNDE HASTA VE AİLEYE YAKLAŞIM 923 KISIM IX ONKOLOJİ HEMŞİRELİĞİNDE MESLEKİ BOYUT xi 1031 79 Dünyada ve Türkiye’de Onkoloji Hemşireliği....................................................... 1033 Sultan Kav 80 Psikososyal Bakımda Onkoloji Hemşiresi.......................................................... 1043 Nazmiye Kocaman Yıldırım 70 Kanser Sürecinde Hastaya Yaklaşım.................. 925 Figen Albayrak Okçin 81 Klinik Çalışmalarda Onkoloji Hemşiresinin Rol ve Sorumlulukları...................................... 1057 Ümran Karalar 71 Kanser Sürecinde Aileye Yaklaşım..................... 933 Hicran Bektaş 82 Onkoloji Hemşireliğinde Vaka Yönetimi......... 1063 Ayşin Kayış 72 Yaşlı Kanser Hastasına Yaklaşım........................ 943 Nuran Akdemir, Yeliz Akkuş 83 Onkoloji Birimlerinde İnsan Gücü Planlama........................................................... 1069 Rujnan Tuna KISIM VII KANSER SONRASI YAŞAM 84 Türkiye’de Hemşirelik: Haklar ve Sorumluluklar.................................................. 1075 Aytolan Yıldırım 955 73 Sağkalanların Gereksinimleri ve Yaşadıkları Sorunlar.............................................................. 957 Ayfer Elçigil 74 Kanser Tedavisine Bağlı Geç Yan Etkiler........... 967 Semiha Akın 75 Kanser Hastalarında Spritüel Bakım................. 981 Leyla Küçük KISIM VIII PALYATİF BAKIM 85 Yasal Sorunlar................................................... 1085 Halide Savaş 86 Onkoloji Hemşireliğinde Tükenmişlik ve Başetme........................................................ 1095 Azize Atlı Özbaş, Nazmiye Kocaman Yıldırım KISIM X ONKOLOJİDE ÖZEL KONULAR 987 76 Kanserli Hastada Palyatif Bakım....................... 989 Çiçek Fadıloğlu 77 Terminal Dönemde Hastaya Yaklaşım............. 1005 Yasemin Yıldırım, Çiçek Fadıloğlu 78 Ölüm ve Ölümü Anlamak................................ 1021 Arzu Aydoğdu 1107 87 Türkiye’de Pediatrik Onkoloji.......................... 1109 Rejin Kebudi 88 Onkoloji Alanında Koçluk............................... 1115 Fatma Ebru Çınar 89 Gebelik ve Kanser............................................. 1121 Ümran Yeşiltepe Oskay, Şükran Başgöl, Ali Paşa Oskay YAZARLAR Prof Dr. Nuran Akdemir Hacettepe Üniversitesi İç Hastalıkları Hemşireliği Anabilim Dalı Emekli Öğretim Üyesi, Ankara Prof. Dr. Adnan Aydıner İstanbul Üniversitesi Onkoloji Enstitüsü, Tıbbi Onkoloji Bilim Dalı, İstanbul Doç. Dr. Semiha Akın Bahçeşehir Üniversitesi Sağlık Bilimleri Fakültesi, Hemşirelik Bölümü, İstanbul Uzm. Hem. Arzu Aydoğdu İstanbul Üniversitesi İstanbul Tıp Fakültesi Psikiyatri Anabilim Dalı, Konsültasyon Liyezon Psikiyatrisi Bilim Dalı, İstanbul Doç. Dr. Yeliz Akkuş Kafkas Üniversitesi Kars Sağlık Yüksekokulu, Kars Prof. Dr. Salih Aksu Hacettepe Üniversitesi Tıp Fakültesi Hematoloji Bilim Dalı, Ankara Prof. Dr. Neriman Akyolcu İstanbul Üniversitesi Florence Nightingale Hemşirelik Fakültesi, Cerrahi Hemşireliği Anabilim Dalı, İstanbul Yard. Doç. Dr. Nuray Akyüz İstanbul Üniversitesi Florence Nightingale Hemşirelik Fakültesi, Cerrahi Hemşireliği Anabilim Dalı, İstanbul Dr. Fatma Arıkan Akdeniz Üniversitesi Hemşirelik Fakültesi, İç Hastalıkları Hemşireliği Anabilim Dalı, Antalya Dr. Alptekin Arifoğlu Neolife Tıp Merkezi Radyasyon Onkoloji Bölümü, İstanbul Doç. Dr. Ergül Aslan İstanbul Üniversitesi Florence Nightingale Hemşirelik Fakültesi, Kadın Sağlığı ve Hastalıkları Hemşireliği Anabilim Dalı, İstanbul Yard. Doç. Dr. Sevcan Atay Ankara Üniversitesi Sağlık Bilimleri Fakültesi Hemşirelik Bölümü, Ankara MSc Burcu Avcıbay Çukurova Üniversitesi Adana Sağlık Yüksekokulu, Adana Prof. Dr. Sevim Buzlu İstanbul Üniversitesi Florence Nightingale Hemşirelik Fakültesi, Ruh Sağlığı ve Hastalıkları Hemşireliği Anabilim Dalı, İstanbul Nurcihan Büker İstanbul Üniversitesi Onkoloji Enstitüsü, Eğitim Hemşiresi, İstanbul Yard. Doç. Dr. Tuluha Ayoğlu İstanbul Üniversitesi Florence Nightingale Hemşirelik Fakültesi, Cerrahi Hemşireliği Anabilim Dalı, İstanbul Doç. Dr. Gülbeyaz Can İstanbul Üniversitesi Florence Nightingale Hemşirelik Fakültesi, İç Hastalıkları Hemşireliği Anabilim Dalı, İstanbul Şükran Başgöl İstanbul Üniversitesi Florence Nightingale Hemşirelik Fakültesi, Kadın Sağlığı ve Hastalıkları Hemşireliği Anabilim Dalı, İstanbul Doç. Dr. İkbal Çavdar İstanbul Üniversitesi Florence Nightingale Hemşirelik Fakültesi, Cerrahi Hemşireliği Anabilim Dalı, İstanbul Prof. Dr. Nezihe Kızılkaya Beji İstanbul Üniversitesi Florence Nightingale Hemşirelik Fakültesi, Kadın Sağlığı ve Hastalıkları Hemşireliği Anabilim Dalı, İstanbul Doç. Dr. Hicran Bektaş Akdeniz Üniversitesi Hemşirelik Fakültesi, İç Hastalıkları Hemşireliği Anabilim Dalı, Antalya Fatma Ebru Çınar Kişisel Gelişim Uzmanı, Yaşam Koçu Doç. Dr. Sezgi Çınar Celal Bayar Üniversitesi Manisa Sağlık Yüksekokulu, İç Hastalıkları Hemşireliği Anabilim Dalı, Manisa Uzm. Hem. Esra Çıtak S.B. Okmeydanı Eğitim ve Araştırma Hastanesi, İstanbul Yard. Doç. Dr. Dilek Bilgiç Cumhuriyet Üniversitesi Sağlık Bilimleri Fakültesi, Ebelik Bölümü, Sivas Dr. Nergiz Dağoğlu İstanbul Üniversitesi Onkoloji Enstitüsü Radyasyon Onkolojisi Anabilim Dalı, İstanbul Prof. Dr. Rukiye Pınar Bölüktaş Yeditepe Üniversitesi Sağlık Bilimleri Fakültesi, Hemşirelik Bölümü, İstanbul Prof. Dr. Nejat Dalay İstanbul Üniversitesi Onkoloji Enstitüsü, Temel Onkoloji Anabilim Dalı, İstanbul Mine Buluş Hacettepe Üniversitesi Erişkin Hastanesi, KT Özel Dal Hemşiresi, Ankara Yard. Doç. Dr. Nihal Bostancı Daştan Kafkas Üniversitesi Kars Sağlık Yüksekokulu, Kars Prof. Dr. Nur Buyru İstanbul Üniversitesi Cerrahpaşa Tıp Fakültesi, Tıbbi Biyoloji Anabilim Dalı, İstanbul Yard. Doç. Dr. Melike Demir Doğan Gümüşhane Üniversitesi Sağlık Yüksekokulu, Gümüşhane xiii xiv Yazarlar Doç. Dr. Ayfer Elçigil Koç Üniversitesi Hemşirelik Yüksekokulu, İstanbul Dr. Zeynep Erdoğan Marmara Üniversitesi Sağlık Bilimleri Fakültesi Hemşirelik Bölümü, İç Hastalıkları Hemşireliği Anabilim Dalı, İstanbul Doç. Dr. Özgül Erol Trakya Üniversitesi Sağlık Bilimleri Fakültesi, İç Hastalıkları Hemşireliği Anabilim Dalı, Edirne Prof. Dr. Çiçek Fadıloğlu Ege Üniversitesi Hemşirelik Fakültesi, Emekli Öğretim Üyesi, İzmir Doç. Dr. Ümmü Yıldız Fındık Trakya Üniversitesi Sağlık Bilimleri Fakültesi, Cerrahi Hemşireliği Anabilim Dalı, Edirne MSc Aslı Genç Gelişim Üniversitesi Sağlık Bilimleri Yüksekokulu, İstanbul Op. Dr. Mustafa Hasbahçeci Bezmialem Vakıf Üniversitesi Genel Cerrahi Anabilim Dalı, İstanbul Prof. Dr. Sultan Kav Başkent Üniversitesi Sağlık Bilimleri Fakültesi Hemşirelik Bölümü, Ankara Prof. Dr. Nevin Kanan İstanbul Üniversitesi Florence Nightingale Hemşirelik Fakültesi Cerrahi Hemşireliği Anabilim Dalı, İstanbul Derya Kaya İstanbul Üniversitesi Cerrahpaşa Tıp Fakültesi Hastanesi, Hemşirelik Hizmetleri Müdürlüğü, İstanbul Doç. Dr. Sevgisun Kapucu Hacettepe Üniversitesi Hemşirelik Fakültesi, İç Hastalıkları Hemşireliği Anabilim Dalı, Ankara Doç. Dr. Ükke Karabacak Acıbadem Üniversitesi Sağlık Bilimleri Fakültesi Hemşirelik Bölümü, İstanbul Uzm. Dr. Müjdegül Zayıfoğlu Karaca T.C Sağlık Bakanlığı Halk Sağlığı Kurumu, Kanser Daire Başkanlığı, Ankara Uzm. Hem. Ayşin Kayış Acıbadem Atakent Hastanesi, Onkoloji Yönetici Hemşiresi, İstanbul Prof. Dr. Rejin Kebudi İstanbul Üniversitesi Cerrahpaşa Tıp Fakültesi, Çocuk Sağlığı ve Hastalıkları Anabilim Dalı ve Onkoloji Enstitüsü Çocuk Hematoloji-Onkoloji Bilim Dalı Yard. Doç. Dr. Leyla Kılıç Fırat Üniversitesi Tıbbi Onkoloji Bilim Dalı, Elazığ Uzm. Hem. Yasemin Karacan Uludağ Üniversitesi Tıp Fakültesi Hematoloji Bilim Dalı, KİT Koordinatörü, Bursa Prof. Dr. Ahmet Kizir İstanbul Üniversitesi Onkoloji Enstitüsü, Radyasyon Onkolojisi Anabilim Dalı, Enstitü Müdürü, İstanbul Doç. Dr. Murat Gultekin T.C Sağlık Bakanlığı Halk Sağlığı Kurumu, Kanser Daire Başkanlığı, Kanser Daire Başkanı, Ankara Prof. Dr. Ayfer Karadakovan Ege Üniversitesi Hemşirelik Fakültesi, İç Hastalıkları Hemşireliği Anabilim Dalı, Fakülte Dekanı, İzmir Prof. Dr. Gülseren Kocaman Dokuz Eylül Üniversitesi Hemşirelik Fakültesi, Emekli Öğretim Üyesi, İzmir Fatma Gündoğdu Onkoloji Hemşireliği Derneği, Ankara Uzm. Hem. Ümran Karalar İstanbul Üniversitesi Onkoloji Enstitüsü, Klinik Araştırma Hemşiresi, İstanbul Dr. Alis Kostanoğlu İstanbul Üniversitesi İstanbul Tıp Fakültesi, Fizik Tedavi Uzmanı, İstanbul Uzm. Hem. Nurseven Karaman Dr Abdurrahman Yurtaslan Ankara Onkoloji Eğitim ve Araştırma Hastanesi, Pediatrik HematolojiOnkoloji Kliniği, Ankara MSc Seda Kurt Trakya Üniversitesi Sağlık Bilimleri Fakültesi, Hemşirelik Bölümü, İç Hastalıkları Hemşireliği Anabilim Dalı, Edirne Dr. Şule Karaman İstanbul Üniversitesi Onkoloji Enstitüsü, Radyasyon Onkolojisi Anabilim Dalı, İstanbul Yard. Doç. Dr. Sevinç Kutlutürkan Gazi Üniversitesi Sağlık Bilimleri Fakültesi, İç Hastalıkları Hemşireliği Anabilim Dalı, Ankara Doç. Dr. Özgül Karayurt Dokuz Eylül Üniversitesi Hemşirelik Fakültesi, Cerrahi Hemşireliği Anabilim Dalı, İzmir Doç. Dr. Seden Küçücük İstanbul Üniversitesi Onkoloji Enstitüsü Radyasyon Onkolojisi Anabilim Dalı, İstanbul Yard. Doç. Dr. Şule Gökyıldız Çukurova Üniversitesi Adana Sağlık Yüksekokulu, Adana Doç. Dr. Zeynep Güneş Adnan Menderes Üniversitesi Aydın Sağlık Yüksekokulu, Hemşirelik Bölümü, İç Hastalıkları Hemşireliği Anabilim Dalı, Aydın Uzm. Dr. Murat Emin Güveli İstanbul Üniversitesi Onkoloji Enstitüsü, Radyasyon Onkolojisi Anabilim Dalı, İstanbul Uzm. Dr. Ezgi Hacıkamiloglu T.C Sağlık Bakanlığı Halk Sağlığı Kurumu, Kanser Daire Başkanlığı, Ankara Yazarlar Doç. Dr. Leyla Küçük İstanbul Üniversitesi Florence Nightingale Hemşirelik Fakültesi, Ruh Sağlığı ve Hastalıkları Hemşireliği Anabilim Dalı, İstanbul Doç. Dr. Sakine Memiş Adnan Menderes Üniversitesi Aydın Sağlık Yüksekokulu, İç Hastalıkları Hemşireliği Anabilim Dalı Başkanı, Aydın Prof. Dr. Mukadder Mollaoğlu Cumhuriyet Üniversitesi Sağlık Bilimleri Fakültesi, Sivas Prof. Dr. Mahmut Müslümanoğlu İstanbul Üniversitesi İstanbul Tıp Fakültesi Genel Cerrahi Anabilim Dalı, Bezmialem Vakıf Üniversitesi Genel Cerrahi Anabilim Dalı, İstanbul Prof. Dr. Nursen O. Nahcivan İstanbul Üniversitesi Florence Nightingale Hemşirelik Fakültesi, Halk Sağlığı Hemşireliği Anabilim Dalı, İstanbul Yard. Doç. Dr. Figen Albayrak Okçin Ege Üniversitesi Hemşirelik Fakültesi, İç Hastalıkları Hemşireliği Anabilim Dalı, İzmir Prof. Dr. Ethem Nezih Oral İstanbul Üniversitesi Onkoloji Enstitüsü Radyasyon Onkolojisi Anabilim Dalı, İstanbul Dr. Ali Paşa Oskay Ethica İncirli Hastanesi, İstanbul Doç. Dr. Ümran Oskay İstanbul Üniversitesi Florence Nightingale Hemşirelik Fakültesi, Kadın Sağlığı ve Hastalıkları Hemşireliği Anabilim Dalı, İstanbul xv Arş. Gör. Dr. Azize Atlı Özbaş Hacettepe Üniversitesi Hemşirelik Fakültesi Psikiyatri Hemşireliği Anabilim Dalı, Ankara Berna Şener İstanbul Üniversitesi Onkoloji Enstitüsü, Kemoterapi Hemşiresi, İstanbul Uzm. Hem. Keziban Özcan Akdeniz Üniversitesi Hastanesi Prof Dr Mustafa SAMUR Kemoterapi Ünitesi, Antalya Dr. Rujnan Tuna İstanbul Üniversitesi, Florence Nightingale Hemşirelik Fakültesi, Hemşirelikte Yönetim Anabilim Dalı, İstanbul Uzm. Hem. Sevil Özcan İstanbul Üniversitesi Onkoloji Enstitüsü, Beslenme Hemşiresi, İstanbul Doç. Dr. Şeyda Özcan Koç Üniversitesi Hemşirelik Yüksekokulu, İstanbul Kader Özcanlı Onkoloji Hemşiresi, İstanbul Ayşe Özkaraman Eskişehir Osmangazi Üniversitesi Eskişehir Sağlık Yüksek Okulu, Eskişehir Doç. Dr. Neriman Sarı Dr Abdurrahman Yurtaslan Ankara Onkoloji Eğitim ve Araştırma Hastanesi, Pediatrik HematolojiOnkoloji Kliniği, Ankara Av. Halide Savaş İstanbul Barosu, Sağlık Kurumları Yönetimi Bilim Uzmanı, İstanbul Yard. Doç. Dr. Selda Seçginli İstanbul Üniversitesi Florence Nightingale Hemşirelik Fakültesi, Halk Sağlığı Hemşireliği Anabilim Dalı, İstanbul Arş. Gör. Elif Sözeri Gazi Üniversitesi Sağlık Bilimleri Fakültesi Hemşirelik Bölümü, İç Hastalıkları Hemşireliği Anabilim Dalı, Ankara Kenan Ören Amerikan Hastanesi Radyasyon Onkolojisi, Radyasyon Onkolojisi Hemşiresi, İstanbul Doç. Dr. Nevin Hotun Şahin İstanbul Üniversitesi Florence Nightingale Hemşirelik Fakültesi, Kadın Sağlığı ve Hastalıkları Hemşireliği Anabilim Dalı, İstanbul Doç. Dr. Ayfer Özbaş İstanbul Üniversitesi Florence Nightingale Hemşirelik Fakültesi, Cerrahi Hemşireliği Anabilim Dalı, İstanbul Doç. Dr. Fatma Şen İstanbul Üniversitesi Onkoloji Enstitüsü, Tıbbi Onkoloji Bilim Dalı, İstanbul Aysel Turan İstanbul Üniversitesi Onkoloji Enstitüsü, Ameliyathane Hemşiresi, İstanbul Yard. Doç. Zeliha Tülek İstanbul Üniversitesi Florence Nightingale Hemşirelik Fakültesi, İç Hastalıkları Hemşireliği Anabilim Dalı, İstanbul Öğr. Gör. Yasemin Uslu Acıbadem Üniversitesi Sağlık Bilimleri Fakültesi Hemşirelik Bölümü, İstanbul Doç. Dr. Serap Tuna Ünsar Trakya Üniversitesi Sağlık Bilimleri Fakültesi, Hemşirelik Bölümü, İç Hastalıkları Hemşireliği Anabilim Dalı, Edirne Prof. Dr. Sezai Vatansever İstanbul Üniversitesi Onkoloji Enstitüsü, Tıbbi Onkoloji Bilim Dalı, İstanbul Doç. Dr. Hatice Balcı Yangın Akdeniz Üniversitesi Hemşirelik Fakültesi, Antalya Prof. Dr. Hülya Yazıcı İstanbul Üniversitesi Onkoloji Enstitüsü, Kanser Genetiği Bilim Dalı, İstanbul Doç. Dr. Öznur Usta Yeşilbalkan Ege Üniversitesi Hemşirelik Fakültesi, Ege Üniversitesi Hemşirelik Fakültesi, İç Hastalıkları Hemşireliği Anabilim Dalı, İzmir Prof. Dr. Aytolan Yıldırım İstanbul Üniversitesi Florence Nightingale Hemşirelik Fakültesi, Hemşirelikte Yönetim Anabilim Dalı, İstanbul xvi Yazarlar Doç. Dr. Nazmiye Kocaman Yıldırım İstanbul Üniversitesi İstanbul Tıp Fakültesi Psikiyatri Anabilim Dalı, Konsültasyon Liyezon Psikiyatrisi Bilim Dalı, İstanbul Doç. Dr. Yasemin Yıldırım Ege Üniversitesi Hemşirelik Fakültesi, İç Hastalıkları Hemşireliği Anabilim Dalı, İzmir Uzm. Dr. İbrahim Yıldız Katip Çelebi Üniversitesi, İzmir Atatürk Eğitim ve Araştırma Hastanesi, İzmir Prof. Dr. Sabire Yurtsever Mersin Üniversitesi Sağlık Yüksekokulu Hemşirelik Bölümü, Mersin Meryem Yıldız Karamanoğlu Mehmetbey Üniversitesi, Sağlık Yüksekokulu, İç Hastalıkları Hemşireliği Anabilim Dalı, Karaman Yard. Doç. Dr. Havva Arslan Yürümezoğlu İzmir Üniversitesi Sağlık Yüksekokulu, İzmir KISIM I KANSER SORUNU Türkiye’de Kanser Kontrolü Ezgi Hacıkamiloğlu, Müjdegül Zayıfoğlu Karaca, Murat Gültekin Giriş Kanser, hem dünyada hem de ülkemizde sebebi bilinen ölümler sıralamasında kardiyovasküler hastalıklardan sonra ikinci ölüm sebebi olması açısından önemli bir toplum sağlığı problemidir. Yeni yayımlanan kanser istatistiklerine göre 2012 yılında Dünya’da toplam 14,1 milyon yeni kanser vakası gelişmiş ve 8,2 milyon kansere bağlı ölüm olmuştur [1]. Dünya’da en çok tanı konulan kanserler akciğer (%13,0), meme (%11,9) ve kolon (%9,7) iken kanserden ölümler ise en çok akciğer (%19,4), karaciğer (%9,1) ve mide kanserinden (%8,8) gerçekleşmektedir. Kanserde benzer seyir devam ettiği takdirde 2030 yılına gelindiğinde yıllık 22 milyon yeni vaka ortaya çıkması, yani 2008 verilerine göre yeni vakalarda %75 artış olması beklenmektedir [2]. Dünya Sağlık Örgütü Uluslararası Kanser Araştırma Ajansı (IARC) yeni kanser istatistiklerinde özellikle kadın kanserlerine dikkat çekmiştir. En son verilere göre, sınırlı sayıda birkaç Afrika ülkesi haricinde Dünya genelinde kadınlarda en sık görülen kanser meme kanseri olmuştur. Kadınlarda meme kanser insidansının bir önceki tahmin- 1 lere göre %20, meme kanserinden ölümlerin ise %14 arttığı belirtilmiştir. Meme kanseri kadın kanserleri içinde en fazla görülen ve en fazla ölüme neden olan kanserdir. Dünyada kanser olan her 4 kadından biri meme kanseridir. IARC meme kanserindeki bu artışın özellikle yaşam koşullarındaki değişiminden kaynaklandığını ifade etmiştir ve özellikle az gelişmiş ülkelerde meme kanserinin erken teşhis, tarama ve tedavisine yönelik çabaların arttırılması gerekliliği üzerinde durulmuştur. Kanser %90 oranında çevresel, %10 oranında ise genetik faktörlere bağlı oluşmaktadır. Çevresel faktörler arasında da tütün, obesite, sağlıksız beslenme, aşırı tuz kullanımı, alkol ve enfeksiyöz hastalıklar en önemli faktörler arasındadır. Son yıllarda giderek artan obesitenin de önümüzdeki yıllar içerisinde meme kanserinde olduğu gibi, genel kanser tiplerinin sıralamasını değiştireceği düşünülmektedir. Dünya genelinde kanserlerin en az üçte biri önlenebilir, bir diğer üçte biri ise taramalar ile erken teşhis edilip tedavi edilebilir kanserlerdir. Özellikle ortaya çıkışının önlenebildiği, taramalarla ölümün yok edilebildiği ve erken teşhis edildiğinde tedavinin yaşam kalitesine çok şey katabildiği kanser türlerini göz önüne alırsak korunmanın önemi artmaktadır. 3 4 KISIM I: KANSER SORUNU 2014 Türkiye’de Kanser ile Mücadele Kanser Kayıtçılığı Kanser Daire Başkanlığımızın en son resmi verilerine göre ülkemizde yaklaşık 162.000 yeni kanser olgusu teşhis edilmektedir. Kanser sıklığı erkeklerde yüzbinde 269.7, kadınlarda ise yüzbinde 173,3’dür. Ülkemizde erkeklerde en sık akciğer kanseri (%28), kadınlarda ise meme kanseri (%24) görülmektedir [3]. Ülkemizde kadınlarda ve erkeklerde görülen diğer kanserlerin yüzde dağılımları Şekil 1 ve 2’de verilmiştir. Ülkemizde bölgeler arasında kanser tipleri arasında bazı farklılıklar görülmekle birlikte; kanser görülme sıklığı açısından anlamlı bir fark görülmemektedir. Türkiye Ulusal Kanser Kontrol Programını dünya genelinde ilk başlatan ülkeler arasındadır. 2013-2018 yılları için revize edilen yeni kanser kontrol programımıza bu yıl IARC, IPRI ve UICC-Dünya Kanser Liderleri zirvesinde en başarılı programlar arasında gösterilmiş ve uluslararası kanser kontrol kitaplarında yer verilmiştir [4]. Kanser kontrolünde en önemli yapıtaşı elinizde doğru, tam ve güvenilir veri olmasıdır. Dünya nüfusunun aktif kanser kayıtçılığı açısından sadece %8’i takip edilirken, 2013 yılında ülkemizde bu oran %50’ye ulaşmıştır. 2014 yılında kurulum aşaması bitecek olan yeni merkezlerimiz ile 81 ilimizde de aktif kanser kayıt merkezi hizmetleri başlayacak ve %100 kapsama oranına ulaşılacaktır. 2013 yılında kurulan Ölüm Bildirim Sistemleri ile ilk defa ulusal çapta kanser tiplerine özel yaşam süreleri analizleri de başlatılmıştır. 2013 yılında Uluslararası Kanser Araştırma Ajansı (IARC) tarafınca dünya kanser verilerinin hesaplandığı sayılı merkezler arasına İzmir, Antalya, Trabzon ve Edirne Kanser Kayıt Merkezleri de dâhil olmuştur. İzmir Kanser Kayıt Merkezi 20 yıllık deneyimi ve sürekliliği nedeniyle 2013 yılında Uluslararası Kanser Ajansı (IARC) tarafından Kuzey Afrika ve Doğu Akdeniz bölgesinde yer alan ülkeler için kanser kayıtçılığı eğitim merkezi olmuştur. Özellikle kanser kayıtçılığı konusunda çok önemli uluslararası etkinlikleri bulunan Ortadoğu Kanser Konsorsiyumu’nun (MECC) merkezinin de Türkiye’ye taşınma kararı alınmıştır. Kanseri Önleme Dünyada ve Türkiye’de kanserin önemli bir kısmı önlenebilen kanserlerdir. Özellikle ülke verilerimiz değerlendirildiğinde tütün ve obesite ile mücadele programımız kanser kontrolünün en önemli yapıtaşlarını oluşturmaktadır. Hiç kuşkusuz ki kanser tedavi üzerine yapılan yatırımlar ile değil, ancak önleme ve erken teşhis üzerine yöneltilen Şekil 1. Tüm yaş gruplarındaki erkeklerde en sık görülen bazı kanserlerin bu grup içindeki yüzde dağılımları (Birleşik Veri Tabanı, 2009). Şekil 2. Tüm yaş gruplarındaki kadınlarda en sık görülen bazı kanserlerin bu grup içindeki yüzde dağılımları (Birleşik Veri Tabanı, 2009). Şekil 3. Yaşa Standardize İnsidans Hızlarının Cinsiyete Göre 2004-2009 Yılları Arasındaki Dağılımı (Birleşik Veri Tabanı, 20042009) (Dünya Standart Nüfusu,100.000 Kişide). BÖLÜM 1: Türkiye’de Kanser Kontrolü eylem planları ile kontrol altına alınabilir. Bunlarla beraber alkol ile mücadele, fiziksel aktivetinin arttırılması, tuzun kısıtlı kullanılması, enfeksiyon ajanları ile mücadele de çok önemli unsurlardır. Ülkemizde bunlara ilaveten ev içerisinde izolasyon ya da badana amaçlı kullanılan asbest ile mücadeleye yönelik değerli akademisyen hocalarımız ile birlikte Asbest Stratejik Eylem Planını başlattık ve 2013 yılında 1600’den fazla yerleşim yerinden örnek alınmasını tamamladık. 2014 yılında çıkacak sonuçları da değerli akademisyen hocalarımız ile paylaşacak ve gerekli kontrol programlarını başlatacağız. Benzer şekilde 2013 yılında TAEK ile Türkiye Ev İçi Radon Düzeyini belirleme hususunda ortak çalışma protokolü imzaladık. Bu yıl içerisinde TUİK tarafınca bilimsel olarak rastgele seçilmiş 65.000’in üzerinde evde radon ölçüm çalışmaları başlatacağız. Son yıllarda dünya genelinde giderek yasaklanan solaryumlardan kaynaklı ultraviyole ışınlara karşı maruziyeti azaltacak mevzuatlarımızı da 2014 yılında yayımlayacağız. 2013 yılında Daire Başkanlığımız Dünya Sağlık Örgütü elektromanyetik alan sağlık etkilerini değerlendirme komisyonuna dâhil edilmiştir. Bu konuda mevcut bilimsel verileri danışman hocalarımızla yakın takip etmekteyiz. 2014 yılında çocukluk yaşlarında cep telefonu kullanımına bağlı elektromanyetik alan maruziyetini minimale indirmek için de bir takım çalışmalar başlatılmıştır. Kanser konusunda doğru bilinen yanlışlara yönelik mücadelemiz de sürecektir. Kamuoyunda tartışılan konuları ulusal ve uluslararası danışmanlarımız ile görüşmekte ve nihai bilimsel raporları www.kanser.gov.tr adresinden yayımlamaktayız. 2013 yılında yaklaşık 20’nin üzerinde bilimsel rapor ve 30’un üzerinde de epidemiyolojik çalışma tamamlanmış ve halkımıza doğru bilginin ulaşması sağlanmıştır. Kanserde Tarama ve Erken Teşhis Kanser tarama programlarımızla, Kanser Erken Teşhis, Tarama ve Eğitim Merkezlerinde (KETEM), “Erken teşhis hayat kurtarır!” prensibiyle meme, kolorektal ve serviks kanserlerine karşı tarama hizmetleri ücretsiz olarak verilmektedir. 2013 yılı itibari ile her ilde en az 1 tane olmak üzere toplam KETEM sayımız 134’e yükselmiştir. Ülke çapında 134 KETEM bulunmaktadır. KETEM’lerde mamografi ile meme taraması, smear ile rahim ağzı kanseri taraması ve gaitada gizli kan ile barsak kanseri taramaları yapılmaktadır. Zaman zaman bu hizmetler aile hekimleri ve toplum sağlığı merkezleri vasıtasıyla köylere kadar ulaştırılmaktadır. Kanserlere yönelik tarama hizmetleri yanı sıra 5 halk eğitimleri düzenlenerek vatandaşlarımız kanser ve risk faktörleri konularında bilgilendirilmektedir. Vatandaşlarımızın kanser taramalarına daha kolay ulaşabilmeleri için Mobil KETEM araçlarımızla yaptığımız pilot çalışmalar sona ermiş ve 130 adet gezici araç için ihale çalışmaları başlatılmıştır. Rahim ağzı kanser taramalarında HPV DNA testlerine yönelik çalışmalarımızda tamamlanmıştır. 2012 yılı ile kıyaslandığında yurt genelinde ve KETEM’lerde kanser taramaları yaptıran vatandaşlarımızın sayısı çok önemli artış göstermiş ve yıllık hedef nüfusun önemli bir kısmı kanser taramalarını tamamlamıştır. Bu başarıda rolü olan tüm sağlık personelimize, KETEM ve Toplum Sağlığı Merkezi çalışanlarımıza, aile hekimlerimize, sivil toplum kuruluşlarımıza ve en önemlisi de katılım gösteren vatandaşlarımıza teşekkür etmek isteriz. Tedavi ve Palyatif Bakım Kanser tedavisi gören hastalarımızın ağrı kontrolünde kullanılan ilaçlara ulaşabilmeleri için yerli ağrı kesici ilaç üretim çalışmaları Hacettepe Üniversitemizce tamamlanmıştır. Benzer şekilde ilk defa ulusal ilaç firmalarımızca yerli kemoterapiler üretilmeye ve hatta ihraç edilmeye başlanmıştır. 2013 yılı içerisinde ilk defa yerli tam otomatik ilaç hazırlama cihazlarının üretimi de tamamlanmıştır (5). Radyoterapi ve kemoterapi merkezlerimizi 2023 planlamamıza göre yaygınlaştırma çalışmalarımız da devam etmektedir. Türkiye’de uluslararası standartlara göre uygulanan tedavilere bütün vatandaşımız kolayca ve ücret ödemeden ulaşabilmektedir. Ayrıca, kanserle mücadele eden ve hayatının son günlerini yaşayan hastalarımızı rahat ettirebilmek, her türlü ihtiyacını karşılayabilmek, fiziksel, ruhsal ve psikososyal yönden destekleyebilmek için geçen yıl pilot olarak uygulamaya koyduğumuz Palyatif Bakım Ünitelerini yurt genelinde yaygınlaştırmayı hedeflemekteyiz. KAYNAKLAR 1. 2. 3. 4. 5. Globocan 2012, www.iarc.fr Stewart BW, Wild CP. World Cancer Report 2014, http://www. iarc.fr/en/publications/books/wcr/index.php (Erişim tarihi: 2 Mayıs 2014) www.kanser.gov.tr Tuncer M. Ulusal Kanser Kontrol Programı. 1. Basım. Türkiye Cumhuriyeti Sağlık Bakanlığı, 2009. Ozgul N, Gultekin M, Koc O, et al. Turkish community-based palliative care model: a unique design. Ann Oncol 2012; 23(Suppl 3):768. Kanser Biyolojisi 2 Nejat Dalay, Nur Buyru Giriş Kanser anormal hücre büyümesi ve çoğalması ile tanımlanan multifaktöryel bir hastalık olup birincil nedeni DNA’nın doğru şekilde eşlenmesini önleyen genetik kararsızlıktır [1]. DNA doğru şekilde kopyalanmadığı zaman mutasyonlar oluşur ve bu da kanser oluşmasına zemin hazırlar. Diğer yandan, bu mutasyonlar bir ya da daha fazla sayıda nedenden kaynaklanabilir. Ancak, kanser genel olarak genetik, sistemik ve çevresel olmak üzere üç değişik faktörün birbiri ile etkileşimi sonucunda gelişir [2]. Çevresel faktörler arasında beslenme, endüstriyel kirlilik ve virüsler yer alırken immün sistemde görülen bozulmalar sistemik etkenlerdir [3]. Bunun yanısıra, onkogenlerin etkinleşmesine yol açan mutasyonlar ile aileden kalıtılan bazı mutasyonlar ve genleri etkileyen kromozomal değişiklikler de genetik faktörleri oluşturur [4]. Genetik ve çevresel faktörlerin etkileşiminde p450 sistemi gibi metabolik yolaklar da kritik bir öneme sahiptir. Sonuç olarak, kanser kalıtımsal ailevi genetik sendromlara bağlı olarak gelişebileceği gibi farkında olmadan ya da bilerek maruz kalınan çevresel faktörlerin ya da karsinojenlerin etkisiyle de ortaya çıkabilir. Çoğunlukla bu mekanizmaların ayrı ayrı etkilerinin ardışık bir dizi aşama süresince birikmesiyle hücrenin normal işlevleri giderek bozulur ve buna bağ- lı olarak gittikçe artan genetik kararsızlık hücrenin kanser hücresine dönüşmesiyle sonuçlanır. Bu süreci en iyi tanımlayan modellerden birisi Vogelstein ve Kinzler tarafından önerilen ve kolon kanserinin gelişmesini simgeleyen modeldir (Şekil 1) [5,6]. Sebep ve etken ne olursa olsun, her durumda hücredeki temel bozukluk DNA’daki hasardır. Kanser DNA hasarı taşıyan kusurlu hücrenin ya da hücre klonunun denetimsiz çoğalması ve yeni değişimler geçirmesi ile seyreden bir hastalıktır. Hücre bölünmesi sırasında DNA’nın kopyalanması aşamasında oluşan herhangi bir hasar veya mutasyon fenotipik lezyonlara yol açabilir. Gerçekleşen bu mutasyonlar DNA sentez/onarım sistemini veya hücre döngüsünü kontrol eden yolaklarda (cdc7 ve cdk genleri) ya da büyüme faktörü reseptörleri veya bunların ligandları ile ilişkili yolaklarda (örneğin, c-Met) yer aldığında karsinogenez potansiyelinde önem taşıyabilir. DNA’da oluşan çok sayıdaki genetik ve epigenetik değişiklikler sonucunda hücreler giderek daha malin özellikler kazanır ve sonunda tümör hücresine dönüşür. Bu değişimler hücrelerin hem birbirleri ile hem de hücre-dışı matris ile etkileşimini değiştirdiği gibi hücre içerisinde gerçekleşen karmaşık sinyal iletisini de bozar. Normal hücrelerde hücre büyümesi ve çoğalması çok sıkı bir denetim altındayken tümör hücrelerinde bu kontrol mekanizmaları işlevini yitirir. Başlangıç noktasın- Şekil 1. Kolon karsinogenezinde kanser hücresinin geçirdiği aşamalar ve ilgili değişiklikler. 7 8 KISIM I: KANSER SORUNU da ortaya çıkan kanserli hücreler (primer tümör) vücudun diğer bölgelerine de yayılma potansiyeline sahiptir (ikincil tümör). Kontrol mekanizmalarının kaybı 3 önemli gruptaki genlerde gerçekleşen değişikliklerden kaynaklanabilir. 1. Protoonkogenler: Protoonkogenler hücre çoğalmasını düzenleyen sinyal yolaklarında yer alan proteinleri kodlar ve mutasyona uğradıkları zaman “dominant” etki gösteren onkogenlere dönüşürler. 2. Tümör baskılayıcı genler: Bu genlerde bir mutasyon olduğu zaman genin kodladığı protein görevini yerine getiremez ve bu işlev kaybı hücre-döngüsü, protein yıkımı, hücresel adhezyon ve motilite gibi önemli hücresel işlemlerin kontrolden çıkmasına yol açar. Tümör baskılayıcı genlerdeki mutasyonlar çekinik etki gösterir. 3. DNA onarım proteinlerini kodlayan genler: Bu grupta yer alan genlerin kodladığı proteinler genomun bütünlüğünü sağlamaktan sorumludur. Gende mutasyon olduğu zaman genin kodladığı proteinler işlevlerini yerine getiremez, sonuçta DNA onarım işlemi aksar, gerçekleşen hata ve hasarlar giderilemez ve genomik kararsızlık ortaya çıkar. VİRÜSLER VE KANSER DNA ve RNA virüslerinin enfekte ettikleri hücreleri transforme edebildikleri çok eskiden beri bilinmektedir. Virüsler genellikle hayvan kanserleri ile ilişkili bulundukları halde bazı virüslerin insanlarda görülen kanserlere de neden olabildikleri gösterilmiştir. Hayvanlara özgü, trasformasyona neden olan virüsler ile bunların kansere yol açan onkogenleri kanser biyolojisinin en yoğun araştırma konusunu oluşturduğu yıllarda hücre transformasyonunun moleküler mekanizmaları da ortaya çıkmış, virüslerin kanser oluşturma mekanizmasının anlaşılması hücresel onkogenlerin tanımlanmasını sağlamıştır. Virüslerin kültürde hücreleri transforme edebildiği ve deney hayvanlarında tümör oluşturabildiği gösterildiği halde uzun yıllar boyunca bu olayın insan kanserleri ile ilişkili olmadığı düşünülmüştür. Bugün ise insan kanserlerinin yaklaşık % 15 inin virüslere bağlı olduğu ve her yıl virüslerden kaynaklanan 1.3 milyon yeni kanser olgusunun görüldüğü bilinmektedir [7]. RNA Virüsleri Hücrede malin transformasyonun nasıl gerçekleştiği konusunda ilk önemli bilgiler retrovirüsler (RNA virüsleri) ile yapılan deneylerden elde edilmiştir. RNA virüslerinin genomu adından da anlaşılacağı gibi bir RNA molekülünden oluşur. Virüs hücreye girdikten sonra RNA genomuna komplementer DNA zinciri sentezlenir ve bu zincir daha sonra hücrenin genomuna yerleşir. RNA virüslerinin genomu normalde virüsün iç proteinini kodlayan GAG, zarf proteinlerini kodlayan ENV ve ters transkriptaz enzimini kodlayan POL geni olmak üzere toplam üç genden oluşur. Transformasyona ve kansere neden olan RNA virüslerinde yukarıda sayılan yapısal genlere ek olarak bir ya da daha fazla sayıda onkogen bulunur. Buna karşılık, virüsün yapısal genleri kusurlu olduğundan virüs enfekte ettiği hücrede kendi başına çoğalamaz ve bazı yardımcı virüslerin varlığına gereksinim duyar [8]. RNA virüslerinin ilk örneği olan ve tavuklarda tümörlere neden olan Rous Sarkoma Virüsü ile yapılan deneylerde virüsün taşıdığı Src onkogeninin aslında virüs kaynaklı olmadığı, virüse çok öncelerde enfekte ettiği bir konak hücrenin genomundan virüs ile konak DNA’ların rekombinasyonuyla geçtiği anlaşılmıştır. Daha sonraları başka virüslerde benzer başka onkogenler keşfedilmiş ve viral karsinogenezin mekanizmaları aydınlatılmıştır. Virüslerin taşıdığı onkogenler kaynaklandıkları orijinal hücresel genlere kıyasla ya bazı değişiklikler (mutasyonlar) taşır, ya da viral promotörün etkisiyle ilgili onkogenin anlatımı değişir. Bu durumlardan hangisinin gerçekleştiğine bağlı olarak ya aşırı aktif bir protein ortaya çıkar ya da söz konusu proteinin miktarı fazlasıyla artar ve hücre çoğalması uyarılır. RNA virüsleri ayrıca insersiyonal mutagenez adı verilen bir olay yardımıyla hücresel protoonkogenleri de ak- Tablo 1: RNA Virüsleri Ve İlişkili Hayvan Tümörleri Onkogen Virüs Tümör v-src Rous sarkoma virüsü Sarkoma v-abl Abelson lösemi virüsü Lösemi v-erb B Tavuk eritroblastozis virüsü Eritrolösemi v-Hras Harvey sarkoma virüsü Sarkoma v-Kras Kirsten sarkoma virüsü Sarkoma v-fms Kedi sarkoma virüsü Sarkoma v-myc Tavuk miyelositomatozis virüsü Lösemi v-myb Tavuk miyeloblastozis virüsü Miyeloblastozis v-sis Simian sarkoma virüsü Sarkoma BÖLÜM 2: Kanser Biyolojisi tifleştirebilir. Bu olayın gerçekleşmesi için virüsün bir onkogen taşıması gerekmez. Hücreyi enfekte eden retrovirüs önce hücrede kendi genomunun çok sayıda DNA kopyasını oluşturur ve bu DNA molekülleri hücre genomuna gelişigüzel biçimde yerleşirler. Yerleşme bölgesi tesadüfen önemli bir hücresel protoonkogenin yakınına rastladığında virüs genomunun iki ucunda yer alan LTR bölgelerinin uyarıcı etkisiyle hücresel protoonkogenin anlatımı artar ve hücre çoğalması uyarılır. DNA Virüsleri DNA virüslerinin genomu retrovirüslere kıyasla daha karmaşık ve daha büyüktür. Bu virüsler kendilerine özgü onkogenik proteinler kodlarlar. DNA virüslerinin kodladığı onkogenik proteinler birbirinden farklı olduğu halde hücrede transformasyona neden olma yolları çoğunlukla ortaktır [9]. Bu virüslerin kodladığı onkoproteinler genellikle hücrenin çoğalmasını engelleyen denetim mekanizmalarını hedef alır. Virüsün etkisiyle p53 ve Rb1 sinyal yolaklarının hücre döngüsü üzerindeki denetimi engellenir ve S-fazı uyarılır, Örneğin, SV40 virüsünün T antijeni hem p53 proteinine bağlanarak p53’ün hücre döngüsü üzerindeki kontrolünü bozar, hem de Rb1 proteinine bağlanarak onu inhibe eder. Benzer şekilde, insan papilloma virüsünün (HPV) kodladığı E6 proteini de p53 molekülü ile bir ubikuitinligaz olan E3A proteinine bağlanır. Bu bağlanma sonucunda p53 proteini ubikutinlenerek yıkıma uğrar. Aynı zamanda, HPV’nin E7 proteini de Rb1 proteinine bağlanarak onun işlevini engeller ve böylece hücre çoğalmasını durduran iki temel yolu da etkisiz bırakır. Adenovirüsler de aynı mekanizmayı kullanır, virüsün E1A proteini Rb1 ile etkileşirken E1B proteini de p53’e bağlanarak onun görevini yerine getirmesini engeller. Kaposi sarkomu ile ilişkili herpesvirüs (HHV-8) siklin D2’ye benzeyen bir protein kodlar. Bu protein CDK6 molekülüne bağlanarak Rb1’in fosforillenmesini sağlar ve böylece Rb1 E2F yazılım faktörünü serbest bırakır. Virüsün kodladığı LANA proteini de p53’ün aktivitesini engeller [9]. Tablo 2: İnsan Kanserleri İle İlişkili Virüsler Virüs Tümör cinsi RNA virüsleri İnsan T-hücreli lösemi virüsü I (HTLV-1) Erişkin T-hücreli lösemi Kaposi sarkomu ile ilişkili herpesvirüs (HHV-8) Kaposi sarkomu, lenfoma DNA virüsleri Hepatit B virüsü (HBV) Hepatosellüler kanser Hepatit C virüsü (HCV) Hepatosellüler kanser Epstein-Barr virüsü (EBV) Burkitt lenfoma, Hodgkin lenfoma, Nazofarenks kanseri İnsan papilloma virüsü (HPV) Serviks kanseri, baş-boyun kanseri 9 EBV B hücrelerini ölümsüzleştiren bir herpesvirüs türüdür. Virüs B hücresinin normal sinyal yolaklarını kullanarak transformasyona neden olur. Virüsün kodladığı altı EBNA ve üç LMP proteini B hücresine özgü hücresel programları kullanarak hücre çoğalmasını hızlandırır ve hücreyi apoptozdan korurlar [7]. ONKOGENLER Onkogenler ilk kez virüslerin deney hayvanlarında tümör oluşumunu uyardığının ve hücre kültüründe hücreleri transforme edebildiklerinin farkedilmesi sayesinde tanımlanmıştır. Onkogenler genellikle, proto-onkogenler olarak adlandırılan normal hücresel genlerin değişikliğe uğramış şekline verilen addır. Proto-onkogenler aslında hücrede birçok temel işlevi düzenleyen ve hücrenin varlığı açısından anahtar görevler üstlenen genlerdir. Bu genlerdeki değişiklik sonucunda ya genin kodladığı protein aşırı aktivite göstermeye başlar, ya da ilgili protein olması gereken miktardan çok daha fazla miktarda sentezlenir. Proto-onkogenlerin onkogene dönüşmesine neden olan genetik değişiklikler nokta mutasyonları, delesyon ve insersiyonlar, kromozomal yeniden düzenlenmeler (translokasyonlar) ya da gen amplifikasyonlarıdır [8]. Bu değişiklerin ilk grubunda genin yapısı değişmiştir. Buna karşılık, amplifikasyonlarda genin yapısı değişmeyebileceği halde, genin kopya sayısında artış oldugu için aşırı miktarda gen ürünü yapılır. MYC ve HER 2/NEU onkogenleri çoğunlukla amplifikasyon sonucunda tümör oluşumuna katkıda bulunan onkogenlerdir [10]. Kromozomal translokasyonlar da genellikle gen ürününün artmasına yol açan genetik değişikliklerdir. Ancak translokasyonlarda amplifikasyondan farklı olarak, birden fazla gen bir araya geldiği için normal hücrede bulunmayan, füzyon proteinleri (şimerik proteinler) yapılır. Bu proteinler genellikle normal hücresel proteine kıyasla aşırı aktivite gösteren proteinlerdir [11]. Proto-onkogenlerin büyük bir kısmı hücrenin çevredeki değişikliklere uyum sağlayabilmesi için hücreye ulaşan fiziksel ve kimyasal sinyalleri algılayan ve hücre içine ulaştıran sinyal ileti yolaklarında işlev gören proteinleri kodlar. Bu karmaşık sinyal ileti yolakları bölünme, hareketlilik ve sağkalım gibi temel hücresel işlevleri kontrol ettiklerinden sıkı şekilde düzenlenmeleri gerekir. Bu düzenlenme genellikle yolakta kilit noktalarda yer alan proteinlerin enzimatik etkinliklerinin kontrolü ile ya da hücrede çoklu moleküllerden oluşan sinyal karmaşımlarının yapılandırılması aşamasında gerçekleşir [8]. Onkogenlerin kodladığı proteinler işlevlerine göre sınıflandırıldığında, büyüme faktörleri, büyüme faktörü reseptörleri, sinyal ileti proteinleri, yazılım faktörleri gibi bu aşamalarda görev alan ve kanser gelişiminde kilit rol oynayan moleküllerdir. Sinyal iletiminde yer alan onkoproteinler ise guanin nükleotidi bağlayan proteinler (G-proteinleri) ya da reseptör olmayan kinazlardan olu- 10 KISIM I: KANSER SORUNU şur. Reseptör olmayan kinazlar da kendi aralarında reseptör olmayan tirozin kinazlar ve serin-treonin kinazlar olmak üzere iki alt gruba ayrılır [8-11]. Oldukça karmaşık olan sinyal yolakları tümör oluşumu ve kanser gelişiminde önemli rol oynar. Birden fazla sayıda bileşeni olan çok sayıda sinyal yolağının bulunması ve bunların birbirleri ile etkileşmeleri kanserin mekanizmasının açıklanmasını daha güç hale getirmektedir. RAS geni RAS geni kanserde en sık mutasyona uğrayan genlerden biridir. Aralarında melenoma, kolerektal, akciğer, mesane,serviks ve pankreas kanserlerinin de bulunduğu birçok kanserde RAS geninin mutasyon taşıdığı (~%30) gösterilmiştir [12]. Sinyalleri hücre yüzey reseptörlerinden alarak hücre içerisine ileten anahtar moleküller olan RAS proteinleri (H-RAS, N-RAS, K-RAS) G-proteinleri üst ailesinin bir üyesidir. Küçük bir molekül olan GTP’yi bağlayabilmesi RAS proteininin bir anahtar gibi işlev görmesini sağlar. Hücre yüzey reseptörü hücre dışından gelen uyaran ile etkinleştiğinde RAS proteini GTP bağlamak üzere uyarılır ve aynı sinyal yolunda, sinyalin reseptörden çekirdeğe iletilmesinde görev alan bir sonraki protein olan RAF’ın bağlanabilmesi için RAS proteininin konformasyonunda değişiklik olur. RAS proteininin bir diğer özelliği enzimatik GTPaz etkinliğine sahip olmasıdır. Protein bu enzimatik etkinliği sayesinde üzerinde bağlı bulunan GTP’nin bir fosfat grubunu uzaklaştırmak üzere GTP yıkımını katalizler. Bu tepkime sonucu RAS-GTP kompleksi RAS-GDP’ye dönüşür. Bu basit değişim RAS proteininin aktivitesinin sonlanmasına ve sinyal yolunu uyaran anahtarın kapanmasına neden olur (Şekil 2). RAS’a GDP bağlı olduğu durumda sinyal yolağında kendisinden sonra yer alan RAF proteininin bağlanma bölgesi de kapalı konumda olur [8]. Şekil 2. Ras proteinin bağladığı guanin nükleotidinin fosforilasyonuna bağlı olarak etkinleşmesi. RAS etkinleşmesi 2 şekilde gerçekleşebilir [12]: 1. RAS proteininde GTPaz etkinliğinin kaybolması. GTP’nin yıkımını sağlayamayan proteinin sürekli GTP-bağlı durumda kalarak sinyal yolunu uyarmasına neden olur. 2. Proteinde G-nükleotid değişim hızının artması. Protein daha fazla miktarda GTP bağlayabildiği için aktivitesi artar. RAS geninde mutasyon gerçekleştiğinde büyüme faktörü reseptöründen uyarı gelmediği halde protein aktif durumunu koruduğundan RAS sinyal yolağı etkin durumda kalır. RAS onkogeninde en sık rastlanılan mutasyonlar 12. kodonun kodladığı amino asidin değişmesine yol açan nokta mutasyonlarıdır. En yaygın değişim 12. kodonun ikinci pozisyonunda yer alan G (GGT) nükleotidinin A (GAT) nükleotidine dönüşmesinden kaynaklanır. Bu değişiklik normal proteinde bu konumda yer alan Glisin amino asidinin yerine mutant proteinde başka bir amino asidin gelmesiyle sonuçlanır. 12. konumdaki Glisin RAS’a bağlı olan GTP’nin GDP’ye hidrolizini sağlayan önemli bir amino asittir ve bu konumda farklı bir amino asidin bulunması GTP hidrolizini engelleyerek RAS proteininin devamlı etkin durumda kalmasına yol açar. Bunun sonucunda da sinyal ileti şekli değişmediği halde RAS “aşırı etkin” durumunu sürdürerek çekirdeğe sürekli uyarı sinyalleri yollar. RAS geninde bunun dışında 13., 59. ve 61. kodonlar gibi başka kodonlarda da etkinleştirici mutasyonlar oluşur. Bunların hepsinde ya proteinin GTPaz etkinliği zarar görmüştür ya da GTP-GDP değişimi bozulmuştur [13]. Büyüme Faktörleri Büyüme faktörleri; hücre zarında bulunan kendilerine özgü reseptörlere bağlanarak hücre içi sinyal yolaklarını etkinleştiren ve bu yolla hücrenin büyümesini, çoğalmasını ve sağkalımını kontrol eden proteinlerdir. Büyüme faktörleri aracılığı ile uyarılan sinyal iletisi, sonunda genlerin etkinleşmesi ya da susturulması ile sonuçlanacak olan sinyalin çekirdeğe kadar iletilmesini sağlar. Büyüme faktörleri etkilerini otokrin ve parakrin mekanizmalar aracılığı ile gösterir. Otokrin uyarıda büyüme faktörü kendisini üreten hücreyi uyarırken parakrin uyarıda komşu hücreleri uyarır. Onkogenik büyüme faktörleri her iki tür uyarı ile de tümör hücrelerinin çoğalmasına neden olabilir. Kanserde birçok büyüme faktörünün aşırı yapıldığı bildirilmiştir [8]. EGF (Epidermal Büyüme Faktörü) epidermal, vasküler, endotel ve glial hücreler ile tümör hücrelerinde hücre çoğalmasını uyarır ve EGF reseptörü bulunan hücrelerde mitojenik bir yanıt oluşturur [14]. Son yıllarda yapılan çalışmalar EGF genindeki bazı polimorfizmlerin de kanserde invazyon ve erken relaps ile ilişkili olduğuna işaret etmektedir [8,15]. EGF ailesinin bir üyesi olan TGF-α (Transforme edici büyüme faktörü α) ise transforme olan hücreler tarafından yapılır ve otokrin etki göstere- BÖLÜM 2: Kanser Biyolojisi rek hücrenin çoğalmasında artışa neden olur. Fibroblastların büyümesini uyaran FGF (Fibroblast Büyüme Faktörü) ise doku hasarına bağlı olarak salgılanan ve yara iyileşmesini sağlamak üzere doku çoğalmasını uyaran bir diğer onkogenik büyüme faktörüdür. Birçok hücrede hücre çoğalmasını arttırıp apoptozu azaltan IGF-1 (İnsülin Benzeri Büyüme Faktörü 1) genindeki mutasyonların IGF-1 proteininin aşırı sentezi ve prostat kanseri ile ilişkili olduğu gösterilmiştir [16]. Büyüme faktörleri grubunun bir diğer üyesi olan VEGF (Vasküler Endotelyal Büyüme Faktörü) de meme kanseri gibi bazı kanserlerde tümör oluşumu ile gelişiminden sorumlu tutulmaktadır [17]. Büyüme Faktörü Reseptörleri Onkogenlerin kodladığı proteinlerin bir diğer grubunu mutasyona uğradıkları zaman büyüme faktörü yokluğunda bile hücreye çoğalma sinyalleri iletebilen büyüme faktörü reseptörleri oluşturur. Büyüme faktörü reseptörlerinin büyük çoğunluğu kendi yapılarında bulunan tirozin aminoasidine inorganik fosfat bağlayabilen Reseptör Tirozin Kinazlardır (RTK). Bu reseptörlerin tirozin kinaz etkinliğindeki artış mitozu uyaran tepkimelere ve sonucunda da hücrenin klonal çoğalmasına yol açar [8]. Reseptörün kontrolsüz etkinleşmesi ya gendeki bir mutasyon sonucunda tirozin kinaz etkinliğinin artmasından ya da gende, reseptörün büyüme faktörüne bağlanan, hücre dışındaki bölümünü kodlayan bölgenin delesyonundan kaynaklanır. RTK’lar sinyali hücre içerisine RAS sinyal yolağı aracılığı ile iletirler. İlk tanımlanan RTK; EGF’ne özgü olan EGFR’dır (Epidermal Büyüme Faktörü Reseptörü). 1250 amino asitlik bir polipeptid zinciri olan EGFR normal hücreler için gerekli olan çoğalma, sağkalım, farklılaşma, adhezyon ve migrasyon gibi yaşamsal öneme sahip işlevlerin yerine getirilmesinde yer alır. Omurgalılarda EGFR ailesinin (aynı zamanda erbB ailesi olarak da tanınır) EGFR/ErbB-1, HER2/ ErbB-2/neu2, HER3/ErbB-3 ve HER4/ErbB-4 olmak üzere dört üyesi bulunmaktadır [18]. EGFR molekülünün hücre için yaşamsal bir önemi vardır. Çünkü EGFR’nin etkinleşmesi kendisinden sonra yer alan karmaşık sinyal olaylarının başlamasına neden olan ilk aşamadır. EGFR’nin fosforillenmesi SH2 (Src-benzeşim) alanı bulunan adaptör moleküllerin ve aralarında SHP-2, GRB2, PI3K (Fosfotidil inositol 3-kinaz), Akt, Fosfolipaz C-γ (PLC- γ) ve STAT ailelerinin üyelerinin de bulunduğu ileti moleküllerinin etkinleşmesine yol açar [19]. GRB2 proteini aracılığı ile Ras/Raf/MAPK yolağı özgün şekilde etkinleştirilir [20]. EGFR tarafından etkinleştirilen PI3K yolağı hücre çoğalmasını uyarmanın yanısıra hücre döngüsünün ilerlemesinde ve tümör oluşumunda önemli bir işleve sahiptir. Diğer yandan, hücre döngüsünü inhibe eden p27 de PI3K/Akt yolağı tarafından baskılanır [21]. Ayrıca EGFR tarafından etkinleştirilmiş olan PI3K yolağı aracılığı ile anjiyogenezi uyaran VGEF’in yazılımı da uyarılır [22]. Meme, mesane, kolon, akciğer ve özefagus kanserlerinde 11 EGFR geninin aşırı ifade edilmesi kötü prognoz ile ilişkilidir [23]. EGFR ailesinin bir üyesi olan HER2/NEU’un aşırı ifadesi de meme ve over kanserinde kötü prognoz ve tekrarlayan hastalık ile ilişkili bulunmuştur [24]. EGFR ailesinin üyelerinin yapısında hücre dışında ligand bağlama bölgesi, hücre zarı içinde zargeçen bir bölge ve hücrenin içinde de hem molekülün kendi aktivitesini düzenleyen, hem de sinyali iletebilmesi için gerekli olan tirozin kinaz etkinliğini yerine getiren sitoplazmik bir bölge bulunur. Aralarında EGF ve TGF-α da dahil olmak üzere en az 8 ligandın EGFR’ı etkinleştirdiği bilinmektedir [25]. Uyarı almadığı zaman EGFR hücre zarında monomer olarak bulunur. Hücre dışına ligandın bağlanması üzerine uyarılan EGFR diğer aile üyeleri ile homodimer ya da heterodimerler oluşturduğu zaman intrinsik kinaz özelliği etkinleşir [26]. Bu etkinleşme sonucunda protein ya kendi yapısında bulunan tirozinleri (otofosforillenme) ya da dimer yapısında yer alan diğer reseptör molekülünün tirozinini fosforiller (transfosforillenme). EGFR’ın fosforillenmesi uyarıcı sinyalin devam etmesini sağlayacak olan aracı ve adaptör proteinlerin etkinleşmesiyle sonuçlanır. EGFR ailesi üyelerinin heterodimerler oluşturabilmesi sinyal yolağında çeşitliliği ve birbirinden çok farklı uyarıların iletilmesini sağlar [18,27]. EGFR geninin insan kanserlerinde sıklıkla mutasyona uğradığı gösterilmiştir. Aralarında beyin, akciğer, mide ve meme kanserlerinin de bulunduğu birçok kanser türünde proteinin kinaz etkinliğinin artmasına yol açan mutasyonlar görülür [21]. EGFR geninde görülen bir diğer mutasyon türü de meme, akciğer ve over kanserlerinde sıklıkla karşılaşılan, proteinin ligand bağlama bölgesini de kapsayan büyük bir bölümünü kodlayan bölgenin delesyonudur [24,28]. Bu durumda reseptörden hücre içine sinyal iletisinin kesilmesi yerine bunun tam tersi gerçekleşir. Proteinin dış ortam ile ilişkisi kesilmesine rağmen proteinin sitozolde bulunan (ve zar-geçen) bölgeleri birbirine yaklaşarak hücre içinde dimerler oluşturur ve sinyal yolağını büyüme faktörüne gereksinim duymadan geriye dönüşümsüz olarak etkinleştirir. EGFR mutasyonu taşıyan hücreler herhangi bir büyüme faktörüne gereksinim duymadıkları için ortamda büyüme faktörü olmadığı zaman da çekirdeğe sinyal iletirler. Böylece hücreler otonomlaşarak tümör hücresi oluşturma yönünde büyük bir adım atmış olurlar [10]. Ayrıca çeşitli kanserlerde EGFR geninde bir ya da birden fazla eksonun delesyona uğradığı ya da genin tamamının amplifiye olduğu bilinmektedir. Her iki durumda da genin aşırı ifade edilmesi sonucu hücre devamlı çoğalma sinyali alıyormuş gibi davranır. EGFR’ye dayalı sinyal ileti yolağının aşırı etkinleşmesine yol açan bir diğer mekanizma EGFR ailesinin bir diğer üyesi olan HER2/ErbB2 ile heterodimerler oluşturmasıdır. HER2, EGF ya da bununla ilişkili ligandlara bağlanma özelliğine sahip olmamakla birlikte heterodimer yapısı içerisinde bulunan eşinin ligandına olan ilgisini arttıran bir ko-reseptör olarak etkisini gösterir. EGFR/HER2 heterodimeri oluştuğu zaman bazal seviyede etkinleşmiş olan 12 KISIM I: KANSER SORUNU reseptörün aktivitesi artar ve bu da sinyal yolunda etkinlik artışına neden olur. Bu nedenle EGFR ve HER2’nin eş zamanlı olarak aşırı ifade edilmesi hücresel transformasyonu hızlandırır [29,30]. EGFR-HER2 heterodimerinin, EGFR homodimerlerinin etkinleştirdiği asıl sinyal ileti yolağı dışındaki yolakları da uyarma özelliği vardır. Heterodimer oluşumu ayrıca, dimerlerin yıkımını ve geri dönüşüm yolağını da yavaşlatarak reseptör kalımlılığının artmasına neden olur. Bunların dışında bazı neoplastik dokuların hem EGFR’ı, hem de reseptörün otokrin yolla etkinleşmesine yol açan başka ligandları aşırı ifade ettiği bilinmektedir. Bütün bu değişimler sonucunda EGFR sinyal yolağı etkinleşerek çekirdeğe devamlı çoğalma sinyalleri iletir [26]. Yazılım (Transkripsiyon) Faktörleri Yazılım faktörleri DNA’ya çoklu protein kompleksleri halinde bağlanarak genlerin yazılımını etkinleştiren ya da değiştiren proteinlerdir. Hücre çoğalması ile sağkalımında işlev gösteren genlerin çalışmasını düzenleyen yazılım faktörlerini kodlayan genlerde gerçekleşen mutasyon ve onkogenik dönüşümler kanser gelişimiyle sonuçlanabilir. Hücre çoğalmasını kontrol eden bir sinyal yolağında görev alan Jun ve Fos proteinleri onkogenik yazılım faktörleri arasında yer alır. E2F ailesinin üyeleri olan proteinler de yazılımı etkinleştiren ya da baskılayan yazılım faktörleridir. Bu grubun bir üyesi olan E2F2’nin mesane ve prostat kanserinde aşırı ifade edildiği görülmektedir [31]. Şekil 3. Hücre döngüsünün evreleri. HÜCRE DÖNGÜSÜ Hücre döngüsü 4 evreden oluşur (Şekil 3): 1. Mitoz (M) evresi, 2. G1 evresi (Gap 1) 3. Sentez evresi 4. G2 evresi (Gap 2) M evresinde kromatidler 2 ayrı kromozom seti oluşturmak üzere ayrılır ve sitokinez gerçekleşir. Bu işlemler sonucunda aynı kromozomları taşıyan ve içerikleri aynı olan iki yavru hücre oluşur. M evresinden sonra hücre ya yeni bir hücre döngüsüne girmek üzere tekrar G1 evresine, ya da hücre döngüsünden çıkmak üzere G0 evresine girer. G1 evresinde hücre çekirdeği büyür ve DNA eşlenmesine hazırlanmak üzere yazılım (transkripsiyon) ve çevirim (translasyon) işlemleri gerçekleşir. G1 evresinin son aşamasında kısıtlayıcı R (restriksiyon) noktası yer alır [32]. Bu noktada hücre DNA eşlenmesini gerçekleştirmek zorundadır. Ancak, hücrenin bulunduğu ortamda bulunan büyüme faktörleri veya besin maddeleri yeterli değil ise hücre R noktasında da G1 evresinden çıkarak G0 evresine girebilir. S evresi ise sentez aşamasıdır ve hücre bu evrede DNA’sını eşleyerek bir set yeni kromatid oluşturur. Eşlenme aşamasından hemen sonra hücre G2 evresine girer. Erişkin bir bireyin vücudundaki hücrelerin çoğu G0 evresinde bulunur. Hücre döngüsünde gerekli işlemlerin doğru şekilde ilerlemesini denetleyen özel biyokimyasal kontrol noktaları bulunur. Bu denetim mekanizması sayesinde bir aşama BÖLÜM 2: Kanser Biyolojisi tamamlanmadan bir sonraki aşamaya geçilmesi önlenmiş olur. Kontrol noktaları S evresine giriş, mitoza giriş (G2/M kontrol noktası) ve mitozdan çıkış aşamalarında yer alır. S evresine girişte yer alan kontrol noktası hasarlı DNA’nın eşlenmesini önler. G2/M kontrol noktası ise hücre içindeki hasarlı ya da eşlenmemiş DNA veya eşlenmemiş sentrozom olup olmadığını denetler. M evresindeki kontrol noktası ise kromozomların hepsi mitotik iğ ipliklerine tutunmamış ise kromozom segregasyonunu önler [33]. Hücre döngüsü sırasında gerçekleşen tüm bu işlemler çok sıkı bir denetim altındadır. Bu sıkı denetim siklin proteinleri tarafından sağlanır. Siklinler hem kendi etkilerini göstermek, hem de onları etkinleştirmek için siklin bağımlı kinazlar (CDK) ile birlikte işlev gösterirler. Siklinler ve CDK’lar hücre döngüsünün belirli noktalarında döngünün ilerlemesini denetleyen proteinlerdir. Hücrenin çoğalması, sessiz kalması veya post-mitotik evreye girmesi hücrenin mikroçevresinde bulunan faktörlerin bileşimine bağlıdır [33]. Kanser hücreleri genellikle G0 evresine girme yetilerini kaybetmiştir. Bunun nedeni de antiproliferatif sinyalleri yöneterek hücre döngüsünü kontrol eden Rb1 proteinlerinin düzeyidir. Rb1 geninde bir mutasyon olduğu zaman hücrede işlevsel Rb1 proteini bulunmayabilir. Hipofosforillenmiş durumdaki Rb1 proteini hücrenin G1’den S evresine geçebilmesi için gerekli olan genlerin ifade edilmesini kontrol eden yazılım faktörü E2F’ye bağlanarak hücre çoğalmasını durdurur. Transforme edici büyüme faktörü β (TGF- β) ise c-myc proteinini baskılayarak ya da siklinCDK kompleksinin oluşumunu engelleyerek Rb1’in fosforillenmesini önler. Rb1 fosforillendiği zaman yazılım faktörü E2F’yi bağlayamaz. Böylece E2F serbest kalarak etkinleşebilir. Yazılım faktörünün etkinleşmesi sonucunda DNA’nın eşlenmesi için gerekli olan proteinler yapılır ve hücrenin G1’den S evresine geçmesinin yolu açılır [34]. Bu genler arasında hücre çoğalmasında en önemli yer tutan genlerden biri Myc genidir. Çünkü RTK’ları etkinleştiren büyüme faktörlerinin birçoğu myc proteininin sentezlenmesini sağlar. MYC Geni Myc ailesinde en iyi tanımlanmış olan c-myc dışında B-myc, L-myc, N-myc ve S-myc proteinleri de bulunmakla birlikte bunlardan sadece c-myc, N-myc ve L-myc’in hücreyi transforme etme potansiyeli olduğu belirlenmiştir. Hücre çeşitli mitojenik sinyaller ile uyarıldığı zaman erken yanıt oluşmasını sağlayan c-myc, L-myc ve N-myc genleri çoğalma, büyüme, apoptoz ve terminal farklılaşmada işlev gösterir [35,36]. Memeli hücrelerinin çoğalması için gerekli olan MYC protein miktarının tümör hücrelerinde normal hücreye kıyasla arttığı görülmüştür. İnsan kanserlerinde normal MYC düzeyinin artmasını ve üzerindeki düzenlenmenin ortadan kalkmasını sağlayan çeşitli mekanizmalar görülür. Bunlardan bir tanesi meme ve akciğer 13 kanserlerinin % 30’unda görülen MYC amplifikasyonudur [37,38]. Genin amplifikasyonu aşırı ifade edilmesine, yani fazla miktarda myc proteini yapılmasına neden olur. Normal hücrede MYC molekülü sayısı 1000 ya da daha az iken bazı kolon kanseri hücrelerinde bu sayının 100.000’in üstünde olduğu görülmüştür. Ancak bunun gen amplifikasyonundan değil, genin aşırı ifade edilmesinden kaynaklandığı anlaşılmıştır. Genin aşırı ifade edilmesine neden olan olaylardan bir tanesi de yazılımı kontrol eden düzenleme mekanizmasının ortadan kalkmasıdır. Burkitt lenfoması gibi lenfoid kanserlerde B-hücrelerinde 8. kromozomda bulunan c-myc proto-onkogeni, translokasyon sonucu 2., 4. veya 22. kromozomlarda yer alan immünglobin genlerinin yanına taşınarak bu genler ile aynı oranda, etkin şekilde ifade edilmeye başlar [39,40]. Hücre döngüsünün düzenlenmesinde yer alan siklinler, siklin-bağımlı kinazlar (CDK) ve siklin-bağımlı kinaz inhibitörleri (CDI) c-myc proteininin denetimi altında düzenlenen genlerdir. Bu nedenle c-myc geni kontrolden çıkarak aşırı ifade edilmeye başladığı zaman hücre döngüsünde görev yapan bu genlerin denetlenmesi bozulur ve hücreyi kansere yönelten değişiklikler başlamış olur [41,42]. Hangi mekanizma ile olursa olsun, Burkitt lenfoması, akciğer ve meme kanseri gibi birçok kanserde c-myc sentezinin arttığı görülmektedir. Bunun dışında nöroblastoma ve retinoblastomada N-myc amplifikasyonu görülürken L-myc artışına özellikle küçük hücre-dışı akciğer kanserinde rastlanmaktadır [43-44]. Onkogenler ve Kromozom Translokasyonları Kanserde gen üzerinde gerçekleşen moleküler değişimler dışında kromozomal değişimlere de sık rastlanır. Kanser hücrelerinde genom kararsız olduğundan bütün bir kromozomun veya kromozomun belli bir parçasının kaybı ya da kazancı görülebildiği gibi kromozomal yeniden düzenlenmeler de gerçekleşebilir. Kromozomal translokasyonlar yapısal bozukluklardır ve bu tür değişikliklere kemik iliği hücrelerinde daha sık rastlanır. Lösemi ve lenfomalar tipik translokasyonların görüldüğü hematolojik kanserlerdir. Karşılıklı translokasyonlarda aynı kromozomun iki bölgesi ya da farklı iki kromozom arasında genetik madde değişimi söz konusudur. Kromozom translokasyonlarının en klasik örneği 1960 yılında Nowell ve Hurgerford tarafından bir KML vakasında saptanmış olan t(9;22)(q34;q11) translokasyonudur [8]. KML vakalarının hemen tümünde görülen bu translokasyonda 9. kromozomun uzun kolunun uç kısmı 34. banttan kırılarak 22. kromozomun 11. bantından ayrılan bir parça ile yer değiştirir. Değişim sonucunda aslında 9. kromozomda yer alan abl protoonkogeni 22. kromozoma (Philadelphia kromozomu) aktarılmış olur ve 22. kromozom üzerinde yer alan BCR geninin yanına yerleşerek yazılımı bu gen ile birlikte gerçekleşir. Böylece ortaya lösemi oluşumunda en önemli etken olan, bir ucu abl geni, dğer ucu da 14 KISIM I: KANSER SORUNU bcr geni tarafından kodlanan hibrit bir füzyon proteini çıkar. Abl geninin ürünü normal durumda hücre çoğalmasını uyaran bir protein kinazdır. Bcr ile birleştiğinde regülatör bölgelerini yitiren protein aşırı aktif bir duruma dönüşerek hücrelerin sürekli çoğalmasına neden olur. t(9;22) translokasyonuna ALL hastalarının yaklaşık % 10-20’sinde de rastlanır. Kromozom translokasyonlarının tipik bir başka örneği de Burkitt Lenfomasında görülür [8]. Bu hastalarda 8. kromozomun bir bölgesi hastaların % 80 inde 14. kromozomda yer alan immunglobulin ağır zincir (IgH) lokusuna, geri kalan % 20 sinde ise 2. kromozomdaki к veya 22. kromozomdaki λ hafif zincir lokuslarına taşınır. Bu translokasyon sonucunda 8. kromozomun taşınan parçası üzerinde yer alan myc geninin yazılımı yeni yerleştiği bölgedeki immunglobin geni ile birlikte yüksek hızda gerçekleşir ve hücrede aşırı miktarda oluşan myc proteini hücre çoğalmasını uyararak kansere neden olur. Lösemilerde translokasyonlar çok sık görülen olaylardır ve bu translokasyonları belirleyen moleküler testler hastalığın tanısı açısından önem taşır. Örneğin, akut promiyelositer lösemide t(15;17) translokasyonu (PML-RARα gen füzyonu) görülür. PML proteini hücre çoğalmasını ve sağkalımı düzenleyen bir yazılım faktörüdür ve tümör baskılayıcı olarak işlev görür. Tümör baskılayıcı etkisi kısmen p53 ve Rb1 ile olan etkileşiminden kaynaklanır. Translokasyon sonucu oluşan hibrit PML-RARA füzyon proteini özellikle PML proteinin tümör baskılama işlevinin ortadan kalkmasına neden olur. Lösemilerde sık görülen diğer translokasyonlar akut miyelositer lösemilerde t(8;21) (AML1-ETO gen füzyonu) ile inv 16 (CBFB-MYH11 gen füzyonu), akut lenfositer lösemide ise t(4;11) (MLL-AF4 gen füzyonu), t(1;19) (E2APBX1 gen füzyonu) ve t(12;21) (TEL-AML1 gen füzyonu) gibi değişikliklerdir [46]. bı (LOH) olarak adlandırılan durum ile kendini gösterir. LOH, normal (ya da yaban tipi) kromozomun ya bir kısmının ya da tamamının kaybolmasıdır. Tümör baskılayıcı genlerde LOH olayının mutasyonlardan daha sık gerçekleştiği düşünülmektedir [10]. Tümör baskılayıcı proteinler hücre içerisinde çok çeşitli işlevler gösterir. APC, MEN1, p53, Rb1 ve WT1 gibi tümör baskılayıcılar DNA’nın yazılımını kontrol etmekte görev alırken BRCA1 ve BRCA2 gibi tümör baskılayıcı genler de öncelikle DNA onarımında işlev görür. Genetik değişikliklere uğradıklarında normal bir hücrenin kanser hücresine dönüşmesine neden olan p53 ve Rb1 genleri tümör baskılayıcı genlerin en iyi bilinen örnekleridir. Her iki gen de hücre döngüsünü düzenleyen kilit genlerden olup “hücre döngüsünün bekçisi” olarak adlandırılırlar. Bu gruptaki genler, belirli bir doku tipinde hücrelerin yenilenmesini kontrol ederek hücre sayısının sabit kalmasını sağlarlar. Bu genlerde bir mutasyon olduğu ve gen işlevini yerine getiremediği zaman hücre bölünmesi durdurulamadığı için ölen hücrelerden çok daha fazla sayıda yeni hücre oluşmaya başlar ve bunun sonucunda da hücre sayısındaki artış kanser hücrelerinin çoğalmasına neden olur [48]. Tümör baskılayıcı genlerde nükleotid değişimi olmadan işlev kaybına neden olabilen bir başka mekanizma da epigenetik değişikliklerdir. Kanserde en yaygın görülen epigenetik düzenlenme ilgili genin aşırı metillenme ile susturulmasıdır. Tümör baskılayıcı genlerin promotör bölgelerinin yakınında bulunan sitozin bazlarına kimyasal olarak metil grubunun eklenmesi genin yazılımının engellenmesine neden olur. Epigenetik mekanizmanın kolon, meme, akciğer, özafagus, mesane ve over kanserlerinde tümör baskılayıcı genlerin susturulmasında rol oynadığı bilinmektedir [49]. Bu yaygın etkilerinden dolayı epigenetik mekanizmaların genlerin etkinliğinin ortadan kalkmasında mutasyonlar kadar önemli olduğu düşünülmektedir. TÜMÖR BASKILAYICI GENLER p53 (TP53) Tümör baskılayıcı genler, hücre çoğalmasını uyaran proteinlerin etkisini engelleyen proteinleri kodlayarak hücre büyümesini ve çoğalmasını negatif yönde düzenlerler. Bu nedenle, tümör hücrelerinde tümör baskılayıcı proteinleri kodlayan genlerde proteinde işlev kaybına neden olan mutasyonlar görülür. Normal hücrelerde tümör baskılayıcı genler hücre çoğalmasını baskılayarak onkogenlerin etkisini engeller [47]. Ancak tümör baskılayıcı genler çekinik etki gösteren genlerdir. Bu nedenle, genin etkisinin ortadan kalkması için ya genin her iki allelinin de mutasyona uğraması, ya da allellerden birinin mutasyonuna ek olarak diğer allelin de başka bir genetik olay sonucu (örneğin, delesyona uğrayarak) kaybolması veya etkisini yitirmesi gerekir. Diğer bir deyişle, tümör oluşabilmesi için tümör baskılayıcı proteini kodlayan genin her iki allelinin de ya mutasyona uğraması ya da kaybolması gerekmektedir. Tümör fenotipinin ortaya çıkması genellikle heterozigotluk kay- Tümör baskılayıcı bir gen olan TP53 17. kromozomun kısa kolu üzerinde bulunur ve p53 proteinini kodlar. Normal koşullar altında etkin olmayan p53 proteini DNA’da hasar ya da genetik bir değişiklik olduğu zaman etkinleşir ve söz konusu hasarın onarılması için gerekli olan hücre sinyal yollarını harekete geçirir. Hasarın onarılamadığı durumlarda ise hücre döngüsünün ilerlemesini G1 evresinde durdurarak hücre ölümünü tetikler [10,50]. p53 proteininin işlevinde ya da yapımında bir değişiklik olduğu zaman hasarlı DNA’yı taşıyan hücreler bölünmeye devam eder. Bunun sonucunda da kanser gelişiminin değişik aşamalarına özgü genetik bozukluklar hücre içerisinde birikmeye başlar. p53’ün hedef genlerinden biri bir siklin- bağımlı kinaz inhibitörü (CDI) olan ve birçok kinazın etkinliğini engelleyen WAF1 (wild-type p53 activated fragment 1) proteinini kodlayan gendir. Siklin-bağımlı kinazlar hücre dön- BÖLÜM 2: Kanser Biyolojisi güsünün devam etmesi için gereklidir ve işlevleri bunlara özgü inhibitörler (CDI) tarafından kontrol edilir. Ancak oluşan DNA hasarının onarılabilmesi için bu hasarın örneğin, UV nedeniyle mi, yoksa başka bir mutajen etkisiyle mi oluştuğunun onarım sistemi tarafından ayırt edilmesi gerekir. Hasarın saptanması ve onarılması için hücrenin zamana ihtiyacı vardır ve bu nedenle hücre döngüsü durdurulur. Ancak hasarın saptanması ve onarılması için hücreye zaman tanımak her zaman yeterli olmaz ve bazı durumlarda hasar onarılamaz. Bu durumda kanser oluşmaması için hücrenin uygulayacağı en iyi taktik kendini yok etmektir. Bu nedenle, p53’ün ikinci kritik görevi apoptozu etkinleştirmektir. Apoptoz hücrenin denetimli bir şekilde kendini öldürmesidir. p53’ün hedef genleri arasında yer alan BAX, PUMA ve NOVA genleri hücrenin apoptoza yönelmesini sağlar. Sitokrom C’nin solunum zinciri proteinlerinden olan BAX, PUMA ve NOVA proteinleri, mitokondri dış zarında geçirgenliği değiştirerek hücre ölüm programının devreye girmesini sağlar. Bu nedenle, mutasyonların birikimi yüzünden bir öncü-tümör hücresine dönüşebilecek olan hücrelerin p53 aracılığıyla ortadan kaldırılması kanserden korunmada vücudun geliştirdiği en etkin yollardan biridir [10,50,51]. Denetlediği kritik işlevler nedeni ile p53 proteini “genomun gardiyanı” olarak adlandırılır. Ancak p53 aynı zamanda kansere neden olan tüm genler arasında en fazla mutasyon görülen gendir. İnsan kanserlerinin % 70’inden fazlasında p53’ün işlevini etkileyen mutasyonlar bulunduğu bilinmektedir. İnsan kanserlerinde en sık delesyona uğrayan 17. kromozom üzerinde bulunan p53 geninde bu güne kadar binlerce mutasyon tanımlanmıştır. p53 mutasyonlarına akciğer kanserlerinin tüm alt tiplerinde oldukça sık rastlanır. Bu mutasyonlar kalıtsal olmayıp somatik niteliktedir. Genellikle onkogenlerde etkinleşmeye neden olan mutasyonlarla birlikte görülen p53 mutasyonlarına meme kanserinde % 60, astrositomlarda % 40 oranında rastlanır. DNA’ya bağlanmış olan p53’ün yapısını aydınlatmak üzere yapılmış olan X-ışını kristalografi çalışmaları p53’ün üzerinde mutasyonların yoğunlaştığı belirli bölgeler bulunduğunu, proteinin DNA ile doğrudan etkileşiminde görev alan ve bir yazılım faktörü olarak işlev göstermesinde önem taşıyan kritik amino asitlerde mutasyon oranının daha yüksek olduğunu göstermektedir. Örneğin, bu noktalardan bir tanesi sigara dumanında bulunan polisiklik aromatik hidrokarbonların (örneğin, benzo[a]piren) hedefi olan belirli konumlardaki guanin nükleotidleridir [10,13,14]. Rb1 Hücre bölünmesi sıkı bir şekilde denetlenen bir dizi aşama ile gerçekleşir. Bir hücrenin iki yavru hücre oluşturmadan önce geçirdiği en önemli aşama DNA’nın eşlenmesi aşamasıdır. Hücre döngüsünü kontrol eden Rb1 proteini bu aşamanın gerçekleşmesinde büyük önem taşır. Rb1 proteini 15 ancak hücre yeterli ve gerekli büyüklüğe ulaştığı takdirde ve hücreye bölünme sinyalleri ulaştığı zaman DNA’nın eşlenmesine izin verir [52]. Rb1 bu işlemi gerçekleştirirken belirli bir grup genin yazılımını düzenler ve E2F ailesini oluşturan bir grup konvansiyonel yazılım faktörü ile birleşerek işlev gösterir. Rb1’in E2F’ye bağlanarak oluşturduğu kompleks bir grup genin yazılımının engellenmesine yol açar. Bu genlerin yazılımı ancak Rb1 üzerinde bağlı olan E2F’yi serbest bıraktığı zaman gerçekleşebilir. Söz konusu genlerin büyük bir kısmı DNA’nın eşlenmesi ve hücre döngüsünün devam etmesi için gerekli olan proteinleri kodlayan genlerdir [32]. Rb1’in kaybı E2F’nin yazılım üzerindeki kontrolünü ortadan kaldırdığından kansere doğru önemli bir adım oluşturur. DNA’nın kusurlu biçimde eşlenmesine yol açan bu durum hücre içinde mutasyonların birikmesiyle sonuçlanır. Rb1, hücre döngüsünün ilerlemesini kontrol eden siklin-bağımlı kinazların hedefi olan bir moleküldür. Normal şartlar altında siklin-bağımlı kinazlar RB1’in fosforillenmesini sağlayarak hücresel dengenin yazılımın baskılanmasından yazılımın etkinleşmesi yönüne dönmesini sağlar. Çünkü fosforillenmiş Rb1’in E2F’ye ilginliği kalmamıştır ve serbest kalan E2F hedef genlerin yazılımını başlatır [53]. Sonuç olarak, bir hücrenin DNA’sının eşlenip eşlenmeyeceğine ve hücrenin döngüsünü sürdürerek bölünüp bölünmeyeceğine Rb1 karar verir. DNA’dan RNA yapılmasını sağlayan enzimler (RNA polimerazlar) de Rb1-E2F kompleksi tarafından kontrol edilir. RNA polimerazlar yaşayan bir hücrede bulunan tüm bileşenlerin yapılmasını sağlayan moleküllerdir. Bu enzimlerin sentezi Rb1 tarafından kontrol edildiğinden hücrenin hangi durumda bulunacağına ve hangi yolda ilerleyeceğine karar veren molekül Rb1 proteinidir [52] DNA Onarımı DNA her gün radyasyon, karsinojenler ve metabolik ürünler gibi kendisine zarar veren birçok etkene maruz kalır. Bu etkenlerin DNA’da oluşturduğu mutasyonların büyük bir çoğunluğu etkin bir şekilde onarılmakla birlikte çok az bir kısmı genomun yapısında varlığını korur. DNA molekülünü oluşturan bazlar sıklıkla değişik noktalarında kovalan modifikasyonlara uğrarlar. Bu modifikasyonlar sonucunda ilgili baz değişebilir. Örneğin, sitozin (C) amino grubunu kaybettiğinde urasile (U) dönüşür ya da guanin O6 pozisyonunda metillendiği zaman normal eşi C yerine timin (T) ile birleşir. Yanlış baz eşleşmeleri, DNA zincirinde oluşan kırıklar ve çapraz bağlar kalıcı nitelik kazanabilir. Organizmada öncelikle reaktif oksijen türlerinin (ROS) aktivitesini ortadan kaldıran enzimler (örneğin, SOD) bulunur. Ayrıca, DNA’nın eşlenmesi sırasında ortaya çıkan hata ve kusurları belirleyip düzelten özel bir mekanizma (proofreading) vardır. Ancak tüm bu önlemlere rağmen DNA’da hasar oluşabilir ve bunların onarılması gerekir. Ayrıca DNA’nın kendini eşlemesi sırasında da hatalar oluşa- 16 KISIM I: KANSER SORUNU bilir.DNA hücre bölünmesinde kritik rol oynayan aktif bir molekül olduğundan DNA onarımı hücre döngüsü ile yakından ilişkilidir. DNA onarım mekanizması hücrenin oluşabilecek mutasyonlara karşı bir savunma sistemidir ve bu sistem düzgün çalışmadığı zaman kansere yol açabilen değişimler ortaya çıkar. DNA onarımında işlev gören proteinlerin önemli bir bölümü tümör baskılayıcı proteinler sınıfındandır. DNA onarım sistemlerinde görev alan proteinler genomun bütünlüğünü sağlamaktan sorumlu olup bunları kodlayan genlerde mutasyonlar olduğu zaman proteinlerde ortaya çıkan işlev kayıpları onarım işleminin aksamasına ve genomik kararsızlığa neden olur [54,55]. Kansere yatkınlık oluşturan birçok genetik hastalığın (Xeroderma pigmentosum, ataxia teleanjientazia, Bloom sendromu, Fanconi anemisi v.b.) yanında bazı onarım bozuklukları da belirli kanserler ile doğrudan ilişkilidir. Örneğin, yanlış eşleşme onarım genlerindeki mutasyonlar Herediter Nonpolipozis Kolon Kanserine (HNPCC) neden olurken BRCA1 ve BRCA2 genlerindeki mutasyonlar meme ve over kanserleri ile ilişkilidir. Bu nedenle hücrelerde birden fazla değişik onarım mekanizması bulunur. Bunlar MMR (Hatalı Eşlenen Bazların Onarımı/ Mismatch Repair), BER (Baz Kesip Çıkartma Onarımı/ Base Excision Repair), NER (Nükleotid Kesip Çıkartma Onarımı/ Nucleotide Excision Repair) ve çift zincir kırıklarının onarımıdır (Double Strand Repair) [8]. DNA’nın iki zincirinden her birinde aynı bilginin bulunduğu durumda bu zincirlerden birinde hata oluşursa sağlam olan diğer zincirdeki bilgi kalıp olarak kullanılarak bu hata MER, BER veya NER mekanizmaları ile doğru ve güvenilir bir şekilde onarılır. Değişik türden DNA kusurlarını onaran her mekanizmada farklı kompleksler kurarak görev yapan onlarca farklı protein ve çok sayıda değişik aşama yer alır. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. KAYNAKLAR 1. 2. 3. 4. 5. 6. 7. 8. Nowell PC. The clonal evolution of tumor cell populations. Science 1976; 194(4260): 23-28. Doll R. Introduction. In: Hiatt H, Watson JR, Winslen JA, eds. Origins of Human Cancer. Cold Spring Harbour. NY: Cold Spring Harbour Laboratory, 1977. p. 1-12. Coppola D. Mechanisms of oncogenesis. An Update on Tumorigenesis. Springer, New York. 2010. p. 71-87. Lichtenstein P, Holm NV, Verkasalo PK, Iliadou A et al. Environmental and heritable factors in the causation of cancer- Analyses of cohorts of twins from Sweden, Denmark, and Finland. N Engl J Med 2000; 343(2): 78-85. Kinzler KW, Vogelstein B. Lessons from hereditary colorectal cancer. Cell 1996; 87(2): 159-170. Kinzler KW, Vogelstein B. Landscaping the cancer terrain. Science 1998; 280(5366):1036-1037. Martin D, Gutkind JS. Human tumor-associated viruses and new insights into the molecular mechanisms of cancer. Oncogene 2009; 27(Supp.2): 31-42. Alberts B, Johnson A, Lewis J et al. Cancer. In: Molecular Biology of the Cell. 5th ed. New York: Garland Science. Taylor & Francis Group. LCC: 2008. p. 1205-1268. 23. 24. 25. 26. 27. 28. 29. Liao JB. Viruses and human cancer. Yale J Biol Med 2006; 79(3-4): 115-122. Weinberg RA. The Biology of Cancer. New York. NY: Garland Science. Taylor & Francis Group. LCC: 2008. p. 91-118. Croce CM. Molecular origins of cancer: Oncogenes and cancer. N Eng J Med 2008; 358: 502-511. Schubbert S, Shannon K, Bollag G. Hyperactive Ras in developmental disorders and cancer. Nat Rev Cancer 2007; 7(4): 295-308. Hesketh R. Cancer genes, mutations and cancer development. In: Introduction to Cancer Biology. Cambridge University Press; New York. 2013. p.67-101. Merkle CJ. Biology of Cancer. In: Yarbro CH, Wujcki D, Holmes Gobel B eds. Cancer Nursing Principles and Practice. Sudbury, MA. Jones and Bartlett, 2011. p. 3-22. Teixeira AL, Ribeiro R, Cardoso D et al. Genetic polymorphism in EGF is associated with prostate cancer aggressiveness and progression-free interval in androgen blockade-treated patients. Clin Cancer Res 2008; 14(11): 3367-3371. Johansson M, McKay JD, Wiklund F et al. Implications for prostate cancer of insulin-like growth factor-I (IGF-I) genetic variation and circulating IGF-I levels. J Clin Endocrinol Metab 2007; 92(12): 4820-4826. Lu H, Shu XO, Cui Y et al. Association of genetic polymorphisms in the VEGF gene with breast cancer survival. Cancer Res 2005; 65(12): 5015-5019. Chen WS, Laser CS, Poenie M, Tsien LY, Gill GN, Rosenfeld MG. Requirement for intrinsic protein tyrosine kinase in the immediate and late actions of the EGF receptor. Nature 1987; 328(6133): 820-823. Wu CJ, O’Rourke DM, Feng GS, Johnson GR, Wang Q, Greene MI. The tyrosine phosphatase SHP-2 is required for mediating phosphatidylinositol 3-kinase/Akt activation by growth factors. Oncogene 2001; 20(42): 6018-6025. Cai T, Nishida K, Hirano T, Khavari PA. Gab1 and SHP-2 promote Ras/MAPK regulation of epidermal growth and differentiation. J Cell Biol 2002; 159(1): 103-112. Narita Y, Nagane M, Mishima K, Huang HJ, Furnari FB, Cavenee WK. Mutant epidermal growth factor receptor signaling downregulates p27 through activation of the phosphatidylinositol 3-kinase/Akt pathway in glioblastomas. Cancer Res 2002; 62(22): 67646769. Jiang BH, Zheng JZ, Aoki M, Vogt PK. Phosphatidylinositol 3-kinase signaling mediates angiogenesis and expression of vascular endothelial growth factor in endothelial cells. Proc Natl Acad Sci USA 2000; 97(4): 1749-1753. Nicholson RI, Gee JM, Harper ME. EGFR and cancer prognosis. Eur J Cancer 2001; 37(Suppl 4): S9-515. Ross JS, Fletcher JA, Linette GP et al. The Her-2/neu gene and protein in breast cancer 2003: biomarker and target of therapy. Oncologist 2003; 8(4); 307-3025. Massagué J, Pandiella A. Membrane-anchored growth factors. Annu Rev Biochem 62;515-541:1993. Muthuswamy SK, Gilman M, Brugge JS. Controlled dimerization of ErbB receptors provides evidence for differential signaling by homo- and heterodimers. Mol Cell Biol 1999; 19(10): 6845-6857. Lenferink AE, Pinkas-Kramarski R, van de Poll ML et al. Differential endocytic routing of homo- and hetero-dimeric ErbB tyrosine kinases confers signaling superiority to receptor heterodimers. EMBO J 1988; 17(12): 3385-3397. Prenzel N, Zwick E, Leserer M, Ullrich A. Tyrosine kinase signalling in breast cancer. Epidermal growth factor receptor: convergence point for signal integration and diversification. Breast Cancer Res 2000; 2(3): 184-190. Worthylake R, Opresko LK, Wıley HS. ErbB-2 amplification inhibits down-regulation and induces constitutive activation of both ErbB-2 and epidermal growth factor receptors. J Biol Chem 1999; 274(13): 8865-8874. BÖLÜM 2: Kanser Biyolojisi 30. 31. 32. 33. 34. 35. 36. 37. 38. 39. 40. 41. 42. Kokai Y, Myers JN, Wada T et al. Synergistic interaction of p185cneu and the EGF receptor leads to transformation of rodent fibroblasts. Cell 1989; 58(2): 287-292. Foster CS, Falconer A, Dodson AR et al. Transcription factor E2F3 overexpressed in prostate cancer independently predicts clinical outcome. Oncogene 2004; 23(35): 5871-589. Brown T. Genome replication. In: Genomes. New York, NY: Garland Science; 2007. p.467-499. Pollard T, Earnshaw WC. Introduction to the cell cycle. In: Cell Biology. 2. ed., Philadelphia, PA: Saunders Elsevier. 2008. p.731-746 Hanahan D, Weinberg RA. The hallmarks of cancer. Cell 2000; 100(1): 57-70. Evan GI, Wyllic AH, Gilbert CS et al. Induction of apoptosis in fibroblasts by c-myc protein. 1992; Cell 69(1): 119-128. Milner AE, Grand RJ, Waters CM, Gregory CD. Apoptosis in Burkitt lymphoma cells is driven by c-myc. Oncogene 1993; 8(12): 3385-3391. Little CD, Nau MM, Carney DN, Gazdar AF, Minna JD. Amplification and expression of the c-myc oncogene in human lung cancer cell lines. Nature 1983; 306(5939): 194-196. Kozbor D, Croce CM. Amplification of the c-myc oncogene in one of five human breast carcinoma cell lines. Cancer Res 1984; 44(2): 438-441. Dalla-Favera R, Bregni M, Erikson J et al. Human c-myc onc gene is located on the region of chromosome 8 that is translocated in Burkitt lymphoma cells. Proc Natl Acad Sci USA 1982; 79(24); 78247827. Taub R, Kirsch I, Morton C, Lenoir G, Swan D, Tronick S, Aaronson S, Leder P. Translocation of the c-myc gene into the immunoglobulin heavy chain locus in human Burkitt lymphoma and murine plasmacytoma cells. Proc Natl Acad Sci USA. 1982; 79(24): 78377841. Coller HA, Grandori C, Tamayo P, Colbert T, Lander ES, Eisman RN, Golub TR. Expression analysis with oligonucleotide microarrays reveals that MYC regulates genes involved in growth, cell cycle, signaling, and adhesion. Proc Natl Acad Sci USA 2000; 97(7): 32603265. Menssen A, Hermeking H. Characterization of the c-MYC-regulated transcriptome by SAGE: identification and analysis of c-MYC target genes. Proc Natl Acad Sci USA 2002: 99(9): 6274-6279. 43. 44. 45. 46. 47. 48. 49. 50. 51. 52. 53. 54. 55. 56. 57. 58. 17 Kohl NE, Gee CE, Alt FW. Activated expression of the N-myc gene in human neuroblastomas and related tumors. Science 1984; 226(4680): 1335-1337. Lee WH, Murphree AL, Benedict WF. Expression and amplification of the N-myc gene in primary retinoblastoma. Nature 1984; 309(5967): 458-460. Nau MM, Brooks BJ, Battey J, Sausville E, Gazdar AF et al. L-myc, a new myc-related gene amplified and expressed in human small cell lung cancer. Nature 1985: 318(6041): 69-73. Zhang Y, Rowley JD. Chromatin structural elements and chromosomal translocations in leukemia. DNA Repair 2006; 5(9-10): 12821297 Weinberg RA. Oncogenes and tumor suppressor genes. CA: Cancer J Clin 1994; 44(3): 160-170. Kinzler KW, Vogelstein B. Cancer-susceptibility genes. Gatekeepers and caretakers. Nature 1997; 386(6627): 761- 763. Esteller M. Epigenetics and Cancer. N Engl J Med 2008; 358(11): 1148-1159. Junttila MR, Evan GI. p53-a Jack of all trades but master of none. Nat Rev Cancer 2009; 9(11): 821-829: 2009. Hesketh R. The oncogene and tumor suppressor gene facts book. 2nd ed. London: Academic Press. 1997. p.405-489. Burkhart DL, Sage J. Cellular mechanisms of tumour suppression by the retinoblastoma gene. Nat Rev Cancer. 2008; 8(9): 671-672. Orr-Weaver TL, Weinberg RA. A checkpoint on the road to cancer. Nature. 1998; 392(6673): 223-224. Hoeijmakers JH. Genome maintenance mechanisms for preventing cancer.Nature 2001; 411 (6835): 366-374. Pallis AG, Karamouzis MV. DNA repair pathways and their implication in cancer treatment.Cancer Met. Rev. 2010; 29(4): 677684. Nowell PC, Hungerford DA. A minute chromosome in human chronic myelocytic leukemia (CML). Science 1960; 132: 1497. Al-Ali HK, Heinrich MC, Lange T et al. High incidence of BCRABL kinase domain mutations and absence of mutations of the PDGFR and KIT activation loops in CML patients with secondary resistance to imatinib. Hematol J 2004; 5(1): 55-60. Greaves M. Darwin and evolutionary tales in leukemia. The HamWasserman Lecture. Hematology Am Soc Hematol Educ Program 2009; 3-12.