ATOM MODELLERİNİN TARİHSEL GELİŞİMİ
DALTON ATOM MODELİ
John Dalton’un önerdiği atom modeline göre;
1. Elementler atom adı verilen ve bölünemeyen çok küçük parçacıklardan oluşur.
2. Atomlar içi dolu kürelerdir.
3. Bir elementin tüm atomları özdeş olup aynı kütleye, büyüklüğe ve özelliklere sahiptir. Fakat bir
elementin atomları diğer elementlerin atomlarından farklı özelliklere sahiptir.
4. Bileşikler farklı element atomlarının, basit bir oranda birleşmesiyle oluşurlar.
THOMSON ATOM MODELİ
Thomson katot ışınlarıyla yaptığı çalışmalar sonucunda atomun yapısındaki negatif yüklü tanecikleri keşfetti.
Elektron adı verilen bu taneciklerin katot ışınlarını oluşturduğunu ve türüne bağlı olmadan her maddenin yapısında
bulunduğunu ortaya koydu. Bu modele göre ;
1. Atomun yapısında negatif yüklü tanecikler(elektron) ve atom yüksüz olduğu için negatif yükleri
dengeleyen pozitif yüklü tanecikler bulunmalıdır.
2. Atomdaki pozitif yükler bir bulut şeklinde olmalı ve elektronlar bu pozitif yük bulutu içinde
yüzmelidir. (Üzümlü kek modeli)
RUTHERFORD ATOM MODELİ
Rutherford ,atomun yapısını incelemek için radyoaktif bir maddenin yaydığı α+2 (alfa) taneciklerini ince bir
demet halinde altın,gümüş veya bakırdan yapılmış çok ince metal levhaya göndermiştir. Deney sonucunda α
taneciklerinin büyük bir kısmının metal levhadan sapmaya uğramadan geçtiğini, çok az bir kısmının az
miktarda saptığını veya geri döndüğünü gözlemlemiştir. Bu modele göre ;
1. Atom kütlesinin çoğu ve (+) yükün tamamı atomun merkezinde bulunan, çekirdek adı verilen çok
küçük bir hacimde yoğunlaşmıştır.
2. Alfa parçacıklarının çoğu hiçbir sapmaya uğramadığına göre, atomun büyük bir kısmı boş bir uzay
parçasıdır.
3. Atomların çekirdeklerinde bulunan pozitif yüklü taneciklerin büyüklüğü atomdan atoma değişir ve
elementin atom ağırlığının yaklaşık yarısıdır.
4. Atomun kendisi nötr olduğundan çekirdeğin dışında çekirdek yüküne eşit sayıda elektron
bulunmalıdır.
Çekirdekte bulunan yüksüz tanecikler (nötron) James Chadwick (Ceymis Çedvik) tarafından keşfedilmiştir.
1
ELEKTROMANYETİK IŞINLARIN DALGA MODELİYLE AÇIKLANMASI
Elektromanyetik ışın uzayda dalga hareketi ile ilerler. Radyo dalgaları, kızıl ötesi(infrared) dalgalar, görünür bölgedrki
ışık ve X-ışınları elektromanyetik ışıma türleridir.
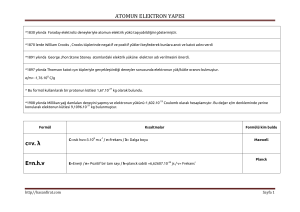
Dalga Boyu( λ ) : Ard arda gelen iki dalga üzerinde benzer noktalar arasındaki uzaklıktır. Başka bir tanımla, iki
maksimum veya iki minimum nokta arasındaki uzaklıktır.
Genlik (A) : Bir dalgada maksimum yüksekliğe veya minimum derinliğe denir. Dalganın şiddeti genliğin karesiyle (A2)
doğru orantılıdır.
Hız (c) : Boşlukta elektromanyetik dalgalar dalga boyuna bağlı olmaksızın aynı hızla hareket eder. C sembolüyle
gösterilen ve 3.108 m/s değerinde olan bu hıza ışık hızı denir.
Işıma frekansı (γ) : Belli bir noktadan bir saniyede geçen dalga sayısıdır. Birimi Hz (Hertz) veya 1/saniye dir.
☺ Dalga boyu ne kadar büyük ise frekans o kadar düşüktür.
☺ Dalga boyu ne kadar küçük ise frekansı o yüksektir.
Örnek : Boşlukta hareket eden bir ışının frekansı 1,2x1014 Hz dir. Buna göre bu ışının dalga boyu kaç metredir?
2
Örnek:Trafik sinyal lambasındaki kırmızı ışığın dalga boyu 750 nm dir. Buna göre bu ışığın frekansı kaç hertz(Hz) dir?
(1nm = 10-9 m)
ELEKTROMANYETİK DALGA SPEKTRUMU
Monokromatik Işık, tek bir dalga boyuna sahip ışıktır.
Polikromatik Işık, dalga boyları farklı ışınlardan oluşan ışıktır. Örnek: güneş ışığı
Bütün frekansları kapsayan elektromanyetik ışın dizisine elektromanyetik spektrum denir.
Yüksek Enerji
Yüksek Frekans
Kısa dalga boyu
Düşük Enerji
Düşük Frekans
Uzun dalga boyu
Görünür bölgede, bütün dalga boylarındaki ışınlardan oluşan beyaz ışık, prizmadan geçirilirse renklere ayrılır. Renk
dizisi kırmızıdan başlar mora kadar devam eder. Kırmızı en uzun dalga boyu en düşük frekansa; mor ise en kısa dalga
boyu ve en yüksek frekansa sahiptir. Göz sadece bu iki renk arasındaki ışınlara karşı duyarlıdır.
IŞIĞIN İKİLİ DOĞASI
Bilim insanları ışık için iki teori ileri sürmüşlerdir.
1. IŞIĞIN DALGA MODELİ
Thomas Young, kendi adıyla anılan girişim deneyini gerçekleştirerek ışığın dalgalı yapıda olduğunu ispatlamıştır.
3
Bu deneyde, bir ışık kaynağının karşısına çift
yarıklı bir engel ve bu engelin arkasına da bir
perde konmuştur. Işık kaynağından gönderilen
ışık, çift yarıktan geçirildiğinde karanlık ve aydınlık
saçaklar oluşur. Bunun nedeni ışığın perde
üzerindeki bazı noktalarda birbirini güçlendirmesi
bazı noktalarda da güçlendirmesidir. Bu da ışığın
tıpkı su dalgaları gibi girişim yaptığını ortaya
koymuştur.
Işığın kırınımı, kırılması, saçılması, girişimi dalga modeli ile açıklanır.
2. IŞIĞIN TANECİK MODELİ
Işığın tanecikler halinde yayıldığını ilk olarak ortaya atan Newton’dur. Daha sonra, Max Plank ışık enerjisinin belirli
büyüklüklerdeki paketler (kuantumlar) halinde alınıp verileceği sonucuna vararak kuantum teorisini geliştirdi. Albert
Einstein, ışık hızı ile hareket eden bu kuantumlara foton adını verdi.
Fotoelektrik olay ve siyah cisim ışıması ışığın tanecik modeli ile açıklanabilmektedir
a) Siyah Cisim Işıması
Üzerine gelen bütün elektromanyetik ışınları soğuran cisimlere siyah cisim denir. Siyah
cisim bir metalden veya kilden yapılmış, her yanı kapalı ve içi karbonla sıvanmış borunun
üzerine bir delik açmakla hazırlanabilir.
Yapılan deneyler ısıtılan siyah cisimlerin sıcaklığa bağlı olarak farklı renklerde olduğunu
gösterdi. Soğuk bir siyah cisim bir miktar enerjiye sahip olduğu için gözle görülemeyen
kızıl ötesi ışınlar yayar. Eğer siyah cisim ısıtılırsa bir süre sonra sırasıyla kırmızı, turuncu,
sarı, beyaz olarak değişir. Klasik fiziğe göre enerjisi artan cismin, yaptığı ışımanın
şiddetinin artması beklenir.
Plank Kuantum Kuramı
Isıtılan cisimler tek bir renkte ışık oluşturmaz ve ışının şiddeti sonsuza kadar artmaz. Örneğin, ısıtılan bir demir metali
sırasıyla kırmızı, sarı ve son olarak da beyaz ışık oluşturur. Yani ısınan demir sadece kırmızı ışık yaymaz ve ısı arttıkça
kırmızı ışığın şiddeti sonsuza kadar artmaz. Kırmızı ışık belirli bir maksimum şiddete ulaştıktan sonra demir daha
yüksek enerjili sarı renkte ışın ve sırasıyla diğer yüksek enerjili ışınları oluşturur. Planck, ışık şiddetinin sürekli
artmadığını ve ışıma enerjisinin maddeler tarafından belli büyüklüklerdeki enerji paketleri halinde yayıldığını veya
soğurulduğunu belirtmiştir. Bu enerji birimleri için kuantum kelimesi kullanılır. Plank her bir kuantumun enerjisini
hesaplamak için
E= h.γ bağıntısını kullandı. h plank sabiti olup, değeri 6,63.10-34 J.s dir.
Işımanın frekansı arttıkça, kuantumun enerjisi ve kuantumlardan oluşmuş ışımanın enerjiside artar.
4
b) Fotoelektrik Olay
Bir metal yüzeyine düşürülen ışın ile, metal yüzeyinden elektron
uzaklaştırılması olayına fotoelektrik etki denir.
Metal yüzeyine gönderilen ışından elektrona enerji aktarılır. Bu enerji
elektronu koparmak için harcanır. Eğer enerji fazla ise, fazla enerji
elektrona kinetik enerji olarak verilerek elektronun hızlanması ve
fırlaması sağlanır.
Metal yüzeyine gönderilen ışının, şiddeti arttırıldığında (yani yeşil ışık daha
parlak yeşil ışık yapıldığında) aynı enerjiye sahip daha fazla elektron kopar.
Işımanın enerjisi arttırıldığında ise fırlayan elektronların hızı artar. Çünkü
elektronu koparmak için gerekli enerji sabit olduğundan daha fazla enerji
elektrona kinetik enerji olarak aktarılır.
Fotoelektrik olay Einstein tarafından açıklanmıştır.
ATOM SPEKTRUMLARI
Beyaz ışık (güneş ışığı) önce dar bir demet yapıcı yarıktan
daha sonra prizmadan geçirilirse görünür bölgede mordan
kırmızıya kadar değişen bütün renkleri içeren kesiksiz
(sürekli) spektrum elde edilir.
5
Elementler, gaz veya buhar halde gerekli yüksek sıcaklığa
kadar ısıtılırsa ışıma meydana gelir. Işımanın prizmadan
geçirilmesi ile kesikli (çizgi) spektrumu elde edilir.
Elementler görünür bölgenin değişik kesimlerinde parlak
çizgiler oluşturur. Oluşan bu çizgi spektrumlarının sebebi
maddelerin enerji aldıklarında, kendine özgü dalga
boylarında ışık yayımlamasıdır. Elementin yayınladığı
görünür bölge ışıması, beyaz ışıkta gözlenebilen tüm dalga
boylarını değil sadece o elemente özgü bir bölümünü içerir.
Her elementin yayımladığı çizgi spektrumu birbirinden
farklıdır. Bunlardan yararlanılarak maddelerin tanınması
sağlanır.
Her element atomunun kendine özgü yayınma spektrumu
olduğu gibi, soğurma (absorpsiyon) spektrumu da vardır.
Çünkü elementler hangi dalga boyunda ışıma yayıyorsa o
dalga boyundaki ışımaları soğurabilir.
Balmer ve Rydberg hidrojen görünür bölge yayınma spektrumundaki en uzun dalga boylu üç çizginin dalga boylarını
hesaplamaya yarayan bir eşitlik geliştirdiler. Bu eşitlik Rydberg eşitliği denir.
BOHR ATOM MODELİ
Bohr atom modelini, hidrojenin yayınma spektrumuna dayanarak ve Planck’ın kuantum kuramını göz önünde
bulundurarak geliştirmiştir.
1. Elektron çekirdek etrafında belirli uzaklıklarda bulunan dairesel yörüngelerde hareket eder.
2. Her yörüngeye karşılık gelen bir enerji değeri vardır. Bu yüzden bu yörüngelere enerji düzeyleri de
denir.
3. Elektron, içinde hareket halinde bulunduğu yörüngenin enerjisine sahiptir.
4. Yörüngeler K,L,M,N,O gibi harflerle gösterildiği gibi 1,2,3,4,5… gibi rakamlarla da gösterilebilir.
5. Çekirdekten uzaklaştıkça (1,2,3,4,5…) o kabukta bulunan elektronun enerjisi artar.
6. Elektron yörünge üzerinde ne kadar kalırsa kalsın enerjisi sabittir.
7. Bir atomun elektronunun çekirdeğe en yakın kabukta bulunduğu hale atomun temel hali denir.
8. Atomun elektronunun dışarıdan enerji alarak daha yüksek enerji düzeylerine ( n=1,2,3,4…) geçmesi
olayına uyarılmış hal denir.
9. Çekirdekten tamamen uzaklaşmış elektronun enerjisi sıfırdır.
10. Bir elektron yüksek enerji düzeyinden düşük enerji düzeyine geçerken seviyeler arasındaki enerji farkı
kadar enerji ( ısı ya da ışık ) yayar.
6
Elektron yüksek enerjili bir katmandan n=1 katmanına inerse ultraviyole şeklinde enerji yayınlanır. Lyman
serisi adı verilen spektral seri meydana gelir.
Yüksek enerjili bir katmandan n=2 katmanına olan elektron geçişleri görünür bölgede gerçekleşmiş olur ve
Balmer serisi adını alır.
Yüksek enerjili bir katmandan n=3 katmanına olan elektron geçişleri ise kızılötesi bölgede(IR, infraraed)
spektrum çizgileri oluşturarak Paschen Serisi adını alır.
Yüksek enerjili bir katmanlardan n=4 katmanına olan elektron geçişlerine Brackett serisi, n=5 katmanına olan
elektron geçişlerine de Pfund serisi adı verilir.
Layman serisinde Balmer serisine göre daha çok enerji açığa çıkar.
Örnek: Hidrojen atomunun 3.temel enerji düzeyindeki, bir elektronun enerjisi kaç Joule dür?
Örnek : 4.temel enerji düzeyinden 1.temel enerji düzeyine düşürülen bir hidrojen atomu elektronunun
fotonun dalga boyu kaç nm dir? (c=3.108 m/s)
yaydığı
7
Örnek: Hidrojen atomuna çarpan bir foton, temel haldeki elektronun 3.enerji düzeyine çıkmasına neden oluyor. Bu
elektron 3.düzeyden 2.düzeye düşerse yayınlanan ışının frekansı ve dalga boyu kaç olur?
Atom Altı Parçacıkların Dalga Özelliği
Bohr Atom Modeli; H, He+, Li+2 gibi tek elektronlu türlerin spektrumlarını başarıyla açıkladığı halde birden fazla
elektron içeren türlerin spektrumlarını açıklamada yetersiz kalmıştır.
Dalga mekaniğindeki gelişmelerin elektronun hareketine uygulanması modern atom modelini geliştirmiştir.
Louis de Broglie, ışık ve maddenin yapısını dikkate alarak, küçük taneciklerin dalgaya benzer özellikler
gösterebileceğini ileri sürdü.
Dalga-Tanecik İkiliği
Louis de Broglie ve Schrödinger ışığın dalga ve tanecik teorilerini birleştirerek bugünkü dalga mekaniğinin temelini
oluşturdular.
De Broglie, hareket eden maddesel parçacıklarında dalga gibi davranabileceğini söyledi. Fotonun dalga boyunun
hesaplanması için kullanılan yukarıdaki eşitlik maddesel bir parçacığın (örneğin elektron, proton, nötron) dalga
boyunun hesaplanması içinde kullanılabilir. Hesaplanan dalga boyu de Broglie dalga boyu olarak da bilinir.
Örnek : Yaklaşık hızı 1.108 m/s olan bir elektronun oluşturduğu dalganın boyu kaç nm dir? (m e=9,109.10-31kg
h=6,626.10-34 kg.m2.s-1)
Örnek : 400 m/s hızla hareket eden 250 gramlık topun yaptığı de Broglie dalga boyu kaç metredir?
(h=6,626.10-34 kg.m2.s-1)
8
De Broglie’nin tezinden sonra, George Paget Thomson, Davisson ve Germer yaptıkları deneylerle
elektronlarında X-ışınları gibi kırınım ve girişime uğradığını ispatlayarak elektronların dalga özelliği
gösterdiğini belirlemişlerdir.
Heisenberg Belirsizlik İlkesi
Elektronun yeri ne kadar yüksek kesinlikle belirlenirse, hızı daha az kesinlikle belirlenebilir veya hızının
belirlenmesindeki kesinlik arttıkça yerinin belirsizliği artar. Bu durum Heisenberg Belirsizlik İlkesi denir.
Bu ilkeye göre, elektronların çekirdek etrafında belirli dairesel yörüngeler izledikleri deneysel olarak ispatlanamaz.
Yani Bohr’un dediği gibi elektronların dairesel hareket yaptığı belirlenemez. Ancak yörünge yerine elektronların
çekirdek etrafında bulunma olasılığının olduğu bölgelerden söz edilir.
9
NELER ÖĞRENDİK;
Sürtünme ile elektriklenmede iki tür yükün olduğunu keşfeden ilk kişi Benjamin Franklin’dir.
Faraday, elektroliz deneyleri yaparak elektriğin maddeler üzerindeki etkisini incelemiştir. Maddeyi
oluşturan atomlarda, atom altı taneciklerin keşfine olanak sağlamıştır.
Stoney atomlarda elektrik yüklü birimlerin bulunduğunu öne sürdü ve bunlara elektron adı
verilmesini önerdi.
Crooks, geliştirdiği ve kendi adıyla da anılan Crooks tüpleri ile yaptığı deneylerde katot ışınlarını
keşfetti.
Thomson, katot ışınlarına manyetik alan uygulayarak, elektronun e / m oranını hesaplamıştır.
Elektron yükü, Millikan tarafından Yağ Damlası deneyi ile ölçülmüştür.
Kanal ışınları ilk defa araştıran Eugen Goldstein'dir.
Moseley, X-ışınlarını kullanarak, atom numaralarını hesaplamıştır.
Rutherford, α saçılma deneyi ile, atom kütlesinin çoğu ve (+) yükün tamamının atomun merkezinde
bulunan, çekirdekte yoğunlaştığını ve atomun büyük bir kısmının boş bir uzay parçası olduğunu
belirlemiştir.
Çekirdekte bulunan yüksüz tanecikler (nötron) Chadwick (Çedvik) tarafından keşfedilmiştir.
Thomas Young, kendi adıyla anılan girişim deneyini gerçekleştirerek ışığın dalgalı yapıda olduğunu
ispatlamıştır.
Max Plank ışık enerjisinin belirli büyüklüklerdeki paketler (kuantumlar) halinde alınıp verileceği
belirterek kuantum teorisini geliştirdi.
Albert Einstein, ışık hızı ile hareket eden bu kuantumlara (enerji paketlerine) foton adını verdi.
Fotoelektrik olay Einstein tarafından açıklanmıştır.
Bohr atom modeline göre, elektronun çekirdek etrafında belirli uzaklıklarda bulunan dairesel
yörüngelerde hareket ettiğini ileri sürmüştür.
De Broglie, hareket eden maddesel parçacıklarında (örneğin elektron, proton, nötron) dalga gibi
davranabileceğini söyledi.
De Broglie’nin tezinden sonra, George Paget Thomson, Davisson ve Germer yaptıkları deneylerle
elektronlarında X-ışınları gibi kırınım ve girişime uğradığını ispatlayarak elektronların dalga özelliği
gösterdiğini belirlemişlerdir.
Heisenberg Belirsizlik İlkesine göre, elektronun yeri ne kadar yüksek kesinlikle belirlenirse, hızı
daha az kesinlikle belirlenebilir veya hızının belirlenmesindeki kesinlik arttıkça yerinin belirsizliği
artar.
10
1) …………………………………….. fotonların metalden elektron koparmasıdır.
2) Louis de Broglie ye göre hareket eden parçacıklarda(örneğin elektron, proton ) …………………………..gibi
davranır.
3) Heisenberg in belirsizlik ilkesine göre bir elektronun ………………………. ve …………………. aynı anda belirlenemez.
4) Heisenberg in belirsizlik ilkesi …………………. atom modelindeki yörünge fikrini çürüttü.
5) ………………………… serisindeki elektron geçişleri görünür bölgedede ışın verir.
6) Üzerine düşen bütün cisimleri soğuran cisimlere…………………………………. denir.
7) Görünür bölgedeki dalga boyu en küçük ışık ………………….., en büyük ışık ………………………dır.
8) Elementlerin gaz veya buhar hallerinin yüksek sıcaklıkta yaydığı ışımalar prizmadan geçirilirse
……………………………………………………..elde edilir.
9) Planck bir kuantumun taşıdığı enerji için ……………………….. bağıntısını kullanmıştır.
10) Siyah cisim ışıması, fotoelektrik olay gibi olaylar ışığın…………………………………özelliğini açıklar.
11) Young deneyi ışığın ……………………….özelliğini kanıtlar.
12) Tek bir dalga boyuna sahip ışığa ………………………………………….., dalga boyu farklı ışınlardan oluşan ışığa
……………………………………ışık denir. Güneş ışığı ……………………….ışığa örnektir.
13) Elektromanyetik dalgalar için dalga boyu ile frekansın çarpımı ………………………………..eşittir.
14) Rutherford atom modeline göre;
Bir atomda……………………yükün tamamı, ………………………..denilen küçük bölgede toplanmıştır.
……………………..yüklerin toplam kütlesi atom kütlesinin yaklaşık…………………kadardır.
………………parçacıklarının çoğu
…………………………..ibarettir.
hiçbir
sapmaya
uğramadığına
göre
atom
çoğunlukla
15) Ardı ardına gelen iki dalga üzerinde benzer noktalar arasındaki uzaklığa …………………………….denir.
16) Belirli bir noktadan bir saniyede geçen dalga sayısına ………………………….denir.
17) Bir dalgada maksimum yüksekliğe veya minimum derinliğe……………………..denir.
18) Gama ışınlarının frekansı görünür bölge ışığından ……………………….tür.
19) Fotoelektrik
olayda
ışıma
şiddetinin
sayısını……………………..fakat……………………………değiştirmez.
arttırılması
fırlatılan
elektron
20) Bohr atom modeline göre,
Bir atomda buluna elektron çekirdekten anck belirli uzaklıklardaki ……………………….bulunabilir.
Elektron en düşük enerji düzeyinde bulunmak ister. Madde enerji aldığında atomlarındaki
elektronlar……………………….enerji
düzeyine
geçer.
Bu
durumdaki
atomlara
…………………………………….denir.
21) Yüksek enerji katmanından n=1 katmanına inen elektron ………………………şeklinde ışık yayınlar.
………………………………..adı verilen seri meydana gelir.
22) …………………………., …………………………., ………………………… ve ……………………ışığın dalga özelliği ile açıklanır.
23) Planck ışının……………………………..oluştuğunu ileri sürmüştür.
24) Bohr atom modeline göre, elektron içinde hareket halinde olduğu ……………………………enerjisini alır.
25) Thomsonun atom modeline ………………………….modeli de denir.
Ufuk Kara – Kimya Ögretmeni
11
ÇALIŞMA SORULARI
ALIŞTIRMA:
Aşağıda verilen birimlerin karşılığını yazınız.
5 μm = …………………………..m
15 pm=………………………………cm
100 nm= …………………………..m
…………………………Ao= 10 -6 m
500 nm=………………………….. Ao
…………………………Ao= 10 -2m
1. Aşağıda kütle spektrometresine gönderilen madde çiftleri verilmiştir. Buna göre verilen madde çiftlerinin
sapma açılarını karşılaştırınız.
1 +
2 +
I.
H
ve
D
4
+
4
II.
He
ve
He+2
20
+2
4
III.
Ne ve
He+2
2. Dalga boyu 7.10-5 cm olan kırmızı ışık için ;
a) Frekansı kaç 1/saniyedir?
b) Enerjisi kaç J dir?
(h=6,63x10-34 J.s , c=3.1010 cm/s)
3. Bir LED 700 nm ışık üretiyorsa bu ışığın frekansı kaçtır? (c=3.108 m/s, 1 nm= 10-9 m)
12
4. Frekansı 1012 Hz olan bir ışımanın dalga boyunu m, nm ve Ao olarak hesaplayınız. (c=3.108 m/s)
(1 Ao = 10-10 m , 1 nm= 10-9 m)
5. Hidrojenin Lyman serisinde n=2 den n=1 e geçiş sırasındaki spektrum çizgisinin frekansını hesaplayınız.
6. Hidrojen atomunun Balmer serisinde n=3 ten n=2 ye olan elektron geçişini temsil eden spektrum çizgisinin
dalga boyu ve frekansını hesaplayınız.
7. Hidrojen elektronunun 1.Bohr yörüngesinden, 4.Bohr yörüngesine uyarılması için,
a) Gereken enerji kaç J dir?
(h=6,63x10-34 J.s)
b) Elektronun soğurduğu ışımanın dalga boyu kaç m dir?
13
8. Hidrojenin elektronunun temel halden 3. Bohr yörüngesine uyarılması için
a) Gereken enerjiyi
b) Elektronun soğurduğu ışımanın dalga boyunu hesaplayınız. (h=6,63x10-34 J.s)
9. Li+2 iyonunda bir elektronun n=4 ten n=2 ye geçişi sırasında yayınlanan ışımanın;
a) Enerji değerini
b) Frekansını
c) Dalga boyunu hesaplayınız.
(h=6,63x10-34 J.s) , (c=3.108 m/s)
14