Dersin Künyesi
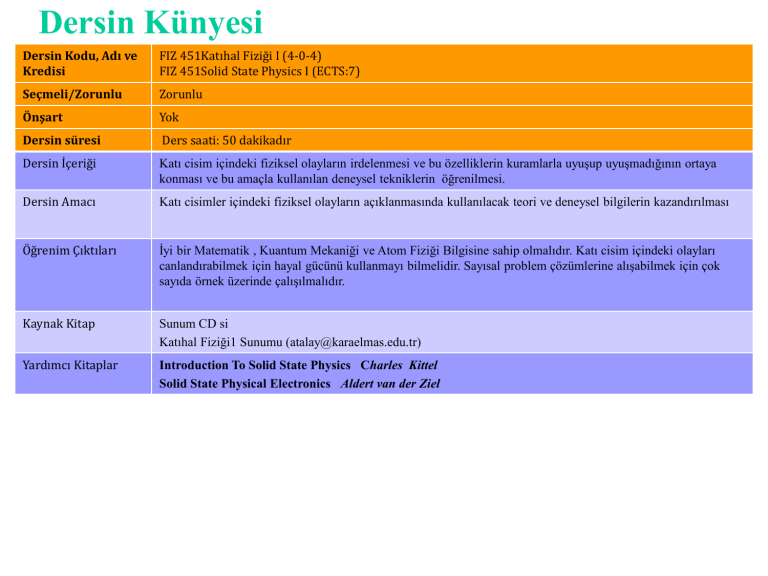
Dersin Kodu, Adı ve
Kredisi
FIZ 451Katıhal Fiziği I (4-0-4)
FIZ 451Solid State Physics I (ECTS:7)
Seçmeli/Zorunlu
Zorunlu
Önşart
Yok
Dersin süresi
Ders saati: 50 dakikadır
Dersin İçeriği
Katı cisim içindeki fiziksel olayların irdelenmesi ve bu özelliklerin kuramlarla uyuşup uyuşmadığının ortaya
konması ve bu amaçla kullanılan deneysel tekniklerin öğrenilmesi.
Dersin Amacı
Katı cisimler içindeki fiziksel olayların açıklanmasında kullanılacak teori ve deneysel bilgilerin kazandırılması
Öğrenim Çıktıları
İyi bir Matematik , Kuantum Mekaniği ve Atom Fiziği Bilgisine sahip olmalıdır. Katı cisim içindeki olayları
canlandırabilmek için hayal gücünü kullanmayı bilmelidir. Sayısal problem çözümlerine alışabilmek için çok
sayıda örnek üzerinde çalışılmalıdır.
Kaynak Kitap
Sunum CD si
Katıhal Fiziği1 Sunumu (atalay@karaelmas.edu.tr)
Yardımcı Kitaplar
Introduction To Solid State Physics Charles Kittel
Solid State Physical Electronics Aldert van der Ziel
Dersin İşleme planı
Hafta
Konular
1. Hafta
Katıhalin tanımı, Kristal Yapısı, kristal simetrileri
2. Hafta
Örgü doğrultu ve düzlemleri,
3. Hafta
Katı cisimler de bağ modelleri, Kristal bağları
4. Hafta
Kovalent Bağlar
5. Hafta
Metalik Bağlar
6. Hafta
Kristallerde bağ enerjisinin kuantum mekaniği ile hesaplanması
7. Hafta
I.Arasınav-Van Der Waals Bağlarının Hesabı
8. Hafta
Metalik Bağların hesabı
9. Hafta
10. Hafta
Metal ve Yarı iletkenlerin serbest elektron teorileri
Serbest Elektronların Kuantum Teorisi
11. Hafta
Elektrik iletkenlik
12. Hafta
II.Arasınav-Katı cisimlerde spesifik ısı
13. Hafta
Katı cisimlerin band modeli
14. Hafta
Katı cisimlerin band modeli-devam
KATIHAL FÝZÝÐİ
Prof.Dr. Turgay
ATALAY
DERS İÇERİĞİ
Bölüm 1
Cisimlerin Kristal Yapısı
Bölüm 2
Katı cisimlerde Atomlar Arasındaki Bağ Çeşitleri
Bölüm 3
Metal ve Yarıiletkenlerin Serbest Elektron Teorisi
Bölüm
Katı Cisimlerin Band Modeli
4
YARDIMCI KİTAPLAR
Introduction To Solid State Physics
Charles Kittel
Solid State Physical Electronics
Aldert van der Ziel
Katıhal Fiziği
Turgay Atalay
Bu ders notları İ.Ü. Emekli Öğretim Üyesi ve Doktora Hocam Sayın
Prof.Dr. Sait AKPINAR’ın notları esas alınarak düzenlenmiştir.
cam
GİRİŞ
Kesin ergime sıcaklığı yok. AMORF
Kesin ergime sıcaklığı var. KRİSTAL
NaCl
Ergime Noktası = Donma Noktası = 801 oC
O
Na
Cl
Si
NaCl’ün kristal
yapısı
Camın kristal
yapısı
BÖLÜM 1
1.HAFTA
CÝSÝMLERÝN KRÝSTAL YAPISI
Kristaller, birbirinin ayný olan atomik veya moleküler yapý taþlarýnýn, uzayda, periyodik ve düzenli
sýralanmasý ile meydana gelen cisimlerdir. Bu tanýma tamamen uyan kristale Ýdeal (mükemmel)
kristal denir. Doðada bulunan veya laboratuvarlarda yapýlan kristallerin hiç biri ideal kristal
deðildir. Ancak göz önüne alýnan fiziksel özellik bakýmýndan bazý hallerde kristalleri ideal kabul
etmek mümkün olabilir. Ýdeal kristal yapýsýna ulaþabilmek için büyük çaba harcanmasý gerekir.
TRANSLASYON (ÖTELEME) GRUBU
Ýdeal bir kristali,
gibi ayný düzlemde olmayan, üç temel
öteleme (translasyon) vektörü tarafýndan belirlenen bir
ÖRGÜ
yardýmý ile tanýmlayabiliriz. Bu örgüde , herhangi bir noktasýndan
örgü noktalarýnýn konumlarýna bakýldýðýnda görülen þekil , baþka
ve
r r n1 a n2 b n3 c
ile tanýmlanan baþka bir noktadan görülen þeklin ayný olmalýdýr.
Burada n1 , n2 ve n3 keyfi olarak seçilen tam sayýlardýr.
a,b, c
öteleme vektörlerine Örgü Vektörleri veya örgünün belirlediði
Kristal Eksenleri denir. Bir kristali kendisine paralel olarak
T n1 a n2 b n3 c
kadar kaydýrmaya Öteleme (Translasyon) iþlemi adý verilir. n1 , n2
ve n3 ' ün alabileceði deðerlerin tümüne Kristalin Öteleme Grubu
denir.
Buna göre, noktalarýn üç boyutta paralel dizilmesi sonucu
oluþan örgü , aslýnda var olmayan düþünsel bir olgudur. Kristal ise,
örgünün her noktasýna oturmuþ, cins , doðrultu ve düzen
bakýmýndan birbirinin eþi ünitelerin bir araya gelmesinden oluþan bir
varlýktýr.
.
.
.
.
.
.
b
.
.
.
a
.
.
.
KRÝSTALLOGRAFÝK NOKTA GRUPLARI
Nokta Grubu , örgünün bir noktasýnda uygulanabilen simetri
iþlemleri'nin
tümüne
verilen
isimdir.
Simetri
iþlemlerinin
uygulanmasý kristalin birim takýmýný deðiþmez (invaryant)
býrakmalýdýr. Simetri iþlemleri bir nokta etrafýnda , n tam sayý
olmak üzere, 2 / n açýsýyla dönme, yansýma ve bunlarýn
kombinasyonundan meydana gelen iþlemlerdir.
Öteleme iþleminin dönme simetri açýlarýna koyduðu sýnýrlamayý görmek için Þekil 1.3
deki örgü noktalarýnda yapýlan açýsý kadar yapýlan dönme sonucu ulaþýlan p ve q noktalarýný
ele alalým.
q
p
m.
a
a
a
a
Şekil 1.3
Bu noktalarýn örgü noktalarý olmasý gerekeceðinden, açýsý geliþi
güzel bir açý olamaz. p ve q noktalarýnýn örgü noktalarý olabilmesi için
aralarýndaki m.a uzaklýðýnýn, örgünün öteleme vektörü a nýn bir tam katý
olmasý, yani, m bir tam sayý olmak koþulu ile;
pq m. a
olmalýdýr. m.a uzunluðu,
m.a = a + 2a Cos
olduðundan,
Cos
m 1
2
olur. m, tam sayý olduðundan, (m-1) de tam sayý olmak zorundadýr. Diðer
taraftan Cos , 1 arasýnda deðerler alabileceðinden (m-1) in - 2 ile + 2
arasýndaki tam deðerleri geçerli çözümler olacaktýr. Buna göre, (m-1) in
alabileceði deðerler , açýlarý ve bunlara karþý gelen dönme kat sayýlarý
tabloda gösterilmiþtir.
(m-1) Cos = 2 / n
n
2
1/2
120
2
1
0
120
3
0
0
90
4
1
1/2
60
4
2
1
0 - 360
1
x
Dönme Ekseni
x
Dönme-Tersinme Ekseni
X/m
Dönme Ekseni ile Ona Dik Yansýma
Düzlemi
X2
Dönme Ekseni ile Ona Dik Ýkili eksen
Xm
Dönme Ekseni ile Ona Paralel
Yansýma Düzlemi veya Düzlemleri
xm
Dönme-Tersinme Ekseni ile Ona
Paralel Yansýma Düzlemi veya
Düzlemleri
x
m
m
(X/ mm) Dönme Ekseni ile Ona Dik
Bir Yansýma Düzlemi ve Paralel
Yansýma Düzlemleri
SÝSTEM
Sistem
Ýçinde
Örgü
Sayýsý
Örgü
Sembolü
BirimHücre
Eksen ve
Açýlarý
Belirtilmesi
Gereken
Uzunluklar,
Açýlar
Örgü
Simetrileri
TRÝKLÝN
1
P
ab c
a,b,c
,,
MONOKLÝN
2
P
C
abc
= =90
a,b,c
2/m
ORTOROMBÝK
4
abc
= = =90
a,b,c
mmm
TETRAGONAL
2
P
C
I
F
P
I
a=b c
= = =90
a,c
4/mmm
KÜBÝK
3
a=b=c
= = =90
a
m3m
TRÝGONAL
1
P
I
F
R
a=b=c
= = <120
a
HEKSAGONAL
1
P
a=b c
= =90
=120
a,c
1
m
6/mmm
a
o
60
60
o
a
Primitif hücre
Kübik F
örgüsünün primitif hücresi
KÜBÝK P
KÜBÝK I
KÜBÝK F
Birim hücre hacmi
Birim hücre baþýna örgü
noktasý
a3
a3
a3
1
2
4
1 / a3
2 / a3
a
3 a/2
6
8
12
2 a
a
a
12
6
6
Birim hacimde örgü noktasý
En yakýn Komþu nokta
Uzaklýðý
4 / a3
a/2
En yakýn komþu sayýsý
Ýkinci komþu uzaklýðý
Ýkinci komþu sayýsý
2.HAFTA
1.5. ÖRGÜ DOÐRULTU VE DÜZLEMLERÝ
1 - Önce yukarýda olduðu gibi, düzlem üzerinde bulunan ve 3
eksen üzerinde, olan 3 noktanýn örgü sabiti cinsinden koordinatlarý
alýnýr. Bunlar 3 tam sayýdýr.
2 - Bu sayýlarýn tersleri alýnýr.
3 - Kesirler oluþursa bunlar en küçük tam sayýya
dönüþtürülür.
Eksenler
a
b
c
1. Ýþlem
2
4
2. iþlem
1/2
1/4
1/ =0
3. iþlem
2
1
0
Düzlem (210) şeklinde
tanımlanır.
Bu sayılara Miller İndeksleri
denir ve (hkl) şeklinde
gösterilir.
c
a
1
2
b
1
2
3
4
c
Bir [uvw] zon ekseni ile bu zona ait bir
(hkl) düzlemi indeksleri arasýnda;
(110)
u.h + v.k + w.l =0
baðýntýsý vardýr.
(122)
Birbirleri ile kesiþen (h1 k1 l1)
ve (h2 k2 l2) düzlemlerinin zon ekseni
[uvw] nin koordinatlarý
b
a
(100)
Kübik örgüde düzlemler
u k1l2 k 2l1
v l1h2 l2 h1
w h1k 2 h2 k
ile hesaplanýr. u, v ve w yi,
u
v
w
h1
k1
l1
h2
k2
l2
matrisi ile hesaplamak daha kolaydır.
3.HAFTA
BÖLÜM 2
KATI CÝSÝMLERDE ATOMLAR ARASINDAKÝ BAÐ ÇEÞÝTLERÝ
1
2
3
4
5
-
ÝYONÝK BAÐ
KOVALENT BAÐ
METALÝK BAÐ
VAN DER WAALS BAÐI
HÝDROJEN BAÐI
Bu baðlarýn hemen tümü elektrostatik karakterlidir. Bunun
yanýnda elektronlarýn hareketinden doðan kinetik etkilerden
kaynaklanan ve çok az da magnetik kuvvetlerden kaynaklanan bað
enerjileri ile karþýlaþýlýr. Atom veya moleküllerin elektron
daðýlýmlarý baðlantý türünü belirleyen en önemli etkendir. Bu
nedenle yukarýdaki bað çeþitlerini her kristalde kesin olarak
ayýrdetmek mümkün olmaz. Hatta bazý kereler ayný kristalin farklý
kristal eksenleri boyunca farklý bað türleri gözlenebilir.
II.1. ÝYONÝK BAÐLAR
Ýyonik kristallerde elektronlar bir cins atomdan
baþka bir cins atoma transfer ederler. Böylece oluþan
pozitif ve negatif iyonlar arasýndaki Coulomb
elektrostatik kuvvetleri iyonik baðýn kaynaðý olurlar.
Örneðin NaCl ymk (yüzey merkezli kübik) yapýda; CsCl
basit kübik yapýda kristallerdir.
NaCl ‘ün kristal yapısı
CsCl ‘ün kristal yapısı
Na
Name of Element : Sodium
Atomic Weight : 23.0
Atomic Number : 11
Group : Alkali Metals
Cl
Name of Element : Chlorine
Atomic Weight : 35.5
Atomic Number : 17
Group : Halogens
Electron Configuration: 1s2
2s2 2p6 3s1
Electron Configuration: 1s2
2s2 2p6 3s2 3p5
1s2 2s2 2p6
1s2 2s2 2p6 3s2 3p6
Cl
Na
NaCl
Ýyonik kristallerin baþlýca karakteristikleri elektrik iletkenliklerinin
çok düþük olmasý, ýsýtýlýnca iyonik karakterde yüksek iletkenlik
göstermeleri, kýrmýzý berisi ýþýnlarý þiddetle absorplamalarýdýr.
Ýyonik kristallerin baðlantý enerjileri büyüktür.
Örneðin oda sýcaklýðýnda baðlantý enerjisi
NaCl için
180 kcal / kmol;
LiF için
240 kcal / kmol dür.
Baðlantý enerjisinin büyük olmasý
Kristalin sert, ergime noktasýnýn yüksek olmasý demektir.
Ýyonik kristallerde valens elektronlarýnýn belirli atomlara oldukça
sýký olarak baðlý kaldýklarý büyük bir yaklaþýklýkla söylenebilir. Bu
nedenle düþük olan elektrik iletkenlik yüksek sýcaklýklarda iyonlarýn
kendilerinin harekete geçmesiyle iyonik karakterde olmak üzere
oldukça büyük deðerler alabilir.
4.HAFTA
II.2. KOVALENT BAÐLAR
Bu çeþit baðlarda elektron çiftleri önemli rol oynar.
Elektronlardan her biri, birbirine baðlanan atomlarýn her ikisine de
aitmiþ gibi davranýrlar. Kovalent baða en basit örnek hidrojen
molekülünde gösterilebilir. Hidrojen molekülünün kuantum mekaniði
LONDON ve HEITLER tarafýndan 1927 de yapýlmýþtýr.
Bir çekirdek ile bir elektrondan oluþan nötr hidrojen atomunu
temsil etmek üzere, öz titreþim frekansý o olan bir elektriksel
titreþim devresi ele alalým. Birbirinin ayný olan ve öz titreþim
frekanslarý o olarak tanýmlanan
bu iki devre birbirine
yaklaþtýrýlýrsa bilindiði gibi rezonans olayý meydana gelir.
k
k (kuplaj sabiti) =
H
L12 L21
m1m2
ve frekanslarý 1 ve 2 ise
L 21
L 12
Þekil 2.3. kuplaj devresi
2
1
20
1 k
2
2
2
20
1 k2
dir. Eðer k küçük ise
02 12 22
olur; k büyük ise eþitlik geçerliliðini yitirir.
Ýki devre daha da birbirine yaklaþtýrýlýrsa, baþka bir deyiþle aralarýndaki kuplaj
arttýrýlýrsa bir o frekansý yerine biri o dan küçük diðeri büyük iki frekans ortaya çýkar.
Baþlangýçta iki hidrojen atomundan oluþan sistemin toplam enerjisi
2Eo = 2 h o iken atomlarýn birbirine yaklaþmasý sonucu oluþan
sistemin (hidrojen molekülünün) birbirinden farklý ;
E1 = 2 Eo W1(R)
ve
E2 = 2 Eo + W2(R)
enerjilerine sahip olacaðý anlaþýlýr.
W1(R) ve
W2(R)
enerjileri iki hidrojen atomu arasýndaki R
uzaklýðýna baðlý kuplaj enerjileridir.
Atomlar birbirinden uzakta iken (disosye olmuþ iken)
sistemin toplam enerjisi E1,
sistemin toplam enerjisi 2Eo ise
E1 < 2E0 dır.
Buna göre E1 enerjisi bir denge, yani bir baðlantý enerjisidir. E2
enerjisi ise iki atomun birbirini itmesine karþýlýktýr.
E1 ve E2enerjileri hidrojen için R ye baðlý olarak hesaplanýrsa
Þekil 2.4 deki eðriler elde edilir.
E(eV
)
5
4
3
2
1
-1
-2
-3
-4
E2
itme
Ro
R
E1
çekme
Þekil2.4 Hidrojen molekülündeki kovalent baðlanmada potansiyel enerji eðrileri
W1 (R) kuplaj enerjisi, iki atomun birbiriyle etkileþmesi
sonucunda dalga fonksiyonlarýnda ortaya çýkan deformasyonun
Hidrojen atomlarý arasýndaki ossilasyon enerjisine karþýlýk gelir.
Bir dalga fonksiyonunun karesi, elektronun belirlenen yerde
bulunma olasýlýðýný verdiði için bu da moleküldeki iki elektronun
atomlar arasýnda ayný frekansla titreþmesi þeklinde yorumlanabilir.
Baþka sözlerle, W1 (R)
bir elektron deðiþ tokuþ (exchange)
enerjisidir.
Periyodik sistemin en sað tarafýndaki elementlerin kapalý bir zarf
oluþturmak için bir veya bir kaç elektronlarý eksiktir. Böyle iki atomun,
örneðin iki Cl atomunu yukarýda yaptýðýmýz gibi birbirine yaklaþtýralým.
Burada da , hidrojende olduðu gibi, iki atom birer elektronlarýný kovalent
bað (elektron çifti baðý) oluþturmak için kullanýrlar, (Þekil 2.5)
Þekil 2.5. Klor molekülünde elektronlarýn ortak
kullanýmý.
Ýki klor atomu arasýnda kalan iki elektron her iki atom tarafýndan da
paylaþýlýr. Pauli Prensibi bu iki elektronun spinlerinin anti-paralel olmasýný
gerektirir. Deðiþ-tokuþ elektronlarý için R uzaklýðýna baðlý olarak potansiyel
enerji deðiþmesi Þekil 2.4 deki E1 eðrisine karþýlýk geldiði halde paralel
spinler için E2 eðrisine benzer bir itme eðrisi elde edilir.
Benzer þekilde dýþ yörünge elektron konfigürasyonu 2 s2 2p2
olan karbon atomlarý da dört komþusunun elektronlarýn paylaþarak 2 p 6
zarfýný doldurmaya çalýþýr.
Yukarýdaki açýklamalara göre, kovalent baðlanmada atomlarýn
arasýndaki bölgede, iyonik baðdakinden daha fazla elektron yoðunluðu
bulunmasý gerekir. Bu nedenle kovalent baðlarda doðrultuya baðlý olma
özelliði ortaya çýkar. Kovalent baðlý kristallere en tipik örnek olarak elmas
gösterilir.
Þekil 2.6 . Elmasýn kristal yapýsý.
Tetrahedral baðlantý durumlarýný
gösteren þema.
1/8 x 8 = 1
1/2 x 6 = 3
1x4 =4
Elmasın tetrahedral bağları ve atomların konfigürasyonları
Elmas' ta her karbon atomu, en yakýn 4 komþusunun oluþturduðu bir
terahedr'in ortasýný iþgal eder. Elmasýn yüzey merkezli kübik kristal
örgüsünde her C atomunun 4 en yakýn komþusu olma özelliði bu kristalin
oldukça gevþek bir yapýya sahip olduðunu gösterir. Elmasta ikinci yakýn
komþu sayýsý 12 olup birim küp baþýna 8 atom vardýr. Buna göre elmas en
sýkýþýk bir yapýya göre % 46 daha az sýkýþýktýr.
Kovalent kristaller en sert kristallerdir (SiC , elmas gibi), normal
sýcaklýklarda iletkenlikleri azdýr, baðlantý enerjileri büyüktür. Örneðin
elmasýn baðlantý enerjisi 170 kcal/kmol ; SiC' ün 238 kcal/kmol dür.
Germanyum, Silisyum ve Tellür de kovalent baðlý kristaller grubunda yer
alýrlar.
Kovalent Kristaller
5.HAFTA
Bað Enerjileri
eV
H-H
4.5
C-C
3.6
Si - Si
1.8
Ge - Ge
1.6
II.3. METAL BAÐLARI
(kcal/kmol)
104
83
42
38
Metallerde kristal baðlarý, pozitif olan metal iyonlarýnýn
serbest elektronlar tarafýndan bir arada tutulmasý þeklinde
açýklanabilir. Alkali metalleri bu tip bað için tipiktir. Demir, Wolfram gibi
transisyon (geçiþ) metallerinde , iç elektron zarflarý arasýndaki
kovalent baðlarýn da rol oynadýðý anlaþýlmýþtýr. Bu gruptaki
elementlerde d zarflarý dolmamýþtýr ve bu elektronlar kovalent bað
oluþtururlar. Serbest elektronlarýn neden olduðu baðlar pek kuvvetli
deðildir. Örneðin Na 'un baðlantý enerjisi 26 kcal / kmol ; Fe 'in ise 94 kcal /
kmol kadardýr.
Ýç d elektronlarýnýn oluþturduðu kovalent baðlarýn rol oynadýðý
Wolfram' da ise bað enerjisi 210 kcal / kmol dür.
II. 4. VAN DER WAALS BAÐLARI
Van der Waals baðlarý , atomlarýn birbirlerine yaptýklarý þekil
deðiþtirme etkileri ile açýklanýr. Bu etki iki türlü olabilir. Birincisinde
moleküllerin dipol momentleri vardýr; bu dipol momentler baþka moleküller
üzerine etki ederek yeni dipol momentler meydana getirirler. Bunlar birbirlerini
çekecek yönde olur (Debye Keesam, 1921). Ýkinci hal, molekülün bir dipol
momente sahip olmadýðý, baþka bir deyiþle elektrik yükünün küresel simetri
gösterdiði durumdur. Bu durumda elektronun bulunduðu yer her an
deðiþtiðinden deðiþen bir elektrik dipol moment var demektir. Bu da yakýn
atomlarda elektriksel indüksiyon (irkitim) yolu ile dipol momentler
oluþmasýna neden olur. Bu tür kuvvetlere dispersiyon kuvvetleri de denir.
+
-
+
-
+++++
------+
-
+
-
+
-
Van der Waals kristalleri zayýf bir þekilde baðlý, ergime ve
kaynama noktalarý düþük kristallerdir. Baðlantý enerjileri Argon'da
1.8 kcal / kmol ; CH4 kristalinde ise 2.4 kcal / kmol gibi çok
küçüktür. Van der Waals kristallerine Moleküler Kristaller adý da
verilmektedir.
dipol momentler
Þekil 2.8. Dipol moment oluþumu
He, Ne, A, Kr ve Xe da atom aðýrlýðý arttýkça Van der Waals
kuvveti artar Bunun nedeni dipol moment kavramýnda yatmaktadýr.
Dipol moment,
=q.l
baðýntýsý ile tanýmlanýr. Atom aðýrlýðý arttýkça atomun çapý büyür
dolayýsýyla l de büyür ve dipol moment artar.
II.5.
HÝDROJEN BAÐI
Bazý hallerde hidrojen atomu, oldukça kuvvetli baðlarla, iki
atomu birbirine baðlayabilir. Hidrojen tek elektronlu bir atom olduðu
için ancak bir tek baþka cins atomla kovalent bað oluþturabilir. Fakat
hidrojenin
iki
atomla
baðlanabilme
olgusu
oldukça
geç
anlaþýlabilmiþtir. Hidrojen baðý denilen bað türü þu þekilde oluþur.
Hidrojen atomu önce tek 1 s
elektronunu bir baþka atoma
vererek iyon haline gelir. H+ iyonu bir protondan oluþan sistem olup,
büyüklüðü diðer tüm iyonlardan en az 105 defa daha küçüktür. Ýþte bu
küçük sistem ikinci bir negatif atomu kendine baðlayarak hidrojen
baðýný oluþturur, Þekil 2.9.
iyon 1
dördüncü
iyon
üçüncü
iyon
iyon 2
Þekil 2.9. Hidrojen baðýnýn oluþmasý
Üçüncü veya dördüncü bir negatif iyon, çapýnýn büyük
olmasý nedeniyle bu sisteme baðlanacak kadar yanaþamaz. Böylece
proton iki atomun birbirine baðlanabilmesi için aracýlýk etmiþ olur.
Bu durum aslýnda hidrojen baðýnýn iyonik karakterde bir bað
olduðunu göstermektedir. Bað enerjisi 2 - 10 kcal / kmol
mertebesindedir, yani çok güçlü bir bað deðildir. Hidrojen baðlarý
H2O
moleküllerinin
su
içindeki
davranýþlarýnda,
protein
moleküllerinin kristal yapý özelliði göstermelerinde önemli rol
oynarlar. Örneðin buzun ergime ve kaynama noktalarý H2S kinden
daha da aþaðýda, - 100 ve 80 oC olacakken hidrojen baðlarý
nedeniyle bu sýcaklýklar 0 ve 100 oC olmaktadýr.
Bu baðlar buhar halinde iken bile HF' ün polimerizasyonuna
da sebeb olurlar. KH2PO4 gibi bazý ferroelektrik kristallerde de
önemlidirler. Hidrojen baðlarý yalnýz en elektro negatif iyonlar
arasýnda gözlenmektedir.
6.HAFTA
II.6. BAÐLANTI ENERJÝSÝNÝN HESABI
ÝYONÝK BAÐLAR
Ýyonik kristallerde, küresel yük daðýlýmý ve Coulomb kuvvetleri gibi
nispeten olaðan olgular bulunduðundan, bað mekanizmasýnýn anlaþýlmasý
ve bað enerjisinin hesaplanmasý daha kolaydýr. Bu nedenle iyonik kristaller
hem denel hem teorik olarak en fazla araþtýrýlmýþtýr. Ýyonik kristallerin bað
enerjisini hesaplamak için NaCl gibi tek deðerli iyonlardan oluþan bir kristali
Cl
klasik görüþle ele almak iyi bir yöntem olabilir.
Þekil 2.10. NaCl kristal yapýsý
Na
Þekil 2.10 dan da görüleceði gibi Na Cl yüzey merkezli kübik bir kristaldir. Buna
göre her iyonun ters yüklü 6 en yakýn ; ayný yüklü 12 ikinci yakýn komþusu
bulunur. Bu komþularýn etkisi ile bir i iyonunun sahip olacaðý i enerjisi, i j
olmak üzere,
i
i,j
j
þeklinde ifade edilebilir. ij , i iyonu ile j iyonu arasýndaki Coulomb potansiyeli ve
iyonlarýn gereðinden fazla birbirine yaklaþmalarýný önleyen ve aralarýndaki uzaklýða rij
n þeklinde baðlý olan iki potansiyelin toplamý olarak ;
i ,j
e2
n
rij
rij
þeklinde yazýlýr. Burada n ve deneysel olarak tayin edilebilen sabitler, e ise iyonlarýn
elektrik yüküdür. + iþareti itme, iþareti çekme enerjisini gösterir. Kristalin yüzeyinden uzak
bölgelerdeki ij enerjisi referens olarak alýnan iyonun bulunduðu yere ve iþaretine baðlý
deðildir. (1) denklemindeki rij büyüklüðünü, en yakýn komþu uzaklýðý R cinsinden ;
rij = pij R
þeklinde yazabiliriz. Bu koþullarda,
1 e2
1
ij
n n
p ij R p ij R
elde edilir. Burada,
p ij1
p ijn A n
j
j
ile gösterilir ve i j olduðu göz önüne alýnýrsa;
.e2 A n .
i ij
n
R
R
j
Potansiyel Enerji
elde edilir.
Þekil 2.11. Ýyonik kristalde bað enerjisinin
hesaplanmasý. i potansiyel enerjisi, iki terimin
toplamý olarak Þekil 2.11 de gösterilmiþtir.
i
itme enerjisi
An
Rn
R
Ro
bað
enerjisi
e2
R
Coulomb enerjisi
Denge halinde;
i
.e2 nA n
2 n1 0
R
R
R
olmalýdýr. Buradan An yý hesaplayıp. bu deðeri yukarıda yerine koyar ve
kristalin N adet çift atomdan oluştuğunu göz önüne alırsak, toplam potansiyel
enerji Uo için
N .e 2
1
U0
1
Ro
n
ifadesi bulunur. Burada Ro iyonlar arasýndaki denge uzaklýðýdýr. Bu
baðýntýda hesaplamamýz gereken ve n sabitleri bulunduðuna dikkat
edilmelidir.
MADELUNG SABÝTÝ
Yukarýda tanýmlanan sabiti, pij sabitlerine, yani kristal iyonlarý
arasýndaki uzaklýklara baðlý bir sayýdýr. Dolayýsyla geometriye baðlý bir
sabit olup doðrudan kristal yapýsýyla ilgilidir. Ýyonik kristaller için büyük
önemi olan bu sabit, bu hesaplarý ilk kez yapan E. Madelung,un 1918 '
adýna izafeten Madelung sabiti olarak isimlendirilmiþtir.
Önce lineer kristal için sabitinin hesaplanýþýný görelim.
Ro
+
(i)
Cl-
+
Na
Referens iyonu
Þekil 2.12. Lineer kristalde Madelung sabitinin hesaplanmasý
Tanýma göre, i referens iyonu olarak bir negatif iyon seçilmiþ ise ,
1
1 1 1 1
2 .....
pj
1 2 3 4
þeklinde olacaktýr. Parantezin önündeki 2 katsayýsý, referens iyonunun her
iki tarafýndaki iyonlarý hesaba katmak için konulmuþtur. serisinin toplamýný
bulmak için ; x = 1 alýnarak,
x2 x3 x4
Ln(1 x ) x
....
2
3
4
serisinden faydalanýlýr. Þekil 2.12 deki lineer kristal için Madelung sabiti,
= 2 Ln 2 = 2 . 0.69315 = 1.3863 olacaktýr. Ayný hesabý üç boyutlu kristal
için yapmaya çalýþalým. Yine negatif iyonlardan birini referens iyonu olarak
seçelim. Bu iyonun etrafýnda + yüklü en yakýn komþusu, 2 Ro
uzaklýðýnda 12 adet (-) yüklü ikinci yakýn komþusu, 3 Ro da 8 adet (+)
yüklü iyon, 2 Ro da 6 adet (-) iyon olduðundan;
.....
= 6.000 - 8.485 + 4.620 - 3.000 + ......
serisi elde edilir. Bu serinin pek parlak bir konverjans göstermediði açýktýr. Bu
nedenle Madelung sabitinin hesabýnda pozitif ve negatif terimlerin birbirini
daha yaklaþýk olarak getirmesine olanak veren hesaplama yollarý denenmiþtir,
(P.P.Ewald, 1921 ; H.M.Evjen 1932) . Aþaðýdaki tabloda bu yöntemlerle
hesaplanmýþ çeþitli kristallere ait Madelung sabitleri verilmiþtir.
Kristal
NaCl
ZnS (çinkoblendi)
CaF2
Al2O3
Madelung Sabiti
1.7476
1.6381
5.0388
25.0312
Kristal
CsCl
ZnS (vurtzit)
CuO2
Madelung Sabiti
1.7627
1.641
4.1155
ÝYONLAR ARASI ÝTÝCÝ KUVVETÝN
n EKSPONENTÝ
Bu sabit, kristalin kompresibilitesi (sýkýþabilirliði) yardýmýyla hesaplanýr.
Alçak sýcaklýklarda ve ýsýsal olaylarýn etkilerinin ihmal edilebileceði
durumlarda termodinamiðin 1. prensibi ,
dU = - p dV
ve kompresibilite
K
1 dV
V dp
þeklinde yazýlabilir. Burada U iç enerji, p basýnç, V de hacimdir.
Gerekli düzenlemeler yapıldıktan sonra
1
.e 2 (n 1)
K
18R04
n
18 R04
K.e .
2
1
denklemlerine ulaşılabilir. Burada n aranılan sabit, R0 atomlar arası denge
uzaklığı, K kompresibilite, Madelung sabiti, e elektron yüküdür.
NaCl kristalinde iyonlar arasý itici kuvvetin n eksponenti için
n = 12.8
deðeri elde edilir. Þimdi artýk N sayýda NaCl molekülünden oluþan bir
kristalin toplam baðlantý enerjisi için bulduðumuz Uo ifadesini
deðerlendirebiliriz. N sayýsýný Avagadro sayýsýna eþit alýrsak, bir mol NaCl
kristalinin baðlantý enerjisini hesaplayabiliriz. Bu hesap yapýlýrsa,
Uo = - 206 + 16 = - 190 kcal/mol
deðeri elde edilir. Buna göre yalnýzca coulomb itici veya çekici kuvvetleri
olsa idi NaCl kristali 206 kcal/mol lük enerji ile baðlanacaktý. 16 kcal/mol lük
enerji, iþaretleri ne olursa olsun iyonlarýn birbirlerine Ro dan daha fazla
yaklaþtýklarý zaman ortaya çýkan itici kuvvetler nedeniyle oluþan enerjidir.
Yukarýda açýklanan klasik teori ile elde edilen deðer 182.6 kcal/mol
deneysel deðerine yakýn olmakla birlikte yine de arada küçük bir fark
gözlenmektedir. Bu fark itici kuvvetin r-12.8 ile orantýlý olarak alýnmasýndan
kaynaklanmaktadýr. Daha iyi bir yaklaþým, bu kuvveti exp (- R/) ile orantýlý
almak ve ihmal edilen Van der Waals kuvvetlerini hesaba katmakla elde edilir.
Bu nedenle Uo ifadesi daha iyi bir yaklaþýmla;
e 2
U0 N
e
R0
r
ρ
6
r
þeklinde kullanýlýr. Burada , ve birer sabittir. 3. terim Van der Waals
kuvvetlerini hesaba katmak için; 4. terim ise mutlak sýfýr noktasý enerjisini
hesaba katmak için denkleme eklenmiþtir.
KOVALENT BAÐLI KRÝSTALLERDE BAÐLANTI ENERJÝSÝNÝN KUANTUM MEKANÝÐÝ
ÝLE HESAPLANMASI
Katý cisimlerde baðlantý enerjisinin kuantum mekaniði yardýmýyla
hesaplanmasý ve ana kavramlarý anlamaya yönelik olarak basit bir
problemi ele alacaðýz. Bu problem hidrojen molekülü problemidir
ve çözümü için iki farklý yol izlemek mümkündür. Bunlardan biri
Heitler - London (1927) tarafýndan, diðeri Mullikan - Hund (19281930) tarafýndan geliþtirilmiþtir.
R.S.Mullikan (1966 Kimya Nobel ödülü sahibi) ve F. Hund
'ýn modelinde a ve b gibi iki hidrojen çekirdeði etrafýnda hareket
eden iki elektron düþünülür. Çekirdekler birbirine yakýn olduklarý
için elektronlarýn her ikisi de ayný anda iki çekirdeðin etkisi
altýndadýr. Hesap önce H2+ iyonu için, yani R uzaklýðýnda iki
çekirdek ile tek elektronlu sistem için yapýlýr.
era
+
rb
+
Elektronun herhangi bir andaki potansiyel
enerjisi
b
a
+
b
a
r
b
e2 e2
V
ra
rb
r
þeklindedir. Bu deðer hidrojen atomu için
Schrödinger denklemine konur.
a
Şekil 2.13. H2+ iyonu için model
2 2
(E V ) 0
2m
Bu denklemi tam (exact) olarak çözmek mümkündür. Normal
durumda elektron en küçük enerji seviyesinde olmalýdýr. Yani a
çekirdeði yakýnýndan geçerken elektronun dalga fonksiyonu,
yalnýz a atomu varmýþ gibi
a (r) e -r a c
c = m e2 / 2 (Bohr yarýçapý)
b çekirdeði yakýnýndan geçerken yalnýzca bunun etkisi altýndaymýþ
gibi ,
b(r) e
-r b c
bir deðer alýr. Normal durumda elektron 1/ c yarýçapýnda bir
dairesel yörünge üzerinde hareket eder. 1/ c ye Bohr yarýçapý denir.
Her iki çekirdeðin ortak etkisi altýnda elektronun gerçek dalga
fonksiyonu bu iki deðerin bir lineer kombinasyonudur. Ýki
kombinasyon olasýlýðý vardýr.
a b e rac e rb c
a b erac erb c
Bu çözümlere karþýlýk gelen enerjilerin hesaplanmasýnda
perturbasyon teorisi kullanýlýr. Önce çekirdekler arasýnda hiç etkileþme
(interaksiyon) yokmuþ gibi a ve b elde edilir, daha sonra aralarýndaki
etkileþme bir perturbasyon potansiyeli gibi hesaba katýlýr. + ve dalga fonksiyonlarý Þekil 2.13 de çizilmiþtir. Görüldüðü gibi (+) simetrik
; ( - ) ise anti-simetrik dalga fonksiyonlarýdýr. Ýki çekirdeðin tam
ortasýnda + yalnýz
tek çekirdek, örneðin yalnýzca b çekirdeði varkenki deðerinin
yaklaþýk iki katýdýr (þekilde ince çizgi) . _ ise ortada sýfýrdýr.
Simetrik durumda elektronun ortada bulunma olasýlýðý, baþka bir
deyiþle elektron yük yoðunluðu,
2
tek çekirdekli duruma göre 4 defa daha büyük olur.
2
ise
sýfýrdýr.
Bu neticeyi daha iyi deðerlendirebilmek için elektronun iki çekirdek
arasýndaki potansiyel enerji deðiþimini çizelim. Bu potansiyel (Þekil
2.14)
2
2
V
e
r
ab
2
olup, r = 0 da,
V
deðerini alýr.
e
r
ab
2
4e2
ab
V
a
b
r
Þekil 2.14. Ýki çekirdek arasýndaki
potansiyel enerji deðiþimi
Yani simetrik dalga fonksiyonu
+, iki çekirdek arasýnda daha
negatif bir potansiyel enerji
deðeri ortaya çýkmasýna neden
olmaktadýr. Bu durum hidrojen
molekül-iyonunun, iki çekirdeði
birbirine
yaklaþtýrýcý
etki
yapmasý
þeklinde
yorumlanabilir.
Dolayýsýla bu olgunun Þekil 2.11 deki E1 eðrisine benzeyen bir
potansiyel enerji deðiþmesine yol açacaðý kolayca anlaþýlabilir. Ýki
çekirdek arasýndaki uzaklýk azaltýlýnca itme kuvveti hýzla artar.
2
nin r = 0 da sýfýr olmasý , yani tam ortada
Anti-simetrik halde
elektron yük yoðunluðunun sýfýr olmasý, iki pozitif çekirdeðin
birbirini itme kuvvetlerinin iki çekirdek arasýnda bir bað oluþmasýný
önlediði þeklinde yorumlanmalýdýr.
Buraya kadar hidrojen molekül iyonu ile ilgilendik. Hidrojen
molekülüne gelince, yine ilk yaklaþým olarak bir elektronun iki çekirdek
alanýnda hareket ettiðini düþünerek iþe baþlayabiliriz. Ancak bu kez ikinci
elektronun varlýðý olayý nasýl etkileyecektir? Bu etkiyi ikinci elektron iki
pozitif çekirdeðin yük etkisini azaltýyor þeklinde yorumlayabiliriz. Bu
durumda Schrödinger denklemini tam olarak çözmek mümkün deðildir. Bu
perdeleme etkisi karþýlýklý olarak her iki elektron için de birbirinin aynýdýr.
Bu, her iki elektronun da dalga fonksiyonlarý ayný olacak demektir. Buradan
H2 molekülü için de simetrik ve anti-simetrik dalga fonksiyonlarýnýn olacaðý
anlaþýlýr. Simetrik durumda iki çekirdek arasýnda elektron yük yoðunluðu
sim
2
sýfýrdan farklýdýr. Bu, ancak elektronlarýn Pauli prensibine
uymalarýyla mümkün olabilir, yani bu elektronlar ayný bölgede iken
spinleri mutlaka anti-paralel olmalýdýr. Bu koþullarda, bu elektron
çifti, elektron çifti baðý meydana getirmiþtir denir.
Anti-simetrik dalga fonksiyonlarý H2+ da olduðu gibi
atomlarýn birbirinden uzaklaþmalarýna neden olur. Burada iki
elektronun spinleri paralel olur ve iki hidrojen atomu arasýndaki
potansiyel enerji Þekil 2.11 dekine benzer bir durum izler, (simetrik
durum için E1 ; anti-simetrik durum için E2 eðrisi). Yalnýz burada her
eðri, moleküldeki her iki elektronun enerjisini temsil eder.
Böylece H2 molekülünün iki elektronu, mümkün olan dört
kuantum durumunu iþgal edebilir (iki enerji seviyesi). Bu önemli bir
sonuçtur. Genel olarak bir molekülün kuantum durumlarýnýn
sayýsýnýn toplamý, teker teker atomlarýnýn kuantum durumlarýnýn
sayýsýnýn toplamýna eþittir.
Kovalent (homopolar) baðlarýn Hund - Mullikan modeline göre
hesaplanma yöntemi hakkýnda fikir edindikten sonra, diðer metodu
da ana hatlarý ile incelemek yararlý olacaktýr.
Heitler - London teorisi yine hidrojen molekülü için aþaðýdaki
gibi bir yol izler. a ve b gibi aralarýnda R uzaklýðý bulunan iki nötr
hidrojen atomu göz önüne alalým. Atomlar normal durumlarýnda, R de
baþlangýçta çok büyük olsun. Bu koþullarda sistemin enerjisi iki
atomun birbirine eþit olan enerjilerinin toplamýna eþit olacaktýr. R
küçük ise sistemin enerjisi için
E0 + E0 + E(R)
yazmak mümkündür. E(R) R'ye baðlý ve E0 yanýnda küçük olan bir
etkileþme (interaksiyon) terimi anlamýndadýr.
Heitler - London teorisinde bu enerji perturbasyon teorisi yardýmýyla
hesaplanýr. Bu amaçla a atomunun elektronuna 1; b atomunun
elektronuna 2 numarasýný verelim (Þekil 2.15).
2
1
r
r 2a
1a
+
a
R
+ r
b
2b
r 1b
Þekil 2.15. Heitler-London modeli
Çekirdeði a olan atomun elektronunun dalga fonksiyonunu 1(a) ile
gösterelim. Temel (normal) durumda kabul edildiði için hidrojenin bu
dalga fonsiyonunu
a 1 e c.r 1a
þeklinde yazabiliriz.
Benzer biçimde,
Ψ b (2) e
c . r2 b
yazýlabilir. Bu iki fonksiyon birbirinin aynýdýr. Bütün sistemi anlatan
dalga fonksiyonu ise bu ikisinin çarpýmý, yani a (1) . b (2)
dir. Burada önemli bir nokta ile karþýlaþýlýr. Ýki elektronun rollerini
deðiþtirmekle a (2) . b (1) gibi ikinci bir dalga fonksiyonu elde edilir.
Bu fonksiyon da ayný sistemi anlatmaktadýr, yalnýz elektronlara
verilen numaralar deðiþmiþtir. Numaralar farklý da verilse iki elektronu
fiziksel olarak birbirinden ayýrdetmek mümkün deðildir. Bunun
anlamý þudur. 1 numaralý elektronu x1 noktasýnda, 2 numaralý
elekteronu x2 noktasýnda bulma olasýlýklarý ; 1 numaralý elektronu x2
noktasýnda, 2 numaralý elektronu x1 noktasýnda bulma olasýlýklarý
birbirine eþittir. Bunun bir tek fiziksel yorumu vardýr, o da x1
noktasýnda 1 elektron; x2 noktasýnda 1 elektron bulma ihtimaliyeti
vardýr. Bu koþulu yerine getiren lineer kombinasyon,
ψ ψ a(1)ψ b (2 ) ψ a(2 )ψ b (1)
ψ ψ a(1)ψ b (2 ) ψ a(2 )ψ b (1)
þeklindedir.
Bu fonksiyonlar perturbe olmamýþ sistemin dalga fonksiyonlarýdýr.
Perturbe olmuþ sistemde ortaya çýkan E(R) etkileþmesini
hesaplamak için etkileþme potansiyelini bilmek gerekir. Bu
potansiyel,
e2 e2 e2 e2
V
R r12 r1b r2 a
þeklindedir. Bu ifade yazýlýrken a çekirdeði elektronuna 1 numarasý
verilmiþtir. Numaralarý deðiþtirmek mümkündür. Bu halde elde
edilecek potansiyel ifadesi,
e2 e2 e2 e2
V
R r12 r2 b r1a
þeklinde olacaktýr. V ve V' yü Schrödinger denkleminde yerine
yazarken (E-V) þeklinde olduðundan bu ifadelerin (-1) ile çarpýlmasý
gerektiðine dikkat edilmelidir.
Bu potansiyeller yardýmý ile E(R) yi hesaplamak için dalga
fonksiyonlarýnın karelerini alýp bunu potansiyel ile çarptýktan sonra
iki elektronun bütün koordinatlarý üzerinden integre etmek gerekir.
E(R)
2
V
d
2
d
Burada V yerine + için V yi ; V 2 d yu açýk olarak yazalým.
için V' yü almak gerekir. Önce
2
2
2
2
2
1d1d 2
V
d
V
1
2
d
d
V
2
a
a
1
2
b
b
2 V a 1 b 1 a 2 b 2 d1d 2
Ýkinci terimde V' yü kullandýk, fakat 3. terimde V veya V ' den
hangisini kullanacaðýmýzý kestirmek gerekir. Bu terime bakacak
olursak 1 elektronunun kýsmen a da kýsmen de b de olduðunu
görürüz. 2 elektronu için de durum aynýdýr.
a(1) b(1) a(2) b(2)
ifadesinde 1 ve 2 yer deðiþtirdiðinde bu ifade deðiþmeyecektir. O
halde V veya V ' den birini kullanabiliriz. Dolayýsýyla ilk iki integral de
birbirine eþittir.
Aþaðýdaki
yapalým.
kýsaltmalarý
e2 e2 e2 e2
C
R r12 r1b r2 b
e2 e2 e2 e2
A
R r12 r1b r2 b
2
a 1 b2 2 d1d 2
a 1 b 1 a 2 b 2 d1d 2
E(R) ifadesinin paydasýný da hesaplayalým. a(1) ve b(2) dalga
fonksiyonlarýný normalize edilmiþ fonksiyonlar olarak kabul
edebiliriz. Yani,
2
2
1d
a
1
b 2 d 2 1
olsun. Bu takdirde payda
2
2
2
2
2
d
1
2
d
d
2
1
2
a b
a b 1d1d 2
2 a 1 b 1 a 2 b 2 d1d 2
S a 1 b 1 a 2 b 2 d1d 2
ile tanýmlanýrsa
Payda = 1 1 2S
için
= 2 2S olur. Buna göre E(R) interaksiyon enerjisi
E(R)
veya
2C 2A C A
2 2S
1 S
C A
E R
1 S
C A
E- R
1 S
elde edilmiþ olur.
Ýki elektronun toplam dalga fonksiyonu, eðer elektronlar antiparalel spinli iseler, daima elektronlarýn koordinatlarýnda simetrik
olurlar. Bu kurala göre E+(R) simetrik olan + ya , E-(R) ise - ye
karþýlýk gelir. Simetrik hal singlet durumuna, spinlerin paralel olduðu
anti-simetrik fonksiyon ise triplet durumuna karþýlýk gelir.
Birincide s = (1/2) - (1/2) = 0 ; ikincide s = (1/2) + (1/2) = 1 dir.
Þimdi C, A ve S integrallerinin anlamlarýný anlamaya
çalýþalým. C integrali içindeki a2 (1) ve b2 (2) a ve b çekirdeklerini
çevreleyen elektron yoðunluklarýdýr. Þu halde C sýrasýyla iki
çekirdek arasýndaki, iki elektron arasýndaki, a çevresinde bulunan
elektron bulutu ile b çekirdeði arasýndaki ve b çevresinde bulunan
elektron bulutu ile a çekirdeði arasýndaki Coulomb etkileþmelerinin
toplamýný verir. Burada C integralinin tüm interaksiyon enerjisini
verdiði sanýlabilir. Ancak göreceðiz ki asýl önemli olan A integralidir.
A, C kadar kolay açýklanamaz. A integralinin 1 ve 2
elektronlarýnýn
ayýrt
edilememesinden
kaynaklandýðýný
hatýrlarsak,
= a (1) b (1)
þeklinde yeni bir yük daðýlýmý tanýmý yapýlabilir. Buna deðiþ-tokuþ
(exchange) yoðunluðu denebilir. A içindeki, e2 / r12 terimi, yani
e
2
1 2
r12
d1d 2
ifadesi bu deðiþ-tokuþ yoðunluðunun kendisiyle etkileþmesini verir. S
integrali R = 0 için 1 'e eþit olur. Çünkü bu durumda a = b ve ,
S 2a 1d1 . b2 2 d 2 1
dir. R 0 iken de S ' nin deðeri 1 den küçüktür. Ancak R çok büyük
olmadýkça sýfýr olmaz. R çok büyük olursa zaten C = A = S = 0 dýr
ve E(R) = 0 olur. Buna göre S integrali ve 1 + S paydasý küçük bir
düzeltme terimi gibi düþünülebilir ve payda 1 'e çok yakýn kabul
edilebilir.
Buna göre hidrojen atomlarýnýn
birbirini çekme veya
itmeleri hemen hemen yalnýzca C ve A nýn R ye baðlý olarak
aldýklarý deðerlere ve bunlarýn iþaretlerine baðlý olacaktýr.
Ýntegralleri hesaplamak güç deðilse de oldukça uzun ve yorucudur.
Bu nedenle biz burada E(R) ifadesini kalitatif olarak irdeleyip hesap
sonuçlarýný grafik olarak göstereceðiz.
Önce R çok büyük olsun. Bu durumda r ler de çok büyük,
buna karþýlýk da sýfýrdýr. Çünkü, a(1) in büyük olduðu
yerlerde b(1) çok küçük; tersine b(1) in büyük olduðu yerlerde a(1)
çok küçüktür. Baþka sözlerle C = A = 0 dýr. E(R) etkileþme enerjisi de
sýfýrdýr.
Çekirdekler arasýndaki uzaklýk orta deðerlerde, örneðin Bohr
yarýçapý mertebesinde olsun. Bu durumda iki atomun elektron
bulutu birbirine temas eder. Bu nedenle deðiþ-tokuþ yük yoðunluðu
oldukça büyüktür. yük yoðunluðu daðýlýmý çekirdeklere de çok
yakýn olduðundan bunlar tarafýndan kuvvetle çekilirler. Bu da A yý
negatif ve büyük deðerli yapar.
Diðer taraftan yük yoðunluðunun muhtelif bölgeleri
arasýndaki ortalama uzaklýk Bohr yarýçapýna nazaran büyük sayýlýr,
yani bunlar arasýndaki itme kuvvetleri az olur, dolayýsýyla A ya
pozitif iþaretli katkýlar da azdýr.
EE(eV)
antisimetrik dalga
E- (R) fonksiyonu
C
0
-1
-2
-3
-4
-5
E+(R) teori
E (R) deney
+
1
2
3
R/RBohr
4
Þekil 2.16. A, S ve C integrallerinin yorumu
C integraline gelince, ayný R deðeri için C nin A dan sayýsal
deðerce daha küçük olmasý beklenebilir. Çünkü, r1b ve r2a ortalama
olarak oldukça uzak, (1) ve (2) yük daðýlýmlarý arasýndaki uzaklýk
da yine nispeten büyüktür. Bu durumda E(R) deðerine A egemendir. A
, E- için pozitif ; E+ için negatiftir.
Çok küçük R mesafelerinde ise çekirdekler birbirlerini þiddetle
iterler. (1) ve (2) elektron bulutlarý hemen hemen üst üste gelir. fakat
çekirdeklere olan mesafeleri deðiþmez. O halde hem C hem A için,
çekirdeklerin birbirlerini itmeleri büyük ve pozitif bir katký meydana
getirir.
Buraya kadar söylenenleri özetlemek gerekirse, iki hidrojen
atomu uzak mesafelerden baþlamak üzere birbirlerine yaklaþtýrýlýrsa,
elektronlarýn spinleri anti paralel ise, birbirlerini çekerler; paralel ise
iterler. Spinler antiparalel ise E+(R) interaksiyon enerjisi yaklaþýk Bohr
yarý çapý mertebelerinde bir minimum gösterir. Daha yakýnlarda
tekrar itme baþlar. Þekil 2.16. A, S ve C integrallerinin hesaplanmasý
sonucunda interaksiyon enerjisinin Bohr yarýçapý birimi ile ölçülen R
uzaklýðýna baðlý olarak deðiþmesini göstermektedir.
Heitler - London teorisinin deneye oldukça yakýn sonuçlar
verdiði görülmektedir. H2 molekülünün baðlantý enerjisi deneyle
4.476 eV bulunurken, bu teori ile 3.2 eV olarak hesaplanmýþtýr.
Çekirdekler arasýndaki denge uzaklýðý deneyle 0.7417 Å ; yahut ilk
Bohr yörüngesi yarýçapý 0.52918 Å olduðuna göre, bu birimle
çekirdekler arasý uzaklýk 1.4 dür. Teori bu uzaklýk için 1.6 deðerini
vermektedir.
Heitler - London metodu ile yapýlan daha duyarlý
hesaplamalar, bu sayýsal sonuçlarý biraz daha deneye yaklaþtýrýr.
( S.C.Wang, 1928), E = 3.76 eV Ra,b = 1.41 RBohr
Hund - Mullikan ve Heitler - London metodlarýný birbirleri ile
karþýlaþtýrýrsak bu iki hesap yönteminin hemen hemen ayný baþarý
derecesiyle H2 molekülünü açýkladýklarýný söyleyebiliriz. Fakat bu
iki metod prensip olarak birbirine tamamen zýt yönlerden olaya
yaklaþmýþlardýr. Hund-Mullikan modelinde elektronlar ayný anda iki
Hidrojen atomuna ait olmakla beraber yalnýz birine aitmiþ gibi de
kabul edilirler. Heitler-London teorisinde ise elektronlar atomlar
arasýnda paylaþýlmýþ gibi kabul edilir, yani hiç bir zaman ikisi de
ayný atom yanýnda bulunmazlar.
Baþka bir ifade ile Hund-Mullikan metodu iki
hidrojen atomu birbirine çok yakýn iken gerçek durumu
daha iyi yansýtýr; Heitler-London teorisi ise atomlar
arasýndaki uzaklýk büyük olduðu zaman gerçek durumu
daha iyi yansýtýr. Buna göre bu teorilerin hiç biri orta
uzaklýklar için doðru sonuç vermez.
Hund-Mullikan modeli katýhal fiziðinin band
modeline; Heitler-London modeli ise katýhalin atomistik
modeline karþýlýk gelir. Bu iki modelden hiç biri kendi
baþýna katýhal olaylarýný tamamen açýklamaya yeterli
deðildir, ancak birbirlerini tamamlarlar.
7.HAFTA
VAN DER WAALS BAÐLARININ HESABI
Önceki bölümlerde kalitatif olarak açýklanan Van der Waals
baðlantý enerjisini hesaplayabilmek için aralarýnda R uzaklýðý
bulunan iki lineer ossilatör düþünelim. Ossilatörler birbirinin ayný
olsun ve sabit iki pozitif yük etrafýnda x doðrultusunda titreþen iki
negatif yükten oluþsun.Bütün yükler elemanter yük e ye eþit olsun.
2a
2a
+e
+e
x1
-e
x
x2
-e
R
Þekil 2.17. Kuple edilmiþ titreþen iki dipol.
Titreþim genliði a, uzanýmlar x1 ve x2 olsun. Böyle bir dipol
ossilatör için elemanter bilgilerle hemen þu baðýntýlar yazýlabilir.
e2
ka
2
a
e2
k=- 3
a
k yay sabiti
Potansiyel enerjiler,
1 e2 2
x1
3
2a
1 e2 2
x2
3
2a
Ýki ossilatörün birbirine yakýn olmasý yani aralarýnda
kuplaj bulunmasý nedeniyle aralarýnda bir etkileþme vardýr.
Coulomb kuvvetleri ossilatörlerin toplam enerjisini deðiþtirir. bu
enerji;
e2
e2
e2
e2
R
R x1 x 2
R x1 R x 2
þeklindedir. Eðer R >> x1 , x2 kabul edilirse,
e2
e2 1
1
x x2
ve
1 2 .....
x
R x
R 1 x
R R
1
R
R
baðýntýlarýndan
yararlanarak,
2 e2 x 1x 2
R3
þeklinde ifade edilebilir. Bu durumda ossilatörün toplam enerjisi,
2 e2 x 1 x 2
1 2
e2
2
2
2
E
P1 P2
x1 x 2
3
2m
2a
R3
olur. Ýki ossilatör birbirinden uzak bulunduðu zaman bunlarýn öz
frekanslarý,
0
1 k
1
e2
=
2 m 2 ma 3
dýr. Kuplajýn sýfýrdan farklý olduðu halde yani 0 iken o ikiye
ayrýlacaktýr. Þimdi bu frekanslarý hesaplayalým. Bunun için E
potansiyel enerjisinin daha kullanýþlý bir hale sokulmasý
gerekmektedir. Bu amaçla x koordinatlarý ile P impulslerini
aþaðýdaki transformasyona tabi tutalým.
1
2
1
2
x 1 x 2 x s
P
2
1
P22 Ps
1
2
1
2
x 1 x 2 x a
P
2
1
P22 Pa
x 2s x 2a x 12 x 22
x 2s x 2a 2 x 1 x 2
Ps2 Pa2 P12 P22
Bu transformasyon ile E enerjisi,
1
e2
e2
2
2
2
2
E
Ps Pa
x s x a 3 x 2s x 2a
3
2m
2a
R
yahut
1
e2
e2
e2 2 1
e2 2
2
2
E
Ps
3 x s
Pa
3 x a
3
3
R
R
2a
2a
2m
2m
Bu enerjiyi, birbiriyle kuple edilmemiþ iki ossilatörün toplam enerjisi
olarak düþünebiliriz. Bunlarýn titreþim frekanslarý,
1 e2 1
2
s
2 m a 3 R2
1 e2 1
2
a
2 m a 3 R2
dir. Bu frekanslardan birinin o dan küçük diðerinin ondan daha
büyük olduðunu görüyoruz.
Þimdi bir lineer ossilatörün kuantum mekaniði
hesaplanmýþ enerji seviyelerini hatýrlayalým. Örneðimizde o
ile
öz frekansý ile titreþen bir ossilatör, n bir tam sayý olmak üzere
ancak,
1
En h 0 n
2
diskret enerjilerini alabilir. Böyle bir harmonik (=lineer) ossilatörün
0 oK deki alabileceði en küçük enerji, yani temel durum enerjisi ( n
=0)
1
E0 h 0
2
dýr. Þu halde birbirinin etkisi altýnda titreþen yukarýdaki ossilatörlerin
kuantalaþmýþ enerji seviyelerini,
1
1
Es a = h s n s + h a n a
2
2
þeklinde yazabiliriz. Burada ns ve na tam sayýlar olup sistemin temel
durumu için
E00
1
h s a
2
elde edilir. Eoo doðal olarak R ye baðlýdýr. R = için Eoo = Eo = (1/2)
ho olur.
Temel durum enerjisinin iþareti ve R ye nasýl baðlý
olduðunu görmek için Eoo ifadesini aþaðýdaki gibi bir seriye
açalým.
E00
h e 2 1
2
3
3
4 m a
R
e2
m
2
1
3 3
R
a
h
e 2
2a3
2a3
1 3 1 3
3
4 ma
R
R
ve
2
n
(
n
1
)
(1 )n 1 n
.......
2!
binomiyal açýlýmýný kullanarak ve a<< R
E00
kabul ederek
h
e2
a6
a6
1
.... h 0 1
....
3
6
6
2 ma 2R
2R
yaklaþýmýný elde ederiz. Buradan Van der Waals enerjisinin negatif,
bir baþka deðiþle iki ossilatörü (atomu) birbirine baðlayan karakterde
olduðu ve R uzaklýðýnýn 6 ncý kuvveti ile ters orantýlý olarak
deðiþtiði görülmektedir. Diðer taraftan bu enerji o öz titreþim frekansý
ile doðru orantýlýdýr. Titreþim genliði ne kadar büyük olursa Van der
Waals enerjisi de o kadar büyük olur. Bu nedenle a, atomlarýn þekil
deðiþtirebilme veya formabiliteleri hakkýnda bir fikir verir.
Ayný cinsten atomlar arasýnda olduðu gibi farklý atom veya
moleküller arasýnda da Van der Waals baðlarý oluþmaktadýr.
Van der Waals enerjisinin bu þekilde hesabý F. London
tarafýndan 1930 da yapýlmýþtýr. bað türünün ismi ise, Van der Waals'
ýn gazlarýn hal denklemini yazarken postüle etmiþ olduðu moleküller
arasý kuvvetler nedeniyle konmuþtur. Van der Waals etkileþmesine
London etkileþmesi veya deðiþen dipol etkileþmesi de denilmektedir.
Van der Waals kuvvetleri atomlarý birbirine zayýf baðlayan
baðlar oluþtururlar. Bu çeþit baðlarla baðlanan atomlarýn birbirlerine
daha çok yaklaþmalarý halinde yine itme kuvvetleri doðar. Bu
kuvvetlerin kaynaðý da Pauli Prensibidir. Atomlarýn birbirine daha
fazla yaklaþmalarý halinde ayný kuantum sayýlý elektronlar ayný
bölgede bulunma durumuna gelir ki buna Pauli prensibi izin vermez.
Böyle bir sýkýþma sonucunda elektronlarýn boþ ve daha yüksek
enerjili seviyelere çýkmalarý gerekir.
Enerjinin artmasý, baðýn zayýflamasý
kuvvetlerinin ortaya çýkmasý anlamý taþýr.
baþka
sözlerle
itme
Birbirinden uzaklýðý R olan iki atomun toplam potansiyel
enerjisi genellikle,
n 6
U(R) 4
R
R
þeklinde ifade edilir. Burada
enerji boyutunda,
ise uzunluk
boyutunda birer parametredir. Bu potansiyele Lenard - Jones
potansiyeli adý verilir. ve gaz halindeki ölçülerden elde edilebilir.
Van der Waals baðlarýyla baðlý, örneðin bir asal gaz kristalinin
baðlantý enerjisi Lenard-Jones potansiyelinin kristali oluþturan bütün
atomlar için çifter çifter toplanmsý ile elde edilir. 0 oK de hepsi y.m.k
sistemde kristalleþen asal gaz kristalleri için deneysel deðerler
aþaðýdaki tabloda verilmiþtir.
ASAL GAZ KRÝSTALLERÝNE AÝT DENEYSEL DEÐERLER
Ergime
noktasý
oK
Baðlantý
Enerjisi
kcal/mol
Ýyonizasyon
Potansiyeli
(eV)
Lenard-Jones Parametreleri
(erg)
(Ao)
Ne
24
0.45
21.56
50.10-16
2.74
A
84
1.85
15.76
167.10-16
3.40
Kr
117
2.67
14.00
225.10-16
3.65
Xe
161
3.83
12.13
320.10-16
3.98
Asal
Gaz
8.HAFTA
II.9. METALÝK BAÐLARIN HESABI
Metal kristallerinin baðlantý (kohezyon) enerjileri daha önce
açýklanan iyonik kristallerin Born teorisine benzer bir yoldan yarý
ampirik bir biçimde hesaplanabilir. G. GRUNEISEN atomlar arasýnda
a
b
E(r) m n
r
r
gibi bir potansiyel enerji kullanarak baðlantý enerjisini
hesaplamýþtýr. Burada a, b, m ve n pozitif sabitlerdir. Ancak teori
deneylerle pek iyi uyuþan sonuçlar vermemiþtir.
E. WIGNER ve F. SEITZ (1934) metallerin serbest elektron
modeline dayanan kantitatif bir yöntemle kohezyon enerjisini tekrar
hesaplamýþlardýr. Hücreler Metodu olarak bilinen bu yaklaþým
yönteminde kristal hacmi, eþit hacimde küçük hücrelere ayrýlýr ve
yalnýz bu hücreler içindeki baðlantýlar göz önüne alýnýr. Bu modelin
gerekçesi þöyle özetlenebilir.
Basit metal kristallerinde iyonlarýn kapalý elektron zarflarý
vardýr, baþka bir deðiþle bunlarýn elektrik alanlarý küresel simetri
gösterirler. Ýyonlar arasýndaki uzaklýklar mertebesinden bir
uzaklýkta, bir iyon civarýnda, diðer iyonlarýn oluþturduklarý alan da
aþaðý yukarý merkezdeki iyonun alanýna eþit kabul edilebilir. Bunun
için kristal örgüsünün yüksek dereceden dönme simetrisi göstermesi
gerekir. Böylece her iyon yakýnýnda oldukça geniþ bir bölgedeki alan,
küresel simetri gösteren bir alan tarafýndan temsil edilebilir.
Alanýn bu simetri özelliði nedeniyle örgünün her bir iyonu
etrafýnda kapalý bir hücre düþünmek suretiyle örgüyü eþdeðer
parçalara bölmek mümkündür. Birer polihedron olarak seçilecek her
hücrenin merkezinde bir iyon bulunur. Hücrelerin nasýl seçileceði
eldeki kristalin yapýsýna baðlýdýr. Tek çeþit atomlu kristallerde, en
uygun olaný, iyonlar arasý uzaklýðýn tam ortasýna dik yüzeyler
tarafýndan meydana getirilen polihedronlardýr. Þekil 2.18 kütle
merkezli ve yüzey merkezli örgüler için çizilen polihedronlarý
göstermektedir.
Þekil 2.18. Yüzey merkezli ve
uzay
merkezli
örgülerde
hücre polihedronlarý
a
b
Birbirine komþu olan polihedronlarýn içlerindeki alanlar
birbirlerine taþmazlar Bir baþka deðiþle polihedromlarýn karýþýk
geometrik þekilleri yerine küreler kabul etmek pek büyük yanlýþlýða
neden olmaz. Hücre içindeki atomun valens elektronu yalnýz ortadaki
iyonun alaný etkisi altýndadýr. Örneðin alkali metallerde serbest
elektronlarýn dalga fonksiyonlarý hücre hacminin % 90 nýnda sabittir.
Ancak çekirdeðin en yakýnlarýnda farklý deðerler alýr. Böylece
Wigner-Seitz modelinde valens elektronlarý enerjilerinde deðiþiklik
olmadan hücrelerin içinde serbestçe hareket edebilirler. Kristali
oluþturan atomlarýn türüne göre bu serbestlik az veya çok olur. Ýyon
yarý çapýnýn iyonlar arasý uzaklýðýn yarýsýna oraný ne kadar küçük
ise elektron o kadar serbest olur. Aþaðýdaki tabloda bazý metaller için
hesaplanan bu oranlar verilmiþtir.
Metal Riyon / R/2
Li
0.39
Na
0.51
K
0.58
Cu
0.78
Ag
0.88
Au
0.95
Bu
listeden
görülen,
Li
içinde
elektronlarýn daha serbest olduðu, bu nedenle
metallerin bir elektron bulutu içine yerleþtirilmiþ
pozitif iyonlardan oluþtuðu þeklindeki klasik
modele az çok uyduðudur. Listenin sonundaki
altýnýn ise böyle bir modele pek uymadýðý
anlaþýlmaktadýr.
Wigner-Seitz
modeli
ile
baðlantý
enerjisini hesaplamak için þu yol izlenir.
Polihedronlarýn içinde
2 2
E Vr 0
2m
Schrödinger denklemi uygun kenar þartlarý ile çözümlenir. Küresel
koordinatlarda çözüm, genellikle,
fl r , E
r
ln ,
þeklinde olup, f(r,E) radial fonksiyonu da
2 d2 f
2 l(l 1)
E
V
(
r
)
f 0
2
2
2m dr
2m r
diferensiyel denklemini uygular. nl ( , ) ise,
ln
l n
l n
! 2l 1 n
Pl Cos ein
! 4
küresel harmonik ifadesidir. Alkali metaller kütle merkezli örgüler
halinde kristalleþtikleri için Þekil 29.b. deki polihedron esas alýnýr
ve bu bir küre kabul edilir. Ýlk yaklaþýmda yalnýzca merkezdeki
iyonun alaný göz önüne alýnýr, hücre içindeki elektron daðýlýmý
ihmal edilir. Bu daðýlým ilk yaklaþýklýkla sabit olduðundan bu ihmali
yapmaya izin verir.
Bu koþullarla alkali metaller için yapýlan hesaplamalar, E
baðlantý enerjisi için, hücre baþýna,
E - (Vo + EF + VÝ )
deðerini verir. Burada Vo elektronlarýn metal içindeki, klasik metal
teorisinde sabit kabul edilen, potansiyel enerjisini; VÝ alkali metalin
iyonizasyon enerjisini; EF ise,
3 3n 0
EF
5 2m 8
2
2/3
deðerinde bir enerjidir. Burada no = N / V birim hacim baþýna
elektron sayýsýný gösterir. Aþaðýdaki tabloda Li. Na ve K için teori ile
deneyi karþýlaþtýran sonuçlar verilmiþtir.
BAZI ALKALÝ METALLERÝN BAÐLANTI
ENERJÝLERÝNÝN DENEYSEL VE TEORÝK DEÐERLERÝ
Metal
rhücre/ rBohr
Vo
VI
EF
EHesap
EÖlçü
Lityum
3.21
- 206.0
123.4
43.6
- 39
- 39
Sodyum
3.96
- 190.0
118.7
46.9
- 24.4
- 26
Potasyum 5.47
- 131.1
91.4
33.1
- 6.6
- 22.6
Tablodan görüleceði gibi Li ve Na için Wigner-Seitz modeli
oldukça iyi sonuçlar vermesine raðmen Potasyum için oldukça farklý
sonuç vermektedir. Bu model daha sonralarý bir çok bakýmlardan
düzeltilmiþ ise de elde edilen baþarý pek büyük olmamýþtýr.
Mükemmel
bir
teori
baðlantý
enerjisinin
duyarlý
hesaplanmasý yanýnda metalin diðer bir çok özelliklerini de doðru
biçimde verebilmelidir. Örneðin alkali metallerin neden yüzey
merkezli deðil de uzay merkezli kristalleþtiðini böyle bir teori
açýklayabilmelidir. Bu þekilde düþünülen mükemmel bir teori henüz
mevcut deðildir.
9.HAFTA
METAL VE YARIİLETKENLERİN
SERBEST ELEKTRON TEORİLERİ
Metaller içinden elektrik akýmýnýn diðer katý cisimlere göre daha
kolay geçebilmesi ve bu sýrada hiç bir madde transferinin olmayýþý,
bu cisimlerde elektronlarýn az çok serbest olduklarý hipotezine yol
açmýþtýr. P. DRUDE (1900) böyle bir hipotezden yola çýkarak
metallerin elektrik ve ýsý iletkenliklerini hesaplayabilmiþtir. Drude
teorisi bu iki iletkenlik arasýndaki oranýn bütün metaller için sabit ve
birbirine eþit olduðunu da gösterebilmiþ ve böylece 1853 de
WIEDEMANN ve FRANZ tarafýndan empirik olarak bulunan kuralýn
anlaþýlmasýna da yardýmcý olmuþtur.
Drude
teorisi,
metaller
içindeki
iletkenlik
elektronlarýnýn bir ideal gazýn atomlarý gibi serbest
hareket edebildiklerini kabul eder. Göz önüne alýnan bir
elektron üzerine diðer elektronlar ile pozitif iyonlarýn
etkilerinin birbirini, birinci dereceden bir yaklaþýkla,
karþýladýklarý düþünülür. Bu etkiler kinetik gaz teorisinde
yapýldýðý gibi, elektronlara bir serbest yol uzunluðu
tanýmlanarak hesaba katýlýr. H.A. LORENTZ (1904)
Drude'nin klasik serbest elektron modelini daha
geliþtirmiþ, serbest elektronlarýn hýz daðýlýmý için
MAXWELL-BOLTZMANN daðýlým kanununu esas almýþ ve
daha doðru hesaplamalar yapmýþtýr. Fakat metallerin
spesifik ýsýlarý ile düþük sýcaklýklarda iletkenlikleri gibi
çok önemli fiziksel olaylarý bu teori ile açýklamak mümkün
olmamýþtýr.
PAULI
prensibi
ve
FERMI-DIRAC
daðýlýmýnýn
açýklanmasýndan sonra bu önemli güçlüklerin çoðu ortadan
kalkmýþtýr.
A. SOMMERFELD (1928), Lorentz'in hesaplarýný
kuantum istatistiðini kullanarak deðiþtirmiþ ve alçak sýcaklýklarda
iletkenlik olaylarý hariç deneylere daha yakýn sonuçlar almýþtýr.
Alçak sýcaklýklarda iletkenlik problemlerinden süper iletkenliðin
açýklanmasý ise J. BARDEEN, L.N. COOPER ve J.R. SCHRIEFFER
tarafýndan 1957 de yapýlabilmiþtir.
Serbest elektron teorilerinden hiç biri metallerin baðlantý
enerjilerinin hesaplanmasýnda kullanýlamaz. Bu teori hangi
cisimlerin metal hangilerinin ametal olduðunu da söylemez. Buna
karþýlýk yukarýdaki konulara ek olarak paramagnetik süseptibilite,
bazý metallerin ultraviyole ýþýnlara karþý geçirgenlikleri, termoiyonik
emisyon olaylarý gibi fiziksel olaylarýn hesabýnda iþe yarar.
Bu bölümde bu olaylarýn bazýlarýný inceleyeceðiz. Ancak bu
konulara girmeden önce serbest elektronlarýn kuantum teorisi ile
Pauli prensibinin iletkenlik elektronlarýnýn daðýlýmý üzerindeki
etkisini, baþka sözlerle Fermi-Dirac Daðýlým Yasasýný öðrenmemiz
gerekecektir.
10.HAFTA
Pauli Prensibi, izole edilmiþ bir atomda iki elektronun bütün
kuantum sayýlarýnýn ayný olamayacaðýný söyler. Bunlar, n temel
(principal) kuantum sayýsý, l yörünge (dönme) kuantum sayýsý, l '
nin verilen bir doðrultu üzerindeki iz düþümü demek olan ml azimütal
kuantum sayýsý ve ms spin kuantum sayýsýdýr.
Bir iletken içindeki elektronlar üzerinde bu prensibin etkisini
inceyebilmek için önce atomun n, l, ml, ms kuantum sayýlarýna
serbest bir elektronda hangi deðerlerin karþýlýk geleceðini bulmak
gerekir.
Serbest olarak p momentumu (impulsu) ile hareket eden bir
elektrona gibi bir DE BROGLIE dalga boyu eþlik eder.
h
h
p mv
denklemi ile tanýmlanan böyle bir dalganýn elektrona eþlik etmesi
olgusu bize aradýðýmýz kuantum sayýlarýný bulmada yardýmcý
olacaktýr.
Schrödinger denklemi serbest, yani hiç bir elektrik potansiyel
alaný etkisinde olmaksýzýn2hareket eden bir elektron için
2 E
2m
þeklinde yazýlabilir. Çözüm e
þeklindedir. Gerçekten uzay
koordinatlarýna göre iki defa türev alýnýrsa,
i k r
ψ
ikei k r
r
2
2 ikr
k
e
2
r
elde edilir. Burada k ile enerji arasýnda
2 2
E=
k
2m
2 k 2
baðýntýsý mevcuttur. k serbest bir elektron için dalga sayýsý
boyutundadýr ve önemli bir kavramdýr. k için,
k k
2
yazýlabilir. Buna göre k, 2 uzunluðunda kaç tane dalga olduðunu
söyler. k vektörüne, dalga vektörü
adý verilir. E enerjisi, de V
potansiyeli sýfýr kabul edildiði için ayný zamanda kinetik enerji
anlamý taþýr, de Broglie baðýntýsý da kullanýlarak;
2
2
2 2
1 h
1
mv 2
E
2m
2m
2
þeklinde ifade edilebilir. Görüleceði gibi bu, serbest hareket eden
elektronun kinetik enerji ifadesidir. Buradan, serbest hareket eden bir
parçacýðýn kinetik enerjisi ile dalga boyu arasýndaki baðýntýnýn
Schrödinger denklemi ve de Broglie denklemi tarafýndan ayný ifade
ile verildiðini görmüþ oluyoruz.
Dalga denkleminin çözümünün e
þeklinde olduðunu
gördükten sonra dalga fonksiyonunu normalize etmemiz gerekir. Bu
iþi dalga fonksiyonunu
i k r
1
V
e
i k r
þeklinde alarak yapabiliriz. Burada V elektronun bulunduðu yerin
hacmidir. Elektronun bulunduðu hacim V ile gösterilirse, bu V hacmi
içinde elektronun bulunma olasýlýðý 1 olmalýdýr. O halde elektronun
serbestçe hareket edebildiði ancak dýþarý çýkamadýðý V hacmi
içinde
ψ dτ
V
100
1
100
yazýlabilir. Elektronun dalga fonksiyonu ise e
þeklinde idi.
Buna uygun bir katsayý bulunursa integral 1 e eþit olur. Bu kat sayý
1 / V olmaktadýr.
i k r
Gerçekten,
1
V
V d V d V 1
*
olur.
Elektronlarý kenar uzunluklarý L olan bir kübün içinde
varsayalým. Dalga fonksiyonlarý x, y , z doðrultularýnda periyodik
olsun ve periyod L ye eþit olsun. Matematik olarak bunu,
x L, y , z x , y L, z x , y , z
þeklinde yazabiliriz. Bu periyodiklik þartý serbest elektronlar için
n
1
V
e
ik r
1
3/ 2
L
e
i
n x xn y y nz z
L
þeklinde bir dalga fonksiyonu tarafýndan saðlanabilir. Burada nx , ny
‘ e karþýlýk
ve nz , 0 1 , 2, 3 ...... gibi tam sayýlardýr.
n
gelen enerji,
2
2 2 2 2 2
2
2
E
k
nx ny nz
2m
2m L
2
2 2 2
n
2m L
dir.
Dikkat edilirse burada,
2
2
k
nx ny nz
n
L
L
deðerindedir. Bu örnekte elektron yoðunluðu, baþka sözlerle
elektronlarýn V = L3 hacmi içinde daðýlým ihtimaliyetleri yoðunluðu,
1
sabit
V
tir. Elektron hareketi ilerleyen bir dalga hareketidir.
Þimdi tekrar elektronun kuantum sayýlarýna dönelim.
Serbest hareket edebilen ve bu hareketi ilerleyen bir dalga hareketi
olarak tanýmlanabilen elektronun durumunu nx , ny ve nz
sayýlarý ve bir de elektronun ns spin kuantum sayýsý ile tam
olarak tanýmlayabileceðimiz açýktýr. Benzer þekilde kx, ky , kz ve
ns dörtlüsü de elektronu tanýmlayabilir. Serbest elektronun
kuantum sayýlarý olarak bu sayýlarý alabiliriz. Enerji n2 ye
baðlýdýr.
nx2 + ny2 + nz2 ne kadar büyük ise enerji o kadar artar.
Elektronun alabileceði en küçük enerji nx2 = ny2 = nz2 = 0 a
karþýlýk gelir. Bu temel durum demektir. Spin kuantum sayýsý ns =
1/2 olabileceði için Pauli Prensibine göre, bir kristal içinde temel
durumda en fazla iki elektron bulunabilecek demektir.
Temel durumdan daha yüksek enerji deðerleri (seviyeleri) n 2
= 1, 2, 3, ..... deðerlerine karþýlýk gelir. n 2 nin her bir deðeri için
elektron sayýsýný hesaplayabiliriz.
Önce n2 = 1 durumunu ele alalým.
n2 = nx2 + ny2 + nz2 = 1
olabilmesi , n x,y,z = 0, 1 olarak alýrsak, 6 türlü olabilir. Bunlarýn her
birinde ns = 1 / 2 , - 1 / 2 imkaný olabileceðinden n2 = 1 durumunda
kristalde 2x6 = 12 elektron bulunabilir. Benzer düþünce yolu ile n2 =
2 , 12 ayrý kombinasyonla elde edilebilir. Bunlarýn her birinde 1/ 2
spinli iki elektron bulunabileceðinden bu seviyeye 24 elektron
yerleþtirilebilir. Bu mantýkla ilerleyerek bir kristalin içindeki N tane
elektronu birer boþ seviyeye yerleþtirebiliriz. Buna göre mutlak sýfýr
sýcaklýðýnda, bir kristalin içinde temel enerji düzeyinde en fazla 2
elektron bulunabilir. Diðer tüm elektronlar daha yüksek enerji
düzeylerine yerleþebilirler.
Bu nokta, klasik serbest elektron teorisinin Maxwell Boltzmann daðýlýmýna hiç uymaz. Bu modelde mutlak sýfýr
sýcaklýðýnda yani kT = 0 oK de, elektron ortalama enerjisi sýfýrdýr.
Baþka bir deðiþle temel enerji seviyesi bütün elektronlar tarafýndan
iþgal edilebilir. Oysa kuantum mekaniði daha doðrusu Pauli Prensibi
buna müsaade etmemektedir.
Yukarýda açýklandýðý gibi mutlak sýfýr sýcaklýðýnda
kristalde mevcut olduðu kabul edilen N sayýdaki elektron belirli bir
seviyeye kadar bütün enerji seviyelerini doldurmuþtur. Bu seviyenin
üstündeki diðer tüm seviyeler ise boþtur. Mutlak sýfýr sýcaklýðýnda
dolu ve boþ enerji seviyelerini ayýran enerji deðerine Fermi Seviyesi
denir ve EF (0) ile gösterilir.
Bu açýklananlara göre Fermi seviyesi mevcut
elektron
n
seviyesi N ye baðlýdýr. Bu baðlantýyý bulabilmek için uzayýnda nF
yarýçapýnda bir küre hacmi içinde kalan ve nF den küçük olan n
sayýsýnýn bulunmasý gerekir. Bu hacim (4/ 3) nF3 dür. Seviye
sayýsý ise bunun iki misli olmalýdýr. Çünkü her seviyeye spinleri +
ve - 1/ 2 olan ikiþer elektron seviyesi yerleþtirilebilmektedir.
Kristalin hacmi L3, hacim birimindeki elektron sayýsý N
olsun. Mutlak sýfýr sýcaklýðýnda dolu olann deðerleri NL3 elektron
tarafýndan iþgal edilmiþtir. Dolayýsyla;
4 3
3
2
n F NL
3
2
3
nF 3
NL3
8
bulunur. Fermi enerjisi ise,
2
2 2 2 2 2
EF 0
nF
2m L
2m L
2
EF(0 )
3 2 N
2m
2
3
3
NL3
8
2
2/ 3
olur. Elektron kosantrasyonu N, iletkenlik ölçüleri yardýmýyla
saptanabilir. Böylece hesaplanan EF(0) Fermi enerjileri bazý metaller
için tabloda verilmiþtir. Bu tabloda kTF = EF(0) þeklinde tanýmlanan
TF Fermi sýcaklýðý da yer almaktadýr.
Enerji seviyesinin yoðunluðu hakkýnda da bir fikir edinmek
önemlidir. Hacim ve enerji birimindeki seviye sayýsý olarak
tanýmlayacaðýmýz seviye yoðunluðu G(E) olsun. Seviyelerin hacim
birimindeki sayýsý, bunlarý iþgal eden elektronlarýn sayýsýna eþit
olacaðý için ,
MUTLAK SIFIR SICAKLIÐINDA
FERMÝ ENERJÝSÝ VE FERMÝ
SICAKLIÐI
METAL EF(0) (eV)
Li
4.72
TF (oK)
55 000
Na
3.12
37 000
K
2.14
24 000
Cs
1.53
18 000
Ag
5.51
64 000
Au
5.51
64 000
G(E)dE N
0
yazýlabilir.
türev alarak
Enerjiye
G(E)
göre
dN(E)
dE
bulunur. EF(0) dan
1 2m
N
2
2
3
3/ 2
dN
1
G(E)
dE 3 2
E3 / 2
2m
2
3/ 2
3 1/ 2
E
2
ve gerekli sadeleþtirmeler ile;
1 2m
G(E)
2
2
2
3/ 2
E1/ 2
elde edilir. Buna göre seviye yoðunluðu enerjiye baðlý olarak bir
parabol çizmektedir. Þekil 3.1 bu baðýntýyý göstermektedir.
G(E)
kT
0oK
oda sıcaklığı
E
E (0)
F
Þekil. 3.1. Seviye yoðunluðunun deðiþimi
T = 0 o K de Fermi enerjisine kadar seviyelerin dolu olduðu
þekilde tarama yöntemi kullanýlarak belirtilmiþtir.
Metal mutlak sýfýr sýcaklýðý yerine daha yüksek, örneðin
oda sýcaklýðýnda bir sýcaklýkta ise, Fermi enerjisinden
kT = 1.38.10 – 23 . 300 / 1.6.10 – 19 = 0.026 eV
kadar daha az enerjisi bulunan elektronlarýn bu mertebeden enerji
kazanarak Fermi seviyesinin üstündeki boþ enerji seviyelerine
çýkmasý beklenir. Mutlak sýfýrýn üstündeki sýcaklýklarda G(E) eðrisi
þekildeki mavi çizgi ile gösterilen þekilde olacaktýr. T sýcaklýðýna
çýkarýlan bir metalde, klasik modelde beklendiði gibi, bütün
elektronlar ortalama olarak kT enerjisini kazanamazlar. Ancak Fermi
seviyesine kT kadar yaklaþýk bulunan seviyelerdeki elektronlar enerji
kazanarak uyartýlabilirler. Daha derinlerdeki elektronlar bu denli
enerjilenemezler. Bu durumun bir metaldeki iletkenlik elektronlarýnýn
ýsý kapasiteleri açýsýndan büyük önemine ilerde tekrar döneceðiz.
11.HAFTA
Klasik serbest elektron modelinde metal içindeki elektronlar,
týpký bir gazýn atomlarý gibi, metalin T sýcaklýðýnýn gerektirdiði
termik dengeye uygun ve Maxwell-Boltzmann yasasýnýn gösterdiði
enerjilerde geliþi güzel yönlerde hareket eder biçimde düþünülür.
Cisme dýþardan bir elektrik alan uygulanmazsa ortalama olarak bir
yöne doðru hareket eden elektronlarýn sayýsý kadar elektron ters
yöne doðru haraket halindedir. Baþka bir deðiþle metalin cm3 de N
elektron varsa ortalama hýz veya difüzyon hýzý
1 N
vd vi 0
N i
dýr. Elektrik alan uygulanýnca elektrostatik kuvvetler nedeniyle bu
denge bozulur ve elektronlarýn difüzyon hýzlarý deðiþir. Bu
deðiþmeyi kantitatif olarak izlemek yani metalin elektrik iletkenliðini
hesaplamak için DRUDE þu yolu izlemiþtir.
Uygulanan E alaný elektronu
e.E
kuvveti ile etkiler ve
elektron metal içinde bir çarpýþma yapýncaya kadar bu kuvvetin
etkisi altýnda hareketine devam eder. Hareket denklemi,
m
d vd
dt
eE
dir. t = 0 ile t = t zamanlarýnda meydana gelen iki çarpýþma arasýnda
,
m v d e Et m v d 0
elde edilir. v d 0 ilk çarpýþma anýndaki hýzdýr. Bu hýzýn tercihli bir
yönü olmadýðýndan bir çok elektron için ortalamasý sýfýrdýr.
vd
bir sonraki çarpýþma anýna kadar zamanla artar. Elektronlarýn
ortalama yol uzunluðu ise, bu artýþ, ortalama,
v
kadar bir süre devam eder.
Burada , yollarýn toplamý / elektron sayýsý anlamýndadýr, v ise
elektronlarýn termik hýzlarýdýr. Pratik olarak her zaman v vd dir.
relaksasyon süresi adý verilen ve mertebesi 10 – 14 s olan bir
zamandýr. Buna göre difüsyon hýzý için,
e
e
v d E E
m
m v
yazabiliriz.
J , Elektrik akým yoðunluðu, iletkenin E elektrik alan yönüne
dik kesitinin birim alanýndan birim zamanda geçen elektrik yük
miktarý olarak tanýmlanýr.
Ne 2 t
J N evd
E sabit. E
m
olur. Bu ifade Ohm yasasýndan baþka bir þey deðildir. Buna göre,
spesifik (öz) iletkenlik;
Ne 2 Ne 2
m
mv
öz (spesifik) direnç ise
1
m
mv
2
Ne Ne 2
olur.
Bu sonucu, prensip itibariyle, klasik Maxwell - Boltzmann
daðýlým yasasý vermiþtir. Bu daðýlým yerine Fermi - Dirac daðýlým
yasasý kullanýlýrsa yine ayný sonuç elde edilir. Bu durum þaþýrtýcý
gibi görünür. Çünkü Fermi - Dirac daðýlýmýna göre ancak enerjileri EF
mertebesinde olan olan elektronlar hýzlanýr ve çarpýþmalara
katýlabilirler. EF nin çok altýndaki enerji seviyelerini iþgal eden
elektronlar etkili olan eE kuvvetinin elektronlarý enerjilendirecek
büyüklükte
olmamasý
nedeniyle
Fermi
seviyesi
üzerine
çýkamamalýdýrlar. Bu da iletkenlik olayýna katýlan elektronlarýn
sayýsýný çok sýnýrlayacaktır. Bu nedenle öz iletkenlik yukarýdaki
ifadeden hesaplanacak değerin çok altýnda kalmalýdýr.
Bunun böyle olmamasý E elektrik alaný etkisi ile bir elektron
eEds
enerji kazanýrken iþgal ettiði enerji seviyesi
deðerine
eþit olan baþka bir elektronun da, yine E alaný etkisiyle hýzlanarak ilk
elektron için Pauli prensibinin gerektirdiði boþluðu yaratmasý
sayesinde mümkün olur. Sonuçta Pauli prensibinin kýsýtlayýcý etkisi
fark edilmemiþ olur.
Yukarýda karþýlaþýlan v,ve
‘ nýn büyüklükleri
hakkýnda fikir edinebilmek için sodyumun iletkenliðini ele alalým.
Na'un atom baþýna 1 serbest elektronu vardýr. Yoðunluðu =
0.954 g/cm3 , atom aðýrlýðý 23 dür. cm3 deki elektron sayýsý,
6.02.10 23
N
0.954 2.5.10 22
23
dir. Ortalama hýz
v
yi, iyi bir yaklaþýklýkla Fermi enerjisi ifadesi,
2
1
EF mv F2
3 2 N
2
2m
2
3
den hesaplanabilir. Yukarýdaki ifadede vF alýnmýþtýr, çünkü
elektronlarýn en büyük enerjisi bu hýzdadýr, elektronlarýn büyük bir
kýsmý EF civarýndadýr. Buna göre,
v v F 1.07.10 8 cm/s
olarak alabiliriz. Na'un özdirenci = 4.3.10
hesaplanan öz iletkenliði (0 oC da )
–6
ohm.cm, bu deðerden
1
5
1
1
2
,
325
.
10
.
cm
4.3.10 6
olduðundan,
mv F
Ne 2
2,325.10 7.9,1.10 31.1,07.10 6
(2,5.10 28.)(1,6.10 19 ) 2
= 353.10
-10
o
m 353 A
bulunur. Sodyumun yüzey merkezli örgüsünde örgü sabiti 4.24 Å, en
yakýn atomlar arasýndaki uzaklýk ise 3.67 Å dür. Buna göre bir
elektron sodyum içinde bir çarpýþma yapmaksýzýn bu mesafelerin
80 - 100 katý gidebilmektedir. Daha düþük sýcaklýklarda elektronlar
daha uzak mesafelere çarpýþma yapmaksýzýn gidebilir. 'nýn
sýcaklýða nasýl baðlý olduðu hesaplanabilir (E. ABRAMS, 1954). Bu
baðýntý aþaðýdaki gibidir.
1 EF
2
Nd kT
2
Burada
d
atomlar arasýndaki uzaklýktýr. Na için sývý He
sýcaklýðýnda (4.2 oK) ortalama serbest yol uzunluðu yaklaþýk
olarak 2.3 cm dir.
Elektronlarýn metal içindeki bu davranýþlarý kuantum
mekaniðinin tipik sonucudur. ABRAMS denklemi gibi bir baðýntýyý
elektronlarýn de Broglie dalgalarýnýn kristal örgüsü içinde ilerlerken
uðradýklarý difraksiyon (saçýlma) olaylarýndan da hesaplamak
mümkündür. Mutlak sýfýr sýcaklýðýnda kristalin atomlarý esas
itibariyle örgü noktalarýnda sükunet halinde bulunurlar.
Elektron dalgalarý bu atomlarda saçýlmaya uðrarlar. Bu saçýlma,
bir optik örgüde saçýlan ýþýk dalgalarý veya kristal örgüsünde
saçýlan x-ýþýnlarýnda olduðu gibi koherent bir saçýlma olayýdýr.
Ýlerleyen dalga ile saçýlan dalga ayný fazda olduðu için kristal
içinde bir sönüme uðramadan uzun mesafelere eriþebilirler. Bunun
için elektronlarýn dalga boyu, ilerleme doðrultusundaki atomlar
arasý mesafenin en az iki katý olmalýdýr.
Elektron dalgalarýnýn rahatlýkla
olabilecek 2 faktör düþünülebilir.
ilerlemelerine
engel
1) Örgü atomlarýnýn titreþimleri. Bu titreþimler elektron
dalga boyu ile örgü sabiti arasýndaki orantýyý ve titreþim
frekansýný deðiþtirir. Faz iliþkileri bozulur, baþka sözlerle saçýlma
inkoherent olur.
2) Kristal örgüsündeki periyodikliðin bozuk olmasý. Bu
özellik de elektron dalgalarýnýn inkoherent olmasýna neden olur.
Birinci halde sýcaklýk mutlak
sýfýrýn üzerindedir. Elektron serbest
yol uzunluðunun sýcaklýkla Abrams
denklemine göre deðiþmesi nedeniyle
özdirenç Þekil 3.6 deki gibi deðiþir.
özdirenç
sıcaklık
Şekil 3.6. Ýdeal bir metalin öz
direncinin sýcaklýkla deðiþimi
Ýkinci hal iki þekilde görülür.
a)
Metal
saftýr,
fakat
örgüsünde
periyodiklik
bozukluðu
vardýr,
örneðin
kaymalar
veya
atomlarýn bulunmasý gereken yerlerde
boþluklar bulunmasý gibi.
b)
Metal saf deðildir. Örgünün bazý noktalarý yabancý
atomlar tarafýndan iþgal edilmiþtir. Her iki durumda da direncin
büyüdüðü görülür.
Saf olmayan, az miktarda yabancý atomlar (kir, impurities)
içeren her metalin mutlak sýfýr sýcaklýðýndaki öz direnci sýfýrdan
farklýdýr. Öz direnç bu malzeme için
örgü kir
þeklinde yazýlabilir. Örgünün termik karakterinden ileri gelen birinci
terim, Þekil 3.5 deki gibi mutlak sýfýr sýcaklýðýnda sýfýra iner.
Kirlerden (impuritelerden) ileri gelen ikinci terime artýk direnç adý da
verilir. Yukarýdaki.denklem katýhal fiziðinde MATTHÝESSEN KURALI
olarak bilinir. Metal içindeki kir yoðunluðu az ise kir sýcaklýða baðlý
deðildir. Þekil 3.7 , Kirlilik bakýmýndan birbirinden farklý iki sodyum
örneðinin öz dirençlerinin sýcaklýkla deðiþimlerini göstermektedir.
40.10 -4
30
R / R 290
20
10
Sıcaklık
0
2
4
6 8
10 12 14 16
20
MacDonald + Mendelsshon, Proc. Roy. Soc.
(London) A202, 103,
1950)
o
K
Þekil 3.7
tavlanmamış
tavlı
Cu
% 100
Cu
Cu
3
Au
CuA
u
% 100
AuAu
Au
Þekil 3.8.
Saf iki metalden oluþan bir alaþýmda öz direnç, karýþým oraný
büyüdükçe artar. Çünkü inkoherent saçýlma merkezlerinin sayýsý
giderek artmaktadýr. 50:50 oraný 'nun maksimumunu verir. Ayný
doðrultuda oran arttýrýlýrsa öz direnç tekrar azalýr, ikinci metalin saf
iken sahip olacaðý deðere kadar iner, Þekil 3.8 Cu-Au alaþýmý için bu
durumu göstermektedir. Alaþým uzun zaman ergime sýcaklýðýnýn biraz
altýnda tutulursa, yani tavlanýrsa bakýr ve altýn atomlarý daha düzenli,
daha düþük enerjili bir yapý kazanýr, özdirenç de düþer. En düzenli
alaþýmlar Cu Au ve Cu3 Au yapýlarýna karþýlýk gelir.
Saf metallerden kübik sistemde kristalleþenlerin özdirençleri
kristal doðrultusuna baðlý deðildir. Diðer sistemlerde
doðrultuya da
baðlýdýr.
12.HAFTA
Elektrik iletkenlik elektronlarýn sadece elektrik alan
doðrultusunda eneri kazanmalarý idi. Elektronlarýn her doðrultuda
enerji kazanmalarý ve bu enerjilerinin daðýlýmý, baþka sözlerle iç
enerjilerinin deðiþmesi katý cisimlerin ýsýsal davranýþlarýný belirler.
Bu bölümde bu olaylar tartýþýlacaktýr.
Klasik istatistik mekaniðin cisimlerin ýsý içerikleri hakkýnda
verdiði en önemli sonuç, serbest hareket eden parçacýklardan
(partiküllerden) oluþan ve T sýcaklþýðýnda dengede olan bir sistemde
serbestlik derecesi ve parçacýk baþýna ortalama enerjinin ,
1
kT
2
harmonik ossilatörlerden ibaret bir sistemde ise
k T
olmasýdýr. ( Burada enerjini yarýsý kinetik yarýsý potansiyel enerjidir.)
Katý cisim 1 mol atomlardan meydana gelmiþ ise cismin
ortalama iç enerjisi
U = 3 NAvo k T = 3 R T
sabit hacim altýnda özgül ýsýsý ise,
CV
dU
kalori
3R 6
dT
mol derece
olur (DULONG - PETIT KURALI).
Dulong - Petit yasasý oda sýcaklýðý üstündeki sýcaklýklarda
çok çeþitli katý cisim ve metal için deneylerin verdiði sonuçtur.
Düþük sýcaklýklarda ise CV Þekil 3.9 da görülen azalmayý gösterir.
6
C
V
Ag
4
= 215
Al = 390
o
o
o
KCl = 227
2
T/
0
0
0.5
1.0
1.5
2.0
Þekil 3.9. Debye spesifik ýsý eðrisi. Ag,
Al, Grafit, Al2O3 ve KCl ile yapýlan
ölçülerin hepsi bu eðri üzerine
düþmektedir.
Mutlak sýfýr sýcaklýðý yakýnlarýnda özgül ýsý ölçüleri metallerde
CV T gibi lineer olarak sýfýra yaklaþmakta; metal olmayan
katýlarda CV T3 gibi baðýntý göstermektedir.
Bu önemli uyuþmazlýðý çözmek üzere A. EINSTEIN (1907)
katý bir cisim için þöyle bir model önermiþtir. N sayýda atomdan
yapýlmýþ bir cisim, hepsi ayný frekansýnda titreþen 3N sayýda
baðýmsýz harmonik ossilatörden oluþmuþ bir sistemdir.
Bir ossilatörün, kuantum mekaniðine göre ortalama enerjisi,
klasik kT deðerinden farklýdýr. Ossilatörün ortalama enerjisini
hesaplamak için ýsýsal denge halinde kuantum sayýlarý birbirinden
bir farklý iki ossilatörün sistem içindeki sayýlarýnýn birbirine oranýný
bulalým. Bu oran Maxwell-Boltzmann yasasýna göre ;
E1 n h
-
E2
e kT /e
e
-
E2 = (n + 1) h
E1
kT
h
kT
dir. Ortalama enerji bütün n kuantum sayýlarýný hesaba katarak,
U
nh
e
nh
kT
n 0
n 0
e
nh
kT
2 h
3 h
h
kT
kT
kT
hn e
2e
3e
....
h
2 h
3 h
1 e
kT
2e
kT
3e
kT
.....
olmalýdýr. Burada e
getirilebilir.
- h / kT
= x alarak yukarýdaki ifade şekline
x 2x 2 3x 3 4x 4 ....
U h
1 x x 2 x 3 x 4 ...
x(1 2x 3x 2 4x 3 )
(1 2x 3x 2 4x 3 )
1 x x2 x3 x 4
1
1 x 2
1
1 x
Böylece Einstein ossilatörünün ortalama enerjisi için
x
1 x
2
U h
1
1 x
h
x
h
he
1
1 x
1 1 e
x
Bulunur. Her terimi e - h / kT ile bölerek
h
kT
h
kT
hν
1
e
-
hν
kT
hν
1
e
hν
kT
1
h
U=
ile
e
h
kT
-1
Klasik sýnýrda, yani yüksek sýcaklýklarda (kT>> h olmasý hali)
e
h
kT
-1
h
ve
kT
UkT
sonucu ve buradan da Dulong - Petit kuralý elde edilir.
Mutlak sýfýr yakýnlarýnda ise ( h >> kT olmasý hali )
ortalama enerji
h
U = h e kT
h
ve spesifik ýsý,
d(NU)
d
CV
Nh e kT
dT
dT
h
h
d
h
kT
kT
de
h
CV Nh
Nh e kT 2
kT
h d T
d kT
2
h hkT
CV Nk e
kT
olur ki bu denklem de T 0 oK civarýnda özgül ýsýnýn exponansiyel
biçimde sýfýra yaklaþmasý gerektiðini gösterir. Bu sonuç alçak
sýcaklýklarda yapýlan ölçülere ne yazýk ki çok aykýrýdýr. Örneðin Ag
için teori ve deneyin verdiði sonuçlar þöyledir.
T(oK)
1.35
Ölçülen CV
(cal/mol.derece)
2.54.10-4
Einstein Modeline
göreCV (cal/mol.der.)
8.76.10-49
Debye Modeline
göre CV
(cal/mol.derece)
2.0
6.26.10-4
1.32.10-32
3.0
15.7.10-4
6.16.10-20
5
50.9.10-4
1.62.10-11
10
475.10-4
1.27.10-4
502.10-4
20
3995.10-4
94.5.10-4
3940.10-4
55.88
3.186
2.946
3.22
103.14
4.797
4.795
4.86
205.30
5.605
5.633
5.66
3N
U=
i =1
h i
e
h i
-1
kT
olmalýdýr. Bu ifadeyi deðerlendirebilmek için i frekanslarýnýn nasýl
daðýldýðýný yani bunlarýn spektrumunu bilmek gerekir. Prensip
olarak cismin atomlarýnýn birbirleriyle kuplaj þekli, kristal örgüsü gibi
bilgiler elde ise spektrumu hesaplamak mümkün olmalýdýr. Fakat bu
oldukça yorucu ve zor çözüm yoludur. Bunun yerine yaklaþým
yöntemleri kullanýlmalýdýr.
Debye teorisinde cm3 içindeki N atomun teker teker titreþim
frekanslarý yerine kristalin tümünün elastik titreþimleri alýnýr. Baþka
sözlerle elastik cisimler teorisinde yapýldýðý gibi cisim ayrý ayrý
atomlardan oluþmuþ bir sistem gibi deðil, sürekli yapýda bir sistem
olarak düþünülür.
Göstermek mümkündür ki hacmi 1 cm 3 olan bir katý cisimde,
cismin biçimi ne olursa olsun, frekanslarý ile ( + d) arasýnda
bulunabilecek duran dalga sayýsý
4p 2
dZ 3 d
c
ye eþittir. Burada c elastik (ses) dalgalarýnýn cisim içindeki hýzýdýr.
Böylece sürekli katý cismin enerjisi için
U
h
e
h1
kT
1
4p 2
d
3
c
integralini yazabiliriz. Ýntegral sýnýrlarý = 0 dan bir m deðerine
kadar olmalýdýr. Bu maksimum koþulu 3N = Z den bulabiliriz.
3N Z
4 2
m
3
3c
Enerji ise,
4
U 3
c
m
0
e
h
kT
h m
4 x m kT
4 kT
d 3
c h3
1
h 3
9
m c
N
4
0
1
3
x 3 dx
ex 1
þeklinde elde edilir. Bu formül DEBYE FORMÜLÜ
Debye formülünde ;
olarak bilinir.
xm =
1
3
h
h 9N
=
e
=
kT kT 4
T
baðýntýsý ile tanýmlanan Debye karakteristik sýcaklýðý veya
kýsaca Debye sýcaklýðý kullanýlarak, iç enerji için,
4 T
T
U 9Nk 3
x 3 dx
0 e x 1
yazýlabilir. Spesifik ýsý da,
3 T
3
4
3
T
dU
T x dx T d x dx
CV
9Nk 4 x
3
x
dT
dT
e
1
e
1
0
0
3 T
3
3
4
T x dx T T
CV 9Nk 4 x
3
2
e
1
T
0
e T 1
3 T
3
T 1
T x dx
CV 9Nk 4 x
e
1
0
e T 1
ve bir mol için
3 T
3
T
1
T x dx
CV 9R 4 x
e
1
0
T
e
1
elde edilir. Yüksek sýcaklýklarda yani T >> halinde
Θ
T
ex 1 x
e -1
Θ
T
3
3
x dx
0 e x 1
2
x
dx
1 Θ
3 T
Θ
T
alýnabileceðinden
3
3
T 1
4
CV 9R 4
1 9R 1 3R
3
3 T
elde edilir. Bu,
Dulong - Petit yasasýndan baþka bir þey deðildir.
Alçak sýcaklýklarda yani T >> halinde,
x 3 dx
4
x
T
e 1 15
0
alýnabilir. Buna göre alçak sýcaklýklarda CV öz ýsýsýnýn
deðeri
T 3 4
CV 9R 4
0
15
T
CV 234
3
olur. Bu sýcaklýk bölgesinde CV , T3 ile orantýlý olarak deðiþir. Bu,
deney sonuçlarýna uygun bir sonuçtur. Çizelgede bazý malzeme için
Debye sýcakýlýklarý verilmiþtir.
Cisim
Be
Fe
Pt
Ag
Au
Al
Si
Ge
C(elmas)
( K)
1160
467
229
215
165
390
658
366
2000
Þekil 3.9 da bazý cisimler için öz ýsýnýn sýcaklýkla
deðiþimleri çizilmiþtir. Absis olarak sýcaklýk yerine bunun
karakteristik sýcaklýk birimiyle ölçülen deðeri , yani T/ koymakla
elde edilen eðri bir çok cisim için ayný ve evrensel bir eðri olur.
Buraya kadar katý cisimlerin spesifik ýsýlarý hakkýnda klasik
teori ile Einstein ve Debye teorilerini kýsaca inceledik. Ancak katý
cisim içindeki elektronlarýn öz ýsýya katkýlarý hakkýnda her hangi bir
þey söylemedik. Her üç teoriye göre de cisim içindeki elektronlarýn
serbest olup olmadýklarýna bakarak bir þeyler söylemek mümkündür.
Klasik modelde, yalýtkanlarda elektronlar serbest olmadýklarý
için öz ýsýya katkýda bulunamamalýdýrlar. Bir metalde ise
elektronlarýn serbestlik derecesi ve elektron baþýna 1/2(kT) kadar
enerji kazanabilmesi için 3/2(kT) enerjisini alabilmesi gerekir. Böylece
yüksek sýcaklýkta tek valens elektronlu bir metalin öz ýsýsý
3
CV 3R R 9 cal/mol.de rece
2
olmalýdýr.
Bu deneye uymayan sonucu Einstein ve Debye teorileri ile de aynen
elde ederiz. O halde elektronlar söz konusu olunca bu teorilerin hiç
biri tatmin edici sonuç vermemektedir.
Bu çeliþkinin nedeni elektronlarýn tamamen serbest hareket
edebilen parçacýklar gibi düþünülmesinde, baþka bir deyiþle Pauli
prensibinin etkisinin hesaba katýlmamasýndandýr.
Serbest elektronlarýn kuantum teorisine göre hacim birimi
içindeki toplam enerji
U E.f(E).G(E
).dE
0
integralini hesaplamakla bulunur. Burada
f (E)
Fermi-Dirac
daðýlýmý, G (E) seviye yoðunluðudur. Ýntegralin hesaplanmasýna
geçmeden önce iþi kolaylaþtýracak bazý noktalara dikkat
edilmesinde yarar vardýr.
Normal bir metal için yüksek olarak nitelendirlecek bir
sýcaklýk, bu teoride, Fermi sýcaklýðýnýn üzerinde bir sýcaklýk
olmalýdýr. Oysa Fermi sýcaklýðý 2 - 8 .104 oC mertebesindedir. Bu
nedenle pratik olarak T<< TF halini incelemek yeterli olacaktýr.
Bu sýcaklýklarda elektronlarýn öz ýsýya katkýlarý hakkýnda
kalitatif bir bilgi edinebilmek için metal içinde hangi elektronlarýn
serbest kabul edilebileceðini düþünelim. T sýcaklýðýnda olan metalde
enerjileri Fermi enerjisi EF(T) = kTF nin çok altýda bulunan elektronlar
kinetik enerji alamazlar. Çünkü (EF - kT) den daha küçük enerjilerdeki
bütün seviyeler doludur. Ancak EF civarýnda kT geniþliðinde bir enerji
bölgesindeki elektronlar serbest kabul edilebilirler. Buna göre 1 cm3
içindeki N elektrondan , yaklaþýk
N
kT
T
N
kTF
TF
tanesi öz ýsýya katkýda bulunabilir. Bu oranýn kesin olmadýðýna
yaklaþýk olduðuna dikkat edilmelidir. Ancak bu sayý kaç tane
elektronun kT den enerji alabileceði konusunda bize bilgi verecektir.
Bu sayýyý 3 serbestlik derecesi ve her serbestlik derecesi baþýna
1/2 (kT) ortalama kinetik enerjisi ile çarparak metalin elektronik
enerjisini elde edebiliriz.
3
T 3
T2
Uel k T N
Nk
2
TF 2
TF
Spesifik ýsý ise bu enerjinin türevi olacaktýr.
CV, el 3Nk
T
TF
Yukarýdaki integralin yorucu fakat yine de yaklaþýk çözümü ise
denklemdeki 3 kat sayýsý yerine
2/ 2 katsayýsýný vermektedir.
CV, el
2
T
Nk
2
TF
Bu denklem, öz ýsýnýn alçak sýcakl
ýklarda T ile lineer olarak
deðiþtiðini göstermektedir. Deneyin de ayný sonucu verdiðine dikkat
edilmelidir. Denklemde dikkat edilmesi gereken bir diðer nokta N nin
anlamýdýr. Burada N nin tek valens elektronu olan malzeme için atom
sayýsýna eþit olacaðý, ancak valens elektron sayýsý 1 den fazla ise
atom sayýsýnýn valens elektron sayýsý z ile çarpýlmasý gerektiði
gözden kaçýrýlmamalýdýr ( N = z.Natom). Bu noktayý da hesaba
katarak ve bir molde Avogadro sayýsý kadar atom bulunacaðýný
hatýrlayarak,
CV, el
2 z N Av o k
T T
2
TF
2 z N Av o k 2
R
=
z
2
TF
2
TF
yazýlabilir. Cv,el 'in büyüklük mertebesi 10-4 T kadardýr. Bu nedenle
yüksek sýcaklýklarda elektronik katkýnýn farkýna varýlamaz. Alçak
sýcaklýklarda ise T3 ile deðiþen titreþim katkýsýnýn hýzla azalmasý
nedeniyle elektronik katký ölçülebilen katký haline gelir.
4
CV/T(10 - 3
joule/mol.derece )2
3
2
1
T
2
(derece )2
0
0
2
4
6
8
10
12 14
16
18
Þekil 3.10. Gümüþün öz ýsýsýnýn alçak sýcaklýklardaki deðiþimi
Þekil 3.10, Ag ile yapýlan ölçü sonucun göstermektedir. Bu sonuçlara
göre spesifik ýsý
CV CV ,titre. CV ,elektronik
CV T 3 T
þeklinde yazýlabileceðinden CV / T yi T2 nin fonksiyonu olarak
çizersek
CV / T = T2 +
fonksiyonu bir doðru verecektir. Bu doðrunun eðiminden , ordinat
eksenini kestiði noktadan bulunabilir,
Bu þekilde ölçülen deðerleri metaller için genellikle
beklenen deðerden daha büyük çýkmaktadýr. Aþaðýdaki çizelge
ölçülerden alýnan bazý sonuçlarý bir arada göstermektedir.
VALENS
(10-4 kal/mol.derece2)
Na
1
4.3
Cu
1
1.73
Be
2
0.54
Mg
2
3.25
Al
3
3.48
Pb
4
7.5
-Mn
-
33.0
Ni
0.6
17.4
Pt
0.6
16-16.5
METAL
Katý cisimlerin spesifik ýsýlarý konusunu kapatmadan önce,
özellikle alçak sýcaklýklarda deneysel açýdan büyük önem taþýyan
bir problemden bahsetmek gerekir. Örgü titreþimleri ve elektron
hareketleri dýþýnda kalan iç serbestlik dereceleri varsa bunlarýn da
öz ýsýya katkýda bulunacaklarýný unutmamak gerekir.
Böyle bir duruma örnek, elektron sayýlarý tek olup toplam
spini sýfýrdan farklý olan cisimlerin (metal, tuz, organik cisim gibi)
paramagnetizma göstermeleri olabilir. Magnetik momenti olan bir
atom veya molekül, bir dýþ H magnetik alaný etkisi altýnda .H
enerjisini alarak alan doðrultusuna yönelir. Magnetik alan
bulunmadýðý zaman da momentlerinin bir doðrultuya paralel veya
anti-paralel durumda olmalarý, kendi aralarýndaki etkileþme
nedeniyle farklý enerjilerde olmalarýný gerektirir.
Cismin içinde N paramagnetik atom bulunsun. Bunlardan N1
tanesi bir doðrultuya; N-N1 tanesi bunun tersi yöne yönelmiþ olsun.
Ýki anti-paralel yönelme nedeniyle meydana gelen enerji farký, atom
baþýna E ise ýsýsal denge durumunda iki doðrultuya yönelmiþ
atomlarýn sayýlarý arasýndaki oran
E
N1
e kT
N N1
N1
veya
N
1 e
E
kT
olur. Cismin salt paramagnatizmadan doðan enerjisi
N E
U N 1E
1 e
E
kT
ve ayný nedenden doðan spesifik ýsý katkýsý,
E
E kT
e
dU
kT
C=
N1k 2
E
dT
1 e kT
olur. Sýcaklýða baðlý olarak spesifik ýsýnýn deðiþmesini bu denklem
vermektedir. Deðiþken olarak x = (E / kT) almak suretiyle
C = N k f (x)
f(x)
e
x 1
yazabiliriz. f(x) aranýlan deðiþim hakkýda fikir
veren bir fonksiyon olup, kT / E,
0.417
yakýnýnda ve
C = 0.439 N k deðerinde bir
maksimum gösterir. Þekil 3.11 paramagnetik
spesifik ýsýnýn kT / E ye baðlý olarak nasýl
deðiþtiðini göstermektedir.
x 1 2
x (1 e )
2
0.5
f(x)
0.4
f x
0.3
ex
1
x2 1 e
1
2
0.2
0.1
x
kT
E
0.0
0
1
2
3
4
5
6
7
Þekil 3.11
Öz ýsýnýn bu þekilde maksimumular göstermesine
SCHOTTKY ANOMALÝLERÝ denir. E malzemeye baðlý bir sabittir.
C 'nin maksimumu genellikle alçak sýcaklýklar bölgesine düþer. Bu
sýcaklýklarda Cörgü çok küçüktür, dolayýsýyla
Cparamagnet izma
Cörgü
10 5
mertebesine kadar çýkabilir. Bu da gösteriyor ki alçak sýcaklýklarda
yapýlan öz ýsý ölçülerinde en küçük bir paramagnetik kir ölçüleri
etkin biçimde deðiþtirebilir.
Ýç serbestlik derecelerinden gelen baþka katkýlar da olabilir.
Moleküler (Van der Waals) kristallerde moleküller içi dönmeler,
kristallografik faz deðiþtirmeleri, yarýiletken cisimlerde yabancý
kirlerin ýsýsal iyonizasyonu gibi fiziksel olaylar öz ýsýya katkýda
bulunabilirler.
13.HAFTA
Serbest elektron modellerinin iletken cisimlerin elektrik iletkenlikleri
gibi bazý fiziksel özellikleri hakkýnda oldukça iþe yarar sonuçlar verebildiðini
bundan önceki bölümde görmüþtük. Buna karþýlýk yine ayný bölümde hangi
cisimlerin iletken veya yalýtkan veya yarýiletken olacaðý hakkýnda bu
modellerin ip ucu vermediklerini de belirmiþtik. Bunun nedeni serbest
elektron yaklaþýmýnda katý cismin iyonlarýnýn hiç hesaba katýlmamasýdýr.
Katý cisimlerin band modeli elektronlarla beraber iyonlarý da hesaba
katar. Bu nedenle daha ileri bir yaklaþým metodudur. Band modeli prensip
olarak iki atomlu moleküller için Hund ve Mullikan tarafýndan ortaya konan
metodun N atomlu bir dev moleküle uygulanmasýna dayanýr. Buna göre bir
elektronun N adet pozitif iyonla (N.z - 1) adet elektrondan oluþan sistem
içindeki davranýþý incelenir. Pozitif iyonlarýn titreþim hareketleri
baþlangýçta ihmal edilir. (Nz - 1) elektronun etkisi de iyonlarýn, göz önüne
alýnan tek elektron üzerine olan etkilerini perdeleyici bir etki gibi düþünülür.
Bu yaklaþýmlar band teorisinin karakteristiklerini, ama ayný zamanda zayýf
noktalarýný belirtir.
Biraz baþka türlü ifade ile band teorisi elektronun E enerji öz
(eigen) deðerlerini
2 2
eU E 0
2m
Scrödinger denkleminden arar. Burada U
Ur Ur n1a1 n2 a 2 n3 a 3
þeklinde tanýmlanan periyodik
bir potansiyeldir. Yukarýdaki
denklemlerde e elektronun yükü, a1 , a 2 , a 3
kristal örgüsünün
translasyon vektörleri, n1 , n2 , n3 tam sayýlar; ise uzay koordinat
vektörü olup,
r i x j y kz
þeklindedir.
Bu þekilde ortaya konan problemin U( r ) potansiyelinin þekline
göre tam (exact) çözümü olabilir veya ancak yaklaþýk bir çözüm
mümkün olabilir.
F. BLOCH, 1928
yukarýda tanýmlanan Schrödinger
denkleminin tanýmlanan periyodik bir potansiyel için çözümlerinin
k r Uk r e
ik r
þeklinde olduðunu göstermiþtir. Burada Uk ( r ) , k dalga vektörüne
baðlý periyodik bir potansiyeldir. eikr
ise, ilerleyen dalga
fonksiyonudur. Buna göre örgünün periyodu ile modüle edilen bir
düzlem dalgayý temsil etmektedir. Yukarýda tanýmlanan dalga
fonksiyonlarýna Bloch Fonksiyonlarý adý verilir.
Aþaðýda daha önceki bilgilerimizden de yararlanarak band
modelini kalitatif olarak inceleyeceðiz. Bunu takiben oldukça yapay
fakat exact olarak çözülmesi mümkün olan bir örnekten kantitatif
durumu gözden geçireceðiz.
enerji
enerji
enerji
enerji
enerji
bo?
bo?
dolu
valens(bo?)
iç(dolu)
iç(dolu)
r
a
r0
b
r
b'
c
r0
c'
Þekil 4.1. Band yapýsýnýn oluþumu.
a) Bir atomun kesikli spektrumu
b) Ayný cinsten kesikli spektrumunun atomlar arasý r uzaklýðýna
baðlý olarak deðiþmesi
c) Yine ayný atomlardan yapýlmýþ bir kristalin band yapýsýnýn r
uzaklýðýna baðlý olarak deðiþmesi
b’, c’) Denge durumunda enerji seviyeleri ve bandlarý.
Her atomun kesikli bir spektrumu vardýr. Þekil 4.1.(a) bir atomun bir kaç
enerji seviyesini göstermektedir. Atomun iç elektronlarýna ait seviyeler
genel olarak doludur. En küçük enerji ile baðlý olan valens elektronlarýna
ait seviye tamamen dolu veya kýsmen dolu olabilir.
Atomlardan ikisinin birbirlerine yaklaþmalarý ile bu enerji
seviyelerinin nasýl deðiþtiklerini daha önce görmüþtük. Bu deðiþme veya
bölünme Þekil 4.1.(b) de her seviye için gösterilmiþ, ayrýca potansiyel
enerjinin minimum olduðu ro denge uzaklýðý için, iki atomlu sistemin
enerji seviyeleri (b') de tekrar çizilmiþtir. Bunun gibi 5 veya 10 atomluk
sistemin de atomlar arasý uzaklýða baðlý olarak enerji seviyelerini
çizebiliriz. Bunu yaparken dikkat edilecek nokta, her enerji seviyesinin 5
veya 10 seviyeye ayrýlmasý gerektiðidir.
Þimdi gerçek bir kristal, örneðin N = 1020 atomdan oluþan bir
sistem için ayný iþlemi tekrarlamak istersek her seviyenin N sayýda
seviyeye bölündüðünü düþünmek gerekecektir. Enerji seviyelerinin
deðerleri bir kaç eV olduðuna göre kristal için çizilecek enerji þemasýnda
10-20 eV aralýkla N sayýda seviye çizilmesi gerekecektir. Bu durum Þekil
4.1(c') de her atomun seviyesinin ayrýldýðý en yüksek ve en alçak
deðerlerinin arasýný taramak suretiyle gösterilmiþtir. Taranmýþ
kýsýmlarda enerji seviyeleri o kadar sýktýr ki bu bölgeleri sürekli bir
enerji þeridi veya band olarak kabul edebiliriz.
Bandlar arasýnda kalan boþluklar tek atomda olduðu gibi yasak bölge
özelliklerini korur.
Kristali oluþturan atomlarýn elektron yapýlarýna ve kristal örgüsüne
göre band yapýsý deðiþir. Genel olarak atomlar arasýndaki etkileþme
(Coulomb etkileþmesi) ne kadar güçlü ise bandlar o kadar geniþtir. Bu nedenle
bir çok hallerde iki veya daha fazla enerji bandý kýsmen üst üste binebilir.
Enerji bandlarý dolu, kýsmen dolu veya boþ olabilir. Pauli prensibi mevcut
elektron sayýsý ve enerji seviyelerine göre durumu düzenler.
Yasak bölgelerin geniþlikleri, enerji bandlarýnýn üst üste gelip
gelmedikleri, dolu olup olmamalarý katý cisimlerin fiziksel davranýþlarýný
belirleyen baþlýca özelliklerdir.
Katý cisimlerin yukarýda çizilen band modeli, oldukça kolay
anlaþýlabilir bir yoldan bir çok olayýn açýklanmasýna yardým eden yaklaþým
yöntemidir. Bu modelden yararlanarak kristallerin elektriksel özelliklerini
kalitatif bir þekilde incelemek istiyoruz.
Na ' un dolu bir 2p zarfý dýþýnda bir tane 3s valens elektronu
bulunduðunu biliyoruz. 3s durumunda Pauli prensibine göre spinleri farklý iki
elektron bulunabilirdi. O halde Na 'un 3s bandý yarý yarýya dolu demektir,
Þekil 4.2.
E
n
e
r
j
i
3p
3s
o
r (A.B)
ro
0
2
4
6
8
10
12
Þekil 4.2. Sodyumun enerji bandlarý
Þekil 4.2, Na 'un 3s ve 3p
seviyelerinin atomlar arasý
uzaklýða baðlý olarak
deðiþmelerini göstermektedir.
Yalnýz 3s (valens) bandýnýn
yarý yarýya boþ olmasý sodyum
kristalinin iletken olmasýna
yeterli olur. Çünkü bu banddaki
elektronlara, dýþardan bir
elektrik alaný aracýlýðý ile
küçük bir enerji dahi vermek
istersek elektronlar daha yüksek
seviye-lerde boþ seviyeler
bularak bu enerjiyi alabilecek
durumdadýrlar.
Ayrýca boþ olan 3p seviyesi Þekilde görüldüðü gibi 3s bandý ile kýsmen
üstüste gelmekte, ortak geniþlemiþ banddaki boþ enerji seviyesi sayýsý
artmýþ olmaktadýr. Bütün metallerde bu durum mevcuttur. Þekil 4.3, bakýrýn
enerji bandlarýnýn durumunu göstermektedir.
E
n
e
r
j
i
4p
4s
3d
o
r(A B)
ro
0
2
4
6
Þekil 4.3. Bakýrýn band
yapýsý.
8
Bu metalde tamamen dolu olan
3d seviyesi (10 elektron), tek
elektronlu yarýsý boþ 4s
seviyesi ve tamamen boþ 4p
seviyesi üst üste binmiþ
durumdadýr.
Ayný
özellik
gümüþ (4d10 5s) ve altýn (5d10
6s) için de geçerlidir.
Ýki deðerli metallerde
valens
elektronlarý
bandý
doludur. Bunlarýn iletkenlikleri,
yalnýz daha yüksek boþ enerji
bandlarý ile valens bandýnýn
üst üste gelmesi sayesinde
mümkün olmaktadýr.
Yalýtkanlara gelince, bu cisimlerde elektron bulunan en üst
band olan valens bandý tamamen doludur. Ancak bu bandý izleyen
ilk boþ band ile valens bandý arasýnda geniþ bir yasak bölge
bulunmaktadýr. Bir örnek olmak üzere KCl 'ün enerji bandlarý,
iyonlar arasý uzaklýðýn fonksiyonu olarak Þekil 4.4 de
gösterilmiþtir.
Enerji
4s (K)
10 eV
3p (Cl)
3s (Cl)
ro
r
Bu iyonik kristalde potasyumun 4s
elektronunun ayrýlarak klorun 5
elektronlu 3p zarfýný 3p6 ya
tamamladýðýný
biliyoruz.
Bu
nedenle 4s bandý tamamen boþ,
3p
bandý
doludur.
Aradaki
yaklaþýk 10 eV 'luk yasak bölge
normal
þartlar
altýnda
3p
elektronu tarafýndan aþýlamaz.
Bu
nedenle
KCl
yalýtkan
karakterde bir kristaldir.
Þekil 4.4. Potasyum klörürün kalitatif
band þemasý.
Dolu ve boþ elektron enerji bandlarý geniþ bir yasak bölge
oluþmasý bazý yüksek örgü simetrisi ve güçlü bað gösteren
kristallerde bandlarýn yarýlmasý yoluyla da ortaya çýkabilir. Elmas
bu duruma örnek oluþturur.
2p
Enerji
2s
r
o,Ge
o
= 2.43 A
o
r o,Si = 2.35 A
0
2
4
Þekil 4.5. Elmasýn band yapýsý
o
6 r (A B)
Þekil 4.5 elmastaki band durumunu göstermektedir. Karbonun
elektron yapýsý bilindiði gibi 2s2 2p2 dir. s seviyesi 2 elektronla dolu, fakat p
seviyesi 6 elektron alabilecekken 2 elektrona sahip olduðundan 2 / 3
oranýnda boþtur. Buradan hemen bir sonuç çýkartmak istersek elmasýn iyi
ve metalik bir iletkenlik göstermesi gerektiðini söyleyebiliriz. Fakat elmasýn
kristal yapýsýndaki yüksek simetri (ymk) ve kuvvetli kovalent baðlar her iki
seviyeyi birer band yerine bir birinden ayrýlmýþ bir kaç banda ayýrmýþtýr.
Biz yalnýz p bandýna bakacak olursak bunun alçak
enerjili olan kýsmýnda iki elektron bulunur, yani burasý doludur. Diðer
p bandý tamamen boþ kalmýþtýr. ro mesafesinde iki kýsmi band
arasýnda yaklaþýk olarak 6-7 eV 'luk bir yasak bölge oluþmuþtur. Bu
durum, karbonu elmas þeklinde kristalleþtiði zaman bir yalýtkan
haline getirir. Pratik olarak hiç bir sýcaklýkta elmasýn elektronlarý bu
boþ p bandýna yükselemezler. Bu da çok yüksek sýcaklýklarda bile
elmasýn yalýtkanlýk özelliðinin kaybolmamasýna neden olur.
Elmasýn bu yalýtkanlýk özelliði, örgü sabitinin ro = 1.54 Ao
birimi gibi çok küçük bir deðerde olmasý, yani çok sýký baðlý bir
yapýda olmasýnýn doðal bir sonucudur. ro 'ýn daha büyük deðer
almasý mümkün olsa idi hiç olmassa nispeten yüksek sýcaklýklarda
biraz iletkenlik gözlenmesi mümkün olurdu. Gerçekten elektron
yapýsý elmasa benzeyen
Si (3s2 3p2) ve Ge (4s2 4p2) 'un kristal
yapýlarý elmasýnkinin aynýdýr. Fakat Si 'un örgü sabiti 2.35 Ao Ge
'unki 2.43 Ao dür. Bu durum, sýcaklýk çok düþük deðilse, Si ve Ge 'a
bir miktar elektronik iletkenlik kazandýrýr.
Elektron iletkenliði bakýmýndan üçüncü grup malzemeye
yarýiletkenler
denir. Silisyum ve Germanyum bu grubun tipik
örnekleridir. Ayrýca bir çok bileþik de yarýiletken davranýþ
göstermektedir.
Yarýiletken bir kristalin enerji bandlarý yapýsý için yukarýda
açýklanan elmasýn band yapýsýndan yararlanabiliriz. Si ve Ge 'un
örgü sabitlerine karþýlýk gelen ro deðerleri bu þekil üzerinde
gösterilmiþtir. Yasak bölgenin geniþliði elmas için 6-7 eV iken
silisyumda bu bölge 1.1 eV ; Ge 'da 0.72 eV dur. Böylece bir yalýtkan
ile bir yarý iletken arasýndaki tek farkýn dolu enerji bandý ile boþ
enerji bandý arasýndaki yasak bölgenin geniþliði olduðunu anlamýþ
oluyoruz.
Mutlak sýfýr sýcaklýðýnda saf ve hatasýz bir yarýiletken
kristal yalýtkan cismin özelliklerini taþýr. Sýcaklýk yükselince
elektronlarýn kT mertebesinden aldýklarý ýsý enerjisi bunlarýn dar
olan yasak bölgeyi atlayarak boþ enerji bandýna geçmelerine yeterli
olur. Bir dýþ elektrik alaný etkisi ile bu enerjiyi kazanabileceklerinden
cisim elektrik iletkenlik gösterir. Ayrýca, evvelce dolu olan banddan
çýkan elektronlarýn geride býraktýklarý deþikler de (elektron
boþluðu, hole) iletkenliðe yardým ederler.
İletkenliði ne olursa olsun bir kristalin T = 0 oK de elektron içeren
en yüksek enerjili bandýna valens bandý; bunu izleyen ilk boþ banda da
iletkenlik bandý denir.
Katý cisimlerin iletkenlikleri hakkýnda buraya kadar söylenenleri
Þekil 4.6 özetlemektedir.
EF
E
F
EF
EF
YARIÝ
LETKEN
Ý
LETKEN
YALITKAN
Þekil 4.6. Kristallerin elektrik iletkenliklerine göre enerji bandlarý yapýsý. EF
Fermi enerji düzeyini göstermektedir.
Enerji bandlarý modelinin kalitatif irdelenmesini bitirirken
Fermi enerji seviyesinin bir iletken veya yalýtkan için ne ifade ettiðinin
üzerinde durulmasý gerekir. Þekil 4. 6 da Fermi enerjisi her üç grup
malzeme için iþaretlenmiþtir. Daha önce gördüðümüz gibi metallerde
EF mutlak sýfýr sýcaklýðýnda elektronlarýn iþgal ettikleri en yüksek
enerji seviyesidir. Sýcaklýk yükselince EF yerinde kalýr. Bir yarýiletken
için Fermi seviyesinin, metallerde olduðu gibi, yani dolu bandýn üst
kenarý olarak tanýmlanmasý yanlýþtýr. Çünkü sýcaklýðýn mutlak
sýfýr sýcaklýðýnýn üzerinde olduðu durumlarda saf bir yarý iletkenin
elektronlarý, ancak yasak bölgeyi atladýktan sonra üstteki boþ banda
çýkabilirler. Sürekli bir eðri olan f (E) fermi fonksiyonunun kuyruk
kýsmýnýn iletkenlik bandýna geçen elektronlarýn sayýsýný doðru
gösterebilmesi ancak bu eðriyi iletkenlik bandýna doðru paralel
kaydýrmakla mümkün olur. Valens bandýnda oluþan deþikler ile
iletkenlik bandýna geçen elektronlarýn sayýsý saf bir yarýiletkende
aynýdýr. Bu da Fermi seviyesinin takriben yasak bölgenin ortasýnda
olmasýný gerektirir. Bu durum Þekil 4.7 de açýklanmaktadýr.
Yalýtkanlar için de ayný durum mevcuttur. Fermi seviyesinin yeri ve
valens bandýnda açýlan deþiklerin sayýsý Fermi-Dirac fonksiyonu
yardýmýyla kantitatif olarak tayin edilebilir. Burada yalnýzca sonucu
ermekle yetineceðiz.
Ei
E
Ei
EF
Ev
v
mp
1
3
EF Ei Ev kT Ln
2
4
mn
(b)
(a)
Yarýiletkenlerde Fermi
Seviyesi
(a) Yanlýþ
(b) Doðru
Þekil 4.7.
Burada Ei iletkenlik bandýnýn alt sýnýrý, Ev valens
bandýnýn üst sýnýrý , mp valens bandýnýn üst sýnýrý civarýnda
boþluklarýn; mn iletkenlik bandýnýn alt kenarýnda elektronlarýn
effektif (etkin) kütleleri dir. Etkin kütle kavramýndan ilerde tekrar
bahsedilecek olmakla beraber þimdilik sadece mp nin mn den çok az
büyük olduðunu söylemekle yetineceðiz.
Dolayýsýyla saf bir yarýiletkende veya yalýtkanda Fermi
seviyesi yasak bölgenin ortasýnýn pek az üstünde ve yukarýdaki
ifadeden de anlaþýlacaðý gibi hafifçe sýcaklýða baðlý olmaktadýr.
14.HAFTA
Bu bölümün giriþ kýsmýnda çizilen yoldan, yani Bloch
fonksiyonlarý yardýmýyla elektronlarýn gerçek bir kristal içindeki
davranýþlarýný tam (exact) olarak hesaplamak, kullanýlan band
modeli bir yaklaþým modeli olmasýna raðmen, çok büyük zorluklar
yaratýr. Bu nedenle 3 boyutlu kristal yerine tek boyutlu bir kristal ele
almak ve ulaþýlacak çözümler yardýmý ile gerçek kristalin
davranýþýný anlamaya çalýþmak yolu tercih edilmiþtir. Bu durumda
bile atomlar arasýndaki problemi doðru olarak verebilen bir Bloch
fonksiyonu kullanarak problemi tam olarak çözmek oldukça çetin
matematik zorluklara sahiptir.
R. de L. KRONIG ve W.G. PENNEY 1931 de atomlar arasýnda
çok basit bir potansiyel seçmek suretiyle tek boyutlu problemi exact
olarak çözmeyi baþarmýþlardýr. Þekil 4.8 de böyle tek sýralý bir atom
dizisinde atomlar arasý potansiyel ile Kronig ve Penney tarafýndan
kabul edilen yaklaþýk potansiyel eðrileri gösterilmiþtir.
V
a+b
a+b
Vo
a
b
-Uo
I
x
-b
+a
0
II
III
Þekil 4.8. Bir boyutlu kristalde potansiyel eðrisi.
I.
Gerçek kristal
II.
Kronig-Penney yaklaþým potansiyeli
III.
Koordinat transformasyonundan sonra potansiyel
enerji eðrisi
Bloch fonksiyonlarýnýn periyodiklik karakterleri korunmuþ yalnýz
þekli basit bir dikdörtgen olarak seçilmiþtir. Periyod (a+b) ye eþittir. Atomlarýn
bulunduklarý yerde x = b geniþliðinde sabit bir - Uo potansiyeli, atomlar
arasýnda sýfýra eþit bir potansiyel vardýr. Potansiyelin sýfýr olduðu mesafe
a dýr.
Böylece iki bölge için iki potansiyel seçilmiþtir. Her bir bölge
için birer Schrödinger denklemi yazmak ve bölge sýnýrlarýnda
süreklilik þartlarý koymak suretiyle elektronlarýn mevcut potansiyel
alanýndaki davranýþlarý incelenir.
Hesaplarý biraz kolaylaþtýrmak için önce uygun bir koordinat
sistemi seçilir. Þekil 4.8. III de görüldüðü gibi x ekseninin sýfýr
noktasý iki potansiyelin birleþtiði noktada olsun. Vo da þekilde
gösterildiði gibi bir elektronun potansiyel enerjisini göstersin, yani
Vo = ( e) (Uo) olsun. Bu bir boyutlu problem için Schrödinger
denklemi;
2 d2
E V 0
2
2m dx
þeklinde yazýlabilir. Þekildeki iki bölge için
2 d2
E V0 0
2
2m dx
2 d2
E 0
2
2m dx
-b x 0
0 x a
yahut,
2mE
2
2
=
2
2m(V0 -E)
2
kýsaltmalarýný kullanarak yukarýdaki iki denklemi,
d2
2
0
2
dx
d2
2
0
2
dx
þeklinde yazabiliriz. Bloch Teorimine göre bu iki denklemin çözümü
örgünün periyodikliði ile modüle edilmiþ bir ilerleyen dalga
fonksiyonu olmalý, yani
k (x) Uk (x) e
ikx
þeklinde olmalýdýr. Bu dalga fonksiyonun, yukarýdaki denklemlerde
yerine koymak üzere, türevlerini alalým.
dk x
dx
d 2 k x
dx 2
dUk x
e
ik x
dx
d 2 Uk x
dx 2
ik e
e
ik x
ik x
Uk x
dUk x
dx
ik e
ik x
k e
2
ik x
Uk x i k e
ik x
dUk x
dx
d 2 d 2 U i k x
dU i k x
2
ik x
e
2i k
e
k Ue
2
2
dx
dx
dx
denklemi yardýmýyla yukarýdaki diferensiyel denklemleri,
-b x 0
- 0 x a
d2U
dU
2
2
2
ik
k
U 0
2
dx
dx
d2U
dU
2
2
2
ik
k
U 0
2
dx
dx
þekline girerler.Yukarýdaki ifadelerde notasyonu kýsaltmak için Uk(x)
yerine U yazýlmýþtýr.
Birinci denklemin - b x 0 arasýnda çözümü,
U1 Ae
ik x
ik x
Be
Ýkinci denklemin 0 x a arasýnda çözümü ise,
U2 C e i k x D e i k x
þeklindedir. Bunun doðruluðu U1 ve U2 nin türevleri alýnarak
yukarýdaki diferensiyel denklemlere yerleþtirilerek gösterilebilir. U1
ve U2 fonksiyonlarýnýn problemin tam bir çözümü olabilmesi için
kenar koþullarýna göre A , B ile C ve D yi tayin etmek gerekir.
Bu þartlar, U fonksiyonu ile bunun türevinin x = 0 ve x = a
da sürekli olmalarý ve periyodikliktir. Bunlarý þöylece özetleyebiliriz.
U1 0 U2 0
dU1 0 U2 0
dx
dx
U1 b U2 a
dU1 b dU2 a
dx
dx
I
II
III
IV
I koþulundan
A+B=C+D
II koþulundan
( ik)A ( ik)B i( k)C i( k)D
III koþulundan
A e-(-ik)b B e(+ik)b C ei(-k)a D e-i(+k)a
IV koþulundan
( - ik) A e-(-ik)b - ( + ik) B e (+ik)b i( - k) C e i(-k)a i( + k) D e -i( +k)a
elde edilir. A, B, C ve D bilinmeyenleri açýsýndan lineer ve homojen
olan bu denklemlerden bu dört sabiti saptamak mümkündür. Ancak,
biz A, B, C ve D nin hepsinin birden sýfýr olmadýðý bir çözümün olup
olmayacaðý ile daha çok ilgilenmek istiyoruz. Böyle bir çözümün
mümkün olabilmesi için yukarýdaki dört denklemin A, B, C, D
katsayýlarýndan oluþturulan determinantýn sýfýra
eþit olmasý
gerekir.
1
1
1
1
( ik )
e
( ik )b
( ik )e ( ik )b
( ik )
e
( ik )
( ik )e( ik )
i( k )
e
i ( k )a
i( k )e i ( k )a
i( k )
e
i ( k )a
i( k )e i ( k )a
0
determinantýn 24 terimini açmak ve eksponansiyel fonksiyonlarla
trigonometrik ve hiperbolik fonksiyonlar arasýndaki baðýntýlardan
faydalanmak suretiyle aþaðýdaki ifade elde edilir.
2 2
sinh b sin a cosh b cos a cosk a b
2
Bu ifadenin sol tarafý E enerjisinin sað tarafý ise k dalga
vektörünün fonksiyonu olarak yorumlanmalýdýr.
Denklemin sað tarafý 1 arasýnda kalacaðý için sol taraf da yani
enerji de bu sýnýrlar arasýnda kalacaktýr. Bu da enerjini bazý
deðerleri alamayacaðý, baþka sözlerle bazý enerji deðerlerinin
yasaklý olacaðý anlamýna gelir.
Þimdi amacýmýz bu söylenenleri daha açýk olarak görebileceðimiz
bir eþdeðer ifade bulmaktýr. Kronig ve Penney Þekil 4.8 (III) de görülen Vo
potansiyel alaný yani Vo.b sabit kalmak üzere
b0
V0
basitleþtirici þartýný kullanmýþlardýr. Bunu temin etmek için
ma
V0 b Sabit c ve
2
kabul edelim. Bu koþullar ve
alýnabileceðinden,
.b
2mV0
V0
c 2
ab m
V0
b
için
V0 - E V0
2bc
a
olur, diðer taraftan V0 E için
2 2
2mVo
2c
a.b
2
yazýlabilir. Bu baðýntýlardan yararlanarak yukarýdaki denklem,
c sinh b
sin a cosh b
a b
cos a cos k(a b)
þekline sokulabilir. Bundan sonra b 0 sýnýrýna geçilir ve
Lim
b0
sinh b
1
b
Lim cosh b = 1
b0
olduðu göz önüne alýnarak daha basit olan,
c
sin a + cos a = cos ka
a
baðýntýsý elde edilir. a enerjiye E 1/ 2 þeklinde baðlý bir
büyüklüktür. Denklemin sol tarafýný ( a) nýn fonksiyonu olarak
çizersek Þekil 4.9 elde edilir. Bu þekilde keyfi olarak c = 10
alýnmýþtýr.
Þekilde yukarýdaki ifadenin sað tarafýndaki cos ka = 1
kýsýtlayýcý koþulu nedeniyle elektronun periyodik alan içinde
alabileceði a deðerleri ile almasý mümkün olmayan yasak
deðerler de gösterilmiþtir. Bu bölgelerde elektron enerjisi,
10
Sin α a Cos α a
α.a
10
5
+1
a
-1
Þekil 4.9. (c/a) Sin a + Cos a fonksiyonunun c = 10 için a ' ya baðlý
olarak deðiþmesi. Taranmýþ bölgeler elektronun alabileceði enerjilere
karþýlýk gelen deðerlerini sýnýrlar. Aradaki enerjiler yasaktýr.
=
2 mE
h
ifadesiyle verilmiþtir.
Böylece periyodik bir alan içinde enerji
bandlarýnýn ortaya nasýl çýktýðýný kantitatif bir örnek üzerinde
görmüþ olduk.
Þekil 4.9 dan ayrýca þu bilgileri de edinmek mümkündür.
1) c = (ma/) Vo b büyüdükçe 49 eðrisi dikleþir. Baþka sözlerle bandlar
daralýr.
c olmasý halinde bandlar çizgiler haline girer, yani izole edilmiþ bir atomun
spektrumu elde edilir. Bu durumda a = n ( n = 1, 2, .... 0 ) olur. Buna
göre enerji,
2 2
En n
2m a 2
2
ile hesaplanýr. yani elektronun enerjileri a geniþliðinde lineer bir kutu içindeki
deðerlere eþit olur. Baþka bir deðiþle elektron a içinde hapsedilmiþtir.
2) c = 0 ise = k olacaðý için,
2
E
k
2m
2
olur. Bu da serbest elektronun enerjisi ifadesidir.
3) Eðer c nin deðeri arada, yani sonlu bir deðerde ise, yukarýda görüldüðü gibi
bandlar oluþur. Ýlk band cos ka = + 1 ile - 1 arasýnda yani k = - /a ile k =
/a arasýnda deðiþmiþtir. Ýkinci bandýn yarýsý k = /a ile k = 2 /a
arasýndadýr. Buna göre genel olarak
kn
a
( n = 1, 2 .....)
band kenarlarýný vermektedir. Bu durumu daha iyi anlamak için E yi k
nýn fonksiyonu olarak çizmek gerekir.. Þekil 4.10, genel denklem ve
Þekil 4.9 kullanýlarak çizilmiþtir.
Enerji
15
22
16
2 ma 2
*
10
*
5
*
*
0
Þekil 4.10 . Enerjinin ka ile deðiþimi
ka
Noktalý çizgi ile gösterilen parabol serbest elektronlarýn enerjilerini
gösteren
2
E
k2
2m
denklemini temsil eden paraboldür. Taranmýþ kýsýmlar ise bandlarý
göstermektedir.
Bandlar içinde E nin k ya baðlýlýðýný biraz daha yakýndan
incelemek yararlý olacaktýr. Enerjiyi k ya göre tanýmlayan denklemi
f (E) ile tanýmlarsak, bunun k ya göre türevi,
df(E)
a sin ka
dk
dýr. Band kenarlarýnda cos ka = 1 yani ka = n dir. O halde band
kenarlarýnda sin ka = 0 dýr. Baþka sözlerle ,
df(E) df(E)da dE
0
dk
da dE dk
yazýlabilir. Buradaki üç faktörden birinci ve ikinci terimler hiç bir
zaman sýfýr olamayacaklarý için ancak dE/dk terimi sýfýr olabilir.
Bu da Þekil 4.10 de E(k) eðri parçalarýnýn k eksenine paralel
baþlayýp paralel bitmelerinin nedenidir. Þeklin sað tarafýnda c = 10
alýnmakla elde edilen enerji bandlarý taranmýþ alanlarla
gösterilmiþtir.
Cosinüs foksiyonu bir çift fonksiyon, yani cos (ka) = Cos (-ka)
olduðu için Þekil 4.10 E ekseni etrafýnda simetrik olarak
düþünülmelidir. Buna göre ilk band k = - /a ile k = + /a arasýnda
meydana gelmiþtir. Ýkinci bandýn yarýsý k = + /a ile k = + 2/a
arasýnda diðer yarýsý k = - 2/a
ile k = - /a arasýndadýr.
Elektronlarýn alabileceði enerji deðerlerini sýnýrlayan k nýn bu
deðerlerine
veya Brillouin ka
Zonlarý
DiðerBrillouin
taraftanBölgeleri
enerji denkleminde
yerineadý
( verilir.
ka + 2n)
koymakla bu ifadenin deðeri deðiþmez. Yani ka daha doðrusu k
dalga sayýsý tek deðerli bir deðiþken deðildir. Bu nedenle k’nýn (- /
a) ile (+ / a) aralýðýndaki deðerleri ile yetinmek mümkündür. Böyle
yapýlýrsa k ya Redüklenmiþ Dalga Sayýsý adý verilir.
Elektron enerjisi redüklenmiþ dalga sayýsýnýn fonksiyonu
olarak çizildiðinde Þekil 4.11 elde edilir.
E
15
n=3
E
10
n=2
5
n=1
n=0
- a
k
a
Þekil 4.11. Redüklenmiþ dalga sayýsýna baðlý olarak
Enerjinin deðiþimi








