MADDE VE ÖZELLİKLERİ
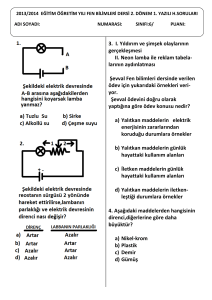
Madde kütlesi hacmi ve eylemsizliği olan her şeydir. Cisim
içerisinde değişmeyen madde miktarına kütle denir. "m"
sembolüyle gösterilir. Eşit kollu terazi denilen araçla ölçülür.Ağırlık
ile kütle farklı şeylerdir, bu iki şey karıştırılmamalıdır. Ağırlık çekim
kuvvetidir ve dinamometre ile ölçülür. Eylemsizlik cisimlerin
hareket durumlarını koruma eğilimleridir. Burada "hareket
durumu" ile anlatılmak istenen, cismin diğer bir cisme göre sabit
hızla hareket etmesi veya durağan halde bulunmasıdır. Maddeler
için ortak özelliktir
MADDENİN HALLERİ
MADDENİN KATI HALİ
Tanecikleri birbirine temas eder. Tanecikleri arasındaki boşluk yok
denecek kadar azdır. Bu sebeple maddenin en düzenli halidir. ·
Tanecikleri yer değiştiremez. Sadece bulundukları yerde sürekli
titreşim halinde bulunurlar. Öteleme hareketi yapamazlar. ·
Belirli bir şekli vardır. Bu şekli bulundukları kabın ya da ortamın
şekline göre değiştirmez. Sıcaklık ile genleşebilir. Sıcaklık etkisi ile
tanecikler birbirinden uzaklaşır ve hacim artar. Ama
sıkıştırılamazlar çünkü tanecikler arasındaki boşluk yok denecek
kadar azdır.
MADDENİN SIVI HALİ
Kendilerine ait bir şekilleri yoktur. Bulundukları kabın şeklini
alırlar.(Bunun sebebi akışkanlıklarıdır). Akışkan halde bulunurlar.
Fakat her sıvının akışkanlığı aynı değildir. Yoğunluklarına göre
değişkenlik gösterirler. ·
Tanecikleri birbiri ile temas halindedir. ·
Tanecikleri arasındaki boşluk katılardan daha fazla olmasına
rağmen çok azdır. · Tanecikleri birbiri üzerinden kayarak hareket
edebilirler. Yani tanecikleri yer değiştirebilir. Bu sayede akışkan
olurlar. Hem titreşim hem de öteleme hareketi yaparlar. ·
Sıcaklık etkisi ile genleşebilir. Sıkıştırılamaz. Maddenin sıvı hali katı
haline göre düzensizdir. Katı haldeki bir maddenin sıvı hale geçmesi
için dışarıdan ısı enerji alması gerekir. Bu değişim fiziksel bir
değişimdir.
MADDENİN GAZ HALİ
Maddenin taneciklerinin serbest hareket ettiği fiziksel hal gaz halidir.
Tanecikler birbirinden bağımsız sürekli hareket halindedir. Belirli bir
şekilleri ve hacimleri yoktur. Tanecikleri arasındaki boşluk çok
fazladır. En fazla boşluk bulunan haldir. Boşluğun çok olmasından
dolayı rahatlıkla sıkıştırılabilir. Sıkışma etkisi ile sıvı hale geçebilir.
Sıcaklık etkisi ile katı ve sıvılara göre daha iyi genleşebilirler. Akışkan
haldedir. Bulundukları kabın her yerine eşit oranda dağılırlar yani
bulundukları kabı doldurarak kabın şeklini alırlar. Hem titreşim hem
de öteleme hareketi yaparlar.
MADDENİN PLAZMA HALİ
Gaz halindeki maddeye enerji vermeye devam edersek, atomların
dış kabuklarındaki elektronlar atomdan ayrılmaya başlar. Bu
durumda madde, artı ve eksi yüklü parçacıklardan oluşan yüksek
enerjili bir gaz haline gelir.
KATILAR
AMORF KATILAR
Atom ve molekülleri gelişigüzel sıralanmış, belirli bir kalıba sahip
değil ise bu katılara amorf katılar adı verilir. Amorf katılar kesildiği
zaman kristal yapıdaki gibi yüzeylerin ve keskin kenarların
oluşmadığı görülür. Cam, plastik, lastik gibi katılar amorf katılara
örnek olarak verilebilir.
KRİSTAL KATILAR
Tanecikleri düzenli ve belirli bir geometrik yapı oluşturacak şekilde
istiflenen katılara kristal katılar denir
Kristal katılar tanecik türleri ve tanecikler arası etkileşme
kuvvetlerine göre
Metalik
İyonik
Moleküler
Kovalent
Kristaller olarak sınıflandırılır
METALİK KRİSTALLER
Kolay tel ve levha haline gelebilirler.
Isı ve elektriği iyi iletirler.
Parlaktırlar.
İYONİK KRİSTALLER
Bu tür katılar elektriği ancak suda çözündükleri zaman veya erimiş
haldeyken iletirler. Katı halde elektriği iletmemelerinin nedeni
serbest elektronlarının bulunmamasıdır. İyonik katılar tel ve levha
haline getirilemezler, sert ve kırılgandırlar. Erime noktaları çok
yüksektir.
MOLEKÜLER KRİSTALLER
Moleküler katılarda örgüyü oluşturan birimler moleküllerdir.
Molekülleri bir arada tutan kuvvetler Van Der Walls kuvvetleri ve
Polar Kovalent bağdır.
KOVALENT KRİSTALLER
Örgü noktalarındaki atomlar, elektronlarını ortaklaşa kullanarak bir
arada tutarlar ve kristal katıları oluştururlar. Bu kristallerde bir ağ
yapısı oluşturur. Ağ örgülerinden dolayı çok serttirler ve erime
noktaları yüksektir. Elektronlar kovalent bağda hareketsiz bir
şekilde yoğunlaştığı için elektriği az iletirler.
SIVILARIN YÜZEY GERİLİMİ
Bir sıvının yüzey alanını arttırmak için gerekli enerjiye yüzey
gerilimi denir. Sıvıların yüzey gerilimi sıvı tanecikleri arası
kuvvetlere ve sıcaklığa bağlı olarak değişir.
ADEZYON VE KOHEZYON KUVVETLERİ
Sıvı tanecikleri arası çekim kuvvetleri kohezyon kuvvetleri, sıvının
temas ettiği yüzeyle arasındaki kuvvetler ise adezyon kuvvetleri
olarak ifade edilir.
VİZKOZİTE
Sıvılarda akmaya karşı görülen dirence denir