www.fendosyasi.com
Atomların elektron alış verişi veya
elektronlarını ortaklaşa kullanmaları
sırasında atomları bir arada tutan kuvvete
kimyasal bağ denir.
www.fendosyasi.com
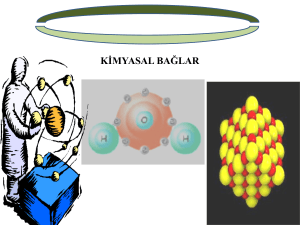
KİMYASAL BAĞLAR
Kimyasal bağlar ikiye ayrılır:
1. İyonik bağ
2. Kovalent bağ
www.fendosyasi.com
Kovalent Bağ :
İki ametal arasında elektronların ortaklaşa
kullanımıyla oluşan bağa kovalent bağ denir.
Polar ve apolar kovalent bağ olmak üzere iki
çeşittir.
www.fendosyasi.com
Polar Kovalent Bağ :
Farklı cins iki ametal arasında oluşan bağa
polar kovalent bağ denir.
Polar kovalent bağ oluşumunda atomlar
arasında elektron alışverişi olmaz. Son
yörüngelerdeki elektronlar ortaklaşa
kullanılır.
Polar kovalent bağ sonucunda oluşan
molekül bileşik molekülüdür.
www.fendosyasi.com
Örnek )
Oksijen
atomunun son
enerji
seviyesinde altı
elektron,
hidrojen
atomunun tek
olan enerji
seviyesinde bir
elektron vardır.
www.fendosyasi.com
Su molekülü oluşurken, iki
hidrojen atomu ve bir
oksijen atomunun son
yörüngeleri şekildekine
benzer girişim yapar.
Oksijen atomu son
yörüngesindeki elektron
sayısını sekize, hidrojen
atomları ikiye tamamlar.
Böylece hidrojen ve oksijen
atomları son
yörüngelerdeki
elektronları ortaklaşa
kullanarak aralarında polar
kovalent bağ oluştururlar.
www.fendosyasi.com
Apolar Kovalent Bağ :
Aynı cins iki ametal atomu arasında oluşan bağa
denir.
Apolar kovalent bağ ile oluşan molekül element
molekülüdür. Soy gazlar hariç, diğer gaz halindeki
elementlerin molekülleri arasındaki bağ apolar
kovalent bağdır.
www.fendosyasi.com
Örnek : Hidrojen gazının oluşumunda iki
hidrojen atomunun yörüngeleri şekildekine
benzer girişim yaparak elektronlarını ortaklaşa
kullanırlar. Böylece iki hidrojen atomu apolar
kovalent bağ ile bağlanarak yörüngelerindeki
elektron sayılarını ikiye tamamlarlar.
www.fendosyasi.com
İYONİK BAĞLAR
www.fendosyasi.com
Elektron alış verişi ile oluşan kimyasal bağa
iyonik bağ denir. Metal ve ametal atomları
arasında görülür.
www.fendosyasi.com
ÖRNEK : 1
Yemek tuzu, Sodyum (Na) ve Klor (Cl)
elementlerinden oluşur.
www.fendosyasi.com
Yukarıdaki şekilde görüldüğü gibi NaCl (Sodyum
klorür) Na ve Cl elementlerinden
oluşur. Bunlar bir araya geldiğinde kararlı yapıya
geçmek için son yörüngelerini
sekize tamamlamak ister. Na atomu son
yörüngesindeki bir elektronunu Cl atomuna
verir.
www.fendosyasi.com
Son yörüngeden bir önceki yörünge son yörünge
konumunu alır. Sekiz olur, soygaza benzer ve 1
elektron verdiği için sodyum Na+1 halini alır. Klor
atomu 1 elektron alarak son yörüngesini 8
elektrona tamamlar (soygaza benzer) ve Cl-1 iyon
halini alır. Böylece her iki atom da kararlı yapıya
ulaşmıştır. Na ve Cl atomu farklı elektrik yüklü iyon
haline geldiğinden aralarında bir çekim kuvveti
oluşur. Bu çekim kuvvetinden doğan bağa da
iyonik bağ denir.
www.fendosyasi.com
http://www.fendosyasi.com