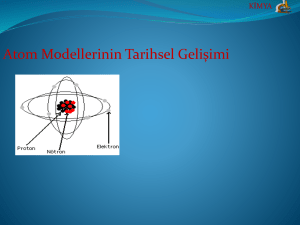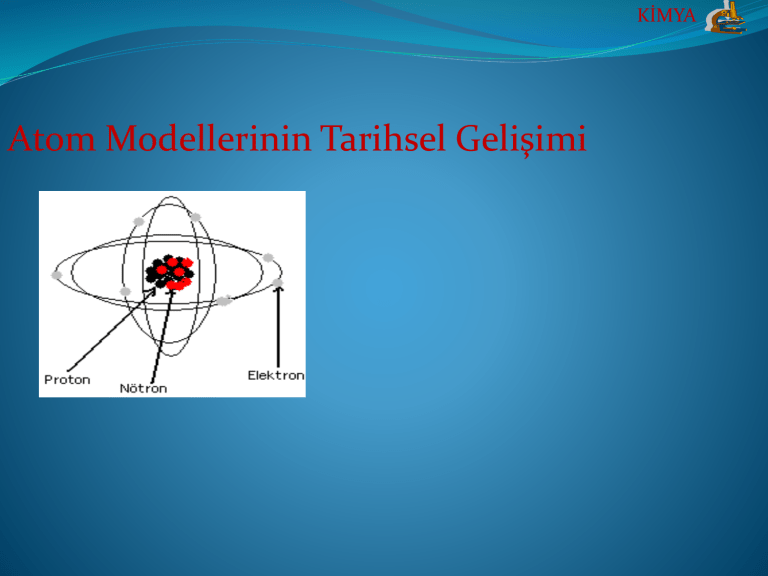
KİMYA Atom Modellerinin Tarihsel Gelişimi KİMYA ATOM MODELLERİ Bugün bildiğimiz atom bilgisi, teorik ve deneysel konularda yıllardır sürekli yapılan çalışmaların bütünüdür. Çalışmalar sonucunda atomun varlığı kesin bilgi hâlini aldıktan sonra, onları daha yakından tanımak, özellikleri ile ilgili araştırma ve incelemeler yapmak için modeller tasarlanmaya başlanmıştır. Model, bir konu ya da olayın anlaşılmasını kolaylaştırmak amacıyla tasarlanır, ancak olayın gerçek niteliğini belirtmez. Atom modelleri; Bilim adamları tarafından hayal edilmiş tablolardan ibarettir. Bunlar atomu doğrudan doğruya gözlemleyerek yapılan tasanlar Değildir. En sade atom modelinde atomlar, içi dolu esnek küre olarak kastedilir. KİMYA 1.Dalton Atom Modeli(1803) Bileşikleri oluşturan elementlerin belirli kütle oranı ile birleştiği ve bu oranın sabit olduğunu bulmuştur. Atom daha küçük parçalara bölünemez; bir elementin bütün atomları aynıdır; atomlar içi dolu küreciklerdir ve farklı elementlerin kütleleri aynı olabilir görüşleri doğru değildir. KİMYA Dalton Atom Modeli KİMYA 2.Thomson Atom Modeli(1897) Elektroliz deneyleri ile maddenin elektrik yüklü bir yapısının olduğu; pozitif ve negatif yüklü tanecikler içerdiğini ortaya koymuştur. Atomdaki pozitif yük içerisinde negatif yüklerin homojen olarak dağılması; atomun yapısının çok büyük bir kısmını protonların oluşturduğu görüşleri doğru değildir. KİMYA Thomson Atom Modeli KİMYA 3.Rutherford Atom Modeli(1911) Alfa ışınları yayan bir radyoaktif maddenin bu ışınlarını çok ince metal bir levha üzerine göndererek meydana gelen olayları inceleyerek atomun yapısını temel olarak açıklamış; ancak elektronların çekirdek çevresindeki konum ve hareketlerinden hiç bahsetmemiştir. KİMYA Rutherford Atom KİMYA 4.Bohr Atom Modeli(1913) Atomların yüksek sıcaklıklarda oluştuğu spektrum çizgilerinden elektronların çekirdeğe uzaklıkları, yörüngeleri, enerji seviyeleri (temel hal, uyarılmış hal) ve potansiyel enerjileri ile ilgili bulgular ortaya koymuştur. KİMYA Bohr Atom Modeli KİMYA Modern Atom Teorisi: Elektronların yeri ve hızı aynı anda bilinemez. Elektronların bulunma olasılığının yüksek olduğu yerler orbitallerdir. Her temel enerji seviyesinden n2(nkare) tane orbital, 2n2(2nkare) tane elektron bulunabilir. Alt enerji seviyeleri s, p, d ve f ‘dir. KİMYA KİMYA Utkucan©2013 M. Utkucan İSENLİK