Atomun Yap*s - WordPress.com
advertisement

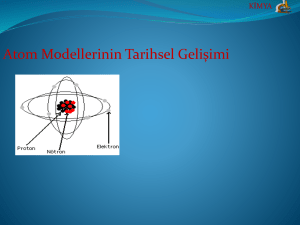
ATOMUN YAPISI ATOM MODELLERİ DALTON ATOM MODELİ BOHR ATOM MODELİ THOMSON ATOM MODELİ RUTHERFORD ATOM MODELİ DALTON ATOM MODELİ (1803) Maddeler çok küçük parçalanamaz atomlardan oluşmuştur. Aynı elementin atomları şekil, büyüklük, kütle bakımından aynıdır. Bir elementin atomları diğer elementin atomlarından farklıdır. Bileşiği oluşturan atomlar arasında tam sayılar ile ifade edilebilen sabit bir oran vardır. Atom içi boş bir küre şeklindedir. THOMSON ATOM MODELİ (1897) Atomlar küre şeklindedir. Atomda pozitif ve negatif yük sayısı eşittir. Elektronlar atom içerisinde homojen olarak dağılmışlardır. 1874 yılında Stoney maddenin yapısın negatif yüklü taneciğin olduğunu öngörmüş ve buna elektron adını vermiştir. 1897 yılında Thomson katot ışınları tüpleriyle yaptığı deneylerde elektronların yük/kütle oranını hesaplamıştır. ÜZÜMLÜ KEK MODELİ (THOMSON) Madde küre şeklindeki atomlardan oluşmuştur. Atomda negatif yüklü elektronlar vardır. Elektronların kütlesi atomun kütlesinden çok küçüktür. Elektriksel nötralliği sağlamak için atomun geri kalan kısmı pozitif yüklü olmalıdır . RUTHERFORD ATOM MODELİ (1911) Rutherford’un deney düzeneğinde alfa ışın kaynağı polenyum elementinden gelen ışınlar ince altın levhaya düşürüldüğünde ışınların çok büyük bir kısmının geçtiği çok az bir kısmının 90 dereceden büyük bir açıyla saptığı gözlenmiştir. Bunun sonucunda Rutherford; Atomun büyük bir kısmı boşluktur. Atomda pozitif yükler çok küçük bir hacimde toplanmıştır. Bu merkeze atom çekirdeği denir. Eksi yükler dağınıktır. Artı yüklere Rutherford proton adını vermiştir . RUTHERFORD ATOM MODELİ Atomdaki elektron sayısı proton sayısına eşittir. Çekirdeğin yoğunluğu çok büyüktür. Günümüzdeki atom modeline yaklaşarak ilk defa çekirdek fikrini ortaya atmıştır. Ancak elektronların neden çekirdeğin içine düşmediğini açıklayamamıştır. BOHR ATOM MODELİ Yörünge fikri ilk defa bu teoride ileri sürülmüştür. Bohr atom teorisi elektronların hareketini oldukça iyi bir şekilde izah eder. Elektronların hareketi sadece belirli ve kararlı hallerde mümkündür. Bu kararlı hallerin sabit ve belirli enerjisi vardır. Elektronlar yörünge etrafında sürekli döner MODERN ATOM MODELİ 19. yüzyılın başlarından itibaren modern atom teorisi ortaya konmuştur. Elektronların kütlesi çok küçük, hızı çok büyük olduğundan elektronun yeri ve hızı aynı anda bilinemez. Elektronlar dalga özelliği gösterir. Elektronların bulunma olasılığının fazla olduğu yerlere orbital denir.