ATOMUN KUANTUM
MODELİ
Bir elektronun bulunduğu konumu ve vektörel
hızı, birbirini bütünleyen özelliklerdir.
Bunlardan birini kesin olarak saptadığımız
zaman, diğeri belirsiz hâle gelir.
Vektörel hız, enerji ile doğrudan ilişkide olduğuna
göre biri hakkında ne kadar çok şey bilirsek
diğeri hakkında o kadar az bilgimiz olur.
Buna rağmen, bir elementin çoğu özelliği o
elementin elektronlarının enerjisine bağlıdır.
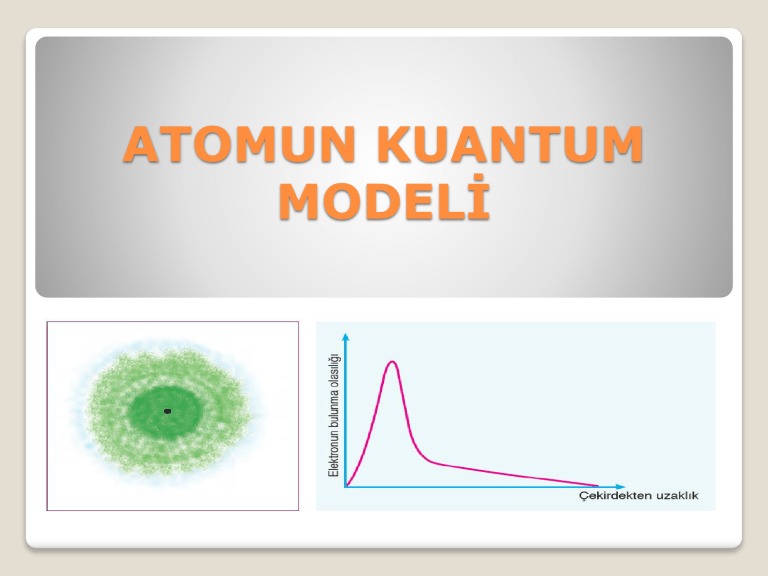
Elektronların enerji durumlarını gösteren olasılık
doğrularını Erwin Schrödinger tarif etmiştir.
Belirsizlik ilkesi gereği, her bir durum için belirli
bir anda bir elektronun enerjisini kesin olarak
ölçebiliriz ancak konumunu belirleyemeyiz.
Bunun yerine, orbital düzeyinde bir olasılık
dağılım haritası ile o elektronun muhtemel
konumunu tanımlayabiliriz.
Schrödinger’e göre herhangi bir atom için
tanecik yoğunluğu, atomdaki elektronların
enerji ve yörüngelerinin matematiksel türevi
ve dalga fonksiyonunun karesi ile doğru
orantılıdır.
Yani elektronun bulunma ihtimalinin en
yüksek olduğu yer, dalga fonksiyonunun
karesinin en yüksek olduğu yer olacaktır.
Atomda enerji düzeyleri ve dalga
fonksiyonları, kuantum sayıları ile ifade edilir
ve kuantum mekaniğinde yörünge yerine
orbital tanımlaması kullanılır.
Orbital, bir matematiksel fonksiyon olduğu
için konumu kesin olarak hesaplanamazken
belli bir uzay bölgesinde bulunma olasılığı
bulunmaktadır.
Orbital
Kuantum mekaniği varsayımlarının
önerilmesine esas olan temel kavram ve
fikirler aşağıdaki gibi özetlenebilir:
Louis de Broglie’un tanecik-dalga ikilemi,
kuantum mekaniğinin önerilmesinde önemli
rol oynamıştır.
Schrödinger denklemi bir dalga denklemi olup
kuantum mekaniğinde sistem hâllerini
belirler.
Zamana bağlı olmayan Schrödinger denklemi,
ancak bazı özel sistemler için çözülebilir.
Klasik mekanik, bir taneciğin konumunu ve
hızını kesin olarak tanımlayabilir. Kuantum
mekaniği ise tanımlayamaz.
Bohr atom modeli, hidrojen atomu ve
hidrojen benzeri iyonların spektrumlarını
açıklayabildiği hâlde çok elektronlu
atomların spektrumlarını açıklayamaz.
Çok elektronlu atomların spektrumlarında
Bohr modelinin öngördüğü çizgilerin
yerinde birden fazla çizgi vardır.
Yani enerji düzeylerinin her biri birden
fazla enerji düzeyine ayrılmaktadır.
Angström mertebesinde büyüklüğe sahip
sistemler için yapılan çalışmalarda klasik
yaklaşımların yeterli olmayıp kuantum
mekaniğine gerek olduğu görülmüştür.
Kuantum mekaniği, “Elektron, çekirdeğin
etrafında tıpkı güneş sistemindeki gibi
belli yörüngelerde dolaşır” tezini geçersiz
kılmıştır.
Kuantum mekaniğinde elektron yörüngesi
diye bir kavram yoktur.
Elektronun yeri hakkındaki bilgiler dalga
fonksiyonundan elde edilir.
Kuantum Sayıları
Dalga fonksiyonu, üç ayrı değişkene bağlı
olduğundan böyle bir fonksiyonu grafiksel
olarak göstermek kolay değildir.
Üç boyutlu Schrödinger denkleminin
çözümünde üç kuantum sayısı vardır.
Birbiri ile ilişkisi olan bu üç kuantum sayısı;
baş kuantum sayısı (n), açısal momentum
kuantum sayısı (l) ve manyetik kuantum
sayısıdır (ml).
Bu üç kuantum sayısı, elektronların çekirdek
etrafında dağılımı, bulundukları enerji
düzeylerinin türü ve sayısı ile belirlenir. n, l
ve ml ile karakterize edilen dalga
fonksiyonlarının birden çok olması, aynı
sistemdeki tek elektronun, çok sayıda enerji
düzeyinde bulunabileceği anlamına gelir.
Baş kuantum sayısı,
yörüngenin toplam boyut ve
enerji miktarını gösteren bir
tam sayıdır.
Çekirdekten itibaren n=1,
n=2, n=3, n=4... şeklinde
değerler alır.
Hidrojen benzeri atomlar ya da
iyonların enerji düzeylerinde
bulunan elektronların
çekirdeğe uzaklıkları yaklaşık
olarak aynıdır.
Örneğin n=1 düzeyi tektir.
Bu durum bir kabuk oluşturur.
Bu kabuklar Bohr atom
modelindeki gibi K, L, M, N...
harfleriyle de gösterilir.
Baş Kuantum Sayısı (n)
Açısal momentum kuantum sayısı (l ) orbitalin şeklini gösterir.
Baş kuantum sayısına (n) bağlı olarak l , 0 ile (n–1) arasında tam
sayı değerleri alır; l = 0, 1, 2, 3... (n–1).
Baş kuantum sayısından sonra toplam enerjiye ikinci derecede
katkıda bulunduğu için açısal momentum kuantum sayısı, ikincil
ya da yan kuantum sayısı olarak da adlandırılır.
l açısal momentum kuantum sayısının her bir farklı değeri için
farklı orbitalleri vardır.
Bu orbitaller l ’nin 0, 1, 2, 3... değerleri için sırasıyla s, p, d, f...
harfleri ile gösterilir.
Açısal Momentum Kuantum Sayısı (l )
Toplam enerjiye üçüncü dereceden katkısı
olan manyetik kuantum sayısı (ml), 0, -l,
+l değerlerini alabilir ve l ’nin tanımladığı
orbital türlerinin her birinde kaç tane
orbital bulunduğunu belirtir.
l ’nin belli bir değeri için ml , (2l+1) sayıda
değere sahip olabilir.
Orbitallerin uzaydaki yönlenmelerini
belirleyen, manyetik kuantum sayısıdır.
Bu orbitaller dış manyetik alanla
etkileşerek çeşitli enerji seviyelerine
ayrılır.
Manyetik Kuantum Sayısı (ml)
İkincil enerji düzeyi olarak da adlandırılan
ml’nin verilen l değeri için alabileceği değerler
ve orbitalin sayısı (2l+1) bağıntısı ile bulunur.
İkincil enerji düzeyindeki orbitallerden biri,
dış manyetik alana dik ise ml=0 değerini alır.
Geriye kalan orbitaller, dış manyetik alanla
yaptıkları açılara bağlı olarak enerji
seviyelerini yükseltici (+l) veya düşürücü (-l)
yönde olabilir.
s Orbitalleri
s orbitalleri küre şeklinde bir bulut olup
çekirdekten uzaklaştıkça yoğunlukları azalır.
Elektron bulutu küresel olduğundan s
orbitallerinin küresel sınır yüzeyine sahiptir.
Yüksek enerjili s orbitalleri daha büyük küre
şeklindedir.
s orbitallerinin büyüklüğü baş kuantum
sayısının karesi ile doğru orantılıdır.
Tüm s orbitalleri için açısal momentum
kuantum sayısı l=0’dır ve her enerji
seviyesinde birer tane s orbitali vardır
(1s, 2s, 3s, 4s...).
Orbital Türleri
p Orbitalleri
p orbitalleri, çekirdeğin iki tarafında zıt
yönelmiş, kum torbası biçiminde iki ayrı
“lob”dan oluşmuş elektron bulutlarıdır.
Bu bulutlardaki loblar, birbirinden bir
düzlemle ayrılmıştır. Bir p elektronu hiçbir
zaman bu düzlemde bulunmaz; dolayısıyla
çekirdekte de bulunmaz.
p orbitalleri; x, y ve z eksenlerine yani
yöne bağlıdır.
p orbitallerinde çekirdeğin merkezinden
geçen simetri ekseni vardır. n=2 için l=1
değerine karşın ml= –1, 0 ve +1 olmak
üzere üç değer alabildiğine göre üç çeşit p
orbitali bulunmaktadır.
Bu orbitaller; x ekseni, y ekseni ve z
ekseni boyunca yönlenir ve px, py, pz diye
isimlendirilir.
p orbitallerinin boyutları baş kuantum
sayılarına bağlı olarak artmaktadır.
d Orbitalleri
d orbitalleri; n=3 ve daha yüksek enerji
düzeyinde görülür.
d orbitalleri; s ve p orbitallerinden daha
karışıktır.
Dış manyetik alan yokken aynı enerji
seviyesinde beş ayrı d orbitali vardır.
d orbitalleri, üç değişkenden (x, y ve z)
ikisinin fonksiyonudur ve bu fonksiyonlardan
biri dx2–y2 şeklinde simgelenir.
Diğer d orbitalleri; dxy, dxz, dyz ve dz2 şeklinde
simgelenir.
Beş d orbitalinden dördü, üzerinde bulunduğu
eksenler dışında aynı görünüme sahiptir,
ancak dz2 orbitali farklı görünümdedir.
Orbitallerin Enerjileri
Hidrojen atomunun dalga modeli, çok
elektronlu atomlara uygulanmak üzere
geliştirilebilir.
Elektronlar enerji seviyelerinde bulunan
orbitallere yerleştirilebilir.
Çok elektronlu atomlarda bir enerji
seviyesindeki orbitallerin enerji
bakımından farklılığı; elektronla çekirdek
arasındaki çekim ve elektronlar arasındaki
itme kuvvetinden dolayıdır.
Elektron Spini: Dördüncü Kuantum Sayısı (ms)
Elektron orbitallerinin tanımlanmasında üç kuantum
sayısına ek olarak dördüncü kuantum sayısına
gereksinim duyulmuştur.
George Uhlenbeck ve Samuel Goudsmit, 1925 yılında
hidrojen spektrumdaki açıklanamayan bazı noktalara
öneriler getirmişlerdir.
Buna göre Uhlenbeck ve Goudsmit, elektronun,
dünyanın ekseni etrafında dönüşüne benzer şekilde,
kendi ekseni etrafında döndüğünü kabul ederek
açıklanabileceğini ileri sürmüşlerdir.
Daha sonra bu dönme olayına spin adı verilmiştir.
Elektron spini için iki olasılık vardır.
Elektron spin kuantum sayısı ms=+1/2 veya ms=–1/2
değerlerini alabilir. ms’nin değeri, diğer üç kuantum
sayısının (n, l, ml ) değerine bağlı değildir.
Hidrojen atomunun temel hâlde baş kuantum
sayısı n=1’dir.
n=1 enerji seviyesi yalnızca s orbitali
içerdiğinden, açısal momentum kuantum
sayısı l=0 olur.
Manyetik kuantum sayısının tek olası değeri
ml=0’dır.
Elektron spini ise ms=+1/2 ya da ms=–1/2
olabilir.
Hidrojen atomunun dört kuantum sayısı şu
şekilde gösterilebilir:
Kletchkowski-Madelung (Kleçkovski-Modelug) İlkesi
Orbitallerin enerjileri (n+l) değerinin artmasıyla
yükselir.
(n + l ) değerlerinin aynı olması durumunda, n sayısı
büyük olan orbitalin enerjisi de yüksek olur.
3d için n=3 ve l=2’dir. (n+l) = 3+2 =5
4p için n=4 ve l=1’dir. (n+l) = 4+1 =5
5s için n=5 ve l=0’dır. (n+l) = 5+0 =5
Yukarıdaki örneklerin üçünde de (n+l)= 5’tir.
Bu durumda Kletchkowski-Madelung İlkesi’ne göre n
değeri büyük olanın enerjisi de yüksek olur.
Örnekteki orbitallerin enerji sıralaması 3d<4p<5s
şeklinde olur.
Kletchkowski-Madelung İlkesi kullanılarak
orbitallerin enerji sıralaması doğru bir
şekilde yapılabilir:
Elektron Dizilimleri
Bir atomun elektron dizilişi,
elektronların orbitallere
nasıl yerleşeceğini gösterir.
Elektronların orbitallere
yerleşimindeki sıra,
spektroskobik ve manyetik
yöntemlerle ortaya
çıkarılmıştır.
Bunun sonucunda bir
yerleşim sırası
kurgulanmıştır.
Elektronların orbitallere
dolması şu sıra ile
gerçekleşir:
Wolfgang Pauli, 1926 yılında atomlara ait
yayılma spektrumlarının karmaşık yapısını
açıklarken bir atomda bütün kuantum sayıları
aynı olan iki elektronun var olamayacağını
savunmuştur.
Pauli Dışlama İlkesi diye adlandırılan bu
ilkeye göre bir orbitalde yalnızca iki elektron
bulunabilir ve bu elektronlar zıt spinlere sahip
olmalıdır.
Buna göre alt kabuklara yerleşebilecek
elektron sayıları; s için en çok 2 elektron, p
için en çok 6 elektron, d için en çok 10
elektron ve f için en çok 14 elektrondur.
Bu sonuca göre elektron sayılarının orbital
sayılarının iki katı olduğu görülmektedir.
Elektron dizilişinde, bir atom olabildiğince
çok sayıda eşleşmemiş elektrona sahip
olmak ister.
Bu durum Hund Kuralı olarak bilinir.
Bu kurala göre elektronlar orbitallere
öncelikle birer birer yerleşir (paralel spinli).
Çok elektronlu atomların elektron dizilişini
örneklerle gösterelim.
Atom numarası 7 olan azot (N) atomunu ele
alalım.
Elektronlarının orbitallere
şeklinde ve
paralel spinli olarak yerleşmiş olduğu bir
yapının, atomun düşük enerjili hâlini daha iyi
temsil ettiği yapılan deneylerle ispatlanmıştır.
Bu durum temel hâl elektron dağılımıdır.
Elektron dağılımını yazmada Almanca “inşa
etme” anlamına gelen aufbau işlemini
kullanacağız.
Bu işlem, atom numarası artarken elektron
dağılımının nasıl “inşa” edileceğini gösterir.
Atomların elektron dizilişleri; periyodik
sistemin, elementlerin periyodik özelliklerinin
ve atomlarının kimyasal bağ oluşturma
yatkınlıklarının belirlenmesinde önemli bir
anahtardır.
Bir atomun, temel hâl elektron dizilişindeki en son
orbitalinin tam dolu ya da yarı dolu olması, atoma
küresel simetri durumu kazandırır.
Bu durumdaki atom daha kararlıdır.
Çünkü küresel simetri özelliği gösteren atomlarda
elektronlar çekirdek tarafından simetrik olarak (eşit
kuvvetle) çekilir.
Çekirdek tarafından simetrik çekilen elektronu
koparmak için dışarıdan verilmesi gereken enerji
değeri daha büyük olur.
Örneğin 10Ne : [He] 2s2 2p6 tam dolu p6 dan dolayı
tam küresel simetri,
2
3
3
15P : [Ne] 3s 3p yarı dolu p ten dolayı yarı küresel
simetri özellik gösterir.
Elektron dizilimi ns2(n–1) d4 ve ns2(n–1) d9 ile
sonlanan atomlarda, dolu s orbitalindeki iki
elektrondan biri boş olan d orbitaline geçerek atoma
daha fazla kararlılık kazandırır.
İyonların elektron dağılımı, atomun aldığı ya da
verdiği elektron sayısı dikkate alınarak yapılır.
Bir katyonun elektron dağılımı yapılırken kopacak
elektronlar sırası ile np, ns ve (n–1)d
orbitallerinden uzaklaştırıldığı hâlde, anyon için
bir sonraki soy gaz yapısına ulaşıncaya kadar
elektron ilave edilir.
Elektron diziliminde en son orbital d ise
atom elektronunu yukarıda verilen
örneklerde olduğu gibi 3d orbitalinden
değil, 4s orbitalinden verir.
Çünkü 3d orbital elektronları çekirdeğe
daha yakın olduğundan 4s
elektronlarından daha güçlü çekilir.