Atomun Yapısı ve Işık
Spektrumu
Tanecik Özelliği
(Foton Özelliği )
Işık
Dalga Özelliği
Işığın Kırınımı ve girişim olayları ışığın tanecikli yapısı ile tam olarak açıklanamamıştır.
Fotoelektik olay gibi bazı olaylar ancak ışığın foton(tanecik) özelliği ile ortaya
konabilmiştir.
Işığın dalga özelliği elektromanyetik dalga ile ortaya konmuş ve her ışık bir
elektromanyetik
dalga ile tanımlanmıştır.
Bir ışın; üç parametre ile tanımlanır:
1- Dalga Boyu, 2- Genlik, 3- Frekans
• Tek bir dalga boyundan oluşan ışına monokromatik ışık, çeşitli dalga boylarını
içeren ışığa polikromatik ışık denir.
Atomun Yapısı ve Işık
Spektrumu
Beyaz ışık birçok dalga
boyundan oluşan ışıkların bir
araya geldiği bir polikromatk
ışın demetidir. Beyaz ışık bir
prizmadan geçirilirse ışınlar
dalga boylarına göre ayrılarak
elektromanyetik spektrumu
meydana getirirler.
Atomun Yapısı ve Işık
Spektrumu
Atomun Yapısı ve Işık
Spektrumu
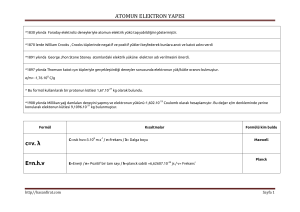
Soru: Aşağıdaki ışıkların (elektromanyetik dalga) enerjilerini hesaplayınız.
•Kırmızı
•Mor
E = h = h.
•Radyo dalgaları
c
a) E = h
5
300000
km
/
s
3
x
10
km / s
=6,63.10-27 erg.sn
= 6,63.10-27 erg.s
700nm
700nm
3 x1010 cm / s
-27
= 6,63.10 erg.s
700 x10 7 cm
= 2,84.10-12 erg
b) E = h
5
300000
km
/
s
3
x
10
km / s
-27
-27
=6,63.10 erg.sn
= 6,63.10 erg.s
400nm
400nm
10
3
x
10
cm / s
= 6,63.10-27 erg.s
400 x10 7 cm
= 4,97.10-12 erg
Atomun Yapısı ve Işık
Spektrumu
c) E = h
5
300000
km
/
s
3
x
10
km / s
-27
=6,63.10-27 erg.sn
=
6,63.10
erg.s
10 3 m
10 3 m
3 x10 8 m / s
-27
= 6,63.10 erg.s
10 3 m
= 1,989.10-21 erg
Atomun Yapısı ve Işık
Spektrumu
1 2
h. = w + m.v
2
Fotoelelektrik olay
Belli frekanslı bir
radyasyonun temiz bir
metal üzerine gönderilmesi
halinde, metalden elektron
kopmasına “fotoelektrik
olay” denir.
h. = h.0 +
1
m.v2
2
1
m.v2 = h ( - 0)
2
m: elektronun kütlesi,
v : elektronun hızı,
0, metalin cinsine bağlı olup “eşik frekansı
w: elektronun metalden koparılması için harcanan enerjidir
Atomun Yapısı ve Işık
Spektrumu
Fotoelelektrik olay
Örnek : Potasyumun çıkış işi 2,24 eV dur. 2537 oA dalga boylu bir ışıkla
oluşturulan foto elektronların kinetik enerjisini ve hızını hesaplayınız.
Gelen fotonun enerjisi için,
10
c
3.10 cm/sn
-27
E = h. = h
= 6,63.10 erg.sn
2537.108 cm
yazılabilir. Buradan,
h. = h.0 +
E = 7,84.10-12 erg
elde edilir. 1 eV = 1,6 10-12 erg olduğundan,
7,84.10 -12
E=
= 4,9 eV
1,6.10 -12
bulunur.
1
m.v2
2
1
m.v2 = h. - h.0
2
m: elektronun kütlesi olup 9,1.10-28 gramdır.
1
m.v 2 = 4,9 - 2,24 = 2,66 eV
2
= 2,66. 1,6.10-12 = 4,26.10-12 erg
v
2 . 4,26 .10 12
9,1.10 28
9,68.10 7 cm/sn
ATOMUN YAPISI VE ÖZELLİKLERİ
• Atom kuramına göre katı, sıvı veya gaz halindeki
maddelerin tümü atom denilen çok küçük
parçacıklardan meydana gelmiştir.
• Atom, elementlerin en küçük kimyasal
yapıtaşıdır.
• Atom çekirdeği: genel olarak nükleon olarak
adlandırılan proton ve nötronlardan meydana
gelmiştir.
• Elektronlar: çekirdeğin etrafında yoğunluğu yer
yer azalıp çoğalan elektronlar bulunmaktadır.
ATOMUN YAPISI VE ÖZELLİKLERİ
ATOMUN YAPISI VE ÖZELLİKLERİ
• Atomun bir kütlesi ve bir hacmi vardır.
• Kütlesi çok küçük bir yer işgal eden çekirdeğidir.Yani
atomun çekirdeği o atomun kütlesini verir.
•Atomun çekirdeği atomun ortasında küçük bir yer
kapladığı halde kütlesi elektronun kütlesinden çok
büyüktür.
•Elektronun kütlesi ise çekirdeğin kütlesi yanında ihmal
edilecek kadar küçüktür.
•Bu nedenle, bir atomun kütlesi yaklaşık olarak
çekirdeğin kütlesine eşittir.
ATOMUN YAPISI
ATOMUN YAPISI VE ÖZELLİKLERİ
• Elektron; kütlesi 9,1094x10-31 kg olan ve elektriksel
olarak eksi (-) yüklü bir parçacıktır. Genellikle “ē”
sembolü ile gösterilir.
• Proton; kütlesi 1,6726x10-27 kg olan, bir elektron
kütlesinin yaklaşık 1836 katı olan ve elektriksel olarak
artı (+) yüklü bir parçacıktır. Protonun sembolü “p”
veya “H+” olarak gösterilir.
• Nötron; kütlesi yaklaşık olarak bir protonun kütlesine
eşit ve elektriksel olarak yüksüz bir parçacıktır.
Nötronun sembolü genellikle “n” ile verilir.
Kısaca;
Nötron KütlesiProton Kütlesi1836 Elektron Kütlesi
diyebiliriz.
ATOMUN YAPISI VE ÖZELLİKLERİ
• Bir elementin nötron sayıları farklı olan
atomları izotoplar olarak tanımlanır.
• 12C, 13C ve 14C, karbon atomunun farklı
izotoplarıdır.
• Doğadaki elementler, belirli oranlarda
izotop atomlar içermektedirler; bu nedenle
atom ağırlıkları tam sayılar değildir.
Element
Sembol Atom No
Atom Element
Sembol Atom No
Ağırlığı
Atom
Ağırlığı
Hidrojen
H
1
1,008 Sodyum
Na
11
22,99
Karbon
C
6
12,01 Magnezyum
Mg
12
24,31
Azot
N
7
14,01 Potasyum
K
19
39,1
Oksijen
O
8
16,00 Kalsiyum
Ca
20
40,08
Fosfor
P
15
30,97 Demir
Fe
26
55,85
Kükürt
S
16
32,06 Bakır
Cu
29
63,55
Klor
Cl
17
35,45 İyot
I
53
126,9
15
• Elektronların çekirdek etrafında hızla
dönmeleri ile meydana getirdikleri bulutlar,
farklı enerji seviyelerine sahiptirler.
• Atom çekirdeği etrafında elektron enerji
seviyeleri, çekirdeğe en yakından itibaren
K, L, M, N, O, P ve Q gibi harfler ile ifade
edilir; bunlar da elementlerin periyodik
tablosundaki 1, 2, 3, 4, 5, 6, 7 periyot
numaralarına uyar.
Kobalt (Co)
• Belirli bir enerji seviyesindeki bir
elektronun atom çekirdeği etrafında % 90
veya daha fazla olasılıkla bulunduğu
yörüngeler orbital olarak tanımlanmıştır.
• -Orbitallar, belirli bir enerji seviyesinde
atom çekirdeğine en yakın olandan itibaren
s, p, d, f orbitalleri olarak isimlendirilirler.
ATOM MODELLERİ
• DALTON ATOM MODELİ
• THOMSON ATOM MODELİ
• RUTHERFORD ATOM MODELİ
• BOHR ATOM MODELİ
Dalton Atom Modeli
• Madde, atom denilen içleri dolu
bölünemeyen taneciklerden oluşmuştur.
• Aynı elementin atomları büyüklük
yönünden birbirinin aynı, farklı
elementlerin atomları tamamen birbirinden
farklıdır.
• Tepkimelerde atomlar korunur.
• Atomların birleşmeleri sonunda moleküller
oluşur.
Bileşikler atomların birleşmesiyle oluşur
Thomson Atom Modeli
• Thomson, maddenin düzgün olarak
dağıtılmış positive yükler ve aralarına
serpiştirilmiş negatif yüklerden oluştuğunu
ifade etmiştir. Bu yönüyle madde atomu
üzümlü keke benzetilebilir. Kek pozitif yük,
üzümler ise elektronlardır.
Thomson atom modeli
Rutherford Atom Modeli
• Merkezde kütlesi çok büyük bir çekirdek
ve etrafında belirli yörüngelerde dolanan
elektronlardan oluşmuştur. Bu görüşün
yetersizliği ise; Elektronun neden
çekirdeğe düşmediği yada atomdan
fırlayıp gitmediği sorusunun cevapsız
kalmasıdır.
Rutherford atom modeli
Bohr Atom Modeli
• Bohr
atom
modeli,
elektronların
çekirdekten herhangi bir uzaklıkta bulunan
tek bir yörüngede değil, belirli yörüngede
olduğunu belirtir. Bir elektronun bulunduğu
yer elektronun sahip olduğu enerjiye
bağlıdır. Bu enerji düzeyleri çekirdeğe
yakın olandan uzağa doğru 1,2,3.... gibi
numaralar verilerek gösterilir. Enerji
düzeylerinin enerjisi çekirdeğe yaklaştıkça
azalır, uzaklaştıkça artar.
Bohr atom modeli
Bohr Atom Modeli
Bohr Atom Modeli
Bohr Atom Modeli
Bohr Atom Modeli
2,178 x10 18
18
E1
2
,
178
x
10
J
2
1
2,178 x10 18
19
E2
5
,
445
x
10
J
2
2
2,178 x10 18
19
E3
2
,
42
x
10
J
2
3
2,178 x10 18
19
E4
1
,
36
x
10
J
2
4
:
:
E 0
Bohr Atom Modeli
E Ed Ei
h= 6,626 x 10-34 J.s
h Ed Ei
1
1
(3,287 x10 s )( 2 2 )
ni nd
15 1
Bohr Atom Modeli
Soru: Hidrojen atomu için elektronun n=4 den n=3 e geçişi
sırasında açığa çıkan enerjiyi, bu enerjiye eşdeğer ışığın
frekansını ve dalga boyunu hesaplayınız.
2,178 x10 18
2,178 x10 18
E E4 E3
(
)
2
2
4
3
E 3,025 x10 19 J
E h. 3,025 x10 19 6,626 x10 34 Js 1 x
4,565 x1014 s 1
c . 3x10 ms .4,565 x10 s
8
1
6,567 x10 m 656,7nm
7
14 1
Kuantum teorisine göre atom
• Atomun kuantum modelini Bohr, de Broglie,
Heisenberg ve Schrödinger gibi bilim adamları
atomun bugün kabul edilen modelinin gelişmesinde
temel rol oynadılar.
• Kısaca söylemek gerekirse Schrödinger’in dalga
denkleminden Modern Atom Modeli geliştirilmiştir.
• Bu teoriye göre proton ve nötronlardan oluşan atom
çekirdeği atomun merkezinde bulunur. Elektronlar ise
çoğunlukla varlıkları ve şekilleri matematiksel olarak
hesaplanan orbitallerde atom çekirdeğinin etrafında
dalga karakterinde bir hareketle dolaşırlar.
Kuantum teorisine göre atom
KUANTUM SAYILARI
• Atomlardaki
elektronların
dalga
karakterleri kuantum sayıları denen dört
sayı ile belirlenir.
Bu sayılar;
1) Baş Kuantum Sayısı(n)
2) Yan(Açısal) Kuantum Sayısı (ℓ)
3) Magnetik Kuantum Sayısı (mℓ)
4) Spin(Dönme) Kuantum sayısı (ms)
Baş Kuantum Sayısı
• n= 1, 2, 3….olabilir. Elektronun çekirdeğe
ortalama uzaklığını tanımlar.Aynı baş
kuantum sayısına sahip olan elektronlar
belirli enerji tabakasını oluştururlar.
• Bu sayı elektronun ait olduğu kabuğu veya
esas enerji düzeyini belirtir.
b)Yan Kuantum Sayısı
• l=0,1,2,3… n-1 değerlerini alırlar.
• Yan kuantum sayısı tabakalar içinde
bulunan elektron bulutlarının şekillerini ve
aynı zamanda elektron bulutundaki
kırılmaları gösterirler.
• l=0 ise elektron küreseldir.Kırılma yoktur
• l=1 ise elektron bulutunda iki kısım yani
bir kırılma vardır.
b)Yan Kuantum Sayısı
n
ℓ
Yan Kuantum
Sayısı
Orbital Türü
0
s
1
2
3
4
p
d
f
g
1
2
3
4
5
0
0,1
0,1,2
0,1,2,3
0,1,2,3,4
s
s, p
s, p,d
s, p,d,f
s, p,d,f,g
c)Magnetik Kuantum Sayısı
• mℓ =-ℓ,………..,0…….+ℓ ye kadar uzanan tam
sayılar olabilir.
• Herbir ℓ değeri için 2ℓ+1 kadar mℓ değeri vardır.
• n=2 ise ℓ=1 dir
• mℓ =-1,0,1 dir
d) Spin(Dönme) Kuantum Sayısı
• Elektronlar çekirdeğin etrafında dönerken aynı
zamanda kendi eksenleri etrafında da dönerler.
Elektronların kendi ekseni etrafından dönmeleri ile ilgili
kuantum sayısı spin kuantum sayısıdır ne ms ile
gösterilir.
• ms = ±½ değerlerini alabilir. Bir orbital içinde aynı spin
kuantum sayısına sahip iki elektron bulunamaz. Bu da
bir orbitalde en fazla iki elektron anlamına gelir.
• İlk üç enerji kabuğu için kuantum sayıları
n
ℓ
mℓ
ms
1
0(s)
0
0(s)
2
1(p)
Alt Kab.
e- sayısı
Toplam esayısı
±½
2
2
0
±½
2
-1
±½
0
±½
+1
±½
0(s)
1(p)
3
2(d)
±½
-1
±½
0
±½
+1
±½
-2
±½
-1
±½
0
±½
+1
±½
+2
±½
e- orb. Gösterimi
6
8
2
6
18
10
• Elektronların Orbitallere Yerleştirilmesi
Pauli Dışlama İlkesi
•Bir atomda dört kuantum sayısıda
aynı olan birden fazla atom olamaz.
•Bir orbitalde en fazla iki ebulunabilir. Bu elektronların en
azından ms kuantum sayıları farklıdır.
Aufbau İlkesi
• (n+ℓ) değeri düşük olan alt kabuğun
enerjisi en düşüktür.
• (n+ℓ) değeri eşitse; n değeri küçük
olana gider.
Hund kuralı
•Elektronlar bir orbitale önce tek tek ve paralel spinli olarak
yerleşirler
• Elektronların Orbitallere Yerleştirilmesi
• Elektronların Orbitallere Yerleştirilmesi
KAYNAKLAR
1- Modern Üniversite Kimyası, C.E. MORTIMER,
Çeviri: Prof.Dr. Turhan ALTINATA v.d. Çağlayan Kitabevi, 1989.
2- Temel Üniversite Kimyası, Prof.Dr.Ender ERDİK, Prof.Dr. Yüksek
SARIKAYA, Gazi Kitabevi, 2009.
3- Genel Kimya, Prof.Dr. Baki HAZER, Karadeniz Teknik
Üniversitesi Yayınları, 3.Baskı, Trabzon, 1995.
4- Temel Kimya, Prof.Dr.Ali Osman AYDIN, Prof. Vahdettin
SEVİNÇ, Değişim Yayınları, Sakarya
5- Genel Kimya, Sabri ALPAYDIN, Abdullah ŞİMŞEK, Nobel
Yayınları, 2012.
6- Fen ve Mühendislik Bölümleri İçin Kimya, R.CHANG, Çeviri:
A.Bahattin SOYDAN ve A.Zehra AROĞUZ, Beta Yayınları, İstanbul,
2000.
7-Muhtelif web sayfaları.