MARMARA ÜNİVERSİTESİ
TEKNOLOJİ FAKÜLTESİ
MAKİNE MÜHENDİSLİĞİ BÖLÜMÜ
MALZEME BİLİMİ
-Fazlar -
Yrd. Doç. Dr. Abdullah DEMİR
FAZ KAVRAMI
Kristal yapılı malzemelerin iç yapılarında homojen ve
belirli özellikler gösteren bölgelere faz (phase) adı
verilir.
Fazlar; bu atom düzenlerinden ve toplam iç yapıda bu
fazların oluşturdukları tanelerden meydana gelir.
KATI ÇÖZELTİ
Sıvı çözeltide olduğu gibi, katı durumda da bir
elementin atomları diğer bir elementin kafes yapısı
içerisinde uygun bir yer bulup yerleşmesi ile katı
çözelti meydana gelir.
Uygun yerler arayer veya yeralan (ikame) olabilir.
Hume-rothery kuralı gerçekleşmişse tam ve sınırsız
bir çözünme (karışma) sağlanabilir.
Hatırlatma
Atom yarıçaplarındaki farkın %15’ten
az olması gerekir.
İki elementinde aynı kristal yapıya
sahip olması gerekir.
Aynı elektronegatifliğe (elektron çekme
kabiliyeti) sahip olmaları gerekir.
Aynı valansa sahip olmaları gerekir.
Yoğunluklarının birbirine yakın olması
gerekir.
Hume-Rothery kuralları:
- Boyut faktörü
- Kristal yapısı
- Valans
- Elektronegativite
Bir elemente diğer bir element karıştırılacak olursa,
daima toplam iç enerji mimimum olacak şekilde yeni
atom düzenleri meydana gelir.
SİSTEMDE ENERJİ
Fazlar: İç enerjinin min. olmasını sağlayacak şekilde
oluşurlar.
Bir sistemde enerji durumu: Sıcaklık, kimyasal
bileşim, basınç gibi değişkenler ile belirlenir.
Eğer basınç sabit ise (atmosferik basınç) sistemin
enerjisi, kimyasal bileşim ve sıcaklık tarafından
belirlenir.
FAZ DİYAGRAMLARI
Kimyasal bileşim ve sıcaklığa bağlı olarak belirli
şartlarda hangi fazların stabil olduğu faz diagramları
ile belirlenir.
Fazların Özellikleri:
• Bir fazın her yerinde yapı ve atomik diziliş aynıdır.
• Bir faz kabaca her yerinde aynı kimyasal bileşim ve
özelliklere sahiptir.
• Bitişik veya civar fazlar arasında kesin bir arayüzey
vardır.
(a) Suyun 3 hali; gaz, sıvı ve katı. Her biri bir fazdır.
(b) Su ve alkol; tam çözünme.
(c) Tuz ve su; sınırlı çözünme.
(d) Su ve yağ; hiç çözünmeme.
Çözünürlük ve Katı Çözeltiler
Çözünürlük: Bir malzemenin bir miktarının ikinci bir
malzemede ikincil faz oluşumuna sebep olmaksızın
tamamen erimesidir.
Sınırsız çözünürlük: Bir malzemenin diğer malzemede
hiçbir zaman ikincil faz oluşturmaksızın çözünmesidir.
Sınırlı çözünürlük: Çözücü malzemede sadece maksimum
miktarda çökeltinin çözünmesidir.
Kopolimer: İki veya daha fazla değişik tür monomerin
özelliklerin karışması fikrinden hareketle birleşmesi ile oluşan
polimerdir.
(a) Sıvı Cu ve Ni, tam çözünür.
(b) Katı Cu ve Ni kristal yapıda rastgele yerlere yerleşmek suretiyle tam katı çözelti oluşturur.
Katı
Çözelti
(c) Cu ve Zn alaşımları sınırlı çözünmeden dolayı
%30’dan fazla Zn çözemez, ikinci faz bölgeleri
oluşturur.
2. Faz
Katı eriyik mukavemetlendirmesi: Katıeriyik oluşturarak
metalik malzemenin mukavemetinin artırılmasıdır.
Dispersiyon mukavemetlendirmesi/sertleştirme: Metalik
malzemelerin ultra-ince dispersiyonları ikincil faz olarak
oluşturulması ile mukavemetlendirilmesidir.
Bakırın akma mukavemeti
üzerine değişik alaşımların
etkileri. Nikel ve çinko
atomları bakır atomları ile
yaklaşık aynı büyüklükte
ama berilyum ve kalay
oldukça farklı boyutlardadır.
Atomik boyutlardaki farklar
ve alaşımlama miktarındaki
değişim
katı-eriyik
mukavemetlendirmesini
artıracaktır.
Katı Eriyik Mukavemetlenmesi
Cu-Ni sisteminde orijinal Cu kafesine bilinçli olarak Ni
arayer atomları sokulduğu için, Cu-Ni alaşımı saf Cu’dan
daha yüksek dayanıma sahiptir.
Cu-Zn sisteminde,%40’dan daha az çinko bakıra ilave
edildiğinde, Zn yeralan atomu olarak davranır, Cu-Zn
alaşımını mukavemetlendirir.
MİKROYAPIDA FAZLAR
İkili
faz
diyagramları:
İki
bileşenli
sistemlerin
faz
diyagramları.
Üçlü faz diyagramları: Üç bileşenli sistemin faz diyagramları.
Izomorfoz faz diyagramları: Bileşenlerin limitsiz çözünürlük
gösterdiği faz diyagramlarıdır.
Likidüs sıcaklığı: Katılaşmada ilk katının oluşmaya başladığı
sıcaklıktır.
Solidüs sıcaklığı: Alt sıcaklıklarda, tüm sıvının tamamıyla
katılaştığı sıcaklıktır.
GİBBS FAZ KURALI
Gibbs faz kuralı–Serbestlik derecesinin sayısını tanımlar
veya fazın sıcaklık ve kompozisyonunu belirlemek için
değişken sayılarını sabitleyen (2+C=F+P basınç ve sıcaklık
değişebilir, 1+C=F+P basınç veya sıcaklık sabit)
F-S diyagramı: Değişik sıcaklık ve basınç koşullarında
fazların termodinamik kararlılığını tanımlar (tekli faz
diyagramları gibi).
Fazın Kompozisyonu
Alaşımdaki her faz, fazdaki her elementin yüzdesi olarak ifade edilen bir kompozisyona sahiptir.
Sabit bir bas basınç için geçerli olan Gibbs faz kuralı:
F+P=C+1
F: Serbestlik Derecesi
C: Sistemdeki bileşenlerin sayısı
P: Faz sayısı
GİBBS FAZ KURALI
Bir sistemde bileşen ve faz sayısının belirli olması
durumunda serbest değişken olup olmadığını
belirlemede kullanılan bir kuraldır.
Basıncın değişken bir parametre olması durumu
F=C–P+2
Basıncın sabit olması durumu (en çok kullanılan bağıntı)
Serbest değişken
sayısı
F=C–P+1
Faz sayısı
Bileşen sayısı
Likidüs çizgisi
TB
Sıvı
S+
T, Sıcaklık
T
Sıvı
T1
TA
S+
T2
Solidüs
çizgisi
(katı)
T3
(katı)
Xs
Kimyasal bileşim: Kompozisyon
X1
X
X1 kompozisyonuna sahip alaşım:
T1 de: S
T2 de: S+
T3 de:
fazlarına sahiptir.
b noktasında:
P=2 (2 Faz: sıvı ve )
C=2 (Bileşenler: A ve B)
F=2–2+1=1
Tek değişken: Sıcaklık
a noktasında:
P=2 (2 Faz: sıvı ve )
C=2 (Bileşenler: A ve B)
F=2–2+1=1
Tek değişken: Sıcaklık
c noktasında:
P=1 (1 Faz: sıvı)
C=2 (Bileşenler: A ve B)
F = 2 -1 + 1 = 2
Değişkenler: Sıcaklık ve bileşim.
GİBBS KURALI VE FAZ DİYAGRAMLARI
Gibbs kuralı kullanılarak elde
edilen soğuma diyagramları, faz
diyagramlarını
oluşturmada
önemli bir araçtır.
İki faz bölgesinde serbestlik derecesi
1 olduğu için sıcaklık belirlendiğinde
iki fazın kompozisyonu daima
sabitleştirilir.
Bağ çizgileri tek fazlı bölgede
kullanılmaz.
Bağ çizgisinin uçları dengedeki 2
fazın kompozisyonlarını gösterir.
İkili faz diyagramı: İki
fazlı bölgede alaşım
varsa istenen sıcaklıktaki
alaşım kompozisyonunu
bir bağ çizgisi ile
belirleyebiliriz. Bu Gibbs
faz kuralının sonucudur.
ERİME NOKTASINDA GİBBS KURALI
Diagramda saf element için erime noktasındaki (TA) durum:
• P = 2 (sıvı ve olarak 2 faz)
• C = 1 (Tek bileşen A)
F=1-2+1=0
T
Sıvının soğuması
Katılaşma aralığı
TA
nın soğuması
t
Basınç sabit, kimyasal bileşimde
değişmediği için tek değişken olan
sıcaklıktır.
Ancak
buda
erime/katılaşma boyunca sıcaklık
sabittir-serbest değişken bulunmaz.
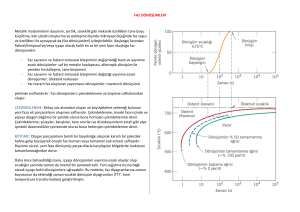
TERAZİ/LEVYE KURALI
Faz diyagramları:
Hangi sıcaklık ve bileşimde hangi fazlar var?
Bu fazların bileşimi nedir?
Faz diagramında, fazların oranlarını ve bileşimlerini
bulmak için terazi/levye kuralı (lever rule) kullanılır.
Alaşımlarda var olan fazların nispi oranları hesaplanabilir.
Tek faz bölgesindeki fazın oranı %100’dür.
Buna karşın 2 faz bölgesinde her fazın oranını
hesaplamak gerekmektedir.
S
xa
%
100
ba
S % % 100%
b-x
x-a
bx
S%
100
ba
x bileşiminin T sıcaklığında bileşim oranları:
S+
T
a
b
x
ÇÖZÜNME DURUMUNA GÖRE
a)
Tam çözünme: Bir elementin diğeri içerisinde sınırsız çözünebilmesi.
Hiç çözünmeme: Bir elementin diğeri içinde hiç çözünememesi.
Sınırlı çözünme: Bir elementin diğeri içerisinde kısıtlı çözünebilmesi.
b)
c)
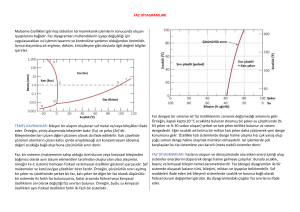
ÖRNEK
Cu-%40 Ni alaşımı için aşağıdaki sıcaklıklarda serbestlik derecelerini bulunuz
(a) 1300 oC, (b) 1250oC ve (c) 1200 oC.
•
%40 Ni’den geçen çizgi alaşımın
kompozisyonunu gösterir:
•
1300 oC’de sadece sıvı mevcuttur.
Sıvı %40 Ni içerir.
•
1270 oC’de iki faz mevcuttur. Sıvı
%37 Ni ve katı %50 Ni içerir.
•
1250 oC’de yine iki faz mevcuttur.
Sıvı %32 Ni ve katı %45 Ni.
•
1200 oC’de sadece katı vardır.
Katı %40 Ni içerir.
ÖRNEK
Cu-%40 Ni alaşımı için aşağıdaki sıcaklıklarda serbestlik derecelerini bulunuz
(a) 1300 oC, (b) 1250oC ve (c) 1200 oC.
Cu - Ni faz diyagramlarında
Basınç sabit olduğu için eşitlik:
(1 + C = F + P) olur.
(a) 1300oC,
P=1 (Sadece sıvı faz),
C=2 (Cu ve Ni)
Böylece;
1+C=F+P
1+2=F+1F=2
ÖRNEK
(b) 1250oC,
İki faz mevcut; P = 2, (Sıvı ve katı)
Cu ve Ni den dolayı; C = 2:
1+C=F+P
1+2=F+2F=1
(c) 1200oC,
P = 1, sadece katı faz;
C = 2, (Cu ve Ni).
1+C=F+P
1+2=F+1F=2
ÖRNEK
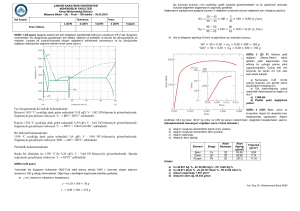
40% Ni kompozisyonunda dikey çizgi çizilir;
-1300oC: Sadece sıvı faz mevcut.
-1270oC: 2 Faz mevcut: Sıvı ve katı.
Sıvı (S) faz 37% Ni,
Katı () faz 50% Ni
konsantrasyonuna sahip.
-1250oC: İki faz mevcut.
Sıvıda (L) 32% Ni, katıda() 45% Ni mevcut
-1200oC: Sadece katı () mevcut; 40% Ni
konsantrasyonuna sahiptir.
100 gr ağırlığına sahip Cu-40% Ni alaşımı, 1250oC de
(a) hangi fazlara sahiptir?
(b) bu fazlarda ağırlığı nedir?
Cu-%40 Ni alaşımında1250 °C’de alfa ve L fazının miktarlarını hesaplayınız?
Cu-Ni sisteminde 1250 °C’deki bağ çizgisi.
Sadece 2 faz mevcuttur: Sıvı faz (L) v katı faz ().
x ; ’nın oranı olacak olursa;
xL= 1 - x. Sıvının oranı
x = (40-32)/(45-32) = 8/13 = 0.62 = % 62
xL = 1-x = 1-0.62 = 0.38= % 38
fazının ağırlığı; 100 gr x 0.62 = 62 gr
Sıvının ağırlığı; 100 gr x 0.38 = 38 gr.
Sıcaklık
TAM ÇÖZÜNME
S, Sıvı
TB
% 90 Sıvı + %10
%10 Sıvı + %90
, Katı
%B
Sıvı
Tamamen sıvı faz
%60 Sıvı + %40
S+
TA
Sıvı
X
Tamamen katı faz.
: %x oranında B elementi içerir.
HİÇ ÇÖZÜNMEME
1.Alaşım
S
TA
1•
2•
Ötektik
Sıcaklık
A+S
3•
4•
5•
X1
1
3•
1
•
2
S+B
•
2•
•
•
•
A+B
%B
X2
Ötektik Bileşim
•
TB
1
2.Alaşım
Sıvı
1
Sıvı
3.Alaşım
1
2
Sıvı
A
2
2
3
Sıvı
A
3
3
3
4
5
4
X3
A Kristalleri
(Açık renk)
B Kristalleri
(Koyu renk)
5
Proötektik A
Ötektik Yapı
Ötektik A
Ötektik B
Sıvı
Sıvı
B
4
5
Ötektik A
Ötektik B
Proötektik B
Ötektik A
Ötektik B
ÖTEKTİK YAPI
Ötektik reaksiyon; sıvı fazın ani olarak iki ayrı katı faza
dönüşmesi reaksiyonudur.
Ötektik reaksiyon:
Sıvı
(Katı) + (Katı)
Soğuma
Ötektik nokta
Ötektik
Sıcaklık
Ötektik noktadan uzaklaştıkça, ötektik reaksiyon,
dönüşüm öncesi var olan sıvı faz kadar
gerçekleşir.
Katılaşma sırasında çekirdeklenme
“A” kristal taneleri
(Açık renk)
birçok noktadan başlar.
Bu çekirdekler tabaka şeklinde
büyürler.
Birbirlerine temas etmeleri ile ince
ve tabakalı yapı meydana gelir.
Çekirdeklenme
ne
kadar
çok
noktadan meydana gelmişse yapı o
kadar ince tabakalı (veya küçük
taneli) olacaktır.
“B” kristal taneleri
(Koyu renk)
Fö = C – P + 1 = 2 – 3 + 1 = 0
ÖTEKTİK YAPI
Ötektik reaksiyon ile oluşan katı faz.
– Lamelli (tabakalar şeklinde paketlenmiş)
– Nodüler (matris faz içerisinde küresel diğer fazın bulunması)
Lamelli yapıda iki katı faz birbiri üzerine paketlenmiş tabakalar şeklindedir. Her bir
tabaka bir tanedir.
1
2
Lamelli
Yapı
Nodular
Yapı
SINIRLI ÇÖZÜNME
Alaşım sistemlerinin çoğunda görülür.
B elementi A’nın içerisinde sınırlı olarak çözünebilir. Oda sıcaklığında X1 kadar, sıcaklık
arttıkça (ötektik sıcaklıkta) X2 kadar çözünebilir.
Sıcaklıkla ısıl aktivasyon artar ve boşluk miktarı artar.
Aynı şekilde A elementi B içerisinde sınırlı miktarda çözünebilir.
Oda sıcaklığında X3 kadar, sıcaklık arttıkça (ötektik sıcaklıkta) X4 kadar çözünebilir.
(Sıcaklıkla ısıl aktivasyon artar ve boşluk miktarı artar).
fazı: Katı
Çözelti
fazı:
2. Faz ve Katı
çözelti
Çözeltiye giremeyen yabancı atomlar
kendilerinin çoğunlukta olduğu yeni atom
düzeni (faz) oluştururlar.
A’nın çoğunlukta olduğu katı çözelti fazını
oluşturur,
B’nin çoğunlukta olduğu katı çözelti fazını
oluşturur.
Fiziksel ve kimyasal özellikleri farklı olan iki
katı faz ve aynı yapıda bir arada
bulunabilir.
Ötektik
Bileşim
Ötektik altı bileşim
(hypo)
Xö
Ötektik üstü bileşim
(hyper)
S
TA
TB
Ötektik
Bileşim
Ötektik
Sıcaklık
+S
Xö
S+
+
X1
X2
%B
X4 X
3
FAZ DİYAGRAMLARI: Sınırlı Çözünme
TA
Tö
I II III IV
1
1•
1•
S
•
2 2
1•
T 2
3• •
2•
B
1• S+
3•
+S
3
2•
3•
4•
4•
5•
X1 X2
+
4•
3•
X3
Xö
%B
4
I
II
III
IV
1
1
1
2
2
2
3
3
3
4
4
5
( dan
ayrışan)
Ötektik
öncesi
Ötektik
Ötektik
Ötektik
öncesi
ÖTEKTOİD REAKSİYON
Soğuma sırasında bir katı fazdan iki ayrı katı fazın oluşması
reaksiyonudur.
Ötektoid reaksiyon:
(Katı)
Soğuma
(Katı) + (Katı)
TA
S
Tötektik
Tötektoid
+S
2•
Xötektoid
S+
+
1•
TB
+
%B
Xötektik
PERİTEKTİK VE PERİTEKTOİD REAKSİYON
Kısmi çözünürlük gösteren alaşım sistemlerinde elementlerin ergime sıcaklıklarının çok
farklı olması durumunda meydana gelen faz reaksiyonlarıdır.
Peritektik reaksiyon:
Sıvı + (Katı)
Peritektoid reaksiyon:
(Katı) + (Katı)
Soğuma
(Katı)
Soğuma
(Katı)
Peritektik reaksiyon:
Sıvı + (Katı)
Soğuma
(Katı)
Peritektoid reaksiyon:
(Katı) + (Katı)
Soğuma
(Katı)
ARAFAZLAR VE METALLERARASI BİLEŞİKLER
Faz diyagramlarının birden fazla reaksiyon içermeleri durumunda görülür.
Arafazın tekbir kimyasal bileşik olması durumunda metaller arası fazlar söz konusudur.
Metaller arası fazlar çok sert ve gevrek malzemelerdir.
Arafazlar
Metallerarası bileşikler
Sıcaklık (oC)
DEMİR KARBON FAZ DİYAGRAMI
Tötektik
Tötektoid
Fe3C: Sementit
: Ferrit
: Ostenit
%C: ağırlık olarak
ÖRNEK
1150 oC, 920 oC, 750 oC, 450 oC ve 300
o
C’lerde yatay çizgiler vardır.
1150oC: δ + L γ, peritektik
920oC: L1 γ + L2 a monotektik
750oC: L γ + β, a ötektik
450oC: γ α + β, a ötektoid
300oC: α + β μ or a peritektoid
Yukarıda verilen faz diyagramında bulunan 3 adet farklı faz reaksiyonlarını tespit ediniz.
(c)2003 Brooks/Cole, a division of Thomson Learning, Inc
Sıcaklık (oC)
DEMİR KARBON FAZ DİYAGRAMI
Tötektik
Tötektoid
Fe3C: Sementit
: Ferrit
: Ostenit
%C: ağırlık olarak
DEMİR SEMENTİT FAZ DİYAGRAMI
%C(sementit)
Sementit; demir karbon faz
diyagramında metallerarası
bir bileşiktir.
Pratikte Fe-C diyagramında
sementite kadar olan bölge
önemlidir.
Sementit; %6,67 C
konsantrasyonuna sahiptir.
Atom ağrılıkları dikkate
alındığında; Fe:56, C:12.
C
12
6.67
3xFe C 3x55 12
Fe/C ve Fe/Fe3C FAZ DİYAGRAMI
Sıcaklık (oC)
Fe/Fe3C FAZ DİYAGRAMI
1148oC
Tötektik
Tötektoid
Fe3C: Sementit
: Ferrit
:
Ostenit
:
Delta demir
%C: ağırlık olarak
DEMİR SEMENTİT FAZ DİYAGRAMI
+S
S
Çelik
Tötektik
Ledeburit
1148oC
Perlit
(ostenit)
+S
Dökme demir
%C: ağırlık olarak
Sementit : Fe3C
Ferrit :
Perlit : + Fe3C
Ostenit:
Delta demir:
Ledeburit.
Tötektoid
ÇELİK İÇİN ÖNEMLİ SICAKLIKLAR
A1 sıcaklığı: Ötektoid reaksiyon sıcaklığı
A2 sıcaklığı: Küri sıcaklığı (769oC). Bu sıcaklıkta manyetiklik kaybolur.
A3 sıcaklığı: Ötektoid altı çeliklerde tam ostenit alanına geçiş sıcaklığı (C oranına bağlı
olarak değişir)
Acm sıcaklığı: Ötektoid üstü çeliklerde tam ostenit alanına geçiş sıcaklığı (C oranına bağlı
olarak değişir)
A3
+
Acm
+Fe3C
A1
+Fe3C
ÇELİK
Çelik; %2’ye kadar C içeren demir alaşımına verilen isimdir.
Otektoit çelik; %0,8 C içeren çeliğe ötektoit çelik adı verilir.
Bu kompozisyonun altındaki çeliklere ötektoit altı çelikler (C oranı < %0,8), bu
bileşimden daha fazla C içeren çeliklere ötektoid üstü çelikler (C oranı > %0,8) adı
verilir.
C oranının %2’yi geçmesi durumunda malzeme artık çelik olarak değil, dökme demir
(cast iron) olarak adlandırılır.
ÇELİK
Perlit: Ötektoit reaksiyon sonrası -Fe ve Fe3C tarafından oluşturulan özel yapıya
verilen isimdir.
C miktarı %0,8 iken (ötektoit çelik) %100 perlitik
yapı elde edilir.
C miktarı sıfıra doğru azaldıkça, perlit azalır, ferrit
(-Fe) artar.
C miktarı %0,8’in üzerinde arttıkça, perlit miktarı
azalır, sementit miktarı artar.
(ferrit) taneleri
(Açık renk)
Sementit taneleri
(Koyu renk)
I
II
I
5
1
2
Perlit
+ 12
3
4
3
Otektoit
Bileşim
III
1
2
3
4
+Fe3C
II
III
Sementit
5
Perlit
Perlit
+ Perlit
%100 Perlit
+
γ +Fe3C
Perlit +Fe3C
Otektoit Bileşim
DÖKME DEMİR
C içeriği %2 den daha fazla olan demir-karbon alaşımıdır.
Artan karbon oranı yapıyı kırılgan hale getirir.
Sıvı fazdan katılaşması sırasında soğuma hızlarına bağlı olarak farklı iç yapılara sahip
olabilir.
Hızlı soğuma: Beyaz dökme demir.
Yavaş soğuma: Kır dökme demir (ferritik, ferritik/perlitik, perlitik).
Temper dökme demir: BDD’in tavlanması ile.
Küresel dökme demir: Mg, Ce gibi grafiti küreselleştiren alaşım elementleri katılması
ile.
BEYAZ DD
Katılaşma (Sıvı fazdan katıya dönüşme) sırasında soğuma hızı
yüksek tutulursa Beyaz DD elde edilir. Bu yapıda sementit
baskındır dolayısıyla sert ve gevrektir.
KIR DÖKME DEMİR
Sıvı fazdan çok yavaş soğuma ile karbon difüzyonla bir araya toplanarak lamelli bir yapı
oluşturur.
Ferritik kır dökme demir : Çok yavaş soğuma hızı.
Ferritik-perlitik kır dökme demir : Biraz daha hızlı olması durumunda.
Perlitik kır dökme demir: Daha hızlı olması durumunda oluşur.
Perlit oranı arttıkça dayanım artar.
Tüm durumlarda süneklik çok kötüdür.
Lamelli yapıda keskin uçların oluşturduğu çentik etkisi nedeniyle mekanik özellikler çok
kötüdür.
Grafit Lameller
Perlitik DD
Ferritik DD
Ferritik-Perlitik DD
Artan Soğuma Hızı
Perlit
KIR DÖKME DEMİR
Grafitin dayanımı demirin yanında ihmal edilebilecek kadar küçüktür.
Dolayısıyla grafit bölgeler boşluk gibi davranır.
Bir de keskin köşelerin oluşturduğu çentik etkisi ilave olunca yapı çok gevrek-kırılgan
davranır.
Dolayısı ile kır DD’ler genelde basmaya karşı zorlanan parçalarda kullanılır. Çekme
zorlanmaları olan yerlerde kullanılmaz.
Lameller
TEMPER VE KÜRESEL GRAFİTLİ DD
Lamellerin mekanik özelliklere olumsuz etkisini ortadan kaldırmak
amacıyla grafitlerdeki keskin kenarları ortadan kaldırmak amacıyla
bazı işlemlere tabi tutulur.
TEMPER DÖKME DEMİR (TDD)
Temper DD: Hızlı soğuma ile elde edilen beyaz dökme demir yaklaşık 950 oC’de uzun süre
(48 saat) tavlanır ve sementit yapı içerisindeki kararsız karbon bir araya toplanarak temper
grafiti denilen topak halinde yapılar meydana getirir. Bu yapıda süneklik %10’a kadar
artabilir.
Soğuma hızına göre Ferritik TDD, Ferritik-perlitik TDD ve Perlitik TDD şeklinde 3 farklı TDD
elde edilebilir.
Temper grafiti
Perlitik TDD
Ferritik TDD
Perlit
Ferritik-Perlitik TDD
Artan Soğuma Hızı
KÜRESEL DÖKME DEMİR (KDD)
Eriyik DD içerisine Mg ve Sb gibi grafitleri küreselleştiren alaşım elementleri katılır. Bu
şekilde oluşan grafitler küresel şekillidir ve süneklik %20’lere kadar artar. Soğuma hızına
göre Ferritik KDD, Ferritik-perlitik KDD ve Perlitik KDD şeklinde 3 farklı KDD elde
edilebilir.
Küresel grafit
Perlitik KDD
Ferritik KDD
Ferritik-Perlitik KDD
Artan Soğuma Hızı
Perlit
EKLER
Segregasyon:
Malzemede
kompozisyon
farklılıklarının
bulunmasıdır. Katılaşma sırasındaki
yetersiz difüzyon nedeniyle genelde
ortaya çıkar.
Dengesiz katılaşmanın oluşturduğu
uniform
olmayan
kompozisyon
segregasyonun gelişmesini veya
dentrit kolları arasında kısa mesafede
oluşan ve göbek olarak bilinen mikro
segregasyonu göstermektedir.
Katı eriyik alaşımlarının katılaşması
sırasında dentritik büyüme ısısal alt
soğuma/aşırı
soğuma
olmadığı
durumda bile tipik olarak meydana
gelir.
Coring:
Döküm
ürünlerde
kimyasal
segregasyondur.
Mikrosegregasyonveya dentritler
arası segregasyon olarak da bilinir.
Homojenizasyon Isıl İşlemi:
Dengesiz katılaşma esnasındaki
mikrosegregasyonları
azaltmak
için uygulanan ısıl işlemdir.
Makrosegregasyon:
Dengesiz
katılaşma sonucu malzemede
uzun
mesafelerde
görülen
kompozisyon farklarıdır.
Sprey atomizasyon: Seramik
uçlar /nozzle kullanılarak ergimiş
alaşım
veya
metallerin
püskürtülmesidir.
Sıcak Yırtılma: Mikrosegregasyon sıcak yırtılmaya veya
denge solidüs altındaki sıcaklıklarda düşük ergime
noktalı dentritler arası malzemenin ergimesine neden
olabilir.
Homojenizasyon: Sıcak yırtılma problemleri ve dentritler
arası segregasyon, homojenizasyon ısıl işlemi
uygulanarak azaltılabilir.
Makrosegregasyon: Makrosegregasyon merkez ve yüzey
arasında, geniş bir mesafe üzerinde olur.