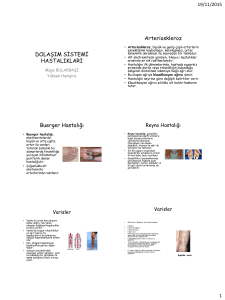
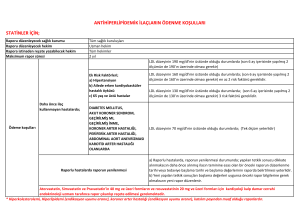
akut miyokard infarktüsü geçirenlerde ötiroid hasta sendromu
advertisement

T.C. BAŞBAKANLIK VAKIFLAR GENEL MÜDÜRLÜĞÜ BEZM-İ ALEM VAKIF GUREBA EĞİTİM HASTANESİ AİLE HEKİMLİĞİ KLİNİĞİ KOORDİNATÖR : DOÇ.DR.TUFAN TÜKEK AKUT MİYOKARD İNFARKTÜSÜ GEÇİRENLERDE ÖTİROİD HASTA SENDROMU SIKLIĞININ ARAŞTIRILMASI UZMANLIK TEZİ DR. İBRAHİM ELİK İSTANBUL,2007 1 İÇİNDEKİLER 1.ÖNSÖZ …………………………………………...1 2.GİRİŞ….. ………………………………………. ..2 3.GENEL BİLGİLER……………………………...4 4.MATERYAL VE METOD……………………..64 5.BULGULAR…….. …... ………………………...65 6.TARTIŞMA …………………………………….72 7.ÖZET …………………………………………....74 8.KAYNAKLAR ……………………………........75 2 ÖNSÖZ Bezm-i Alem Valide Sultan Vakıf Gureba Eğitim ve Araştırma Hastanesindeki asistanlık eğitimimde emeği geçen Aile Hekimliği Koordinatörü II.Dahiliye Klinik Şefi Doç. Dr. Tufan TÜKEK’e, I. Dahiliye Klinik Şefi Kardiyolog Dr. Nail ERHAN’ a, Kardiyolog Dr. Tülin KURT’a, I. ve II. Dahiliye Kliniğindeki Uzman Doktorlara, Asistanlara, Hemşire ve Personeline, Çocuk Sağlığı ve Hastalıkları Klinik Şef Yrd. Uzman Dr. Özgül YİĞİT’ e ve diğer Uzmanlara, Asistanlara, Hemşire ve Personeline, III. Genel Cerrahi Servisi Klinik Şefi Doç.Dr.Rıza Kutaniş’e,Uzman Dr, Asistan ve Personeline, Kadın Hastalıkları ve Doğum Kliniğindeki Uzman Doktorlar, Asistan, Ebe, Hemşire ve Personeline ,Psikiyatri Klinik Şefi Doç.Dr.Sefa Saygılı’ya,Uzman Dr,Asistan ve Personeline, Tezimin Hazırlanmasında yardımlarını esirgemeyen Göğüs Kalp Damar Cerrahisi Kliniğindeki Uzman Dr. Sedat ZİYADE’ ye, Koroner Yoğun Bakım Ünitesinde başta Hemşire Zerafet Hanım olmak üzere Tüm Hemşire ve Personeline, Uzman Dr. M. Ali ÇIKRIKÇIOĞLU’ na, kaynakların çevirisinde yardımcı olan M. Erdem ŞENEL’ e ve Kardeşine, Tezimin hazırlanmasında, yazılmasında gece gündüz demeden çalışan, emek veren Veysel SİN kardeşime, sevgili eşime ve aileme sonsuz teşekkür ederim. DR.İBRAHİM ELİK 3 GİRİŞ VE AMAÇ Koroner kalp hastalığı gelişmiş ülkelerde olduğu gibi ülkemizde de mortalite ve morbilite açısından değerlendirildiğinde ilk sırada yer almaktadır.A.B.D.’de günümüzde 60 milyon erişkinde aterosklerotik kardiyovasküler hastalık vardır ve bu durum yıllık ölümlerin %42’sinden sorumludur.Neyse ki hastalığın katastrofik yüküne rağmen, son 10 yıl içinde bir çok kişide uygun yaşam tarzı ve ilaç müdahaleleri ile aterosklerozun ilerleyişinin yavaşlatılabileceğini veya geri dönüştürülebileceğini gösteren bulgular ortaya çıkmıştır. Günümüzde görülen kardiyovasküler hastalık epidemisinin kaynağı,1700’ler de endüstrileşme dönemine uzanır. Bundan büyük ölçüde sorumlu üç faktör,tütün ürünlerinin kullanımında artış,fiziksel aktivitenin azalması ve yağ,kalori ve kolesterolden zengin diyetin benimsenmesidir. Kardiyovasküler hastalığının yükselen akımı 20. yüzyıla kadar sürmüş ama,Framingham çalışmasının verileri kardiyovasküler hastalık için sigara,hipertansiyon ve hiperkolesterolemi gibi bazı modifiye edilebilir faktörleri tanımladığı zaman gerilemeye başlamıştır.(1) Kardiyovasküler hastalığa bağlı ölüm sayısı,batı dünyasında 1964’ten 1965’e kadar en yüksek seviyeye çıkmıştır.Yapılan son çalışmalar tüm dünyada kardiyovasküler hastalıklar dan ölüm oranını 1990 ve 2020 yılları arasında %28,9’dan %36,3’e yükseleceğini göstermektedir.(2) kardiyovasküler hastalığa bağlı kadın ölüm oranları 1984 de erkek ölüm oranlarını geçmiştir ve son 30 yıl içinde azalma göstermiştir.(3) Her yıl Amerika Birleşik Devletlerinde yaklaşık 1 milyon kişi akut miyokard infaktüsü geçirmektedir.(4) Koroner arter hastalığı genellikle orta yaşlarda görülür. Miyokard infaktüsünün yaklaşık %45’i 65 yaş altı hastalardan meydana gelirken;Koroner alter hastalığından ölen erkeklerin %37’si,kadınların ise %29’u 55 yaşın altındadır.(5) Ülkemizde Türk Kardiyoloji Derneğinin öncülüğünde 1990’dan beri yürütülen TEKHARF(Türk Erişkinlerde Kalp Hastalığı ve Risk Faktörleri) çalışmasının 12 yıllık izlem verilerine göre, Türkiye de 2.0 milyon koroner kalp hastasının bulunduğu ve bu sayının her yıl 90 bin civarında arttığı saptanmıştır.(6) Kalp hastalığına bağlı ölümlerde ise son bir yılda 92 bin’i erkek 61 bin’i kadın olmak üzere toplam 153 bin kişinin hayatını kaybettiği tahmin ediliyor.(7) TEKHARF Çalışması erişkinlerimizde yıllık Koroner kalp hastalığı mortalitesini erkeklede %0,52 ,kadınlarda ise %0,32 olarak bulmuştur. Nedeni bilinen ölümler arasında Koroner kalp hastalığına bağlı ölüm %42,5’lık bir pay ile başı çekmiş onu %24’lük oranda kanser ve %12’lik bir oranda serebrovasküler olay nedenli ölümler izlemiştir.(7) Avrupa ülkelerinde koroner kalp hastalığından yıllık mortalitenin 45-74 yaş kesiminde erkeklerde %0,2 ile 0,9 kadınlarda %0,06 ile 0,03 arasında değiştiği bildirilmiştir. Halbuki TEKHARF Çalışması ülkemizde aynı yaş kesiminde koroner kalp hastalığı mortalitesini erkeklerde %0,85 kadınlarda %0,45 olarak belirlemiştir. Koroner mortalite açısından Avrupa ülkeleri arasında erkeklerde Letonya ve Estonya’dan sonra 3. sırada kadınlarda ise 1. sırada yer almaktadır. Nüfusumuz gelişmekte olan ülkelerde ki gibi genç yapıda iken, toplumumuzda koroner hastalık mortalitesinin yaşlı nüfus yapısına sahip gelişmiş toplumlarda ki kadar yüksek olması, hem günümüz hem de gelecek için kaygı vericidir. Bu olumsuz eğilim devam ettiği takdirde 2010 yılına kadar halen 2 milyon civarında olan koroner kalp hastası sayısının 1.4 milyon artarak 3.4 milyon kişiye ulaşacağı öngörülmektedir.(8) Yakın gelecekte,3. dünya ülkelerinde,aterosklerotik kardiyovasküler hastalığına bağlı ölüm,önde gelen ölüm nedeni olarak infeksiyonun yerini alacaktır.(9) Tiroid hastalıklarının kardiyovasküler sistem üzerindeki etkileri birçok araştırmacı tarafından incelenmiştir. Bu çalışmalar tiroid hormon seviyelerindeki düşük veya yüksek değerlerin kardiyovasküler sistem üzerinde çeşitli olumsuz etkilerini ortaya koymuştur. 4 Artmış tiroid hormonlarının periferik hemodinamik etkileri, vasküler rezistansda azalma şeklindedir. Hipotiroidik hastalarda ise artmış vasküler direnç gözlenir ve bu hastalarda izlenen tansiyon yüksekliği tiroid hormon tedavisinin başlaması ile tedrici bir azalma gösterir. Hipertiroidili hastalarda hiperadrenerjik durumdaki hastalara benzer klinik bulgular gözlemlenirken hipotiroidili hastalarda da azalmış adrenerjik tonus ile uyumlu semptomlar gözlenir. Tiroid hormonlarının plazma lipid seviyeleri üzerinde de etkileri bulunmaktadır. Hemen hemen tüm hastalıklar serum tiroid hormon düzeylerini etkileyebilirler; enfeksiyonlar, sepsis, travma, kronik dejeneratif hastalıklar, diabetes melitus gibi metabolik hastalıklar, beslenme yetersizliği, açlık bunların başlıcaları sayılabilir. Yapılan bir çalışmada hastanede yatan hastaların %25 il %50’sinde (Bermudes ve Arkadaşları 1975), diğer bir çalışmaya göre %40-70’inde (Kaplan ve Arkadaşları 1982), gerçek bir tiroid patolojisi olmadığı halde tiroid hormonlarının bir yada birkaçında sapma olduğu gösterilmiştir. Tiroid hastalığı olmaksızın tiroid hormonlarında görülen bu bozukluklara ‘’ euthyroid sick syndrome ‘’(ESS) denilmektedir. Bizlerde bu çalışmamızda Akut Miyokard Enfarktüsü geçiren hastalarda ötiroid hasta sendromu(ÖHS) sıklığını araştırdık. 5 GENEL BİLGİLER ATEROSKLEROZ Ateroskleroz, batı dünyasında en sık ölüm nedenidir ve ciddi morbiditeye neden olur. Dünya Sağlık Örgütü(WHO), Aterosklerozun yakın gelecekte tüm dünyada da, mortalitenin birinci nedeni olabileceğini bildirmiştir.(10) Ateroskleroz, elastik arterlerin(aorta,karotis ve iliak arterler) ve büyük ve orta büyüklükteki müsküler arterlerin(koroner ve popliteal arterler) hastalığıdır, buna karşılık daha küçük arterler nadiren etkilenirler. Ateroskleroz, damar duvarının kalınlaşması ve esnekliğinin kaybolmasıyla karakterize arteriyel hastalık grubunun bir parçasıdır. Bu hastalıklar için kullanılan ortak terim arterlerin sertleşmesi anlamına gelen ‘’Arteriyoskleroz’’dur. Bu gruptaki diğer hastalıklar, küçük arterler ve arteriyollerin duvarlarında hyalen kalınlaşma ve proliferasyon ile beliren arteriyoloskleroz ve müsküler arterlerin media tabakasının kalsifikasyonu ile karakterize olan Mönckeberg’in medial kalsifik sklerozudur. Ateroskleroz, arteriyosklerozun en sık görülen ve en önemli formudur ve bu iki terim bazen aynı anlamda kullanılır.(11) Ateroskleroz arter intimasında plazmadan kaynaklanan aterojenik lipopotein birikmesine karşı karmaşık bir inflamatuar-fibroproliperatif cevaptır.(12-13) Aterosklerozun belli bir genetik altyapı ve riske sahip kişilerde risk faktörlerinin etkisiyle ortaya çıkan bir hastalık olduğu, eskiden düşünüldüğü gibi kaçınılmaz dejeneratif bir hastalık olmadığı anlaşılmıştır.(14) Bazı kişiler ateroskleroza diğerlerinden daha çok yatkındırlar. Aynı durum aynı kişide farklı arter segmentleri için de geçerlidir. Ateroskleroz aort, iliofemoral, koroner, karotis(bifürkasyon) ve daha az oranda intrakranial arterleri içeren büyük ve orta çaplı arterlerin fokal intimal hastalığıdır. Altta yatan mediada ve adventisyada özellikle hastalığın ileri dönemlerinde değişiklikler oluşabilir. Bilinmeyen nedenlerle bazı arterler(internal mammarian arter gibi) ateroskleroza oldukça dirençlidir. Epikardiyal koroner arterler vücutta ateroskleroza en yatkın damarlar olmasına karşın, intramiyokardiyal arterler ateroskleroza oldukça dirençlidir.(15) Aterosklerozun hastalık süreci primer olarak arter duvarının intima tabakasına sınırlıdır. Bu tabaka, lipidler ve enflamatuar hücreler tarafından infiltre olur,değişik derecelerde fibrozis gelişir.(16) Bu gözlem, aterosklerozun en azından kısmen damar tamiri ile ilgili yanıtların aktivasyonuna bağlı olduğu düşüncesine neden olmuştur. Arteriyel travma, medial düz kas hücrelerinin, intima içine göç eden, fibroblasta benzer tamir hücrelerine fenotipik modülasyonunu içeren bir iyileşme reaksiyonu başlatır.Bu hücreler, intima içinde prolifere olur ve ekstraselüler matriks’i oluştururlar. Zarar damarın içinden de gelse, dışından da gelse, bu reaksiyon aynıdır. Arteriyel tamir sürecinin hemen hemen tamamen intima tabakası içinde gelişmesinin nedeni bilinmemektedir, ama daha uygun mekanik özellikler buna neden olabilir. Travmaya vasküler yanıt ve ateroskleroz arasındaki benzerliklerin ışığında, Ross ve Glomset 1976’da, ateroskleroz patogenezi için ‘’hasara yanıt’’ hipotezini öne sürmüşlerdir.(17) Bu hipotezin bazı yönleri, yıllar içinde değişmiş olmasına rağmen, genel kavram günümüzde yaygın olarak kabul görmüştür. Lipoprotein kaynaklı lipidlerin ve özellikle oksidatif olarak modifiye olan lipidlerin biikmesinin arteri hasara uğrattığına ve düz kas hücresine bağımlı tamir sürecini başlattığına inanılmaktadır.(18) Bu durum, diğer iyileşme reaksiyonlarında görülen skar dokusuna benzeyen intimal plakların oluşmasına yol açar. İyileşme reaksiyonları, sürekli travma ile engellendiği zaman, skar dokusu çoğunlukla hipertrofiye uğrar. Bu durum, aterosklerotik plakların gerilemek yerine(vasküler iyileşme yanıtının normal koşullarda gelişmesine izin verildiğinde plaklar geriler.) neden büyümeye devam ettiklerinide açıklayabilir. 6 Aterosklerotik süreç belirgin olarak intimada lokalize olmasına rağmen, arter duvarının diğer tabakalarıda hastalıktan etkilenir. Plakların arkasındaki media tabakasında çoğunlukla düz kas hücresi kaybı ile birlikte atrofi görülür. Bu durum, media tabakasındaki hücrelere besin desteğinin azalmasına ve medial düz kas hücrelerinin bir çoğunun intimaya göç etmiş olduğu gerçeğine bağlı olabilir. Medial atrofinin sonucu olarak arter dilate olur. Ancak, son dönemden önce bile, mediada remodeling oluşur ve plakla uyum sağlamak için damar genişler ve böylece lümenin boyutları korunmuş olur. Sonuç olarak, arter, ciddi ateroskleroz gelişmiş olmasına rağmen, anjiyografik değerlendirmede önemli bir problem oluşturur. Genel olarak, anjiyografide bir plak görüldüğünde, bunun yeni bir plak değil, ‘’buz dağının görünen kısmı’’ olduğu düşünülür. Ateroskleroz, arterleri düzenli bir şekilde tutmaz : Fokal bir hastalıktır. ‘’ Plak ‘’ terimi, otopside,aorta yüzeyini kaplayan nokta şeklindeki lezyonları tarif eden patolog tarafından kullanılmıştır. Hastalığın fokal olma özelliği, ateroskleroz gelişmesi açısından, hiperlipidemi, hipertansiyon,sigara ve diyabet gibi çoğu risk faktörlerinin sistemik olması ve arteryel sistemin tüm bölümlerini benzer şekilde etkileyebilme olasılığı ile ters düşmektedir. Bu durum, sistemik risk faktörlerinin lokal faktörlerle uyum içinde etki etmesi gerektiğini açık bir şekilde göstermektedir. Bu lokal faktörlerden biri, kan akımı tarafından oluşturulan shear strestir. Aterosklerotik plaklar, arteryel sistem içinde tesadüfi olarak gelişmezler. Daha çok lümen yüzeyi ile düşük dansiteli lipoprotein (LDL) gibi kandaki partüküller arasında etkileşim süresinin artmış olduğu, düşük shear stresi bulunan dallanma bölgelerine yakın yerlerde yerleşirler. Bu durum, lipoproteinlerin transendotelyal diffüzyonunda artışla ve hiperlipidemi varlığında subendotelyal matriks’te lipid birikiminde artışla ilişkilidir.(19) Vasküler permeabilite üzerinde etkisi olabilecek diğer bir risk faktörü, homosisteinemidir, çünkü homosisteinin yüksek konsantrasyonları, endotel tabakasındaki hücrelerde hasara neden olabilir. Son zamanlarda dikkatler, mikroorganizmaların aterosklerozdaki rolü üzerinde toplanmıştır. Bazı epidemiyolojik çalışmalar, Chlamydia Pneumoniae enfeksiyonu ve kardivasküler hastalıkla arasında bir ilişki otaya koymuştur.(20) Operasyon esnasında alınan vasküler örneklerin incelenmesi, tüm aterosklerotik plakların %50-75’ inde C.Pneumoniae varlığını göstermektedir.(21). Bu mikroorganizmaların lokal etkisinin,plak gelişimine katkıda bulunabilmesi ve hastalığın fokal özelliğinin bir açıklamasını oluşturması olasıdır. Aterosklerozun klinik semptomları, plak gelişimi ve büyümesinden ziyade, oluşmuş plakların dejenerasyonu ve rüptürü ile ilişkilidir. Lipid birikimi ve fibrosizle birlikte plak gelişimi, nadiren, kan akımını önemli ölçüde sınırlayacak derecede büyük lezyonlara neden olur (%75’den fazla lümen daralması). Bu durumda bile, koroner arterlerde oluştuğunda, plağın yavaş oluşumu, küçük kollateral damarların oluşması için yeterli zaman sağlamış olur. Akut miyokard enfaktüsü ve kararsız anjina vakalarında, plaklar hemen her zaman, rüptüre olmuş lezyonlar üzerinde trombüs oluşumuna atfedilirler. Bazen seri anjiyografilerde gözlenen hızlı plak oluşumu da muhtemelen plağın rüptürü ve bunu takiben fissür iyileşmesi ve trombüsün ve diğer kan hücrelerinin enkapsülasyonuna bağlıdır. Buna uygun olarak, bilinen koroner arter hastalığı olan hastalarda, ateroskleroz tedavisi, primer olarak plak stabilizasyonu üzerinde odaklanmalıdır. Lipid düşürücü maddeler(statinler) kullanılan çalışmalardan elde edilen deneyimler, plak stabilizasyonunun kardiyovasküler olayların azalmasından sorumlu majör bir faktör olabileceğini de göstermektedir. 7 ARTER DUVARININ ANATOMİSİ VE HÜCRE YAPISI Normal arterin çok basit bir anatomisi vardır. Üç ayrı tabakadan oluşur: Arter duvarı ve dolaşan kan arasında bariyer oluşturan tunika intima; kalın kas tabakası olan tunika media; ve çevredeki organların bağ dokusuyla birleşen ve bağ dokusu tabakası olan tunika adventisya.(22) Tunika media arter duvarının en geniş tabakasıdır. Tek bir hücre tipinden, vasküler düz kas hücresinden oluşmuştur. Vasküler düz kas hücresi, arterin hücre kitlesinin büyük kısmını ve medianın ekstraselüler matriks bileşenlerini oluşturur. Düz kas hücreleri, birbirlerine birleşme yeri kompleksleri ile yapışan uzun hücrelerdir. Bu hücreler, dairesel tabakalar şeklinde organize olmuştur ve arter lümenini konsantrik daireler şeklinde çevrelerler. Çok miktarda elastik lifler oluştururlar ve bu lifler, kas hücre tabakaları arasında lameller oluştururlar. Bu nedenle, mediada çok tabakalı bir organizasyon vardır: iki elastik lamel, bir düz kas hücresi tabakasını çevreler ve bir lameller üniteyi oluşturur. Aorta gibi elastik arterlerde böyle 20-50 lameller ünite, tunika medyayı oluşturur. Daha küçük musküler arterlerde, düz kas hücre tabakaları ve elastik lifler görülmesine rağmen, organizasyon daha az gelişmiştir. En dıştaki elastik lamel, kalın bir elastik membran olan lamina elastika eksternayı oluşturur ve bu membran media ve adventisya arasındaki sınırı belirler. Benzer şekilde, en içteki elastik lamel olan lamina elastika interna kalındır ve media ve intima arasındaki sınırı oluşturur. Adventisya ,çevredeki bağ dokusu stroması içine devam eden,bir bağ dokusu yapısıdır. İç kısmı fibrözdür ve ön planda kollajen ve elastinden oluşur,ama media tabakasından uzaklaştıkça ,bunların yerini gevşek bağ dokusu alır. Adventisya,liflere ek olarak fibroblastlar,mast hücreleri ,adipositler ve sempatik sinir uçlarını içerir. Aynı zamanda,medianın 1/3 dış kısmına penetre olan kan ve lenf damarlarınıda taşır. Normal arterde ,medianın iç kısmı ve tüm intima avaskülerdir. Ancak ,ateroskleroz gibi patolojik durumlarda ,anjiojenik faktörler,intimaya kadar yayılan neovaskülarizasyonu uyarırlar. İntima ,endotelyum denen sürekli tek hücre tabakası ,bunun bazal membranı ve az miktarda pirimitif mezenkimal hücrelerle birlikte olan bir bağ dokusu tabakasından oluşur. Yenidoğanda ,bu tabaka sadece birkaç mikrometre genişliğindedir. Ancak ,bu tabakada,yaşam boyunca ilerleyici intimal kalınlaşma olur ve erişkin aortasında,birkaç yüz mikrometre kalınlıkta olabilir. Bu durum,bağ dokusu lifleri ,proteoglikanlar ve mezenkimal hücrelerin sürekli birikmesine bağlıdır. Mezenkimal hücrelerin,kontraktilite kapasitesini ve fibroblast olarak fonksiyonunu kaybetmiş(bağ dokusu elemanları üreterek) ‘’modifiye’’ düz kas hücreleri olduğu düşünülmektedir. İntima kalınlığında artışa bağlı ‘’yastıklar’’ ve arteryel dezorganizasyon,arteryel ağacın dallanma noktalarında bulunur. Burada endotel tabakasında permeabilite artmıştır ve proliferasyon hızı daha yüksektir. İntima kalınlaşmıştır,medianın lameller organizasyonu bozulmuştur ve düz kas hücreleri daha yüksek hızla prolifere olmaktadır. Bu bölgeler ,hücre bölünmesi ve doku yenilenmesi açısından önemli bölgelerdir ve vasküler kök hücreleri içerebilirler. Ancak artmış hemodinamik zorlanmaya karşı, doku yanıtınıda yansıtabilirler, çünkü çoğunlukla akımın bozulduğu bölgelerde bozulurlar. Ateosklerotik lezyonların anatomik dağılımının, intimal yastıkların anatomik dağılımı ile aynı olması dikkat çekicidir. Yastıkların lezyon oluşumu için substrat oluşturup oluşturmadığı veya yastık oluşumunu uyaran aynı faktörlerin(hemodinamik zorlanma) aterosklerozu da uyarıp uyarmadığı bilinmemektedir.(23) 8 ARTER DUVARININ HÜCRELERİ Endotel Hücreleri Endotelyum hücresi, bariyer oluşturmak ve kan-arter permeabilitesini kontrol etmek üzere özelleşmiş, ince-uzun bir epitel hücresidir. Stoplazması, hücreden dışarı penetre olan pinositotik veziküllerle doludur. Yan yana duran endotelyum hücreleri arasındaki sınırlar, mekanik gücü arttıran ve makromoleküler permeabiliteyi kontrol eden özel yapıları olan bileşke kompleksleri şeklinde gelişmiştir. Arterler ve venlerin ve kapillerlerin çoğunun endotelyum hücreleri bu bileşke bölgeleri ile birbirine sıkı şekilde bağlı olan sürekli bir poligonal hücre tabakası oluştururlar. Bunlar, embriyonal olarak, pimitif endotelyum keseleri ve tüpleri ile bilikte kan adacıkları oluşturan hemanjiyopoetik kök hücrelerinden gelişirler. Pimitif endotelyum, embriyonun tüm organlarına penetre olur, sürekli bir damar yapısı oluşturur ve lokal mezankimal hücreleri toplar. Lokal mezankimal hücreler, endotel tabakasındaki tüpleri çevreleyen düz kas hücrelerine dönüşür. Endotelyumun üç önemli fonksiyonu vardır: kan-doku permeabilitesini sağlamak, damar tonusunu kontrol etmek ve hemostaz ve enflamasyona göre damar yüzeyinin özelliklerini düzenlemek. transendotelyal permeabilite, hassas bir şekilde kontrol edilir ve moleküllerin büyüklüğü ve fizikokimyasal özelliklerine bağlıdır. Oksijen gibi küçük ve elektrik yükü taşımayan gaz molekülleri, endotelyumdan kolay difüze olur ve bir konsantrasyon gradyanı boyunca kandan ekstravasküler aralığa geçer. Glukoz gibi diğer birçok küçük moleküllerin, endotelyumdan serbest difüzyon açısından sınırlanmaları az miktardadır. Arterler ve venlerde, oksijen ve besin desteği, büyük ölçüde transendotelyal difüzyon yoluyla gerçekleşir. Bunun tersine, makromoleküller büyüklüklerine bağımlı olarak, endotelyum içine sadece sınırlı bir düzeyde penetre olurlar. Küçük proteinler, endotelyal yarıklardan geçebilirken, büyük proteinler ve partiküller endositotik veziküller yoluyla sadece subendotel aralığa ulaşabilirler. Lipoproteinler endotelyuma bu yolla penetre olan partiküllerdir; bunlar aterosklerozun başlatılmasında çok önemli bir rol oynarlar. Damar tonusu, arterin düz kas hücrelerinin kontraksiyon derecesi ile belirlenir. Ancak, endotelyum, düz kas hücre kontraktilitesini, parakrin vazoaktif mediyatörler salgılayarak kontrol eder. Bu mediyatörlerin en iyi şekilde tanımlanmış olanı, NO sentaz (bir endotelyal enzim) tarafından L-argininden oluşturulan inorganik bir gaz olan nitrik oksittir.(NO) Bu molekül,1980’lerde keşfedilmiştir.(lipopolisakkarit tarafından hazır hale getirilen makrofajlardan izole edilmiştir.)(24) Bu üretim, yapısal olarak gerçekleşir ama endotelyum hücresi içinde intraselüler kalsiyum düzeyi yükseldiği zaman, asetilkolin, bradikinin ve bazı diğer dolaşan mediyatörlerin etkisi sonucunda artar. Nitrik oksit, endotelyal plazma membranından difüze olur, ekstraselüller aralıktan geçer ve düz kas içinde enzimatik bir kaskadı aktive eder. Bu durum düz kasın gevşemesine ve damar tonusunun azalmasına yol açar. Diğer vazoaktif endotelyal faktörler bu etkinin tersine çalışırlar. Bu faktörler arasında, endotelyum hücresinde büyük bir prepro-endotelyum polipeptidi olarak taşınan ve endotelyum aktivasyonu esnasında proteolitik olarak işlem görerek, aktif endotelin-1’e dönüşen vazokonstiriktif peptid endotelin-1 vardır. Anjiyotensi-II de, endotelin-1 gibi düz kas hücrelerini kasar. Dolaşımda anjiyotensinojen olarak bulunur ve endotelyum hücreleri tarafından taşınan enzimler tarafından anjiyotensin-II’ e dönüştürülür. Endotelyum, hemostaza, enflamasyona ve damar tonusuna bağlı olarak aktif fonksiyonlar gösterir. Endotelyumun yüzeyi, trombosit adhezyonu, pıhtılaşma ve fibrinolizi regüle eden faktörler içerir. Bu faktörler, pıhtılaşma faktörü VIII kompleksinin bir elemanı olan von Willebrand faktörü, trombosit adhezyonunda rol oynayan yüzey moleküllve plazminojen aktivatörleri(doku ve ürokinaz tipi) ve bunların inhibitörü (plazminojen aktivatör 9 inhibitör-1) gibi fibrinolizi regüle eden faktörlerdir. Bu faktörlerin bazıları, özel intraselüler organeller olan Weibel-Palade cisimcikleri içinde depolanırlar. Hücre trombin veya diğer mediyatörler tarafından aktive olduğu zaman, bu organeller, içeriklerini endotel tabakasının hücre yüzeyine boşaltırlar. Benzer şekilde, endotelyum hücreleri, E-selektin ve interselüler adhezyon molekülü-1(ICAM-1) gibi, lökosit adhezyon moleküllerini, lökositlerin toplanmasını uyaran kemokinleri(monosit kemotaktik protein-1 ve interlökin-8) ve interlökin1 gibi immün hücreleri aktive edebilen sitokinleri taşıyarak, damar yüzeyinin enflamatuvar özelliklerini kontrol eder. Düz Kas Hücreleri Düz kas hücresi, arterlerde en fazla bulunan hücre tipidir(tüm hücrelerin % 95 ‘inden fazlasını oluşturur). Düz kas hücreleri, miyozin ve aktin filamanları içerir, ama kalp ve iskelet kasının çizgili kas hücrelerine göre, kontraktiliteleri daha az gelişmiştir.Vasküler düz kas hücresi özellikle primitiftir ve tonusunu değiştirebilme kapasitesini, damar duvarının geniş ekstraselüler matriksinin üreticisi olarak, fibroblasta benzer rol oynayabilmesi ile birleştirir. Düz kas hücreleri, embriyonal gelişim esnasında, lokal mezenkimden gelerek toplanırlar. Bu, muhtemelen, endotelyal etrafında dairesel bir tabaka oluşturmak için mezenkimal hücreleri uyaran, embriyonal endotelyumdan gelen moleküller bir sinyalle başlatılır. Erişkin arterinde, hemen hemen tüm düz kas hücreleri, medial tabakada bulunur. Bunlar birbirlerine sıkı ve boşluklu bileşkeler içeren, bileşke kompleksleri ile bağlıdır. Bu durum, düz kas tabakasının sadece gerilim kuvvetini artırmaz, aynı zamanda arteryel düz kas boyunca, hücreler arasında sinyal moleküllerinin hızlı transferini de sağlar. Düz kas hücrelerinin kontraktil aparatında, bir aktin izoformu olan alfa- SM aktinden oluşan aktin filamanları baskındır. Kontraktil filamanlar, birbiri ile bağlantılı olmasına ve ‘’yoğun cisimcikler ‘’ olarak adlandırılan özel yapıları oluşturmalarına rağmen, çizgili kasta olduğu kadar iyi gelişmemişlerdir ve bunlarda sarkomer gözlenmez. Bu durum, çizğili kasla karşılaştırıldığında düz kas hücresinin kontraksiyon kapasitesini azaltır. Artelyel ağacın büyük bölümünde, düz kas hücresinin kontraktil repertuarı, damar tonusundaki değişikliklerle sınırlıdır. Ancak, bu durum sadece kan basıncında dalgalanmalara izin vermez, aynı zamanda değişik organ ve dokuların perfüzyonunu kontrol eder. Düz kas tonusu, birkaç mekanizma ile regüle olur. Endotelyum tarafından lokal regülasyon, yukarıda denildiği gibi çok önemlidir. Ayrıca, çevre doku tarafından üretilen metabolitler, sempatik sinir uçlarından gelen otonom sinir kontrolü ve dolaşımdaki mediyatörler, düz kas tonusunu kontrol ederler. Bütün bu uyarılar birlikte damar tonusu, kan basıncı ve lokal perfüzyonu düzenlerler. Düz kas tarafından üretilen matriks, elastik ve kollagen lifler olmak üzere iki majör lif tipi ve gevşek bir proteoglikan ağı içeren temel maddeden oluşmuştur. Elastik lifler, damar mediasının mekanik özellikleri açısından özellikle önemlidir, buna karşılık kollegan intimada düz kas hücrelerinin majör sekretuvar bir ürünüdür. Düz kas hücreleri endotelyum hücreleri gibi, normalde bilinmeyen pasif hücrelerdir. Ancak, damar hasarı, medial düz kas hücrelerinin bölündüğü, intimaya göç ettiği ve sonra intimal kalınlaşma oluşturmak üzere tekrar tekrar bölündüğü proliferatif bir yanıtı ortaya çıkarır. Anjiyoplasti ve damar cerrahisi sonrasında gözlenen restenoza benzeyen bir süreç, büyüme faktörleri tarafından kontrol edilir.(25) Böylece, mediada ilk replikasyon, dokuda ekstraselüler depolardan salınan fibroblast büyüme faktörünün temel izoformu tarafından başlatılır. Daha sonra gerçekleşen göç ve devam eden proliferasyon, damar yüzeyindeki aktive trombositlerden, infilte etmiş olan monositlerden ve belli safhalarda, damar endotel tabakası ve düz kas hücrelerinin kendilerinden salınan, trombosit kaynaklı büyüme faktörü(PDGF) tarafından uyarılmaya bağlıdır. 10 İnfiltre eden lökositler ve diğer nonvasküler hücreler Makrofajlar, normal arterde hücre popülasyonunun küçük ama önemli bir kısmını oluşturur. Kan monositlerinden kaynaklanırlar, lökosit adhezyon molekülleriyle etkileşime girerek, endotelyuma girerler(muhtemelen hem luminal endotel tabakasına, hemde vasa vazorum endotel tabakasına) ve intima ve adventisyada yerleşirler. Arterde, makrofajlar kadar sık olmasa da, lenfositler de bulunurlar. T hücreleri, intima ve adventisyada bulunurlar, buna karşılık B hücreleri büyük ölçüde adventisyada sınırlı kalırlar. Periarteryel lenf düğümleri, normalde aorta ve majör dalları boyunca bulunurlar. Bunlar, arter duvarına penetre olan ve sonra arter duvarındaki lenf damarları tarafından lokal lenf düğümlerine taşınan, dolaşımdaki antijenler tarafından inmün aktivasyona olanak sağlarlar. Hematopoetik kök hücrelerinden kaynaklanan ve bağ dokusunda bulunan mast hücreleri, özellikle adventisya olmak üzere, arter duvarında da bulunular. Son olarak, adipositler, adventisyada sık bulunurlar ve arteri çevreleyen gevşek bağ dokusundaki majör hücre tipidir. Lokal fibroblastlardan kaynaklanırlar ve bunların sayı ve büyüklükleri, beslenme durumuna bağlıdır. ATEROSKLEROZUN HİSTOPATOLOJİSİ Uzun yıllar boyunca, patologlar tarafından yapılmış olan morfolojik incelemelerin ışığında, üç tip aterosklerotik plak tarif edilmiştir: • yağlı çizgilenmeler; • fibröz plaklar; ve • komplike lezyonlar. Yağlı çizgilenmeler, çok sayıda lipid damlacıkları ile dolu makrofajların intimada birikmesinden oluşurlar. Lipid damlacıkları, spesifik bir temizleyici reseptör ailesi tarafından alınan, okside olmuş veya toplanmış LDL’den kaynaklanan kolesterol esterlerinden oluşur. Makroskopik incelemede, kan akımı yönünü takip eden sarı çizgiler şeklinde görülür. Yağlı çizgilenmeler kan akımını etkilemezler. Fibröz plaklarda, lipidler, hem makrofaj köpük hücrelerinde, hemde ekstraselüler matriks içinde bulunurlar. İntima, düz kas hücreleri ve ekstraselüler matriks proteinlerinin birikmesine bağlı olarak kalınlaşmıştır. Lipidler ve makrofajlar, çoğunlukla, T lenfositleri ve bazen B lenfositleri ve mast hücrelerini de içeren çekirdek bölgesinde daha sık görülür. Düz kas hücreleri ve ekstraselüler matriks, subendotelyal bölgede daha fazla miktarda bulunur ve plağın daha derin olan bölümünde, lipid ve enflamatuvar hücreleri kaplayan fibröz bir şapka oluşturur. Koroner arterlerde, fibröz plaklar çoğunlukla damarın sadece bir kısmını kaplar. Fibröz plaklar,damar lümenini önemli derecede daraltacak kadar büyüseler bile,sağlam kaldıkları sürece ,majör klinik semptoma neden olmadıklarına inanılır.ancak fibröz plaklar,bir taraftan lipid ve enflamatuvar hücrelerin miktarı ile,diğer taraftan fibröz doku miktarı arasındaki dengeye bağlı olarak heterojendirler. İnce fibröz şapkası ve lipid ve enflamatuvar hücrelerden oluşan büyük bir çekirdeğe sahip olan plakların yırtılma riski yüksektir. Bu riskin, plağın büyüklüne bağlı olmadığı düşünülmektedir. Komplike lezyonlar, lipidler, enflamatuvar hücreler ve fibröz dokuya ek olarak, hematom veya kanama ve trombotik depozitler de içeren plaklardır.Komplike lezyonlar,daha çok fibröz plağın yırtılması sonucunda gelişirler.Diğer muhtemel bir neden , adventisyal vaza vazorumdan plağa giren kapillerde kanama olabilir,fibröz şapka ve luminal yüzeyde fissürler,erozyonlar ve ülserasyonlar,diğer sık görülen özelliklerdir.Koroner ateroskleroza 11 bağlı morbidite ve mortalite, esas olarak bu lezyonlara bağlıdır;daha yaşlı kişilerde bu lezyonlar,çoğunlukla kalsiyum depozitleri içerirler.Bu kalsiyum depozitlerinin patofizyolojik önemi belirgin değildir, ama bunlar plakları daha kırılgan ve gerilme stresine yanıt olarak yırtılmaya daha eğilimli hale getirebilirler. Bu değişik lezyon tiplerine hasara yanıt olarak,iyileşme reaksiyonları açısından bakmak yararlı olabilir. Bu açıdan bakıldığında ,intimada lipid birikiminin,vasküler hasar nedeni olarak,önemli bir rol oynadığı görülür.Makrofajların,başlangıçta intimada toplanması gerçeği,ekstraselüler matrikste,lipid birikimlerinin toksik etkilerine bağlı minör zararların varlığına işaret eder.Makrofaj uptake’i yoluyla,ekstraselüler lipidlerin uzaklaştırılması,bu zarara yanıt olarak etkili bir erken savunma mekanizmasını yansıtır.Bu savunmanın başarısız olması, fibröz plakların oluşmasına yol açar. Makrofajlar, toksik lipid ürünlerini uzaklaştıramazsa, sonuçta oluşan doku zararı, mediadaki düz kas hücrelerinin toplanmasını içeren bir tamir sürecini aktive edecektir. Başarılı bir tamir süreci , intima tabakasını koruyacaktır. Ancak,tamir süreci fonksiyonunu yerine getiremezse, plağın fibröz parçası kan akımının germe kuvvetlerine direnç gösteremeyecek derecede zayıf olacak ve yırtılacaktır. Aterosklerozun değişik hayvan modellerinden elde edilen deneyimler ve morfolojik özelliklerin ışığında,üç plak tipinin değişik ateroskleroz safhalarını yansıttığı ve kronolojik bir sıra ile,yağlı çizgilenmelerden fibröz plaklara ve sonuçta komplike lezyonlara gelişirler. Ancak ,aterosklerotik süreç ile ilgili bilgilerimiz artıkça,bu görüşün ,hastalığın karmaşık doğasını yeterli bir şekilde açıklamadığı ortaya çıkmıştır. Yağlı çizgilenmelerin sadece belli kısmının,daha ileri lezyonlara dönüşme riski vardır. Yırtılmaya yanıt olarak,plak özelliklerinde hızlı değişikliklerin,göz önünde tutulması gereken önemli klinik etkileri vardır. Amerikan Kalp Birliği Damar Lezyonları Komitesi ,lezyonun ilerleme sürecini sekiz değişik safhaya ayırana yeni bir sınıflama öne sürmüştür.(26) Bu terminoloji, aynı zamanda,damar duvarında,adaptif intima kalınlaşması gibi fizyolojik değişikliklerin rolünü de hesaba katmaktadır. İnsan arterlerinde,normalden hem ince,hem de kalın segmentler vardır. Bu farklılıklar,doğumda mevcuttur ve shear ve gerilim kuvvetlerinde fizyolojik varyasyonları yansıtır. Daha kalın intima segmentleri dalların yakınında bulunur ve adaptif intimal kalınlaşma olarak adlandırılır. Bunlar kendiliğinden gerileme gösterir ve hiçbir zaman kan akımını tıkamaz. Adaptif kalınlaşma kesitte, bifurkasyonun dış duvarının eksantrik, yarımay şeklinde artışı olarak görünür. Adaptif intima kalınlaşması, çok miktarda elastik lifler, kollagen ve düz kas hücreleri ile birlikte daha derin bir doku tabakasını kaplayan, seyrek düz kas hücreleri içeren subendotelyal, proteoglikandan zengin ekstraselüler bir matriks tabakasından oluşur. Adaptif, intimal kalınlaşmanın en kalın kısmı, bebeklikten itibaren medianın kalınlığının iki katı kadar olabilir ve bu nedenle yanlışlıkla ilerlemiş aterosklerotik lezyon olarak algılanabilir. Bu intimal kalınlaşmalar, normal fizyolojik adaptasyonunun bir sonucu olarak gerçekleşir ve aterosklerotik sürecin bir parçası olarak kabul edilmez. Ancak, aynı zamanda, intimal adaptif kalınlaşmalar, aterosklerotik lezyonların gelişmesi açısından özellikle duyarlı görünmektedirler. Tip I lezyon en erken lezyondur ve minör lipid birikimleri ve seyrek makrofaj köpük hücreleri ile karakterizedir. Koroner arterlerde, tip I lezyonlar, çoğunlukla adaptif intimal kalınlaşmalar ile bulunur. Bu durum, bu değişikliklere neden olan aynı gerilim faktörlerinin, aterosklerotik plakların oluşumu ile de ilişkili olduğunu gösterir. Doğumdan hemen sonra, bebeklerin %45’inde, tip I lezyon vardır. Bu lezyonlar, çocukluğun ilk yıllarında azalır, ama 10 yaş civarında tekrar artar. 12 Tip II lezyonda, makrofaj köpük hücreleri daha fazla sayıdadır ve klasik olarak yağlı çizgilenmeler şeklinde organize olmuşlardır. Tip II lezyonlarda, az miktarda T hücreleri, mast hücreleri ve lipidle dolu düz kas hücreleri de vardır. Adaptif intimal kalınlaşma içinde bulunduklarında köpük hücreleri, çoğunlukla iç elastik membrana yakın olan daha derin intima bölgelerinde görülürler. Tip II lezyonlar, çocuklarda nadir değildir ve uzun yıllar, bunların daha ilerlermiş lezyonlara dönüşüp dönüşemeyecekleri tartışma konusu olmuştur. Günümüzde, daha ilerlemiş lezyonların,’’tip IIa lezyonları’’ olarak isimlendiren, bir tip II lezyon alt popülasyonundan kaynaklandığı kabul edilmektedir. Bunlar, çoğunlukla lezyon gelişmesine eğimli olan belli bölgelerde bulunurlar ve adaptif intimal kalınlaşma olan segmentler, bu açıdan en yüksek riske sahiptir. Tip IIb lezyonlar, nisbeten ince intiması olan segmentlerde bulunur ve hiperlipidemi veya diğer risk faktörlerinin varlığında bile, nadiren daha ileri plaklara dönüşür. Tip III lezyon, klasik patoloji tarafından, aterosklerotik plak veya aterom olarak tanımlanan ilk safhayi yansıtır. Tip II lezyona göre en önemli ayırt edici özelliği, küçük ekstraselüler lipid depozitlerinin varlığıdır. Bu lipid, makrofajlar ve T hücrelerinin altında, lezyonun en derin bölgelerinde birikir. Lipid depozitleri, ekstraselüler matriks kompartmanını genişletir ve intimanın hücresel organizasyonunu bozar. Tip III lezyonlar, genç erişkinlerde, tip IIa lezyonların çocuklarda bulunduğu aynı bölgelerde bulunur. Tip III lezyonlann varlığının, gelecekteki klinik hastalığın göstergesi olduğuna inanılmaktadır. Tip IV lezyonlarda, ekstraselüler lipid miktarı artmış ve hücreden yoksun bir kolesterol depozit havuzu oluşmuştur. Lipid, hem dejenere olmuş, köpük hücrelerinden, hem de lipoprotein lipidlerin direkt birikiminden kaynaklanabilir. Eski sınıflandırmaya göre, hastalık artık ilerlemiş lezyon safhasına gelmiştir. Lipid çekirdeği, enflamatuvar hücreler tarafından çevrelenmiş ve ince bir düz kas hücre tabakası ve bağ dokusu tarafından kaplanmıştır. Adventisyal vaza vazorumdan kaynaklanan kapillerler, plağın daha derin kısımlarının içine doğru büyümeye başlar. Daha erken lezyonlarla uyumlu olarak, tip IV lezyonlar, baslangıçta adaptif intimal kalınlaşma bulunan aynı bölgelerde gelişirler. Tip IV lezyonlar, genellikle yarım ay şeklindedir ve damar duvaının kalanlığını artırırlar. Bu safhada orijinal lümen hacmini korumak için arter de yeniden yapılanma oluşur. Damarın dış kontürü oval şekil alır ve sonuç olarak bu lezyonlann, anjiyografi ile gorüntülenmeleri zordur. Tip IV lezyonlar, genellikle klinik olarak sessiz olmasına rağmen, bunların intravasküler ultrasonografi, MRI veya damar lezyonları için yüksek afiniteye sahip radyoaktif madde ile işaretlenmiş ligandlarla tanımlanması önemli olacaktır, çünkü bunların hızla semptom oluşturan yırtılmalara yol açma potansiyelleri vardır. Yeni yapılmış, anjiyogramda normal görünen bir koroner arterin bir bölümünde, tıkanıklık veya önemli stenoz geliştiği zaman, yırtılmış tip IV lezyonlarda, trombus oluşumu, en muhtemel açıklamadır. Tip V lezyonlar, lipid çekirdeği kaplayan fibröz dokuda artış ile karakterizedir. Bu fibrozis, prolifere olan ve kollagen ve proteoglikanlar gibi ekstraselüler matriks proteinlerini salgılayan düz kas hücreleri tarafından oluşturulur. Hayvan deneyleri, bu düz kas hücrelerinin, bazı hücrelerin fenotipik olarak fibroblasta benzer tamir hücrelerine dönüştüğü, media tabakasından geldiğini göstermektedir. Kontraktil düz kas hücrelerinin tersine, bu "sentetik" düz kas hücreleri, bol miktarda granüllü endoplazmik retikulum içerir, ama filaman demetleri içermez. Çoğu hayvanın tersine, insan arteryel intimasında, normalde az miktarda düz kas hücresi vardır. İnsanlarda, tip V lezyonlarda fibröz dokuyu oluşturan hücrelerin, media tabakasından mı, yoksa daha önceden mevcut intima hücrelerinden mi kaynaklandığı bilinmemektedir. Kollagen, çoğu zaman tip V lezyonların önde gelen özelliği olmaktadır ve plak hacminin çoğundan sorumlu olabilir. Kapillerlerin içeri doğru ilerlemesi de, tip IV lezyonlara göre daha ön plandadır. Tip V lezyonlar çoğunlukla çok büyüktür ve bu nedenle arterde remodeling ile kompensasyon gerçekleşemez. Sonuçta lümen daralır. Bu daralmaların kontürü düz kalır, ama genellikle anjiyografi ile saptanabilir. 13 Tip V lezyonlar, tip IV lezyonlara göre daha fazla fibröz doku içermelerine rağmen, yırtılmaların çoğu halen bu lezyon tipinde gerçekleşir. Yırtılmaya eğilimli tip V lezyonlarda, tipik olarak plakla çevredeki normal intima arasındaki sinir bölgesinde, ince bir fibröz doku tabakası vardır. Bu bölge, düz kas hücre ölümünde artış ve ekstraselüler matriksin enflamatuvar hücreler tarafından degradasyonu ile karakterizedir. Tip V lezyonlar, genellikle lümeni istila ettiği ve laminar kan akımını bozduğu için, gerilim kuvvetlerine daha fazla maruz kalırlar. Tip VI lezyonlar, trombotik depozitler veya kanama içeren plaklardır. Tip VI lezyonun gelişmesinin temel nedeni plak yırtılmasıdır ve subendotelyal fibröz dokuda fissürler, erozyonlar ve ülserasyonlar sık olarak gözlenir. Tip VI lezyonların, vaza vazorumdan plak içine ulaşan kapillerlerde kanama sonucunda olması muhtemeldir. ama bu muhtemelen daha az sık görülür. Akut miyokard enfarktüs ve kararsız anjina gibi klinik olaylar, birkaç istisna dışında tip VI lezyona bağlıdır. Ancak, tip VI lezyonların gelişmesi, klinik semptom olmaksızın da gerçekleşebilir. Koroner aterosklerozu olup nonkardiyak nedenlere bağlı olarak ölen kişilerin otopsi incelemelerinde, hipertansiyon ve diyabeti olanların %16'sında ve bu faktörlere sahip olmayanlann %8'inde, yeni gelişmiş plak içi trombus varlığı görülmüştür. 30-59 yaşlar arasındaki bir popülasyonda yapılan başka bir çalışmada. aortada ilerlemiş lezyonları olanların %38'inde, lezyonların yüzeyinde trombuslar vardı. Yırtılmıs bir plağın üzerinde oluşan trombusun çoğu, fibrinolitik sistem tarafindan uzaklaştırılabilir, ama materyalin bir kısmı plağın içine geçebilir. Bu süreç, anjiyografi ile birlikte görülebilen, hızlı plak ilerleyişi vakalarının çoğundan sorumludur. Trombotik materyal, yavaş yavaş düz kas hücreleri tarafından kolonize olur ve bu hücreler, trombotik materyali fibröz dokuya dönüştürür. Bu iyileşme sürecinin sonucu olarak, lezyon tip V morfolojisine geri döner. Tip VII ve tip VIII lezyonlar, lipid içermeyen veya az miktarda lipid içeren, kalsiyum depozit kitleleri içeren (tip VII lezyonlar) veya ön planda kollagenden oluşan (tip VIII lezyonlar) ilerlemiş lezyonlardır. Bu lezyonların, hastalığın son safhasını yansıttığına inanılmaktadır. Kalsifikasyon yaşla ilişkili bir kavramdır ve 70 yaşın üzerindeki kişilerde, koroner arterlerde yaygın olarak bulunur. Kalsifikasyon daha önceden mevcut olan dokuda oluştuğu için, genellikle plak gelişimine katkıda bulunmaz. Plak kalsifikasyonunun klinik önemi belirgin değildir, ama lezyonlan daha az elastik ve gerilim kuvvetlerine karşı daha duyarlı hale getirir. Tip VIII lezyonlar, tip V ve VI lezyonlara gore daha stabildir. Tip V ve VI lezyonlar, tip VIII lezyonlara dönüştürülebilse, klinik açıdan büyük kazanç sağlanmış olurdu. Anjiyografik end-point kullanan. lipid düşürücü müdahale çalışmaları, kardiyovasküler olaylar üzerindeki yararlı etkilerin, plak büyüklüğü üzerinde az miktardaki etkiye bakılarak beklenilenden çok daha fazla olduğunu göstermiştir. Bu gözlem, lipid düşürücü tedavinin etkisinin, plak gerilemesinden ziyade, plak stabilizasyonu olduğunu göstermektedir. Bu bilgi, statinlerin plak lipidlerini ve enflamasyonu azalttığını ve plak kollagen içeriğini artırdığını gösteren yeni çalışmalarla da desteklenmiştir.(27) 14 Temel Ateroskleroz Süreci. Plazmadaki düşük dansiteli lipoprotein (LDL) intimaya girer, modifiye olur ve endotelde monosit migrasyonuyla sonuçlanan değişiklikleri başlatır.Intimada daha da fazla okside olan LDL, makrofajlar tarafından aktif biçimde alındığında köpük hücreleri oluşur. Makrofaj ölümüyle, lipidler serbest kalarak çekirdeği oluşturur. Endotel hücreleri ve makrofajlar tarafından salınan büyüme faktörleri, düz kas hücresinde büyümeyi ve bağ dokusu matriksinde sentezi uyarırlar. ATEROSKLEROZUN PATOGENEZİ TARİHSEL ZEMİN Aterosklerotik lezyonların oluşma ve gelişme mekanizmaları, bilim adamlarını 150 yıldan beri şaşırtmıştır. Alman patolog Rudolf Virchow 1856'da,aterosklerozun, plazma komponentleri (lipidleri de içeren) arter duvarında enflamatuvar bir yanıt ortaya çıkardığı zaman geliştiğini öne sürmüştü. Diğer bir patolog, Von Rokitansky, aterosklerotik lezyonun, arterlerin yüzeylerindeki trombusların organizasyonu ile oluştuğunu öne sürmüştü. Son yüzyılın ilk yıllarında, St Petersburg'da, Anitsjkov, aterosklerotik plaklarda büyük lipid depozitlerini gözlemlediği, kolesterolun ateroskleroza neden olabileceğini öne sürdüğü ve tavşanları kolesterol ile besleyerek (insanlarda görülene benzer aterosklerotik lezyonlara neden oldu)bu düşünceyi test ettiği zaman, bulmacaya majör bir parça eklenmişti. Birkaç yıl sonra, iki Rus araştırmacı Starokadomskij ve Sobolev, aortada mekanik zararın, ateroskleroza benzeyen intimal lezyonlara neden olduğunu gösterdiler. Bu, Virchov'un hipotezine uyuyordu, çünkü zarar plazma komponentlerinin arteri infilte etmesini arttıracaktı. 1950’lerde, Florey ve arkadaşları, deendotelizan zararın, lipid ve makrofajların arterde birikimini arttırdığını göstererek, bu gözlemlerin bazılarını birbiriyle birleştirmişlerdir.(28) Moleküler tıbbın gelişmesi ile, ateroskleroz patogenezi için, daha spesifik hipotezler belirtmek olası hale gelmiştir. Ross ve arkadaşları 1974'de, arteryal zararın, trombositlerden ve/veya diğer hürcelerden lokal PDGF salınımına neden olduğunu öne sürmüştür.(29)Bu durum, düz kas populasyonunda proliferatif bir yanıtı başlatabilir ve ateroskleroza yol açabilir. Benditt tarafından öne sürülen alternatif bir hipoteze gore, ateroskleroz, selim bir tümörde görülene benzer şekilde, kontrolsüz düz kas hücre proliferasyonuna bağlıdır.(30) Brown ve Goldstein’in LDL reseptörlerini ve kolesterol metabolizmasının mekanizmasını(31) keşfetmesi, "kolesterol hipotezi"nin, etkin farmakolojik ve genetik araçlarla 15 test edilmesine olanak sağlamıştır. Deneysel modellerde ve insanlarda, serum kolesterolü (özellikle LDL kolesterolü) ve aterosklerozun derecesi arasında direkt bir korelasyon oldugu açık bir şekilde gösterilmişir.. Bu bulgularla. ateroskleroz patogenezi ile ilgili her hipotezin, bu hastalıkta kolesterolun rolünü açıklamaya çalışması gerektigi ortaya çıkmıştır. Gen silinmesi veya inaktivasyonu (knockout) uygulanmiş sıçanlarda, lipid metabolizması bozukluklarına dayalı, yeni genetik hastalık modelleri, patogenez basamaklarının ayrıntılı olarak incelenmesine olanak sağlamış ve son 10 yıl içinde aterosklerozun anlaşılmasında çok önemli ilerlemelere yol açmıştır.(32) ATEROSKLEROZ: GÜNCEL BİR HİPOTEZ İnsanlardaki lezyonlarm incelenmesi, hastalık sürecine katılan molekülleri ve hücreleri tanımlamıştır. Genetik sıçan modellerindeki yeni gelişmeler, böyle spesifik faktorlerin, aterosklerotik lezyonlarm oluşmasında ve ilerleyişindeki rolünün test edilmesine olanak sağlamıştır. Ancak, aterogenezde çok önemli olabilen belli faktörler (bazı büyüme faktörleri ve adhezyon molekülleri) bu şekilde incelenemez, çünkü bu faktörleri kodlayan genlerin defektleri yaşamla bağdaşmaz. Gen silinmesi (knockout) teknolojisindeki yeni ilerlemeler, belli bir zaman noktasında ve/veya belli bir dokuda, gen defekti indüksiyonuna olanak sağlar; bu metodlann kullanımı, bu konu ile ilgili bilgilerimizin artmasma neden olacaktır. Düşük dansiteli lipoprotein birikmesi ve modifikasyonu Hiperkolesterolemi gibi proaterogenik uyarılara maruz kalan deney hayvanında, ilk saptanan değişiklikler, subendotelyal intimada, kan kaynaklı lipidlerin ve endotelyum yüzeyinde lökosit adhezyon moleküllerinin görülmesidir. Plazmada LDL düzeyleri yükseldiği zaman, çok miktarda LDL endotelyumdan geçerek intimaya gider. Transendotelyal permeabilitenin arttığı, arteryel ağacın dallanma bölgelerinde, bu süreç hızlanır. LDL'nin intimadan eliminasyonu sınırlıdır, çünkü bu bölgede mikrodamarlar eksiktir. Bu nedenle, LDL ekstraselüler matriks içinde tutulur. Matriksin proteoglikanlarının LDL'ye afinitesi vardır. Böylece, LDL matrikse bağlanır ve LDL havuzu oluşur.(33) LDL, intimada, agregasyon, oksidasyon ve LDL komponentlerinin degradasyonunu içeren bir seri modifikasyona uğrar. Bunlar, LDL partikülü üzerine oksitadif bir saldırı ile açıklanabilir (muhtemelen doku makrofajlarında oluşturulan oksijen radikalleri yoluyla).(34) Ancak, kanda LDL'yi oksidasyondan koruyan antioksidanların, intimada aynı süreci neden önleyemediği bilinmemektedir. Enflamatuvar hücrelerin toplanması LDL'nin oksidasyonu. lizofosfatidilkolin gibi modifiye lipidlerin salınımına yol açar. Bu lipid türlerinin bazıları. endotelyum hücrelerini aktive eden sinyal molekülleri olarak rol oynayabilir.(35) Bu durum, lökosit adhezyon molekülü olan, damar hücresi adhezyon molekulü-1’in(VCAM-1) ekspresyonuna yol açar. VCAM-1, monositler ve T lenfositleri için bir reseptördür.(36) Böyle hücreler, bir "karşı reseptör" olan, çok geç aktivasyon molekülü-4ü (VLA-4) taşırlar. VLA-4, damar yüzeyindeki belli matriks moleküllerine ve VCAM-l'e bağlanabilir. VCAM-1’in bağlanması, diğer adhezyon moleküllerinin etkileşimleri ile uyumlu olarak, monositlerin ve T hücrelerinin, lipid birikim ve modifikasyon bölgelerinde, endotelyal yüzeye yapışmasına yol açar. Kemokinler(kemotaktik sitokinler), makrofajlar, endotelyal hücreler ve düz kas hücreleri tarafından üretilir. Mekanizması tam olarak açıklanamamış olmasına rağmen, bunların indüksiyonu, lipid birikimi ve oksidasyonu ile ilişkilidir.(37) Ayrıca, okside kolesterol agregatları, kemotaktik sinyalleri de üreten, kompleman aktivasyonunu uyarır.(38) Her iki uyarı, mononükleer hücrelerin, endotel tabakasının interselüler yarıklarından, subendotelyal intima içine göçünü başlatabilir. 16 Lipid dışında diğer uyarıların. endotelyumu aktive etmesi ve intimaya lökositlerin toplanmasını başlatması olasıdır. Özellikle, hücre hasar esnasında görülen ısı şok proteinlerinin, endotelyumu aktive ettiği ve monositlerin ve T hücrelerinin girişini başlattğı gösterilmiştir.(39) İl-ginç bir sekilde, bu ısı şok proteinleri ile immünizasyon, aterosklerozu şiddetlendirir. Intimada, monositler makrofajlara dönüşür. Bu süreç, aktive damar hücreleri tarafından üretilen sitokin monosit koloni uyarıcı faktör (M-CSF) tarafindan başlatılır. Monosit, aktive makrofajın nisbeten pasif bir proformu oldugu için, diferansiyasyon süreci, patoloji açısından çok önemlidir. Bu durum, M-CSF eksik olan sıçanlarda, hiperkolesterolemiye maruz kalmalarına veya ateroskleroza eğilimli sıçanlarla birleştirilmelerine rağmen, ateroskleroz gelişmediği gözlemi ile ortaya konmaktadır.(40) Köpük hücre oluşumu Makrofaj, aterosklerotik lezyonun oluşmasında çok önemli büyük rol oynar. Okside lipoproteinleri içine alma kapasitesi nedeniyle, kolesterolü biriktirir ve lipid dolu köpük hücresine dönüştürür. Köpük hücresi, aterosklerozun prototip hücresidir. Lipoprotein reseptorleri ve kolesterol metabolizması ile ilgili keşifleri nedeniyle Nobel ödülü almış olan Brown ve Goldstein, makrofajların, önemli miktarda normal, yerli LDL almadığını gözlemişlerdi. Ancak, temizleyici reseptorler yoluyla, büyük miktarlarda okside LDL'i içlerine alabiliyorlardı.(34,41) Bu hücre yüzey reseptorleri, birikmiş negatif yük içeren "makromoleküler şekiller"i tanıyorlardı; böyle şekiller, okside LDL'de bulunurlar, ama bakteri endotoksinleri ve diğer bazi makromoleküllerde de bulunabilirler.(42) Böyle ligandlar, temizleyici reseptörlere bağlanırlar, lizozomların içine alınır ve parçalanırlar. Okside LDL'de bulunan kolesterol esterleri, hidrolize olur ve serbest kolesterol sitoplazma içine kaçar. Sitozolik enzimler tarafından yeniden esterifiye olur ve kolesterol ester havuzu, makrofaj içinde, intraselüler damlacıklar oluşturmaya başlar. Okside LDL'nin alımının devam etmesi ile makrofaj, lipid yüklü köpük hücresine dönüşene kadar, bu lipid damlacıkları birikir. Yağlı çizgilenme, esasen sağlam endotelyumda, köpük hücrelerinin bir miktar T hücresi ve ekstraselüler kolesterolle (büyük ölçüde lipoproteinler) birlikte birikmesidir. SR-A, SR-B1. MARCO, CD reseptörleri ve diğerlerini içeren temizleyici reseptör ailesi, evolüsyon esnasında, okside LDL ile savaşmaktan ziyade, bizi endotoksinemiden korumak için gelişmiş olabilir(42) ve makrofaj yüzeyindeki temizleyici reseptörlerin sayısı, intraselüler kolesterol içeriği tarafından kontrol edilmez. Bu nedenle, makrofaj, sitoplazmasi kolesterol esteri ile yüklü olana kadar, okside LDL'i içine almaya devam edecektir. Ancak, temizleyici reseptörler, immün sistemin sitokinleri ve kolesterol dışında diğer metabolik faktörler tarafından regüle edilirler.(43,44) Genel olarak, enflamatuvar sitokinler, reseptör düzeylerini azaltma eğilimindedirler, buna karşılık makrofaj gelişimi ve diferansiyasyonunu uyaran sitokinler, reseptor düzeylerini artırır. Bu durum, dikkatimizin, yağlı çizgilenmenin enflamatuvar/immün yönlerine odaklanmasına neden olmaktadır. 17 ATEROSKLEROZ İNDÜKSİYON HİPOTEZİ OLUŞAN LEZYONDA T HÜCRELERİ VE İMMÜN REAKSİYONLAR Antijenler ve immun aktivasyon T hücreleri, makrofajlar gibi, arteryel intimaya, aktive olmuş endotelyuma bağlandıktan sonra girerler. Hemen hemen tüm T hücreleri, hafıza/efektör tip hücrelerdir (lenfoid organlarda, antijenle daha önce tanışmışlardır).(45) Tanıdıkları antijen bulunursa, T hücreleri, oluşan lezyonun içinde, yeniden aktive olabilirler. Ayrıca, antijen sunan hücrelere gereksinim vardır, çünkü B hücrelerinin tersine, T hücreleri, serbest, çözünebilir antijenleri tanıyamazlar. Antijenin parçalanmış, ve majör histokompatibilite kompleksi (MHC) moleküllerine bağlanmış şekilde sunulmasına gereksinim duyarlar. Plakta, antijen sunumu, büyük ölçüde, antijenin makrofajlar tarafından alınmasından sonra oluşur. Makrofajlar, MHC sınıf II moleküllerine (insanlarda, HLA-DR, DQ ve DP) bağlı antijen parçalarını sunarlar. Bu antijen-MHC kompleksleri, plakta önde gelen T-hücre tipi olan CD4+ T hücreleri tarafından tanınır.(46) Tanınma, intraselüler sinyallerin zincir şeklinde bir reaksiyonu olan aktivasyona neden olur. Bu durum, otokrin büyüme faktörlerinin üretimi, DNA sentezi, T hücre bölünmesi, sitokinlerin salınması ve bazı vakalarda, sitotoksik özelliklerin gelişmesine neden olur. Aşağıda tartışıldığı gibi, sitokinler, antijenin tanınmasını etkili mekanizmalara dönüştürür. İnsanda, T hücrelerinin plaktan izole edilmesi ve klonlanması, bunların önemli bir bölümünün okside LDL'i tanıdığını göstermiştir.(47) Bu nedenle, LDL, oksidasyonla otoantijene dönüşen bir endojen partikül olarak kabul edilebilir. Okside LDL'e karşı antikorlar, aterosklerozu olan hastalarda ve hastalığın deneysel modellerinde, yüksek titrelerde bulunur. Ancak, antikor titrelerinin, hastalığın ilerleyiş derecesini gösterip göstermediği bilinmemektedir. Ateroskleroz için, okside LDL'e ek olarak, diğer bazı aday antijenler öne sürülmüştür.(46) Isı şok proteini 60, Chlamydia pneumoniae proteinleri ve okside LDL gibi bazıları, sadece T-hücre bağımlı antijenler olarak görev yapmazlar, aynı zamanda enflamasyonu başlatmak üzere direkt olarak makrofajlar üzerinde etki ederler. ''Ateroantijenler"in bu ikili etkisi, hastalığın ilerleyişi açısından önemli olabilir. 18 İmmün sitokinler ve efektör mekanizmalar Aktivasyondan sonra üretilen T-hücre sitokinleri, makrofajları, endotelyal ve düz kas hücrelerini aktive eden proenflamatuvar sitokinlerdir, ama aynı zamanda, enflamasyonu baskılayabilir ve fibrozisi başlatabilirler. Değişik T-hücre alt grupları, farklı fonksiyonel yanıtlara yol açan, farklı sitokin grupları üretirler. İnsan plağında, T hücrelerinin çoğu, makrofaj aktivasyonu ve enflamasyona neden olan Th1 tipindedir.(48) En önemli Thl sitokini, önemli vasküler aktivitesi bulunan interferon-gamma'dır.(46) Adhezyon moleküllerinin eksprese edilmesi için endotelyum hücrelerini aktive eder, prokoagülan aktiviteyi başlatır, düz kas hücrelerinin kollagen ve aktin yapmasını baskılar ve damar duvarında hücre bölünmesini kontrol eder. En önemlisi, interferon-gamma’nın, majör makrofaj aktive edici sitokin olmasıdır. Fagositozu arttırmak üzere, makrofajı uyarır, tümor nekroz faktörü-alfa (TNF-alfa) ve interlökin-1 gibi enflamatuvar sitokinleri salgılar, proteolitik enzimleri açığa çıkarır ve büyük miktarlarda toksik oksijen ve NO radikalleri üretir. Ayrıca, TNF-alfa, prokoagülan aktiviteyi uyarır ve endotelyum yüzeyinde, fibrinolitik ve antifibrinolitik faktörler arasındaki dengeyi değiştirir.(49) Bütün bu etkiler, aterosklerozu uyarır ve interferon-gamma'nın, transplante edilmiş organlarda gelişen, özel arteriyoskleroz formuna neden olan, majör sitokin olduğu düşünülmektedir.(50) Proenflamatuvar Thl efektör aktivitesine karşı, Th2 ve Th3 sistemleri vardır. Th2 sitokinler, allerjik reaksiyonlara neden olur. buna karşılık Th3 sitokin (transforming büyüme faktörü beta), enflamasyonu baskılar ve fibrozisi başlatır. Farklı gruplar arasındaki denge, değişik organlarda, enflamatuvar hastalığın seyri esnasında zamanla ve konağın metabolik durumu ile değişir. Bu, antijen düzeylerine, antijenin sunulduğu koşullara ve interlökin-10 ve interlökin-12 gibi immün regülator sitokinlerin varlığına veya yokluğuna bağlıdır. İnterlökin12, proenflamatuvar immün yanıtları başlatabileceği aterosklerotik plaklarda saptanmıştır.(51) Sitokinler, çözünebilir, hormon benzeri maddeler olmalarına rağmen, aterogenez esnasında, hücreden hücreye sinyal verilmesinde, bazı hücre yüzeyi faktörleri de önemli olabilir. CD40, makrofajlar, B hücreleri ve damar hücreleri üzerinde bulunan bir hücre yüzey reseptörüdür. T hücreleri üzerinde bulunan (bazı koşullarda damar hücreleri tarafından da taşınır) diğer bir yüzey proteini olan, CD40 ligandina bağlanır. Etkileşim, immün aktivasyona yol açar. Oluşmakta olan aterosklerotik lezyonda gerçekleştiği zaman, hastalığın ilerleyişi için önemli bir itici kuvvettir ve proenflamatuvar hücreler gibi etki eder.(52) Belli immün yanıtlar, proaterogeneik olmaktan ziyade koruyucu olabilirler. Okside LDL ile immünizasyon, bazı hayvan modellerinde, aterosklerozu baskılar.(53) Bu paradoksik etki, anti-enflamatuvar veya damar koruyucu sitokinlerin uyarılmasına ve/veya koruyucu antikorların üretimine bağlı olabilir. İmmün aktiviteyi kontrol eden bazı terapötik yaklaşımlar, hayvan modellerinde, aterosklerozu inhibe etmek için, başarılı bir şekilde kullanılmıştır. Bu uygulamalar, poliklonal immünglobülinlerin 47 ve antiCD40L antikorlarının kullanılması(52) ve okside LDL ile immünizasyondur.(53) YAĞLI ÇİZGİLENMEDEN ATEROSKLEROTİK PLAĞA İLERLEYİŞ Yağlı çizgilenmenin klinik önemi yoktur. Ancak, bazı yağlı çizgilenmeler, gerçek aterosklerotik, fibrin ve yağ içeren plaklara dönüşürler. Bu durum, karakteristik olarak, hemodinamik zorlanma bölgelerinde olur. Düz kas hücreleri, subendotelyal aralığa göç ederler, bölünürler ve ekstraselüler matriksi sentezlerler. Sonuçta, lezyonun lipid dolu çekirdeğini, endotelyal yüzeyden ayıran, fibröz bir şapka oluşur. Bu şapka, çevresinde kendi matriksinin kalın tabakaları bulunan, fibrosite benzer, uzun düz kas hücrelerinden oluşur. Fibroz şapka oluşumunu başlatan uyarılar, muhtemelen düz kas aktivasyonunu uyararak etki ederler.(16) Bundan sonra, hücre göçü ve proliferasyonu ve hücrelerin kollagen 19 ve proteoglikan sentezi devam edecektir. Plakların fokal lokalizasyonu ışığında, arter duvarındaki lokal faktörlerin, düz kas hücrelerini aktive etmesi olasıdır. Büyüme faktörleri üzerinde durulmuştur ve vasküler zarar modellerinden elde edilen veriler, temel fibroblast büyüme faktöru (bFGF) ve PDGF'nin, in vivo olarak, pasif arteryel düz kas hücrelerinin proliferasyonunu uyarabildiğini göstermiştir. Ayrıca, PDGF, düz kas hücreleri için kemotaktik bir faktör olarak rol oynar. PDGF, arteryel ekstraselüler matrikste depolanır ve zarardan sonra salınabilir, buna karşılık endotelyal hücrelerde, PDGF'nin ekspresyonu, PDGF düzenleyicisinde, shear stres yanıt elemanı yoluyla, akım değişikliklerine bağlı olarak artabilir.(54) Hematopoetik hücreler, PDGF'de açığa çıkarabilirler ve özellikle trombositler ve makrofajlar, bu büyüme faktörü için önemli kaynaklar olabilir. Deneysel modellerde, hastalığın bu safhasında, defektlerin trombosit mikrotrombusları ile kaplandığı, endotelyum hasarı gözlenmiştir. Makrofajın PDGF'i salgılaması, aktivasyonla başlar ve T hücreleri ve damar hücrelerinden kaynaklanan sitokinler tarafından kontrol edilir. Bu nedenle, yağlı çizgilenmeden fibröz plağa dönüşüm ile ilgili akla yakın bir senaryo, hemodinamik stresin ve/veya enflamatuvar aktivasyonun, trombositler ve/veya makrofajlardan PDGF salınımına neden olmasıdır. Bu durum, düz kas hücrelerinin göç etmesini, bölünmesini ve fibröz şapkayı oluşturmasını uyarır. Lipid çekirdek, fiziksel olarak endotelyal yüzeyden ayrılmıştır ve plak stabilize olmuştur. Bunun bedeli, arter lümeninin daralmasıdır. PLAK AKTİVASYONU VE KLİNİK SENDROMLARIN OLUŞUMU Lümen hacminin ilerleyici bir şekilde azalması, efor anjinası ve intermitan klodikasyon gibi klinik sendromlara yol açabilir, ama çok büyük plakların bile asemptomatik olabilmesi dikkat çekici bir durumdur. Akut klinik komplikasyonların gelişmesi, genellikle ek bir patogenetik olayın gerçekleşmesini (plak üzerinde trombus oluşumu) gerektirir.(55)Bu durum oluştuğunda, miyokard enfarktüsü gibi akut koroner sendromlar gözlenir. Diğer damar yataklarında, geçici serebral iskemik ataklar, beyin enfarktı ve akut iskemik gangren, plak trombozuna bağlıdır. Araştırmalar, akut iskeminin başlamasında trombozun rolünü ortaya koymuştur. Akut koroner sendrom bulunan hastalara, radyoaktif fibrinojen enjeksiyonu, taze koroner trombuslara inkorporasyonu göstermiştir ve koroner arterlerin histopatolojik olarak incelenmesi, "suçlu lezyonlar" üzerinde mural trombusların saptanmasına olanak sağlamıştır. Bu lezyonlarda, hemen hemen her zaman, yüzey hasarı bulgusu vardır: Bunların aşağı yukarı %80'inde, endotelyumdan geçerek plağa giden küçük fissürler vardır, buna karşılık kalan %20'sinde, endotelyal deskuamasyon bölgeleri vardır.(55) Bu yüzey defektleri, protrombik subendotelyal materyale maruz kalınmasına yol açar ve hızlı bir şekilde, trombozla sonuçlanır. Lezyonlann çoğunda bulunan yüzeysel fissürler, plak yırtılmasının göstergesi olarak kabul edilmiştir. Bu terim, tüm endotel duvarında yarılma anlamında değil, intimal plak yapısında veya bu yapının bir kısmında fissür anlamında kullanılır. Plak fissürü, endotelyal yüzeyden fibröz şapkaya doğru ilerler ve plağın lipid çekirdeğine kadar gider. Plaklar neden yırtılır? Önemli bir ipucu, aktive makrofajlar, T hücreleri ve mast hücrelerinin, yırtılma bölgesi civarında bol miktarda bulunduğunun gözlemlenmesidir.(56,57) Bu durum, yırtılmayı başlatan olayın, enflamatuvar bir mekanizma olduğuna işaret eder. Bu yorum, kararsız anjina gibi akut koroner sendromu bulunan hastalarda, dolaşımda, sitokinlerin ve aktive T hücrelerinin saptanması ile desteklenmiştir.(58) Daha sonra yapılan immünohistokimyasal, biyokimyasal ve hücre biyolojisi çalışmaları, plak aktivasyonu ve yırtılması ile ilgili bir senaryonun ortaya konmasına olanak sağlamıştır.(59) Bu hipoteze göre, plağın enflamatuvar hücreleri, proenflamatuvar lipidler, sitokinler, antijenler veya mikroplar tarafından aktive edilir. Ortaya çıkan immun/enflamatuvar aktivasyon, makrofaj aktivasyonu ile sonuçlanır. Bunun bir parçası olarak, makrofajlar, fibröz şapkanın kollagenini sindiren enzimler olan matriks metalloproteinazlarını salgılar. Enflamatuvar 20 bölgede bulunan proenflamatuvar sitokinler, kollagen gen ekspresyonunu baskılayarak, kollagen liflerinin yeniden kurulmasını önlerler. Bu sitokinler (özellikle interferon gamma ve TNF-alfa), fibröz şapkanın tamir mekanizmalarını yok edecek şekilde, düz kas proliferasyonunu ve aktin gen ekspresyonunu da baskılarlar. Makrofajlar tarafından salınan sitotoksik oksijen ve NO radikalleri, apopitotik hücre ölümüne neden olarak, sürece katkıda bulunurlar. Tüm bu olaylar, fibröz şapkanın gerilim kuvvetini, kan akımının mekanik stresine yenilecek derecede azaltır. Kan komponentleri, subendotelyuma maruz kaldıkları zaman, trombositler hemen aktive olur. Yüzeye yapışırlar ve kümelenmeye başlarlar. Yüzey reseptörleri, trombosit ve doku arasındaki bağlanmayı düzenler; bunlar, fibrinojeni bağlayan glikoprotein IIb/IIIa ve von Willebrand faktörünü bağlayan glikoprotein Ib'dir. Trombositten salınan ADP ve diğer faktörler, diğer trombositlerin aktivasyonunu uyarır ve trombosit membran yapılarının açığa çıkması, Humoral pıhtılaşma kaskadının aktivasyonunu başlatır. Humoral pıhtılaşma kaskadı, protein doku faktörü (tromboplastin) yüzeyde açığa çıktığı zaman başlar. Makrofajlarda, endotelyal hücrelerde ve düz kas hücrelerinde, proenflamatuvar sitokinler ve CD40 sistemi ile indüklenebilir. Böylece, enflamatuvar/immün aktivasyon, trombozu iki yolla başlatır: Plak yırtılmasına neden olarak ve doku faktörü ekspresyonunu indükleyerek. Humoral pıhtılaşma için, doku faktörüne ek olarak, membran fosfolipidleri ve von Willebrand-faktor VIII kompleksi gibi kofaktörler de önemlidir. Sonuçta, trombosit trombusunu çevreleyen ve stabilize eden bir fibrin pıhtısı oluşur. Solid trombus oluşumu ile, çoğunlukla akut koroner sendrom presipite olur. Ancak, kan ve damar duvarına bağlı savunma mekanizmaları, tromboza karşı gelebilir ve tam obstrüksiyonu önleyebilir veya ortadan kaldırabilir. Bu savunma mekanizmalarının en önemlisi, fibrinolitik sistemdir. Bu, plazminojen aktivatörleri (doku plazminojen aktivatorü ve ürokinaz tipi plazminojen aktivatörü; her ikisi de endotelyal hücrelerde görülebilir) tarafından aktive edilen proteolitik bir kaskaddır. Fibrinolizin bir inhibitorü olan, plazminojen aktivatör inhibitör-1 (PAI-1) de, endotelyal hücrelerde bulunur ve fibrinoliz ve antifibrinoliz arasındaki denge, trombus oluşumunun kontrolü açısından çok önemlidir. Plazminojen aktivatör ve PAI-1 genlerinin ekspresyonunu yöneten proenflamatuvar sitokinler, bu denge için, önemli düzenleyici faktörlerdir. Sessiz aterosklerozdan miyokard enfarktüsüne giden patogenetik mekanizmalar ile ilgili araştırmalar, uygun modellerin olmaması nedeniyle engellenmiştir. Ancak, yeni sıçan modelleri, akut koroner sendromların patogenetik sırasını aydınlatmak açısından yararlı olabilir.(60,61) 21 MİYOKARD İSKEMİSİNİN PATOGENEZİ Miyokard iskemisi, miyokardın metabolik gereksinimlerine göre, yetersiz miyokardiyal kan akımı ile karakterize bir durumdur. İskemi, metabolizma ürünlerini uzaklaştırma kabiliyetinde azalma ile birlikte, oksijen ve metabolik substratların taşınmasında azalma ile ilişkilidir. Miyokardiyal hipoksi ve sonuçta anaerobik metabolizma, iskeminin temel özelliklerindendir. Miyokard iskemisi, aterosklerotik koroner arter hastalığının majör sonuçlarından biridir ve koroner arter hastalığı ile ilişkili çeşitli klinik sendromlara neden olur(stabil anjina, anstabil anjina ve sessiz iskemi). Geleneksel olarak, tıbbi terminoloji Miyokard iskemisi ile anjina pektorisi aynı anlamda kullanılmasına rağmen, günümüzde Miyokard iskemisinin, tanımlanabilen semptomlar olmaksızın oluşabileceği bilinmektedir.(sessiz iskemi).(62) Hastalar, klinik belirtilerin ciddiyeti açısından ve semptomların Miyokard iskemisi epizoduna eşlik etme sıklığı açısından faklılık gösterirler. Aynı hastada bile, bazı iskemi epizodları, klinik olarak sessiz kalabilirken, bazılarına semptomlar eşlik eder. Miyokard iskemisi, efor toleransı ve yaşam kalitesini sınırlamaya ek olarak, Akut Miyokard enfarktüsü ve ani ölüm gibi çok daha ciddi klinik bir sonuç oluşturabilir.(özellikle anstabil anjinası olan hastalarda).(63) Tekrarlayan semptomatik veya sessiz iskemi veya kronik miyokard iskemisinin de, sol ventrikül disfonksiyonuna yol açabileceği öne sürülmüştür.(64) Miyokard iskemisine yol açan mekanizmaların anlaşılması, uygun terapötik müdahalelerin seçilmesi için akılcı bir temel sağlamaktadır. İskemik kalp hastalığında önemli hedeflerden birisi, miyokard iskemisinin ortadan kaldırılmasıdır. MİYOKARDİYAL OKSİJEN TÜKETİMİNİN BELİRLEYİCİLERİ Miyokard enerjisini büyük ölçüde oksidatif metabolizmadan elde eder. Miyokard oksijen gereksinimini temel olarak kontraksiyon esnasında gelişen ventriküler basınçla, miyokardiyal kısalmanın derecesi(stroke volüm) ile, kalp hızı ve kontraktil durum ile regüle edilir. Kontrakte olmayan köpek kalbinin oksijen tüketimi, 100 gr doku basıncı ortalama 1.5 ml/dk’dır; buna karşılık atan bir köpek kalbi 100 gr doku başına 815 ml/dk tüketir. Miyokardiyal oksijen tüketimi, serbest yağ asitlerinin metabolizmasından gelen enerjiden de etkilenir. Yağ asidi metabolizması, dolaşan yağ asitlerinin düzeyleri ile direkt olarak, glukoz konsantrasyonu ile ters olarak değişir. KORONER KAN AKIMININ BELİRLEYİCİLERİ Koroner kan akımı, koroner arterler içindeki itici basınçla direkt olarak, koroner damar direnci ve kardiyak kompresif kuvvetlerle ters orantılı olarak ilişkilidir. Koroner damar direnci, metabolik, nörohormonal ve endotelyal faktörlerle regüle edilir. Miyokard, istirahatte yüksek oksijen ekstraksiyonu olan aerobik bir organ olduğu için, normal bir kalpte miyokardiyal oksijen tüketiminde artış, koroner kan akımında hızlı bir artışla karşılanır. Böylece oksijen tüketimi, akımla yakın bir şekilde eşleşir. Artan metabolik gereksinime yanıt olarak artan kan akımı, adenozin üretiminde artışa atfedilmiştir. Adenozin güçlü bir vazodilatatördür. Ancak, nitrik oksid ve diğerleri gibi farklı vazoaktif maddeler de, artan kan akımına katkıda bulunabilir.(65,66) KORONER KAN AKIMI OTOREGÜLASYONU Diğer tüm değişkenlerin sabit tutulduğu, dikkatli kontrol edilen deneysel durumlarda, köpekte koroner kan akımı 60-130 mmHg’lik ortalama arteryel basıncında nisbeten sabit kalır. Otoregülasyon adı verilen bu fenomen, insanlarda da önemli bir rol oynar. Otoregülasyon, poststenotik koroner basınçta azalmaya rağmen, ciddi bir stenozun distalinde miyokardda normal istirahat perfüzyonunu idame ettirir. Kan akımının otoregülasyonu, arteriollerin ayarı değiştirilerek sağlanır. Böylece, arteriyolar vazodilatasyon, stenoz derecesi, tüm vazodilatatör 22 rezervin tükeneceği noktaya ulaşana kadar, epikardiyal koroner stenoz varlığında, normal akımı idame etmeye eğilimlidir; bu noktada stenozda daha fazla artış veya akıma karşı yönde arteryel basınçta düşüş kan akımını azaltır. Koroner kollaterallerde otoregülasyon olmadığı için, kollaterallerden geçen akım, itici basınca göre direkt olarak değişir. Otoregülasyon, gerilme ve shear hızında değişiklikler gibi, çeşitli sinyallere yanıt olarak damar endotelyumundan salgılanan güçlü bir vazodilatatör olan nitrik okside ve direkt miyojenik kontrole atfedilmiştir. KARDİYAK KOMPRESİF KUVVETLER Her ventriküler sistolle birlikte, intrakaviter basınçta bir artış ve miyokardiyal kontraksiyonun boğazlama etkisi sistolik kan akımını kapatır(özellikle akımın ön planda diyastolik kaldığı subendokadiyumda). Bu kompresif fenomen, kompresif kuvvet aortik basıncı geçtiğinde artar(valvüler veya subvalvüler sol ventriküler çıkış obstrüksiyonu). Böyle durumlarda diyastolün kısalması ve sistolün nisbi olarak azalması ile birlikte taşikardi veya egzersiz veya ilaçlarla indüklenen arteriyoler vazodilatasyon, koroner arter stenozu olmaksızın subendokardiyal iskemiyi hızlandırabilir. Sol ventrikülün tersine, sağ ventrikül perfüzyonu, hem diyastolde, hem de sistolde gerçekleşme eğilimindedir, çünkü sağ kalpte sistolik kompresif basınç önemli derecede daha düşüktür. Ancak, sağ ventrikül hipertansiyonu varlığında, perfüzyon modeli sol ventrikülün perfüzyon modeline benzer ve sağ ventrikülü iskemik travmaya daha duyarlı hale getirir. MİYOKARD İSKEMİSİNİN METABOLİK SONUÇLARI Koroner kan akımı, metabolik gereksinimlerin altına düştüğü zaman, hücresel adenozin 5’trifosfat(ATP) ve kreatinin fosfatta hızlı bir düşüş olu(sentez azalmışken tüketim devam ettiği için). Ayrıca, yetersiz oksidatif fosforilasyon nedeniyle, adenozin 5’-difosfat(ADP) yıkımı, sonuçta adenozin, inozin, hipoksantin ve ksantin oluşmasına yol açar. İskemiye, serbest yağ asitlerinin ekstraksiyonunda azalma, laktat ekstrasyonunda azalma ve laktat üretiminde artma eşlik eder. İskemi, miyokardda pH’ın azalmasına ve ekstraselüler potasyum konsantrasyonunda artışa yol açar. Ciddi ve uzun süreli iskemi ile, ATP depoları %80 veya daha fazla tükenirse, hücrenin hacim ve iyon bütünlüğünü idame ettirme kabiliyeti ve yüksek enerjili fosfatları üretme kabiliyeti kaybolur.(67) Sonuç olarak, intraselüler kalsiyumun hücre içinde birikmesinde artış ile birlikte, hücrede şişme ve sarkolemma’da hasar oluşur ve irreversibl miyosit hasarı devam eder. MİYOKARD İSKEMİSİNİN HEMODİNAMİK VE FONKSİYONEL SONUÇLARI Kalp aerobik bir organ olduğu için, koroner kan akımında azalma, miyokarda oksijen taşınmasında, hızlı bir düşüşe yol açar ve bölgesel kontraktil fonksiyon hızla kaybolur. Miyokardiyal tutulumun derecesine ve noniskemik miyokardın kompensatuvar hiperfonksiyonunun yeterliliğine bağlı olarak, bölgesel disfonksiyon, miyokard fonksiyonunda global bir azalmaya yol açar ve ventriküler dilatasyonda, ejeksiyon fraksiyonunda ve stroke volümde azalma olur. İskemi, kontraktik disfonksiyona ek olarak, bölgesel ve global miyokardiyal diyastolik fonksiyon da oluşturur. Bu durum, gevşemenin azalması ve diyastolik sertlikte artış (her ikisi de, sol ventrikül dolma basıncında artışa ve kalp yetmezliğine katkıda bulunur) ile gösterilir. Sistolik ve diyastolik fonksiyon değişikliklerini, EKG değişiklikleri ve sonuçta anjina semptomları takip eder; ancak, tüm miyokard iskemisi epizodlarından sonra anjina görülmeyebilir. Bölgesel miyokard iskemisi esnasında, noniskemik segmentler, kompensatuvar hiperfonksiyon gösterebilir(global ventriküler fonksiyonu koruyarak).(68) 23 İSKEMİNİN DALGA ŞEKLİNDE YAYILMASI VE NEKROZ Koroner kan akımı azaldığında, zayıf kollateral akım ve metabolik gereksinimlerde artış nedeniyle, subendokardiyum iskemik hasarın ağırlığını yüklenir. Ancak, miyokardın en iç hücre tabakaları, akım azalmasına karşı dirençli kalır, çünkü oksijen kaviter kandan direkt olarak difüze olur. Kan akımı kesildikten sonra, 20 dakika içinde, subendokardiyal iskemik nekroz(miyokard enfarktüsü) gelişmeye başlar ve nekroz subendokardiyumdan subepikardiyuma doğru, zamana bağımlı olarak dalga şeklinde yayılır.(69,70) Rezidüel kan akımı kısıtlandığı zaman (kollateral akım olmadığı için veya tam veya persistan koroner oklüzyon nedeniyle) veya miyokardiyal metabolik gereksinimler yüksek olduğu zaman, nekrozun bu endokardiyumdan-epikardiyuma yayılımı hızlanır. Bunun tersine, tam olmayan veya intermitan koroner oklüzyondan rezidüel akım varlığında veya iyi gelişmiş kollaterallerin hızla toplanması ile nekrozun yayılımı yavaşlar veya durur. Koroner arter oklüzyonundan sonra miyokard nekrozunun zamana bağımlı olarak evrimi, dar bir fırsat penceresi sağlar. Bu süre içinde, başarılı reperfüzyon, nekrozun ilerleyici dalga şeklinde yayılımını durdurabilir. Böylece, miyokard enfarktüs geçiren hastalarda, enfarkt bölgesi sınırlanır, miyokardiyal disfonksiyon düzelir ve klinik prognoz iyileşir. MİYOKARDİYAL STUNNİNG Ciddi iskemi epizodlarının, iskeminin süresini uzatan, uzun sistolik ve diyastolik disfonksiyona yol açabileceği tekrar tekrar gösterilmiştir. Bu duruma, miyokardiyal stunning ismi verilir.(71) İstirahatte kontraktil fonksiyon eksikliğine rağmen, miyokard inotrop uyarıya karşı yanıt verir durumda kalır. Bu fenomen, saatler, günler veya haftalar süren yavaş ama sonuçta düzelen uzun süreli miyokardiyal disfonksiyona yol açar. İskeminin yoğunluğu ve süresi, postiskemik reversibl disfonksiyonun derecesinin majör belirleyicileri olarak görünmektedir. Klinik olarak, miyokardiyal stunning, istirahatte intermittan iskemi epizodlarına bağlı anstabil anjina esnasında, spontan ve terapötik reperfüzyonu takiben akut miyokard enfarktüsünde ve kardiyopulmoner bypas esnasında, iskemik kardiyak arrestten sonra görülür. Öne sürülen bir çok mekanizmaya rağmen, miyokardiyal stunning’in kesin metabolik ve biyokimyasal temeli iyi anlaşılamamıştır.(72) İSKEMİK ÖN KOŞULLANMA Yeni yapılan bazı deneysel çalışmalar, 1.5-3 saat süren koroner arter oklüzyonundan önce, kısa koroner oklüzyon periyodlarının ve bunu takiben perfüzyonun, kollateral akımdan bağımsız olarak enfarkt boyutunda direkt azalmaya neden olduğunu göstermiştir. Bu gözlemler, ‘iskemik ön koşullanma’ kavramının ortaya çıkmasına yol açmıştır. Bu ilginç fenomenin kesin biyokimyasal mediatörleri tam olarak anlaşılamamıştır; potansiyel mediatörler, enerji koruyan ATP ile aktive olan potasyum kanalının aktivasyonu, intraselüler asidozda azalma ile birlikte glikolizde yavaşlama ve ısı şok proteininin indüksiyonu ile birlikte moleküler adaptasyonu kapsar.(73,74) İnsanlarda, iskemik ön koşullanma fenomeninin varlığı çoğunlukla indirekttir. Örneğin, enfarkt öncesinde preenfarkt anjinası olan(kısa iskemi periyodları için klinik gösterge) hastalarda, preenfarkt anjinası olmayanlara göre daha küçük enfarkt boyutu, daha iyi korunmuş ventriküler fonksiyon ve Q-dalgası akut miyokard enfarktüsünün mortalitesinin daha düşük olması, iskemik ön koşullanma için potansiyel bir örneği temsil eder.(75) PATOFİZYOLOJİ Koroner arter hastalığında, miyokard iskemisi, miyokardiyal enerji gereksinimi(miyokardiyal oksijen gereksinimi) ile miyokardiyal oksijen ve substrat taşınması(miyokardiyal oksijen desteği) arasında dengesizliğe bağlı olarak oluşur. Normalde, epikardiyal koroner arterler, ön planda kanallar olarak işlev görür ve kan akımına az direnç gösterir. Koroner arter stenozunda 24 ilerleyici bir artışla birlikte, istirahatteki miyokard kan akımı, stenoz çapın %90’ı kadar olana dek korunur.(76) Ancak, kısa süreli total oklüzyona karşı pik hiperemik yanıt (akım reservi) veya papaverin veya dipiradamol gibi arteriyoler dilatatör uyarıya yanıt olarak pik hiperemik yanıt, çapın %50-60 oranında azaldığı stenozda azalır. Epikardiyal stenoz arttığında, istirahat kan akımının korunması, bazıları tarafından, istirahatte ilerleyici arteriyoler dilatasyona (stenozda akım yönünde) atfedilmiştir. Böylece istirahat akımını korumak için akım rezervi kullanılmış olur (otoregülasyon). Gould bu fenomen için değişik bir açıklama getirmiştir.(77) Gould’a göre, istirahat koroner akımı, primer olarak aortik basıncın, epikardiyal stenozun direnci (Rs) ile akım yönündeki arteriyoler direncin (Rb) toplamına olan oranı tarafından belirlenir. Akım yönündeki arteriyoler direnç, epikardiyal dirence göre, daha fazla olduğunda, epikardiyal stenozda büyük değişikliklerin, total koroner akım üzerinde etkisi azdır. Ancak, epikardiyal stenoz direnci, akım yönünde arteriyoler direnci geçtiğinde, koroner akımın otoregülasyonu kaybolur ve total koroner kan akımı primer olarak sadece stenoz direnci ile belirlenir. İskeminin en çok fiziksel veya emosyonel stres esnasında oluştuğu koroner arter hastalığının stabil fazı esnasında, miyokardiyal oksijen gereksiniminin belirleyicilerinde (kalp hızı, kontraktil durum ve duvar basıncı) artış, miyokardiyal oksijen gereksinimini arttırarak sıklıkla iskemiyi tetikler. Miyokardiyal oksijen gereksiniminde artış, subendokardiyal bölgeye kan akımında mutlak azalmaya yol açar. Subendokardiyumda subepikardiyumla karşılaştırıldığında, vazodilatatör akım rezervinde çok daha fazla sınırlanma nedeniyle endokardiyum-epikardiyum akımı yeniden dağılır (endo-epi steal). Normalde, sol ventrikülün subendokardiyal tabakalarında, subepikardiyuma göre, %25 oranında daha fazla kan akımı vardır, çünkü bölgede sistolik kompresif kuvvetler ve duvar stresi ve vazodilatasyon düzeyi daha fazladır. İstirahatte vazodilatasyon daha yüksek düzeyde olduğu için, subendokardiyumda akım rezervi azalır. Bu durum, subendokardiyal itici basınçta(koroner perfüzyon basıncı ve ventriküler diyastolik basınç arasındaki fark) azalma olduğunda veya kalp hızında artış olduğunda, subendokardiyumun iskemiye karşı daha fazla hassas olmasından sorumludur. KORONER ARTER STENOZUNUN DİNAMİK ÖZELLİĞİ Stenoz derecesinde pasif değişiklikler Otopsi incelemeleri, birçok koroner arter stenozunun, arteryel duvarın sadece bir bölümünü içeren, dış merkezli aterosklerotik plaklara bağlı olduğunu göstermiştir.(78) Böyle uysal koroner stenozlarda, genişleme basınçlarındaki değişikliklerin, stenozun derecesinde değişiklik oluşturduğu gösterilmiştir. Stenozda artan kan akımı veya akıma ters yönde aortik basınçta düşme, genişleme basıncında düşüşe neden olabilir. Bu durum, damar duvarının esnek segmentinin pasif kollapsına neden olarak, stenozun ciddiyetini arttırır.(79) Endotel disfonksiyonunun rolü 1980’de Furchgott ve Zawadski’nin yaptığı dönüm noktası oluşturan çalışmadan beri, endotelin büyük mural arterlerde ve mikrodolaşımda damar tonusunu ayarlamada önemli rol oynadığı bilinmektedir.(80,81) Bazı çalışmalar, asetilkolin, serotinin, norepinefrin (noradrenalin), trombin, substans-P, adenin nükleotidleri, bradikinin ve endotelinin vazoaktif etkilerinin, bunların damar düz kası üzerindeki direkt vazokonstriktör etkileri ile indirekt endotel-bağımlı ve vazodilatatör etkileri arasındaki dengenin sonucu olduğunu göstermiştir.(81,82) Endotel sağlam ve sağlıklı olduğunda, net vazodilatatör etki ön plandadır; ancak endotel yapısal olarak hasarlı veya fonksiyonel olarak anormal olduğunda, bu endotele bağlı vazodilatatörlere karşı vazodilatatör yanıtlar zayıflar ve paradoksal vazokonstriksiyon oluşabilir. Aterosklerotik koroner arterlerde (stenoz veya luminal düzensizlik olan), 25 nonaterosklerotik büyük damarlarda(brakiyal arter) ve aterosklerotik koroner arter hastalığı olan hastalarda koroner ve önkol mikrodolaşımında , bu endotel bağımlı vazodilatörlere paradoksal vazokonstriktör yanıt veya düşük vazodilatatör yanıt gösterilememiştir. Bunun tersine, nitrogliserine ve nitroprusside vazodilatatör yanıt genellikle normaldir, çünkü bu maddeler endotele gereksinim olmadan damar düz kasları üzerinde direkt vazodilatatör etkiler oluşturan endotelden bağımsız vazodilatörlerdir. Asetilkoline ve diğer humoral mediatörlere karşı anormal vazokonstriktör yanıtlar genellikle fiziksel egzersiz, mental stres, soğuk ve artmış shear stresi gibi fizyolojik uyarılara karşı anormal vazokonstriktör yanıtlarla ilişkilidir.(82,83). Bu nedenle, bir koroner stenoza süperempoze fiziksel ve mental strese karşı yanıt olarak anormal vazokonstriksiyon, koroner stenozun ciddiyetinde geçici olarak kötüleşmeye yol açabilir. Bu etki azalmış mikroasküler vazodilatatör fonksiyonla birlikte, örneğin fiziksel egzersiz, mental stres ve soğuğa maruz kalım esnasında miyokardiyal iskemiyi tetikleyebilir. Damar duvarında yapısal bozukluk olmasa bile, aterosklerotik damar hastalığı açısından risk faktörlerinin varlığında (ilerlemiş yaş, dislipidemi, sigara bağımlılığı, hipertansiyon, diyabet, hiperhomosisteinemi, östrojen eksikliği), azalmış vazodilatatör fonksiyon gösterilmiştir. Bu durum, endotelyal disfonksiyonun aterosklerotik lezyonların gelişmesinden önce olabileceğini göstermektedir. Normal endotel, nitrik oksid (NO), prostasiklin ve bir hiperpolarizen faktör gibi vazodilatatörler ve endotelin, anjiyotensin II ve vazokonstriksiyon yapan prostanoidler gibi vazokonstriktörleri içeren bazı vazoaktif moleküller sentez eder.(84,85) Aterosklerozda ve ateroskleroz için risk faktörlerinin varlığında, azalmış vazodilatatör yanıtlar, sağlıklı endotel tarafından üretilen temel vazodilatatör sinyal moleküllerinden biri olan NO’nun azalmış üretimi ve artmış inaktivasyonuna atfedilmiştir.(81,82) Bazı çalışmalar, endotelin yapısal olarak, nitrik oksid sentaz (NOS) isimli bir enzimin etkisi ile argininden küçük miktarlarda NO ürettiğini göstermiştir.(81,82) Nitrik oksid damar mediasına hızla difüze olur ve burada düz kas hücrelerinde siklik guanilik asit (GMP) düzeylerini arttırır. Siklik GMP, siklik GMPbağımlı protein kinaz için bir substrat olarak rol oynar. Siklik GMP-bağımlı protein kinaz, damar düz kas hücelerinin relaksasyonuna neden olan Siklik GMP’nin İntraselüler kalsiyum düşürücü etkileri için gereklidir.(81) Nitrik oksidin, enflamatuvar hücrelerde endotelyal adheziviteyi azaltmak, antitrombosit etki ve damar düz kas hücrelerinde antiproliferatif etki gibi diğer biyolojik etkileride vardır.(81,82) Ayıca, düz kas hücre yanıtında artış ve vazokonstriktör peptit endotelin üretimde artış rol oynayabilir. Bazı çalışmalar, risk faktörlerinde agresif modifikasyon ile endotel bağımlı vazodilatatör fonksiyonda düzelme ve semptomatik ve sessiz miyokard iskemi sıklığında azalma göstermiştir.(86,87) PLAK PARÇALANMASI VE TROMBOZ Anstabil anjinada miyokard iskemisinin ön planda dinamik koroner trombozla tetiklendiği kabul edilmektedir. Bu durum, koroner stenozda ani ve epizodik artışa ve koroner kan akımında azalmaya neden olur.(63,88,89) Koroner trombuslar dinamik olma eğilimindedir; epizodik büyüme, lizis, plak içine inkorporasyon ve akım yönünde embolizasyon, koroner kan akımı üzerinde epizodik etkilere neden olur. Koroner trombus, genellikle aterosklerotik bir plağın parçalanması ile ortaya çıkar. Aterosklerotik bir plağın parçalanması iki ana şekilde olabilir: Koroner plak rüptürü (veya çatlaması); ve geri kalan % 20-30’dan sorumlu plak erozyonu.(88,90) Rüptür, yüksek düzeyde trombojen lipidden zengin ateromatöz çekirdeğin akan kana maruz derin bir plak yaralanmasıdır. Plak rüptürünün tersine, plak erozyonu iyi tanımlanmamış bir yüzeysel 26 yaralanmadır; bu terim, aslında koroner trombusların altında bulunanlar hariç tüm rüptürle ilişkili plak değişiklikleri için kullanılır (plak erozyon ve enflamasyonu mikroskopik olarak tanımlanabilir olsun veya olmasın). Sınırlı sayıda veri,kadınlarda, diyabetlilerde ve muhtemelen sigara içen gençlerde rüptürden ziyade plak erozyonunun daha önemli bir mekanizma olduğunu göstermektedir.(88,90) Rüptüre olan ve koroner trombuslar oluşturan plaklar genellikle büyüktür, ama rüptüre olmadan önce anjiyografide ciddi olarak obstrüktif olmayabilirler.(63,88,89) Böyle plaklar, artmış enflamatuvar hücre infiltrasyonu (makrofajlar, T hücreleri,mast hücreleri), artmış neovaskülarite, daha az sayıda düz kas hücresi ve incelmiş fibröz şapkalarla birlikte lipidden zengin olma eğilimindedir.(63,88,89) Bu özelliklere sahip plakların rüptüre olmadan önce hassas plaklar olduğu düşünülmüştür, ancak böyle bir değişimi gösteren prospektif çalışma yoktur. Plak rüptürüne yol açan mekanizmalar iyi anlaşılamamıştır.enflamatuvar hücreler tarafından (çoğunlukla makrofajlar) taşınan matriks-parçalayıcı enzimlerin [matriksparçalayıcı metalloproteinazlar (MMPs) ve katepsinler gibi sistein proteazlar] salınımı yoluyla aşırı ekstraselüler matriks parçalanmasının ve apoptozis yoluyla matriks sentez eden damar düz kas hücre ölümünde artışın, fibroz şapkada kollajen iskeletini tüketebileceği hipotez olarak ileri sürülmüştür.(63,88,89) Fibröz şapkanın kollajen içeriği, plağın gerilim gücünden büyük ölçüde sorumludur; kollajenin tükenmesi, şapkanın incelmesine ve spontan olarak veya hemodinamik streslere yanıt olarak mekanik yetersizliğine (rüptür) neden olacaktır. Çeşitli sitokinler, immün mekanizmalar ve CD40, mast hücre kaynaklı proteazlar, oksidan stres ile okside olan lipidler gibi immünomodülatör moleküller ve C.pneumoniae gibi (plakların %50’sinde bulunur) enfeksiyöz ajanlar ve plakta makrofajlar tarafından üretilen tenaskin-c gibi matriks molekülleri, aterosklerotik lezyonlarda MMP’leri arttırarak matriks parçalayıcı aktivitede net bir artışa neden olabilirler.(63,88,89) Ayrıca, aktive enflamatuvar hücreler ve plakta okside lipidlerin toksik komponentleri, apoptozis ile düz kas hücre ölümü uyarısı yoluyla matriks içeriğini azaltarak plak parçalanmasına yol açabilirler. Plak parçalanmasını takiben trombotik yanıtın süresi ve boyutu muhtemelen plak öğelerinin trombojenisitesi ile belirlenir; stenozun ciddiyeti ile ilişkili lokal reoloji ve sonuçta oluşan shear hız; ve sistemik trombotik-antitrombotik ve fibrinolitik-antifibrinolitik denge. (63,88,89) Plak öğeleri arasında, lipidden zengin çekirdek, yüksek düzeyde doku faktörü içeriği nedeniyle yüksek düzeyde trombojenik görünmektedir; doku faktörü, en çok plaktaki enflamatuvar hücreler (en çok makrofajlar) tarafından üretilir. KOLLATERALLERİN ROLÜ Kolateraller epikardiyal koroner arterleri birleştiren ve bir koroner arter obstrüksiyonunun distalinde alternatif kan akımı kaynağı sağlayan damar kanallarıdır. Normal kalpte bulunan bu bağlayıcı damar kanallarının çapları 20-200mm arasındadır ve yoğunlukları farklı kişiler ve türlerde çok değişkendir.(91,92) Bu kollateral kanallar anatomik olarak mevcut olmalarına rağmen, normal koşullarda, verici ve alıcı arterler arasında basınç gradyanı olmadığı için fonksiyonel olarak kapalı kalırlar. Ancak, bir koroner arter obstrüksiyonu oluştuğu zaman, poststenotik basınç düşüşü, yüksek basınçlı verici damarından düşük basınçlı alıcı damarına doğru akım için gradyan yaratır ve kolleteral kanallar açılır. Açıldıktan sonra, ince duvarlı kollateral kanallarda, bunları epikardiyal koroner arterlere benzeyen üç tabakalı yapıya dönüştürecek bazı değişiklikler oluşur ve sonuçta luminal çapta on kart artış olur. Endojen endotel-bağımlı nitrik oksid ve prostasiklinin,kollateral kan akımını regüle ettiği gösterilmiştir. Koroner kollateraller, koroner arter hastalığında, koruyucu bir rol oynar. Olgun kollateraller, istirahatte ve orta derecede egzersiz esnasında, poststenotik veya postokluzif segmentlere giden normal kan akımını koruyabilir, ama maksimal egzersiz veya farmakolojik vazodilatasyon ile kollateral akım, subendokardiyal iskemi gelişmesini olanak dışı bırakmak 27 için yeterli olmayabilir. Kollateraller, önemli derecede koroner arter obstrüksiyonu ile ilişkili iskeminin ciddiyetini önemli derecede azaltabilir, akut koroner oklüzyon sonrasında miyokardiyal nekrozun boyutunu ve kontraktil disfonksiyonu azaltabilir; koroner oklüzyondan sonra miyokardı canlı ama nonkontraktil durumda (hibernating miyokart) koruyabilir; ve bazı durumlarda, total koroner arter oklüzyonu varlığında, miyokard enfarktüsü ve ventriküler disfonksiyonu tamamen önleyebilir. Koroner kollateral dolaşımın yoğunluğu ve yaygınlığı tür ve obstrüksiyonun şiddetine göre değişir. İnsanlarda, fonksiyonel kollaterallerin anjiyografik göstergesi, koroner stenoz çapı % 70’ten fazla olana kadar nadiren gözlenir; bu durum daha önceden mevcut kollateral kanalların açılması için basınç gradyanının önemini vurgular. Çok sayıda çalışma, insanlarda ve hayvanlarda, kronik egzersizin koroner kollateral gelişimi üzerindeki etkisini incelemişler, ama sonuçlar umut verici olmamıştır. Son yıllarda, fibroblast büyüme faktörü (FGF) ve damar endotelyal büyüme faktörü (VEGF) gibi anjiyojenik büyüme faktörlerin lokal veya sistemik uygulaması ( bu proteinlerin rekombinan formları, bu proteinleri kodlayan çıplak DNA veya bu proteinleri kodlayan DNA’ı taşıyan viral vektörler kullanılarak ), deneysel ekstremite ve kardiyak iskemi modellerinde test edilmiştir. Bu yöntemlerin, kollateral ve neovasküler büyümeyi uyardığı gösterilmiştir.(93) Periferik ve koroner arter hastalığının bu anjiyojenik faktörleri ile ilgili insan çalışmaları devam etmektedir. KRONİK MİYOKARD İSKEMİSİ VE MİYOKARDİYAL HİBERNASYON Ciddi koroner stenozlar veya kolateralize olmuş total oklüzyon nedeniyle miyokard perfüzyonunun kronik veya tekrarlayan bir şekilde azalması, kontraktil fonksiyonda azalmaya ve miyokard metabolizmasında adaptif değişikliklere neden olabilir. Bu durum, kontrakte olmayan ama canlı miyokardın bulunduğu miyokardiyal ‘hibernasyon’ durumu ile sonuçlanır.(71) Kan akımı, revaskülarizasyon ile yerine konduğunda, bu fonksiyonel olmayan miyokard segmentleri kontraktil fonksiyonlarını geri kazanırlarsa, canlılık kanıtlanmış olur. Klinik açıdan, ventriküler fonksiyonu ciddi olarak baskılanmış olan ve konjestif kalp yetmezliği olan arter hastalarında, noninvazif görüntülemeler, nonkontraktil miyokard segmentlerinde canlılık bulgusu sağlarsa, revaskülarizasyonla semptomatik yarar görülür ve prognoz iyileşir.(94) Miyokardın canlılığını değerlendirmek için bazı noninvazif teknikler kullanılır.(40) • Çeşitli radyoaktif perfüzyon izotopları ile miyokard perfüzyon görüntülemesi (istirahatte ve yeniden dağılımda veya yeniden enjeksiyonda); • Miyokard kan akımını değerlendirmek için, radyoaktif madde ile işaretlenmiş amonyak kullanan ve miyokard metabolizmasını değerlendirmek için,radyoaktif madde ile işaretlenmiş deoksiglükoz kullanan pozitron emisyon tomografisi; • Dobutamin ve kontrast ekokardiyografi; ve • MRI. ATEROSKLEROTİK RİSK FAKTÖRLERİ Risk faktörlerinin tanımlanması ve bunların tedavisi asemptomatik kişilerde koroner kalp hastalıklarının önlenmesi (primer koruma), belirlenmiş hastalığı olan kişilerde tekrarlayan olayların önlenmesi (sekonder koruma) için gereklidir. İnsanlardaki risk faktörlerinin araştırılmasına ilişkin sistematik çalışmalar, yaklaşık olarak yüzyılın ortalarında başlamıştır. Prospektif, halk tabanlı "Framingham Kalp Çalışmaları", hiperkolesterolemi, hipertansiyon ve diğer faktörlerin kardiyovasküler riskle ilişkili olduğunu destekleyen önemli kanıtlar sağlamıştır. Gözleme dayanan benzer çalışmalar ABD'de gerçekleştirilmiştir ve geniş çapta yapılan yaygın, bağımsız araştırmalar kardiyovasküler hastalıklar için risk faktörleri kavramını desteklemiştir.(96) 28 Ulusal Kolesterol Eğitim Programı'nın (NCEP) 2001'de yayınlanan III.Yetişkin tedavi panelinde (ATP III), koroner arter hastalığı risk faktörleri şu şekilde sınıflandırılmıştır(97): Koroner Arter Hastalığı Risk Faktörleri (NCEP ATP III) (97) 1. Lipid risk faktörleri (LDL, Trigliseridler, Non-HDL Kolesterol, HDL düşüklüğü, Aterojenik dislipidemi) 2. Nonlipid risk faktörleri Α. Modifiye edilebilen risk faktörleri a. Hipertansiyon b. Sigara içiyor olmak c. Diyabetes Mellitus d. Fazla kiloluluk/Obezite e. Fiziksel inaktivite f. Aterojenik diyet g. Trombojenik/hemostatik durum B. Modifiye edilemeyen risk faktörleri a. Yaş b. Erkek cinsiyeti c. Ailede erken koroner kalp hastalığı öyküsü Koroner Arter Hastalığı İçin Bağımsız Risk Faktörleri (NCEP ATP III) (97) 1. Yaş (erkeklerde ≥45, kadınlarda ≥55 ) 2. Ailede erken koroner kalp hastalığı öyküsü 3. Sigara içiyor olmak 4. Hipertansiyon (Kan basıncı ≥140/90 mmHg veya antihipertansif ilaç kullanımı) 5. Düşük HDL kolesterol (HDL< 40 mg/dl) 6. Yüksek LDL kolseterol ( LDL ≥130 mg/dı) *HDL > 60 mg/dl ise risk hesaplamalarında bir risk faktörü çıkarılır (Çünkü HDL kolesterol yüksekliği koroner arter hastalığı riskini azaltır). *DM varlığı koroner arter hastalığı risk eşdeğeri olarak değerlendirilir. Aşağıda ise Türk Kardiyoloji Derneği'nin 2002'de yayınladığı Koroner Kalp Hastalığı Korunma ve Tedavi Klavuzunda yer alan koroner kalp hastalığı risk faktörlerini görmektesiniz (98): 1. Yaş (erkeklerde ≥45, kadınlarda ≥55 veya erken menopoz) 2. Aile öyküsü (birinci derece akrabalardan erkekte 55, kadında 65 yaşından önce koroner arter hastalığı bulunması) 3. Sigara içiyor olmak 29 4. Hipertansiyon (kan basıncı ≥140/90 mmHg veya antihipertansif tedavi görüyor olmak) 5. Hiperkolesterolemi (total kolesterol ≥200 mg/dl, LDL-kolesterol ≥130 mg/dl) 6. Düşük HDL-kolesterol değeri(< 40 mg/dl) 7. Diabetes mellitus (diyabet bir risk faktörü olmanın yanısıra, koroner kalp hastalığı varlığına eşdeğer bir risk taşıdığından risk değerlendirmesinde ayrı bir yeri vardır.) Düşük Yoğunluklu Lipoprotein Kolesterol (LDL) Çeşitli tipteki kanıtlar LDL'nin primer aterojenik faktör olduğunu desteklemektedir ve kontrollü çalışmalar LDL 'nin düşürülmesinin koroner kalp hastalığı riskini azalttığını göstermiştir(99). Buna göre Ulusal Kolesterol Eğitim Programı (NCEP), lipid düşürücü tedavide LDL kolesterolünü primer hedef olarak belirlemiştir. Laboratuar hayvanları üzerinde yapılmış birçok çalışma serum LDL ve bununla ilgili lipoprotein seviyelerinin yükseltilmesinin aterogenezi başlattığı ve bu prosesi devam ettirdiğini işaret etmektedir( Ayrıca yüksek LDL genetik formlarına sahip insanlar erken aterosklerotik hastalık göstermektedir.Sözü edilen her iki örnek de diğer risk faktörleri olmaksızın tek başına yüksek LDL seviyelerinin aterojenik olduğunu saptamaktadır. Yıllar boyunca LDL 'nin esas fonksiyonunun arter duvarında kolesterol depozisyonu olduğu düşünülmüştür. Son zamanlarda LDL'nin proinflamatuar bir ajan olduğu bulunmuştur; aterosklerotik lezyonun en önemli belirtisi olan kronik inflamatuar cevabı harekete geçirmektedir(100). Yüksek LDL seviyeleri aterosklerozun tüm evrelerinde rol almaktadır; endotel disfonksiyonu, plak formasyonu ve büyümesi, kararsız plak, plak yırtılması ve tromboz. Plazmada yüksek LDL kolesterol seviyelerinin mevcudiyeti LDL partiküllerinin arter duvarında retansiyonunun artmasına, oksidasyonuna ve çeşitli inflamatuar mediyatörlerin sekresyonuna neden olur(101). Bu olayların bir sonucu okside LDL tarafından endotel hücre fonksiyonlarının bozulması ve bunun sonucunda nitrik oksid üretiminin azalmasıdır. Yüksek LDL kolesterol seviyelerinin tedavi edilmesi asetilkoline karşı normal vazodilatör cevabın geri dönmesine sebep olur. LDL ayrıca düz kas hücrelerinin güçlü bir mitojenidir(99). TEKHARF çalışması, toplumumuzda total kolesterol düzeylerinin batılı toplumlarla karşılaştırıldığında genelde düşük olduğunu ortaya koymaktadır. Ancak yine de total kolesterol düzeyi 9 milyon vatandaşımızda 200 mg/dl'nin üzerindedir. Türk erkek ve kadını erişkin hayata iyi kolesterol değerleri ile başlamakta, ancak bu düşük kolesterol değerleri zaman içinde korunamamakta, ilerleyen yaşla total kolesterol değerleri her iki cinsiyette de hızla yükselmektedir. 20-29 yaş arası ortalama total kolesterol değeri Amerika Birleşik Devletleri, Avrupa ve Japonya' da ortalama 180mg/dl civarında seyrederken, Ülkemizde erkekte 148mg/dl, kadında 151mg/dl bulunmuştur. 40-49 yaş grubuna ulaşıldığında her iki cinsiyette ortalama total kolesterol değerleri 188mg/dl'ye yükselmektedir. İki dekad içinde total kolesterol değerini 39mg/dl yükselten başka bir ülke bulunmamaktadır. Yaşla görülen bu yükselmenin LDL yıkımında azalma, hormonal değişiklikler ve çevresel faktörlere bağlı olduğu sanılmaktadır. Özellikle ülkemizde yaşla birlikte daha sedanter bir yaşam tarzına eğilim, kilo alma ve diyet alışkanlığının olumsuz yönde değişmesi, bu ani yükselmede etken olmuş olabilir. Hem primer hem de sekonder koruma çalışmalarının toplu sonuçları kolesterol düşürücü tedavinin koroner kalp hastalığı riskini azalttığını göstermiştir(102). Güçlü LDL düşürücü ajanlar olan HMG-CoA redüktaz inhibitörlerinin (statinler) ortaya çıkışı kolesterol hipotezinin daha etkili test edilebilmesine olanak sağlamıştır. 1993'den itibaren statinler ile yapılan beş majör çalışma yayınlanmıştır: üç sekonder koruma (103,104,105). ve iki primer 30 koruma (106,107) çalışması. Tüm bu çalışmalar majör koroner olaylarda belirgin bir azalma göstermiştir. Üç tanesinde total mortalitede azalma tespit edilmiştir. Bu çalışmaların hiçbirinde nonkardiyak mortalitede artış oluşmamıştır. Bu çalışmalar kolesterol düşürücü tedavinin koroner kalp hastalığı riskinin azaltılmasında güvenli ve etkili bir tedavi olduğunu ortaya koymaktadır. Ayrıca pek çok çalışma LDL seviyelerinde belirgin azalmanın koroner lezyon progresyonunu yavaşlattığını, bazı vakalarda ise regresyonu başlattığını saptamıştır. LDL seviyelerinin düşürülmesi ilaç ve ilaç dışı tedaviler ile mümkün olabilir, ilaç dışı tedavi yöntemlerinin önemi küçümsenmemelidir. Bunların arasında en önemlileri diyetteki kolesterol yükseltici yağ asitlerinin (doymuş ve trans yağ asitleri) ve kolesterol miktarının azaltılmasıdır(97). Fazla kilolu kişilerde istenilen vücut ağırlığına ulaşılması LDL kolesterol seviyelerini düşürerek koroner kalp hastalığı riskini azaltır. Diyete ait yardımcı faktörlerin kullanılması ile risk azaltılması konusunda artan bir ilgi mevcuttur. Bitki stanollerinin günlük 3 gram kullanımı diyetteki kolesterolün ve kolesterol düşürücü yağ asitlerinin azaltılmasından bağımsız olarak LDL kolesterol seviyelerini %10-15 oranında azaltır(108). Diyet ile alınan lif oranının arttırılması LDL seviyelerini %3-5 oranında azaltır. Doymamış yağ asitleri LDL kolesterolünü azaltır ve koroner kalp hastalığı global riskini farklı yollardan azaltabilir. Belirlenmiş koroner kalp hastalığı olan hastalarda NCEP, LDL kolesterol seviyelerini ≤100mg/dl olarak hedeflemektedir(97). Sekonder korumada optimal LDL kolesterol seviyelerinin tanımlanabilmesi için yeni klinik çalışmalar başlatılmıştır; bununla birlikte, pek çok çalışmadan kaynaklanan kanıtlara göre NCEP hedef olarak ≤100mg/dl kolesterol seviyelerini belirlemiştir(109). Amerika Kalp Birliği (American Heart Association) LDL kolesterol seviyeleri >130 mg/dl olan tüm koroner kalp hastalarında kolesterol düşürücü tedavinin başlatılmasını önermektedir(110). LDL kolesterol seviyeleri 100-129 mg/dl arasında olan hastalarda kolesterol düşürücü ilaçların başlanıp başlanmaması henüz tam belirlenmemiştir. Bu hastalara maksimum ilaç dışı tedavi başlanmalıdır(99). Kişinin kendi risk faktörlerini bilme eğiliminin yerleşmesinin, koruyucu hekimlik açısından büyük önemi vardır. Bu amaçla, NCEP ATP III, 20 yaş üzerindeki erişkinlerde total kolesterol, HDL kolesterol, LDL kolesterol ve trigliserid düzeylerinin her 5 yılda bir kontrol edilmesini önermektedir(97). NCEP nin önceki panellerinde olduğu gibi 2001 de yayınlanan, III.Yetişkin tedavi panelinde de (ATP III), LDL kolesterolün azaltılmasında, terapötik yaşam tarzı değişiklikleri iki majör modaliteden biri olarak yer almaktadır, diğeri ise ilaç tedavisidir. Terapötik yaşam tarzı değişiklikleri esas olarak 3 temel yaklaşımdan oluşur: Sature yağlar ve kolesterol alımının azaltılması, fizik aktivitenin artırılması ve kilo kontrolü.(97) HDL Kolesterol Düşüklüğü Epidemiyolojik çalışmalardan elde edilmiş çok sayıda kanıt plazma HDL kolesterol düzeyi ile, daha sonra koroner olay gelişme riski arasında güçlü bir ters ilişkinin varlığını göstermektedir. Bu tersine ilişki hem erkekler hem de kadınlar için geçerli olup, koroner kalp hastalarında da asemptomatik kişiler kadar güçlüdür. Ortalama 1mg/dl HDL kolesterol düşmesi koroner kalp hastalığı riskini %2-3 artırmaktadır(111). Koroner kalp hastalığı için düşük (<40 mg/dl) HDL kolesterol seviyelerinin bir risk faktörü, buna karşılık yüksek (> 60 mg/dl) HDL kolesterol seviyelerinin ise koruyucu bir faktör olduğu kılavuzlarda vurgulanmıştır. Düşük HDL düzeylerine yol açan pek çok faktör mevcuttur. Bunlar arasında çoğu hastada genetik faktörler önem taşır. Edinsel nedenler arasında yaşam tarzı, yani; sigara, fıziksel inaktivite ve obeziteye yol açan aşırı kalori alımı büyük yer tutar . Bunların yanısıra beta blokerler, anabolik steroidler ve progestasyonel ajanlar gibi ilaçlar HDL kolesterolü düşürür. HDL kolesterol ve trigliserid düzeyleri arasında orta derecede güçlü tersine 31 korelasyon vardır ve çeşitli hipertrigliseridemik tablolara düşük HDL kolesterol de eşlik eder(112). Epidemiyolojik çalışmalara ilişkin gözlemler, koroner arter hastalığı riskinin belirlenmesinde değişik plazma lipidlerinin bir aradaki etkisini hesaba katmanın önemini ve koroner arter hastalığı riskinin önceden kestirilmesinde plazma total kolesterol/HDL kolesterol oranının yararını vurgulamaktadır. Normal olarak bu oranın 5'in altında olması istenir ve total kolesterol düzeyleri 200-250 mg/dl olanlarda girişim gereksiniminin belirlenmesinde özel önem taşır(113). TEKHARF çalışmasının 12 yıllık izlem verileri, erişkinlerimizde ortalama HDL kolesterol değerlerinin batılı toplumlardan her iki cinsiyette %20 oranında daha düşük olduğunu ortaya koymaktadır. Bunda kalıtsal faktörlerin yanısıra, sigara içimi, alkollü içki kullanma alışkanlığının azlığı, abdominal şişmanlık, fıziksel aktivite azlığı ile hiperinsülineminin rolü belirlenmiştir. HDL kolesterolde 12 mg/dl' lik azalma, toplumumuzda fatal ve fatal olmayan koroner olay riskini %36 oranında yükseltmektedir. TEKHARF çalışması, total kolesterol/HDL kolesterol oranının, halkımızda koroner kalp hastalığının en iyi lipid öngörücüsü olduğunu ortaya koymuştur. Aynı çalışmanın sonuçlarına göre total kolesterol/HDL kolesterol oranında 2 birimlik artış, koroner olay ve ölüm riskini bağımsız biçimde %68 oranında yükseltmektedir. Sigara, obezite ve fiziksel inaktivite plazma HDL kolesterolünü azaltır, bu risk faktörlerinin giderilmesi ise bu etkileri tersine çevirir . NCEP ATP III, düşük HDL kolesterol düzeyini 40 mg/dl'nin altındaki değerler olarak tanımlamaktadır . Koroner arter hastalığı olan ve HDL düzeyi düşük hastalar tekrarlayan olaylar açısından risk altındadır ve yoğun ilaç dışı tedavi uygulanmalıdır (diyet değişiklikleri, kilo kaybı ve egzersiz). HDL kolesterol düzeyi düşük kişilerde tedavinin birinci hedefi LDL kolesteroldür; NCEP ATP III diyet, egzersiz ve ilaç tedavisi klavuzu izlenerek hedeflenen LDL kolesterol düzeyine ulaşılmalıdır. Düşük HDL düzeyi yüksek trigliseridlerle ilişkili olduğunda (200-499 mg/dl), ikinci öncelik hedeflenen HDL dışı kolesterol düzeyine ulaşmak olmalıdır. Ayrıca, trigliseridler 200mg/dl'den düşük ise (yalın düşük HDL kolesterol), HDL düzeyini yükseltecek ilaçlar (fibratlar veya nikotinik asit) düşünülebilir. Nikotinik asit, fibratlar ve statinler genelde HDL düzeyini yükseltir(114). Trigliseridler Prospektif epidemiyolojik çalışmaların çoğunun tek değişkenli analizinde, plazma trigliseridleri, daha sonra gelişebilecek koroner arter hastalığı olaylarını öngörmede işe yarar. Öte yandan diğer risk faktörlerinin etkileri yönünden gerekli istatiksel ayarlamalar yapıldığında, plazma trigliseridlerinin bağımsız etkileri zayıflamakta veya yok olmaktadır (115). Trigliseridlerle koroner arter hastalığı ilişkisi büyük oranda diyabet, obezite, hipertansiyon, yüksek LDL kolesterol ve düşük HDL kolesterol gibi diğer faktörlerle ilişkilidir(116). Ayrıca, hipertrigliseridemi sıklıkla hemostatik faktörlerle de ilişkili bulunmuştur. Ancak yakın zamanda prospektif çalışmaların metaanalizi ile sınır (150199mg/dl) ya da yüksek (200mg/dl'den yüksek) trigliserid düzeylerinin koroner arter hastalığı için bağımsız bir risk faktörü olduğu gösterilmiştir.(97,39117,118) Yüksek trigliseridlerin ilaç dışı tedavisi kilo kaybı, bu mekanizmanın neden olabildiği kişilerde alkol tüketiminin azaltılması, sigaranın bırakılması ve fizik aktiviteden ibarettir. Trigliserid düzeyini düşürebilen ilaçlar nikotinik asit, fibrat türevIeri ve daha az derecede statinlerdir(114). Daha önce yapılmış çeşitli çalışmalar hipertrigliserideminin çeşitli aterojenik faktörler ile güçlü bir birliktelik gösterdiğini ortaya koymuştur. Bu faktörler arasında aterojenik 32 dislipidemi (artmış serum trigliseridleri, küçük yoğun LDL partikülleri ve düşük HDL kolesterol'den oluşan lipid triadı) ve metabolik sendrom sayılabilir. Bu nedenle, hipertrigliseridemili hastaların tedavisine klinik yaklaşım geniş tabanlı bir stratejiyi gerektirir; yani böyle bir yaklaşım, aterojenik trigliseridlerden zengin lipoproteinlerin azaltılması, lipid triadının düzeltilmesi, ve metabolik sendromun uygun biçimde modifiye edilmesini kapsamalıdır. Aterojenik Dislipidemi LDL primer lipid risk faktörü olmasına rağmen diğer lipid parametreleri LDL kolesterol seviyeleri yüksek olan veya olmayan hastalarda koroner kalp hastalığı riskini arttırır. Yüksek konsantrasyonlarda trigliserid, küçük yoğun LDL ve düşük seviyelerde HDL kombinasyonu aterojenik dislipidemi olarak tanımlanır. LDL kolesterol seviyeleri tedavide primer öneme sahip olmasına rağmen aterojenik dislipidemi koroner kalp hastalığı patogenezine yardımcı bir faktör olduğu için büyüyen öneme sahiptir(119). Aterojenik dislipideminin her bir öğesinin bağımsız bir risk faktörü olup olmadığı tartışması uzun süreden beri devam etmektedir. Her öğenin bağımsız olarak aterojenik olduğuna dair kanıtlar mevcuttur. Trigliseridler için pek çok prospektif çalışmanın metaanalizleri, yüksek serum trigliserid seviyelerinin koroner kalp hastalığı için risk faktörü olduğunu güçlü bir şekilde öne sürmektedir(117,120). Diğer prospektif çalışmalar düşük HDL kolesterol seviyelerinin bağımsız bir risk faktörü olduğunu göstermiştir(121,122). Daha düşük orandaki veriler, küçük yoğun LDL partiküllerinin normal büyüklükteki LDL kolesterolden daha aterojenik olduğunu öne sürmektedir. Aterojenik dislipidemiye sıklıkla metabolik sendromun diğer aterojenik risk faktörleri eşlik eder(119). Japonya'da yapılan bir çalışmada küçük yoğun LDL'ye sahip kişilerde diyabet varlığından bağımsız olarak daha fazla koroner kalp hastalığı görüldüğü bildirilmiştir(123). Aterojenik dislipidemi modifikasyonunun koroner kalp hastalığı riskini azaltması hakkında hiçbir kontrollü çalışma yapılmamıştır. İndirekt veriler, büyük klinik çalışmaların post hoc analizlerinden ve aterojenik dislipidemiyi modifiye eden ilaçların kullanıldığı çalışmalardan gelmektedir. Sözü edilen ilaçlar nikotinik asit ve fibrik asitleri içermektedir. Bu ilaçlar LDL seviyelerinde küçük bir etkiye sahiptir, değişikliklerin pek çoğu aterojenik dislipidemi öğelerinden oluşmaktadır. Bununla birlikte bu çalışmaların pek çoğu ilaç tedavisi ile koroner olaylarda belirgin bir azalma veya azalma eğilimi göstermiştir(99). Helsinki Kalp çalışması, Stokholm İskemik Kalp Hastalığı çalışması ve Bezofibrat İnfarktüs Koruma çalışması'nda en iyi sonuçlar, aterojenik dislipideminin bir işareti olan yüksek trigliserid seviyelerine sahip olan kişilerde elde edilmiştir. Bu çalışmalar total mortalitede bir azalma ortaya koymamışlardır ve istatiksel olarak bu güce sahip değillerdir. Bununla beraber bir bütün olarak ele alındığında bu çalışmalar ilaç tedavisi ile aterojenik dislipidemi modifikasyonunun koroner kalp hastalığı riskini azalttığını güçlü bir şekilde öne sürmektedir. Bu bulgular fibratlar ile yapılan anjiyografik çalışmalarda koroner aterosklerozun ilerlemesinin yavaşlaması ile desteklenmektedir(124,125). Aterojenik dislipidemi tedavisi için ilk seçenek kilo kontrolü ve fiziksel aktivitedir . Kilo kontrolü ve düzenli egzersiz sadece aterojenik dislipidemiyi değil, metabolik sendromun diğer öğelerini de geriletir. Hem fibrik asitler hem de nikotinik asit aterojenik dislipidemisi olan hastalarda lipoprotein paternini düzeltirler. Statinler aynı zamanda trigliseridden zengin lipoproteinler ve küçük yoğun LDL konsantrasyonlarını azaltıp, HDL kolesterol seviyelerini hafifçe yükselterek aterojenik dislipidemiyi modifiye ederler.. Aterojenik dislipidemisi olan hastalarda primer hedef LDL kolesterol seviyelerini primer ve sekonder koruma için belirlenmiş olan seviyelere indirmektir. Pek çok hastada LDL hedeflerine ulaşmak için statin tedavisi gerekir. LDL hedeflerine ulaştıktan sonra da anormallikler devam ederse kilo kontrolü ve artmış fiziksel aktivite için yeni gayretler gerekli 33 olabilir. Bu önlemler başarısız olursa ikinci bir lipid düşürücü ilaç diğer lipoproteinleri modifiye etmek için kullanılabilir. NCEP'in sekonder hedefleri olan HDL > 40mg/dl ve trigliserid < 200mg/dl seviyelerine ulaşabilmek için fibrik asit veya nikotinik asit kullanılabilir. Fibratların yüksek doz statinler ile kullanımı artmış myopati riski nedeni ile kaçınılması gerekli olan bir durumdur(97,99). HİPERTANSİYON Hipertansiyon koroner kalp hastalığı için çok önemli bir risk faktörüdür. Bütün aterosklerotik kardiyovasküler olayların %35'inden hipertansiyon sorumludur. Koroner kalp hastalığı, hipertansiflerde normotansiflere göre 2-3 kat daha fazladır Hipertansiyon, kadın ve erkekte, akut miyokard enfarktüsü riskini 2-3 misli arttırmaktadır. Diyastolik kan basıncında 15 mmHg veya sistolik kan basıncında 25 mmHg'lık yükselme reenfarktüs riskini sırasıyla %40 ve %37 arttırmaktadır. Bu durum diğer risk faktörlerinden bağımsızdır. Çeşitli majör prospektif çalışmada hem sistolik hem de diyastolik kan basıncı ile, kan basıncının eşik risk seviyesi olmaksızın, güçlü, pozitif, devamlı ve kademeli bir ilişkisi saptanmıştır . Farklı ülkelerdeki popülasyonlar arasında koroner kalp hastalığı göreceli riski, kan basıncındaki artışlar ile aynıdır, ancak verilen bir kan basıncındaki mutlak risk oldukça değişkendir(126). Hipertansiyon insülin direnci, hiperinsülinemi, glukoz intoleransı, dislipidemi, sol ventrikül hipertrofisi ve obezite ile birliktedir ve izole olarak populasyonun %20'sinden daha azında gözlenir.(127) Hipertansiyonu olan ve akut miyokard enfarktüsü geçirenlerde enfarktüs sonrası angina pektoris, sessiz miyokard iskemisi, atriyal fibrilasyon, ventrikül taşikardisi, ventrikül fibrilasyonu, kardiyojenik şok normotansiflere göre daha fazladır. Koroner arter hastalığı olan veya koroner bypas operasyonu yapılan hipertansiflerde 5 yıllık mortalite normotansiflere göre daha fazladır(128). TEKHARF çalışmasının 12 yıllık izlem verileri, hipertansiyonun erişkinlerimizde koroner kökenli ölümleri belirleyici en önemli etken olduğunu ortaya koymuştur. Sistolik kan basıncında her 20 mmHg' lik yükselme, yeni koroner olayları yüzde 50 oranında, koroner ölüm olasılığını iki kattan fazla artırmaktadır. Sistolik hipertansiyonlularda nabız basıncı, sistolik basıncın koroner olayları öngördürücü gücüne anlamlı biçimde katkı yapmaktadır. Hipertansiyon ülkemizde çok yaygın bir risk faktörü olup halen 5 milyon erkek ile 7 milyon kadınımızda bulunduğu tahmin edilmektedir. Hipertansiyonun koroner olaylara neden oluşundaki olası mekanizmalar, bozulmuş endotel fonksiyonu, endotel lipoprotein geçirgenliğinin artışı, artmış oksidatif stres, akut plak rüptürünü tetikleyen hemodinamik stres, artmış myokardiyal duvar stresi ve artmış myokardiyal oksijen ihtiyacını içerir. Arteriyel katılığın (stiffness) bir işareti olan geniş nabız basıncı, Koroner kalp hastalığını tahmin eden bir faktör olarak önem kazanmaktadır(129). Hafif orta hipertansiyonu olan 47000 kadın ve erkek üzerinde antihipertansif ilaçlar ile yapılmış olan 17 randomize çalışmanın metaanalizinde inmenin %38, koroner kalp hastalığının %16 oranında azaldığı gösterilmiştir. Bu çalışmaların pekçoğu beta blokerü olsun veya olmasın yüksek doz diüretiklerle yapılmıştır. Diüretikler ve beta blokerler primer korumada koroner kalp hastalığı morbidite ve mortalitesini azalttığı gösterilen ve üzerinde en çok araştırma yapılan ilaç gruplarıdır(130). Kan basıncı kilo kaybı, egzersiz, tuz kısıtlaması ve alkol kullanımının azaltılması ile de düşürülebilir, ancak bu önlemlerin hipertansif hastalarda koroner kalp hastalığını önlemedeki önemi randomize kontrollü çalışmalar ile test edilmemiştir. Yüksek Kan Basıncının Belirlenmesi Değerlendirilmesi ve Tedavisinde Ulusal Komite (The Joint National Committee on Detection, Evaluation and Treatment of High Blood 34 Presure) tedavi hedefini < 140/90mmHg olarak belirlemiştir. Diyabet veya kronik böbrek yetersizliği olan hastalar için ise < 130/80mmHg uygun bir hedeftir(131). SİGARA İÇİCİLİĞİ Her iki cinsiyet grubunda, gençlerde ve yaşlılarda ve tüm ırk gruplarında içilen sigara miktarı ile koroner kalp hastalığı arasında güçlü bir ilişki gösterilmiştir(132). Sigara içiciliği riski ikiüç kat arttırır ve diğer risk faktörleri ile etkileşerek riskin artışına neden olur. Sigaradaki modifikasyonların ve filtrelerin riski azalttığına dair bir kanıt yoktur. Sigara içenlerde miyokard enfarktüsü ve kardiyak ölüm riski içmeyenlere göre erkeklerde 2.7, kadınlarda 4.7 kat daha fazla bulunmuştur(133). Sigara içiciliği, mortalitenin en önemli önlenebilir nedenidir. TEKHARF çalışması, sigara içiminin ülkemizde en yaygın risk faktörü olduğunu ortaya koymaktadır. Günde 10 sigaradan fazla miktarda sigara tüketme, koroner olay riskini 1.7 kat, herhangi bir nedenli ölüm oranını 2-2.5 kat yükseltmektedir. Sigara içme alışkanlığı, ülkemizde erkeklerde azalma, kadınlarımızda ise artma eğilimindedir. Kadınlarımızda koroner kalp hastalığı mortalitesinin Avrupa ülkeleri arasında en yüksek seviyede olduğu göz önüne alındığında, kadınlarımızda sigara içme eğilimindeki bu artışın ciddiyeti daha da önem kazanmaktadır. Aktif sigara içiciliği uzun zamandan beri bir risk faktörü olarak belirlenmiştir, sigara dumanına çevresel olarak maruz kalma veya pasif içicilik de değiştirilebilir bir risk faktörü olarak saptanmıştır . Onsekiz epidemiyolojik çalışmanın yapılan bir metaanalizinde sigara içmeyen bir insanın sigara dumanına maruz kalmasının riski %20-30 arttırdığı gösterilmiştir(134). Bu risk solunum yolu kanserlerine ve diğer sigara ile alakalı hastalıklara ek bir riskdir. Patofizyolojik çalışmalar sigara içiciliğinin koroner kalp hastalığına neden olma mekanizmaları hakkında pek çok öneri ortaya atmıştır. Sigara içen kişilerde okside LDL de dahil olmak üzere oksidasyon ürünleri artmış olarak bulunmuştur(135). Sigara içiciliği HDL’nin kardiyoprotektif etkilerini ortadan kaldırır. Bu etkiler, karbonmonoksit ve nikotinin direkt etkileri ile birlikte endotel hasarı oluşturur. Bu mekanizmalar yolu ile sigara içenlerde vasküler reaktivite artar. Kanın oksijen taşıma kapasitesinin azalması myokardiyal iskemi eşiğini düşürür ve koroner spazm riskini artırır. Sigara içiciliği aynı zamanda artmış fibrinojen seviyeleri ve artmış trombosit agregasyonu ile birliktedir(136). Sigara kullanımının bırakılması Koroner kalp hastalığı olaylarında düşüş ile birliktedir. Daha önceden sigara içen bir kişinin sigarayı bırakması halinde göreceli riski sigara içmeyen bir kişinin risk seviyelerine bir yıl ya da daha az sürede iner . 35 yaşında bir kişinin sigarayı bırakması halinde koroner kalp hastalığı olaylarının azalması ile birlikte yaşam süresinin 3 ile 5 yıl uzadığı hesaplanmıştır(137). Myokard enfarktüsü geçirmiş olan bir hastada tekrarlayan olay riski sigara kullanımının bırakılması ile azalır. Sigara içmeye devam eden bir kişi ile karşılaştırıldığında tekrarlayan olay riski %50 oranında azalır (133,138) DİYABETES MELLİTUS Diyabet koroner kalp hastalığı için bağımsız bir risk faktörüdür ve erkek ve kadında riski sırası ile iki ile dört kat artırır (97,139). Myokard enfarktüsü hikayesi olmayan diyabetik hastaların koroner mortalite riski, myokard enfarktüsü geçirmiş diyabetik olmayan hastaların riski ile aynıdır. Tip 2 diyabeti olan bir hasta myokard enfarktüsü geçirdiğinde bu hastaların sağkalım prognozu, diyabeti olmayan koroner kalp hastalığı hastalarından çok daha kötüdür. Tip 2 diyabetli hastalarda artmış kardiyovasküler riskin en önemli belirleyici özelliği, muhtemelen, insülin rezistansı ile birlikte görülen ve diyabetik dislipidemi olarak bilinen anormal lipoprotein profili ile ilişkilidir. Diyabetli hastalarda LDL kolesterol seviyeleri sıklıkla normale yakın seyrederken, LDL parçacıklarının daha küçüldüğü ve yoğunlaştığı ve 35 böylece daha aterojenik olma eğilimi kazandığı saptanmıştır. Diyabetik dislipideminin diğer özellikleri düşük HDL ve artmış trigliseridleri kapsamına almaktadır. Diyabet premenopozal kadınların koroner kalp hastalığı korunmasını ortadan kaldırır(124). Diyabetik erkekler ile karşılaştırıldığında diyabetik kadınların tekrarlayan myokard enfarktüsü riski iki kat daha fazladır(140). Diyabetik erkekler ile karşılaştırıldığında diyabetik kadınlarda daha fazla koroner kalp hastalığı riskinin gözlenmesi, kısmen diyabetin kadınlarda lipoproteinler üzerindeki kötü etkilerine bağlanmaktadır. TEKHARF çalışmasında, ülkemizde Tip 2 Diyabet prevalansının erişkinlerimizde 2 milyona vardığını, diyabetli sayısının yılda ortalama %6 veya 120 bin arttığını ortaya koymuş, bunun da kardiyovasküler sağlığımız için kaygı verici olduğunu vurgulamıştır. Diyabetin, sistolik kan basıncı, santral obezite ve dislipidemiden bağımsız olarak kardiyak olayları %70 dolayında yükselttiği prospektif olarak gösterilmiştir. Hiperinsülineminin diyabetli olmayan erkek ve kadınlarımızda koroner kalp hastalığının önemli bağımsız bir etkeni olduğu ortaya konulmuştur. Diyabetin ateroskleroza yol açma mekanizmaları, düşük HDL, yüksek trigliserid/ artmış lipoprotein kalıntı partikülleri, artmış LDL, yüksek Lp(a) konsantrasyonu, artmış lipoprotein oksidasyonu, LDL glikasyonu, artmış fibrinojen, artmış trombosit agregasyonu, artmış PAI-1, bozulmuş fibrinoliz, yüksek von Willebrand faktör seviyeleri, hiperinsülinemi ve bozulmuş endotel fonksiyonlarını içerir(99). Diyabetin koroner kalp hastalığı riskini artırdığına dair gözlemsel veriler bulunmasına rağmen, glisemik kontrolün riski azalttığına dair çok az veri mevcuttur(99). Yoğun glisemik kontrolün makrovasküler sonlanma noktalarını azalttığına dair güçlü kanıtlar olmamasına rağmen diyabetik hastalarda yoğun lipid kontrolü koroner kalp hastalığı riskini azaltmaktadır. NCEP ve Amerika Diyabet Birliği (American Diabetes Association, ADA) klavuzu diyabetik hastaların primer korumasında daha düşük bir LDL hedefi (<100mg/dl) belirlemiştir(97,139). Amerika Kalp Birliği (American Heart Association, AHA) diyabetik hastalarda normale yakın açlık kan şekeri seviyeleri ve normalin ≤ %1 'inden daha az yüksek seviyelerde HbAlc seviyelerini tedavi hedefi olarak belirlemiştir(139). HbAlc'de sağlanan %1 oranındaki düşmenin mikrovasküler komplikasyonlarda %30 azalma sağladığı gösterilmiştir(141). Diyabetik olgularda vasküler komplikasyonların gelişiminde hipertansiyon önemli bir risk faktörüdür ve diyabeti olmayanlara göre hipertansiyon 2 kat daha sıktır. Hem makrovasküler, hem de mikrovasküler komplikasyonları azaltmada kan basıncı kontrolünün önemi açık olarak gösterilmiştir(142). Bu olgularda hipertansiyon erken ve sıkı bir şekilde tedavi edilmeli, hedef kan basıncı < 130/80mmHg olmalıdır. Özellikle proteinürisi olan diyabetlilerde agresif kan basıncı kontrolü çok önemlidir. Hipertansiyonu olan diyabetiklerde ilk seçenek ilaç olarak ACE İnhibitörleri veya anjiyotensin II reseptör blokerlerinin kullanılması uygundur .. Güçlü kontrendikasyonlar olmadığı müddetce myokard enfarktüsü sonrası diyabetik hastalarda beta blokerler kesilmemelidirler, çünkü diyabetik myokard enfarktüslü hastalar beta blokerler ile tedavi edildiklerinde mortaliteleri azalmaktadır. OBEZİTE Obezite AHA tarafından koroner kalp hastalığı için majör bir risk faktörü olarak tanımlanmıştır(143). Obezite, prevalansı bütün dünyada giderek artan ve birçok ülkede epidemik boyutlara ulaşan bir sağlık sorunu haline gelmiştir(. Amerika Birleşik Devletlerinde yetişkinlerin hemen hemen üçte biri fazla kiloludur, beşte biri ise obez tanımına uymaktadır TEKHARF çalışmasına göre, obezitenin ülkemizdeki prevalansı 30 yaş üzerinde erkeklerde %21, kadınlarda %43 'tür. Yine ülkemizde yaşlanmanın etkisi için yapılan düzeltmelerden sonra bile 10 yıl içinde beden kitle indeksi kadınlarda 1.26 kg/m2, erkeklerde 36 1.29 kg/m2 artmıştır. Bu da bize, kendi toplumumuzun da hızlı bir şişmanlama eğilimi içinde olduğunu göstermektedir(144). Obezite, insülin direnci, hiperinsülinemi, tip 2 diyabet, hipertansiyon, hipertrigliseridemi, düşük HDL kolesterol, düşük yoğun LDL, protrombik faktörler ve sol ventrikül hipertrofısi birliktelik gösterir(131. Obezite artmış kardiyovasküler ve tüm sebeplere bağlı mortalite ile beraberdir. FİZİKSEL İNAKTİVİTE Fiziksel inaktivite koroner kalp hastalığı için bağımsız bir risk faktörüdür ve riski ortalama olarak iki kat artırır. Haftalık yapılan egzersiz dozu ile kardiovasküler ölüm ve tüm nedenlere bağlı ölüm arasında doza bağlı bir ilişki mevcuttur.(145) Fiziksel aktivite insanlarda anjiografik olarak tanımlanmış koroner aterosklerozun ilerlemesini engeller. Daha çok erkekler üzerinde yapılan 50’nin üzerindeki çalışmada fiziksel aktivitenin koroner kalp hastalığı riskini azalttığı sağlanmıştır. Düzenli fiziksel aktivite ile kilo azalmakta, LDL kolesterol ve trigliserid düzeyleri düşmekte, HDL kolesterol düzeyleri yükselmekte, insüline duyarlık artmakta kan basıncı düşmekte, endotele bağlı vazodilatasyon,ve fibrinolitik aktivite artmaktadır. TEKHARF çalışmasında fiziksel inaktivitenin, hem gelecekteki koroner ölümler için, hem de kesitsel taramada koroner kalp hastalığı tanısı için, multivariye analizde, diğer önemli koroner risk öngördürücülerinden bağımsız anlamlı bir risk faktörü olduğu gösterilmiştir. Yetişkinlerimizde gelecekteki koroner mortalitenin özellikle erkeklerde, prevalan koroner kalp hastalığının da özellikle kadınlarda bağımsız belirleyicileri arasına giren fıziksel etkinliğin, kronik inflamasyon sürecine, diyastolik hipertansiyon ile glukoz intoleransına karşı koyduğu, kadınlarımızda HDL kolesterolü yükseltmede ve erkeklerimizde hiperkolesteroleminin önlenmesinde yararlı olduğu anlaşılmıştır. Fizik aktivitenin son 10 yıl içinde orta yaşlı Türk kadınlarında %8 oranında azalması kaygı verici bir gelişme olarak görülmelidir. Fiziksel inaktivite, düzeltilebilecek major risk faktörleri arasında sıralanmış ve terapötik yaşam tarzı değişiklikleri girişiminde odaklanılacak ana hedef olarak kabul edilmiştir(97). Yapılacak fizik egzersizin tipi, sıklığı, şiddeti ve süresi önemlidir. Haftada en az 4 gün düzenli olarak, yarım saati aşan sürelerde, hızlı yürüme, merdiven çıkma, yüzme, bisiklete binme, dansetme ve benzeri, orta şiddette, büyük kas gruplarının ardısıra kasılıp gevşemesini sağlayan her türlü dinamik egzersiz, koroner kalp hastalığı riskini azaltmakta yararlı olmaktadır(124). Daha yoğun egzersiz, özellikle yaşlılarda, kalp hastalığı olanlarda ve yüksek riskli kimselerde sakıncalı olup, 1/60.000 oranında ani ölüm ve bundan 7 kat yüksek olarak miyokard enfarktüsüne yol açma gibi ciddi riskler taşımaktadır. Bu nedenle, orta riskli grupta bulunan yaşı 45'i aşan erkekler ve 55'i aşan kadınlar ile yüksek riskli kimseler, önce semptomla sınırlı efor testi ile değerlendirilmeli, yapabilecekleri egzersiz düzeyi belirlendikten sonra egzersiz önerilmelidir . Egzersiz kişinin kendini iyi hissettiği zamanlarda, açken veya yemekten iki saat sonra, yeterli sıvı alınarak, çok sıcak, nemli ve aşırı güneşli olmayan ortamda, rahat elbise ve ayakkabı ile yapılmalı, yavaş başlamalı ve yavaş sonlandırılmalıdır; aşırı yorgunluk, göğüste baskı, ağrı ve benzeri rahatsızlık, nefes darlığı, kas, iskelet ve eklem ağrısı gibi yakınmalar ortaya çıktığında egzersize devam etmemeli ve doktora başvurmalıdır. ATEROJENİK DİYET Aterojenik diyet ve fiziksel aktivite azlığı sigara kullanımından sonra ölümün önlenebilir nedenleri olarak düşünülebilinir. Epidemiyolojik veriler kolesterolden ve hayvansal yağlardan 37 zengin diyet tüketen toplumlarda koroner kalp hastalığı oranlarının yüksek olduğunu göstermiştir. Buna karşılık, yüksek oranda balık ve sebze tüketen toplumlarda koroner kalp hastalığı oranı düşüktür(146). 1970 ve 1980' lerde hayvansal yağ tüketimini arttırmış olan toplumlarda koroner kalp hastalığı mortalite oranları yükselmiştir, yıllık yağ tüketimini azaltan toplumlarda ise koroner kalp hastalığı mortalitesi azalmıştır .. Aynı şekilde sodyum alımı fazla olan populasyonlarda ortalama kan basıncı yüksektir. Kişi bazında, modifiye diyetler ile yapılmış son klinik çalışmalarda anjiyografık ilerleme ve klinik hastalığın tekrarlaması azalmıştır. Batı tipi diyetin etkilerinin doymuş yağlar, diyetteki kolesterol ve sodyum ile LDL kolesterol, vücut ağırlığı, diyabet ve kan basıncı gibi geleneksel risk faktörleri üzerinden zararlı etkilerini gösterdiği düşünülmüştür. Lyon Diyet Kalp çalışması alfa-linoleik asitten zengin olan Akdeniz tipi diyet ile batı tipi diyeti karşılaştırmıştır ve geleneksel risk faktörlerinde belirgin değişiklik olmaksızın tekrarlayan koroner olaylarda %65 risk redüksiyonu saptamıştır. Bu kazançların açıklaması olarak öne sürülen mekanizmalar antioksidan, antiinflamatuar ve antitrombosit etkilerdir. Doymuş yağ, kolesterol ve sodyumdan düşük, tekli doymamış yağ, meyve, sebze ve balıktan zengin diyetin bu belirgin ve bağımsız yararı, aterojenik diyetin ayrı ve modifiye edilebilir bir risk faktörü olduğunu göstermektedir(99). Hayvansal yağ, kolesterol ve sodyum tüketiminin azaltılması populasyona dayalı koroner hastalık korumasında ana hedef olmalıdır. Dislipidemi, hipertansiyon, diyabet ve obezitenin tedavisinde diyetsel intervasyonlar ilk adım olmalıdır. STARS Çalışması(147) ve Yaşam Tarzı Kalp Çalışması(148) gibi düşük yağ diyetleri ile yapılan çalışmalarda LDL kolesterol düşürülmesi ile yeni veya ilerleyen koroner darlıklarda azalma saptanmıştır. Oslo Diyet Kalp Çalışması sigara kullanımının bırakılması ve doymuş yağlardan düşük diyet tüketiminin reinfarktüs oranlarını belirgin oranlarda düşürdüğünü göstermiştir(149). Lyon Diyet Kalp Çalışmasında alfa-linoleik asitten zengin olan Akdeniz tipi diyet 4 yıllık dönemde tekrarlayan kardiyak olayları ve ölümü %65 oranında azaltmıştır(150). Bu kazancın büyüklüğü lipid düşürücü ilaçlar ile yapılmış olan çeşitli çalışmalar ile aynı ya da daha fazladır. Şu andaki diyet önerileri doymuş yağ, kolesterol ve sodyumdan düşük, meyve ve sebzelerden yüksek, dengeli bir diyetin önemini vurgulamaktadır. Yağdan çok fakir diyetlerin tolere edilmesi zordur ve uzun dönem güvenilirliği ve verimliliği şüphelidir. Kalorisinin %30'undan daha azı yağ olan diyetler genellikle önerilmektedir ve bu diyetin kalorik içeriği ideal vücut ağırlığını devam ettirecek şekilde olmalıdır. Vasküler hastalığı veya hiperlipidemisi olan hastalar için günlük doymuş yağ oranı < %7 ve günlük toplam kolesterol alımı < 200 mg şeklinde olmalıdır(2). Karbonhidratlar ile karşılaştırıldığında balıklardan elde edilen tekli doymamış yağlar ve omega-3 yağ asitleri iyi bir kalori kaynağı olabilir. YAŞ VE CİNSİYET Koroner kalp hastalığı insidansı ve prevalansı yaş ile artar, böylece yaş en önemli risk faktörü olarak düşünülebilinir(99). Aterosklerozun erken lezyonlarının çocukluk çağında ortaya çıkmasına rağmen koroner kalp hastalığından ölüm oranı ile belirlenen klinik olarak aşikar hastalığın görülmesi ileri yaşlarda, her dekadda artar. Örneğin 40 yaşından 60 yaşına kadar myokard enfarktüsü insidansında 5 kattan fazla artış vardır. Erkeklerde 45 yaş, kadınlarda 55 yaş üzeri koroner kalp hastalığı için güçlü bir risk faktörüdür(96). Diğer risk faktörleri eşitse, erkekler ateroskleroza kadınlardan çok daha fazla eğilimlidirler. Kadınlar menopoza kadar, hastalık yapan ileri aterosklerozdan bir miktar korunurlar ki, diyabet veya az görülen (olasılıkla ailesel) hiperlipidemi formları veya ciddi hipertansiyon gibi predispozan durumlar olmadığı sürece premenopozal kadında myokard enfarktüsü nadirdir(97). Erkeklerdeki koroner kalp hastalığı insidansı oranları, 10 yaş daha 38 yaşlı olan kadınlar ile aynıdır. 35-55 yaşları arasında koroner kalp hastalığından ölüm oranı beyaz kadınlarda beyaz erkeklerin beşte biridir. Kadınlar lehine olan bu korunma, menopozdan sonra, myokard enfarktüsü sıklığının her iki cinsiyette de aynı olduğu yedincisekizinci dekada doğru yavaş yavaş azalır. Yaklaşık olarak kadınların % 52'si, erkeklerin % 46'sı aterosklerotik hastalık nedeniyle ölmektedir. Erkeklerde ve yaşlı kişilerde artmış risk oranları değiştirilebilir risk faktörlerinin daha yoğun bir biçimde tedavi edilmesini gerektirir. AİLESEL PREDİSPOZİSYON 35' in üzerinde vaka kontrollü ve ileriye dönük çalışmada, koroner kalp hastalığı ile ailede birinci derece yakınların erken başlangıçlı koroner kalp hastalığı hikayesi arasında ilişki saptanmıştır. Bu risk genellikle diğer risk faktörlerinin düzeltilmesinden sonra da devam eder . Koroner hastalık için en güçlü aile hikayesi birinci derece bir yakında erken yaşta koroner kalp hastalığı öyküsü olmasıdır. Baba veya diğer birinci derece erkek akrabalarda 55 yaşından önce, anne veya diğer birinci derece kadın akrabalarda 65 yaşından önce erken koroner arter hastalığı gelişiminin olması, o kişide ateroskleroz gelişim riskini 1,31,6 kat artırmaktadır(96,99). Erken yaşta koroner kalp hastalığına sahip yakın sayısı arttıkça veya ailede koroner kalp hastalığına yakalanma yaşı azaldıkça, aile öyküsünün tahmin edici değeri artar. Değiştirilemez bir risk faktörü olarak düşünülse de, pozitif aile hikayesi, ailelerde toplanmış olan risk faktörleri açısından kişinin ayrıntılı olarak taranmasını gerektirir. Bu ailesel aggregasyonlar bilinen fenotipik expresyonları ve kalıtımsal paternleri olan monojenik faktörleri, daha az bilinen expresyon ve kalıtım paternleri olan polijenik faktörleri veya paylaşılan çevreyi temsil edebilir(99). Williams ve arkadaşları, erken koroner kalp hastalığı öyküsü bulunan aileler üzerinde yaptıkları incelemede,sadece %10 ailede konkordant risk faktörü olmadığını saptamıştır. Bu bakımdan, erken yaşta koroner kalp hastalığı saptanmış bireylerin birinci derece akrabaları risk faktörleri açısından taranmalıdır. MENAPOZ, ESTROGEN VE ORAL KONTRASEPTİFLER(151) KKH aynı yaştaki erkeklere oranla premenepozal kadınlarda çok daha seyrektir. Kadın ve erkek hastalar arasındaki bu fark 35-44 yaşları arasında daha da belirgindir. Menapoz sonrası dönemde kadınların KKH'na yakalanma oranları erkeklere yaklaşmaktadır. Ateroskleroz oluşumu kadın ve erkeklerde farklı değildir. Ayrıca her iki cins içinde KKH riski oluşturan faktörler aynıdır. Kadın ve erkeklerde koroner aterosklerozun prevalansındaki farklılık estrogen ve androgenik hormonların fonksiyonlarının farklı olmasına bağlıdır. Pubertede, erkeklerde dolaşan testosteron düzeyleri, kadınlarda ise estrogen yapımı artar. HDL düzeyleri puberteye kadar kadın ve erkeklerde eşit düzeydedir. Fakat puberteden sonra testosteron etkisiyle erkeklerde HDL düzeyleri düşmektedir. Testosteron en belirgin olarak HDL2 fraksiyonunu etkilemektedir. Doğal menapozda biyokimyasal parametreler üzerine değişiklikler oluşmaktadır. Menapozda serum HDL düzeyleri tedricen azalır ve serum total kolestrol ve LDL-kolestrol düzeyi ise artar. Lipid profilindeki bu değişikliklerin ateroskleroza predispozan faktör olduğu bilinmektedir. Lipidlerdeki bu olumsuz değişiklik hormon replasman tedavisi ile düzeltilebilir. Postmenapozal kadınlarda dolaşımdaki küçük, yoğun HDL partiküllerinin de arttığı gösterilmiştir. Olasılıkla bu partiküllerin de ateroskleroz gelişiminde rolü vardır. Yapılan çalışmalarda postmenapozal dönemde kullanılan estrogenin koroner ateroskleroz oluşumunu yavaşlattığı gösterilmiştir. Menapozdaki estrogen alan kadınlarda HDL kolestrol, almayanlara göre %20 oranında yüksek bulunmuştur. 39 Oral kontraseptiflerin etkisi daha komplekstir. Çünkü bu preparatlar değişik oranlarda hem estrogen hem de progesteron ihtiva ederler. Progesterol analogları hem trigliserid hem de HDL düzeylerini düşürür. Bu komplikasyonların ateroskleroz üzerine olan etkisinin ortaya çıkarılması gerekmektedir. Oral kontraseptiflerdeki progesteron ve estrogen dozu genellikle düşük düzeydedir ve kardiyak risk üzerine olan etkisi bu iki ilacın rölatif konsantrasyonlarına bağlıdır. Testosteron içermeyen ajanlar HDL'yi önemli derecede azaltmaktadır. Fakat estrogenin trigliserid ve HDL'yi arttırdığı ve LDL'yi azalttığı bilinmektedir. Mann ve arkadaşlarının yaptığı bir çalışmada ilk kez oral kontraseptif kullanan hastalarda akut MI riskinin arttığı gösterilmiştir. Bu çalışmada oral kontraseptif kullananlarda kullanmayanlara göre rölatif riskin 4.5 kat arttığı saptanmıştır. Bu hastalarda sigara içiminin bu riski daha da arttırdığı gösterilmiştir. Ancak son yıllarda bu konuda tereddütler ortaya çıkmıştır. Son yıllarda yapılan çalışmalarda oral kontraseptiflerin KKH oranını arttırmadığı gösterilmiştir. Bu araştırma çalışma sonuçlannın da gösterdiği gibi, oral kontraseptiflerin KKH üzerine etkileri henüz açıklık kazanmamıştır. PSİKOLOJİK, SOSYAL, KÜLTÜREL VE YAPISAL FAKTÖRLER(151) Günümüzde birçok araştırmacı psikolojik faktörlerin KKH insidansında önemli rol oynadığını iddia etmektedir. Stres gibi birçok psikolojik faktörün KKH oluşturmadaki etki mekanizmaları tam olarak aydınlatılamamıştır. Yapılan çalışmalarda depresyon ve anksiyete gibi psikolojik bozukluğu olan bireylerde emosyonel stresin KKH semptomlarını arttırdığı gösterilmiştir. Ayrıca İsveç'te yapılan bir çalışmada emosyonel faktörler ile akut MI arasında belirgin bir ilişki saptanmıştır. Klinik izlemelerde, KKH olan hastalarda psikolojik gerginliklerin, anginal atakların başlamasına neden olduğu gözlenmektedir. KKH olan hastalara psikolojik gerginliklerden uzak durması önerilmeli ve gerekirse sedatif ilaçlar verilmelidir. PROSTAGLANDİNLER VE ENDOTELYAL FAKTÖRLER(151) Son yıllarda yapılan araştırma çalışmalarında lokal etkili endotelyal faktörlerin ve prostaglandinlerin aterosklerozdaki rolü araştırılmaktadır. Trombozisde önemli rol oynayan tromboksan A2 (TxA2) ile antitrombotik etkisi olan prostasiklin (PGI2) hem sistemik hem de lokal etkili vazoaktif maddelerdir. Bu iki madde arasındaki denge bozukluğu koroner kan akımını etkilemektedir. Özellikle TxA2'nin ateroskleroz oluşumunu hızlandırdığı iddia edilmektedir. Son yıllarda bulunan endotelin bilinen en güçlü vazokonstrüktör maddedir. Aynı şekilde lokal etkili anjiyotensin II de hem vazokonstrüktör hem de proliferatif özelliği olan bir ajandır. Bunların karşıtı olarak endothel derivating relaxing factor (EDRF) veya nitrik oksit (NO) ise vazodilatatör etkili bir ajandır. Bu lokal etkili endotelyal faktörlerin ateroskleroz oluşumunda neden mi yoksa sonuç mu olduğu tam olarak bilinmemektedir. Bu konuda yoğun araştırma çalışmaları yapılmaktadır. ALKOL(151) Aşırı alkol alımı önemli bir morbidite ve mortalite nedenidir. Alkolün kardiyovasküler sistem üzerine etkileri oldukça karışıktır. Alkol koroner ateroskleroz olmadığında dilate kardiyomiyopati ile ilişkili olabilir. Yapılan çalışmalarda, aşırı alkol alımının yüksek kan basıncı ile birlikte olduğu ortaya konmuştur. Fakat orta derecede alkol alımının total veya KKH'na bağlı mortaliteyi arttırıp arttırmadığı bilinmemektedir. Birçok çalışmada orta derecede alkol alımı ile kardiyak olaylar arasında ters bir ilişki olduğu gösterilmiştir. Fakat bu görüşü desteklemeyen araştırmalarda mevcuttur. 40 Orta derecede alkol alımının KKH'lığından korunmada faydalı olabileceği konusunda geniş oranda spekülasyon yapılmıştır; halen de yapılmaktadır. Bu konu halen tartışılmaktadır. Alkol almayan bireylere alkol alması tavsiye edilmemektedir. Alkol alan bireylerde erkekler için haftada toplam 190 g'ı, bayanlar için 130 g'ı geçmemeleri önerilmelidir. BAZI ESER ELEMENTLER(151) Klevay yaptığı araştırmalarda bakır eksikliğinin veya çinko fazlalığının sekonder hiperkolestrolemiye zemin hazırladığını ve bu yolla aterosklerozise neden olduğunu saptamıştır. Eser elementlerin KKH üzerine etkileri henüz tam açıklanamamıştır. Bu konuda araştırma çalışmaları devam etmektedir. SUYUN SERTLİĞİ(151) Çeşitli araştırmacılar yaptıkları çalışmalarda suyun sertliği ile kardiyovasküler mortalitenin ters orantılı olduğunu bulmuşlardır.Ancak bu görüşü destekleyen prospektif çalışmalar mevcut değildir. HİPERKALSEMİ(151) Arteryel duvardaki kalsiyum fazlalığı ateroskleroz patogenezinde rol oynayabilir. İntrasellüler kalsiyum birikimi vasküler tonusu arttırır ve böylece kolestrol birikimi ve aterosklerotik plak oluşumuna katkıda bulunur. Arter duvarının kalsiyuma olan afinitesi yaş ile artar. Verapamil, diltiazem ve nifedipin gibi kalsiyum antagonistleri deneysel aterogenez oluşumunu inhibe eder. Bir raporda, nifedipinin yeni koroner arter lezyon oluşumunu azalttığı gösterilmiştir. HİPERKOAGULABİLİTE(151) Framingham çalışması dahil birçok epidemiyolojik çalışmada fibrinojen konsantrasyonu KKH riski arasında korelasyon saptanmıştır. Fibrinojen aynı zamanda kolestrol ve trigliserid konsantrasyonları ile de pozitif ilişki gösterir. Fibrinojen ayrıca sigara, obezite ve sosyoekonomik stres ile de korelasyon göstermektedir. Faktör VII de hiperlipidemi özellikle hipertrigliseridemi ile pozitif korelasyon gösterdiği bilinmektedir. Bazı çalışmalarda KKH olanlarda antitrombin III aktivitesinde azalma rapor edilmiştir. Trombosit agregasyonunun aterogenez patogenezinde majör rol oynadığına inanılmaktadır. Koroner aterosklerozu olan hastalarda trombosit agregasyonunda artış saptanmıştır. KKH'lığı oluşmamış bireylerde yapılan çalışmalarda günaşırı alınan 325 mg aspirinin MI riskini %44 oranında azalttığı saptanmıştır. Unstable angina ve diğer akut iskemik sendromların tedavisinde antipletelet (aspirin, dipridemol...) tedavinin müsbet etkisi gösterilmiştir. Risk faktörü olan bireylerde primer korunmada ve KKH'lığı tanısı konanlarda ise sekonder korunmada antipletelet ilaçlar (özellikle aspirin günde 75-325 mg) önerilebilir. VASEKTOMİ(151) Vasektomi ile MI arasındaki korelasyon tartışmalıdır. Deney hayvanlarında yapılan çalışmalarda, vasektominin ateroskleroz şiddetini arttırdığı saptanmıştır. Fakat epidemiyolojik çalışmalarda vasektomi ile koroner olaylar arasında bir bağlantı bulunamamıştır. KAHVE İÇİMİ(151) Kahve içiminin KKH için risk olup olmadığı epidemiyolojik çalışmalarda tam olarak ortaya konulamamıştır. Kahvenin erkeklerde total kolesterol ve LDL kolesterol düzeyini azalttığı, kadınlarda ise her iki lipid fraksiyonunu artırdığı gözlenmiştir. Kahve alımı sempatik aktiviteyi arttırarak taşikardi ve ekstrasistollere neden olmaktadır. Bu nedenle KKH'lığı olanların fazla kahve almamaları uygun olur. 41 HİPERÜRİSEMİ(151) Birçok çalışmada yüksek ürik asit düzeyleri ile hipertrigliseridemi arasında anlamlı bir ilişki olduğu ortaya konmuştur. Framingham çalışmasında ürik asit konsantrasyonu ile hem sistolik hem de diyastolik basınç arasında korelasyon olduğu ortaya konmuştur. Ürik asiti yüksek olan hastalar izlenmeli ve ürik asiti normal düzeylerde tutacak diyet ve ilaç tedavisi yapılmalıdır. KALP TRANSPLANTASYONU(151) Kalp transplantasyonu olan hastalardaki en büyük problemlerden biri ateroskleroz oluşumunun hızlanmasıdır. Sitotoksik B-hücresi antikorların neden olduğu kronik immün hasar ve lipid profilindeki değişiklikler transplanta bağlı aterosklerozda önemli faktörlerdir. Siklosporin LDL reseptör aktivitesini azalttığı ve böylece total ve LDL-kolestrol'ü arttırdığı ve HDL kolestrol'ü azalttığı gösterilmiştir. Donör yaşının büyük olması ve plazma trigliserid düzeylerinin yüksek olması da ateroskleroz gelişiminde önemlidir. Kalp transplantasyonu yapılmış hastalar risk faktörlerinden daha dikkatli bir şekilde korunmalıdır. GENETİK FAKTÖRLERİN ROLÜ Miyokard iskemisinin oluşması ile direkt olarak ilişkili bilinen genetik faktör olmamasına rağmen, miyokard iskemisinin anatomik belirleyicileri olan koroner ateroskleroz ve tromboza predispozisyon üzerinde etkili genetik faktörler vardır. Bu genetik faktörler, lipoprotein metabolizması, hemostatik sistem, enflamasyon ve matriks regülasyonu, homosistein metabolizması, demir metabolizması, insülin direnci, hipertansiyon, renin-anjiyotensin sistemi, endotelyal NO sentezi ve hücresel redoks durumu ile ilgili çeşitli genlerde hem mutasyon, hem de polimorfizmi içerir. Bu faktörlere ek olarak, genetik etkiler, koroner arter hastalığının sonuçlarını hafifletmek açısından önemli rol oynayan koroner kollateral dolaşımının boyutunun ve yeterliliğinin belirleyicileri arasında olabilir. KLİNİK ÖZELLİKLER Ateroskleroza bağlı koroner stenozun yanında,endotel disfonksiyonunun,vazokonstriksiyonun ve tromboz ile birlikte plak parçalanmasının daha iyi anlaşılması, miyokard iskemisinin hafifletilmesi için daha gelişmiş terapötik seçeneklere yol açmıştır. Miyokard iskemisi şu noktaları gerçekleştiren müdahelelerle hafifletilebilir: • Koroner stenozun şiddetini azaltan(perkütan translüminal koroner anjioplasti/stent); • Stenozu atlayan(by-pass cerrahi); • Myokardial oksijen gereksinimini azaltan(beta-blokerler,kalp hızını yavaşlatan kalsiyum kanal blokerleri ,nitratlar) • Koroner vazomotor tonusu direkt olarak azaltan(nitratlar, kalsiyum kanal blokerleri); • Endotelyal fonksiyonu düzelten (lipid düşürücü, risk faktörünü modifiye eden tedaviler, oral L-arginin) ;ve • Plak stabilizasyonu (lipid düşürücü ve risk faktörünü modifiye eden tedaviler)ve antitrombotik aktivite (anstabil sendromlarda antitrombosit ve antikoagülan ilaçlar) yoluyla plak parçalanmasını önleyen. Miyokardiyal hibernasyona yol açan persistan veya tekrarlayan iskemi,kronik ciddi sol ventrikül disfonksiyonu ve konjestif kalp yetmezliği sendromuna neden olabilir (koroner arter hastalığı olanlarda); invazif tedavi ile perfüzyonun yeniden oluşturulması, yaşam kalitesi ve sürviyi iyileştirebilir. Kollateraller ve kollateral büyümesini etkileyen faktörlerin koruyucu rolünün daha iyi anlaşılması, terapötik anjiyogenez düşüncesine yol açmıştır. Bu düşünce 42 invazif revaskülarizasyona yanıt vermeyecek olan son safha semptomatik iskemik kalp hastalığı olan hastalarda, miyokard perfüzyonunu ve yaşam kalitesini iyileştirmek için yeni bir yaklaşım sağlayabilir. Son olarak, iskemik ön koşullanma fenomeni, terapötik açıdan diğer bir potansiyel hedef olasılığını ortaya koyar. AKUT MİYOKARD İSKEMİSİ VE ENFARKTÜSÜN TANISI Miyokard hasarı olmaksızın akut koroner sendromları,az miktarda kardiyak hasar öğesi bulunan kişilerden ayırt etmenin, günümüzde her zamankinden daha zor olduğu açık olarak görülmektedir. Bu ikinci guptaki hastalar, miyokard enfaktüsü olan hastalardır.(152) Klinik durum uygunsa veya EKG bulguları varsa, biyomarkerların yüksek olması akut iskemik kardiyak hasar tanısına götürecektir. Biyomarkerlar günümüzde çok daha duyarlıdır ve yeni markerların kanda yüksek düzeyde bulunması, geçmişte kullanılan markerlara göre çok daha uzun süre devam etmektedir. Biyomarkerlarda, akut iskemik kalp hastalığı dışındaki kardiyak hastalıklara bağlı yükselme, sık olarak saptanmaktadır. Bu nedenle, iskemik etyolojiye bağlı akut miyokard hasarını saptamak için, hastanın ilk prezantasyonuna, altta yatan risk faktörlerine ve EKG incelemesine daha fazla odaklanılmalıdır. KLİNİK PREZANTASYONLAR Miyokard iskemisinin klasik tarifi, adrenerjik, semptomlarla ilişkili olan ezici veya bunaltıcı retrosternal rahatsızlıktır; ancak, böyle bir prezentasyon, daha az karakteristik bir şekilde prezente olan belli gruplarda olağan dışıdır. Örneğin, karakteristik ağrı, özellikle daha sık olarak ilerlemiş yaşlarda prezente olan kadınlarda olmak üzere yaşlılarda nadir görülür. Bu nedenle, bu gruplarda, şüphe düzeyinin yüksek tutulması gerekir. Diyabetik hastalarda da atipik prezentasyon kuraldır.(153) The National Heart Attack Group Program,(154) şu bulgularla prezente olan hastaların, muhtemel miyokard enfarktüsü açısından değerlendirilmelerini önermiştir: • Göğüste ağrı, basınç hissi, sıkışma veya ağırlık hissi veya boyun, çene, omuzlar, sırt veya kollara yansıyan ağrı; • Hazımsızlık veya mide yanması/bulantı ve/veya kusma-bulantı, akut enfarktüsü olan hastaların %50 kadarında, çoğunlukla diğer semptomlarla birlikte görülür; • Nefes darlığı; • Halsizlik, baygınlık hissi, sersemleşme veya bilinç kaybı. Koroner arter hastalığı için risk faktörlerinin varlığı, EKG diyagnostik veya tamamen normal olduğu zaman, nadiren yararlı olur, ama bu parametrelerin daha az kesin olduğu kişilerde, koroner kalp hastalığının varlığı veya yüksek riskinin olması, ilk değerlendirmede tanının doğruluğunu destekler. Hastaların %50 kadarında da, prodromal semptomlar olabilir.Son olarak, akut enfarktüsü olan hastaların disproportionate bir bölümü sabah erken saatlerde prezente olur.(155) Acil birime ilk olarak gelen hastalar için, sadece miyokard iskemi/enfarktüsün klinik prezentasyonu önemli değildir, aynı zamanda uygun anamnez veremeyecek olan çeşitli hasta gruplarında, şüphe düzeyi yüksek tutulmalıdır. Örneğin, kritik durumdaki hastalarda, çoğunlukla nonspesifik EKG değişiklikleri vardır ve semptomları ile ilgili olarak spesifik bir şekilde iletişim kurabilirler veya kuramayabilirler. Benzer bir durum, postoperatif cerrahi hastalarında gözlenir. Bu grup hastalarda, örneğin diyabetikler gibi riskte olduğu bilinen hastalar ve durumu kötü olan hastalarda, altta yatan kardiyovasküler hastalık ve iskemik kalp hastalığından şüphe edilmelidir. Hastayı atak anında muayene olanağı olmadıkça, fizik muayene çoğunlukla yardımcı olmaz. Atak anında yapılan fizik muayene önemli bilgiler sağlayabilir. İskemi ile uyumlu semptomlarla birlikte olan mitral regürjitasyon üfürümü, semptomlar kaybolduktan sonra 43 kayboluyorsa, bunun diyagnostik önemi vardır. Aynı durum, üçüncü ve dördüncü kalp sesi ve pulmoner raller için de geçerlidir. Konjestif kalp yetmezliğinin varlığı da, kalp yetmezliği etyolojisinin iskemik kalp hastalığı ile ilişkili olup olmadığı konusunun düşünülmesine neden olmalıdır. Akut koroner sendromu olan anstabil anjinalı hastalar, ilk prezentasyonlarına düşük ve yüksek risk gruplarına ayrılabilir. ELEKTROKARDİYOGRAFİ EKG, sadece tanı için değil, terapötik müdahalenin etkisinin değerlendirilmesi içinde yaygın olarak kullanılan, maliyet yararlılığı yüksek bir testtir. İskeminin saptanması ve reperfüzyon için duyarlı bir testtir. Ancak, iskemik ataklar esnasında gözlenen EKG bozukluklarının özgüllüğü düşüktür. İSKEMİ ESNASINDA ERKEN ELEKTROKARDİYOGRAFİK DEĞİŞİKLİKLER Miyokard iskemisi ve enfarkt P-segmentinde, QRS kompleksinde, ST-segmentinde ve T dalgasında erken değişikliklere neden olabilir. Bazen, Q dalgası geçici olarak çok erken görülebilir. Ancak, iskeminin en tipik erken EKG bulgusu ST-segmentinde oluşur. T-dalga değişiklikleri, olayın ilk saatleri içinde bulunabilmesine rağmen, genellikle daha sonra, STsegment değişikliklerinin evrimi esnasında oluşur. Kronik ve çoğunlukla kalıcı faz, tipik olarak ST-segment deviasyonu olmaksızın devam eden Q dalgaları ile temsil edilir. Erken dönemde, subepikardiyal iskemi, iskemik bölgeyi gösteren derivasyonlarında ST-segment elevasyonu ile birliktedir. ST-segment elevasyonu, transmural iskemi varlığı (ve sonuçta enfarktüs) açısından yüksek olasılığı gösterir. Buna karşılık, ST-segment depresyonu, daha sık olarak subendokardiyal lezyonlarla ilişkilidir. Bu kuralın bir istisnası, ön derivasyonlarda ST-segment depresyonu ile prezente olabilen posterior transmural enfarktın oluşmasıdır. Subendokardiyal iskemi, iskemik bölgeyi gösteren ST-segment değişikliklerine de neden olur. Ne ST-segment elevasyonu, ne de ST-segment depresyonu, iskemi tanısı için spesifik değildir. ST segment elevasyonu, iskemi olmaksızın sol ventrikül anevrizması , miyokardit veya perikarditte görülebilir. ST-segment depresyonu, uzak bir bölgedeki subepikardiyal iskemiyi (resiprokal ST değişiklikleri) veya iskemi ile ilişkili olmayan repolarizasyon bozukluklarını (dijital etkisi, dal blokları, sol ventrikül hipertrofisi) gösterir. ST-segment değişikliklerinin, iskemiyi saptamak açısından özgüllüğü düşük, ama duyarlılığı yüksektir. Göğüs ağrısı varlığında, tamamen normal bir repolarizasyon modelinin (normal ST-segmenti ve T dalgaları), negatif prediktif değeri %95’dir. İlk EKG’de STsegment elevasyonu veya depresyonu, akut enfarktı olan hastaların %75’inde oluşur, ama bu oran zaman geçtikçe artar. (156) Fesmire ve arkadaşları., göğüs ağrısı varlığında, 20 dakika aralarla ST-segmenti takibinin, akut miyokard enfarktüsünün saptanması açısından duyarlılığı ve özgüllüğü önemli derecede artırdığını göstermişlerdir.(157) Akut miyokard enfarktüsü olan hastaların %25 kadarında, başlangıçta akut değişiklikler olmayabilir. Bu hastaların büyük çoğunluğunda (%85), non-Q dalgası miyokard enfarktüsü gelişecektir. Transmural enfarktüsün gelişmesi esnasında etkilenen bölgeyi gösteren derivasyonlarda, ST-segment elevasyonu görülür. ST-segment elevasyonu, enfarktın başlangıcından aşağı yukarı 1 saat sonra maksimuma ulaşır. Revaskülarizasyon yapılmadığında, 10-20 saatte başlangıç durumuna yavaş yavaş geri döner. Bu süre esnasında, özellikle ilk 6 saat içinde, ST düzeyinde geçici elevasyonlarla birlikte spontan dalgalanmalar olabilir. Bunu yavaş yavaş normale dönüş takip eder. Bu tipik zaman seyri, perfüzyonun geri dönmesini sağlayan müdahalelerle çarpıcı bir şekilde değişir.(158) ST-segment ve elevasyonunun zaman seyri (en basit olarak gösterildiğinde), inen ve çıkan kollarla birlikte bimodal bir şekle sahiptir. Bu nedenle, tek başına ST-segment 44 elevasyonunun derecesi, olayın süresini saptamak için yetersiz olabilir. Birnbaum ve Sclarovsky(159), bir koroner arterin oklüzyonundan sonra oluşan üç EKG safhasını tarif etmişlerdir. Q dalgalarının oluşması, miyokard enfarktüsü için klasik EKG bulgusudur. Q dalgaları, miyokardın depolarizasyonu esnasında ilk kuvvetlerin yönünde değişikliğe bağlı olarak oluşur. QRS’in normal başlangıç kuvvetleri (ilk 20ms), interventriküler septumun aktivasyonu ve sol ve sağ ventriküllerin serbest duvarlarının erken aktivasyonunun sonucudur. Ancak, bu vektörler, halen aktivasyonu bekleyen miyokardın elektriksel kuvvetleri tarafından da etkilenir. Bu nedenle, ilk kuvvetlerin yönü, sadece bu erken elektriksel aktiviteyi direkt olarak etkileyen septal enfarktlardan değil, aynı zamanda, elektriksel kuvvetlerin dengesini bozan ve ilk vektörün yönünü değiştiren, kalbin alt,ön ve arka duvarlarını tutan enfarktlar tarafından da etkilenir. Nekroza bağlı gelişen Q dalgaları genellikle 40 ms veya daha uzun sürer. Nekroz varlığında, bu vektörlerin yönü enfarkt bulunan bölgenin ters yönüne doğru kayar. Anormal Q dalgaları, genel olarak transmural hasarı gösterir, ama enfarktın transmural derinliğinin güvenilir göstergeleri değildir. Q dalgaları, genellikle semptomlar başladıktan sonra 10-12 saat içinde ortaya çıkar. Q dalgaları, zamanla değişmeden kalabilir veya tamamen kaybolabilir. Miyokard enfarktüsü, orta ve geç QRS kuvvetlerini de etkiler. Bu durum, QRS süresinde genel artışla birlikte, QRS’te çentikleşme veya şekil bozukluğuna neden olabilir. Ancak, bu değişiklikler nonspesifiktir ve miyokard hasarından daha çok His-Purkinje sisteminde iletim defektlerinin varlığını gösterebilir. Son olarak, akut miyokard enfarktüsünden sonra, negatif T dalgalarının persistansı, transmural skarla ilişkilidir, ama canlı miyokardla ilişkili değildir. T dalgaları normalleştiğinde, Q dalgalarının varlığına rağmen, fibrozise çoğunlukla normal miyokard eşlik eder.(160) ENFARKTÜSÜN LOKALİZASYONU Ön duvar enfarktüsü Sol ventrikülün ön duvarını etkileyen transmural enfarktüsün varlığında, ortalama STsegment vektörü öne, sola ve yukarı doğru yönelir. Bu nedenle, V1-V4’de ST segmentleri yükselmiştir. Tüm prekordiyal derivasyonlar tutulmuşsa (V1-V6), muhtemelen lateral duvara da yayılma vardır. V1-V2’de ST-segment elevasyonu, klasik olarak septumu içeren enfarktüs olarak yorumlanmıştır, ama apekse de yayılabilir.(161) Yan duvar enfarktüsü I ve aVL’de ST segment elevasyonu, yan duvarı içeren sol ventrikül enfarktüsü vakalarında gözlenir. V5 ve V6’da da, ST segment elevasyonu görülebilir. Ancak, bu ikincisi, ön, arka ve alt duvarları içeren vakalarda da görülür. Alt duvar enfarktüsü Arka duvar enfarktüsü, tipik olarak II,III ve aVF’de ST-segment elevasyonu ile belli olur. Bazı vakalarda, en erken değişiklik I ve aVL’de ST segment depresyonudur. )Alt duvar miyokard enfarktüsü ve prekordiyal derivasyonlarda ST-segment depresyonu olan hastalarda, enfarktüs daha geniştir ve prognoz daha kötüdür. Arka duvar enfarktüsü Sol ventrikülün arka duvarı tutulduğu zaman, ST vektörü arkaya yönelir ve V1-V4’de STsegment depresyonu görülür. Böyle ST değişiklikleri, arka duvar miyokard enfarktüsünün tek belirtisi olabilir. T dalgaları karakteristik olarak diktir ve R dalgalarının amplitüdünde ilerleyici artış vardır. 45 Sağ ventrikül enfarktüsü Sağ prekordiyal derivasyonlarda (V2R-V6R), ST-segment elevasyonu, sağ ventrikül enfarktüsü için diyagnostik olarak kabul edilir. Sağ ventrikül enfarktüsü esnasında, ST vektörü, sağa ve öne doğru yönlendiği için, bazı hastalarda V1 ve V2’de ST-segment elevasyonu olabilir ve bu durum ön duvar miyokard enfaktüsünü taklit eder. Ancak, sağ ventrikül enfarktüsü vakalarında, V1’deki elevasyon V2’ye göre daha fazla olma eğilimindedir. SUÇLU ARTERİN SAPTANMASI İÇİN ELEKTROKARDİOGRAMIN KULLANILMASI Sol anterior desendan koroner arter Sol anterior desendan koroner arterde (LAD) oklüzyon olan hastaların çoğunda (%93), V1V3’de ST-segment elevasyonu vardır. Bu model yoksa, negatif prediktif değer %94’dür. LAD’de proksimal oklüzyona bağlı akut iskemi, ön derivasyonlarda, ST segmentinde majör değişiklikler olmaksızın, derin olarak ters dönmüş T dalgalarına neden olabilir. Bu model ilk olarak Wellens(162) tarafından tarif edilmiştir. Ön ve yan duvarlarda, T dalgaları simetrik ve terstir. Kardiyak kateterizasyonda, ön duvarda hafif hafif hipokinezi ile birlikte LAD’de tek proksimal %95’lik oklüzyon görülmüştür (ilk septal arterin distalinde, ama ilk diyagonal arterin proksimalinde). Bazıları, bu modelin stunned veya hibernating miyokardın göstergesi olduğunu söylemektedir, çünkü rekanalizasyona yanıt bölgesel fonksiyonda belirgin düzelmeye yol açar.(163) Ön duvar miyokard enfarktüsü varlığında, intraventriküler iletim bozukluklarının varlığı, genellikle LAD’deki lezyonun, ilk septal perforatörün kaynağının proksimalinde olduğunu gösterir. Burada oklüzyonun, iletim sistemini etkileme olasılığı daha yüksektir. Sağ koroner arter Alt duvar miyokard enfarktüsüne yol açan genellikle sağ koroner arterin (RCA) oklüzyonu olmasına rağmen, alt duvar sol sirkumfleks arter (LCA) tarafından beslenebileceği için, alt derivasyonlarda, ST segment değişiklikleri RCA oklüzyonu için diyagnostik değildir. Alt derivasyonlarda, ST-segment elavasyonunun varlığı, I ve aVL’de ST-segment depresyonu, segmentlerin aşağı yukarı %80’inde RCA’nın oklüzyonuna bağlıdır.(164) Sol sirkumfleks arterin oklüzyonu, I ve aVL’de normal veya yükselmiş ST-segmentine neden olur. Sol sirkumfleks arter LCA yan ve arka duvarları besler. Anatomik varyanta bağlı olarak, alt duvar da LCA tarafından beslenebilir. LCA’nın oklüzyonuna bağlı akut miyokard enfarktüsünün EKG bulguları, suçlu oklüzyonun bulunduğu yere ve hastanın anatomisine bağlıdır. LCA’nın oklüzyonu, klasik alt, arka veya yan miyokard enfarktüsü veya bunların kombinasyonuna yol açabilir. Birçok LCA oklüzyon vakasında, EKG bulgusu yoktur veya azdır; LCA oklüzyonu vakalarının %38’i nondiyognastik EKG ile prezente olurlar. Total LCA oklüzyonu olan hastaların yarısından azında, ST-segment elevasyonu vardır. Sol ana koroner arter Sol ana koroner arterden (LMCA) kaynaklanan global iskemi hastalığı, EKG’de aVR ve bazen II haricinde tüm derivasyonlarda, yaygın ST-segment depresyonu ve negatif T dalgalarını etkileyen değişikliklerle prezente olabilir. 46 AYIRICI TANI T dalgası değişiklikleri T dalgalarında ters dönme ile ilişkili yüzlerce durum vardır. Rosenbaum ve arkadaşları(165) tarafından tarif edilen T dalgası hafızası, ventriküllerde aberan bir aktivasyon döneminden sonra T dalgasının ters dönmesi anlamına gelir. LBBB, RBBB veya ventriküler preeksitasyon döneminden sonra gözlenebilir. Normal olarak iletilen akımlarda T dalgasının aksı, pacing QRS’i ile aynı yöndedir. Bu durum T dalgası hafızası için karakteristiktir ve böyle bir özelliğin olmaması, T dalgası hafızası tanısı olasılığını çok azaltır. ST-segment değişiklikleri Genel olarak, lokalize ST-segment elevasyonu, akut iskeminin varlığı açısından spesifik olmasına rağmen, koroner arter oklüzyonu olmaksızın fokal ST-segment elevasyonu ile prezente olabilen kardiyomiyopati ve perikardit vakaları vardır. Ventriküler pre-eksitasyon Aksesuar bir yoldan iletim anormal Q dalgalarına yol açabilir. Ventriküler pre-eksitasyon, repolarizayonu da değiştirebilir ve ST-segment ve T dalgası değişikliklerine yol açar. Q dalgaları İnterventriküler septumun aktivasyonunu gösteren Q dalgaları, normalde erişkin EKG’sinde I, aVL, V5 ve V6’da görülür. Çocuklarda ve vertikal bir elektiksel aksı olan normal erişkinlerde (90º ye yakın), ilk kuvvetler yukarı doğru yönlenmiştir. Bu durum, alt derivasyonlarda, normal Q dalgaları oluşturur. Bu Q dalgaları, kısa süreli (40 ms’den az) ve düzdür. QRS’in başlangıç kuvvetleri, LAFB, sol posterior fasiküler blok, LBBB (tam veya tam olmayan), sol ventrikül hipertrofisi ve ventriküler pre-eksitasyon (Wolff-Parkinson-White) sendromu gibi bozukluklardan etkilenir. BİYOKİMYA Akut kardiyak hasarın tanısı için vazgeçilmez olan bulgu, kardiyak hasar biyomarkerlarında yükselmedir. Miyokard enfarktüsü tanısı için Dünya Sağlık Örgütü’nün kriterleri, aşağıdaki kriterlerden iki tanesine gerek duymasına rağmen: iskemi ile uyumlu klinik semptomlar, EKG bozuklukları ve miyokard hasarı için tipik olan enzimlerde iki kat artış, kardiyak hasar tanısının tek başına semptomlar ve EKG değişikliklerine dayanılarak konması olağan dışı olur.(28) Özellikle karmaşık klinik durumlarda, marker proteinlerde yükselmenin, saptanan tek bozukluk olabileceği bilinmektedir. Bu nedenle, bazı araştırmacılar, uygun klinik ortamda, iskemik kalp hastalığı ile ilişkili tipik biyomarker salınım modellerinin, akut iskemik hasarın onaylanması için yeterli olacağını öne sürmüşlerdir.(166) Biyomarkerların gelişmesinde değişiklikler oluşurken, bu testler için gereksinimde de belirgin değişiklikler olmuştur. Günümüzde, modern uygulamada, hızlı kararlar ve testlerde yüksek doğruluk derecesi istenmektedir. Vakaların sadece az bir bölümünde (göğüs ağrısı ile gelen hastaların %10-20’si), akut miyokard enfarktüsü saptanır. Anstabil anjina ile gelen hastaların kabaca 1/3’ünde, bir miktar kardiyak hasar komponenti olduğu kabul edilmesi nedeniyle bu oran artmış olmasına rağmen,(167) göğüs ağrısı olan hastaların büyük çoğunluğunda (birçoğunda iskemi vardır), biyomarkerlar normal değerlerdedir. Günümüzde, biyomarkerları yüksek olan tüm hastalara akut miyokard enfarktüsü tanısı konup konmaması gerektiği veya klinik olarak anstabil anjinası ve az miktarda miyokard nekrozu bulgusu olan 47 hastaların ayrı olarak ele alınıp alınmaması gerektiği de belli değildir. İkinci gupta, biyomarkerların yükselmesi, uzun ve kısa vadedeki riske işaret eder ve muhtemelen farklı tedavi rejimlerini gerektirir. KREATİNİN KİNAZ Bu marker bize uzun yıllar hizmet etmiştir ve halen birçok laboratuvarda ölçülmektedir. Ön planda kullanılan testler aktivite testleridir. Bu markerin ölçümü klinik olarak gereksizdir, çünkü kardiyak hasarı gösteren daha spesifik izoenzim testleri vardır. Kreatinin kinazın (CK) üç izoenzimi ve bir mitokondriyal formu vardır. Üç izoenzim, M ve B zincirlerinden oluşur. Bir çok dokuda, MM izoenzimi ön plandadır. BB izoenzimi, daha çok beyinde ve gastrointestinal sistemde bulunur. MB izoenzimi kalp için oldukça spesifiktir. Ancak, diğer dokularda az miktarda CK-MB bulunur ve yeni doğan gelişimi esnasında, B zinciri en sık görülen CK formu olduğu için, iskelet kasında doku hasarı, B zinciri protein miktarında artışa neden olur ve böylece CK-MB artar. Bu nedenle, akut ve kronik iskelet kası hasarı bulunan hastalarda, yükselen ve düşen bir modelle birlikte, CK-MB’de yalancı-pozitif yükselmeler tarif edilmiştir ve bu durum tanıda karışıklık yaratabilir.(168) CK ve CK izoenzimleri için ölçüm teknikleri Total CK, genel olarak kreatinin fosfokreatinine dönüşmesine dayanan aktivite testi ile ölçülür. Fosfokreatinin NADP veya NADPH oluşturmak için kullanılır. NADP veya NADPH floresan ile saptanır. Bu testler, ısıdan ve örneğin oksidasyon durumundan etkilenir ve reaksiyona yüksek enerjili fosfatın (ATP) katıldığı durumlarda (örneğin hemolizle) sonuç karışabilir. İskelet kasında bol miktarda CK-MM bulunduğu ve iskelet kasında salınım oranının fazla olma olasılığı yüksek olduğu için az miktarda iskelet kası hasarı belirgin yükselmeye neden olabilir.(169) Miyokardda gram başına düşen total TK miktarı daha düşük olduğu ve salınım oranı daha düşük olduğu için, kardiyak hasarda gram başına artış miktarı çok daha azdır. Yıllar boyunca, CK-MB çeşitli yöntemlerle ölçülmüştür ve aktivite testleri halen bazı laboratuvarlarda kullanılmaktadır. Ancak, laboratuvarların çoğu, CK-MB için duyarlılığı ve doğruluğu artıran ve artefakt sayısını azaltan kütle testlerini kullanır.Halen sadece B subünite proteini üzerinde odaklanan bazı radyoimmünoassayler olmasına rağmen, bunların büyük çoğunluğu, MB 'nin kendisi için özgüllüğü yüksek olan sofistike monoklonal antikorları kullanır. Radyoimmünoassaylerde bu ilerleme, çeşitli makrokinazlarla (CK içeren immunglobulinler veya dimerize olabilen mitokondriyal CK) ilişkili olabilen yanlış pozitif sayısını belirgin şekilde azaltmıştır, ama tamamen ortadan kaldıramamıştır. Genel olarak, normal testlerde saptanan düşük CK-MB düzeyi nedeniyle (iskelet kasında bulunan az miktarın turnover'ına bağlı olduğu düşünülür), testin düşük alt sınırında yüksek düzeyde doğruluk aranmamıştır. Bu nedenle, normalin içindeki yükselmelerin analitik olarak saptanması zor olmuştur. Son zamanlarda, bazı testler, belli gruplarda normal sınırların saptanmasına dayandırılmıştır. Bu durum, plazmada CK-MB düzeyinde orta derecede yükselme durumunda çok yüksek doğruluk düzeyi olan testlerin geliştirilmesini sağlamıştır. Akut miyokard enfarktüsünün tanısı CK-MB'nin ölçümü, uzun yıllar akut miyokard enfarktüsü tanısı için altın standart olmuştur. Artış, akut enfarktüsten 6 saat sonra başlar (özellikle genel olarak daha duyarlı olan kütle radyoimmünoassayleri ile) . Tüm hastalarda, artış 12 saatte oluşur (bazı serilerde 10 saatte).(170) Pik değerler, kabaca 24 saatte oluşur ve CK-MB 36-72 saatte normale döner. Bu nedenle, 8-12 saatte bir kan örneği alınması önerilir. Ek kan örneği alınması, diyagnostik duyarlılığı yükseltir. Uygun klinik ortamda, yükselen ve düşen bir modelle birlikte artışlar diyagnostiktir. İskelet kası hasarında yüksek düzeyler çoğunlukla sürer. 48 Rekanalizasyondan sonra CK-MB daha erken pik yapar ve kalpten gelen miktarın daha büyük bir oranı, plazmada görünür. Bu durum, salınım oranının iki kata yükselmesini (deneysel koşullarda) ve kan akımının yeniden oluşmasının CK-MB'nin hızla plazma içine geçişine neden olduğu gerçeğini yansıtır.(171) Böylece, damarları açılan hastalarda, daha erken yükselmeler görülür ve genellikle pik değerlere 16 saatten önce ulaşılır. Bekleneceği gibi, rekanalizasyondan sonra, değerler daha hızlı bir şekilde normale döner (genellikle 24 saat içinde). Veriler, non-Q-dalgası enfarktüsü olan hastalarda, CK-MB pik değerlerine daha erken ulaşıldığını gösterdiği için, bu enfarktüsün patofizyolojisinin geçici oklüzyon ve reperfüzyon ile ilişkili olabileceği hipotezi öne sürülmüştür.(172) Bu ilginç bir spekülasyondur, ama bunu destekleyecek direkt veriler az sayıdadır. CK-MB yükselmesi ile ilişkili diğer kardiyak hasar formları Herhangi bir nedene bağlı miyokardiyal hücre ölümü CK-MB'de artışa neden olacaktır.Bu artışlar, kardiyak kontüzyon, elektriksel hasar, miyokard tutulumu ile birlikte ciddi perikardit ve miyokardit olan hastalarda açık bir şekilde gözlenmiştir. Ancak, bu koşullarda uygun tanı koymak çoğunlukla zordur, çünkü klinik koşullar çoğunlukla karmaşıktır. CK-MB'de artışın iskelet kası hasarına bağlı olabileceği olasılığı düşünülmelidir. Bazıları, bu durumda, oran kriterlerinin kullanımının yararlı olacağını öne sürmüşlerdir. Bu yaklaşımın temeli, kalp, çok yüksek CK-MB oranı olan tek organ olduğu için (total CK'nın %15'i), kandaki total CK miktarına göre daha yüksek CK-MB oranının, iskelet kasından ziyade kalp kasından salınımın göstergesi olmasıdır. Bu, basit durumlar için geçerli olmasına rağmen, daha karmaşık durumlar tartışmalıdır. İskelet kası ve kalp hasarının birlikte bulunduğu durumlarda, oran kriterlerinin kullanılması, özgüllüğü artırır, ama gerçek kalp hasarını saptama kabiliyetini ortadan kaldırır. Kronik iskelet kas hasarı varsa, doku hasarına yanıt olarak B zincir geninin ekspresyonu nedeniyle yalancı pozitif olan çok yüksek oranlar gözlenecektir.Bu nedenle, belli bir hastada, CK-MB'de artışın iskelet kasına ve/veya kalp kasına bağlı olup olmadığını belirlemek çok zordur. Bu, CK-MB yükselmesinin sık görüldüğü (hastaların aşağı yukarı %20'si) böbrek yetmezliği bulunan hastalarda tartışma yaratmıştır.(173) Bu artışlar, kalsiyum, fosfor ve paratiroid hormonunun, protein kas turnover'ı üzerindeki etkilerine bağlı olabilir. Yalancı-pozitif artışların, iskelet kası hastalığına bağlı olmadığı diğer durumlar arasında, CKMB 'nin klirensinin bozuk olduğu hipotiroidizm vardır. Reperfüzyonun saptanması Reperfüzyonun saptanması, trombolitik tedavinin başlamasından beri zor bir hedef olmuştur. Mutlak değerler veya değişme oranları kullanılarak, açık ve kapalı damarların ayırt edilmesi umut edilmişti. Ne yazık ki, total CK ve CK-MB 'nin pik değerleri için geçen zaman, pik değerlere çok erken (<4 saat) veya çok geç (> 16 saat) ulaşan küçük bir grup hastanın sınıflandırılmasını sağlar. İnferior miyokard enfarktüsü olan hastalar için CK-MB'de ilk 2 saat içinde 2.2 kat artış ve anterior enfarktüsü olan hastalar için 2.5 kat artışın, rekanalizasyonu saptamak için kullanılabileceği öne sürülmüştür.(174) Enfarktüsün yaygınlığının hesaplanması Bazı eski çalışmalar, nispi enfarkt boyutunun seri CK ve CK-MB ölçümlerinden hesaplanabileceğini ortaya koymuştur.(175) Bu şekilde ölçülen enfarkt boyutu, diğer çeşitli parametrelerle iyi koreledir ve prognozun önemli bir prediktörüdür. Ancak, yukarıda gösterildiği gibi, salınım oranı rekanalizasyondan sonra değişir.(171) Bu nedenle, enfarktüsün boyutunu hesaplamak için, pik değerleri, CK eğrisinin altındaki integre bölge yerine kullanmaya alışkın olan klinisyenler, rekanalizasyon yapılmış olan ve olmayan hastaları karşılaştırma konusunda dikkatli olmalıdırlar. Rekanalizasyon yapılmış olanlarda, salınım oranı daha yüksek olacaktır (kalp kaynaklı herhangi bir miktar için, plazmada daha fazla 49 protein ortaya çıkacaktır) ve pik değer daha yüksek olacaktır. Bu nedenle, bu değerler arasında karşılaştırma yapmak uygun değildir. Müdahale prosedürlerinden sonra artışlar Müdahale prosedürlerinden sonra artışların, ilk olarak sadece komplikasyon gelişen hastalarda oluştuğu düşünülmüştü. İlk çalışmalar, tamamen komplikasyonsuz prosedürler uygulanan hastalarda, total ve CK-MB artışlarının nadir olduğunu göstermiştir.(176) CA VEAT çalışması, müdahale prosedürlerinden sonra CK ve CK-MB'de çok fazla sayıda artışı kapsayan bir seri araştırmayı başlatmıştır.(177) Bunların önemi tartışılmıştır. Bazı verilere göre, yükselmelerin önemli prognostik etkisi vardı ve morbidite ve mortaliteyi gösteriyordu. Diğer çalışmalarda, bu bulgular ortaya konamadı. Safenöz ven greftleri üzerinde müdahale yapılan hastalarda, yakın zamanda pozitif bulgular bildirilmiştir.(178) Bazı biyokimyasal konuların düşünülmesi gerekir. Birincisi, daha sonraki reperfüzyonda, geçici oklüzyon varsa, salınım oranının değişmesinin olası olduğudur. Böylece, kronik oklüzyonda, CK için %15 veya oklüzyon ve reperfüzyondan sonra 2 saat içinde %30'a karşılık, oran %60-70 ve hatta daha yüksek olabilir. Gözlenen minör artışlar muhtemelen hastanın göğüs ağrısı ile prezente olduğu standart koşullardakine göre çok daha küçük bir nekroz miktarını yansıtmaktadır. Bu artışlar, bazı değişik süreçleri yansıtabilir: • prosedürün komplikasyonları- örneğin intravasküler ultrason gibi bir değerlendirme yapılmadıkça bunların bazılarının saptanması zordur; • bazı prosedürlerde, akıntı yönünde debris veya prosedür için gerekli olan uzun süreli oklüzyon nedeniyle bir miktar zorunlu kalp hasarı oluşabilir ; ve artışlar, müdahalenin uygulandığı damarın sağladığı kollateral perfüzyonun kaybı nedeniyle oluşabilir. Bunların her birisinin etkisinin farklı olabileceği öne sürülebilir. Komplikasyona bağlı olarak bir miktar kalp hasarı ile ilişkili prosedürler uzun enflasyon gereksinimi veya debrisin akım yönünde migrasyonu nedeniyle oluşan artışlara bağlı olarak farklı bir öneme sahip olabilir (özellikle prosedürün sonucu çok başarılı ise). Bu nedenle, çalışmalarda görülen farklı sonuçların, CK elevasyonlarının etyolojisinin farklı patofizyolojilerinin nispi karışımlarını yansıtabilir. Bunların hepsinin olumsuz sonuç progenitorü olup olmadığı belli değildir. Yükselmenin derecesi ne olursa olsun, prosedür sonrasında, CK yükselmesi veya MB yükselmesi yakından takip edilmelidir, çünkü bazılarının olumsuz sonuçları olabilir. Yükselme iki kat, üç kat veya beş kat olduğunda miyokard enfarktüsü tanısı konup konmaması konusunda tartışma anlamlıdır. Günümüzde kabul edilen üç kattır.(179) MiYOGLOBiN Miyoglobin, kalp ve iskelet kasında bol miktarda bulunan düşük molekül ağırlıklı bir proteindir. Miyoglobin miyokard enfarktüsünün duyarlı bir markerıdır, ama özgüllüğü yoktur. Miyokarddan hızla salınır ve böbreklerden hızla atılır. Hızlı kinetiği nedeniyle, miyoglobin, akut bir olayın başlangıcından sonra erken yükselir ve bu nedenle, kardiyak hasarın erken saptanması ve/veya ekarte edilmesi açısından güvenilirdir. Ancak, özgüllüğü olmadığı için, güvenilir olan pozitif prediktif değerinden ziyade, negatif prediktif değeridir. 4-6 saatlik süre içinde miyoglobinde artış olmaması veya 6 saat geçtikten sonra artış olmaması, kardiyak hasarı ekarte etmek için çok doğru bir kriterdir.(170) Bu, hızlı triyajın gerekli olduğu durumlarda (hastaları hızla yönlendirme gereksinimi olan acil birimde) önemli olabilir. Kolay radyoimmünoassay bulunduğu için, miyoglobin, bu amaçla CK izoformlarından daha sık kullanılmıştır. Miyoglobin kullanıldığında, sürekli olmayan salınım modeli nedeniyle dikkatli olmak gerekir. Bu model 'staccato fenomeni' olarak isimlendirilir ve hızla normale dönen geçici yükselmelere neden olur.(179) Bu durum, akut 50 koroner sendromu olan hastalarda, koroner anjiyogramlarda görülen aralıklı oklüzyon ve reperfüzyonla ilişkili olabilir. Miyoglobin, tromboliz veya anjiyoplasti sonrasında erken rekanalizasyonu saptamak için de kullanılmıştır. Çalışmalar, yükselme hızına (>2.6 ng/ml/dk, 60 dk içinde) veya 2 saat içinde 4.6'lık yükselmeye dayanmıştır. KALP YAĞ ASİDİ BAĞLAYICI PROTEİN Yağ asidi bağlayıcı proteinler, doku hasarına yanıt olarak miyokarddan hızla çıkan düşük molekül ağırlıklı sitozolik proteinlerdir. Kalp yağ asidi bağlayıcı proteinin kendine özgü bir yapısı vardır, ama bu izoform iskelet kasında ve böbrekte de bulunur. Salınım özellikleri, miyoglobine benzediği için, kardiyak hasarın erken saptanmasında yararlıdır ve bazıları, kalpte daha yüksek konsantrasyonda bulunduğu için, miyoglobinden daha spesifik olduğunu öne sürmüşlerdir.(180) Bu konu tartışmalıdır ve daha fazla çalışmanın yapılması gerekmektedir. LAKTAT DEHİDROGENAZ Günümüzde, laktat dehidrogenazın, kullanılması önerilmez. Hospitalizasyondan günlerce önce oluşan enfarktüsün saptanması için kullanılması, troponin markerlarının bulunması ile gündemden kalkmıştır. Bu nedenle, laktat dehidrogenaza, kardiyovasküler hastaların değerlendirme ve tedavisi için artık gereksinim duyulmamaktadır. TROPONİNLER Kardiyak troponinlerin geliştirilmesi, kardiyak hasar tanısında devrim yaratmıştır. Saptanan troponin izoformları, kardiyak hasar açısından tamamen spesifiktir ve bunların artan duyarlılığı ve uzun süren diyagnostik penceresi, daha önce bilinmeyen pek çok bozukluğu saptamaya başlamıştır. Bu durum, kardiyak markerları kullanma şeklimizde değişiklik yapma gereksinimine yol açmıştır. Troponinlerin temel biyolojisi Üç kardiyak troponin vardır: troponin I(cTnI), T (cTnT) ve C (cTnC). Bu proteinler, aktin ve miyozinin kalsiyuma bağlı etkileşimini regüle ederler. cTnC, düz kasta bulunan troponin izoformu ile aynı olduğu için, kardiyak spesifisitesi yoktur. Ancak, cTnI ve cTnT'nin kardiyak formları, özel genlerden gelmektedir ve bu nedenle, kardiyak özgüllükleri yüksektir. Kardiyak özgüllük konusu, cTnI için barizdir. Günümüzde, cTnI kalp dışında hiçbir dokuda bulunmamıştır (sadece neonatal gelişim esnasında bulunan dokular dahil) . Bu son gözlem önemlidir, çünkü CK'nın B zincirinde olduğu gibi, neonatal gelişim esnasında taşınan proteinler çoğunlukla doku hasarına yanıt olarak yeniden taşınırlar. Bu nedenle, neonatal gelişim esnasında eser miktarların bile bulunamaması, bu formun, patolojik durumlarda bile taşınmayacağının indirekt de olsa, güçlü bir göstergesidir. Bu varsayımın klinik değerlendirmesi için, ciddi olarak hasar görmüş iskelet kası, cTnI'e karşı spesifik antikolar araştırılmıştır.(181) Bu koşullarda kardiyak form bulunamamıştır. Bu durum, ciddi akut veya kronik iskelet kası hasarı bulunan hastalarda, kanda cTnI saptayamayan çok sayıda çalışmayı desteklemektedir. Bu nedenle, kandaki yüksek düzeyler, kandan salınımı göstermektedir. cTnC ile ilgili durum daha karmaşıktır. Kardiyak form, neonatal gelişim esnasında iskelet kasında taşınmaktadır ve doku hasarına yanıt olarak yeniden taşınır. Ancak, cTnT'nin multipl fetal izofomu vardır. İskelet kasında doku hasarına yanıt olarak taşınan izoformlar, günümüzde kullanılan monoklonal antikorlarla saptanamaz.(182) Bu nedenle, bu formlar poliklonal serumlarla saptanabilmesine rağmen, günümüzde cTnT için kullanılan testin yineleme özgüllüğü, cTnI ile aynıdır. 51 Troponinler iki havuzda bulunurlar. 'Sitozolik' olarak isimlendirilen 'erken salınan havuz', cTnT'nin 57 %5'ine ve cTnI'nin 58 %3'üne katkıda bulunur. Bu, kabaca sitozoldeki CK-MB miktarına denktir. Ancak, troponinin önemli bir miktarı kontraktil aparatus içinde bulunur. Bu nedenle, troponinin genel miktarı, miyokardın gramı başına CK-MB miktarının 13-15 katı kadardır. Troponinin salınım modeli, bu havuzlarla ilişkilidir. Erken salınım kabaca, CK-MB ile aynı zaman seyrinde olur (erken salınabilen havuzdan) . Bu havuz CK-MB havuzu ile aynı boyutta olmasına rağmen, daha yüksek düzeyler ve artış hızı gözlenmiştir (duyarlılığın daha yüksek olduğuna işaret eder).Yüksek duyarlılığa ek olarak, kontraktil aparatus içindeki troponin havuzu, daha yavaş salınır. Böylece, kardiyak hasar sonrasında troponinde yükselme uzun süre devam eder. Bunun nedeni klirensin yavaş olması değildir. Kliriens çalışmaları, alfa distributif yarı ömrün 1-2 saat olduğunu göstermiştir. Hasar gören bölgede günler boyunca remodeling oluştukça sürekli salınım olması muhtemeldir. Troponin yüksekliğinin en az 6-8 gün sürmesi beklenir ve bir çok durumda daha da uzun sürer. Yüksekliğin devam etmesi ile enfarkt boyutu, enfarktın tipi (Q-dalgası veya non-Q-dalgası) veya uygulanan tedavinin tipi arasında herhangi bir ilişki görünmemektedir.(183) Yüksek duyarlılık ve uzun süreli yüksek düzey kombinasyonu, troponinlerin yükselmesinin, sadece iskemik kalp hastalığı olanlarda değil, diğer çeşitli zarar durumlarında da saptanma olasılığının neden yüksek olduğunu anlamaya yardımcı olur. Troponinlerin klinik kullanımı: akut iskemik kalp hastalığı Kardiyak hasarın düşünüldüğü en sık görülen durum, akut iskemik kalp hastalığıdır. Bu alanda problemli olan önemli bir konu, iskemik semptomlar ve EKG değişiklikleri ile gelen ve CK-MB değil sadece troponin yükselmesi olan hastalara enfarktüs tanısı koymak mı yoksa bir miktar nekrozla birlikte anstabil anjina olarak tanımlamak mı sorusu olmuştur. Bu konu tüm klinisyenler tarafından anlaşılmalıdır.(184) Troponinler için kullanılan testlerle, troponin değerleri, normalin üst sınırını, CK-MB ile aynı zamanda geçerler (4-6 saatte başlar). Hastaların çoğunda, yüksek cut -off değerleri kullanılsa bile, 8-12 saatte yükselme olur.(170) Veriler, cTnT'nin, cTnI'dan biraz daha ağır olmasına rağmen, biraz daha erken salındığını (1saat) göstermektedir.(185,186) Bu fark, test için seçilen cut-off değerlerin duyarlılığı ve bunların analitik variyabilitesi ile ilişkili olabilir. Böylece, mevcut testler ve geleneksel cut -off değerleri ile erken tanı (<6saat) oluşturulamaz. Yükseliş hastaların çoğunda, en az 6-8 gün devam eder ve 2-3 hafta kadar sürebilir. Bu durum, akut enfarktüsün retrospektif tanısının konulmasını sağlar ve laktat dehidrogenaz enzimlerinin, iskemik kalp hastalığı olan hastaların değerlendirilmesinde artık kullanılmasına gerek kalmamasının nedenidir. Uzun süreli yüksek değerler, alınan ilk örnekteki yüksek değerin, akut olan veya 1-2 haftalık bir olayı yansıttığı anlamına gelir. Bu durumda, tekrarlayan enfarktüs tanısı için troponinle birlikte CK-MB 'nin kullanılmasıdır. Rekanalizasyon ile, kana troponin geçişi artar. İlk veriler, troponinde hızlı artışların diyagnostik öneminin, CK-MB gibi markerlarda hızlı artışlara eşdeğer olduğunu göstermiştir.Ancak, bu konu ile ilgili daha detaylı çalışmalar gerekmektedir. Yükselmede sürekliliğin, reperfüzyon tedavisinin uygulanması ile belirgin şekilde etkilenmediği görünmektedir.(183) Bazı çalışmalar, akut enfarktüsü olan hastalarda, troponinde erken yükselmelerin prognostik önemi olduğunu öne sürmüştür.(187) Gelişte troponin düzeyi yüksek olanlarda olmayanlara göre prognoz çok daha kötüdür. Bu muhtemelen kısmen troponinin yükselmesi için zaman gerektiği ve yükseklik olan hasta kohortunun biraz daha geç geldiği gerçeği ile ilişkilidir. Geç gelen hastalar, agresif akut müdahalelerden daha az yararlanabileceklerdir. Yine de, mortalitenin neredeyse iki kat olmasını sadece bu kavrama bağlamak zor olmuştur. 52 Gelişte yüksek troponin düzeyleri olan akut enfarktüs hastalarını daha yüksek riske sahip bir grup olarak kabul etmek akılcı görünmektedir. Bu hastalar, zaman içinde de daha yüksek riske sahip görünmektedir. Uzun vadeli takip verileri, akut enfarktüsten sonra mortalite ve olay oranlarının, başlangıçta troponin düzeyi yüksek olanlarda, olmayanlara göre daha yüksek olduğunu göstermiştir Bu durum, gelişte yüksek düzeyde troponin değerleri olan hastaların bir yüksek risk grubu olduğu göstermektedir. Troponin markerları, CK-MB artışının iskelet kası hasarına bağlı olabileceği karmaşık durumlarda, özellikle yararlıdır.Yükselmeler, perioperatif kardiyak hasarın tanısını koymak ve durumu kötü olan hastalarda kardiyak hasarı saptamak açısından yararlıdır. Bu ikinci grupta, kardiyak hasar bulgusu, çoğunlukla gizlidir ve kısa vadede olumsuz prognoza işaret eder. Önemli sayıda hasta, göğüs ağrısı, EKG değişiklikleri ve bilinen iskemik kalp hastalığı ile prezente olur. Bu hastalar sınıflandırılmıştır. Bu hastaların, anstabil anjinası olan önemli bir bölümünde, gelişte veya hospitalizasyonun 8-12.ci saatinde, geleneksel markerlarda artış olmaksızın troponinlerde artış olduğu bilinmektedir.(188,189) Bu yükselmelerin bazıları, prezentasyondan önce oluşan olayları yansıtabilir. Ancak, veriler, yükselmelerin çoğunun, troponinlerin kardiyak hasarı saptamak açısından duyarlılığında artışı yansıttığını göstermektedir.(170) Anstabil anjinası olan hastaların %30'unda bu model görülür ve troponinde yükselmeler, daha sonra gelişecek olay riskini artırır (miyokard enfarktüsü ve acil revaskülarizasyon gereksinimi)(188) ve geniş çalışmalarda yüksek mortaliteye işaret etmektedir. Genel olarak, yükseklik ne kadar fazla ise, risk o kadar fazladır.(189) Tipik anstabil anjina ile prezente olan yüksek troponin düzeylerine sahip hastalar, daha agresif tedavi gerektiren gruptur. Troponin yükselmesinin patolojik anlamı tanımlanmaya başlamıştır. Anstabil anjina ve ST-segment değişikliği olan hastalar, troponin yükselmesine daha çok eğilimlidirler. Daha önceki çalışmalarda, ST-segment değişikliğinin, artmış prokoagülan aktivitenin göstergesi olduğu öne sürülmüştü. Ayrıca, bazı çalışmalarda, anatomik bilgi ve düşük molekül ağırlıklı heparin ve abciximab gibi maddelere karşı yanıta dayanılarak, yüksek troponin düzeyine sahip hasta grubunda, antitrombotik ve/veya fibrinolitik tedavilere daha yararlı yanıt olduğu gösterilmiştir.(190,191) Örneğin, refrakter anstabil anjinası ve müdahale tedavisine gereksinimi olan bir grup hastada yapılan bir çalışmada, bir IIB/IIIA trombosit antagonisti olan abciximab'ın tek yararı, troponin değerleri yüksek olan hastalarda görülmüştür. Yüksek troponin düzeylerine sahip olan hastaların, daha agresif antitrombotik/fibrinolitik tedaviye gereksinimi olduğu görülmektedir. Miyokard enfarktüsü açısından düşük riske sahip hastaların değerlendirilmesi, tartışmalı bir konudur, çünkü bu grupta olay oranları düşüktür. Küçük bir grupta troponin düzeyinin yüksek olması bile, kısa vadede olumsuz bir sonuca işaret etmeyebilir. Ancak, daha sonraki olaylar açısından risk altında olan hastaların saptanması için, troponin markerları kullanılabilir. Yeni yapılan bir çalışmada, Hamm ve arkadaşları.(192), kesin EKG değişiklikIeri olmaksızın göğüs ağrısı ile prezente olan 700'ün üzerinde hastayı değerlendirmiştir. Saptanma sınırının üzerindeki değerleri anormal olarak tanımlamışlardır (duyarlı bir kriter). Bu çalışmada, daha sonraki olaylar açısından risk altında olan tüm hastalar, troponinde yükselme ile saptanmıştır Ayrıca, bu yüksek oranda duyarlı cut-off kullanılarak, kardiyak hasar tanısını 6 saat içinde koymak veya ekarte etmek açısından, troponinde yükselmenin, daha önceki kardiyak hasar markerlarına (miyoglobin ve CKMB izoformları) benzediği görülmüştür. Bu strateji ile ilgili problem, anlaşılabilir belirgin bir kardiyak hasar patofizyolojisi olmadığı için, triyajı zor olan minör yükselmeye sahip çok sayıda hasta bulunmasıdır. Bu durum, bazılarının iki cut-off değerinin kullanılmasını önermesine yol açmıştır. Bunlar, CKMB'nin yüksek bulunduğu değerlere eşdeğer olabilir.Böyle bir strateji, akut enfarktüs 53 tanımını, daha önceki değerlendirmeler ve daha önceki örneklerle daha sabit hale getirir, ama yüksek düzeylerin prognostik değeri kaybolur ve markerı erken bir markerdan ziyade geç bir marker haline getirir. Kesin öneriler yapılmadan önce daha fazla sayıda araştırma gerekmektedir. Tüm markerlarda olduğu gibi, iskemik kardiyak hasarı göstermeyen yükselmeler olabilir. Ancak, diğer dokularda hasara bağlı olan yükselme durumlarının tersine, troponin yükselmesi sadece kalp hasarından kaynaklanır. Bu konu önemli bir problem olmuştur. Troponinlerin yüksek duyarlılığı ve uzun süre yüksek düzeylerde kalması nedeniyle, çok sayıda minör yükselmeler saptanmıştır.(184) Bu problem, yukarıda anlatılan test problemleri ve herhangi bir testin alt duyarlılık sınırında, analitik variyabilite derecesinin artması gerçeği ile daha da alevlenmiştir. Spektrumun alt ucundaki değerler (saptanma sınırında), tek başına analitik nedenlere bağlı olarak yüksek bulunabilecek değerlerdir. Bu problem, uzun vadede, yeni yinelemelerle çözülecektir. Ancak, troponin markerlarının duyarlılığı yüksek olduğu için, (her türlü analitik problemin üzerinde), çok sayıda kişide, kardiyak hasar her zamankinden daha duyarlı bir şekilde saptanacaktır. Troponin yükselmesinin diğer nedenleri, noniskemik özelliği olan kardiyak hasarı içerir. Örneğin, kardiyoversiyonlar,kardiyak ablasyon ve hatta implante edilebilir defibrilatörler, troponin değerlerini yükseltecektir. Genel olarak artışlar düşük düzeydedir. Benzer şekilde, perikardit, miyokardit, kemoterapötik ilaçlara karşı toksik reaksiyonlar (5florourasil, adriyamisin), kardiyak kontüzyon bulunan ve kalp cerrahisi geçiren hastalarda, troponinler yüksek bulunacaktır. Bu durumlarda, uygun şekilde yorum yapıldığında markerlar çok yararlıdır. Konjestif kalp yetmezliği olan hastalarda, akut olarak dekompanse şekilde prezente olduklarında veya bazen kronik dekompansasyon esnasında troponinlerin yüksek olduğu bildirilmiştir.(193,194) Böbrek yetmezliği olan hastalarda, özellikle cTnT olmak üzere troponinlerde yükselme olduğu düşünülmüştü. Yeni immünohistokimyasal veriler, bu yükselmelerin muhtemelen kardiyak etyolojiye bağlı olduğunu onaylamaktadır. Bu durum, böbrek yetmezliği olan hastalarda, koroner kalp hastalığının çok sık bulunması ve böbrek yetmezliğinin anormal metabolik ortamının kas proteinlerinin turnover'ı üzerinde bilinen etkileri ile uyumludur.Son olarak, marotonların sonrasında, troponin yükselmesi gözlenmemiştir.(195) MİYOKARDİYAL GÖRÜNTÜLEME Birçok hasta, miyokard enfarktüsüne işaret eden göğüs ağrısı ile prezente olur, ama EKG'leri nondiyagnostiktir. Bu hastaların bazılarında, görüntüleme testi, biyomarkerların yükselmesini beklemekten daha üstün olabilir. Geçmişte, Tc-pirofosfat ve In-antimiyozin gibi enfarktı gösteren maddelere ilgi vardı. Bu maddelerin diyagnostik doğruluğu yüksek olmasına rağmen, çoğunda sonuç için en az 6 saat gerekmektedir.(196) Genel olarak, özellikle akut miyokard enfarktüsü tanısını koymak için gerekli süre önemli olduğu durumlarda, bu beklemek için çok uzun bir süredir. Ayrıca, bu uygulama önemini kaybetmiştir, çünkü troponin markerları kanda uzun süre kaldıkları için, akut miyokard enfarktüsün geç tanısında, tek başına bunlar kullanılabilir. Enfarktı gösteren görüntüleme yöntemleri, akut miyokard enfarktüsünden sonra günlerce pozitif kalır ve sol ventrikül anevrizması gelişen hastalarda, persistan olarak pozitif olabilir. Bu nedenle, akut miyokard enfarktüsünü erken saptayabilen, risk altındaki miyokard alanını hesaplayabilen ve enfarkt boyutunu hesaplamak için kullanılabilen ve böylece miyokard enfarktüsünün yaygınlığını değerlendirebilen akut perfüzyon görüntülemesi üzerinde yoğunlaşılmıştır. Bu amaç için, Tc-sestamibi özellikle çekicidir, çünkü kolaylıkla bulunabilir ve izotopun redistribüsyonu minimal düzeydedir ve akut müdahale gerekiyorsa, görüntüleme 2 saate kadar geciktirilebilir.(197) Akut miyokard enfarktüsü tanısı için, 54 perfüzyon görüntülemesinin duyarlılığı %100'e yakındır. Özgüllük %75-80'dir; ancak bu uygulama, maliyet ve günün 24 saati ve haftanın 7 günü hizmet sağlayabilmek açısından lojistik zorluklar nedeniyle popülarite kazanamamıştır. Son zamanlarda, normal markerları olan veya akut miyokard enfarktüs olasılığı çok düşük olan ve göğüs ağrısı ile gelen hastalarda, bu yaklaşım kullanılmıştır. Böyle hastalarda, konu akut enfarktüsü değil, iskemiyi taramaktır. Bu uygulama ile, scan sayısı azalır ve maliyet azalır. Ayrıca, bu uygulamalar lojistik açıdan daha az zahmetlidir, çünkü hastalar grup olarak daha az hasta olan bir gruptur. Negatif scani olan hastalarda, daha sonra koroner arter hastalığı gösterilse bile, prognozun mükemmel olduğu ortaya konmuştur. Günümüzde, birçok merkez bu uygulamayı göğüs ağrısı değerlendirme üniteleri içine sokmuştur. Akut miyokard enfarktüsünün görüntüleme ile erken tanısı için diğer bir uygulama, sol ventrikül duvar hareketini değerlendirmektir, çünkü akut enfarktüs hemen hemen her zaman miyokard kontraksiyon bozukluğuna neden olur. Bu, Tc-sestamibi ile miyokardiyal perfüzyon görüntülemesi yapılarak gerçekleştirilebilir. Radyonüklid izotopun sol kalpten ilk geçişi ve sol ventrikülün gated üç boyutlu tomografik dilim rekonstrüksiyonu incelenir. Bu uygulama diğer radyonüklid tekniklerinin dezavantajlarına sahiptir: maliyet ve lojistik problemler. Bu nedenle, taşınabilen ve maliyeti daha düşük olan ekokardiyografi üzerinde durulmuştur. Ayrıca, duvar kalınlığı ve hareket ekokardiyografi ile değerlendirilebilir ve bunlar diyagnostik doğruluğu arttırabilir. Acil birimde, akut miyokard enfarktüsü tanısı için, ekokardiyografi ile ilgili prospektif bir çalışma, duyarlılığın %93 olduğunu göstermiştir, ama özgüllük sadece %59 olarak saptanmıştır, çünkü ekokardiyografi eski ve yeni bölgesel disfonksiyonu ayırt edemez.(198) Hastaların %94'ünde, yorum yapılabilir ekokardiyogramlar elde edilmiştir. Buna karşılık, radyonüklid görüntüleme, teknik olarak hastaların hemen hemen %100'ünde uygundur. Ancak, duvar hareketinin radyonüklid değerlendirilmesinde, ekokardiyografide görülen aynı özgüllük problemi vardır, çünkü akut ve eski enfarktı, stunned ve enfarktlı miyokardı ve hibernating miyokardı birbirinden ayırt edemez. Ancak, hem ekokardiyografi, hem de radyonüklid görüntülemenin negatif prediktif değerleri yüksektir; diğer bir deyişle, duvar hareketi normalse, hastada bir miyokard enfarktüsü olma olasılığı çok düşüktür veya inceleme zamanında yapılmışsa, iskemi olma olasılığı da çok düşüktür. GÖĞÜS RADYOGRAFİSİ Göğüs radyografisinin akut miyokard enfarktüsünün erken tanısında genellikle pek bir değeri yoktur. Sadece hemodinamik distresi(kardiyojenik şok veya akciğer ödemi) olan hastalarda sol ventrikülün dolma basıncının belirlenmesinde yardımcı olabilir. EKOKARDİYOGRAFİ Göğüs ağrısıyla nondiyagnostik bir EKG’si olan hastalarda ,ekokardiyografi önem taşıyabilir.erken ekokardiyografi ,duvar hareket bozukluklarının gözlendiği iskemik orjinli göğüs ağrısı ile nonkardiyak göğüs ağrısını ayırt edebilir. Ayrıca ,eksüdatif perikardit ile ayırıcı tanı da yapılabilir. Akut miyokad enfaktüsü olan hastalarda,ekokardiyografik anomaliler ile nihai enfarkt boyutu arasında iyi bir korelasyon vardır.(özellikle inferior veya posterior miyokard enfarktüsü olan hastalarda.) AKUT MİYOKARD ENFAKTÜSÜNÜN TEDAVİSİ(27) Akut miyokard enfarktüsü şüphesi taşıyan hastada,ani koroner ölüm riski yüksek olduğu için ,acil önlemler alınmalıdır. 55 PRİMER ÖNLEMLER Kalp ritminin takibi EKG,kalp ritminin mobil monitörleri, taşınabilir defibrilatörler üzerinde mevcuttur. Akut miyokard enfarktüsü şüphesi taşıyan bir hasta hemen bu monitörlerden birine bağlanmalıdır, çünkü akut miyokard enfarktüsünün ilk saatlerinde, ventriküler fibrilasyon gelişebilir. Venöz kanül yerleştirilmesi Akut miyokard enfarktüsünün erken saatlerinde, en sık rastlanan komplikasyon ventriküler fibrilasyona bağlı kardiyak arrest olduğu için, yaşam desteğini sağlayacak ilaçlar ve sıvıların verilmesi açısından venöz damar yolunun açılması önemlidir. Transfer Akut miyokard enfarktüsü şüpheli bir hasta acil birimi veya koroner bakım ünitesi olan bir hastaneye transfer edilmelidir. Bu gibi kurumlarda, uygun triyaj sağlanabilir ve daha sonra uygun tedavi uygulanabilir. Bazı bölgelerde, hastane öncesi triyaj yapılabilir ve bazen trombolitik tedavi bile hastane öncesinde başlatılabilir. Lokal duruma bağlı olarak trombolitik tedavi zamanı 30-150 dakikaya kadar kısaltılabilir ve bu şekilde sol ventrikül fonksiyonun daha iyi idamesi ve korunması sağlanır. Ancak, çoğu bölgelerde, telefonik EKG tanısı ile birlikte hastane öncesi tromboliz için infrastrüktüre gereksinim olmaktadır ve bu bölgelerde hızlı bir transfer zorunludur. İKİNCİL ÖNLEMLER Ağrı ve anksiyetenin rahatlatılması Akut miyokard enfarktüsü olan hastalar, ezici bir ağrı hissederler ve endişelidirler. Ağrı ve anksiyeteden kurtulmak için, bir antiemetik olarak droperidol ile birlikte 5-10mg morfin sülfatın intravenöz olarak kullanılması uygundur. İlaçlar intramüsküler değil, venöz kanül yoluyla verilmelidir, çünkü intramüsküler enjeksiyon, miyokard enfarktüsün enzimatik tanısını yanıltabilir ve trombolitik terapiye başlandıktan sonra şiddetli kanama komplikasyonlarına neden olabilir. Oksijen Akut miyokard enfarktüsü olan hastalarda oksijen kullanımı halen tartışmalıdır. Ancak, akut miyokard enfarktüsünün bir sonucu olarak her an ortaya çıkabilecek kalp yetmezliğinde veya belirgin kalp yetmezliğinde yararlıdır. Nitrogliserin Akut miyokard enfarktüsünde, nitrogliserinin rutin kullanımı da tartışmalıdır. Ancak, miyokard enfarktüsü şüphesi taşıyan hastalarda nitrogliserin uygulanması miyokard nekrozu gelişimini durdurabilir ve böyle bir vakada, nitrogliserin terapötiktir. İki geniş randomize klinik çalışmada, nitrogliserin bandının veya isosorbid mononitratın rutin kullanımı, mortalitede %5 oranında istatistiksel anlam açısından sınırda kalan göreceli bir düşüşe yol açtı. Rutin nitrogliserin, hastaların çoğunda yararlı olamayacağı halde, belli bir hasta alt grubunda kullanışlı olabilir. Bunun riski neredeyse sıfırdır. 56 ÜÇÜNCÜL ÖNLEMLER Reperfüzyon terapisi Trombolitik terapi Trombolitik terapi, akut miyokard enfarktüsünün erken tedavisi için ileri doğru en büyük adım olmuştur. Semptomlar başladıktan 6 saat sonra trombolitik tedavi uygulanmasının, sadece çok az yararlı olacağı da kesinlik kazanmıştır. Mutlak veya görece kontrendikasyonlara karşı trombolitik tedavi endikasyonu karşılaştırılmalıdır. Hasta ne kadar erken gelirse, risk altında olan alan ne kadar genişse ve kontrendikasyonlar ne kadar göreceli ise, trombolitik terapi o kadar yararlı olur. Hasta ne kadar geç gelirse ve risk altındaki alan ne kadar küçükse, trombolitik tedavi o kadar az yararlı olur ve kontrendikasyonlar o kadar sağlamdır. Trombolitik tedavinin temel riskleri, doğasında varolan kanama komplikasyonlarında yatar. En ciddi kanama komplikasyonu, intraserebral hemoraji gelişimidir. Bu, trombolizle birlikte tedavi edilen hastaların %0.5'inde görüıür .Trombolitik tedavi sonrası serebral kanama gelişimindeki risk faktörleri; düşük vücut ağırlığı (65 kg.ın altı), kadın cinsiyet, hipertansiyon ve tromboliz öncesi oral antikoagülan kullanımıdır. Arterin delinmesinden sonra gastrointestinal kanama ve hemoraji de oluşabilir. çoğu vakada bu kanama komplikasyonları konservatif olarak tedavi edilebilir ve iyi bir prognoz gösterir. Reoklüzyon, trombolitik terapi sonrasında görülen ikinci bir problemdir. Hastane yatışı süresince vakaların aşağı yukarı % 10'unda ve trombolizden sonraki yıl içinde aşağı yukarı %30 oranında reoklüzyon görülür. Şimdiye kadar, hiçbir spesifik ilaç veya müdahalenin reoklüzyona karşı etkili olduğu kanıtlanmamıştır. Günümüzde kullanılan ilaçlar, aspirin ve heparin, trombolitik tedavi gören hastalarda önemlidir ama bunların reoklüzyona karşı etkinliği kanıtlanmış değildir. Son olarak, trambolitik ajanlar immunojen olabilir. Bu, özellikle streptokinaz ve anistreplaz gibi streptokinaz kaynaklı ilaçlarda görülür. Endojen plazminojen aktivatörleri [doku plazminojen aktivatörü (alteplaz) ve tek zincirli ürokinaz benzeri plazminojen aktivatörü veya (saruplaz)] düşük immunolojik reaksiyon insidansı taşırlar ve streptokinaz allerjisi olan hastalara veya daha önceden streptokinaz verilmiş olan hastalara uygulanabilirler. Ancak, bu ilaçların erken (90 dakika) rekanalizasyon oranları farklıdır: streptokinazda sadece %30-35'e karşı 'front-loaded doku plazminojen aktivatörü'nde %50. Erken açıklık erken sürvi ile korele olduğu için,sadece başlangıçta kullanılan trombolitik ilacın maliyeti önemli değildir. Geniş bir miyokard enfarktüsü olan ve erken başvuran hastalar, erken açıklık oranı yüksek olan bir ilaçtan, küçük bir miyokard enfarktüsü olan ve geç başvuran hastalara göre daha fazla fayda görürler. Koroner anjiyoplasti Akut miyokard enfarktüsü için reperfüzyon stratejisinde, trombolitik tedaviye kesin bir alternatif primer koroner anjiyoplastidir. Bu tedavi, en az optimal trombolitik strateji kadar yararlıdır (front-loaded doku plazminojen aktivatörü).Primer anjiyoplastinin en önemli dezavantajı, sınırlı kullanım alanı ve tedavinin gecikmesidir. Gecikmenin nedeni katerizasyon 57 laboratuarının hazırlanması ve prosedürü uygulamak için personelin harekete geçmesidir. Ayrıca, hastaların primer anjiyoplasti için transfer edilmesi gerektiğinde, gecikme önemli derecede olabilir. Primer anjiyoplastinin başlangıç maliyeti, trombolitik tedaviden fazladır ama elde edilen açıklık oluşumu trombolitik tedaviden daha fazladır (%90'a varabilir). Primer anjiyoplastinin riskleri trombolitik tedaviden daha azdır, çünkü primer anjiyoplastide serebral kanama oluşmaz. Bu nedenle, çoğunlukla stent implantasyonu ile birlikte primer anjiyoplastinin başarıyla ve hızlı bir şekilde uygulandığı üçüncül merkezlerinde, akut miyokard enfarktüsünde tercih edilen tedavi budur. Farmakolojik önlemler Beta-blokajı İstirahatte uzun süreli akut iskemisi olan hastalar, iskemiyi azaltmak için beta-blokerlerle tedavi edilmelidir. Oral beta-blokerlerin kalp atışlarını ve kan basıncını yavaşlatmada klinik olarak etkili olması en az 30 dakika aldığından, özellikle akut transmural miyokard iskemisi olan hastalarda, intravenöz beta-blokerler tercih edilebilir. İntravenöz betablokajı daha iyi hastane survisi ile ilişkilidir.Bunun nedeni, büyük olasılıkla miyokard iskemisinin, re enfarktüs oranlarının ve miyokard rüptürü oranlarının azalmasıdır.Ayrıca, trombolitik dönemde, intravenöz beta-blokajının tekrarlayan miyokard iskemisi ile miyokard enfarktüsünün azaltılmasında etkili olduğu gösterilmiştir. Metropolol (intravenöz lOmg) ve atenolol (intravenöz 5mg), akut miyokard enfarktüsünde kullanılan intravenöz ilaçlar olarak tanımlanmıştır. İntravenöz beta-blokajını oral beta-blokajı takip etmelidir. Aspirin ve heparin İstirahatte uzun süreli miyokard iskemisi olan bütün hastalara intravenöz veya oral olarak aspirin verilmelidir. Anstabil anjinası ve akut miyokard enfarktüsü olan her iki hasta grubunda da aspirinin enfarktüs, reenfarktüs ve ölüm oranını %30-50 azalttığı gözlenmiştir.Aspirinin yükleme dozu, trombosit tromboksan A2 biyosentezini tamamen durdurmak için gereklidir. İlk doz en az 100mg olmalıdır ama tercihen 200mg veya daha fazla da olabilir. Sonradan verilen dozlar günlük 75 ve 325mg arasında olabilir. Non-Q-dalga miyokard enfarktüsü ve anstabil anjinası olan hastalarda yapılan bazı çalışmalarda, istirahatte uzun süreli iskemide,heparinin rolü ortaya konmuştur. Aspirin tedavisi gören hastalara verilmesinin. enfarktüs ve ölüm oranını % 15 düşürdüğü gösterilmiştir.Subkutan, düşük molekül ağırlıklı heparin, intravenöz heparin için bir alternatiftir. Dalteparin ve enoksaparin anstabil anjinada kullanılmaktadır. Akut transmural miyokard enfarktüsünde heparinin rolü daha azdır.Trombolitik tedavi ile en iyi sonuçlar, ‘front-loaded doku plazminojen aktivatörü’nün heparinle kombinasyonuyla gelmiştir..Ancak trombolitik tedavi ile birlikte kullanıldığında heparin, şiddetli kanama komplikasyonlarıyla da ilişkilidir. Heparin trombolizle (doku plazminojen aktivatörü veya streptokinaz) birleştirilerek kullanıldığında serebral kanama olasılığı artar. Ekstrakraniyal kanama da heparin kullanımı ile birlikte artar. Heparinle ilgili olarak herhangi bir plasebo kontrollü erken açıklık çalışması olmamasına rağmen, trombolizle birlikte düşük molekül ağırlıklı heparinin rolü üzerine çalışmalar sürmektedir. 58 Diğer farmakolojik önlemler Ventriküler aritmilerin önlenmesi için yapılan rutin antiaritmik tedavi, akut miyokard enfarktüslü hastalarda endike değildir ve zararlı bile olabilir. Akut miyokard enfarktüslü hastalara verilen lidokain (lignokain) ventriküler fibrilasyon oluşumunu anlamlı derecede engeller ama asistolü uyarır. Ayrıca, lidokain negatif-inotrop bir ilaçtır ve konvülsiyonu uyarabilir; total atriyoventriküler blok vakalarında asistole neden olabilir. Hastaneye başvurduğunda bariz kalp yetmezliği olan hastalar, miyokard enfarktüsünden sonra ilk saatler ve günler içinde konjestif kalp yetmezliği gelişen hastalarda olduğu gibi, bu tedaviden yararlanabileceği halde, rutin anjiyotensin konverting enzim inhibitörlerinin rutin olarak uygulanması, mortalite ve morbidite oranını anlamlı derecede düşürmez. Akut miyokard enfarktüsünde, magnezyum sülfatın rutin kullanımı da yararlı değildir. İnvazif önlemler Akut miyokard enfarktüsünün ilk saatlerinde, rutin koroner anjiografi yapılması endike değildir. Erken anjiyografiden (acil revaskülarizasyon ile takip edilmelidir), sadece şiddetli konjestif kalp yetmezliği veya kardiyojenik şokta olan hastalar yararlanabilir.Reoklüzyon az rastlanır olmamasına ve bazen trombolitik tedaviden soma şiddetli residüel stenoz devam etmesine rağmen, trombolitik tedavi gören hastalarda , erken rutin invazif prosedürler yararlı değildir. Non-Q-Dalga miyokard enfarktüsü olan ve anstabil anjinası olan hastaların. Akut ataktan sonraki aylar ve haftalar içerisinde tekrarlayan iskemi ve kardiak ölümle karşı karşıya kalabilecekleri iyi bilinmektedir. Ancak bu hastalarda erken rutin invazif prosedürler (anjiyografi ve sonrasında anjioyoplasti veya koroner cerrahisi), enfarktüsü, reenfarktüsü veya ölümü engellemez. Optimal antiiskemik ve antitrombotik tedaviye rağmen, tekrarlayan iskemisi olan hastalarda, eğer uygunsa, erken koroner anjiyografi ve sonrasında anjiyoplasti ve koroner cerrahi müdahele endikedir. Miyokard enfarktüsü gelişmekte olan hastalarda; rutin invazif prosedürlerin yararlı değil zararlı olmasının nedeni, akut iskemik sendromlarda, koroner plağın hassas olması ve mekanik tedavinin yıkıcı olma olasılığıdır. Ayrıca, miyokard enfarktüsü gelişmekte olan hastalarda, koroner cerrahi yüksek bir mortalite ile koreledir. PROGNOZ Akut miyokard enfarktüsü olan hastalarda, mortalite, semptomların görüldüğü ilk dakikalarda en yüksek orandadır. Ventriküler aritmi miyokard enfarktüsündeki bu çok erken fatal sonucun nedeni olarak kabul edilir. Akut miyokard enfarktüsü geçiren hastaların aşağı %25’ i semptomların başlangıcından sonraki ilk saat içerisinde, genelde medikal veya paramedikal personel, olay yerine ulaşmadan önce ölür. Medikal veya paramedikal personelin gelmesinden hemen önce ventriküler fibrilasyon gelişen hastalarda bile, hastalar hastaneye canlı ulaştırılabilmesine rağmen kötü bir prognoz görülür. Ambulans geldiğinde veya hastaneye yatırıldığında hala yaşıyor olan hastalar bile ciddi bir ventriküler fibrilasyon riski altındadır. Akut MI’nün ilk saatlerinde ventriküler fibrilasyon gelişen hastalar, düzgün şekilde defibrile edilse bile, ventriküler fibrilasyon geçirmeyen hastalara göre kötü bir hastane prognozu gösterirler. Rol oynayan mekanizmalar kesinlik kazanmamıştır; enfarktın boyutu rol oynayabilir, ama bu da tartışmalıdır. Hastaneden taburcu olduktan sonra, ventriküler fibrilasyon geçirmiş hastalar, geçirmeyenlerle aynı prognoza sahiptir. 59 Akut miyokard enfarktüsünde klinik ve biyokimyasal markerlar, erken pragnostik göstergelerdir. Trombolitik tedavi için uygun olmayan hastalarda, trombolitik tedavi alan hastalara göre prognoz daha kötüdür. Trombolitik tedavinin başarısızlığı (ST-segment elevasyonu ve ağrının persistansı bunun göstergesidir), trombolitik tedavi görmeyen hastalarda olduğu gibi aynı kötü prognoza işaret eder. Tekrarlayan miyokard iskemisi, özellikle trombolitik tedavinin yokluğunda, multidamar koroner arter hastalığının bir bulgusudur. Bu tip hastalara mümkün olduğunda, acil anjiyografi ve revaskülarizasyon uygulanması gerekir . TİROİD BEZİ VE HORMONLARI Tiroid bezinin fonksiyonel birimleri, kolloidle dolu 15-500 µm çapındaki küresel foliküllerdir. Folikül tek sıralı kübik epitelle çevrilidir ve bu hücreler kolloidin başlıca maddesi olan tiroglobulini sentezler. Bu hücrelerin hemen yanında seyrek olarak kalsitonin salgılayan parafoliküler hücreler bulunur(199). Tiroid hormon sentezi, ön hipofizden salgılanan Tiroid Stimülan Hormon (Tirotropin, TSH ) tarafından bir negatif feed-back mekanizmasıyla kontrol edilir. TSH salgılanması ise hipotalamustan salınan Tirotropin Serbestleştirici Hormon (TRH) ile ayarlanır. Ayrıca tiroid hormon sentez aşamasında otoregülatuar mekanizmalar da önemli rol oynamaktadır(200,201,202). Tiroid hormonlarının ana maddesi tirozin ve iyottur. İyot ince barsaklardan iyodür olarak emilir, dolaşım ile tiroide gelir. Hormonların sentez ve metabolizması kısaca şu aşamalardan geçer (200,201,202); 1.İyodürün tutulması, peroksidaz ile oksidasyonu ve serbestleştirilmesi 2.Tirozin içeren tiroglobulin sentezi 3. İyodun tirozine bağlanması ve organifikasyonu 4. Monoiodotironin (MİT) ve diiodotironin ( DİT )’ in birleşerek Triiodotironin (T3) ve tiroksin(T4 ) oluşturması 5. Kolloid tiroglobulinin hidrolizi ile MİT, DİT, T3, T4‘in serbestleşmesi ve dolaşıma salgılanması 6.MİT ve DİT‘lerin deiodinasyonu ve iyodun tekrar tiroid içinde kullanımı. Plazmada total T4 konsantrasyonu 5-12 µg/dl, total T3 konsantrasyonu ise 80-200 µg/dl kadardır. Bu hormonların büyük kısmı, tiroksin bağlayıcı globulin(TBG), tiroksin bağlayıcı prealbumin(TBPA) ve albumine bağlı olarak bulunur. Normalde kandaki T4 ‘ün yaklaşık %0.04’ü, T3 ‘ün ise %0.4’ü serbest şekilde bulunur. Aktif olan kısım serbest kısımdır. Tiroid bezinin salgıladığı asıl hormon T4 ‘dür. T3 ‘ün % 96-98 ‘i periferde T4 ‘ün 5’Monodiodinaz(5’-MDI) enzimi ile deiodinasyonu sonucunda oluşur. T3 yapımının asıl yolu T4‘deki dış zincirinden enzimatik deiodinasyondur. Alternatif olarak T4 iç halkasından deiodinize olur ve revers T3 (rT3 ) meydana gelir, bu T3‘ün inaktif formudur. Üç tip iodotironin deiodinaz enzimi mevcuttur. Bu enzimler karaciğer, böbrek, beyin, tiroid, fetal dokular, plasentada bulunurlar. Bir çok ilaç ve fizyolojik durum yanında siroz, kronik böbrek yetmezliği, sepsis, açlık ve cerrahi girişimlerin periferdeki T4‘ün T3‘e dönüşümünü inhibe ettiği bilinmektedir. Deiodinasyonlar devam eder ve metabolitler idrarla atılır, bir kısmı ise safra yoluyla atılır. T4‘ün yarılanma süresi 8 gün, T3 ‘ün yarılanma süresi ise 24 saattir (199,200,202). Tiroid Hormonlarının Etkileri (199): Tiroid bezinin salgıladığı hormonlar anabolik hormonlardır. Hemen tüm hücrelerde, nukleusa ve mitokondrial spesifik reseptörlere etkiyerek, hücre enzim sistemlerini, aktif iyon 60 transportunu ve protein sentezini arttırır.Membranlardaki Na-K-ATPaz enzimi üzerinden oksijen tüketimini ve ısı oluşumunu,sonuçta da bazal metabolizmayı arttırır. Somatik ve mental gelişimi artırıcı etkileri vardır. Karbonhidrat metabolizmasında, glikozun absorbsiyonundan glikojenolize kadar tüm aşamaları arttırır. Yağ metabolizmasında artışa neden olur . Serbest yağ asitleri artar, kolesterol, fosfolipid ve trigliseridlerin miktarı azalır.Solunum sisteminde, oksijen tüketimi ve karbondioksit oluşumu artar, solunum frekansı ve derinliği değişir. Gastrointestinal kanalda motilite artışına neden olur. Hormon fazlalığında ileri derecede sinirlilik, anksiyete, paranoya gibi psikonörotik eğilimler gelişir. Kaslarda hormonların az miktarda artışı sert kasılmalara neden olur. Aşırı hormon salınımında ise katabolizmanın artmasına bağlı kaslarda zayıflık oluşur. Hormon eksikliğinde ise kaslarda tembellik, kasılmalardan sonra yavaş gevşeme olur. Özetle; kan akımı ve kalp debisini arttırır. Kalp hızını arttırır. Kardiyak kontraksiyon gücünü arttırır. Kan hacmini ve arteriyel basıncı arttırır.Β adrenerjik reseptör aktivitesini ve postreseptör yanıt yeteneğini artırarak katekolaminlerin etkilerini şiddetlendirir. Diğer endokrin bezler üzerine etkisi: İnsülin, ACTH, glikokortikoid artışına neden olur. Hormonların azlığı da çokluğu da seksüel disfonksiyona, libido kaybına yol açar. TİROİD FONKSİYON TESTLERİ (202): Plazma Total T4 (tT4): Tiroid bezi fonksiyonunu değerlendirmek için kullanılır. Normal değerleri 5-12 µg/dl. Gebelikte, östrojen alımında, TBG yüksekliğinde, salisilat alımında yüksek seviyeler ölçülür. Androjen, kortikosteroid, antikonvülzan alanlarda, kronik böbrek ve karaciğer hastalıklarında düşük seviyeler saptanır. Plazma Serbest T4 (sT4): Radyoimmunassay yöntemiyle yapılan test tiroidin fonksiyonel durumunu belirten en iyi testtir. Gebelik ve TBG‘yi etkileyen faktörlerden etkilenmez. Normal seviyesi 0.7-2.1 ng/dl ‘dir. Plazma Total T3 (tT3): TBG ‘deki değişikliklerden etkilenir. Normal düzeyi 80-200 ng/dl’dir. Plazma Serbest T3 (sT3): Radyoimmunassay yöntemiyle seviyesi tespit edilebilir. Gebelik ve TBG’yi etkileyen diğer faktörlerden etkilenmez. Normal düzeyi 0.2-6.5 ng/dl’dir. T3 resin uptake testi (RT3U): Tiroid hormonları bağlayan proteinlerdeki hormonlar tarafından doldurulmamış bağlayıcı uçların ölçülmesidir. Serbest hormon düzeyi hakkında dolaylı bilgi verir. Hipertiroidi ve ötiroid hasta sendromunda artar, hipotiroidi ve hamilelikte azalır. Normalde % 23-35’tir. TSH düzeyi: Normali 0-3-5.0 mU/L’dir. Primer hipotiroidide daima yüksek bulunur. Radyoaktif İyot Uptake (RAIU): İyot içeren ilaçlarda etkilenir. Normalde 2. saatte % 10.52.7 ve 24. saatte %30-4.9’dur. TRH uyarısına TSH cevabı. T3 Süpresyon testi Bu testlerle tiroid fonksiyonlarını değerlendirirken T3 ,T4, TBG miktarları birlikte gözden geçirilmelidir. TBG düzeyi, oral kontraseptif alımında, gebelikte, kronik aktif 61 hepatitte ve akut intermittan porfiriada artar. Testesteron, kortikosteroid ve fenitoin kullanımında, siroz, nefrotik sendrom ve bazı kalıtsal durumlarda azalır. ÖTİROİD HASTA SENDROMU Sağlıklı ve hasta bir şekilde metabolik durumu genellikle tiroid dokusundan salgılanan tiroid hormonlarının belirlediği kabul edilir. Ancak, metabolik kontrolden sadece tiroid glandı sorumlu değildir. Çeşitli dokulardaki hücre içi olaylar, aktif hormon olan T3’ün ve inaktif rT3’ün yapımını, lokal T4’ün deiyodinasyonu aracılığıyla ayarlarlar. Normal şartlarda, günlük T4 yapımı, tamamı tiroid kaynaklı olmak üzere 100µg’dır. T3’ün ise günlük yapımı 30µg’dır ve bunun %20’si tiroidden doğrudan salgılandığı halde, %80’i periferik dokularda T4’ün 5’deiyodinasyonu ile meydana gelir. T4’ün geri kalan kısmı rT3’e veya konjuge bileşiklere dönüşür. T4’ün aktif veya inaktif metabolitlerine dönüşümü, tip I ve tip II 5’deiyodinaz (D1 ve D2) ve tip III 5’deiyodinaz (D3) enzimlerinin aktivitesine bağlıdır. Çeşitli hastalıklar, lokal T3 veya rT3 yapımını farklı şekillerde etkiler. Öneğin hipotiroidizmde, beyinde ve hipofizde bulunan D2 enziminin aktivitesi artarken, karaciğer ve böbrekte D1 enzimi, merkezi sinir sisteminde D3 enzimi aktivitesi azalır. Böylece bu örnekte D1 ve D3 enzimleri, doku düzeyinde T4-T3 dönüşümünü arttırarak (5’-deiyodinaz) veya T4 yıkımını azaltarak (5deiyodinaz) T3 yapımını ayarlamaya çalışırlar. Ağır sistemik hastalıklar, fiziksel travma ve psikiyatrik bozukluklar, tiroid hormonlarını, tiroid dokusunda bir hastalık olmadan değiştirebilirler. Bu durumu tarif etmek için ‘’tiroid dışı hastalık sendromu’’, ‘’ötiroid hasta sendromu’’ ve ‘’düşük T3 sendromu’’ gibi çeşitli isimler kullanılmıştır. ÖHS’na bağlı tiroid hormon değişikliklerine, endojen tiroid hastalıklarına bağlı tiroid hormon değişikliklerinden daha sık rastlanır. ÖHS’de saptanan tiroid hormon değişiklikleri genellikle primer veya sekonder hipotiroidizmi taklit eder. Bu hastalarda hipotiroidizmin kesin bulguları olmamakla birlikte, en azından bazı dokularda tiroid hormon etkisinin azalmış olduğu gösterilmiştir. Rastlanan bulgular geçicidir ve altta yatan nedenin tedavisi ile hipofizer-tiroid ekseni normal işlevini kazanır. Bu yüzden, hastalığa adaptasyon sayılabilecek geçici bir hipotiroidizm döneminin oluştuğu ve bu sayede aktif hormon olan T3’ün dokulara ulaşmasının ve primer hastalığın olumsuz etkilerinin azaltıldığı söylenebilir. Başka bir deyişle, meydana gelen geçici doku hipotiroidizmi, organizmanın hastalığa veya açlığa adaptasyonunu kolaylaştırır. ÖHS’de gerçek hipertiroidizm ve hipertiroidizmin tanısı güçlükler yaratır. ÖHS’nin çeşitli şekilleri vardır. T3 Azalması (düşük T3 normal T4) Akut ve kronik tiroid dışı hastalıkların büyük kısmında serum T3 düzeyi azalmıştır. Değişik hastalıklar nedeniyle hastaneye yatırılmış hastaların önemli bölümünde serum T3’ünün azalmış olduğu, bunların %70’inde bu azalmanın hipotiroidi sınırları içinde olduğu gösterilmiştir. Düşük serum T3 değeri, diabetes mellitus, kronik karaciğer hastalığı, akut ve kronik infeksiyonlar, böbrek, kalp ve akciğer hastalıkları ve neoplastik hastalıklarda ve cerrahi girişim ve travma sonrasında görülebilir. Akut ve kronik açlıkta, protein-kalori malnütrisyonunda ve normal fetus ve birkaç saat süreyle yeni doğanda, serum T3 değerinde azalma yanında, T3 yapımında da azalma saptanır. Bu durumlardaki T3 düşüşünün sebebi, tiroid dışı dokularda, başlıca D1 enzimi ile ayarlanan, T4-T3 dönüşümünün azalmasıdır. Kandaki T3’ün yaklaşık %90’ı D1 enziminin etkisiyle meydana geldiğinden T3 azalmasıda büyük ölçüde D2 enziminden ziyade, D1 enzim aktivitesinin azalmasına bağlıdır. Çeşitli dokularda tespit edilen enzim değşiklikleri farklı yönlerde olabilir. Gerçekten de açlık, hipotiroidizm ve fetal hayatta veya yenidoğan döneminde, beyin ve hipofiz dokusunda, D2 enzim aktivitesi ve buna bağlı olarak T3 neogenezi artarken, beyin dışındaki dokularda D1 enziminin azalması ve T3 yapım azalması daha belirgindir. Tiroid dışı hastalıklarda T3 62 azalmasına yol açan çeşitli mekanizmalar ileri sürülmüştür. Sistemik hastalıkların büyük kısmında, makrofaj ve monositlerden salgılanan sitokinlerin (TNF-α, IL-2, IL-6) uyardığı ‘’doku inhibitörü’’, D1 enzimini etkileyerek serum T3 düzeyinde azalma meydana getirir. Propranolol, propiltiyourasil ve kolesistografi ilaçları ise doğrudan D1 enzimini inhibe ederek, serum T3 düzeyini azaltırlar. Diğer muhtemel mekanizmalar arasında, hücreye yeterli substratın (T4) ulaşamaması, enzim kofaktör eksikliği, ekstraselüler ve intraselüler T4 bağlanma defektleri, ve T3’ün T3 sülfat (T3S) konjugasyonunun hızlanması, ileri sürülmüştür. T3 düşüklüğü ile seyreden ÖHS’de genellikle total ve serbest T4 normal, serum rT3 ise yüksektir. T3 ve rT3 arasındaki bu ters yönde değişimden, 5’ deiyodinaz enzimi sorumludur. 5’deiyodinaz enzim aktivitesindeki azalma, T4’ün T3’e dönüşümünü azaltırken, rT3’ün de diiyodotironin (T2)’e yıkılmasını azaltır.T4 ve TSH değerleri normal sınırlar içinde olduğundan, düşük T3 ile seyreden ÖHS’nin hipotiroidizmden ayrılması zor değildir. T3 ve T4’ün birlikte azalması (düşük T3, düşük T4) Hafif veya orta derecede ağır hastalıkların büyük kısmında, serum T3 düzeyi azalmış olduğu halde T4 düzeyi normal kalmaya devam eder. Çeşitli infeksiyonlar, kalp hastalıkları, habis tümörler, yanık ve ağır travmalara bağlı daha ciddi hastalığı olanlar da ise, T3 azalması yanında T4 azalması azalması da tespit edilir. Total T4 düzeyi azaldığı halde, T3RU normal sınırlar içinde veya artmıştır. Diyaliz yöntemi ile ölçülen ST4 ve ST4I, genellikle normal veya hafif derecede azalmıştır. Duyarlı TSH düşük, TRH’ya TSH cevabı yatıktır. Hastalık düzelirken, TSH seviyesi artar ve T3-T4 normale gelinceye kadar bir süre yüksek kalır. Ön maddesi olan T4 azaldığı için, rT3 yapım miktarı azalır, ancak yıkımı da yavaşladığından serum rT3 düzeyi genellikle yüksek bulunur. Hipofizer hipotiroidizmde ise rT3 düşüktür ve bu sayede ÖHS ile ayrımı yapılabilir. Hastaların önemli bölümünde bu değişikliklerden, 1) bağlayıcı proteinler (TBG, Transtiretin ve Albumin) deki azalma ve T4 ‘’turnover’’ının hızlanması; 2) tiroksinin bağlayıcı proteinlerden, yağ asitleri veya proteinlerin (inhibitör) etkisi ile ayrılması, ve 3) TSH sekresyonunun azalması, sorumlu tutulmuştur. Bazı hastalarda, T4 ve T3’ün TBG’ye bağlanmasını etkileyen salisilatlar, furosemid ve heparin gibi ilaçların kullanılması, serum T4 azalmasını kısmen açıklayabilir. T4’ün azalması ile hastalığın ciddiyeti arasında bir ilişki vardır. Ağır tiroid dışı hastalığı olan hastalarda, serbest tiroid hormonlarının ticari kitlerle doğrudan ölçülmesi yorum hatalarına yol açabilir. Böyle hastalarda, ST4’ün diyaliz metodu ile tayini tecih edilir. Ancak diyaliz metodu, günlük uygulamada zorluklarla dolu ve yavaş bir testtir. Yeni ve daha güvenilir, iki aşamalı ST4 tayinleri bu amaçla kullanılabilir. Bu yöntemin uygulandığı durumlarda da hastaların %2-10’unda yalancı yüksek veya yalancı düşük ST4 değerleri elde edilebilir. ÖTİROİD HASTA SENDROMUNUN AZ RASTLANAN ŞEKİLLERİ Bazı hastalıklarda, yukarıda bahsedilen tiroid hormon değişikliklerinden farklı bulgular ortaya çıkabilir. Akut ve kronik karaciğer hastalarında genellikle total T4 artar, serbest T4 ve T3 ise normal sınırlar içinde kalır. Total T4 artışının nedeni, karaciğerde TBG yapım fazlalığına bağlı olarak serum TBG’nin yükselmesidir. Serum rT3 düzeyi azalma eğilimi gösterir. Akut ve kronik viral hepatit, alkolik siroz, akut intermittent porfiri, bu değişikliklerin en sık görüldüğü karaciğer hastalıklarıdır. Sebebi tam bilinmemekle birlikte, TSH düzeyi minimal artış gösterebilir. Kronik renal yetmezlikte, genellikle rT3 normal, TSH ise hafif yüksektir. Kronik renal yetersizlikte genellikle rastlanan parathormon yüksekliği rT3 klirensinin azalmasına yol açabilir. 63 HIV infeksiyonu gösteren hastalarda, genellikle yüksek T4, normal T3 ve azalmış rT3, normal TSH düzeyi saptanır. Ağır HIV infeksiyonlarında, düşük T4 seviyesi nadir bir bulgudur. Akut psikozda, total ve serbest T4 düzeyi yükselebilir, T3 normal sınırlar içindedir ve TSH normal veya hafif derecede artmış veya azalmış olabilir. Bu değişiklikler, uygun tedavi sonrası birkaç gün içerisinde süratle düzelir. Muhtemelen hipofiz-adrenal fonksiyon bozukluklarına bağlı olarak gelişen bu tiroid hormon değişikliklerinin özel bir tedavisi yoktur. Düşük T3’ün en sık rastlanan nedeni, yaşlanmadır. T3 düşüklüğünden, doğrudan yaşlanma veya yaşlılıkta birlikte bulunabilecek başka bir hastalık sorumlu olabilir. Sağlıklı ve fiziksel olarak aktif yaşlılardan seçilmiş bir toplulukta, serum T3 düzeyi genç erişkinlerden farklı bulunmamıştır. Ufak bir grup yaşlıda, TSH düzeyi düşük, buna karşılık total ve serbest T4 düzeyi normal bulunmuştur. Bu bulguları açıklamak için, hipofiz tirotropin hücresi ayar eşiğinin farklı bir seviyede ayarlanmış olabileceği ileri sürülmüştür. Yaşlılarda sık rastlanan multinodüler toksik guatrın erken tirotoksikoz (subklinik hipertiroidizm) dönemlerinde benzer bulgular tespit edilebilir ve tanı zorluklarına yol açabilir. ÖHS’nin klinik önemi Bozuk tiroid fonksiyon testleri, tiroid dışı hastalıklarda en az tiroid hastalıklarında oldukları kadar sıktır. ÖHS’de görülen tiroid fonksiyon bozuklukları gerçek tiroid bozukluklarını bazen taklit eder, bazen de gizleyebilirler. Ayrıca, tiroid fonksiyon değişikliklerinin şiddeti ve niteliği, dizgesel hastalığın prognozunu sezdirebilir. Örneğin düşük bir T3 düzeyi karaciğer sirozunda, konjestif kalp yetmezliğinde, ya da olasılıkla diğer hastalıklarda mortalite yüksekliğini gösterebilir. Benzer biçimde TT4 düşüklüğü dizgesel hastalıklarda mortalite artışını gösterir. Ayırıcı Tanı Tiroid dışı hastalığı olanlarda, tiroid hastalığı olup olmadığının nasıl ve ne zaman değerlendirilmesi gerektiği önemli bir tanı sorunu oluşturabilir. Özellikle tıbbı ya da nöropsikiyatrik bir hastalık nedeniyle hastanede yatmakta, dahası yoğun bakım tedavisi görmekte olanlar için sorun daha da yaşamsaldır. Tiroid testlerini akut hastalık geçinceye ya da yatışıncaya kadar geciktirmek bir yöntem olsa da, uygulanan tedaviye yanıt alınmadığı ya da guatr, taşikardi, bradikardi, atriyal fibrilasyon, kalp yetmezliği, bilinç değişikliği, hiper ya da hipotermi ya da anormal tendon refleksleri gibi tiroid hastalığını düşündüren belirtilerin varlığında bu tutum uygun olmayabilir. TSH ile serbest T4 ikilisinin ölçümü, hasta bireylerde en verimli (cost-effective) ve yararlı testlerdir. Her ikisi de normal sınırlardaysa hastanın ötiroid olduğu, ya da klinik olarak önemli bir tiroid hastalığı olmadığı düşünülebilinir. Eğer serum TSH düzeyi hafif düşük (0.1-0.5 mU/L) ya da yüksek (5-20 mU/L) ve serum ST4 değeri normal ise, tanı büyük olasılıkla tiroid dışı bir hastalıktır. TSH düzeyindeki bu izole değişiklik, yatan hastaların %l5'inde görülebilir (Spencer ve ark. 1987). Yatan hastaların % 2-3 'ünde ise TSH düzeyleri gerçek bir tiroid hastalığını düşündürürcesine ya şiddetle baskılanmış ( < 0.1 mU/L) ya da yükselmiştir (> 20 mU/L). Bu hastalarda ST4 düzeylerinin TSH ile uyumlu değişikliği ya da semptomların varlığı tiroid hastalığı olasılığını arttırır. TSH ölçümlerinde daha duyarlı testlerin varlığı soruna büyük katkıda bulunabilir; Çünkü tiroid dışı hastalığı olanların çoğunda TSH 0.lmU/L den düşük, ancak, 0.01 mU/L den yüksektir. Eğer bu denli duyarlı bir yöntem elde yoksa o zaman TRH uyarı testi uygulanıp, TSH'ın 0.lmU/L den yüksek , dolayısıyla da tirotoksik bir çok hastada görülen 0.01 den düşük olmadığı anlaşılabilir. Ancak, TSH ve ST4 ikilisinin düşüklüğü durumlarında santral 64 hipotiroidiyi dışlamak güçtür. Rosen ve ark.(1994), yaptıkları bir çalışma ile bu iki durumu ayırmanın, ÖHS da kortizal artışının gösterilmesi ile olası olduğunu ileri sürmüşlerdir. Bu görüş, Langer ve ark.(1992) tarafından kolesistektomi uygulanan hastalardan yaşlı gurupta (>65) operasyonla gelişip postoperatif devam eden anlamlı kortizal artışı ile de uyumlu bulunmuştur. TSH düzeylerindeki değişiklikler tiroid dışı hastalıklarda geçici olduğundan, tanı güçlüğü yaratan hastalarda ölçümlerin yinelenmesi ve tiroid dışı hastalıklarda gözlenecek değişimlere karşın, gerçek tiroid hastalıklarındaki değişmezliğin saptanması bakımından yararlıdır. Bu durumun geçerli olmadığı hastalar, özellikle yoğun bakım ünitelerinde uzun süre dopamin verilen, ya da yüksek doz glukokortikoid aldıkları için TSH' ları baskılanmış olanlardır. Bu ilaçlar primer hipotiroidili hastaların yüksek TSH düzeylerini normal düzeylere indirebilmektedirler. Tedavi ÖHS lu hastaların çoğu tiroid dışı hastalığın kısalığından, normal ST3, ve / ya da T3 olmayan maddelerin katkısı ile ötiroid olabilirler. Ancak bazıları, özellikle hastalığı uzun sürenler (diyaliz ile ST4'ü düşük olanlar), biyokimyasal olarak gerçekten hipotiroid olabilirler ve tiroid hormon tedavisinden yarar görebilirler. Bu görüş tiroid dışı hastalıklardan ölen hastaların dokularında daha az tiroid hormonu bulunması, dokularda tiroid hormon etkinliğini gösteren markerların azaldığının belirlenmesi gibi bulgularla da desteklenmiştir. Tiroid dışı hastalıklarda tiroid hormonlarının yararlılığını araştıran bazı çalışmalar vardır. T4 hormonu ile yapılan çalışmanın olumsuzluğuna karşın T3 ile yararsızın yanında belirgin yanıt alınanlar da bulunmaktadır. Ayrıca, kardiyotorasik ya da koroner cerrahisi uygulanan hastalarda T3 hormonunun yararını bildiren yayınlara da rastlanmaktadır (GombergMaitland 1998). T3 ile alınan bu olumlu yanıtların farmakolojik mi, yoksa fizyolojik mi olduğu ise bilinmemektedir. Yine de T3 ile bu idameye yakın dozlarda sağlanan başarılar cesaret verici bulunmaktadır (Chopra 1997). 65 MATERYAL VE METOD Bu çalışmaya Şubat 2007 –Haziran 2007 tarihleri arasında Vakıf Gureba Eğitim veAraştırma Hastanesi Koroner Yoğun Bakım Ünitemize yatmış ve Q dalgalı veya Q dalgasız Akut Miyokard Enfarktüsü tanısı almış 149 hasta alındı. Olguların 52’si kadın (%34.9) ve 97’si erkek (%65.1) iken ortalama yaş 62.35±12.32’dir. Belirtilen tarihler arasında çalışma kriterlerini taşıyan 149 hasta çalışmaya alındı. Çalışmamızın amacı bu hastalarda tiroid hormon düzeylerine bakarak Ötiroid Hasta Sendromu sıklığını ve tiroid hormonlarının hangi paternde değiştiğini tespit etmeye çalıştık. Akut Miyokard Enfarktüsü tanısı için kabul edilen kriterler:30 dakikadan uzun süren tipik göğüs ağrısı,serum enzim düzeylerinin (total CK,CK-MB,AST,LDH) anlamlı yükselmeleri ve patolojik Q dalgası içeren tipik EKG değişiklikleri ve/veya takip eden en az iki derivasyonda lokalize ST-T dalga değişiklikleri .Bu kriterlerinden ikisinin varlığında AMI tanısı konuldu.Çalışmaya tipik gögüs ağrısı ve EKG değişikliği olup enzim yükselmesi olmayan hastalar dahil edilmedi. Çalışmaya alınan tüm kişiler KYBÜ’ne kabul edildikleri andan itibaren ilk gün her altı saatte bir serum enzimleri ve standart 12 derivasyonlu EKG’leri kayıt edildi,takip eden günlerde bu değerler günlük olarak yapıldı. Kardiak enzimler için kan örnekleri antekübital ven yoluyla kuru tüplere alındı ve hastanemiz Biyokimya laboratuarında Abbott Architect otoanalizör C 8000 cihazıyla çalışıldı. Akut miyokard enfarktüsü tanısı alınmış hastaların tiroid hormonları için kan örnekleri ilk 24 saat içinde alındı. Bu hormonlar:TSH,FT3(serbest T3),TT3(total),FT4(serbest T4) ve TT4(total) olup Biyokimya laboratuarında İmmulite 2000 immunolojik analizör cihazıyla kemiluminesans yöntemiyle çalışıldı. İstatistiksel analiz: SPSS for Windows 15.0 version hazır paket programı yardımıyla yapıldı. 66 BULGULAR Çalışmaya Akut miyokard enfarktüsü geçiren 149 hasta alındı. Hastaların 97’si(%65.1) erkek,52’si(%34.9) kadın hasta idi. Hastaların yaş ortalaması:62.35 ±12.31olup (min:32max:87),erkeklerin 60.29±12.87 ,kadın hastaların ise 66.19±10.27 bulundu. cins Valid Frequency 97 52 149 erkek kadin Total Percent Valid Percent 65,1 65,1 34,9 34,9 100,0 100,0 Cumulative Percent 65,1 100,0 Tablo1. AMI geçiren hastaların %34.9’u kadın ,%65.1’ erkek hastalardan oluşmaktaydı. TSH Frequency Valid Percent Valid Percent Cumulative Percent normal 124 83,2 83,2 83,2 dusuk 15 10,1 10,1 93,3 100,0 yuksek Total 10 6,7 6,7 149 100,0 100,0 Tablo2.AMI’lı 149 hastadan 124’ünün (%83)TSH ‘ı normal iken ,15 hastada düşük(%10),10 hastada (%7) ise ;yüksek bulunmuştur. 100 84 80 60 40 40 cinsiyet 20 sayi erkek 8 0 normal 7 5 dusuk 5 yuksek TSH 67 kadin CINS erkek FT3 normal dusuk yuksek Total Count Expected Count % within FT3 % within CINS % of Total Count Expected Count % within FT3 % within CINS % of Total Count Expected Count % within FT3 % within CINS % of Total Count Expected Count % within FT3 % within CINS % of Total 81 78,8 66,9% 83,5% 54,4% 15 16,9 57,7% 15,5% 10,1% 1 1,3 50,0% 1,0% ,7% 97 97,0 65,1% 100,0% 65,1% Total kadin 40 42,2 33,1% 76,9% 26,8% 11 9,1 42,3% 21,2% 7,4% 1 ,7 50,0% 1,9% ,7% 52 52,0 34,9% 100,0% 34,9% erkek 121 121,0 100,0% 81,2% 81,2% 26 26,0 100,0% 17,4% 17,4% 2 2,0 100,0% 1,3% 1,3% 149 149,0 100,0% 100,0% 100,0% 100 80 81 60 40 40 cinsiyet Count 20 15 erkek 11 0 kadin normal dusuk yuksek fT3 Tablo 3. Hastaların 26 (%17.4)’sında serbest T3 düşük tespit edildi.bu hastaların 15’i(%10.1) erkek iken 11’i(%7.4) kadın hastalardan oluşuyordu. 68 Total CINS erkek FT4 normal Count Expected Count dusuk 143 93,1 49,9 143,0 65,7% 34,3% 100,0% % within CINS 96,9% 94,2% 96,0% % of Total 63,1% 32,9% 96,0% 0 2 2 1,3 ,7 2,0 % within FT4 ,0% 100,0% 100,0% % within CINS ,0% 3,8% 1,3% % of Total ,0% 1,3% 1,3% 3 1 4 2,6 1,4 4,0 Expected Count Count Expected Count % within FT4 Total erkek 49 % within FT4 Count yuksek kadin 94 75,0% 25,0% 100,0% % within CINS 3,1% 1,9% 2,7% % of Total 2,0% ,7% 2,7% 97 52 149 97,0 52,0 149,0 Count Expected Count % within FT4 % within CINS % of Total 65,1% 34,9% 100,0% 100,0% 100,0% 100,0% 65,1% 34,9% 100,0% 100 94 80 60 49 40 cinsiyet Count 20 erkek kadin 0 normal dusuk yuksek FT41 Tablo 4. AMI geçiren hastaların 143’ünde(%96) FT4 normal idi,sadece 2 kişide düşük(%1.3) tespit edilmiştir. 69 Total CINS erkek TT3 normal Count Expected Count % within TT3 % within CINS % of Total Count Expected Count % within TT3 % within CINS % of Total Count Expected Count % within TT3 % within CINS % of Total Count Expected Count % within TT3 % within CINS % of Total dusuk yuksek Total 69 59,9 75,0% 71,1% 46,3% 26 35,2 48,1% 26,8% 17,4% 2 2,0 66,7% 2,1% 1,3% 97 97,0 65,1% 100,0% 65,1% kadin 23 32,1 25,0% 44,2% 15,4% 28 18,8 51,9% 53,8% 18,8% 1 1,0 33,3% 1,9% ,7% 52 52,0 34,9% 100,0% 34,9% erkek 92 92,0 100,0% 61,7% 61,7% 54 54,0 100,0% 36,2% 36,2% 3 3,0 100,0% 2,0% 2,0% 149 149,0 100,0% 100,0% 100,0% 80 69 60 40 28 26 Count 20 23 cinsiyet erkek 0 kadin normal dusuk yuksek TT3 Tablo 5.Hastaların 28’i(%53.8) kadın,26’sı(%26.8) erkek toplam 54(%36.2) hastada TT3 düşük bulunmuştur. 70 Total CINS erkek TT4 normal Count 140 91,1 48,9 140,0 % within TT4 67,1% 32,9% 100,0% % within CINS 96,9% 88,5% 94,0% % of Total 63,1% 30,9% 94,0% 0 2 2 1,3 ,7 2,0 % within TT4 ,0% 100,0% 100,0% % within CINS ,0% 3,8% 1,3% % of Total ,0% 1,3% 1,3% 3 4 7 4,6 2,4 7,0 % within TT4 42,9% 57,1% 100,0% % within CINS 3,1% 7,7% 4,7% % of Total 2,0% 2,7% 4,7% 97 52 149 97,0 52,0 149,0 Count Expected Count yuksek Count Expected Count Total erkek 46 Expected Count dusuk kadin 94 Count Expected Count % within TT4 65,1% 34,9% 100,0% % within CINS 100,0% 100,0% 100,0% 65,1% 34,9% 100,0% % of Total 100 94 80 60 46 40 cinsiyet Count 20 erkek 0 kadin normal dusuk yuksek TT4 Tablo 6.Hastaların 140 ‘nda(%94) TT4 normal ,7 hastada(%4.7) yüksek bulundu. 71 FT3 ve/veya TT3 Frequency Valid normal dusuk yuksek Total 88 57 4 149 Percent Valid Percent 59,1 38,3 2,7 100,0 59,1 38,3 2,7 100,0 Cumulative Percent 59,1 97,3 100,0 70 65 60 50 40 30 29 20 28 23 cinsiyet 10 olgu erkek 3 0 normal dusuk kadin yuksek Tablo7. DÜŞÜK T3 SENDROMU:toplam 57 hastada FT3 ve/veya TT3 düşüklüğü(%38,3) oranında tespit edildi. 72 T3T4 D Frequency normal dusuk yuksek Total 145 2 2 149 Percent Valid Percent 97,3 1,3 1,3 100,0 97,3 1,3 1,3 100,0 Cumulative Percent 97,3 98,7 100,0 120 100 97 80 60 40 yüzde 20 0 normal dusuk yuksek Tablo 8. DÜŞÜK T3,T4 SENDROMU;toplam 2 hastada (%1.3) bulundu. 73 TARTIŞMA Çalışmamızda Akut miyokard enfarktüsü geçiren 149 hastada Ötiroid Hasta Sendromu sıklığını ve tiroid hormonlarının ağırlıklı olarak hangi paternde olduğunu tespit etmeye çalıştık. Bilindiği Ötiroid Hasta Sendromu ;tiroid bezinde primer bir hastalık,patolojik durum olmadığı halde tiroid hormonlarının bir ya da birkaçında sapma görülmesi durumudur. Bazı yazarlar bu duruma ÖHS yerine ‘tiroid dışı hastalıklar sendromu ’şeklinde ifade etmeyi uygun görmekteler. Bu sendromun değişik varyantları mevcut olup en sık görülen tipi Düşük T3 sendromu ‘durDiğer tipler:düşük T3-T4 sendromu,Yüksek T4 sendromu…Yakın zamanda 144 hasta üzerinde yapılan bir çalışmada ÖHS oranı %23 olarak bulunmuştur.(Di Napoli 1994) .Normal ya da normale yakın serum TSH ve total ve serbest T4 düzeylerinin eşlik ettiği,düşük total ve serbest T3 durumu,organizmanın tiroid dışı hastalıklara verdiği en sık tiroid yanıtıdır. Serbest T3 düzeylerindeki düşüşün derecesi değişiklik göstermekle beraber,genelde hastalığın ağırlığı ile ilgilidir. Ortalama düzeyi genelde normal değerin %40’ı dolaylarında olur. 1981 yılında Wiersinga ve arkadaşlarının yaptığı bir çalışmada Akut miyokard enfarktüsü geçiren 34 hastanın ciddi anlamda tiroid hormon ölçümleri iki haftalık periyodla araştırılmış;34 hastanın 24 ünde plazma RT3 değerinde artma veTT3 de azalma komplike akut miyokard enfarktüsü olanlarda ;komplike olmayanlara göre anlamlı derecede belirgin olduğu görülmüş .Ayrıca geçici bir TSH ve TT4 yüksekliği tespit edilmiş.(203) 1997 yılında Jug ve arkadaşları 31 AMI lü hastada yaptıkları çalışmada hospitalizasyonun 1 ve 10.gününde TT3.FT3,FT4,TT4,TSH,TBG ölçümü yapmışlar. 1günde TT3,FT3 ve TBG değerleri belirgin olarak düşük,, T4 ve TSH belirgin olarak yüksek bulunmuştur.(kontrol grubuna göre) .Benzer bulgular10.gün aynı şekilde kaydedildi.TSH AMI grubunda daha düşüktü ama kontrol grubuna göre belirgin bir farklılık göstermiyordu.(204) 2002de Pawlov ve arkadaşları ; 95 akut myokard enfarktüslü ve 19 USAP’ lı olmak üzere toplam 114 hastada(Bu hastaların 72’si erkek,42’si kadın idi.) ötiroid hasta sendromu sıklığını araştırmışlar.Hastalığın ilk 5 gününde belirgin TT3 düşüklüğü ve RT3 yüksekliği tüm hastalarda tespit edilirken; FT3 ve FT4 de değişiklik olmamıştır.Komplike enfarktüslülerde RT3 yüksekliği ve TT3 düşüklüğü komplike olmayanlara göre daha belirgin bulunmuş.TSH,T4 ve TBG ve Albümin sadece komplike enfarktüslülerde belirgin olarak düşükmüş.(205) 2006 da Pimentel ve arkadaşlarının Dos servidores do Estado, Rio De Jenario hastanesi koroner yoğun bakım ünitesinde 70 akut koroner sendromlu(bu hastalar ST elevasyonu olmayan AMI ve USAP bir grup; ST elevasyonu olan AMI ise ikinci grup olmak üzere iki grup halinde araştırılmış) hasta üzerinde yaptığı bir çalışmada 70 hastanın 13’ünde yani %18.6 oranında Ötiroid hasta sendromu tespit edilmiş.(TT3 ve/veyaFT3 değerlerinde düşme ,RT3 de yükselme ve bunlara ilaveten normal TSH,FT4 değerleriyle karekterize) .Hastalardan hormonlar için alınan kan örnekleri 1,4 ve 7.günlerde bakılarak değerlendirilmiş.. ST elevasyonu olan grupta daha yüksek RT3,daha düşük TT3 ve FT3 74 değerleri bulunmuş.Sonuç olarak ACS de ÖHS tanınması daha kötü prognoz açısından önemlidir.(206) Bizlerde 97’si erkek 52’si kadın 149 Akut miyokard enfarktüsü geçiren hastada yaptığımız ötiroid hasta sendromu sıklığını çeşitli varyasyonlarda tespit ettik:57 hastada FT3 ve/veya TT3 düşük, TT4 normal yani DÜŞÜK T3 SENDROMUNU %38.3 oranında,2 hastada hem T3 ‘ler hem de T4’ler düşük bulundu.(düşük T3,T4 sendromu %1.34) 7 hastada hem T3,T4 hem TSH düşük yani Düşük TSH,T3,T4 sendromu %4.69 bulundu.3 hastada ise T4 yüksek idi.yani Yüksek T4 sendromu %2.01 tespit edildi. .Psödö santral hipotiroidi paterni yani TSH normal veya düşük,FT3 ve FT4 düşük olan hasta tespit edilmedi Rutin uygulamada hastaneye yatan her hastanın tiroid fonksiyonları hakkında FT3,FT4,TSH ‘a bakarak karar verdiğimiz için;adı geçen hormonlardaki değişiklik paternini ve sıklığını göz önüne almak daha faydalı olacağı kanaatini taşımaktayız. Sadece FT3,FT4’e bakarak Ötiroid Hasta Sendromu ararsak daha az sıklıkta buluruz;çünkü daha ağır Akut Myokard İnfarktüsü kliniği olanlarda ya da sistemik hastalığı olanlarda bu hormonların düşüklüğü ortaya çıkmaktadır.Daha hafif vakalarda sıklıkla TT3 düşüklüğü olmaktadır. 75 ÖZET Ateroskleroz ve onun komplikasyonu olan akut miyokard enfarktüsü tüm dünyada mortalite ve morbiditenin en başta gelen nedenleri arasında ilk sıralarda yer alıp ve tüm korunma çabalarına rağmen sıklığında artış olan ciddi bir sağlık sorunu haline gelmiştir. Çalışmamızda akut miyokard enfarktüsü geçiren hastalarda ötiroid hasta sendrom sıklığını ve tiroid hormonlarının değişme paternini tespit etmeyi amaçladık.97 erkek,52 kadın toplam 149 akut miyokard enfarktüsü geçiren hasta çalışmaya alındı.tiroid hormonları ilk 24 saat içinde değerlendirildi. Çalışma sonunda diğer sistemik hastalıklarda görülme oranı yaklaşık %40 olan ötiroid hasta sendrom sıklığını bizlerde ötiroid hasta sendromunun baskın formu olan düşük T3 sendromu olarak %38.3 oranında tespit ettik. Genel olarak FT3 %17.4,FT4 %1.3,TT3 %36.2,TT4 %4.7 oranında düşük bulundu. FT3 ve /veya TT3 düşüklüğü %38.3,T3 ve T4 düşüklüğünüde %1.3 tespit edilmiştir. Akut Miyokard İnfarktüsü ‘nde Ötiroid Hasta Sendromu kötü prognozla ilişkilendirilmiştir.Bu yüzden Ötiroid Hasta Sendromonun değişik paternlerini tanımalı ve bu hastalarda daha dikkatli olunmalıdır. 76 KAYNAKLAR 1. Wong ND,Wilson PW, kannel WB. Serum cholesterol as a prognostic factor after miyocardial infarction: The Framingham Study. Ann Intern Med 1991;115:687693. 2. Charles H, Hennekens, MD, DrPH. Increasing burden of cardiovascular disease. Current knowledge and future firections for research on rise factors. Circulation.1998;97:1095-1102 3. McGovern PG, Pankow JS, Shahar E, et al. Recent trends in acute coronary heart disease-mortality, morbidity, medical care and risk factors. The Minnesota Heart Survey Investigators. N Engl J Med 1996;334:884-890. 4. American Heart Association: Heart and Stroke Facts: 1995 Statistical Suppl. Dallas, American Heart Association,1994. 5. Anderson KM, Wilson PWF, Odell PM, Kannel WB. An updated coronary risk profile: A statement for health professionals. Circulation 1991:83;56. 6. Türkiye Kalp Raporu 2000, Türk Kardiyoloji Derneği, Yenilik Basımevi, İstanbul 2000; s.11-25. 7. TEKHARF; Oniki Yıllık İzleme Deneyimine Göre Türk Erişkinlerinde Kalp Sağlığı. Prof. Dr. Atlan Onat, Prof. Dr. Vedat Sansoy, Prof Dr. İnan Soydan, Prof. Dr. Lale Tokgözoğlu, Prof. Dr. Kamil Adalet. Argos İletişim Hizmetleri Reklamcılık ve Ticaret Anonim Şirketi. Temmuz 2003, İstanbul. 8. Koroner Kalp Hastalığı Primer ve Sekonder Korunma 2001. Prof. Dr. Hakan Kültürsay. Argos İletişim Hizmetleri Reklamcılık ve Ticaret Anonim Şirketi. Sayfa 101-190. 9. Reddy KS, Yusuf S. Emerging epidemic of cardiovascular disease in developing countries. Circulation 1998;97:596-601. 10. Murray CJ, Lopez AD. Global mortality, disability, and the contribution of risk factors: Global Burden of Disease Study. Lancet 1997;349:1436-42. 11. Göran K Hansson & Jan Nilsson. Michael H Crawford, John P DiMarco. Cardiology. 2003.1.1. 12. Tamminen M, Mottino G, Qiao JH, et al. Ultrastructure of early lipid accumulation in Apo E, deficient mice. Arterioscler Thromb Vasc Biol 1999;19:847853. 13. Williams KJ, Tabas I. The responce-to-retention hypothesis of atherogenesis reinforced. Curr Opin Lipidol 1998;9:471-474. 77 14. Thompson Gr : A Handbook of hyperlipidaemia. Current Science Ltd. London,1990. 15. Dursun A,N. Koroner Ateroskleroz Patolojisi. Michael J. Davies. Hurst’s The Heart Türkçe 1.baskı. İstanbul, AND Yayıncılık;2002.p.1065-1066. 16. Ross R.Atherosclerosis –an inflammatory disease. 1999;340:115-26. N Engl J Med 17. Ross R, Glomset, JA. The pathogenesis of atherosclerosis. N Engl J Med 1976;295;420-5. 18. Steinberg D,Partasarathy S, Carew TE, Khoo JC, Witztum JL. Beyond cholesterol Modifications of lowdensity lipoprotein that increase its atherogenicity. N Engl J Med 1989;320:915-25. 19. Schwenke DC, Carew TE. Initiation of atherosclerotic lesions in cholesterolfed rabbits.II.Selective retention of LDL vs. selective increases in LDL permeability in susceptile sites of arteries. Arteriosclerosis 1989;9:908-18. 20. Saikku P, Leinonen, M, Mattila, K, et al. Serological evidence of an association of an novel Chlamydia, TWAR, with chronic coronary heart disease and acute myocardial infarction. Lancet 1988;2:983-6. 21. Saikku P.Chlamydia pneumoniae and atherosclerosis an uptade. Scand J Infect Dis supply.1997;104;53-6. 22. Harrison’s Principles of Internal Medicine, Braunwald, Fauci, Kasper, Hauser, Longo, Jameson. 15th edition. s.1377-87 23. Swartz SM , Heimark RL, Majesky MW. Developmental mechanisms underlying pathology of arteries. Physiol Rev 1990;70:1177-209. 24. Palmer RM, Ferrige AG, Moncada S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature 1987;327:524-526. 25. Reidy MA, Fingerle J, Lindner V. Factors controlling the development of arterial lesions after injury. Circulation 1992;86:III43-6. 26. Stary HC, Chandler A, Dinsmore R, et al. A definition of advanted types of atherosclerosis lesions and histological classification of atherosclerosis. A report from the Committee on Vascular Lesions of the Council on Arteriosclerosis, American Heart Association. Circulation 1995;92:1355-13. 27. Michael H Crawford, John P DiMarco, Crawford Cardiology 1.Baskı 1.Cilt 2003 s.1.7 28. Poole J, Florey HW. Changes in the endothelium of the aorta end the behaviour of macrophages in experimental atheroma of rabbits. J Pathol Bacteriol 1958;75:24552. 78 29. Ross R, Glomset, JA, Kariya, B, Harker, LA. A platelet dependent serum factor that stimulates the proliferation of arterial smooth muscle cells in vitro. 30. Benditt EP, Benditt JM. Evidence for a monoclonal origin of human atheosclerotic plaques. Proc Natl Acad Sci USA 1973;70:1753-6. 31. Brown MS, Goldstein JL. A Receptor-mediated pathway for cholesterol homeostasis. Science 1986;232:34-47. 32. Breslow JL. Mouse models of atherosclerosis. Science 1996:272:685-8. 33. Camejo G, Hurt-Camejo E, Olsson U, Bondjers G. Proteogylcans and lipoproteins in atherosclerrosis. Curr Opin Lipidol 1993;4:385-391. 34. Steinberg D. Low density lipoprrotein oxidation and its pathobiological significance. J Biol Chem 1997;272:20963-6. 35. Navab M, Berliner JA, Watson AD, et al. The Yin and Yang of oxidation in the development of the fatty streak. A review based on the 1994 George Lyman Duff Memorial Lecture. Arteriosclerosis thrombosis Vasc Biol 1996;16:831-42. 36. Cybulsky MI, Gimbrone MA. Endothelial expression of a mononuclear leukocyte adhesion molecule during atherosclerosis. Science 1991;251:788-91. 37. Quinn MT, Parthasarathy, s, Steinberg, D. Endothelial cell-derived chemotactic activity for mouse peritoneal macrophages and the effects of modified forms of low density lipoprotein. Proc Natl Acad Sci USA 1985;82:5949-53. 38. Seifert PS, Hugo F, Hansson GK, Bhakdi S. professional complement activation in experimental atherosclerosis. Terminal C5b-9 complement deposition coinsides with cholesterol accumulation in the aortic intima of hypercholesterolemic rabbits. Lab Invest 1989;60:747-54. 39. Xu Q, Wick, G. The role of heat shock proteins in protection pathophysiology of the arterial wall. Molec Med Today 1996:372-9. and 40. Smith JD, Trogan E, Ginsberg M, Grigaux C, Tian J, Miyata M. Decreased atherosclerosis in mice deficient in both macrophage colony-stimulating factor (op) and apolipoprotein E. Proc Natl Acad Sci USA 1995;92:8264-8. 41. Brown MS, Goldstein JL. Lipoprotein metabolism in the macrophage: implifications for cholesterol deposition in atherosclerosis. Annu Rev Biochem 1983;52:223-61. 42. Krieger M, Acton S, Ashkenas J, Pearson A, Penman M, Resnick D. Molecular flypaper, host defense, and atherosclerosis. J Biol Chem 1993;268:4569-72. 43. Geng YJ, Hansson GK. Interferon-g inhibits scavenger receptor expressionand foam cell formation in human monocyte-derived macrophages. J Clin 79 44. Tontonoz P, Nagy, L, Alvarez, JGA, Thomazy, VA, Evans, RM. PPARg promotes monocyte/macrophage differentiation and uptake of oxidized LDL. Cell 1999;93:241-52. 45. Stemme S, Holm J, Hansson GK. T lymphocytes in human atherosclerotic plaques are memory cells expressing CD45RO and the integrin VLA-1. Arterioscl Thromb 1992;12:206-11. 46. Hansson GK. Cell-mediated immunity in atherosclerosis. Curr Opin Lipidol 1997;8:301-11. 47. Stemme S, Faber B, Holm J, Wiklund O, Witztum JL, Hansson GK. T lymphocytes from human atherosclerotik plaques recognize oxidized LDL. Proc Natl Acad Sci USA 1995;92:3893-7. 48. Frostegard J, Ulfgren, A-K, Nyberg, P, et al. Cytokine expression in advanced human atherosclerotic plaques: dominance of proinflammatory (Th1) and macrophage- stimulating cytokines. Atherosclerosis 1997;145:33-43. 49. Libby P. Vascular cells produce and respond to cytokines. In: hansson GK, Libby P, eds. Immune functions of the wessel wall. Amsterdam: Harwood, 1996:4564. 50. Tellides G, Tereb DA, Kirkiles-Smith NC, et al. Interferon-gamma elicits arteriosclerosis in the absence of leukocytes. Nature 2000;403:207-11. 51. Uyemura K, Demer L, Castle SC, et al. Crossegulatory roles of interleukin (IL)-12 and IL-10 in atherosclerosis. J Clin Invest 1996;97:2130-8. 52. Mach F, Schönbeck U, Sukhova GK, Atkinson E, Libby P. Reduction of atherosclerosis in mice by inhibition of CD40 signaling. Nature 1998;394:200-3. 53. Palinski W, Miller E, Witztum JL. Immunization of low density lipoprotein (LDL) receptor-deficient rabbits with homologous malondialdehyde-modified LDL reduces atherogenesis. Proc Natl Acad Sci USA 1995;92:821-5. 54. Gimbrone MA, Nagel, .T, Topper, JN. Biomechanical activation: an emerging paradigm in endothelial adhesion biology, J Clin Invest 1997;100:S61-5. 55. Davies MJ, Thomas A. Thrombosis and acute coronary-artery lesions in sudden cardiac ischemic death. N Engl J Med 1984;310:1137-40. 56. Van Der Wal AC, Becker AE, van der Loos CM, Das PK. Site of intimal rupture or erosion of thrombosed coronary atherosclerotic plaques is characterized by an inflammatory process irrespective of the dominant plaque morphology. Circulation 1994;89:36-44. 80 57. Kovanen PT, Kaartinen M, Paavonen T. Infiltrates of activated mast cells at the site of coronary atheromatous erosion or rupture in myocardial infarction. Circulation 1995;92:1084-8. 58. Maseri A. Inflammation, atherosclerosis, and ischemic events-exploring the hidden side of the moon .N Engl J Med 1997;336:1014-6. 59. Libby P.Moleculer bases of the acute coronary syndromes.circulation 1995;91:2844-50. 60. Carmeliet P, Ng YS, Nuyens D, et al. Impaired myocardial angiogenesis and ischemic cardiomyopathy in mice lacking the vascular endothelial growth factor isoforms VEGF164 and VEGF188. Nature Med 1999;5. 61. Caligiuri G, Lévy, B, Pernow, J, Thorén, P, Hansson, GK. Myocardial infarction mediated by endothelin receptor signaling in hypercholesterolemic mice. Proc Natl Acad Sci USA 1999;96:6920-4. 62. Gottlieb SO. Asymptomatic or silent myocardial ischemia in angina pectoris: pathophysiology and clinical implications. Cardiol Clin 1991;9;49-61. 63. Shah PK. Pathophysiology of acute coronary syndromes. Am J Cardiol 1997;79:790-2. 64. Schaper J. Effects of multiple ischemic events of human myocardium: an ultrastructural study. Eur Heart J 1988;9:141-9. 65. Rossen JD, Oskarsson H, Minor RL, et al. Effect of adenosine antagonism on metabolically mediated coronary vazodilation in humans. J Am J Cardiol 1994;23:1421-6. 66. Yamabe H, Okumura K, Ishizaka H, et al. Role of endothelium derived nitric oxide in myocardial reactive hyperemia. Am J Physiol 1992;263:H8-14. 67. Steenbergen C, Hill ML, Jennings RB. Volume regulation and plasma membrane injury in aerobic, and ischemic myocardium in vitro. Circ Res 1985;57:864-75. 68. Yamanishi K, Fujita M, Sasayama S, et al. Functional characteristic of nonischemic regions during pacing induced myocardial ischemia in angina pectoris. Am J Cardiol 1988;61:1214-8. 69. Reimer KA, Jennings RB, The ‘Wave-front’ phenomenon of myocardial ischemic cell death: II. Transmural progression of necrosis within the framework of ischemic bed size (myocardium at risk) and collateral flow. Lab Invest 1979;40:6334. 70. Ganz W, Watanabe I, Kanamasa K, et al. Does reperfusion extend necrosis? A study in a single territory of myocardial ischemia-half reperfused and half not reperfused. Circulation 1990;82:1020-33. 81 71. Kloner RA, Bolli R, Marban E, Reinlib L, Braunwald E. Medical and Cellular implications of stunning, hibernation, and preconditioning. Circulation 1998;97:184867. 72. Yellon DM, Baxter GF, Garcia-Dorado D, Heusch G, Sumeray MS. Ischemic preconditioning: present position and future directions (review). Cardiovasc Res 1998;37:21-33. 73. Gross G, Auchampach JA. Blockade of ATP sensitive potassium channels prevents myocardial preconditioning in dogs. Circ Res 1995;70:222. 74. Chen W, Gabel S, Steenbergen S, et al. A redox based mechanism of cardiac protection induced by ischemic preconditioning in perfused rat heart. Circ Res 1995;77:424-9. 75. Anzai T, Yoshikawa T, Asakura Y, et al. Preinfarction angina as a major pedictor of left venricular function and long term prognosis after a first Q-wave myocardial infarction. J Am Coll Cardiol 1995;26:319-27. 76. Gould KL, Lipscomb K, Hamilton GW. Physiologic basis for assessing critical coronary stenosis: instantaneous flow response and regional distribution during coronary hyperemia as a measeure of coronary flow reserve. Am J Cardiol 1974;33:87-94. 77. Gould KL. Quantification of coronary artery stenosis in vivo. Circ Res 1985;57:341-53. 78. Freudenberg H, Lichtlen PR. The normal Wall segment in coronary stenosis: a post mortem study. Z Kardiol 1981;70:863-9. 79. Schwartz JS, Bache RJ. Effect of arteriolar dilation on coronary artery diameter distal to coronary stenosis. Am J Physiol 1985;249:H981-8. 80. Furchgott RF, Zawadzki JV. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle cells by acetylcholine. Nature 1980;288:373-6. 81. Harrison Harrison DG. Endothelial control of vasomotion and nitric oxide production. Cardiol Clin 1996;14:1-15. 82. Lerman A, Burnett JC Jr. Intact and altered endothelium in regulation of vasomotion. 83. Yeung Al, Vekshtein VI, Krantz DS, et al. The effect of atherosclerosis on the vasomotor response of coronary arteries to mental stress. N Engl J Med 1991;325:1551-6. 84. Palmer RMJ, Ferrige AG, Moncada S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature 1987;327:524-6. 82 85. Yanagisawa M, Kurihara H, Kimura S,et al.A novel potent vasoconstriktor peptide produced by vascular endothelial cells.Nature 1988;332:411-5. 86. Treasure CB, Klein JL, Weintraub WS, et al. Beneficial effects of cholesterollowering therapy on the coronary endothelium in patients with coronary artery disease. N Engl J Med 1995;332:491-7. 87. Anderson TJ, Meredith IT, Yeung AC, et al. The effect of cholesterol-lowering and antioxidant therapy on endothelium dependent coronary vasomotion. N Engl J Med 1995;332:488-93. 88. Falk E, Shah PK, Fuster V.Coronary plaque disruption. Circulation 1995;92:657-71. 89. Shah PK. Role of inflammation and matalloproteinases in plaque disruption and thrombosis. Vasc Med. 1998;3:199-206. 90. Burke AP, Farb A, Malcom GT, Liang Y-H, Smialek J, Virmani R. Coronary risk factors and plaque morphology in men with coronary disease who died suddenly. N Engl J Med 1997;336:1276-82. 91. Kanazawa T. Coronary collateral Circulation. Jpn Circ J 1994;58:151-65. 92. Schaper W. New pradigms for collateral vessel growth. Basic Res Cardiol 1993;88:193-8. 93. Isner JM, Walsh J K, Symes J, et al. Arterial gene therapy for therapeutic angiogenesis in patients with peripheral artery disease. Circulation 1995;91:2687-92. 94. Di Carli MF, Maddahi J, Rokhsar S, et al. Long-term survival of patients with coronary artery disease and left ventricular dysfunction: implications for the role of myocardial viability assessment in management decisions. J Thorac Cardiovasc Surg 1998;116:997-1004. 95. Stillman AE, Wilke N, Jerosch-Herold M. Myocardial viability. Radiol Clin North Am 1999;37:361-78. 96. İç Hastalıkları. İliçin, Biberoğlu, Süleymanlar, Ünal. Güneş Kitabevi, 2. baskı, 2003. Sayfa, 449-474. 97. Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, EvaIuation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) Final Report. National Cholesterol Education Program National Heart, Lung, and Blood Institute. National Institutes of Health, NIH Publication No.025215 September 2002. 98. Türk Kardiyoloji Derneği Koroner Kalp Hastalığı Korunma ve Tedavi Kılavuzu 2002. 83 99. Hurt's The Heart. Valentin Fuster, R. Wayne Alexander, Robert O'Rourke. 10. Baskısının Türkçe çevirisi. And Danışmanlık Eğitim Yayıncılık ve Organizasyon Ltd. Şti. 1. Basım. 2002 Sayfa, 1065-1109. 100. Navab M, Berliner JA, Watson AD, et al. The Yin and Yang of oxidation in the development of the fatty streak: A review based on the 1994 George Lyman Duff Memorial Lecture. Arterioscler Thromb Vas Biol 1996;16:831. 101. Flavahan NA. Atherosclerosis or lipoprotein induced endothelial dysfunction: Potential mechanisms underlying reduction in EDRF/ nitric oxide activity. Circulation 1992; 85:1927. 102. Gordon DJ. Cholesterol lowering and total mortality. IN: Rifkind BM, ed. Lowering Cholesterol in High Risk Individuals and Populations. New York: Mareel Dekker; 1995:33. 103. Sacks FM, Pfeffer MA, Moye LA, et al. The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels. Cholesterol and Recurrent Events Trial Investigators. N Engl J Med 1996;335:1001. 104. Lipid Study Group. Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels. The Long-Term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group. N Engl ] Med 1998;339:1349. 105. Scandinavian Simvastatin Survival Study. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: The Scandinavian Simvastatin Survival Study. Lancet 1994; 344:1383. 106. Stepherd J, Cobbe SM, Ford I, et al. Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. West of Scotland Coronary Prevention Study Group. N Engl J Med 1995; 333: 1301. 107. Downs JR, Clearfield M, Weis S, et ai. Primary prevention of acute coronary events with lovastatin in men and women with avarege cholesterol levels: Results of AFCAPS/TexCAPS. Air Force/Texas Coronary Atherosclerosis Prevention Study. JAMA 1998; 279:1615. 108. Cater NB, Grundy SM. Lowering serum cholesterol with plant sterols and stanols:Historical Perspectives. In: Nguyen TT,ed. Postgraduate Medicine Special Report: New Developments in Dietary Management of High Cholesterol. New York: McGrawHill; 1998:6. 109. Lee TH, Cleeman JI, Grundy SM, et al. Clinical goals and performance measures for cholesterol management in secondary prevention of coronary heart disease. JAMA 2000; 283:294 84 110. Grundy SM, Balady GJ, Criqui M, et aL. When to start cholesterol lowering theraphy in patients with coronary heart disease: A statements for healthcare professionals from the American Heart Association Task Force on Risk Reduction. Circulation 1997; 95: 1683. 111. Gordon DJ, Probsfelt JL, Garrison JW, et ai. High density lipoprotein cholesterol and cardiovascular disease: Four perspective American Studies. Circulation 1989; 79:8-15 112. Genest J Jr, McNamara JR, Urdovas JM, et al. Lipoprotein cholesterol, apolipoprotein AL and B and lipoprotein (a) abnormalities in men with premature coronary artery disease. J Am Coll Cardiol 1992; 19:792-802. 113. Assman G, Schulte H. Relation of high-density lipoprotein cholesterol and triglyserides to incidence of atherosclerosis and coronary artery disease. (the PROCAM experience). Am J Cardiol 1992; 70:733-737. 114. ACC/AHA Guideline Update for the Management of Patients With Chronic Stable Angina Summary Article. A Report of the American Collage of Cardiology/ American Heart Association Task Force on Practice Guidelines. (Committee on the Management of Patients With Chronic Stable Angina) Circulation 2003;107:149. 115. Criqui MB, Hejss G, Chon K, et ai. Plasma triglyseride lewel and mortality from coronary heart disease. NEJM 1993; 328: 1220-1225. 116. Reaven GM. Insulin resistance and compensatory hyperinsulinemia: role in hypertension, dyslipidemia, and coronary heart disease. Am Heart J. 1991;121:1283-1288. 117. Assmann G, Schulte H, Funke H, et al. The emergence of triglyserides as a significiant independent risk factor in coronary artery disease. Eur Heart J. 1998;19 (suppl M): M8M14. 118. Austin MA, Hokanson J E, Edwards KL. Hypertriglyseridemia as a cardiovascular risk factor. Am J CardioI. 1998; 81: 7B-12B. 119. Grundy SM. Hypertriglyseridemia, atherogenic dyslipidemia, and the metabolic syndrome. Am J Cardiol 1998; 81:18B. 120. Hokanson JE, Austin MA. Plasma triglyseride level as a risk factor for cardiovascular disease independent of high-density lipoprotein cholesterol level: A meta-analysis of population-based prospective studies. J Cardiovasc Risk 1996; 3 :213. 121. Miller NE. High-density lipoprotein: A major risk factor for coronary atherosc1erosis. Baillieres Clin Endocrinol Metab 1987; 1:603. 85 122. Vega GL, Grundy SM. Hypoalphalipoproteinemia ( low high-density lipoprotein) as a risk factor for coronary heart disease. Curr Opin Lipidol 1996; 7 :209. 123. Kba S, Hirano T, Shibata M et al. Remarkably high prevalance of smail dense Low Density Lipoprotein particles in Japanese men with coronary heart disease, irrespective of the presence of diabetes. JACC 2001 Supl(A); 1128-173: 248A. 124. Frick MH, Elo O, Haapa K, et al. Helsinki Heart Study: Primaryprevention trial with gemfibrozil in middle-aged men with dyslipidemia. Safety of treatment, changes in risk factors, and incidence of coronary heart disease. N Engl J Med 1987; 317:1237. 125. Ericsson CG, Hamsten A, Nilson J,et al. Angiographic assessment of effects of bezafıbrate on progression of coronary artery disease in young male post infarction patients. Lancet 1996; 347:849. 126. Van den Hoogen PC W, Feskens EJM, Jaglekerke NJD. The relation betveen blood pressure and mortality due to coronary heart disease among men in different parts of the world. N Eng J Med 2000; 342: 127. Kannel WB.Blood pressure as a cardiovascular risk factor: Prevention and treatment. JAMA 1996; 275: 1571 128. Kramsch DM, Aspen AJ, Abramowitz BM, et al: Reduction of coronary atherosclerosis by moderate conditioning exercise in monkeys on an atherogenic diet. N Eng J Med 1981; 305:1483-9. 129. Franklin SS, Khan SA, Wong ND,et aL. Is pulse pressure useful in predicting risk for coronary heart disease? The Framingham Heart Study. Circulation 1999; 100: 354 130. Davis BR, Cutler JA, Gordon DJ, et al. Rationele and design for the antihypertensive and lipid lowering treatment. Am J Hipertens 1996; 9:342. 131. Joint National Committee on Prevention, Evaluation and Treatment of High Blood Pressure. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation and Treatment of High Blood Pressure (JNC 7 Report). National Institutes of Health; National Heart, Lung and Blood Institute. JAMA 2003; 289: 2560-2572. 132. US Department of Health and Human Services. The Health Consequenees of Smoking: Cardiovascular Disease, A Report of the Surgeon General. Washington, DC: Office of Smoking and Health, US government Printing Office; 1983 133. Wilhelmsson C, Vedin JA, Elmfeldt D,et al. Smoking and myocardial infarction. Lancet 1975; 1: 415-419. 86 134. He J, Vupputuri S, Allen K, et al. Passive smoking and risk of coronary heart disease: A meta- analysis of epidemiologic studies. N Eng J Med 1999; 340: 920 135. Frei B, Forte TM, Ames BN. et al. Gas phase oxidants of cigarette smoke induce lipid peroxidation and changes in lipoprotein properties in human blood plasma: Protective effects of ascorbicacid. Biochem J 1991;277: 133. 136. Rival J, Riddle JM, Stein PD. Effects of chronic smoking on platelet funetion. Thromb Res 1987;45:75. 137. Tsevat J, Weinstein M C, Williams L W, et al. Expected gains in life expectancy from various coronary heart disease risk factor modifications. Circulation 1991;83:1194. 138. Hermanson B,Omenn GS, Kronmal RA, et al. Benefical six-year outcome of smoking cessation in older men and women with coronary artery disease: Results from the CASS Registry. N Eng J Med 1988; 319:1365. 139. Grundy SM, Benjamin IJ, Burke GL, et al. Diabetes and cardiovascular disease: A statement for healthcare professionals from the American Heart Association. Circulation 1999; 100: 1134. 140. Abbott RD, Donahue RP, Kannel WB, et al. The impact of diabetes on survival following myocardial infarction in men vs women: The Framingham Study. JAMA 1988;260:3456. 141. Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin dependent diabetes mellitus. The Diabetes Control and Complications Trial Research Group. N Eng J Med 1993; 329: 977-86. 142. DK Prospective Study Group. Tight blood pressure control and risk of macrovascular and microvascular complications in type 2 diabetes. UKPDS 38. Br Med J 1998;317:703-13. 143. Eckel RH, Krauss RM. American Heart Association call to action: Obesity as a major risk factor. Circulation 1998; 97: 2099. 144. Onat A, Şenocak M. Obesity in Turkish adults: prevalence, validity as a coronary risk factor and interrelation with other risk factor so Int JAng 1995; 4: 94-8. 145. Fletcher GF, Balady G, Blair SN, et al. Statement on exercise: Benefits and recommendations for physical activity. Circulation 1996; 94:857. 146. Kesteloot H, Joossens JV. Nutrition and international patterns of disease. In: Marmot M, Elliot P, eds. Coronary Heart Disease Epidemiology: From Etiology to Public Health. Oxford: Oxford University Press; 1993;152. 87 147. Watts GF, Lewis B, Brunt JN, et al. Effect on coronary artery disease of lipid-Iowering diet, or diet plus cholestyramine, in the St Thomas' AtheroscIerosis Regression Study (STARS). Lancet 1992; 329:563. 148. Ornish D, Brown SE, Scherwitz LW, et al. Can lifestyle changes reverse coronary heart disease? The Lifestyle Heart. Lancet 1990; 336: 129. 149. Leren P. The Oslo diet-heart study: Eleven year report. Circulation 1970; 42:935. 150. De Lorgeri1 M, Salen P, Martin JL, et al. Mediterranean diet, traditional risk factors, and the rate of cardiovascular complications after myocardial infarction: Final report of The Lyon Diet Heart Study. Circulation 1999; 99:779. 151. Prof. Dr. Nurettin ÖZCAN. Koroner Kalp Hastalıkları. Koroner kalp hastalıklarında risk faktörleri, korunma ve tedavi. ANKARA 1997 s.46-52. 152. Jaffe, AS. Pandora's box is tom asunder (editorial). Am Heart J 1999;138:9-12. 153. Sigurdsson E, Thorgeirsson G, Sigvaldason H, Sigfusson N. Unrecognized myocardial infarction: epidemiology, clinical characteristics, and the prognostic role of angina pectoris. The Reykjavik Study. Ann Intern Med 1995;122:96-102. 154. NHAAPC 60 minutes to treatment working group. Washington, DC: Emergency Department: rapid identification and treatment of patients with acute myocardial infarction. NIH Publication No. 93-3278. National Heart, Lung, and Blood Institute, Public Health Service, US Department of Health and Human Services; 1993. 155. Muller JE, Stone PH, Turi ZG, et al. Circadian variation in the frequency of onset of acute myocardial infarction. N Engl J Med 1985;313:1315-22. 156. Rude RE, Poole WK, Muller JE, et al. Electrocardiographic and clinical criteria for recognition of acute myocardial infarction based on analysis of 3,697 patients. Am J Cardiol 1983;52:936-42. 157. Fesmire FM, Percy RF, Bardoner JB, Wharton DR, Calhoun FB. Usefulness of automated serial 12-lead ECG monitoring during the initial emergency department evaluation of patients with chest pain. Ann Emerg Med 1998;31:3-11. 158. Krucoff MW, Green CE, Satler LF, et al. Noninvasive detection of coronary artery patency using continuous ST-segment monitoring. Am J Cardiol 1986;57:916-22. 159. Birnbaum Y, Sclarovsky S. Correlations between the early 12-lead electrocardiogram and the underlying coronary artery anatomy and prognosis in acute myocardial infarction. In: Clements IP, ed. The electrocardiogram in acute myocardial infarction. Armonk, NY: Futura Publishing Company; 1998:199-221. 88 160. Maeda S, Imai T, Kuboki K, Chida K, Watanabe C, Ohkawa S. Pathologic implications of restored positive T waves and persistent negative T waves after Q wave myocardial infarction. J Am Call Cardiol 1996;28:1514-8. 161. Matetzky S, Freimark D, Chouraqui P, et al. Significance of ST segment elevations in posterior chest leads (V7 to V9) in patients with acute inferior myocardial infarction: application for thrombolytic therapy. J Am Coll Cardiol 1998;31:506-11. 162. De Zwaan C, Bar FW, Wellens HJ. Characteristic electrocardiographic pattern indicating a critical stenosis high in left anterior descending coronary artery in patients admitted because of impending myocardial infarction. Am Heart J 1982;103:730-6. 163. Renkin J, Wijns W, Ladha Z, Col J. Reversal of segmental hypokinesis by coronary angioplasty in patients with unstable angina, persistent T wave inversion, and left anterior descending coronary artery stenosis. Additional evidence for myocardial stunning in humans. Circulation 1990;82:913-21. 164. Fisch C. Electrocardiography and vectorcardiography. In: Braunwald E, ed. Heart disease: a textbook of cardiovascular medicine. Philadelphia, PA:WB Saunders;1997:116-60. 165. Rosenbaum MB, Blanco HH, Elizari MV, Lazzari JO, Davidenko JM. Electronic modulation of the T wave and cardiac memory. Am J Cardiol 1982;50:213-22. 166. Roberts R. The two out of three criteria for the diagnosis of infarction. Is it passe? Chest 1984;86:511-3. 167. Klootwijk P, Hamm C. Acute coronary syndromes: diagnosis. Lancet 1999; 353 (Suppl2}: SII10-5. 168. Lenke LG, Bridwell KH, Jaffe AS. Increase in creatine kinase MB isoenzyme levels alter spinal surgery. J Spinal Disord 1994;7:70-6. 169. Roberts R. Gowda KS, Ludbrook PA, Sobel BE. Specificity of elevated serum MB creatine phosphokinase activity in the diagnosis of acute myocardial infarction, Am J Cardiol 1975:36:433-7 170. Zimmerman J. Fromm R, Meyer D, et al. Diagnostic marker cooperative study for the diagnosis of myocardial infarction. Circulation 1999:99:1671-7. 171. Vatner SF, Baig H, Manders WT, Maroko PR. Effects of coronary artery reperfusion on myocardial infarct size calculated from creatine kinase. J Clin Invest 1978;61:1048-56. 89 172. Ong L, Resier P, Coromilas J, Scherr L, Morrison J. Left ventricular function and rapid release of creatine kinase MB in acute myocardial infarction. Evidence for spontaneous reperfusion. N Engl J Med 1983;309:1-6. 173. Jaffe AS, Ritter C, Meltzer V, Harter H, Roberts R. Unmasking artifactual increases in creatine kinase isoenzymes in patients with renal failure. J Lab Clin Med 1984;104:193-202. 174. Garabedian HD, Gold HK, Yasuda T, et al. Detection of coronary artery reperfusion with creatine kinase MB determinations during thrombolytic therapy: correlation with acute angiography. J Am Coll Cardiol 1988;11:729-34. 175. Roberts R, Ambos HD, Sobel BE. Estimation of infarct size with MB rather than total CK. Int J Cardiol 1983;2;479-92. 176. Spadaro JJ, Ludbrook PA, Tiefenbrunn AJ, Kurnik PB, Jaffe AS. Paucity of subtle myocardial injury after angioplasty delineated with MB CK. Cathet Cardiovasc Diagn 1986;12:230-4. 177. Harrington RA, Lincoff AM, Califf RM, et al. Characteristics and consequences of myocardial infarction after percutaneous coronary intervention: insights from the Coronary Angioplasty Versus Excisional Atherectomy Trial (CAVEAT). J Am Coll Cardiol 1995;25:1693-9. 178. Hong MK, Mehran R, Dangas G, et al. Creatine kinase-MB enzyme elevation following successful saphenous vein graft intervention is associated with late mortality. Circulation 1999;100:2400-5. 179. Kagen L, Scheidt S, Butt A. Serum myoglobin in myocardial infarction: the ‘staccato phenomenon’. Is acute myocardial infarction in man an intermittent event? Am J Med 1977;62:86-92. 180. Van Nieuwenhoven FA, Kleine AH, Wodzig WH, et al. Discrimination between myocardial and skeletal muscle injury by assessment of the plasma ratio of myoglobin over fatty acid-binding protein. Circulation 1995;92:2848-54. 181. Bodor GS, Porterfield D, Voss EM, Smith S, Apple FS. Cardiac troponin-I is not expressed in fetal and healthy or diseased adult human skeletal muscle tissue. Clin Chem 1995;41:1710-5. 182. Haller C, Zehelein I, Remppis A, Muller-Bardorff M. Katus HA. Cardiac troponin T in patients with end-stage renal disease: absence of expression in truncal skeletal muscle. Clin Chem 1998;44:930-8. 183. Jaffe AS, Landt Y, Parvin CA, Abendschein DR, Geltman EM, Ladenson JH. Comparative sensitivity of cardiac troponin I and lactate dehydrogenase isoenzymes for diagnosing acute myocardial infarction. Clin Chem 1996;42:1770-6. 90 184. Jaffe AS. Pandora's box is torn asunder (editorial). 1999;138:9-12. Am Heart J 185. Bodor GS, Porter S, Landt Y, Ladenson JH. Development of monoclonal antibodies for an assay of cardiac troponin-I and preliminary results in suspected cases of myocardial infarction. Clin Chem 1992;38:2203-14. 186. Katus HA, Remppis A, Neumann FJ, et al. Diagnostic efficiency of troponin T measurements in acute myocardial infarction. Circulation 1991;83:902-12. 187. Ohman EM, Armstrong PW. Christenson RH, et al. Cardiac troponin T levels for risk stratification in acute myocardial ischemia. GUSTO IIA Investigators. N Engl J Med 1996;335:1333-41. 188. Hamm CW, Ravkilde J, Gerhardt W, et al. The prognostic value of serum troponin T in unstable angina. N Engl J Med 1992;327:146-150. 189. Antman EM, Tanasijevic MJ, Thompson B, et al. Cardiac-specific troponin I levels to predict the risk of mortality in patients with acute coronary syndromes. N Engl J Med 1996;335:1342-9. 190. Lindahl B, Venge P, Wallentin L. Troponin T identifies patients with unstable coronary artery disease who benefit from long-term antithrombotic protection. Fragmin in Unstable Coronary Artery Disease (FRISC) Study Group. J Am Coll Cardiol 1997;29:43-8. 191. Heeschen C, Hamm CW, Goldmann B, Deu A, Langenbrink L, White HD. Troponin concentrations for stratification of patients with acute coronary syndromes in relation to therapeutic efficacy of tirofiban. PRISM Study Investigators. Platelet Receptor Inhibition in Ischemic Syndrome Management. Lancet 1999;354:1757-62. 192. Hamm CW, Goldmann B, Heeschen C, et al. Emergency room triage of patients with acute chest pain by means of rapid testing for cardiac troponin T or troponin I. N Eng J Med 1997;337:1648-53. 193. Missov E, Calzolari C, Pau B. Circulating cardiac troponin I in severe congestive heart failure. Circulation 1997;96:2953-8. 194. Chen YN, Wei JR, Zeng LJ, Wu My. Monitoring of cardiac troponin I in patients with acute heart failure. Ann Clin Biochem 1999;36:433-37. 195. Davila-Roman VG, Guest TM, Tuteur PG, Rose WJ, Ladenson JH, Jaffe AS. Transient right but not left ventricular dysfunction after strenuous exercise at high altitude. J Am Coll Cardiol 1997;30:468-73. 196. Tamaki N, Yamada T, Matsumori A, et al. Indium-111-antimyosin antibody imaging for detecting different stages of myocardial infarction: comparison with technetium-99m-pyrophosphate imaging. J Nucl Med 1990;136. 91 197. Christian TF, Clements IP, Gibbons RJ. Non-invasive identification of myocardium at risk in patients with acute myocardial infarction and non-diagnostic electrocardiograms with technetium-99m sestamibi. Circulation 1991;83:1616-20. 198. Sabia P, Afrookteh A, Touchstone DA, Keller M, Esquiel L, Kaul S. Value of regional wall motion abnormality in the emergency room diagnosis of acute myocardial infarction: a prospective study using two-dimensional echocardiography. Circulation 1991;84(suppl I):185-92 199. Guyton AC, Hall JE: Tıbbi fizyoloji. 9. baskı, Nobel Tıp Kitabevi, İstanbul, 1999. 200. Murkin JM: Anesthesia and hypothyroidism: A review of thyroxine physiology, pharmacology and anesthetic implications. Anest Analg. 6;371-383,1982. 201. Burns TW, Carlson HE: Fizyopatoloji. 1.baskı, Türkiye Klinikleri Kitabevi, Ankara, sayfa 1092-1148,1992. 202. Guerrero EB, Kramer DC, Schwinn DA: Effect of chronic and acute thyroid hormone reduction on perioperative outcome. Anesth Analg. 85;30-36,1997. 203. Wiersinga WM,Lie KI,Touber JL. Thyroid hormones in acute myocardial infaction.Clin Endocrinol.1981 Apr;14(4):367-74 204. Jug M,Korsic M,Plavsic V,Greguric N,Batinic Z,Goldner V.. Parameters of thyroid gland function in acute myocardial infarct.Lijec Vjesn.1997 Aug-Sep;119(8-9):223-5 205. Pavlou HN,Kliridis PA,Panagiotopoulos AA,Goritras CP,Vassilakos PJ. 206. Euthyroid sick syndome in acute ischemic syndromes.Angiology.2002 Nov-Dec;53(6):699-707. 207. Pimentel RC,Cardoso GP,Escosteguy CC,Abreu LM. Thyroid hormone profile in acute coronary syndromes.Arq Bras Cardiol.2006 Dec;87(6):688-94 92