i
T.C.
İSTANBUL ÜNİVERSİTESİ
SAĞLIK BİLİMLERİ ENSTİTÜSÜ
( YÜKSEK LİSANS TEZİ )
TÜBERKÜLOZ DIŞI MASTİTLERİN ETİYOLOJİSİNDE
ROL ALAN AEROP VE ANAEROP BAKTERİLERİN
DAĞILIMI VE ANTİMİKROBİK MADDELERE DİRENÇ
DURUMLARI
ZEYNEP TANER
DANIŞMAN
PROF. DR. HRİSİ BAHAR TOKMAN
TIBBİ MİKROBİYOLOJİ ANABİLİM DALI
MİKROBİYOLOJİ PROGRAMI
İSTANBUL-2015
ii
TEZ ONAYI
iii
BEYAN
iv
İTHAF
Anneme ve Babama ithaf ediyorum.
v
TEŞEKKÜR
Eğitim ve öğrenimim boyunca değerli bilgi ve deneyimlerinden yararlandığım
hocamız, Anabilim Dalı Başkanı Sayın Prof. Dr. Nuri KİRAZ'a,
Yüksek lisans eğitimime başladığım günden itibaren sevgisini, hoşgörüsünü,
disiplinini ve azmini örnek aldığım, tezimin planlanmasında ve yüksek lisans
eğitimimin her aşamasında benden desteğini esirgemeyen, bilgi ve tecrübeleriyle beni
yönlendiren, her konuda ilgi, şefkat ve anlayış gösteren değerli danışman hocam Sayın
Prof. Dr. Hrisi BAHAR TOKMAN’a,
Yetişmemde çok emekleri geçen değerli hocalarımız Sayın Prof. Dr. Bekir
KOCAZEYBEK, Prof.Dr.Arif KAYGUSUZ, Prof. Dr. Murat HÖKELEK, Prof. Dr.
Gökhan AYGÜN, Prof. Dr. Ömer KÜÇÜKBASMACI, Prof. Dr. Nevriye GÖNÜLLÜ,
Prof. Dr. Murat GÜNAYDIN,Prof. Dr. Kenan MİDİLLİ, Doç.Dr. Fatma KÖKSAL
ÇAKIRLAR,Doç. Dr. Yavuz UYAR, Doç. Dr. Sevgi ERGİN, Doç. Dr. Mustafa
ASLAN, Doç. Dr. Suat SARIBAŞ, Yrd. Doç. Dr. Erdal POLAT ve PhD. Mert Ahmet
KUŞKUCU 'ya,
Tez çalışmam için gereken desteği esirgemeyen İ.Ü. Cerrahpaşa Tıp Fakültesi
Genel Cerrahi Anabilim Dalı Başkanı sayın Prof. Dr. Ertuğrul GÖKSOY’a ayrıcaGenel
Cerrahi Anabilim Dalı’ndan, Prof. Dr. Varol ÇELİK, Uzman Dr. Mehmet
VELİDEDEOĞLU, Asistan Dr. Fatih DAL, Asistan Dr. Yasemin KÜÇÜK ve çalışma
arkadaşlarına ve Enfeksiyon Hastalıkları Anabilim Dalı’ndan Doç. Dr. Birgül
METE’ye,
Bana olan desteklerini ile sürekli yanımda hissettiğim, tez çalışmamın
laboratuvar aşamasında yardımlarını benden esirgemeyen çok değerli doktora öğrencisi
Msc. Mehmet DEMİRCİ’ye,
İlgi ve desteklerini benden esirgemeyen çok sevgili arkadaşlarım, Msc. Fatma
KALAYCI, Biy. Harika Öykü DİNÇ, Ecz. Nergiz İMAMOVA, Msc. Esra BAKIR, Biy.
Eylül Yağmur DOĞANTÜRK, Biy. Ezgi Gözün ŞAYLAN ve Biy. Okan
AYDOĞAN’a,
Tecrübelerinden her zaman faydalandığımız sevgili doktora öğrencilerine ve çok
değerli uzmanlık öğrencilerine,
vi
Çalıştığı laboratuvarın kapılarını ardına kadar açan sevgili Nida KÜÇÜK
AYDIN’a, yardımlarını esirgemeyen sevgili Nuray KÜRK, Tuba SOYSAL, Mustafa
KIRKAN, Orhan YATMAZ, Nihat DOĞAN ve Yılmaz TAŞDEMİR’e ve tüm
mikrobiyoloji kürsüsü emekçilerine,
Moral desteğini ve yardımlarını esirgemeyen sevgili Msc. Aykut KURT’a,
Ve tabii ki bugüne kadar her zaman desteklerini arkamda hissettiğim iyi ki var
dediğim sevgili ailem, özellikle tezimin her aşamasında emeği geçen sevgili kardeşim
Ece TANER´e ve kıymetli dostum Beril KALEAĞASI’na,
Sonsuz teşekkürlerimi sunuyorum.
Bu çalışma, İstanbul Üniversitesi Bilimsel Araştırma Projeleri Birimi tarafından
desteklenmiştir. Proje No: 48735
vii
İÇİNDEKİLER
TEZ ONAYI ..................................................................................................................... İ
BEYAN ...........................................................................................................................İİİ
İTHAF ............................................................................................................................ İV
TEŞEKKÜR..................................................................................................................... V
İÇİNDEKİLER ............................................................................................................. Vİİ
TABLOLAR LİSTESİ ..................................................................................................... X
ŞEKİLLER LİSTESİ ..................................................................................................... Xİ
SEMBOLLER / KISALTMALAR LİSTESİ ............................................................... Xİİ
ÖZET .......................................................................................................................... XİV
ABSTRACT.................................................................................................................. XV
1. GİRİŞ VE AMAÇ .........................................................................................................1
2. GENEL BİLGİLER ......................................................................................................3
2.1. Tarihçe .....................................................................................................................3
2.2. Memenin Anatomik Yapısı ......................................................................................3
2.3. Meme Hastalıkları ....................................................................................................5
2.3.1. Mastit ..................................................................................................................5
2.3.1.1. Laktasyonel Mastit .........................................................................................6
2.3.1.2. Non-laktasyonel Mastit ..................................................................................7
2.3.1.3. Meme Apsesi ..................................................................................................8
2.3.2. Mastitlerin Patogenezi.........................................................................................9
2.3.2.1. Laktasyonel Mastit Patogenezi ......................................................................9
2.3.2.2. Non-laktasyonel Mastitlerin Patogenezi ........................................................9
2.3.2.3. Meme Apseleri Patogenezi ..........................................................................11
2.3.3. Mastit Etiyolojisinde Rol Alan Bakteriler ........................................................11
2.4. Biyofilm .................................................................................................................16
2.5. Bakteri Tanımlaması ..............................................................................................17
2.5.1. Konvansiyonel Yöntemlerle Tanı .....................................................................17
2.5.2. Yarı -Otomatize Yöntemlerle Tanı ...................................................................19
2.5.3. Otomatize Sistemlerle Tanı ...............................................................................20
2.5.4. Moleküler Yöntemlerle Tanı .............................................................................20
viii
2.5.4.1. 16S rRNA Analizi ........................................................................................21
2.6. Antimikrobiyal Duyarlılık Testleri ........................................................................21
2.7. Duyarlılık testlerinde kullanılan antibiyotikler ......................................................24
2.8. İstatistiksel yöntemler ............................................................................................31
3. GEREÇ VE YÖNTEM ...............................................................................................32
3.1. Gereçler ..................................................................................................................33
3.1.1. Kullanılan Besiyerleri .......................................................................................33
3.1.1.1. Aerop Kültürler İçin Kullanılan Besiyerleri ................................................33
3.1.1.2. Anaerop Kültürler İçin Kullanılan Besiyerleri .............................................38
3.1.2. Kullanılan Stok Solüsyonlar .............................................................................42
3.1.3. Kullanılan Ayıraçlar ..........................................................................................42
3.1.4. Bakterilerin Tanımlanmasında Kullanılan Diskler ...........................................43
3.1.4.1. Antibiyotik diskleri ......................................................................................43
3.1.5. Aerop ve Anaerop Bakterilerin Moleküler Yöntemlerle Tanımlanmasında
Kullanılan Gereçler .....................................................................................................44
3.1.5.1. DNA İzolasyonunda Kullanılan Kit .............................................................44
3.1.5.2. Agaroz Jel Hazırlanmasında Kullanılan Gereçler ........................................44
3.1.5.3. 16S rRNA'nın PZR Amplifikasyonunda Kullanılan Gereçler .....................44
3.1.5.4. 16S rRNA Gen Bölgesinin Dizileme Çalışmasında Kullanılan Gereçler ....45
3.2. Yöntemler ..............................................................................................................45
3.2.1. Hastalara Ait Formların Doldurulması .............................................................45
3.2.2. Hastalardan Örnek Alınması ve Laboratuvara Taşınması ................................46
3.2.3. Besiyerlerine ekim, aerop/anaerop ortamların sağlanması ve inkübasyon .......46
3.2.4. Aerop Bakterilerin İzolasyon ve Tanımlanmasında Kullanılan Yöntemler......46
3.2.4.1. Gram Pozitif Diplokokların Tanımlanması ..................................................47
3.2.4.2. Gram Negatif Çomakların Tanımlanması ....................................................49
3.2.4.3. Gram Pozitif Çomakların Tanımlanması .....................................................51
3.2.5. Anaerop Bakterilerin İzolasyon ve Tanımlanmasında Kullanılan Yöntemler ..51
3.2.6. Aerop ve Anaerop Bakterilerin Tanısında Kullanılan Moleküler Yöntemler...51
3.2.6.1. DNA İzolasyonu...........................................................................................51
3.2.6.2. DNA Miktar Tayini ve DNA Saflık Derecesinin Belirlenmesi ...................52
3.2.6.3. Agaroz Jel Elektroforezi ..............................................................................52
3.2.6.4. 16S rRNA'nın PZR Amplifikasyonu............................................................52
ix
3.2.6.5. 16S rRNA Gen Bölgesinin Dizileme Çalışması ..........................................54
3.2.6.6. 16S rRNA Sekans Verilerinin Analizi .........................................................54
3.2.7. Aerop ve Anaerop Bakterilerin Antimikrobiyal Duyarlılığının Belirlenmesinde
Kullanılan Yöntemler ..................................................................................................54
3.2.8. İstatistiksel yöntemler .......................................................................................55
4. BULGULAR ...............................................................................................................56
5. TARTIŞMA ................................................................................................................70
KAYNAKLAR ...............................................................................................................90
FORMLAR ...................................................................................................................101
ETİK KURUL KARARI ..............................................................................................102
ÖZGEÇMİŞ ..................................................................................................................103
x
TABLOLAR LİSTESİ
Tablo 3-1: 16S rRNA'nın PZR amplifikasyonu için kullanılacak reaksiyon karışımının
hazırlanışı ........................................................................................................................ 53
Tablo 3-2: 16S rRNA'nın PZR amplifikasyonu için kullanılacak reaksiyon karışımının
transfer işleminden sonra PZR reaksiyonu için belirtilen şartlar. ................................... 54
Tablo 4-1: Laktasyonel ve non-laktasyonel mastitli hastalarda yaş aralığı ve yaş
ortalaması. ....................................................................................................................... 57
Tablo 4-2: Laktasyonel ve non-laktasyonel mastitli hastalara ait özelliklerin dağılımı. .
........................................................................................................................................ 58
Tablo 4-3: Laktasyonel ve non-laktasyonel mastit tanısı almış hastalarda üreyen aerop
bakterilerin dağılımı. ....................................................................................................... 61
Tablo 4-4: Laktasyonel ve non-laktasyonel mastit tanısı almış hastalarda üreyen anaerop
bakterilerin dağılımı. ....................................................................................................... 62
Tablo 4-5: Mastit hastalarına ait 10 örnekte saptanan bakteri birliktelikleri. ................. 63
Tablo 4-6:ABI 3730XL cihazında elde edilen kromatogramlardan çıkan Fasta
dizilerinin NCBI ve DSMZ veri bankalarına göre sonuçları. ......................................... 65
Tablo 4-7: Mastitli hastalarda üreyen aerop bakterilerin antibiyotiklere direnç durumları
........................................................................................................................................ 68
Tablo 4-8: Mastitli hastalarda üreyen anaerop bakterilerin antibiyotiklere direnç
durumları ve denenen antibiyotiklerin MİK değerleri ................................................... 69
xi
ŞEKİLLER LİSTESİ
Şekil 2-1: Memenin normal anatomik yapısı .................................................................... 4
Şekil 2-2: Mastitlerin sınıflandırılması ............................................................................. 6
Şekil 4-1: Laktasyonel ve non-laktasyonel mastit tanısı almış hastaların dağılımı. ....... 56
Şekil 4-2: Non-laktasyonel mastitli 56 hastada granülomatöz mastitli ve periduktal
mastitli olguların dağılımı. .............................................................................................. 56
Şekil 4-3:Laktasyonel ve non-laktasyonel mastitli hastalarda yaş gruplarının dağılımı. 57
Şekil 4-4: Laktasyonel mastitli hastaların örneklerinde bakteri üremesi saptananların
oranı ................................................................................................................................ 59
Şekil
4-5:
Non-laktasyonel
mastitli
hastaların
örneklerinde
bakteri
üremesi
saptananların oranı ........................................................................................................ 59
Şekil 4-6: Kültürde üreme olmadığı halde Gram boyamada bakteri görülen örneklerin
hasta gruplarına göre dağılımı. ....................................................................................... 60
Şekil 4-7: Staphylococcus epidermidis ATCC 12228 genomu. ..................................... 64
Şekil 4-8: Corynebacterium kroppenstedtii DSM 44385 genomu. ................................ 64
xii
SEMBOLLER / KISALTMALAR LİSTESİ
İGM
: İdiyopatik granülomatöz mastit
TDLU
: Terminal duktolobüler ünit
MRSA
: Metisilin dirençli Staphylococcus aureus
MSSA
: Metisilin duyarlı Staphylococcus aureus
USG
: Ultrasonografi
DM
: Diyabetes mellitus
GM
: Granülomatöz mastit
TNF-α
: Tümör nekroz faktör alfa
INF-γ
: İnterferon gamma
TSI
: Three sugar iron agar (üç şekerli demirli agar)
MIO
: Hareket indol ornitin besiyeri
TAE
: Tris bazı, asetik asit ve EDTA içeren tampon solüsyon
16S- rRNA : 16 Swedberg birimi büyüklüğünde prokaryot ribozomal RNA’sı
dATP
: Deoksiadenozin trifosfat
dCTP
: Deoksisitidin trifosfat
dGTP
: Deoksiguanozin trifosfat
DNA
: Deoksiribonükleik asit
RNA
: Ribonükleik asit
dNTP
: Deoksiribonükleotit trifosfat
dTTP
: Deoksitimidin trifosfat
DDH
: DNA-DNA hibridizasyonu
MİK
: Minimal inhibitör konsantrasyonu
MBK
: Minimal bakterisidal konsantrasyon
PBP
: Penisilin bağlayıcı proteinler
xiii
CRF
: Koagülaz reaktan faktör
PYR
: L-Pirolidonil-β-Naftilamid
IL
: İnterlökin
pH
: Asitlik –bazlık birimi [H+] iyonlarının - logaritması
PZR
: Polimeraz Zincir Reaksiyonu
P
: Penisilin
A
: Ampisilin
CRO
: Seftriakson
CAZ
: Seftazidim
AMC
: Amoksisilin/ Klavulonik Asit
IPM
: İmipenem
MEM
: Meropenem
DA
: Klindamisin
E
: Eritromisin
SXT
: Trimetoprim/sulfametoksazol
CN
: Gentamisin
CIP
: Siprofloksasin
VA
: Vankomisin
LZD
: Linezolid
xiv
ÖZET
Taner, Z. Tüberküloz dışı mastitlerin etiyolojisinde rol alan aerop ve anaerop
bakterilerin dağılımı ve antimikrobik maddelere direnç durumları. İstanbul Üniversitesi
Sağlık Bilimleri Enstitüsü, Tıbbi Mikrobiyoloji ABD. Yüksek Lisans Tezi. İstanbul.
2015.
Mastit memenin inflamatuar hastalığını ifade eden, çoğu zaman patojen
mikroorganizmaların çoğalması sonucu gelişen bir hastalıktır. Mastite neden olan
bakterilerin tanısı ve antimikrobiyal duyarlılıkları hastalığın tedavisi ve takibi açısından
büyük önem taşımaktadır. Bu bakterilerin hastaların cerahat veya doku örneklerinden
tanımlanması için başta aerop ve anaerop kültür yöntemleri kullanılmaktadır. Ancak
birçok kaynakta belirtildiği gibi, etkenlerin konvansiyonel bakteriyolojik tekniklerle
izolasyonunda her zaman başarı sağlanamadığı için günümüzde moleküler
yöntemlerden de yararlanılmaktadır.
Kasım 2015-Haziran 2015 tarihleri arasında, İstanbul Üniversitesi Cerrahpaşa
Tıp Fakültesi, Acil Cerrahi ve Genel Cerrahi Meme Polikliniği’ne başvuran ve klinik
muayeneleri ve/veya histopatolojik incelemeleri sonuçlarına göre mastit tanısı almış
olan, 44 laktasyonel mastit ve 56 non-laktasyonel mastitli 100 hastaya ait doku ve/veya
apse cerahatleri ile gerçekleştirdiğimiz çalışmada aerop ve anaerop kültürler,
antimikrobiyal duyarlılık testleri ve moleküler testler sonucunda, laktasyonel mastitli
hastaların örneklerinde en yüksek oranda üretilen bakterilerin Gram pozitif
diplokoklardan Staphylococcus aureus (%43,1) olduğu, non-laktasyonel mastitli
hastalardan granülomatöz mastitli olanlarda ise en yüksek oranda üretilen bakterilerin
Corynebacterium türleri (%26,1) olduğu belirlenmiştir.
Granülomatöz mastitli hastaların cerahatlerinde, gerek kültür gerek 16S rRNA
ve dizi analizi ile Corynebacterium kroppenstedtii, Corynebacterium urealyticum,
Corynebacterium amycolatum ve Corynebacterium pseudotuberculosis ülkemizde ilk
defa bu çalışma ile belirlenmiş ve granülomatöz mastit ile Gram pozitif çomakların
varlığı arasında anlamlı bir ilişki olduğu gösterilmiştir. Ayrıca aynı gruptaki hasta
örneklerinde yine aynı yöntemle Staphylococcus saprophyticus, Staphylococcus capitis,
Lactococcus lactis ve Bifidobacterium breve de ilk defa saptanmıştır. Bunun yanı sıra,
düşük oranda da olsa mastitlerde peptostreptokokların en baskın üreyen anaerop bakteri
olduğu belirlenmiştir.
Mastitli hastalara uygulanan tedavilere, hastalarda sık üretilen bakteriler olan
Gram pozitif diplokoklar ve Gram pozitif çomaklara etkili ve yağ dokuya penetrasyonu
güçlü olan antibiyotiklerin eklenmesinin yararlı olacağı görüşündeyiz.
Anahtar Kelimeler: Mastit, aerop bakteriler, anaerop bakteriler, antimikrobiyal direnç,
PZR, 16S rRNA, dizi analizi
Bu çalışma, İstanbul Üniversitesi Bilimsel Araştırma Projeleri Birimi tarafından
desteklenmiştir. Proje No: 48735
xv
ABSTRACT
Taner, Z. The distribution of aerobic and anaerobic bacteria in the etiology of nontuberculous mastitis and their resistance to antimicrobial agents. Istanbul University,
Institute of Health Science, Department of Medical Microbiology. Thesis of Master of
science. Istanbul. 2015.
Mastitis is an inflammatory disease of the breast, often develops as a result of
the proliferation of pathogenic microorganisms. The diagnosis of the bacteria that
causes mastitis is very important due to the treatment and the monitoring of the disease.
For the identification of these bacteria from patients pus or tissue samples, aerobic and
anaerobic culture methods are used. However, as mentioned in many sources, it is not
always possible to identify the agents by conventional bacteriological methods, today
molecular methods are also utilized.
Between November 2015 and June 2015, pus and tissue samples of the 44
lactational mastitis patient and 56 non-lactational mastitis patients who were diagnosed
with mastitis disease by clinical examinations and/or histopathological examinations
and admitted to Istanbul University Medical Faculty, Emergency Surgery and General
Surgery Breast outpatient department were collected and examined. As a result of our
aerobic and anaerobic culture studies, antimicrobial sensitivity studies and molecular
tests, we found that S. aureus (%43,1) is the most common bacteria which is isolated
from the lactational mastitis patient samples and Corynebacterium spp. (%26,1) is the
most common bacteria which is isolated from the non-lactational mastitis patient
samples.
In the pus of granulomatous mastitis patients, both with culture and 16S rRNA
sequencing methods, Corynebacterium kroppenstedtii, Corynebacterium urealyticum,
Corynebacterium
amycolatum
andCorynebacterium
pseudotuberculosiswere
determined by this study and a significant correlation between granulomatous mastitis
and Gram positive rods were shown for the first time in our country. Also in the
samples of the same patient group, S. saprophyticus, S. capitis, Lactococcus lactis
andBifidobacterium brevewere determined for the first time again with the same
method. In addition, eventhough with the low levels, peptostreptococci is determined as
the most dominant anaerobic bacteria isolated on mastitis.
We believe that it would be beneficial with the addition of the antibiotics which
were effective on the most common isolated bacteria such as Gram positive diplococci
and Gram positive rods and were penetrating strongly to the adipose tissue to the
treatment of the patients with mastitis.
Keywords:Mastitis, aerobic bacteria, anaerobic bacteria, antimicrobial resistance, PCR,
16S rRNA, sequence analysis
The present work was supported by the Research Fund of Istanbul University. Project
No. 48735
1
1. GİRİŞ VE AMAÇ
Mastit memenin inflamatuar hastalığını ifade eden, genellikle kadınları etkileyen
ve çoğu zaman patojen mikroorganizmaların çoğalmasının sonucu gelişen bir hastalıktır
(1). Mastitler; laktasyonel mastit, non-laktasyonel mastit ve meme apsesi olmak üzere
üç grupta incelenmektedir. Non-laktasyonel mastit, kendi içinde santral veya subareolar
enfeksiyon, periferal enfeksiyon ve granülamatöz enfeksiyon olmak üzere üç gruba
ayrılır (1).
Laktasyon süresinde kadınların %33 kadarında laktasyonel mastit (enfeksiyöz
mastit) görülmektedir. Güncel verilerin ışığında enfeksiyöz bakteriyel mastitlerin
etiyolojisinde genellikle stafilokok, streptokok ve/veya Corynebacterium türlerinin rol
oynadığı, Staphylococcus aureus ile Staphylococcus epidermidis’in temel etiyolojik
etkenler olduğu gösterilmiştir (2). Özellikle laktasyonel mastitte, antibiyotik tedavisine
istenilen yanıtın alınamaması, bu iki stafilokok türünde görülen çoklu antibiyotik
direnci ve biyofilm oluşturabilme özellikleri ile ilişkilendirilmiştir (3). Bunun dışında
laktasyonel mastitte başta Bacteroides spp. ve Propionibacterium spp. olmak üzere
anaerop bakterilerin de etkenler arasında yer alabileceği gösterilmiştir (3).Laktasyonel
mastitin aksine non-laktasyonel mastitte ise bakteriyel etkenlerin nadir görüldüğü
bildirilmektedir. Non-laktasyonel mastitin en sık rastlanılan türü olan granülomatöz
mastitte ise etiyolojik rolü olan bakteriler tam olarak bilinmemektedir. Araştırmalarda
başta Corynebacterium türleri olmak üzere, Escherichia coli, Bifidobakteriler,
anaerobik streptokoklar, Clostridium türleri ve Propionibacterium acnes etkenler
arasında gösterilmiştir (4).
Mastite neden olan bakteriyel etkenlerin tanısı hastalığın tedavisi ve takibi
açısından büyük önem taşımaktadır. Mastit tanısı almış hastaların apse ve doku
örneklerinden bakterilerin tanımlanması için başta aerop ve anaerop kültür yöntemleri
kullanılmaktadır (1). Ancak birçok kaynakta belirtildiği gibi, etkenlerin konvansiyonel
bakteriyolojik tekniklerle izolasyonunda
her zaman başarı
sağlanamadığı için
günümüzde moleküler yöntemlerden (polimeraz zincir reaksiyonu (PZR), multiplex
PZR, gerçek zamanlı PZR) de yararlanılmaktadır (1, 2, 4).
Mastit tedavi edilmediğinde hastalarda meme apseleri ve geniş meme dokusu
nekrozları gelişebilmektedir. Tüberküloz dışı bakteriyel mastitli hastalara uygulanan
tedavi merkezden merkeze değişebileceği gibi genelde apse drenajı yanı sıra ampirik
2
olarak penisilinler, sefalosporinler, beta laktam inhibitörleri ve klindamisine
başvurulmaktadır (5). Bunun yanı sıra, son yapılan çalışmalarda sağlıklı annelerin
sütlerinden izole edilen bazı Lactobacillus türlerinin
(Lactobacillus salivarus,
Lactobacillus gasseri) tedavide kullanıldığı ve olumlu yanıtlar alındığı bildirilmiştir (5).
Ayrıca etki mekanizmaları tam olarak bilinmemekle beraber özellikle granülomatöz
mastitlerin tedavisinde steroidler de kullanılmaktadır (6).
Ülkemizde ve dünyada mastit oldukça yaygın olmasına ve kadınlara ciddi
psikolojik ve fiziksel güçlükler yaşatmasına karşın etiyolojisinde rol oynayan ya da
klinik tabloya sekonder olarak eklenerek hastalığın şiddetini arttıran bakterilere yönelik
araştırmalar ülkemizde yok denilecek kadar azdır. Biz bu araştırmamızda mastit tanısı
almış hastalarda infeksiyona neden olabilen Mycobacterium tuberculosis dışındaki
aerop ve anaerop bakterileri başta kültür yöntemleri olmak üzere imkanlarımız
dahilinde moleküler yöntemleri de kullanarak saptamayı ve üretebildiğimiz etkenlerin
antibiyotik duyarlılıklarını belirleyerek ampirik tedavide kullanılan antibiyotiklere
yönelik yeni yaklaşımlar getirebilmeyi amaçlamaktayız.
3
2. GENEL BİLGİLER
2.1. Tarihçe
Meme muayene edilirken göz ve elle ulaşılması en kolay organlardan biridir.
Dolayısıyla bu organda ortaya çıkan patolojik değişiklikler ilk çağlardan beri insanların
ve hekimlerin dikkatini çekmiş ve önemli gözlemlerin yapılmasına olanak sağlamıştır
(7). Meme hastalıkları ile ilgili ilk yazılı kayıtlara Mısır’da 1829 yılında rastlanmıştır.
M.Ö. 3000 yıllarına ait bu papiruslar Edwin Smith tarafından bulunup okunmuştur. 48
vakaya ait bilgi içeren bu papiruslarda apse, travma, infekte yaralar ve tümör hakkında
bilgiler verilmiştir. 16.ve 17. yy’da önce Fabry sıkıştırarak meme amputasyonu yapan
bir alet geliştirmiş daha sonra Arceo ilk kez memenin cerrahi yolla çıkarıldığı
mastektomi ameliyatını tarif etmiş; Cabrol buna büyük pektoral kasın çıkarılmasını
eklemiştir. Kısa bir sure sonra ise Severinus koltuk altı disseksiyonunu eklemiştir (8).
İlk defa 1862’da Sir Astley Cooper tarafından tanımlanan meme tüberkülozu,
günümüzde en sık görülen spesifik granülomatöz mastit tipidir (6). 1894 yılında hem
Halsted hem de Mayer; günümüzde hala uygulanan radikal mastektomiyi tarif
etmişlerdir. Daha sonra, bir yandan çıkarılan kısımlar genişletilirken (geniş radikal
mastektomi) diğer yanda modifiye radikal mastektomi, basit mastektomi gibi sınırlı
amputasyonlar yapılmaya başlanmıştır. İlk uygulamaları 1940’lı yıllarda başlayan ve
ameliyattan sonra memenin ışınlanmasını gerektiren meme koruyucu ameliyatlar o
zamanki ışınlama tekniğinin komplikasyonları sonucu yaygın kullanım alanı
bulamamıştır. İdiyopatik granülomatöz mastit (İGM) 1970 yılında Milward ve Gough
tarafından tanımlanmasına rağmen ilk kez 1972 yılında Kessler ve Woolloch tarafından
çok sayıda granülom ve apse formasyonları ile karekterize beş olgu üzerinden klinik ve
patolojik bulguları ile tariflenmiştir (6). 1980’lerden itibaren mastit enfeksiyöz ve
nonenfeksiyöz olmak üzere iki alt grupta incelenmeye başlamıştır (1). Meme
hastalıkları ile ilgili çalışmalar bu tarihsel sürecin ardından günümüz tıbbında
dadurmaksızın sürmektedir.
2.2. Memenin Anatomik Yapısı
Meme, modifiye bir ter bezidir (9). Anterior torasik duvarın en ön kesiminde
bulunur. Laktasyon dönemi dışında bir meme ortalama 10-12 cm çapında ve 150-400 g
ağırlığındadır (10). Meme şekli genetik faktörler tarafından etkilenir ve diskoid, konik,
4
hemisferik gibi şekillerde olabilir (11). Meme boyutları ve ağırlığı kişiden kişiye, hatta
aynı kişide sağ ile sol arasında ve hayatın değişik dönemlerinde farklılık gösterebilir
(12).
Vücutta, klavikula ile altıncı-sekizinci kostalar arasında yer alırlar. Mediolateral
yerleşimleri de sternum ile midaksiller çizgi arasındadır (13). Toraksın önünde yüzeyel
fasyadadırlar ve derinde pektoral kaslardan derin fasya ile ayrılırlar. Meme Cooper
ligamanları ile cilde sıkıca bağlanmıştır ancak derin fasyadan kolayca ayrılabilir (14).
Memenin büyük kesimi pektoralis major kası üzerindedir. Lateralde serratus anterior
kasının, medialde rektus kası kılıfının üst kısmını örter (15).
Şekil 2-1: Memenin normal anatomik yapısı (1: Göğüs duvarı, 2: Pektoral kas ve fasyası, 3:
Lob, 4: Meme başı, 5: Areola, 6: Segmental duktus, 7: Retro/Periglandüler yağ
dokusu, 8: Cilt ) (10)
Meme glandüler doku, fibröz doku ve yağ dokusundan meydana gelir ve 15-20
lobdan (segmentten) oluşur (9,12). Her bir lob meme başından başlayarak ışınsal tarzda
doku içine dağılmıştır. Her bir lobun meme başına doğru yönelmiş olan ayrı bir kanalı
ve her bir lob 20-40 lobulus içerir. Her lobulusta da 10-100 adet asinus (duktül) vardır.
Asinuslar birleşerek terminal duktusa (intralobüler ve ekstralobüler segmentten oluşur)
açılırlar (16). Bir terminal duktusun intralobüler segmenti ile buna açılan asinuslar
lobulusu oluşturur. Bu yapıya terminal duktolobüler ünit adı verilmiştir (TDLU) (17,
18). Terminal duktuslar birleşerek subsegmental duktusu oluştururlar. Bunlar da
5
birleşerek segmental (laktifer) duktusu meydana getirirler. Laktifer duktus meme
başında genişler, laktifer sinüs olarak isimlendirilir. Laktifer sinüs de ampulla ile meme
başından dışarı açılır (16). Laktasyonda sütün toplandığı yer bu laktifer sinüstür (14).
Areolada sebase glandlar bulunur, bunlar gebelikte areola ve meme başını
koruyan bir madde salgılar. Areola altında yağ bulunmaz. Meme başı areola orta
kesiminde yerleşmiş koni ya da silindir şeklinde çıkıntıdır ve 4. interkostal aralıkta
bulunur. Ancak bireyden bireye farklılık gösterebilir. Meme başının ucunda laktifer
sinüslerin açıldığı yerler bulunur (14).
2.3. Meme Hastalıkları
Meme hastalıkları denildiğinde akla ilk gelen meme kanseri olmasına karşın
meme kistleri, fibroadenomlar, filloid tümörler, duktalektazi, intraduktal papillom, yağ
nekrozları, mondor hastalığı ve meme enfeksiyonları anlamına gelen mastit gibi iyi
huylu meme hastalıklar da bulunmaktadır (19). Mastiti de kapsayan pek çok benign
meme hastalığı, oluşan yapısal ve kimyasal değişiklikler nedeni ile gebelik ve laktasyon
dönemlerinde daha sık görülür(19).
2.3.1. Mastit
Mastit meme dokusunun tamamının veya bir bölümünün çeşitli nedenlerle
oluşan inflamasyonunu ifade eder. Meme dokusundaki bu inflamasyon, basit mastit
olarak tanımlanan tedavisi kolay enfeksiyöz bir ajana sekonder oluşabileceği gibi
inflamatuar meme kanseri gibi ciddi bir hastalığın klinik bulgusu da olabilir. Mastit
genellikle laktasyon dönemindeki kadınlarda olmak üzere üreme çağındaki kadınlarda
daha sık görülür(20, 21).
Etkene bağımlı olarak inflamasyonun klinik ve histopatolojik özellikleri
farklılıklar göstermekle birlikte en sık rastlanılan fizik muayene bulguları; memenin bir
bölümünde veya tamamında sertlik, hassasiyet, ödem ve ciltte renk değişikliğidir.
Sıcaklık artışı, kitle formasyonu, fluktuasyon, ciltte portakal kabuğu görünümü ve
akıntılı sinüsler gibi bulgular nadiren saptanabilir (22, 23).
Mastitte etkili tedavi, tanımlanmış patojen etkene spesifik tedavinin uygulanması
esasına dayanır. Mastit tedavisi laktasyonel dönemde görülen mastitlerde anamnez ve
fizik muayene ile ileri tetkik yapmadan başlanacak kadar basit olabileceği gibi,
tekrarlayan görüntüleme ve biyopsilere rağmen tanı konulamayan, etkeni izole
6
edilemediği için genellikle non-spesifik tedavi denemeleri yapılan (granülomatöz
mastitte olduğu gibi) sıkıntılı bir süreçle seyredebilir (6).
Mastitler; laktasyonel mastit, non-laktasyonel mastit ve meme apsesi olmak
üzere üç grupta incelenmektedir. Non-laktasyonel mastit, kendi içinde santral veya
subareolar enfeksiyon oluşturabilen periduktal mastit, periferal enfeksiyon ve
granülamatöz mastit olmak üzere üç gruba ayrılır(1).
Şekil 2-2: Mastitlerin sınıflandırılması
2.3.1.1. Laktasyonel Mastit
Laktasyonel mastit en sık görülen mastit şeklidir ve ana nedenlerin süt stazı ve
enfeksiyon olduğu düşünülmektedir (2, 24). Primer neden süt stazıdır, bunu takiben IL8 gibi sitokinlerin de etkisiyle enflamasyon gelişir ve mastitin klinik bulguları ortaya
çıkar, bakterilerin gelişebileceği uygun ortam oluşur ve enfeksiyon da eklenir.
Laktasyonel mastitin sınıflandırılmasında, vakaların sütlerinde lökosit ve bakteri
sayılarının hesaplanmasına dayanan bir yöntem de önerilmiştir (3). Enfeksiyon gelişme
halinde, enfeksiyonun memeye hangi yoldan ulaştığı belirsizdir, ancak meme başı
çatlağı majör risk faktörü olarak düşünülmektedir (25). En sık görülen enfeksiyöz
7
etkenlerin başında Staphylococcus aureus (Metisilin dirençli Staphylococccus
aureus)yer almaktadır, bunu streptokoklar ve Staphylococcus epidermidis izlemektedir
(26, 27, 28).
2.3.1.2. Non-laktasyonel Mastit
Non-laktasyonel mastitler santral veya subareolar enfeksiyon oluşturan
periduktal mastitler, periferal enfeksiyonlar ve granülomatöz mastitler olmak üzere üç
grupta incelenmektedir. Genelde neden periduktal mastittir ve dilate duktuslar
etrafındaki enflamasyon olarak tanımlanır (1).
Periduktal Mastit
Periduktal mastitte duktal ektazi sürecin ilk adımıdır (29). Keratin üretimiyle
tıkanan kanalda, sekretuar materyal birikimi ile dilatasyon olur, epitel rüptürüyle
periduktal doku hasarı gelişir, dolayısıyla bakteriyel gelişim için uygun ortam oluşur.
Enfeksiyöz etkenler arasında anaerop ve aerop bakteriler belirtilmiştir (30). Periduktal
mastitlerde hormonal değişimler (prolaktin, östrojen), vitamin A eksikliği ve sigara
başlatıcı faktörler olarak düşünülmektedir (4). Özellikle sigara kullananlarda subareoler
kanallarda daha yoğun olarak bulunan nikotinin doğrudan toksik etki veya hipoksi ile
zarar verdiği düşünülmektedir (4). Periduktal mastitler non-laktasyonel apselerin
çoğunu oluştururlar. Erkeklerde de görülebilirler ve bilateral olabilirler. En sık şikâyet
ağrı ve meme başı akıntısıdır. Kitle, meme başı çekintisi, apse ya da fistül görülebilir.
Enfeksiyon ve apse sık tekrarlar (29). Anamnezde benzer şikâyetlerin daha önce
geçirilip geçirilmediği sorgulanmalıdır. Klinik tanıda ultrasonografi (USG) bulguları
nonspesifiktir dolayısıyla karsinomla karışabilir (30).
Periferal enfeksiyon
Periferal enfeksiyon nadir görülür ve genelde idiyopatiktir. Diyabet, romatoid
artrit, steroid kullanımı, travma veya karsinom ile ilişkili olabileceği bildirilmiştir (4).
Etkenler Staphylococcus aureus, streptokoklar ve bazen de anaeroplardır(26, 27, 28).
Laktasyon dışı dönemdeki periferal enfeksiyonlar için en önemli risk faktörü diyabetes
mellitus (DM) olarak bildirilmektedir (31).
Granülamatöz mastit
Granülomatöz mastit (GM) memenin nadir görülen kronik inflamatuar bir
hastalığıdır. Genellikle 50 yaş altı kadınlarda görülür. Etiyolojik nedenleri tam olarak
8
bilinmemektedir. Klinik ve radyolojik bulguları meme kanseri ile karışabilmektedir.
Granülomatöz mastitlerin spesifik granülomatöz mastitler ve idiyopatik granülomatöz
mastitler olmak üzere iki klinik görüntüsü bildirilmiştir (1).
Spesifik granülomatöz mastitlerde Mycobacterium tuberculosis en sık rastlanılan
etken
olarak
belirtilmiştir.
Bunu
takiben
Salmonella
typhi,
Brucella
spp.,
Mycobacterium leprae ve nadir olarak da parazitler, mantarlar ve virüsler enfeksiyon
etkenleri olarak
bildirilmiştir. Enfeksiyon dışı faktörler olarak da yabancı cisim,
Wegener granülomatozu ve sarkoidoz bildirilmiştir (6).
İdiyopatik granülamatöz mastit ilk kez 1972 yılında Kessler ve Wolloch
tarafından tanımlanmış ve granülomatoz reaksiyon yapabilen enfeksiyoz (tüberküloz,
bazı mantar enfeksiyonları) ve non-enfeksiyoz (sarkoidoz, vaskülit) nedenler ekarte
edildikten sonra histopatolojik incelemede granülomatöz inflamasyonun bulunması tanı
kriteri olarak belirtilmiştir (6). İdiyopatik granülamatöz mastit en sık görülen
granülomatöz mastit türüdür. İnsidansı literatürde değişik sıklıkta verilmekle beraber
cerrahi olarak tedavi edilen meme hastalıklarının %3’ünde rastlanıldığı bildirilmiştir
(1). Lokal otoimmun reaksiyon sonucu veya doğuma sekonder reaksiyon sonucu
oluştuğu ileri sürülen bu mastit türüne neden olan belirli bir etken saptanamamıştır.
Klinik tanıda, ağrılı veya ağrısız olarak ele gelen kitle önem taşır. Genellikle genç
kadınlarda, tek taraflı olarak ortaya çıkan bu mastit türünün ultrasonografik ve
mammografik olarak meme kanserini taklit edebildiği bildirilmiştir (1).
2.3.1.3. Meme Apsesi
Apse meme enfeksiyonunun ciddi bir komplikasyonudur; meme parankimi
içinde sınırlayıcı pü koleksiyonudur. Memede fluktuasyon veren kitle şeklinde
karşımıza çıkar. Meme apseleri genellikle gebe ve laktasyon dönemindeki kadınlarda
görülür. Laktasyon dışı dönemde nadiren görülmektedir(1). Meme apseleri laktasyonel
mastit veya non-laktasyonel mastitlerin bir sonucu olarak da gelişebilir. Laktasyon
döneminde ortaya çıkan meme apseleri genellikle travma veya piyojenik mastitin
komplikasyonu olarak ortaya çıkmaktadır(33, 34). Meme apselerinde en sık izole edilen
etkenlerin başında Staphylococcus aureus bildirilmiştir (31). Bunun dışında nadiren de
olsa Escherichia coli etken olarak karşımıza çıkmaktadır (35).
9
2.3.2. Mastitlerin Patogenezi
2.3.2.1. Laktasyonel Mastit Patogenezi
Mastit meme bezinin parenkim enfeksiyonudur. Emziren kadınların %2-10’unda
görülür. Laktasyonun ilk haftalarında süt birikmesi ve sütün dışardan kontaminasyonu
ile epidemik yada sporadik tipte mastit gelişebilir. İlk çocuk, ağır uzamış tek taraflı
meme angorjmanı, zayıf süt drenajı, meme başı çatlağının varlığı mastit için risk
faktörleridir (25). Laktasyonel mastit ilk gebeliklerde ve çoğu zaman emziren annelerde
daha sık görülür. Emzirilen bebeğin burun ve boğaz florası mastite neden olan
mikroorganizmaların kaynağı olarak belirtilmiştir. Bakterilerin meme başındaki bir
çatlak veya küçük sıyrıktan girerek enfeksiyona neden olduğu bildirilmiştir (26).
Annenin otuz yaş üzerinde olması, ilk gebelik, jestasyonel yaşın kırkbir haftanın
üzerinde olması, mastit varlığı laktasyonel mastit için risk faktörleridir (36).
Laktasyonel mastitin primer nedeni süt kanallarının tıkanmasıdır. Bunu takiben
IL-8, IL-2, IL-10, IL-6, TNFα, INFγ gibi sitokinlerin de etkisiyle inflamasyon gelişir ve
mastitin klinik bulguları ortaya çıkar, bakterilerin gelişebileceği uygun ortamın da
oluşmasıyla kliniğe enfeksiyon da eklenir (27, 32). Doğum ardından 10. ile 15. günler
arasında enfeksiyon varlığındamemede hassasiyet, sertlik, ödem, kızarıklık gibi bölgesel
semptomların yanısıra ateş, gibi semptomların da ortaya çıkabileceği gösterilmiştir (37).
Enfeksiyonun memeye hangi yoldan ulaştığı belirsizdir, ancak meme başı çatlağı majör
risk faktörüdür (25). Bebeğin hipofarenksindeki mikroorganizmalar ya da hijyen
kurallarına uymayan annenin meme başı etrafında bulunan mikroorganizmalar meme
başı çatlaklarından süt kanallarına ve lenfatiklere geçerek üreme için uygun ortamı
bulduğu belirtilmiştir (25).
2.3.2.2. Non-laktasyonel Mastitlerin Patogenezi
Periduktal mastit dilate duktuslar etrafında oluşan inflamasyonu tanımlayan
mastittir. Zuska hastalığı, kronik piyojenik mastit, komedomastit gibi isimlerde
verilmiştir. Patofizyolojisinde duktal ektazi ve tekrarlayan apselerin, duktusun kolumnar
epitelinin epidermalizasyonu ve squamoz metaplazi sonucu duktal tıkanma olduğu
düşünülmektedir. Keratin üretimiyle tıkanan kanalda, sekretuar materyal birikimi
dilatasyon yapar, basınç artışı ile epitel rüptürü, ardından periduktal hasar ve keratin
irritasyonu ile inflamasyon gelişir (29). Duktal epidermalizasyonu ve squamoz
metaplaziyi uyaran neden tam bilinmemektedir. Hormonal değişimler (östrojen,
10
prolaktin), vitamin A eksikliği, sigara başlatıcı faktörler olarak bildirilmiştir (4).
Periferal enfeksiyon ise diyabet, romatoid artrit, steroid kullanımı, travma ve karsinom
ile ilişkili olabileceği gibi, genellikle idiyopatiktir. Otuz beş yaşını geçmiş risk faktörü
bulunmayan hastalarda mamografi çekilmesi duktal karsinoma in situ ayrımı için
önerilmektedir. Etken Staphylococcus aureus, streptokoklar, bazen anaeroplardır (31).
Granülomatöz mastitte memenin inflamatuar lezyonları genellikle nadirdir.
Çoğunlukla postpartum dönemde veya laktasyonun başlangıcında görülür. Dilate olan
kanallardaki süt akımının yavaşlaması enfeksiyon için predispozandır. Her ne kadar
kesin nedeni bilinmese de subareolar kanal ektazisi ve majör duktusların
obstrüksiyonunun bakteriyel proliferasyona ve takibinde apse oluşumuna yol
açabileceği ileri sürülmüştür (38).
Akut inflamasyon, yaralanma, mikroorganizma veya diğer yabancı maddelere
karşı hızlı bir şekilde oluşan lökosit ve plazma hücre cevabı ile oluşur. Etken
uzaklaştırıldıktan sonra geride nekrotik doku kalır. İnflamasyona neden olan etkenin
dirençli olması ya da normal iyileşme süreci olarak akut cevap ile çözülememesi ile
akut inflamasyon zaman içerisinde kronik inflamasyona dönüşebilir. Kronik
inflamasyon, haftalar, aylar veya yıllar içerisinde devam eden ve akut inflamasyondan
farklı olarak makrofaj, lenfosit ve plazma hücrelerini içeren mononükleer hücre
infiltrasyonu ile karakterizedir (32).
Granülomatöz inflamasyon aktive olmuş makrofajların agregatlar haline
gelmesiyle oluşan özel bir kronik inflamasyondur. Granülomlar dirençli inflamasyon
halinde T hücrelerinin uzun süreli makrofajları uyarması sonucu oluşur. Elimine
edilmeye dirençli durumlarda granülom oluşumu ile inflamasyon alanı sınırlandırılmaya
çalışılır. Çoğu zaman granülom oluşumu tüberküloz gibi hastalıklarda organ
disfonksiyonuna yol açmaktadır (38).
Etiyolojisi net olarak bilinmeyen granülomatöz mastit non-kazeöz granülomlarla
karekterize, nekroz, dev hücre fomasyonu, nötrofil infiltrasyonunun görüldüğü, meme
dokusunda lokalize bir immün reaksiyon olarak başlamaktadır. Oluşum mekanizması
dikkate alındığında etiyolojik faktör olarak oral kontraseptiflere karşı oluşan kimyasal
reaksiyon, otoimmünite, duktuslarda artan kimyasal sekresyonlara karşı lokal reaksiyon
ve hormonal dengesizlikler gibi etkenler suçlanmaktadır (39, 40). Hastalığın
patofizyolojisinde otoimmun hipotezler günümüzde yaygın olarak kabul edilmektedir.
Duktal epitel hasarıdan oluşan proteinden zengin sekresyonun çevre yağ dokusuna ve
11
lobuler konnektiv dokuya geçmesi ile lenfosit ve makrofaj migrasyonu sonucu
granülomatöz reaksiyon oluştuğu düşünülmektedir. Laktasyon, lokal travma ya da diğer
enfeksiyonlar bunu tetikleyebilmektedir. Yapılan immunohistokimyasal çalışmalarda T
hücre varlığı gösterilmiştir (38).
Gram pozitif basil olan Coryneabacterium cinsleri ile GM arasında olası bir
ilişki düşünülmektedir. Korinebakterilerin histolojik olarak zor gösterilmesi ve
genellikle normal cilt florası ile kontaminasyon düşündürmesi nedeniyle etyolojide çok
fazla incelenmemiştir (41, 42).
2.3.2.3. Meme Apseleri Patogenezi
Cerrahi enfeksiyonların oluşumu için doğal savunma engeli olan deri-mukoza
epitel devamlılığının bozulması, enfeksiyon etkenlerinin bulaşması ve potansiyel
virülansın aktif hale geçmesi, bir diğer deyişle, saldırı-savunma dengesinin saldıran
lehine bozulması gerekmektedir. Böyle bir durumda, enfeksiyon etkenlerinin sayısı ve
virülansı yani kontaminasyon karşısında vücudun doğal dengesinin yenik düşmesi söz
konusudur (43).
Apseler ayrıca sebase kist, hidradenitis supüritiva gibi kutanöz lezyonlara ikincil
olarak da gelişebilir. Bu apse tipleri cilt lezyonlarının varlığı ile ayırt edilebilir. Meme
apseleri genellikle gebe ve laktasyon dönemindeki kadınların hastalığıdır. Laktasyon
dışı dönemde nadiren görülmektedir (31).
2.3.3. Mastit Etiyolojisinde Rol Alan Bakteriler
Laktasyonel mastitlerde en sık rastlanılan etken Staphylococcus aureus’tur
(MRSA dahil), Streptokok ve Staphylococcus epidermidis de günümüzde sıkça ortaya
çıkan etkenlerdendir (26). Güncel verilerin ışığında enfeksiyöz bakteriyel mastitlerin
etiyolojisinde genellikle stafilokok, streptokok ve/veya Corynebacterium türlerinin rol
oynadığı gösterilmiştir (5, 32). Bunun dışında enfeksiyöz mastit olarak da kabul edilen
laktasyonel mastitte başta Bacteroides spp. ve Propionibacterium spp. olmak üzere
anaerop bakterilerin de etkenler arasında yer alabileceği gösterilmiştir (37).
Non-laktasyonel periferal enfeksiyonlarda etken Staphylococcus aureus,
streptokoklar ve bazen de anaeroplardır. Non-laktasyonel mastitin en sık rastlanılan
türü olan granülomatöz mastitte ise etiyolojik rolü olan bakteriler tam olarak
bilinmemektedir.
Escherichia
coli,
Araştırmalarda
başta
Bifidobakteriler,
Corynebacterium
peptostreptokoklar,
türleri
olmak
Clostridium
üzere,
türleri
ve
12
Propionibacterium acnes etkenler arasında gösterilmiştir (4). Spesifik granülomatöz
mastitlerde ise olası bakteriyel etkenler Mycobacterium tuberculosis,Salmonella typhi,
Brucella spp., Mycobacterium leprae olarak sıralanmıştır (4).
Meme apselerinde ise Staphylococcus aureus en sık rastlanılan etken olarak
bildirilmiştir. Bunu takiben Staphlococcus epidermidis, Escherichia coli gibi aerob ve
Bacteroides fragilis, Peptostreptokoklar, Propionibacterium acnes gibi anaerop
bakteriler meme apselerinden izole edilmiştir (44).
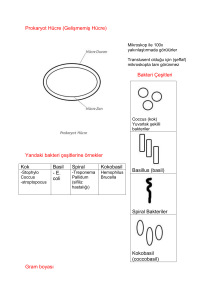
Staphylococcus cinsi
Stafilokok cinsi bakteriler Micrococcaceaefamilyası içinde yer almaktadır.
Düzensiz üzüm salkımına benzer kümeler, bazen 3-5 koktan ibaret veya ikişerli gruplar
oluşturan, tüm hücreleri birbirine benzerlik gösteren, sporsuz, hareketsiz ve kapsülsüz
Gram pozitif koklardır(45).Tüm stafilokoklar ve mikrokoklar özellikle glikozlu
besiyerlerinde katalaz pozitiftirler. Stafilokoklar klinik mikrobiyoloji laboratuvarlarında
primer
olarak
koagülaz
enzimi
üretip
üretmemelerine
göre
sınıflandırılırlar
(45).Koagülaz pozitif stafilokoklar ve Staphylococcus aureus dışındaki tüm stafilokok
türleri genel olarak koagülaz negatif stafilokoklar adı altında toplanmaktadır. Bazı
kökenlerinde belirgin bir kapsül veya mukus katmanı oluşur. Stafilokoklar başta glikoz
olmak üzere birçok karbonhidratları fermentatif olarak parçalarlar ve son ürün olarak
laktik asit yaparlar. Gaz oluşturmazlar. Mannitole etkileri değişken olup özellikle S.
aureus bu şekere etkilidir. Diğerlerinin etkisi değişkendir. Stafilokoklar başta burun
mukozası, nazofarinks, deri ve daha az olmak üzere bağırsak ve diğer mukozaların
normal floralarında bulunan bakterilerdir (45).Staphylococcus aureus özellikle
laktasyon döneminde görülen mastit türlerinde olmak üzere tüm mastit türlerinde en sık
izole edilen etkendir (4).
Streptococcus cinsi
Streptokok cinsi bakteriler Streptocococcaceae familyası içinde yer almaktadır.
Yuvarlak veya oval şekilli, tek tek, ikişer ikişer bir arada bulunan veya kısa-uzun zincir
teşkil eden, Gram pozitif, katalaz negatif, kok şeklinde mikroorganizmalardır.
Streptokoklar kanlı agardaki hemolizlerine göre sınıflandırılmışlardır (45).Ağız, boğaz,
burun ve diğer mukozal alanlar yanı sıra deri ile sindirim ve genital sistemin normal
florasında bulunabilen streptokoklar, insanlarda çok çeşitli enfeksiyonlar da meydana
getirmektedirler. Streptokokkal farenjit, impetigo, bakteriyel endokardit ve idrar yolu
13
enfeksiyonları, deri ve derialtı enfeksiyonları, apseler yanında akut romatizmal ateş,
romatizmal kalp hastalığı ve akut glomerulonefrit gibi çok ciddi postenfeksiyöz
sendromlara yol açmaktadırlar. Streptokokların çoğu aerob veya fakültatif anaerob iken
bir kısmı zorunlu anaeroptur (Peptostreptococcus spp.) (45). Streptokoklar genellikle
hayvanlarda mastit etkeni olmakla beraber insanlarda da meme enfeksiyonlarında da
primer veya sekonder etken olarak izole edilmiştir (31).
Corynebacterium cinsi
Korinebakteriler Gram pozitif, aerob, hareketsiz, çomak şeklinde olup, katalaz
enzimine sahiptirler ve normal uygun gelişme koşullarında düzensiz şekilli, golf sopası
veya V-şeklinde karakteristik düzenlemeleri gösteren mikroorganizmalardır. V-şekilli
hücre grupları, hücre bölünmesinin hemen sonrasında kırılma hareketi sonucu meydana
gelmektedir. Kırılarak bölünme, hücre duvarının iki tabakadan oluşmasından
kaynaklanmaktadır; yalnızca içteki tabaka çapraz-duvar oluşumuna katılır, böylece
çapraz-duvar oluşumu tamamlandıktan sonra hücre duvarının dıştaki tabakasına
tutunmuş iki yeni hücre oluşur. Hücre duvarının dış tabakasındaki kırılma ile kırılan
kısımdan itibaren iki hücre birbirinden uzaklaşır ve bu şekilde V-şekilli formlar oluşur
(46).
Korinebakterilerdeki
ana
cinsler
Corynebacterium
ve
Arthrobacter’dir.
Corynebacterium cinsi hayvan ve bitkilerde patojen olan, aynı zamanda saprofit çok
çeşitli bakteri gruplarını bulundurur. C. diphteriae, C.ulcerans, C. equi, C. ovis,
C.haemolyticum gibi bazı türler patojendir. Korinebakterilerin bazı üyeleri gelişim
süreçlerinde kok veya pleomorfik olabilirler, bakterilerin genellikle uç kısımları şişkin
hücrelerdir, bu onlara golf sopası şeklinde bir görüntü verir (cins adı olan koryne
Yunanca ‘sopa’ anlamındadır) (46). Korinebakterlerin patojen türleri apse oluşumunda
önemli rol oynamakta bu nedenle mastitlerde de sıklıkla karşımıza çıkmaktadır.
Özellikle non-laktasyonel granülomatöz mastitlerde sıklıkla izole edilmektedir (6).
Klebsiella cinsi
Gram negatif, sporsuz, kapsüllü, hareketsiz ve çomak şeklinde bakterilerdir.
Besiyerlerinde mukoid koloniler yaparlar. O ve K antijenlerine göre ayrılırlar.
Klebsiella cinsinin besiyerlerinde kolay üremesi, spesifik koloni biçimi, hareketsiz
olması ve laktozu parçalama özelliği nedeniyle bakteriyolojik tanısı kolaydır. Bağışık
serumlar sayesinde kapsül şişme deneyi ile tipi de kolayca tayin edilebilir ve bu hastane
14
enfeksiyonlarının izlenmesinde faydalı olabilir. K. pneumoniae, K. oxytoca, K. ozaenae,
K. granulomatis gibi patojen türler insanda bronşit, bronkopnömoni, otitis media,
mastoidit, sinüzit, beyin ve diğer dokularda apseler, menenjit, plevra-perikard-peritonprostat-safra yolu iltihapları, septisemi, idrar yolu enfeksiyonları ve mastite neden
olabilmektedir (47).
Escherichia cinsi
Escherichia cinsi üyeleri evrensel olarak insan ve sıcakkanlı hayvanların
bağırsak kanalında bulunmakla birlikte bu habitatlardaki baskın organizmalar değildir.
Gram negatif çomak şeklinde, hareketli, glikoz, laktoz ve sukrozu fermente edebilen
bakterilerdir. Bağırsak kanalında Escherichia cinsi üyeleri tarafından sentezlenen
vitaminler ve özellikle de K vitamini beslenmede önemli rol oynar. Escherichia suşları
şekerler, amino asitler, organik asitler ve diğer çok çeşitli karbon ve enerji kaynakları
üzerinde gelişebilmektedirler (46).
Bazı Escherichia suşları patojendir. Bu suşlar bebeklik çağındaki çocuklarda
ishale neden olur. Bu tip ishal vakalarıçocuk yuvalarında ve doğum koğuşlarında
sıklıkla epidemik boyuta ulaşabilir. Escherichia, yaşlılarda ve cerrahi operasyon
geçirdiği ya da iyonizan radyasyona maruz kaldığı için bağışıklığı baskılanmış
bireylerde idrar yolu enfeksiyonlarına da neden olabilir. Enteropatojenik E.coli suşları
sıklıkla dizanteri benzeri enfeksiyonlara ve ateşin yükselmesine neden olur. Bu suşlar,
ince bağırsağa yapışıp kolonize olmalarını sağlayan K antijeni ve ishal belirtilerinden
sorumlu olan enterotoksin oluştururlar (46). Bunun dışında nadiren de olsa laktasyon
dışı dönemde meme apselerinden izole edilebilmektedirler (35).
Proteus cinsi
Proteus cinsindeki bakteriler pleomorfik, Gram negatif, sporsuz, kapsülsüz ve
hareketli bakterilerdir. Genel olarak insan barsak florasında, lağım sularında, kokmuş
organik maddelerde ve kirli sularda bulunurlar. Enterobacteriaceae ailesinde yer alırlar
(45). Proteus cinsi bakteriler özellikle üriner sistem infeksiyonları başta olmak üzere
yara enfeksiyonları, organ apseleri, pnömoni, septisemi olgularından sıklıkla ve nadiren
mastitlerden izole edilirler. Tek başlarına veya başka bakterilerle birlikte hastane
infeksiyonlarına
sebep
olabilirler.
Proteus
bakterilerinin
de
dahil
olduğu
Enterobactericeae ailesinde yer alan bakterilerde geniş spektrumlu beta-laktamlar,
15
florokinolonlar ve aminoglikozidleri kapsayan çoğu antimikrobiyale direnç gelişimi
önemli bir problemdir (46).
Propionibacteriumcinsi
Propionibacterium cinsi bakteriler Propionibacteriaceae ailesi içinde yer
almaktadır. Propionibakteriler geç üreyen, sporsuz, Gram pozitif, anaerobik
bakterilerdir. Çomak şeklinde veya dallanmış, tek tek, çiftler halinde veya grup halinde
görülebilirler. Glukozdan propionik asit, laktik asit ve asetik asit üretirler. Gram pozitif
hücre duvarları bakteriye yapısal kararlılık kazandırarak, kuruluğa, osmotik basınca ve
mekanik strese karşı dirençli olmalarını sağlar(45).Propionibacterium cinsi bakteriler
genellikle patojen değildirler bununla birlikte, kan kültürü ve vücut sıvılarında
kotaminant olarak üreyebilirler ve başta akne vulgaris olmak üzere birçok enfeksiyona
yol açabilirler. Propionibacterium cinsinde bulunan P.acnes anaerop ya da aerotoleran
olabilen hareketsiz, sporsuz, Gram pozitif, pleomorfik bir çomaktır. Bu bakteri, deri,
ağız, nazofarenks, gastrointestinal sistem, ürogenital sistem ve konjonktivanın normal
florasında yer almaktadır. P.acnes kan kültürlerinden sıklıkla kontaminant olarak
üretilmektedir. Bunun dışında P. acnes ve P. granulosum gibi patojen türler korneal
apselere, kalp kapaklarında ve prostetik kalp kapaklarında apselere, memede apse
oluşumlarına neden olmaktadır (48).
Bacteroides cinsi
Bacteroides cinsi, zorunlu anaerobik, sporlanmayan sakkarolitik, şeker ya da
proteinleri fermente ederek türe bağlı olarak asetat ve süksinatı son ürün olarak
oluşturan türleri içerir. Bacteroides normalde kommensal olarak insan ve diğer
hayvanlarda bulunur. Aslında Bacteroides türleri insan kalın bağırsağında sayı olarak
baskın olup, yapılan ölçümlerle insan dışkısının bir gramında 1010 kadar hücrenin varlığı
gösterilmiştir (46). Bacteroides türleri, sifingolipidleri sentezleyen çok az birkaç
gruptan biridir. Sifingolipidler, gliserol yerine uzun-zincirli amino grup alkol
sifingozinin yer aldığı lipidlerin heterojen toplamıdır. Sifingolipidler, sifingomiyelin,
serebrositler ve gangliyositler gibi, memelilerin özellikle beyin ve diğer sinir
dokularında yaygın olarak bulunurlar (46).
Bacteroides cinsi safraya dirençli ve duyarlı olanlar şeklinde iki gruba ayrılır.
%20 oranında safraya dirençli olanlar Bacteroides fragilis grubu olarak tanımlanır ve
kanamisin, vankomisin ve kolistin tanı disklerine dirençlidirler. Gram boyamada soluk,
16
düzensiz boyanma özelliğindedirler. B.fragilis karaciğer, akciğer ve beyin apseleri
yapabilir. Anaerop bakteriyemilerin %70’inden sorumlu olan bu bakterinin nonlaktasyonel mastitli hastaların apselerinden de izole edildiğini belirten kaynaklar
bulunmaktadır (4, 44, 49).
Clostridium cinsi
Clostridium cinsinde bulunan bakteriler sporlu, iri veya irice, düz veya hafif
bükük, bazen limon, lobut ve iğ şeklinde zorunlu anaerop çomakcıklardır. Bunlar Gram
pozitif ve genellikle hareketli bakterilerdir. Sporlar genellikle hücreden daha geniştir, ya
içte uca yakın veya uçta olurlar (50).
Clostridium türleri toprakta, suda ayrıca C. perfringens ve C. sporogene gibi
bazıları insan ve hayvanların bağırsaklarında bulunur. Bu türler ölüm sonrası kan ve
dokuları sarar ve Proteus’larla birlikte ölünün kokuşmasına ve parçalanmasına neden
olurlar (50). Clostridium türleri canlı dokuda çoğalmazlar, fakat ölü dokuya yerleşince
ürer ve saldıkları toksinlerle hastalığa neden olurlar. Clostridium türleri vücut direncinin
kırıldığı hallerde bulundukları bağırsak boşluğu ve diğer yerlerden dokulara geçerek
endojen enfeksiyonlara yol açarlar (50).
Clostridium bakterileri bakteriyemi ve sepsis yaptıkları gibi deride ve yumuşak
dokularda irin yapan enfeksiyonlar, anaerobik selülit, perirektal apse, diyabetlilerin
yatak ülserleri, bası yaraları, konjonktüvit, gazlı gangren veya miyonekroz da yaparlar.
C. perfringens hayvanlarda ve insanlarda mastite neden olmaktadır (50).
Bakterilerde antimikrobiyal direncin giderek yaygınlaştığı ve gerek bakterinin
direnç profili gerekse biyofilm oluşturma özelliği nedeni ile tedavide güçlükler
yaşandığı birçok kaynakta belirtilmektedir. Mastit etiyolojisinde rol oynayan tüberküloz
dışı bakterilerin de antimikrobiyal direnç durumları hakkında bilgi sahibi olunması yeni
tedavi seçeneklerinin belirlenmesi bakımından büyük önem taşımaktadır (51, 52).
2.4. Biyofilm
Biyofilm, canlı veya cansız bir yüzeye yapışarak kendi ürettikleri organik bir
ekzopolisakkarid matriks içine gömülü ve hareketsiz olarak birbirine, bir katı yüzeye
veya
bir
ara
yüzeye
geri
dönüşümsüz
olarak
tutunmuş
halde
yaşayan
mikroorganizmaların oluşturduğu topluluktur (52). Biyofilm, insan vücudunda
kateterler, kontakt lensler, protez kalp kapakçıkları ve kalp pilleri, rahim içi araçlar,
böbrek taşı, akciğer dokusu, meme dokusu gibi canlı ve cansız birçok yüzeyde
17
bulunabilir (51). Tıbbi uygulamalarda girişimsel tekniklerin ve kalıcı tıbbi araçların
kullanımının artışı biyofilm enfeksiyonlarının da artışına neden olmuştur. Kalıcı tıbbi
araçlar üzerinde gelişen biyofilmler Gram pozitif ve/veya Gram negatif bakteriler
ve/veya mayalardan oluşur (52). Biyofilmde yer alan mikroorganizmalar antimikrobiyal
ajanlara, planktonik şekillerine göre 200-500 kat daha dirençlidir (53).Biyofilm ortamı
sadece antibiyotiklere karşı değil, dezenfektanlara karşı da direnç gelişmesinde rol
oynamaktadır. Biyofilm tabakası içindeki bakteriler sıvı ortamda serbest üreyen
bakterilere göre, dezenfektanlara 10-100 kat daha dirençlidir. Biyofilm üreten bakteriler
antiseptik solüsyonlar içinde uzun süre canlı kalabilmektedir. Dezenfektanlara dirençli
biyofilm üreten kökenlerin yol açtığı salgınlar bildirilmiştir (54). Biyofilm hücrelerinin
kendi
aralarındaki
etkileşimlerisonucunda
genetik
yapılarında
değişiklikler
gözükmektedirve biyofilmler ekstrakromozomal DNA değişimleri için ideal ortamlar
oluşturur.
Direnç
plazmidlerininaktarılması
sayesinde
genetik
yapısı
değişen
hücrelerantimikrobiyal ajanlara karşı daha fazla direnç geliştirmişolurlar (55).
Staphylococcus aureus veStaphylococcus epidermidis’in temel etiyolojik
etkenler olarak kabul edildiği laktasyonel mastitte, antibiyotik tedavisine istenilen
yanıtın alınamaması, bu iki stafilokok türünde görülen çoklu antibiyotik direnci ve
biyofilm oluşturabilme özellikleri ile de ilişkilendirilmiştir (1).
2.5. Bakteri Tanımlaması
Günümüzde teknolojik ilerlemelerle birlikte bakteri tanımlamasında kullanılan
yöntemler hızla gelişmektedir. Konvansiyonel yöntemler tamamen terk edilmemekle
birlikte çoğunlukla yarı otomatize ya da otomatize sistemlerle hatta daha da ileri giderek
moleküler yöntemlerle bakterilerin tanımlamasına gidildiği görülmektedir.
2.5.1. Konvansiyonel Yöntemlerle Tanı
Konvansiyonel yöntemler bakterinin fenotipik ve biyokimyasal özelliklerine
göre bakterinin tanımlanmasını amaçlamaktadır. Mikrobiyoloji laboratuvarında bakteri
tanımlanmasında konvansiyonel yöntem olarak mikroskobi, kültür ve serolojik tanı
yöntemleri kullanılmakta ayrıca moleküler yöntemlerle de tanıya gidilebilmektedir.
18
Mikroskopi
Bu yöntemde, mikroorganizmaların büyütülerek gözle görülebilmesi ve
ayrıntıların incelenebilmesi amaçlanmıştır. Mikroskobik incelemelerde aydınlatma, ışık
kaynağı ya da elektron yığınları aracılığı ile sağlanmaktadır. İstenen incelemenin
özelliğine göre aerop ve anaerop bakterilerin incelenmesinde genellikle ışık
mikroskopları kullanılmaktadır (56).
Klinik mikrobiyolojide mikroskopi örneklerin değerlendirilmesi aşamasında en
temel yöntemlerin başında gelmektedir. Bu yöntem faydalı ve çabuk bilgiler
sağlayabilir. Mikroskobik incelemelerde çeşitli boyama yöntemleri kullanılmakta ve
bunların başında Gram boyama yöntemi gelmektedir. Hazırlanan ve Gram yöntemiyle
boyanan preparatlar önce küçük büyütme ile incelenmeli, hücre dağılımı ve oranları
konusunda fikir edinilmeli ve özellikle araştırılacak alanlar böylece belirlenmelidir.
Örneğin bir apse örneğinde yoğun lökosit kümelerinin belirlendiği alanlar daha özenle
taranmalıdır. Gram incelemelerde bakterilerin morfoloji ve boyutları da belirlenebilir ve
boyanma özelliklerine ek olarak şekil özellikleri de belirlenerek ileri tanımlayıcı
işlemler yapılır ayrıca kültür sonuçları buna göre yorumlanır (57).
Kültür
Aerop ve anaerop bakterilere ait özelliklerin incelenebilmesi, metabolik
aktiviteleri
sonucu
oluşan
ürünlerin
belirlenebilmesi
ve
bu
ürünlere
göre
tanımlanabilmeleri için üretilmeleri gerekmektedir. In vitro koşullarda saf kültür
şeklinde üretim besiyerlerinde mümkün olabilmektedir. Bakterilerin üreyebilmesi için
gereksinim duydukları maddeleri içeren ortamlarda yalnızca tek türe ait bir
mikroorganizmanın üretilebilmesi sonucu o mikroorganizmanın saf kültürü elde edilir
(50). Aerop bakterlerin üretilebilmesi için genelde %5 oranında katılan koyun kanı ile
zenginleştirilmiş genel üretim besiyerlerinden olan, koyun kanlı agar, çukulatamsı agar
ve seçerek üretici bir besiyeri olan MacConkey agar tercih edilmektedir. Bakteri
tanımlamasında tanıtıcı besiyeri olarak başta üç şekerli demirli agar (TSI) besiyeri
olmak üzere hareket besiyeri, üre besiyeri gibi aranan özelliğe spesifik olan pek çok
besiyeri kullanılabilmektedir (50). Anaerop bakterilerin üretilmesi ve tanımlanması için
ise seçerek üretici besiyerleri olan kanlı, kanamisin-vankomisinli anaerop agar, kanlı,
fenil etil alkollü anaerop agar, kanlı anaerop agar ve zenginlestirilmiş tiyoglikolatlı sıvı
19
besiyerleri kullanılmaktadır. Aerop ve anaerop bakterilerin üretilmeleri için uygun
atmosferin sağlanmasına özen gösterilmektedir (50).
Seroloji
Mikrobiyoloji laboratuvarında bakteri tanımlanmasında mikroskopi ve kültür
yöntemlerinin yanı sıra hasta serumunda etkene özgül bağışık yanıtın belirlenmesine
dayanan bir yöntem olan seroloji de kullanılmaktadır. Hasta serumunda etkene özgü
bağışık yanıtın belirlenmesi, immün sistemin hücreleriyle gerçekleşmektedir. İmmün
sistem yanıtının belirlenmesinde kullanılan temel hücreler antijene karşı gelişen
antikorlardır.
Serolojik
testler;
enfeksiyon
hastalıklarının
tanısında,
bilinen
mikroorganizmaya özgün antijenlerin kullanılmasıyla hasta serumundaki antikorların
saptanmasında, bilinen antikorlar içeren bağışık serumların kullanılarak hasta
materyalindeki mikroorganizma antijenlerinin belirlenmesinde, kişinin bağışıklık
durumunun saptanmasında ve etken olan mikroorganizmanın serogrup, serotip,
immünotipinin saptanmasında kullanılmaktadır. Klinik mikrobiyolojide immünolojik
tanıda; antijen antikor reaksiyonları ile tanımlama, monoklonal antikorlarla tanımlama,
katı faz immünoassey yöntemleri ve immünofloresans teknikleri ile tanımlama şeklinde
4 temel yöntem kullanılmaktadır (58).
2.5.2. Yarı -Otomatize Yöntemlerle Tanı
Bakterilerin tanımlanmasında API kitleri
Mikrobiyoloji
laboratuvarında
bakterilerin
konvansiyonel
yöntemlerle
tanımlanmasında kullanılan geleneksel biyokimyasal testlerde yoğun işgücü, yüksek
miktarda ayıraç ve besiyeri tüketilmektedir. Bundan kaçınmak için minyatürize
biyokimyasal yöntemler geliştirilmiştir. Son yıllarda API kitleri aerop ve anaerop
bakterilerin tanımlanmasında sıklıkla kullanılmaktadır. Kitler
(bioMerieux, Marcy
l’Etoile, France) özel olarak hazırlanmış bir veritabanı ile birlikte standartlaştırılmış ve
minyatür hale getirilmiş biyokimyasal testler kullanarak hazırlanmış bir tanımlama
sistemidir. Dehidrate test maddelerini içeren 20 mikrotüp içeren bir stripten oluşmuştur.
Bu mikrotüpler, özel medyumu ile hazırlanmış bir bakteri süspansiyonu ile ekilir.
İnkübasyon sırasında, enzim substrat reaksiyonları sonucunda oluşan değişiklikler,
kendiliğinden veya ilave testler sonucunda oluşan renk değişikliği ile görülür hale gelir.
Bu reaksiyonlar okuma tablosuna göre okunur ve analitik profil indeksi veya bilgisayar
tanımla programı ile tanımlanır(59).
20
2.5.3. Otomatize Sistemlerle Tanı
Bakterilerin Tanımlanmasında VITEK, PHOENIX yöntemleri
Otomatize yöntemlerle tanı, yarı otomatize yöntemlerle bakteri tanımlanmasında
olduğu gibi yoğun işgücü, yüksek miktarda ayıraç ve besiyeri tüketiminden kaçınmak
için geliştirilmiştir. Bu tip minyatürize biyokimyasal yöntemlerde dehidrate ayıraçlar
veya kullanıma hazır besiyerleri kullanılmktadır. Bu yöntemler, pleytlerde hazır
bulunan sıvı veya katı besyerlerine saf kültürlerin inoküle edilip inkübe edilmesi ve
enzim-substrat ilişkisine bağlı oluşan renk değişimleri veya gaz oluşumuyla bakterilerin
belirlenmesini esas almaktadır. Son yıllarda tam otomatize tanı yöntemlerinden olan
VITEK ve PHOENIX yöntemi aerop ve anaerop bakterilerin tanımlanmasında sıklıkla
kullanılmaktadır (60).
2.5.4. Moleküler Yöntemlerle Tanı
Başta tıp olmak üzere moleküler teknikler, hızlı sonuç vermeleri ve özgüllükleri
nedeni ile pek çok alanda kullanılmaktadır. Enfeksiyon hastalıklarında moleküler
tekniklerin kullanıma girmesiyle, etkeni üretilemeyen ya da geç üreyen mastit gibi pek
çok hastalığın etkenleri tespit edilmiştir. Bunun dışında, bakteriyel enfeksiyonlarda
etkenlerin tanımlanıp direnç haritalarının belirlenmesinde de moleküler yöntemler
kullanılabilmektedir. Enfeksiyon hastalıklarının moleküler tanısında kullanılan başlıca
teknikler; nükleik asit probları ile tanı, amplifikasyon teknikleri ile tanı ve DNA dizi
analizi ile tanıdır (61). Nükleik asit probları ile tanıda; tanımlanmak istenen nükleik asit
bölgesini tamamlayıcı olan ve belirleyici olarak kullanılan tek iplikli, özgün ‘’prob’’ adı
verilen nükleik asit parçaları kullanılmaktadır. Bu problar, enzim, radyoizotop gibi
maddelerle işaretlenerek tamamlayıcı oldukları nükleik asit dizileriyle hibridize
olmaktadır. Ancak bu yöntem apse gibi klinik örneklere sık uygulanmamaktadır.
Amplifikasyon teknikleri ile tanıda, yöntem direkt olarak klinik örnekte var olan bir
nükleik asit bölgesinin çoğaltılmasına dayanır. Kültürün zor olduğu durumlarda
özellikle tercih edilir. DNA dizi analizi yönteminde ise DNA’nın nükleotid dizilerinin
saptanması esas alınmıştır. Bu yöntem dizi analizi yapılacak DNA’nın hazırlanması,
reaksiyonlar ve yüksek voltaj jel elektroforezi olmak üzere üç ana aşamadan
oluşmaktadır. DNA dizi analizi ilaç dirençlerine neden olan mutasyonların
saptanmasında da moleküler altın standart olarak kabul edilmektedir (61).
21
2.5.4.1. 16S rRNA Analizi
16S rRNA gen bölgesi filogenetik ilişkinin belirlenmesinde ve bakteriyal
tanımlama çalışmalarında yaygın olarak kullanılmaktadır. 16S rRNA gen bölgesi
RNA’nın bir alt birimi olup toplam uzunluğu yaklaşık 1540 nükleotittir. Yüksek oranda
korunmuş bölgeleri içeren 16S rRNA gen bölgesi tüm türlerin tanımlanmasında oldukça
yararlıdır ve bu bölgeler türe spesifiktir (62). Korunmuş bölgeler yavaş evrimleştikleri
için taksonomik karşılaştırmaları sağlayacak verileri içermektedir. 16S rRNA sekans
verileri gen bankalarında biriktirilmekte ve ihtiyaç duyulduğunda bu veriler gen
bankalarından kolaylıkla elde edilebilmektedir (62, 63, 64).
16S rRNA dizisinde saptanan bir farklılığın %3’ten fazla olması yeni bir tür
olarak yorumlanabilmektedir. Bunu destekleyen en önemli veri, 16S rRNA dizisinde
%97’den az benzerlik gösteren iki prokaryotun genomik DNA’larının genelde %70’ten
az hibridize olduğudur (65, 66, 67). 16S rRNA dizisi, cinsler ve doğru kararlaştırılmış
türler arasında ilişki kurmak ve onları birbirlerinden ayırt etmek için kullanılmaktadır.
Ancak son dönemde yapılan bazı çalışmalar sadece 16S rRNA gen bölgesinin yeni bir
türü belirlemek için yeterli olamayabileceğini de göstermiştir (68).
16S rRNA gen sekansları, fizyolojik testler ve DNA-DNA hibridizasyon (DDH)
analizlerinde, cins içerisindeki türlerin filogenetik olarak sınıflandırılmasında kullanılan
başlıca metodlardır. 16S rRNA gen analizleri ve DNA-DNA hibridizasyonu, modern
bakteriyal taksonominin “altın standardı” olmalarına rağmen bazı dezavantajları da
olduğu bilinmektedir. 16S rRNA molekülünün yüksek oranda korunmuş yapısı
bakterilerin cins seviyesinde ve cins içindeki türlerin %98,7 sekans benzerliğinin
üzerindeki değerlerle ayrımında oldukça faydalı olduğu halde, 16S rRNA gen sekans
karşılaştırmaları çok yakın ilişkili türler arasında kesin bir ayırım için yeterli
olamayabilmektedir (68, 69, 70).
2.6. Antimikrobiyal Duyarlılık Testleri
Antibiyotikler
mikroorganizma
türleri
tarafından
sentezlenen
ve
diğer
mikroorganizmaları öldüren ya da üremelerini durduran doğal maddelerdir. Geçmişte
sentetik olarak üretilen benzer etkideki maddelere kemoteröpetik adı verilmiş olsa da,
günümüzde üretilen antibiyotiklerin de sentetik olması nedeniyle ‘antibiyotik’ tanımı
tümünü kapsamaktadır (47). Günümüz mikrobiyoloji uygulamalarında bir bakterinin
tanımlanması ne kadar önemli ise, o bakterinin antibiyotiklere olan direncinin
22
öğrenilmesi de aynı derecede önem kazanmıştır. Bakterilerde antibiyotik direnci,
antibiyotik kullanımını takiben başlamış ve günümüzde oldukça önemli bir sorun haline
gelmiştir. Bu sorun günümüzde, var olan tüm antibiyotiklere dirençli bakterilerle
gelişen enfeksiyonlara neden olmaktadır. Yetersiz doz ve sürede uygulanan antibiyotik
tedavisi ve kullanılan uygunsuz antibiyotikler, dirençli suşların ortamda çoğalması ve
yayılması açısından büyük öneme sahiptirler. Antibiyotik direnci doğal ya da
kazanılmış olabilir (47).
Mikrobiyoloji laboratuvarında bakterilerin antimikrobiyal duyarlılığı/direnci
çeşitli yöntemlerle test edilebilir.
Disk Difüzyon Yöntemi
Bu test antibiyotiklerin bakterilere karşı etkinliklerini saptamada en yaygın
şekilde kullanılan ve uygulaması en kolay olan testtir. Test belirlenmiş yoğunluktaki
bakteri süspansiyonunun yayıldığı besiyeri yüzeyine standart miktarda antibiyotik
emdirilmiş disklerin konulması ile uygulanır. 37 °C’de 24 saatlik inkübasyon sırasında
antibiyotik agar içinde giderek azalan gradyent oluşturacak şekilde difüze olurken
bakteriler de üremektedir. Sonuç olarak, antibiyotik diski etrafında bakterilerin
üreyemediği bir zon oluşur ve bu zona inhibisyon zonu adı verilir. Testin sonucunda
elde edilen zon çapı değerleri uluslararası geçerli kılavuzlarda belirtilen değerlerden
büyükse bakteri antibiyotiğe duyarlı küçükse dirençli olarak yorumlanır. İki değer
arasında kalan sonuçlar orta duyarlı olarak verilir. Bu yöntemle Petri kutusunda
bakterinin birçok antibiyotiğe karşı duyarlılığı belirlenebilmektedir (47).
Dilüsyon Testleri
Bu yöntemle, bakterilerin üremesini durduran en küçük değer (minimal inhibitör
konsantrasyon: MİK) ya da bakteriyi öldüren en küçük değer (minimal bakterisidal
konsantrasyon: MBK) saptanır. Test, sıvı veya katı besiyerlerinde yapılabilir. Sıvı
dilüsyon testlerinin uygulaması için antibiyotiğin belirli oranlarda dilüsyonları
hazırlanır ve tüplere dağıtılır. İşlemler steril koşullarda gerçekleştirilmelidir. Daha sonra
hazırlanan 105 bakteri/mL içeren süspansiyondan eşit hacimde her tüpe dağıtılır. Pozitif
kontrol için hiç antibiyotik içermeyen besiyerine de ekim yapılır ve negatif kontrol için
bir adet bakteri eklenmemiş antibiyotik süspansiyonu da inkübasyona kaldırılır. 24 - 48
saat sonra değerlendirme yapılır. Gözle görülebilir üremeyi engelleyen en küçük değer
o antibiyotiğin MİK’i olarak belirlenir. Bakterilerin ölüp ölmediğinin anlaşılması için
23
üreme görülmeyen tüplerden katı besiyerlerine pasajlar alınır. Üreme görülmeyen veya
<10 koloni belirlenen tüpler MBK değerini verir. Agar dilüsyon testlerinde de temel
yöntem aynıdır, antibiyotiği belirli oranlarda içeren plaklar dökülür ve bakteri
süspansiyonundan bu plaklara ekim yapılır. Üremenin görülmediği plaktaki antibiyotik
yoğunluğu MİK değerini verir (47).
E-test Yöntemi
MİK değerini tayin eden bir diğer yöntem E-test yöntemidir. Belirli bir
antibiyotiğin bir şeride belirli oranlarda emdirilmesi sonucu elde edilir. Besiyeri disk
difüzyon yöntemindeki gibi hazırlanır ve diskler yerine konulan E-test şeritleri
değerlendirilir. Ürememe zonunun şeridi kestiği yerde okunan oran MİK değeridir.
Antibiyotiğin MİK değerinin belirlemesinde kullanılan yeni ve en kolay yöntemdir.
Dezavantajları standartlarının henüz oturmamış olması ve pahalı bir yöntem oluşudur
(47).
Otomatize Ticari Sistemler
Bu sistemler, bir bilgisayar ya da kitapçıklar yardımıyla bir kerede bakterinin,
pek çok özelliğine bakarak tanımlanmasını sağlayan ticari sistemlerdir. Bu sistemlerin
bazılarında (Phoenix vb.) bakterinin belirli antibiyotikler için MİK değerini de belirleme
imkanı vardır (47).
Biyokimyasal Testler ile Antibiyotik Direnci Araştırılması
Bu yöntemlerde bakterilerin antibiyotikleri parçalamak amacıyla oluşturdukları
enzimlerin saptanması amaçlanmaktadır. Beta laktamaz yapımı ile direnç gelişimi özel
olarak pH değişikliğini yani beta laktamın yıkımını gösteren maddeler emdirilmiş
çubukçuklar ve diskler kullanılarak araştırılır. Bazen bir deney tüpünde bakteri ve
penisilin karıştırılarak yapılsa da testler için en çok nitrosefin disk ve çubukçukları
kullanılır. Gonokok, enterokok, stafilokok, gibi pek çok bakteri için kullanılabilirler
(47).
Moleküler Metodlarla Direnç Araştırılması
Bakteri kromozomunda olan mutasyonlar ya da bakterilere dışarıdan ulaşan
genetik elemanlar dirence yol açarlar. Direnç, bu mutasyonu ya da genetik elemanları
ortaya çıkararak belirlenebilir. Fakat bu direnç geninin varlığı mutlaka direnç anlamına
gelmez çünkü bu gen aktif değilse bakteri dirençli olmayabilir. Bu şekilde direnç
24
belirlenmesi için polimeraz zincir reaksiyonu (PZR), DNA dizileme metodları, DNA
probları, gibi pek çok yöntem kullanılmaktadır. Günümüzde moleküler metodlar M.
tuberculosis gibi geç üreyen bakterilerin direncinin belirlenmesi ve en sık olarak da
dirençli bakterilerin epidemiyolojik olarak izlenmesinde kullanılmaktadırlar (47).
2.7. Duyarlılık testlerinde kullanılan antibiyotikler
β-Laktamlar
Yapılarında β-laktam halkası taşımaları nedeniyle bu ismi almışlardır. β-laktam
antibiyotikler peptidoglikan sentezinin son aşamasında rol alan transpeptidaz
enzimlerine bağlanarak bakteri hücre duvarı sentezini durdururlar. Bu nedenle
transpeptidaz
enzimleri
‘Penisilin
Bağlayan
Proteinler
(PBP)’
olarak
da
adlandırılmaktadır. Hücreyi bir kafes gibi sararak osmotik basınçla patlamasını önleyen
peptidoglikan tabakasının, β-laktam antibiyotikler tarafından bozulması hücrenin
erimesine neden olurlar (47).
Penisilinler
Penisilinler
bakteri
hücre
duvarı
sentezini
durdurarak
etki
gösteren
antibiyotiklerdir. Doğal penisilinler, bazı Penicillium cinsi küflerin fermentasyonu ile
elde edilir. Özellikle aerop ve anaerop Gram pozitif bakterilere etkilidir bunun dışında
Neisseria ve spiroketlere de etkilidir. Buna karşın doğal penisilinlere dirençli olanlar
Bacteroides fragilis ve aerop Gram negatif çomakların çoğudur (47).
Doğal penisilinler, oral ve parenteral olarak kullanılabilir ve iki çeşittir. Penisilin
G mide asidi ile inaktive olduğundan yalnızca parenteral olarak uygulanabilmektedir.
Aynı zamanda penisilin G böbreklerden hızla atıldığından tedavide sık aralıklarla
uygulanması gerekmektedir. Kandaki düzeyini yüksek tutarak uygulama sıklığını
azaltan prokain penisilin ve benzatin pensilin gibi sadece kas içi uygulanan bileşikleri
de vardır. Penisilin V mide asidine dirençlidir ve oral kullanılır (47).
Yarı sentetik penisilinler, doğal olarak elde edilen penisilinlerin antimikrobik
aktivitelerini, vücutta dağılım ve atılımlarını, mide asidine dirençlerini ve bakeriler
tarafından sagılanan enzimlere dayanıklılıkları arttırılmak üzere, bazı kimyasal gruplar
eklenerek
sentez
penisilinlergrubunda
bulunmaktadır (47).
edilen
penisilinlerdir.
aminopenisilinler,
Geniş
spektrumlu
karboksipenisilinler,
yarı
sentetik
üreidopenisilinler
25
Aminopenisilinler Gram pozitif bakterilerden enterokoklara ve Listeria
monocytogenes’e penisilin G’den daha etkilidir. Bunun dışında Escherichia coli,
Salmonella,
Shigella
Karboksipenisilinler
gibi
Gram
Enterobacter,
negatif
barsak
Citrobacter,
bakterilerine
Serratia
de
üzerinde
etkilidir.
etkilidirler.
Üreidopenisilinlerin ise etki spektrumu karboksipenisilinlere oranla daha geniştir ve
streptokok ve enterokoklara daha iyi etkilidirler (47).
Sefalosporinler
Penisilindeki tiazolidin halkasının yerinde dihitrotiazin halkası içerirler.
Sefalosporinler de penisilinler gibi bakteri hücre duvarı sentezini durdurarak etki eden
antibiyotiklerdendir. Sefaosporinler genel özelliklerine ve antibakteriyel spektrumlarına
göre 5 kuşağa ayrılmışlardır. Birinci kuşak sefalosporinler özellikle aerop ve anaerop
Gram pozitif kok şeklinde bakterilere etkilidirler. Fakat Enterobacteriaceae üyelerine
ve Pseudomonas cinsinden bakterilere etkisizdirler. İkinci kuşak sefalosporinler Gram
negatif bakterilere karşı 1. kuşak sefalosporinlerden daha etkilidirler. Oral ve parenteral
formları bulunmaktadır ve beyin-omurilik sıvısına geçebilirler. Üçüncü kuşak
sefalosporinler özellikle antibiyotiklere dirençli Gram negatif çomaklar ile oluşan ciddi
enfeksiyonların tedavisinde kullanılırlar. Gram pozitif bakterilere karşı 1. kuşak
sefalosporinler kadar etkili değildirler. Dördüncü kuşak sefalosporinler genel olarak
üçüncü kuşak sefalosporinlere benzer etki gösterirler ancak kromozomal β-laktamazlara
karşı daha dirençlidirler. Beşinci kuşak sefalosporinler Gram negatif çomaklara,
Pseudomonas’lara ve metisiline dirençli stafilokoklar dahil Gram pozitif bakterilere
etkilidirler (47).
Monobaktamlar
Grubun tek üyesi aztreonamdır ve yalnızca Gram negatif aerop bakterilere
etkilidir. Enterobacteriaceae ailesindeki bakterilere, Pseudomonas, Neisseria ve
Haemophilus cinslerine etkilidir. Gram pozitif bakteriler ile anaerop bakterilere
etkisizdir. Etki mekanizması bakteri hücre duvarı sentezini durdurmaktır (47).
Karbapenemler
Gram pozitif ve Gram negatif, aerop ve anaerop bakterilerin çoğuna etkili,
bilinen en geniş spektrumlu β-laktam antibiyotiklerdir. Kromozomal veya plazmid
kaynaklı β-laktamaz oluşturan birçok bakteriye karşı etkilidirler. Ancak karbapenemaz
özelliğinde
β-laktamaz
oluşturan
Stenotrophomonas
maltophilia’ya
ve
bazı
26
Bacteroidesfragilis suşlarına etkisizdir. İmipenem böbrekte bulunan dehidropeptidaz
enzimi ile hızla hidrolize olur. Bunu önlemek için dehidropeptidazın spesifik inhibitörü
olan silastatin ile birlikte kullanılır. Meropenem dehidropeptidaz enzimine dirençlidir.
İmipenem menenjitli hastalarda konvulziyonlara neden olduğundan, menenjit
tedavisinde kullanılmaz. Doripenemin etkinliği hemen hemen imipenem ve meropenem
ile aynıdır. Ertapenem, Enterobacteriaceae üyelerine, Haemophilus, Moraxella,
Neisseria, Pasteurella gibi zor üreyen Gram negatif çomaklara diğerlerinden daha
etkilidir. Ancak Enterococcus faecalis, Pseudomonas aeruginosa ve Acinetobacter’lere
etkisizdir (47).
Glikopeptidler ve Lipopeptidler
Glikopeptidler hücre duvarı sentezini, peptidoglikanın yapısındaki N-asetil
müramik aside bağlı pentapeptidin son iki amino asidine (D-Ala-D-Ala) bağlanarak
önlerler. Glikopeptidler yalnızca Gram pozitif aerop ve anaerop bakterilere etkilidirler.
Gram negatif bakterilere etkisizdirler bunun nedeni glikopeptid yapıdaki antibiyotik
moleküllerinin Gram negatif bakteri hücre duvarındaki dış zardan geçemeyecek kadar
büyük olmasıdır. Bu grubun halen tedavide kullanılan iki üyesi vankomisin ve
teikoplanindir. Metisiline dirençli stafilokok enfeksiyonlarının tedavisinde kullanılan
başlıca antibiyotikler vankomisin ve teikoplanindir. Ayrıca penisiline direçli enterokok
enfeksiyonlarında ve Clostridium difficile’nin oluşturduğu psödomembranöz enterokolit
tedavisinde de kullanılmaktadırlar. Vankomisin türevi olan oritavansin ve telavansin ile
teikoplanin
türevi
olan
dalbavansin
yeni
kullanıma
giren
lipoglikopeptid
antibiyotiklerdir. Bunların dışında siklik lipopeptid grubunun tek üyesi olan daptomisin,
Gram pozitif bakteri sitoplazmik zarının fonksiyonlarını bozarak hücre ölümüne neden
olur (47).
Aminoglikozidler
Aminoglikozidler ribozomun 30S alt ünitesine bağlanarak protein sentezini
inhibe ederler. Streptomisin, aminoglikozidlerin ilk üyesidir ve tüberküloz tedavisinde
bir devrim yaratmıştır. Daha sonra neomisin, kanamisin, gentamisin, tobramisin,
amikasin, netilmisin ve isepamisin kullanıma girmiştir. Aminoglikozidler anaerop
bakterilere etkisizdir. Aminoglikozidler, aerop Gram negatif çomaklara çok etkilidirler.
Ancak Gram pozitif bakterilere olan etkinlikleri oldukça sınırlıdır. Streptomisin ve
amikasin Mycobacterium tuberculosis’e etkilidir ve minör antitüberküloz ilaçlar
27
grubunda yer alır. Aminoglikozidlerin doz ve süre ile ilişkili ototoksisite ve
nefrotoksisite gibi iki önemli yan etkileri vardır ve bu nedenle tedavi sırasında izlem
önemlidir (47).
Tetrasiklinler
Tetrasiklinler de ribozomun 30S alt ünitesine bağlanmak suretiyle protein
sentezini inhibe ederek etki gösterirler. Bu grupta bulunan antibiyotikler klortetrasiklin,
oksitetrasiklin, tetrasiklin, demetilklortetrasiklindir. Doksisiklin ve minosiklin ise yarı
sentetik tetrasiklinlerdir. Tetrasiklinler sitoplazma zarından hem enerjiye bağımlı aktif
transport sistemleri hem de enerjiden bağımsız mekanizmalarla hücre içine girer ve
ribozomların 30S alt ünitine bağlanıp aminoaçil tRNA’nın ribozoma bağlanmasını
engelleyerek, protein sentezini durdururlar. Tetrasiklinler geniş spektrumludur. Gram
pozitif ve Gram negatif aerop ve anaerop bakterilere etkilidirler. Ancak birçok Gram
negatif çomak cinsi, stafilokoklar, pnömokoklar ve gonokoklar tetrasikline direnç
kazamıştır. Ayrıca metisiline dirençli stafilokokların tedavisinde kullanılabilirler (47).
Kloramfenikol
Bakteri ribozomunun 50S alt ünitinin peptidiltransferaz bölgesine reversibl
olarak bağlanarak transpeptidasyonu önlerler ve bakteriyostatik etki meydana getirirler.
Gram pozitif ve Gram negatif aerop ve anaerop bakterilere, Chlamydia, Mycoplasma,
Rickettsia cinslerine de etkili olan, bilinen en geniş spektrumlu antibiyotiklerden biridir.
Ancak bazı hastalarda kemik iliği inhibisyonu sonucu aplastik anemi yapar dolayısıyla
kullanımı sınırlıdır. Pratikte pek kullanımı olmasa da tifo tedavisinde en etkili
antibiyotiklerden olması ve ucuz olması nedeniyle halen kitaplarda ve tedavi
rehberlerinde yer almaktadır. Tiamfenikol kloramfenikolden türetilmiştir ve etki
spektrumu kloramfenikole benzer, daha az toksiktir (47).
Makrolidler
Makrolidler bakteri ribozomunun 50S alt ünitine bağlanır ve tRNA’nın
ribozomdan ayrılmasını önleyerek protein sentezini inhibe ederler. Makrolid
antibiyotikler
özellikle
Gram
pozitif
bakterilere
etkilidirler.
Yarı
sentetik
makrolidlerden H. influenza’ya ekili olanlar klaritromisin ve azitromisindir. Bu
antibiyotiklerin özellikle solunum yolu enfeksiyonlarında kullanılmasının nedeni
alveolar makrofajlarda yüksek konsantrasyona ulaşmaları ve spektrumlarının solunum
sistemi enfeksiyonu etkeni bakterilerin neredeyse tamamını kapsamasıdır. Eritromisin,
28
klaritromisin, azitromisin günümüzde en sık kullanılanlardır. Eski makrolidlerden
spiramisin halen toksoplazmoz tedavisinde kullanılmaktadır (47).
Linkozamidler
Etkilerini bakteri ribozomunun 50S alt ünitesine bağlanıp protein sentezini
inhibe ederek gösterirler. Bu grubun iki üyesi vardır, ilki linkomisin diğeri
klindamisindir. Bu iki üyenin etki spektrumları benzerdir. Ancak klindamisinin
antimikrobiyal etkisi daha kuvvetlidir. Klindamisin Gram pozitif aerop bakterilere ve
özellikle de Gram pozitif ve Gram negatif anaerop bakterilere etkilidir. Anaerop
enfeksiyonların tedavisinde sıkça tercih edilmektedir. Ancak uzun süre kullanımında
psödomembranöz kolite neden olabilirler. Penisilin duyarlılığı olan hastalardaki Gram
pozitif kok enfeksiyonlarında alternatif olarak kullanılabilmektedir (47).
Streptograminler
Bakteri ribozomunun 50S alt ünitesine bağlanarak hem aminoaçil tRNA’nın
ribozoma bağlanmasını, hem de mRNA’nın translasyonunu inhibe eder. Doza bağımlı
olarak bakterisit etkileri vardır. Günümüzde özellikle metisiline dirençli S.aureus ve
vankomisine dirençli enterokok tedavisinde yarı sentetik bir streptogramin olan
kinupristin/dalfopristin kullanılmaktadır (47).
Oksazolidinonlar
Sentetik bir antibiyotik grubu olan oksazolidinonlardan günümüzde halen
kullanımda olan yalnız linezolid vardır. Bakterinin 50S ribozomuna bağlanarak
tRNA’ların buraya bağlanmasını engeller. Gram pozitif bakterilerin birçoğuna etkilidir.
Metisiline dirençli stafilokok ve vankomisine dirençli enterokok enfeksiyonlarında
kullanılmaktadır (47).
Fusidik Asit
Bakteriyostatik etki gösterir. Elongasyon faktörü 2, guanozin difosfat ve
ribozom ile stabil bir kompleks oluşturma sonucunda, gelişmekte olan polipeptit
zincirinin uzamasını inhibe eder. Gram negatif koklara ve stafilokoklara etkilidir. Ancak
Gram negatif çomaklara karşı etkisizdir. Stafilokok enfeksiyonlarının tedavisi sırasında
fusidik aside karşı direnç çok çabuk gelişir ve bu nedenle genellikle diğer antistafilokok
özelliği olan antibiyotiklerle birlikte kombinasyon şeklinde kullanılır (47).
29
Kinolonlar
Kinolonlar bakterilerde DNA replikasyonu, rekombinasyonu ve tamirinden
sorumlu olan topoizomeraz enzimlerine bağlanarak nükleik asit sentezini ve
fonsiyonunu bozarak etki göstermektedirler. Kinolonlar Gram negatif ve Gram pozitif
bakterilere karşı etkilidir. Kinolonlar DNA sentez ve onarımını bozarak bakterisit etki
oluştururlar. Kinolonlar yüksek selektif toksisite gösterirler bunun nedeni, kinolonların
bakteri topoizomerazlarına olan afinitesinin, ökaryot hücre enzimlerine oranla çok daha
yüksek olmasıdır. İlk bulunan nalidiksik asittir ve bunu takiben Gram negatif bakterilere
etkili, idrar yolu enfeksiyonlarının tedavisinde kullanılan kinolonlar bulunmuştur.
Günümüzde kullanılan kinolonlar iki halkalı kinolon nükleusuna fluor eklenerek sentez
edilirler ve fluorokinolon olarak adlandırılırlar. En sık kullanılanlar siprofloksasin,
ofloksasin, norfloksasin, levofloksasindir. Fluorokinolonlar Gram pozitif ve negatif
aerop ve anaerop bakterilere etkilidirler (47).
Rifamisinler
mRNA sentezini, bakteri RNA polimeraz enzimine bağlanarak durdurur ve
bakterisit etki gösterirler. Yüksek selektif toksisite gösterirler, bunun nedeni ökaryot
hücrede mRNA sentezi inhibisyonu için gereken konsantrasyonun, bakteri hücresi için
gerekenden 10,000 kat daha fazla olmasıdır. Rifampisin günümüzde en sık kullanılan
rifamisindir. Gram pozitif ve negatif koklara etkilidir. Ayrıca tüberküloz tedavisinde
kullanılan major ilaçlardan biridir. Buna ek olarak, vankomisin ile birlikte kombine
şekilde metisiline dirençli stafilokok enfeksiyonlarında kullanılabilir (47).
Sülfanomidler
Sülfanomidler
bakteri
hücresindeki
dihidropteroat
sentetaz
enzimi
ile
birleşekerek folik asit sentezini bozar. Selektif toksisite gösterirler. Sülfanomidlerin
günümüzdeki kullanımı gelişen bakteri dirençleri nedeniyle kısıtlanmış olsa dahi
geçmişte streptokok, stafilokok, meningokok, gonokok enfeksiyonlarında ve idrar
yolları enfeksiyonlarında çok sık kullanılmışlardır. Ayrıca başka ilaçlarla kombine
edilerek çeşitli protozoon cinsleri ile oluşan enfeksiyonların tedavisinde de kullanılırlar.
Sülfanomid türevlerine örnek olarak sulfodiazin, sülfisoksazol ve sulfametoksazol
verilebilir (47).
30
Trimetoprim
Folik asit sentezinin son aşamasında yer alan dihidrofolat redüktaz enzimini
inhibe edip dihidrofolik asidin tetrahidrofolik aside dönüşmesini engelleyerek etki
göstermektedir. Ancak trimetoprim insandaki folik asit metabolizmasınıda etkiler.
Bununla birlikte bakterideki hedef enzime uygunluğu, insandakinden 50,000 kat daha
fazladır. Dolayısıyla insan için toksik değildir ve tedavi dozunda selektif toksisite
gösterir. Sülfametoksazol/trimetoprim ile kombine edildiğinde folik asit sentezinin iki
aşaması durdurularak sinerjik etki elde edilmektedir. Günümüzde yaygın olarak
kullanılan bu kombinasyon geniş spektrumlu ve birçok bakteriye etkilidir. Ancak
anaerop bakterilere ve P.aeruginosa’ya etkisizdir. Üriner sistem enfeksiyonlarında
sıklıkla kullanılır (47).
Nitroimidazoller
Mikroorganizma DNA’sına, kimyasal yapısındaki nitro grubundan hücre içinde
yüksek derecede toksik metabolitlerin ortaya çıkması sonucu zarar verir. Güçlü
bakterisit etki gösterirler. Zorunlu anaerop bakterilere karşı etkilidir. Tedavide en sık
kullanılan türleri metronidazol, ornidazol ve tinidazoldür. Trichomonas vaginalis,
Giardia intestinalis ve Entamoeba histolytica’ya etkilidir (47).
Kloramfenikol
Bakteri ribozomunun 50S alt ünitinin peptidiltransferaz bölgesine reversibl
olarak bağlanarak transpeptidasyonu önlerler ve bakteriyostatik etki meydana getirirler.
Gram pozitif ve Gram negatif aerop ve anaerop bakterilere, Chlamydia, Mycoplasma,
Rickettsia cinslerine de etkili olan, bilinen en geniş spektrumlu antibiyotiklerden biridir.
Ancak bazı hastalarda kemik iliği inhibisyonu sonucu aplastik anemi yapar dolayısıyla
kullanımı sınırlıdır. Pratikte pek kullanımı olmasa da tifo tedavisinde en etkili
antibiyotiklerden olması ve ucuz olması nedeniyle halen kitaplarda ve tedavi
rehberlerinde yer almaktadır. Tiamfenikol kloramfenikolden türetilmiştir ve etki
spektrumu kloramfenikole benzer, daha az toksiktir (47).
Kolistin
Kolistin polimiksinler grubuna ait polimiksin E olarak da adlandırılan parenteral
olarak kullanılan bir antibiyotiktir. Proteus, Providencia, Serratia ve Neisseria
dışındaki Gram negatif bakterilere ve özellikle Pseudomonas’lara iyi etkili, Gram
31
pozitif bakterilere ve anaeroplara karşı etkisizdir. Kolistinin ciddi nörotoksik ve
nefrotoksik etkileri olduğu bilinmekte ve dolayısıyla sistemik tedavide kullanılması
tercih edilmemektedir. Kolistin çoğul dirençli Pseudomonas ve Acinetobacter ile oluşan
hastane enfeksiyonlarında sistemik olarak da kullanılmaktadır (47).
2.8. İstatistiksel yöntemler
Araştırmamızda laktasyonel mastitli hastalarda ve non-laktasyonel mastitli
hastalardan granülomatöz mastitli olanlarda üretilen bakterilerle hasta grupları arasında
bir ilişki (korelasyon) olup olmadığı SPSS ile Spearman’s korelasyon analizi yapılarak
belirlenmiştir.Analizde bakteriler ve bu bakterilerin üretildiği hasta sayıları değişkenler
olarak kullanılmıştır.
32
3. GEREÇ VE YÖNTEM
Çalışmamız, Kasım 2015-Haziran 2015 tarihleri arasında, İstanbul Üniversitesi
Cerrahpaşa Tıp Fakültesi, Acil Cerrahi ve Genel Cerrahi Meme Polikliniği’ne başvuran
ve klinik muayeneleri ve/veya histopatolojik inceleme sonuçlarına göre mastit tanısı
almış olan 100 hastaya ait doku ve/veya apse cerahatleri ile gerçekleştirilmiştir.
Örnekler Tıbbi Mikrobiyoloji Anabilim Dalı laboratuarlarında aerop ve anaerop
bakterilerin
varlığı
yönünden
incelenmiştir.
Moleküler
testler
Roche
Ar-Ge
Laboratuvarlarında gerçekleştirilmiş (Y.L.Ö Zeynep Taner tarafından) ve sonuçlar
danışman hoca (H.Bahar Tokman) tarafından değerlendirilmiştir.
Çalışmamız, İ.Ü. Cerrahpaşa Tıp Fakültesi Etik kurulunca onaylanmıştır (Onay
no:76624604/050.99–1465).
Çalışmaya dahil olacak hastalar için temel kriterlerimiz:
1-Ergenliğe girmiş olmak.
2-Laktasyonel mastit tanısı almış olmak (Emzirme döneminde 38 ◦C üzerine
çıkan ateş, memede eritem, hassasiyet ve şişkinlik belirtilerinden en az ikisinin varlığı
ile) (2,23).
3-Non-laktasyonel mastit tanısı almış olmak (Meme dokusundan alınan örneğin
histopatolojik incelemesinde yoğun inflamatuar reaksiyon ile hastalığın karakteristik
özelliği olan non-kazeifiye granülomların görülmesi ve granülomatöz reaksiyon
yapabilen diğer etiyolojilerin var olmadığının gösterilmesi ile ya da periareolar bölgede
ciltte eritem, meme başında şişkinlik, sertlik, akıntı varlığı ile) (1,6, 29).
4-Tüberküloz mastit tanısı almamış olmak.
5-Meme kanseri tanısı almamış olmak.
6-Son 72 saatte antibiyotik kullanmamış olmak.
Çalışmamızda aşağıda belirtilen gereçler kullanılmıştır.
33
3.1. Gereçler
3.1.1. Kullanılan Besiyerleri
3.1.1.1. Aerop Kültürler İçin Kullanılan Besiyerleri
Koyun Kanlı Agar Besiyeri
Agar base (oxoid)
Defibrine koyun kanı
Distile Su
40 g
50 mL
1000mL
Üretici firmadan (Oxoid) toz besiyeri 500 g'lık kutuda hazır olarak alındı. 1000 ml
distile suda 40 g toz besiyeri [(Tripton (14 g), nötralize pepton (4,5 g), maya özütü (4,5
g), sodyum klorit (5 g), agar (12 g)] eritildi. pH 7,3 ± 0,2’e ayarlandı ve 121 ˚C’de 15
dakika otoklavlandıktan sonra 45˚C’ye kadar soğutuldu. 50 mL defibrine koyun kanı
ilave edilerek iyice karıştırıldı. 4 mm kalınlıkta olacak şekilde Petri kutularına
dökülerek donduruldu. Koyun kanlı agar besiyeri bakterilerin hemoliz özelliklerini
araştırmak amacıyla kullanıldı (71).
Çukulatamsı Agar Besiyeri
Agar base (oxoid)
Defibrine koyun kanı
Distile Su
40 g
50 mL
1000mL
Üretici firmadan (Oxoid) toz besiyeri 500 g'lık kutuda hazır olarak alındı 1000 mL
distile suda 40 g toz besiyeri [(Tripton (14 g), nötralize pepton (4,5 g), maya özütü (4,5
g), sodyum klorit (5 g), agar (12 g)] eritildi . pH 7,3 ± 0,2’e ayarlandı ve 121˚C’de 15
dakika otoklavlandıktan sonra 45˚C’ye kadar soğutuldu. 50 mL defibrine koyun kanı
ilave edilerek iyice karıştırıldı.2 dakika boyunca kaynayan suda tutuldu. İyice
karıştırıldıktan sonra 4 mm kalınlıkta olacak şekilde Petri kutularına döküldü. Bu
besiyeri genel üretim amaçlı kullanıldı (72).
MacConkey Agar Besiyeri
Pepton
20 g
Laktoz
10 g
NaCl
5g
34
Agar
15 g
Safra tuzları
1,5 g
Nötral kırmızısı
0,03 g
Kristal viyole
0,001 g
Distile su
1000 mL
Üretici firmadan (Oxoid) toz besiyeri 500 g’lık kutuda hazır olarak alındı. 1000 ml
distile suda 51,5 g toz besiyeri eritildi. pH 7,1 ± 0,2’e ayarlandı ve121 ºC’de 15 dakika
otoklavlandı. 45°C’ye kadar soğutulduktan sonra4 mm kalınlıkta olacak şekilde Petri
kutularına döküldü. Bu besiyeri, içerdiği kristal viyole ve safra tuzlarının etkisiyle Gram
pozitif bakterilere karşı inhibitör etki göstemekte, buna karşın Gram negatif çomakların
üremesine uygun ortam sağlamaktadır. İçerdiği laktoz sayesinde de özellikle laktozu
kullanan Gram negatif çomaklar bu besiyerinde belirlenebilmektedir. Bu besiyeri hasta
örneklerinden Gram negatif çomakların ayırımında kullanıldı (48).
Safralı Eskülin Agar
Pepton
14 g
Safra tuzları
15 g
Ferrik sitrat
0.5 g
Eskülin
1g
Agar
14 g
Üretici firmadan (Oxoid) toz besiyeri 500 g’lık kutuda hazır olarak alındı. 44,5 g toz
besiyeri 1000 mL distile suda eritildi. pH 7,1 ± 0,2’e ayarlandı, 121 ºC’de 15 dakika
otoklavlandı. 45°C’ye kadar soğutulduktan sonra 4 mm kalınlıkta olacak şekilde Petri
kutularına döküldü.Bu besiyeri enterokokların/Grup D streptokokların ayırımında
kullanıldı (72).
DNaz Besiyeri
Deoksiribonukleikasit
2g
Triptoz
20 g
Sodyum klorür
5g
35
Agar
15 g
Distile su
1000 mL
Üretici firmadan (Oxoid) toz besiyeri 500 g'lık kutuda hazır olarak alındı. 42 g toz
besiyeri 1000 ml distile suda eritildi, pH 7,3 ± 0,2’e ayarlandı ve 121°C’de 15 dakika
otoklavlandı. 45 °C’ye kadar soğutulduktan sonra 4 mm kalınlıkta olacak şekilde Petri
kutularına dökülerek donduruldu. Bu besiyeri bakterinin DNAz aktivitesini göstermek
için kullanıldı (72).
Mueller Hinton Agar Besiyeri
Sığır et suyu (B-21)
300 mL
Kazein hidrolizatı
17 g
Nişasta
1,5 g
Agar
17g
Distile su
1000 mL
Üretici firmadan (Oxoid) toz besiyeri 500 g'lık kutuda hazır olarak alındı. 38 g toz
besiyeri 1000 ml distile suda eritildi, pH 7,4 ± 0,2’e ayarlandı ve 121°C’de 15 dakika
otoklavlandı. 45 °C’ye kadar soğutulduktan sonra 4 mm kalınlıkta olacak şekilde Petri
kutularına dökülerek donduruldu. Bu besiyeri, aerop bakterilerin antibiyotiklere
duyarlılıklarının belirlenmesinde disk difüzyon yönteminin uygulanması için kullanıldı
(72).
Üç Şekerli Demirli Agar Besiyeri (TSI)
‘Lab- Lemco’ tozu
3g
Maya özü
3g
Pepton
20 g
Sodyum klorit
5g
Laktoz
10 g
Sükroz
10 g
Glikoz
1g
Ferrik sitrat
0,3 g
36
Sodyum tiyosülfat
0,3 g
Fenol kırmızısı
0,024 g
Agar
12 g
Distile su
1000 mL
Üretici firmadan (Oxoid) 2,5 kg’lık kutuda hazır olarak alındı. 64,52 g toz besiyeri 1000
mL distile suda eritildi ve tüplere 2,5 mL dağıtıldı. pH 7,3 ± 0,2’e ayarlandı. Besiyeri
içeren tüpler, 121°C’de 15 dakika otoklavlandı. Otoklavdan çıkarıldıktan sonra yatık
konumda soğutuldu. Bu besiyeri, Gram negatif çomakların dekstroz, laktoz ve sükroz
fermentasyonu ile hidrojen sülfid üretimi özelliklerinin belirlenmesinde kullanıldı (45).
Hareket, İndol, Ornitin Besiyeri (MIO)
Pepton
10 g
Maya özü
3g
Tripton
10 g
Dekstroz
1g
L-ornitin HCl
5g
Brom krezol moru
0,02 g
Agar
2g
Distile su
1000 mL
Üretici firmadan (Difco) 500 g’lık kutuda hazır olarak alındı. Üzerindeki prosedüre göre
31 g toz besiyeri 1000 mL distile suda eritildi ve tüplere dağıtıldı. pH’sı 6,5’e ayarlandı
ve tüpler, 121°C’de 15 dakika otoklavda steril edildi. Hareket, indol, ornitin besiyeri
Enterobacteriaceae üyelerinin ornitin dekarboksilaz aktivitesi, indol üretimi ve hareket
özelliklerinin belirlenmesinde kullanılmıştır (73).
Christensen Besiyeri (Üre Besiyeri)
Pepton
1g
Glikoz
1g
Sodyum klorit
5g
37
Disodyum fosfat
1,2 g
Potasyum dihidrojen fosfat
0,8 g
Fenol kırmızısı
0,012 g
Agar
15 g
Distile su
1000 mL
Glikoz ve üre dışındaki maddeler suda eritildi. pH 6,8 ± 0.2’e ayarlandı besiyeri 121
°C’de 15 dakika steril edildi. 50°C’ye kadar soğuyunca besiyerine, süzülerek steril
edilen glikoz ve üre eriyikleri katılarak iyice karıştırıldı ve steril şartlarda steril tüplere
1’er ml dağıtıldı.Besiyerinin dik olarak katılaşması sağlandı. Bu besiyeri üreaz
enziminin varlığının saptanmasında kullanıldı (45).
Sitrat Besiyeri
Sodyum klorit
5g
Amonyum dihidrojen fosfat
1g
Dipotasyum fosfat
1g
Magnezyum sülfat
0,2 g
Sodyum sitrat
3g
Bromtimol mavisi eriyiği
0,08 g
Agar
20 g
Distile su
1000 mL
Maddeler karıştırılıp eritildikten sonra tüplere 5’er ml dağıtıldı. pH’sı 6,8 ± 0,2’ye
ayarlandı, 100°C’de 1 saat steril edildi. Tüpler yatık konumda tutularak soğutuldu. Bu
besiyeri Gram negatif bakterilerin karbon kaynağı olarak sitrattan yararlanıp
yararlanmadıklarını belirlemek amacıyla kullanıldı (45).
Dekstroz (D) Besiyeri
Bromtimol mavisi eriyiği
0.04 g
Kazeinin pankreatik dijesti
10 g
Glikoz
5g
38
Agar
15 g
Distile su
1000 mL
Üretici firmadan (BD Diagostic Systems) alınan hazır besiyeri 1000 mL distile su
içerisinde ertildi. 100°C’de, 1 saat tutularak steril edildi. pH 6,9 ± 0,2’e ayarlandı ve
tüplere 5’er ml olarak bölündü. Tüpler, 121°C’de 15 dakika otoklavlandı. Bu besiyeri
Gram negatif çomakların dekstroza oksitleyici ve fermentleyici etkisinin, asit, gaz ve
asetoin yapımının araştırılmasında kullanıldı (72).
3.1.1.2. Anaerop Kültürler İçin Kullanılan Besiyerleri
Zenginlestirilmiş Tiyoglikolatlı Sıvı Besiyeri
Maya özütü
5g
Tripton
15 g
Glikoz
5,5 g
Sodyum tiyoglikolat
0,5 g
Sodyum klorit
2,5 g
L-sistein
0,5 g
Resazurin
0,001 g
Hemin stok solüsyon
1mL
Agar
0,75 g
Distile su
1000 mL
Besiyeri (Oxoid) 1000 mL distile suda ısıtılarak eritildikten sonra pH 7,1 ± 0,2’e
ayarlandı ve tüplere 10 mL dağıtıldı. 121 °C’de 15 dakika otoklavlandıktan sonra 45°C
’ye gelinceye kadar soğutuldu. Bu besiyeri parafilm ile kapatılıp 4°C’de saklandı
(72,74).
Schaedler AgarBesiyeri
Schaedler agar
41,9 g
Distile su
1000 mL
Üretici firmadan (Acumedia) alınan hazır besiyeri, [Kazeinin pankreatik dijesti (10 g),
hayvan dokusunun peptik dijesti (10 g), maya özütü (2 g), sodyum klorür (5 g), dekstroz
39
(1 g), sodyum bisülfit (0,1 g), agar (15 g)]1000 mL distile suda ısıtılarak eritildikten
sonra pH 7,6 ± 0,2’e ayarlandı ve tüplere 10 mL dağıtıldı. 121°C’de 15 dakika
otoklavlandıktan sonra 45°C ’ye gelinceye kadar soğutuldu,içine süzülerek steril edilen
vitamin K1 solüsyonu (10 mg/mL) eklendi. Bu besiyeri parafilm ile kapatılıp 4°C’de
saklandı (72,74). Brusella agar besiyerine yayılacak olan 0,5 Mac Farland
bulanıklığındaki anaerop bakteri süspansiyonu bu besiyerinde hazırlandı.
Kanlı Anaerop Agar Besiyeri
Schaedler agar
45 g
Distile su
1000 mL
45 g Schaedler agar (Oxoid)[(Tripton Soya Agar (10 g), pepton (5 g), maya özütü (5 g),
glikoz (5 g), hemin (0,01 g), tris buffer (0,75 g), agar (13,5 g)], 1000 mL distile suda
eritildikten sonra 250 mL’lik balonlara bölündü. pH 7,4 ± 0,2’e ayarlandı 121°C’de 15
dakika steril edildi. Kullanılacağı zaman 250 mL’lik besiyeri eritilip, 45°C’ye kadar
soğutuldu. Soğuyunca içine;
Vitamin K1 solüsyonu
0,25 mL
Koyun kanı
12,5 mL
İlave edildi, iyice karıştırıldıktan sonra 4 mm kalınlığında olacak şekilde Petri
kutularına dağıtıldı. Bu besiyeri anaerop bakterilerin üretimi için kullanıldı (74).
Kanlı, Fenil Etil Alkollü Anaerop Besiyeri
Schaedler agar
45 g
Fenil etil alkol
2,5 mL
Distile su
1000 mL
45 g Schaedler agar (Oxoid) [(Tripton Soya Agar (10 g), pepton (5 g), maya özütü (5 g),
glikoz (5 g), hemin (0,01 g), tris buffer (0,75 g), agar (13,5 g)], 1000 mL distile suda
eritildikten sonra içine 2,5 mL fenil-etil alkol ilave edildi ve 250 mL’lik balonlara
bölündü. 121°C’de 15 dakika steril edildi. Kullanılacağı zaman 250 mL’lik besiyeri
eritilip 45°C’ye soğutulup içine süzülerek steril edilen vitamin K1 solüsyonu (10
mg/mL) ve koyun kanı eklendi.
40
Vitamin K1 solüsyonu (10 mg/ml)
0,25 mL
Koyun kanı
12,5 mL
İyice karıştırıldıktan sonra 4 mm kalınlığında olacak şekilde Petri kutularına döküldü.
Bu besiyeri, içerdiği fenil etil alkol nedeniyle fakültatif anaerop Gram negatif
çomakların üremesini baskılamaktadır. Besiyeri Gram negatif ve Gram pozitif zorunlu
anaerop bakterileri üretmek amacıyla kullanıldı (74).
Kanlı, Kanamisin-Vankomisinli Anaerop Besiyeri
Schaedler agar
45 g
Distile su
1000 mL
45 g Schaedler agar (Oxoid) [(Tripton soya agar (10 g), pepton (5 g), maya özütü (5 g),
glikoz (5 g), hemin (0,01 g), tris buffer (0,75 g), agar (13,5 g)], 1000 ml distile suda
eritildi ve pH 7,1 ± 0,2’ye ayarlandı. 250 mL’lik balonlara bölünüp 121°C’de 15 dakika
otoklavlandı. Kullanılacağı zaman 250 mL’lik besiyeri eritilip 45°C’ye soğuyunca
içine: süzülerek steril edilmiş olan vitamin K1 solüsyonu (10 mg/mL), kanamisin (100
mg/mL), vankomisin (7,5 mg/mL) ayrıca koyun kanı ilave edildi.
Vitamin K1 solüsyonu (10 mg/mL)
0,25 mL
Kanamisin (100 mg/mL)
0,25 mL
Vankomisin (7,5 mg/mL)
0,17 mL
Koyun kanı
12,5 mL
İyice karıştırıldıktan sonra 4 mm kalınlığında olacak şekilde Petri kutularına döküldü.
Anaerop bakterilerin üretiminde seçici besiyeri olarak kullanıldı (74).
Modifiye Brucella Agar Besiyeri
Brusella agar
43 g
Distile su
1000 mL
L-sistein
0,5 g
Sodium tiyoglikolat
0,5 g
Hemin stok solüsyon
1mL
41
43 g Brusella agar (Acumedia), 1000 mL distile suda eritildi ve pH 7,1 ± 0,2’ye
ayarlandı. 250 mL’lik balonlara bölünüp 121°C’de 15 dakika otoklavlandı.
Kullanılacağı zaman 250 mL’lik besiyeri eritilip 45°C’ye soğuyunca içine: süzülerek
steril edilmiş olan vitamin K1 solüsyonu (10 mg/mL) ve koyun kanı ilave edildi.
Vitamin K1 solüsyonu (10 mg/mL)
0,25 mL
Koyun kanı
12,5 mL
İyice karıştırıldıktan sonra 4 mm kalınlığında olacak şekilde Petri kutularına döküldü.
Anaerop bakterilerin antimikrobiyal duyarlılığının belirlenmesinde E test için kullanıldı
(74).
Gliserollü sıvı Brucella besiyeri (Brucella broth)
Brucella Broth
28 g
Gliserin
100 mL
Distile su
900 mL
Üretici firmadan (Acumedia) 500 g'lık kutuda hazır olarak alındı. Belirtilen prosedüre
göre 28 g toz besiyeri 900 mL distile suda eritildi, 100 mL gliserin eklendi ve pH 7.5 ±
0.2’e ayarlandı, 121°C’de 15 dakika otoklavlandı. 45°C’ye kadar soğutulduktan sonra
steril ependorf tüplerine aktarıldı. Bu besiyeri kültürde üretilen aerop bakterileri -70
˚C’de saklamak amacıyla kullanıldı (72).
%10 Gliserollü Yağsız Süt Besiyeri
Yağsız Süt Besiyeri
10g
Distile su
100 mL
Üretici firmadan (Oxoid) alınan toz halindeki yağsız süt (skim milk powder) besiyeri az
miktarda distile su ile karıştırıldı, daha sonra %10 w/v karışım elde edilene kadar distile
su ilave edilmeye devam edildi karışıma %10 gliserol eklendi ve 121°C’de 5 dakika
otoklavlandı. 45°C’ye kadar soğutulduktan sonra steril ependorf tüplerine dağıtıldı. Bu
besiyeri kültürde üretilen anaerop bakterileri -70˚C’de saklamak amacıyla kullanıldı
(74).
42
3.1.2. Kullanılan Stok Solüsyonlar
Hemin Stok Solüsyonu (5 mg/ml)
Hemin
0,5 g
NaOH (1N solüsyon)
10 mL
Distile su
90 mL
Hemin 10 mL 1 N NaOH solüsyonunda çözündürüldü. 90 mL distile su ilave edildikten
sonra 121 °C’de 15 dakika otoklavlanıp soğutuldu ve buzdolabında saklandı (72).
Vitamin K1 Stok Solüsyonu (10 mg/ml)
K1 vitamini
0,1 g
Saf etanol
100 mL
K1 vitamini (Sigma) saf etanol ile karıştırılarak koyu renkli bir şişede buzdolabında
saklandı. Dilüsyonu distile su ile yapıldı (74).
Kanamisin Stok Solüsyonu (100 mg/ml)
Kanamisin
1g
Steril fosfat tampon (pH= 8)
10 mL
Kanamisin (Sigma) fosfat tamponda çözündürüldükten sonra tüplere 0,5’er mL dağıtıldı
ve derin dondurucuda saklandı (74).
Vankomisin Stok Solüsyon (7.5 mg/ml)
Vankomisin
Hidroklorik asit ( N/20)
75 mg
5 mL
Distile su
5 mL
Vankomisin hidroklorik asitte çözündürüldü ve distile su ilave edildi. Tüplere 0,5’er mL
dağıtıldı ve derin dondurucuda saklandı (74).
3.1.3. Kullanılan Ayıraçlar
Katalaz Ayıracı
Aerop bakteriler için %3’lük H2O2 (hidrojen peroksit) kullanıldı (63).
Anaerop bakteriler için %15’lik H2O2 kullanıldı (74).
43
Oksidaz Ayıracı (Kovacs Oksidaz Ayıracı)
Tetrametil-p-fenilendiamin dihidroklorür
0,1 g
Distile su
10 mL
Tetrametil-p-fenilendiamin dihidroklorür distile su ile karıştırılarak hazırlandı (72).
İndol Ayıracı
Aerop bakteriler için;
Para-dimetil aminobenzaldehid
5g
Amil alkol
75 mL
HCl (konsantre)
25 mL
Maddeler karıştırılarak damlalıklı şişeye konuldu (72).
Anaerop bakteriler için;
Paradimetilamino-sinnamaldehit
0,1 g
HCI
1 mL
Distile su
9 mL
Koyu renkli şişede oda ısısında saklandı (74).
3.1.4. Bakterilerin Tanımlanmasında Kullanılan Diskler
Optokin (Etilhidrokuprein hidroklorit) Diski
Optokin antibiyotik diski (BBL); S.pneumoniae’nin viridans streptokoklardan
ayırımında 6 mm’lik (5 μg etilhidrokuprein içeren) diskler kullanıldı (45).
PYR (L-pirolidonil-β-naftilamid) Testi
DrySlide PYR (OXOİD) kiti, Enterokoklar ve A Grubu beta hemolitik
streptokokların identifikasyonunda kullanıldı.
3.1.4.1. Antibiyotik diskleri
Çalışmada, amoksisilin/ klavulonik asit (20/ 10 μg), siprofloksasin (5 μg),
sefoksitin (30 vankomisin (30 μg), klindamisin (2 μg), eritromisin (15 μg), meropenem
(10 μg), imipenem (10 μg), seftazidim (30 μg), seftriakson (30 μg), penisilin (10 μg),
kotrimoksazol
(1.25/
23.75
μg),
gentamisin
(10
μg),
linezolid
(10
μg)
44
disklerikullanılmıştır. Diskler üretici firma tarafından (Oxoid)belirtilen koşullarda
muhafaza edilmiştir.Sefoksitin (30 μg) diski ise metisilin dirençli stafilokokların
belirlenmesinde ve geniş spektrumlu beta laktamaz varlığının saptanmasında
kullanılmıştır.
Anaerop bakterilerin duyarlılıklarının belirlenebilmesi için ise penisilin,
amoksisilin/ klavulonik asit, imipenem, klindamisin, metronidazol ve sefoksitin Etestleri kullanılmıştır(bioMerieux, Marcy l’Etoile, France).
3.1.5. Aerop ve Anaerop Bakterilerin Moleküler Yöntemlerle Tanımlanmasında
Kullanılan Gereçler
3.1.5.1. DNA İzolasyonunda Kullanılan Kit
Magna Pure 96 DNA/Viral NA Small volume kiti (Roche Diagnostics GmBH /
Mannheim–Almanya) DNA izolasyonu için kullanıldı. Çalışmada, üretici firma
direktifleri doğrultusunda Magna Pure 96 cihazında (Roche Diagnostics GmBH /
Mannheim – Almanya) pathogen universal 200 2.0 protokolü kullanıldı.
3.1.5.2. Agaroz Jel Hazırlanmasında Kullanılan Gereçler
DNA örneklerinin kalitesi ve miktarı %1’lik agaroz jelde incelenmistir. Bunun
için; 1,5 g agaroz, 150 μl 1x Tris-asetat(TAE) tamponunda kaynatılarak çözülmüstür.
Agaroz çözeltisi 40°C’ ye kadar soğutulmuştur. Soğutmadan sonra 10 μl etidyum
bromür çözeltisi (10 mg/mL) eklenmistir.
3.1.5.3. 16S rRNA'nın PZR Amplifikasyonunda Kullanılan Gereçler
1. Primer stoklar (20 μM, Invitrogen) :
27f (forward primer: 16S rRNA'nın başlangıç bölgesine bağlanan evrensel primer, 5’AGAGTTTGATCMTGGCTCAG-3’)
1525r (reverse primer: 16S rRNA'nın son bölgesine bağlanan evrensel primer 5’AAGGAGGTGWTCCARCC-3’)
2. dNTP mix stok (100 μl’lik stok solüsyonda her biri 25 mM olacak şekilde dATP,
dCTP, dGTP ve dTTP karışımı; Promega)
3. Taq DNA polimeraz (HotStarTaq®, QIAGEN) 10xTaq DNA polimeraz tampon
(HotStarTaq®)
4. 5 - 10 μl DDH2O içinde çözülmüş, saf genomik DNA (50-300 ng)
45
3.1.5.4. 16S rRNA Gen Bölgesinin Dizileme Çalışmasında Kullanılan Gereçler
16S rRNA, baz dizileme analizinde kullanılan oligonükleotit primerler, bu
primerlerin nükleotit dizileri ve bağlanma bölgeleri aşağıda verilmiştir.
Primer Adı:27f – 5’ AGAGTTTGATCTGGCTCAG-3’
Bağlanma Bölgesi 8 - 27
Primer Adı : MG3f- 5’ CAGCAGCCGCGGTAATAC-3’
Bağlanma Bölgesi 520 - 536
Primer Adı: MG5f- 5’ AAACTCAAAGGAATTGACGG-3’
Bağlanma Bölgesi 907 - 926
Primer Adı: 1525R – 5’AAGGAGGTGWTCCARCC-3’
Bağlanma Bölgesi 1544 - 1525
3.2. Yöntemler
Çalışmamızda örnek alımından bakteri türlerinin PZR ile tanımlanmasına kadar
olan aşamalarda kullanılan yöntemler aşağıda belirtilmiştir.
1-Hastalara ait bilgilerin yer aldığı formların doldurulması
2-Hastalardan örneklerin alınması ve laboratuvara taşınması
3-Besiyerlerine ekim, aerop/anaerop ortamların sağlanması ve inkübasyon
4-Üretilen bakterilerin tanımlanması
5-Kültürde
üretilen
bakterilerin
antimikrobik
maddelere
dirençlerinin
belirlenmesi
6-Gram
preparasyonlarda
bakteri
görüldüğü
halde
kültürlerde
bakteri
üretilemeyen örneklerin PZR ile incelenmesi.
3.2.1. Hastalara Ait Formların Doldurulması
Çalışmamızda İstanbul Üniversitesi Tıbbi Etik Kurul Yönergesi’ne göre
hastaların yasal temsilcilerinin bilgilendirilmiş onayları alındı. Genel Cerrahi Meme
Polikliniği’ne gelen mastitli hastalara ait bilgilerin yer aldığı formlar dolduruldu. Bu
formlarda; çalışmaya dahil edilen hastaların; yaş, cinsiyet, doğurma şekli ve kaçıncı
doğumları
olduğu,
emzirme
süreleri,
emzirme
döneminde
pompa
kullanılıp
46
kullanılmadıkları, mastite bağlı süt miktarındaki değişim, apsenin başlangıç tarihi,
apsenin tahmini nedeni, sigara ve alkol kullanımı, aile içi stres durumları, yakın
zamanda geçirilmiş ya da var olan önemli hastalıkları, kullanmakta oldukları antibiyotik
veya diğer ilaçlar, üriner enfeksiyon geçirip geçirmedikleri, ailede mastit öyküsü varlığı
sorgulandı. Hekimin klinik tanısına göre mastitin (laktasyonel/non-laktasyonel) tipi
kaydedildi (Form 1).
3.2.2. Hastalardan Örnek Alınması ve Laboratuvara Taşınması
Apseden alınan cerahat örnekleri, Genel Cerrahi Meme Polikliniği’ne başvuran
mastitli hastalardan, cerrahi hekimleri tarafından, steril enjektör ile herhangi bir
anestezik madde kullanılmadan alındı. Alınan örnekler zaman kaybedilmeden derhal
laboratuvara getirildi. Doku biyopsileri ise derhal Carry & Blair transport besiyerine
alınarak laboratuvara getirildi.
3.2.3. Besiyerlerine ekim, aerop/anaerop ortamların sağlanması ve inkübasyon
Aerop kültüre alınacak cerahat örnekleri, azaltma yöntemi ile direkt olarak, doku
örnekleri ise steril bir Petri kutusu içinde, steril bistüri ile küçük parçalara ayrılarak %5
koyun kanlı agara, çukulatamsı agar ve MacConkey agar besiyerlerine ekildi.
Besiyerleri 37°C’ de 24 saat inkübe edildi. 24 saat sonucunda üreme görülmemesi
halinde inkübasyon 72 saate kadar uzatıldı. Anaerop kültüre alınacak cerahatler ve
küçük biyopsi parçaları, kanlı, kanamisin-vankomisinli anaerop agar, kanlı, fenil etil
alkollü anaerop agar, kanlı anaerop agar, zenginlestirilmiş tiyoglikolatlı sıvı
besiyerlerine ekilerek, anaerop jarlarda anaerop ortam sağlayıcılar (Oxoid AnaerogenTM,
BD GasPak EZ Anaerobe Container System) ile 37°C’ de en az 72 saat inkübe edildi.
Cerahatten bir miktar steril bir ependorfa alındı ve ihtiyaç duyulması halinde moleküler
testlerde kullanılmak üzere -80°C’ de saklandı.
3.2.4. Aerop Bakterilerin İzolasyon ve Tanımlanmasında Kullanılan Yöntemler
Cerahat ve doku parçalarından yapılan ekimlerden sonra direkt örnekten Gram
preparasyonları
hazırlandı.
Ayrıca
inkübasyon
sonrası
örneklerin
ekildiği
besiyerlerindeki üreyen kolonilerden hazırlanan kültür preparasyonları Gram yöntemi
ile boyandı ve değerlendirildi.
47
Gram boyama
Cerahat örneği ya da doku parçası direkt lama sürülerek kurumaya bırakıldı ve
daha sonra Gram yöntemi ile boyandı. Kültür preparatlarının hazırlanması için üreyen
kolonilerden alınarak bir damla tuzlu su konmuş lama yayıldı ve kurumaya bırakıldı.
Daha sonra bu preparatlar Gram yöntemi ile boyandı. Gram boyama yönteminde havada
kurutulup alevde tespit edilen preparatlar üzerine; kristal viyole damlatılıp 2 dakika
beklendi. Daha sonra su ile yıkandı. Lugol damlatılıp 2 dakika bekletildikten sonra
tekrar su ile yıkandı. Alkol ile renkli sıvı akana kadar renk giderildi ve su ile yıkandı.
Son olarak, sulu fuksin damlatılıp 30 saniye beklendi ve su ile yıkandı. Boyamanın
ardından preparatlar havada kurutuldu. Hazırlanan preparatlar immersiyon yağı
damlatılarak 100’lük büyütmeli objektif ile ışık mikroskobunda incelendi (45).
Preparatta görülen mikroorganizmaların Gram boyanma özellikleri, morfolojileri,
miktarları ve lökosit varlığı kaydedildi.
3.2.4.1. Gram Pozitif Diplokokların Tanımlanması
24 saatlik kültürlerden hazırlanan Gram preparasyonların incelenmesi sonucu,
kültürlerde Gram pozitif diplokok olduğu saptanan bakterilerin tanımlanmasında;
katalaz, Dnaz testi, koagülaz deneyi, novobiosin, basitrasin ve optokin disklerine olan
duyarlılık veya dirençlerinin belirlenmesi, PYR testi ve gereğinde APİ kitleri ile
Phoenix cihazı kullanıldı.
Katalaz Enziminin Belirlenmesi
Gram
pozitif
kok
morfolojisine
sahip
olan
Streptococcaceaeve
Micrococcaceaefamilyasındaki etkenleri ayırt edebilmek için katalaz testi uygulandı.
18–24 saatlik inkübasyonundan sonra çukulatamsı besiyerinden steril plastik bir özeyle
alınan koloniler lama sürüldü, üzerine 1 damla %3’lük H2O2 damlatıldı. Katalaz enzimi
oluşturan bakteriler H2O2’yi su ve oksijene ayrıştırdığı için ortamdaki oksijen çıkışı
kabarcık oluşumu ile belirlendi. Kabarcıklar oluşmadığında ise katalaz negatif olarak
degerlendirildi (48).
48
Dnaz Testi
24 saatlik kültürlerden hazırlanan Gram preparasyonların incelenmesi sonucu
Stafilokok olduğu belirlenen kökenlerden DNaz besiyerine çizgi ekimi yapıldı. Besiyeri
37°C’de 18-24 saat inkübe edildi. İnkübasyondan sonra besiyerinin tüm yüzeyini
kaplayacak şekilde %1’lik HCl döküldü. Üreme çizgisinin çevresinde saydam bölgenin
oluşması kökenin DNaz pozitif olduğunu gösterdi. Saydam bölge oluşturmayan
kökenler ise DNaz negatif olarak kabul edildi (45).
Koagülaz Deneyi
Staphylococcus aureus’un diğer stafilokoklardan ayırt edilmesinde kullanıldı.
Koagülaz deneyi iki yöntemle yapıldı.
Tüp Deneyi: Bu deney ile besiyerinde üreyen Stafilokokların oluşturdukları ve
besiyerine saldıkları bağımsız koagülaz araştırıldı. Koagülaz enzimi plazmada bulunan
Coagulase reacting factor (CRF) ile ilişki kurarak fibrinojeni pıhtılaştırmayı sağladı. Bir
deney tüpü içerisine 1 mL fizyolojik tuzlu su konuldu ve stafilokoklarla yoğun bir
süspansiyon hazırlandı. Bu süspansiyondan 0,5 mL alınarak, içinde 0,5 mL 1:5 oranında
sulandırılmış sitratlı plazma bulunan tübe aktarıldı. 37°C’de beklettiktensonra 1. ve 4.
saatlerde ekim yapılmış tüpler kontrol edildi. Pıhtı oluşmamasıdurumunda tüpler oda
ısısında bir gece bekletildi. Pıhtının oluşması pozitif oluşmaması ise negatif sonuç
olarak değerlendirildi (45).
Lam Deneyi: Bu deney ile bağlı koagülaz=kümeleştirici faktör=clamping factor
ortaya konuldu. Bakteri yüzeyindeki faktör plazmadaki fibrinojeni pıhtılaştırarak
stafilokokların kümelenmesini sağladı. Temiz bir lamın bir ucuna 1 damla fizyolojik
tuzlu su, diğer ucuna da bir damla plazma damlatıldı. 24 saatlik kültürlerden hazırlanan
Gram preparasyonların incelenmesi sonucu Stafilokokolduğu belirlenen kökenlerden
öze ile alındı ve bu iki damlaya karıştırılıp homojen süspansiyon haline getirildi.
Çevirme hareketleri ile karıştırıldı. 1,0-3,0 saniye içinde stafilokoklarda gözle görülen
kümelerin oluştuğu kökenler pozitif olarak değerlendirildi (45).
Optokin (etilhidrokuprein hidroklorit) Duyarlılık Testi
Streptokok morfolojisine sahip olan ve alfa hemoliz yapan birkaç koloni öze
yardımı ile alınarak %5 koyun kanlı besiyerine homojen olacak şekilde ekildi. Ekimi
yapılan plaklar üzerine, 5 μg optokin içeren Taxo ‘P’ diski (BBL) yerleştirilerek 35
49
°C’de %5 CO2’li etüvde 18-24 saat inkübasyona bırakıldı. Diskin etrafında 14 mm’ye
eşit ya da daha fazla inhibisyon zonu oluşturarak üreyen bakteriler, S. pneumoniae
olarak tanımlandı (45).
PYR (L-pirolidonil-β-naftilamid) Testi:
PYR testi ile bakterideL-pyrrolidonyl arylamidase varlığı araştırıldı. Bu enzim
L-pirolidonil-β-naftilamid’i hidroliz eder. Hızlı testte (BBL DrySlide PYR Kit), PYR
maddesi emdirilmiş filtre kağıdına Enterokok morfolojisine sahip olan birkaç koloni öze
yardımı ile alınarak konuldu, önce bir damla solvent ayıracı damlatıldı ve 5 dakika
beklendi. Ardından üzerine bir damla PYR ayıracı kondu. 30-60 saniye içinde reaksiyon
için beklendi.L-pyrrolidonyl-beta-naphthylamide hidrolizi sonucunda açığa çıkan betanaphthylamine spesifik renk indikatörü varlığında kırmızı renk oluşumu pozitif olarak
değerlendirildi. Kırmızı renk oluşturan koloniler Enterococcus spp. olarak tanımlandı.
Sarı veya portakal rengi negatif olarak değerlendirildi (45).
3.2.4.2. Gram Negatif Çomakların Tanımlanması
24 saatlik kültürlerden hazırlanan Gram preparasyonların icelenmesi sonucu,
kültürlerde Gram negatif çomak olduğu saptanan ve MacConkey agarda üreyen farklı
morfolojilerdeki kolonilerden; üç şekerli demirli agar (TSI), hareket-indol-ornitin
(MİO), Christensen, sitrat ve Dekstroz (D) besiyerlerine ekim yapıldı ve oksidaz
özellikleri incelendi. Gereğinde Phoenix cihazı kullanıldı (45).
Oksidaz Özelliğinin İncelenmesi
Petri kutusu içine süzgeç kâğıdı yerleştirildi ve ortasına 2-3 damla Kovaks
ayıracı damlatıldı. Gram negatif bakterilerin 18-24 saatlik saf kültürlerinden, tek
kullanımlık plastik steril öze ile alınarak ayıracın damlatıldığı yere sürüldü. Koyu mor
rengin oluşumu oksitlenmenin varlığını ifade ettiğinden pozitif sonuç olarak
değerlendirildi (45).
Üç Şekerli Demirli Agar (TSI) Besiyerinde Üremenin Değerlendirilmesi
D-Glikoz ve sükroz fermantasyonunun varlığı, 18-24 saatlik inkübasyondan
sonra, besiyerinin kırmızımsı renginin, tüpün dip kısmından başlayarak sarıya
dönüşmesi ile değerlendirildi. Sarı renk oluşumu pozitif olarak değerlendirildi. Laktoz
fermantasyonunun varlığı, 18-24 saatlik inkübasyondan sonra, besiyerinin eğik
yüzeyinin kırmızıdan sarıya dönüşmesi ile değerlendirildi. H2S oluşumu, 18-24 saatlik
50
inkübasyondan sonra, besiyerinde yüzeyden başlayıp derine doğru ilerleyen siyahlaşma
ile tanımlandı (45).
Hareket, İndol, Ornitin Özelliklerinin Değerlendirilmesi
Bakterilerde hareket özelliği: Gram negatif bakterilerin MİO besiyerinde 18–24
saatlik inkübasyonundan sonra, besiyerinin tam ortasında, inokulasyon hattı boyunca
sınırlı bir üreme gösteren ve besiyerine dağılmayan kökenler hareketsiz, besiyerinde
dağılarak homojen bir bulanıklığın oluşmasına neden olan kökenler ise hareketli
bakteriler olarak değerlendirildi. (45,73).
İndol oluşumunun belirlenmesi: Gram negatif bakterilerin MİO besiyerinde 18–
24 saatlik inkübasyonundan sonra besiyerine 0,2-0,3 ml Kovacs indol ayıracı eklendi;
kırmızı renk oluşumu indol varlığını gösterdi (73).
Ornitin varlığının belirlenmesi: Gram negatif bakterilerin MİO besiyerinde 18–
24 saatlik inkübasyonundan sonra oluşan sarı rengin, mora dönüşümü ornitin
dekarboksilaz varlığında putresin oluşumunu gösterdi. Ornitin dekarboksilaz oluşmazsa
ortam sarı kalır (73).
Üreaz Aktivitesinin İncelenmesi
Gram
negatif
bakterilerin
Christensen
besiyerinde
18–24
saatlik
inkübasyonundan sonra üreaz enziminin aktivitesi ile ürenin hidrolizi sonucu amonyak
ve karbondioksit oluşur ve ortam alkalileşir. Besiyerinin renginin pembeye dönüşmesi,
üreaz enziminin varlığını gösterdi (45).
Sitrat Özelliğinin İncelenmesi
Gram negatif bakterilerin sitrat besiyerinde 18–24 saatlik inkübasyonundan
sonra bakterilerin sitrat kullanımı sonucunda amonyum tuzlarından nitrojen açığa
çıkması ile besiyeri alkalileşir ve besiyerinde bulunan bromtimol mavisinden dolayı
alkalen ortamda yeşil renkli besiyeri maviye döner. Besiyerinin renginin koyu maviye
dönmesi pozitif sonuç olarak yorumlandı (45).
Glikoz Fermantasyonunun İncelenmesi
Gram negatif bakterilerin dekstroz besiyerinde 18–24 saatlik inkübasyonundan
sonra bakterilerin glikoza etkisi nedeniyle ayıraç asit reaksiyon vererek yeşilden sarıya
51
döner. Bu durumda glükoz fermantasyonu pozitif kabul edildi. Besiyerinin parçalanmış
olması, gaz oluşumu olarak değerlendirildi (45).
3.2.4.3. Gram Pozitif Çomakların Tanımlanması
24 saatlik kültürlerden hazırlanan Gram preparasyonların incelenmesi sonucu,
kültürlerde Gram pozitif çomak olduğu saptanan bakterilerin tanımlanması; Gram
preparasyondaki görünümleri (Çin harfleri gibi şekiller çizecek tarzda dizilmeleri,
dallanma varlığı) ve spor oluşturup oluşturmamalarına göre yapıldı (24). Gereğinde
Phoenix cihazı kullanıldı (72).
3.2.5. Anaerop Bakterilerin İzolasyon ve Tanımlanmasında Kullanılan Yöntemler
Anaerop besiyerlerinde üreyen her farklı koloniden Gram preparasyonları
hazırlandı ayrıca eş zamanlı olarak bir kanlı anaerop besiyerine ve iki çukulatamsı agar
besiyerine saf kültürler elde edilmek üzere pasajlar alındı. Kanlı anaerop besiyeri derhal
jara kaldırıldı ve oksijensiz ortam sağlayıcı AnaeroGen ile 37°C’de en az 72 saat inkübe
edilerek muhtemel anaerop bakterilerin saf kültür şeklinde üretimi için gereken şartlar
sağlandı. Pasaj alınan çukulatamsı besiyerlerinden biri 37°C’de etüvde tutularak
muhtemel aerop bakterilerin üremesi, diğeri ise 37°C’de karbondioksitli ortamda 72 saat
tutularak muhtemel aerotoleran bakterilerin üremesi sağlandı (75, 76, 77).Aerop
şartlarda ve karbondioksitli ortamda tutulan besiyerlerinde üremeyen yalnızca anaerop
şartlarda tutulan besiyerlerinde üreyen bakteriler anaerop bakteri olarak değerlendirildi.
Bakterilerin tanımında APİ 20 A kiti ve gereğinde moleküler yöntemler kullanıldı (74).
3.2.6. Aerop ve Anaerop Bakterilerin Tanısında Kullanılan Moleküler Yöntemler
3.2.6.1. DNA İzolasyonu
DNA izole edeceğimiz apse cerahatinden ya da cerahatin ekildiği tiyoglikolatlı
sıvı besiyerinden 200 µl alınarak Magna Pure 96 (Roche Diagnostics GmBH,
Mannheim – Almanya) cihazı kartuşlarına eklendi ve üretici firma direktifleri
doğrultusunda Magna Pure 96 cihazında (Roche Diagnostics GmBH / Mannheim –
Almanya), Magna Pure 96 DNA/Viral NA Small volume kiti (Roche Diagnostics
GmBH/Mannheim – Almanya) ile Pathogen universal 200 2.0 protokolü kullanılarak
çalışıldı. İşlem tamamlandığında sistemden 100 µl DNA elde edildi. Bu elde edilen
DNA’lar Nanodrop spektrofotometre (Nanodrop Technologies, Wilmington, DE, USA)
52
aracılığıyla 260 nm’de kontrol edilerek konsantrasyonlarının ve 260/280 nm’de kontrol
edilerek saflıklarının ölçümü yapıldı. Örnekler spektrofotometrede ve agaroz jelde
yapılan kontrollerden sonra 1,5 ml’lik steril ependorf tüplere alınıp -20 °C’de DNA dizi
analizi için 16S rRNA amplifikasyonu gerçekleştirilinceye kadar saklandı.
3.2.6.2. DNA Miktar Tayini ve DNA Saflık Derecesinin Belirlenmesi
DNA örneklerinin miktar tayini ve saflık derecesi, UV spektrofotometrede
sulandırılmış örneklerin 260 ve 280 nm dalga boylarında okuma değerleri alınarak
belirlendi. 260 nm dalga boyunda ölçülen absorbsiyon değerleri (A260) DNA solüsyonu
içerisindeki DNA miktarını ve 280 nm dalga boyunda ölçülen absorbsiyon değerleri
(A280) ise protein miktarını göstermektedir.
DNA örneğinin saflık derecesi 260 ve 280 nm dalga boylarında okunan değerler
arasındaki oran (A260 / A280) hesaplanarak belirlendi (78).
3.2.6.3. Agaroz Jel Elektroforezi
Agaroz jel, jel tankına dökülmüs ve taraklar yerlestirilmistir. Jel katılaştıktan
sonra taraklar çıkarılmıs, 1x TAE tamponu ile doldurulan elektroforez sistemine
yerleştirilmistir. 5 μl DNA örnegi, 1 μl 6x yürütme tamponuyla yüklenmiştir.
Örneklerin yüklenmesinden sonra 500ng DNA moleküler agırlık belirteci (GeneRuler
DNA Ladder Mix, Fermentas, 1 kb) ilk kuyuya yüklenmiştir. 50 mA ’de 3 saat süreyle
elektroforez yapılmış ve DNA miktar ve kalitesi jel dokümantasyon sisteminde
(GeneLine, ABD) incelenmiştir.
3.2.6.4. 16S rRNA'nın PZR Amplifikasyonu
16S rRNA'nın polimeraz zincir reaksiyon işlemleri 0,5 ml 'lik PZR tüplerinde
Thermal Cycler (T100 Biorad, Fransa)’da yapıldı. DNA örneklerinin 16S rRNA genini
kodlayan DNA bölgesinin amplifikasyonu için evrensel iki primer (27f ve 1525r)
kullanıldı (79). PZR reaksiyonu için hazırlanan bütün stok solüsyonlar otoklav edilmiş
DDH2O ile hazırlandı. Stok solüsyonlar kontaminasyon riskine karşılık küçük
miktarlarda (25–100 μl) steril ependorflara bölünerek kullanıma kadar tüm stok
solüsyonlarla birlikte -18°C'de saklandı. Hedef DNA bölgesinin amplifikasyonundan
otomatik sekanslama aşamasına kadar olan tüm işlem basamakları aşağıda belirtilmiştir.
53
1. dNTP mix, primer solüsyonları, MgCl2 ve 10xTaq tampon buz üzerinde
çözüldü ve buzda tutulmaya devam edildi. Taq DNA polimeraz gereksinim
duyuluncaya kadar -18°C’ de tutuldu.
2. PZR amplifikasyonu için kullanılan bir örnek için 50 μl ölçüdeki reaksiyon
karışımı örnek sayısınca artırılarak Taq DNA polimeraz ve DNA örnekleri hariç 1,5 ml
steril ependorf tüpü içerisine buz üzerinde transfer edildi.
3. Reaksiyon karışımından ayrı olarak her bir örnek için DDH2O ve DNA
örnekleri toplam 10 μl olacak şekilde steril PZR tüpü içerisine transfer edildi ve T100
(Biorad Fransa) Thermal Cycler’da 95°C' de 5 dk ön denatürasyona tabi tutuldu.
4. Ön denatürasyonu takiben tüpler buz ortamına alınıp 5 dk bekletildi.
5. -18°C’den Taq DNA polimeraz alınarak buzda bekletilen reaksiyon
karışımına hızlı bir şekilde ilave edildi.
6. Reaksiyon karışımı her bir örnek için toplam hacim 50 μl olacak şekilde
tüplere buz üzerinde transfer edildi (Tablo 1).
7. Transfer işleminden hemen sonra PZR reaksiyonu (T100 Biorad Fransa)
Tablo 2’de belirtilen şartlarda başlatıldı.
Tablo 3-1: 16S rRNA'nın PZR amplifikasyonu için kullanılacak reaksiyon karışımının
hazırlanışı
10xTaq tampon
MgCl2
dNTP (25 mM)
5 μl
1,5 μl
1 μl
27f (20 μM)
2,5 μl
1525r (20 μM)
2,5 μl
Taq DNA polimeraz (HotStarTaq®, QIAGEN)
0,25 μl
DNA (50–300 ng)
1 μl
DDH2O
X μl
Toplam hacim
50 μl
54
Tablo 3-2: 16S rRNA'nın PZR amplifikasyonu içim kullanılacak reaksiyon karışımının
transfer işlemnden sonra PZR reaksiyonu için belirtilen şartlar.
Ön Denatürasyon
Ön Denatürasyon
Amplifikasyon
Denatürasyon
Bağlanma
Elongasyon
Bitiş
Soğuma
Son
Uzama
Uzatma
95°C
95°C
55°C
72°C
72°C
4°C
5 dk
1 dk
2 dk
3 dk
10 dk
1 dk
1 döngü
1 döngü
1 döngü
35 döngü
3.2.6.5. 16S rRNA Gen Bölgesinin Dizileme Çalışması
PZR amplifikasyon ürünleri elde edildikten sonra çalışma izolatlarımızın
16Sgen bölgesinin saflaştırılması ve baz dizi analizi, farklı 4 oligonükleotit primeri ile
ABI 3730XL (otomatik baz dizileme) cihazı ile üretici firma direktifleri doğrultusunda
okunmuş ve kromatogramları alınmıştır.
3.2.6.6. 16S rRNA Sekans Verilerinin Analizi
ABI formatındaki kromatogram dosyaları fasta formatına dönüştürüldükten
sonra Sequencer 4.10.1, MEGA 4.1, Finch TV programları kullanılarak karşılaştırmalı
ve manuel olarak dört farklı primerden elde edilen diziler birleştirildi ve 16S rRNA
dizileri elde edildi(80). 4 farklı primer kullanılarak hazırlanan 1446–1515 nt
uzunluğundaki 16S rRNA gen fasta dizileri analizlerde kullanıldı(80).
16S rRNA gen dizileri http://www.ncbi.nlm.nih.govweb adresinden tek tek
indirilerek elde edilen bakteri tip örneği 16S rRNA nükleotit baz dizileri ile test
örneklerinin baz dizileri MEGA 4.1 programı kullanılarak dizilendi. DNA dizilerinin
biyoenformatik programları tarafından okunması içi belli standart formatlar
oluşturulmuştur ve bunların en yaygını fasta dizileridir (80).Elde edilen bu fasta dizileri
NCBI ve DSMZ gibi gen bankalarından kontrol edildikten sonra bakteri
isimlendirilmesinde kullanıldı.
3.2.7. Aerop
ve
Anaerop
Bakterilerin
Belirlenmesinde Kullanılan Yöntemler
Antimikrobiyal
Duyarlılığının
Disk difüzyon testi
Çalışmada, amoksisilin/klavulonik asit (20/ 10 μg), siprofloksasin (5 μg),
vankomisin (30 μg), klindamisin (2 μg), eritromisin (15 μg), meropenem (10 μg),
55
imipenem (10 μg), seftazidim (30 μg), seftriakson (30 μg), penisilin (10 μg),
kotrimoksazol (1.25/ 23.75 μg), gentamisin (10 μg), linezolid (10 μg) diskleri kullanıldı
ve test Mueller-Hinton agar besiyeri üzerinde yapıldı. Zor üreyen mikroorganizmalar
için kan ilave edildi. Besiyeri Petri kutularına 4 mm kalınlığı geçmeyecek şekilde
döküldü ve bakteri steril serum fizyolojik içinde 108 bakteri/ml olacak şekilde
süspansiyon haline getirildi. Bunun için McFarland tüpleri kullanıldı. Müeller-Hinton
agar besiyeri üzerine 3 öze bakteri süspansiyonu konduktan sonra steril bireküvyon
yardımıile süspansiyon besiyeri yüzeyine yayıldı ve antibiyotik diskleri besiyeri üzerine
aralarında en az 24 mm ve Petri kutusu kenarlarına 14 mm uzaklık olacak şekilde
yerleştirildi (63). Besiyerleri, 18-24 saat 37 ºC’de inkübe edildi ve duyarlılık ürememe
zonlarına göre değerlendirildi. Zonlar ölçüldü ve sonuçlar European Committee on
Antimicrobial Susceptibility Testing (EUCAST) standartlarına göre, duyarlı, orta
duyarlı ya da dirençli olarak değerlendirildi (63,81).
E-test
Dilüsyon ve disk difüzyon tekniklerinin belirli dezavantajları elimine edilerek
MİK sonuçları elde etmek amacıyla geliştirilmiştir. Anaerop bakterilerin duyarlılığının
belirlenmesinde MİK belirlemeye yönelik testler önerildiğinden, uygulaması en kolay
olan E test yöntemi kullanılmıştır. Penisilin, amoksisilin/klavulonik asit, imipenem,
klindamisin, metronidazol ve sefoksitin E-test stripleri ile, antibiyotiklerin anaeroplara
karşı MIK değerleri belirlenmiştir. E-test uygulanmadan önce bakteri suşlarından 0.5
Mc Farland bulanıklığındaki süspansiyon Schaedler broth besiyerinde hazırlanmıştır.
Hazırlanan süspansiyon modifiye Brusella Agar besiyerinin yüzeyine
yayılmış ve
kuruması için birkaç dakika beklendikten sonra E-test şeritleri yerleştirilmiştir.
Besiyerleri jara kaldırılarak oksijensiz ortam sağlayıcı AnaeroGen ile 37 °C’ de en az 72
saat inkübasyona bırakılmıştır. İnkübasyon sonrasında elips şeklindeki inhibisyon
zonunun strip ile kesiştiği nokta MİK değeri olarak değerlendirilmiştir (66).
3.2.8. İstatistiksel yöntemler
Araştırmamızda laktasyonel mastitli hastalarda ve non-laktasyonel mastitli
hastalardan granülomatöz mastitli olanlarda üretilen bakterilerle hasta grupları arasında
bir ilişki
olup olmadığı SPSS ile Spearman’s korelasyon analizi yapılarak
belirlenmiştir.Analizde bakteriler ve bu bakterilerin üretildiği hasta sayıları değişkenler
olarak kullanılmıştır. p<0,05 istatistiksel olarak anlamlı kabul edilmiştir.
56
4. BULGULAR
Çalışmamızda mastit tanısı almış olan 100 hastanın cerahat/doku örneklerinden
yapılan aerop, anaerop kültür, PZR ve antimikrobial duyarlılık çalışmaları sonucunda
elde edilen veriler aşağıda açıklanmıştır.
Araştırmaya dahil edilen 100 mastit hastasından 44’ü laktasyonel mastit 56’sı
non-laktasyonel mastit tanısı almıştır (Şekil 4–1).Tüberküloz mastiti saptanmış hastalar
çalışmaya dahil edilmemiştir.
Şekil 4-1: Laktasyonel ve non-laktasyonel mastit tanısı almış hastaların dağılımı.
Non-laktasyonel mastit tanısı almış 56 hastanın 10 (%17,8)’u periduktal mastit,
46 (%82,1)’sı ise granülomatöz mastit olarak tanımlanmıştır. Bu tanımlama hastaların
klinik özellikleri ve her bir hastaya ait histopatolojik inceleme raporu sonucuna göre
genel cerrahi anabilim dalında sorumlu uzman tarafından yapılmıştır. Periferal
enfeksiyonlu hastaya rastlanmamıştır (Şekil 4-2).
Şekil 4-2: Non-laktasyonel mastitli 56 hastada granülomatöz mastitli ve periduktal mastitli
olguların dağılımı.
57
Çalışmaya alınan laktasyonel mastitli 44 hastanın yaşlarının 22 ile 34 arasında
değiştiği ve yaş ortalamasının 29 olduğu buna karşın non-laktasyonel mastit tanısı almış
hastalardan periduktal mastitli grupta yaş aralığının 38 ile 41 arasında değiştiği ve yaş
ortalamasının 39,5 olduğu, granülomatöz mastitli grupta ise yaş aralığının 23 ile 55
arasında değiştiği ve yaş ortalamasının 34,5 olduğu saptanmıştır.Laktasyonel mastitli 40
yaş üstü hastaya rastlanmamasına karşın non-laktasyonel mastitli hasta grubunda 40 yaş
üstü hastaların bulunduğu ve %25-30’unu oluşturdukları belirlenmiştir (Tablo 4–1,
Şekil 4-3).
Tablo 4-1: Laktasyonel ve non-laktasyonel mastitli hastalarda yaş aralığı ve yaş ortalaması.
Hastalar
Laktasyonel Mastit (44)
Yaş aralığı
Yaş ortalaması
22–34
29
38- 41
39,5
23–55
34,5
Nonlaktasyonel mastit (56 )
Periduktal mastit (10)
Nonlaktasyonel mastit (56 )
Granülomatöz mastit (46)
Şekil 4-3:Laktasyonel ve non-laktasyonel mastitli hastalarda yaş gruplarının dağılımı.
58
Tablo 4-2: Laktasyonel ve non-laktasyonel mastitli hastalara ait özelliklerin dağılımı. s(%).
Hastaların özellikleri
Laktasyonel mastitli
hastalar
s:44
Non-laktasyonel mastitli
hastalar
s:56
Periduktal
mastit
s:10
Granülomatöz
mastit
s:46
21 (47,7)
23 (52,3)
3 (30)
7 (70)
18 (39,1)
28 (60,8)
10 (23)
34 (77,2)
2 (20)
8 (80)
21 (45,6)
25 (54,3)
2 (4,5)
42 (95,4)
0
10 (100)
4 (8,4)
42 (91,3)
Var
Yok
10 (23)
34 (77,2)
6 (60)
4 (40)
28 (60,8)
18 (39,1)
Var
Yok
33 (75)
11 (25)
7 (70)
3 (30)
27 (58,6)
19 (41,3)
Var
Yok
0
44 (%100)
0
10 (%100)
0
46 (%100)
Var
Yok
7 (15,9)
37 (84)
9 (90)
1
28 (60,8)
18 (39,1)
Var
Yok
12 (27,2)
32 (72,7)
3 (30)
7 (70)
11(23,9)
35 (76)
Var
Yok
26 (59)
18 (40,9)
6 (60)
4 (40)
24 (52,1)
22 (47,8)
Var
Yok
20 (45,4)
24 (54,5)
5 (50)
5 (50)
10 (21,7)
36 (78,2)
Doğurma şekli
Normal
Sezaryen
Pompa kullanımı ile travma
Var
Yok
Darbe ile travma
Var
Yok
Hastada geçirilmiş
mastit öyküsü
Mastitle birlikte
üriner enfeksiyon
Otoimmün hastalık
Sigara Kullanımı
Alkol Kullanımı
Aile içi stres
Ailede mastit öyküsü
59
Hastaların sosyodemografik özellikleri incelendiğinde non-laktasyonel mastitli
hastalardan özellikle periduktal mastitlilerde sigara kullanımının belirgin şekilde yüksek
olduğu (9/10) laktasyonel mastitlilerde ise çok düşük olduğu (7/44) belirlenmiştir.Gerek
laktasyonel (12/44) gerekse non-laktasyonel mastitli (15/56) hastalarda alkol
kullananların sayısında benzerlik olduğu görülmüştür. Aile içi stres laktasyonel mastitli
hastaların 26 (%59)’sında, non-laktasyonel mastitli hastalardan periduktal mastitli
olguların 6 (%60)’sında ve granülomatöz mastitli olguların 24 (%52,1)’ünde
belirlenmiştir. Çalışmaya aldığımız hastaların diğer aile bireylerinde mastit öyküsü olup
olmadığı araştırıldığında laktasyonel mastitli 20 (%45,4) hastanın ve non-laktasyonel
mastitli 15 (%26,7) hastanın abla,kardeş ya da teyzelerinin mastit geçirmiş olduğu
saptanmıştır(Tablo 4- 2).
Araştırmamızda
mastit
tanısı
almış
hastaların
kültür
sonuçları
değerlendirildiğinde, laktasyonel mastit tanısı almış 44 hastanın 38 (%86,4)’inde bakteri
ürediği, 6 (%13,6) ’sında ise bakteri üremediği tespit edilmiştir (Şekil 4–4).
Şekil 4-4: Laktasyonel mastitli hastaların örneklerinde bakteri üremesi saptananların oranı
Non-laktasyonel mastit tanısı almış hastalardan periduktal mastitli olan grupta 4
(%40) hastada ve granülomatöz mastitli grupta 20 (%43,7) hastada üreme görülmüştür
(Şekil 4–5).
Şekil 4-5: Non-laktasyonel mastitli hastaların örneklerinde bakteri üremesi saptananların
oranı(A:Periduktal mastitli grup, B: Granülomatöz mastitli grup)
60
Araştırmamızda, laktasyonel mastitli 1 hastanın ve non-laktasyonel mastitli
olgulardan granülomatöz mastitli 19 (%28) hastanın örneklerinde üreme olmadığı halde
bu örneklerden hazırlanan Gram preparasyonlarda bakteri görülmüştür (Şekil 4–6).
Şekil 4-6: Kültürde üreme olmadığı halde Gram boyamada bakteri görülen örneklerin
hasta gruplarına göre dağılımı.
Çalışmaya dahil ettiğimiz laktasyonel ve non-laktasyonel mastit tanısı almış 100
hastada üreyen aerop bakterilerin dağılımı incelendiğinde Gram pozitif diplokokların en
yüksek oranda üreyen bakteriler olduğu belirlenmiştir. Bu oranı ikinci sırada Gram
pozitif çomaklar takip etmektedir; üçüncü sırada ise Gram negatif çomaklar yer
almaktadır.
Gram
pozitif
diplokoklardan
Staphylococcus
aureus’un
özellikle
laktasyonel mastitli hastalarda çok yüksek oranda olduğu(%43,1), non-laktasyonel
mastitli hastalarda ise Staphylococcus aureus’un periduktal mastitlilerde %40,
granülomatöz mastitlilerde ise %4,3 oranında ürediği saptanmıştır. Gram pozitif
diplokoklarda üreme oranı bakımından ikinci sırada yer alan Staphylococcus
epidermidis’inlaktasyonel mastitli hasta grubunda %9 oranında ürerken non-laktasyonel
mastitli hasta grubunda hiç üremediği gözlenmiştir. Buna karşın, Staphylococcus
saprophyticus laktasyonel mastitli yalnızca 2 hastada ve granülomatöz mastitli yalnızca
1 hastada saptanmıştır. Streptokokların laktasyonel mastitli hastalarda hiç bulunmadığı
gözlenirken, non-laktasyonel mastitli hastalarda Streptococcus pyogenes 1 periduktal
mastit olgusunda ve 1 granülomatöz mastit olgusunda ayrı ayrı üremiştir. Non-hemolitik
streptokok ise yalnızca 1 granülomatöz mastitli olguda üremiştir. Bu durumda
streptokok türlerinin stafilokoklara göre mastitli hastalarda çok daha düşük oranda
ürediği belirlenmiştir (Tablo 4–3).
61
Gram pozitif diplokokları, Gram pozitif çomaklardan özellikle Corynebacterium
türleri takip etmiştir. Corynebacterium kroppenstedtii laktasyonel mastitli hiçbir hastada
üremezken granülomatöz mastitli 7 (%15,2) hastada üremiş, Corynebacterium
urealyticum ve Corynebacterium amycolatum iselaktasyonel mastitli yalnızca birer
hastada ürerken C. urealyticum granülomatiz mastitli 3 (%6,5), C. amycolatum ise 2
(%4,3) hasta örneğinde üremiştir. Bu türlerin non-laktasyonel mastitli hastalardan
granülomatöz mastit tanısı almış grupta %26,1 oranda üremesi, buna karşın periduktal
mastitli hiçbir hastada ürememesi ve laktasyonel mastitli 2 hastada üremesi dikkat
çekmiştir(Tablo 4–3)..
Araştırmamızda, Gram negatif çomaklardan başta Escherchia coli olmak üzere
Proteusmirabilisve Klebsiella pneumoniaetürlerinin ürediği saptanmıştır. Escherchia
coli yalnızca laktasyonel mastitli olgularda üremiştir (%6,8). Klebsiella spp. yalnız 1
granülomatöz mastitli olguda üremiştir. Buna karşın, Proteus mirabilisher hasta
grubundan 1’er kişide üremiştir (Tablo 4–3).
Tablo 4-3: Laktasyonel ve non-laktasyonel mastit tanısı almış hastalarda üreyen aerop
bakterilerin dağılımı.
Aerop bakteriler
Laktasyonel mastitli
hastalar
s:44
Non-laktasyonel mastitli
hastalar
s:56
Periduktal mastit
Granülomatöz mastit
s:10
s:46
25 (%56)
5 (%50)
5 (%10,9)
19 (%43,1)
4 (%40)
2 (%4,3)
4 (%9)
-
-
2 (%4,5)
-
1
Non-hemolitik Streptokok
-
-
1
Streptococcus pyogenes
-
1
1
Gram negatif çomaklar
Escherichia coli
4 (%9)
3 (%6,8)
1
-
2 (%4,3)
-
Proteus mirabilis
1
1
1
Klebsiella pneumoniae
-
-
1
2 (%4,5)
-
-
12 (%26,1)
7 (%15,2)
Corynebacterium urealyticum
1
-
3 (%6,5)
Corynebacterium amycolatum
1
-
2 (%4,3)
Gram pozitif diplokoklar
Staphylococcus aureus
Staphylococcus epidermidis
Staphylococcus saprophyticus
Gram pozitif çomaklar
Corynebacterium kroppenstedtii
62
Çalışmaya dahil ettiğimiz mastitli hastalarda üreyen anaerop bakterilerin
dağılımını incelediğimizde gerek laktasyonel mastit gerek non-laktasyonel mastitli hasta
gruplarımızda
en
fazla
peptostreptokok
türlerinin
ürediği
dikkati
çekmiştir.
Peptostreptococcus spp. laktasyonel mastitli 5 hastada ürerken, 1’i periduktal mastitli
diğer 3’ü granülomatöz mastitli hastalar olmak üzere non-laktasyonel mastitli 4 hastada
üremiştir. Anaerop Gram negatif çomaklar mastitli 2 hastamızda üremiştir.
Granülomatöz mastit tanısı almış olan bu 2 hastada etkenin Bacteroides fragilis olduğu
saptanmıştır. Bununla birlikte, anaerop Gram pozitif çomaklar yalnızca 4 hastada
üremiştir. Bu hastalardan 3’ü laktasyonel mastit tanısı almıştır ve üreyen bakterinin
Propionibacterium acnes olduğu belirlenmiştir. Diğer bir tür ise granülomatöz mastitli 1
hastada üremiş olan Clostridium spp.’dir (Tablo 4–4).
Tablo 4-4: Laktasyonel ve non-laktasyonel mastit tanısı almış hastalarda üreyen anaerop
bakterilerin dağılımı.
Anaerop bakteriler
Laktasyonel mastitli
Non-laktasyonel mastitli
hastalar
hastalar
s:44
s:56
Periduktal mastit
Granülomatöz mastit
s:10
s:46
1
3 (%6,5)
-
-
2 (%4,3)
3 (%6,8)
-
-
-
-
1
Gram pozitif diplokoklar
Peptostreptococcus spp.
5 (%11,3)
Gram negatif çomaklar
Bacteroides fragilis
Gram pozitif çomaklar
Propionibacterium acnes
Clostridium spp.
Çalışmaya dahil ettiğimiz 100 mastit hastasından alınan örneklerin 6’sında iki
farklı bakteri türü birlikte, 3’ünde ise üç farklı bakteri türü birlikte üremiştir. İki tip
bakteri birlikteliği laktasyonel mastitli 2 hasta örneğinde ve non-laktasyonel mastitli 4
hasta örneğinde buna karşın üç tip bakteri birlikteliği laktasyonel mastitli 1 hasta
örneğinde ve non-laktasyonel mastitli 2 hasta örneğinde saptanmıştır (Tablo 4–5). Diğer
örneklerde ya tek bir bakteri türü etken olarak üremiş ya da bakteri ürememiştir.
63
Tablo 4-5: Mastit hastalarına ait 10 örnekte saptanan bakteri birliktelikleri.
Bakteri birliktelikleri
Laktasyonel
mastitli hastalar
s:44
Non-laktasyonel
mastitli hastalar
s:56
Periduktal Granülomatöz
mastit
mastit
İki bakteri türü birlikteliği
S. aureus + Peptostreptococcus spp.
1
-
-
Corynebacteriumkroppenstedtii+ Peptostreptococcus
spp.
Corynebacterium urealyticum+ Proteus mirabilis
-
-
3
-
-
1
Escherichia coli + Propionibacterium acnes
1
-
-
S. aureus+ B.fragilis+ Proteus mirabilis
-
-
1
Corynebacteriumurealyticum + Bacteroides fragilis +
Clostridium spp.
-
-
1
Corynebacterium amycolatum+Peptostreptococcus
spp. + Propionibacterium acnes
1
-
-
Üç bakteri türü birlikteliği
Araştırmamızda, direkt Gram boyamada bakteri görüldüğü halde kültürlerde
bakterilerin üretilemediği 20 cerahat örneğinden ya da bunların ekildiği tiyoglikolatlı
sıvı besiyerlerinden yapılan 16S rRNA'nın PZR amplifikasyonu sonucunda elde edilen
bakteri DNA larının fasta dizilerine göre 2 örnekte Staphyloccoccus aureus, 3 örnekte
Staphyloccoccus
epidermidis,
1
örnekte
Staphyloccoccus
capitis,2
örnekte
Streptococcus spp., 1 örnekte Lactococcus lactis, 1 örnekte Klebsiella pneumoniaeve 5
örnekte Corynebacterium spp. (C.kroppenstedtii, C. urealyticum ve C. amycolatum)
saptanmıştır. Anaerop bakterilerden ise 1 örnekte Peptostreptococcaceae bacterium, 1
örnekte Propionibacterium spp.,2 örnekte Propionibacterium acnes ve 1 örnekte
Bifidobacterium brevesaptanmıştır.Moleküler yöntemlerle yapılan çalışmalara dahil
edilen her bir örnekte yalnızca bir tür saptanabilmiştir. PZR ile, saptanan 1 P.acnes
NC_018707.1 DNA sı laktasyonel mastitli bir hasta örneğinden saptanmıştır, diğer
bakteri DNA ları non-laktasyonel mastitli hastalardan granülomatöz mastitli hasta
grubuna ait örneklerdebelirlenmiştir (Tablo 4-6).
64
Spearman’s korelasyon analizi aerop ve anaerop kültürler ve PZR ile saptanan
türler dikkate alınarak yapılmıştır.Laktasyonel mastitli 44 hastanın 29 (%65.9) unda
aerop ve anaerop kültürler sonucunda Gram pozitif diplokok saptanmış, PZR ile
saptanmamıştır.Laktasyonel mastitli hastalarlaGram pozitif diplokokların varlığı
arasında güçlü bir korelasyon olmasa da istatistiksel olarak anlamlı bir ilişki olduğu(rs=
0,544, p<0,05 ) belirlenmiştir. Bunun yanı sıra non-laktasyonel mastitli hastalardan
granülomatöz mastitli 46 hastanın 20(%43,4)’sinde aerop ve anaerop kültürler ve PZR
ile Gram pozitif çomaklar saptanmış ve granülomatöz mastitli hastalarla Gram pozitif
çomaklar arasında güçlü bir korelasyon olmasa da istatistiksel olarak anlamlı bir ilişki
olduğu (rs=0,392, p<0,05) belirlenmiştir. Periduktal mastitli hasta sayımız ve
üretilebilen ya da PZR ile saptanabilen Gram negatif çomak sayımız az olduğundan
bunlar istatistiksel incelemelere alınmamıştır
Araştırmamızda 16S rRNA'nın PZR amplifikasyonu sonucunda elde edilen
bakteri DNA larının fasta dizilerine göre bakteri türlerinin saptanmasında örnek alınan
bakteri genomlarından bazıları aşağıda belirtilmiştir (Şekil 4-7, Şekil 4-8).
Şekil 4-7: Staphylococcus epidermidis ATCC 12228 genomu (83).
Şekil 4-8: Corynebacterium kroppenstedtii DSM 44385 genomu (84).
65
Tablo 4-6:ABI 3730XL cihazında elde edilen kromatogramlardan çıkan Fasta dizilerinin
NCBI ve DSMZ veri bankalarına göre sonuçları.
Accession no.
Bakteriler
Aerop bakteriler
1
NZ_CP010297.1
Staphyloccoccus aureus
2
NZ_CP010297.1
Staphyloccoccus aureus
3
NC_004461.1
Staphyloccoccus epidermidis
4
NC_004461.1
Staphyloccoccus epidermidis
5
NC_004461.1
Staphyloccoccus epidermidis
6
NZ_HG7377333.1
Staphyloccoccus capitis
7
NZ_CP007628
Streptococcus spp.
8
NZ_JYGR010000005.1
Streptococcus mitis
9
NZ_JNLP010000001.1
Lactococcus lactis
10 NZ_CP011313.1
Klebsiella pneumonia subsp. pneumonia
11 NZ_CP010889.1
Corynebacterium pseudotuberculosis
12 NC_012704.1
Corynebacterium kroppenstedtii
13 NC_012704.1
Corynebacterium kroppenstedtii
14 NC_012704.1
Corynebacterium kroppenstedtii
15 NC_020230.1
Corynebacterium urealyticum
Anaerop bakteriler
16 NZ_JH815225.1
Peptostreptococcaceae bacterium
17 NZ_KI515698.1
Propionibacterium spp.
18 NC_018707.1
Propionibacterium acnes*
19 NC_018707.1
Propionibacterium acnes
20 NZ_CP006716.1
Bifidobacterium breve
*Laktasyonel mastitli hastaya ait örnekten PZR ile izole edilmiştir.Saptanan diğer türler nonlaktasyonel mastitli (granülomatöz mastitli ) hasta örneklerine aittir.
66
Çalışmaya dahil ettiğimiz mastitli hastalarda üreyen aerop bakterilerin
antibiyotiklere direnç durumlarını belirlemek için yaptığımız disk difüzyon yöntemi
sonuçları EUCAST 2015 dokümanına göre değerlendirilmiştir (81). Buna göre Gram
pozitif
diplokoklardan,
metisilin-dirençli
Staphylococcus
aureus
(MRSA)
kökenlerinde,penisilin, seftriakson ve amoksisilin/klavulonik asit direnci 9 kökende,
eritromisin direnci 4 kökende, klindamisin direnci 3 kökende ve siprofloksasin direnci 1
kökende
saptanmıştır.
Buna
karşın,
trimetoprim/sülfametoksazol,
gentamisin,
vankomisin ve linezolid direnci hiçbir kökende tespit edilmemiştir. Metisilin duyarlı
Staphylococcus aureus (MSSA) kökenlerinde eritromisin direnci 2 kökende,
klindamisin ve linezolid direnci 1’er kökende saptanmıştır. Diğer bir safilokok türü olan
metisilin duyarlı Staphylococcus epidermidis kökenlerinde eritromisin ve siprofloksasin
direncine 1’er kökende rastlanırken, penisilin, seftriakson, amoksisilin/klavulonik asit,
klindamisin trimetoprim/sülfametoksazol, gentamisin, vankomisin ve linezolid direnci
hiçbir kökende saptanmamıştır. Metisilin duyarlı Staphylococcus saprophyticus
kökenlerinde ise klindamisin direnci 1, eritromisin direnci yine 1 kökende
belirlenmiştir.
İzole
edilen
amoksisilin/klavulonik
1
non-hemolitik
aside,
streptokok
klindamisine,
kökeni
penisiline,
eritromisine
ve
trimetoprim/sülfametoksazol dirençli olarak tespit edilmiştir. Diğer bir streptokok türü
olan Streptococcus pyogenes kökenlerinin birinde eritromisin direnci saptanmıştır. Bu
kökenler denenen diğer antibiyotiklere duyarlı bulunmuştur. Gram negatif çomaklardan
Escherichia coli kökenlerinde ampisilin direnci 1 kökende, seftriakson direnci 1
kökende, trimetoprim/sülfametoksazol direnci 1 kökende ve siprofloksasin direnci yine
1 kökende saptanmıştır. İzole edilen Proteusmirabilis kökenlerinde yine ampisilin
direnci 1 kökende, seftriakson direnci 1 kökende, meropenem direnci 1 kökende,
trimetoprim/sülfametoksazol direnci 1 kökende görülürken, Proteusmirabilis’de
seftazidim, amoksisilin/klavulonik asit, imipenem, gentamisin ve siprofloksasin direnci
gözlenmemiştir.
İzole
edilen
1
Klebsiellapneumoniae
kökeni
ise
trimetoprim/sülfametoksazol ve siprofloksasine dirençli olarak bulunmuştur. Aerop
Gram
pozitif
çomaklardan
üretebildiğimiz
Corynebacteriumkroppenstedtii,
C.
urealyticum ve C. amycolatum kökenlerinde siprofloksasin direncine 5 kökende,
klindamisin direncine 3 kökende rastlanmış, buna karşın penisilin, gentamisin,
vankomisin ve linezolid direnci hiçbir kökende saptanmamıştır (Tablo 4-7).
67
Tüm
bu
bulgularımıza
göre
trimetoprim/sülfametoksazol,
gentamisin,
siprofloksasin, vankomisin ve linezolidin aerop Gram pozitif diplokoklara, seftazidim,
amoksisilin/klavulonik asit, imipenem ve gentamisinin aerop Gram negatif çomaklara,
penisilin, gentamisin, vankomisin ve linezolidin Gram pozitif difteroid çomaklara en
etkili antibiyotikler olduğu belirlenmiştir.
Çalışmaya dahil ettiğimiz mastitli hastalarda üreyen anaerop bakterilere karşı
antibiyotiklerin MİK değerlerini belirlemek için yaptığımız E-test sonuçları EUCAST
2015 dokümanına göre değerlendirilmiştir (81). Yalnızca sefoksitinin MİK sınırları bu
dokümanda henüz belirtilmediğinden değerlendirme CLSI M11 A8 dokümanına göre
yapılmıştır. (82). Buna göre izole edilen Peptostreptococcus spp. kökenlerinden
tümünün amoksisilin/klavulonik asit, imipenem ve klindamisine duyarlı olduğu, 3’ünün
penisiline, 1’inin metronidazol ve 3’ünün sefoksitine dirençli kökenler olduğu
saptanmıştır.
Penisilin,
klindamisin,
metronidazol
ve
sefoksitine
dirençli
Peptostreptococcus spp. nin dirençli olduğu antibiyotikler için saptanan MİK değerleri
sırası ile 2 mg/L, 6 mg/L, 8 mg/L, 128 mg/L’dir. İzole edilen 2 Bacteroides fragilis
kökeni amoksisilin/klavulonik asit, imipenem, klindamisin ve metronidazole duyarlı,
penisiline ve sefoksitine dirençli bulunmuştur. Bacteroides fragilis’in dirençli olduğu
antibiyotikler için saptanan MİK değerleri sırası ile 4 mg/L, 128 mg/L ´dir (Tablo 4-8).
İzole edilen anaerop Gram pozitif çomaklardan 3Propionibacterium acnes kökeninin
penisiline, amoksisilin/klavulonik aside, imipeneme, klindamisine, metrondazole ve
sefoksitine duyarlı kökenler olduğu saptanmıştır. Benzer şekilde, izole edilen diğer bir
anaerop Gram pozitif çomak olan 1 Clostridium spp. kökenide penisiline,
amoksisilin/klavulonik asit, imipenem, klindamisin, metrondazol ve sefoksitine duyarlı
bulunmuştur (Tablo 4-8). Amoksisilin/klavulonik asit, imipenem, klindamisin ve
metronidazolün izole ettiğimiz anaerop bakterilere en etkin antibiyotikler olduğu
saptanmıştır.
68
Tablo 4-7: Mastitli hastalarda üreyen aerop bakterilerin antibiyotiklere direnç durumları
ANTİBİYOTİK DİSKLERİ
(μg)
P/A
(10)
s
CRO
(30)
s
CAZ
(30)
s
AMC
(20/ 10)
s
IPM
(10)
s
MEM
(10)
s
DA
(2)
s
E
(15)
s
SXT
(1.25/23.75)
s
CN
(10)
s
CIP
(5)
s
VA
(30)
s
LZD
(10)
s
S.aureus (MSSA) (16)
9
0
9
0
-
9
0
-
-
3
1
4
2
0
0
0
0
1
0
0
0
0
1
S.epidermidis (MS) (4)
0
0
-
0
-
-
0
1
0
0
1
0
0
S. saprophyticus (MS) (3)
0
0
-
0
-
-
1
1
0
0
0
0
0
Non-hemolitik Streptokok (1)
1
0
-
1
0
0
1
1
1
-
-
0
0
S. pyogenes (2)
0
-
-
-
-
-
0
1
-
-
-
-
0
E. coli (3)
1
1
0
0
0
0
-
-
1
0
1
-
-
Proteus mirabilis (3)
1
1
0
0
0
1
-
-
1
0
0
-
-
Klebsiella pneumoniae (1)
0
0
0
0
0
0
-
-
1
0
1
-
-
0
-
-
-
-
-
3
-
-
0
5
0
0
Aerop bakteriler
(Toplam köken sayısı)
Gram pozitif diplokoklar
S.aureus (MRSA) (9)
Gram negatif çomaklar
Gram pozitif çomaklar
Corynebacterium spp. (14)
s : Dirençli köken sayısı , (-): Denenmedi
P: Penisilin, A: Ampisilin, CRO: Seftriakson, CAZ: Seftazidim, AMC: Amoksisilin/ Klavulonik Asit, IPM: İmipenem, MEM: Meropenem, DA: Klindamisin, E: Eritromisin,
SXT: Trimetoprim/sulfametoksazol, CN: Gentamisin, CIP: Siprofloksasin, VA: Vankomisin, LZD: Linezolid
MRSA: Metisilin dirençli Staphylococcus aureus, MSSA: Metisilin duyarlı Staphylococcus aureus, MR: Metisilin dirençli, MS: Metisilin duyarlı
Corynebacterium spp: C. kroppenstedtii, C. urealyticum, C. amycolatum
69
Tablo 4-8: Mastitli hastalarda üreyen anaerop bakterilerin antibiyotiklere direnç
durumları ve denenen antibiyotiklerin MİK değerleri (81, 82).
MİK (mg/L)
Antibiyotikler
1.k
2.k
3.k
4.k
5.k
6.k
7.k
8.k
9.k
D
0,125
0,125
1
0,19
2
2
4
-
-
-
-
-
-
-
2
Propionibacterium acnes(3)
0,006
0,032
0,19
-
-
-
-
-
-
0
Clostridium spp.(1)
0,125
-
-
-
-
-
-
-
-
0
Peptostreptococcus spp. (9)
0,125
0,19
0,38
0,19
2
0,5
0,125
1
0,75
0
Bacteroides fragilis (2)
0,25
0,125
-
-
-
-
-
-
-
0
Propionibacterium acnes(3)
0,012
0,032
0,125
-
-
-
-
-
-
0
Clostridium spp.(1)
0,25
-
-
-
-
-
-
-
-
0
Peptostreptococcus spp. (9)
0,06
0,125
0,25
0,125
0,5
0,38
0,19
0
Bacteroides fragilis (2)
0,25
0,5
-
-
-
-
-
-
-
0
Propionibacterium acnes(3)
0,125
0,032
0,25
-
-
-
-
-
-
0
Clostridium spp.(1)
0,125
-
-
-
-
-
-
-
-
0
Peptostreptococcus spp. (9)
0,125
0,125
0,38
0,125
6
0,25
0,19
1
0,5
1
Bacteroides fragilis (2)
0,125
0,5
-
-
-
-
-
-
-
0
Propionibacterium acnes(3)
0,38
0,19
0,25
-
-
-
-
-
-
0
Clostridium spp.(1)
0,5
-
-
-
-
-
-
-
-
0
Peptostreptococcus spp. (9)
2
2
0,75
0,25
8
0,75
0,25
0,25
0,38
1
Bacteroides fragilis (2)
2
1,5
-
-
-
-
-
-
-
0
Propionibacterium acnes(3)
1
0,5
0,25
-
-
-
-
-
-
0
0,38
-
-
-
-
-
-
-
-
0
Peptostreptococcus spp. (9)
2
1,5
8
4
128
96
2
1,5
0,5
2
Bacteroides fragilis (2)
96
128
-
-
-
-
-
-
-
2
Propionibacterium acnes(3)
0,38
0,125
0,19
-
-
-
-
-
-
0
Clostridium spp.(1)
0,25
-
-
-
-
-
-
-
-
0
Penisilin (MİK >0.5mg/L)*
Peptostreptococcus spp. (9)
Bacteroides fragilis (2)
0,75 0,125 0,25 0,125
3
Amoksisilin/ Klavulonik Asit
(MİK > 8 mg/L)*
İmipenem (MİK > 8 mg/L)*
0,125 0,19
Klindamisin (MİK >4 mg/L)*
Metronidazol (MİK >4 mg/L)*
Clostridium spp.(1)
Sefoksitin (MİK > 64 mg/L)**
*EUCAST duyarlılık MIK sınırı , **CLSI duyarlılık MİK sınırı, D: Dirençli köken sayısı, k:köken
70
5. TARTIŞMA
Mastit olarak bilinen meme enflamasyonu enfektif ya da non enfektif
olabilmektedir. Toplumumuzda emziren annelerde en sık rastlanan enfeksiyonlardan
biri laktasyonel mastit olarak bilinen enfektif mastittir. Ancak enfektif olsun ya da
olmasın mastitin klinik belirtileri olan enflamasyonun yarattığı kızarma, sıcaklık,
hassasiyet gibi hafif semptomlar kadınlarda güç kaybı, moral bozukluğu gibi etkilerde
de bulunabilmektedir. Mastitli hastalarda, hafif belirtiler dışında ateş, apse gelişimi ve
septisemi gibi hospitalizasyon gerektirebilecek komplikasyonlar da sık olmamakla
beraber görülebilmektedir. Özellikle doğum sonrası ilk 3 ay içinde görülen enfektif
mastit (laktasyonel mastit) anneyi yatağa bağlar, aktivitesini kısıtlar ve moral
bozukluğuna neden olur. Ayrıca, enfektif mastit (laktasyonel mastit) süt azalmasına da
neden olacağından bebeğin bakımında zorluk yaşanmasına yol açar. Emzirmenin
sürdürülmesine karşı olan negatif etkisi ve annede yarattığı sıkıntının yanı sıra septisemi
gibi ciddi komplikasyonlara da neden olması mastitte erken tanı ve etkin tedavi
gereksinimini ortaya çıkartmaktadır (85).
Non enfeksiyöz mastit (non-laktasyonel mastit) memenin lobüllerinde genişleme
ile seyreden nedeni henüz kesin olarak belirlenememiş bir mastit türüdür. Özellikle
granülomatöz mastit bu grupta en sık rastlanan kliniktir. Sarkoidoz, histoplazmos,
wegener granülomatözü, bruselloz, tifo gibi patolojik durumlarda granülomatöz mastit
gelişebilmektedir. En sık rastlanan granülomatöz mastit tipi idiyopatik granülomatöz
mastittir.
Patogenezi
belirsizdir.
Otoimmün
hastalıklarla
beraber
olabileceği
belirtilmiştir (86). Toplumumuzda granülomatöz mastitli hastalar memede ağrılı kitle,
apse
oluşumu,
fistül,
başvurabilmektedir
karışabilmektedir.
ve
meme
başında
çoğunlukla
Non-laktasyonel
çekilme
olgular
mastitli
gibi
şikayetlerle
başlangıçta
hastalarda,
meme
memede
hastaneye
kanseri
gelişen
ile
abse
odaklarından izole edilen etkenlerin patolojiye sekonder olarak eklendiği ileri
sürülmektedir (1).
Ülkemizde mastitli hastaların kliniğine yönelik araştırmaların çoğunlukta
olmasına karşın, gerek laktasyonel gerekse non-laktasyonel mastitli hastalarda
enfeksiyona neden olan mikroorganizmaların oranına ve tür dağılımına yönelik
araştırmalar yok denecek kadar azdır.
71
Araştırmaya dahil ettiğimiz 100 mastit hastasından 44 (%44)’ü laktasyonel
mastit, 56 (%56)’sı ise non-laktasyonel mastit tanısı almıştır. Jafanhar, 2013 yılında,
213 mastitli olgudan 100 (% 46,9)’ünün enfektif mastitli (laktasyonel mastit), 113
(%53)’ünün ise non enfektif mastitli (non-laktasyonel mastit) olduğunu belirtmiştir
(87).Bu oranların, bizim 100 hastayla çalıştığımız grupta yer alan laktasyonel ve nonlaktasyonel mastitli hasta oranlarına oldukça yakın olduğu görülmektedir. Çalışmamıza
dahil ettiğimiz non-laktasyonel mastit hastalarından 10 (%17,8)’u periduktal mastit, 46
(%82,1)’sı ise granülomatöz mastit tanısı almıştır. Nair ve ark. 2013’te 50 nonlaktasyonel mastitli hasta ile gerçekleştirdikleri çalışmada hastaların 12 (%24)’sinin
periduktal mastit, 38 (%76) ’inin ise granülomatöz mastit tanısı aldığını belirtmişlerdir
(88). Bu oranlar, hasta grubumuzun bir bölümünü oluşturan non-laktasyonel mastitli
olgularımız arasında periduktal mastit ve granülomatöz mastit tanısı alan olgularımızın
oranları ile benzeşmektedir.
Ülkemizin bulunduğu coğrafik konum yanı sıra, ülkemizdeki beslenme
alışkanlıkları, kadınların doğum yapma sayısı, kadının aile içindeki yeri ve çalışan kadın
olarak toplumdaki yeri göz önünde bulundurulduğunda, mastit tanısı almış hasta
gruplarında yaş ortalamalarını belirten veriler, farklı ülkelerden yine mastitli hastalar
için bildirilen yaş ortalaması verileri ile karşılaştırmalar yapılabilesi ve zaman içinde
toplumumuzda mastitli hastaların yaş ortalamalarında görülebilecek değişimlerin
izlenebilmesi açısından önem taşımaktadır. Araştırmamızda, laktasyonel mastit tanısı
almış 44 hastamızda yaş ortalamasının 29 olduğu belirlenmiştir. 2014 yılında Mediano
ve ark. İspanya’da 368 laktasyonel mastitli hastayla yaptıkları çalışmada yaş
ortalamasının 33,7 olduğunu bildirmişlerdir (89). Amir ve ark. 2007 yılında
Avustralya’da, 3 farklı merkezde bulunan laktasyonel mastitli hastalarla yaptıkları
araştırmada, 1. merkezde bulunan 112 mastit hastasının yaş ortalamasının 29,6,
2.merkezde bulunan 192 mastit hastasında yaş ortalamasının 32,6 ve 3. merkezde 889
hastada yaş ortalamasının 28,5 olduğunu belirtmişlerdir (90).Ülkemizde ise laktasyonel
mastitli hastaların yaş ortalaması, 2003 yılında Dener ve ark’nın 128 hastayla yaptığı
çalışmada, 28 olarak bulunmuş yaş aralığı ise 17-43 yaşlar olarak bildirilmiştir (91).
1996 yılında Kurt ve ark. 18 laktasyonel mastit olgusu ile yaptıkları çalışmada yaş
ortalamasını 21,2 + 4,2 olarak saptamışlardır (92). Bu veriler ışığında araştırmamızda
29 olarak belirlediğimiz laktasyonel mastitli hastaların yaş ortalamasının ülkemizde
yapılmış
farklı
araştırmalarda
bildirilen
oranlarla
uyum
sağladığı,
Avrupa
72
ülkesiİspanya’dan bildirilen oranlardan biraz daha düşük olduğu ve coğrafik
bölgemizden oldukça uzakta olan Avustralya’dan bildirilen oranlarla da yine uyum
sağladığı anlaşılmaktadır. Yukarıda da belirttiğimiz gibi ülkelerin coğrafik konumu
dışında bu oranları etkileyen bir çok faktörün bulunduğu kanaatindeyiz.
Araştırmamızda non-laktasyonel mastit tanısı almış hastalarda yaş aralığının
34,5 ile 40 arası olduğu belirlenmiştir. Bu veri dahilinde periduktal mastitli 10
hastamızda yaş ortalaması 39,5; granülomatöz mastitli 46 hastayı kapsayan grupta ise
yaş ortalaması 34,5 olarak saptanmıştır. Kok ve ark, 2010 yılında Brunei’den
yayınladıkları araştırmalarında 43 non-laktasyonel mastit (granülomatöz mastit) tanısı
almış hastada yaş ortalamasını 34 olarak bildirmişlerdir (93).Hovanessian Larsen ve
ark., 2009 yılında yaptıkları araştırmada non-laktasyonel mastitli (granülomatöz mastit)
hastalarının yaşlarınının 22-44 arasında olduğunu belirtmişlerdir (94).Ülkemizde
Akbulut ve ark., 2011 yılında yaptıkları araştırmada çalışmaya dahil ettikleri 4
granülomatöz mastitli olguda yaş ortalamasını 33,2 olarak saptamışlardır (95). 2012
yılında Parlakgümüş ve ark. 47 non-laktasyonel mastit (granülomatöz mastit) tanısı
almış hastada yaş ortalamasının 36 olduğunu belirtmişlerdir (96). Bu veriler ışığında
non-laktasyonel mastitli hasta grubumuzu teşkil eden hastaların yaş ortalamasının gerek
ulusal gerek uluslararası kaynaklarda belirtilen yaş ortalaması ile uyum gösterdiği
görülmektedir.
Laktasyonel mastitli 44 hastanın 21 (%47,7)’i normal doğum 23 (%52,3)’ü ise
sezaryenle doğum yapmıştır. Non-laktasyonel mastitli hastalarda ise periduktal mastili
ve granülomatöz mastitli grupların her ikisinde de sezaryenle doğum yapanların normal
doğum yapanlara göre daha yüksek oranda olduğu saptanmıştır [Periduktal mastitli 7
hasta (%70), granülomatöz mastitli 28 hasta (%60,8)]. Amir ve ark 2007’de 3 farklı
merkezde bulunan 1193 laktasyonel mastitli hasta ile gerçekleştridikleri çalışmada, 1.
merkezde bulunan 112 mastit hastasının %64,4’ünün, 2. merkezde bulunan 192 mastit
hastasının %31,3’ünün, 3. merkezde 889 hastanın % 47,8’inin normal doğum yaptığını
belirtmiştir (90). Kurt ve ark. ülkemizde 18 laktasyonel mastit olgusu ile
gerçekleştirdikleri
çalışmada
olgulardan
16
(%88,8)’sının
normal
doğum
gerçekleştirdiklerini belirtmişlerdir (92). Dolayısıyla, laktasyonel mastitli hasta
grubumuzu teşkil eden hastaların doğum şekilleri uluslararası kaynaklarda belirtilen
verilere göre biraz daha yüksek çıkmıştır.
73
Araştırmamızda, laktasyonel mastitli hastaların 10 (%23)’unda, periduktal
mastili hastaların 6 (%60)’sında ve granülomatöz mastitli hastaların 28 (%60,8)’inde
önceden geçirilmiş mastit öyküsü belirlenmiştir. Foxman ve ark Michigan ve
Nebraska’da 946 laktasyonel mastit hastası ile gerçekleştirdikleri çalışmada 134
(%14,2) hastanın önceden geçirilmiş mastit öyküsü bulunduğunu belirtmişlerdir (97).
Scott ve ark 2008’de 70 laktasyonel mastitli hasta ile gerçekleştirdikleri çalışmada
hastaların %16’sının önceden geçirilmiş mastit öyküsü bulunduğunu belirtmişlerdir
(98). Ammari ve ark. 2002 yılında gerçekleştirdikleri çalışmada, 29 non-laktasyonel
mastitli hastadan 4 (%11)’ünün önceden geçirilmiş mastit öyküsü bulunduğunu
bildirmişlerdir (99). Bu sonuçlara göre araştırmamıza dahil olan mastitli hastalarda
diğer uluslarası verilere göre daha yüksek oranda önceden geçirilmiş bir mastit öyküsü
olduğu dikkati çekmektedir. Bu durumun, ülkemizde hanımların yaptıkları doğum sayısı
ile tedavideki aksamalarla ve buna bağlı gelişen nükslerle ilişkili olabileceği
görüşündeyiz.
Üriner sistem enfeksiyonu ise laktasyonel mastitli hastaların 33 (%75)’ünde,
periduktal mastili hastaların 7 (%70)’sinde ve granülomatöz mastitli hastaların 27
(%58,6)’sinde görülmüştür. Şimşek ve ark. 2014 yılında yaptıkları bir olgu sunusunda
nonlaktasyonel mastitli bir hastada E.coli’ye bağlı bilateral meme apsesi tespit etmiş ve
bunun muhtemel nedeninin hastanın yakın zamanda geçirdiği tam tedavi edilmemiş bir
idrar yolu enfeksiyonu olduğunu öne sürmüşlerdir (100). Sandhu ve ark. 50 laktasyonel
mastitli hasta ile gerçekleştirdikleri çalışmada, hastaların %6’sının üriner sistem
enfeksiyonu geçirmekte olduğunu bildirmişlerdir (44). Mediano P ve ark. 2014’te 368
laktasyonel mastitli hasta ile gerçekleştirdikleri çalışmada 79 (%21,64)’unun üriner
sistem enfeksiyonu geçirmekte olduğunu belirtmişlerdir (89). Bu çalışmamızda mastit
sırasında üriner sistem enfeksiyonu geçiren hasta oranımız oldukça yüksek çıkmıştır.
Araştırmaların sonuçlarına göre, mastit ile üriner sistem enfeksiyonu arasında bir ilişki
olabileceği öne sürülse de bu durumu destekleyici daha spesifik araştırmalara gerek
olduğu kanaatindeyiz.
Güncel çalışmalarda, periduktal mastitin etiyolojisinde sigaranın önemli bir
faktör olduğu periduktal mastitli hastaların %90‘ının sigara kullanmakta olduğu,
nikotinin direkt veya indirekt olarak subareolar meme kanallarına zarar verdiği ve zarar
görmüş dokuların aerop ve anaerop bakteri enfeksiyonlarına daha açık olduğu öne
sürülmüştür (4). Sigaranın aynı zamanda in ivo ve in vitro olarak Gram pozitif bakteri
74
üremesini baskıladığı dolayısıyla periduktal mastit etiyolojisinde rol alan Gram- negatif
aerobik ve anaerobik bakterilerin aşırı üremesine neden olduğu öne sürülmüştür (99).
Hastaların
sosyodemografik
özellikleri
incelendiğinde
non-laktasyonel
mastitli
hastalardan özellikle periduktal mastitlilerde sigara kullanımının belirgin şekilde yüksek
olduğu (9/10,%90),granülomatöz mastitli hastalarımızda ise, periduktal mastitlilerde
belirlenen oran kadar olmasa da %60,8’lere ulaştığı, laktasyonel mastitlilerde ise çok
düşük olduğu (7/44, %16) belirlenmiştir. Ammari ve ark. 2002 yılında 29 periduktal
mastitli hastayla gerçekleştirdikleri çalışmada, hastaların %26’sının sigara kullanmaka
olduğunu belirtmişlerdir (99). Ülkemizde Ocal ve ark. 2009’da 16 granülomatöz
mastitli hasta ile yaptıkları çalışmada 6 (%37,5) hastanın sigara kullanmakta olduğunu
belirtmişerdir (101). Yine ülkemizden Parlakgümüş ve ark. 2012 yılında, 47
granülomatöz mastitli hasta ile gerçekleştridikleri çalışmada hastaların 9 (%19)’unun
sigara kullanmakta olduğunu bildirmişlerdir (96). Oran ve ark 46 nonlaktasyonel
mastitli hastanın 16 (%35)’sının sigara kullanmakta olduğunu bildirmişlerdir (102).
Ramalingam ve ark 2014’te Hindistan’da, Batı literatürüne zıt olarak, 35 periduktal
mastitli
hasta
ile
gerçekleştirdikleri
çalışmada
hastaların
hiçbirinin
sigara
kullanmamakta olduğunu bildirmişlerdir (103). Mediano ve ark. 2014’te İspanya’da
gerçekleştirdikleri çalışmada 368 laktasyonel mastitli hastanın 72 (%20)’sinin sigara
kullanmakta olduğunu bildirmişlerdir (89). Foxman ve ark Michigan ve Nebraska’da
946 laktasyonel mastit hastası ile gerçekleştirdikleri çalışmada 61(%6,5) hastanın sigara
kullanmakta
olduğunu
belirtmişlerdir
(97).
Özellikle
periduktal
mastitli
ve
granülomatöz mastitili hastalarımızda saptadığımız yüksek sigara kullanım oranının
kaynaklarda bildirilen oranların oldukça üzerinde olduğu belirlenmiştir.
Non-laktasyonel mastitli hastalardan alınan örneklerde mikroorganizmaların
üretilemediği birçok kaynakta belirtilmektedir (86, 87, 99, 101).. Buna karşın
laktasyonel mastit tanısı almış hastalarda enfeksiyon etkeni bakterilerin genellikle
üretildiği bildirilmektedir. Bizim araştırmamızda, laktasyonel mastit tanısı almış 44
hastamızdan alınan örneklerin 38 (%86,4)’inde kültürde bakteri ürediği, 5 (%11,3)’inde
Gram ile hazırlanan preparasyonlarda bakteri görülmediği ve kültürde de bakteri
üremediği, 1’inde ise Gram ile hazırlanan preparasyonlarda bakteri görüldüğü halde
kültürde üretilemediği tespit edilmiştir. Araştırmamızda laktasyonel mastitli hastalardan
aldığımız örnekler sonucunda yaptığımız kültürlerde en sık üreyen bakterinin
Staphylococcus aureus (%43,1) olduğunu tespit ettik. Uluslararası kaynaklarda, Kvist
75
ve ark 2008 yılında 192 laktasyonel mastit tanısı almış hasta ile gerçekleştirdikleri
çalışmada, hastaların 87(%45,3)’sinde S. aureus ürettiklerini bildirmişlerdir (27).
Osterman ve ark. 2000 yılında İsveç’te 40 laktasyonel mastit hastası ile
gerçekleştirdikleri çalışmada 13 hastaörneğinden (%32,5) S. aureus izole ettiklerini
belirtmişlerdir (105). Delgado ve ark. 2008 yılında İspanya’da yaptıkları çalışmada 20
laktasyonel mastitli hastadan ürettikleri 149 kökeni PCR-DGGE ile tarayarak 14’ünün
S. aureus olduğunu tespit etmişlerdir (28). Kasım 2015-Haziran 2015 tarihleri arasında
MEDLINE veri tabanında yaptığımız araştırmalar sonucunda ülkemizde laktasyonel
mastitli hasta örneklerini mikrobiyolojik yönden inceleyen yalnızca 1 yayına rastladık.
Dener ve ark. 2003 yılında 26 laktasyonel mastit hastasından topladıkları cerahatlerde
yaptıkları incelemelerde 10 hastada (%38) S. aureus izole etmişlerdir (91). Laktasyonel
mastitli hastaların örneklerinde, gerek uluslarası gerekse ulusal literatürde bildirilen
S.aureus oranının bizim saptadığımız oranla uyum gösterdiği belirlenmiştir. Olgularda,
en yüksek oranda saptanan bakterinin S.aureus olması, süt emen bebeğin ağız florasında
yer alan bu bakterinin sıklıkla meme ucundaki çatlaklardan anneye geçerek enfeksiyona
neden olması ile ilişkilendirilmiştir(1).
Araştırmamızda, laktasyonel mastitli olgularda 2. sıklıkta üretilen bakterinin
anaerop Gram pozitif diplokoklardan Peptostreptococcus spp. olduğu saptanmıştır.
Çalışmamıza dahil edilen 44 laktasyonel mastit hastasının 5 (%11,3)’inden
Peptostreptococcus spp. izole edilmiştir. Sandhu ve ark. 2014 yılında laktasyonel
mastitli
olgularla
gerçekleştirdikleri
çalışmada,
örneklerin
%12,5’inden
Peptostreptococcus spp. ürettiklerini bildirmişlerdir (44). Kasım 2015-Haziran 2015
tarihleri arasında MEDLINE veri tabanında yaptığımız araştırmalar sonucunda ise
ulusal literatürde laktasyonel mastitli olgularda Peptostreptococcus spp. varlığına
değinen bir kaynak bulunamamıştır. Ancak Sandhu ve ark‘nın saptadığı oranla bizim
oranımızı uyuşmuştur (44).
Ulusal ve uluslararası kaynaklarda laktasyonel mastitli hasta örneklerinden
sıklıkla izole edildiği belirtilen diger bir bakteri Staphylococcus epidermidis’tir.
Araştırmamızda, laktasyonel mastitli hasta örneklerinden 2. sıklıkta ürettiğimiz
Peptostreptococcus spp.’ye yakın oranlarda (%9) Staphylococcus epidermidis saptadık.
Sandhu ve ark 2014 yılında gerçekleştirdikleri çalışmada laktasyonel mastitli hastaların
%40’ında S. epidermidis ürettiklerini belirtmişlerdir (44). Osterman ve arke 2000
yılında 40 laktasyonel mastitli hasta ile gerçekleştirdikleri çalışmada 23 hastadan
76
(%57,5) koagülaz negatif stafilokok izole ettiklerini belirtmişlerdir (105). Delgado ve
ark 2008 yılında 20 laktasyonel mastit hastası ile gerçekleştirdikleri çalışmada 149
izolattan 72 (%48)’sinin S. epidermidis oldugunu belirlemişlerdir (28). S.epidermidis
için bildirilen bu yüksek oranlara karşı, bizim araştırmamızda saptadıgımız %9’luk
Staphylococcus epidermidis oranına benzer şekilde, Bharat ve ark 2009 yılında 12
laktasyonel mastitli hasta ile gerçekleştirdikleri çalışmada %7 oranında S. epidermidis
ürettiklerini belirtmişlerdir (106). Kasım 2015-Haziran 2015 tarihleri arasında
MEDLINE veri tabanında yaptığımız araştırmalar sonucunda ülkemizde yapılan
çalışmalarda ise laktasyonel mastitli olgularda etken mikroorganizmaların dağılımına
yönelik araştırmalarda S. epidermidis oranına değinen bir kaynak bulunamamıştır.
Ayrıca laktasyonel mastitli hasta grubumuzda 2 köken S. saprophyticus üretmemize
rağmen ulusal ve uluslararası kaynaklarda bu verilerimizi destekleyen bir yayın da
bulamadık. Staphylooccus spp. kasık, perine, koltuk altı deri florasını oluşturur. Daha
çok nekroz ve cerahatlenmeye, apseleşmeye neden oldugu bilinmektedir. Başta
koagülaz negatif stafilokoklar olmak üzere, birçok türünün biyofilm oluşturarak
enfeksiyonlara neden oldugu gösterilmiştir (107). S. saprophyticus ise insanda özellikle
idrar yolu epiteline tutunabilme özelligi ile bilinen bir bakteridir ve idrar yolu
enfeksiyonlarına neden oldugu bildirilmiştir (107). S. Saprophyticus saptadığımız 2
hastamızın mastit sırasında üriner sistem enfeksiyonu geçiriyor olması bizim için
oldukça ilginç ve bulgumuzu destekleyici bir veri olmuştur. Araştırmamızda,
laktasyonel mastitli hastalarda numune alım sırasında deri dezenfeksiyonuna özen
gösterildiği ve böylece flora bakterilerinin örnege kontaminasyonunun titizlikle
önlendiğini bildiğimizden üreyen bakterilerin deriden kontamine olma olasılığı
düşünülmemiştir.
Laktasyonel mastitli hasta grubumuzda saptadığımız diğer bakteriler Escherichia
coli (%6,8) ve Proteus mirabilis’dir. 2003 yılında Leborgne ve ark. yaptıkları çalışmada
laktasyonel mastitli hastaların %5’inde Proteus mirabilis %3’ünde ise Escherichia coli
izole ettiklerini bildirmişlerdir (108). Delgado ve ark. 2008 yılında laktasyonel mastitli
hastalardan izole ettikleri 149 köken ile gerçekleştirdikleri çalışmada, 1 hasta
örneğinden E. coli izole ettiklerini bildirmişlerdir (28). Bharat ve ark 2009 yılında 12
laktasyonel mastitli hasta ile gerçekleştirdikleri çalışmada, hastaların %4,4’ünden
Proteus spp. ürettiklerini bildirmişlerdir (106). Kasım 2015-Haziran 2015 tarihleri
arasında MEDLINE veri tabanında yaptığımız araştırmalar sonucunda bu uluslararası
77
kaynaklar dışında laktasyonel mastitli hastaların örneklerinde E. coli ve Proteus spp.
varlıgını belirten ulusal bir yayına rastlanmamıştır. Çalışmamıza dâhil ettiğimiz
laktasyonel mastitli hasta örneklerinde ayrıca 2 Corynebacterium spp. kökeni izole
edilmiştir. Kasım 2015-Haziran 2015 tarihleri arasında MEDLINE veri tabanında
yaptığımız araştırmalar sonucunda ulusal literatürde bu verimizi destekleyecek bir
yayına rastlamamış olsak da uluslararası yayınlarda saptadığımız Corynebacterium
spp.’ye yönelik verilere ulaştık. Paviour ve ark, 2002 yılında, laktasyonel mastit
hastalarından 3 Corynebacterium spp. kökeni izole ettiklerini bildirmişlerdir (104).
Laktasyonel mastitli hastalarımızın örneklerinden izole edilen bir diğer Gram pozitif
çomak anaerobik bir bakteri olan Propionibacterium acnes’tir. Bu bakteri laktasyonel
mastitli hastalarımızın 3 (%6,8)’ünde üretilmiştir. Bunun dışında 1 hastanın Gram
preparasyonunda Gram pozitif çomak gördügümüz halde kültürde ürememesi üzerine
örnek PZR ile analize alınmış ve 1 Propionibacterium acnes DNA’sı saptanmıştır.
Böylece laktasyonel mastitli olgularımızın 4 (%9)’ünde P.acnes varlığı gösterilmiştir.
Bu verimizi destekleyecek yayınlar arasında uluslararası kaynaklarda bulduğumuz
önemli bir çalışma, Kvist ve ark’nın 2008 yılında 192 laktasyonel mastit tanısı almış
hasta
ile
gerçekleştirdikleri
araştırmadır
(27).
Hasta
örneklerinin
%1‘inde
Propionibacterium spp. saptadıklarını belirtmişlerdir. Paviour ve arkadaşları ise 2002
yılında yaptıkları araştırmada laktasyonel mastitli olgularda, %6 oranında P.acnes
varlığı bildirmişlerdir (104). Uluslararası kaynaklarda bildirilen P. acnes oranlarının
bizim bulgularımızla uyum gösterdiği belirlenmiştir. Laktasyonel mastitli olguların
örneklerinde P.acnes varlığını belirten ulusal bir yayına ulaşılamamıştır.
Non-laktasyonel mastit tanısı almış toplam 56 hastamızın 43’ünde Gram ile
hazırlanan preparasyonlarda bakteri görülmüş ve bunların 24’ünde kültürde bakteri
üretilebilmiştir. Uluslararası kaynaklarda non-laktasyonel mastitli (granülomatöz mastit)
olgulardan alınan örneklerde Gram boyama sonuçlarının kültürdeki üremeyle uyumlu
olmadığı belirtilmektedir. Taylor ve ark. 2003 yılında yaptıkları araştırmada, kültürde
üreme
saptadıkları
16
örneğin
10’unda
Gram
preparasyonlarında
bakteri
göremediklerini belirtmişlerdir (41). Renshaw ve ark. 2011 yılında 3 non-laktasyonel
mastit (granülomatöz lobüler mastit) olgusuna ait örneklerden hazırlanan Gram
preparasyonlarda bakteri gördükleri halde kültürde bakterileri üretememişlerdir (109).
Fletcher ve ark. 1982 yılında yaptıkları araştırmada, 7 non-laktasyonel mastitli
(granülomatöz mastit) hastadan aldıkları örneklerde histolojik inceleme raporlarında
78
mikroapseler ve granüloma belirtildiği halde kültürde üreme saptayamamışlardır (110).
Ülkemizde granülomatöz mastitli hastalardan üretilen bakterilere ait bilgiler içeren
sınırlı sayıda araştırma bulunmaktadır. Oran ve ark. 2013 yılında, 11 non-laktasyonel
mastitli (granülomatöz mastit) hastanın apse örneğinde bakteri varlığını araştırmış ancak
8’inde bakteri üretebilmişlerdir (102). Son yıllarda, non-laktasyonel mastitli hastalarda,
henüz etiyolojisi tam açıklanamamış, kronik enflamatuvar özellikteki hastalıkla beraber
memede yoğun cerahat oluşmasına karşın bakteri üretilememesi nedeniyle, hastaların
cerahatlerinden üretilen bakteri türlerine yönelik ilgi artmış ve bu konudaki
araştırmalara ağırlık verilmiştir. Non-laktasyonel mastitli hastalarımızın örneklerinde en
sık üretilen aerop bakterinin Corynebacterium türleri olduğu dikkati çekmektedir. Bunu
Staphylococcus aureus ve Enterobacteriaceae ailesinden Proteus mirabilis ve
Klebsiella pneumoniae takip etmektedir. Yine araştırma sonuçlarımıza göre nonlaktasyonel mastitli olgularda en sık üretilen anaerop bakterinin Peptostreptococcus
spp. olduğu bunu Bacteroides fragilis’in izlediği belirlenmiştir. Ayrıca, Clostridium
spp.’nin de etkenler arasında bulunduğu gösterilmiştir. Korinebakteriumların nonlaktasyonel mastitli olgulardaki varlığı birçok araştırmacının dikkatini çekmiş ancak
üretimde başarı sağlanamadığı bildirilmiştir. 2012 yılında Flèche-Matéosve ark. nonlaktasyonel mastitli (granülomatöz mastit) bir olguda direkt Gram boyamada bakteri
görülmediği halde Corynebacterium kropenstedii’nin ürediğini belirtmişlerdir (111).
Yine Paviour ve ark. 2002 yılında, 15 mastitli hastadan üretilen 19 Corynebacterium
türünü bildirmişler ve bunların 14’ünün Corynebacterium kropenstedii 2sinin C.
tuberculostearicum ve 3 ünün C. amycolatum olduğunu belirtmişlerdir (104). Özellikle
non-laktasyonel mastitli olgularda saptanan Corynebacterium türlerine ait oranların
diğer türlere nazaran oldukça fazla olduğu belirtilmektedir (104).
Araştırmamızda non-laktasyonel mastitli hastalar arasında özellikle 46 hastayı
kapsayan
granülomatöz
mastitli
hasta
grubunda
en
sık
üreyen
bakterinin
Corynebacterium spp. olduğu belirlenmiştir. PZR ile yapılan araştırmalarımız
sonucunda ise yine granülomatöz mastitli hastalarda 5 Corynebacterium DNA’sı daha
saptanmıştır. Böylece araştırmamızda granülomatöz mastitli hasta grubumuzda 17
(%36,9) korinebakterium saptanmıştır. Taylor ve ark, 2003 yılında Yeni Zelanda’da gen
sekanslama yöntemi ile gerçekleştirdikleri çalışmada, 34 granülomatöz mastitli hasta
örneğinin
24
(%70,6)’ünde
lipofilik
Corynebacterium
spp.
izole
ettiklerini
belirtmişlerdir (41). Granülomatöz mastitli hastalarımızda, saptanan Corynebacterium
79
türleri arasında C. pseudotuberculosis, C. kroppenstedtii ve C. urealyticum’un yer aldığı
görülmektedir. Taylor ve ark. 2003 yılında granülomatöz mastitli hastalarda C.
kropenstedii’nin %41 oranında saptandığını belirtmişlerdir (41). Ang ve ark., 2006
yılında İngiltere’de gerçekleştirikleri bir çalışmada C. accolens türünü bir granülomatöz
mastitli hastadan izole ettiklerini bildirmişlerdir (42). Araştırmamızda gerek kültürle
gerekse PZR ile saptayabildiğimiz Corynebacterium türleri arasında C. accolens türüne
rastlanmamıştır. Ülkemizde ise granülomatöz mastitli olgulardan alınan cerahatlerde
Corynebacterium varlığını gösteren iki araştırma bulunmaktadır. Parlakgümüş ve ark
2012 yılında 28 granülomatöz mastit tanısı almış hastadan alınan örneklerin 6’sında
üreme olduğunu belirtmişler ve üretilen kökenlerden 1’inin bir difteroid basil olduğunu
belirtmişlerdir ancak tür tanımına gidemememişlerdir (96). Özaydın ve ark ise, 2009
yılında granülomatöz mastitli 1 olguda Corynebacteriumamycolatum üretmişlerdir
(112). Kasım 2015-Haziran 2015 tarihleri arasında MEDLINE veri tabanında
yaptığımız araştırmalar sonucunda bu veri dışında non-laktasyonel mastitli olgularda
Corynebacterium spp. oranını belirten ya da Corynebacterium spp. varlığına değinen
ulusal bir yayına rastlayamadık.
Corynebacterium türleri sıklıkla hayvanlarda mastit etkeni olarak bildirilmiştir
(113). Bunun dışında, bu bakteriler insanda deri florası bakterileri olduğundan klinik
örnekte üretilmeleri durumunda enfeksiyon etkeni mi oldukları, kolonize mi ya da
kontaminant mı oldukları tartışılmaktadır. Özellikle granülomatöz mastitli hastalarda,
granülomalardaki cerahatli akıntılardan hazırlanan Gram preparasyonlarda polimorf
nüveli lökositlerle birlikte görülmeleri ve tek etken olarak üretilmeleri durumunda,
enfeksiyon etkeni olarak kabul edilmeleri önerilmektedir (113). Bununla beraber,
normal steril vücut bölgelerinde üretilmeleri halinde enfeksiyon etkeni oldukları kabul
edilmektedir(113). Corynebacterium türlerinin mastitli olgularda nadir etkenler olarak
bildirilmesinde Gram preparasyonlarda soluk boyanmalarına bağlı olarak kolay
görülememelerinin ayrıca, bu bakterilerin lipofilik özelliğinden dolayı üreme için %1
Tween80
içeren
besiyerlerine
ihtiyaç
duymaları,
Tween80
eksikliğinde
üretilememelerinin, rol oynadığı kanaatindeyiz. Bu bilgiler yanı sıra son yıllarda
özellikle
uluslararası
kaynaklarda
mastitli
olgulardan
alınan
cerahatlerde
Corynebacterium türlerinin varlığına değinen, tür düzeyinde tanısına inen ve hatta
oranını belirten yayınlar yer almaktadır (41, 42, 104, 111, 112). Bu yayınlarda özellikle
bakterinin Gram boyamada soluk boyanması ve kültürde zor üremesi nedeniyle gözden
80
kaştığı vurgulanmaktadır. Biz bu araştırmada hastalarımızın 19’unda kültür ve/veya
PZR ile Corynebacterium türleri saptadık. Bu türler uluslarası kaynaklarda nonlaktasyonel mastitli hastalarda bildirilmiştir ancak ülkemizde elde edilen ilk verilerdir.
(41, 104, 111).
Araştırmamızda, non-laktasyonel mastitli olgularda 2. sıklıkta üretilen bakterinin
Staphylococcus aureus olduğu belirtilmiştir. Sandhu ve ark 2014 yılında yaptıkları bir
araştırmada non-laktasyonel mastitli olguların apse cerahatlerinde en sık üretilen
bakterinin S. aureus (%33) olduğunu belirtmişlerdir (44). Leborgne ve ark ise 2003
yılında yaptıkları çalışmada apse örneklerinde %42 oranında S. aureus varlığı
belirtmişlerdir (108). Kasım 2015-Haziran 2015 tarihleri arasında MEDLINE veri
tabanında yaptığımız araştırmalar sonucunda gerek ülkemizde gerekse uluslararası
yayınlarda non-laktasyonel mastitli olgularda S.aureus varlığını belirten yeterli sayıda
yayın bulunamamıştır. Bu durum verilerimizin diğer verilerle kıyaslanmasında
zorluklara neden olmuştur. Ülkemizde yalnızca Oran ve ark non-laktasyonel mastitli
olgularda S. aureus varlığından ve oranından bahsetmişlerdir (102). Bu araştırmacılar
11 non-laktasyonel mastitli hastadan aldıkları cerahat örneklerinin 5 (%45)’inde S.
aureus’u izole ettiklerini belirtmişlerdir (102). Araştırmamız sonucunda nonlaktasyonel mastitli olguların 43 (%76,8)’ünde bakteri varlığı saptanmıştır. Bunların 8
(%18,6)’inde S. aureus varlığı tespit edilmiştir. Araştırmamız sonucunda saptadığımız
%18’lik oran, Oran ve ark’nın belirttiği %45’lik orandan ve uluslararası kaynaklarda
belirtilen %33-%42’lik oranlardan oldukça düşüktür. Ancak bunun nedenini
saptayabilmek için sonuçlarımızı kıyaslayabileceğimiz daha fazla araştırmaya gerek
duyulduğu kanaatindeyiz. S. aureus dışında ulusal ve uluslararası kaynaklarda nonlaktasyonel mastitli olgularda az sayıda da olsa S. epidermidis varlığından
sözedilmektedirb(44, 96). Biz araştırmamızda non-laktasyonel mastitli olgularımızda
kültürle S. epidermidis saptamamamıza karşın PZR yöntemiyle 3 örnekte S. epidermidis
varlığını belirledik. Bu oran S. aureus oranımızdaki gibi Sandhu ve ark’nın belirttiği
%25’li S. epidermidis oranından ve ülkemizde Parlakgümüş ve ark’nın belirttiği
%14,3’lük orandan düşüktür. Bu verimizi sağlıklı bir şekilde tartışabilmek için daha
fazla ulusal ve uluslararası yayına ihtiyaç olduğunu düşünmekteyiz. Non-laktasyonel
mastitli hasta grubumuzda 1 S. saprophyticus kökeni üretilmiş ve 1 S. capitis DNA’sı
PZR ile saptanmıştır. Kaynaklarda, bu bakterilerin özellikle ineklerde gelişen
mastitlerden alınan örneklerden izole edilmiş olduğu, insanlarda bu konuda yapılmış
81
sınırlı sayıda araştırma incelendiğinde bu verilerimizi destekleyen ulusal ve uluslararsı
literatürde bir yayın bulunmadığı belirlenmiştir. Non-laktasyonel mastitli olgularda
streptokok türlerinin varlığına değinen ve oranların oldukça düşük olduğunu gösteren
birkaç sınırlı sayıda ulusal ve uluslararası yayına ulaşılabilmiştir. Bu yayınlarda
belirlenen köken sayısı düşük olduğundan oran bilgisinden kaçınılmıştır. Sandhu ve ark
50 non-laktasyonel mastitli hastada 2 Streptococcus pyogenes kökeni, Oran ve ark ise
ülkemizde 2013 yılında 11 granülomatöz mastit hastasının 3’ünde Streptococcus spp
varlığını saptamıştır (44, 102). Biz araştırmamızda kültürle 1 S. pyogenes kökeni yine
aynı hasta grubumuzda PZR ile 1 S. mitis DNA’sı ve türü kesin olarak tanımlanamayan
bir Streptococcus spp. DNA’sı saptadık. Non-laktasyonel mastitli hasta grubumuzda
saptadığımız diğer bakteriler Enterobacteriaceae ailesinde yer alan Klebsiella ve
Proteus’tur. Bu hasta grubunda 2 Proteus mirabilis ve 1 Klebsiella pneumoniae kökeni
üretilmiştir ancak üretilen bakteri sayısı az olduğundan oran bildiriminden kaçınılmıştır.
Uluslarası kaynaklarda, Ramalingam ve ark 2014 yılında, 35 periduktal mastitli hasta
örneğinin 2’sinde Klebsiella pneumoniae izole etmişlerdir (103). Nair ve ark ise 2015
yılında 38 idiyopatik granülomatöz mastitli hastanın 2’sinde ve 12 periduktal mastitli
hastanın 1’inde Klebsiella spp. izole etmişlerdir (88). Klebsiella spp. yanı sıra Proteus
spp.varlığına da değinen Sandhu 2014 yılında yaptığı araştırmada non-laktasyonel
mastitli olguların 1’inde Proteus spp. saptamıştır (44). Bharat ve ark ise 2009 yılında 77
non-laktasyonel mastitli hastada 3 Proteus spp. saptamıştır (106). Ulusal kaynaklarda
non-laktasyonel mastitli olgularda Proteus spp. varlığına değinen bir yayın
bulunamamıştır.
100 mastit hastası ile gerçekleştirdiğimiz araştırmamızda aerop kültürlerin yanı
sıra anaerop kültürler de yapılmıştır. Laktasyonel ve non-laktasyonel mastitli hasta
örnekleri ile gerçekleştirdiğimiz anaerop kültürler sonucunda, anaerop Gram pozitif
diplokoklardan
Peptostreptococcus
spp.,
anaerop
Gram
negatif
çomaklardan
Bacteroides fragilis ve anaerop Gram pozitif çomaklardan Propionibacterium acnes ve
Clostridium spp. izole edilmiştir. Araştırmamıza dahil ettiğimiz 44 laktasyonel mastit
hastasından alınan örneklerde en sık rastlanılan anaerobik etken yukarıda da belirtildiği
gibi Peptostreptococcus spp. (%11,3) olmuştur. Laktasyonel mastitli hastalarımızın
örneklerinden izole edilen bir diğer anaerobik bakteri ise %6,8 oranında izole ettiğimiz
Propionibacterium acnes’tir.
82
Non-laktasyonel mastitli hastalarımızda ise anaerop kültür ile en sık
üretebildiğimiz bakteri Peptostreptococcus spp.’dir (%7,1), (periduktal mastitli 1 olguda
ve granülomatoz mastitli 3 olguda). Sandhu ve ark. 2014 yılında gerçekleştirdikleri bir
çalışmada, non-laktasyonel mastitli hastalarda %60 oranında Peptostreptococcus spp.
izole ettiklerini bildirmişlerdir (44). Paviour ve ark. 2002 yılında, Yeni Zelanda’da
gerçekleştirdikleri bir çalışmada hastaların yalnıza 1’inin anaerobik kültürlerinden
Peptostreptococcus spp. izole ettiklerini bildirmişlerdir (104). Ülkemizde ise nonlaktasyonel mastitli hastalarla gerçekleştirilmiş hiçbir çalışmada anaerop kültür
yapılmadığı için Peptostreptococcus spp.’den söz edilmemiştir. Çalışmamıza dahil
ettiğimiz 56 non-laktasyonel mastitli hastadan 2. sıklıkta ürettiğimiz anaerobik bakteri
%4,3 oranında saptadığımız Bacteroides fragilis’tir (granülomatöz mastitli 2 olguda).
Ammari ve ark. 2002 yılında gerçekleştirdikleri çalışmada, 29 non-laktasyonel mastitli
hastanın 22’sinden alınan örneklerde Bacteroides spp. (%41) izole ettiklerini
belirtmişlerdir(99). Sandhu ve ark. 2014 yılında gerçekleştirdikleri bir çalışmada, nonlaktasyonel mastitli hasta kültürlerinden %40 oranında Bacteroides spp. izole ettiklerini
bildirmişlerdir (44). Ülkemizde ise non-laktasyonel mastit hastalarıyla gerçekleştirilmiş
hiçbir
çalışmada
anaerop
üremesinedeğinilmemiştir.
56
kültür
yapılmamış
non-laktasyonel
mastit
ve
Bacteroides
hastasının
dahil
fragilis
olduğu
çalışmamızda, granülomatöz mastitli olgularımızın birinde 1 Clostridium spp. kökeni
izole edilmiştir ancak ulusal ve uluslararası kaynaklarda non-laktasyonel mastitli
olgularda bu bakterinin varlığına değinen bir kaynak bulunamamıştır. Buna karşın
hayvanlardan özellikle sığır ve ineklerde gelişen mastitlerde Clostridium spp’nin
enfeksiyon etkeni olduğunu belirten kaynaklar bulunmaktadır (114, 115).
Araştırmamızda gerçekleştirdiğimiz aerop ve anaerop kültürlerin sonucunda
yalnızca bir bakteri türü üreyen örnekler yanı sıra birden fazla bakteri türünün ürediğini
gözlediğimiz örneklere de rastladık. Laktasyonel mastitli hasta grubumuzda 4 hastadan
aldığımız örneklerin 2’sinde aerop ve anaerop bakterilerin oluşturduğu 2 bakteri türü
birlikteliği 1’inde ise üç tip bakteri türü birlikteliği saptadık. Nonlaktasyonel mastitli
hasta grubumuzdan periduktal mastitli hasta grubunda tüm hasta örneklerinin
kültürlerinde tek tip üreme gözlenirken granülomatöz mastitli grupta 4 hastada 2 türün,
2 hastada ise üç bakteri türünün birlikteliğini gözledik. En sık rastladığımız bakteri
birlikteliği ise, nonlaktasyonel mastitli grubumuzdan granülomatöz mastitli hasta
örneklerinin üçünde saptadığımız Corynebacterium spp. ve Peptostreptococcus spp.
83
birlikteliğidir. Sandhu ve ark 50 mastitli hasta ile yaptıkları çalışmada, yalnızca
nonlaktasyonel mastitli grupta 7 hasta örneğinde karışık kültür gözlediklerini
belirtmişlerdir (44). Ammari ve ark 2002’de 22 nonlaktasyonel mastitli hasta ile
gerçekleştirdikleri çalışmada 4 hasta örneğinde Enterococci ve Bacteroides birlikteliğini
saptamışlardır (99). Paviour ve ark. 24 mastitli hasta örneğinin 5’inde 2 tür bakteri
birlikteliği gözlediklerini bildirmişlerdir (104). Araştırmamızda örneklerde saptadığımız
bu bakteri birlikteliklerinin tedavide uygulanacak antibiyotiklerin düzenlenmesi için
önemli bir veri olacağı kanaatindeyiz.
Mastit tedavisinde kesin çözüme ulaşmak ya da nükslerin önüne geçebilmek için
dikkat edilecek önemli noktalardan biri etkene yönelik antibiyotik kullanımını tercih
etmektir. Dirençli suşların ortaya çıkmasında uygulanan antibiyotik politikalarının
rolünün büyük olduğu düşünüldüğünde etkenlerin saptanması ve antimikrobiyal
duyarlılıklarının belirlenmesi aşırı ve kontrolsüz antibiyotik kullanımının önlenmesi
açısından önem taşımaktadır.
Mastitin tedavisinde öncelikle beta-laktamaz dirençli penisilinler önerilmektedir.
Ayrıca, alkali olan eritromisin anne sütünde iyi konsantre olarak aktif kalabildiğinden,
Stapyhylococcus spp. ‘nin bazı türlerinin eritromisine dirençli olduğu bilindiği halde bu
antibiyotik, enfeksiyonun primer olarak süt bezlerini tuttuğu laktasyonel mastit
tedavisinde en iyi ilaç seçeneklerinden biri olarak gösterilmiştir (116). Ayrıca, yeni
doğanların ertiromisin almasında bir sakınca görülmemesi ve bu antibiyotiğin
antibiyotik direnç reaksiyonlarını daha az tetiklemesi de bu antibiyotiğin tercih
nedenlerinden olmuştur. Mastit tedavisinde, geniş spektrumlu antibiyotiklerin yaygın
kullanımının, enfeksiyona neden olan etkenlerde antibiyotik direnç oranlarının artışına
neden olduğu ve MRSA artışından kaçınmak için amoksisilin/klavulonik asit gibi
kombine antibiyotik kullanımlarından olabildiğince kaçınılması gerektiği önerilmiştir
(27, 29, 116).
Araştırmamızda laktasyonel ve non-laktasyonel mastitli hasta örneklerinden
ürettiğimiz
aerop
bakterilerin
amoksisilin/klavulonik
asit,
penisilin,
imipenem,
ampisilin,
meropenem,
seftriakson,
seftazidim,
klindamisin,
eritromisin,
trimetoprim/sulfametoksazol, gentamisin, siprofloksasin, vankomisin ve linezolide
duyarlılık ve direnç durumları disk difüzyon yöntemi ile saptanmıştır.
Metisilin-dirençli Staphylococcus aureus (MRSA) kökenlerinde, penisilin,
seftriakson ve amoksisilin/klavulonik asit direnci 9 kökende, eritromisin direnci 4
84
kökende, klindamisin direnci 3 kökende ve siprofloksasin direnci 1 kökende
saptanmıştır. Buna karşın, trimetoprim/sülfametoksazol, gentamisin, vankomisin ve
linezolid direnci hiçbir kökende tespit edilmemiştir. Metisilin duyarlı Staphylococcus
aureus (MSSA) kökenlerinde ise eritromisin direnci 2 kökende, klindamisin ve linezolid
direnci 1’er kökende saptanmıştır. Ramalingam ve ark 35 mastitli hasta ile
gerçekleştridikleri çalışmada, hasta örneklerinden ürettikleri 4 S. aureus kökeninin
3’ünde trimetoprim/sülfametoksazol, 2’sinde penisilin, eritromisin ve siprofloksasin
direncine rastladıklarını buna karşın, kökenlerin linezolid, rifampisin, sefoksitin,
amikasin ve vankomisine direnç geliştirmediklerini belirtmişlerdir (103).
İzole ettiğimiz, Staphylococcus epidermidis kökenlerinde eritromisin ve
siprofloksasin
direncine
1’er
kökende
rastlanırken,
penisilin,
seftriakson,
amoksisilin/klavulonik asit, klindamisin trimetoprim/sülfametoksazol, gentamisin,
vankomisin ve linezolid direnci hiçbir kökende saptanmamıştır. Ramalingam ve ark,
mastitli hastalardan izole ettikleri 3 S. epidermidis kökeninden hepsinin penisiline,
2’sinin eritromisine, trimetoprim/sülfametoksazol ve siprofloksasin’e, 1’inin sefoksitin
ve amikasin’e dirençli olduğunu buna karşın rifampisin, linezolid ve vankomisin
dirençlerini hiçbir kökende saptamadıklarını bildirmişlerdir (103). Yılmaz ve ark.
2013’te
yaptıkları
araştırmada,
kan
kültürlerinden
izole
ettikleri
metisilin
dirençlikoagülaz-negatif stafilokok türlerinin %98,4’ünde penisilin, % 81,8’inde
eritromisin, %81,8’inde siprofloksasin ve %50,3’ünde klindamisin direnci tespit
ettiklerini belirtmişlerdir. Bu çalışma ile kıyasladığımızda çalışmamızda izole ettiğimiz
koagülaz negatif stafilokok türlerinin direnç oranlarının uyuştuğu belirlenmiştir (117).
Staphylococcus saprophyticus kökenlerinde ise klindamisin ve eritromisin
direnci 1 kökende belirlenmiştir. İzole edilen 1 non-hemolitik streptokok kökeni
penisiline,
amoksisilin/klavulonik
aside,
klindamisine,
eritromisine
vetrimetoprim/sülfametoksazole dirençli olarak tespit edilmiştir. Diğer bir streptokok
türü olan Streptococcus pyogenes kökenlerinin birinde eritromisin direnci saptanmıştır.
Bu bulgumuzun aksine Ramalingam ve ark, mastitli hastalardan izole ettikleri tek bir S.
pyogenes kökeninde penisilin ve trimetoprim/sülfametoksazol direncine rastladıklarını
belirtmişlerdir (103).
Gram negatif çomaklardan Escherichia coli kökenlerinde ampisilin direnci 1
kökende, seftriakson direnci 1 kökende, trimetoprim/sülfametoksazol direnci 1 kökende
ve siprofloksasin direnci yine 1 kökende saptanmıştır. İzole edilen Proteus mirabilis
85
kökenlerinde yine ampisilin direnci 1 kökende, seftriakson direnci 1 kökende,
meropenem direnci 1 kökende, trimetoprim/sülfametoksazol direnci 1 kökende
görülürken, Proteus mirabilis’te seftazidim, amoksisilin/klavulonik asit, imipenem,
gentamisin ve siprofloksasin direnci gözlenmemiştir. İzole edilen 1 Klebsiella spp.
kökeni ise trimetoprim/sülfametoksazol ve siprofloksasine dirençli olarak bulunmuştur.
Ramalingam ve ark ürettikleri bir tek Klebsiella pneumoniae kökeninin penisilin,
rifampisin,
amoksisilin/sulbaktam,
sefoksitin,
trimetoprim/sülfametoksazol,
siprofloksasine dirençli buna karşın, linezolid, eritromisin, amikasin, netilmisine duyarlı
olarak tespit etmişlerdir (103).Çıkman ve ark. 2014’te yaptıkları araştırmada, idrar
kültürlerinden izole ettikleri tüm Enterobacteriacea ailesi üyelerini ertapenem ve
meropeneme karşı duyarlı bulunmuştur. Bu antibiyotikler dışında Enterobacteriacea
türlerine en etkili diğer antibiyotikler; amikasin, piperasilin-tazobaktam ve sefoksitin
olarak bildirmişlerdir (118).
Granülomatöz mastitli hastaların örneklerinden ürettiğimiz Corynebacterium
spp. kökenlerinde siprofloksasin direncine 5 kökende, klindamisin direncine 3 kökende
rastlanmış, buna karşın penisilin, gentamisin, vankomisin ve linezolid direnci hiçbir
kökende saptanmamıştır. Ang ve ark İngiltere’de gerçekleştirdikleri bir olgu
bildirisinde, granülomatöz mastitli bir hasta örneğinden ürettikleri Corynebacterium
accolens‘in
trimetoprim/sülfametoksazole
dirençli,
eritromisin,
klindamisin,
aminoglikozidlere
tetrasiklin
ve
penisilin,
sefalosporinler,
duyarlı
olduğunu
bildirmişlerdir (42). Fransa’da gerçekleştirilen bir başka olgu bildirisinde FlècheMatéosve ark. 2012’de granülomatöz mastitli hastadan ürettikleri Corynebacterium
kroppenstedtii’nin trimetoprim/sülfametoksazole ve fosfomisine dirençli buna karşın,
penisilin, amoksisilin, sefotaksim, minosiklin, kanamisin, gentamisin, ertromisin,
klindamisin, vankomisin, rifampisin, linezolid, moksifloksasine duyarlı olduğunu
saptamışlardır (111). Ülkemizde Öztürkeri ve ark. idrar kültürlerinden izole ettiklei
Corynebacterium spp.’de izolatların %95’ini penisiline dirençli bulurken tümünü
vankomisine duyarlı olarak bulmuşlardır. Aynı zamanda C. urealyticum izolatlarının
%27’sini klindamisine duyarlı bulmalarına rağmen C.jeikeium izolatlarının hepsini
direçli olarak tespit etmişlerdir. Araştırmalarında, penisilnin bakterilere etkisiz
olduğunu ve vankomisinin son seçenek olarak kullanılabileceğini belirtmişlerdir (119).
Corynebacterium türlerimizde saptadığımız direnç oranların özellikle uluslararası
kaynaklarda belirtilen direnç oranları ile uyumlu olduğu belirlenmiştir.
86
Araştırmamızda gerek laktasyonel gerek non-laktasyonel mastitli hastalarda
ürettiğimiz anaerop bakterilerin antibiyotiklere direnç durumu antibiyotiklerin MİK
değerleri ile belirlenmiştir. Anaerop bakteriler için penisilin, amoksisilin/klavulonik
asit, imipnem, klindamisin, metronidazol, sefoksitin olmak üzere 6 antibiyotiğin MİK
değerleri saptanmıştır. Örneklerimizden ürettiğimiz 9 Peptostreptococcus spp.
kökenlerimizden 3’ü penisiline, bunlardan 2’si aynı zamanda sefoksitine ayrıca 1’i
klindamisin ve metronidazole dirençli bulunmuştur. Dirençli kökenlerimizde en yüksek
MİK değeri penisilin için 2 mg/L, sefoksitin için 128 mg/L, klindamisin için 6 mg/L ve
metronidazol için 8 mg/L olarak saptanmıştır. Anaerop bakterilerde antimikrobiyal
direncin hızla arttığı pek çok kaynakta belirtilmektedir. Özellikle penisilin direncindeki
artışın penisilinaz ve beta-laktamaz oluşturan anaeroplarda korkutucu düzeyde arttığı
öne sürülmektedir (120). Peptostreptococcus spp.’de penisilin MİK değerlerinin 8
mg/L’ye ulaştığını belirten kaynaklar bulunmaktadır (120). Bu durum bir beta-laktam
antibiyotik olan sefoksitini de kapsamaktadır. Peptostreptococcus spp.’de uluslararası
kaynaklarda klindamisin direncinin %10’a kadar ulaştığı bildirilmektedir (120).
Ülkemizde ise Peptostreptokokların antimikrobiyal direncine değinen güncel bir
araştırma
bulunmamaktadır.
Ülkemizde
korneal
apselerden
izole
edilen
Peptostreptococcus anaerobius kökenlerinde %13,3 oranında klindamisin direnci
saptandığını belirten yayınla bizim araştırmamızda saptadığımız %11,1’lik direnç
uyuşmaktadır.
Bacteroides
fragilis
grubu
bakterileri
beta-laktamaz
yapan
ve
klinik
kullanımdaki antibiyotiklere yüksek oranda direnç geliştiren bakteriler olarak
bilinmektedir. Araştırmamızda ürettiğimiz 2 B. fragilis kökeninin penisilin ve
sefoksitine dirençli olduğu belirlenmiştir. En yüksek MİK değerleri sırasıyla, 4 mg/L ve
128 mg/L olarak belirlenmiştir. Brook ve ark. araştırmalarında sefoksitin dirençli
Bacteroides fragilis kökenlerinde MİK değerinin 64 mg/L’nin üzerinde olduğuna işaret
etmişlerdir ve %4 ile %25 arasında değişen bir sefoksitin direncine işaret etmişlerdir.
Ülkemizde Bacteroides fragilis kökenlerinin güncel sefoksitin direncine değinen bir
araştırma bulunmamaktadır. Ancak penisilin dirençli B. fragilis’lerde MİK değerinin
256 mg/L’ye kadar ulaştığı belirtilmektedir (121). Propionibacterium acnes genellikle
antibiyotiklere
duyarlı
bir
anaerop
bakteri
olarak
bilinmektedir.
Penisilin,
amoksisilin/klavulonik asit, imipenem ve sefoksitine direnç henüz bildirilmemiştir
(120). Ancak P. acnes’in klindamisin direncindeki artışın bugün %20’lere kadar ulaştığı
87
bilinmektedir (120). Ülkemizde P. acnes’in güncel klindamisin direncinin %34 olduğu
ve dirençli kökenlerde klindamisin MİK değerinin 64 mg/L’ye kadar ulaştığı
bildirilmiştir. Bizim araştırmamızda saptadığımız 3 P. acnes kökeni klindamisine
duyarlı bulunmuştur. Clostridium spp. genelde antibiyotiklere duyarlı türler olarak
bilinmektedir. Uluslararası literatürde belirtildiği şekilde bizim araştırmamızda da
saptadığımız 1 Clostridium kökeni antibiyotiklere duyarlı olarak bulunmuştur.
Araştırmamız süresince laktasyonel mastitli bir hastanın ve non-laktasyonel
mastitli 19 hastanın örneğinde Gram preparasyonlarda bakteriler görüldüğü halde
kültürde üreme olmadığı saptanmıştır. Özellikle non-laktasyonel mastitli olgulardan
granülomatöz mastitli olanlarda, kültürde üremelerin olmadığı birçok kaynakta
belirtilmiştir (41). Bu nedenle son yıllarda, moleküler yöntemleri kullanan araştırmalar
dikkati çekmektedir. Taylor ve ark, 16S rRNA gen analizi ile granülomatöz mastitli
olguların 14’ünde Corynebacterium kroppenstedtii saptamıştır (41). Paviour ve ark ise
kültürde ürettikleri 19 Korinebakterium izolatının tür tanımını 16S rRNA gen analizi ile
gerçekleştirmişler
ve
14’ünün
Corynebacterium
kroppenstedtii,
2’sinin
Corynebacterium tuberculostearicum, ve 3’ünün Corynebacterium amycolatum
olduğunu belirlemişlerdir (104). Bu araştırmamızda direkt Gram boyamada Gram
pozitif çomak saptadığımız ancak kültürde bakteri üretemediğimiz 5 örneğin 3’ünde
Corynebacterium kroppenstedtii, 1’inde Corynebacterium uralyticum ve diğer 1’inde
Corynebacterium pseudotuberculosis’i 16S rRNA gen analizi ile saptadık.
Ayrıca araştırmamızda 16S rRNA'nın PZR amplifikasyonu sonucunda elde
edilen bakteri DNA’larının fasta dizilerine göre 1 örnekte Lactococcus lactis izole
edilmiştir. Uluslararası literatürde insandan izole edildiğini belirten bir kaynağa
rastlanmamıştır. Hayvan mastitlerinde ise gittikçe önemi artan yaygın patojen
olarakbildirilmiştir (122, 123). Ülkemizde nonlaktasyonel mastitli olgularda PZR ile
bakteri
saptayan
bir
araştırmaya
rastlayamadık.
Ayrıca
mastitli
olgularda
Bifidobacterium brevi varlığını gösteren ulusal ya da uluslar arası hiçbir makaleye de
rastlayamadık.
Sonuç olarak, doldurduğumuz hasta formlarındaki bilgilere göre laktasyonel
mastitli hastalarımızın yaş ortalamasının 29 olduğu ve bunların %75’inin mastitle
beraber seyreden bir üriner sistem enfeksiyonu da geçirdikleri buna karşın nonlaktasyonel mastitli hastalarımızdan özellikle granülomatöz mastitli grupta yaş
88
ortalamasının 34,5 olduğu, bunların %60’ının sezaryenle doğum yaptığı, önceden
geçirilmiş bir mastit öykülerinin bulunduğu ve sigara kullandıkları saptanmıştır.
Yapılan aerop kültürlerde laktasyonel mastitli hasta örneklerinde en yüksek
oranda üretilen bakterilerin Gram pozitif diplokoklardan S. aureus (%43,1) olduğu
belirlenmiştir. Bunun dışında bu gruptaki hastalarda saptanan diğer stafilokok ve
streptokok türleri (aerop/anaerop) de göz önünde bulundurulduğunda laktasyonel mastit
ile Gram pozitif diplokokların varlığı arasında istatistiksel olarak anlamlı bir ilişki
bulunduğu (p<0.05) ve bu ilişkide en fazla S.aureus’un rolü olduğu kanaatindeyiz.
Non-laktasyonel mastitli hastalardan özellikle granülomatöz mastitli olanların
örneklerinde, kültür ya da 16S rRNA'nın PZR amplifikasyonu sonucunda elde edilen
bakteri DNA’larının dizi analizi ile Corynebacterium kroppenstedtii, Corynebacterium
urealyticum, Corynebacterium amycolatum ve Corynebacterium pseudotuberculosis’in
varlığı ülkemizde ilk defa bu çalışma ile belirlenmiştir. Granülomatöz mastitli
hastalarda saptanan tüm Gram pozitif çomaklar (aerop/anaerop kültür ve PCR ile) göz
önünde bulundurulduğunda, granülomatöz mastit ile Gram pozitif çomakların varlığı
arasında istatistiksel olarak anlamlı bir ilişki olduğu belirlenmiştir (p<0.05). Bu ilişkide
en fazla Corynebacterium türlerinin rolü olduğu düşünülmektedir. Ayrıca aynı gruptaki
hasta örneklerinde yine aynı yöntemle şimdiye kadar yalnızca hayvan mastitlerinde
gösterilmiş olan S. saprophyticus,S. capitis, Lactococcus lactis veBifidobacterium
breve’de ilk defa insanlarda saptanmıştır. Bunun yanı sıra, düşük oranda da olsa
mastitlerde peptostreptokokların en baskın üreyen anaerop bakteri olduğu belirlenmiştir.
Laktasyonel mastitlerin etiyolojisinde rolü olan bakterilerin bilinmesine ve
tedavide çoğunlukla başarı sağlanmasına karşın non-laktasyonel mastitlerin önemli bir
bölümünü teşkil eden granülomatöz mastitlerin patogenezi ve etiyolojisi bugün kesin
olarak bilinmemektedir; tedavi yanıtında yaşanan güçlükler ve sıkça karşılaşılan nüksler
nedeni ile bu hasta grubunda elde edilen her verinin üstünde durulmaya değer olduğu
belirtilmektedir. Bakterilerin granülomatöz mastit etiyolojisinde birincil rolü olduğunu
söyleyen kaynaklar yanı sıra, bu bakterilerin sekonder olarak klinik tabloya eklendiğini
belirten kaynakların da bulunması, ürettiğimiz bakterilerle mastit arasındaki ilişkinin
incelikleri hakkında yorum yapmamızı zorlaştırmaktadır. İnsanda granuloma oluşumuna
neden olan birçok klinik neden yanı sıra özellikle M.tuberculosis, Brucella spp. ve bazı
mantarların bizzat bu oluşumdan sorumlu olduğu göz önünde bulundurulduğunda,
89
lipofilik olan Corynebacterium türleri ile granuloma oluşumu arasında da benzer bir
ilişki olabileceği ve ileride bunun gösterilebileceği düşünülebilir.
Ürettiğimiz bakterilerin antimikrobial duyarlılık testleri sonuçlarına göre,
trimetoprim/sülfametoksazol, gentamisin, siprofloksasin, vankomisin ve linezolidin
aerop Gram pozitif diplokoklara, seftazidim, amoksisilin/klavulonik asit, imipenem ve
gentamisinin aerop Gram negatif çomaklara, penisilin, gentamisin, vankomisin ve
linezolidin Gram pozitif difteroid çomaklara, ayrıca amoksisilin/klavulonik asit,
imipenem, klindamisin ve metrondazolün de izole ettiğimiz anaerop bakterilere en etkin
antibiyotikler olduğu saptanmıştır.
Gerek laktasyonel gerekse non-laktasyonel mastitlerde enfeksiyona neden olan
bakterilerde direnç gelişimine neden olabilecek geniş spektrumlu antibiyotikleri içeren
ampirik tedavi protokollerinin uygulanmasından ziyade aerop/anaerop etkenlerin
belirlenerek etkene spesifik tedavi uygulanmasının anlamlı olacağı özellikle etkenlerin
üretilmesinde güçlükler yaşanan granülomatöz mastitli olgularda iseGram pozitif
çomaklara (Corynebacterium türlerine) etkili penisilin, gentamisin, vankomisin ve
linezolid gibi yağ dokuya penetrasyonu güçlü olan antibiyotiklerin tedaviye mutlaka
eklenmesinde yarar olacağı kanısındayız.
90
KAYNAKLAR
1.
Oran SE, Gurdal SO, Soybir GR. Mastitler. J Breast Health 2013; 9 (1): 1-4.
2.
Kvist LJ. Toward a clarification of the concept of mastitis as used in empirical
studies of breast inflammation during lactation. J Hum Lact2010;26:53-59.
(PMID:19910519)
3.
Thomsen AC, Espersen T, Maigaard S. Course and treatment of milkstasis,
noninfectious inflammation of the breast, and infectiousmastitis in nursing
women. American Journal of Obstetrics andGynecology 1984;149:492-495.
(PMID:6742017)
4.
Dixon JM, Khan LR. Treatment of breast infection. BMJ 2011;11: 342396.(PMID:21317199)
5.
Arroyo R, Martín V, Maldonado A, Jiménez E, Fernández L, RodríguezJM.
Treatment of infectious mastitis during lactation: antibioticsversus oral
administration of Lactobacilli isolated from breast milk.Clin Infect Dis,
2010;50:1551-1558. (PMID:20455694)
6.
Mızraklı T. 2012. Granülomatöz Mastit Tanılı Hastalarda Tanı ve Tedavi
Yaklaşımı. Uzmanlık Tezi. İstanbul.
7.
Unal M. Meme hastalıkları giriş ve tarihce. Editor Kalaycı G. Genel Cerrahi Cilt
1.Nobel, İstanbul 2002; 533-36.
8.
Sikorak K, et al. Genes, dreams and cancer. BMJ, 1994; 308: 1217-21.
9.
Carol M. Rumack, Stephanie R. Wilson, J. William Charboneau, Jo-Ann M.
Johnson.Diagnostic Ultrasound third edition, Mosby Inc, 2005; 797-798.
10.
Romrel LJ, Bland KI. Anatomy of the breast, axilla, chest wall and related
metastaticsites. In: Bland KI, Copeland EM, editors. The breast Comprehensive
management of benignand malignant disease, Philadelphia: W.B. Saunders
Company, 17-35, 1991.
91
11.
Beller F: Development and anatomy of the breast. In: Mitchell Jr. GW, Basset
LW,editors. The female breast and its disorders. Baltimore: Williams and
Wilkins, 1990; 1-12.
12.
Gray H.Anatomy of the Human Body. Philadelphia: Lea & Febiger, 1918.
13.
Daniel B. Kopans. Breast Imaging, Third Edition, Lippincott Williams and
Wilkins, Philadelphia, USA,2007; 7.
14.
Keith L. Moore. Clinically Oriented Anatomy, Third eddition, Williams and
WilkinsBaltimore, USA 1992; 45-46.
15.
Mc Carty Jr KS, Tucker JA: Breast. In: Sternberg SS, ed. Histology for
Pathologists. NewYork: Raven Pres, 1992;893-902.
16.
EE Üstün, Mamografi Atlası, İzmir Güven ve Nobel Tıp Kitabevleri, 2000; 3.
17.
Tavassoli F. A. : Pathology of the Breast. Appleton and Lange. Norwalk,
Connecticut,1992.
18.
Page DL, Anderson TJ: Diagnostic histopathology of the breast. Edinburg:
Churchill Livingstone, 1987;4-10.
19.
Ceylan İ, Uysal S, Törüner A, Alıç B. Meme Hastalıkları. Türkiye Klinikleri
Yayınevi, Ankara, 1996; 52-65.
20.
Kamal RM, Hamed ST, Dorria S. Classification of inflammatory reast disorders
and step by step diagnosis. Breast J, 2009; 15: 367–380.
21.
Altıntoprak F, Baytekin HF, Altınay AE, Eren T. Meme kanserini taklit eden
idiyopatik granülomatöz mastit. Meme Sağlığı Dergisi 2009; 5 (1); 40-43.
22.
Haagensen CD. Anatomy of the mammary glands. In: Diseases of the Breast.
Haagensen CD. Ed Saunders Company 1986; 1-48.
23.
Inch S, Von Xylander S. Mastitis: Causes and Manegement. Geneva: WHO,
Department of Child and Adolescent Health and Development, 2000;13;56-61.
24.
Novy MJ. Disorders of lactation. In: Benson RC, ed. Obstetric andgynecologic
diagnosis and treatment Los Altos, Lange MedicalPublications 1984;864-867.
92
25.
Inch S, Fisher C. Mastitis: infection or inflammation? Practitioner,
1995;239:472-476. (PMID:7659673)
26.
Schoenfeld EM, McKay MP. Mastitis and methicillin-resistantStaphylococcus
aureus (MRSA): the calm before the storm? J EmergMed 2010;38:31-34.
(PMID:19232875)
27.
Kvist LJ, Larsson BW, Hall-Lord ML, Steen A, Schalén C. The role ofbacteria
in lactational mastitis and some considerations of the use ofantibiotic treatment.
Int Breastfeed J, 2008;7:3-6. (PMID:18394188)
28.
Delgado S, Arroyo R, Martín R, Rodríguez JM. PCR-DGGE assessmentof the
bacterial diversity of breast milk in women with lactationalinfectious mastitis.
BMC Infect Dis, 2008; 18;8:51. (PMID:18423017)
29.
Infectious and Inflammatory Diseases of the Breast. In Sabel MS. ed.Essentials
of the Breast Disease. 5th ed. Philadelphia: Mosby Elsevier;2009:83-90.
30.
Rosa M. “Inflammatory” changes in breast: how to provide a bettercare to our
patients. Arch Gynecol Obstet 2010;281:901-905.(PMID:19789887)
31.
Rizzo M et al. Management of breast abscesses in nonlactating women. Am
Surg. 2010; 76(3): 292-5.
32.
Ingman WV, Glynn DJ, Hutchinson MR. Inflammatory mediators in mastitis
and lactation insufficiency. J Mammary Gland Biol Neoplasia, 2014; 19:161167.
33.
Devereux WP. Acute puerperal mastitis. Evaluation of its management. Am J
Obstet Gynecol, 1970; 108:78-81. (PMID: 5454586)
34.
Eryilmaz R, Sahin M, Hakan Tekelioglu M, Daldal E. Management of
lactational breast abscesses. Breast 2005; 14:375-379. (PMID: 16216739)
35.
Şimşek G, Gündeş E, Tekin S, Tavlı A. Laktasyonda olmayan kadında E.
Coli’ye bağlı bilateral meme apsesi: nadir bir olgu. J Breast Health 2014; 10:
174-176.
93
36.
Kadanalı A, Karagöz G. Puerperal İnfeksiyonlar. Ümraniye Tıp Dergisi. 2012;5:
22-28.
37.
Buğra D. Hastane Dışı Cilt ve Yumuşak Doku İnfeksiyonlarında Antimikrobik
Tedavi.ANKEM Derg 5 (3): 1991; 275-281.
38.
Yau FM, Macadam SA, Kuusk U, Nimmo M, Van Laeken N. The surgical
management of granulomatous mastitis. Annals of Plastic Surgery 2010;64:9–
16.
39.
Memis A, Bilgen I, Ustun EE, Ozdemir N, Erhan Y, Kapkac M. Granulomatous
mastitis: imaging findings with histopathologic correlation. Clin Radiol 2002;
57:1001–1006.
40.
Mudgil AV, Macias ES, Karsif K. Idiopathic Granulomatous Lobular Mastitis.
Int J Dermatol 2012 ;51(2):142-151.
41.
Taylor
GB,
Paviour
SD,
Musaad
S,
Jones
WO,
Holland
DJ.
A
clinicopathological review of 34 cases of inflammatory breast disease showingan
association between corynebacteria infection and granulomatous mastitis.
Pathology 2003;35:109–19.
42.
Ang LM, Brown H. Corynebacterium accolens isolated from breast abscess:
possible association with granulomatous mastitis. Journal of Clinical
Microbiology 2007;45:1666–8.
43.
Breast Abscess. İçinde: Borgen PI, Hill AK. eds. Breast Diseases, 3. Baskı.
Texas:Landes Bioscience 2000:56-58.
44.
Sandhu GS, Gill HS, Sandhu GK, Gill GP, Gill AK. Bacteriology in Breast
Abscesses. Sch. J. App. Med. Sci. 2014; 2(4E) : 1469-1472.
45.
Bilgehan H. Klinik Mikrobiyolojik Tanı. 3.Baskı. İzmir, Barış yayınları, 2002;
495-532.
46.
Madigan TM ve Martinko JM. Brock Mikroorganizmaların Biyolojisi. İçinde
Prokaryotik Çeşitlilik: Bacteria. Ankara: Palme Yayıncılık, 2010; 331-416.
94
47.
Kiraz N. Mikrobiyoloji ve Klinik Mikrobiyoloji Ders Kitabı. Cilt 1. İçinde
Kaygusuz A, Samastı M, Aygün G (Ed.), Bulaşıcı Hastalıklarla Mücadele.
İstanbul: İstanbul Üniversitesi Basım ve Yayınevi Müdürlüğü, 2011; 613-659.
48.
Koneman EW, Allen SD, Janda WM, Schereckenberger BC, Winn WC. Color
Atlas and Text Book of Diagnostic Microbiology6th ed. JH. Philadelphia:
Lippincott, 2006.
49.
Kiraz N. Mikrobiyoloji ve Klinik Mikrobiyoloji Ders Kitabı. Cilt 2. İçinde
Torun MM (Ed.), Anaerop Gram Negatif Çomaklar.İstanbul: İstanbul
Üniversitesi Basım ve Yayınevi Müdürlüğü,2011; 1047-1056.
50.
Unat EK. Tıp Bakteriyolojisi ve Virolojisi. İçinde Endospor Yapan Bakteriler.
İstanbul: Dergah Tıp Yayınları, 1986; 240-291.
51.
Monzon M, Oteiza C, Leiva J, Amorena B. Synergy of different antibiotic
combinations
in
biofilms
of
Staphylococcusepidermidis.
J Antimicrob
Chemother. 2001;48:151.
52.
Lindsay D, Von Holy A. Bacterial biofilms within the clinical setting: what
healthcare professionals should know? J Hosp Infect. 2006;64:313-25.
53.
Fux CA, Costerton JW, Stewart PS, Stoodley P. Survival strategies of infectious
biofilms. Trens Microbiol. 2005;13:34-40.
54.
Russel AD. Bacterial adaption and resistance to antiseptics, disinfectants and
preservatives is not a new phenomenon. J Hosp Infect. 2004;57:97-104.
55.
Uludağ Altun H, Şener B. Biyofilm infeksiyonları ve antibiyotik direnci.
Hacettepe Tıp Dergisi. 2008; 39:82-88.
56.
Kiraz N. Mikrobiyoloji ve Klinik Mikrobiyoloji Ders Kitabı. Cilt 1. İçinde Bahar
H (Ed.), Mikrobiyolojide Mikroskopla İnceleme Yöntemleri. İstanbul: İstanbul
Üniversitesi Basım ve Yayınevi Müdürlüğü, 2011; 125-135.
57.
Kiraz N. Mikrobiyoloji ve Klinik Mikrobiyoloji Ders Kitabı. Cilt 1. İçinde
Aygün G (Ed.), Klinik Mikrobiyolojik Tanı II. İstanbul: İstanbul Üniversitesi
Basım ve Yayınevi Müdürlüğü; 2011; 717-755.
95
58.
Kiraz N. Mikrobiyoloji ve Klinik Mikrobiyoloji Ders Kitabı. Cilt 1. İçinde Bahar
H (Ed.), Klinik Mikrobiyolojide Antijen-Antikor Reaksiyonları. İstanbul: İstanbul
Üniversitesi Basım ve Yayınevi Müdürlüğü, 2011; 399-415.
59.
Kloos WE, Wolfshohl JF. Identification of Staphylococcus species with the API
STAPH-IDENT system.J Clin Microbiol. 1982;16(3):509-16.
60.
Aras Z. Mikrobiyolojide Hızlı Tanı Yöntemleri. Erişim 11.05.2015, Turk Hij
Den
Biyol
Derg,
2011;
68(2):
97-104:
http://www.journalagent.com/turkhijyen/pdfs/THDBD_68_2_97_104.pdf
61.
Altaş K, Midilli K. Enfeksiyon hastalıklarında moleküler tanı yöntemleri.
Kalıtsal hastalıklara moleküler tıp açısından bakış sempozyumu. 2003; 59-71.
62.
Brown-Elliot, B.A., Brown, J.M., Conville, P.S., Wallace, R.J. Clinical and
Laboratory features of the Nocardia spp. Based on current molecular taksonomy.
Clin. Microbiol. Rev., 2006; 19, 259-282.
63.
Zhi, X.Y., Li, W.J., Stackebrandt, E. An update of the structure and 16S rRNA
gene sequence-based definition of higher ranks of the class Actinobacteria, with
the proposal of two new suborders and four new families and emended
descriptions of the existing higher taxa. Int. J. Syst. Evol.Microbiol., 2009; 59,
589-608.
64.
Tindall, J., Rosselló-Móra, R., Busse, H.J., Ludwing, W., Kampfer, P., Notes on
the characterization of prokaryote strains for taxonomic purposes. Int. J. Syst.
Evol. Microbiol.,2010; (60): 249-266.
65.
Coenye, T., Gevers, D., Van de Peer, Y., Vandamme, P., Swings, J., Towards a
prokaryotic genomic taxonomy. FEMS Microbiol. Rev., 2005; 29, 147–167.
66.
Stackebrandt, E. Molecular identification, systematics, and population structure
of prokaryotes. (Stackebtandt, E., Ed.)Springer. Berlin, 2006; 320.
67.
Goodfellow, M., Fiedler, H.P., A guide to successful bioprospecting: informed
by actinobacterial systematics. Antonie van Leeuwenhoek, 2010; 119–142.
96
68.
Kirby, B.M., Everest, G.J., Meyers, P.R.,. Phylogenetic analysis of the genus
Kribbella based on the gyrB gene: proposal of a gyrB-sequence threshold for
species delineation in the genus Kribbella. Antonie van Leeuwenhoek, 2010;
131–142.
69.
Everest, G.J., Meyers, P.R.,. The use of gyrB sequence analysis in the phylogeny
of the genus Amycolatopsis. Antonie van Leeuwenhoek, , 2009;(95) 1-11.
70.
Stackebrandt, E., Ebers, J. Taxonomic parameters revisited: tarnished gold
standards. Microbiol Today, 2006; (33) 152–155.
71.
Şenocak MŞ. Biyoistatistik ve Araştırma Yöntem Bilimi. İstanbul: İstanbul Tıp
Kitabevi. 2014.
72.
Unat EK. Tıp Bakteriyolojisi Ve Virolojisi. 2nd. ed. İstanbul:Dergah
Yayınları;1986.
73.
Ederer GM, Clark M. Motility-indole-ornithine medium. Appl Microbiol. 1970;
20: 849-850.
74.
Jousimies-Somer H, Summanen P, Citron DM, Baron EJ, Wexler,HM, Finegold
SM. Wadsworth-KTL Anaerobic bacteriology. Manual, 6th ed, California: Star
Publishing, 2002: 43-54.
75.
Onderdonk A.B: Methods fort the isolation and identification of obligate
anaerobes. Eur J Clin Microbiol Infect Dis. 1992; 11 1039-1043.
76.
Summanen P, Baron E.J., Citron D.M., Strong C.A., Wexler H.M., Finegold
S.M. Wadsworth Anaerobic Bacteriology Manual. 5. Baskı Star Publ. Co.
Belmont 1993.
77.
Woods G.L., Ayers L.W., Washington J.A., Medical Microbiology. Henry J.B
eds. Clinical Diagnosis and Management by Laboratory Methods, 6. baskı W B
Saunders Company Philadelphia 1996; 1166-1170.
78.
Sambrook, J., Fritsch, E.F., Maniatis, T. Molecular cloning: a laboratory manual.
3rd ed. Cold Spring Harbor Laboratory Press, New York.2001.
97
79.
Lane, D.J. 16S/23S rRNA sequencing. In Nucleic acid techniques in bacterial
systematics, (Edited by Stackebrandt, E and Goodfellow, M. John Wieley and
Sons), New York 1991; s: 115-175.
80.
Kumar, S., Nei, M., Dudley, J., Tamura K. MEGA: A biologist-centric software
fr evolutionary analysis of DNA and protein sequences. Briefing in
Bioinformatics, 2008; 9 (4): 299-306.
81.
European Committee on Antimicrobial Susceptibility Testing.2015.Setting
breakpoints for existing antimicrobial agents. EUCAST SOP 2.0.European
Committee on Antimicrobial Susceptibility Testing, Växjö,Sweden.
82.
Clinical and Laboratory Standards Institute. 2015. Methods for antimicrobial
susceptibility testing of anaerobic bacteria. Approved standard,8th ed.CLSI
document M11-A8. Clinical and Laboratory StandardsInstitute, Wayne, PA.
83.
National Center for Biotechnology Information (US); 2010. Erişim: 20.07.2015
http://www.ncbi.nlm.nih.gov/nuccore/27466918?report=fasta
84.
National Center for Biotechnology Information (US); 2010. Erişim: 20.07.2015
http://www.ncbi.nlm.nih.gov/nuccore/237784637?report=fasta
85.
Amir H, Lumley J. Women’s experience of lactational mastitis- ‘I have never
felt worse’. Aust Fam Physician. 2006; 35(9):745-7
86.
Asoğlu O, Ozmen V, Karanlık H, et al. Feasibility of surgical management in
patients with granülomatous mastitis. Breast J. 2005; 11: 108-14
87.
Jahanfar S1, Ng CJ, Teng CL.Antibiotics for mastitis in breastfeeding
women.Cochrane Database Syst Rev.2013; 2.
88.
Nair CG, Hiran, Jacob P, Menon RR, Misha. Inflammatory diseases of the nonlactating female breast. Int J Surg. 2015; 13:8-11
89.
Mediano P, Fernández L, Rodríguez JM, Marín M. Case-control study of risk
factors for infectious mastitis in Spanish breastfeeding women. BMC Pregnancy
Childbirth. 2014 Jun 6;14:195
90.
Amir LH, Forster DA, Lumley J, McLachlan H. A descriptive study of mastitis
in Australian breastfeeding women: incidence and determinants. BMC Public
Health. 2007 Apr 25;7:62
91.
Dener C, Inan A. Breast abscesses in lactating women. World J Surg. 2003
Feb;27(2):130-3
98
92.
Kurt S, Erler A, Demir N. Puerperal mastitlerin klinik izlemi. Türk Ekopatoloji
Derg 1996; 2 (1-2):22-24.
93.
Kok KY, Telisinghe PU. Granulomatous mastitis: presentation, treatment and
outcome in 43 patients. Surgeon. 2010; 8(4):197-201.
94.
Hovanessian Larsen LJ, Peyvandi B, Klipfel N, Grant E, Iyengar G.
Granulomatous lobular mastitis: imaging, diagnosis, and treatment. AJR Am J
Roentgenol. 2009 Aug;193(2):574-81.
95.
Akbulut S, Arikanoglu Z, Senol A, Sogutcu N, Basbug M, Yeniaras E, Yagmur
Y. Is methotrexate an acceptable treatment in the management of idiopathic
granulomatous mastitis? Arch Gynecol Obstet. 2011 Nov;284(5):1189-95.
96.
Parlakgümüş A, Yıldırım S, Bolat F, Purbager A, Çolakoğlu T, Belli S, Tarım A.
Comparison of conservative therapy with steroids and surgical treatment for
idiopathic granulomatous mastitis: Our clinical experience. Turkish Journal of
Surgery 2012;(28):134-8.
97.
Foxman B, D'Arcy H, Gillespie B, Bobo JK, Schwartz K.Lactation mastitis:
occurrence and medical management among 946 breastfeeding women in the
United States.Am J Epidemiol. 2002 Jan 15;155(2):103-14.
98.
Scott JA, Robertson M, Fitzpatrick J, Knight C, Mulholland S.Occurrence of
lactational mastitis and medical management: a prospective cohort study in
Glasgow.Int Breastfeed J. 2008 Aug 25;3:21.
99.
Ammari FF, Yaghan RJ, Omari AK.Periductal mastitis. Clinical characteristics
and outcome.Saudi Med J. 2002 Jul;23(7):819-22.
100. Şimşek G, Gündeş E, Tekin Ş, Tavlı Ş. Laktasyonda Olmayan Kadında
E.Coli’ye Bağlı Bilateral Meme Apsesi: Nadir Bir Olgu. J Breast Health 2014;
10: 174-176.
101. Ocal K, Dag A, Turkmenoglu O, Kara T, Seyit H, Konca K.Granulomatous
mastitis: clinical, pathological features, and management.Breast J. 2010 MarApr;16(2):176-82.
102. Oran EŞ, Gürdal SÖ, Yankol Y, Öznur M, Calay Z, Tunacı M, Soybir GR.
Management of idiopathic granulomatous mastitis diagnosed by core biopsy: a
retrospective multicenter study. Breast J. 2013 Jul-Aug;19(4):411-8.
103. Ramalingam K, Srivastaa A, Vuthaluru S, Dhar A, Chaudhry R. Duct ectasia
and periductal mastitis in Indian women. Indian J Surg 2014.
99
104. Paviour S, Musaad S, Roberts S, Taylor G, Taylor S, Shore K, Lang S, Holland
D. Corynebacterium species isolated from patients with mastitis. Clin Infect Dis.
2002 Dec 1;35(11):1434-40.
105. Osterman KL, Rahm VA. Lactation mastitis: bacterial cultivation of breast milk,
symptoms, treatment, and outcome. J Hum Lact. 2000 Nov;16(4):297-302.
106. Bharat A, Gao F, Aft RL, Gillanders WE, Eberlein TJ, Margenthaler JA.
Predictors of primary breast abscesses and recurrence. Word J Surg, 2009;
33(12) 2582-2586
107. Huebner
J,
Goldmann
DA.Coagulase-negative
staphylococci:
role
as
pathogens.Annu Rev Med. 1999;50:223-36.
108. Leborgne F. Treatment of breast abscesses with sonographically guided
aspiration, irrigation, and instillation of antibiotics. AJR Am J Roentgenol. 2003
Oct;181(4):1089-91.
109. Renshaw AA, Derhagopian RP, Gould EW. Cystic neutrophilic granulomatous
mastitis: an underappreciated pattern strongly associated with gram-positive
bacilli. Am J Clin Pathol. 2011 Sep;136(3):424-7.
110. Fletcher A, Magrath IM, Riddell RH, Talbot IC. Granulomatous mastitis: a
report of seven cases. J Clin Pathol. 1982 Sep;35(9):941-5.
111. Le Flèche-Matéos A, Berthet N, Lomprez F, Arnoux Y, Le Guern AS, Leclercq
I, Burguière AM, Manuguerra JC. Recurrent Breast Abscesses due to
Corynebacterium kroppenstedtii, a Human Pathogen Uncommon in Caucasian
Women. Case Rep Infect Dis. 2012;120968.
112. Özaydın İ, Yıldırım M, Şahin İ, Doğan S. Recurrent breast abscess caused by
Corynebacterium amycolatum: a cae report. Turk J Med Sci 2009;39(1):147-149.
113. Funke, G., A. von Graevenitz, J. E. Clarridge III, K. A. Bernard. Clinical
microbiology of coryneform bacteria. Clin. Microbiol. Rev. 1997;(10):125-159.
114. Osman KM, El-Enbaawy MI, Ezzeldeen NA, Hussein HM. Mastitis in dairy
buffalo and cattle in Egypt due to Clostridium perfringens: prevalence,
incidence, risk factors and costs.Rev Sci Tech. 2009 Dec;28(3):975-86.
115. Schoonderwoerd M, Lewis IM, Scholten JA.Acute gangrenous mastitis due to
Clostridium perfringens type A and Escherichia coli in a cow.Can Vet J. 1990
Jul;31(7):523-4.
100
116. Kataria K, Srivastava A, Dhar A. Management of lactational mastitis and breast
abscesses: review of current knowledge and practice. Indian J Surg. 2013
Dec;75(6):430-5. doi: 10.1007/s12262-012-0776-1.
117. Yılmaz S, Gümral R, Güney M, Bedir O, Güçlü AÜ, Duyan S, Basustaoglu AC.
Iki yıllık dönemde kan kültürlerinden izole edilen mikroorganizmalar ve
antibiyotik duyarlılıkların degerlendirilmesi. Gülhane Tıp Derg 2013; 55: 247252)
118. Çıkman A, Gündem NS, Gülhan B, Aydın M, Parlak M, Bayram Y. İdrar
kültürlerinden soyutlanan Enterobacteriaceae türlerinin GSBL üretimi ile
ertapenem ve diğer antibiyotiklere direncinin belirlenmesi. Dicle Med J. 2014;
41 (3): 474-478.
119. Öztürkeri H, Düztaş O, Kocabeyoğlu Ö, Erdemoğlu A, Emekdaş G. Üriner
enfeksiyon
etkeni
Corynebacterium
urealyticum
ve
Corynebacterium
jeikeum’un idrar kültürlerinden izolasyon sıklığı ve antibiyotiklere duyarlılıkları.
ANKEM Derg 1999; 13 (4): 474-478.
120. Brook I, Wexler HM, Goldstein EJ.Antianaerobic antimicrobials: spectrum and
susceptibility testing.Clin Microbiol Rev. 2013 Jul;26(3):526-46.
121. Bahar H, Altındaş M, Sarıbaş S, Altınkum S, Torun MM. Anaerobic
microbiology of diabetic patients foot ulcers: a retrospective study of 180 cases.
Cerrahpasa Med Rev. 2007; 15 (1):19-22.
122. Wyder AB1, Boss R, Naskova J, Kaufmann T, Steiner A, Graber HU.
Streptococcus spp. and related bacteria: their identification and their pathogenic
potential for chronic mastitis - a molecular approach. Res Vet Sci. 2011
Dec;91(3):349-57.
123. Barrett M. Identification, Characterization, and Management of an Emerging
Mastitis Pathogen, Lactococcus lactis, subspecies lactis 2013 Final Report.
Erişim 12.07.2015:
http://mysare.sare.org/mySARE/ProjectReport.aspx?do=viewRept&pn=ONE11133&y=2013&t=1)
101
FORMLAR
102
ETİK KURUL KARARI
103
ÖZGEÇMİŞ
Kişisel Bilgiler
Adı
Zeynep
Soyadı
Taner
Doğ.Yeri
İstanbul
Doğ.Tar.
22/07/1989
Uyruğu
Email
T.C.
zynptaner@hotmail.com
TC Kim No 20699173670
05333076799
Tel
Eğitim Düzeyi
Mezun Olduğu Kurumun Adı
İstanbul Üniversitesi, Cerrahpaşa Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı
Marmara Üniversitesi, Fen Edebiyat Fakültesi,
Biyoloji Bölümü
Yük.Lis.
Lisans
Beşiktaş Atatürk Anadolu Lisesi
Lise
Yabancı
Dilleri
Mez. Yılı
Okuduğunu
Anlama*
İngilizce Çok iyi
Fransızca Orta
2015
2011
2007
Konuşma*
Yazma*
Çok iyi
Orta
Çok iyi
Orta
YDS
Puanı
IELTS
Puanı
78.75
7.0
*Çok iyi, iyi, orta, zayıf olarak değerlendirin
ALES Puanı
Sayısal
Eşit Ağırlık
Sözel
74,25
75,26
67
Bilgisayar Bilgisi
Program
Microsoft Word
Microsoft Powerpoint
Microsoft Excel
Kullanma becerisi
İyi
İyi
İyi
Yayınları/Tebligleri Sertifikaları/Ödülleri
Kocazeybek B, Demirci M, Taner Z, Algingil RC, Karakullukcu A, Can K, Yuksel P,
Tokman HB. ‘The role of anaerobic bacteria in bite wound abscesses: Results of 53
young adult patients’. Int J Infect Dis 2014; Volume 21. 21S1: Abstract number:
58.048.
H. Bahar Tokman , R. Çalışkan , G. Iskeleli , M. Demirci , S. Saribaş , P. Yuksel , K.
Can , Z. Taner , S. Sirekbasan , E. Gurel , M. Sevgi , F. Koksal , B. Kocazeybek , M.
Mamal Torun. ‘Propionibacterium acnes in biomaterials-associated infection: frequency
and antimicrobial resistance’. FEMS, 6th Congress of European Microbiologists 2015;
461: Abstract number: 2210