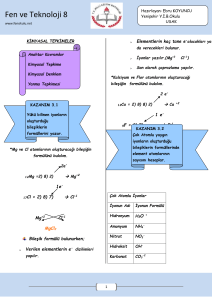
Ag HNO3
AgNO3 NO H 2 O
N2 H 2
NH 3
aAg bHNO3
cAgNO3 dNO eH 2 O
a N2 b H 2
c NH 3
Ag için a c
N için 2a c
ise c 2 diyelim
H için 2b 3c
Bu durumda
2a 2 ise a 1
H için b 2e
N için b c d
e diyelim...
O için 3b 3c d e
3(c d) 3c d e
2d e
2b 3.2 ise b 3 olur.
b 2.2 ise b 4 olur.
Denklem :
2d 2 ise d 1 olur.
N 2 3H 2
2NH 3
4 c 1 ise c 3 a olur.
Olur
3 Ag 4HNO3
3AgNO3 NO 2H 2O
denklem
olur.
Bu yöntemde;
Oksijen ve hidrojen elementleri genellikle en son denkleştirilir.
Denenecek ilk bileşik seçilirken; formülünde atom cinsi ve sayısı en çok olan bileşik
seçilmesi en uygun olur.
Al4 C3 H 2O
Al(OH)3 CH 4
Al4C3’ün kat sayısını 1 alalım
Bu durumda Al(OH)3 ün kat sayısı “4” olur.
CH4 ün kat sayısı “3” olur.
O halde denklem;
Al4 C3 H 2O
4Al(OH)3 3CH 4
Olur.
Sağdaki oksijen atomlarını sayarsak tak 12 tane var. O halde soldaki
oksijenler de 12 tane olması için H2O’nun kat sayısı “12” olmalı.
Bu durumda denklem;
Al4 C3 12H 2O
4Al(OH)3 3CH 4
olur.
Bu yöntemde;
Oksijen ve hidrojen elementleri genellikle en son denkleştirilir.
Denenecek ilk bileşik seçilirken; formülünde atom cinsi ve sayısı en çok olan bileşik
seçilmesi en uygun olur.
Cn H 2n 2 O2
CO2 H 2O
Cn H 2n 2 nin kat sayisini "1" alalim
CO2 kat sayisi" n" olur.
H 2O kat sayisi" n 1" olur.
O2 ' nin kat sayisini bulmak için,
sagdaki O ları sayalim
3n 1 tane O var. O halde
O2 nin kat sayisi
3n 1
olur. Bu durumda denklem...
2
3n 1
Cn H 2n 2
O2
nCO2 (n 1)H 2O olur.
2
Tesir değerliği; bir
maddenin karşısındaki
maddeyi etkileyebilme
gücüdür.
Tesir değerliği; tespit edilirken
tepkimedeki maddelerin davranış
biçimlerine göre karar verilir. Bunun
için aşağıdaki açıklamaları dikkatlice
inceleyiniz…
1 Mol asidin suda çözündüğünde çözeltiye
vermiş olduğu hidrojen iyonunun (H+) mol
sayısıdır.
HCl
H Cl
-1
TD 1
H 2 SO4
H HSO4-1
TD 1
H 2 SO4
2H SO4- 2
TD 2
H 3 PO4
H H 2 PO4-1
TD 1
H 3 PO4
2H HPO4- 2
TD 2
H PO
3H PO
34
TD 3
-3
4
1 mol bazın suda çözündüğünde
çözeltiye vermiş olduğu hidroksit
iyonu (OH-1) mol sayısıdır.
1
-1
NaOH
Na
OH
TD 1
Al(OH)3
Al(OH)21 OH -1
TD 1
Al(OH)3
Al(OH) 2 2 OH -1
TD 2
Mg(OH)2
Mg(OH) 1 OH -1
TD 1
Mg(OH)2
Mg 2 2 OH -1
TD 2
Al(OH)3
Al 3 3 OH -1
TD 3
1 mol tuzun formülünde bulunan
katyonların yükleri toplamıdır.
1
Na Cl td 1
3
Al F3 td 3
3
Fe 2 O3 td 6
3
Al 2 (SO4 )3 td 6
1 mol maddenin mol-atom başına
aldığı ya da verdiği mol-elektron
sayısıdır.
3
Fe Fe 3e
td 3
7
Cl 8e Cl
-1
td 8
3
Fe 1e Fe
td 1
2
H 2 SO4
td 2
Al(OH)3 Al2 (SO4 )3 H 2O
td 3
td 6
td 1
3 H 2 SO4 2 Al(OH)3 Al2 (SO4 )3 6H 2O
CaCO3 HCl CaCl2 CO2 H 2O
CaCO3 2HCl CaCl2 CO2 H 2O
Fe2O3 HCl FeCl3 H 2O
Fe2O3 6 HCl 2 FeCl3 3 H 2O
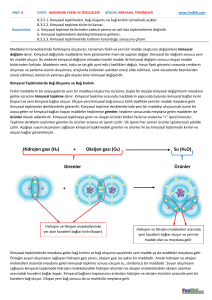
Maddelerin oksijen ile tepkimeye girip oksitlerine dönüşürken ortama ısı enerjisi vermesi olayına YANMA denir.
Tüm yanma olayları egzotermiktir. (ısı veren) ancak azot (N2) gazınınkiler hariç.
Yanma olaylarında oksijen (-2) değerliğini alır.
BİR YERDE YANMA OLAYININ GERÇEKLEŞEBİLMESİ İÇİN;
1.
2.
3.
Yanıcı madde olması gerekir.
Yakıcı madde olması gerekir.
Bu yanıcı madde ile yakıcı maddenin tutuşma sıcaklığına kadar ısıtılmış olması gerekir.
BİR YERDE YANGININ SÖNDÜRÜLEBİLMESİ İÇİN;
1.
2.
3.
Yanan maddenin ortamdan uzaklaştırılması gerekir.
Yakıcı maddenin ortamdan uzaklaştırılması gerekir.
Yanıcı maddenin yanan yüzeyi ile yakıcı maddenin arasına yanmayan bir madde (YANGIN SÖNDÜRÜCÜ)
eklenmeli.
BİR MADDENİN YANGIN SÖNDÜRÜCÜ OLMASI İÇİN;
1.
2.
3.
4.
Tutuşma sıcaklığının çok yüksek olması gerekir.
Öz kütlesi havadan ağır olmalı.
Yanıcı ve yakıcı madde ile kimyasal tepkime vermemeli
Ekonomik olmalı.
NOT: Su düşük sıcaklıktaki (adi yangınlar) yangınlarda söndürücü olabilir. Ancak yüksek sıcaklıktaki (Petrol gibi
kimyasal maddelerin) yanmalarında yangın söndürcü olarak kullanılamaz.
Bir element yandığında o elementin oksidi oluşur.
Soygazlar yanmaz (He, Ne. Ar, Kr, Xe, ve Rn)
Metaller yandığında metal oksitler oluşur. Metal oksitler genellikle bazik özellik
gösterir.
Ametaller yandığında ametal oksitler oluşur. Ametal oksitler genellikle asidik
özellik gösterir.
ÖNEMLİ:
Bir element yandığında alabileceği en büyük pozitif değerliği almış ise buna TAM
YANMA denir. En büyük pozitif değerliği alamamışsa buna KISMİ YANMA denir.
Tam yanma sonucu oluşan oksitler bir daha yanmazlar.
Kısmi Yanma soncu oluşan oksitler tam yanma olayını gerçekleştirene kadar
yeniden yanabilirler.
Örnekleri dikkatlice inceleyelim…
He O2
yanmaz
1
2 Na O2
Na2O
2
C O2
CO2
tam yanma
tam yanma
2 C O2
2 CO Kismi yanma
1
Fe O2
FeO kismi yanma
2
Fe O2
Fe2O3
tam yanma
1
CO O2
CO2
tam yanma
2
1
2FeO O2
Fe2O3 tam yanma
2
Bir bileşik yandığında bileşikteki her bir elementin oksidi oluşur.
ÖNEMLİ
Bileşikteki anyon oksijen ile yanarken (-) yük mutlak değer içine alınır. Bundan
sonra onun 8’e tamamlayan pozitif değeri ile oksidinin formülü yazılır.
Aşağıdaki örnekleri dikkatlice inceleyiniz…
H 2 S O2
H 21S 2 O2
H 1O-2 S 6 O-2
H 2 S 2 O2
H 2O SO3
Bir bileşik yandığında bileşikteki her bir elementin oksidi oluşur.
ÖNEMLİ
Bileşikteki anyon oksijen ile yanarken (-) yük mutlak değer içine alınır. Bundan
sonra onun 8’e tamamlayan pozitif değeri ile oksidinin formülü yazılır.
Aşağıdaki örnekleri dikkatlice inceleyiniz…
Al4C3 9 O2
4 Al2O3 3 CO2
2 NH 3 4 O2
N 2O5 3 H 2O
Mg 3 N 2 4 O2
3 MgO N 2O5
CH 4 2 O2
CO2 2 H 2O
Cn H 2n 2
3n 1
O2
nCO2 (n 1)H 2O
2
Bir karışım yandığında; karışımdaki her bir saf madde kendi kuralına göre yanar. Yani
elementler kendi kurallarına göre, bileşikler ise kendi kurallarına göre yanar.
( Mg + He ve CH4 ) karışımı oksijen ile yandığında yanma ürünleri nelerdir?
Burada dikkat edilmesi gereken:
1.
Mg element ve metal olduğundan oksijen ile yanar ve metal oksit oluşur
2.
He soygaz olduğu için oksijen ile yanmaz.
3.
CH4 bileşik olduğundan oksijen ile yandığında bileşikteki her bir elementin oksidi (CO 2 ve H2O)
oluşur.
4.
Karışımdaki her bir saf maddenin oksijen ile tepkimesini ayarı ayarı yazıp üzerinde işlem yapmalıyız.
1
Mg O2
MgO
2
He O2
YANMAZ
CH 2 2 O2
CO2 2H 2 O
MgO He
CO2 2H 2O
Her türlü asit ile
tepkime verirler
Asitler ve kuvvetli
bazlar ile tepkime
verirler
Yalnız oksijenli
inorganik asitler
ile tepkime verirler
Hiçbir asit ve baz
ile tepkime
vermezler
Aktif metaller asitler ile reaksiyona girdiğinde asidin hidrojen
iyonu ile metal yer değiştirir. Ürün olarak METALİN TUZU ve
HİDROJEN GAZI oluşur.
Na HCl
NaCl H 2
Mg 2 HNO3
Mg(NO3 )2 H 2
3Fe 2H 3 PO3
Fe3 (PO4 )2 3H 2
Ca H 2 SO4
CaSO4 H 2
Anfoter metaller asitler ile reaksiyona girerse aktif metaller gibi davranırlar.
Yani ürün olarak metalin tuzu ve hidrojen gazı açığa çıkar.
Zn 2 HCl
ZnCl2 H 2
2 Al 3 H 2 SO4
Al2 (SO4 )3 3 H 2
Anfoter metaller kuvvetli bazlar ile reaksiyona girerse; Çifte tuz (Çift katyonlu
tuz) ve hidrojen gazı oluşur.
Zn 2 NaOH
Na2 ZnO2 H 2
2 Al 3 NaOH
Na3 AlO3 3 H 2
Yarısoy metaller oksijeni olmayan inorganik asitler ile tepkime vermezler.
Cu HCl
CuCl2 H 2 OLMAZ
Ag HCl
OLMAZ
Cu HI
OLMAZ
....................................
Soy metaller hiçbir asit ya da baz ile tek başına tepkime vermezler.
Au HNO3
Olmaz
Pt H 2 SO4
Olmaz
Au H 2 SO4
Olmaz
Ancak:
Altını çözebilen bir karışım vardır. Bu
karışım
3 molarlık HNO3 +1 molarlık HCl
Eşit hacimlerde karıştırılması ile oluşur.