RADYONÜKLİD
TEDAVİ
Radyonüklid tedavi
Radyofarmasötiklerin tutulumu
etkileyen doku faktörleri
Kan perfüzyonunun değişikliği
– Tümör büyüdükçe perfüzyonu azalır
– Vasküler staz trombüse ve oklüzyona neden
olur
– Tümör hücrelerinde hipoksi ve nekroz gelişir
Ekstravasküler alanının artması
İntertisiyel basınç ve permeabilitede
değişme
Radyonüklid tedavi
Perfüzyonun azalması
Kan akımındaki azalma radyonüklid
tedavinin etkisini azaltır, çünkü:
– Canlı hücrelere çok daha az radyofarmasötik
gider
– Fonksiyonel bütünlüğün kalkması nedeni ile
metabolik maddelere karşı gereksinim azalır
– Hücrelerin hipoksik durumu radyasyona karşı
duyarlılığı azaltır
Radyonüklid tedavi
Radyofarmasötiklerin tutulum ve retansiyonu
Absorbe edilen radyasyon dozu
radyofarmasötiğin
– Tutulum ve
– Retansiyonuna bağlıdır
Radyonüklid tedaviyi etkileyen faktörler
– Radyonüklidin yarı ömrü
Yarı ömrü az olanlar yetersiz, çok olanlar ise gereksiz
radyasyon dozu verir
– Heterojen tutulum lokal yetersiz radyasyon verir
– Hiçbir radyofarmasötik selektif olarak tutulmaz
– Farmakolojik intervasyon radyofarmasötiğin
biyokinetiğini etkiler
Radyonüklid tedavi
Kullanılan radyofarmasötikler
Radyonüklidler yaydıkları ışınlara göre 5
gruba ayrılır
– Alfa partikülü yayanlar (At-211(actinium))
– ß radyasyonu yayanar
<200µm (P-33)
>200µm <1mm (Re-186, Cu-67, I-131)
>1 mm (P-32, Re-188, Y-90, Sr-89)
– Auger ve Coster Kronig konversiyon
elektronları (Ga-67, I-125)
Radyonüklid tedavi
Kimyasal bağlantı ve radyasyon toksisitesi
Radyonüklidlerin kimyasal bağlantısı
radyofarmasötiklerin dağılımını
etkilemektedir
İyi bağlanmayan radyofrmasötiklerin
dağılımı değişmekte ve istenmeyen
radyasyona neden olmaktadır
Verilen radyoaktivite tiroit, mesane,
karaciğer, kemik iliği ve yakın normal doku
üzerine toksik etki yapabilir
Radyonüklid tedavi
Doz hesaplanması
Tedavinin optimizasyonu için hastalıklı ve
sağlıklı doku üzerine olan radyasyon
etkisinin radyofarmasötik verilmezden
önce hesaplanması gerekir
– Klasik yöntemler
MIRD sistem
ICRP yöntemi
– Yeni yöntem
Monte Carlo
Radyonüklid tedavi
Tiroit hastalıklarında
– Selim
– Habis
Fosfor-32 tedavisi
Kemik ağrısı palyasyonu
Radyonüklid ile işaretli
antikorlar (Radyoimmün
tedavi)
MIBG tedavisi
Resepötöre yönelik
radyopeptit tedavisi
Hepatik tümörlerde işaretli
lipiodol tedavisi
Target tedavisine alternatif
tedaviler
–
–
–
–
–
–
–
–
–
–
–
Direkt lezyon içi injeksiyon
Direkt kist içi injeksiyon
İntra arteryel injeksiyon
İntrakorener uygulama
İntralenfatik infüzyon
Seröz kaviteye injeksiyon
İntraperikardial injeksiyon
Intrapleural injeksiyon
İntraperitonel injeksiyon
Intravesikal tedavi
Dermal epidermal kontak
tedavi
– Intranasal sinüs tedavisi
– Intraartiküler tedavi
Selim tiroid hastalıklarında
Radyoiyot tedavisi
1940’lı yıllardan beri kullanılmaktadır
Etkili
Emniyetli
Nispeten ucuz
I-131
–
–
–
–
–
Beta ve gamma ışını mevcut
Tiroidde metabolize olur
Beta ışınlarının ulaşımı 1-2mm
Follikül hücrelerini tahrip eder
Zaman içinde atrofi, fibroz ve kronik inflamasyon sonucu
hacimde küçülme ve hipotiroidi
Selim tiroid hastalıklarında
Nontoksik guatr
Endikasyon
–
–
–
–
Dispne ve disfaji
Yaşlılık
Anestezi riski
Nüks guatr (larinks sinirini
zdeleme)
– Soğuk nodüllerde tutulum
olmaz
Hazırlık
– İyot içeren maddeler
tedaviden önce kesilir
– Radyoiyot 100µCi/g olarak
verilir
Sonuç
– Mekanik semptomlar %80
kalkar
– Küçük guatrlarda volüm
azalması daha fazla olur
– Radyoiyodun etkisi iki yıl
sürer
Yan etkileri
– Hipotiroidism
%0-45
– Tiroidit
Tedaviden 5-10 gün sonra
ve %1-5 hastada görülür
Selim tiroid hastalıklarında
Tirotoksikozda
Radyoiyot tedavisi
I-131 uygulaması
Doz miktarı
– Graves hastalığı:
50-150 Gy (5000-15000 rad)
– Toksik nodüler guatr
Daha yüksek doz
Doz hesaplaması
–
–
–
–
–
Tiroid hacmi
Tiroidin iyod uptake’i
İyodun gland içindeki dolaşım hızı
İyodun fiziksel yarı ömrü
Önce kullanılan antitiroid ilaçlar
Organifikasyonu bozar
Radyoiyot tedavisi
Uygulama
Formüller
80-120uCi I-131 X tiroid gland ağırlığı
24 saatlik tiroid uptake
Genelde 5-15 mCi RI verilir
Yüksek doz
–
–
–
–
–
–
–
Uptake düşük olanlara
Büyük guatr ve
Ağır hipertiroidi (hızlı turnover)
Toksik nodüler guatr
Önce ve sonra antitiroit ile tedavi
İkinci kez doz alanlara
Kalp hastalarına
Radyoiyot tedavisi
Takip
6-8 hafta sonra %50-60 hastada normal
fonksiyon ve tiroit hacminde küçülme
İlk dozda %80-90 hasta ötiroit
%10- 20 ikinci doz gerekir
Çok az hastada daha fazla RI
İkinci doz 3-12 ay sonra verilebilir
Radyoiyot tedavisi
Komplikasyonları
Hipotiroidism
Tiroit ve diğer tümörler
Teratojenite ve kromozom harabiyeti
Diğer etkileri
Radyoiyot tedavisi
Hipotiroidi
– İlk sene içinde %90
– Her sene %2-3
– Yüksek antiTPO olanlarda fazla
– Önce ve sonra verilen antitiroit ilaçlar
hipotiroidismi azaltır
– Geçici hipotiroidi %90
İlk 2 ay içinde oluşur 1-4 ay sürer
– Geçici tiroit bozukluğu
– Devamlı TSH supresyonu
Radyoiyot tedavisi
Tiroit ve diğer tümörlerin oluşumu
Çocuklarda ve gençlerde?
Karsinojenik etki?
Radyoiyot tedavisinden sonra kanser gelişimi
gösterilmemiş
Uzun süreli retrospektif çalışmalar
sonucu:ÇOCUKLARDA VE GENÇLERDE
KULLANILABİLİR
Rİ tedavisinden sonra diğer tümörlerde artış
görülmemiştir
Radyoiyot tedavisi
Teratojenite ve kromozom harabiyeti
Gebelikte kesin kontrendikasyon
Rİ alanların çocuklarında herhangi bir
doğum anomalisi görülmemiştir
Rİ alan kadınların 3 ay sonra hamile
kalmaları önerilmektedir
Radyoiyot tedavisi
Rİ’un diğer yan etkileri
Allerjik etkisi yoktur
Nadiren gastrit’e bağlı bulantı
Tiroiditise bağlı boyun ağrısı
Nadiren tirotoksikoz alevlenmesi
Çok nadir
– Hipoparatiroidi
– Hiperparatiroidi
– Vokal kort felci
Radyoiyot tedavisi
Endikasyonları
Graves hastalığında
Çocuklarda
Genç erişkinlerde
Erişkinlerde endikedir
Çünkü,
En uygun ve
en ucuz tedavidir,
hipertiroidiyi hızlı ve güvenli bir şekilde
tedavi eder
Radyoiyot tedavisi
Toksik adenom ve
multinodüler toksik guatrda tedavi
Antitiroit ilaç kullanılmaz
Antitiroit ilaçlar sadece cerrahi ve Rİ tedavisine hazırlık
için kullanılır
Rİ tedavisi
– Cerrahiden daha az morbidite
– Daha yüksek radyoiyot dozu
– Diğer hastalıklarla birlikte olan yaşlılarda
Cerrahi tedavi
– Gençlerde >5cm
– Substernal guatırı olanlarda
– Hipotiroidi daha sık görülür
P-32 tedavisi
Polisitemia Vera (1)
Polisitemia vera (PV) kronik
miyeloproliferatif hastalık
Eritrosit kan kitlesinde artış,
lokositoz, trombositoz ve
splenomegali
Pluropotent stem hücrelerinin
neoplastik klonundan oluşur;
genetik ve çevresel faktörler ile
gelişir
Eritrosit kitlesinde artış
olmasına rağmen eritrosit
yaşam süresi uzamamıştır
Genellikle 10 yıl sonra miyeloid
ve akut lösemiye dönüşür (%515)
Miyeloid metaplazi, dalakta
ileri derecede büyüme, eritrosit
morfolojisinde değişme, kemik
iliği fibrozu ile karakterizedir
Miyeloid metaplaziye dönüşen
hastaların %25-50’si akut
lösemiye dönüşür
Ortalama yaşam süresi 1.5 yıl
Tedavi ile ortalama yaşam
süresi 10 yıl
P-32 tedavisi
Polisitemia Vera (2)
Tedavide
– Flebotomi
– Kemoterapi
Busulfan veya hidroksiüre
– Interferon-α
– Radyofosfor (P-32)
Hiçbir tedavi şekli tam olarak tedavi nedici
değildir, konservatif tedavi yanında
yardımcı olarak kullanılmaktadır
P-32 tedavisi
Polisitemia Vera (3)
P-32
– Saf bir ß yayıcısıdır
– Doku içindeki girginliği 3-8 mm
– Kemik iliğindeki biyolojik yarı ömrü 7-9 gündür
– Hiperproliferatif hücreleri süprese eder
ortadan kaldırmaz
– IV veya oral yoldan verilir
– Kemik iliği dalak ve karaciğer tarafından
tutulur
P-32 tedavisi
Polisitemia Vera (4)
PVSG ve EORTC çalışma grupları
flebotomi, chlorombucil ve P-32
karşılaştırılmış:
– Chlorombucil diğer iki tedavi yöntemeine göre
yaşam süresini azaltmış
– Flebotomi ile P-32 arasında 10 yıl yaşam
süresi arasında fark bulunmamış
– Flebotomi tedavisinde fatal tromboembolik
komplikasyonlar daha fazla
– P-32’de AML daha (%10) sık
P-32 tedavisi
Polisitemia Vera (5)
P-32 ve busulfan karşılaştırılmasında
– Busulfan tedavisinde yaşam süresi daha uzun
Tedavide öneriler
– P-32 tedavisi flebotomiden sonra hematokrit %4247’ye düşünce başlanır
– 3-5 mCi P-32 IV olarak verilir
– Cevap vermeyen vakalarda her 3 ayda bir doz miktarı
%25 artırılarak verilir
– P-32 tedavisi özellikle yaşlılarda ilaç almada zorluk
çekenlerde ideal bir tedavi yöntemidir
P-32 tedavisi
Esansiyel Trombositemia (1)
İdiopatik miyoloproliferatif trombositlerin
artışı ile karekterize bir hastalıktır
Daha fazla gençlerde ve kadınlarda
görülür
Miyoloid metaplazi veya AML’ye dönüşür
Yüksek riskli hastalar 60 yaşın üzerinde ve
herhangi bir yaşta trombüs gösteren
hastalardır
P-32 tedavisi
Esansiyel Trombositemia (2)
Yüksek riskli hastaların tedavisinde
– P-32
– Hyhdroxyurea
– İnterferon alfa
P-32 tedavisi
– Oral ve IV olarak uygulanır
– Trombosit sayısı <450x 109/L oluncaya kadar
P-32 tedavisine devam edilir
Radyonüklid tedavi
Kemik ağrısı palyasyonu
Metastazlarda ortaya çıkan kemik ağrısı hayat
kalitesini düşüren sık görülen bir problemdir
Semptomlar
–
–
–
–
norolojik defisit,
patolojik kırık,
hareketsizlik ve
hiperkalsemi sekeline bağlı artar
Kemik palyasyonunda tedavi stratejisi ağrı
yapan sebep üzerinedir
Radyonüklid tedavi
Kemik ağrısı palyasyonu (2)
Kemik metastazı en sık (%85)
– Meme Ca
– Prostat Ca
– Akciğer Ca
Kemik metastazlarının %50 sinde ağrı
oluşur
Kemik metastazları
– Hematolojik
– Direkt
Radyonüklid tedavi
Kemik ağrısı palyasyonu (3)
Kemik metastazları radyografik olarak
– Litik (osteolysis)
– Osteoblastik (osteosklerosis)
Kemik metastazlarında ağrı oluşmasında
mekanizma
– Sinir uçlarının prostaglandinler, kinin, histamin
tarafından uyarılması
– Periostal gerginlik
– Patolojik kırık
– Lokal invazyon
Radyonüklid tedavi
Kemik ağrısı palyasyonu (4)
Kemik palyasyonunda strateji
– Analjezik
– İlaç
Kemoterapi
Hormon
Steroid
Psikomimetik
Bifosfanat
– Girişim
Cerrahi
Girişimsel anastezi
– Radyasyon
Radyoterapi
Radyofarmasötik tedavisi
Radyonüklid tedavi
Kemik ağrısı palyasyonu (5)
İlk tedavi non-narkotik analjezikler
Daha sonra narkotik analjezikler
– Somnolans
– Davranış bozukluğu
– Bulantı, kusma, kabızlık
Eksternal radyasyon
– Palyasyonda anlamlı gelişme
– Kemik iliği toksisitesi
Radyonuklid tedavi
–
–
–
–
–
Direkt metastaz üzerine etki
Radyoterapi kadar etkili
Bir tek tedavi ile bütün metastatik bölgeler tedavi edilir
Yeni ağrılı odakların çıkmasını engeller
Daha ucuzdur
Radyonüklid tedavi
Kemik ağrısı palyasyonu (6)
Palyasyonda kullanılacak ideal
radyonuklidlerin özellikleri
– Metastazda selektif olarak tutulması
– Yumuşak doku ve normal kemikten hızlı
olarak atılması
– Fiziksel yarı ömrünün biyolojik yarı ömründen
daha fazla olması
– Dağılımının Tc-99m MDP kemik sintigrafisi ile
belirlenmesi
– Ucuz olması ve herzaman bulunabilmesi
Radyonüklid tedavi
Kemik ağrısı palyasyonu (7)
Radyofarmasötikler
– Strontium-89 (Sr-89)(metastron)
Beta yayıcısı
Yarı ömrü 50.5 gün
Kalsyuma kimyasal benzerşiği ile kemikte tutulur
Ağrı 1-3 hafta içinde azalır ortlama 3-6 ay devam eder
3-4 mCi iv olarak verilir
– Samarium -153 (Sm-153)(Quadramet)
Beta ve gama yayıcısı
Yarı ömrü 46.3 saat
İmaj alınabiliyor
Kemik palyasyonu 1-2 haftada başlar ortlama 2.6 ay sürer
1mCi/kg olarak iv olarak verilir
– Rhenium-186 etidronate
Radyonüklid tedavi
Kemik ağrısı palyasyonu (8)
Endikasyonlar
– Hormonal ve kemoterapiye cevap vermeyen
vakalarda
– Narkotik analjezik istenmeyen vakalarda
– Yan etkisi
Subklinik trombositopeni (8-24 saat sonra normale
döner)
Radyonüklid tedavi
Radyoimmun tedavi
Son zamanlarda bu tedavi şekli
yaygınlaşmaya başladı
Tümör cevabını etkileyen en önemli
faktörler
– Tümörün almış olduğu toplam doz
– Doz hızı
– Penetrasyon
– Tümörün radyasyona karşı duyarlılığı
Radyonüklid tedavi
Radyoimmun tedavi (2)
RIT de kullanılan radyofarmosötikler iki kısımdan
oluşur
– Antikor
Antikorlar tümör antijenlerine karşı oluşturulur(CD20, CD22,
HLA-DR...)
İki şekilde üretilir
– Sıçanlardan
– İnsanlardan
– Radyonüklid
Birçok radyonüklid kullanılır (Cu-67, Rh-188, Rh-186, At-211)
En sık kullanılanlar
– I-131 (beta ve gamma ışını yayar)
– Y-90 (beta ışını yayar)
Radyonüklid tedavi
Radyoimmun tedavi (3)
Klinik uygulama
– En iyi sonuç NHL’da alınmıştır
– NHL’de dört ajan kullanılmaktadır
Bexxar (I-131 B1)
Zevalin (Y-90 2B8)
Lymphocide (I-131/Y-90 LL2)
Oncolym (I-131 Lym-1)
– Birçok NHL B hücre orijilidir ve CD20 içerir
Zevalin (ibritumomab tiuxetan)
– Ibritumomab (murine parent of rituximab)
CD20 bağlanır
– Tiuxetan
stabil
retansiyonu
90Y’un
CD20 antigen
Sadece B-lineage
hücreleri üzerinde
bulunur
90Y
B cell
CD20
antigen
Zevalin
Ibritumomab
Tiuxetan
90Y
ODAC Presentation 40
Radyonüklid seçimi
Yttrium-[90]
Half-life
64 hours
Energy emitter
Beta
(2.3 MeV)
Path length
90 5 mm
Administration
Outpatient
ODAC Presentation 41
111In-işaretli
4 hours
66 hours
Zevalin imajları
139
hours
Abdominal SPECT
Abdominal CT
ODAC Presentation 42
Radyonüklid tedavi
Radyoimmun tedavi (5)
Zevalin tedavisi,
– nüks ve refrakter ,
– düşük gradeli,
– folliküler,
– veya CD20+transforme B-hücreli NHL ve
– rituximab-refraktör NHL’de klinik olarak anlamlı ilerleme
göstermiştir.
Radyonüklid tedavi
MIBG TEDAVİSİ
Meta-iodobenzylguanidin (MIBG) nöral
crest tümörlerinin tedavisinde kullanılır
Feokromositomada ve noroblastomada
duayrlılığı %81-96, özgü değeri %96-100
Carsinoid ve meduller tiroit kanserinde
duyarlılık sırasıyla %70 ve %35 ‘dir
Başarılı tedavi için tümörün selektif olarak
MIBG’yi tutması ve kalıcılığı önemlidir
Radyonüklid tedavi
MIBG TEDAVİSİ (2)
Endikasyonu
– Yüksek tutulum ve kalıcılığı
olan
Feokromositoma,
Noröblastoma
Meduller tiroit kanseri
Paraganglioma
Karsionoid
Uygulama
– Öncelikle 0.5-1 mCi MIBG
iv olarak verilerk imaj alınır
– Tedavi için 100-300mCi I131-MIBG iv olarak verilir
– Tedaviye sonuç alınıncaya
kadar 4-6 haftalık
aralıklarla devam edilir
– Noroblastoma’da tanıdan
hemen sonra,
kemoterapiden sonra veya
birlikte uygulanabilir
Radyonüklid tedavi
MIBG TEDAVİSİ (3)
Feokromositomada MIBG tedavisindeki
amaç
– Semptomların azaltılması
– Tümör fonksiyonunu azaltılması
– Tümörün ortadan kaldırılması
– Tümörün küçültülmesi
Radyonüklid tedavi
Reseptörlere yönelik radyopeptit
tedavi (1)
Peptitler aminoaslerin birleşmesi ile oluşan moleküllerdir
Birçok önemli biyolojik işlemin düzenleyicisidirler
–
–
–
–
Hücresel fonksiyonları sağlar ve kontrol eder
Hücreler arasındaki haberleşmeyi sağlar
İmmunite cevabı verirler
Peptit protein etkileşmesi sağlar
En önemli protein reseptörleri grubu reseptörlerle
birleşmiş G protein reseptörleridir
Bunlar hücre yüzeylerinde bulunmaktadır
Bunlara karşı geliştirilen ligantlar tanı ve radyoterapide
kullanılmaktadır
Radyonüklid tedavi
Radyopeptit tedavi (2)
Tanı ve tedavide kullanılan nöropeptitler
– Somatostatin analogları
Octreotide
Lenlantreotide
– Bunlar hormon sekrete eden nöroendokrin
tümörlerin
Sekresyonunu inhibe ederek hayat kalitesini
artırmakta
Tümör büyüklüğü ve hacmi üzerine etki
etmemektedir
Radyonüklid tedavi
Radyopeptit tedavi (3)
Endojen somatostatin
–
–
–
–
–
Santral sinir sisteminde
Hipotalamopituiter sistemde
Gastrosintestinal sistemde
Exocrin ve endokrin pankreasta
İmmun sistemde bulunur
Somatostatin etkileri
– İnhibitör
– Nörotransmiter ve nöro hormon
– Tümör büyümesini önler
Radyonüklid tedavi
Radyopeptit tedavi (4)
Somatostatin reseptör sintigrafisinde gold
standart olarak In-111-DTPA ocreotide
(Ostreoscan) kullanılır
Somatostatin resöpterlerine bağlanarak
etkilerini gösterirler
5 çeşit somatostatin reseptörü mevcuttur
Somatostatin reseptör radyotedavisi bu
reseptörlerin tümör hücrelerindeki
çokluğuna dayanmaktadır
Radyonüklid tedavi
Radyopeptit tedavi (5)
Radyopeptit tedavisinde
kullanılan ajanlar
– In-111-DTPA octreotide
(Octreoscan)
– Y-90 DOTATOC (DOTA
octreotide)
– Y-90 MAURITUS (DOTA –
Lanreotide)
– Lu-177 TATE (octreotide)
Tedavi edilebilen
nöroendokrin tümörler:
–
–
–
–
–
–
–
İnsilinoma
Gastrinoma
Vipoma
Glucogonoma
Somatostatinoma
Malin karsinoid sendrom
Nonfonksiyone pankreas
tümörleri
– Merkel hücreli karsionom
– Feokromositoma ve
paraganglioma
– Glioma ve astrositoma
Radyonüklid tedavi
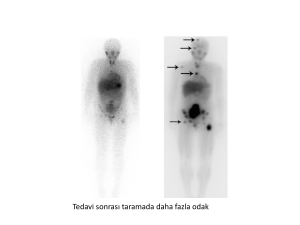
Karaciğer metazı ile birlikte pankreatik
tümör
Karaciğere metastaz yapmış metastatik
nöroendokrin tümör: A. Tedavi öncesi; B.
Tedavi sonrası
Intra-artiküler tedavi
(Radyasyon sinoviyektomi)
İntra artiküler enjeksiyonla uygulanan
tedavi şeklidir
Endikasyonları
– Romatoit artrit ve diğer inflamatuar eklem
hastalıklarında
– Pigmente villonodüler sinovitis
– Hemofilik eklem hastalığı
Intra-artiküler tedavi
(Radyasyon sinoviyektomi)
Radyofarmasötikler
–
–
–
–
–
–
–
P-32
Y-90
Re-186
Sm-153
Au-198
Re-188
Ho-166
Radyonüklidler kolloid formu ile (3-15um)
intrartiküler olarak enjekte edilir
Brakiterapi
In-stent re-stenozlarda intravasküler
brakiterapi ile restenoz önlenebilir
– Re-188 balon içerisinde stenoz bölgesine
yerleştirilir ve belirli miktarda radyasyon verilir
– Ucuzdur
– Herzaman hazır olarak bulunmaktadır
Clinical case: P 1 (A. K.)
48 year old man, proximal Cx ISR
After c.b.
Angiography
Cutting balloon
After IVRT
IVRT
After 6 months