DENEY 1 Metal-metal bağı içeren kompleksler ve manyetik moment
advertisement

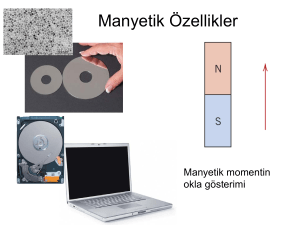
DENEY 11 MANYETİZMA 1. Amaç Bu deneyde, geçiş metal komplekslerinin manyetik duyarlık (manyetik süsseptibilite) ölçümlerinden komplekste bulunan eşlenmemiş elektron sayıları tayin edilecektir. Bu bilgiden yararlanarak Değerlik Bağı Kuramı (VBT) uygulanarak komplekslerin geometrisi tayin edilecek ve Kristal Alan Kuramı (CFT) uygulanarak komplekslerin KAKE tayin edilecektir. 2.Giriş Bütün maddeler manyetik özelliğe sahiptir, maddelerin manyetik özelliklerini inceleyen bilim dalına manyetokimya adı verilir. Manyetik alana konan maddeler manyetikleşir. Manyetikleşme birim hacim başına düşen toplam manyetik momenttir. Maddelerin manyetik özellikleri manyetik duyarlık ölçümleri ile incelenir. Manyetik duyarlık(χ), manyetikleşmenin(M) uygulanan manyetik alana(H) oranıdır, diğer bir değişle, manyetik alana konan maddelerin manyetikleşme derecesine manyetik duyarlık denir ve boyutsuz bir büyüklüktür. Manyetik duyarlılık tayininde kullanılan yöntemler, Gouy terazisi, Faraday yöntemi ve NMR dır. Son iki yöntem mikroölçek çalışmalar için uygundur. Manyetizma, maddenin atom ve kristal yapılarına bağlıdır. Manyetik özelliklerin büyüklükleri ve sıcaklığa bağımlılıkları farklıdır. Manyetizmanın bazı türleri şunlardır: (a) Diyamanyetizma (b) Paramanyetizma (c) Ferromanyetizma (d) Ferrimanyetizma (e) Antiferromanyetizma (g) Zorlanmış ferromanyetizma Diyamanyetik maddeler, manyetik momente sahip değildirler, dış manyetik alan tarafından zayıfça itilirler; tüm elektronları eşleşmiştir; örnek olarak H2O, Cu (k), N2, BaSO4 verilebilir. Paramanyetik maddeler ,manyetik alan tarafından zayıfça çekilirler, eşleşmemiş elektronlara sahiptirler. Elektronların spin ve orbital hareketleri manyetizmayı doğurur. Dış manyetik alan kalktığında manyetizmaları yok olur. Eşleşmemiş elektron sayısı arttıkça paramanyetik özellik artar. Örnek olarak O2, Fe, Gd, Mg verilebilir. Ferromanyetik maddeler, Belirli bir sıcaklığın (Curie sıcaklığı) altında kalıcı manyetik özelliğe sahiptirler; paramanyetizmanın 1000 katı daha büyüktürler; atomların manyetik momentleri aynı doğrultuda yönlenmiştir, dış manyetik alan kalktığında manyetik özelliklerini korurlar; Örnek olarak Fe, Ni, Co verilebilir. Ferrimanyetik maddeler, Kristal içindeki iyonların manyetik momentleri antiparalel yönelmiştir, birbirlerini tamamen yok etmemiştir, net manyetik moment hâlâ mevcuttur. Örnek olarak “magnetit” verilebilir. Antiferromanyetik maddeler, yönelmeleri sonucu atom veya iyonların manyetik momentleri birbirlerini yok eder, net manyetik moment sıfırdır. Zorlanmış ferromanyetik maddeler, spinleri bir kuvvet uygulanarak paralel hale getirilmiş antiferromanyetik maddelerdir. (A) paramanyetizma (B) ferromanyetizma (C) antiferromanyetizma (D) ferrimanyetizma (E) zorlanmış ferromanyetizma Aşağıda bazı manyetizmaların manyetik duyarlıkları verilmektedir. Manyetizma χ değeri Diyamanyetizma küçük ve negatif Paramanyetizma küçük ve pozitif Ferromanyetizma büyük ve pozitif Antiferromanyetizma küçük ve pozitif Antiferromanyetik maddelerde, sıcaklık arttıkça χ değeri artar. Paramanyetik maddelerde, sıcaklık arttıkça χ değeri değişmez veya azalır. Bazı maddeler, özellikle lantanitler, sıcaklık azaldıkça, paramanyetikten antiferromanyetiğe sonra ferromanyetiğe döner. Ferromanyetik ve antiferromanyetik maddeler ısıtıldıklarında manyetik özelliklerini kaybederek paramanyetik maddelere dönüşürler. Ferromanyetik maddeler için bu sıcaklığa Curie sıcaklığı (Tc) , antiferromanyetik maddeler için Néel sıcaklığı (TN) adı verilir. Atomlardaki elektronlar dönerken manyetik moment(µ) oluşturur. Manyetik momentle açısal momentum arasındaki ilişki şu bağıntı ile verilir. µ = − g µB J Burada g Lande g-faktörüdür, µB atomik manyetik moment birimidir ve Bohr magneton adı verilir, J açısal momentumdur. Eksi yük için manyetik moment ve açısal momentum zıt yöneldiği için negatif işaretlidir. J=L+S ve g = 2 (elektron için) Sadece elektron spinlerini dikkate alırsak µs = − 2 µB S Burada S toplam spin kuantum sayısıdır. Bu ifadeyi şu şekilde düzenleyebiliriz. µs = 2 µB√ S(S + 1) veya µ S = µ B n( n + 2 ) Burada n eşleşmemiş elektron sayısı ve S = n/2 dir. Fe2+ iyonunun µS değerini hesaplayalım. Fe2+ nin elektron dizilişi, [Ar] 3d6 dir. Buna göre . Böylece n =4, ve µ S = µ B 4( 4 + 2 ) = 4.90 µ B veya 4.90 BM dir. Manyetik moment doğrudan ölçülmez, manyetik duyarlıktan hesaplanır. Burada µeff, manyetik duyarlıktan elde edilen, etkin (veya efektif) manyetik moment, χm ise molar manyetik duyarlıktır. Molar manyetik duyarlık, gram manyetik duyarlık ve molekül ağırlığı çarpımından elde edilir. χM = χg x M Molar manyetik duyarlık, maddelerdeki diğer atomların diyamanyetik katkısını da içermektedir. Ölçüm sonuçlarından elde edilen molar manyetik duyarlık gerçek değerinden daha küçüktür. Bu nedenle bileşikteki iç kabuk elektronları, ligantlar veya atomlar için diyamanyetik düzenlemeler yapılmalı ve molar duyarlık değerine ilave edilmelidir. χM (düzeltilmiş) = χMpara + χMdiya (iç kabuk elektronları) + χMdiya(ligant) + χMdiya(diğer) Gram manyetik duyarlık ise çeşitli yöntemlerle ölçülebilir. Manyetik duyarlık bu deneyde Evans terazisi kullanılarak tayin edilecektir. 3. [Co(NH3)4CO3]NO3 sentezi 20 g (NH4)2CO3 60 ml suda çözülüp üzerine 60 ml derişik NH3 ilave edilir.Başka bir kapta 15 g Co(NO3)2.6H2O 30 ml suda çözülür ve bu iki çözelti karıştırılır.Bunların üzerine 8 ml %30 luk H2O2 ilave edildikten sonra karışım çeker ocakta 90 ml ye kadar buharlaştırılır. Buharlaştırma sırasında azar azar (NH4)2CO3 ilave edilir.Karışımın kaynamamasına dikkat edilir. Karışım bir gece bekletilir ve bir tromp yardımı ile süzülür. Oluşan kımızı renkli kristaller etilalkol ile yıkanır, kurutulur ve tartılır. 4. Manyetik duyarlık tayini 1. Önce komplekslerin Evans Terazisi ile gram manyetik duyarlıkları tayin edilir. χg = Burada C Bal × L × ( R − Ro ) 109 × m χg: gram manyetik duyarlık ( birimi : cgs cinsinden ergG-2g-1) C : cihazın kalibrasyon sabiti L: cam tüpteki numune boyu R: numunenin ölçüm değeri R0 : boş tüpün ölçüm değeri m: numune ağırlığı Bileşik m0 (g) M (g) L (cm) R R0 χg kompleks 2. Molar manyetik duyarlık (χm) tayin edilir. İstenirse gerekli düzeltme parametreleri ilave edilir (χm*). 3. Ortamın sıcaklığı ölçülür. µeff=2.83(χMT)1/2 formülünden etkin manyetik moment hesaplanır. Bileşik M.A. Mn+ µs (calc) χm dn χm* µeff n (denel) Kompleks * Düzeltilmiş molar manyetik duyarlık 4. Eşleşmemiş elektron sayısı tayin edilir. 5. Komplekslerin hibritleri, geometrileri, KAKE hesaplanır. 5. Sorular 1. Bir bileşikte metal-metal bağının oluştuğu hangi yöntemlerle tayin edilebilir? 2. Beklenenden daha düşük manyetik moment hangi nedenlerden kaynaklanabilir? 3. Karedüzlem d7 iyonunun spin manyetik momenti nedir? 4. Diyamanyetik [Ni(CN)4]2- ve paramanyetik [NiCl4]2- anyonlarının hibritleşmesi ve geometrisi nedir? 5. Ni(CO)4 kompleksinin hibriti, geometrisi ve KAKE nedir? 6. FeCl3•6H2O kompleksinin spin manyetik momentini hesaplayınız. 7. HgCo(SCN)4 kompleksinin 20 °C da χm = 16.44x10-6 cm3/mol (cgs) dir. a) Kompleksin etkin manyetik momentini hesaplayınız. b) Kompleksin eşleşmemiş elektron sayısını tayin ediniz. c) Kompleksin hibritini ve geometrisini belirleyiniz. 6. Kaynaklar 1. D. P. Shoemaker, C. W. Garland and J. W. Nibler, “Experiments in Physical Chemistry”, 5th ed., Exp. 33, pp 418-429, Mcgraw-Hill, New York, 1989. 2. K. C. de Berg, and K. J. Chapman, J. Chem. Ed.,78(5), 670 (2001). 3 Figgis, B.N.; Lewis, J. In Modern Coordination Chemistry: Principles and Methods, Lewis, J.; Wilkins, R.G. (Eds.); Interscience: New York, 1960, p. 400. [QD471.L62] 4. Butler, I.S.; Harrod, J.F. Inorganic Chemistry; Benjamin/Cummings: Redwood City, Ca., 1989, p. 428ff. [QD151.2.B88] 5. Dunn, T.M.; et al, Some Aspects of Crystal Field Theory; Harper & Row: New York, 1965, p. 58ff. [QD475.D8] 4. Figgis, B. N. Introduction to Ligand Fields; Interscience Publishers: New York,1966. [QD471.F57]