T.C.
MERSİN ÜNİVERSİTESİ
SAĞLIK BİLİMLERİ ENSTİTÜSÜ
TIBBİ BİYOLOJİ ANABİLİM DALI
ÜLSERATİF KOLİTTE WNT SİNYAL YOLAĞINDA
ROL OYNAYAN BAZI GENLERİN METİLASYONU
VE GEN EKSPRESYONU
Dr. Zuhal MERT ALTINTAŞ
DOKTORA TEZİ
DANIŞMAN
Prof. Dr. Mehmet Emin ERDAL
MERSİN-2012
T.C.
MERSİN ÜNİVERSİTESİ
SAĞLIK BİLİMLERİ ENSTİTÜSÜ
TIBBİ BİYOLOJİ ANABİLİM DALI
ÜLSERATİF KOLİTTE WNT SİNYAL YOLAĞINDA
ROL OYNAYAN BAZI GENLERİN METİLASYONU
VE GEN EKSPRESYONU
Dr. Zuhal MERT ALTINTAŞ
DOKTORA TEZİ
DANIŞMAN
Prof. Dr. Mehmet Emin ERDAL
Bu tez, Mersin Üniversitesi Bilimsel Araştırma Projeleri Birimi Tarafından BAP-SBE
TBG (ZMA) 2009-3 DR numaralı proje olarak desteklenmiştir.
Tez No: 25
MERSİN-2012
Mersin Universitesi Saghk Bilimleri Enstitusii
Tibbi Biyoloji ve Genetik Anabilim Dali Doktora Programi Cer?evesinde yurutulmus
olan Ulseratif Kolitte Wnt Sinyal Yolagmda Rol Oynayan Bazi Genlerin Metilasyonu
ve Gen Ekspresyonu basjikh 9ahsma, jurimiz tarafmdan Doktora tezi olarak kabul
edilmi§tir.
Tez Savunma Tarihil 1/06/2012
Prof. Dr. MehmetVEmin ERDAL
Mersin Universitesi Tip Fakultesi
Jiiri Ba§kani
Prof. Dr. Orhan SEZGlN
Prof. Dr. Davut ALPTEKIN
Mersirj Universitesf Tip Fakultesi
Jiiri Uye
Cukurova Universitesi Tip Fakultesi
Jiiri Uyesi
er BARLAS
fversitesi Tip Fakultesi
Jtiri Uyesi
Bu tez, Enstitii Yonetim Kurulunun
Yrd. Do?. DijOzlem IZCI AY
Mersin Universitesi Tip Fakultesi
Jiiri Uyesi
tarih ve.2-Q/2,//D.6. sayih karan
ile onaylanmi§tir.
Prof. D
GLU
TEŞEKKÜR
Doktora eğitimim boyunca, akademik açıdan yetişmemde büyük katkısı olan,
Anabilim Dalı Başkanımız, danışman hocam Sn. Prof. Dr. M. Emin ERDAL’a, tezimin
hazırlanması boyunca gösterdiği titizlik, özveri ve bilimsel katkıdan dolayı teşekkür
ederim.
Anabilim dalımızın değerli hocaları; Sn. Doç. Dr. Nurcan ARAS ATEŞ’e, Sn.
Doç. Dr. Etem AKBAŞ’a, Doç. Dr. İ. Ömer BARLAS’a, Yrd. Doç. Dr. Özlem İZCİ
AY’a ve Yrd. Doç. Dr. M. Ertan AY’a doktora eğitimim boyunca yaptıkları bilimsel ve
akademik katkıdan dolayı teşekkür ederim.
Tezimde yer alan hasta gruplarının toplanması sırasındaki yardımlarından
dolayı, ME.Ü. Tıp Fakültesi İç Hastalıkları Anabilim Dalı Gastroenteroloji Bilim Dalı
Öğretim Üyeleri Sn. Prof. Dr. Orhan SEZGİN’e, Sn. Doç. Dr. Engin ALTINTAŞ’a,
Doç. Dr. Fehmi ATEŞ’e, gastroenteroloji asistanlarına ve endoskopi hemşirelerine,
tezimin istatistikleri ve bulguların değerlendirilmesi konusundaki yardımlarından dolayı
Biyoistatistik ve Tıbbi Bilişim Anabilim Dalı araştırma görevlisi Mehmet Ali
SUNGUR’a, eğitimim boyunca, her türlü desteğini esirgemeyen laboratuvarda birlikte
çalıştığım arkadaşlarımın hepsine teşekkür ederim.
Hayatımın her aşamasında yanımda olan, maddi ve manevi destekleriyle,
eğitimimin akademik yönde devam etmesini sağlayan aileme, eşime ve kızlarıma
sonsuz teşekkür ederim.
iii
İÇİNDEKİLER
KABUL VE ONAY
ii
TEŞEKKÜR
iii
İÇİNDEKİLER
iv
ŞEKİLLER DİZİNİ
vi
ÇİZELGELER DİZİNİ
vii
SİMGELER ve KISALTMALAR DİZİNİ
vii
ÖZET
x
ABSTRACT
xi
1. GİRİŞ
1
2. GENEL BİLGİLER
4
2.1. Hastalık Aktivitesinin Değerlendirilmesi
4
2.2. Ülseratif Kolit ve Displazi
5
2.3. Malignite Gelişimi
6
2.3.1. ÜK hastalarında kolorektal kanser gelişme riskini etkileyen faktörler
6
2.3.1.1. Kolonik tutulumun yaygınlığı
6
2.3.1.2. Hastalığın süresi
7
2.3.1.3. Hastalığın şiddeti
7
2.3.1.4. Başlangıç yaşı
8
2.3.1.5. Primer sklerozan kolanjit
8
2.3.1.6. Ailede kolorektal kanser bulunması
8
2.4. Kolitle İlişkili Kanserin Klinik ve Patolojik Özellikleri
9
2.5. Patogenez
11
2.6. Wnt/β-katenin sinyal yolağı
16
2.7. Kanserde Wnt/β-katenin sinyali
17
3. GEREÇ ve YÖNTEM
21
3.1. Hasta ve Kontrol Gruplarının Toplanması
21
3.2. RNA İzolasyonu ve RT-PCR
22
3.2.1. Kullanılan Solusyonlar
22
iv
3.2.2. Yöntem
22
3.2.3. Real-Time PCR-Comparative CT (ΔΔCt) Metodu ile Ekspresyon Analizleri
23
3.2.4. Kullanılan Primer ve Problar
23
3.2.5. Real-Time PCR Reaksiyon Ortamının Hazırlanışı
24
3.2.6. Real-Time PCR Reaksiyon Şartları
25
3.2.7. Ekspresyon Tayini
25
3.3. DNA İzolasyonu
26
3.3.1. DNA Modifikasyonu
27
3.3.2. Metilasyon Spesifik PCR İçin Kullanılan Primerler
28
3.3.3. Metilasyon Spesifik PCR Ortamının Hazırlanışı
29
3.3.4. Metilasyon Spesifik PCR Şartları
28
3.3.5. Metilasyon Spesifik PCR Annealing Dereceleri ve Ürün Boyutları
29
3.4. İstatistiksel Analiz
31
4. BULGULAR
32
4.1. Metilasyon Spesifik PCR Bulgularının Değerlendirilmesi
32
4.1.1. SFRP2
33
4.1.2. SFRP4
34
4.1.3. SFRP5
35
4.1.4. APC1
37
4.1.5. APC2
38
4.2. Metilasyon ve İnflamasyon Bulgularının Değerlendirilmesi
39
4.3. Real Time-PCR (Comparative CT) Analiziyle İlgili Bulgular
45
5. TARTIŞMA
52
6. SONUÇLAR ve ÖNERİLER
59
7. KAYNAKLAR
60
8. ÖZGEÇMİŞ
72
v
ŞEKİLLER DİZİNİ
Şekil 2.1. Kolit ilişkili kolorektal kanserin moleküler patogenezi
12
Şekil 2.2. Sporadik kolorektal kanserin moleküler patogenezi
13
Şekil 2.3. Kanser ve kanser olmayan hücrede Wnt yolağının şematik gösterimi
17
Şekil 2.4. Kanserde Wnt sinyalizasyonunun ilişkisi
19
Şekil 4.1. SFRP2 geninin metile primer ile PCR görüntüsü
33
Şekil 4.2. SFRP2 geninin unmetile primer ile PCR görüntüsü
34
Şekil 4.3. SFRP4 geninin metile primer ile PCR görüntüsü
35
Şekil 4.4. SFRP4 geninin unmetile primer ile PCR görüntüsü
35
Şekil 4.5. SFRP5 geninin metile primer ile PCR görüntüsü.
36
Şekil 4.6. SFRP5 geninin unmetile primer ile PCR görüntüsü
36
Şekil 4.7. APC1 geninin metile primer ile PCR görüntüsü
37
Şekil 4.8. APC1 geninin unmetile primer ile PCR görüntüsü
37
Şekil 4.9. APC2 geninin metile primer ile PCR görüntüsü
38
Şekil 4.10. APC2 geninin unmetile primer ile PCR görüntüsü
39
Şekil 4.11. SFRP2 geninin distal kolon örneklerinin metilasyon ve inflamasyon
durumları.
41
Şekil 4.12.SFRP4 geninin distal kolon örneklerinin metilasyon ve inflamasyon
durumları.
42
Şekil 4.13. SFRP5 geninin distal kolon örneklerinin metilasyon ve inflamasyon
durumları
43
Şekil 4.14. APC1 geninin distal kolon örneklerinin metilasyon ve inflamasyon
durumları.
44
Şekil 4.15. APC2 geninin distal kolon örneklerinin metilasyon ve inflamasyon
durumları.
45
Şekil 4.16. ACTB genine ait real time PCR amplifikasyon eğrisi
46
Şekil 4.17. SFRP2 genine ait real time PCR amplifikasyon eğrisi
46
Şekil 4.18. SFRP4 genine ait real time PCR amplifikasyon eğrisi
47
Şekil 4.19. SFRP5 genine ait real time PCR amplifikasyon eğrisi
47
Şekil 4.20. APC1 genine ait real time PCR amplifikasyon eğrisi
48
Şekil 4.21. APC2 genine ait real time PCR amplifikasyon eğrisi
48
vi
ÇİZELGELER DİZİNİ
Çizelge 3.1. Real-Time PCR için kullanılan primer ve problar
24
Çizelge 3.2. Metilasyon Spesifik PCR için kullanılan primerler
28
Çizelge 3.3. Metilasyon Spesifik PCR annealing dereceleri ve ürün boyutları
30
Çizelge 4.1. Hastaların klinik ve inflamatuvar özellikleri
40
Çizelge 4.2. Ülseratif kolit hastaları ile kontrol gruplarının proksimal ve distal
kolonlarından alınan örneklerin ekspresyon oranı
50
Çizelge 4.3. Hastaların distal kolon örneklerinde inflamasyon ile genlerinin ekspresyon
oranı
51
vii
SİMGELER ve KISALTMALAR DİZİNİ
ACTB
Beta Aktin geni
AGPC
Asit Guanidinyum-Fenol-Kloroform Yöntemi
AOM
Azoksimetan
APC
Adenomatöz polipozis koli
Bç
Baz çifti
C
Sitozin
CCND1
Siklin D1
CDH1
Kaderin 1 geni
cDNA
Komplementer Deoksiribonükleik Asit
CH
Crohn hastalığı
CIN
Servikal intraepitelyal neoplazi
CKI
Kazein Kinaz
COX
Siklooksijenaz
CpG
Sitozin-Guanin dinükleotidi
DCC-DCP4
Kolon ve pankreas kanserinde delesyon olan genler
DEPC-H2O
Dietilpirokarbonatlı su
DKK
Dickkopf protein ailesi
DNA
Deoksiribonükleik asit
dNTP
Deoksiribonükleotid trifosfat
DSS
Dekstran sodyum sülfat
DVL
Disheveled
E-CD
Epitelyal kaderin
G
Guanin
GSCN
Guanidinyum İsotiyosiyonat
GSK
Glikojen sentez kinaz
HMG-box
High Mobility Group box
hMHL1
İnsan mutL homolog 1
HSK
Hepatosellüler kanser
İBH
İnflamatuvar barsak hastalığı
KRK
Kolorektal kanser
viii
Kras
Kirsten ras onkogen
KCl
Potasyum klorür
LDH
Laktat dehidrogenaz
LEF1
Lenfoid arttırıcı bağlayan faktör 1
LOH
Heterozigozite kaybı
LRP
Düşük dansiteli lipoprotein reseptör ilişkili protein
l
Mikrolitre
Min
Multiple intestinal neoplazm
MSH2
İnsan mutator gen homoloğu
MSI
Mikrosatellit instabilite
MSP
Metilasyon Spesifik PCR
MYC
Traskripsiyon için kodlanan regülatör gen
PCR
Polimeraz zincir tepkimesi
PSK
Primer sklerozan kolanjit
p14ARF
Alternatif okuma çerçevesi
p16INK4A
Prototipik INK4 protein
p53
Tümör protein 53
Real Time PCR
Gerçek Zamanlı Polimeraz Zincir Reaksiyonu
RNA
Ribonükleik asit
ROR2
Reseptör-related 2
Rpm
Dakikadaki devir sayısı
RT-PCR
Reverse transkriptaz polimeraz zincir tepkimesi
SFRP
Çözünür Frizzled ilişkili proteinler
TCF
T-hücre faktör
ÜK
Ülseratif kolit
WİF
WNT inhibitör faktörü
ix
ÖZET
Ülseratif Kolitte Wnt Sinyal Yolağında Rol Oynayan Bazı Genlerin
Metilasyonu ve Gen Ekspresyonu
Ülseratif kolit; gastrointestinal yolağın kronik inflamatuvar hastalığı olup,
kolorektal kanser için artmış riske sahiptir. Ülseratif kolitle ilişkili neoplazide
Wnt sinyal yolağının rolü son yayınlarda bildirilmiştir. Bu çalışmada ülseratif
kolitle ilişkili neoplazide Wnt sinyal yolağı genlerinin metilasyon ve ekspresyon
durumlarının incelemesi amaçlandı.
Hasta grubu distal tip ülseratif kolit tanısı almış ve sürveyans kolonoskopisi
yapılan 20 bireyden; kontrol grubu kolon kanseri taraması yapılan herhangi bir
yakınması ve endoskopik patolojisi olmayan 15 bireyden oluşturuldu. Hasta ve
kontrollerin kolonik biyopsilerinden DNA ve RNA elde edildi. SFRP2, SFRP4,
SFRP5, APC1, APC2 ve ACTB gen ekspresyonları Real-Time PCR ve
“Comparative CT (ΔΔCt)” analizi ile belirlendi. Metilasyon spesifik PCR ile bu
genlerin metilasyon durumlarına bakıldı.
APC2 geninin metilasyonu için hasta grubunda 8 kişi metile (%40) ve 12
kişi unmetile (%60) iken kontrollerin 1’i metile (%6,7), 14’ü unmetile (%93,3) idi
(p=0,018). Hasta grubunda SFRP5 geni için metilasyon durumu ve ekpresyonları
arasında anlamlı bir ilişki bulundu (p=0,015). Hasta ve kontroller arasında diğer
genler için metilasyon, ekspresyon ve inflamasyon durumu arasında istatistiksel
olarak anlamlı ilişki bulunmadı.
Ülseratif kolitte APC2’nin metilasyonunun arttığı, SFRP5 metilasyon
artışının ekspresyonu azalttığı bulgusunun inflamasyonla ilişkisi olduğu ileri
sürülebilir. Ülseratif kolit ilişkili neoplazi ile ilişkisini söyleyebilmek için daha fazla
çalışmaya ihtiyaç vardır.
Anahtar Kelimeler: Ekspresyon, metilasyon, neoplazi, ülseratif kolit, Wnt Yolağı.
x
ABSTRACT
Methylation and Expression of the Genes that Have a Role in the
Wnt Signaling Pathway in Ulcerative Colitis
Ulcerative colitis, being chronically inflammatory disease of gastrointestinal
pathway, has increased risk of colorectal cancer. The role of WNT signaling
pathway in neoplasia related with ulcerative colitis has been indicated in recent
publications. In this study, it is aimed to investigate the methylation and expression
status of WNT signaling pathway genes in neoplasia related with ulcerative colitis.
Patient group composed of 20 people diagnosed with distal type ulcerative
colitis and having surveillance colonoscopy, control group composed of 15 people
having colon cancer screening, not having any complaints or endoscopic pathology.
DNA and RNA are obtained from the biopsies of the patient and control groups.
SFRP2, SFRP4, SFRP5, APC1, APC2 and ACTB gene expressions are determined
by Real-Time PCR and “Comparative CT (ΔΔCt)” analysis. The methylation status
of the genes are studied by using methylation specific PCR.
For APC2 gene methylation; in patient group 8 people are methylated
(%40) and 12 are unmethylated (%60) whereas in the control group 1 is
methylated (%6.7), 14 are unmethylated (93.3%) (p=0.018). In patient group, for
SFRP5 gene, a significant relationship is observed between the methylation status
and expressions (p=0.015). Regarding the other genes, no significant statistical
relationship is observed among the methylation, expression and inflamation status
between the patient and control groups.
In ulcerative colitis, it is suggested that the findings of the increase in the
methylation of APC2, and the decrease in the expression due to the incease of
SFRP5 methylation both have a relationship with inflamation. However, further
studies are needed in order to suggest its relationship with ulcerative colitis related
neoplasia.
Keywords: Expression, methylation, neoplasia, ulcerative colitis, WNT pathway.
xi
1. GİRİŞ
Ülseratif kolitli hastalar kolorektal kanser için artmış riske sahiptir ve ülseratif
kolitle ilişkili kolorektal neoplazi bazı hastalarda artmış mortalitenin başlıca nedenidir.
Ülseratif kolitle ilişkili neoplazili hastaların prognozunu iyileştirmek için, erken veya
prekanseröz evrede tanımak önemlidir. Ülseratif kolitte kolorektal neoplaziye yatkınlık
genellikle uzun süren hastalık ve yaygın kolitin varlığı olarak bilinen 2 risk faktörüne
bağlıdır (1-3). Ekbom ve ark. (1) kolorektal kanser riski için standardize edilmiş
insidans oranlarını proktitli hastalar için 1.7, sol taraf koliti için 2.8 ve total kolit için
14.8 olarak bildirmişlerdir. Son bir meta analizde ülseratif kolitli hastalarda kolorektal
kanserin sıklığı 10 yılda %2, 20 yılda %8 ve 30 yılda %18 bulunmuştur (3). Bu nedenle
çoklu rastgele biyopsilerle sürveyans kolonoskopi uzun süreli ve yaygın ülseratif kolitli
hastalar için önerilmektedir (4-6). Ancak ülseratif kolitle ilişkili neoplaziyi endoskopik
olarak saptamak ve histolojik olarak inflamatuvar rejeneratif epitelden ayırt etmek
genellikle güç olduğu için ülseratif kolitle ilişkili neoplazinin erken saptanması için
geleneksel sürveyans kolonoskopisinin etkili olup olmadığı halen tartışmalı bir konudur.
Sürveyans kolonoskopisinin ülseratif kolitle ilişkili neoplazilerin tanısı için yetersiz
olması, uzun süreli ve yaygın ülseratif kolitli hastalar arasında neoplazinin artmış
riskine
sahip
kişilerin
saptanmasına
yardım
edecek
moleküler
belirteçlerin
araştırılmasına yol açmıştır.
Kanser ilişkili genlerin DNA metilasyon bağımlı sessizleşmesi kolorektal
kanserde önemli ve erken bir olaydır. Promotor ilişkili CpG adasının metilasyonu
MeCP2, MBD2 ve MBD3 gibi metil bağlama domainlerine sahip çeşitli proteinlerin
bağlanmasına yol açar; daha sonra bu proteinler transkripsiyonel sessizleşmeye yol açan
olaylar zincirini başlatır (7). Transkripsiyonel sessizleşme histon deasetilazın birikimi
yanı sıra histon H3 lizin 9 metilasyonu ve histon H3 lizin 27 metilasyonu gibi histon
kuyruklarındaki
değişiklikleri
de
kapsar
(8,9).
Bu
modifikasyonların
tümü
transkripsiyonel sessizleşmeyi hızlandıran transkripsiyon faktörlerinin girişini kısıtlayan
sıkı kompakt kromatine dönüştüren lokal kromatin yapılarındaki değişiklerle sonuçlanır.
p16, E-kaderin, hMLH1, p14, HPP1, ER vb gibi genlerin aberan yaş ilişkili kanser
spesifik metilasyonu inflamatuvar barsak hastalığı (İBH) ilişkili neoplazi (displazi ve
1
kanserler) durumunda bildirilmiştir (10-14). İBH gibi kronik inflamatuvar durumların
tümör süpresör genlerin aberan metilasyonunu ve inaktivasyonunu arttırarak kanserin
gelişimini etkileyebileceğine inanılmaktadır.
Wnt sinyal yolağı sporadik kolorektal kanser (KRK) gelişiminde önemlidir (1516). Wnt sinyal yolağındaki aktive edici mutasyonlar sporadik KRK’ların %80’ninden
fazlasında görülür (17-18). Bir sekrete edilen faktör olan Wnt ligandı sinyaller zincirini
başlatacak olan Frizzled (Fz) reseptörüne ve LRP5/6 koreseptörüne bağlandığı zaman
Wnt sinyal yolağındaki sinyal başlar (19). Daha sonra Disheveled (Dsh veya dvl)
ailesinin proteinleri Fz resptörleri ile etkileşir (20). Takiben bu etkileşimler adenomatöz
polipozis koli (APC), AKSİN ve gikojen sentaz kinaz 3β’nin (GSK-3β) kompleks
oluşturmasının inhibisyonuna yol açar. Normalde APC/AKSİN/GSK-3β kompleksi β–
kateninin fosforilasyonunda ve degradasyonunda rol oynar. APC/AKSİN/GSK-3β
kompleksi inhibisyonunun bir sonucu olarak, β katenin MYC, siklooksijenaz 2 (COX-2)
ve siklin D1’i içeren birçok kanser ilişkili genlerin transkripsiyonunu nükleusta
upregüle eder, fosforillenmemiş β-katenin sitoplazmada birikir ve sonunda nükleusa
transloke olur (21-24). Wnt sinyal yolağı gibi kuvvetli gelişimi ayarlayan yolaklar
şiddetli negatif regülasyonla kontrol edilir, eğer bu regülasyon bozulursa onların aberran
aktivasyonuna ve tümorogenezise yol açabilir. Wnt sinyal yolağı soluble Fz ilişkili
proteinler (SFRPs) ve ekstrasellüler olarak Wnt ligandlarına bağlanan Wnt inhibitör
faktörü (WIF1) ve düşük dansiteli lipoprotein reseptör ilişkili protein (LRP) yüzey
molekülüne bağlanan dickkopf (DKK) ailesinin proteinleri tarafından inhibe edilir (2526). Bu nedenle promotor metilasyonu gibi mekanizmalarla SFRPs, WIF1 ve
DKK’lerin inaktivasyonu kanser hücrelerinde Wnt sinyalinin aktivasyonuna yol
açabilir. Benzer şekilde mutasyon veya promotor metilasyonu veya her ikisiyle
APC’nin inaktivasyonu β kateninin degradasyonunun engellenmesine yol açabilir.
Normalde APC daha önce açıklandığı gibi diğer proteinlerle kompleks yaparak βkateninin degradasyonunda rol oynar. Sporadik KRK’larda APC’yi içeren Wnt sinyal
yolağı genlerinin mutasyonları bildirilmiş olmasına rağmen bu genlerin mutasyonları
İBH ilişkili neoplazilerde (%0-6) nadirdir (27).
Ülseratif kolitli hastalar kolorektal kanser için artmış riske sahiptirler ve ülseratif
kolitle ilişkili kolorektal neoplazi bazı hastalarda artmış mortalitenin başlıca nedenidir.
2
Ülseratif kolitle ilişkili neoplazili hastaların prognozunu artırmak için erken veya
prekanseröz evrede tanımak önemlidir (1-3). Son yayınlarda İBH ilişkili neoplazilerde
Wnt sinyal yolağının rolü bildirilmiştir, fakat İBH ilişkili neoplazide bu yolağın
epigenetik regülasyonu hakkında çok az şey bilinmektedir (28-30). Artmış nükleer βkatenin ve azalmış stoplazmik APC1A ekspresyonu ülseratif kolit ilişkili kanserlerde
bildirilmiştir (31,32).
Wnt sinyal yolağı genlerinin mutasyonu İBH ilişkili neoplazilerde nadir bir olay
olduğundan Wnt yolağındaki genlerin metilasyonunun bu lezyonlardaki Wnt sinyalinin
disregülasyonundan sorumlu olabileceği ileri sürülmektedir. Wnt antogonist genleri
tümör supresör olarak işlev gördüğü ve bazı insan malignitelerinin patogenezine katkıda
bulunduğu bildirilmiştir. Uzun süreli ÜK’li hastalardan inflame mukozalarında Fz’in
artmış ekspresyonu bu reseptörlerin aracılığıyla sinyalin İBH’lı hastalarda malign
transformasyonunda ve premalign değişikliklerinde yer alabildiği ileri sürülmektedir.
Bu çalışmada Wnt yolağı genlerinin promotor metilasyonunun ve ekspresyonlarının
İBH ilişkili karsinogenezisin seyri sırasında ortaya çıkıp çıkmadığını ve ayrıca İBH
ilişkili neoplazininin seyri sırasında metilasyon olaylarının ve ekspresyonlarının
progresyonu karakterize edip etmeyeceği araştırıldı. Bu İBH ilişkili neoplazilerin erken
saptanması için biyomarkırlar olarak araştırmalar için potansiyel adaylar bulmaya
yardım edebilir. Bu çalışmada Wnt sinyal yolağı genlerinin metilasyonunun ve
ekspresyon durumlarının uzun süredir var olan ülseratif kolitte görülebilen erken olay
olup olmadığı ve İBH ilişkili neoplazinin gelişimi sırasında Wnt sinyal yolağı genlerinin
metilasyonunda bir artış olup olmadığı ve ekspresyon durumlarını gösterilmesi
amaçlanmıştır.
3
2. GENEL BİLGİLER
Ülseratif kolit (ÜK) ve Crohn hastalığı (CH); gastrointestinal yolağın kronik
inflamatuvar hastalıkları olup, klinik, endoskopik ve histolojik bulguları ile
tanımlanırlar. ÜK; etiyolojisi bilinmeyen kronik inflamatuar bağırsak hastalığı grubunda
yer alır. Her iki cinsiyeti eşit oranda etkileyebilir (33). Sıklıkla 20-30 veya 70-80 yaş
aralığında görülmekle beraber herhangi bir yaşta da ortaya çıkabilir (34,35). Beyaz ırk
ve Yahudilerde sık olarak görülen hastalık A.B.D, Güney Avrupa ve Avustralya’da
fazla görülmektedir. İnsidans 3-15/100.000, prevalans 80-120/1.000.000 olarak
bildirilmektedir. ÜK ilk olarak 1859 yılında Samuel Wilks tarafından tanımlanmıştır.
Genellikle rektosigmoid bölgeden başlayarak proksimale doğru ilerler (36). ÜK;
kolonda hastalığın tutulum yerine göre sınıflandırılır. Rektum ve sigmoid kolona sınırlı
kalırsa ülseratif proktokolit (%40-50), sadece sol kolon tutulumu mevcutsa sol kolit
(%30-40), tüm kolon tutulmuşsa pankolit (%20) olarak isimlendirilir (34,37). Hastalık
remisyon ve relapslarla karakterize olup rektal kanama, diare ve abdominal ağrı klinik
olarak en sık görülen şikâyetlerdir (34). Tanısı ağırlıklı olarak klinik, endoskopik,
histopatolojik inceleme ve rezeksiyon materyallerinden konur (38).
ÜK’ de görülen mukozal değişiklikler sigmoid kolon ve rektum da belirgin
olmakla beraber kolonun diğer lokalizasyonlarına da yayılabilir. İleum, vakaların üçte
birinde tutulabilir (34). Bu tutulum yüzeyeldir, çok az klinik önemi vardır ve her zaman
kolonik hastalıkla devamlılık gösterir. Sadece rektum ile sınırlı vakalar ise %5-10
oranında görülebilir
(37).
Apendiks
vakaların %20-60’ında,
genelde çekum
tutulumunun ilerlemiş şekli veya sıçrama lezyon şeklinde görülebilir. Anal lezyonlar
%10 vakada saptanır, orta hat fissürleri, deri soyulmaları, akut perianal ve iskiorektal
abseler veya rektovajinal fistüllerden oluşabilir (34).
2.1. Hastalık Aktivitesinin Değerlendirilmesi
Ülseratif kolitli hastalar, hastalığın lokalizasyonun ve klinik seyrinin yanı sıra;
ülseratif kolitin şiddetine göre de sınıflandırılırlar (39). İlk atak esnasında hastaların
%50’si hafif hastalığa, %6-19’u da şiddetli hastalığa sahiptirler (40,41). Hastalık
4
aktivitesinin değerlendirilmesi prognozun tahmin edilmesi ve tedavi planlaması için yol
göstericidir. Ülseratif kolitte hastalık aktivitesinin değerlendirilmesi için çeşitli
yöntemler geliştirilmiştir. Fakat hiçbirisi üniversal bir standart olarak kabul
görmemiştir. Bu amaçla en sık kullanılanlardan birisi Truelove-Witts’in sınıflamasıdır
(42,43). Truelove-Witts kriterlerine göre hastalığın klinik şiddeti; klinik ve laboratuar
bulgularına göre hafif, orta ve ağır olarak sınıflandırılır. (42,43). Burada; dışkılama
sıklığı, rektal kanama, ateş, taşikardi, anemi ve sedimantasyon hızına göre sınıflandırma
yapılır. Truelove-Witts sınıflaması klinik pratikte kullanım için güvenilir ve basit bir
sınıflamadır. Yaygın kolitli hastalarda kullanım için çok uygun olmasına karşın sınırlı
hastalığı olan hastalarda hastalık şiddetinin değerlendirilmesi için yeterli değildir.
Truelove-Witts sınıflaması hastalık şiddetinin değerlendirilmesi için endoskopik
bulguları dikkate almaz (43). Ayrıca kolitin ciddiyet derecesini endoskopik görünüme
dayandıran değerlendirme yöntemleri varsa da tedavi edici karar endoskopik görünüm
değil öncelikle klinik duruma dayandırılmalıdır (36).
Sınırlı hastalığı olanlarda ve klinik araştırmalarda, daha yararlı olan bir sayısal
aktivite değerlendirme yöntemi “Ülseratif kolit hastalık aktivite indeksi” dir (43). Bu
indeks 4 komponentten elde edilen skorların toplanması ile hesaplanır. Bu
komponentler: dışkılama sayısı, rektal kanama, sigmoideskopik bulgular ve hekimin
genel değerlendirmesinden oluşur. Bu hastalık aktivite indeksinde elde edilen skor 0-12
arasında değişir. Genel olarak 0-2 puan alanlar remisyonda kabul edilir. Eğer skor
10’dan fazla ise hastalığın şiddetli olduğunu gösterir. Daha yüksek skorlar daha şiddetli
hastalığı gösterir. Başlangıç skoruna göre 3 puan ve ya daha fazla azalma tedaviye
klinik cevap olarak kabul edilir (43).
2.2. Ülseratif Kolit ve Displazi
Displazi, intestinal epitelin neoplastik değişimi olarak tanımlanır. Makroskopik
olarak düz, plak, nodül ya da adenoma benzer polipoid yapılanmaları içeren mukozada
saptanır. Histolojik olarak displazi tanısı; hücresel ve nükleer pleomorfizm, nükleer
hiperkromazi, nükleer polarite kaybı, belirgin nükleer tabakalanma artışı ile
konulmaktadır (37). Normalde akut kolitin tamir sürecinde displazi ile reperatif atipiyi
(tamirsel değişiklikleri) karıştırmak mümkündür. Özellikle ÜK’li hastalarda devam
eden inflamasyon ve reperatif etkiler nedeniyle displazi tanısı koymak zordur. Reperatif
5
etkilerde görülen kriptlerde dallanma, neoplastik proliferasyonla çok rahat bir şekilde
karışabilir. Kural olarak akut inflamasyonlu alanlarda displazi tanısı verilmemelidir
(34). ÜK hastalarında displaziyi bulma ve evreleme sonuçları tecrübeli patologlar
arasında bile değişiklikler göstermektedir (44). Displazinin varlığı arasındaki uzlaşma
%68-84 arasında değişmektedir. Atipi varlığı %90’dan fazla oranda, yüksek dereceli
displazinin varlığı ise %33-100 arasında değişiklik göstermektedir (45). Kronik kolitler
de displazi Rindell’in modifiye edilmiş klasifikasyonuna göre;
Displazi olmayan grup: Normal mukoza, inaktif kolit, aktif kolit
Displazi belirsiz grup: Muhtemel negatif, bilinmeyen, muhtemel pozitif
Displazi mevcut grup: Düşük dereceli ve yüksek dereceli olarak ayrılmaktadır (37).
2.3. Malignite Gelişimi
Kronik ülseratif kolitli hastalarda artmış kolon kanseri gelişme riski vardır.
Malignite riski ülseratif kolitin en korkulan yönüdür (36,46). Sporadik kolon kanserine
zıt olarak ülseratif kolitli hastalarda kanserin adenomatöz polipten menşe alması
gerekmez. Fakat kolonoskopide yanındaki displastik olmayan mukozadan ayırt
edilemeyen düz displastik epitelyumdan menşe alabilir. Ülseratif kolitli olmayan
hastalar gibi ülseratif kolitli hastalarda displastik değişiklikler gösteren polipler
gelişebilir (36).
2.3.1. ÜK hastalarında kolorektal kanser gelişme riskini etkileyen faktörler:
2.3.1.1. Kolonik tutulumun yaygınlığı: Ülseratif proktitli hastalarda risk; uygun yaş
grubu kontrollere benzerken, hastalığı splenik fleksura proksimaline yayılan hastalar
daha yüksek risk taşır. Sol taraf kolitli hastaların orta bir risk taşıdığı var sayılır (36).
Pankolonik ülseratif kolit hastalarında kolorektal kanser riski: Dünyadaki değişik
merkezlerden elde edilen, 20. yıldan fazla süren ülseratif kolitli hastaların kümülatif
kanser insidans oranları %3,1 ile %16 arasında değişmektedir. 30. yılda ise kümülatif
kanser riski %30’dur (47-51). Bu farklılık kolektomi oranlarındaki farklılıktan
kaynaklandığı düşünülmektedir. Kanada, Winnipeg’de yapılan toplumsal temelli
çalışmada İBH’lı hastalar aynı yaşta, cinsiyette, aynı yılda ve aynı yerde yaşayan
insanlardan oluşan bir toplum grubu ile karşılaştırılmıştır. Bu çalışmadaki ülseratif
kolitli hasta sayısı 2672 idi. Bu çalışmada ülseratif kolitli hastalarda, kolorektal kanser
6
insidansı için relatif risk 2.75 olarak bulunmuştur (52). Ülseratif kolitli hastalarda,
kolorektal kanser insidansı için relatif risk, İsveç’te yapılan bir toplumsal çalışmada 5,7:
(53, 43), Danimarka çalışmasında ise 1.8 olarak bulunmuştur (1,3,54). Ülseratif kolitte
kolon kanseri riskinin araştırıldığı bütün çalışmaların incelendiği bir meta-analizde
kümülatif kolorektal kanser insidansı 10. yılda %2, 20. yılda %8, 30. yılda ise %18
olarak saptanmıştır (3).
Sol tarafı tutan ülseratif kolit hastalarında kolorektal kanser riski: Eldeki verilere göre
proktit ve proktokoliti olan ülseratif kolitli hastalarda kolorektal kanser insidansında
belirgin bir artış yoktur (2). Yapılan kontrollü çalışmalarda sol kolonu tutan vakalarda
20. yılda kolorektal kanser insidansı %3.8-%5 arasında değişmektedir. Bu veriler
sonucunda sol taraf koliti olan hastalarda kolorektal kanser için ortalama bir risk artışı
olduğu düşünülmektedir. Gilat ve ark. (55) 20. yılda kümülatif kanser insidansını
proktitli hastalarda sıfır, sol kolonu tutan hastalarda ise %3.8 olarak saptamıştır. Bütün
bu çalışmalar sol taraf koliti olanlarda kolon kanseri riskinin pankolit olanların üçte bir
ila dörtte biri kadar olduğunu göstermektedir.
2.3.1.2. Hastalığın süresi: Çalışmalarda riskin büyüklüğü farklı ise de bütün
çalışmalarda uzun devam eden ülseratif kolitli hastalarda, kolon kanseri riski yaş
uyumlu nüfusa göre anlamlı olarak yüksektir (36). Hastalığın süresi 8 yıldan daha kısa
ise kolorektal kanser ile çok nadiren karşılaşılır. Daha sonraki yıllarda kanser gelişme
riski her yıl %0.5 ila %1 arasında artar (46). Tersiyer referans merkezlerinde yapılan
çalışmalarda bildirilen kanser riski 20 yıldan sonra %13, 30 yıldan sonra %34 iken,
nüfusa dayalı çalışmalarda risk 20 ve 30 sene sonra sırasıyla %5.5 ve %13’tür (36).
Eldeki veriler, pankolitli hastalarda 8. yıla kadar, sol taraf koliti olan vakalarda ise 12
yıla kadar kanser için tarama çalışmalarına başlamaya gerek olmadığını göstermektedir
(46).
2.3.1.3. Hastalığın şiddeti: Daha şiddetli inflamasyonun, daha çok genetik mutasyona
ve artmış kanser riskine yol açtığına dair elde güçlü veriler yoktur. Ancak daha şiddetli
hastalarda kolektomi olma ihtimalinin daha yüksek olması nedeniyle şiddetli aktiviteli
hastalarda kolerektal kanser gelişme riski yapay olarak düşecektir (46).
7
2.3.1.4. Başlangıç yaşı: İsveç’te yapılan toplum temelli iki araştırmada erken yaşta
teşhis edilen hastalarda artmış bir kanser riski olduğu gösterilmiştir (1,56). Karlen ve
ark. (56) 1955-1989 yılları arasında 1547 ülseratif kolitli hastada 29 yaşının
altındakilerde relatif riskin %3.0 (CI= %95) olmasına karşın daha yaşlı grupta relatif
risk %2.0-4.2 olduğunu göstermişlerdir. Benzer şekilde Ekbom ve ark. (1) 14 yaşından
daha genç ülseratif kolitli hastaların en yüksek riske sahip olduğunu göstermişlerdir.
“Multivariate” analizler başlangıç yaşının kolorektal kanser için bağımsız bir risk
faktörü olduğunu göstermektedir. Danimarka çalışmasında başlangıcı 0-19 yaşları
arasında olanlarda kolorektal kanser gelişme için relatif risk 163 iken; başlangıcı 20-39
yaşları arasında olanlarda relatif risk 22; Kanada’daki bir toplumsal temelli çalışmada,
40 yaşından önce tanı konulan vakalarda artmış kolon kanseri insidansı için en yüksek
risk (relatif risk 12.4) saptanmıştır. Ancak tüm çalışmalarda kolorektal kanser riski ile
erken yaşta teşhis arasındaki ilişki gösterilememiştir (46). Bu konuda yeni çalışmalara
ihtiyaç vardır.
2.3.1.5. Primer sklerozan kolanjit: Ülseratif kolitli hastalarda primer sklerozan
kolanjit (PSK) insidansı yaklaşık olarak %5’dir. Çeşitli vaka serileri ÜK ve PSK’li
hastaların, yalnız başına ÜK olan hastalara göre kolorektal kanser için yüksek risk
altında olduklarını göstermektedir. Cleveland Klinik’te 1976-1994 yılları arasındaki
PSK’si olan 132 ÜK hastasında kolorektal kanser gelişme riski %13 iken, PSK’si
olmayan ÜK hastalarda kanser gelişme oranı %3 olarak bulunmuştur. Kanser ve
displazi için relatif risk 3.2 idi (57). İsveç’te ki bir toplum temelli çalışmada PSK’i olan
104 ÜK hastasında kümülatif kanser gelişimi oranları teşhisten sonraki 10. yılda %10,
20. yılda %33, 30. yılda ise %40 olarak bulunmuştur (46).
2.3.1.6. Ailede kolorektal kanser bulunması: Birinci derecede akrabaları arasında
kolorektal kanser bulunanlarda kolorektal kanser gelişme insidansı yaklaşık olarak iki
kat daha yüksektir (58, 59). İsveç’te yapılan toplum temelli bir çalışmada 1941 ile 1995
yılları arasında takip edilen 19.876 kişide birinci derecede akrabalarında kolorektal
kanser bulunan ÜK hastalarında, birinci derecede akrabalarında kolorektal kanser
olmayan ÜK hastalarına göre relatif risk 2.5 olarak bulunmuştur. Bu grup içinde birinci
8
derecede akrabalarında kolorektal kanser gelişimi 50 yaşından önce olanlarda relatif
risk 9,2 olarak bulunmuştur (46).
ÜK veya Crohn kolitli İBH hastaları KRK gelişimi için artmış riske sahiptir. Bu
riskteki artış genetik bir yatkınlıktan daha çok gastrointestinal mukozanın kronik
inflamasyonu sonucudur. Çoğu KRK’lar genelde displastik öncü bir lezyondan gelişir.
Sporadik KRK’larda displastik öncü genellikle endoskopik polipektomi ile tipik olarak
uzaklaştırılan neoplazinin ayrı bir odağı olan adenomatöz polip (adenoma)’dır. Aksine
polipoid, düz, lokalize veya multifokal displastik lezyon gelişen İBH’lı hastalar kolon
inflamasyonunun işaretidir ve neoplazi için artmış bir risktir ve sıklıkla tüm kolon ve
rektumun cerrahi çıkarımı için gerekli endikasyondur. Lezyonların biyolojik davranışı
ve morfolojisindeki bu farklılıklar sadece İBH’lı hastalar arasında KRK taraması için
dürtü oluşturmaz aynı zamanda kronik inflamasyonun KRK’nın gelişimine nasıl katkıda
bulunduğunun sorusuna yol açar. Sporadik kolorektal tümörlerin gelişimi sırasında
ortaya çıkan adenomadan karsinomaya ilerleme İBH ile ilişkili KRK’da inflamasyondisplazi-karsinom sırasını gösterebilir (60).
2.4. Kolitle İlişkili Kanserin Klinik ve Patolojik Özellikleri
Kronik inflamasyonun İBH’lı hastalarda KRK için bir anahtar risk faktörü
olduğunu gösteren birkaç kanıt dizisi bildirilmiştir (61, 62). Gelişen KRK için risk,
kolitin daha uzun süresi ile artar. KRK’ya 7 yıldan daha az koliti olan kişilerde nadir
rastlanırken; daha sonra risk her yıl için yaklaşık olarak %0,5-1 olarak artar. Kolitin
yaygınlığı diğer bir risk faktörüdür, kolitle tutulu daha fazla kolonik yüzey kolon
kanseri için daha büyük bir risktir. Ancak rektuma sınırlı inflamasyonu olan hastalar
kanser riskinde anlamlı artışa sahip değildirler. KRK riski safra kanalı kanserine de
yatkınlığı olan safra kanalının kronik inflamasyonu ile karakterize bir idiopatik durum
olan primer sklerozan kolanjiti de olan İBH’lı küçük hasta grubunda da oldukça
yüksektir (60). Bazı çalışmalar antiinflamatuvar ilaçlar özellikle mesalamin ve
muhtemelen kortikosteroidler İBH’lı hastalar arasında kolorektal displazi ve kanser
gelişme olasılığını azaltığını bildirmiştir. Nonsteroid antiinflamatuvar ilaç alan sağlıklı
kişiler ve familyal adenomatöz polipozisli hastalar için adenom boyut ve sayısının
azaldığına ait benzer bulgular bildirilmiştir (60).
9
KRK patogenezinde kronik inflamasyonu gösteren kanıtlara rağmen birkaç
çalışmada İBH’lı hastalarda KRK riski ile inflamasyonun düzeyi arasında bir
korelasyon olup olmadığını doğrudan araştırılmıştır. Semptomatik alevlenmenin
sıklığına göre ölçülmüş hastalık aktivitesi KRK’nın sıklığı ile korele olmadığı
gösterilmiştir (63, 64). Ancak endoskopik ve/veya histolojik ölçülere dayanan aktif
inflamasyon derecesini ölçmenin daha doğru olduğu bildirilmiştir. Bir İBH merkezinde
yapılan bir retrospektif vaka kontrol çalışması KRK sıklığı ile histolojik analizle
tanımlanan aktif inflamasyonun daha yüksek derecesi ile ilişkilendirilmiştir (65). Bu
çalışmada kanser veya displazili hastalar aynı cinsiyet ve hastalığın benzer süresi ve
yaygınlığı olan 2 displazisiz kişi (kontrol) ile karşılaştırılmıştır. Histolojik analize dayalı
inflamasyonun şiddeti kolorektal neoplazi sıklığı için bir önemli değişken iken, bir
multivariable modelde ise diğer değişkenler kontrol edildikten sonra; 5 puanla
derecelendirilen inflamasyonun her bir ünitesi displazi ve kanser için riski 4,7 kat arttığı
bulunmuştur. Ancak univaryant analizde anlamlı olan endoskopi ile ölçülen
inflamasyon multivaryable modelde kanser riskinin anlamlı bir belirleyicisi olmadığı
bildirilmiştir. Önemli olarak kanserli olgularla sınırlandırılan analiz (bu yüzden
displazili olgular analizden çıkartılmıştır) histolojik inflamasyon ile kanser arasındaki
ilişkiyi teyit etmiştir. Bu vaka kontrol çalışması histolojik inflamasyon için yeni bir
skorlama bildirmesi ve diğerleri zaman ile inflamasyon durumunu (ortalama skor
kullanmışlardı) hesaba katmamalarına rağmen histoloji ile inflamasyonun derecesi KRK
için bir risk faktörü olarak kabul edilmiştir. Bu bulgular inflamasyon ölçümü için iyi
kurgulanmış sistem kullanan ve yalnızca surveyans altında olan ve displazisiz olduğu
saptanan hastaları içeren bir retrospektif çalışma ile teyit edilmiştir (66). Bu çalışmada
histolojik inflamasyonu sınıflamak için 4 farklı evreleme sistemi kullanılmıştır. Buna
göre histolojik aktivite indeksi evreleri şunlardır;
i.
İnaktif Kolit: Kriptit veya kript absesi yok.
ii.
Hafif Aktif Kolit: Örneklenmiş kriptlerin veya kesitlerin %50’sinden azında
nötrofil infiltrasyonu veya ülserler veya erozyonlar yok.
iii.
Orta Aktif Kolit: Örneklenmiş kriptlerin veya kesitlerin %50’si ve
fazlasında nötrofil infiltrasyonu veya ülser veya erozyon yok.
iv.
Ciddi Aktif Kolit: Diğer özelliklere bakılmaksızın ülser veya erozyonların
olmasıdır.
10
İnflamasyon skorunda her bir birim artışı zaman içinde yüksek derece displazi veya
KRK için riskte 3.8 kat artışa neden olduğunu gösterilmiştir (66).
KRK aşikar kolitli bölgelerin proksimalindeki mikroskobik kolitli bölgelerde
oluşabilmesi kanser riskinin saptanmasında kolonoskopiden daha ziyade histolojik
inflamasyon bulgusunun daha önemli olduğu düşüncesini destekler (67). Çok ciddi
inflamasyonlu hastalar tıbbi tedaviye yanıt vermedikleri için hastalığın erken evresinde
sıklıkla kolektomiye gider. Böyle hastalar artık kolorektal kanser için riskte olmadıkları
için bu ciddi kolitin artmış KRK ile ilişkili olmadığı yanlış izlenimini verebilmektedir.
Erken evre kolektomiden kaçınmak için aktif inflamasyonun aşağıya yerleştiği hastalar
KRK gelişmesi için risk altındadırlar. Histolojik olarak ölçülen aktif inflamasyon KRK
için bir risk faktörü olduğu kanıtına rağmen, KRK gelişen İBH’lı çoğu hasta sessiz
kronik inflamasyona sahiptir (60).
2.5. Patogenez
Kolit ile ilişkili kanser kronik olarak inflame mukozadan gelişir ve displazi yok–
belirsiz displazi–düşük dereceli displazi–yüksek dereceli displazi–karsinoma silsilesinde
geliştiğine inanılmaktadır. Hastalarda tümör progresyonu bu basamakların bir veya daha
çoğunu atlayabilir (61). Sporadik KRK gibi, İBH’lı hastada kolon karsinogenezi
somatik hücrelerdeki mutasyonları takiben onların klonal genişlemesi gibi olaylar
silsilesi yoluyla gerçekleşir. Ancak, kolonun 1 veya 2 odağında displaziden gelişen
sporadik KRK’dan farklı kolitik mukozadan doğan kanser sıklıkla alan değişikliği
etkisini gösteren multifokal displaziden gelişir. Genomik instabilitenin bir belirteci olan
anöploid hücreleri takip etmek için, tekrarlayan kolonoskopik incelemenin kullanıldığı
kronik ÜK’li hastaların çalışmaları hücre popülasyonlarının kolonun aynı konumunda
kaldığını fakat zaman içinde yayılımın mukozanın daha geniş alanlarını işgal ettiğini
gösterilmiştir (68). Üstelik, anöploidinin spesifik bir bölge içinde, anöploid hücrelerinin
subklonları onların öncüllerinden ortaya çıktığı görülmektedir. Subklonlar, normal
epitelin pahasına genişlediğinden giderek daha fazla miktarda bozulur. İBH’lı
hastalarda çoğu kısım için neoplastik lezyonlar kolonik mukozanın inflame bölgeleri
içinden doğar. Anormal klonlarla kolonik mukozanın geniş yamalarının gözlemlenen
reepitelizasyonu kronik inflamasyondan ülserasyona iyileşme cevabının bir sonucudur.
11
Anöploidi displaziden sıklıkla daha yaygın olduğu için substansiyel genomik
değişiklikler bozulmuş morfoloji olmaksızın kolonik mukozada ortaya çıkar (60).
Kolit ilişkili kolon kanseri
Anöploidi/CIN,
MSİ
Metilasyon
COX-2
p53
mut.
Normal
mukoza
p53
LOH
DCC-DCP4
Erken
adenom
Ara
adenom
APC
k-ras
Geç
adenom
Kanser
Şekil 2.1. Kolit ilişkili kolorektal kanserin moleküler patogenezi. APC: Adenomatöz polipozis koli, CIN:
Servikal intraepitelyal neoplazi, COX: Siklooksijenaz, DCC-DCP4: Kolon ve pankreas kanserinde
delesyon olan genler, DKK: Dickkopf protein ailesi, k-ras: Kirsten ras onkogen, LOH: Heterozigozite
kaybı, MSI: Mikrosatellit instabilite (60).
Sporadik kolorektal karsinom gelişimi ile ilişkili hücresel bozukluklar birçok
kolit ile ilişkili kolon karsinogenez ile de ilişkilidir (69). Anöploidi/kromozomal
instabilite, mikrosatellit instabilite (MSI), DNA metilasyonu, onkogen k-ras’ın
aktivasyonu, COX-2 aktivasyonu, mutasyon ve sonuç olarak p53, APC ve DCC/DPC4
heterozigositesinin kaybını içeren yolaklar arasında benzerlik vardır. Ancak, kanserler
arasında bu olayların sıklığı ve silsilesi farklıdır (69) (Şekil 2.1). Kolitle ilişkili kanserde
kromozom instabilitesi ve MSI’nin sıklığı sırasıyla %85 ve %15’tir ve sporadik
kolorektal karsinomadakine yaklaşık olarak benzerdir (70). Fakat sporadik kolorektal
kanserin progresyonu bu değişikliklerin zamanlamasında ve sıklığında İBH ilişkili
KRK’dan
farklıdır
(Şekil
2.2).
Örneğin
sporadik
kolorektal
karsinomanın
progresyonunda ilk olay olan APC işlevinin kaybı, daha az sıklıktadır ve genellikle kolit
12
ilişkili displazi ve karsinomanın gelişmesinde geç ortaya çıkar (27,31,71). Displazi için
negatif veya belirsiz olan kolitik mukoza hücrelerinde APC’deki mutasyonlar nadirdir,
düşük dereceli displazili veya kanser dokularının %14’den azında APC’de mutasyonlara
sahiptir (31,71,72). Ayrıca APC’nin allelik kaybı kolitle ilişkili neoplazmların
%33’ünden daha azında görülmektedir (72).
Sporadik kolon kanseri
Anöploidi
Metilasyon
MSİ
k-ras
COX-2
APC
Normal
mukoza
Erken
adenom
DCCDCP4
Ara
adenom
p53
Geç
adenom
Kanser
Şekil 2.2. Sporadik kolon kanserinin moleküler patogenezi. APC: Adenomatöz polipozis koli, CIN:
Servikal intraepitelyal neoplazi, COX: Siklooksijenaz, DCC-DCP4: Kolon ve pankreas kanserinde
delesyon olan genler, DKK: Dickkopf protein ailesi, k-ras: Kirsten ras onkogen, LOH: Heterozigozite
kaybı, MSI: Mikrosatellit instabilite (60).
p53 işlevinin kaybı kolitle ilişkili kanserin progresyonunda önemli bir
basamaktır. p53’ün allelik delesyonu kolitle ilişkili tümörlerin yaklaşık %50-%85’inde
gözlemlenmektedir (73,74). p53’te heterozigositenin kaybı malign progresyonuyla
ilişkilidir; displazisiz biyopsi örneklerinin %6’sında, belirsiz displazinin %9’unda,
düşük dereceli displazinin %33’ünde, yüksek dereceli displazinin %63’ünde ve
kanserlilerin %85’inde saptanmıştır (73). p53 mutasyonları kolitik kolon doku
mukozasında bulunmuştur ve nondisplastik veya displazi için belirsiz mukozada sıktır
(73,75). Dikkatli şekilde haritalanmış kolektomi örneklerinde p53 mutasyonu
13
anöploididen önce tümorogeneziste erken ortaya çıktığı saptanmıştır (75). Gerçekte p53
mutasyonları kronik inflamasyonun bu mutasyonlara sahip olabileceğini gösteren
kanser olmayan ÜK hastalarının %50‘den fazlasından inflame mukozasında
bulunmuştur (76).
DNA metilasyonu kolitle ilişkili kanserin gelişimi ve progresyonuna da katkıda
bulunur. Birkaç gendeki CpG adalarının metilasyonu displaziden öncedir ve ÜK’li
hastaların mukozası boyunca saptanabilmektedir (13). Kolitli hastalardan neoplastik
örnekler arasında hMLH1 hipermetilasyonun MSI’nin yüksek düzeyleri ile (%46)
6/13’ünde, MSI’nın düşük düzeyleri ile (%16) 1/6’sında ve MSI’sız (%15) 4/27’sinde
gözlemlenmiştir, bu yüzden hMLH1 hipermetilasyonu MSI’a neden olabilir veya
gelişimine
katkıda
bulunabilir
(11).
Hücre
siklus
inhibitörü
p16INK4a’nın
ekspresyonunun kaybı sporadik KRK ile ilişkilidir; bu gen ÜK hastalarının neoplastik
örneklerinde sıklıkla hipermetillenmiştir (12). Displazi içermeyen biyopsi örneklerinin
yaklaşık %10’u p16 promotorunun hipermetilasyonuna sahiptir; oran displazinin daha
yüksek dereceleriyle artar, tümör örneklerinde %100’e ulaşır. p14ARF p53’ün indirekt
regülatörüdür; p16INK4a gibi aynı gen tarafından kodlanır. Kodlayan genin
hipermetilasyonu
yoluyla,
p14ARF
ekspresyonunun
kaybı
adenokarsinomanın
%50’sinde, displastiklerin %33’ünde ve ÜK’li hastalardan alınan displazisiz mukoza
örneklerinin %60’ında bildirilmiştir (77).
Genetik olarak kolon kanserine yatkın farede inflamasyonun oluşturulması
neoplastik fenotipi uyarır. Örneğin, MSH2-/- farede dış tetikleyici olmaksızın spontan
olarak kolon kanseri gelişmez. Ancak, dekstran sodyum sülfat (DSS) oral uygulaması
ile inflamasyon oluşturulduğunda,
30 MSH2-/- farenin 28’i displazi veya kanser
geliştirir, yüksek derecede displazi sıklığı MSH2-/-, MSH2+/- ve MSH2+/+ için
sırasıyla %47, %23 ve %8 olduğu görülmüştür (78). MSH2-/-
farede displastik
lezyonlar dışında inflame ve inflame olmayan kolonik mukozanın MSI’ye de sahip
olduğu, MSI kolonik inflamasyon yoluyla oluşturulabileceği ve insanlarda gösterildiği
gibi displaziden önce meydana gelebileceği gösterilmiştir. DSS ile indüklenmeyen
kolitli APC Min/+ farelerde kolon tümörleri gelişmemiştir (79), fakat bu farelere 1 defa
DSS verildiğinde %22’sinde, 2 defa DSS verildiğinde %40’ında tümör gelişmiştir.
Ayrıca, DSS uygulaması akut ve kronik inflamasyon bölgeleri yanı sıra iyileşmiş
mukoza bölgelerinde displazinin yüksek sıklığıyla sonuçlanmıştır. Yüksek inflamasyon
14
skorlu hayvanlar kolitin APC Min/+ farede neoplazinin gelişimini hızlandırdığını
gösteren anlamlı daha fazla displastik lezyonalara sahip olduğu bildirilmiştir (79).
Kolon kanserinin kesin hücresel kaynağı hakkında bilgi azdır. Mutasyonlar
prolifere
olmayan
farklılaşmış
hücre
tipinde
ortaya
çıkarsa
mutasyonlar
yayılmayacaktır. Kript tabanındaki transforme olmuş kök hücreler bu nedenle erken
neoplastik lezyonların gelişimi ve devamından sorumlu olabileceği düşünülmektedir.
Kolonik kök hücreden spesifik olarak APC’nin kaybı progresif olarak büyüyen
neoplazmlarla sonuçlanır, oysaki (kript tabanına yakın yerleşmiş) transit amplifiye
hücrelerden kayıp neoplazm ile sonuçlanmaz (80). APC Min/+ farede sulindak
apopitozu uyararak kök hücreleri ortadan kaldırır (81). Epitel kök hücre bölümü yerel
mikro çevreden önemli sinyaller alır ve kript tabanındaki epitel mezenkim etkileşimini
bu bölüm sürdürür (82). Örneğin epimorfin kolon kök hücrelerinde etkisi olan
myofibroblastlar ve intestinal mezenkimal hücrelerden yapılan bir antiproliferatif,
promorfojenik faktördür. İnflamasyonu uyarmak için DSS verilen ve karsinojen
azoksimetana (AOM/DSS) maruz kalan epimorfin yoksun fare vahşi tip fare ile
karşılaştırıldığında kolon tümörü oluşumunun sıklığı ve yaygınlığı azaldığı görülmüştür
(83). Kolitin uyardığı kolon kanserinde kök hücrelerin rolü hakkında bilgiler azdır, fakat
kök hücrelerin kesin belirteçleri ile genetik çalışmalar daha fazla bilgi sağlayacaktır.
Transkripsiyonel sessizleşme birçok organizma için genel fizyolojik bir süreçtir
ve uygun gelişim için sıklıkla gereklidir (84). İnsan hücrelerinde, genellikle sessizleşme
etkilenen genlerin promotorlerinde CpG zengin dizilerinin (CpG adaları) metilasyonunu
içerir ve imprint ve X kromozomu inaktivasyonu için önemlidir. Metilasyon, sırayla;
metillenmiş DNA bağlayıcı protein ve histon deasetilazları içeren bir protein kompleksi
alımı ile ve en sonunda, transkripsiyon faktörlerinin dışlanması ile kapalı bir kromatin
yapısının oluşumu ile sonuçlanır (85). Bu sessizleşme klonaldir ve somatik hücrelerde
fizyolojik olarak geri dönüşümsüz olduğu düşünülmektedir. Neoplastik hücreler; hücre
döngüsü kontrolü, DNA onarımı ve anjiyogenez gibi kritik süreçleri düzenleyen genleri
içeren çeşitli genlerin susturulması ve sıklıkla anormal metilasyon gösterir (86).
Neoplastik hücrelerde anormal promotor metilasyonunun nedeni (leri) tam olarak
aydınlatılmış değildir.
Wnt proteinleri hücre büyüme ve farklılaşmasını düzenleyen glikozillenmiş ve
lipidlenmiş 19 proteinli bir ailedir (87,88). Wnt’ler embriyonun GPS sistemidir: vücut
15
aksını belirler ve organları doğru yönde büyümeye götürür. Yetişkin memelilerde
Wnt’lerin kontrolü kemik iliği, barsak ve deri gibi kendini sürekli yenileyen dokuların
idamesini kontrol eder (89,90). Bozulmuş Wnt sinyali gelişme bozuklukları ile
sonuçlanır ve kolorektal kanser, osteoporoz ve nörodejeneratif bozukluklar gibi farklı
insan patolojilerinin altında yatar (89,90). Farklı hücre içi sinyal iletim yollarının
aktivasyonu yoluyla onların etkilerini ortaya çıkarır. Wnt’lerin belirgin sinyal çıkışı alıcı
hücreler üzerinde mevcut hücre yüzey reseptörlerinin repertuvarına bağlı görünüyor.
Örneğin yedi transmembran reseptörlerinin (7TMs) Frizzled ailesinin bir üyesine Wnt5a ve düşük dansiteli lipoprotein reseptörü ile ilişkili protein ailesinin (LRP5/6) bir
temsilcisine bağlanır, Wnt duyarlı genlerin transkripsiyonu düzenleyen T-hücre faktörü
(TCF) ile uyum içinde hareket eden β-kateninin stabilizasyonunu uyarır (91,92). Ancak
bu reseptöre tirozin kinaz ROR2’yi bağlarsa Wnt-5a bu β-katenin-bağımlı yolu inhibe
edebilir (92,93). Böylece reseptör düzeyleri ve onların reseptörlerine Wnt ligandlarının
nisbi afiniteleri sinyal çıkışını belirler (94-96).
β-katenin sinyal hiperaktivasyonunun özellikle kolon kanseri olmak üzere çeşitli
kanserlerin bir tetikleyicisi olduğu ortaya çıkarılmıştır (89). Oysaki azaltılmış sinyal
bozulmuş kemik oluşumu ve nörodejeneratif hastalıkların altında yatar (97). Sonuç
olarak farklı endikasyonlar için bu yolağın inhibitörlerinin veya aktivatörlerinin etkisi
olduğu düşünülmektedir.
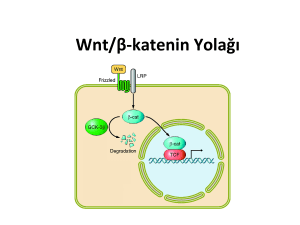
2.6. Wnt/β-katenin sinyal yolağı
Wnt/β-katenin
sinyali
sitoplazmada
β-katenin
degradasyonu
sayesinde
düzenlenir. Latent hücrelerde β-kateninin sitoplazmik ve nükleer fazlalığı destrüksiyon
kompleksi olarak adlandırılan büyük bir proteinin toplanmasının etkisiyle düşük
düzeyde tutulmaktadır. Destrüksiyon kompleksi bir
tümör baskılayıcı genin
Axin1/Axin2 ve APC içeren birkaç yapı proteinini içerir. Buna ek olarak bu Ser/Thr
kinaz glikojen sentaz kinaz 3 (GSK3α/ GSK3β) ve kazein kinaz Iα (CKIα) içerir
(87,88). De novo-sentezlenen β-katenin birkaç N-terminal serin ve treonin rezidülerinde
CKIα ve GSK3 yoluyla sırayla fosforillendiği destrüksiyon kompleksine katılır. Bu
fosforilasyonlar proteozom tarafından ve ubikuitinasyon ve sonraki destrüksiyon için βkatenini işaret eder. β-kateninin eksikliğinde TCF ailesinin proteinleri Wnt spesifik gen
transkripsiyonunu baskılar (Şekil 2.3) (87,88).
16
Wnt/β-katenin sinyali Frizzled ailesinin bir üyesine, LRP5 veya LRP6’a
Wnt’lerin bağlanmasıyla başlatılır. Sonuçta oluşan üçlü kompleks destrüksiyon
kompleksinin birkaç bileşenlenini membrana toplar. Destrüksiyon kompleksinin
fonksiyonu inhibe edilir ve fosforillenmemiş β-katenin sitoplazmada birikir ve sonunda
nükleusa transloke olur. Burada Wnt duyarlı gen transkripsiyonu represör TCF
aktivatöre dönüştürme TCF proteinleri ile ilişkilidir (87,88).
WNT yolağı etkin değil
WNT Yolağı
WNT yolağı etkin
W
DKK 1
Frizzled
LRP5/6
GBP
LKB1
Ubikinasyon
aracılı yıkım
Aksin
GSK3
APC
Dsh
β-
tcf
P
βΒkatenin
Hedef genler
Kanser olmayan hücre
CBP
Kanser hücresi
Şekil 2.3. Kanser ve kanser olmayan hücrede Wnt yolağının şematik gösterimi (98).
2.7. Kanserde Wnt/β-katenin sinyali
1990’ların başında, Wnt/β katenin sinyaline olan ilgi β-kateninin tümör süpresör
APC’e bağlanmasının bulunmasıyla giderek artmaktadır (99). O zamandan beri APC
genini içeren kromozomal bölgedeki delesyonlar çok sayıda intestinal polip ve sonunda
tümör oluşumu ile karakterize ailesel adenomatöz polipozis diye adlandırılan bir
herediter hastalıkla ilişkilendirilmiştir. APC’de fonksiyon kaybedici mutasyonlar sadece
17
ailesel adenomatöz polipozisin büyük çoğunluğunda bulunmadığı ayrıca sporadik
kolorektal karsinomlarda da bulunduğu görülmüştür. Bu mutasyonlar tipik olarak β
katenin, Axin1 veya Axin 2’nin bağlanmasının yetersiz olduğu kısalmış proteinlerin
oluşumuyla sonuçlanır (89,100). O zamandan beri destrüksiyon kompleksinin diğer
çekirdek bileşenlerinde mutasyonlar çok çeşitli kanserlerde varolduğu bildirilmiştir.
Kolon karsinomalarının küçük bir kısmında ve melonomalarda β-katenin geninde
mutasyonlar gözlemlenmiştir (3,19). Bu mutasyonlar ya β-kateninin N terminalinin
delesyonuna yol açan kısalmalardır ya da GSK3α/β veya CKIα tarafından hedeflenen
serin, treonini etkileyen nokta mutasyonlarıdır. Bu mutant β-katenin proteinleri
fosforilasyona dirençlidir ve böylece proteozomal degredasyondan kaçarlar. Sonuçta βkatenin etkilenmiş hücre içinde birikir. Stabilize edilmiş ve nükleusa lokalize olmuş βkatenin hemen hemen tüm kolon kanserlerinde bulunur ve onkogen c-myc ve hücre
siklusu regülatörü siklin D1 gibi proliferatif Wnt düzenleyici genler tümör
progresyonuna katkıda bulunur (89,100).
Wnt sinyal yolağı, kolon karsinogenezisi ve kolon kök hücre kısmının çoğalma
ve farklılaşmasının kontrolünde yer alır (15,16). Wnt2, Wnt5a, frizzled (Fz) reseptörleri
ve downstream transkripsiyonel düzenleyici LEF1’i içeren Wnt yolağının diğer
bileşenlerinin mekanizması bozulduğu için bu yolağı aktive eden mutasyonlar kolon
kanserinin sporadik formlarında % 80 daha fazla bulunmuştur. Bu yolak inflamatuvar
barsak hastalığı (İBH) ile ilişkilendirilmiş kolon kanserinde veya genel olarak İBH’da
önemli bir rol oynayıp oynamadığı araştırılmaya devam etmektedir (17,18,101,102).
Wnt yoluyla sinyal bir Wnt ligandı ile başlar, serpantin hücre yüzey Fz reseptörü
ve LRP5/6 koreseptör ile etkileşen salgılanan büyüme faktörü ile sinyal kaskadı
başlatılır (19). Disheveled (insan terminolojide Dsh veya dvl diye adlandırılır) ailesinin
üyeleri glikojen sentaz kinaz-3β’nın inhibisyonuna yolaçan Fz (20), APC ve axin
etkileşimi, β-kateninin fosforilasyonu ve yıkımını önler. β-katenin sonra birikir ve
MYC, siklooksijenaz-2 (COX-2) ve siklin D1 (CCND1)’i içeren birçok hedef genlerin
transkripsiyonu başlatan HMG-box transkripsiyon faktörlerinin ailesi lenfoid-arttırıcıfaktör/T-hücre faktör (LEF / TCF) üyelerini bağlayan çekirdeğine geçer (21-24). βkatenin aracılı Wnt sinyalizasyon kanonikal Wnt yolu olarak adlandırılır. Sinyalizasyon
ekstraselüler olarak Wnt ligandları bağlayan çözünür Fz ilişkili proteinler (sFRPs, FzBs)
18
tarafından ve LRP yüzey molekülü bağlayan dickkopf (DKK) ailesi proteinleri
tarafından bloke edilebilir (25,26).
β-katenin stabilizasyonu ile sonuçlanan ya APC yada β-katenin kendisindeki
mutasyonlar sporadik kolon kanserinde son derece yaygın iken bu tür mutasyonlar
ülseratif koliti olan hastaların tümörlerinde nadir olarak ortaya çıkmaktadır (şekil 2.4)
(27,31,72,103). 1-hydrozyanthraquinone ve methylazoxymethanol asetat yoluyla
indüklenen ülseratif kolit ile ilişkili rat-kolon karsinogenezinde β-katenin mutasyonları
görülebilmesine rağmen APC mutasyonları görülmez (104-106). Uzun süredir ülseratif
kolitliler kolon kanseri için yüksek riske sahiptir ve bu hastalardan alınan örneklerde,
Crohn hastalığı olan hastaların iltihaplı mukozalarının, ülseratif kolitli hastaların
iltihaplı barsak mukozaları ile karşılaştırıldığı nükleotid dizi analizi 3 Wnt yolağı geni
SARP1 (SFRP2), frizzled (FZD) ve disheveled (DVL)’nin ekspresyonunun artmış
olduğu gösterilmiştir (107).
Kanserde Wnt sinyalizasyonu
Tümör Baskılayıcı
Gen
Onkogen
WNT 5A
Wnt 1
Fz
SFRP
Dsh
APC
GSK
AKSİN
β katenin
Frat/GBP
Lgs/BCL 9
TCF 1
Şekil 2.4. Kanserde Wnt sinyalizasyonunda ilişkisi (108).
19
Wnt antogonist genleri tümör supresör olarak işlev görür ve bazı insan
malignitelerinin patogenezine katkıda bulunur. Son zamanlarda promotor CpG
hipermetilasyonu ve sFRP-1, sFRP-2, sFRP-4, ve sFRP-5, Dkk-3, ve Wif-1 genleri gen
susturmada bazı insan kanserlerinde tespit edilmiştir (109,110).
20
3. GEREÇ ve YÖNTEM
3.1. Hasta ve Kontrol Gruplarının Toplanması
Bu
Çalışmada
WNT
yolağı
genlerinin
promotor
metilasyonunun
ve
ekspresyonunun İBH ilişkili karsinogenezisin seyri sırasında ortaya çıkıp çıkmadığını
ve ayrıca İBH ilişkili neoplazininin seyri sırasında metilasyon olaylarının ve
ekspresyonunun progresyonu karakterize edip edemeyeceğini araştırıldı. Mersin
Üniversitesi Yerel Etik Kurulu’ndan çalışma için onay alındı. Çalışmaya katılan
bireylerin hepsi için bilgilendirilmiş onam formu oluşturuldu ve çalışma hakkında bilgi
sahibi olmaları sağlanarak onayları alındı. Mersin Üniversitesi, Tıp Fakültesi, Dâhili Tıp
Bilimleri, İç Hastalıkları Anabilim Dalı’nın Gastroenteroloji Bilim Dalı tarafından takip
edilen ve distal tip ÜK tanısı almış ve sürveyans kolonoskopisi yapılan 20 bireyden
hasta grubunu oluşturuldu. Kontrol grubu ise kolon kanseri taraması yapılan herhangi bir
yakınması ve endoskopik patolojisi olmayan 15 kişiden oluşturuldu. Surveyans
kolonoskopisi yapılan ÜK’lı hastalarda çekumdan başlandı ve her 10 cm. de bir 4
kadrandan 2’şer biyopsi alınarak anal kanala dek biyopsi örnekleri alındı. Bu biyopsiler
tarama amaçlı histopatolojik incelemeye tabi tutuldu. Distal tip ÜK’li hastalarda
biyopsiler, rektum 20. santimetreden ve çekuma 10 cm uzaklıktan her bir bölgeden en
az 5 adet olmak üzere standart biyopsi forsepsi ile alındı. Sürveyans kolonoskopisi
yapılan hasta grubunda malignite şüphesi var ise veya displazi ile ilişkili lezyon-kitle
(DALM) şüphesi olan lezyonlardan ayrıca biyopsi alındı. ÜK’in endoskopik aktivitesi
Rahmilevich endoskopik aktivite indeksine göre derecelendirildi. Sürveyans için alınan
örnekler aynı zamanda histopatolojik incelemeye tabi tutuldu. Böylelikle distal tip
ÜK’li hastalarının hem normal görünümlü hem de inflame kolonik mukozasından
biyopsiler alınarak ÜK hastalarında inflame ve inflame olmayan mukoza arasında
çalışılan Wnt yolağı genlerinin metilasyonu ve ekspresyonları açısından bir fark olup
olmadığı araştırıldı. Kontrol grubu hastalarında da sürveyans kolonoskopilerindeki gibi
aynı şekilde biyopsiler; rektum 20. santimetreden ve çekuma 10 cm uzaklıktan
biyopsiler alındı. Alınan biyopsi materyallerinden RNA ve DNA izolasyonu yapıldı.
Manuel yöntemle izole edilen RNA’lar kullanılarak cDNA’ları elde edildi.
21
3.2. RNA İzolasyonu ve RT-PCR
Endoskopik kolon biyopsi örneklerinden RNA izolasyonu manuel olarak Asit
Guanidinyum-Fenol-Kloroform Yöntemi (AGPC) ile yapıldı (111).
3.2.1. Kullanılan Solüsyonlar
a. Sodyum Sitrat (0,75 M): 15,78 g sodyum sitrat tartıldı ve DEPC-H2O ile 100
ml’ye tamamlanarak hazırlandı. Oda ısısnda 6 ay stabildir.
b. N-Lauroyl Sarkozil (%10): 1 gr sarkozil tartıldı ve DEPC-H2O ile 10 ml’ye
tamamlanarak hazırlandı. Oda ısısnda 3 ay stabildir.
c. DEPC-H2O: 1000 ml de-iyonize su içerisine 1 ml DEPC eklendi. 1 gece oda
ısısında bekletildi. Ertesi gün, 60oC’de 2 saat şişenin kapağı hafifçe gevşetilerek
bekletildikten sonra otaklavlandı. +4 oC’de 1 yıl stabil kalabilir.
d. Guanidinyum İsotiyosiyonat (GSCN) Solusyonu: 25 mg GSCN (4 M), 5 ml
sodyum sitrat (0,75 M), 2,5 ml sarkozil (%10) tartıldı ve DEPC-H2O ile 50
ml’ye tamamlanarak hazırlandı. Oda ısısnda 3 ay stabildir.
e. Denatürasyon Solüsyonu: 9,9 ml GSCN çözeltisi içerisine 0,1 ml 2merkaptoetanol (14 M) eklenerek hazırlandı. Oda ısısnda 1 ay stabildir.
3.2.2. Yöntem
RNA izolasyonu için steril ependorftaki doku homojenize edilip üzerine 500 l
denatürasyon solüsyonu eklenip birkaç saniye vortekslendikten sonra 15 dk -20oC’de
bekletildi. 700 l fenol-kloroform-isoamilalkol (25:24:1) (UltraPure™ Phenol:
Chloroform: Isoamyl Alcohol (25:24:1, v/v) 15593-031) eklenip, 15 dk -20oC’de
bekletildi. 4 dk 10.000 rpm’de santrifüjlendi. Üst faz yeni bir 1,5 ml’lik tüpe alındı ve
üzerine 700 l kloroform-isoamilalkol (24:1) (Ambresco x205 Chloroform: Isoamyl
Alcohol 24:1) eklendi. 2 dk 10.000 rpm’de santrifüjlendi. Üst faz yeni bir 1,5 ml’lik
ependorf tüpe alınarak üzerine 1 ml absolu etanol eklendi ve en az 1 gece bekletilmek
üzere -20oC’ye bırakıldı. 15 dk 12.500 rpm’de santrifüjlendi. Tüpteki etanol dökülüp,
500 l %70’lik etanol eklendi ve birkaç saniye vortekslendi. 5 dk 12.500 rpm’de
22
santrifüjlendi. Süpernatant atılıp, tüpün ağzı açık olarak en az 10 dk bekletildi. Pelet
üzerine 50 l DEPC-H2O eklendi. RNA’nın çözülmesi için 70oC’de 1 saat bırakıldı.
Elde edilen total RNA, 200 ünite Moloney Murine Leukemia Virus Reverse
Transkriptaz (MMLV-RT) enzimi kullanılarak cDNA’ya reverse transkribe edildi.
Bunun için elde edilen RNA örnekleri ile (1 µl) RT-PCR yapıldı. PCR ortamı; 5 µl 5X
RT-PCR buffer,(Fermentas) 10 µl dNTP (2 mM Fermentas) karışımı, 1µl poli-T primeri
(05μg/μl Metabion), 0,1 µl reverse transkriptaz enzimi (200u/µl Fermentas), 0,5 µl
RNAse inhibitörü (40u/µl Fermentas) ve 12 µl distile su ile hazırlandı.
RT-PCR koşulları; 37 oC’de 1 saat
95 oC’de 5 dakika
Elde edilen cDNA’lar analizi yapılana kadar +4 oC’de saklandı.
3.2.3. Real-Time PCR-Comparative CT (ΔΔCt) Metodu ile Ekspresyon Analizleri
Biyopsi örneklerinin RNA’larından cDNA eldesi yapılarak, SFRP2, SFRP4,
SFRP5, APC1, APC2 ve house keeping gen olan beta aktin’in (ACTB) ekspresyonları
Real-Time PCR (ABI 7500, Applied Biosystems) cihazı ile ve “Comparative CT
(ΔΔCT)” analizi yapılarak belirlendi (112-114). Bu çalışma hazırlığı için bu genlerin
her birinin primer ve prob dizaynı yapılıp sentezletildi.
3.2.4. Kullanılan Primer ve Problar
Primer
ve
problar,
“Metabion
International
AG,
D-82152
Martinsried/Deutschland” tarafından sentezlendi. Kullanılan primer ve problar çizelge
3.1. de gösterilmiştir.
23
Çizelge 3.1. Real-Time PCR için kullanılan primer ve problar.
Gen Adı
Diziler
SFRP2
Forward 5’- TGCTTGAGTGCGACCGTTT -3’
NCBI
Reference
Sequence:
NM_003013.2
SFRP4
Reverse 5’- CAGGAGGTGGTCGCTGCTA -3’
NCBI
Reference
Sequence:
NM_003014.3
SFRP5
Reverse 5’- TGATAGGGTCGTGCAGGAACT -3’
NCBI
Reference
Sequence:
NM_003015.3
Reverse 5’-TGGTGTCCTTGCGCTTCAG-3’
Probe 5’-Fam- ACAACGACCTTTGCATCCCCCTCG -BHQ-1-3’
Forward 5’- GCCGTGCTGCGCTTCTT -3’
Probe 5’-Fam- CCATGTACGCGCCCATTTGCAC -BHQ-1-3’
Forward 5’- TGATTGGAGCCCAGAAAAAGA -3’
Probe5’-Fam-AAGCTGCTCAAGCCGGGCCC-BHQ-1-3’
APC1
Forward5’-GAACCTGGAGGTACTTCATGTGAA-3’
NCBI
Reference
Sequence:
NM_022662.2
APC2
Reverse5’-GCAAATGTTTGGCCCACTAAA-3’
Probe5’-Fam-AGCGCTTCGTTCAAACAGCAATCCA-BHQ-1-3’
Forward5’-CATCAGCGAGCGGATGTG-3’
NCBI
Reference
Sequence:
NT_011255.14
ACTB
Reverse5’-GCAGTTCTCGATGCAGATGGA-3’
NCBI
Reference
Sequence
NM_001101.3
Reverse5’-GCCGATCCACACGGAGTACT-3’
Probe5’-Fam-CCTCGAACTCAAGCTGCTGCCGG-BHQ-1-3’
Forward5’-GGCACCCAGCACAATGAAG-3’
Probe5’-YakimaYellow-TCAAGATCATTGCTCCTCCTGAGCGC-BHQ-1-3’
3.2.5. Real-Time PCR Reaksiyon Ortamının Hazırlanışı
Real-Time PCR reaksiyon ortamını, total 25 µl olacak şekilde hazırlandı:
a. 12.5 µl, 2X TaqMan Gene Expression Master Mix (Applied Biosystems)
24
b. Son konsantrasyon; SFRP2R, SFRP2F, SFRP4R, SFRP4F, SFRP5R,
SFRP5F, APC1R, APC1F, APC2R, APC2F, ACTB-F ve ACTB-R
primerlerinden 900 nmol olacak şekilde primerler kullanıldı. FAM ile
işaretli SFRP2-Pr, SFRP4-Pr, SFRP5-Pr, APC1-Pr ve APC2-Pr
problarından ve Yakima Yellow ile işaretli ACTB-Pr probundan 200
nmol olacak şekilde problar kullanıldı.
c. 2,5 µl cDNA örneği
d. 5 µl Distile Su
3.2.6. Real-Time PCR Reaksiyon Şartları
50ºC’de
2 dakika ön inkübasyon
(1 döngü)
95ºC’de
10 dakika aktivasyon
(1 döngü)
95ºC’de
15 saniye denatürasyon
(50 döngü)
60ºC’de
1,5 dakika bağlanma/uzama (50 döngü)
Real Time PCR işlemi ve kantitasyon “ABI Prism 7500 Real-Time PCR System
(Applied Biosystems)” cihazı ve “7500 Software; SDS 2.0.3 software for 7500 Real
Time PCR Product (Applied Biosystems)” programı kullanılarak gerçekleştirildi.
3.2.7. Ekspresyon Tayini
Primer ve problar kullanılarak Gerçek Zamanlı Polimeraz Zincir Reaksiyonu
(Real Time Polymerase Chain Reaction) yöntemiyle “Comparative CT (ΔΔCT)” analizi
yapılarak SFRP2, SFRP4, SFRP5, APC1 ve APC2 genlerinin kantitasyonu belirlendi.
Kontrol geni olarak insan ACTB kullanıldı.
Comparative CT analiziyle ekspresyon tayini yapabilmek için ayrıca bir internal
kontrol olarak standart bir RNA’dan (Taqman Control-Human RNA, 50ng/µl)
hazırlanan cDNA kullanıldı.
25
3.3. DNA İzolasyonu
Çalışmamızda hasta ve kontrol grubuna ait bireylerden alınan endoskopik kolon
biyopsi örnekleri 1,5ml’lik steril santrifüj tüplerine her bireye ait özel protokol
numaraları kaydedilerek -80oC’de saklandı. DNA izolasyonu için High Pure PCR
Template Preparation Kit (Roche) kullanılarak aşağıda sıralanan yöntem uygulandı:
1. Steril santrifüj tüpü içerisine konan endoskopik kolon biyopsi örnekleri
homojenize edilip üzerine 200 l Doku Parçalama Solüsyonu ve 40l Proteinaz
K Solüsyonu eklendi, dikkatlice vortekslenerek karışması sağlandı.
2. Örnekler 55 oC’de yarım saat inkübasyona bırakıldı.
3. İnkübasyonu tamamlanan örneklerin üzerine 200 l bağlanma (binding buffer)
solüsyonu eklendi ve vortekslenerek karıştırıldı. 10 dakika 70
o
C’de
inkübasyona bırakıldı.
4. İnkübasyondan alınan karışımın üzerine 100 l izopropanol eklendi ve
vortekslenerek karıştırıldı.
5. Hazırlanan karışım 2 ml’lik toplama tüpüne yerleştirilmiş kolona aktarıldı ve
8000 rpm’de 1 dk santrifüj edildi, toplama tüpü atılarak kolon yeni toplama
tüpüne yerleştirildi.
6. Kolon üzerine 500 l Wash Buffer I pipetlendi ve 8000 rpm’de 1dk santrifüj
edildi, toplama tüpündeki sıvı boşaltılarak kolon tekrar yerleştirildi.
7. Kolon üzerine 500 l Wash Buffer II pipetlendi ve maksimum hızda (>12000
rpm) 3 dk santrifüj edildi, toplama tüpü atılarak kolon 1,5 ml’lik steril saklama
tüpüne yerleştirildi.
8.
Kolon üzerine 200 l Elution Buffer pipetlendi. 2 dk oda ısısında bekletildikten
sonra 8000 rpm’de 1dk santrifüj edildi,
Kolon atıldı ve elde edilen DNA +4 oC’de saklandı.
26
3.3.1. DNA Modifikasyonu
Elde edilen DNA’lar EZ DNA Metilasyon Gold Kit (Zymo Research)
kullanılarak üretici firmanın önerdiği yöntemle metilasyon dönüşümleri gerçekleştirildi.
Bu işlem için aşağıdaki adımlar takip edildi;
1. PCR tüpünün içine 130 μl CT conversion reagent ve 20 μl DNA örneği konur ve
örnek tüpleri thermocycler’da;
98 oC’de 10 dakika
64 oC’de 2,5 saat PCR yapıldı.
2. Zymo-Spin kolonlarına 600 μl M- Binding buffer konur ve spinependorf tüpünün
içersine yerleştirilir.
3. Thermocycler içindeki örnekler M- Binding buffer içeren Zymo-Spin kolon içersine
kondu ve birkaç kez ters-düz etmek suretiyle karıştırıldı.
4. 10000 rpm’de 1 dk santrifüj edildi ve alttaki sıvı uzaklaştırıldı.
5. Kolon içine 100 μl M-Wash buffer eklendi 12500 rpm’de 45 saniye santrifüj edildi.
6. Kolon içine 200 μl M-desulphination buffer ilave edildi oda sıcaklığında 15 dakika
inkübe edildikten sonra 10000 rpm'45 saniye santrifüj edildi.
7. Kolon içine 200 μl M-Wash buffer konulup ve 10000 rpm’de 30 saniye santrifüj
edildi.
8. Tekrar 200 μl M-Wash buffer eklendi ve 10000 rpm’de 45 saniye santrifüj edildi.
9. Kolon 1,5 ml’lik mikrosantrifüj tüpüne yerleştirildi 10 μlM- Elution buffer kolonun
matriksine eklenip 13500 rpm’de 1 dk santrifüj edildi.
Elde edilen modifiye DNA’lar -20
o
C’de saklandı. WNT yolağı genlerinin
metilasyon durumunu MSP (Metilasyon Spesifik Polimeraz Zincir Reaksiyonu)
yöntemi ile araştırıldı. MSP; Sitozinlerdeki metilasyon durumunun tespiti için
geliştirilen metotlardan biridir.
27
3.3.2. Metilasyon Spesifik PCR İçin Kullanılan Primerler
Bu çalışma kapsamında öngörülen genlerin metilasyon profilinin MSP yöntemi
ile tespit edilmesi için kullanılan primer dizileri Çizelge 3.2.’de verilmektedir.
Çizelge 3.2. Metilasyon Spesifik PCR İçin kullanılan primerler
Metile
F 5’-GGGTCGGAGTTTTTCGGAGTTGCGC-3’
R 5’-CCGCTCTCTTCGCTAAATACGACTCG -3’
SFRP2
Unmetile
F 5’- TTTTGGGTTGGAGTTTTTTGGAGTTGTGT -3’
R 5’- AACCCACTCTCTTCACTAAATACAACTCA-3’
Metile
F 5’- GGGTGATGTTATCGTTTTTGTATCGAC-3’
R 5’- CCTCCCCTAACGTAAACTCGAAACG-3’
SFRP4
Unmetile
F 5’- GGGGGTGATGTTATTGTTTTTGTATTGAT-3’
R 5’- CACCTCCCCTAACATAAACTCAAAACA-3’
Metile
F 5’- AAGATTTGGCGTTGGGCGGGACGTTC-3’
R 5’- ACTCCAACCCGAACCTCGCCGTACG-3’
SFRP5
Unmetile
F 5’- GTAAGATTTGGTGTTGGGTGGGATGTTT-3’
R 5’- AAAACTCCAACCCAAACCTCACCATACA-3’
Metile
F 5’- TATTGCGGAGTGCGGGTC-3’
R 5’- TCGACGAACTCCCGACGA-3’
APC1
Unmetile
F 5’- GTGTTTTATTGTGGAGTGTGGGTT-3’
R 5’- CCAATCAACAAACTCCCAACAA-3’
Metile
F 5’- GTCGTTTGTTTAGGTTCGGATC-3’
R 5’- GACCCGAAATAACCTCGAAACG-3’
APC2
Unmetile
F 5’- TGGTAGTGTTGTTTGTTTAGGTTTGGATTG-3’
R 5’- ACCAAAAATCCCAACCCAAAATAACCTCAAAACA-3’
28
3.3.3. Metilasyon Spesifik PCR Ortamının Hazırlanışı
Metilasyon profillerinin tespiti için içeriğinde Hot-Start Taq Polimeraz (5 U/μl
ZymoTaq™ DNA Polymerase, E2002), 2X Reaksyon buffer (ZymoTaq™ E2002),
dNTP (25mM ZymoTaq™ E2002), 25 mM MgCl2 (Fermentas), her bir gen için Primer
M (Metabion International AG) ve Primer U (Metabion International AG), Bisulfid
DNA1μl olacak şekilde 25 μL reaksiyon karışımı hazırlandı. Pozitif ve negatif
kontroller için M kontrol DNA olarak (Chemicon International 90394) ve U kontrol
DNA olarak (Chemicon International 90393) kullanıldı.
3.3.4. Metilasyon Spesifik PCR Şartları
95ºC’de
5 dakika
95ºC’de
30 saniye
Annealing
30 saniye
72ºC’de
30 saniye
72ºC’de
5 dakika
Denatürasyon
35 siklus Amplifikasyon
Son uzama
100 ml 1XTBE (Tris-Borat-EDTA) tamponu içerisinde 2 gr agaroz plus
mikrodalga fırında eritildikten sonra 0.5 g/ml konsantrasyonunda olacak şekilde
etidyum bromid eklenerek, %2’lik agaroz hazırlandı. Elde edilen MSP ürünleri standart
U ve M kontrol eşliğinde, %2’lik agaroz jelde 120 Volt elektrik akım uygulanarak
elektroforez işlemi yapıldı. Jel Görüntüleme Sistemi (Vilber Lourmat Marne La Vallée,
France) ile sonuçlar değerlendirildi.
3.3.5. Metilasyon Spesifik PCR Annealing Dereceleri ve Ürün Boyutları
Çalışılan SFRP2, SFRP4, SFRP5, APC1 ve APC2 genlerinin metile ve
unmetile primerlerle ile yapılan MSP’nin annealing dereceleri ve ürün boyutları Çizelge
3.3’de gösterilmiştir.
29
Çizelge 3.3. Metilasyon Spesifik PCR Annealing Dereceleri ve Ürün Boyutları
Gen Adı
Annealing Derecesi
Ürün Boyutu
SFRP2-M
58 ºC
138 bç
SFRP2-U
64 ºC
145 bç
SFRP4- M
64 ºC
111 bç
SFRP4-U
64 ºC
115 bç
SFRP5 -M
64 ºC
136 bç
SFRP5-U
64 ºC
141 bç
APC1-M
61 ºC
98 bç
APC1-U
61 ºC
108 bç
APC2-M
64 ºC
98 bç
APC2-U
64 ºC
102 bç
30
3.4. İstatistiksel Analiz
Çalışmanın
istatistiksel
analizleri
Mersin
Üniversitesi
Tıp
Fakültesi
Biyoistatistik ve Tıbbi Bilişim Anabilim Dalı tarafından yapılmıştır. Yaş ve ekspresyon
düzeyleri bakımından ülseratif kolit hastaları ile kontrol gruplarının karşılaştırmalarında
ve
hastalarda
ekpresyon
düzeylerinin
metilasyon
gruplarına
göre
yapılan
karşılaştırmalarında Independent Samples t test kullanılmıştır. Kategorik değişkenlerin
analizinde Ki-kare veya Likelihood ratio testinden yararlanılmıştır. İstatistik analizler
SPSS v.11.5 paket programı ile yapılmıştır. İstatistik analizlerde p<0,05 ise sonuçlar
anlamlı kabul edilmiştir. Sürekli değişkenler için tanımlayıcı istatistikler ortalama ve
standart sapma cinsinden, kategorik değişkenler için ise frekans ve yüzde cinsinden
tablo halinde verilmiştir.
31
4. BULGULAR
Ortalama 13.65 yıldır distal tip ÜK tanısı almış 20 bireyden hasta grubu
oluşturuldu. Kontrol grubu kolon kanseri taraması yapılan herhangi bir yakınması ve
endoskopik patolojisi olmayan 15 bireyden oluşturuldu. İncelenen hasta ve kontrol
grupları arasında yaş bakımından dağılımları; hasta grubunda 53,5±12,9 kontrol grubunda
53,6±9,8 idi ve bu fark istatistiksel olarak anlamlı değildi (p= 0.967).
Değerlendirilen hasta grubundaki 20 bireyin 16’sı erkek (%80), 4’ü kadın (%20)
ve kontrol grubundaki 15 bireyin 7’si erkek (%46,7), 8’i kadın (%53,3) idi.
Bu hastaların endoskopik olarak 7’sinde splenik köşeden itibaren anüse dek
submukozal damar ağı distorsiyone ya da submukozal damar ağı seçilmiyordu,
Rahmilevich endoskopik aktivite indeksi 4 ve altındaydı. 12’sinde Rahmilevich
endoskopik aktivite indeksi 6 idi ve 1’inde Rahmilevich endoskopik aktivite indeksi 8 idi.
Rahmilevich endoskopik aktivite indeksi 8 olan hastada çıkan kolon proksimalinde
(burada Rahmilevich endoskopik aktivite indeksi 1 idi) 1santimetrelik polip görüldü,
çıkartılan polip materyalinin histopatolojik incelemesinde düşük dereceli displazi
saptandı. Histopatolojik incelemede distal kolondan alınan biyopsi örneklerinde 13
hastada şiddetli aktif inflamasyon varken, 7 hastada ise hafif inflamasyon vardı.
Proksimal kolonundan alınan biyopsi örneklerinde 12 hastada hafif aktif inflamasyon
varken 8’inde inflamasyon yoktu. Proksimal kolonda inflamasyonu olmayan 8 hastanın
4’ünde distal kolonda hafif, diğer 4 hastada da şiddetli aktif inflamasyon vardı. (Çizelge
4.1).
4.1. Metilasyon Spesifik PCR Bulgularının Değerlendirilmesi
Hastaların ve kontrollerin distal kolonundan alınan örneklerinin SFRP2, SFRP4,
SFRP5, APC1ve APC2 genlerinin MSP ile değerlendirildiğinde metile primer ile bant
görünen örnekler homozigotmetile, unmetile primer ile ile bant görünen örnekler
unmetile ve hem metile primer hemde unmetile primer ile ile bant görünen örnekler ise
heterozigot metile olarak kabul edildi. İstatistiksel değerlendirmede metile olanlar ve
heterozigot metile olanlar metile olarak değerlendirildi.
32
4.1.1. SFRP2
Hastaların ve kontrollerin distal kolonundan alınan örneklerinin SFRP2 geninin
MSP ile değerlendirildiğinde 20 hastadan 19’u metile (%95), 1 kişi unmetile (%5);
kontrollerin ise 13’ü (%86,7) metile, 2’si unmetile (%13,3) idi (Şekil 4.1; Şekil 4.2).
Hasta ve kontroller arasında distal kolonun metilasyonu açısından istatistiksel olarak
anlamlı bir fark bulunmadı (p=0,385). Proksimal kolondan alınan örneklerin SFRP2
geninin MSP ile değerlendirilmesinde 20 hastadan 17’si metile (%85), 3’ü unmetile
(%15) iken; 15 bireyden oluşan kontrol grubunun 14’ü metile (%93,3), 1’i unmetile
(%6,7) idi. Proksimal kolondaki metilasyon oranları bakımından hasta ve kontrol
grupları arasında istatistiksel olarak önemli bir farklılık saptanmadı (p=0,431).
Hastaların distal ve proksimal kolonları kendi içinde değerlendirildiğinde ise distal
kolonunda metilasyon olan 19 kişiden 16’sının (%84,2)
proksimal kolonunda da
metilasyon bulundu.
Şekil 4.1 SFRP2 geninin metile primer ile PCR görüntüsü. 1-8 örneklerin görüntüsü, NK: Negatif
kontrol, PK: Pozitif kontrol (138 bç), M: Markır (50bç). 1-4 ve 6-8 numaralı örneklerde metilasyon
gözlenirken 5 numaralı örnekte metile primer ile metilasyon gözlenmedi.
33
Şekil 4.2 SFRP2 geninin unmetile primer ile PCR görüntüsü. 1-8 örneklerin görüntüsü, NK: Negatif
kontrol, PK: Pozitif kontrol (145 bç), M: Markır (50bç). 1-4, 6-8 numaralı örnekler unmetile primer ile
unmetile bant gözlenirken 5 numaralı örnek unmetile primer bant gözlenmedi.
4.1.2. SFRP4
Hastaların distal kolonundan alınan örneklerde 19 hasta metile (%95) ve 1 hasta
unmetile (%5) iken; kontrollerin 14’ü (%93,3) metile, 1’i unmetile (%6,7) bulundu
(Şekil 4.3; Şekil 4.4). Hasta ve kontrol gruplarında distal kolondaki metilasyon oranları
arasında istatistiksel olarak anlamlı bir farklılık yoktu (p=0,834). Proksimal kolondan
alınan örneklerde ise hastalardan 12’si metile (%60) ve 8’i unmetile (%40), kontrollerin
14’ü (%93,3) metile ve 1’i unmetile (%6,7) idi. Metilasyon oranları bakımından
proksimal kolon örnekleri arasında istatistiksel olarak anlamlı bir fark bulundu
(p=0,018). Hastaların proksimal kolon örneklerinde kontrollere göre metilasyon
azalmıştı. Distal kolonu metile olan 19 kişinin 11’nin (%57,9) proksimal kolonunda da
metilasyon bulundu.
34
Şekil 4.3. SFRP4 geninin metile primer ile PCR görüntüsü. 1-8 örneklerin görüntüsü, 1-5,6,7 numaralı
örnekler metile primer ile metile bant gözlenirken 5,8 numaralı örneklerde metile primer ile metile bant
gözlenmedi. NK: Negatif kontrol, PK: Pozitif kontrol (111 bç), M: Markır (50bç).
Şekil 4.4. SFRP4 geninin unmetile primer ile PCR görüntüsü. 1-8 örneklerin görüntüsü, NK: Negatif
kontrol, PK: Pozitif kontrol (115 bç), M: Markır (50bç). 1,2,4,5,6 ve 7 nolu örnekler unmetile primer ile
bant görülürken 3 numaralı örnekte unmetile bant gözlenmedi.
4.1.3. SFRP5
Hasta ve kontrollerin distal kolonlarından alınan örneklerde; 20 hastanın 12’si
metile (%60) ve 8’i unmetile (%40), kontrollerin ise 7si (%46,7) metile, 6’sı unmetile
(%53,3) idi (Şekil 4.5; Şekil 4.6). Hasta ve kontrol gruplarında distal kolondaki
metilasyon oranları arasında istatistiksel olarak anlamlı bir farklılık yoktu (p=0,433).
35
Proksimal kolondan alınan örnekler incelendiğinde ise hastalarda 13 kişi metile (%65)
ve 7 kişi unmetile (%35) bulundu. Kontrollerde ise 8 kişi metile (%53,3) ve 7 kişi
unmetile (%46,7) idi. Proksimal kolondaki metilasyon oranları bakımından hasta ve
kontrol grupları arasında istatistiksel olarak önemli bir farklılık saptanmadı (p=0,486).
Hastaların distal kolonunda metilasyon olan 12 kişiden 8’inin (%66,7) proksimal
kolonunda da metilasyon gözlemlendi. Distal ve proksimal kolonlardaki metilasyon
oranları arasında istatistiksel olarak anlamlı bir fark gözlenmedi (p=0,848).
Şekil 4.5. SFRP5 geninin metile primer ile PCR görüntüsü. 1-9 örneklerin görüntüsü, NK: Negatif
kontrol, PK: Pozitif kontrol (136 bç), M: Markır (50bç). 1-9 nolu örneklerde metile primer ile metile bant
gözlendi.
Şekil 4.6. SFRP5 geninin unmetile primer ile PCR görüntüsü. 1-9 örneklerin görüntüsü, NK: Negatif
kontrol, PK: Pozitif kontrol (141 bç), M: Markır (50bç). 1-9 nolu örnekler unmetile primer ile unmetile
bant gözlemlenirken 10 numaralı örnekte unmetile bant gözlenmedi.
36
4.1.4. APC1
Distal kolondan alınan örneklerin incelemesi sonucu 20 hastanın 4’ü metile
(%20), 16’sı unmetile (%80) iken kontrollerin 7’si metile (46,7) ve 8’si unmetile
(%53,3) idi (Şekil 4.7; Şekil 4.8).
Distal kolonda hasta ve kontroller arasında
metilasyon açısından istatistiksel olarak anlamlı fark gözlenmedi (p=0,093). Proksimal
kolondan alınan örnekler incelendiğinde ise 11 hasta metile (%55), 9 hasta unmetile
(%45) ve kontrollerin 10’u metile (%66,7) ve 5’i unmetile (%33,3) bulundu. Hasta ve
kontroller arasında metilasyon durumu açısından proksimal kolonda istatistiksel olarak
anlamlı fark bulunmadı (p=0.486). Distal kolonu metile olan 4 hastadan 1’nin (%25)
proksimal kolonunda da metilasyon gözlemlendi. Distal ve proksimal kolonlardaki
metilasyon oranları arasında istatistiksel olarak anlamlı bir fark gözlenmedi (p=0.173).
Şekil 4.7. APC1 geninin metile primer ile PCR görüntüsü. 1-8 örneklerin görüntüsü, NK: Negatif kontrol,
PK: Pozitif kontrol (98 bç), M: Markır (50bç). 2, 6-9 numaralı örneklerde metile primer ile metile bant
görülürken 3-5 numaralı örneklerde metile bant görülmedi.
Şekil 4.8. APC1 geninin unmetile primer ile PCR görüntüsü. 1-7 örneklerin görüntüsü, NK: Negatif
kontrol, PK: Pozitif kontrol (108 bç), M: Markır (50bç). 1-3 ve 5-7 numaralı örneklerde unmetile primer
ile unmetile bant görülürken 4 numaralı örnekte unmetile primer ile bant görülmedi.
37
4.1.5. APC2
Hastaların distal kolonundan alınan örnekler incelendiğinde 8 kişi metile (%40)
ve 12 kişi unmetile (%60) iken kontrollerin 1’i metile (%6,7), 14’ü unmetile (%93,3) idi
(Şekil 4.9; Şekil 4.10). Hasta ve kontroller arasında distal kolonda metilasyon
bakımından istatistiksel olarak anlamlı fark bulundu (p=0,018). Hastaların distal
kolonunda kontrollere göre metilasyon artmıştı. Proksimal kolonda ise hastaların 6’sı
metile (%30), 14’ü unmetile (%70) iken kontrollerin 2’si metile (%13,3) ve 13’ü
unmetile (%86,7) bulundu. Proksimal kolon örneklerinde metilasyon bakımından fark
istatistiksel olarak anlamlı değildi (p=0,235). Distal kolonu metile olan 8 hastadan
3’nün proksimal kolonuda metile idi. Distal ve proksimal kolonlardaki metilasyon
oranları arasında istatistiksel olarak anlamlı bir fark gözlenmedi (p=0,552).
Şekil 4.9. APC2 geninin metile primer ile PCR görüntüsü. 1-8 örneklerin görüntüsü, NK: Negatif kontrol,
PK: Pozitif kontrol (98 bç), M: Markır (50bç).3,4 ve 6-8 numaralı örnekler metile primer ile metile bant
gözlenirken 1,2 ve 5 numaralı örnekler metile primer ile metile bant gözlenmedi.
38
Şekil 4.10. APC2 geninin unmetile primer ile PCR görüntüsü. 1-8 örneklerin görüntüsü, NK: Negatif
kontrol, PK: Pozitif kontrol (102 bç), M: Markır (50bç). 1 ve 4-8 numaralı örnekler unmetile primer ile
unmetile bant gözlemlenirken 2,3 numaralı örneklerde unmetile primer ile unmetile bant gözlemlenmedi.
4.2. Metilasyon ve İnflamasyon Bulgularının Değerlendirilmesi
Hastaların distal
ve
proksimal
kolonlarındaki
inflamasyon
bulgularını
karşılaştırabilmek için; hastaların klinik ve inflamatuvar özellikleri, yaş, cinsiyet ve
hastalık süreleri Çizelge 4.1’de verilmişitr.
39
Çizelge 4.1. Hastaların klinik ve inflamatuvar özellikleri. PMİ: Proksimal mikroskopik inflamasyon,
DMİ: Distal mikroskopik inflamasyon, PEİ: Proksimal endoskopik inflamasyon, DEİ: Distal endoskopik
inflamasyon, H: Hafif inflamasyon, Ş: Şidetli inflamasyon, E: Erkek, K: Kadın.
Hasta
PMİ
DMİ
PEİ
DEİ
Hastalık
Süresi (yıl)
Yaş
Cinsiyet
UK-1
YOK
Ş
YOK
Ş
15
41
E
UK-2
YOK
Ş
YOK
H
18
46
E
UK-3
H
Ş
YOK
Ş
14
61
K
UK-4
YOK
Ş
YOK
Ş
12
36
K
UK-5
H
Ş
YOK
Ş
12
33
E
UK-6
H
H
YOK
H
15
59
E
UK-7
H
Ş
YOK
H
10
37
E
UK-8
H
H
YOK
Ş
15
47
E
UK-9
YOK
Ş
YOK
Ş
11
69
E
UK-10
YOK
H
YOK
H
15
56
E
UK-11
H
H
YOK
H
10
40
E
UK-12
YOK
H
YOK
Ş
13
49
E
UK-13
YOK
H
YOK
Ş
12
68
E
UK-14
H
Ş
YOK
Ş
16
62
E
UK-15
H
Ş
YOK
Ş
17
67
E
UK-16
H
Ş
YOK
Ş
13
80
E
UK-17
H
Ş
YOK
H
11
67
K
UK-18
H
Ş
YOK
H
10
53
E
UK-19
H
Ş
YOK
Ş
15
49
K
UK-20
YOK
H
YOK
Ş
19
50
E
40
Hastaların distal kolondan alınan örneklerin SFRP2 geninin metilasyon
durumları ile mikroskobik inflamasyon durumu karşılaştırıldığında inflamasyonu
olmayan grupta metile ve unmetile kişi gözlemlenmezken hafif inflamasyonu olan 7 kişi
(%100) metile; şiddetli inflamasyonu olanlardan 12 kişi metile (%92,3) ve 1 kişi
unmetile (%7,7) bulundu. (Şekil 4.11).
Şekil 4.11. SFRP2 geninin distal kolon örneklerinin metilasyon durumları (metile, unmetile) ile distal
mikroskobik inflamasyon durumlarının (yok, hafif, şiddetli) grafiksel gösterimi.
Hastaların distal kolondan alınan örneklerin SFRP4 geninin metilasyon
durumları ile mikroskobik inflamasyon durumu karşılaştırıldığında inflamasyonu
olmayan grupta metile ve unmetile kişi gözlemlenmezken hafif inflamasyonu olan 7 kişi
(%100) metile; şiddetli inflamasyonu olanlardan 12 kişi metile (%92,3) ve 1 kişi
unmetile (%7,7) bulundu. (Şekil 4.12).
41
Şekil 4.12. SFRP4 geninin distal kolon örneklerinin metilasyon durumları (metile, unmetile) ile distal
mikroskobik inflamasyon durumlarının (yok, hafif, şiddetli) grafiksel gösterimi.
SFRP5 geninin distal kolon örneklerinde metilasyon ve
mikroskobik
inflamasyonu değerlendirildiğinde inflamasyonu olmayan grupta metile ve unmetile kişi
gözlemlenmezken hafif inflamasyonu olan 4 kişi (%57,1) metile, 3’ü unmetile (%42,9);
şiddetli inflamasyonu olanlardan 8 kişi metile (%61,5) ve 5 kişi unmetile (%38,5)
bulundu. (Şekil 4.13).
42
Şekil 4.13. SFRP5 geninin distal kolon örneklerinin metilasyon (metile, unmetile) ile distal mikroskobik
inflamasyon durumlarının (yok, hafif, şiddetli) grafiksel gösterimi.
APC1
geninin
distal
kolon örneklerinde
metilasyon
ve
mikroskobik
inflamasyonu değerlendirildiğinde inflamasyonu olmayan grupta metile ve unmetile kişi
gözlemlenmezken hafif inflamasyonu olan 3 kişi (%42,9) metile, 4’ü unmetile(%57,1);
şiddetli inflamasyonu olanlardan 1 kişi metile (%7,7) ve 1 kişi unmetile (%92,3)
bulundu. İstatistiksel olarak anlamlı değildi (p=0,065) (Şekil 4.14).
43
Şekil 4.14. APC1 geninin distal kolon örneklerinin metilasyon durumları (metile, unmetile) ile distal
mikroskobik inflamasyon durumlarının (yok, hafif, şiddetli) grafiksel gösterimi.
APC2
geninin
distal
kolon örneklerinde
metilasyon
ve
mikroskobik
inflamasyonu değerlendirildiğinde inflamasyonu olmayan grupta metile ve unmetile kişi
gözlemlenmezken hafif inflamasyonu olan 2 kişi (%28,6) metile, 5’i unmetile(%71,4);
şiddetli inflamasyonu olanlardan 6 kişi metile (%46,2) ve 7 kişi unmetile (%53,8)
bulundu. İstatistiksel olarak anlamlı değildi (p=0,439) (Şekil 4.15).
44
Şekil 4.15. APC2 geninin distal kolon örneklerinin metilasyon durumları (metile, unmetile) ile
inflamasyon (yok, hafif, şiddetli) durumlarının grafiksel gösterimi.
4.3. Real Time-PCR (Comparative CT) Analiziyle İlgili Bulgular
Hasta ve kontrol grubunun proksimal ve distal kolonlarından alınan biyopsi
örneklerinden elde edilen cDNA’lar ile Wnt yolağında yer alan SFRP2, SFRP4, SFRP5,
APC1, APC2 ve ACTB’nin gen ekspresyonları Real-Time PCR (ABI 7500, Applied
Biosystems) cihazı ile “Comparative CT (ΔΔCt)” analizi yapılarak belirlendi. Real-Time
PCR cihazı ile her bir gen için elde edilen PCR amplifikasyon eğrileri ile her bir örneğin
ekspresyon oranları değerlendirildi. (Sırasıyla ACTB, SFRP2, SFRP4, SFRP5, APC1 ve
APC2; Şekil 4.16, Şekil 4.17, Şekil 4.18, Şekil 4.19, Şekil 4.20, Şekil 4.21). Elde edilen
veriler SPSS (V.11.5) programına aktarılarak istatiksel analiz yapıldı.
45
Şekil 4.16. ACTB genine ait, YAKIMA YELLOW ile işaretlenmiş real time PCR amplifikasyon eğrisi.
Şekil 4.17. SFRP2 genine ait, FAM ile işaretlenmiş real time PCR amplifikasyon eğrisi.
46
Şekil 4.18. SFRP4 genine ait, FAM ile işaretlenmiş real time PCR amplifikasyon eğrisi.
Şekil 4.19. SFRP5 genine ait, FAM ile işaretlenmiş real time PCR amplifikasyon eğrisi.
47
Şekil 4.20. APC1 genine ait, FAM ile işaretlenmiş real time PCR amplifikasyon eğrisi.
Şekil 4.21. APC2 genine ait, FAM ile işaretlenmiş real time PCR amplifikasyon eğrisi.
48
Hastaların
distal
kolonlarının
metilasyon
durumu
ile
ekspresyonları
karşılaştırıldığında; SFRP2 için, distal kolonda metile olan19 kişinin ekspresyonlarının
ortalaması 1,42±0.41 iken unmetile olan 1 kişinin ekspresyonu 0,78±0,41 bulundu.
Proksimal kolonda ise; metile olan 17 kişinin ekspresyon ortalaması 1,47±0,45,
unmetile olan 3 kişinin ortalaması 1,07±0,57 bulundu. SFRP4 geninde distal kolonda
metile olan 19 kişinin ekspresyonlarının ortalaması 1,11±0.35 iken unmetile olan 1
kişini ve ekspresyonu 2,43±0,35 bulundu. SFRP4 için proksimal kolonda metile olan 12
kişinin ekspresyon ortalaması 0,93±0,27, unmetile olan 8 kişinin ortalaması 1,10±0,70
bulundu. Bu fark istatistiksel olarak anlamlı değildi (p=0,468). SFRP5 geni için distal
kolonu metile olan 12 kişinin ekpresyon ortalaması 0,93±0,51, unmetile olan 8 kişinin
ekspresyon ortalaması 1,41±0,26 olup metile olanların ekspresyonu azalmıştı ve bu fark
istatistiksel olarak anlamlı (p=0,015) bulundu. SFRP5 proksimal kolonda metile olan 13
kişinin ortalaması 0,90±0,42 unmetile olan 7 kişinin 1,26±0,40 olarak bulundu. Bu ilişki
istatistiksel olarak anlamlı değildi (p=0,080). APC1 distal kolon için metile olan 4
kişinin ekpresyon ortalaması 3,28±4,48 ekspresyonu değerlendirilebilen unmetile
olan15 kişinin ortalaması 2,98±3,70 bulundu. Proksimal kolonda ekspresyonu
değerlendirilebilen 9 metile kişinin ortalaması 2,84±3,58 unmetile olan 9 kişinin
ekspresyon ortalaması ise 0,72±0,23 ve bu ilişki istatistiksel olarak anlamlı değildi
(p=0,114). APC2 için distal kolonda metile olan ekpresyonu değerlendirilebilen 7
kişinin ortalaması 1,19±0,48 unmetile olup ekspresyonu değerlendirilebilen 11 kişinin
ortalaması 1,44±0,91 (p=0,462) bulundu ve bu fark istatistiksel olarak anlamlı değildi.
APC2 proksimal kolonda ekspresyonu değerlendirilebilen metile 5 kişinin ortalaması
1,35±0,45 unmetile olan 14 kişinin ekspresyon ortalaması ise 1,20±0,68 olarak bulundu.
Hasta ve kontrol gruplarının proksimal ve distal kolonundan alınan örneklerinin
SFRP2, SFRP4, SFRP5, APC1 ve APC2 genlerin arasında ekspresyon düzeyleri
arasında bir ilişkiye rastlanmadı (Çizelge 4.2). Hasta ve kontrollerin gruplarında bazı
genlerde çalışılan kişi sayısından daha az kişide ekspresyon bulgusu elde edildi.
49
Çizelge 4.2. Ülseratif kolit hastaları ile kontrol gruplarının proksimal ve distal kolonlarından alınan
örneklerin SFRP2, SFRP4, SFRP5, APC1 ve APC2 genlerinin ekspresyon oranı (E) değerinin
ortalamaları ve standart sapmaları. D:Distal, P: Proksimal
GEN
APC1_D
E değeri
Ortalaması
Standart
Sapma
Standart
Hata
19
3,04332
3,806595
0,873293
kontrol 14
1,81029
2,405780
0,642972
18
1,78578
2,698554
0,636055
kontrol 14
0,87314
0,528305
0,141196
1,34433
0,764438
0,180180
GRUP N
hasta
p
Değeri
0,296
APC1_P
hasta
0,224
APC2_D
hasta
18
0,311
kontrol 14
APC2_P
1,09536
0,542992
0,145121
19
1,24479
0,625936
0,143599
kontrol 14
1,10979
0,269475
0,072020
20
1,39150
0,424981
0,095029
kontrol 14
1,14579
0,319665
0,085434
1,13605
0,461128
0,103111
hasta
0,408
SFRP2_D
hasta
0,077
SFRP2_P
hasta
20
0,645
kontrol 14
SFRP4_D
1,07321
0,245333
0,065568
20
1,17850
0,457725
0102350
kontrol 14
1,08629
0,291176
0,077820
20
1,00130
0,485713
0,108609
kontrol 14
0,96414
0,207596
0,055482
1,12490
0,487984
0,109117
hasta
0,511
SFRP4_P
hasta
0,790
SFRP5_D
hasta
20
0,613
kontrol 14
SFRP5_P
1,04729
0,345501
0,092339
20
1,03080
0,439783
0,098338
kontrol 14
0,99764
0,215682
0,057643
hasta
0,773
50
Hastaların distal kolonlarında inflamasyon durumu (hafif/ şiddetli) ile distal
kolonda SFRP2, SFRP4, SFRP5, APC1 ve APC2 genlerinin ekspresyon düzeyleri
arasında anlamlı bir ilişki bulunmadı (Çizelge 4.3).
Çizelge.4.3. Hastaların distal kolon örneklerinde inflamasyonu ile SFRP2, SFRP4, SFRP5, APC1 ve
APC2 genlerinin ekspresyon oranı (E) değerinin ortalamaları ve standart sapmaları.
Gen
APC1
APC2
SFRP2
SFRP4
SFRP5
İnflamasyon
Durumu
N Ortalama
Standart
Sapma
Standart
Hata
hafif
7
3,39000
3,559290
1,345285
şiddetli
12
2,84108
4,084111
1,178981
hafif
7
1,29314
0,484805
0,183239
şiddetli
11
1,37691
0,921628
0,277881
hafif
7
1,56800
0,487312
0,184187
şiddetli
13
1,29646
0,373188
0,103504
hafif
7
1,33357
0,421877
0,159455
şiddetli
13
1,09500
0,470273
0,130430
hafif
7
1,09214
0,632811
0,239180
şiddetli
13
1,14254
0,419344
0,116305
p
Değeri
0,771
0,828
0,180
0,278
0,832
51
5. TARTIŞMA
Bu çalışmada sürveyans kolonoskopisi yapılan distal tip ÜK tanısı alan hastalar
ile kanser taraması yapılan sağlıklı kişilerin proksimal ve distal kolonlarından alınan
örneklerde Wnt yolağında etkili olan genlerden SFRP2, SFRP4, SFRP5, APC1 ve
APC2 genlerinin metilasyon durumları ile ekspresyon düzeyleri incelendi. Hasta ve
kontrollerin distal ve proksimal kolon örneklerinin SFRP2 geninin metilasyon durumları
arasında istatistiksel olarak anlamlı bir fark bulunmadı. SFRP2 genin ekspresyonlarının
proksimal kolon örneklerinde istatistiksel anlamlı bir fark bulunmazken hasta grubunun
distal kolon örneklerinde ekspresyon oranları 1,39±0,42; kontrol grubunda ekspresyon
oranları 1,14±0,32 bulundu. Hastaların distal ve proksimal kolonlarından alınan
örneklerin metilasyon durumu ve ekpresyonları arasında SFRP2 geni için istatistiksel
olarak anlamlı bir fark bulunmadı. SFRP4 geni incelendiğinde hasta ve kontrollerin
proksimal kolon örneklerinde metilasyon durumunda istatistiksel olarak anlamlı bir fark
vardı (p=0,018) ve proksimal kolonda metilasyon azalmış görünüyordu. SFRP4 genin
hastaların distal ve proksimal kolonlarından alınan örneklerde metilasyon durumu ve
ekpresyon oranları arasında anlamlı bir ilişki gözlemlenmedi. SFRP5 geni için
hastaların distal kolonlarından alınan örneklerin metilasyon durumu ve ekpresyon
oranları arasında istatistiksel olarak anlamlı bir ilişki bulundu (p=0,015). Distal kolonda
SFRP5 geninin metilasyonu arttıkça ekspresyonunun azaldığı görüldü. APC2 geni için
hastaların distal kolonundan alınan örnekler ile kontrollerin metilasyon durumu arasında
istatistiksel olarak anlamlı bir fark vardı (p=0,018). Hastaların distal kolonunda
kontrollere göre metilasyon artmıştı. İnflamasyon durumu ile bu genlerin metilasyonu
ve ekspresyonu arasında istatistiksel olarak anlamlı bir ilişki bulunmadı.
İBH’da artmış mortalitenin asıl sebebi KRK’dır. Bu risk hastalığa maruziyet
süresiyle artmaktadır. Bu nedenle uzun süredir bu hastalığa sahip kişilere 1-3 yıl arayla
düzenli sürveyans kolonoskopileri önerilmektedir. Ancak İBH ilişkili karsinomların
kolonoskopide tanınması zordur ve displazi %90 güvenlikte bulmak için kolonoskopik
biyopsi sayısını 33 ve üzerine çıkarmak gerekmektedir. Sürveyansın etkinliğini
arttırmak için uzun süreli hastalıktan muzdarip hastalar arasında İBH ilişikili neoplastik
lezyonların erkenden saptanması için objektif ve güvenli moleküler belirteçlere büyük
52
ihtiyaç vardır. Kanser ilişkili genlerin DNA metilasyon bağımlı sessizleşmesi KRK’da
önemli ve erken bir bulgudur. p16, E-cadherin, hMLH1, p14, HPP1, ER vb gibi
genlerin kanser spesifik metilasyonları İBH ilişkili neoplazi durumunda (displazi ve
kanser) varolduğu bildirilmiştir (10-14). Normalde Wnt sinyal yolağı hücre dışında Wnt
ligandlarını bağlayan SFRP’ler, WIF1 ve LRP yüzey molekülünü bağlayan DKK ailesi
proteinleri tarafından inhibe edilir. Hücre içinde ise APC, aksin, GSK3 kompleksi
tarafından β-katenin degredasyonu ile hedef genlerin ekspresyonları inhibe edilir.
SFRP’ler, WIF1ve DKK proteinleri ve APC’nin promotor metilasyonu ile inaktive
olmaları sonucu kanser hücresinde Wnt sinyalinin aktivasyonu ve genlerin
ekspresyonları artar. APC promotor metilasyonu KRK’da sağ kolonda sol kolona göre
daha fazla bulunduğu ve hata tamir eksikliği de sağ kolonda daha fazla olduğu
bildirilmiştir (115). Prasad CP ve ark. (116) invaziv duktal karsinomda E-CD ve APC
protein kaybı ve β-katenin/Wnt sinyal yolağı aktivasyonu ile CDH1 ve APC promotor
metilasyonunun ilişkisini göstermişlerdir. Bu çalışmada APC1genin promotor
metilasyonu ve ekspresyonu arasında istatistiksel olarak anlamlı bir fark bulunmadı.
Tümörlerde hipermetilasyon ile inhibitör Wnt ligandları olan SFRP’lerin
susturulduğu bilinmektedir (117). SFRP2 metilasyon sıklığını kolorektal kanser (118)
ve Zou ve ark. (109) barret özafagusunda, karsinojenik transformasyon yoluyla
metilasyon sıklığının arttığı veya varolan özafagus kanserinde metilasyonlarının
arttığını bildirmişlerdir. Urakami S ve ark. (110) mesane tümörünün progresyonu ve
patogenezi ile ilgili çalışmada Wnt antagonist genleri SFRP1, SFRP2, SFRP4, ve
SFRP5, DKK3, ve WIF1 genleri metilasyon düzeylerini yüksek ve mesane tümöründe
MSP negatif gruba göre MSP pozitif grupta mRNA ekspresyon düzeyleri oldukça
yüksek bulmuşlardır.
promotor
Onların bu sonuçları mesane tümörünün patogenezini içeren
hipermetilasyonu
yoluyla
Wnt
antogonistlerinin
zayıflatılmasına neden olduğunu desteklemektedir.
fonksiyonlarının
Urakami S ve ark.’nın (110)
çalışmalarında idrar örneklerinden çıkan sonuçlar tümör doku DNA ile benzer ve
metilasyonun yüksek yüzdesini göstermiştir. Ayrıca normal olan kontrollerde idrar
DNA’sında %90’dan fazla anormal metilasyon olmadığını bulmuşlardır. Bu bulgular
(a)Wnt antagonist genlerinin metilasyonun bulunmasının makul ve güvenilir olduğu ve
(b) Wnt antagonist genlerinin idrar metilasyon skoru, mesane tümörü için mükemmel
bir noninvaziv tanı biyomarkırı olarak kullanılabileceğini göstermiştir. Sonuç olarak,
53
Wnt antagonist genlerinin hipermetilasyonu mesane tümörünün patogenezinde önemli
bir rol oynadığı ve mesane tümörlü hastaların idrarında kolaylıkla saptanabileceğini
bildirmişlerdir. Fakat Dulaimi ve ark. (119) sistitli hastaların idrar DNA’sında tümör
süpresör genler APC, RASSF1A, p14’ün metilasyon olmadığını gözlemlediklerini
bildirmişlerdir. Wang DR ve ark. (120) 2008’te yaptıkları çalışmada doku ve fekal
DNA SFRP2 geninin metilasyonu karşılaştırmışlar ve dokuda KRK’da % 92,1,
adenomda %74,3 ve hiperplastik polipte %53,8 ve aynı vakaların fekal örneklerinde
sırasıyla %87, %61,8 ve %42,3 hipermetillenmiş olduğunu bildirmişlerdir. Buna göre;
dışkı örneklerinden fekal DNA izole edildiğinde, SFRP2 geninin metilasyonu kolorektal
kanser için taramada moleküler bir biyomarkır olarak kullanılabileceğini bildirmişlerdir.
Suzuki H ve ark. (118) mutant β-katenin veya APC yoluyla Wnt sinyal
aktivasyonu
SFRP’lerin
aşırı
ekspresyonu
ile
kısmen
baskılanabileceğini
bildirmişlerdir. Cheng YY ve ark. (121) gastrik kanserde SFRP1, SFRP2, SFRP4 ve
SFRP5 mRNA ekspresyon düzeyleri ve metilasyon durumlarını çalışmışlar ve
bunlardan sadece SFRP2’nin gastrik kanserde sessizleştiğini ve metillendiğini
bulmuşlardır. SFRP2 promotor metilasyonunu özellikle gastrik kanserde mRNA
ekspresyonu düşük veya yokluğu ile ilişkili bulmuşlardır. Ayrıca gastrik kanser hücre
hatlarını demetilleyici ajan 5-aza-20-deoksisistidin ile tedaviden sonra SFRP2
ekspresyonunun geri döndüğünü teyit etmişler ve bu da SFRP2 promotor bölgesinin
hipermetilasyonunun gastrik kanserde SFRP2 transkripsiyonel sessizleşmesi için kritik
olabileceğini göstermiştir. Hipermetilasyon mide kanserinde %73,3, intestinal
metaplazide %37,5 ve komşu kanser dışı dokularda %20 olarak bulmuşlardır. Bu
nedenle SFRP2 ‘deki epigenetik değişiklikler malign transformasyona yol açan önemli
bir mekanizma olduğunu mide kanseri olmayan hastalarda bile pre-neoplastik evrede
olduğunu destekler. Bu veriler birlikte ele alındığında bir tümör süpresör gen olarak
SFRP2’nin gastrik kanserde etkisi olduğunu ve sessizleşmesi tümör büyüme ve
genişlemesini arttırabileceğini göstermişlerdir (121). Takagi H ve ark. (122) karaciğer
kanser hücre hatlarında SFRP4’ün daha az sıklıkla metillendiğini SFRP1, SFRP2 ve
SFRP5’in ise daha fazla metillendiğini göstermişlerdir. Ayrıca RT-PCR analizi ile
metillenmiş hücre hatlarında SFRP1, SFRP2 ve SFRP5 kayıp ya da downregüle
olduğunu ve bir DNA metil inhibitörü 5-aza-20-deoksisistidin ile tedaviden sonra
ekspresyonların düzeldiğini göstermişlerdir. SFRP genlerini hepatosüllüler kanserde
54
(HSK) epigenetik sessizleşmesinin yaygın bir bulgu olduğunu bildirmişlerdir. Ayrıca,
SFRP’lerin
metilasyonu
hepatokarsinogenezlerde
preneoplastik
bu
metilasyonun
lezyonlarda
sık
oldukça
erken
görüldüğünü
evrede
ve
çıktığını
bildirmişlerdir. Viral enfeksiyonlarla ilişkilendirilmiş siroz ve kronik hepatitin
preneoplastik lezyonlar olduğu düşünülmektedir. SFRP genlerinin metilasyonu ve viral
enfeksiyonlar arasındaki mekanik bağlantıyı açıklamak için daha fazla çalışmaya ihtiyaç
olmasına rağmen metilasyonun tespiti HSK gelişimi yüksek riskli hastaların takibi için
yararlı moleküler markır olabileceğini bildirmişlerdir (122).
Biz de yaptığımız çalışmada SFRP2 genin ekspresyonunu distal kolon
örneklerinde hasta grubu ile kontrol grubu arasında istatistiksel olarak anlamlı olmayan
bir fark gözlemledik (distal SFRP2 hasta 1,391±0,424; distal SFRP2 kontrol
1,145±0,319). Hastaların ve kontrollerin distal kolonlarından alınan örneklerin SFRP2
geni için metilasyon durumu arasında istatistiksel olarak anlamlı bir ilişki
bulunmamıştır (p=0,385). SFRP4 genini incelendiğimizde ise hasta ve kontrollerin
proksimal kolon örneklerinde metilasyon durumunda istatistiksel olarak anlamlı bir fark
vardı (p=0,018) ve hastaların proksimal kolon örneklerinde kontrollere göre metilasyon
azalmış görünüyordu. SFRP4 genin hastaların distal kolonlarından alınan örneklerin
metilasyon durumu ve ekpresyonları arasında ise anlamlı ilişki saptanmamıştır. SFRP5
geni için hastaların distal kolonlarından alınan örneklerin metilasyon durumu ve
ekpresyonları arasında istatistiksel olarak anlamlı bir ilişki gözlemlenmiştir (p=0,015).
Distal kolonda SFRP5 metilasyonu arttıkça ekspresyonun azaldığı gözlemlenmiştir.
Distal kolonda hasta ve kontrollerin metilasyon durumlarının APC2 geni için
karşılaştırıldığında anlamlı bir fark bulunmuştur (p=0,018). Hasta grubunda kontrol
grubuna göre metilasyon daha fazla olduğu gözlemlenmiştir.
İnflamasyon mikrobiyal infeksiyonlarda, alerjenlere ve toksik kimyasallara
maruziyetle, otoimmün hastalıkla ve obezite içeren birçok etkenle ortaya çıkabilir.
Dengeli bir inflamatuvar yanıtın antitümorejenik etkisi olabilir; ancak devam eden veya
kronik inflamatuvar yanıt, immün yanıt artık bozulmuş olduğundan genellikle zararlı
hale gelmektedir. Kronik inflamasyonla kanser arasındaki nedensel ilişki oldukça iyi
bilinmektedir ve gastrointestinal kanalın birçok kronik olarak inflame organı bu ilişkiyi
gösterir. Buna inflamatuvar barsak hastalığı iyi bir örnek olup genel nüfüsa göre
55
kolorektal kanser riski 2-3 kat artmıştır. Kolit ilişkili kanserin çok yönlü olduğu
düşünülmektedir ve muhtemelen genetik faktörlerin, çevresel faktörlerin, hastalığın
süresinin, yaygınlığın ve şiddetinin kombinasyonu kolit ilişkili kanserin gelişimine
katkıda bulunduğu düşünülmektedir. Son zamanlarda DNA metilasyonundaki özel
değişikliklerin; epigenetik değişiklikler, inflamasyon sırasında ve inflamasyon ilişkili
kanser sırasında meydana geldiği bildirilmiştir. Mukozal inflamasyonun global
metabolik sonuçlarının incelendiği bir çalışmada hücresel metilasyon reaksiyonları ile
ilişkili spesifik metabolit düzeylerinin inflamasyona yanıtta belirgin olarak değiştiği,
ayrıca tüm hücresel metilasyonun kilit enzimlerinin ekspresyonunun arttığı da
gösterilmiştir. (123). Hücresel metilasyonun inhibisyonu hastalık alevlenmesiyle
sonuçlanmıştır ve metilasyonu uyaran folat idamesi kolitin kısmen iyileşmesi ile
sonuçlanmıştır.
Tüm
metilasyondaki
global
bu
bulgular
değerlendirildiğinde
değişiklikleri
gösteren bu
inflamasyon
sonuçlar
sırasında
mukozal epitelde
metilasyonun koruyucu bir rolü olduğu anlamına gelir. Folatın yararlı etkisi
metilasyonun global kaybının önlenmesi ve inflamasyonun baskılaması yeteneği
nedeniyle olduğu düşünülmektedir. (124).
İBH ilişkili neoplazide Wnt sinyal yolağının ilk epigenetik katılımının
gösterildiği bir çalışmada Wnt sinyal yolağının genlerin metilasyonu uzun süredir IBH
kolitli olan hastalarda daha önce başladığı ve IBH ilişkili neoplazi geliştirilmesi
sırasında kademeli olarak bu genlerin metilasyonunun arttığı bulunmuştur (98). Dhir M
ve ark.’nın (98) yaptığı çalışmada %29’u metillenen SFRP2 ve %7’si metillenen WIF1
hariç tüm genler için metilenmeme normal kolon örnekleri ile eşit bulunmuştur. Tüm
Wnt sinyal yolağının genlerinin (LKB1 hariç) metilasyonunun İBH ilişkili kolit ve İBH
ilişkisiz neoplazili örneklerde sık görüldüğü bildirilmişitr. İBH kolitli örneklerde
görülen Wnt sinyal yolağının genlerinin metilasyonun sıklığı normal kolonda da
görülenden anlamlı olarak daha yüksek bulunduğu fakat SFRP2’de fark istatistiksel
olarak anlamlı bulunmadığı bildirilmiştir (98). Ayrıca Wnt sinyal yolağı genlerin (tüm
İBH ilişkili neoplazilerde unmetile olan LKB1 hariç) metilasyon sıklığı İBH kolit
örnekler
ile
karşılaştırıldığında
İBH
ilişkili
neoplazili
örneklerde
arttığı
gösterilmişlerdir. APC1A, APC2, SFRP1 ve SFRP2’nin metilasyonu İBH kolit ile
karşılaştırıldığında İBH ilişkili neoplazide anlamlı olarak yüksek bulmuşlar (sırasıyla
APC1A %43.8 ile %16.0, p=0.05; APC2 %81.3-%48.0, p=0.03; SFRP1 %87.5-%54.1,
56
p=0.03 ve SFRP2 %86.7-%52.0, p=0.03). Ayrıca tüm Wnt sinyal yolağı genlerinin
metilasyonunu İBH ilişkili kanserlerle uyan evrede (Evre 1 ve 2) olan 24 sporadik KRK
de test edilmişler ve sporadik KRK’de görülen Wnt sinyal yolağındaki genlerin
metilasyon sıklığı SFRP4 ve WIF1 dışında İBH ile ilişkili neoplaziler (displazileri ve
kanser dahil) görülenlere benzer bulunmuştur. SFRP4’ün, sporadik KRK’lere (%37,5)
göre İBH ilişkili kanserlerde (%81,3) önemli ölçüde daha fazla metillendiğini
göstermişlerdir. Aksine WIF1 İBH ile ilişkili neoplazilere (%68,8) göre sporadik
KRK’lerde (%100) önemli ölçüde daha fazla metillenmiş olduğunu bulmuşlardır (98).
Bizim çalışmamızda gözlemlediğimiz SFRP4’ün metilasyonunun azaldığı bulgusu Dhir
M ve ark.’nın (98) bulgusu ile benzer değil iken Takagi ve ark.'nın (122) karaciğer
kanser hücre hatlarında SFRP4’ün daha az sıklıkla metillendiği bulgusu ile benzerdir.
Erken dönemdeki bu metilasyon değişikliklerinin malignite riski açısından ne ifade
ettiğini söyleyebilmek çalışma
grubumuzdaki prenoplastik/neoplastik olguların
olmaması nedeniyle mümkün değildir. Yine aynı çalışmada (98)
İBH ile ilişkili
displazide APC2, SFRP1, SFRP2 ve APC1A’in erken metilasyon bulguları bu
lezyonların tanısında daha güvenilir bir belirteç olabileceği bildirilmiştir. Aslında, düşük
dereceli displazi ve yüksek dereceli displazi olan tüm hastalar displazi için bir belirteç
olarak kullanılabileceği düşünülen APC2 %100 metilasyon gösterdiği de bulunmuştur.
Çalışmamızda APC2 geni için hastalar ile kontrollerin distal kolonlarında metilasyon
durumu arasında istatistiksel olarak anlamlı bir fark vardı ve İBH’lı hastalarda
metilasyonun arttığı gösterilmiştir. APC2, yakın zamanlarda tanımlanmış, APC1A ile
yüksek homolojisi gösteren bir gendir (125) APC2’nin, APC1A gibi Wnt sinyalini
modüle de edebileceği bildirilmiştir (125, 126). APC1A da mutasyonlar dışında İBH ile
ilişkili neoplazilerde diğer tümör baskılayıcı gen olan p53’ün mutasyonunun
zamanlaması ve sıklığı arasında farklılık gösterir. P53 mutasyonları sporadik KRK’de
geç ortaya çıkar. p53 mutasyonları İBH ilişkili neoplazi de erken ve daha sık görülürken
kanserler adenomlarla karşılaştırıldığında daha sık görülür. Düşük dereceli displazilere
benzer erken lezyonlar ülseratif kolit ve hatta bazen displastik olmayan mukozada P53
mutasyonuna sahip olabilir (73,75). İlginç bir şekilde, APC2 bir anti-apoptotik gen Bcl2
ve p53 ile sırayla etkileşen 53BP2 bir protein ile etkileşimi gösterilmiştir. Bu hücre
döngüsü sürecinin ve hücre ölümünün p53/Bcl2-bağımlı yolakta APC2’nin işlevsel bir
rolünü düşündürmektedir (127). İBH ile ilişkili neoplazi incelendiğinde ise P53 yolağı
57
ile APC2’nin etkileşimi çok ilginçtir. Erken displastik lezyonlar P53 mutasyonu ve Bcl2
aşırı ekspresyonunun yüksek seviyesini gösterir (74,75,128). Benzer şekilde, APC2’nin
inflame kolon lezyonlarında yüksek seviyelerde metile olduğunu bulunmuştur. Bizim
çalışmamızda da APC2’i inflame kolon da metillenmiş olarak bulundu. Fakat çalışma
grubumuzda
preneoplastik,
neoplastik
lezyon
olmadığından
dolayı
neoplazi
gelişimindeki rolü hakkında bir yorum yapmak zordur.
Bu
nedenle,
APC2
metilasyonu,
p53
mutasyonunun
ve
Bcl2
aşırı
ekspresyonunun bu lezyonların patogenezinde sinerjik bir rol oynayabiliceği
düşünülmektedir. Bu, bulgunun daha fazla araştırılması gerektirmektedir.
58
6. SONUÇLAR ve ÖNERİLER
1. Wnt sinyal yolağı genlerinin metilasyonu ÜK hastalarında bildirilmiştir. Wnt
sinyal yolağı genlerinin metilasyon sıklığının İBH ilişkili neoplazi gelişimi
sırasında arttığını bildiren çalışmalar olmakla birlikte bizim çalışmamızda
preneoplastik lezyon ve neoplazi olmaması nedeniyle böyle bir ilişkiyi
çalışalamadı.
2. İBH ile ilişkili inflamasyonda, APC2’nin artmış metilasyon bulguları ve
SFRP5’in metilasyon artışı ile ekspreyonunun azalması ve SFRP4’de metilasyon
azlığının ÜK’te inflamasyona eşlik ettiği bulgusunun kolit ile ilişkili neoplazinin
erken tespitinde kullanılabilecek yöntem ve objektif belirteç sağlayıp
sağlayamayacağının araştırılması gerekimektedir.
3. Mevcut bulguların immünohistokimyasal çalışmalarlada da desteklenmesi
bulguların değerini daha da arttıracaktır.
4. İBH’da KRK’in önlenmesi için stratejiler patoloğun uzmanlığından bağımsız
olan displazi ve kanser için objektif belirteçlerin eklenmesi ile güçlendirilebilir.
59
7. KAYNAKLAR
1.
Ekbom A, Helmick C, Zack M, Adami HO. Ulcerative colitis and colorectal cancer: a
population-based study. N Engl J Med 1990;323:1228-1233.
2.
Langholz E, Munkholm P, Davidsen M, Binder V. Colorectal cancer risk and mortality in
patient with ulcerative colitis. Gastroenteology 1992;103:1444-1451.
3.
Eaden JA, Abrams KR, Mayberry JF. The risk of colorectal cancer in ulcerative colitis: a
meta-analysis. Gut 2001;48(4):526–535.
4.
Riddell RH, Goldman H, Ransohoff DF, Appelman HD, Fenoglio CM, Haggitt RC, Ahren
C, Correa P, Hamilton SR, Morson BC, Sommers SC, Yardley JH. Dysplasia in inflammotory bowel
disease: standardized classification with provisional clinical applications. Hum Pathol 1983;14:931-968.
5.
Kornbluth A, Sachar DB. Practice Parameters Committee of the American College of
Gastroenterology: Ulcerative colitis practice guidelines in adults (update): American College of
Gastroenterology, Practice Parameters Committee. Am J Gastroenterol 2004;99:1371-1385.
6.
Farrell RJ, Peppercorn MA. Ulcerative colitis. Lancet 2002;359(9303):331–340.
7.
Baylin SB, Herman JG. DNA hypermethylation in tumorigenesis: epigenetics joins genetics.
Trends Genet 2000;16(4):168–174.
8.
Baylin SB. DNA methylation and gene silencing in cancer. Nat Clin Pract Oncol 2005;2(Suppl
1):S4–S11.
9.
Herman JG, Baylin SB. Gene silencing in cancer in association with promoter
hypermethylation. N Engl J Med 2003;349(21):2042–2054.
10.
Azarschab P, Porschen R, Gregor M, Blin N, Holzmann K. Epigenetic control of the Ecadherin gene (CDH1) by CpG methylation in colectomy samples of patients with ulcerative colitis.
Genes Chromosomes Cancer 2002;35(2):121–126.
11.
Fleisher AS, Esteller M, Harpaz N, Leytin A, Rashid A, Xu Y, Liang J, Stine OC, Yin J,
Zou TT, Abraham JM, Kong D, Wilson KT, James SP, Herman JG, Meltzer SJ. Microsatellite
instability in inflammatory bowel disease-associated neoplastic lesions is associated with
hypermethylation and diminished expression of the DNA mismatch repair gene, hMLH1. Cancer Res
2000;60(17):4864–4868.
60
12.
Hsieh CJ, Klump B, Holzmann K, Borchard F, Gregor M, Porschen R. Hypermethylation of
the p16INK4a promoter in colectomy specimens of patients with long-standing and extensive ulcerative
colitis. Cancer Res 1998;58(17):3942–3945.
13.
Issa JP, Ahuja N, Toyota M, Bronner MP, Brentnall TA. Accelerated age-related CpG island
methylation in ulcerative colitis. Cancer Res 2001;61(9):3573–3577.
14.
Moriyama T, Matsumoto T, Nakamura S, Jo Y, Mibu R, Yao T, Iida M. Hypermethylation
of p14 (ARF) may be predictive of colitic cancer in patients with ulcerative colitis. Dis Colon Rectum
2007;50(9):1384–1392.
15.
de Lau W, Barker N, Clevers H. WNT signaling in the normal intestine and colorectal cancer.
Front Biosci 2007;12:471–491.
16.
Pinto D, Clevers H. Wnt control of stem cells and differentiation in the intestinal epithelium.
Exp Cell Res 2005;306(2):357–363.
17.
Miyoshi Y, Nagase H, Ando H, Horii A, Ichii S, Nakatsuru S, Aoki T, Miki Y, Mori T,
Nakamura Y. Somatic mutations of the APC gene in colorectal tumors: mutation cluster region in the
APC gene. Hum Mol Genet 1992;1(4):229–233.
18.
932.
Potter JD. Colorectal cancer: molecules and populations. J Natl Cancer Inst 1999;91(11):916–
19.
Cadigan KM, Nusse R. Wnt signaling: a common theme in animal development. Genes Dev
1997;11(24):3286–3305.
20.
Klingensmith J, Nusse R, Perrimon N. The Drosophila segment polarity gene dishevelled
encodes a novel protein required for response to the wingless signal. Genes Dev 1994;8(1):118–130.
21.
Behrens J, von Kries JP, Kuhl M, Bruhn L, Wedlich D, Grosschedl R, Birchmeier W.
Functional interaction of beta-catenin with the transcription factor LEF-1. Nature 1996;382(6592):638–
642.
22.
He TC, Sparks AB, Rago C, Hermeking H, Zawel L, da Costa LT, Morin PJ, Vogelstein B,
Kinzler KW. Identification of c-MYC as a target of the APC pathway. Science 1998;281(5382):1509–
1512.
61
23.
Howe LR, Subbaramaiah K, Chung WJ, Dannenberg AJ, Brown AM. Transcriptional
activation of cyclooxygenase-2 in Wnt-1-transformed mouse mammary epithelial cells. Cancer Res
1999;59(7):1572–1577.
24.
Stutman M, Zhurinsky J, Simcha I, Albanese C, D’Amico M, Pestell R, Ben-Ze'ev A. The
cyclin D1 gene is a target of the beta-catenin/LEF-1 pathway. Proc Natl Acad Sci USA
1999;96(10):5522-5527.
25.
Bafico A, Gazit A, Pramila T, Finch PW, Yaniv A, Aaronson SA. Interaction of frizzled
related protein (FRP) with Wnt ligands and the frizzled receptor suggests alternative mechanisms for FRP
inhibition of Wnt signaling. J Biol chem 1999;274(23):16180-16187.
26.
Zorn AM. WNT signaling: antagonistic Dickkopfs. Curr Biol 2001;11(15):R592-R595.
27.
Tarmin L, Yin J, Harpaz N, Kozam M, J, Noordzij Antonio LB, Jiang HY, Chan O,
Cymes K, Meltzer SJ. Adenomatous polyposis coli gene mutations in ulcerative colitis-associated
dysplasias and cancers versus sporadic colon neoplasms. Cancer res 1995;55(10)2035-2038.
28.
You J, Nguyen Av, albers CG, Lin F, Holcombe RF. Wnt pathway-related gene expression in
inflammatory bowel disease. Dig Dis Sci 2008;53(4):1013-1019.
29.
You XJ, Bryant PJ, Jurnak F, Holcombe RF. Expression of Wnt pathway components
frizzled and disheveled in colon cancer arising in patients with inflammatory bowel disease. Oncol rep
2007;18(3):691-694.
30.
van Dekken H, Wink JC, Vissers KJ, Franken PF, Ruud Schouten W, Hop WCJ, Kuipers
EJ, Fodde R, Janneke van der Woude C. Wnt pathway-related gene expresion during malignant
progression in ulcerative colitis. Acta Histochem 2007;109(4):266-272.
31.
Aust DE, Terdiman JP, Willenbucher RF, Chang CG, Molinaro-Clark A, Baretton GB,
Loehrs U, Waldman FM. The APC/beta catenin pathway in ulcerative colitis related colorectal
carcinomas: a mutational analysis. Cancer 2002;94(5):1421-1427.
32.
Aust DE, Terdiman JP, Willenbucher RF, Chew K, Ferrell L, Florendo C, Molinaro-Clark
A, Baretton GB, Löhrs U, Waldman FM. Altered distribution of beta-catenin, and its binding proteins
E-cadherin and APC, in ulcerative colitis related colorectal cancers. Mod Pathol 2002;14(1):29-39.
33.
Feoglio-Preiser CM, Noffsinger AE, Stemmermann GN, Lantz PE, Listrom MB, Rilke FO.
Inflamatory Bowel Disease. In: Norvi el M, ed. Gastrointestinal Pathology An Atlas and Text. 2nd ed.
Philadelphia: Lippincott Williams & Wilkins; 1999. p.659-716.
62
34.
Rosai J. Colitis. In: Houston M, ed. Rosai and Ackerman’s Surgical Pathology. 9th ed. Philadelhia: Elsevier; 2004. p.782-8.
35.
Owen DA, Kelly JK. Disease of the large bowel. In: Owen DA, Kelly JK, eds. Atlas of
Gastrointestinal Pathology. 1st ed. Philadelphia: W.B. Saunders Company; 1994. p.141-2
36.
Judge TA, Lichtenstein GR Inflammatory Bowel Disease. In: Friedman SL, McQuaid KR,
Grendell JH, eds. Current diagnosis and treatment in gastroenterology. 2nd ed. New York; Lange
Medical Boks/McGraw- Hill: 2003. p.108-30.
37.
Ming S, Goldman H. Ulcerative colitis and Crohn’s Disease. In: Ming S, Goldman H, eds.
Pathology of the Gastrointestinal Tract. 1st ed. Philadelphia: W.B. Saunders Company; 1992.p.643-63.
38.
Odze R. Diagnostic problems and advances in inflammatory bowel disease. Mod Pathol
2003;16(4):347-58.
39.
Özin YÖ, Ülker A. İnflamatuvar bağırsak hastalıkları. In: Özden A, Şahin B, Yılmaz U, Soykan
İ, eds. Gastroentereloji. 1. baskı, İstanbul, Fersa Matbaacılık Ltd. Şti. 2002. p.283-7.
40.
Sinclair TS, Brunt PW, Mowat NA. Nonspecific proctocolitis in northeastern Scot land: a
community study. Gastroenterology 1983;85 (1):1-11.
41.
315
Edwards Fc and Truelo SC. The Course And Prognosis of Ulcerative Colitis. Gut 1963;4:299-
42.
Tözün N, Altuğ Ö. İltihabi Barsak Hastalıkları. In: Memik F, ed. Klinik Gastroenteroloji.
1.baskı, İstanbul, Nobel Tıp Kitapevleri Ltd Şti. Nobel Güneş tıp kitapevi. 2004. p.448-61.
43.
Su C, Lichtenstein GR. Ulcerative Colitis. In: Feldman M, Friedman LS, Brandt LJ. Sleisenger
MH, eds. Sleisenger Ford tran’s Gastrointestinal and liver disease. 8th ed. Philadelphia; Saunders
Elseiver: 2006. p.2499-548.
44.
Silverberg SG, Delellis RA, Frable WJ. Non-Neoplastic Diseases of the Small and Large
Intestine. In: Silverberg SG, Delellis RA, Frable WJ, eds. Principles and Practice of Surgical Pathology
and Cyto pathology. 3rd ed. New York: Churchill Living stone; 1997. p.1780-3.
45.
Dixon MF, Brown LJ, Gilmour HM, Price AB, Smeeton NC, Talbot IC, Williams GT.
Observer variation in the assessment of dysplasia in ulcerative colitis. Histopathology. 1988
Oct;13(4):385-97.
63
46.
Sharan R, Schoen RE. Cancer in inflammatory bowel disease. An evidence-based analysis and
guide for physicians and patients. Gastroenterol Clin North Am 2002;31(1):237-54.
47.
Eaden JA, Mayberry JF. Colorectal cancer complicating ulcerative colitis: a review. Am J
Gastroenterol 2000;95(10):2710-9
48.
Greenstein AJ, Sachar DB, Smith H, Pucillo A, Papatestas AE, Kreel I, Geller SA,
Janowitz HD, Aufses AH Jr. Cancer in universal and left-sided ulcerative colitis: factors determining
risk. Gastroenterology 1979; 77(2):290-4.
49.
Mir-Madjlessi SH, Farmer RG, Easley KA, Beck GJ. Colorectal and extra colonic
malignancy in ulcerative colitis. Cancer 1986;58(7):1569-74.
50.
Prior P, Gyde SN, Macartney JC, Thompson H, Water house JA, Allan RN. Cancer
morbidity in ulcerative colitis. Gut 1982;23(6):490-7.
51.
Bernstein CN, Blanchard JF, Kliewer E, Wajda A. Cancer risk in patients with inflammatory
bowel disease: a populati on-based study. Cancer 2001;91(4):854-62.
52.
Hendriksen C, Kreiner S, Binder V. Longterm prognosis in ulcerative colitis-based on results
from a regional patient group from the county of Copenhagen. Gut 1985;26(2):158-63.
53.
Stonnington CM, Phillips SF, Zinsmeister AR, Melton LJ 3rd. Prognosis of chronic
ulcerative colitis in a community. Gut 1987;28(10):1261-6.
54.
Mellemkjaer L, Olsen JH, Frisch M, Johansen C, Gridley G, McLaughlin JK. Cancer in
patients with ulcerative colitis. Int J Cancer 1995;60(3):330-3.
55.
Gilat T, Fireman Z, Grossman A, Hacohen D, Kadish U, Ron E, Rozen P, Lilos P.
Colorectal cancer in patients with ulcerative colitis. A population study in central Israel.
Gastroenterology 1988;94(4):870-7.
56.
Karlén P, Löfberg R, Broström O, Leijonmarck CE, Hellers G, Persson PG. Increased risk
of cancer in ulcerative colitis: a populati on-based cohort study. Am J Gastroenterol; 1999;94(4):1047-52.
57.
Shetty K, Rybicki L, Brzezinski A, Carey WD, Lashner BA. The risk for cancer or dysplasia
in ulcerative colitis patients with primary sclerosing cholangitis. Am J Gastroenterol 1999;94(6):1643-9.
64
58.
Fuchs CS, Giovannucci EL, Colditz GA, Hunter DJ, Speizer FE, Willett WC. A prospective
study of family history and the risk of colorectal cancer. N Engl J Med 1994;331(25):1669-74.
59.
Schoen RE. Families at risk for colorectal cancer:risk assessment and genetic testing. J Clin
Gastroenterol 2000;31(2):114-2.
60.
UllmanTA, Itzkowitz
2011;140:1807–1816.
SH.
Intestinal
Inflammation
and
Cancer.
Gastroenterology
61.
Farraye FA, Odze RD, Eaden J, Itzkowitz SH. AGA technical review on the diagnosis and
management of colorectal neoplasia in inflammatory bowel disease. Gastroenterology 2010;138:746–
774.
62.
Itzkowitz SH, Yio X. Inflammation and cancer IV. Colorectal cancer in inflammatory bowel
disease: the role of inflammation. Am J Physiol Gastrointest Liver Physiol 2004;287:G7–G17.
63.
Eaden J, Abrams K, Ekbom A, Jackson E, Mayberry J.. Colorectal cancer prevention in
ulcerative colitis: a case-control study. Aliment Pharmacol Ther 2000;14:145–153.
64.
Pinczowski D, Ekbom A, Baron J, Yuen J, Adami HO. Risk factors for colorectal cancer in
patients with ulcerative colitis: a case-control study. Gastroenterology 1994;107:117–120.
65.
Rutter M, Saunders B, Wilkinson K, Rumbles S, Schofield G, Kamm M, Williams C, Price
A, Talbot I, Forbes A. Severity of inflammation is a risk factor for colorectal neoplasia in ulcerative
colitis. Gastroenterology 2004;126:451–459.
66.
Gupta RB, Harpaz N, Itzkowitz S, Hossain S, Matula S, Kornbluth A, Bodian C, Ullman T.
Histologic inflammation is a risk factor for progression to colorectal neoplasia in ulcerative colitis: a
cohort study. Gastroenterology 2007;133:1099–1105.
67.
Mathy C, Schneider K, Chen YY, Varma M, Terdiman JP, Mahadevan U. Gross versus
microscopic pancolitis and the occurrence of neoplasia in ulcerative colitis. Inflamm Bowel Dis
2003;9:351–355.
68.
Rubin CE, Haggitt RC, Burmer GC, Brentnall TA, Stevens AC, Levine DS, Dean PJ,
Kimmey M, Perera DR, Rabinovitch PS. DNA aneuploidy in colonic biopsies predicts future
development of dysplasia in ulcerative colitis. Gastroenterology 1992;103:1611–1620.
65
69.
Itzkowitz SH. Molecular biology of dysplasia and cancer in inflammatory bowel disease.
Gastroenterol Clin North Am 2006;35: 553–571.
70.
Willenbucher RF, Aust DE, Chang CG, Zelman SJ, Ferrell LD, Moore DH 2nd, Waldman
FM.. Genomic instability is an early event during the progression pathway of ulcerativecolitis-related
neoplasia. Am J Pathol 1999;154:1825–1830.
71.
Redston MS, Papadopoulos N, Caldas C, Kinzler KW, Kern SE. Common occurrence of
APC and K-ras gene mutations in the spectrum of colitis-associated neoplasias. Gastroenterology
1995;108:383–392.
72.
Umetani N, Sasaki S, Watanabe T, Shinozaki M, Matsuda K, Ishigami H, Ueda E, Muto T.
Genetic alterations in ulcerative colitis-associated neoplasia focusing on APC, K-ras gene and
microsatellite instability. Jpn J Cancer Res 1999;90: 1081–1087.
73.
Burmer GC, Rabinovitch PS, Haggitt RC, Crispin DA, Brentnall TA, Kolli VR, Stevens
AC, Rubin CE. Neoplastic progression in ulcerative colitis: histology, DNA content, and loss of a p53
allele. Gastroenterology 1992;103:1602–1610.
74.
Yin J, Harpaz N, Tong Y, Huang Y, Laurin J, Greenwald BD, Hontanosas M, Newkirk C,
Meltzer SJ. p53 point mutations in dysplastic and cancerous ulcerative colitis lesions. Gastroenterology
1993;104:1633–1639.
75.
Brentnall TA, Crispin DA, Rabinovitch PS, Haggitt RC, Rubin CE, Stevens AC, Burmer
GC. Mutations in the p53 gene: an early marker of neoplastic progression in ulcerative colitis.
Gastroenterology 1994;107:369–378.
76.
Hussain SP, Amstad P, Raja K, Ambs S, Nagashima M, Bennett WP, Shields PG, Ham AJ,
Swenberg JA, Marrogi AJ, Harris CC. Increased p53 mutation load in noncancerous colon tissue from
ulcerative colitis: a cancer-prone chronic inflammatory disease. Cancer Res 2000;60:3333–3337.
77.
Sato F, Harpaz N, Shibata D, Xu Y, Yin J, Mori Y, Zou TT, Wang S, Desai K, Leytin A,
Selaru FM, Abraham JM, Meltzer SJ. Hypermethylation of the p14(ARF) gene in ulcerative colitisassociated colorectal carcinogenesis. Cancer Res 2002;62:1148–1151.
78.
Kohonen-Corish MR, Daniel JJ, te Riele H, Buffinton GD, Dahlstrom JE. Susceptibility of
Msh2-deficient mice to inflammation-associated colorectal tumors. Cancer Res 2002;62:2092–2097.
66
79.
Cooper HS, Everley L, Chang WC, Pfeiffer G, Lee B, Murthy S, Clapper ML. The role of
mutant Apc in the development of dysplasia and cancer in the mouse model of dextran sulfate sodiuminduced colitis. Gastroenterology 2001; 121:1407–1416.
80.
Barker N, Ridgway RA, van Es JH, van de Wetering M, Begthel H, van den Born M,
Danenberg E, Clarke AR, Sansom OJ, Clevers H. Crypt stem cells as the cells-of-origin of intestinal
cancer. Nature 2009;457:608–612.
81.
Qiu W, Wang X, Leibowitz B, Liu H, Barker N, Okada H, Oue N, Yasui W, Clevers H,
Schoen RE, Yu J, Zhang L. Chemoprevention by nonsteroidal anti-inflammatory drugs eliminates
oncogenic intestinal stem cells via SMAC-dependent apoptosis. Proc Natl Acad Sci USA
2010;107:20027–20032.
82.
Shaker A, Rubin DC. Intestinal stem cells and epithelial-mesenchymal interactions in the crypt
and stem cell niche. Transl Res 2010;156:180–187.
83.
Shaker A, Swietlicki EA, Wang L, Jiang S, Onal B, Bala S, DeSchryver K, Newberry R,
Levin MS, Rubin DC. Epimorphin deletion protects mice from inflammation-induced colon
carcinogenesis and alters stem cell niche myofibroblast secretion. J Clin Invest 2010;120:2081–2093.
84.
Wolffe AP, Matzke MA. Epigenetics: regulation through repression. Science (Wash. DC),
1999;286: 481–486.
85.
Kass SU, Wolffe AP. DNA methylation, nucleosomes and the inheritance of chromatin structure
and function. Novartis Found. Symp. 1998;214: 22–35.
86.
Jones PA, Laird PW. Cancer epigenetics comes of age. Nat. Genet. 1999;21:163–167.
87.
Logan CY, Nusse R. The Wnt signaling pathway in development and disease. Annu. Rev. Cell
Dev. Biol. 2004;,20: 781–810.
88.
MacDonald BT, Tamai K, He X. Wnt/beta-catenin signaling: components, mechanisms, and
diseases. Dev. Cell. 2009;17(1): 9–26.
89.
Clevers H. Wnt/beta-catenin signaling in development and disease. Cell. 2006; 127:469–480.
90.
Polakis P. The many ways of Wnt in cancer. Curr. Opin. Genet. Dev. 2007;17:45–51.
67
91.
He X, Saint-Jeannet JP, Wang Y, Nathans J, Dawid I, Varmus H. A member of the Frizzled
protein family mediating axis induction by Wnt-5A. Science. 1997; 275:1652–1654.
92.
Mikels AJ, Nusse R. Purified Wnt5a protein activates or inhibits beta-catenin-TCF signaling
depending on receptor context. PLoS Biol. 2006;4(4):115.
93.
Verkaar F, Blankesteijn WM, Smits JF, Zaman GJ. Beta-Galactosidase enzyme fragment
complementation for the measurement of Wnt/β-catenin signaling. FASEB J. 2010;24:1205–1217.
94.
Verkaar F, Zaman GJ. A model for signaling specificity of Wnt/Frizzled combinations through
co-receptor recruitment. FEBS Lett. 2010;584: 3850–3854.
95.
van Amerongen R, Nusse R. Towards an integrated view of Wnt signaling in development.
Development. 2009;136:3205–3214.
96.
Angers S, Moon RT. Proximal events in Wnt signal transduction. Nat.Rev. Mol. Cell Biol.
2009;10:468–477.
97.
Hoeppner LH, Secreto FJ, Westendorf JJ. Wnt signaling as a therapeutic target for bone
diseases. Exp. Opin. Ther. Targets. 2009;13 (4): 485–496.
98.
Dhir M, Montgomery EA, Glöckner SC, Schuebel KE, Hooker CM, Herman JG, Baylin
SB, Gearhart SL, Ahuja N. Epigenetic regulation of WNT signaling pathway genes in inflammatory
bowel disease (IBD) associated neoplasia. J Gastrointest Surg. 2008;12(10):1745-53.
99.
Rubinfeld B, Souza B, Albert I, Müller O, Chamberlain SH, Masiarz FR, Munemitsu S,
Polakis P. Association of the APC gene product with beta-catenin. Science. 1993;262: 1731–1734.
100.
Barker N, Clevers H. Mining the Wnt pathway for cancer therapeutics. Nat. Rev. Drug Discov.
2006; 5: 997–1014.
101.
Hovanes K, Li TW, Munguia JE, Truong T, Milovanovic T,Lawrence Marsh J, Holcombe
RF, Waterman ML. Beta-catenin-sensitive isoforms of lymphoid enhancer factor-1 are selectively
expressed in colon cancer. Nat Genet 2001;28:53–57.
102.
Holcombe RF, Marsh JL, Waterman ML, Lin F, Milovanovic T, Truong T. Expression of
Wnt ligands and frizzled receptors in colonic mucosa and in colon carcinoma. Mol Pathol. 2002; 55:220–
226.
68
103.
Tamura K. Alterations of CDKNZA and mismatch repair deficiency may be important as early
events of colorectal tumors associated with ulcerative colitis. Proc AACR 2003;44:1477.
104.
Tanaka T, Kohno H, Murakami M, Shimada R, Kagami S. Colitis-related rat colon
carcinogenesis induced by 1-hydrozyantraquinone and methylazoxymethanol acetate. Oncol Rep
2000;7:501–508.
105.
Suzui M, Ushijima T, Yoshimi N, Nakagama H, Hara A, Sugimura T, Nagao M, Mori H.
No involvement of APC gene mutations in ulcerative colitis-associated rat colon carcinogenesis induced
by 1-hydrozyanthraquinone and methylazixymethanol acetate. Mol Carcinog 1997;20:389–393.
106.
Suzui M, Ushijima T, Dashwood RH, Yoshimi N, Sugimura T, Mori H, Nagao M. Frequent
mutations of the rat betacatenin gene in colon cancers induced by methylazoxymethanol acetate plus 1hydrozyanthraquinone. Mol Carcinog 1999;24:232–237.
107.
Uthoff SM, Eichenberger MR, Lewis RK, Fox MP, Hamilton CJ, McAuliffe TL, Grimes
HL, Falandiuk S. Identification of candidate genes in ulcerative colitis and Crohn’s disease using cDNA
array technology. Int. J. Oncology 2001;19:803–810.
108.
http://www.stanford.edu/group/nusselab/cgi-bin/wnt/cancer Erişim; 24.04.2012.
109.
Zou H, Molina JR, Harrington JJ, Osborn NK, Klatt KK, RomeroY, Burgart LJ, Ahlquist
DA. Aberrant methylation of secreted frizzled-related protein genes in esophageal adenocarcinoma and
Barrett’s esophagus Int. J. Cancer 2005;116:584–591.
110.
Urakami S, Shiina H, Enokida H, Kawakami T, Kawamoto K, Hirata H, Tanaka Y,Kikuno
N, Nakagawa M, Igawa M, Dahiya R. Combination Analysis of Hypermethylated Wnt-Antagonist
Family Genes as a Novel Epigenetic Biomarker Panel for Bladder Cancer Detection. Clin Cancer Res
2006;12(7): 2109-2116.
111.
Chomczynski P, Sacchi N. Single-step method of RNA isolation by acid guanidinium
thiocyanate-phenol-chloroform extraction. Anal Biochem, 1987; 162 (1): 156-159.
112.
Livak KJ, Schmittgen TD. Analysis of Relative Gene Expression Data Using Real-Time
Quantitative PCR and the 2-ΔΔCT Method. Methods. 2001; 25: 402–408.
113.
Schmittgen TD, Livak KJ. Analyzing real-time PCR data by the comparative CT method.
Nature Protoc, 2008; 3 (6): 1101-1108.
69
114.
Schefe JH, Lehmann KE, Buschmann IR, Unger T, Kaiser HF. Quantitative real-time RTPCR data analysis: current concepts and the novel “gene expression’s CT difference” Formula. J Mol
Med, 2006; 84: 901–910.
115.
Hiltunen MO, Alhonen L, Koistinaho J, Myöhänen S, Pääkkönen M, Marin S, Kosma VM,
Jänne J. Hypermethylation of the APC (adenomatous polyposis coli) gene promoter region in human
colorectal carcinoma. Int J Cancer. 1997;70:644–648.
116.
Prasad CP, Mirza S, Sharma G, Prashad R, DattaGupta S, Rath G, Ralhan R. Epigenetic
alterations of CDH1 and APC genes: Relationship with activation of Wnt/β-catenin Pathway in invasive
ductal carcinoma of breast. Life Sciences 2008; 83: 318–325.
117.
Klaus A, Birchmeier W. Wnt signalling and its impact on development and cancer Nature
Reviews Cancer. 2008; 8: 387-398.
118.
Suzuki H, Watkins DN, Jair KW, Schuebel KE, Markowitz SD, Chen WD, Pretlow TP,
Yang B, Akiyama Y, Engeland M van, Toyota M, Tokino T,Hinoda Y, Imai K, Herman JG, Baylin
SB. Epigenetic inactivation of SFRP genes allows constitutive WNT signaling in colorectal cancer Nature
Genetıcs 2004; 36 (4):417–422.
119.
Dulaimi E, Uzzo RG, GreenbergRE, Al-Saleem T, Cairns P. Detection of bladder cancer in
urine by a tumor suppressor gene hypermethylation panel. Clin Cancer Res, 2004;10:1887- 93.
120.
Wang DR, Tang D. Hypermethylated SFRP2 gene in fecal DNA is a high potential biomarker
for colorectal cancer noninvasive screening World J Gastroenterol, 2008; 14(4): 524-531.
121.
Cheng YY, Yu J, Wong YP, Man EP, To KF, Jin VX, Li J, Tao Q, Sung JJ, Chan FK,
Leung WK. Frequent epigenetic inactivation of secreted frizzled-related protein 2 (SFRP2) by promoter
methylation in human gastric cancer. British Journal of Cancer. 2007;97: 895 – 901.
122.
Takagi H, Sasaki S, Suzuki H, Toyota M, Maruyama R, Nojima M, Yamamoto H, Omata
M, Tokıno T, Imai K, Shinomura Y. Frequent epigenetic inactivation of SFRP genes in hepatocellular
carcinoma J Gastroenterol 2008; 43:378–389.
123.
Kominsky DJ, Keely S, MacManus CF, Glover LE, Scully M, Collins CB, Bowers BE,
Campbell EL, Colgan SP. An endogenously anti-inflammatory role for methylation in mucosal
inflammation identified through metabolite profiling. J Immunol. 2011;186(11):6505-14.
70
124.
Gonda TA, Kim YI, Salas MC, Gamble MV, Shibata W, Muthupalani S, Sohn KJ, Abrams
JA, Fox JG, Wang TC, Tycko B. Folic Acid increases global DNA methylation and reduces
inflammation to prevent helicobacter-associated gastric cancer in mice. Gastroenterology. 2012
Apr;142(4):824-833.
125.
Nakagawa H, Murata Y, Koyama K, Fujiyama A, Miyoshi Y, Monden M, Akiyama T,
Nakamura Y. Identification of a brain-specific APC homologue, APCL, and its interaction with betacatenin. CancerRes. 1998;58(22):5176–5181.
126.
van Es JH, Kirkpatrick C, van de Wetering M, Molenaar M, Miles A, Kuipers J, Destree
O, Peifer M and Clevers H. Identification of APC2, a homologue of theadenomatous polyposis coli
tumour suppressor. Curr Biol. 1999;9 (2):105–108.
127.
Nakagawa H, Koyama K, Murata Y, Morito M, Akiyama T, Nakamura Y. APCL, a central
nervous system-specific homologue of adenomatous polyposis coli tumor suppressor, binds to p53binding protein 2 and translocates it to the perinucleus. Cancer Res. 2000;60(1):101–105.
128.
Bronner MP, Culin C, Reed JC, Furth EE. The bcl-2 protooncogene and the gastrointestinal
epithelial tumor progression model. Am J Pathol 1995;146(1):20–26.
71
ÖZGEÇMİŞ
AD-SOYAD: Zühal MERT ALTINTAŞ
DOĞUM TARİHİ ve YERİ: 03.06.1970 Ankara
EĞİTİM DURUMU:
1976-1979: Abdülvahit Sağlam İlkokulu, Ayvalık, BALIKESİR
1979-1981: Sakarya İlkokulu, Ayvalık, BALIKESİR
1981-1983: Ayvalık Lisesi, Ayvalık, BALIKESİR
1983-1987: Mustafa Kemal Lisesi, Yenimahalle, ANKARA
1987-1994: Gazi Üniversitesi Tıp Fakültesi
2004-2006: Mersin Üniversitesi Tıp Fakültesi Tıbbi Biyoloji ve GenetikYüksek Lisans
2006-
:Mersin Üniversitesi Tıp Fakültesi Tıbbi Biyoloji ve Genetik Doktora
SERTİFİKALAR:
09-15 Kasım 1998: 1.Sağlık Projesi Uyum Eğitimi Sertifikası
15/09/2000: Hemodiyaliz Sorumlu Hekim Sertifikası (Sertifika no:317)
DENEYİMLER:
Ocak 1995-Ağustos 1996: Merkez Sağlık Ocağı, Taşköprü; Kastamonu
Ağustos 1996- Mayıs 1998: 1 Nolu AÇSAP, Karabük
Haziran 1998-Ekim 1999: 1 Nolu AÇSAP, Yenimahalle, ANKARA
Ekim 1999-Aralık 1999: Acil Müdahale, Türkiye Yüksek İhtisas Hastanesi, Ankara
72
Ocak 2000-Ekim 2001: Hemodiyaliz Ünitesi, Türkiye Yüksek İhtisas Hastanesi,
Ankara
Mayıs 2001-Ekim 2001: Transplantasyon Koordinasyon Sorumlusu, Türkiye Yüksek
İhtisas Hastanesi, Ankara
30 Ekim 2001- 03 Mart 2003 Hemodiyaliz Ünitesi, Devlet Hastanesi, Mersin
03 Mart 2003 –Kasım 2004: Hemodiyaliz Ünitesi, Mersin Üniversitesi Tıp Fakültesi
Araştırma ve Uygulama Hastanesi
Kasım 2004- : Mersin Üniversitesi Tıp Fakültesi Tıbbi Biyoloji ve Genetik AD.
YAYINLAR:
1. Akbas E, Polat S, Karakas-Celik S, Altintas ZM, Yildirim M, Yilgor E. A
severely mental and motor retarded boy with monosomy 9pter-->p22 trisomy
10q26-->qter due to paternal reciprocal translocation 46,XY,t(9;10)(p23;q26).
Genet Couns. 2011;22(4):417-23.
2. Barlas IO, Sezgin M, Erdal ME, Sahin G, Ankarali HC, Altintas ZM, Türkmen
E.Association of (-1,607) 1G/2G polymorphism of matrix metalloproteinase-1
gene with knee osteoarthritis in the Turkish population (knee osteoarthritis and
MMPs gene polymorphisms). Rheumatol Int. 2009 Feb;29(4):383-8.
3. Sezgin M, Barlas IO, Ankarali HC, Altintaş ZM, Türkmen E, Gökdoğan T,
Sahin G, Erdal ME. Tumour necrosis factor alpha -308G/A gene polymorphism:
lack of association with knee osteoarthritis in a Turkish population. Clin Exp
Rheumatol. 2008 Sep-Oct;26(5):763-8.
73
4. Sezgin M, Erdal ME, Altintas ZM, Ankarali HC, Barlas IO, Turkmen E, Sahin
G. Lack of association polymorphisms of the IL1RN, IL1A, and IL1B genes
with knee osteoarthritis in Turkish patients. Clin Invest Med. 2007;30(2):E8692.
74