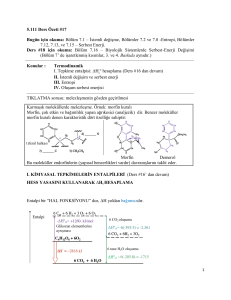
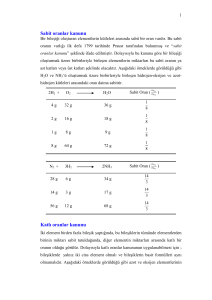
Kimya 1 Öğretmen Klavuzu
advertisement

LİSE KİMYA 2 2004 © Paşa Yayıncılık Ltd. Şti. Bu kitabın tüm yayın hakları Paşa Yayıncılık Ltd. Şti.ʼne aittir. Yayınevinden yazılı izin alınmadan kısmen veya tamamen alıntı yapılamaz, hiçbir şekilde kopya edilemez, çoğaltılamaz ve yayınlanamaz. Kişi kendisi için bu copyright ibaresi ile birlikte olmak koşuluyla bir basılı kopya ve bilgisayarında bir dijital kopya bulundurabilir. Bunun dışındaki tüm eylemlerde 5/12/1951 TARİH VE 5846 SAYILI FİKİR VE SANAT ESERLERİ KANUNU çerçevesinde tüm hukuksal haklarımız aranır. Tüm hakları saklıdır. DERS KİTABI ÖĞRETMEN KLAVUZU Faruk KARACA KİMYA-I 1 I MADDENİN GAZ HÂLİ LİSE KİMYA 2 BÖLÜM I MADDENİN GAZ HÂLİ DEĞERLENDİRME ÇALIŞMALARI 1 ÇÖZÜMLERİ 1. Gaz yoğunlukları havadan hafif balonların yapılmasında büyük önem taşır. Gaz ile doldurulmuş bir balon ancak gazın yoğunluğu havadan küçük ise atmosferde yükselir. Gaz yoğunluğu mol kütlesi ile doğru orantılı olduğundan, daha düşük mol kütleli gaz daha çok kaldırma kuvvetine sahiptir. Zeplinlere ve meteoroloji balonlarına hidrojen gazı yerine helyum gazı konur. Hidrojen gazı yanıcı, patlayıcı olduğundan dolayı kullanılmaz. m = –––– MP bağıntısına göre bir gazın yoğunluğu sıcaklık ile ters orantılıdır. Sıcak hava, soğuk havadan d = ––– V RT daha az yoğundur. Ancak balon yükseldikçe dış hava yoğunluğu hızla düşmesinden dolayı sıcak hava ya da sıcak gaz doldurulmuş balonların çıkabileceği yükseklik sınırlıdır. 2. İdeal gaz denklemine uyan gazlar, aynı zamanda basit gaz yasalarına da uyar. Örneğin Boyle ve Charles Yasası bir gazlar karışımı olan havanın davranışı üzerine kurulmuştur. Böylelikle basit gaz yasaları ile ideal gaz denklemi tek tek gazlara uygulandığı gibi birbiriyle etkileşmeyen gaz karışımlarına da uygulanabilir. Gaz karışımlarının çalışıldığı bu tür durumlarda ideal gaz denkleminden yararlanılır. p RT = sabit bağıntısı yazılabilir. Bir kapta bulunan gaz karışımındaki her bir gazın PV = nRTʼden ––– = –––– n V kabı dolduracak şekilde konulduğunda kaba yaptığı basınç o gazın kısmî basıncı olarak bilinir. Dalton kısmî basınçlar yasasına göre karışımın toplam basıncı, toplam mol sayısına oranı her bir gazın kısmî basıncının, PT PA P mol sayısına oranıdır (––– = ––– = –––B =…). nT nA nB F Bu durumda ağırlık bir kuvvettir ve ağırlık ile kütle orantılıdır 3. Basınç birim alana düşen kuvvettir (p = –––). A (G = m·g). Bir sıvının kütlesi onun hacmi ile yoğunluğunun çarpımıdır (m = V · d). Silindirin hacmi onun yüksekliği ile kesit alanının çarpımıdır (V = h · A). Bu bağıntılar basınç bağıntısında yerine konulduğunda p = hdg elde edilir. Toriçelli deneyinde barometredeki cıva seviyesinin yüksekliği cam borunun çapına bağlı olmadığını göstermektedir. 4. Plâstikten yapılmış hava sızdırmaz ve esnek bir balona 1 atm basınç yapacak şekilde helyum ya da hidrojen gazı gönderildiğinde gazın mol sayısı değişmeyeceğinden; a. Balonun hacmi değişmez. b. Hidrojen mol kütlesi helyumun mol kütlesine göre daha düşüktür. Bu nedenle balon ve içindekilerin toplam kütlesi azalır. 3,5 9 5. 3,5 g CO, ––––– = 0,125 molʼdür. 0,5 mol X2O 9 g ise 1 mol –––– = 18 gʼdır. 28 0,5 Aynı koşullarda V α nʼdir. 18 = 2MX + 16 3,5 L gaz 0,125 mol ise MX = 1 14 L gaz X X: 1 ––––––––––––––––––––––– 14 x 0,125 X = –––––––––––– = 0,5 molʼdür. 3,5 7. P1V1 = P2V2 6. P1V1 = P2V2 19 x 4 = P2 x 0,2 380 P2 = 380 mm Hg ––––– = 0,5 atm 760 V1 V2 800 V2 8. –––– = –––– ⇒ ––––– = ––––– ⇒ V2 = 1092 mL T1 T2 400 546 2 1520 –––––– x 4 = 0,5 x V2 ⇒ V2 = 16 L 760 P1 P2 4 P2 9. –––– = –––– ⇒ –––– = ––––– ⇒ P2 = 8 atm T1 T2 273 546 www. pasayayincilik.com © 2004 I MADDENİN GAZ HÂLİ 1520 –––––– x 16 P1V1 P2V2 4x4 760 10. ––––– = –––––––– ⇒ –––––– = ––––––––––– ⇒ T2 = 546 K, t2 = 273˚C T1 T2 273 T2 m 14 22,4 11. PV = –––– RT ⇒ P x 11,2 = –––– x –––––– x 546 ⇒ P = 2 atm M 28 273 0,082 d d 22,4 12. P = ––– RT ⇒ 1,12 = –––– x ––––– x 273 ⇒ d = 1,6 g L–1 M 32 273 m 360 13. PV = –––– RT ⇒ 2 x 246 = –––––– x 0,082 x 600 ⇒ MX = 18 g mol–1, X: 18 M 2MX 1 x 0,082 x 273 14. PH x VH = nRT ⇒ PH = –––––––––––––––– ⇒ PH = 4,48 atm 2 2 2 2 5 PH VH + PN VN + PO VO = PSON VTOPLAM 2 2 2 2 2 2 4,48 x 5 + 2 x 2 + 1 x 3 = PSON x 10 PSON = 2,94 atm 2 15. 2 g CH4, –––– = 0,125 molʼdür. 16 PCH PT P 3P 4 –––––– = ––––– ⇒ ––––––– = ––––– ⇒ nT = 0,375 mol nCH nT 0,125 nT 4 nX = nT – nCH ⇒ nX = 0,375 – 0,125 ⇒ nX = 0,25 mol 4 mX 20 mX = 22 – 2 ⇒ mX = 20 g MX = ––––– ⇒ MX = –––––– ⇒ MX = 80 g mol–1 nX 0,25 d 2,2 16. P = –––– RT ⇒ 1,23 = ––––– x 0,082 x 300 ⇒ M = 44 g mol–1 M M 16 17. 16 g O2 gazı, ––––– = 0,5 molʼdür. 32 P1 P2 ––––– = ––––– n1 n2 4 3 ––––– = –––––––––– n1 (n1 – 0,5) 4n1 – 2 = 3n1 ⇒ n1 = 2 mol 2 mol O2, 2 x 32 = 64 gramdır. 19. Graham difüzyon yasasına göre; 3,01 x 1023 18. 3,01 x 1023 tane O2 molekülü, –––––––––––– = 0,5 molʼdür. 6,02 x 1023 Aynı koşullarda (P,T aynı ise) V α nʼdir. 4 Lʼde 0,5 mol gaz varsa 1 Lʼde X ––––––––––––––––––––––– 0,5 X = ––––– = 0,125 mol gaz vardır. 4 0,125 mol SO3 gazı, 0,125 x 80 = 10 gramdır. vx MY 2 MY MY 4 = ⇒ = = = bulunur. vY MX 1 MX MX 1 Her iki gaz için ideal gaz denklemi yazılıp oranlanırsa; m P VX ––––– R T MX VX MY MY –––––– = ––––––––– ⇒ ––––– = ––––– bulunur. ––––– oranı yerine konulursa; m VY MX MX P VY ––––– R T MY VX 4 ––––– = ––– ⇒ VX = 4VY bulunur. VY 1 KİMYA-2 3 I MADDENİN GAZ HÂLİ 20. Manometreye göre, PCl = Phava + hʼdir. 2 PCl = 760 + 190 ⇒ PCl = 950 mm Hg, PCl = 1,25 atm 2 2 2 m 22,4 PV = nRT ⇒ 1,25 x 8,96 = –––– x –––––– x 273 ⇒ m = 35,5 gram 71 273 P1V1 = P2V2 21. PX = PT – Psu 2 1176,2 x V1 = P2 x 2V1 PX = 1200 – 23,8 2 P2 = 588,1 mm Hg PX = 1176,2 mm Hg 2 PT = P´X + Psu 2 PT = 588,1 + 23,8 ⇒ PT = 611,9 mm Hg 22. Tüp çapı sabit olduğundan hacimler aşağıdaki gibi alınabilir. PI VI = PII VII PI = Ph + 15 (Ph + 15) 20 = (Ph – 15) 30 PII = Ph – 15 Ph = 75 cm Hg VI = 20 VII = 30 DEĞERLENDİRME ÇALIŞMALARI 2 ÇÖZÜMLERİ P1 P2 P1 280 1. X2 gazı için: –––– = –––– ⇒ –––– = –––––– ⇒ P1 = 210 mm Hg T1 T2 300 400 V1 Y2 gazı için: P1 V1 = P2 V2 ⇒ P1 x V1 = 1180 x –––– ⇒ P1 = 590 mm Hg 2 PToplam = P1 (X2) + P1 (Y2) ⇒ PToplam = 210 + 590 ⇒ PToplam = 800 mm Hg 2. PX = Phava + h 532 532 mm Hg, –––––– = 0,7 atmʼdir. 760 2 PX = 0,9 + 0,7 ⇒ PX = 1,6 atm 2 (Doğru Seçenek D) 2 22,4 PV = nRT ⇒ 1,6 x 5,6 = n x –––––– x 273 ⇒ n = 0,4 mol (Doğru seçenek A) 273 3. Açık hava basıncının değişmesi X ve Y gazlarının kısmî basıncını değiştirmeyeceğinden içteki manometrenin a ve b kollarındaki cıva düzeyi aynı kalır (X gazının bağlı olduğu manometrede cıva düzeyi uzun kolda biraz yükselmekle birlikte bundan kaynaklanan hacim artışı ihmal edilebilir düzeydedir.). (Doğru seçenek A) 4. Kapta bulunan O2 ve CH4 gazlarının her birinin 32 gram olduğu kabul edilirse nO = 1 mol, nCH = 2 mol 2 4 olur. P α n ve nCH = 2nO olduğu için PCH = 2PO (A doğrudur.) 4 2 4 2 x x 3x PCH = x ise PO = ––– olur ve PTop = x + ––– ⇒ PTop = –––– bulunur. (B doğrudur.) 4 2 2 2 2 VCH 4 VO2 = M O2 M CH 4 ⇒ VCH 4 VO2 = VCH 4 32 = 2 ⇒ VCH 4 2VO2 (Cdoğrudur.) ⇒ 16 VO2 n α N nCH = 2nO olduğu için NCH = 2NO (D doğrudur.) 4 2 4 2 Ek α T olduğu için aynı sıcaklıkta gazlar farklı da olsa ortalama kinetik enerjileri aynı olur (E yanlıştır.) (Doğru seçenek E) 4 www. pasayayincilik.com © 2004 I MADDENİN GAZ HÂLİ 5. T ve R sabittir, mol sayısındaki değişme P ile Vʼden kaynaklandığı için n = PV bağıntısı kullanılabilir. Başlangıçta: nX = PX VX ⇒ nX = 3 x 4 ⇒ nX = 12 mol 2 2 2 2 2 Musluk açılıp kapatılınca : nX = PX VX ⇒ nX = 2 x 4 ⇒ nX = 8 mol 2 2 2 2 2 Dolayısıyla 12 – 8 = 4 mol X2 gazı II numaralı kaba geçmiştir. II numaralı kaptaki gaz başlangıçta; nY = PY VY ⇒ nY = 1 x 1 ⇒ nY = 1 molʼdür. II numaralı kapta gazların mol sayısı 4 + 1 = 5 molʼdür. 2 2 2 2 2 Kapta 1 mol gaz varken basınç 1 atm ise 5 mol gaz varken 5 atm olur. (Doğru seçenek E) 6. PO VO + PN VN + PCO VCO = PSON + VTOPLAM 2 2 2 2 2 2 2 x 4 + 4 x 2 + 4 x 4 = PSON x 10 (Doğru seçenek C) PSON = 3,2 atm 22,4 7. PV = nRT = 1 x 22,4 = n x –––––– x 273 ⇒ n = 1 mol 273 25,6 nO = –––––––– ⇒ nO = 0,8 mol nX = 1 – 0,8 ⇒ nX = 0,2 mol 2 2 32 0,2 mol X 15,2 g ise 1 mol X x –––––––––––––––––––––––– 15,2 x = –––––– = 76 gʼdır. Mol kütlesi 76 g olan gaz N2O3ʼtir. 0,2 22,4 8. PV = nRT ⇒ 1 x 44,8 = n x –––––– x 273 ⇒ n = 2 mol H2 vardır. 273 1 1 gram H2 gazı –––– = 0,5 molʼdür. Kapta 2 – 0,5 = 1,5 mol H2 kalmıştır. 2 28 Kaba gönderilen N2 gazı, –––– = 1 molʼdür. 28 Toplam mol sayısı nH + nN = 1,5 + 1 = 2,5 molʼdür. 2 2 22,4 PV = nRT ⇒ P x 44,8 = 2,5 x ––––––– x 273 ⇒ P = 1,25 atm 273 (Doğru seçenek D) (Doğru seçenek D) 9. Musluk açılmadan : PCO = Phava + h (1 atm = 76 cm Hg) 2 PCO = 76 + 38 ⇒ PCO = 114 cm Hg 2 2 Musluk açılınca : P1V1 = P2V2 ⇒ 114 x 3 = P2 x 9 ⇒ P2 = 38 cm Hg Musluk açılınca : Phava > PCO olduğu için; 2 PCO = Phava – h 2 38 = 76 – h ⇒ h = 38 cm bulunur ve b kolunda 38 cm yükselir. (Doğru seçenek B) 22,4 10. PV = nRT ⇒ 0,5 x 5,6 = n x ––––––– x 273 ⇒ n = 0,125 mol 273 P, T, V eşit olduğu için nCH = nSO = 0,125 molʼdür. 4 2 0,125 mol CH , 0,125 x 16 = 2 gramdır. 4 VCH 4 VSO2 = M SO2 M CH 4 ⇒ VCH 4 VSO2 = 0,125 mol SO2 , 0,125 x 64 = 8 gramdır. 64 ⇒ VCH 4 =2VSO2 16 Sıcaklık aynı olduğu için gazların kinetik enerjileri aynıdır. Birim zamanda birim yüzeye çarpma sayısı moleküllerin ortalama hızlarıyla orantılıdır ve bu oran 4 değil 2ʼdir. (Doğru seçenek E) KİMYA-2 5 I MADDENİN GAZ HÂLİ 11. A şehrinde: PHe = Phava + h PHe = 740 + 60 ⇒ PHe = 800 mm Hg B şehrinde: PHe = Phava + h PHe = 660 + 40 ⇒ PHe = 700 mm Hg 16 16 g He, ––––– = 4 molʼdür. 4 P1 P2 800 700 –––– = –––– ⇒ –––––– = –––––– ⇒ n2 = 3,5 mol n1 n2 4 n2 3,5 mol He; 3,5 x 4 = 14 gramdır. 12. I. yol (Doğru seçenek D) mX = 40 kütle birimi ise mY = 100 kütle birimidir. mX = 2 birim ise MY = 1 birimdir. Buna göre; 40 nX = –––– = 20 mol 2 100 nY = ––––– = 100 molʼdür. 1 PX PY PX 20 1 –––– = –––– ⇒ –––– = ––––– = ––– nX nY PY 100 5 II. yol mX = 0,40 mY mX 0,40 mY mY nX = ––––– ⇒ nX = –––––––– ⇒ nX = 0,2 nY –––– = nY MX 2MY MY ( MX = 2MY PX nX PX 0,2 nY PX P α n ise ––––– = –––– ⇒ –––– = ––––––– ⇒ –––– = 0,2 PY nY PY nY PY 13. PC 4H8 = Phava + h ⇒ PC 4H8 = 750 + 10 ⇒ PC 4H8 1 0,2 = ––– 5 ) (Doğru seçenek A) = 760 mm Hg (1 atm) 22,4 PV = nRT = 1 x 2,8 = n x –––––– x 273 ⇒ n = 0,125 mol 273 1 mol C4H8ʼde 12 NA tane atom varsa 0,125 mol C4H8ʼde x ––––––––––––––––––––––––––––––––––––––– x = 0,125 x 12 NA = 1,5 NA = 3/2 NA tane atom vardır. (Doğru seçenek A) 14. Sıcaklık aynı ve PV çarpımları eşit (6 atm L) olduğu için gazların mol sayıları da eşittir (nCH = nO ). 4 2 Mol kütleleri farklı (MCH = 16 g mol–1, MO = 32 g mol–1) olduğu için, m = nM bağıntısına göre kütleleri 4 2 farklı olur. Sıcaklığı aynı olan tüm gazların moeküllerinin ortalama kinetik enerjisi aynıdır. (Doğru seçenek E) 15. Musluk açıldığında a ve b kollarında cıva düzeyleri eşitlendiğine göre, II ve III numaralı kaplarda bulunan gaz karışımının toplam basıncı; I numaralı kaptaki gazın basıncına yani 3Pʼye eşit olacaktır. PIIVII + PIII VIII = PSON VTOPLAM 8P 4P x V + PIII 3V = 3P x 4V ⇒ PIII = –––– 3 6 (Doğru seçenek C) www. pasayayincilik.com © 2004 I MADDENİN GAZ HÂLİ 16. PH VH + PN VN = PSON VTOPLAM 2 2 2 2 3 x 5 + 2 x 2 = PSON x 10 ⇒ PSON = 1,9 atm (Doğru seçenek B) 17. PY = Phava – h ⇒ PY = 76 – (100 – 40) ⇒ PY = 16 cm Hg 2 2 2 2 2 PX = PY + h ⇒ PX = 16 + (100 – 40) ⇒ PX = 76 cm Hg 2 2 (Doğru seçenek D) d 18. P = –––– RT bağıntısına göre; M 2 x 10–2 P1 = –––––––– RT ⇒ P1 = 1,25 x 10–3 RT 16 P2 = P1ʼdir. 4 x 10–2 P2 = –––––––– RT ⇒ P2 = 1,25 x 10–3 RT 32 (Doğru seçenek C) 19. I numaralı şekilde manometrenin kapalı ucundaki havanın basıncı P1 için; PI = Phava + 15 ⇒ PI = 75 + 15 ⇒ PI = 90 cm Hg PI VI = PII VII h 90 x h = PII ––– ⇒ PII = 180 cm Hgʼdir. 2 PX = PII + 20 ⇒ PX = 180 + 20 ⇒ PX = 200 cm Hg 2 20. 2 (Doğru seçenek E) 2 M SO2 VHe VHe 64 = = = ⇒ VHe =4VSO2 VSO2 M He VSO2 4 SO2 gazı 1 birim yol aldığında He gazı 4 birim, SO2 gazı 2 birim yol aldığında He gazı 8 birim yol alır ve 8. bölmede karşılaşırlar. (Doğru seçenek E) DENEY 1.1: Bir mol gazın kapladığı hacim Deney Sonu Sorularının Yanıtları ® Mg şeridin 1 mʼsi 1,2 g, 5 cmʼsi ise 0,06 gʼdır. 0,06 n = ––––––– = 0,0025 moldür. 24 ® Suyun sıcaklığa bağlı buhar basıncı için sayfa 43 Tablo: 3.3ʼten yararlanınız. a KİMYA-2 b 7 II KİMYASAL REAKSİYONLAR LİSE KİMYA 2 BÖLÜM II KİMYASAL REAKSİYONLAR DEĞERLENDİRME ÇALIŞMALARI 1 ÇÖZÜMLERİ 1. Girenlerdeki atom sayısı = X + 12O = X = X = Ürünlerdeki atom sayısı 4C + 10H + 13O 4C + 10H + O C4H10O 2. Girenlerin toplam kütlesi = Ürünlerin toplam kütlesi 4,8 + X = 12 + 4,8 + 2,7 X = 14,7 g 42 3. 42 g CO, –––– = 1,5 molʼdür. 28 Denkleme göre 3 mol CO elde etmek için 1 mol Fe2O3 ile 3 mol C gerekmektedir. 1,5 mol CO elde etmek için bu miktarların yarısı kadar (0,5 mol Fe2O3 + 1,5 mol C) kullanılmalıdır. 0,5 mol Fe2O3, 0,5 x 160 = 80 g Fe2O3 1,5 mol C, 1,5 x 12 = 18 g C + –––––––––––– 98 g giren kullanılmalıdır. 4. 2KClO3 ⎯⎯⎯→ 2KCl + 3O2 2 x 122,5 g 3 x 22,4 L (N.K. da) N.K. da 3 x 22,4 L O2 oluşması için 2 x 122,5 g KClO3 ayrışırsa 6,72 L O2 oluşması için x –––––––––––––––––––––––––––––––––––––––––––––––– 6,72 x 2 x 122,5 x = ––––––––––––––– = 24,5 g KClO3 ayrışır. 3 x 22,4 49 g KClO3ʼın 24,5 gʼı ayrışırsa 100 g KClO3ʼın x –––––––––––––––––––––––––––––– 100 x 24,5 x = –––––––––– = 50 gʼı ayrışır. KClO3ʼın %50ʼsi ayrışmıştır. 49 5. 2 Cx Hy On + 5 O2 ⎯⎯→ 4 CO2 + 6 H2O 2nC = 4 nCO ⇒ 2x = 4 ⇒ x = 2 2 2nH = 12 nH ⇒ 2y = 12 ⇒ y = 6 2nO + 10 = 4 nCO + 6 nH 2 2O CxHyOn ⎯→ C2H6O2 ⇒ 2n = 14 – 10 ⇒ n = 2 6. H2 + 1/2O2 ⎯→ H2O N.K. da 1/2 x 22,4 L O2 ile 2 g H2 tepkimeye girerse 5,6 L O2 ile x –––––––––––––––––––––––––––––––––––––––– 5,6 x 2 x = –––––––––– = 1 g H2 gazı tepkimeye girer. 1/2 x 22,4 8 www. pasayayincilik.com © 2004 II KİMYASAL REAKSİYONLAR 7. CaCO3 ⎯→ CaO + CO2 100 g N.K. da 22,4 L N.K. da 22,4 L CO2 için 100 g CaCO3 gerekirse 200 g CaCO3ʼın 5,6 L CO2 için x ––––––––––––––––––––––––––––––––––––––––– 5,6 x 100 x = –––––––––– = 25 g CaCO3 gerekir. 22,4 100 g CaCO3ʼın x ––––––––––––––––––––––––––––––––––– x = 12,5 CaCO3ʼın %12,5ʼi ayrışmıştır. 25 gʼı ayrışırsa 8. CO + 1/2O2 ⎯→ CO2 28 g 16 g 16 g O2 ile 28 g CO tepkimeye girerse Başlangıçtaki mCO = Tepkimeye giren mCO + Artan mCO 1,6 g O2 ile x ––––––––––––––––––––––––––––––––––– 1,6 x 28 x = ––––––––– = 2,8 g CO tepkimeye girer. 16 9. 16 g 3 x 22,4 L (N.K.da) Kütlesi fazla olan oksijenin kütlesini (16 g) ölçü olarak alalım. Bu durumda, 16 g da C almış oluruz; ancak 12 g C harcanır. 16 gram Cʼun 12 gʼı harcanırsa 100 gram Cʼun x –––––––––––––––––––––––––––– 100 x 12 x = ––––––––– = 75 gʼı harcanır. 16 Cʼun %75ʼi harcanmıştır. 12. Başlangıçtaki mCO = 5,6 gram 10. C2H5OH(s) + 3O2(g) ⎯⎯→ 2CO2(g) + 3H2O(g) + 1230 kJ C + 1/2O2 ⎯→ CO 12 g Başlangıçtaki mCO = 2,8 + 2,8 mgirenler = mürünler 14,2 + 25,7 = mAlF + 2,8 + 21,3 3 mAlF = 15,8 gram 1230 kJ ısı açığa çıkması için 3 x 22,4 L O2 kullanılırsa 205 kJ ısı açığa çıkması için x ––––––––––––––––––––––––––––––––––––––––––––––– 205 x 3 x 22,4 x = –––––––––––––– = 11,2 L O2 kullanılmalıdır. 1230 11. N2 + 3H2 ⎯→ 2 NH3 mgirenler = mürünler + martan mN + mH = 17 + 5,6 2 2 nN x 28 + nH x 2 = 22,6 nN = x olsun; 2 2 2 28x + (2,2 – x) 2 = 22,6 x = 0,7 mol N2; 0,7 mol ise H2; 2,2 – 0,7 = 1,5 molʼdür. 3 13. X(OH)2 + 2HCl ⎯→ XCl2 + 2H2O 0,8 mol HCl harcandığında MXCl = MX + 2MCl 2 38 g XCl2 oluşursa 95 = MX + 2 x 35,5 2 mol HCl harcandığında M g XCl2 oluşur. –––––––––––––––––––––––––––––––––––––––– 2 x 38 = 0,8 x M ⇒ M = 95 g mol–1 14. N2(g) + 3H2(g) ⎯→ 2NH3(g) 3 mol H2ʼden 2 mol NH3 oluşursa 0,75 mol H2ʼden x mol NH3 oluşur. ––––––––––––––––––––––––––––––––– 0,75 x 2 x = ––––––––– = 0,5 mol NH3 oluşur. 3 15. 1,8 g H2O oluşması için MX = 24 g mol–1 X : 24 PV = nRT 4 x V = 0,5 x 0,082 x 273 V = 2,8 L 8,5 g X(OH)2 gerekirse 2 x 18 g H2O oluşması için M g X(OH)2 gerekir. ––––––––––––––––––––––––––––––––––––––––––––– 1,8 x M = 2 x 18 x 8,5 ⇒ M = 170 g mol–1 KİMYA-2 MX(OH) = MX + 2M + 2MH 2 O 170 = MX + 2 x 16 + 2 x 1 MX = 136 g mol–1 X : 136 9 II KİMYASAL REAKSİYONLAR 16. 4 g X ile 9 g Y birleşirse 1,6 g X ile M g Y birleşir. ––––––––––––––––––––––––––– 1,6 x 9 M = –––––––– = 3,6 g Y birleşir. 4 MX Y = 1,6 g X + 3,6 Y = 4,6 gʼdır. 17. mN = 4,6 – 3,2 ⇒ mN = 1,4 g 1,4 3,2 nN = ––––– ⇒ nN = 0,1 mol nO = –––– ⇒ nO = 0,2 mol 14 16 NXOY ⎯→ N0,1O0,2 ⎯⎯→ NO2 (Basit formül) (Basit formül kütlesi) x n = Mol kütlesi (14 + 2 x 16) x n = 92 2 5 n =2 Gerçek formül, (NO2)2 ⎯→ N2O4 şeklindedir. 18. Bileşik 100 gram kabul edilirse elementlerin bağıl mol sayıları şöyledir: 6,25 nH = –––––– ⇒ nH = 6,25 mol 1 43,75 nN = ––––––– ⇒ nN = 3,125 mol 14 50 nO = –––– ⇒ nO = 3,125 mol 16 H 6,25 N 3,125 O 3,125 → O 6,25 N 3,125 O 3,125 → H 2 NO 3,125 3,125 3,125 19. Bileşik 100 gram kabul edilirse elementlerin bağıl mol sayıları şöyledir: 80 5 ––––– = –––– mol X 96 6 , 20 5 ––––– = ––––– mol Y 16 4 X 5 Y5 → X 1 Y1 → X Y6 X 4 Y6 → X 2 Y3 6 4 6 4 4 20. Bileşik 100 gram kabul edilirse elementlerin bağıl mol sayıları şöyledir: 40 60 nS = –––– ⇒ nS = 1,25 mol nO = –––– ⇒ nO = 3,75 mol 32 16 S1,25 O 3,75 → S1,25 O 3,75 → SO 3 1,25 1,25 x 21. Mn + xHCl ⎯→ MnClX + ––– H2 2 pV 0,951 · 3,22 nH = –––– = –––––––––––– = 0,1 mol 2 RT 22,4 –––––– · 373 273 2,75 nMn = –––– = 0,05 mol 55 0,05 mol 0,1 mol H2 1 mol x –––––––––––––––––––––––– 0,1 x = –––––– = 2 mol 0,05 2 mol H2 4 H atomu içerir. Buna göre bileşiğin formülü MnCl4ʼtür. DEĞERLENDİRME ÇALIŞMALARI 2 ÇÖZÜMLERİ 1. Verilen olaylardan yalnız mumun yanması kimyasal bir olaydır. (Doğru seçenek B) 6,72 2. 6,72 L H2, N.K.ʼda –––––– = 0,3 molʼdür. 22,4 Oluşan H2 gazı 0,3 mol ise stokiyometrik kat sayılara göre; oluşan XYO2 0,2 mol, harcanan YOH 0,2 molʼdür. m Bu maddelerin mol kütleleri M = ––– bağıntısından; n 19,6 11,2 MXYO = –––––– = 98 g mol–1 MYOH = –––––– = 56 g mol–1 bulunur. 2 0,2 0,2 MYOH = 56 ⇒ MY + MO + MH = 56 ⇒ MY + 17 = 56 ⇒ MY = 39 g mol–1 MXYO = 98 ⇒ MX + 39 + 2 x 16 ⇒ MX = 27 g mol–1 2 X : 27 , Y: 39 10 (Doğru seçenek D) www. pasayayincilik.com © 2004 II KİMYASAL REAKSİYONLAR 3. Al4C3 + 12H2O ⎯→ 4Al(OH)3 + 3CH4 MAl4C3 = 4 x 27 + 3 x 12 ⇒ MAl4C3 = 144 g mol–1 N.K.ʼda 3 x 22,4 L CH4 için 144 g Al4C3 gerekirse 200 g örnek 24 g Al4C3 içeriyorsa 100 g örnek x ––––––––––––––––––––––––––––– 100 x 24 x = ––––––––– = 12 g Al4C3 içerir. % 12 200 (Doğru seçenek A) mH 1 4. H2Oʼda ––––– = ––––ʼdir, yani 1 g H2 ile 8 g O2 birleşir ve 9 g H2O oluşur. mO 8 Eşit kütle denildiğine göre alınan H2 de 4 gramdır. 9 g H O için 8 g O gerekirse 11,2 L CH4 için x ––––––––––––––––––––––––––––––––––––––– 11,2 x 144 x = ––––––––––– = 24 g Al4C3 gerekir. 3 x 22,4 2 2 4,5 g H2O için x –––––––––––––––––––––––––––– 4,5 x 8 x = –––––––– = 4 g O2 gerekir. 9 8 g O2 ile 1 g H2 tepkirse 4 g O2 ile x –––––––––––––––––––––––––––– 4 x = ––– = 0,5 g H2 tepkir. 4 – 0,5 = 3,5 g H2 artar. 8 (Doğru seçenek B) mFe 7 mFe 7 2. bileşikte : –––––– = ––– 5. 1. bileşikte : –––– = –––– mS 8 mS 4 7 g Fe ile 8 g Sʼten 15 g 2. bileşik elde edilir. 7g Fe ile 4 g Sʼten 11 gram 1. bileşik elde edilir. 7 g Feʼden 15 g 2. bileşik elde edilirse 11 g 1. bileşik için 7 g Fe kullanılırsa 44 g 1. bileşik için x ––––––––––––––––––––––––––––––––– 44 x 7 x = ––––––– = 28 g Fe kullanılır. 11 6. H2 + n mol 1/2O2 ⎯→ H2O n ––– mol 2 28 g Feʼden x –––––––––––––––––––––––––––––––––––– 28 x 15 x = –––––––– = 60 g 2. bileşik elde edilir. 7 (Değer seçenek E) n mol 0,5 0,5 gram H2, –––– = 0,25 molʼdür. 2 39,2 N.K. da 39,2 L gaz, –––––– = 1,75 molʼdür. 22,4 Tepkimeye giren gaz 1,75 – 0,25 = 1,50 molʼdür. n n + ––– = 1,5 mol gaz karışımından oluşan su n = 1 moldür. 1 mol su 18 gramdır. 2 mY 8 7. –––– = ––– ⇒ 8 g Y ile 3 g Xʼten 11 g bileşik oluşur. mX 3 8 g Y ile 3 g X birleşirse 11 g bileşik için 8 g Y gerekirse 32 g Y ile x 44 g bileşik için x –––––––––––––––––––––––––––– ––––––––––––––––––––––––––––– 32 x 3 44 x 8 x = –––––––– = 12 g X birleşir. x = ––––––– = 32 g Y gerekir. 8 11 32 – 12 = 20 g X artar. 8. Karışımda yanabilen sadece H2 gazıdır. (Doğru seçenek C) (Doğru seçenek D) 2H2 + O2 ⎯⎯→ 2H2O 1 100 cm3 havada 100 x ––– = 20 cm3 oksijen vardır. 5 Denkleme göre 20 cm3 oksijen, 20 x 2 = 40 cm3 hidrojen gazı ile tepkir. 80 – 40 = 40 cm3 CO2 gazı vardır. Karışımın yarısı yani %50ʼsi CO2ʼtir. KİMYA-2 (Doğru seçenek D) 11 II KİMYASAL REAKSİYONLAR 9. 2N2O3 ⎯⎯→ 2N2 + 3O2 ––––––– –––––– –––––– 2 hacim 2 hacim 3 hacim N2O3 gazının 2x hacmi ayrışırsa, 2x hacim N2 ve 3x hacim O2 oluşur. (10 – 2x) + 2x + 3x = 19 ⇒ x = 3 litredir. Bozunmadan kalan N2O3, 10 – (2 x 3) = 4 litredir. 10 Lʼnin 4 Lʼsi bozunmadıysa 100 Lʼnin x –––––––––––––––––––––––––––– 4 x 100 x = –––––––– = 40 Lʼsi bozunmadan kalır. %40ʼı bozunmadan kalır. 10 (Doğru seçenek D) 21,6 –1 10. MN O = 108 g mol nN O = –––––– = 0,2 mol 2 5 2 5 108 0,2 mol N2O5, 0,2 mol N2O4 ile 0,1 mol O2 gazlarının tam tepkimesinden oluşur. Öyleyse artan gaz, 0,5 – (0,2 + 0,1) = 0,2 molʼdür. 0,2 molʼü 18,4 g ise 1 molʼü x –––––––––––––––––––––––––––––– 18,4 x = ––––– = 92 gʼdır. 1 molʼü (mol kütlesi) 92 gram olan gaz N2O4ʼtir. 0,2 Dolayısıyla başlangıçta: 0,2 + 0,2 = 0,4 mol N2O4 gazı ile 0,1 mol O2 gazı vardır. (Doğru seçenek D) 11. H2X + YO2 ⎯⎯→ YOX + H2O 0,9 0,9 g H2O, ––––– = 0,05 molʼdür. 18 m Denkleme göre diğer maddeler de 0,05ʼer molʼdür. M = –––– bağıntısına göre; n 1,7 MH X = ––––– = 34 g mol–1 MH X = 2MH + MX ⇒ 34 = 2 x 1 + MX ⇒ MX = 32 g mol–1 X: 32 2 2 0,05 3 MYOX = ––––– = 60 g mol–1 MYOX = MY + MO + MX ⇒ 60 = MY + 16 + 32 ⇒ MY = 12 g mol–1 Y: 12 0,05 (Doğru seçenek B) 12. Mg + Br2 ⎯→ MgBr2 –––– ––––– 24 g 160 g Mg ve Br2ʼdan 160ʼar gram alınırsa, brom tükenirken Mgʼun ancak 24 gʼı tüketilir. 160 g Mgʼun 24 gʼı tüketilirse 100 g Mgʼun x –––––––––––––––––––––––––––– 100 x 24 x = ––––––––– = 15 gʼı tüketilir. %15ʼi tüketilir. 160 13. Zn + 2AgCl ⎯⎯→ ZnCl2 + 2 Ag 1 mol (Doğru seçenek A) 2 mol 3,96 3,96 gram Zn –––––– molʼdür. Tepkimede Zn x mol harcanırsa, 2x mol Ag oluşur. 65 mZn + mAg = 10 MZn x nZn + MAg x nAg = 10 3,96 65 (–––– – x) + 108 x 2x = 10 ⇒ x = 0,04 mol 65 Oluşan gümüş, 2x mol yani 2 x 0,04 = 0,08 molʼdür. 0,08 mol Ag, 0,08 x 108 = 8,64 gramdır. (Doğru seçenek D) 14. Bileşik; 1,82 – 0,62 = 1,2 g X içerir. 1,2 0,62 nX = –––– = 0,03 mol nY = ––––– = 0,02 mol Bileşiğin olası formülü: X0,03 Y0,02 ⇒ X3Y2ʼdir. 40 31 (Doğru seçenek E) 12 www. pasayayincilik.com © 2004 II KİMYASAL REAKSİYONLAR 15. Bileşiği 100 g kabul edip elementlerin bağıl mol sayılarını bulalım. 21,2 nN = –––––– ⇒ nN = 1,5143 mol 14 6 nH = –––– ⇒ nH = 6 mol 1 24,24 nS = ––––––– ⇒ nS = 0,7575 mol 32 48,5 nO = ––––––– ⇒ nO = 3,03125 16 16. %70 Fe varsa %30 da O vardır. 70 30 nFe = –––– = 1,25 nO = –––– = 1,875 ⇒ Fe1,25 O1,875 ⇒ Fe2O3ʼtür. 56 16 MFe O = 2MFe + 3MO ⇒ MFe O = 2 x 56 + 3 x 16 ⇒ MFe O = 160 g mol–1 2 3 2 3 2 3 (Doğru seçenek B) (Doğru seçenek C) 17. Bileşiği 100 g kabul edip elementlerin bağıl mol sayılarını bulalım. 52 nX = –––– = 0,8 mol 65 X0,8 Y0,8 Z2,4 ––––––––––––––––––––– 9,6 nY = ––––– = 0,8 mol ÷ 0,8 12 38,4 X1 Y1 Z3 ⎯→ XYZ3 nZ = ––––– = 2,4 mol 16 18. MCuSO = 64 + 32 + 64 = 160 g mol–1 (Doğru seçenek E) 4 2,52 2,52 g CuSO4, –––––– = 0,01575 molʼdür. 160 Kütledeki azalma suyun buharlaşmasından kaynaklanır. mSu = 3,94 – 2,52 ⇒ mSu = 1,42 gram 1,42 1,42 g H2O, –––––– = 0,07888 molʼdür. 18 0,01575 mol bileşikte 0,07888 mol H2O varsa 1 mol bileşikte x ––––––––––––––––––––––––––––––––––––––––– 0,07888 x = ––––––––– = 5,008 mol (≈ 5 mol) H2O vardır. 0,1575 19. 2 Na2S + Na2CO3 + 4 SO2 ⎯⎯→ 3 Na2S2O3 + CO2 6,02 x 1023 tane 23 6,02 x 10 tane Na2CO3ʼtan 22 3 x 158 gram 3 x 158 g Na2S2O3 elde edilirse 2 x 10 tane Na2CO3ʼtan x ––––––––––––––––––––––––––––––––––––––––––––––––––– 22 2 x 10 x 3 x 158 x = ––––––––––––––––– = 15,75 g Na2S2O3 elde edilir. 6,02 x 1023 20. 2KNO3 + 4C ⎯⎯→ K2CO3 + 3CO + N2 –––––– ––––––– 4 x 12 g N.K. da 3 x 22,4 L 4 x 12 g Cʼdan 3 x 22,4 L CO oluşursa (N.K. da) 7,5 g Cʼdan x ––––––––––––––––––––––––––––––––––––––––––––– 7,5 x 3 x 22,4 x = –––––––––––––– = 10,5 L CO oluşur. 4 x 12 KİMYA-2 (Doğru seçenek E) (Doğru seçenek D) (Doğru seçenek D) 13 MADDENİN YOĞUN FAZLARI (SIVILAR-KATILAR) LİSE KİMYA 2 III BÖLÜM III MADDENİN YOĞUN FAZLARI (Sıvılar - Katılar) DEĞERLENDİRME ÇALIŞMALARI 1 ÇÖZÜMLERİ 1. Dış basınç arttıkça kaynama noktası yükselir, dış basınç azaldıkça kaynama noktası düşer. Sıvıların donma noktası genellikle basınç arttıkça yükselir, basınç azaldıkça donma noktası düşer. Ancak su gibi donarken genleşen sıvıların donma noktasına basıncın etkisi diğer sıvılarınkine göre ters yöndedir. 2. Kaynama noktası ile buharlaşma hızı ve buhar basıncı ters orantılıdır. Bir sıvının kaynama noktası yüksekse görece yavaş buharlaşır ve o sıcaklıktaki buhar basıncı görece düşüktür. 3. X → gaz, Y → sıvı, Z → sıvı, W → katı 4. X → gaz, Y → sıvı, Z → katı 5. mT = 15 + 60 = 75 g çözelti mÇ 15 Y = –––– x 100 ⇒ Y = –––– x 100 ⇒ Y = %20 mT 75 6. n = MV ⇒ n = 4 x 0,2 ⇒ n = 0,8 mol MHCl = 1 + 35,5 = 36,5 g mol–1 0,8 mol HCl , 0,8 x 36,5 = 29,2 gʼdır. 7. 3 Mʼlık çözeltinin hacmi V1 alınırsa 6Mʼlık çözeltinin hacmi (6 – V1) olur. M1V1 + M2V2 = MSON VTOPLAM 3 x V1 + 6 (6 – V1) = 4 x 6 V1 = 4 L ve V2 = 6 – 4 = 2 L bulunur. Y d 10 x 1,35 8. M = –––––––– x 10 ⇒ M = –––––––––– x 10 ⇒ 1,38 mol L–1 bulunur. (Y → kütlec %, d → öz kütle) MH SO 98 2 4 n = MV ⇒ n = 1,38 x 0,2 ⇒ n = 0,276 mol H2SO4 bulunur. 0,276 mol H2SO4, 0,276 x 98 ≅ 27 gramdır. 10. Al2(SO4)3 ⎯⎯→ 2Al+3 + 3SO4–2 9. CaCl2 ⎯→ Ca+2 + 2Cl¯ KCl → K+ + Cl¯ 1 mol 3 mol 1 mol 2 mol 1 mol 1 mol M1V1 + M2V2 = MSon VToplam 2(0,25 x 0,4) + M x 0,1 = 0,8 x (0,4 + 0,1) n = MV ⇒ n = 0,9 x 0,3 n = 0,27 mol Al2(SO4)3 SO4–2 iyonları ise 3 x 0,27 = 0,81 molʼdür. M = 2 molar n 0,81 mÇ 10 V = –––– ⇒ V = ––––– = 1,35 L ⇒ 1350 mL 11. Y = ––––– x 100 ⇒ 25 = ––––– x 100 ⇒ mT = 40 g M 0,6 mT mT Eklenecek su miktarı 1350 – 300 = 1050 mLʼdir. msu = mT – mÇ ⇒ msu = 40 – 10 ⇒ msu = 30 gram mÇ mÇ 12. Y1 = –––– x 100 ⇒ 30 = ––––– x 100 ⇒ mÇ = 18 g CuSO4 mT 60 Çözeltiye eklenen CuSO4 x gram olsun. mÇ + x 18 + x Y2 = –––––––– x 100 ⇒ 50 = –––––––– x 100 ⇒ x = 24 g eklenmelidir. mT + x 60 + x mÇ + x mÇ 13. Y1 = –––––––– x 100 ⇒ 10 = ––––– x 100 ⇒ mÇ = 4 g alkol mT 40 mÇ + 10 4 + 10 Y2 = –––––––––– x 100 ⇒ Y2 = –––––––– x 100 ⇒ Y2 = 28 ⎯→ %28 mT + 10 40 + 10 15. n = MV ⇒ n = 3 x 0,4 ⇒ n = 1,2 mol NaOH 14. n = Mv ⇒ n = 0,2 x 0,25 ⇒ n = 0,05 mol VT = 400 + 600 = 1000 mL = 1L M = 98 g mol–1 ise; n 1,2 M = ––– ⇒ M = –––– ⇒ M = 1,2 mol L–1 0,05 mol H2SO4, 0,05 x 98 = 4,9 gramdır. V 1 14 www. pasayayincilik.com © 2004 III MADDENİN YOĞUN FAZLARI (SIVILAR-KATILAR 16. 2,8 17. N.K. da 2,8 L NH3, ––––– = 0,125 molʼdür. 22,4 n 0,125 M = –––– ⇒ M = –––––– ⇒ M = 0,5 mol L–1 V 0,25 M1V1 + M2V2 = MSon VToplam 0,4 x 0,4 + 0,2 x 0,4 = M x (0,4 + 0,4) M = 0,3 mol L–1 Y 1 x d1 40 x 1,225 18. M1 = –––––––– x 10 ⇒ M1 = ––––––––––– x 10 ⇒ M1 = 5 mol L–1 m 98 –3 M1V1 + M2V2 = M (V1 + V2) d = 1,4 g cm → 1,4 g H2SO4 1 cm3 ise 5 x 0,2 + 1 x 0,2 = M (0,2 + 0,2) 280 g H2SO4 x ––––––––––––––––––––––––––––––– M = 3 mol L–1 280 x = ––––– = 200 cm3 (200 mL) → V2 1,4 2 mol HClʼden 22,4 L H2 oluşursa 19. n = MV ⇒ n = 0,4 x 0,2 ⇒ n = 0,08 mol HCl Zn + 2HCl ⎯⎯→ ZnCl2 + H2 2 mol 22,4 L (N.K. da) +2 20. CaX2 ⎯⎯⎯→ Ca 0,4 M 0,4 M + 2X¯ 0,8 M I. Yol m [M] = –––––––– MA V 40 0,4 = ––––––––––––– (40 + 2X) 0,5 40 = 0,4 x 0,5 (40 + 2X) 200 = 40 + 2X 0,08 mol HClʼden x –––––––––––––––––––––––––––––––––––– 0,08 x 22,4 x = –––––––––––– = 0,896 L H2 oluşur. 2 II. Yol nX¯ = MV ⇒ nX¯ = 0,8 x 0,5 ⇒ nX¯ = 0,4 mol nX¯ 0,4 nX¯ = 0,4 mol ise nCaX = –––– ⇒ nCaX = ––––– = 0,2 molʼdür. 2 2 2 2 0,2 mol CaX2 40 g ise 1 mol CaX2 x –––––––––––––––––––––––––– 40 x = ––––– = 200 gramdır. 0,2 MCaX = MCa + 2MX 2 160 = –––––– ⇒ X = 80 g mol–1 ⇒ X : 80 200 = 40 + 2MX ⇒ MX = 80 g mol–1 ⇒ X : 80 2 n 21. M = ––– ⇒ n = MV ⇒ n = 0,2 · 0,25 n = 0,05 mol V m n = ––– ⇒ m = n · M ⇒ m = 0,05 · 250 ⇒ m = 12,5 g M X DEĞERLENDİRME ÇALIŞMALARI 2 ÇÖZÜMLERİ 1. 2. Y1m1 = Y2m2 30 x m1 = 25 x (m1 + 40) ⇒ m1 = 200 g mÇ Y1 = –––––– x 100 mT mÇ 30 = –––– x 100 ⇒ mÇ = 60 g tuz. 200 Y1 m1 + Y2m2 = YmT 10 x 40 + 20 x 60 = Y(40 + 60) ⇒ Y = 16 (Doğru seçenek C) 4. mtuz = 10 + 30 = 40 g mçözelti = (200 + 200) + 400 (eklenen su) = 800 g mÇ 40 Y = ––––– x 100 ⇒ Y = ––––– x 100 ⇒ Y = 5 mT 800 (Doğru seçenek A) KİMYA-2 3. Y1m1 (Doğru seçenek C) = Y2m2 15 x 75 = 5 (75 + x) ⇒ x = 150 g (Doğru seçenek D) 5,6 5. 5,6 g KOH, –––– = 0,1 molʼdür. 56 n 0,1 M = –––– ⇒ M = ––––– ⇒ M = 0,25 mol L–1 V 0,4 (Doğru seçenek B) 15 III MADDENİN YOĞUN FAZLARI (SIVILAR-KATILAR) 6. Y d Y x 1,4 M1V1 = M2V2 7. M = ––––––– x 10 ⇒ 2,5 = –––––––– x 10 ⇒ Y = 10 1,2 V1 = 4,8 (V1–3) MKOH 56 (Doğru seçenek B) V1 = 4 L n = MV ⇒ n = 1,2 x 4 ⇒ n = 4,8 mol KOH (Doğru seçenek D) 8. n = MV ⇒ n = 2 x 0,150 ⇒ n = 0,3 mol XSO4 0,3 mol XSO4 40,8 g ise MXSO = MX + MS + 4MO 4 1 mol XSO4 x –––––––––––––––––––––––– 40,8 x = –––––– = 136 gʼdır. 0,3 9. M1V1 = M2V2 136 = MX + 32 + 4 x 16 MX = 40 g mol–1 (Doğru seçenek D) X : 40 10. M1V1 = M2V2 M x 2 = 0,8 (2 + 2) 1,6 x 2 = 8 (2 – x) M = 1,6 mol L–1 M1V1 + M2V2 = MV 2 x 0,6 + M2 x 0,4 = 2,7 (0,6 + 0,4) M2 = 3,75 mol L–1 X = 1,6 L (Doğru seçenek E) (Doğru seçenek E) 11. HCl için tesir değerliği (Td) 1 olduğundan N = Mʼdir. n 0,1 M = ––– ⇒ M = ––––– ⇒ M = 5 molar ⇒ N = 5 normal V 0,02 12. NaNO3 → Na+ + NO¯ 0,1 mol (Doğru seçenek E) 3 0,1 mol nNO3̄ = 0,1 + 0,4 + 0,9 ⇒ nNO3̄ = 1,4 mol Cu(NO3)2 → Cu+2 + 2NO¯3 0,2 mol n 1,4 M = ––– ⇒ M = –––– ⇒ M = 0,7 mol L–1 V 2 0,4 mol Fe(NO3)3 → Fe+3 + 3NO¯3 0,3 mol (Doğru seçenek C) 0,9 mol 8 13. 8 g NaOH –––– = 0,2 molʼdür ve 0,2 mol OH¯ iyonu oluşturur. 40 2M, 400 mL Ba(OH)2, 2 x 0,4 = 0,8 molʼdür ve 0,8 x 2 = 1,6 mol OH¯ iyonu oluşturur. 2M, 200 mL Al(OH)3, 2 x 0,2 = 0,4 molʼdür ve 0,4 x 3 = 1,2 mol OH¯ iyonu oluşturur. nOH¯ = 0,2 + 1,6 + 1,2 ⇒ nOH¯ = 3 molʼdür. VT = 0,4 + 0,2 = 0,6 L n 3 M = ––– ⇒ M = ––––– ⇒ M = 5 mol L–1 V 0,6 12,04 x 1023 14. 12,04 x 1023 tane OH¯ iyonu, –––––––––––– = 2 molʼdür. 6,02 x 1023 nKOH + 2nMg(OH) = 2 (Doğru seçenek E) 2 (Doğru seçenek A) 1 x 0,4 + 2(2 x V) = 2 ⇒ V = 0,4 L = 400 mL 15. n SO–2 = MV ⇒ n SO–2 = 0,02 x 0,5 = 0,01 mol 4 4 n SO–2 = n CuSO4 x H 2 O = 0,01 mol MCuSO = 0,01 mol CuSO4 . XH2O 1 mol bileşikte 250 – 160 = 90 g su vardır. 4 2,5 g ise 1 mol CuSO4 . XH2O x ––––––––––––––––––––––––––––––– 2,5 x = –––––– = 250 gramdır. 0,01 16 160 g mol–1 4 nH 2O 90 = X = –––– = 5ʼtir. 18 (Doğru seçenek E) www. pasayayincilik.com © 2004 III MADDENİN YOĞUN FAZLARI (SIVILAR-KATILAR 16. MgCl2 ⎯→ Mg+2 + 2Cl¯ 0,2 ––– = 0,1 M 2 17. Çözelti ısıtıldığında hacmi büyür. Dolayısıyla molar derişimi küçülür. Ancak kütlesi değişmediğinden % derişimi sabit kalır. 0,2 M (Doğru seçenek D) n = MV ⇒ n = 0,1 x 0,1 ⇒ n = 0,01 mol MgCl2 m = nM ⇒ m = 0,01 x 95 ⇒ m = 0,95 gram MgCl2 (Doğru seçenek B) Y d 20 x 1,2 18. M = ––––––––– x 10 ⇒ M = –––––––––– x 10 MNaOH 40 M = 6 mol L–1 (Doğru seçenek C) 19. 2(M1V1) + M2V2 = MV 2 (0,25 x 0,4) + M x 0,1 = 0,8 (0,4 + 0,1) M = 2 mol L–1 (Doğru seçenek B) 20. nMg+2 = MV ⇒ nMg+2 = 0,02 x 0,5 = 0,01 mol 0,01 mol bileşik 2,46 g ise 1 mol bileşik x –––––––––––––––––––––––––––– 2,46 x = –––––– = 246 gramdır. 0,01 246 = MMgSO + XMH 4 246 = 120 + X18 2O X= 7 (Doğru seçenek B) DENEY 3.1: Saf maddeler ile çözeltilerin kaynama ve donma sırasındaki davranışları Deney Sonu Sorularının Yanıtları 1. Saf su ve tuzlu su çözeltisinin kaynaması için geçen süreler birbirinden farklıdır. 2. Saf su ve tuzlu su çözeltilerinin kaynama noktaları farklıdır. (Tuzlu su çözeltisinin kaynamaya başladığı sıcaklık daha yüksektir.) 3. Tuzlu su çözeltisinin kaynaması süresince sıcaklık sabit kalmaz, yükselir. 4. Saf su ve tuzlu su çözeltisinin donma noktası farklıdır. (Tuzlu su çözeltisinin donmaya başladığı sıcaklık daha düşüktür.) tuzlu su saf su 5. Tuzlu su çözeltisinin donması süresince sıcaklık sabit kalmaz. DENEY 3.2: Su-etil alkol çözeltisinin damıtılması Deney Sonu Sorularının Yanıtları 1. Deney sırasında sıcaklığın sabit kaldığı anlar olur. termometre 2. Sıcaklığın sabit kaldığı ilk anda etil alkol ikinci anda su kaynar. 3. Yoğunlaşma kaplarında toplanan sıvılar karışımın bileşenleridir. Bu durum etil alkolün yanmasından, suyun yanmamasından anlaşılır. 4. Damıtma sırasında ısıtma kabının çeperlerinde yoğunlaşarak geriye dönen sıvı, etil alkole göre kaynama noktası daha yüksek olan sudur. soğutma suyu çıkışı Liebig soğutucu soğutma suyu girişi damıtma ürünü 5. Damıtma ile elde edilen sıvılar karıştırılırsa ilk sıvı karışımı elde edilir. KİMYA-2 17 IV BÖLÜM IV RADYOAKTİVİTE LİSE KİMYA 2 RADYOAKTİVİTE DEĞERLENDİRME ÇALIŞMALARI 1 ÇÖZÜMLERİ 1. Atom çekirdeği çok küçük olduğundan çekirdeği oluşturan proton ve nötronların çok sıkışık durumda olmaları ve birbirlerini itmeleri sonucu çekirdekte büyük bir kuvvet ortaya çıkar. Protonlar aynı cins elektrik yüküyle yüklü ve aralarındaki uzaklık çok küçük olduğundan Coulomb Yasasıʼna göre birbirlerini çok büyük kuvvetlerle iter. Ayrıca çekirdekteki P/n oranı büyüdükçe ya da küçüldükçe atomun çekirdeğinde kararsızlığa neden olur. 2. Kararsız çekirdek yapısına sahip olan elementler kararlı bir çekirdek yapısına ulaşmak için alfa (α), beta (β¯), gama (γ), pozitron (β+) bozunması ve elektron yakalanması şeklinde bozunmaya uğrayarak ışıma yapar. Bu elementlere ışıma yapan anlamında radyoaktif elementler denir. Radyoaktif ışımaların giricilikleri ve etkileri birbirinden tamamen farklıdır. Bu farklılık radyoaktif maddelerin karakteristik özelliğidir. 3. Bir nükleer reaktörde fisyon enerjisi kontrol altındadır. Reaktörde zenginleştirilmiş uranyum çubukları su içerisinde yüksek basınç altında asılmış durumdadır. Su iki amaçla kullanılır. Birincisi nötronları yavaşlatmak, ikincisi soğuk suyu, su buharına dönüştürmektir. Nükleer reaktörlerde nötronları kontrol amacıyla kadmiyum çubukları kullanılır. Bu çubuklar reaktör içine indirildiklerinde fisyon işlemi yavaşlar. Çubuklar reaktörden çıkarılınca nötron yoğunluğu artar fisyon hızı büyür patlamalara neden olur. Bu nedenle zincirleme çekirdek tepkimesi kontrol altında tutulmalıdır. 4. ADE bileşiği radyoaktif değilse A, D ve E elementleri radyoaktif değildir. Bu durumda CDE bileşiğinin radyoaktif oluşunun C elementinden kaynaklandığı kesindir. B elementinin radyoaktif olup olmadığı bu bilgilerle söylenemez. ABC bileşiğinin radyoaktif oluşu yalnız Cʼden kaynaklanacağı gibi Cʼnin yanında Bʼden de kaynaklanabilir. Radyoaktifliği kesin olan yalnız C elementidir. 5. Atom numarası 83ʼten büyük olan elementlerin izotoplarında hem proton sayısı hem de nötron sayısı fazladır. Bu nedenle bu izotoplar proton ve nötron sayılarını azaltmak için genellikle, çekirdekten 2 proton ve 2 nötron fırlatılmasıyla sonuçlanan α bozunmasına uğrarlar. Diğer ışımalar ise çekirdekteki proton ve nötron sayısında bu denli azalmaya neden olmaz. 6. Başlangıçtaki radyoaktif izotop X ile simgelenirse, α 2β– A A–4 4 A–4 A–4 0 ZX ⎯⎯⎯⎯→ Z–2Y + 2He Z–2Y ⎯⎯⎯→ ZQ + 2 –1e X ile Qʼnun atom numaraları aynı olduğu için X, VIIA grubundaysa Q da VIIA grubundadır. (X ile Q birbirinin izotopudur.). 3α , 2β– 226 2α β– 8. 88Ra ⎯⎯⎯⎯⎯→ ZAX + 342He + 2–10e 4 A–8 A–8 0 7. AZX ⎯⎯→ A–8 Z–4Y + 22He Z–4Y ⎯⎯→ (Z–4)+1 Z + –1e 226 = A + 3 x 4 = 2 x 0 ⇒ A = 214 A – 8 = 227 ⇒ A = 235 88 = Z + 3 x 2 + 2 (–1) ⇒ Z = 84 → 235 92X (Z – 4) + 1 = 89 ⇒ Z = 92 10. – 9. α, nβ ⎯⎯⎯⎯⎯→ 89 = 88 + 2 + n (–1) 225 89Ac 221 88X + 42He + n–10e 1 tane α ve 1 tane β¯ ışıması yapar. A ZX + 42He ⎯⎯→ 189Y + 11H A + 4 = 18 + 1 ⇒ A = 15 Z+2 =9+1⇒Z=8 18 0 – + AZX ⎯⎯⎯→ 197 79Au + –1β + Enerji 196 + A = 197 ⇒ A = 1 78 + Z = 79 – 1 ⇒ Z = 0 n = 1 tane β– ışıması 11. 196 78Pt n=A–Z n=7 Kütlesi 1, yükü sıfır olan tanecik nötrondur (10n). 1 2 3 4 12. 80 g ⎯→ 40 g ⎯→ 20 g ⎯→ 10 g ⎯→ 5 g t 48 Yarılanma sayısı = ––––– ⇒ 4 = ––––– ⇒ t1/2 = 12 dk t1/2 t1/2 www. pasayayincilik.com © 2004 IV RADYOAKTİVİTE t 2,5 x 60 13. n = –––– ⇒ n = ––––––––– t1/2 30 16 –––– m0 1 16 14. m = –––– n ⇒ –––– = ––––– 2 16 2n n n 4 2 = 16 ⇒ 2 = 2 ⇒ n = 4 kez yarılanır. t t n = –––– ⇒ 4 = –––– ⇒ t = 64 gün geçer. t1/2 16 n = 5 kez yarılanır. m0 m0 m = –––– ⇒ 5 = ––––– ⇒ m0 = 5 x 32 2n 25 m0 = 160 g 6. gün m0 12. gün m0 18. gün m0 15. m0 ⎯⎯⎯⎯→ ––––– ⎯⎯⎯⎯⎯→ ––––– ⎯⎯⎯⎯⎯→ ––––– 2 4 8 m0 m0 m0 96 –––– – –––– = 12 ⇒ m0 = 96 gramdır. m = –––– ⇒ m = –––– ⇒ m = 3 gram kalır. 4 8 2n 25 t 30 n = –––– ⇒ n = –––– ⇒ n = 5 kez yarılanır. t1/2 6 ∆m = (2mp + 2mn) – mHe 16. 2mp = 2 x 1,6726 x 10–24 = 3,3452 x 10–24 g ∆m = 6,6948 x 10–24 – 6,6466 x 10–24 2mn = 2 x 1,6748 x 10–24 = 3,3496 x 10–24 g ∆m = 0,0482 x 10–24 g ⇒ ∆m = 4,82 x 10–29 kg 2mp + 2mn = 3,3452 x 10–24 + 3,3496 x 10–24 g E = ∆mc2 2mp + 2mn = 6,6948 x 10–24 g E = 4,82 x 10–29 x (3 x 108)2 ⇒ E = 4,338 x 10–12 J 17. Çekirdek tepkime denklemlerinde, tepkimeye girenler ile oluşan ürünlerin nükleonlarının (proton ve nötronların) toplam sayısı değişmez. Kütle numaraları ve atom numaraları korunur. Ancak nükleonların korunması çekirdek tepkimelerinde kütlenin korunduğu anlamına gelmez. Nötronlar protona, protonlar nötrona dönüşürken büyük miktarda enerji açığa çıkar. E = mc2 denklemine göre açığa çıkan enerji taneciklerin birbirine dönüşümü sırasında kütle kaybı ya da kazancı olarak varsayılır. 18. a. 56 26Fe b. ⎯⎯→ AZX + –10e 56 27X d. 235 92U + –10e ⎯⎯→ AZX c. 179 74X 75 – 1 = Z ⇒ Z = 74 A 1 + 10n ⎯⎯→ 135 54Xe + ZX + 20n e. 235 + 1 = 135 + A + 2 x 1 ⇒ A = 99 4 + AZX ⎯⎯→ 32 16S + 2He 1 1X (11H) 17 + Z = 16 + 2 ⇒ Z = 1 26 0 + 25 12Mg ⎯⎯→ 13Al + 0γ A + 25 = 26 + 0 ⇒ A = 1 99 38X 92 + 0 = 54 + Z + 2 x 0 ⇒ Z = 38 A ZX 35 17Cl 35 + A = 32 + 4 ⇒ A = 1 179 + 0 = A ⇒ A = 179 56 = A + 0 ⇒ A = 56 26 = Z – 1 ⇒ Z = 27 179 75Re Z + 12 = 13 + 0 ⇒ Z = 1 1 1X (11H) 19. İyonlaştırıcı ışınlar kansere neden oldukları gibi kanser tedavisinde de kullanılabilir. Bu nedenle dikkatlice yönlendirilmiş γ ışınları ya da x ışınları uygun dozda verildiğinde kanserli hücrelerin büyümesini engeller ve sadece bu hücrelerin ölümüne neden olur. Radyoaktif izotopların fiziksel ve kimyasal özellikleri ile radyoaktif olmayan izotopların özellikleri arasında hiç bir fark yoktur. Tek fark çekirdeklerinin kararsız olmasıdır. Örneğin bitki besin maddesine az miktarda radyoaktif fosfor eklenerek bitki tarafından kullanılan fosfor miktarı izlenebilir. Benzer şekilde çok az radyoaktif iyot içeren bir iyodür çözeltisi insan tarafından içildiğinde iyodun vücut içindeki dağılımı izlenebilir. İyot, tiroit bezinde yoğunlaştığından, radyoaktif iyodun zararlarından daha önce normal iyot alınarak korunabilir. Bu durumda tiroit bezi radyoaktif olmayan iyot ile doymuş hâle gelir. Böylece radyoaktif iyodu kabul etmez. KİMYA-2 19 IV RADYOAKTİVİTE adde 1,0 bozunan — kalan x M 20. I. Yol geçen zaman 0,5 x –––– 2 x –––– 2 67 0,250 x –––– 4 x –––– 4 67 0,125 x –––– 8 x –––– 8 67 0,0625 x –––– 16 x –––– 16 67 t 268 n = ––––– = ––––– = 4 t1/2 67 m0 1 1 II. Yol m = –––– –––– = –––– ⇒ 16 = 2n ⇒ 24 = 2n ⇒ n = 4 olur. 2n 1 2n –––– 8 4 2 1 16 II. Yol ––– ––– ––– ––– 8 1 8 2 8 3 8 21. I. Yol m0 = 1,0 g 7 1 m = 1 – ––– = ––– olur. 8 8 3 kez yarılanmıştır. Yarı ömür 10 m0 1 1 saat olduğundan; m = –––– ⇒ ––– = ––– ⇒ n = 3ʼtür. 2n 8 2n 3 x 10 = 30 saat t t n = –––– ⇒ 3 = –––– ⇒ t = 30 t1/2 10 DEĞERLENDİRME ÇALIŞMALARI 2 ÇÖZÜMLERİ 1. XZ radyoaktif değilse X ve Z elementleri radyoaktif değildir, Y radyoaktiftir. 2. 3. (Doğru seçenek D) ⎯⎯→ 11p + –10e A değişmezken Z bir artar ve bu arada 1 e¯ fırlatılır. Bu durum β¯ ışımasında söz konusudur. 1 0n (Doğru seçenek A) ⎯⎯→ 10n + +10e Pozitron bozunmasında bir proton 1 nötrona dönüşür ve bu arada bir pozitron fırlatılır. 1 1p (Doğru seçenek B) 4. Bir maddenin radyoaktifliği fiziksel ve kimyasal süreçlerle değişmez. (Doğru seçenek C) 12 5. Kütle numarasında (234 – 222 = 12) azalma –––– = 3α ışımasıyla olur. 4 3α nα 234 222 4 6. 119X ⎯⎯⎯→ 115X + n4He 90Th ⎯⎯⎯→ 84X + 32He 119 = 115 + n x 4 ⇒ n = 1 → 1α ışıması yapmıştır. nβ– 222 222 0 84X ⎯⎯⎯→ 86Rn + n–1e 1α, nβ– 119 115 4 0 – X ⎯⎯⎯⎯⎯→ 49 49X + 2He + n–1e 84 = 86 + n(–1) ⇒ n = 2 β 49 = 49 + 2 + n (–1) ⇒ n = 2 → 2β– ışıması yapmıştır. ışıması ile gerçekleşir. (Doğru seçenek B) (Doğru seçenek D) 3α, 2β–, 1β+ A 4 0 0 2α, 3β– 230 8. 223 87Fr ⎯⎯⎯⎯⎯⎯⎯→ ZX + 32He + 2–1e + +1e A 4 0 7. ZX ⎯⎯⎯⎯→ 92Y + 22He + 3–1e 223 = A + 3 x 4 + 2 x 0 + 0 ⇒ A = 211 A = 230 + 2 x 4 + 3 x 0 ⇒ A = 238 211 238 82X 93A 87 = Z + 3 x 2 + 2(–1) + 1 ⇒ Z = 82 Z = 92 + 2 x 2 + 3(–1) ⇒ Z = 93 (Doğru seçenek B) (Doğru seçenek D) 9. Pbʼnun bir izotopunun oluşması için ışımalar sonucu yine Z = 82 olmalıdır. Bunun koşulu ise n tane α ışımasına karşılık 2n tane β– ışıması yapılmasıdır. 1α, 2β– 214 210 4 0 Pb ⎯⎯⎯⎯⎯→ 82 82Pb + 2He + 2–1e (Doğru seçenek C) 20 www. pasayayincilik.com © 2004 IV RADYOAKTİVİTE 10. ZX 2α, 1β ⎯⎯⎯⎯⎯⎯⎯→ Z–3Y + 224He + –10e ZX IIA grubunda ise elektron sayısı 3 tane eksik olan Z–3Y bir önceki periyodun VIIA grubunda (halojenler) bulunur. (Doğru seçenek A) t 18 11. n = –––– ⇒ n = ––––– ⇒ n = 3 kez yarılanmıştır. t1/2 6 m0 m0 m = ––––– ⇒ m0–31,5 = ––––– ⇒ m0 = 36 g n 2 23 m = 36 – 31,5 ⇒ m = 4,5 g (Doğru seçenek A) t 16 12. n = –––– ⇒ n = ––––– ⇒ n = 4 kez yarılanmıştır. t1/2 4 m0 100 m = ––––– ⇒ m = –––––– ⇒ m = 6,25 g % 6,25ʼi bozunmadan kalır. (Doğru seçenek E) n 2 24 3. saat m0 6.saat m0 9.saat m0 12. saat m0 15. saat m0 18.saat m0 13. m0 ⎯⎯⎯→ –––– ⎯⎯⎯⎯→ –––– ⎯⎯⎯→ –––– ⎯⎯⎯→ ––– ⎯⎯⎯⎯→ –––– ⎯⎯⎯⎯→ –––– 2 4 8 16 32 64 m0 m0 –––– – –––– = 28 ⇒ m0 = 256 gʼdır. (Doğru seçenek E) 9m0 m0 8 64 15. m = m0 – –––––– ⇒ m = ––––– 12 4 m0 m0 m0 m0 m0 m0 14. m = –––– ⇒ ––––– = ––––– m = ––––– 2n 8 2n n ⇒ –––– = ––––– 2 4 2n 2n = 8 ⇒ 2n = 23 ⇒ n = 3 kez yarılanır. n 2 = 4 ⇒ n = 2 kez yarılanır. t t n = ––––– ⇒ 3 = –––– ⇒ t = 12 gün geçer. t 12 t1/2 4 n = ––––– ⇒ 2 = ––––– ⇒ t1/2 = 6 gün (Doğru seçenek A) t1/2 t1/2 (Doğru seçenek D) A 1 247 4 16. ZX + 1p ⎯⎯→ 96Cm + 2He 1 143 Y 1 17. 230 90Th + 0n ⎯⎯⎯→ XI + 37Rb + 30n A + 1 = 247 + 4 ⇒ A = 250 230 + 1 = 143 + Y + 3 x 1 ⇒ Y = 85 250 97X 90 = X + 37 ⇒ X = 53 Z + 1 = 96 + 2 ⇒ Z = 97 (Doğru seçenek A) m0 8 x 108 8 8 18. m = –––– ⇒ 8 x 10 – 7,5 x 10 = ––––––––– ⇒ 2n = 16 ⇒ n = 4 2n 2n t 4 n = –––– ⇒ 4 = ––––– ⇒ t1/2 = 1 dk ⇒ t/2 = 60 s t1/2 t1/2 5 x 1021 19. 5 x 1021 tane 240X, –––––––––––– = 8,33 x 10–3 molʼdür. 6,02 x 1023 8,33 x 10–3 mol 240X, 8,33 x 10–3 x 240 ≈ 2 gʼdır. m0 16 m = –––– ⇒ 2n = 8 ⇒ n = 3 kez yarılanmıştır. n ⇒ 2 = –––– 2 2n t 8,1 x 104 n = –––– ⇒ 3 = –––––––––– ⇒ t1/2 = 2,7 x 104 yıl t1/2 t1/2 20. Geçen süre (t) aynı ise; (Doğru seçenek C) (Doğru seçenek C) (Doğru seçenek C) nX . t1/2(X) = ny . t1/2(y) yazılabilir. nX . 2t1/2(y) = ny . t1/2(y) ⇒ 2nX = ny bulunur. m0 m0 nX = 1 ise; mX = ––––– 1 ⇒ mX = ––––– olur. 2 2 m0 m0 ny = 2 olur ve my = ––––– 2 ⇒ my = ––––– bulunur. 2 4 KİMYA-2 m0 –––– mx 2 mx –––– = –––– ⇒ ––––– =2 my m0 my –––– 4 (Doğru seçenek B 21 KİMYASAL REAKSİYONLAR VE ENERJİ (TERMOKİMYA) V BÖLÜM V LİSE KİMYASAL REAKSİYONLAR VE KİMYA 2 ENERJİ (TERMOKİMYA) DEĞERLENDİRME ÇALIŞMALARI 1 ÇÖZÜMLERİ 1. 1 mol H2O olufltuğunda 241,8 kJ ısı açığa çıkarsa 5 mol H2O olufltuğunda x –––––––––––––––––––––––––––––––––––––––––– x = 5 x 241,8 = 1209 kJ açığa çıkar. 5500 cal için 2. 5 L su ≈ 5000 g sudur. 1 g kömür yakılırsa 110 000 cal için x –––––––––––––––––––––––––––––––– 110 000 x = –––––––– = 20 g kömür yakılır. 5500 Qsu = mc (t2–t1) Qsu = 5000 x 1 x (42 – 20) Qsu = 110 000 cal 3. N2(g) + 3H2(g) ⎯→ 2NH3(g) 0,1 mol NH3 oluflunca 1,4 1,4 g N2, ––––– = 0,05 molʼdür. 28 0,05 mol N2ʼtan 2 x 0,05 = 0,1 mol NH3 oluflur. 4,69 kJ ısı açığa çıkarsa 1 mol NH3 oluflunca x ––––––––––––––––––––––––––––––––––––––––– 4,69 x = –––––– = 46,9 kJ ısı açığa çıkar. 0,1 –1 ∆HN̊H = – 46,9 kJ mol 3 4. H2(g) + 1/2O2(g) ⎯→ H2O(g) ∆H˚ = –241,8 kJ + H2O(g) + 1/2O2(g) ⎯→ H2O2(g) –––––––––––––––––––––––––––––– H2(g) + O2(g) ⎯→ H2O2(g) 5. + ∆H˚ = + 105,4 kJ –––––––––––––––––––––––––––––––––– ∆H˚ = –241,8 + 105,4 ⇒ ∆H˚ = –136,4 kJ +2 Zn(k) + Cu+2 (suda) ⎯→ Zn (suda) + Cu(k) –––––– –––––––– 1 mol ∆H˚ = –217,6 kJ 1 mol 2,6 2,6 g Zn, ––––– = 0,04 molʼdür. Cu+2 iyonları, 0,2 x 0,05 = 0,01 molʼdür. 65 0,01 mol Cu+2 iyonu 0,01 mol Zn ile tepkimeye girer (0,03 mol Zn artar). 1 mol Cu+2 iyonundan 217,6 kJ ısı açığa çıkarsa +2 0,01 mol Cu iyonundan x –––––––––––––––––––––––––––––––––––––––––––––– x = 0,01 x 217,6 = 2,176 kJ ısı açığa çıkar. 6. H2O(k) ⎯→ H2O(s) 0,9 0,9 g buz, ––––– = 0,05 molʼdür. 18 1 mol buz için 49,7 kJ gerekirse ∆H˚ = 5,7 kJ + H2O(s) ⎯→ H2O(g) –––––––––––––––––––– H2O(k) ⎯→ H2O(g) + ∆H˚ = 44 kJ ––––––––––––––– ∆H˚ = 49,7 kJ 0,05 mol buz için x –––––––––––––––––––––––––––––– x = 0,05 x 49,7 = 2,485 kJ gerekir. 7. CH3OH(s) + 3/2O2(g) ⎯→ CO2(g) + 2H2O(g) ∆H˚ = ∑∆HÜ̊ – ∑∆HR̊ ∆H˚ = (∆HC̊O 2 + 2∆HH̊ O) – (∆HC̊H 2 3OH + 3/2 ∆HO̊ ) 2 ∆H˚ = [–393,5 + 2(–241,8)] – (–238,7 + 0) ⇒ ∆H˚ = –638,4 kJ 22 www. pasayayincilik.com © 2004 KİMYASAL REAKSİYONLAR VE ENERJİ (TERMOKİMYA) 8. 9. S(k) + 3/2O2(g) → SO3(g) H2(g) + 1/2O2(g) → H2O(s) + SO3(g) + H2O(s) → H2SO4(s) ––––––––––––––––––––––––––––––– S(k) + H2(g) + 2O2(g) → H2SO4(s) ∆H˚ = –395,7 kJ ∆H˚ = –285,8 kJ + ∆H˚ = –130,7 kJ –––––––––––––––––––––––––––––––––––– ∆H˚ = (–395,7) + (–285,8) + (–130,7) ∆H˚ = –812,2 kJ 2Al(k) + 3/2O2(g) → Al2O3(k) ∆H˚ = –1676 kJ + Fe2O3(k) → 2Fe(k) + 3/2O2(g) –––––––––––––––––––––––––––––––––– 2Al(k) + Fe2O3(k) → Al2O3(k) + 2Fe(k) 10. I. ∆H˚ = 2 (+393,5) kJ H2O(s) → H2(g) + 1/2O2(g) III. IV. + ∆H˚ = +824,2 kJ –––––––––––––––––––––– ∆H˚ = –1676 + 824,2 ∆H˚ = –851,8 kJ 2CO2(g) → 2C(k) + 2O2(g) II. ∆H˚ = +285,8 kJ 2C(k) + H2(g) → C2H2(g) ∆H˚ = +226,7 kJ C2H2(g) + H2O(s) → CH3HO(s) ∆H˚ = –138 kJ + V. C2H5OH(s) + 3O2(g) → 2CO2(g) + 3H2O(s) –––––––––––––––––––––––––––––––––––––––––––– C2H5OH(s) + 1/2O2 → CH3CHO(s) + H2O(s) 11. 1/2N2(g) + 3/2H2(g) → NH3(g) + ısı ––––––– –––––– 14 g V + ∆H˚ = –1380 kJ ––––––––––––––––––––––– ∆H˚ = –218,5 kJ 1,4 g N2ʼtan 1 mol 4,686 kJ ısı açığa çıkar 14 g N2ʼtan x –––––––––––––––––––––––––––––––– x = 46,86 kJ ısı açığa çıkar. 14 g N2ʼtan 1 mol NH3 olufltuğuna göre; 56 cm3 su ≈ 56 gramdır. Qsu = mc∆t Qsu = 56 x 4,184 x 20 NH3 için ∆HN̊H = – 46,86 kJ mol–1 Qsu = 4686 J = 4,686 kJ 3 0,25 mol X 12. Q = Qkap + Qsu 22,9 kJ 1 mol X x –––––––––––––––––––– 22,9 x = –––––– = 91,96 kJ 0,25 –1 ∆HX̊(yanma) = –91,96 kJ mol Q = mc∆t + mc∆t Q = 500 x 0,836 x 5 + 1000 x 4,18 x 5 Q = 22900 J Q = 22,9 kJ 13. NaOH(suda) + HNO3(suda) → NaNO3(k) + H2O(s) ∆H˚= –Q kJ Q kJ ısı 1 mol NaOHʼtan Q ––– kJ ısı x 4 –––––––––––––––––––––––––––– Q/4 x = ––––– = 0,25 mol NaOHʼtan açığa çıkar. vQ 14. n M = –––– V 0,25 M = –––––– 0,25 M = 1 mol L–1 KClO3(k) → K(k) + 1/2Cl2(g) + 3/2O2(g) + K(k) + 1/2Cl2(g) + 2O2(g) → KClO4(k) ––––––––––––––––––––––––––––––––––– KClO3(k) + 1/2O2(g) → KClO4(k) 1 mol KClO3ʼtan 35,1 kJ 2 mol KClO3ʼtan x ––––––––––––––––––––––––– x = 2 x 35,1 = 70,2 kJ ısı açığa çıkar. KİMYA-2 ∆H˚ = +397,7 kJ + ∆H˚ = –432,8 kJ –––––––––––––––––––– ∆H˚ = –35,1 kJ ∆H˚ = –70,2 kJ 23 V KİMYASAL REAKSİYONLAR VE ENERJİ (TERMOKİMYA) 15. 2X(k) + 3/2O2(g) → X2O3(k) 1129,7 kJ için ∆H˚ = –1129,7 kJ 0,4 mol X 2 mol X gerekirse 1 mol X x ––––––––––––––––––––––– 20,8 x = ––––– = 52 gʼdır. X: 52 0,4 225,9 kJ için x –––––––––––––––––––––––––––––– 225,9 x 2 x = –––––––––– = 0,4 mol X gerekir. 1129,7 16. Mg(k) + 1/2O2(g) → MgO(k) ∆H˚ = –601,7 kJ 16 g O2 24 g Mg ile tepkirse 16 g O2ʼden 601,7 kJ ısı açığa çıkarsa 2,4 g O2 x ––––––––––––––––––––––––– x = 3,6 g Mg ile tepkir. t2 = 41,08˚C 17. H2(g) + 1/2O2(g) → H2O(s) 2g 20,8 g ise 2,4 g O2ʼden x –––––––––––––––––––––––––––––––– x = 90,255 kJ ısı açığa çıkar. ∆H˚ = –285,8 kJ 90 255 = 20 000 x 4,184 (t2 – 40) 18. 2O3(g) → 3O2(g) 2 x 48 g O3ʼdan 16 g ∆H˚ = –285,4 kJ 285,4 kJ ısı açığa çıkarsa 4,8 g O3ʼdan x –––––––––––––––––––––––––––––––––––– 4,8 x 285,4 x = –––––––––––– = 14,27 kJ ısı açığa çıkar. 2 x 48 Denkleme göre 16 g O2 ile 2 g H2 tepkime verir ve 285,8 kJ ısı açığa çıkar (Hidrojen gazının 2 gramı artar.). 19. H—C ≡ C—H + H—H → H—C = C — H | | H H ∆H = ∑HK — ∑HO Q = mc (t2 – t1) 20. 2H—O—O—H → 2H—O—H + O = O ∆H = (2 x 413 + 839 + 432) – (4 x 413 + 614) ∆H = ∑HK – ∑HO ∆H = 2(2 x 467 + 146) – [2(2 x 467) + 495] ∆H = –203 kJ ∆H = –169 kJ 21. 22,4 L CH4ʼten 890 kJ 22,4 L C2H6ʼdan 1559,8 kJ 1 L CH4ʼten x 1 L C2H6ʼdan x ––––––––––––––––––––––––––– ––––––––––––––––––––––– x = 39,73 kJ x = 69,63 kJ C2H6 = X L ise CH4 = 10 – x Lʼdir. 69,63 · x + 39,73 (10 – x) = 436 x ≅ 1,3 L ⇒ C2H6 = 1,3 L CH4 = 10 – 1,3 = 8,7 L 1. Ep (ürünler) ∆H = Ep DEĞERLENDİRME ÇALIŞMALARI 2 ÇÖZÜMLERİ > Ep (girenler) – Ep (ürünler) 2. ∆H < 0 ise Ep (girenler) (ürünler) 3. 24 < Ep ⇒ ∆H > 0ʼdır ve tepkime endotermiktir. (Doğru seçenek B) ʼdir. (girenler) (Doğru seçenek D) 393,3 890 1 g C yanınca ––––– = 32,775 kJ ısı açığa çıkar. 1 g CH4 yanınca –––– = 55,625 kJ ısı açığa çıkar. 12 16 241,8 1559,8 1 g H yanınca –––––– = 120,9 kJ ısı açığa çıkar. 1 g C2H6 yanınca ––––– = 51,993 kJ ısı açığa çıkar. 2 2 50 283 1 g CO yanınca ––––– = 10,11 kJ ısı açığa çıkar. 28 Eflit kütleleri (örneğin 1 gram) alındığında en çok ısı veren H2ʼdir. (Doğru seçenek B) www. pasayayincilik.com © 2004 V KİMYASAL REAKSİYONLAR VE ENERJİ (TERMOKİMYA) 4. 2H2S(g) + 3O2(g) → 2H2O(g) + 2SO2(g) ∆H˚ = ∆HÜ̊ ∆H˚ = (2∆HH̊ O 2 5. 6NO(g) + 4NH3(g) → 5N2(g) + 6H2O(g) – ∆HR̊ + 2∆HS̊O ) – (2 x ∆HH̊ S) 2 2 ∆H˚ = ∆HÜ̊ – ∆HR̊ ∆H˚ = 6∆HH̊ O 2 – (6∆HN̊O + 4∆HN̊H ) ∆H˚ = 6 (–241,8) – [(6 x 90,25) + 4(–46,1)] ∆H˚ = –1035,94 kJ ∆H˚ = –1807,9 kJ (Doğru seçenek E) (Doğru seçenek B) 6. NO2(g) → NO(g) + 1/2O2(g) ∆H˚ = 58,6 kJ + SO2(g) + 1/2O2(g) + H2O(s) → H2SO4(s) –––––––––––––––––––––––––––––––––––––––– NO2(g) + SO2(g) + H2O(s) → H2SO4(s) + NO(g) 7. 3 ∆H˚ = [2(–241,8) + 2(–296,8)] – [2(–20,63)] + ∆H˚ = –230 kJ –––––––––––––––––– ∆H˚ = 58,6 + (–230) ⇒ ∆H˚ = –171,4 kJ (Doğru seçenek B) 2NO2(g) → N2(g) + 2O2(g) ∆H˚ = 2 x (–33,18) kJ N2(g) + 3H2(g) → 2NH3(g) ∆H˚ = –92,2 kJ + 4H2(g) + 2O2(g) → 4H2O(g) –––––––––––––––––––––––––––––– 2NO2(g) + 7H2(g) → 2NH3(g) + 4H2O(g) + ∆H˚ = 2 x (–483,6) kJ ––––––––––––––––––––––––––––– ∆H˚ = [2 x (–33,18)]+(–92,2) + [2 x (–483,6)] ∆H˚ = –1125,76 kJ (Doğru seçenek C) 8. 6KOH(suda) + 3Cl2(g) → 5KCl(k) + KClO3(k) + 3H2O(s) ∆H˚ = –862 kJ ∆H˚ = ∆HÜ̊ – ∆HR̊ –862 = (5∆HK̊Cl + ∆HK̊ClO + 3∆HH̊ O) – (6 ∆HK̊OH) 3 2 –862 = [5(–436,7) + ∆HK̊ClO + 3(–285,8)] – [6(– 424,8)] ∆HK̊ClO 3 3 = –369,9 kJ (Doğru seçenek C) 9. Verilen üç tepkimenin ∆Hʼsi aynı zamanda tepkimelerde oluflan maddelerin standart oluflma entalpisidir. 2AgNO3(k) + H2S(g) → Ag2S(k) + 2HNO3(g) ∆H˚ = (2∆HH̊NO 3 ∆H˚ = –112,1 kJ + ∆HÅg S) – (2∆HÅgNO + ∆HH̊ S) 2 3 2 –112,1 = [2 (–173,2) + (–31,8)] – [2AHÅgNO + (–20,63)] ∆HÅgNO 3 = –122,7 kJ 10. 238,5 kJ ısı 29 gʼdan oluflursa 1431 kJ ısı M gʼdan oluflur. –––––––––––––––––––––––––––– 1431 x 29 M = ––––––––––– = 174 g 238,5 3 (Doğru seçenek A) MX 2SO4 = 2MX + MS + 4MO 174 = 2MX + 32 + 4 x 16 MX = 39 g mol–1 X: 39 (Doğru seçenek B) 11. 2NH3 + 5/2O2 → 2NO + 3H2O ∆H˚ = – 453,4 kJ 2 mol NH3ʼtan 453,4 kJ ısı oluflursa 0,5 mol NH3ʼtan x –––––––––––––––––––––––––––––––––– 0,5 x 453,4 x = ––––––––––– = 113,35 kJ ısı oluflur. 2 KİMYA-2 2C + H2 → C2H2 ∆H˚ = 226,7 kJ 226,7 kJ ısı harcanınca 22,4 L C2H2 oluflursa (N.K. da) 113,35 kJ ısı harcanınca x ––––––––––––––––––––––––––––––––––––––––––––––– 113,35 x 22,4 x = –––––––––––– = 11,2 L C2H2 oluflur. 226,7 (Doğru seçenek B) 25 V KİMYASAL REAKSİYONLAR VE ENERJİ (TERMOKİMYA) 12. CO(g) + 3H2(g) → CH4(g) + H2O(g) + ısı 22,4 L 3 x 22,4 L 3 x 22,4 L H2 ile 22,4 L CO tepkirse 1,12 L COʼten 3,36 L H2 ile x –––––––––––––––––––––––––––––––––––– 3,36 x 22,4 x = ––––––––––– = 1,12 L CO tepkir. 3 x 22,4 ∆H˚ = ∆HÜ̊ – ∆HR̊ 10,4 kJ ısı oluflursa 22,4 L COʼten x –––––––––––––––––––––––––––––––––––– 22,4 x 10,4 x = ––––––––––– = 208 kJ ısı oluflur. 1,12 –208 = (∆HC̊H + ∆HH̊ O) – (∆HC̊O) 4 2 –208 = [∆HC̊H + (–241,8)] – (–110,5) ⇒ 4 ∆HC̊H 4 (Doğru seçenek C) = –76,7 kJ 13. 6NaOH(k) + 3Cl2(g) → 5NaCl(k) + NaClO3(k) + 3H2O(s) ∆H˚ = ∆HÜ̊ – ∆HR̊ ∆H˚ = (5∆HN̊aCl + ∆HN̊aClO + 3∆HH̊ O) – (6 ∆HN̊aOH) 3 2 ∆H˚ = [5(– 411,1) + (–365,8) + 3(–285,8)] – [6(– 425,6)] ∆H˚ = –725,1 kJ 725,1 kJ ısı 6 mol NaOHʼten oluflursa 36,255 kJ ısı x ––––––––––––––––––––––––––––––––––– 36,255 x 6 x = –––––––––– = 0,3 mol NaOHʼten oluflur. 725,1 14. CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) ∆H˚ = –890 kJ n M = –––– V 0,3 M = –––––– 0,4 M = 0,75 mol L–1 (Doğru seçenek C) 2,24 2,24 L CH4 gazı, N.K. da ––––– = 0,1 molʼdür. 22,4 8 8 g O2 gazı, –––– = 0,25 molʼdür (0,05 mol O2 artmaktadır.). 32 I. Daha çok CH4 kullanılırsa ortamda O2 olduğu için daha çok ısı elde edilir. II. CH4ʼın hepsi 8 g O2 gazı ile tüketildiği için daha çok ısı elde edilemez. III. Sıcaklık sabitse hacim veya basınç değiflimi gazların oluflma entalpisini değifltirmez. 15. 6KOH(k) + 3Cl2(g) → 5KCl(k) + KClO3(k) + 3H2O(s) ∆H˚ = –889,8 kJ (Doğru seçenek A) 2 NH3(g) → N2(g) + 3H2(g) ∆H˚ = 92,2 kJ 3 x 22,4 L Cl2 gazından 889,8 kJ ısı oluflursa 3,48 L Cl2 gazından x –––––––––––––––––––––––––––––––––––––––– 3,48 x 889,8 x = –––––––––––– = 46,08 kJ ısı oluflur. 3 x 22,4 92,2 kJ ısı harcanınca 2 mol NH3 ayrıflırsa 46,08 kJ ısı harcanınca x ––––––––––––––––––––––––––––––––––––– 46,08 x 2 x = –––––––––– 0,999 ≈ 1 mol NH3 ayrıflır. 92,2 (Doğru seçenek E) 16. CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) ∆H˚ = –890 kJ 22,4 PV = nRT ⇒ 2 x 33,6 = n x –––––– x 273 ⇒ n = 3 mol CH4 273 1 mol CH4ʼdan 890 kJ ısı açığa çıkarsa 3 mol CH4ʼdan x ––––––––––––––––––––––––––––––––––– x = 3 x 890 = 2670 kJ ısı açığa çıkar. 26 (Doğru seçenek D) www. pasayayincilik.com © 2004 V KİMYASAL REAKSİYONLAR VE ENERJİ (TERMOKİMYA) 17. 2C(k) + O2(g) → 2CO(g) 1 mol O2ʼden ∆H˚ = –221 kJ C(k) + CO2(g) → 2CO(g) ∆H˚ = 110,5 kJ 110,5 kJ ısının soğrulması için 221 kJ ısı oluflursa 2 mol O2ʼden x –––––––––––––––––––––––––––––– x = 2 x 221 = 442 kJ ısı oluflur. 18. 760 cm3 su, 760 gramdır (dsu = 1 g cm–3) 1 mol CO2 tepkirse 442 kJ ısının soğrulması için x –––––––––––––––––––––––––––––––––––––––––– 442 x = –––––– = 4 mol CO2 tepkir. 110,5 (Doğru seçenek C) Q = m c ∆t ⇒ Q = 760 x 4,184 x 24,89 ⇒ Q = 79146 J ⇒ Q = 79,15 kJ S(k) + 3/2O2(g) → SO3(g) 6,4 g S yakılınca ∆H˚ = ∆HS̊O 3(g) 79,15 kJ ısı açığa çıkarsa 32 g S yakılınca x –––––––––––––––––––––––––––––––––––––– 32 x 79,15 x = ––––––––––– = 395,75 kJ ısı açığa çıkar. ∆HS̊O = –395,75 kJ mol–1 3(g) 6,4 (Doğru seçenek B) 19. 3Cu(k) + 8HNO3(s) → 3Cu(NO3)2(k) + 2NO(g) + 4H2O(s) ∆H˚ = –2050 kJ 2050 kJ ısı açığa çıktığında 2 mol NO açığa çıkarsa 410 kJ ısı açığa çıktığında x ––––––––––––––––––––––––––––––––––––––––––– 410 x 2 x = –––––––– = 0,4 mol NO açığa çıkar. 2050 22,4 PV = nRT ⇒ P x 11,2 = 0,4 x –––––– x 273 ⇒ P = 0,8 atm 273 (Doğru seçenek C) 20. 1. tepkime 2/3 ile çarpılmalı, 2. tepkime ters çevrilip 3ʼe bölünmelidir ki toplamları ∆Hʼsi sorulan tepkimeyi versin. 4 8 –––– NH3 + 2N2O → –––– N2 + 2H2O 3 3 2 4 –––– N2 + 2H2O → –––– NH3 + O2 + 3 3 –––––––––––––––––––––––––––––––––––– 2 ∆H1̊ ´ = –––– ∆H1̊ 3 ∆H2̊ ∆H2̊ ´ = ––––– + 3 –––––––––––––––––––––– 2∆H1̊ – ∆H2̊ ∆H˚ = ––––––––––––– 3 (Doğru seçenek C) 2N2O → 2N2 + O2 DENEY 5.1: Tepkime ısısının belirlenmesi Deney Sonu Sorularının Yanıtları 1. Qsu = 100 · 4,18 · (∆t) Qcam = m · 0,836 · (∆t) Qçöz = 100 · 4,18 (∆t) 2. Tepkimelerde 1 mol NaOH kullanılırsa yaklaflık 10,3 kcal ısı açığa çıkar. NaOH HCl NaCl – 3. NaOH(k) → Na+(suda) + OH(suda) : ∆H ≅ –10,3 kcal NaOH(suda) + HCl(suda) → NaCl(suda) + H2O ∆H ≅ –15,1 kcal NaOH(k) + HCl(suda) → NaCl(suda) + H2O ∆H ≅ –24,1 kcal KİMYA-2 27 VI BÖLÜM VI KİMYASAL REAKSİYONLARIN HIZLARI LİSE KİMYA 2 KİMYASAL REAKSİYONLARIN HIZLARI DEĞERLENDİRME ÇALIŞMALARI 1 ÇÖZÜMLERİ 1. Giren taneciklerinin çarpışarak ürüne dönüşebilmeleri için sahip olmaları gereken minimum enerjiye aktiflenme enerjisi denir. 3. 2. Aktifleşme enerjisi kadar enerjiye sahip giren taneciklerinin çarpışması sırasında oluşan ve ömrü çok kısa olan kararsız yapıya aktifleşEkzotermik tepkimelerde; miş kompleks adı verilir. Tepkimeler, bir çeşit Ea < Ea EP > EP i g G Ü geçiş durumu olan aktifleşmiş kompleks oluş∆H = Ea –Ea ∆H = Ep –Ep i g ü G tuktan sonra gerçekleşir. ∆H < 0 ∆H < 0 CO + NO2 ⎯→ [NO2CO] → CO2 + NO Girenler Aktifleşmiş kompleks Endotermik tepkimelerde Ea > Ea EP < EP ∆H = Ea –Ea ∆H = Ep –Ep ∆H > 0 ∆H > 0 i g i g G Ü Ü Ürünler 4. Tepkimenin hızını artıran ve tepkimeden kimyasal özellikleri değişmeden çıkan maddelere katalizör denir. Katalizörler, giren taneciklerin daha düşük enerjili aktifleşmiş kompleks oluşturmalarını sağlar, yani aktifleşme enerjisini düşürür. Aktifleşme enerjisi Ea kadar olan bir tepkimeye katalizör eklenirse, tepkimenin aktifleşme enerjisi ∆E kadar düşer. 5. ® Tepkimede renk değişimi oluyorsa rengin değişmesinden, ® Ortamda gaz madde varsa basınç ya da hacim değişmesinin ölçülmesinden, ® İyonlu bir tepkime varsa elektiriksel iletkenliğin ölçülmesinden, ® Çökelme oluyorsa çökelek miktarının ölçülmesinden, + – ® Ortamda H ya da OH varsa ortamın pHʼ sinin ölçülmesinden, vb. tepkimenin hızı ölçülebilir. 6. Bir tepkimede girenlerin, art arda gerçekleşen bir dizi basamakla ürünlere dönüşme sürecine tepkime mekanizması denir. Bir tepkimenin hızının, girenlerin derişimine ne oranda bağlı olduğunu ifade eden bağıntıya hız denklemi adı verilir. Hız sabiti, her tepkimede o tepkimeye özgü bir değere sahip olan ve değeri yalnız sıcaklıkla değişen sabit sayıdır. 7. Hız denkleminde yer alan maddelerin molar derişimlerinin , tepkime hızına hangi oranda etkili olduklarını gösteren sayıların (sembollerdeki “üs” lerin) toplamına derecesi denir. Söz gelimi; hız denklemi v = k [NO2]2 şeklinde olan 2 NO2 → 2NO + O2 tepkimesinin derecesi 2ʼdir. H2 + Br2 → 2HBr tepkimesi ilk bakışta 2. dereceden gözükmekle beraber deney sonucuna göre yazılan hız denklemi v = k[H2] [Br2]1/2 1 3 şeklinde olup tepkimenin derecesi, 1+ ––– = –––ʼdir. 2 2 28 www. pasayayincilik.com © 2004 G KİMYASAL REAKSİYONLARIN HIZLARI 8. VI ® Çok sayıda bağın koptuğu ve oluştuğu tepkimeler diğerlerine göre, aynı yüklü iyonların tepkimesi zıt yüklü iyonların tepkimesine göre yavaştır. ® Derişimin artması girenlerin birbiriyle çarpışma olasılığını artıracağından tepkimelerin hızlanmasına neden olur. ® Sıcaklığın artırılması, kinetik enerjinin artmasına, kinetik enerjinin artması giren taneciklerinin hızlanmasına ve bu da girenlerin birbirleriyle daha sık çarpışmasına, dolayısıyla tepkimenin hızlanmasına neden olur. 9. v = 3 x 104 k = 3 x 10 4 ⇒ v = k dir, v = k [Girenler]n bağıntısının v = k şeklinde olabilmesi için n = 0 olmalıdır. 10. N2O2(g) + H2(g) → H2O(s) + N2O(g) v = k [N2O2] [H2] Tepkimenin derecesi , 1 + 1 = 2ʼdir. 0,3 n 0,15 11. nH = ––––– ⇒ n = 0,15 mol MH = –––– ⇒ MH = ––––– ⇒ MH = 0,015 mol/L–1 2 2 2 2 2 V 10 ∆M 0,015 vH = ––––– ⇒ vH = ––––––– ⇒ vH = 1,5 x 10–4 mol L–1s–1 2 2 2 ∆t 100 N2(g) + 3H2(g) → 2NH3(g) 2 2 vNH = ––– vH ⇒ vNH = ––– x 1, 5x 10–4 ⇒ vNH = 1 x 10–4 mol L–1s–1 3 2 3 3 3 3 5,5 12. ∆mCO = 22 – 16,5 = 5, 5 gʼdır. 5,5 g CO2, ––––– = 0, 125 molʼdür. 2 44 n 0,125 MCO = –––– ⇒ MCO = ––––––– ⇒ MCO = 0,5 mol L–1 2 2 2 V 0,25 ∆M 0,5 vCO = ––––– ⇒ vCO = –––––– ⇒ vCO = 1, 33 x 10–2 mol L–1 s–1 2 2 2 ∆t 37,5 b. ∆H < 0 ise tepkime ekzotermiktir. 13. CH3OH(s) + 3/2O2(g) ⎯→ CO2(g) + 2H2O(g) ∆H˚ = ∆HÜ̊– ∆HG̊ ∆H˚ = (∆H˚CO + 2∆H˚H O) – (∆H˚CH 2 2 ) 3OH ∆H˚ = [(–393,5) + 2(–241,8)] – (–238,7) ∆H˚ = –638,4 kJ a. ∆H = Ea – Ea ⇒ –638,4 = 60 – Ea ⇒ Ea = 698,4 kJ i g g g 14. Bağ kopması ve bağ oluşumu içermeyen II numaralı tepkime bir tek elektronun transferiyle gerçekleşir. Bu yüzden en hızlıdır. Birden fazla elektronun transfer edildiği zıt yüklü iyonların tepkimesini içeren III numaralı tepkime, çok sayıda bağın koptuğu, çok sayıda bağın oluştuğu I numaralı tepkimeden hızlıdır.Tepkimelerin bağıl hızları, II > III > I şeklindedir. 15. 1. ve 2. deneyde [NO] sabitken, [O2] 2 katına çıkınca hız da 2 katına çıkmıştır, dolayısıyla v α [O2] dir. 3. ve 5. deneyde [O2] sabitklen, [NO] 3 katına çıkınca hız 9 katına çıkmıştır, dolayısıyla v α [NO]2 dir. a. v = k [NO]2 [O2] b. 1. deneyin verileri hız denkleminde yerine konulursa, 7 x 10–6 = k (1 x 10–3)2 (1 x 10–3)⇒ k = 7 x 103 c. Tepkime denklemine göre yazılacak hız denklemi de v = k [NO2]2 [O2] şeklindedir, dolayısıyla tepkime mekanizmalı değildir ve tek basamakta gerçekleşir. KİMYA-2 29 VI KİMYASAL REAKSİYONLARIN HIZLARI 16. a. 1. deneye göre v α [X2] [Y2] [Z2], v α [X2]2 [Y2], v α [X2] [Y2]2, … olabilir. 2. deneye göre v α [X2]2 [Y2] ya da v α [X2] [Y2]2 şeklinde olmalıdır. 3. deneye göre (2. deney dikkate alındığında) v α [Y2]2 olmak zorundadır. Dolayısıyla Z2 hıza etkili değildir. Tepkimenin hız denklemi; v = k [X2] [Y2]2 şeklindedir. b. X2(g) + 2Y2(g) → 2XY2(g) (yavaş) şeklinde olabilir. 17. 1. ve 2. deneylere göre v α [X2] b. 1. deney verileri yerine konulursa, 3 x 10–4 = k . 1 x 10–2 ⇒ k = 3 x 10–2 2. ve 4. deneylere göre v, [Y2]ʼne bağlı değildir. c. X2 ⎯→ 2X (yavaş) şeklinde olabilir. a. v = k [X2] 18. Hızı belirleyen basamak yavaş gerçekleşendir. Hız denklemi yavaş gerçekleşen basamağa göre yazılır. v = k [HBr] [O2] 19. a. İleri tepkimede, Ea > Ea ʼdir. i g i g Geri tepkimede, Ea < Ea ʼdir. Ea < Ea olan geri tepkime, tersi olan ileri yöndeki endotermik i g tepkimeye göre aynı koşullarda daha hızlı gerçekleşir. b. Sıcaklık artışı endotermik tepkimenin (bunun tersi olan ekzotermik tepkimeye göre ) daha çok hızlanmasına neden olur. Tepkime ileri yönde endotermik olduğu için ileri tepkime daha çok hızlanır. 20. ∆H = Ea – Ea ⇒ ∆H = 40 – 30 ⇒ ∆H = 10 kJ i g a. ∆H > 0 ise tepkime yazıldığı şekliyle endotermiktir ve geri tepkime ekzotermiktir. b. Geri yönde Ea =30 kJ, Ea = 40 kJʼdür. i g ∆H = Ea – Ea ⇒ ∆H = 30 – 40 ⇒ ∆H = –10 kJ i g 21. v = k [A]2 ⇒ v = 0,0018 · (0,155)2 ⇒ v = 4,32 · 10–5 M/s DEĞERLENDİRME ÇALIŞMALARI 2 ÇÖZÜMLERİ 1. 5H2C2O4(suda) + 2MnO–4(suda) + 6H+(suda) → 10CO2(g) + 2Mn+2(suda) + 8H2O(s) Menekşe Açık pembe I. Tepkime stokiyometrisine göre girenlerdeki iyon derişimi ürünlerdeki iyon derişiminden büyüktür. Bu nedenle elektiriksel iletkenlik giderek azalır II. Tepkimede oluşan CO2 gazı basınç artmasına neden olur. – III. Tepkime sırasında MnO 4 iyonunun menekşe rengi kaybolurken Mn+2 iyonundan kaynaklanan açık pembe renk oluşur. Bu üç fiziksel değişikliğin hızı ölçülmek suretiyle tepkime hızı belirlenebiler. ( Doğru seçenek E) 2. Bir tepkimenin hızını belirleyebilmek için basıncın zamanla değişimini ölçmek, ancak ürünlerin toplam mol sayısı(nÜ) ile girenlerin toplam mol sayısı (nG) farklı ise mümkündür. Eğer tepkimenin her iki yanında gazların mol sayıları toplamı eşitse basınç değişimi olmaz ve hız bu yolla ölçülemez. I. nÜ = nG II. nÜ = nG III. nÜ ≠ nG IV. nÜ ≠ nG (Doğru seçenek E) 3. Çok sayıda bağın kopup çok sayıda bağın oluştuğu tepkimelerin en yavaş olması beklenir. İyonlu tepkimeler organik tepkimelere göre daha hızlıdır. (Doğru seçenek D) 30 www. pasayayincilik.com © 2004 VI KİMYASAL REAKSİYONLARIN HIZLARI 4. ® I. işlem demirin temas yüzeyini artırdığından oksijenle tepkimeyi hızlandırır. ® Sıcaklığın artırılması tüm tepkimeleri hızlandırır. ® Tepkimenin hızı oksijen miktarına bağlı olduğu için oksijen derişiminin artması tepkimeyi hızlandırır. (Doğru seçenek E) 5. Tepkimenin stokiyometrik kat sayıları ilgili maddelerin harcanma ve oluşma hızları arasındaki ilişkiyi verir. ∆M Örneğin; 4 mol Ag harcanırken 2 mol H2O oluştuğuna göre, v = ––––– bağıntısına göre Agʼ ün harcanma ∆t hızı (v1), H2Oʼ yun oluşma hızının (v5) 2 katına eşit olmalıdır (v1 = 2v5). 4 Ag(k) + 2 H2S (g) + O2(g) → 2 Ag2S(k) + 2H2O(s) (Doğru seçenek B) v1 = 2v2 = 4v3 = 2v4 = 2v5 6. T2 sıcaklığında aktifleşme enerjisini aşan molekül sayısının daha fazla olduğu grafikten görülmektedir. Dolayısıyla etkin çarpışma sayısı T2 sıcaklığında daha fazladır ve bu sıcaklıkta tepkime hızı daha büyüktür. (Doğru seçenek C) 7. Tepkimenin hızı yavaş adımın hızına eşittir. v = k [H2O2] [I¯] Bu adımda tepkimeye I2 katılmadığından tepkimenin hızı I2 derişimine bağlı değildir. 8. CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) 9. Aktifleşme enerjisi (Ea) engelini aşan molekül sayısının fazla olduğu tepkimede etkin çarpışma daha fazla olacağı için o tepkime daha hızlı gerçekleşir. ∆H˚= ∆HÜ̊ – ∆HG̊ ∆H˚= (∆HC̊O +2 ∆HH̊ O) – (∆HC̊H ) 2 2 4 ∆H˚= [(–393,5 + 2 (–241,8)] – (–74, 8) ∆H˚= –802,3 kJ ∆H˚= Ea –Ea ⇒ –802, 3 = 334,7 – Ea i Ea =1137 kJ g g (Doğru seçenek B) g (Doğru seçenek E) (Doğru seçenek E) 10. ∆H˚= Ea – Ea ⇒ 134 = 166 – Ea ⇒ Ea = 32 kJ i g g g ∆H˚= 134 kJ, Ea = 166, Ea = 32 kJ olan tepkimenin i g grafiği, B seçeneğindeki gibidir. (Doğru seçenek B) 11. Y basamağının aktifleşme enerjisi en büyüktür. Dolayısıyla en yavaş gerçekleşen I. tepkime Y basamağıdır. Aktifleşme enerjisi en küçük olan bu nedenle en hızlı gerçekleşen tepkime X ile simgelenen III numaralı tepkimedir. (Doğru seçenek C) 12. ® Hacmin yarıya düşürülmesi derişimlerin 2 katına çıkması demektir. 1. ve 2. deneylerde derişimin 2 ya da 3 katına çıkarılması, hızı 23 ya da 33 şeklinde etkilemektedir. Bu sonuca ve 2. deney sonucuna göre v α [X2]2 [Y2] ya da v α [X2] [Y2]2ʼdir. ® 3. deney sonucuna göre Z2ʼnin hıza etkisi yoktur ve hızın 4 katına çıkmasını sağlayan [Y2]ʼnin 2 katına çıkmasıdır. Buna göre tepkimenin hız denklemi; v = k [X2] [Y2]2 şeklindedir. (Doğru seçenek E) 13. Tepkimenin hızı yavaş adımın hızına eşittir. Tepkimenin hız denklemi ise, v = k [H2O2] [I¯] şeklindedir. Tepkime hızı I2 derişimine bağlı değildir. (Doğru seçenek B) 14. I. Cl2 ⎯→ 2Cl II. 2(N2O +Cl ⎯→ N2 + ClO) + III. 2ClO ⎯→ Cl2 +O2 ––––––––––––––––––––––––––– 2N2O ⎯→ 2N2 +O2 Bu tepkimede Cl ve ClO ara üründür. Tepkimenin başlaması için Cl2ʼun ayrışması gerektiğine göre katalizör Cl2ʼdur ve Cl2, III. basamakta tekrar oluşmakta yani tepkimeden aynen çıkmaktadır. (Doğru seçenek C) KİMYA-2 31 VI KİMYASAL REAKSİYONLARIN HIZLARI 15. Tepkimelerin hız denklemleri, yavaş gerçekleşen basamaktaki girenlerin derişimlerine göre ve stokiyometrik kat sayıları dikkate alınarak yazılır. (Doğru seçenek A) v = k [HBr] [O2] ise yavaş basamağın girenler kısmı HBr + O2 → ... şeklindedir. 16. ® 1. ve 2. deneylere göre tepkimenin hızı ya [Y] ile ya da [Z] ile orantılıdır: ® 1. ve 3. deneylere göre eğer v α [Z] ise vα[X]2 dir. ® 2. ve 3. deneylere göre eğer v α [Y] ise v α [X]4 olmalıdır, ancak bu durum tepkimenin 5. derecede olmasını gerektirir ki tepkimelerin en çok 3. derecede olabileceği gerçeğine aykırıdır. v = k [X]2 [Z] ⇒ 3 x 10–4 = k (0,1)2 (0,01) ⇒ k = 3 17. ® 2. deneye göre v α [A2] dir. (Doğru seçenek C) 2 ® 3. deneye göre v α [B] dir. ® 4. deneye göre v α [A2] olduğundan, v α [A2] [C2] olmalıdır. Bu sonuçlara göre; v = k [A2] [B]2 [C2] şeklindedir. (Hız denklemine göre tepkime 4. derece gözükmektedir. Oysa bu durum olası değildir. Bununla beraber söz konusu örneğin hız denklemi vb. unsurları bulabilmek amacıyla düzenlenmiş farazî bir örnek olduğu düşünülmelidir.) (Doğru seçenek C) 18. 2 x 10–4 = k (0,1) (0,1)2 (0,1) ⇒ k = 2 (Doğru seçenek C) 19. Basınç iki katına çıkarılırsa derişimler de iki katına çıkar. v´ = k [2A2] [2B]2 [2C2] ⇒ v´ = 16 k [A2] [B]2 [C2] ⇒ v´ = 16 v (Doğru seçenek A) 2 20. v = k [A] [B] Tepkimenin derecesi hız denklemindeki maddelerin molar derişimlerinin üslerinin toplamına eşittir ve 2 + 1 = 3. derecedir. (Doğru seçenek D) DENEY 6.1: Madde türünün ve sıcaklığın tepkime hızına etkisi Deney Sonu Sorularının Yanıtları 1. İki tepkime arasındaki hız farkının nedeni Fe+2 ve C2O4–2 iyonları arasındaki bağ farkıdır. 2. Tepkime hızlarının farklı olması, sıcaklık arttıkça tepkime hızının artmasından ileri gelir. a b d c 3. Sıcaklıktaki 10˚Cʼluk bir artış tepkimesinin hızını yaklaşık 3,25 kat artırır. 4. Tepkimede H2SO4 katalizördür. DENEY 6.2: Derişimin tepkime hızına etkisi Deney Sonu Sorularının Yanıtları 1. M1V1 = M2V2 I. 0,02 · 9 = M2 · 10 ⇒ M = 0,018 II. 0,02 · 8 = M2 · 10 ⇒ M = 0,016 III. 0,02 · 7 = M2 · 10 ⇒ M = 0,014 a b c d e 2. Derişim, birim hacme düşen mol sayısıdır. Birim hacim L, dm3, cm3 vb.ʼdir. Bu nedenle toplam hacim 10 mLʼye tamamlanır. 3. Grafik yaklaşık yandaki gibidir: 4. Tepkime hızı derişimle doğru orantılıdır. 32 www. pasayayincilik.com © 2004 BÖLÜM VII LİSE KİMYASAL REAKSİYONLARDA KİMYA 2 DENGE DEĞERLENDİRME ÇALIŞMALARI 1 ÇÖZÜMLERİ 1. Bir maddenin fiziksel hâlleri arasında ya da çözünme gibi fiziksel bir dönüşümde gözlenebilir özellikler (sıcaklığın sabit, sistemin kapalı olması koşuluyla) değişmiyorsa bu durum fiziksel denge olarak nitelendirilir. – PbCl2(k) ä Pb+2 (suda) + 2Cl (suda) (çözünürlük dengesi) H2O(s) ä H2O(g) (su-su buharı dengesi) 2. Sıcaklığı sabit tutulan kapalı bir ortamda gerçekleşen bir tepkimede gözlenebilir (makroskobik) özelliklerin değişmemesine kimyasal denge denir. 2NO2(g) ä N2O4(g) kahverengi 3. N2O4(g) + 58 kJ ä 2NO2(g) Dengedeki bir sisteme herhangi bir dış etki yapıldığında sistemin bu etkiyi azaltacak yönde tepki göstermesi Le Chatelier ilkesi olarak bilinir. Örneğin; yukarıdaki tepkime dengedeyken ortamın sıcaklığı yükseltilirse tepkime sıcaklığı azaltacak yönde tepki gösterir. İleri tepkime endotermik olduğu için denge ürünler lehine bozulur ve ortamın sıcaklığı biraz düşer. renksiz Yukarıdaki tepkime dengeye ulaştığında tepkime ortamındaki renk sabit kalır. Ayrıca tepkime gerçekleşirken giderek ortamın basıncı azalır, dengeye ulaşıldığında ortamın basıncı bir etki olmadıkça değişmez. 4. Dengeyi etkileyen faktörler; derişim, basınç (ya da hacim) ve sıcaklıktır. 5. Denge sabitini etkileyen faktörler sıcaklık ve stokiyometrik kat sayılardır. [SO3]2 P2SO 3 6. a. Kd = –––––––––––– , K = –––––––––––– p [SO2]2 [O2] P2SO . PO 2 2 [H2O] [Cl2] c. Kd = –––––––––––– , Kp = [HCl]4 [O2] 10 2 2 2 2 P H O . P Cl 2 2 ––––––––––– P4HCl . PO 2 [H2O]6 [NO]4 P6H O . P4NO 2 b. Kd = ––––––––––––– , K = –––––––––– p [NH3]4 [O2]5 P4NH . P5O 3 2 [H2O] PH O 2 d. Kd = –––––– , Kp = ––––– [H2] PH 2 +2 2 [CO2] [Mn ] e. Kd = –––––––––––––––––––––– , Kp = [CO2]10 [C2O4–2]5 [MnO–4]2 [H+]16 7. Ürünlerin denge derişimlerinin artması için dengenin ürünler lehine bozulması gerekir ki bu amaçla; sıcaklığı artırmak, Cl2 ya da NH3 gazlarını ortamdan uzaklaştırmak, kaba HCl ya da N2 gazları ilâve etmek, kabın hacmini küçültmek işlemlerinden biri uygulanabilir. 8. Denge, tepkimenin izlediği yola yani mekanizmaya bağlı değildir. Dolayısıyla denge bağıntısı toplam (net) denkleme göre yazılır. [I2] Kd = –––––––––––––––––––– [H2O2] [H3O+]2 [I–]2 9. 2NH3(g) ä N2(g) + 3H2(g) Başlangıç (mol) : 1 0 0 Değişme (mol) : –0,4 +0,2 +0,6 Denge (mol) : 0,6 0,2 0,6 0,6 0,2 0,6 [NH3] = ––––– = 0,3 M [N2] = ––––– = 0,1 M [H2] = –––– = 0,3 M 2 2 2 [N2] [H2]3 0,1 x (0,3)3 Kd = ––––––––––– ⇒ Kd = –––––––––––– ⇒ Kd = 3 x 10–2 [NH3]2 (0,3)2 KİMYA-2 33 VII KİMYASAL REAKSİYONLARDA DENGE 10. 2SO2(g) + O2(g) ä 2SO3(g) Başlangıç (mol) : 0 0 x Değişme (mol) : +0,4 +0,2 –0,4 Denge (mol) : 0,4 0,2 (x – 0,4) Hacim 1 L olduğu için denge derişimleri dengedeki mol sayılarının değerine eşittir. [SO3]2 (x – 0,4)2 Kd = –––––––––– ⇒ 4,5 = ––––––––––– ⇒ x ≈ 0,78 mol [SO2]2 [O2] (0,4)2 (0,2) 11. A(g) + 3B(g) ä C(g) + 2D(g) Başlangıç (mol) : 10 x 0 0 Değişme (mol) : –4 –12 +4 +8 (Denge (mol) : 6 (x – 12) 4 8 Hacim 1 L olduğu için denge derişimleri = dengedeki mol sayılarıdır. [B] = [C] ⇒ x – 12 = 4 ⇒ x = 16 mol L–1 ve x = 16 molʼdür. 12. SO2(g) + NO2(g) ä SO3(g) + NO(g) V = 1 L ise [SO3] = 0,4 M, [NO] = 0,4 M, [SO2] = 0,8 M, [NO2] = 0,2 M [SO3] [NO] Kd = ––––––––––––– [SO2] [NO2] 0,4 x 0,4 Herhangi bir andaki durumu Q ile ifade edersek; Q = ––––––––– Q = 1 0,8 x 0,2 Kd ≠ Q olduğu için (Kd>Q) sistem dengede değildir. Kd=Q olması için ürünlerin derişiminin artması, girenlerin derişiminin azalması gerekir. Tepkime ileri yönde (ürünler yönünde) daha hızlı gerçekleşmektedir. 13. A(suda) + B(suda) ä C(suda) + D(suda) ∆H > 0 I. Grafik IIʼdeki tepkime daha çabuk dengeye ulaştığından (tX > tY) katalizör kullanılmıştır. II. Tepkime gaz fazında olmadığından hacim değişikliği dengeyi etkilemez. III. Tepkimede I. konumdaki denge, ürünler lehine bozularak yeniden (II) denge kurulmuş; ürün derişimleri artmış, giren derişimleri azalmıştır. Bu durumu sağlayan sıcaklığın artırılmasıdır. [SO3] [NO] 0,6 x 0,4 14. Kd = ––––––––––––– ⇒ Kd = ––––––––––– ⇒ Kd = 3 [SO2] [NO2] 0,8 x 0,1 SO2(g) + NO2(g) ä SO3(g) + NO(g) Başlangıç (mol) : 0,8 0,1 0,6 0,4 Değişim (mol) : +0,2 +0,2 –0,2 x – 0,2 Denge (mol) : 1,0 0,3 0,4 0,2 + x [SO3] [NO] 0,4 x (0,2 + x) Kd = –––––––––––– ⇒ 3 = ––––––––––––––– ⇒ x = 2,05 mol L–1 2,05 mol NO eklenmelidir. [SO2] [NO2] 1 x 0,3 [CO] [H2O] 0,8 x 0,3 15. Kd = ––––––––––––– ⇒ Kd = ––––––––––– ⇒ Kd = 2 [CO2] [H2] 0,6 x 0,2 CO2(g) + H2(g) ä CO(g) + H2O(g) 34 Başlangıç (mol) : 0,6 0,2 0,8 0,3 Değişim (mol) : –x + 0,2 +0,2 –0,2 –0,2 Denge (mol) 0,8 – x 0,4 0,6 0,1 : [CO] [H2O] 0,6 x 0,1 Kd = –––––––––––– ⇒ 2 = –––––––––––– [CO2] [H2] (0,8 – x) 0,4 x = 0,725 mol www. pasayayincilik.com © 2004 VII KİMYASAL REAKSİYONLARDA DENGE 16. PB = 0,2 atm ise PA = 2 x 0,2 = 0,4 atmʼdir. A2B(k)ä 2A(g) + B(g) KP = P2A PB ⇒ KP = (0,4)2 x 0,2 ⇒ Kp = 0,032 17. Kapta başlangıçta toplam 0,2 + 0,4 + 1 = 1,6 mol gaz vardır. Kaptaki mol sayısı dengede 1,7 mol ise tepkime geri yönde (mol sayısının arttığı yöne) doğru gerçekleşiyor demektir. 2SO2(g) + O2(g) ä 2SO3(g) Başlangıç (mol) : 0,2 0,4 1 Değişim (mol) : +2x +x –2x (0,4 + x) (1–2x) Denge (mol) : (0,2 + 2x) 2 2 3 (0,2 + 2x) + (0,4 + x) + (1 – 2x) = 1,7 x = 0,1 mol PSO PT PSO 3,4 2 = –––– 2 = ––––– ⇒ P ––––– ⇒ ––––– SO2 = 0,8 atm nSO nT 0,4 1,7 2 PO PT PO 3,4 2 = –––– 2 ––––– ⇒ ––––– = ––––– ⇒ PO = 1 atm 2 nO nT 0,5 1,7 2 PSO PT PSO 3,4 3 = –––– 3 = ––––– ⇒ P ––––– ⇒ ––––– SO3 = 1,6 atm nSO nT 0,8 1,7 Dengede : nSO = 0,2 + 2(0,1) = 0,4 mol 2 nO = 0,4 + 0,1 = 0,5 mol 2 nSO = 1 – 2 (0,1) = 0,8 mol 3 P2SO (1,6)2 3 Kp = –––––––––– ⇒ K = –––––––––– ⇒ Kp = 4 p P2SO . PO (0,8)2 (1) 2 nSO + nO + nSO = nT 3 2 0,5 0,5 1,5 18. 1. denge derişimleri: [N2] = ––––– = 0,1 M, [O2] = ––––– = 0,1 M, [NO] = –––– = 0,3 M 5 5 5 [NO]2 [0,3]2 Kd = –––––––––– ⇒ Kd = ––––––––– ⇒ Kd = 9 [N2] [O2] 0,1 x 0,1 N2(g) + O2(g) 2NO(g) ä Başlangıç (mol) : 0,5 0,5 1,5 Değişim (mol) : +x +x 1,5 – 2x Denge (mol) : (0,5 + x) (0,5 + x) (3–2x) 2 [NO]2 Kd = = 9= [N 2 ][O 2 ] 3 – 2x 3 – 2x 5 ⇒ x = 0, 3mol ⇒3= 0, 5 + x 0, 5 + x 0, 5 + x 5 5 Dengede : nN = 0,5 + x ⇒ nN = 0,5 + 0,3 ⇒ nN = 0,8 mol 2 19. 2 2 PH3(g) + 4Cl2(g) ä PCl5(g) + 3HCl(g) Başlangıç (mol) : 4 4 0 0 Değişim (mol) : –x –4x x +3x (4 – 4x) x 3x Denge (mol) : (4 – x) PCl PT 1 9 5 –––––– = –––– ⇒ –––– = –––––––––––––––––––––––– ⇒ x = 0,8 mol nPCl nT x (4 – x) + (4 – 4x) + x + 3x 5 nT = (4 – x) + (4 – 4x) + x + 3x ⇒ nT = (4 – 0,8) + (4 – 4 x 0,8) + (4 – 4 x 0,8) + 0,8 + 3 x 0,8 ⇒ nT = 7,2 mol KİMYA-2 35 VII KİMYASAL REAKSİYONLARDA DENGE nHCl = 3x ⇒ nHCl = 3 x 0,8 = 2,4 mol nPH = 4 – x ⇒ nPH = 4 – 0,8 = 3,2 mol 3 3 nCl = 4 – 4x ⇒ nCl = 4 – 4 x 0,8 = 0,8 mol 2 2 PHCl PT PHCl 9 ––––– = ––––– ⇒ –––––– = –––– ⇒ PHCl = 3 atm nHCl nT 2,4 7,2 PPH PT PPH 9 3 = –––– 3 = –––– ⇒ P ––––– ⇒ ––––– PH3 = 4 atm nPH nT 3,2 7,2 3 PCl PT PCl 9 2 = –––– 2 = ––––– ⇒ P ––––– ⇒ ––––– Cl2 = 1 atm nCl nT 0,8 7,2 2 PPCl . P3HCl 1 x (3)3 5 Kp = –––––––––––– ⇒ Kp = ––––––––– ⇒ Kp = 6,75 PPH . P4Cl 4 x (1)4 3 2 Kd = 0,6 1 20. N2(g) + O2(g) ä 2NO(g) 1 K´d = –––––––– 2 + 2NO(g) + O2(g) ä 2NO2(g) (Kd )2 2 ––––––––––––––––––––––––––– 1 Kd = Kd x K´d ⇒ Kd = 0,6 x –––––– ⇒ Kd = 15 N2(g) + 2O2(g) ä 2NO2(g) 3 1 2 3 3 (0,2)2 DE⁄ERLENDİRME ÇALIŞMALARI 2 ÇÖZÜMLERİ 1. ® Dengede minimum enerji eğilimi ile maksimum düzensizlik eğiliminin “uzlaştığı” düşünülür (I. yargı doğru). ® Denge, kinetik açıdan ileri ve geri tepkimelerin hızlarının eşitlendiği andır (II. yargı doğru). ® Dengede ürünlerin derişimi girenlerin derişimine eşit olabilir. Ancak çok özel durumlarda ortaya çıkan bu sonuç, dengenin kurulması için bir koşul değildir (III. yargı yanlış). (Doğru seçenek C) 2,408 x 1023 28,4 2. nCO = –––––––––––– = 0,4 mol, nCl = ––––– = 0,4 mol, nCOCl = 0,6 mol 2 2 6,02 x 1023 71 V = 1 L olduğu için bu sayılar aynı zamanda denge derişimlerine eşittir. CO(g) + Cl2(g) ä COCl2(g) [COCl2] 0,6 Kd = –––––––––––– ⇒ Kd = ––––––––– ⇒ Kd = 3,75 [CO] [Cl2] 0,4 x 0,4 (Doğru seçenek A) 3. 2NO2(g) + 7H2(g) ä 2NH3(g) + 4H2O(g) Başlangıç (mol) : 1,5 2,75 0 0 Değişim (mol) : –0,5 –1,75 +0,5 +1 1 1 0,5 1 Denge (mol) : 2 4. 4 2 4 [NH3] [H2O] (0,5) x 1 Kd = ––––––––––––––– ⇒ Kd = ––––––––––– ⇒ Kd = 0,25 2 7 [NO2] [H2] 12 x 17 N2(g) + O2(g) ä 2NO(g) Başlangıç (mol) : 0 0 x Değişim (mol) : +0,4 +0,4 –0,8 Denge (mol) : 0,4 0,4 (x – 0,8) Kd = [NO]2 = 9= [N 2 ][O 2 ] ( x – 0, 8 )2 0, 4 x 0, 4 ⇒3= x – 0, 8 ⇒ x = 2 mol 0, 4 (Doğru seçenek A) (Doğru seçenek D) 5. Başlangıçta kapta 0,2 + 0,4 + 1 = 1,6 mol gaz varken dengede 1,7 mol gaz varsa tepkime mol sayısının daha fazla olduğu yöne doğru yani girenler tarafına daha hızlı gerçekleşiyor demektir. 2NO(g) + O2(g) ä 2NO2(g) Başlangıç (mol) : 0,2 0,4 1 Değişim (mol) : +2x +x –2x Denge (mol) : (0,2 + 2x) (0,4 + x) (1 – 2x) 36 www. pasayayincilik.com © 2004 VII KİMYASAL REAKSİYONLARDA DENGE nNO + nO + nNO = nT 2 2 (0,2 + 2x) + (0,4 + x) + (1 – 2x) = 1,7 ⇒ x = 0,1 mol nNO = 0,2 + 2x ⇒ nNO = 0,2 + 2 x 0,1 ⇒ nNO = 0,4 mol [NO] = 0,4 M nO = 0,4 + x ⇒ nO = 0,4 + 0,1 ⇒ nO = 0,5 mol [O2] = 0,5 M 2 2 2 2 2 nNO = 1 – 2x ⇒ nNO = 1 – 2 x 0,1 ⇒ nNO = 0,8 mol [NO2] = 0,8 M 2 [NO2]2 (0,8)2 Kd = –––––––––––– ⇒ K = ––––––––––– ⇒ Kd = 8 d [NO]2 [O2] (0,4)2 (0,5) 6. X2(g) + Y2(g) ä 2XY(g) Başlangıç (mol) : 4 4 0 Değişim (mol) : –x –x +2x Denge (mol) : (4 – x) (4 – x) 2x Kd = [Y]2 = 36 = [X 2 ][Z 2 ] (Doğru seçenek B) ( 2 x )2 2x ⇒6= ⇒ x = 3mol ( 4 – x )( 4 − x ) 4–x (Doğru seçenek C) nXY = 2X ⇒ nXY = 2 x 3 = 6 mol 7. ZY ile XZ5 ürün XY3 ile Z2 ise girendir. XY3(g) + 4Z2(g) ä 3ZY(g) + XZ5(g) 3 1 4 2 [ZY] = ––– = 0,6 M, [XZ5] = ––– = 0,2 M, [XY3] = ––– = 0,8 M, [Z2] = ––– = 0,4 M 5 5 5 5 [ZY]3 [XZ5] (0,6)3 x (0,2) Kd = ––––––––––––– ⇒ Kd = ––––––––––––– ⇒ Kd = 2,1 [XY3] [Z2]4 (0,8) x (0,4)4 (Doğru seçenek C) 1 7,2 8. 1 gram H2, ––– = 0,5 molʼdür; 7,2 g FeO, –––– = 0,1 molʼdür. 2 72 FeO(k) + H2(g) ä Fe(k) + H2O(g) Başlangıç (mol) : 0,4 0,5 0 0 Değişim (mol) : –0,3 –0,3 +0,3 +0,3 Denge (mol) : 0,1 0,2 0,3 0,3 [H2O] 0,3 Kd = ––––––– ⇒ Kd = ––––– ⇒ Kd = 1,5 [H2] 0,2 9. C2N2(g) + O2(g) ä 2CO(g) + N2(g) Başlangıç (mol) : 1 1 0 0 Değişim (mol) : –0,75 –0,75 +1,5 +0,75 Denge (mol) : 0,25 0,25 1,5 0,75 (Doğru seçenek C) nT = 0,25 + 0,25 + 1,5 + 0,75 ⇒ nT = 2,75 mol PCO PT PCO 5,5 PN 2 = ––––– = –––– ⇒ –––– = ––––– ⇒ PCO = 3 atm –––– nCO nT 1,5 2,75 nN 2 PC N PT PC N 5,5 PO 2 2 = –––– ⇒ ––––– 2 2 = ––––– ⇒ P 2 ––––– C2N2=0,5 atm ––––– = nC N nT 0,25 2,75 nO 2 2 2 P2CO . PN 32 x 1,5 2 Kp = ––––––––––– ⇒ Kp = ––––––––– ⇒ Kp = 54 PC N . PO 0,5 x 0,5 2 2 KİMYA-2 2 PT PN 5,5 2 ––– ⇒ ––––– = ––––– ⇒ PN = 1,5 atm 2 nT 0,75 2,75 PT PO 5,5 2 = ––––– ⇒ P –––– ⇒ ––––– O2 = 0,5 atm nT 0,25 2,75 (Doğru seçenek E) 37 VII KİMYASAL REAKSİYONLARDA DENGE 10. P2O5(g) ä P2O3(g) + O2(g) Başlangıç (mol) : 5PV 0 0 Değişim (mol) : –x +x +x Denge (mol) : (5PV – x) x x (5PV – x) + x + x = 8PV ⇒ x = 3PVʼdir. 8PV mol PP O . PO 1,5 x 1,5 2 3 2 Kp = ––––––––––– ⇒ Kp = ––––––––– ⇒ Kp = 2,25 PP O 1 4 atm ise 2 5 3PV mol x ––––––––––––––––– 3x4 x = –––––– = 1,5 atm 8 11. X(g) PP PP + 2Y(g) ä = PO = x ⇒ PP 2O3 2 Z(g) + 2 2O5 = 1 atm (Doğru seçenek C) 4W(g) 1 1,2 0 0 Değişim (mol) : –x –2x +x +4x (1,2 – 2x) x 4x : (1 – x) = PO = 1,5 atm = 4 – (1,5 + 1,5) ⇒ PP 2O5 Başlangıç (mol) : Denge (mol) 2O3 PW PT 1 3,25 –––– = –––– ⇒ –––– = ––––––––––––––––––––––––– ⇒ x = 0,2 mol nW nT 4x (1 – x) + (1,2 – 2x) + x + 4x nT = (1 – x) + (1,2 – 2x) + x + 4x ⇒ nT = 1 – 0,2 + 1,2 – 2(0,2) + 0,2 + 4(0,2) ⇒ nT = 2,6 mol PZ PT PZ 3,25 ––––– = ––––– ⇒ –––– = ––––– ⇒ PZ = 0,25 atm nZ nT 0,2 2,6 PY PT PY 3,25 ––––– = –––– ⇒ ––––– = –––––– ⇒ PY = 1 atm nY nT 0,8 2,6 12. X2(g) + 3Y2(g) ä 2XY3(g) Kp = Kd (RT)∆n PX PT PX 3,25 –––– = –––– ⇒ –––– = –––––– ⇒ PX = 1 atm nX nT 0,8 2,6 PZ . P4W 0,25 x 14 KP = –––––––– ⇒ K = ––––––––– ⇒ Kp = 0,25 p PX . P2Y 1 x 12 (Doğru seçenek A) 13. 2SO2(g) + O2(g) ä 2SO3(g) Kp = Kd (RT)∆n Kp = 4,1 (0,082 x 400) 2–3 1 x 10–3 = Kd (0,082 x 1000)2 – 4 Kp = 4,1 (32,8)–1 ⇒ Kp = 0,125 1 x 10–3 Kd = –––––––– ⇒ Kd = 6,724 (Doğru seçenek A) (82)–2 (Doğru seçenek C) 0,8 0,2 0,2 14. 1. dengede : [AB] = ––––– = 0,4 M, [A2] = ––––– = 0,1 M, [B2] = ––––– = 0,1 M 2 2 2 2 2 [AB] (0,4) Kd = –––––––––– ⇒ Kd = ––––––––– ⇒ Kd = 16 [A2] [B2] 0,1 x 0,1 A2(g) + B2(g) ä 2AB(g) Başlangıç (mol) : 0,2 0,2 0,8 Değişim (mol) : +0,2 +0,2 – 0,4 + x Denge (mol) 0,4 0,4 + x : 0,4 0,4 0,4 [A2] = ––––– = 0,2 M, [B2] = ––––– = 0,2 M, 2 2 0,4 + x [AB] = –––––––– 2 (0,4 + x)2 0,4 + x [AB] 2 = 16 = Kd = ⇒4= 2 ⇒ x = 1,2 mol [A 2 ][B2 ] 0,2 x 0,2 0,2 2 38 (Doğru seçenek C) www. pasayayincilik.com © 2004 VII KİMYASAL REAKSİYONLARDA DENGE 15. 16. SO3(g) ä SO2(g) + 1/2O2(g) + CO(g) + 1/2O2(g) ä CO2(g) –––––––––––––––––––––––––––––– CO(g) + SO3(g) ä SO2(g) + CO2(g) K d1 = 1 0,25 K d2 = 2 K dT = 1 x 2 ⇒ Kd = 4 0,25 3HCl(g) + 3/4O2(g) ä 3/2H2O(g) + 3/2Cl2(g) K´1 = + 3/2Cl2(g) + NH3(g) ä 3HCl(g) + 1/2N2(g) –––––––––––––––––––––––––––––––––––––––––– 3/4O2(g) + NH3(g) ä 1/2N2(g) + 3/2H2O(g) 1 K1 K´2 = 1 K2 (Doğru seçenek D) K 3 = K´1 x K´2 1 x K1 K3 = 1 = K2 1 1 K1 x K 2 (Doğru seçenek D) 17. Ürünlerin denge derişimleri her iki grafikte de aynıdır. Ancak Grafik IIʼde dengeye ulaşma zamanı (a), Grafik Iʼde dengeye ulaşma zamanından (b) daha kısadır. Bu durum ancak katalizörle mümkündür. (Doğru seçenek C) 18. ® Sıcaklık yükseltilirse, tepkime ekzotermik olduğu için geri tepkime hızlanır. ® Hacim küçültülürse basınç artar, basıncı azaltmak için ileri tepkime hızlanır. ® O2 eklenirse, O2ʼyi harcamak için ileri tepkime hızlanır. ® SO3 gazı çekilirse SO3 derişimini artırmak için ileri tepkime hızlanır. II, III ve IV. yargılar doğrudur. (Doğru seçenek E) 19. CS2(g) + 3O2(g) ä CO2(g) + 2SO2(g) [CO2] [SO2]2 0,75 x (1,5)2 Kd (Q) = –––––––––––– Q = ––––––––––– =2 [CS2] [O2]3 0,25 x (1,5)3 Kd ≠ Q ve Kd > Q dur. Kd = Q olması için ürünlerin derişiminin artması, reaktiflerin derişiminin azalması gerekir yani tepkime ileri yönde gerçekleşmektedir. (Doğru seçenek A) DENEY 7.1: Kimyasal denge hâline derişimin etkisinin renk değişimi ile incelenmesi Deney Sonu Sorularının Yanıtları 1. Renk değişimi kimyasal bir tepkimenin gerçekleştiğini gösterir. 1 2 3 4 1 2 3 4 – +2 2. Fe+3 (suda) + SCN (suda) ä FeSCN (suda) açıkkahverengi kırmızı 3. İkinci beherglasa KSCN kristalleri eklendiğinde renk değişimi dengenin ürünler lehine bozulduğunu gösterir. 4. Üçüncü beherglasa Fe(NO3)3 eklendiğinde renk değişimi dengenin ürünler lehine bozulduğunu gösterir. 5. Yeni bir tepkimenin oluştuğunu gösterir. KİMYA-2 39 VIII ÇÖZÜNÜRLÜK DENGELERİ LİSE KİMYA 2 BÖLÜM VIII ÇÖZÜNÜRLÜK DENGELERİ DEĞERLENDİRME ÇALIŞMALARI 1 ÇÖZÜMLERİ 1. Bir maddenin başka bir madde içinde gözle görülemeyecek kadar küçük parçalar hâlinde homojen olarak dağılmasına çözünme denir. 2. İyonlar içeren ve bu nedenle elektrik akımını iletebilen çözeltilere elektrolit çözelti, iyonlar içermediği için elektrik akımını iletmeyen çözeltilere elektrolit olmayan çözelti denir. 3. Maddenin oluşturduğu fazlara göre düzensizliği katı → sıvı → çözelti → buhar sırasına göre artar. Bu nedenle katı ve sıvıların çözünmesinde düzensizliğin arttığı, gazların çözünmesinde ise düzensizliğin azaldığı söylenebilir. Minimum enerji eğilimi ile maksimum düzensizlik eğilimi genellikle birbiriyle yarışır. Bu iki eğilimin etkisinin dengelendiği nokta bir maddenin o koşullardaki çözünürlüğünü verir (Ancak su-etil alkol çözeltisi gibi istisna çözeltilerde her iki eğilim de çözünmeyi destekleyebilir ki bu durumda çözünme sınırsız olduğu için çözünürlükten de söz edilemez.). 4. Çözücünün türü, sıcaklık, ortak iyon ve yabancı iyonlar çözünürlük dengesini etkileyen faktörlerdir. 5. I2(k) ä I2 (CCl4ʼde) ∆H1̊ = 24,3 kJ I2(k) ä I2 (C2H5OHʼde) ∆H2̊ = 6,3 kJ Maksimum düzensizlik eğilimi her iki çözücü için yaklaşık olarak aynı yönde etkide bulunur. ∆H1̊ > ∆H2̊ olması, I2ʼun CCl4ʼde çözünmesi için daha çok enerjiye gerek olduğu anlamına gelir. Yani minimum enerji eğiliminin etkisi etil alkolde daha büyüktür ve I2 etil alkolde daha çok çözünür. + – 6. NH3(g) + H2O(s) ä NH 4(suda) + OH (suda) ∆H1̊ = –30,5 kJ – NaCl(k) ä Na+(suda) + Cl (suda) ∆H2̊ = 3,76 kJ NH3 için maksimum düzensizlik eğilimi çözünmenin aleyhine, minimum enerji eğilimi ise çözünmenin lehine etki yapar. NaCl için maksimum düzensizlik eğilimi çözünmenin lehine, minumum enerji eğilimi ise çözünmenin aleyhine etki yapar. – ä Ba+2 (suda) + 2F (suda) 7. a. BaF2(k) – – KÇÇ = [Ba+2] [F ]2 – b. Bi(OH)3(k) +3 3 ä Bi+3 (suda) + 3 OH (suda) KÇÇ = [Bi ] [OH ] c. BaSO4(k) –2 ä Ba+2 (suda) + SO 4(suda) KÇÇ = [Ba+2] [SO4–2] –2 +3 2 –2 3 d. Ce2(C2O4)3(k) ä 2Ce+3 (suda) + 3 C2O 4(suda) KÇÇ = [Ce ] [C2O4 ] 7,2 x 10–3 8. nCuBr = ––––––––––– = 5 x 10–5 mol 144 CuBr(k) ä Cu+(suda) + Br–(suda) 2 x 10–4 2 x 10–4 + n 5 x 10–5 M = –––– ⇒ M = ––––––––– ⇒ M = 2 x 10–4 mol L–1 V 0,25 2 x 10–4 – KÇÇ = [Cu ] [Br ] ⇒ KÇÇ = 2 x 10–4 x 2 x 10–4 ⇒ KÇ = 4 x 10–8 6,55 x 10–6 9. M = ––––––––––– ⇒ M = 1,31 x 10–4 mol L–1 0,050 – Mg(OH)2(k) ä Mg+2 (suda) + 2 OH (suda) 1,31 x 10–4 M 1,31 x 10–4 M – 2 2 x 1,31 x 10–4 M KÇÇ = [Mg+2] [OH ] ⇒ KÇÇ = 1,31 x 10–4 (2 x 1,31 x 10–4)2 ⇒ KÇÇ = 8,99 x 10–12 40 www. pasayayincilik.com © 2004 VIII ÇÖZÜNÜRLÜK DENGELERİ 1 x 10–2 x 10–3 10. nCaCO = ––––––––––––––– ⇒ nCaCO = 1 x 10–7 mol 3 3 100 1 x 10–7 mol CaCO3 içerenin sertliği –2 CaCO3(k) ä Ca+2 (suda) + CO 3(suda) xM xM 9,33 x 10 mol CaCO3 içerenin sertliği x –––––––––––––––––––––––––––––––––––––– 9,33 x 10–5 x = ––––––––––– = 933ʼtür. 1 x 10–7 xM KÇÇ = [Ca+2] [CO3–2] ⇒ 8,7 x 10–9 = x . x x = 9,33 x 10–5 mol L–1 –2 11. BaCO3(k) ä Ba+2 (suda) + CO 3(suda) xM xM 1 ise –5 7,88 x 10–3 g BaCO3 xM 1 L ise 3,94 g BaCO3 x ––––––––––––––––––––––––––––––– x = 500 L KÇÇ = [Ba+2] [CO3–2] ⇒ 1,6 x 10–9 = x2 x = 4 x 10–5 mol L–1 mBaCO = 4 x 10–5 x 197 ⇒ mBaCO = 7,88 x 10–3 gram 3 12. XY2(k) ä xM X+2 (suda) xM + – 2Y (suda) 3 2x M – – KÇÇ = [X+2] [Y ]2 ⇒ 1,08 x 10–7 = 4x3 ⇒ x = 3 x 10–3 M ⇒ [Y ] = 6 x 10–3 M – XY(k) ä X+(suda) + Y (suda) – – KÇÇ = [X+] [Y ] ⇒ 4 x 10–6 = x2 ⇒ x = 2 x 10–3 ⇒ [Y ] = 2 x 10–3 M M1V1 + M2V2 = MSON VTOP ⇒ 6 x 10–3 x 0,1 + 2 x 10–3 x 0,1 = MSON x 0,2 ⇒ MSON = 4 x 10–3 mol L–1 13. Verilen tuzların hepsinde 1 mol tuz çözündüğünde 3 mol iyon oluşmaktadır. Dolayısıyla KÇÇ değeri aynı koşullarda en büyük olan BaF2 tuzunun çözünürlüğü en büyüktür ve iyon derişimleri büyük olduğu için elektrik akımını da en iyi ileten BaF2 çözeltisidir. 4 0,1 – 14. nNaOH = –––– = 0,1 mol MNaOH = ––––– = 0,2 mol L–1 ⇒ [OH ] = 0,2 mol L–1 40 0,5 – AgOH(k) ä Ag+(suda) + OH (suda) (Çözünürlükten gelen Ag+ iyonlarının derişimi 0,2 M yanında xM xM – xM küçük olduğundan ihmal edilir.) KÇÇ = [Ag+] [OH ] ⇒ 2 x 10–8 = x (x + 0,2] ⇒ x = 1 x 10–7 mol L–1 1 Lʼde 1 x 10–7 mol çözünürse 0,5 Lʼde x –––––––––––––––––––––––––––– x = 5 x 10–8 mol çözünür. 15. M1V1 = M2V2 ⇒ 0,004 x 250 = M2 x 500 ⇒ M2 = 0,002 mol L–1 ⇒ [Mg+2] = 2 x 10–3 M M1 M1 M1V1 = M2V2 ⇒ M1 x 250 = M2 x 500 ⇒ M2 = ––––– mol L–1 ⇒ [CO3–2] = ––––– M 2 2 –2 MgCO3(k) ä Mg+2 + CO (suda) 3(suda) M1 +2 –2 KÇÇ = [Mg ] [CO3 ] ⇒ 1 x 10–5 = 2 x 10–3 x ––––– ⇒ M1 = 1 x 10–2 M olmalıdır. 2 3,2 x 10–7 16. Eşit hacimde karıştırılınca [H2S] = –––––––––– = 1,6 x 10–7 M ve [S–2] = 1,6 x 10–7 M olur. 2 + –2 Ag2S(k) ä 2Ag (suda) + S (suda) xM 2x M xM + 2 –2 KÇÇ = [Ag ] [S ] ⇒ 6 x 10–50 = [Ag+] x 1,6 x 10–7 ⇒ [Ag+] = 6,12 x 10–22 M 2x = 6,12 x 10–22 M ise x = [AgNO3] = 12,24 x 10–22 M KİMYA-2 41 VIII ÇÖZÜNÜRLÜK DENGELERİ 17. nCO –2 = 3 x 10–2 x 0,2 ⇒ nCO –2 = 6 x 10–3 mol 3 3 nSr+2 = 4 x 10–2 x 0,15 ⇒ nSr+2 = 6 x 10–3 mol –2 Sr+2 (suda) + CO 3(suda) ä SrCO3(k) 6 x 10–3 mol 6 x 10–3 mol İyonlardan artan olmadığı için sadece SrCO3 katısının çözünmesiyle oluşan Sr+2 iyonları söz konusudur. –2 SrCO3(k) ä Sr+2 (suda) + CO 3(suda) xM xM xM KÇÇ = [Sr+2] [CO3–2] ⇒ 7 x 10–10 = x2 ⇒ x = [Sr+2] = 2,65 x 10–5 M 18. AgBrO3(k) ä Ag+(suda) + BrO–3(suda) xM xM + xM [BrO–3] –3 KÇÇ = [Ag ] ⇒ 4 x 10–6 = x2 ⇒ x = [AgBrO3] = 2 x 10–3 M 1 Lʼde 2 x 10 mol çözünürse 0,5 Lʼde x ––––––––––––––––––––––––––––– x = 1 x 10–3 mol çözünür; 3 x 10–3 – 1 x 10–3 = 2 x 10–3 mol çözünmeden kalır. MAgBrO = 2 x 10–3 x 236 = 0,472 gram çözünmeden kalır. 3 0,073 19. nSrF = ––––––– = 5,79 x 10–4 mol 2 126 – SrF2(k) ä Sr+2 + 2F (suda) 5,79 x 10–4 M +2 5,79 x 10–4 M 2 x 5,79 x 10–4 M – 2 KÇÇ = [Sr ] [F ] ⇒ KÇÇ = (5,79 x 10–4) (2 x 5,79 x 10–4)2 ⇒ KÇÇ = 7,7 x 10–10 –2 20. a. CuS(k) ä Cu+2 (suda) + S (suda) xM xM +2 xM –2 KÇÇ = [Cu ] [S ] ⇒ 6 x 10–36 = x2 ⇒ x = 2,45 x 10–18 M b. [Na2S] = 0,01 M ise [S–2] = 0,01 Mʼdır. İhmal edilir. KÇÇ = [Cu+2] [S–2] ⇒ 6 x 10–36 = x (x + 0,01) ⇒ x = 6 x 10–34 M c. [CuSO4] = 0,02 M ise [Cu+2] = 0,02 Mʼdır. KÇÇ = [Cu+2] [S–2] ⇒ 6 x 10–36 = (x + 0,02) x ⇒ x = 3 x 10–34 M İhmal edilir. DEĞERLENDİRME ÇALIŞMALARI 2 ÇÖZÜMLERİ 1. Aynı koşullarda pudra şekeri, toz şeker ve kesme şeker eşit miktarda çözünür. (Doğru seçenek E) 2. Gazoz şişesinin kapağı açılınca şiddetli gaz çıkışının gözlenmesi, gazoz çözeltisi üzerindeki basıncın düşmesi ile ilgilidir. (Doğru seçenek 4. 40 ˚Cʼta 100 cm3 suda 50 g X çözünürse A) 200 cm3 suda x 3. 60 ˚Cʼta 100 cm3 suda 60 g X çözünürse ––––––––––––––––––––––––– x = 100 g X çözünür. 500 cm3 suda x ––––––––––––––––––––––––– 100 – 10 = 90 g X çözünmelidir. x = 300 g X çözünür. (Doğru seçenek E) (Doğru seçenek B) 80˚Cʼta 100 cm3 suda 70g X çözünürse 5. 20 ˚Cʼta 100 cm3 suda 40 g X çözünürse 300 cm3 suda x ––––––––––––––––––––––––––––– x = 120 g X çözünür. 300 cm3 suda x ––––––––––––––––––––––––––––– x = 310 g X çözünür. 310 – 120 = 90 X çözünmelidir. (Doğru seçenek B) 42 www. pasayayincilik.com © 2004 VIII ÇÖZÜNÜRLÜK DENGELERİ 100 cm3 suda 20 g X çözünürse 3 250 cm suda x –––––––––––––––––––––––––––– x = 50 g X çözünür. 40˚Cʼta 50 g X için 100 cm3 su gerekir. 250 – 100 = 150 cm3 suyun buharlaştırılması gerekir. 6. 0 ˚Cʼta (Doğru seçenek B) 3 7. 500 cm suda 200 g X çözünürse 3 100 cm suda x ––––––––––––––––––––––––––––––––––––– x = 40 g X çözünür. 100 cm3 suda 40 g Xʼin çözündüğü sıcaklık 20˚Cʼtur. (Doğru seçenek C) mX mX . 100 ⇒ 20 = ––––– . 100 ⇒ mX = 40 g 8. Y = ––––– mT 200 Çözen (su) miktarı = 200 – 40 = 160 g 60 ˚Cʼta 100 cm3 suda 60 g X çözünürse 3 160 cm suda x –––––––––––––––––––––––––––––––––––– x = 96 g X çözünür. 96 – 40 = 56 g X çözünmelidir. –2 3,15 x 10 9. nSrF = ––––––––––– ⇒ nSrF = 2,5 x 10–4 2 2 126 – +2 SrF2(k) ä Sr (suda) + 2 F (suda) 1 x 10–3 M 1 x 10–3 M 2,5 x 10 MSrF = ––––––––––– ⇒ MSrF = 1 x 10–3 M 2 2 0,25 2 x 10–3 M – 2 +2 (Doğru seçenek A) –4 KÇÇ = [Sr ] [F ] ⇒ KÇÇ = (1 x 10–3) (2 x 10–3)2 ⇒ KÇÇ = 4 x 10–9 (Doğru seçenek A) – 10. XY3(k) ä X+3 (suda) + 3Y (suda) 1 x 10–3 M 3 x 10–3 M – KÇÇ = [X+3] [Y ]3 ⇒ KÇÇ = (1 x 10–3) (3 x 10–3)3 ⇒ KÇÇ = 27 x 10–12 11. Pb(OH)2(k) ä xM Pb+2 (suda) +2 xM – 2 +2 – OH (suda) (Doğru seçenek B) xM KÇÇ = [Pb ] [OH ] ⇒ 4 x 10–18 = 4x3 ⇒ x = [Pb(OH)2] = 1 x 10–6 M n = MV ⇒ n = (1 x 10–6) (0,2) ⇒ n = 2 x 10–7 mol Pb(OH)2 m = nM ⇒ m = 2 x 10–7 x 241 ⇒ m = 4,82 x 10–5 gram 12. nSr(NO nNa 3)2 2CrO4 (Doğru seçenek C) = 0,5 x 0,2 = 0,1 mol = 0,8 x 0,125 = 0,1 mol –2 SrCrO4(k) ä Sr+2 (suda) + CrO 4(suda) xM xM +2 KÇÇ = [Sr ] [CrO4–2] nSr+2 = nCrO –2ʼdir ve çözeltideki Sr+2 iyonları çöken SrCrO4ʼın 4 çözünmesinden kaynaklanır. xM ⇒ 3,6 x 10–5 = x2 ⇒ x = [Sr+2] = 6 x 10–3 M 13. Sertlik derecesi 1 iken 13,6 mg CaSO4 Sertlik derecesi 50 iken x ––––––––––––––––––––––––––––––––––––– x = 680 mg = 0,68 g CaSO4 nCaSO CaSO4(k) ä Ca+2 (suda) + MCaSO 5 x 10–3 M 5 x 10–3 M SO–2 4(suda) 5 x 10–3 M 4 4 0,68 = ––––––– = 5 x 10–3 mol 136 5 x 10–3 = ––––––––– = 5 x 10–3 M 1 KÇÇ = [Ca+2] [SO4–2] ⇒ KÇÇ = 5 x 10–3 x 5 x 10–3 ⇒ KÇÇ = 2,5 x 10–5 KİMYA-2 (Doğru seçenek C) (Doğru seçenek C) 43 VIII ÇÖZÜNÜRLÜK DENGELERİ nY–n 3 14. ––––– = ––– ⇒ 2nY–n = 3nX+m ve iyon yükleri Y–2 ve X+3 olmalıdır ki bileşik yüklerinin toplamı sıfır olsun. nX+m 2 –2 X2Y3(k) ä 2X+3 (suda) + 3 Y (suda) KÇÇ = [X+3]2 [Y–2]3 ⇒ KÇÇ = (2 x 10–3)2 (3 x 10–3)3 ⇒ KÇÇ = 1,08 x 10–13 15. PbBr2(k) ä x Pb+2 (suda) + x +2 (Doğru seçenek D) 2Br–(suda) 2x İhmal edilir. – 2 KÇÇ = [Pb ] [Br ] = 4 x 10–6 = x (2x + 0,2)2 ⇒ x = 1 x 10–4 M nPbBr = 1 x 10–4 x 5 ⇒ nPbBr = 5 x 10–4 mol 2 (Doğru seçenek A) 2 16. M1V1 = M2V2 ⇒ 3 x 10–5 x 0,2 = M2 0,6 ⇒ M2 = [Ag+] = 1 x 10–5 M 2 M1V1 = M2V2 ⇒ M1 x 0,4 = M2 x 0,6 ⇒ M2 = [Cl–] = –––– M1 3 + – AgCl(k) ä Ag (suda) + Cl (suda) 2 KÇÇ = [Ag+] [Cl–] ⇒ 1,6 x 10–10 = (1 x 10–5) (––– M1) ⇒ M1 = 2,4 x 10–5 M 3 (Doğru seçenek E) 17. Çözeltiler eşit hacimde (varsayalım 1ʼer litre) karıştırılsın. Bu durumda Fe(OH)2 ve NaOH mol sayıları – 0,2ʼşer molʼdür. Fe(OH)2(k) ä Fe+2 (suda) + 2OH (suda) – FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl KÇÇ = [Fe+2] [OH ]2 1 mol 0,2 2 mol 0,2 ⇒ 0,1 FeCl2 artar. – 1,8 x 10–15 = (0,05) [OH ]2 0,1 [FeCl2]ʼden [Fe+2] = ––––– = 0,05 Mʼdır. 2 – [OH ] = 1,89 x 10–7 M (Doğru seçenek D) 18. M1V1 = M2V2 ⇒ 5 x 10–3 x 0,1 = M2 x 0,5 ⇒ M2 = [Hg+] = 1 x 10–3 M M1V1 = M2V2 ⇒ 2,5 x 10–4 x 0,4 = M2 x 0,5 ⇒ M2 = [Cl–] = 2 x 10–4 M QÇÇ = 1 x 10–3 x 2 x 10–4 ⇒ QÇÇ = 2 x 10–7 > KÇÇ QÇÇ > KÇÇ olduğundan bir miktar HgCl çökmüştür. Denge hâlindeki çözeltide Hg+ ve Cl– iyonları derişimi çarpımı KÇÇʼye eşit olmak zorundadır. (Doğru seçenek E) DENEY 8.1: Bazı bileşiklerin sulu çözeltileri arasındaki tepkimeler Deney Sonu Sorularının Yanıtları 1. a. Pb(NO3)2 + K2CrO4 → PbCrO4 + 2KNO3 –2 b. Pb+2 (suda) + CrO4(suda) → PbCrO4(k) c. FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl – Fe+3 (suda) + 3OH(suda) → Fe(OH)3(k) d. 2AgNO3 + K2CrO4 → Ag2CrO4 + 2KNO3 2Ag+(suda) + CrO–2 4(suda) → Ag2CrO4(k) e. 3AgNO3 + FeCl3 → 3AgCl + Fe(NO3)3 – Ag+(suda) + Cl(suda) → AgCl(k) 2. Çökelti oluşması, tepkimede oluşan tuzun çözünürlüğünün küçük olmasından ileri gelir. 44 www. pasayayincilik.com © 2004 BÖLÜM IX LİSE KİMYA 2 + ASİTLER VE BAZLAR DEĞERLENDİRME ÇALIŞMALARI 1 ÇÖZÜMLERİ – 1. Çözeltinin [H ]ʼni artıran maddelere asit, [OH ]ʼni artıran maddelere baz denir. 2. Asitler: Sulu çözeltileri elektrolittir. Cu, Hg ve Ag gibi yarı soy metallere oksijenli asitler etki eder ve H2O oluşur. Soy olmayan metallere tüm asitler etki eder ve H2 gazı açığa çıkar. Bazlar: Sulu çözeltileri elektrolittir. Al, Zn gibi amfoter metallere (oksitlerine ve hidroksitlerine de) etki eder, diğer metallerle etkileşmez. 3. Asitlere karşı baz, bazlara karşı asit olarak davranan element ya da bileşiklere amfoter madde denir. Al, Zn, Pb, Al2O3, ZnO, PbO2, Cr2O3 amfoter maddelere örnektir. + – 4. Nötrleşme: H iyonuyla OH iyonunun birleşerek su oluşturması, Titrasyon: Hacmi bilinen bir çözeltinin derişimini bulmak için, derişimi belli bir çözeltiyi ölçerek ona ekleyip, tepkimenin bitiş noktasını uygun bir belirtecin renk değişimiyle saptama yöntemi. – + Hidroliz: Bir tuzun suyla tepkimeye girerek H ya da OH iyonlarını oluşturması Tampon etkisi: Zayıf bir asitle (ya da bazla) onun tuzunun oluşturduğu karışımın, eklenen asit ya da baza karşın ortamın pHʼ sini sabit tutması. 5. 6. a. H2SO4(s) + H2O(s) ä H3O+(suda) + H2SO–4(suda) N2O5 +H2O ä 2HNO3 (asit) CO(g) ä CO(suda) (nötr) Asit 1 Asit 1 CaO + H2O ä Ca(OH)2 (baz) 7. Asit 1 8. Baz 2 – H2PO 4(suda) Asit 1 9. + Asit 2 CO–2 3(suda) Baz 2 + ä Baz 1 – Baz 1 Asit 2 Asit 1 Baz 2 + NH3(suda) Baz 1 Baz 1 pH = 12 ⇒ [H ] = 1 x 10 Asit 2 + HPO–2 4(suda) –12 Baz 2 c. C6H5NH2(s) + H2O(s) ä C6H5NH 3(suda) + OH (suda) CH3OH(suda) (nötr) ä Baz 1 b. HCN(s) + H2O(s) ä H3O+(suda) + CN (suda) CrO3 + H2O ä H2CrO4 (asit) H3O+(suda) Asit 2 – SO3 + H2O ä H2SO4 (asit) CH3OH(s) ä + NH 4(suda) + H2O(s) Baz 2 – + HCO 3(suda) Asit 2 – M ⇒ [OH ] = 1 x 10–2 M nNaOH = 1 x 10–2 x 2 ⇒ nNaOH = 2 x 10–2 mol mNaOH = 2 x 10–2 x 40 = 0,8 gram 7,3 0,2 10. nHCl = ––––––– = 0,2 mol MHCl = ––––– = 0,01 = 1 x 10–2 mol L–1 36,5 20 + –2 pH = –log [H ] ⇒ pH = –log 10 ⇒ pH = 2 0,01 11. [HA] = –––––– = 1 x 10–1 M 0,1 + HA(suda) ä H (suda) + A–(suda) 1 x 10–1 M + 2 x 10–5 M – 2 x 10–6 + + [H ] = –––––––– ⇒ [H ] = 2 x 10–5 mol L–1 0,1 2 x 10–5 M [H ][A ] 2 x 10–5 x 2 x 10–5 Ka = –––––––––– ⇒ Ka = –––––––––––––––––– ⇒ Ka = 4 x 10–9 [HA] 1 x 10–1 + 12. pH = 1 ⇒ [H ] = 10–1 M nH+ = 10–1 x 0,01 ⇒ nH+ = 0,001 mol + pH = 2 ⇒ [H ] = 10–2 M nH+ = 10–2 x 0,1 ⇒ + pH = 3 ⇒ [H ] = 10–3 M nH+ = 10–3 x 1 ⇒ KİMYA-2 nH+ = 0,001 mol nH+ = 0,001 mol Çözeltiler karıştırılıp su eklenince; 0,001 + 0,001 + 0,001 + [H ] = –––––––––––––––––––––––––– 0,10 + 0,100 + 1,000 + 1,890 + [H ] = 1 x 10–3 pH = 3 45 IX ASİTLER VE BAZLAR – pH = 13 ⇒ pOH = 1 ve [OH ] = 0,1 mol L–1 dir. 14. 13. nNaOH = nOH– = 0,002 x 3 = 0,006 mol nHNO = 0,8 x 0,4 = 0,32 mol nHNO = nH+ = 0,022 x 3 = 0,066 mol 3 3 + nKOH = 0,7 x V Artan H iyonu, 0,066 = 0,006 = 0,06 molʼdür. nKOH 0,7 V – 0,32 0,06 + MKOH = ––––––– ⇒ 0,1 = ––––––––––––– [H ] = –––––– = 0,01 = 1 x 10–2 mol L–1 pH = 2 VTOP V + 0,4 6 + –2 V = 0,6 L = 600 mL 15. pOH = 12 ⇒ pH = 2 ⇒ [H ] = 10 M 4,6 0,1 nHCOOH = ––––– = 0,1 mol MHCOOH = ––––– = 0,5 mol L–1 46 0,2 + – HCOOH(s) ä H (suda) + HCOO (suda) + – [H ] [HCOO ] 10–2 x 10–2 Ka = ––––––––––––––– ⇒ Ka = –––––––––––– ⇒ Ka = 2 x 10–4 [HCOOH] 0,5 – – 16. pH = 8 ⇒ pOH = 6 ⇒ [OH ] = 10–6 M +3 17. M(OH)2(k) ä M+2 (suda) + 2OH (suda) – xM La(OH)3(k) ä La (suda) + 3OH (suda) xM xM +3 – 3 KÇÇ = [La ] [OH ] ⇒ 2 x 10 – –6 3 x = 5 x 10–7 M 2x = [OH ] = 1 x 10–6 M = x (x + 10 ) x = 0,2 M 2xM – 2 KÇÇ = [M ] [OH ] ⇒ 5 x 10–19 = 4x3 xM –19 xM +2 İhmal edilir. pOH = 6 ⇒ pH = 8 nLa(OH) = 0,2 x 0,5 = 0,1 mol 3 18. nKOH = nOH– = 4 x 10–2 x 0,25 ⇒ nOH– = 0,01 mol Nötrleşme anında, nOH– = nH+ olacağından; 0,01 MH+ = MHCl = –––––– ⇒ MHCl = 0,01 mol L–1 ⇒ pH = 2ʼdir. 1 + – + CH3NH 3(suda) + H2O(s) ä CH3NH2(suda) + H3O+(suda) 19. CH3NH3Cl(suda) ⎯→ CH3NH 3(suda) + Cl (suda) 0,044 M 0,044 M + (0,044 – x) M –14 xM xM 2 Ksu [CH3NH2] [H3O ] 1 x 10 x Kh = ––––– = ––––––––––––––––– ⇒ –––––––––– = ––––––––– ⇒ x = 1 x 10–6 M + –4 Kb [CH3NH 3] 4,4 x 10 0,044 – x + –6 [H ] = X = 1 x 10 M ⇒ pH = 6 İhmal edilir. 20. nCH 2,05 0,025 = –––––– = 0,025 mol MCH COONa = ––––––– = 0,05 M 3 82 0,05 [Asit] 0,2 [H+] = Ka ––––––– ⇒ [H+] = 1,8 x 10–5 –––––– ⇒ [H+] = 7,2 x 10–5 M [Tuz] 0,05 3COONa PV 21. nHCl = –––– RT 0,5 · 0,112 0,056 nHCl = –––––––––– ⇒ nHCl = ––––––– = 0,0025 mol 0,082 · 273 22,4 0,0025 [HCl] = [H+] = –––––––– = 0,01 M ⇒ pH = –log[H+] = –log 1 · 10–2 = 2 0,25 DEĞERLENDİRME ÇALIŞMALARI 2 ÇÖZÜMLERİ 1. C6H5NH2(suda) + H2O(s) ä C6H5NH+3(suda) + OH–(suda) Baz 1 – Asit 2 Asit 1 (Doğru seçenek C) Baz 2 2. [OH ] > 10–7 ise pOH < 7 ve pH > 7 olur. 2 3. nNaOH = –––– = 0,05 mol nOH– = 0,05 mol 40 0,05 1 x 10–14 – + + [OH ] = –––––– = 0,1 M ⇒ [H ] = ––––––––––– ⇒ [H ] = 1 x 10–13 ⇒ pH = 13 0,5 0,1 46 (Doğru seçenek D) (Doğru seçenek E) www. pasayayincilik.com © 2004 IX ASİTLER VE BAZLAR 4. + pH = 5 ⇒ [H ] = 1 x 10–5 M ⇒ [HCl] = 1 x 10–5 M nHCl = 1 x 10–5 x 0,2 = 2 x 10–6 mol m = 2 x 10–6 x 36,5 = 7,3 x 10–5 gram (Doğru seçenek D) – 5. pH = 11 ⇒ pOH = 3 ⇒ [OH ] = 1 x 10–3 M – Ni(OH)2(k) ä Ni+2 (suda) + 2 OH (suda) xM (2x + 1 x 10–3) M xM – 2 +2 İhmal edildi. KÇÇ = [Ni ] [OH ] ⇒ 1,6 x 10–16 = x (2x + 1 x 10–3)2 ⇒ x = [NiOH] = 1,6 x 10–10 M (Doğru seçenek E) + 6. pH = 2 ⇒ [H ] = 1 x 10–2 M nH+ = 1 x 10–2 x 0,1 ⇒ nH+ = 1 x 10–3 mol n 1 x 10–3 + pH = 4 ⇒ [H ] = 1 x 10–4 M V = –––– ⇒ V = ––––––––– ⇒ V = 10 L M 1 x 10–4 10 L = 10 000 mL Eklenen su, 10 000 – 100 = 9900 mLʼdir. (Doğru seçenek C) – 7. pH = 9 ⇒ pOH = 5 ⇒ [OH ] = 1 x 10–5 M + [AgNO3] = [Ag ] = 2 x 10–3 M – Ag+(suda) + OH (suda) ⇒ KÇÇ = 2 x 10–3 x 1 x 10–5 ⇒ KÇÇ = 2 x 10–8 8. CH3COOH ä H 0,5 M + x M + + CH3COO – (Doğru seçenek D) – x M [H ] [CH3COO ] x2 + Ka = –––––––––––––––– ⇒ 1,8 x 10–5 = –––– ⇒ x = [H ] = 3 x 10–3 M [CH3COOH] 0,5 + 9. MOH ä M + OH 0,01 M xM + – – 0,1 M bazın xM [M ] [OH ] x2 Ka = –––––––––––– ⇒ 9 x 10–7 = ––––– [MOH] 0,1 x = 3 x 10–4 [HA] 10. 100 Mʼın 0,3 Mʼı iyonlaşırsa 0,5 M 0,5 Mʼın x ––––––––––––––––––––––––––– x = 1,5 x 10–3 Mʼı iyonlaşır. 3 x 10 Mʼi iyonlaşırsa 100 M bazın x ––––––––––––––––––––––––––––––––––––––– x = 0,3 Mʼı iyonlaşır; bazın %0,3ʼü iyonlaşmıştır. ä + H + + A – (Doğru seçenek A) 1,5 x 10–3 M 1,5 x 10–3 M [H ] [A–] 1,5 x 10–3 x 1,5 x 10–3 Ka = –––––––– ⇒ Ka = –––––––––––––––––– ⇒ Ka = 4,5 x 10–6 [HA] 0,5 (Doğru seçenek D) 8 x 10–4 – 11. [OH ] = ––––––––– = 2 x 10–3 M 0,4 + – MOH ä M + OH xM (Doğru seçenek B) –4 2 x 10–3 M 2 x 10–3 M + – [M ] [OH ] (2 x 10–3)2 Kb = –––––––––––– ⇒ 4 x 10–5 = ––––––––––– ⇒ x = 0,1 M [MOH] x m 0,68 nMOH = 0,1 x 0,4 = 0,04 mol MMOH = –––– ⇒ MMOH = –––––– = 17 g mol–1 n 0,04 + – 12. MOH ä M + OH x + (Doğru seçenek A) x – [M ] [OH ] x2 – Kb = –––––––––––– ⇒ 4 x 10–10 = –––––– ⇒ x = [OH ] = 1 x 10–5 M [MOH] 0,25 – Cd(OH)2(k) ä Cd+2(suda) + 2 OH (suda) xM xM +2 – 2 2x M KÇÇ = [Cd ] [OH ] ⇒ 5,9 x 10 –15 İhmal edilir. = x (2x + 1 x 10–5)2 ⇒ x = 5,9 x 10–5 M (Doğru seçenek C) KİMYA-2 47 IX ASİTLER VE BAZLAR 13. nH 3PO4 14. nNaOH = 1 x 0,06 = 0,06 mol = 0,1 x 0,1 = 0,01 mol nasit = 0,125 x 0,16 = 0,02 mol H3PO4 + 3KOH → K3PO4 + 3H2O 0,01 mol 3 x 0,01 mol m m n = –––– ⇒ 0,03 = ––––– ⇒ m = 1,68 gram M 56 20 g KOHʼin 1,68 gʼı tepkimeye girerse 100 g KOHʼin x –––––––––––––––––––––––––––––––––––––– x = 8,4 gramı tepkimeye girer. KOH, %8,4ʼlüktür. (Doğru seçenek C) 0,65 16. nZn = –––––– = 0,01 mol nHCl = 0,3 x 0,1 = 0,03 mol 65 Zn + 2HCl → ZnCl2 + H2 0,01 mol 0,02 mol nH+ = nOH– olabilmesi için asit 3 değerli olmalıdır. 0,06 n = ––––––– = 3 (Doğru seçenek C) 0,02 15. nKOH = 0,8 x 0,1 = 0,08 mol 2KOH + H2A → K2A + 2H2O 0,08 mol 0,04 mol 100 60 6 x ––––––––––––––– x = 3,6 H2A m 3,6 n = –––– ⇒ 0,04 = ––––– ⇒ M = 90 g mol–1 M M (Doğru seçenek D) Artan HCl, 0,03 – 0,02 = 0,01 molʼdür. 0,01 + [HCl] = [H ] = ––––– = 0,1 M pH = 1 0,1 (Doğru seçenek B) nasit 2 x 10–4 + + 17. [H ] = Ka ––––– ⇒ [H ] = 4 x 10–10 –––––––––– ntuz 8 x 10–5 + 18. nHBr = 0,01 x 0,1924 ⇒ nHBr = 1,924 x 10–3 mol [H ] = 1 x 10–9 M ⇒ pH = 9 (Doğru seçenek D) HBr + (CH ) NH → (CH ) NH Br 3 2 1,924 x 10–2 mol 3 2 2 1,924 x 10–2 mol 1,924 x 10–2 [(CH3)2NH] = –––––––––––– = 1,924 x 10–3 M 1 + – (CH3)2NH + H2O ä (CH3)2 NH 2 + OH + x x [(CH3)2 NH 2] x2 Kb = ––––––––––––––– ⇒ 5,2 x 10–4 = –––––––––––– ⇒ x = 10–3 M [(CH3)2NH] 1,924 x 10–3 – x = [OH ] = 1 x 10–3 M pOH = 3 olur. (Doğru seçenek A) 20. pH < 7 ise XO2 asit oksittir. 19. X → asidik tuz –––––––– pH < 7 Z → bazik tuz –––––––– pH > 7 ise Y2O bazik oksittir. (Doğru seçenek A) (Doğru seçenek B) Y→ nötr tuz ––––––– pH = 7 pH > 7 pH = 7 ise XO nötr oksittir. DENEY 9.1: Asit ve baz titrasyonu Deney Sonu Sorularının Yanıtları 1. n = MV ⇒ n = 0,1 · 0,05 ⇒ n = 5 · 10–3 mol 2. HCl + NaOH → NaCl + H2O Tepkime denklemine göre tüketilen NaOH da 5 · 10–3 moldür. n 5 · 10–3 3. M = –––– ⇒ M = –––––––– ⇒ M = 0,1 molar. V 5 · 10–2 a 48 b www. pasayayincilik.com © 2004