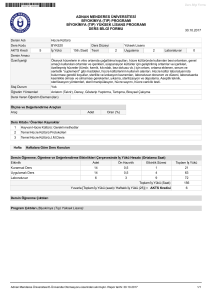
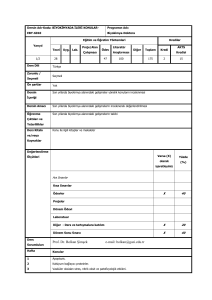
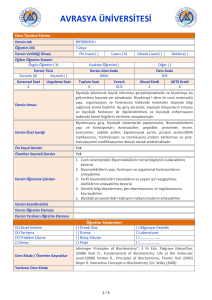
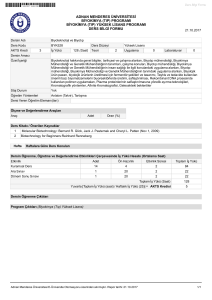
deney ı - Marmara Üniversitesi
advertisement
Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Biyokimya Laboratuvarı I – Güz 0 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı İçindekiler Laboratuvar Kuralları ve Güvenlik……………………………………….....2 Deney I Amino Asitlerin Titrasyon Eğrileri Ve İzoelektrik Nokta Tayini ……………….…....3 Deney II Amino Asitlerin Kağıt Kromatografisi İle Ayrılmaları………………………….......7 Deney III Amino Asitlerin Ve Proteinlerin Bazı Özelliklerinin İncelenmesi .…………………11 Deney IV Tampon Çözeltiler…………………………………………………..……..…………….19 Deney V Katekolün Oksidasyonuna Polifenol Oksidaz Enziminin Etkisi………………………...23 Deney VI Proteinlerin Saflaştırılması Ve Karakterizasyonu…………………………………….....32 Deney VII Proteinlerin Kantitatif Tayini………………………………………………...………….39 Deney VIII Proteinlerin Elektroforez İle Ayrılmaları Ve Molekül Ağırlıklarının Tayini………....…45 Deney IX Proteinlerin N- Terminal Amino Asitlerinin İnce Tabaka Kromatografisi İle Belirlenmesi……54 Deney X Memeli Dokularından DNA İzolasyonu Ve Bazı Özelliklerinin İncelenmesi………..…60 Kapak resmi: İnsan insülin parçalayıcı enziminin beta-amiloid (mavi) ile verdiği kompleksin yapısı Biyokimya Laboratuvarı I – Güz 1 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Laboratuvar Kuralları ve Güvenlik Biyokimya laboratuvarı güz döneminde, protein saflaştırılması ve karakterizasyonu, enzim kinetiği ve DNA izolasyonu gibi biyokimyada yaygın olarak kullanılan tekniklerle ilgili genel prosedürlerin tanıtılması hedeflenmektedir. Ayrıca biyokimyada sık olarak kullanılan bazı cihazların kullanımı öğretilecektir. Her labarotuvardan önce o gün yapılacak olan deneyi mutlaka dikkatle okuyunuz. Her deneyden önce bir kısa sınav yapılacaktır. Bu sınav sonucunda sıfır almış olan öğrenci o deneye alınmaz. Laboratuvarda çalışırken laboratuvar önlüğü ve (steril olmayan) laboratuvar eldiveni kullanılır. Önlük ve eldivenlerinizi laboratuvardan ayrılıncaya kadar çıkarmayınız. Bazı yumuşak lensler laboratuvar kimyasalları ile tepkimeye girerek rahatsızlık oluşturacağından, eğer mümkünse kontak lenslerinizi laboratuvara girmeden önce çıkarınız. Deney esnasında asistanların talimatlarını dikkatle uygulayınız. Deney bitiminde tüm cihazları kapatıp, çalıştığınız yerin temizliğini iyi bir şekilde yapınız. Bazı kimyasallar zehirli, mutajenik, karsinojenik veya teratojenikdir (doğum kusurlarına yol açan). Bu kimyasalların kullanımında ve atılmalarında laboratuvardaki görevlilerin yaptığı uyarıları dikkate alınız. Tüm öğrencilerin bir laboratuvar defteri tutmaları istenmektedir. Deney esnasında yaptığınız her bir ölçümü, deney aşamasını, dikkatle laboratuvar defterinize not alınız. Her deneyin tamamlanmasından sonra en geç bir sonraki deneyden bir gün önce deney raporlarınızı ilgili asistana teslim ediniz. Bu raporlar aşağıdaki şekilde hazırlanmalıdır. Başlık: Deneyin adı Materyal ve Metod: Kısaca deneyin yapılışı ve kullanılan kimyasallar Sonuçlar ve tartışma: Deney sonunda elde ettiğiniz veriler ve yorumlarınız Çalışma Soruları: Çalışma sorularına verdiğiniz yanıtlar Öğrenciler deneyleri gruplar halinde yapmaktadırlar ancak her bir öğrenci kendi yorumlarını, kendi hazırladığı deney raporu ile sunmalıdır. Birbirinin aynı olan raporlar kabul edilmez. Aynı şekilde çalışma sorularına cevap verilmemiş deney raporları da kabul edilmez. Deneylerin değerlendirilmesinde en önem verilen kısım tartışma kısmıdır. Mutlaka her bir deneyin neden gerçekleştiği (veya neden gerçekleşmediği) konusunda kendi açıklamalarınızı ekleyiniz. Her dönemde bir ara sınav yapılır. Laboratuvar kısa sınavlarının %10’u deney raporlarının %20’si ve ara sınavın %70’i alınarak öğrencinin vize notu saptanır. Ara sınavdan sonra yapılan deneyler için de laboratuvar kısa sınavlarının %10’u deney raporlarının %20’si ve finalin %70’i alınarak öğrencinin final notu saptanır. Biyokimya laboratuvarında devam zorunluluğu %80’dir. 3 kez laboratuvara gelmeyen bir öğrenci devamsızlıktan kalmış olur ve sınavlara alınmaz. Biyokimya Laboratuvarı I – Güz 2 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı DENEY I AMİNO ASİTLERİN TİTRASYON İZOELEKTRİK NOKTA TAYİNİ EĞRİLERİ VE Amfoterik maddeler olan amino asitlerde iki fonksiyonel grup bulunur. Bunlar karboksilik asit (-COOH) ve amino (-NH2) gruplarıdır. Bu fonksiyonel gruplar nötral ortamda iç tuz oluştururlar. Nötral Ortamda: (İç Tuz) Asidik Ortamda: (Katyon) Bazik Ortamda: (Anyon) Yukarıdaki denklemlerden de görülebileceği gibi amino asitlerin amino grubu hidrojen iyonu kabul edebilir, karboksil grubu ise hidrojen verebilir. Bu sebepten dolayı amino asitler hem asitler hem de bazlarla titre edilebilirler, yani amfoterik özellik gösterirler. Amino asitlerde titre edilebilir en az iki grubun olması, en az iki denge sabiti (K) ve iki iyonizasyon sabiti (Ki) olduğu anlamına gelir. İzoelektrik nokta (pI), aminoasitte bulunan artı ve eksi yüklerin birbirine eşit olduğu, yani amino asidin net yükünün 0 olduğu pH değeridir, yani K1 ve K2’nin dengede olduğu noktadır. Biyokimya Laboratuvarı I – Güz 3 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Asit-baz titrasyonları protonların kademeli olarak eklenmesi veya uzaklaştırılmasıdır. Aşağıdaki şekilde glisinin titrasyon eğrisi gösterilmiştir. Şekilden glisinin iki tamponlama aralığına sahip olduğu görülmektedir. Bunlar pH 2.34 ve pH 9.6 merkezli +/-1 pH aralığına sahip dikdörtgen alanlar olarak gösterilmişlerdir. Glisin bu pH aralıklarında tampon çözelti olarak kullanılabilir. Şekilden de görüldüğü gibi glisinin izoelektrik noktasının teorik değeri 5.97’dir. İyonlaşabilen yan zincire sahip amino asitlerde ise üç bölgeli bir titrasyon grafiği beklenmelidir. Şekil 1.1- Glisinin titrasyon eğrisi KÂĞIT Şekil 1.2- Glutamik asidin titrasyon eğrisi Biyokimya Laboratuvarı I – Güz Şekil 1.3- Histidinin titrasyon eğrisi 4 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı KİMYASALLAR HCl, NaOH, Glisin. YÖNTEM 50 mL 0.1 N Glisin çözeltisi hazırlanır. pH metrenin kalibrasyonu yapıldıktan sonra, hazırlanan çözeltiden 20 mL’lik bir hacim bir behere aktarılarak pH metre yardımı ile pH tayin edilir. Daha sonra 0.1N HCl ile titre edilir. Her 1 mL asit ilavesinden sonra beher karıştırılarak pH ölçümü yapılır. İşleme pH göreceli olarak sabit kalıncaya kadar devam edilir. pH metrenin elektrodu destile su ile yıkanır, kurulanır. Hazırlanmış olan 0.1N Glisin çözeltisinden bir başka behere 20 mL daha alınır ve pH metre yardımı ile pH ölçümü yapılır. Daha sonra 0.1N NaOH ile titre edilir. Her 1mL baz ilavesinden sonra beher karıştırılarak pH ölçümü yapılır. İşleme pH göreceli olarak sabit kalıncaya kadar devam edilir. Elde edilen değerler veri tablosuna işlenir. Asit titrasyonu veri tablosu: Eklenen HCl (mL) 0 1 pH Eklenen HCl (mL) pH Eklenen HCl (mL) pH Eklenen HCl (mL) pH Baz titrasyonu veri tablosu: Eklenen Baz (mL) 0 1 pH Eklenen Baz (mL) pH Eklenen Baz (mL) pH Eklenen Baz (mL) pH Biyokimya Laboratuvarı I – Güz 5 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı VERİLERİN KULLANIMI Milimetrik grafik kağıdı kullanarak x eksenine eklenen asit ve eklenen baz hacmini, y eksenine ise ölçülen pH değerlerini koyarak grafiği çiziniz ve grafikten pKa ve pKb değerlerini ve pI değerini bulunuz. Grafik üzerinden elde ettiğiniz verileri teorik değerler ile karşılaştırınız. Şekil 1.4- Glisinin asit ve bazla titrasyon eğrisi ÇALIŞMA SORULARI 1- Glutamik asit ve histidinin pI değeri nasıl hesaplanır? Aminoasitlerin farklı pI değerlerine sahip olmalarının önemi nedir? 2- Genel amino asit denklemi kullanılarak izoelektrik noktası formülü nasıl çıkarılır? Biyokimya Laboratuvarı I – Güz 6 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı DENEY II AMİNO ASİTLERİN KÂĞIT KROMATOGRAFİSİ İLE AYRILMALARI Kromatografi bir karışımdaki maddelerin iki faz arasında farklı dağılması esasına dayanan bir ayırma yöntemidir. Sistemdeki fazlardan biri sabit (stasyoner) faz, diğeri ise hareketli (mobil) faz olarak adlandırılır. Sabit faz genellikle destek ortamı oluşturmak amacı ile kullanılırken, hareketli faz, karışımı oluşturan bileşenleri taşımak amacı ile kullanılır. Karışımı oluşturan bileşenler hareketli ve sabit faz ile farklı oranlarda etkileşerek farklı hızlarda yürürler. Bu esasa dayalı olarak ayırma yapan yöntemlere kromatografik yöntemler denir ve ayırmayı sağlayan kuvvete göre adsorpsiyon, dağılım, iyon değişim, jel geçirgenlik ve afinite (ilgi) olmak üzere beş sınıfa ayrılır. Kromatografik yöntemler biyokimya alanında, istenen bir maddenin saflaştırılması (örneğin bir bitki ya da bir hayvan dokusundan proteinlerin elde edilmesi), seyreltik çözeltilerin konsantre edilmesi, bir maddenin saflığının kontrol edilmesi ve organizmadaki metabolitlerinin belirlenmesi gibi alanlarda kullanılır. Kâğıt kromatografisi, dağılım kromatografisinin özel bir şeklidir. Burada kullanılan Whatman kromatografi kâğıtları saf selülozdan, herhangi bir katkı maddesi kullanılmadan üretilmiştir ve düzgün gözenek boyutuna sahiptir. Whatman kâğıdı, durağan faz olarak adsorplanmış su içerir. Hareketli fazın kapiler etkisiyle ayrımı yapılacak olan maddeler Whatman kâğıdı boyunca hareketli faz ile etkileşimlerine göre farklı hızlarda ilerlerler. Karışımı oluşturan bileşenler renkli ise kâğıt üzerinde yürüdükleri yerlerde yuvarlağa yakın lekeler şeklinde görülürler. Eğer renksiz iseler üzerlerine bir reaktif püskürtülerek ya da UV ışığı altında renk göstermeleri ile görünür hale getirilirler. Leke büyüklüğü ve renk şiddeti kullanılarak kantitatif veya semi-kantitatif analiz yapılabilir. Retensiyon Faktörü (Rf) lekelerin merkez noktasının başlangıç noktasına uzaklığının, çözücü sınırının başlangıç noktasına olan uzaklığına bölünmesi ile elde edilir. Rf değeri bir karışımı oluşturan bileşenlerin tanımlanması için kullanılır. Aynı şartlarda (sabit ve hareketli fazın cinsi, sıcaklık vb.) kromatografisi yapılan her bir maddenin karakteristik bir Rf değeri vardır. Biyokimya Laboratuvarı I – Güz 7 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Şekil 2.1- Amino asitlerin ninhidrin reaksiyonu mekanizması KİMYASALLAR Asetik asit, n-butanol, ninhidrin, aspartik asit, lösin, valin, arjinin, prolin, fenilalanin, HCl, Whatman No.1 kromatografi kâğıdı. YÖNTEM n-butanol: asetik asit: su (65:15:25) karışımı hareketli faz olarak hazırlanır. Kromatografi tankına 10 mL (yaklaşık 1 cm yüksekliğinde olacak şekilde) çözücü konulur ve tankın ağzı kapatılır. Tankın çözücü buharı ile dengeye gelmesi için kromatografi kâğıdı yerleştirilinceye kadar kapağı açılmaz. Biyokimya Laboratuvarı I – Güz 8 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Size verilen 5cm x 8cm boyutundaki Whatman No:1 Kromatografi kağıdının kısa kenarından 1.2 cm uzaklığında kurşun kalemle bastırmadan çok hafif bir çizgi çizilir ve bu çizgi üzerinde 1cm aralıkla 4 nokta işaretlenir. 1N HCl içinde çözünmüş aspartik asit, lösin, valin, arjinin, prolin, fenilalanin çözeltilerinden grubunuza verilmiş olan üçü ve amino asit karışımı bilinmeyen örnek, ayrı ayrı işaretlenmiş 4 noktaya temiz bir kapiler tüp yardımı ile tatbik edilir. Tatbik noktasının çapı 4 mm’yi geçmemelidir. Birden fazla damla tatbikinde, her damla tatbikinden sonra leke yerinin kurutulması ve ikinci damlanın ondan sonra tatbik edilmesi gereklidir. Tatbik edilen noktalar kurutulduktan sonra kâğıt, bir pens ile tutularak tatbik noktaları aşağıya gelecek şekilde tanka yerleştirilir. Kâğıdın, tankın kenarlarına değmemesine ve tatbik noktalarının çözücü ile doğrudan temas etmemesine dikkat edilir. Çözücünün ilerlemesi takip edilir ve üstten yaklaşık Şekil 2.1- Kromatografi kağıdı 0.5 cm boşluk kalıncaya kadar yürütülür (Bu işlem yaklaşık 45 dakika sürer). Çözücünün yürüdüğü mesafe hemen kurşun kalemle işaretlenerek kâğıt etüvde kurutulur. Etüvden çıkartılan kâğıdın üzerine çeker ocakta ninhidrin reaktifi püskürtülür ve kurutulmak üzere yeniden etüve konulur. Oluşan mor lekelerin çevresi kurşun kalemle işaretlenerek Rf değerleri hesaplanır ve veri tablosuna kaydedilir. Karışımda bulunan amino asitlerin hangileri olduğu hesaplanan Rf değerleri ile karşılaştırılarak tayin edilir. Amino Asit Lekenin Rengi Rf Değeri Aspartik Asit Lösin Valin Arjinin Prolin Fenilalanin Örnek Şekil 2.2- Yürümesi tamamlanmış olan kromatografi kağıdı. Biyokimya Laboratuvarı I – Güz 9 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı ÇALIŞMA SORULARI 1- Rf değerlerini hesapladığınız amino asitlerin yürüme hızlarının farklı olmasının nedenlerini araştırınız. Bu amino asitlerin formülleri aşağıda yer almaktadır. 2- Glutamik asit, histidin, glisin, triptofan ve izolösinden oluşan bir amino asit karışımı, NH3:Benzen (10:90) hareketli fazı kullanılarak kağıt kromatografisi ile ayrılmak isteniyor. Amino asitlerin yürüme hızlarının nasıl olmasını beklersiniz? 3- Amino asitler organizmada protein yapısına katılmaktan başka hangi görevleri yaparlar? Şekil 2.3- Protein yapısında yaygın olarak bulunan amino asitler. Biyokimya Laboratuvarı I – Güz 10 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı DENEY III AMİNO ASİTLERİN VE PROTEİNLERİN ÖZELLİKLERİNİN İNCELENMESİ BAZI I- AMİNO ASİTLER Amino asitler yapılarında en az bir karboksil ve bir amino grubu içeren organik bileşiklerdir. Tabiatta bulunan yaklaşık 300 amino asidin 20 tanesi protein yapısına girer. Protein yapısına giren amino asitler L, α- aminoasitlerdir. Amino asitler peptid (amid) bağları ile bağlanarak polipeptid ve proteinleri oluştururlar. Amino asitler polar olmayan organik çözücülerde çok az, etanolde az, suda çok çözünürler ve nötral çözeltiler verirler. Hem asidik, hem de bazik çözeltilerde artan bir çözünürlüğü, yani amfoter bir karaktere sahiptirler. Erime ve bozulma noktaları 120300 °C aralığındadır. Saf bir amino asidin suda çözülmesiyle meydana gelen çözeltinin pH değerine izoiyonik nokta denir. Amino asitlerin ve proteinlerin izoiyonik noktada çözünürlükleri maksimumdur. 8 amino asidi (valin, lösin, izolösin, treonin, metiyonin, fenilalanin, triptofan, lizin) organizma sentezleyemez. Bunlara esansiyel amino asitler denir. Bu amino asitlerin diyetle dışarıdan alınması gereklidir. Şekil 3.1- Alanin amino asidinin stereoizomerleri II- PEPTİDLER Bir amino asidin amino grubu, ikinci bir amino asidin karboksil grubu ile reaksiyona girdiğinde bir molekül su ayrılması ile dipeptid oluşur. Arada oluşan kovalent bağa peptid bağı denir ve rezonans gösterdiği için son derece kararlıdır. 2 amino asit bir dipeptid, 3 amino asit bir tripeptid, 10 veya daha az sayıda amino asit bir oligopeptid, 50-100 amino asit ise bir polipeptid oluşturur. Peptidlerin asidik ve bazik özellikleri zincirin iki ucundaki amino ve karboksil grupları ile yan zincirlerde bulunan iyonlaşabilen gruplara bağlıdır. Biyokimya Laboratuvarı I – Güz Şekil 3.2- Peptid bağının oluşumu 11 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Şekil 3.3- Serilglisiltirozilalanillösin pentapeptidi Peptidler N-terminali (peptid zincirindeki serbest amino grubu) solda, C-terminali (peptid zincirindeki serbest karboksil grubu) sağda kalacak şekilde yazılırlar ve bu şekilde isimlendirilirler. Bu pentapeptid serilglisiltirozilalanillösin veya Ser–Gly–Tyr– Ala–Leu olarak isimlendirilir. III- PROTEİNLER 100’den fazla aminoasit içeren polipeptidlere protein adı verilir. Bazen belirli bir biyolojik fonksiyonu gerçekleştirmek üzere, belirli bir konformasyonu almış olmak şartı ile 100’den daha az sayıda amino asit içeren polipeptidlere de protein adı verilebilir. Canlı hücrelerin kuru ağırlığının yarısından fazlasını proteinler oluşturur. Proteinler organizmada enzimlerin, hormonların, reseptörlerin, bağışıklık sistemi ve pıhtılaşma faktörlerinin yapısında bulunurlar. Yapı ve hareket sistemi içinde görev alırlar. Amino asitler birleşerek peptid zincirini oluştururlar. Bu proteinlerin primer yapısıdır. Peptid zincirleri daha kararlı bir hale gelmek üzere temel bir üç boyutlu yapı oluştururlar. Buna proteinlerin sekonder yapısı denir. Bir polipeptidde birden fazla sekonder yapı bir araya gelerek çeşitli kimyasal etkileşmeler sonucu üç boyutlu yapıda katlanırlar. Buna tersiyer yapı denir. Birden fazla tersiyer yapıda katlanmış polipeptid zincirleri bir araya gelerek kuaterner yapıyı oluştururlar. Şekil 3.4- Proteinlerin yapısı Proteinin doğal yapısındaki herhangi bir değişim denatürasyon olarak adlandırılır. Sıcaklık, asitler (HCl, trikloroasetik asit, perklorik asit vb.) organik çözücüler (etanol, aseton vb.), çapraz bağlayıcılar (formaldehit, glutaraldehit), kaotropik ajanlar (üre 6-8 M, guanidin klorür 6M), indirgeyici ajanlar (2-merkaptoetanol, ditiyotreitol, iyodoasetat), Biyokimya Laboratuvarı I – Güz 12 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı yüksek konsantrasyonda tuzlar (amonyum sülfat), ağır metal tuzları (cıva(II)klorür, bakır(II)sülfat vb.) ve bazı deterjanlar (sodyumdodesilsülfat) proteinlerde denatürasyona yol açarlar. Eğer denatüre edici faktörün ortamdan kaldırılması ile protein doğal yapısını yeniden kazanabiliyorsa buna geri dönüşümlü denatürasyon denir. Eğer denatüre edici faktörün ortamdan kaldırılması ile protein doğal yapısını yeniden kazanamıyorsa buna geri dönüşümsüz denatürasyon denir. Denatüre olan proteinlerde kuaterner, tersiyer ve kısmen sekonder yapılar bozulur ancak primer yapı bozulmaz. Eğer polipeptid zincirinde kopmalar meydana geliyorsa buna degradasyon adı verilir ve geri dönüşümsüzdür. Düşük konsantrasyonlarda tuzlar proteinlerin çözünürlüğünü arttırırlar. MgCl2, (NH4)2SO4 gibi iki değerlikli tuzlar, NaCl ve NH4Cl gibi tek değerlikli tuzlara göre daha etkilidirler. Bu tuzların konsantrasyonları arttıkça proteinlerin çözünürlükleri azalır ve yüksek tuz konsantrasyonlarında proteinler çöker. KİMYASALLAR Glisin, arjinin, glutamik asit, fenilalanin, tirozin, triptofan, histidin, sistein, sistin, kazein, yumurta albümin, sülfat asidi, nitrat asidi, hidroklorik asit, sodyum hidroksit, cıva(II)klorür, sodyumnitroprussiyat, bakır(II)sülfat, bakır(II)asetat, kadmiyum sülfat ve bizmut(II)nitrat. YÖNTEM I- Amino Asitlerin Reaksiyonları Amino asitlerin çözünürlüğü ve pH’sı: 4 ayrı tüpe az miktarda katı glisin, arjinin, glutamik asit ve fenilalanin alınır. Tüm tüplere eşit miktarda destile su ilave edilir ve karıştırılır. Amino asitlerin çözünürlükleri kaydedilir. Oluşan çözeltilerin pH’ları pH kâğıdı ile tayin edilir. Ksantoprotein Reaksiyonu: Fenil halkası içeren aromatik amino asitler derişik nitrat asidi ile muamele edildiklerinde sarı renkli nitro türevlerine dönüşürler. Nitrat asidinin cilde temas etmesiyle oluşan sararmanın sebebi budur. Şekil 3.5- Ksantoprotein reaksiyonu Biyokimya Laboratuvarı I – Güz 13 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Tirozin, triptofan, fenilalanin, histidin ve kazein’in sulu çözeltilerinden yaklaşık olarak az miktarda alınarak üzerine 5 damla derişik nitrat asidi konur. Reaksiyona zor giren fenilalanin tüpüne 5 damla daha nitrat asidi ve 5 damla derişik sülfat asidi eklenir. Tüpler su banyosunda ısıtılır ve renk değişimi kaydedilir. Daha sonra tüpler bir portüpe alınarak soğumaya bırakılır. Tüpler oda sıcaklığına geldiğinde %10 NaOH çözeltisi, ortam bazik oluncaya kadar eklenir. Renk değişimi kaydedilir. Millon Reaksiyonu: Millon Reaktifi: 15 g HgCl2, 100 mL %50 HNO3 içinde çözülerek hazırlanır. Fenol içeren bileşikler bu reaksiyonu verir. Tirozin amino asidi fenol grubu içeren tek amino asit olduğundan bu reaksiyon tirozine özgüdür. Önce tirozinin fenol grubu reaktif çözeltisindeki nitrik asit tarafından nitratlanır. Daha sonra nitratlanmış tirozin molekülü çözeltideki cıva (I) ve cıva (II) iyonları ile kırmızı renk verir. Ayrı tüplerdeki az miktarda tirozin ve kazeinin sulu çözeltilerine birkaç damla millon reaktifi eklenir ve tüpler kaynar su banyosunda ısıtılır. Renk oluşumu kaydedilir. Nitroprussiyat Reaksiyonu Sülfidril grupları içeren bileşikler ağır metaller ve sodyum nitroprussiyat ile koyu renkli kompleksler oluştururlar. Sistein serbest –SH grupları içerdiğinden bu reaksiyonu verir. Sistin serbest –SH grubu içermediğinden bu reaksiyonu vermez. Şekil 3.6- Sistin oluşumu Şekil 3.7- Sodyum nitroprussiyat 3 tüpe ayrı ayrı sistein, sistin ve kazein çözeltileri alınır ve üzerlerine az miktarda %10 NaOH ve aynı hacimde %2 sodyum nitroprussiyat çözeltisi eklenir. Renk değişimi kaydedilir. Kazein tüpüne bir miktar derişik HCl eklenir ve gözlemler kaydedilir. Biyokimya Laboratuvarı I – Güz 14 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Triptofan Reaksiyonu İki ayrı tüpteki az miktarda triptofan ve glisin çözeltileri üzerine eşit hacimde derişik asetik asit konulur. Bu karışımın üzerine damla damla, tabaka oluşturacak şekilde derişik sülfat asidi ilave edilir. Turuncu-mor halka oluşumu triptofan varlığını belirtir. Bu triptofana özgü bir denemedir. Aminoasitlerin verdikleri genel tanınma reaksiyonları: Reaksiyon Reaktif Amino asit Renk Ninhidrin Reaksiyonu Ninhidrin Serbest NH2 Grubu Mor Biüret Alkali CuSO4 Amid Bağları Mavi Lowry Reaksiyonu Fosfomolibdat Tirozin Mavi Millon Reaksiyonu HNO3, HNO2, HgNO3 Tirozin Kırmızı Ksantoprotein Kaynar HNO3 Triptofan, Tirozin, Fenilalanin Sarı Ehrlich Reaksiyonu Der. HCl içinde pdimetilamino benzaldehit Triptofan Mavi Sakaguchi Reaksiyonu α- Naftol, NaOCl veya NaOBr Arjinin Kırmızı Nitroprussiyat Reaksiyonu Sodyum nitroprussiyat, NaOH Sistein Kırmızı Sullivan reaksiyonu Sodyum-1,2-naftokinon-4sülfonat ve NaHSO4 Sistein Kırmızı Kurşun Sülfür Reaksiyonu NaOH, Seyreltik Kurşun asetat Sistein Siyah Hopkins-Cole Reaksiyonu Glioksilik asit, Sülfürik Asit Triptofan Mor Pauly Reaksiyonu Sülfanilik asit, HCl, Sodyum Histidin, Triptofan karbonat, Sodyum nitrit Biyokimya Laboratuvarı I – Güz Histidin: Sarı Triptofan: Mor 15 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı II- Proteinlerin Reaksiyonları Proteinler ile ilgili denemelerde yumurta albümin çözeltisi kullanılacaktır. Yumurta albümin çözeltisinin hazırlanması için bir yumurtanın akı, sarısından ayrılarak bir behere aktarılır. Hacminin altı katı kadar su ilave edilir ve çözeltinin köpürmemesine dikkat edilerek karıştırılır. Proteinlerin Denatürasyonu: Isının etkisi: Bir tüpe az miktarda yumurta albümin çözeltisi alınır ve bir süre sıcak su banyosunda tutulur. Gözlemler kaydedilir. Konsantre asitlerin etkisi: Bir tüpe az miktarda yumurta albümin çözeltisi alınır ve üzerine hacminin iki katı kadar derişik nitrik asit ilave ederek gözlemler kaydedilir. Ağır metal tuzlarının etkisi: 3 ayrı tüpe az miktarda yumurta albümin çözeltisi alınır ve üzerlerine az miktarda ayrı ayrı bakır(II)asetat, kadmiyumsülfat ve bizmut(II)nitrat ilave edilerek gözlemler kaydedilir. Biüret reaksiyonu: İki veya daha fazla peptid bağı ihtiva eden bileşikler alkali bakır sülfat ile menekşe veya mor renkli kompleksler oluştururlar. Rengin koyuluğu proteindeki peptid bağlarının sayısına bağlıdır. Bu test, peptid bağlarını belirlediğinden amino asitlerle reaksiyon vermez. Bu reaksiyon ayrıca azot veya karbon atomuna bağlı iki karbonil grubu ihtiva eden bileşiklerle de pozitif sonuç verir. Bu test proteinlerin kantitatif olarak tayini için de kullanılmaktadır ancak bu amaçla kullanılan biüret reaktifi sodyum potasyum tartarat, bakır sülfat ve potasyum iyodür içerir. Üç ayrı tüpe az miktarda glisin, yumurta albümin ve kazein çözeltileri alınır. Tüplere aynı hacimde %10 NaOH çözeltisi ve beşer damla %1 CuSO4 çözeltisi eklenir ve renk değişimi kaydedilir. Şekil 3.8- Biüret reaksiyonu sonucunda oluşan bakır-protein kompleksi Biyokimya Laboratuvarı I – Güz 16 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Biyokimya Laboratuvarı I – Güz 17 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı ÇALIŞMA SORULARI 1- Glu-His-Trp-Ser-Gly-Leu-Arg-Pro-Gly dizisine sahip peptidi çiziniz. Bu peptidin pH 3, 8 ve 11’deki net yükü nedir? (Bir grubun pKa değerinin altında ve üstünde net yük değişiminin nasıl olduğunu hatırlayın). Bu peptidin pI değeri ne olabilir? 2- Organizmada görev yapan önemli peptidlere birkaç örnek veriniz ve ne görev yaptıklarını belirtiniz. Şekil 3.9- Amino asitlerin amino ve karboksil gruplarının pKa değerleri Biyokimya Laboratuvarı I – Güz 18 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı DENEY IV TAMPON ÇÖZELTİLER Zayıf bir asidin kendisini ve anyonunu (konjuge bazını) veya zayıf bir bazın kendisini ve katyonunu (konjuge asidini) yan yana içeren çözeltilere tampon çözeltiler adı verilir. Tampon çözeltiler az miktarda asit veya baz ilavesiyle belirgin bir pH değişimi göstermezler. Bir çözeltinin tampon etkisini gösterebilmesi için ayrı ayrı hem H+ iyonu veren hem de H+ iyonu alan tanecikleri yeterli konsantrasyonda içermesi gereklidir. Tampon çözeltiler sabit pH aralıklarında çalışmak üzere hazırlanırlar. Henderson-Hasselbalch Denklemi (A-: Tuz / HA: Asit) Bu denklem bir çözeltinin teorik pH değerini hesaplamak için kullanılır. Denklemden de görülebileceği gibi tamponu oluşturan maddeler arasında oran değişiklikleri yapılarak pH’sı farklı tamponlar elde edilebilir. Tampon çözeltiyi oluşturan maddeler her oranda değil sadece belirli bir oranda en iyi tampon etkisini gösterirler. A-/HA oranı bire eşit olduğunda log1 = 0 olacağından pH değeri de pKa değerine eşit olur. Bu pH değerine tamponun optimum pH değeri denir. Bu pH değerinin dışındaki değerlerde tamponun etkisi zayıflar. Tamponlar optimum pH değerlerinin bir birim altı ve bir birim üstündeki pH aralıklarında en etkili olarak kullanılabilirler. Tamponlar biyolojik ortamların hazırlanmasında faydalanılan çözeltilerdir. Canlı organizmalarda pH değerleri son derece küçük bir aralıkta sabittir ve bu değerler sıkı bir şekilde kontrol altında tutulur. Çünkü pH’daki değişiklikler enzimler, hücre membranları ve nükleik asitler gibi birçok moleküler yapının yüklü bölgelerine etki eder ve fizyolojik aktivitelerini etkiler. pH değerlerindeki 0.5 birimlik bir değişim canlının yaşamını tehlikeye sokar. Organizmanın farklı bölgeleri farklı pH değerlerine sahiptir. (kan: 7.4, mide özsuyu 1.5, pankreas özsuyu 8.0, beyin omurilik sıvısı 7.4 gibi). Bu bölgelerdeki pH farklı tampon sistemlerince korunur. Bu sistemlere örnek olarak bikarbonat/karbonik asit (HCO3-/H2CO3), protein/proteinat, oksihemoglobin/protonlanmış oksihemoglobin (HbO2/HHbO2) ve fosfat (HPO4-/H2PO4-) tampon sistemleri verilebilir. Organizma sıvılarının asit baz dengesinin asit tarafına kaymasına asidoz, alkali tarafına kaymasına ise alkaloz denir. Asit metabolizma ürünleri artarsa, oluşan H+ iyonları HCO3/CO2 tarafından tutulur ve H2CO3 meydana gelir. Bunun dissosiasyonu ile oluşan H+ iyonları diğer tamponlarca tutulur. Bir kısmı da karbondioksit ve suya dönüşür. Karbondioksidin artması nedeniyle pH 7.4’ün altına düşer. HCO3- konsantrasyonunun azalması ile meydana gelen bu duruma metabolizma asidozu denir. Diyabette, açlıkta ve karbonhidratsız rejimlerde görülen asidozlar buna örnektir. HCO3- konsantrasyonunun artması ile metabolizma alkalozu meydana gelir. Aşırı sodyum bikarbonat alınması ve şiddetli kusma sonucu midede HCl kaybı ile oluşan alkalozlar buna örnektir. Biyokimya Laboratuvarı I – Güz 19 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı KİMYASALLAR Monopotasyum fosfat (KH2PO4), disodyum fosfat (Na2HPO4), NaOH, HCl. YÖNTEM Tampon çözelti hazırlama tablolarından yararlanarak 50 mL pH 7.4 Fosfat (Sørensen), 25 mL pH 6 sitrikasit/fosfat tamponlarını hazırlayınız. Hazırladığınız tamponun pH değerini ölçünüz. Eğer pH değerleri gerekenden farklı bir değere sahip ise 1N NaOH veya 1N HCl kullanarak pH’sını ayarlayınız. ÇALIŞMA SORULARI 1- Bir tampon litrede 0.01 mol laktik asit (pKa=3.86) ve 0.05 mol sodyum laktat içermektedir. a- Tamponun pH değerini hesaplayınız. b- 1 L tampona 5 mL 0.5 M HCl eklendiğinde pH değişimi ne olur? 2- Organizma sıvılarında pH düzenlemesinde en önemli görev üstlenen organlar nelerdir ve bunu hangi yollarla gerçekleştirirler. Biyokimya Laboratuvarı I – Güz 20 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Biyokimya Laboratuvarı I – Güz 21 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Biyokimya Laboratuvarı I – Güz 22 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı DENEY V KATEKOLÜN OKSİDASYONUNA OKSİDAZ ENZİMİNİN ETKİSİ POLİFENOL Enzimler canlı organizmalardaki reaksiyonları katalizlerler. Laboratuvar ortamında çok yüksek veya çok düşük basınç, pH ve sıcaklıkta oluşan kimyasal değişme ve reaksiyonlar, canlı hücrelerin bozulmadan kalabildikleri dar basınç, pH ve sıcaklık aralığında, ancak enzimler aracılığıyla gerçekleştirilebilirler. Küçük bir grup katalitik RNA moleküllerinin haricinde tüm enzimler protein yapısındadırlar. Katalitik aktiviteleri genellikle proteinin doğal yapısında olmasına bağlıdır. Eğer bir enzim denatüre olur veya alt ünitelerine ayrılırsa katalitik aktivitesi genellikle kaybolur. Bazı enzimler aktivite göstermek için bir veya daha fazla anorganik iyona veya kompleks organik veya metallorganik bileşiklere ihtiyaç gösterirler. Bu iyon ya da bileşiğe kofaktör adı verilir. Organik bileşik enzimin protein kısmı ile çok sıkı bir şekilde bağlanmış ise prostetik grup, çok sıkı bağlanmamış ve dissosiye olabiliyorsa koenzim adını alır. Katalitik olarak etki gösteren tam enzime holoenzim denir. Holoenzimin protein kısmına ise apoenzim adı verilir. Şekil 5.1- Enzim yapısı Enzimin etki ettiği bileşiğe substrat adı verilir. Enzimin katalizlediği reaksiyonu proteinin tamamı değil, sadece “aktif bölge” adı verilen belirli bir bölgesi etkiler. E=Enzim, S= Substrat, ES= Enzim-Substrat kompleksi ve P= Ürün olmak üzere enzim reaksiyonu şu şekilde özetlenebilir. Biyokimya Laboratuvarı I – Güz 23 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Böyle bir reaksiyon genel kimyasal reaksiyon mekaniğine ve kinetiğine uyar. Diğer katalizörlerde de olduğu gibi enzimler reaksiyonun yönünü değiştirmezler sadece reaksiyonun hızına etki ederler. Reaksiyona ilerleyebileceği daha düşük aktivasyon enerjili ara yollar sunarak reaksiyonu hızlandırırlar. Şekil 5.2- Enzimli reaksiyonun serbest enerji diyagramı Şekilde ΔGEnzimsiz enzimsiz reaksiyonun aktivasyon enerjisi, reaksiyonun aktivasyon enerjisidir. ΔH Reaksiyon entalpisidir. ΔGEnzimli ise enzimli Reaksiyon başında substrat konsantrasyonu yüksek, ürün konsantrasyonu ise ihmal edilecek kadar azdır. ES kompleksi büyük bir serbest enerji düşmesi ile ayrıldığından k4 ihmal edilebilir. Öyleyse ES oluşumunun net hızı, ES bozunmasının net hızına eşit olacaktır ki denklem 1’e göre bu eşitlik; olur. Reaksiyonun başında [P] ihmal edilebilir olduğundan, şeklinde yazılabilir. Burada Km, kontrollü şartlarda reaksiyonun maksimum hızının yarısına eşit hız veren substrat konsantrasyonudur ve Michaelis-Menten sabiti olarak adlandırılır. Biyokimya Laboratuvarı I – Güz 24 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı [E0], başlangıçtaki toplam enzim konsantrasyonu ve reaksiyonun herhangi bir anındaki enzim konsantrasyonu [E] ise, [E] = [E0] – [ES] olur. Denklem 3 aşağıdaki şekle dönüşür; Maksimum hız toplam enzim konsantrasyonu ile orantılı olduğu kadar, başlangıç hızıyla da orantılıdır. Böylece Vmaks = K3 [E0] olduğundan denklem 4’te yerine konulursa aşağıdaki denklem elde edilir. Denklem 5’te başlangıç hızı V0 yalnız bırakılacak olursa; eşitliği bulunur. Denklem 6’ya göre V0 ile [S] arasında çizilen grafik aşağıdaki gibi olur. Bu eğriye Michaelis-Menten eğrisi denir. Şekil 5.3- Michaelis-Menten eğrisi Biyokimya Laboratuvarı I – Güz 25 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Düşük substrat konsantrasyonlarında denklem 6’nın paydasında Km >> [S] olduğunda [S], Km yanında ihmal edilebilir ve = Vmaks [S] / Km olur. Yüksek substrat konsantrasyonlarında denklem 6’nın paydasında Km << [S] olacağından Km, [S] yanında ihmal edilebilir, V0= Vmaks olur ve denklem 6’daki eşitlikle bölünerek doğru denklemi verecek şekle dönüştürülebilir. Y eksenine 1/V0, X eksenine de 1/[S] değerleri yerleştirilerek çizilen grafikte elde edilen doğrunun eğimi Km/Vmaks’a ve Y eksenini kesen nokta 1/Vmaks’a eşit olur. Km değeri de grafikte gösterildiği şekilde bulunabilir. Bu eğriye Lineweaver-Burk eğrisi adı verilir. Eğer V0 değerine karşı V0/[S] grafiği çizilecek olursa bu eğriye Eadie-Hofstee eğrisi elde edilir. Km değerlerinden enzimlerin ayırt edilmesinde, ES komplekslerine ilişkin sabitlerin bulunmasında faydalanılır Km substrat konsantrasyonu birimi cinsindendir (mol/L veya mmol/L). Şekil 5.4- Lineweaver-Burk eğrisi Şekil 5.5- Eadie-Hofstee eğrisi Enzim aktivitesinin ölçülmesinde çeşitli birimler kullanılır. En çok kullanılan aktivite birimi enzim ünitesidir (aktivite). Enzim ünitesi (U): 25°C’de 1 dakikada optimum şartlarda 1µmol substratı ürüne çeviren enzim miktarıdır. Spesifik aktivite (U/mg protein): 1 mg protein başına enzim ünitesidir. Enzimin saflık derecesinin bir göstergesidir. Molar Aktivite: Bir tek enzim molekülü tarafından birim zamanda ürüne çevrilen substrat molekülü sayısıdır. Dönüşüm sayısı olarak da adlandırılır. Katal: 1 saniyede 1 mol substratı reaksiyona sokan enzim miktarıdır. Biyokimya Laboratuvarı I – Güz 26 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Enzim miktarı çok küçük olduğundan direkt olarak ölçmek zordur. Optimum şartlarda katalizledikleri reaksiyon hızları diğer şartlar sabit kalmak üzere, enzim konsantrasyonu ile orantılıdır. Böylece enzim konsantrasyonu hız ölçülmesi ile tayin edilebilir. Enzimle katalizlenmiş reaksiyonların hızı inhibitör adı verilen bazı maddeler tarafından azaltılır veya tamamen durdurulur. Buna enzim inhibisyonu denir. Enzim inhibisyonu geri dönüşümlü veya dönüşümsüz olabilir. Polifenol oksidaz enzimi doğada yaygın olarak bulunan, bakır içeren bir enzimdir. Meyve ve sebzelerde hasar görmüş bölgelerin hava ile teması sonucu kararması ve cildin esmerleşmesi (melanin sentezi) gibi reaksiyonlardan sorumludur. Enzimin aktivitesi, fenollerin katekollere orto-hidroksilasyonu ve katekollerin orto-kinonlara oksidasyonu olacak şekilde ikiye ayrılabilir. Aktif merkezde substratın bağlanabileceği bir boşluk vardır ve bu merkezdeki histidin kalıntıları bakır bağlamada görev yaparlar. Şekil 5.6- Polifenol oksidaz enziminin 3 boyutlu yapısı ve aktif merkezi Bu denemede katekolün benzokinona enzimatik dönüşüm reaksiyonunun kinetikleri incelenecektir. Biyokimya Laboratuvarı I – Güz 27 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Şekil 5.7- Polifenol oksidaz enziminin katalizlediği oksidasyon reaksiyonunun mekanizması Bu reaksiyonda kullanılan katekol çözeltisi renksizdir, oluşan 1,2-benzokinon ise kahverengidir. Böylece oluşan ürünün miktarı kolorimetrik olarak izlenebilir. 1,2benzokinon 480 nm dalga boyunda maksimum absorbans verdiğinden bu dalga boyunda yapılan spektrofotometrik ölçüm yardımı ile belli bir zamanda çözeltide bulunan ürün miktarı hesaplanabilir. Şekil 5.8- Spektrofotometrenin çalışma prensibi Spektrofotometrik ölçümde bir ışık kaynağı geniş bir spektrumda ışık yayar, monokromatör belirli bir dalga boyundaki ışığı seçer ve örnek küvetine gönderir. Işık küvetten geçerken absorblayıcı moleküllerin konsantrasyonuna bağlı olarak bir kısmı absorblanır ve çözeltiden geçen ışık bir dedektör tarafından ölçülür. Biyokimya Laboratuvarı I – Güz 28 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Bu denemede amaç iki anahtar parametrenin bulunmasıdır. Bunlar maksimum hız (Vmaks) ve Michaelis-Menten sabitidir (Km). KİMYASALLAR Sitrik asit-fosfat tamponu pH 6, katekol, benzokinon. YÖNTEM Ham enzimin hazırlanması: Patatesler soyulur ve bıçakla küçük parçalara ayrılır. Daha sonra blender cihazı yardımıyla ve 200 mL pH 6 sitrik asit - fosfat tamponu varlığında homojenize edilir. Enzimlerin aktivitesi sıcaklıktan etkilendiği için bu aşamadan sonraki tüm işlemler hızlı bir şekilde ve buz üzerinde gerçekleştirilir. Elde edilen homojenizat, bir buz banyosuna önceden yerleştirilerek soğutulmuş erlen ve huni yardımıyla cam pamuğundan süzülür ve süzüntü deney süresince buz banyosunda tutulur. Substrat konsantrasyonunun reaksiyon hızına etkisi: 6 adet deney tüpü aşağıdaki tabloda gösterildiği şekilde (enzim konulmadan) hazırlanır. Enzim çözeltisi spektrofotometrik ölçümden hemen önce konulacaktır. Tüp No Substrat Katekol 0.01 M (mL) Su (mL) Enzim (µL) 1 2 3 4 5 6 7 0 1 2 3.5 5 7 9 10 9 8 6.5 5 3 1 500 500 500 500 500 500 Absorbans 1. dk. 2. dk 3. dk 4. dk 5.dk 6.dk Grafikten Hesaplanan Hız Sıfırlama yapılır 2-7 numaralı tüplerin dakika başına verdikleri absorbans değeri ölçülecektir. Bu işlem şöyle yapılır; 1 numaralı tüpe 500µL enzim konulur ve tüp iyice karıştırılarak içeriği iki spektrofotometre küvetine aktarılır. Bu çözeltiler bizim şahit çözeltilerimiz olacaktır. İki şahit küveti kullanılarak spektrofotometre 480 nm dalga boyunda sıfırlanır. Daha sonra 2 numaralı tüpe enzim konulur ve enzim konulduğu anda kronometre çalıştırılır. İçinde enzim bulunan 2 numaralı tüp iyice karıştırılır, içeriği bir spektrofotometre küvetine aktarılır ve spektrofotometreye yerleştirilir. Biyokimya Laboratuvarı I – Güz 29 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Bu sırada kronometre takip edilerek ilk enzimin konulmasından tam 30 saniye sonra 3 numaralı tüpe 500 µL enzim konulur ve iyice karıştırılarak içeriği bir spektrofotometre küvetine aktarılır ancak spektrofotometreye yerleştirilmez. Kronometre 01:00 değerini gösterdiğinde spektrofotometrenin gösterdiği absorbans değeri kaydedilir. Spektrofotometrenin içindeki 2 numaralı çözeltiyi içeren küvet çıkarılır ve 3 numaralı çözeltiyi içeren küvet yerleştirilir. Kronometredeki değer 01:30 değerini gösterdiğinde spektrofotometrenin gösterdiği absorbans değeri kaydedilir. Küvetler değiştirilerek her bir küvet için dakikada bir absorbans değeri ölçülür. Her bir küvet için 6 değer alınıncaya kadar bu işlem devam eder. Daha sonra aynı işlemler 4-5 ve 6-7 numaralı tüpler için de tekrarlanır. Her işlemin başında spektrofotometre şahit çözeltiler kullanılarak sıfırlanır. Ekstinksiyon sabitinin bulunması: 100 mL 0.01 M benzokinon çözeltisi hazırlanarak 480 nm dalga boyundaki absorbansı ölçülür. Benzokinon zor çözündüğünden bu çözelti deney başladığında hazırlanır ve ölçümü deneyin sonunda yapılır. VERİLERİN KULLANIMI 2-7 numaralı tüpler için 480 nm’de elde edilen absorbans değerleri ayrı ayrı, zamana karşı grafiğe çizilir. Şekil 5.9- Absorbans- zaman grafiği Her grafikte, hiperbolik eğrilere teğet doğrular çizilir ve bu doğruların eğimleri hesaplanır. Eğim = ΔA/Δt, A=ε.c.l olduğundan her bir küvet için başlangıç hızı V = m / ε . l denkleminden hesaplanır. 2-7 numaralı tüplerin her biri için katekol konsantrasyonları hesaplanır. Bulunan başlangıç hızları ile substrat konsantrasyonları arasında Michaelis-Menten eğrisi çizilir. Bu hız ve substrat konsantrasyonları için Lineweaver-Burk ve Eadie-Hofstee grafikleri çizilerek Vmaks ve Km değerleri hesaplanır. Biyokimya Laboratuvarı I – Güz 30 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı ÇALIŞMA SORULARI 1- Substrat ile doygun olduğu zaman 10-6 M konsantrasyonundaki karbonik anhidraz enzimi saniyede 0.6 mol/L karbonik asit oluşumunu katalizler. Buna göre dönüşüm sayısı nedir. 2- Geri dönüşümlü enzim inhibisyonu, inhibitörün enzime bağlanmasına göre yarışmalı, yarışmasız ve yarı-yarışmalı olmak üzere üçe ayrılabilir. Aşağıda verilen şekilleri ve grafikleri inceleyerek her bir durum için inhibitör konsantrasyonu değişimi ile V maks ve Km değerlerinin nasıl değiştiklerini yorumlayınız. Şekil 5.10- Enzim inhibisyon mekanizmaları Biyokimya Laboratuvarı I – Güz 31 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı DENEY VI PROTEİNLERİN SAFLAŞTIRILMASI VE KARAKTERİZASYONU I- Proteinlerin Ekstraksiyonu ve Diyaliz Bir proteinin yapısının ve özelliklerinin araştırılabilmesi için, o proteinin saf bir şekilde elde edilmesi gerekir. Proteinler kolaylıkla denatüre olabildiklerinden ve biyolojik materyallerde (örneğin vücut sıvılarında ve doku ekstraktlarında) kompleks bir karışım halinde bulunduklarından, saflaştırılmaları oldukça zordur. Proteinlerin elde edilebildiği kaynaklar genellikle dokular ve hücrelerdir. Bir proteinin saflaştırılmasında yapılacak ilk işlem hücrelerin parçalanarak içerdikleri proteini bir çözeltiye almaktır. Bu çözeltiye ham ekstrakt denir. Bu ham ekstrakt istenen proteinin yanı sıra pek çok başka protein ve molekül de içermektedir. Daha sonra proteinlerin çözünürlük farkları, büyüklükleri, elektriksel yükleri ve polariteleri gibi çeşitli özelliklerinden yararlanılarak protein ekstraktı fraksiyonlara ayrılır. Bu özelliklere dayanarak proteinlerin saflaştırılması ile ilgili pek çok yöntemler kullanılmaktadır. Bunlara örnek olarak kademeli santrifüj, tuzla çöktürme, aseton ve alkolde soğukta çöktürme, ultrafiltrasyon ve çeşitli kromatografik yöntemler verilebilir. Aşağıda ham ekstrakttan bir enzimin kromatografik yöntemler kullanılarak saflaştırılması için örnek bir yöntem verilmiştir. abcde- Ham ekstraktın elde edilmesi Tuzla (amonyum sülfat) çöktürülmesi İyon değişim kromatografisi Jel geçirgenlik (moleküler elek) kromatografisi Afinite (ilgi) kromatografisi. Proteinler saflaştırma işlemi sırasında her bir basamakta çeşitli kayıplara uğrarlar ve aktiviteleri azalır. Ancak istenilen enzim her bir basamakta daha saf hale gelir, bu nedenle daha derişik hale gelir ve spesifik aktivitesi artar. Enzimlerle çalışıldığında ortamın pH’sı ve sıcaklığının çok iyi bir şekilde kontrol edilmesi gerekir. İşlem Basamağı Fraksiyon Hacmi (mL) Total Protein (mg) Aktivite (Ünite) Spesifik Aktivite (Ünite/mg) Ham Ekstrakt 1400 10000 100000 10 Tuzla Çöktürme 280 3000 96000 32 İyon Değişim 90 400 80000 200 Jel Geçirgenlik 80 100 60000 600 Afinite 6 3 45000 15000 Biyokimya Laboratuvarı I – Güz 32 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı İyon Değişim Kromatografisi Şekil 6.1- İyon değişim kromatografisi Biyokimya Laboratuvarı I – Güz 33 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Jel Geçirgenlik (moleküler Elek) Kromatografisi Şekil 6.2- Jel geçirgenlik (moleküler elek) kromatografisi Biyokimya Laboratuvarı I – Güz 34 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Afinite (İlgi) Kromatografisi Şekil 6.3- Afinite (ilgi) kromatografisi Biyokimya Laboratuvarı I – Güz 35 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Tuzla çöktürme işlemi sonunda ortamda bulunan tuzlar saflaştırma işleminin ileri safhalarında ve protein karakterizasyonu işlemleri sırasında deneyleri bozarlar. Bu nedenle tuzların ortamdan uzaklaştırılması gerekir. Bu amaçla jel filtrasyon, ultra santrifüj ve diyaliz yöntemleri kullanılabilir. Büyüklük farkına dayanan bir ayırma yöntemi olan diyaliz basit ve pahalı olmayan bir işlemdir. Şekil 6.4- Diyaliz Diyaliz işleminde yarı geçirgen selüloz membranlar kullanılır. Bu membranların gözenek büyüklükleri bellidir ve sadece belli bir boyuttaki moleküllerin geçmesine izin verirler. Diyaliz tamponu olarak tuz konsantrasyonu düşük olan çözeltiler kullanılır. Membranın içindeki tuz konsantrasyonu, membranın dışındaki diyaliz tamponunun tuz konsantrasyonundan daha fazla olduğu için membran içindeki tuzlar membran dışına doğru hareket ederler. Proteinlerin molekül ağırlıkları tuzlar ile kıyaslandığında çok daha büyük olduğundan membranın gözeneklerinden geçemezler ve membran içinde kalırlar. Bu işlem diyaliz tamponu ve membran içindeki çözelti arasında bir tuz konsantrasyonu dengesi oluşuncaya kadar devam eder. Bu dengenin oluşması yaklaşık 4–6 saat kadar sürer. Dengeye ulaşıldığında diyaliz tamponu tazelenir, böylece denge bozulur ve tuzlar membran dışına çıkmaya devam eder. Bu şekilde protein molekülleri tuzdan kurtarılmış olur. Biyokimya Laboratuvarı I – Güz 36 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı KİMYASALLAR Potasyumdihidrojen fosfat, disodyumhidrojen fosfat, amonyum sülfat, üre, tiyoüre, trishidroksimetil aminometan, diyaliz membranı. YÖNTEM Bu deneyde 3 farklı dokudan protein ekstraksiyonu yapılacaktır. Bu amaçla dana karaciğeri, yumurta akı ve yumurta sarısı protein kaynakları olarak kullanılacaktır. Liziz tamponu: 9 M üre, 0.04 M Tris ve %0.1 SDS çözeltisinden oluşur. 0.484 g Tris ve 54.63 g üre 100 mL’lik bir balonjojeye alınır ve pH 7.4 Sørensen tamponu ile hacim tamamlanır. Daha sonra homojenizata 1 mL %10 SDS çözeltisi ilave edilir. Homojenizasyon Karaciğer yıkanır, parçalara ayrılır ve liziz tamponu varlığında blender cihazı kullanılarak daha küçük parçalar haline getirilir. Daha sonra homojenizatör yardımı ile homojenize edilir. Homojenizata 1 mL %10 SDS çözeltisi ilave edilerek karıştırılır. ve santrifüj tüplerine alınarak santrifüj edilir. Süpernatant (tüpün üst kısmındaki sulu çözelti) dekante edilerek bir behere alınır. Yumurta akı ve sarısı sıvı oldukları için bu homojenizasyon basamağına gerek duymazlar. Behere alınan yumurta akı ve sarısı üzerine liziz tamponu ve az miktarda %10 SDS ilave edilir. Köpürmemesine dikkat edilerek karıştırılır ve santrifüj edilerek süpernatantlar ayrı ayrı bir behere toplanır. Çöktürme Tuzla çöktürme: Homojenize edilmiş olan çözeltilerden 10 mL alınır ve aşağıda verilmiş olan doygunluk hesabı tablosundan yararlanılarak istenen amonyum sülfat doygunluğunda çöktürme yapmak için gerekli olan amonyum sülfat miktarları hesaplanır. Biyokimya Laboratuvarı I – Güz 37 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Gerekli miktar tartıldıktan sonra, katı amonyum sülfat protein örneklerini içeren tüplere eklenir, dikkatle karıştırılır ve santrifüjlenir. Santrifüj sonunda süpernatant dekante edilerek atılır ve presipitat (çökmüş olan katı kısım) üzerinden deneye devam edilir. Asetonla çöktürme: Homojenize edilmiş olan çözeltilerden 4 mL alınır ve üzerine 8 mL soğuk aseton ilave edilir. Dikkatle karıştırılır ve santrifüj edilir. Santrifüj sonunda süpernatant dekante edilerek atılır ve presipitat üzerinden deneye devam edilir. Çözünürleştirme Çöktürülmüş olan proteinlere az miktarda pH 7.4 Sørensen fosfat tamponu ilave edilir. Dikkatle karıştırılarak proteinlerin mümkün olduğunca çok çözünmesi sağlanır. Daha sonra tüpler santrifüj edilerek süpernatantlar alınır ve presipitatlar atılır. Diyaliz Tuzla çöktürülmüş olan proteinler daha önceden hazırlanmış olan diyaliz torbalarına, torbanın en fazla 3/4’ü dolacak şekilde yerleştirilir ve diyaliz tamponu olarak destile su kullanılarak diyaliz edilirler. 4 saate bir diyaliz tamponu değiştirilerek soğukta 2 gün boyunca diyaliz edilirler. Diyaliz sona erdikten sonra diyaliz torbaları açılır ve diyalizatlar temiz bir tüpe alınır. Bu işlemler sonrasında elde edilen çözeltiler protein örnekleridir, proteinlerin konsantrasyon tayini ve elektroforez denemelerinde bu çözeltiler kullanılacaktır. Bu amaçla elde edilen protein çözeltileri hacimlere ayrılır ve -20°C soğutucuda saklanırlar. ÇALIŞMA SORULARI 1- Günlük hayatta saflaştırılmış proteinler nerelerde kullanılmaktadır? Araştırınız. Biyokimya Laboratuvarı I – Güz 38 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı DENEY VII PROTEİNLERİN KANTİTATİF TAYİNİ Protein saflaştırılması işleminde her basamakta elimizde bulunan protein konsantrasyonunun bilinmesi çok önemlidir. Sonraki basamaklarda hangi yöntemlerin kullanılacağı protein konsantrasyonuna bağlı olarak belirlenir. Çözünür proteinlerin çözelti içindeki konsantrasyonlarının ölçümü için birçok farklı yöntem geliştirilmiştir. Her yöntemin bazı avantaj ve dezavantajları vardır. En yaygın kullanılan 3 yöntem; basit absorbans yöntemi, Lowry yöntemi ve Bradford yöntemidir. Bu yöntemlerde bilinen konsantrasyonlardaki protein çözeltileri ile hazırlanan standart kalibrasyon grafikleri kullanılarak bilinmeyen örneğin konsantrasyonu bulunur. Her üç yöntem de proteinlerin analizi için spektrofotometrik ölçümleri kullanır. Basit Absorbans Yöntemi Bu yöntem proteinlerdeki tirozin ve triptofan amino asitlerinin 280 nm’de maksimum absorbans vermesine dayanır. Bu absorbsiyona fenilalanin amino asidi ve disülfit bağları da az miktarda olmakla birlikte katkıda bulunur. Çok hızlı ve ucuz bir yöntemdir, az miktarda materyale ihtiyaç gösterir ayrıca protein örneği üzerinde herhangi bir kimyasal modifikasyon yapılmadığından örnek geri kazanılabilir. Ancak hassasiyeti düşüktür (0.05–2 mg protein/mL). Ayrıca farklı miktarlarda tirozin ve triptofan içeriğine sahip proteinler aynı konsantrasyonda olsalar bile farklı absorbans verirler. Yakın bir dalga boyunda maksimum absorbans verdiklerinden nükleik asitler ve başka kromofor gruplarda etkileşim yapabilir. Ayrıca uzak UV alanda da (190 nm) bu yöntem uygulanabilir. Peptid bağlarına bağlı olarak absorbans verildiğinden amino asit kompozisyonunun değişiminden bağımsızdır ve hassasiyeti yüksektir (0.01–0.05 mg). Ancak pek çok çözelti ve tampon bu bölgede absorbans verdiğinden girişimler de artar. Ayrıca oksijen absorbsiyonundan ötürü özelleşmiş cihazlara ihtiyaç duyar. Sığır serum albümin (BSA) çözeltisi bu denemede sıklıkla standart olarak kullanılır. Lowry (Folin-Ciocalteau) Yöntemi Bu yöntem hem biüret hem de folin reaksiyonuna dayanır. Biüret reaksiyonunda alkali şartlarda bakır, proteinlerin peptid bağları ile reaksiyona girerek Cu+ oluşturur. FolinCiocalteau reaksiyonunda ise fosfomolibdotungstat, aromatik amino asitlerin Cu katalizli oksidasyonu ile heteropolimolibden mavisine indirgenir. Sonuçta kısmen tirozin ve triptofan bileşimine bağlı olan, şiddetli koyu bir mavi renk elde edilir. Biyokimya Laboratuvarı I – Güz 39 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Lowry yöntemi de tirozin ve triptofan içeriğine bağlıdır ancak proteinden proteine olan farklılıklar orta seviyededir. 0.01 mg/mL hassasiyete sahiptir ve 0.01–1 mg/mL protein içeren çözeltiler için kullanımı uygundur. Bu yöntemin bir dezavantajı girişimlerin fazla oluşudur. Çeşitli tamponlar, ilaç aktif maddeler, deterjanlar, EDTA, amonyum sülfat, Glisin, merkaptoetanol, nükleik asitler ve şekerler gibi bir grup madde deneme ile girişim gösterir. Hücre ekstraktları ve kompleks örnekler, örneğin perkloroasetik asit/ etanol çöktürmesi gibi bir temizleme basamağına ihtiyaç gösterebilir. Günümüzde denemenin ihtiyaçlarına göre modifiye Lowry yöntemleri kullanılmaktadır. Reaksiyon pH bağımlıdır, pH’nın 10–10.5 arasında olması önemlidir. İnkübasyon basamağındaki süre kritik değildir 10 dakika ile birkaç saat arasında değişebilir. Tüplerin iyi karıştırılması çok önemlidir, çünkü folin reaktifi alkali ortamda kararsız olduğu için kısa bir süre aktivite gösterir. Deneme yüksek konsantrasyonlarda lineer değildir, kalibrasyon eğrisinin buna göre hazırlanması gerekir. Bradford Yöntemi Bradford yöntemi Coomassie Brilliant Blue G250 (CBB) boyar maddesinin proteinlere kovalent olmayan bağlanmasına dayanır. CBB’nin asidik çözeltideki proteine bağlanması boyanın 465 nm’deki maksimum absorbsiyonunu 595 nm’ye kaydırır. 595 nm’deki absorbsiyon doğrudan protein konsantrasyonlarına aittir. Bu yöntem Lowry yöntemine göre daha hızlı, daha ucuz, daha kolay ve daha hassastır. CBB’nin protein örneğine katılması ile 2 dakika gibi kısa bir zamanda renk oluşu ve bu renk 1 saat sabit olarak kalır. 0.001 mg/mL protein ölçülebilir. Lowry ile karşılaştırıldığında, yaygın kimyasal bileşikler ve biyolojik örneklerdeki protein olmayan moleküllerden daha az etkilenir. Amfolitler, deterjanlar bu yöntemde girişim yaparlar. CBB arjinin ve lizin amino asitlerine daha kolay bağlanır bu sebeple farklı proteinler farklı renk yoğunluğu verebilirler. Bu yöntemin dezavantajlarından biridir. CBB serbest arjinin ve lizine, 3000 kDa’dan daha küçük peptid moleküllerine bağlanmaz. Biyokimya Laboratuvarı I – Güz 40 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Yukarıdaki tablodan da görüldüğü gibi her kantitatif protein tayin yönteminin kendine özgü avantajları ve dezavantajları bulunmaktadır. Bu sebeple bir protein tayini yöntemi seçilirken yapılan çalışmanın özellikleri göz önünde bulundurulmalı ve çalışma ortamındaki moleküllerle girişim yapmayacak, yeterli hassasiyette, ucuz ve uygulanabilir bir yöntem seçilmelidir. KİMYASALLAR NaCl, Sığır Serum Albümin (BSA), Na2CO3, CuSO4·5H2O, KNaC4H4O6·4H2O, Folin Reaktifi, Bradford Reaktifi, NaOH, Ovalbümin. Biyokimya Laboratuvarı I – Güz 41 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı YÖNTEM Basit absorbans Serum Fizyolojik: %0.0897’lik NaCl çözeltisi hazırlanır. BSA Stok Çözeltisi: Serum fizyolojik içinde %0.2’lik 100 ml BSA çözeltisi hazırlanır. Aşağıdaki tabloya göre tüpler hazırlanır. Deneydeki hata oranını azaltmak ve tekrarlanabilirliği arttırmak için tüpler çift çalışılmalıdır. Serum fizyolojik çözeltisi şahit olarak kullanılarak her bir tüpün 280 nm’deki absorbansı ölçülür, kaydedilir ve protein konsantrasyonları 2–5 numaralı tüpler için hesaplanır. Bu konsantrasyon verileri kullanılarak kalibrasyon grafiği çizilir. Bilinmeyen örneğin absorbansı grafik üzerine yerleştirilerek konsantrasyonu bulunur. Tüp no BSA Stok (mL) Serum Fizyolojik (mL) 1 0 3.0 2 0.5 2.5 3 1.0 2.0 4 1.5 1.5 5 2.0 1.0 6 Absorbans (280 nm) Protein Konsantrasyonu (µg/mL) Bilinmeyen örnek (3.0) Biyokimya Laboratuvarı I – Güz 42 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Lowry Kompleks oluşturucu reaktif: Stok çözeltilerden taze olarak hazırlanmalıdır. 50 mL %2’lik Na2CO3 (Çözelti A), 10 mL %1’lik CuSO4·5H2O (Çözelti B) ve 10 mL %2’lik KNaC4H4O6·4H2O (Çözelti C) stok çözeltileri hazırlanır. Bu çözeltiler A:B:C 100:1:1 oranında karıştırılarak hazırlanır. Protein stok çözeltisi: Serum fizyolojik içerisinde 2 mg/mL BSA çözeltisi hazırlanır. Bu çözelti protein stok çözeltisi olarak kullanılacaktır. Folin reaktifi: 1N Fosfomolibdat ve fosfotungstik asit çözeltisi (Bu çözelti hazır halde verilecektir.) Serum Fizyolojik (µL) %8’lik NaOH Çöz.(µL) 1 0 500 500 2 25 475 500 3 50 450 500 4 75 425 500 5 100 400 500 6 Bilinmeyen Örnek (500) 500 Komp. Oluş. Reakt. (µL) 1000 1000 1000 1000 1000 1000 Biyokimya Laboratuvarı I – Güz Folin reaktifi 100 100 100 100 100 100 İyice karıştırılır ve 30 dk. İnkübe edilir Protein Stok Çöz. (µL) Karıştırılır ve 10 dk. inkübe edilir Tüp No 100°C’de 10 dk. inkübe edilir ve oda sıcaklığına soğutulur Aşağıdaki tabloya göre tüpler hazırlanır. Deneydeki hata oranını azaltmak ve tekrarlanabilirliği arttırmak için tüpler çift çalışılmalıdır. 1 numaralı tüp şahit olarak kullanılarak her bir tüpün 550 nm’deki absorbansı ölçülür, kaydedilir ve protein konsantrasyonları 2-5 numaralı tüpler için hesaplanır. Bu konsantrasyon verileri kullanılarak kalibrasyon grafiği çizilir. Bilinmeyen örneğin absorbansı grafik üzerine yerleştirilerek konsantrasyonu bulunur. Absorb. (550 nm) Protein Kons. (µg/mL) 43 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Bradford Bradford reaktifi: Coomassie Brilliant Blue G-250 etanol içinde çözünerek hazırlanır. (Bu çözelti hazır halde verilecektir.) Tüp No Protein Stok Çöz. (µL) Destile su (µL) Bradford Reaktifi (µL) 1 0 800 200 2 3 4 5 6 20 40 60 80 Örnek (2) 780 760 740 720 798 200 200 200 200 200 Karıştırılır ve 10 dk. inkübe edilir Protein stok çözeltisi: 2 mg/mL ovalbümin stok çözeltisi 0.1mg/mL olacak şekilde seyreltilerek hazırlanır. Absorb. (595 nm) Protein Kons. (µg/mL) VERİLERİN KULLANIMI Bradford yöntemi kullanılarak, bir önceki denemede elde edilen tüm ekstraktların protein konsantrasyonları tayin edilir ve µg/mL cinsinden aşağıdaki tabloya kaydedilir. Karaciğer %20 Tuz Karaciğer %80 Tuz Yumurta Sarısı %50 Tuz Yumurta Akı Aseton Yumurta Sarısı Aseton Karaciğer Aseton Yumurta Akı %50 Tuz 1. Grup 2. Grup 3. Grup 1. Grup 2. Grup 3. Grup ÇALIŞMA SORULARI 1- Protein kimyasında Coomassie boyalarının kullanım alanları nelerdir? Biyokimya Laboratuvarı I – Güz 44 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı DENEY VIII PROTEİNLERİN ELEKTROFOREZ İLE AYRILMASI VE MOLEKÜL AĞIRLIKLARININ TAYİNİ Elektroforez, bir elektrik alan altındaki moleküllerin, bu alanda farklı hareket etmeleri esasına dayanılarak yapılan bir ayırma yöntemidir. Bu elektrik alan altında pozitif yük taşıyan proteinler katoda, negatif yük taşıyan proteinler anoda doğru göç ederler. Bu göçün hızı çeşitli faktörlerden etkilenir; a- Yükün büyüklüğü: Net yük arttıkça proteinlerin göç hızları da artar. b- Molekül büyüklüğü: Proteinin büyüklüğü arttıkça göç hızı azalır. Burada proteinin molekül ağırlığı olduğu kadar molekülün şekli de önemlidir. c- Destek ortamının özelliği: Destek ortamındaki gözeneklerin boyutu küçüldükçe, proteinin göç hızı azalır. d- Elektrik alanın büyüklüğü: Voltaj arttıkça göç hızı da artar. e- Tamponun iyonik gücü: Tamponun iyonik gücü azaldıkça göç hızı artar. f- Sıcaklık: Sıcaklık arttıkça göç hızı artar. Elektroforez günümüzde saflaştırılmış bir protein örneğinin saflığının kontrolünde, küçük miktarlarda proteinin elde edilmesinde, bir örnekteki proteinlerin kalitatif ve kantitatif analizlerinde kullanılmaktadır. Kâğıt elektroforezi, bölge elektroforezi, SDSPoliakrilamid jel elektroforezi (SDS-PAGE), immüno elektroforez, DNA elektroforezi gibi çok çeşitli elektroforez yöntemleri mevcuttur. Günümüzde proteinlerin analitik tayinleri için en çok kullanılan yöntem poliakrilamid jel elektroforezidir. Bu yöntemde destek maddesi olarak poliakrilamid polimerinden yararlanılır. Poliakrilamid jel uzun polimer zincirleri oluşturan, aktive edilmiş akrilamid moleküllerinin reaksiyonu ile oluşur. Çözeltide bu zincirler tek başlarına birleşemezler. Jelin oluşumunda zincirlerin çapraz bağlanması için N,N′-metilenbisakrilamid kullanılır. Şekil 8.1- Poliakrilamid polimeri Biyokimya Laboratuvarı I – Güz 45 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Bu elektroforez yöntemi de çeşitli alt gruplara ayrılır. PAGE’de yatay, dikey kasetler ve dikey diskler kullanılabilir. Kasetler farklı boyutlarda olabilir. Kaset boyutu büyüdüğünde yapılan ayırmanın çözünürlüğü ve gücü artar ancak işlem süresi uzar ve jelin çalışılması zorlaşır. a- Doğal şartlarda PAGE: Ayırma analizlenen proteinin yük ve boyutuna göre yapılır. Genellikle alkali (pH 8–9) tampon sistemleri kullanılır. Proteinler denatüre olmadan yürütüldükleri için elektroforez sonunda proteinler aktivitelerini kaybetmezler ve geri kazanılabilirler. Ancak bu sistem sadece çözünür proteinler ve elektroforez sırasında agregat oluşturmayan proteinler için kullanılabilir. b- Denatüre edici şartlar altında SDS-PAGE: SDS anyonik bir deterjandır. Negatif yüklü SDS molekülleri protein molekülünü kaplar ve proteinlerin net yükünü maskeler. Tüm proteinler negatif yükle kaplanmış olduklarından ayırma yüke göre değil sadece molekül boyutuna bağlıdır. Şekil 8.2- SDS ile proteinlerin negatif yüklenmesi SDS-PAGE’e uygulanacak olan örnekler, merkaptoetanol, SDS, bromfenol mavisi ve gliserol içeren tamponla muamele edilirler. Merkaptoetanol proteinin tersiyer yapısını bir arada tutan disülfit bağlarını indirger. SDS proteini denatüre ederek doğal yapısını bozar ve molekülü eksi yüklü bir kılıfla kaplar. Farklı konsantrasyonlarda (%7.5, %10, %12.5 akrilamid/bisakrilamid konsantrasyonu içeren) jeller kullanılarak elektroforez gerçekleştirilebilir. Düşük konsantrasyonlu jeller büyük molekül ağırlıklı proteinlerin, yüksek konsantrasyonlu jeller ise küçük molekül ağırlıklı proteinleri ayırmak için kullanılır. c- İki boyutlu PAGE: İki boyutlu poliakrilamid jel elektroforezinde proteinler izoelektrik odaklama (IEF) ve SDS-PAGE yöntemleri kullanılarak ayrılırlar. Bu yöntemlerin her biri jel başına 100 bileşeni ayırma gücüne sahipken, birleştiklerinde yaklaşık 10000 bileşenin ayrılmasını sağlarlar. IEF yönteminde pH gradyanı oluşturan çeşitli amfolitler kullanılarak proteinler önce izoelektrik noktalarına göre ayrılır. Daha sonra aynı proteinler SDS-PAGE yöntemi kullanılarak molekül büyüklüklerine göre ayrılırlar. Biyokimya Laboratuvarı I – Güz Şekil 8.3- İki boyutlu jel elektroforezi 46 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Şekil 8.4- İki boyutlu elektroforez ile elde edilmiş jel görüntüsü Şekilde iki boyutlu poliakrilamid jel elektroforezi sonucunda elde edilen bir jel gösterilmektedir. Buradaki her bir nokta bir protein veya polipeptide karşılık gelir. KİMYASALLAR Amonyumperoksodisülfat, akrilamid, bisakrilamid, tris, TEMED, SDS, glisin, HCl, βmerkaptoetanol, bromfenol mavisi, metanol, asetik asit, Coomassie G250, fosforik asit, amonyum sülfat. YÖNTEM Çözeltilerin hazırlanması: Amonyumperoksodisülfat (APS): %10 (w/v) oranında taze olarak hazırlanır. Akrilamid/Bisakrilamid çözeltisi: 29.2 g akrilamid ve 0.9 g bisakrilamid destile su içinde çözülerek hacmi 100 mL’ye tamamlanır ve +4oC’de saklanır. 1.5 M Tris-HCl çözeltisi (pH 8.8): 18.15 g tris baz tartılır ve bir miktar destile suda çözüldükten sonra pH’sı 6 N HCl ile 8.8’e ayarlanır ve son hacmi 100 mL’ye tamamlanarak +4 oC’de saklanır. 1 M Tris-HCl çözeltisi (pH 6.8): 12.11 g tris baz tartılır ve bir miktar destile suda çözüldükten sonra pH’sı 6 N HCl ile 6.8’e ayarlanır ve son hacmi 100 mL’ye tamamlanarak +4 oC’de saklanır. SDS çözeltisi: %10 (w/v) oranında taze olarak hazırlanır. PAGE Tamponu: 3 g Tris baz, 15 g Glisin ve 1 g SDS bir miktar destile suda çözüldükten sonra 1 L’ye hacmi tamamlanır (her elektroforez işleminde taze hazırlanır). Biyokimya Laboratuvarı I – Güz 47 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı SDS-PAGE jel kasetinin hazırlanması: İçinde jelin polimerize olacağı kuru ve temiz cam levhalar aralarına plastik ayırıcı konularak üst üste konulur. Kıskaçlar takılarak döküm standına yerleştirilir. Şekil 8.5- Jel kasetlerinin hazırlanması Poliakrilamid jelin hazırlanması: Aşağıdaki tabloya göre jel çözeltisi hazırlanır. 65 mL %12.5’lik Alt Jel Kompozisyonu Akrilamid/Bisakrilamid 26 mL Tris-HCl 1.5 M pH 8.8 16.25 mL SDS %10 (w/v) 650 µL Destile su 21,64 mL APS %10 (w/v) 350 µL TEMED 70 µL 20 mL %4.5’lik Üst Jel Kompozisyonu Akrilamid/Bisakrilamid 3 mL Tris-HCl 1 M pH 6.8 2.5 mL SDS %10 (w/v) 200 µL Destile su 15 mL APS %10 (w/v) 70 µL TEMED 20 µL Biyokimya Laboratuvarı I – Güz 48 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı TEMED ve APS çözeltileri polimerleşmeyi başlatacak olan çözeltiler oldukları için jel çözeltisinin kasete dökülmesinden hemen önce ilave edilir. Hazırlanan alt jel çözeltisi iyice karıştırılır ve jel kasetlerinin içine kasetin 4/5’i dolacak şekilde dikkatle dökülür. Üzerine bir miktar n-butanol çözeltisi ilave edilir ve polimerleşmenin tamamlanması beklenir. Polimerleşme tamamlandıktan sonra n-butanol çözeltisi kasetin içinden alınır. Hazırlanan üst jel çözeltisine TEMED ve APS ilave edilerek iyice karıştırılır ve jel kasedine dökülür. Döküldükten hemen sonra örneklerin tatbik edileceği kuyuların oluşması için tarak yerleştirilir ve polimerleşme tamamlanıncaya kadar beklenir. Polimerleşme tamamlandıktan sonra tarak kuyuların bozulmamasına dikkat edilerek çıkartılır. Şekil 8.6- Jellere tarağın yerleştirilmesi PAGE Yükleme Tamponu 1 M Tris-HCl (pH 6.8) 1.0 mL Gliserin 1.6 mL %10 SDS (w/v) 0.2 mL β-merkaptoetanol 0.4 mL Destile su 8.0 mL Bromfenol mavisi Eser miktarda Biyokimya Laboratuvarı I – Güz 49 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Örneklerin yüklenmesi: Protein örneklerinin konsantrasyonları 3 µg/µL olacak şekilde hesaplanır ve gerekli seyreltmeler PAGE yükleme tamponu ile yapılır. Örneklerden 100 µL alınarak ependorf tüplere konularak 1 dakika 100°C’lık su banyosunda ısıtılarak denatüre edilirler. Soğutulduktan sonra bir otomatik pipet yardımıyla her kuyuya aşağıdaki şekilde gösterildiği gibi 10 µL (kuyu başına 30 µg protein düşecek şekilde) protein tatbik edilir. Şekil 8.7- Örneklerin yüklenmesi Kuyu Numarası 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Yüklenen Protein Karaciğer %20 Tuz Karaciğer %80 Tuz Yumurta Akı %50 Tuz Yumurta Sarısı %50 Tuz Protein Standardı Karaciğer Aseton Grup 1 Karaciğer Aseton Grup 2 Karaciğer Aseton Grup 3 Yumurta Akı Aseton Grup 1 Yumurta Akı Aseton Grup 2 Yumurta Akı Aseton Grup 3 Protein Standardı Yumurta Sarısı Aseton Grup 1 Yumurta Sarısı Aseton Grup 2 Yumurta Sarısı Aseton Grup 3 Şekil 8.8- Jel üzerindeki kuyuların yerleşimi Biyokimya Laboratuvarı I – Güz 50 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Standart Protein Sığır Albumin Yumurta Albumin Gliseraldehit-3-p-Dehidrojenaz Sığır Karbonik Anhidraz Tripsinojen Tripsin İnhibitör α-Laktalbumin Molekül Ağırlığı (kDa) 66 45 36 29 24 20 14.2 Jellerin Elektroforez Cihazına Yerleştirilmeleri: Protein tatbik edilen kuyuların üzeri SDS-PAGE yürütme tamponu ile doldurulur ve kaset aşağıdaki şekilde görüldüğü gibi merkezi soğutma aparatına yerleştirilir. Elektroforez sırasında bu aparatın içinden geçen su jelin fazla ısınmasını önleyerek yürümenin düzgün olmasını sağlar ve jeller için destek görevi görür. Ayrıca jel kasetleri soğutucu aparata yerleştirildiklerinde üst tampon haznesini oluşturur. Şekil 8.9- Jel kasetlerinin tampon haznesine yerleştirilmesi. Merkezi soğutma aparatı tampon haznesine yerleştirilir. PAGE Yürütme Tamponu (1.5 L için) Tris-Baz Glisin %10 SDS (w/v) 4.5 g 22.5 g 1,5 mL Taze olarak hazırlanmış 1500 mL SDS-PAGE yürütme tamponu, öncelikle üst tampon haznesi dolacak şekilde ve platin elektrotların ıslanmamasına dikkat edilerek tampon haznesine doldurulur. Üst tampon haznesi dolduktan sonra PAGE yürütme tamponun kalan kısmı tampon haznesinin altında jeller ile temas edecek seviyeye kadar yükselir ve alt tampon haznesini oluşturur. Platin elektrotların kuruluğu kontrol edildikten sonra doğru kutupların üst üste gelmesine dikkat edilerek güç kablolarını taşıyan kapak kapatılır. (Kapaktaki + ucun ( kırmızı) soğutma aparatındaki + uca (kırmızı) ve – ucun (siyah) soğutma aparatındaki – uca (siyah) denk gelmesine dikkat edilir). Biyokimya Laboratuvarı I – Güz 51 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Şekil 8.10- Elektroforezde kullanılan güç kaynağı ve elektroforez aparatı Jellerin yürütülmesi: Soğutma aparatının su bağlantıları takılır ve elektroforez sistemi bir güç kaynağına bağlanır. Jel başına önce 20 mA, daha sonra 30 mA verilecek şekilde güç kaynağı ayarlanır ve elektroforez işlemine başlanır. Bu işlemin süresi ortam sıcaklığına, jelin konsantrasyonuna ve boyutuna bağlıdır. Bizim deneyi gerçekleştirdiğimiz şartlarda jelin tam olarak yürümesi yaklaşık 5 saat sürer. Elektroforez işlemi tamamlandıktan sonra jel kasedi soğutma aparatından ayrılır, plastik ayırıcılar çıkarılır ve cam levhalar açılarak jel içinde 500 mL fiksasyon çözeltisi bulunan bir kaba alınır. Bu aşamada jelin kırılmaması ve parçalanmaması için çok dikkatli olunmalıdır. Jellerin boyanması: Jel Fiksasyon Çözeltisi %50 (v/v) Metanol %10 (v/v)Asetik asit Boya Çözeltisi % 0.065 (w/v) Coomassie G250 %34 (v/v) Metanol 3% (v/v) fosforik asit %17 (w/v)Amonyum sülfat Boya Çıkarma Çözeltisi %10 (v/v) Asetik Asit 250 mL metanol ve 50 mL asetik asit çözeltisi 500 mL’lik bir balon jojeye konulur ve destile su ile hacim tamamlanır. A: 55 g Amonyum sülfat /220 mL destile su. B: 0.2 g Coomassie G250/110 mL metanol + 10 mL fosforik asit. Boya çözeltisi, boyamadan hemen önce, karıştırılmakta olan B çözeltisi üzerine A çözeltisi ilave edilerek hazırlanır. 100 mL asetik asit çözeltisi 1 L’lik balon jojeye alınır ve destile su ile hacim tamamlanır. Jel önce fiksasyon çözeltisi içinde bir gece boyunca bekletilir. Burada amaç proteinlerin jele sabitlenerek boyama sırasında protein kayıplarının önlenmesi ve iyi bir boyamanın sağlanmasıdır. Fiksasyon çözeltisi uzaklaştırıldıktan sonra jellere boya çözeltisi ilave edilir ve 2 gün boyunca (veya spotların görünür hale gelinceye dek) jellerin boyanması sağlanır. Bu aşamada bir orbital çalkalayıcı kullanılarak jellerin hafifçe çalkalanması sağlanır. Biyokimya Laboratuvarı I – Güz 52 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Böylece boya çözeltisi jeldeki protein molekülleri ile bağlanır. Ancak boya jelin protein olmayan kısımlarına da bağlanır (spesifik olmayan bağlanma). Boya çözeltisinden çıkarılan jeller ayrı bir kaba konulurlar ve boya çıkarma çözeltisi ile muamele edilirler. Boya çıkarma çözeltisi jel üzerindeki spesifik olarak bağlanmamış Coomassie boyasını uzaklaştırılarak arka planın renginin koyu maviden, açık maviye (veya şeffafa) doğru değişmesini sağlar ve protein bantlarının daha net bir şekilde görülmesini sağlar. Boyamaları tamamlanmış olan jellerin görüntüleri alınır ve daha sonraki işlemlerde kullanılmak üzere saklanırlar. Şekil 8.11- Boyama işlemi sonucu elde edilen jel görüntüsü VERİLERİN KULLANIMI 5 ve 12 numaralı kuyulara tatbik edilmiş olan protein standardı örneklerine ait protein bandlarının her biri için Rf değerleri hesaplanır. Rf değerleri x eksenine ve molekül ağırlıklarının ln değeri y eksenine gelecek şekilde bir kalibrasyon grafiği çizilir. Bu grafikten yararlanılarak diğer protein örneklerindeki belirgin protein bantlarının hangi molekül ağırlığına karşı geldiği hesaplanır. Şekil 8.12- Proteinlerin molekül ağırlığının bulunması ÇALIŞMA SORULARI 1- Proteomik (proteomics) nedir? Araştırınız. Biyokimya Laboratuvarı I – Güz 53 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı DENEY IX PROTEİNLERİN N- TERMİNAL AMİNOASİTLERİNİN İNCE TABAKA KROMATOGRAFİSİ İLE BELİRLENMESİ Proteinlerin fonksiyonları amino asit dizilimlerine bağlıdır. Çünkü bir proteinin aminoasit dizilimi (sekuansı) o proteinin hangi kimyasal özelliklere sahip olacağını ve 3 boyutlu yapısının nasıl olacağını belirler. Bu sebeplerden dolayı proteinlerin tanımlanmasında dizi analizlerinin yapılması gerekir. Dizi analizleri farklı yöntemlerle gerçekleştirilebilir. Bu yöntemlerden biri Edman degradasyonudur. Aşağıda bir dizi analizi şematik olarak gösterilmiştir. Şekil 9.1- Proteinlerin dizi analizi Biyokimya Laboratuvarı I – Güz 54 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Genel olarak bir dizi analizi çalışmasında şu basamaklar uygulanır. 1- Protein birden fazla alt birim içeriyorsa önce alt birimlere ayrılır. Protein ve alt birimler saflaştırılır. 2- Proteinde bulunan peptid içi (intra) ve peptidler arası (inter) disülfit bağları 2merkaptoetanol, ditiyotreitol (DTT) gibi bir ajanla indirgenir ve ortaya çıkan serbest –SH gruplarının sonraki basamaktaki asit hidrolizinde oksitlenmelerini engellemek için sisteinler iyodoasetat ile S-karboksimetilsistein’e dönüştürülür. Bu aşamadan sonra örnek birkaç kısma ayrılır ve devam eden işlemler ayrı ayrı bu protein kısımlarına uygulanırlar. 3- Protein 6N HCl ile sıcakta muamele edilerek amino asitlerine ayrılır ve kromatografik yöntemlerle her bir amino asitten ne miktarda içerdiği bulunur, yani toplam amino asit bileşimi tayin edilir. 4- Karboksil ve amino terminal analizleri gerçekleştirilir. 5- Proteaz enzimleri kullanılarak protein belirli bölgelerden kırılır ve Edman degradasyonu uygulanarak her bir parçanın amino asit dizilimi bulunur. (Edman yöntemi sadece 5060 aminoasitten oluşan parçaların tayinine izin verir, daha uzun proteinlerde hata oranı artmaya başlar) 6- Bu parçaların dizilimi, amino asit bileşimi, Nve C- terminal analiz bilgileri bir araya getirilerek proteinin amino asit dizilimi bulunur. Şekil 9.2- Sığır insülin proteinin amino asit dizilimi Biyokimya Laboratuvarı I – Güz 55 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Şekil 9.3- Disülfit bağının indirgenmesi ve oksidasyonu Yukarıda anlatıldığı gibi proteinlerin parçalara ayrılmaları için proteaz adı verilen enzimler kullanılır. Bazı proteazlar peptid bağını sadece belli bir amino asitten sonra (veya önce) ve bu sayede tahmin edilebilir bir şekilde kırarlar. Proteaz veya Kimyasal Ajan Kırılan Peptid Bağı Tripsin Lizin, Arjinin (C) Kimotripsin Fenilalanin, Triptofan, Tirozin (C) Pepsin Fenilalanin, Triptofan, Tirozin (N) Termolizin Fenilalanin, Triptofan, Tirozin (C) Submaxillarus proteaz Arjinin (C) Endoproteinaz Lys C Lizin (C) Siyonejen Bromür Metiyonin (C) Karboksipeptidaz A C Terminal Aminoasit (N) (C): C- Terminalinden kırma yapar. (N): N- Terminalinden kırma yapar. Biyokimya Laboratuvarı I – Güz 56 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Örneğin; glisinilfenilalaninilalanin tripeptidi kimotripsin ile muamele edilirse glisinilfenilalanin ve alanin elde edilir. Eğer pepsin ile muamele edilirse glisin ve fenilalaninilalanin elde edilir. Proteinin C- terminalinin bulunması için, protein karboksipeptidaz A ile muamele edilir ve kopan amino asit kalıntısı tayin edilir. Ancak enzim sürekli olarak C-terminalindeki amino asitleri koparmaya devam edeceğinden reaksiyonun istenilen basamakta kesilmesi önemlidir. Şekil 9.4- Glisinilfenilalaninilalanin tripeptidi Şekil 9.5- Karboksipeptidaz A enziminin mekanizması Proteinin N- terminal analizi için Sanger yöntemi kullanılır. Bu yöntemde 2,4dinitroflorobenzen reaktifi kullanılarak proteinin N-terminal ucundaki amino asit 2,4dinitrofenil türevine dönüştürülür. Daha sonra asit hidrolizi ile protein amino asitlerine ayrılır ve bir amino asit karışımı oluşur. Bu karışımdaki N-terminal amino asidinin 2,4dinitrofenil türevi kromatografik yöntemler kullanılarak tanımlanır. Ancak protein tamamen amino asitlerine parçalandığından dizi analizinde kullanılamaz. Proteinlerin amino asit dizi analizlerinin tayini için Edman yöntemi kullanılır. Bu yöntemde N- terminal amino asidi fenilizotiyosiyanat ile reaksiyona sokulur. Bu amino asit feniltiyohidantoin oluşturarak peptid zincirinden ayrılır ve kromatografik yöntemlerle tayin edilir. Her seferinde sadece N- terminalindeki amino asit ayrıldığı ve zincirin geri kalan kısmı korunduğu için bu işlem tekrar tekrar yapılarak zincirdeki bütün amino asitler tanımlanabilir. Edman yöntemi tamamen otomatik cihazlar yardımıyla gerçekleştirilebilir. Ancak her bir döngüde bazı yan ürünler açığa çıktığından 50-60 amino asit sonrasında tayinde hatalar artar. Bu nedenle proteinlerin daha önceden proteazlarla parçalanması gerekir. Biyokimya Laboratuvarı I – Güz 57 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Şekil 9.6- Edman ve Sanger yöntemi Günümüzde elektroforez ile saflaştırılmış proteinlerin amino asit diziliminin bulunmasında MALDI-TOF yöntemi ve protein veri bankaları kullanılmaktadır. Bu yöntemde proteinler tripsin kullanılarak parçalara ayrılır ve kütle spektrofotometreleri ile her bir parçanın kütle analiz şablonları çıkarılır. Bu şablonlar internet üzerindeki veri tabanlarındaki proteinlere ait şablonlar ile karşılaştırılarak bilinmeyen proteinin ne olduğu ve dolayısıyla amino asit dizilimi bulunabilir. Ancak bu yöntem dolaylı bir analiz yöntemidir, daha önceden yapısı aydınlatılmamış bir proteinin amino asit diziliminin bulunması için kullanılamaz. Saflaştırılmış ve amino asit dizilimi belirlenmiş olan polipeptidin 3 boyutlu yapısı xışınları kristalografisi ve NMR teknikleri kullanılarak aydınlatılır. Böylece protein saflaştırılması ve karakterizasyonu tamamlanmış olur. Biyokimya Laboratuvarı I – Güz 58 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı KİMYASALLAR Aspartik asit, lösin, valin, arjinin, prolin, sistein, sistin, glisin, Na2CO3, 2,4dinitroflorobenzen, HCl, kloroform, benzil alkol, glasiyel asetik asit. YÖNTEM 50 mL’lik bir erlen içinde 20 mg amino asit %5’lik 10 mL Na2CO3 çözeltisinde çözülür. Üzerine 0.5 mL 2,4-dinitroflorobenzen (DNFB) ilave edilir. DNFB bazı insanlarda alerjik reaksiyonlara sebep olabileceğinden çalışma sırasında eldiven takılmalı ve dikkatli olunmalıdır. Karışım 40°C sıcaklıkta 30 dakika devamlı karıştırılarak tutulur. Sıcaklığın 40 °C’nin üzerine çıkmamasına dikkat edilir. Isıtma sonunda çözeltinin rengi turuncuya döner. Reaksiyona girmemiş olan DNFB bir pipet yardımıyla uzaklaştırılır. Daha sonra 1.5 mL derişik HCl dikkatle ilave edilir. Türev bu aşamada çöker. Eğer çökelme olmazsa erlen buz banyosunda soğumaya bırakılır. Çökelti bir test tüpüne alınarak az miktarda aseton içinde çözülür. Mobil faz olarak (kloroform: benzil alkol: glasiyel asetik asit) ; (45:20:1) karışımı kullanılır. Mobil faz 1 cm yüksekliğinde olacak şekilde kromatografi tankına konulur. Bir TLC (thin layer chromatography; ince tabaka kromatografisi) plakasına kurşun kalemle plakayı zedelememeye dikkat ederek alttan 3 cm yükseklikte bir çizgi çekilir. 2 cm aralıkla bu çizgi üzerinde tatbik noktaları işaretlenir. Hazırlanmış olan amino asit türevleri bu noktalara tatbik edilir. Bütün örnekler tatbik edildikten sonra TLC plakasının kuruması beklenir ve kromatografi tankına yerleştirilir. Mobil fazın plaka üzerinde üstten 2 cm kalıncaya kadar yürümesi beklenir. Plaka tanktan çıkarılır, mobil fazın yürüme sınırı kurşun kalem ile işaretlenir. Çeker ocakta kurutulur. Her bir aminoasidin ve türevinin Rf değerleri hesaplanır. ÇALIŞMA SORULARI 1- Proteinlerin 3 boyutlu yapı aydınlatılması nasıl yapılır? Araştırınız. Biyokimya Laboratuvarı I – Güz 59 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı DENEY X MEMELİ DOKULARINDAN DNA İZOLASYONU VE BAZI ÖZELLİKLERİNİN İNCELENMESİ DNA ve RNA nükleik asitler olarak adlandırılırlar ve nesilden nesile kalıtımsal bilginin aktarılmasını sağlayan uzun zincirli polimerlerdir. Bu makromoleküllerin yapı taşları nükleotidlerdir. Her nükleotid bir şeker, bir fosfat ve bir bazdan oluşur. Şekil 10.1- DNA ve RNA yapısında yer alan azotlu bazların yapıları Şekil 10.2- Deaoksinükleotid yapısı Nükleik asitler nükleotidlerin 3′, 5′-fosfodiester köprüleri ile bir araya gelmesinden oluşmuştur. Bu zincirlerde fosfodiester köprüleri ile bağlanmış şeker molekülleri nükleik asitlerin iskeletini oluşturur. Biyokimya Laboratuvarı I – Güz 60 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Şekil 10.3- Nükleik asit yapısı Şekil 10.4- DNA yapısında yer alan baz çiftleri Biyokimya Laboratuvarı I – Güz 61 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı DNA ikili sarmalında adenin-timin (A-T) ve guanin-sitozin (G-C) bağları kurulur. DNA ikili sarmalını bir arada tutan kuvvetler, nükleotid zincirleri arasındaki A-T ve G-C çiftleri arasındaki hidrojen köprüleri (yatay interaksiyon) ve nükleotid zincirleri üzerindeki bazlar arasındaki etkileşimlerdir (dikey interaksiyon). Şekil 10.5- DNA çift sarmal yapısı Protein molekülünde olduğu gibi DNA molekülünün yapısındaki herhangi bir bozulmaya da denatürasyon denir. DNA denatürasyonu yatay ve dikey çekici güçlerden herhangi birindeki azalma veya kopma sonucu olur. Yatay güçlerdeki azalma ya da kopma sonucu olan denatürasyon DNA’nın 260 nm’deki absorbansının artması ile belirlenebilir. Dikey güçlerdeki azalma ya da kopma sonucu olan denatürasyon (hipokromisite) tek başına 260 nm’de absorbans değişikliğine sebep olmaz. Ancak DNA’nın 210 nm civarındaki 2. pikinin absorbansında azalma hatta tamamen yok olma ve pikin dalga boyunun daha yüksek dalga boylarına kayması meydana gelir. DNA sarmalını oluşturan zincirlerin birindeki veya her ikisindeki bazlardan bir veya bir kaçının kopması sonucu nükleotid zincirde kısalma meydana geliyorsa bu olaya DNA’nın degradasyonu denir. Degradasyon gerçekleştiğinde 260 nm’deki absorbansta azalma meydana gelir. 42°C’ın üzerindeki sıcaklıklarda DNA ikili sarmalı arasındaki hidrojen köprüleri öncelikle A-T zengin bölgelerde olmak üzere gevşeyip açılmaya başlar. Kullanılan tampon çözeltiye bağlı olarak 56-80°C arasındaki sıcaklıklarda DNA ikili sarmalı kendisini oluşturan nükleotid zincirlerine ayrılır. Buna DNA’nın erimesi denir. DNA heliksinin %50’sinin denatüre olduğu sıcaklığa DNA’nın erime sıcaklığı (Tm) adı verilir. Tm değeri o DNA’nın A-T/G-C oranına bağlı olduğundan, DNA’nın tanımlanmasını sağlayan spesifik bir değerdir (yani bir fareden alınan DNA’nın Tm değeri, bir insandan alınan DNA’nın Tm değerinden farklı olacaktır veya aynı bakterinin iki farklı suşunun Şekil 10.6- DNA‘nın erimesi DNA’larının Tm değerleri farklı olacaktır). Ayrıca Tm değeri kullanılan tampon çözeltinin iyonik şiddetine ve pH’sına da bağlıdır. Bu nedenle Tm değeri verilirken mutlaka deneyin hangi, şartlarda yapıldığı da belirtilmelidir. Biyokimya Laboratuvarı I – Güz 62 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı DNA erimesi sıcaklık 90-100 °C’nin üzerine çıkılmadığı sürece geri dönüşümlüdür. Eğer 80°C’ye ısıtılmış bir DNA çözeltisi, oda sıcaklığında yavaş yavaş soğumaya bırakılırsa iki sarmal tekrar birleşerek DNA ikili sarmalını oluştururlar (hibridizasyon). Ancak aynı DNA oda sıcaklığında değil de bir buz banyosunda ani soğutmaya bırakılacak olursa DNA sarmalarında hibridizasyon gerçekleşmez ve nükleotid zincirleri birleşmezler. Ayrıca DNA boyunda kısalmalar, yani DNA degradasyonu meydana gelebilir. Eğer degradasyon meydana gelmediyse bu çözeltiler yeniden ısıtılıp yavaş yavaş soğumaya bırakılırlarsa DNA ikili sarmalını yeniden oluşturabilirler. Şekil 10.7- DNA’nın erimesine G-C içeriğinin etkisi Yukarıda anlatıldığı gibi nükleik asitler 260 nm dalga boyunda absorbans piki verirler. Bu absorbans değeri kullanılarak nükleik asidin konsantrasyonu tayin edilebilir. 260 nm dalga boyunda, 1 cm’lik kuartz küvetlerde 1’lik bir absorbans 50µg/mL DNA konsantrasyonuna karşılık gelir. Tek zincirli DNA veya RNA içinse bu değer 40 µg/mL’dir. Nükleik asitlerin saflığını tayin etmek için nükleik asit çözeltilerinin absorbanslarının 240-300 nm arasında ölçülmesi gerekir. Proteinler 280 nm’de pik verdiklerinden A260 nm/ A280 nm oranından yararlanılarak saflık tayini yapılabilir. DNA için bu oran 1.8, RNA içinse 2.0 olmalıdır. Eğer bu verilen değerlerden daha düşük değerler elde ediliyorsa, bu örneğin proteinlerle kontamine olduğunu gösterir. Kontaminasyon bir kimyasal karışım içinde düşük miktarlarda (genellikle istenmeyen) başka maddelerin var olmasıdır. Hücreler (hücre tiplerine göre farklılık göstermekle birlikte) büyük ölçüde su içerdiklerinden, hücre organellerinin yapısal özellikleri su ile reaksiyonları sonucu ortaya çıkar. Hücreler ve hücre organelleri yapısal özellik ve bütünlüklerini izotonik çözeltiler içinde koruyabilirler. Hücrelerle aynı osmatik basınca sahip çözeltilere izotonik çözeltiler denir. İzotonik çözeltilerde hücre ile etrafındaki çözelti arasındaki su alış verişi dengededir. %0.876’lık NaCl (serum fizyolojik), %5 dekstroz (serumda kullanılır) gibi çözeltiler yaygın olarak kullanılan izotonik çözeltilere örnek olarak verilebilirler. Biyokimya Laboratuvarı I – Güz 63 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı Her ne kadar hemen hemen tüm hücreler DNA içerseler de bazı dokularda bu miktar çok az olduğundan bu tip dokular DNA izole etmek için iyi bir kaynak değildirler. Bazı dokular ise yüksek deoksiribonükleaz aktivitesine sahip olduklarından DNA izolasyon esnasında küçük parçalara ayrılır. Bu nedenle DNA elde etmek için yüksek DNA ve düşük nükleaz aktivitesine sahip dokular tercih edilmelidir. Bu amaçla en iyi kaynaklar timus ve lenf en iyi dokulardır. Dalak, testis ve yumurtalıklarda DNA elde etmek için kullanılabilirler. KİMYASALLAR NaCl, EDTA, SDS, etanol. YÖNTEM Çözeltilerin hazırlanması: Ekstraksiyon çözeltisi: 0.15 M NaCl ve 0.1 M EDTA çözeltisinden oluşur. 0,925 g EDTA ve 2,19 g NaCl 250 mL destile su içinde çözülerek hazırlanır. Deneyde soğuk olarak kullanılır. 2M NaCl çözeltisi: 11.7 g NaCl 100 mL destile suda çözülerek hazırlanır. DNA’nın İzolasyonu: DNA izolasyonunun yapılacağı dokudan yaklaşık 10 g alınır ve 100 mL ekstraksiyon çözeltisi ilave edilir. Daha sonra kısa sürelerle ve DNA içeren çözeltinin ısınmamasına dikkat edilerek homojenizatörde homojenize edilir. DNA’nın bozulmaması için bu işlemler soğukta yapılmalı ve kullanılan çözeltiler önceden soğutulmuş olmalıdır. Homojenize hale getirilmiş olan çözeltiye 1 mL %10 SDS ilave edilir. Hafifçe alt üst edilerek çözelti karıştırılır (SDS deterjan olduğundan köpürmemesine dikkat edilir). Daha sonra 4000 rpm’de 5 dakika santrifüj edilir. Üstteki çözelti (süpernatant) dikkatle alınır ve temiz bir santrifüj tüpüne hacim 4 mL olacak şekilde aktarılır. Süpernatant çözeltisine 8 mL soğuk 2M NaCl çözeltisi ilave edilir ve dikkatle karıştırılır. Daha sonra 4000 rpm’de 5 dakika santrifüj edilir. Süpernatant yaklaşık 4 mL hacimde olacak şekilde dikkatle temiz bir santrifüj tüpüne alınır. Süpernatanta yaklaşık 8 mL soğuk etanol yavaş yavaş ilave edilir ve tüpteki değişim gözlenir. Daha sonra 4000 rpm’de 1-2 dakika santrifüj edilir. Santrifüj sonunda üstteki süpernatant dekante edilir ve beyaz renkli DNA presipitatı alınır. Etanol kalıntısını uzaklaştırmak için 1-2 mL 0.1 M EDTA çözeltisi ile, karıştırılmadan kalıntılar yıkanır, yıkama çözeltisi dekante edilerek uzaklaştırılır ve daha sonra yeterli miktarda ekstraksiyon çözeltisinde çözülür. Çözünmeyen kısımlar santrifüj ile uzaklaştırılır. Elde edilen DNA çözeltisi derin dondurucuda uzun süre saklanabilir. Biyokimya Laboratuvarı I – Güz 64 Marmara Üniversitesi Fen-Edebiyat Fakültesi Kimya Bölümü / Biyokimya Anabilim Dalı DNA’nın Erimesi: DNA çözeltisinin 260 nm ve 280 nm’deki absorbansları ölçülür ve konsantrasyonu ve saflığı tayin edilir. 4 cam tüpe elde edilen DNA çözeltisinden yaklaşık 5’er mL alınır. Tüplerden bir tanesi oda sıcaklığında bekletilirken diğer üçü 80°C sıcaklıktaki su banyosunda 10 dakika bekletilir. Bu sürenin sonunda bir tüp oda sıcaklığında, bir tüp buz banyosunda ve bir tüp de –80°C soğutucuda 5 dakika tutulur. Soğutulmuş olan tüplerin oda sıcaklığına gelmesi beklenir ve 4 tüpün absorbans değerleri 260 nm’de ekstraksiyon çözeltisi kör olarak kullanılarak ölçülür. Tüp Hacim No (mL) Uygulanan işlem Oda sıcaklığında bekletilir. 1 5 2 5 80°C ısıtıtma (10 dakika) 3 5 80°C ısıtıtma (10 dakika) 4 5 80°C ısıtıtma (10 dakika) Uygulanan işlem Oda sıcaklığında bekletilir. Oda sıcaklığında bekletilir. Buz Banyosunda Bekletilir (5 dakika) -80°C soğutucuda bekletilir (5 dakika) Uygulanan işlem Oda sıcaklığında bekletilir. Oda sıcaklığında bekletilir. Oda sıcaklığında bekletilir. Absorbans Absorbans (260 nm) (280 nm) Ölçüm yapılmaz Oda sıcaklığında bekletilir. ÇALIŞMA SORULARI 1- Genomik (Genomics) nedir? Genomik çalışmalar niçin önemlidir? 2- Bilimsel araştırmalarda DNA izolasyonunda genellikle fenol ekstraksiyonu kullanılır. Bu yöntemin nasıl yapıldığını ve prensibini araştırın. Biyokimya Laboratuvarı I – Güz 65