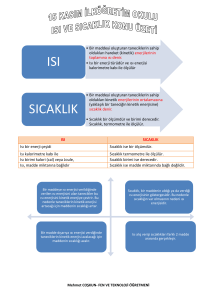
ISI-SICAKLIK VE HAL DEĞİŞİMİ
Sıcaklık:
Maddeleri oluşturan taneciklerin ortalama hareket enerjisidir.
Birimi 0C dir.
Isı alan maddenin sıcaklığı yükselir; ısı veren maddenin sıcaklığı
düşer.
Sıcaklık termometre ile ölçülür.
Şekilde verilen kaplarda başlangıç sıcaklıkları aynı olan aynı
maddeler bulunmasına ve bu kaplar özdeş ısıtıcılarla eşit süre
ısıtılmasına rağmen, son durumda 200 g su bulunan kaptaki
sıcakık daha azdır.
Maddeyi oluşturan tanecik sayısı; yani kütle arttıkça o maddenin
sıcaklığını artırmak için vermemiz gereken ısı miktarı artar.
Öz Isı:
Isı:
Maddeyi oluşturan taneciklerin toplam enerjisine ısı denir.
Bir enerji çeşidi olduğundan birimi joule veya kalori olarak
kullanılır.
Kalorimetre kabı ile ölçülür.
Isı kavramının kullanılabilmesi için sıcaklıkları farklı maddeler
arasında enerji akışı olması gerekir. Maddenin sahip olduğu ısıdan
bahsedilemez; ancak yaydığı veya aldığı ısıdan bahsedilebilir. Bu
nedenle “hava ısısı, suyun ısısı, vücut ısısı” gibi kullanımlar doğru
değildir.
Isı akışı sıcaklığı yüksek olan maddeden düşük olana doğrudur ve
sıcaklık dengeleninceye kadar devam eder.
Maddenin yaydığı/ aldığı ısı miktarı ısı kaynağına ve maddenin
türüne bağlı olduğu kadar kütlesine de bağlıdır.
ÖRNEK:
25 0C
100 g su
25 0C
200 g su
1 g maddenin sıcaklığını 1 0C artırmak için verilmesi gereken ısı
miktarına öz ısı denir.
Maddeler için ayırt edici bir özelliktir.
Birimi joule/g 0C veya cal/g 0C olarak ifade edilir.
“c” ile gösterilir.
Öz ısısı yüksek olan madde geç ısınıp geç soğur; öz ısısı düşük olan
madde çabuk ısınıp çabuk soğur.
Eşit kütlede ve başlangıç sıcaklıkları aynı olan farklı maddelere eşit
ısı verildiğini düşünelim. Bu maddelerden öz ısısı yüksek olan
daha geç ısınacağından son sıcaklığı diğerinden düşük olur.
ÖRNEK:
csu > calkol
100 g alkol
100 g su
0
25 C
25 0C
Bu kaplar özdeş ısıtıcılarla eşit süre ısıtıldığında suyun son sıcaklığı
alkolden daha düşük olur. Çünkü suyun sıcaklığını artırmak için
vermemiz gereken enerji miktarı daha fazladır.
NOT
Hal Değişimi
Maddeleri oluşturan tanecikler arası çekim kuvveti ne kadar fazla
ise o maddenin hal değişimi için yapması gereken ısı alışverişi de o
kadar fazla olur.
Katı maddelerdeki tanecikler birbirine en yakındır. Bu nedenle
tanecikler arasındaki çekim kuvveti de en fazladır.
ÖRNEKLER
20 g buzu sıvı hale getirmek için vermemiz gereken enerji kaç
0
kalori olur? (Le= 80 cal/g C)
17096 joule ısı alarak kaç gram alkol sıvı halden gaz hale
geçer? (Lb: 854,8 joule/ g0 C)
ERİME VE BUHARLAŞMA ISISI
Katı maddenin sıvı hale geçtiği sıcaklık: Erime Noktası (E.N.)
Sıvı maddenin gaz hale geçtiği sıcaklık: Kaynama Noktası (K.N.)
Le : 1 g katı maddeyi sıvı hale geçirmek için gerekli olan ısı miktarı
Lb: 1 g sıvı maddeyi gaz hale geçirmek için gerekli olan ısı miktarı