PINAR ÖZ
İSTANBUL ÜNİVERSİTESİ SAĞ. BİL. ENST.
YÜKSEK LİSANS TEZİ
İSTANBUL-2012
T.C.
İSTANBUL ÜNİVERSİTESİ
SAĞLIK BİLİMLERİ ENSTİTÜSÜ
YÜKSEK LİSANS TEZİ
ATP BİYOLUMİNESANS HİJYEN MONİTOR SİSTEMİNİN
PERFORMANSININ KLASİK MİKROBİYOLOJİK METOT
(SWAP) İLE KARŞILAŞTIRMAK SURETİYLE
ÖLÇÜLMESİ
PINAR ÖZ
DANIŞMAN
PROF. DR. ÖZGE ÖZGEN ARUN
BESİN HİJYENİ VE TEKNOLOJİSİ ANABİLİM DALI
BESİN HİJYENİ VE TEKNOLOJİSİ PROGRAMI
İSTANBUL-2015
ii
TEZ ONAYI
iii
BEYAN
Bu tez çalışmasının kendi çalışmam olduğunu, tezin planlanmasından yazımına
kadar bütün safhalarda etik dışı davranışımın olmadığını, bu tezdeki bütün bilgileri
akademik ve etik kurallar içinde elde ettiğimi, bu tez çalışmasıyla elde edilmeyen bütün
bilgi ve yorumlara kaynak gösterdiğimi ve bu kaynakları da kaynaklar listesine
aldığımı, yine bu tezin çalışılması ve yazımı sırasında patent ve telif haklarını ihlal edici
bir davranışımın olmadığı beyan ederim.
iv
İTHAF
Yapmış olduğum bu çalışmayı çok değerli aileme ithaf ediyorum.
v
TEŞEKKÜR
Başarının bir varış noktası değil zirveye giden yolda çıkılan bir basamak
olduğunu öğreten ilk öğretmenlerim canım annem Gönül ÖZ’e ve canım babam Atıf
ÖZ’e, bilimsel bir rapor hazırlamadaki deneyim, bilgi ve tecrübelerini paylaşan canım
ağabeyim Plastik Rekonstrüktif ve Estetik Cerrahi Uzmanı Op. Dr. Cem ÖZ’e, canım
kardeşim Tekstil Müh. Damla ÖZ’e ve 18 Temmuz 2015 tarihinde kaybettiğimiz
asaleti, özgüveni ve merhametini örnek aldığım rahmetli anneannem Hikmet TEMEL’e
desteklerinden dolayı gönülden teşekkür ederim.
Yüksek lisans eğitimim süresince bana yol gösteren, bilimsel düşünme ve
uygulama fırsatı sunan, çalışmalarımı takip ederek beni doğruya yönlendiren çok
saygıdeğer danışman hocam Prof. Dr. Özge ÖZGEN ARUN’a,
Çalışmalarım süresince desteklerini esirgemeyen İ. Ü. Veteriner Fakültesi Besin
Hijyeni ve Teknolojisi Anabilim Dalı Başkanı Prof. Dr. Özer ERGÜN’e,
Çok değerli bilgileriyle tezime katkıda bulunan Prof. Dr. Bülent EKİZ’e,
teşekkürlerimi sunarım.
Bu çalışma, İstanbul Üniversitesi Bilimsel Araştırma Projeleri Birimi tarafından
desteklenmiştir. Proje No: 14970
vi
İÇİNDEKİLER
TEZ ONAYI .................................................................................................................... İİ
BEYAN………………………………………………………………………………...İİİ
İTHAF ............................................................................................................................ İV
TEŞEKKÜR…………………………………………………………………………….V
İÇİNDEKİLER .............................................................................................................. Vİ
TABLOLAR LİSTESİ…………………………………………………………………İX
SEMBOLLER / KISALTMALAR LİSTESİ……………………..…………………….X
ÖZET…………………………………………………………………………………...Xİ
ABSTRACT.................................................................................................................. Xİİ
1. GİRİŞ VE AMAÇ .........................................................................................................1
2. GENEL BİLGİLER ......................................................................................................3
2.1. Gıda Güvenilirliği ve Gıda Hijyeninin Tanımı…………………………………..…3
2.2. Gıda Güvenilirliği Tehlikeleri………………………………………………………3
2.2.1.Fiziksel Tehlikeler……………………………………………………………..…..3
2.2.2. Kimyasal Tehlikeler………………………………………………………...…….4
2.2.3. Mikrobiyolojik Tehlikeler……………………………………………………...…4
2.2.3.1. Gıda Bozulmaları…………………………………………………………….…5
2.2.3.2. Gıda Zehirlenmeleri…………………………………………………………….5
2.3. Gıda İşletmelerinde Gıda Güvenilirliğini Güvence Altına Alan Sistemler…….…..6
2.4. Gıda İşletmelerinde Hijyen Uygulamalarının Doğrulanması İçin Kullanılan
Metotlar………………………………………………………………………………….7
2.4.1. Kültürel Metot…………………………………………………………………….8
2.4.2. 3MTM PetrifilmTM....................................................................................................9
2.4.3. Compact Dry…………………………………………………………………….10
2.4.4. Hazır Agarlı Plakalar………………………………………………………...…..10
2.4.5. Direkt Epifluoresan Filtre Tekniği (DEFT)………………………………….….11
2.4.6. Enzimle Bağlı İmmunosorbent Ölçüm Metodu (ELISA) Ve Enzimle Bağlı
Floresan Ölçüm Metodu (ELFA)………………………………...……………….........12
vii
2.4.7. Polimeraz Zincir Reaksiyonu (PCR)…………………………………………….13
2.4.8. Gerçek Zamanlı Kantitatif Polimeraz Zincir Reaksiyonu (RT-PCR, Q-PCR...…14
2.4.9. ATP Biyolüminesans…………………………………………………………….15
2.4.9.1. ATP Biyolüminesans Metodunun Prensibi……………………………………15
2.4.9.2. Biyoluminesans Reaksiyonu……………………………………………….…..15
2.4.9.3. ATP Biyolüminesans Metodunun Gıda Mikrobiyolojisindeki Uygulamaları…16
2.5. Kanatlı Endüstrisi………………………………………………………………….17
2.5.1. Kanatlı Kesimhanelerinde Hijyen Uygulamaları……………………………..…17
2.5.2. Kanatlı Kesimhanelerinde Hijyen Doğrulama İhtiyacı………………………….18
3. GEREÇ VE YÖNTEM ...............................................................................................20
3.1. GEREÇ…………………………………………………………………………….20
3.1.1. Model Yüzeyler………………………………………………………………….20
3.1.2. Referans Kültürler……………………………………………………………….20
3.1.3. Kullanılan Cihazlar………………………………………………………………20
3.1.4. Analizlerde Kullanılan Besiyeri ve Çözeltiler………………………………...…21
3.2. YÖNTEM………………………………………………………………………….21
3.2.1.Model Çalışma Yüzeylerinin Dezenfeksiyonu……………...………………...….21
3.2.2. Temiz Yüzeylerin Mikroorganizma Yükünün Kontrolü……………….………..22
3.2.3. Kontaminasyon için Kullanılacak Kültürlerin Hazırlanması……………………22
3.2.4. Yüzeylerin Kontaminasyonunda Kullanılacak Kültürleri İçeren Çözeltinin
Hazırlanması ve Mikroorganizma Yükünün Belirlenmesi…………………………..…22
3.2.5. Yüzeylerin Kirletilmesi………………………………………………………….22
3.2.6. ATP Ölçümleri…………………………………………………………..………23
3.2.7. Klasik Swap Yöntemi için Örneklerin Alınması…………………………..…….23
3.2.8. Swap Örneklerinin Mikrobiyolojik Ekimleri……………………………………23
3.2.8.1. Seri Seyreltimlerin Yapılması…………………………………………………23
3.2.8.2. E. coli Sayımı………………………………………………………………….23
3.2.8.3. Salmonella Sayımı…………………………………………………………..…23
3.2.8.4. S. aureus Sayımı……………………………………………………………….24
3.2.8.5. S.cerevisiae Sayımı…………………………………………………………….24
3.2.8.6. Toplam Aerobik Bakteri Sayımı……………………..…………………..…….24
viii
3.2.9. Kanatlı Kesimhanesinden Alınan Örneklerin Analizi………………………..….25
3.2.10. İstatistiksel Analizler…………………………………………………..……….25
3.2.11. RLU Değerlerinin Yorumlanması…………………………………………..….25
4. BULGULAR ...............................................................................................................26
4.1. Temiz Yüzeylerin Mikroorganizma Yükünün Kontrolü…………………………..26
4.2. Model Çalışma Yüzeylerinde Salmonella Bulguları………………………………26
4.3. Model Çalışma Yüzeylerinde E. coli Bulguları……………………………………27
4.4. Model Çalışma Yüzeylerinde S. aureus Bulguları………………………………...28
4.5. Model Çalışma Yüzeylerinde S. cerevisiae Bulguları……………………………..29
4.6. ATP Metodu İle Klasik Külterel Metot Arasındaki Korelasyon Değerleri ……….30
4.7. Bir Kanatlı Kesimhanesinden Alınan Numunelerle Yapılan Çalışma Sonuçları….31
5. TARTIŞMA ..........................................................................................................…..32
KAYNAKLAR….. .........................................................................................................37
ÖZGEÇMİŞ ....................................................................................................................51
ix
TABLOLAR LİSTESİ
Tablo 4-2 : Model çalışma yüzeylerinde Salmonella bulguları (log10 kob/cm2)…….26
Tablo 4-3 : Model çalışma yüzeylerinde E. coli bulguları (log10 kob/cm2)…….……27
Tablo 4-4 : Model çalışma yüzeylerinde S. aureus bulguları (log10 kob/cm2)…........28
Tablo 4-5 : Model çalışma yüzeylerinde S. cerevisiae bulguları (log10 kob/cm2)…...29
Tablo 4-6 : ATP metodu ile klasik kültürel metot arasındaki korelasyon
değerleri..........................................................................................................................30
Tablo 4-7 : Bir kanatlı kesimhanesinden alınan numunelerle yapılan çalışma
sonuçları……………..……………………………………………….…..………..…...31
x
SEMBOLLER / KISALTMALAR LİSTESİ
ATP
: Adenozin Trifosfat
BRC
: İngiliz Perakendecilik Konsorsiyumu Standardı
CDC
: ABD Hastalık Kontrol ve Korunma Merkezleri
DEFT
: Direkt Epifloresan Filtre Tekniği
ELISA
: Enzimle Bağlı Immunosorbent Ölçüm Metodu
ELFA
: Enzimle Bağlı Floresan Ölçüm Metodu
FDA
: Amerikan Gıda ve İlaç Dairesi
HACCP
: Tehlike Analizi ve Kritik Kontrol Noktaları
IFS
: Uluslararası Gıda Standardı
IMS
: Immuno Manyetik Seperasyon
ISO
: Uluslararası Standartlar Örgütü
kob
: Koloni Oluşturan Birim
PCR
: Polimeraz Zincir Reaksiyonu
RLU
: Relatif Işık Ünitesi
RT-PCR (Q-PCR) : Gerçek Zamanlı Kantitatif Polimeraz Zincir Reaksiyonu
sa.
: saat
TSE
: Türk Standartları Enstitüsü
USDA
: Amerikan Tarım Departmanı
WHO
: Dünya Sağlık Örgütü
xi
ÖZET
Öz, P. (2015). ATP Biyoluminesans Hijyen Monitor Sisteminin Performansının Klasik
Mikrobiyolojik Metot (Swap) İle Karşılaştırmak Suretiyle Ölçülmesi. İstanbul
Üniversitesi Sağlık Bilimleri Enstitüsü, Besin Hijyeni ve Teknolojisi AbD. Yüksek
Lisans Tezi. İstanbul.
Gıda işletmelerinde uygun bir hijyen prosedürünün uygulanması ve etkinliğinin
doğrulanması gıda güvenilirliğini sağlamanın önemli şartlarından biridir. Bu nedenle,
araştırmacılar,
gereksinimlerinin
kuruluşların
karşılanması
üretim
için
prosesindeki
hızlı
ve
rutin
güvenilir
hijyen
doğrulama
alternatif
metotların
geliştirilmesine yönelmiştir. ATP biyoluminesans hijyen görüntüleme metodu hızlı ve
kolay uygulanabilir olması nedeniyle geniş bir kullanım alanı bulmuştur. Bu tez
çalışmasında, ATP biyoluminesans metodunun performansı ve uygulanabilirliği, klasik
metot ile karşılaştırılarak incelenmiştir. Bunun için, paslanmaz çelik yüzeyler dört farklı
mikroorganizmanın yüksek, orta ve düşük olmak üzere üç farklı kontaminasyon
seviyesi ile kirletilmiş ve buralardan elde edilen ATP biyoluminesans RLU değerleri ve
klasik metot ile sayılan kob değeri karşılaştırılmıştır. Elde edilen bulgular metodun
performansının mikroorganizma yükü, yüzeydeki kirlilik ve florada mevcut bulunan
mikroorganizma türüne göre farklılık gösterdiğini kanıtlamıştır. Buna göre metot
fiziksel kir bulunmayan ve yüksek mikroorganizma seviyesinde daha güvenilir sonuçlar
vermektedir. İncelenen mikroorganizma türleri içerisinde en anlamlı sonuçlar
Salmonella taşıyan yüzeylerden elde edilmiştir.
Anahtar Kelimeler: ATP Biyoluminesans, Gıda Hijyeni, Hijyen Monitor, Kanatlı, Hızlı
metot
Bu çalışma, İstanbul Üniversitesi Bilimsel Araştırma Projeleri Birimi tarafından
desteklenmiştir. Proje No: 14970
xii
ABSTRACT
Öz, P. (2015). Evaluation of the Performance of ATP Bioluminescense Hygiene
Monitoring System by Comparing with Conventional Microbiological Method (Swap).
Istanbul University. Institute of Health Science. Department of Food Hygiene and
Technology. Master Degree Thesis. İstanbul.
Application of an appropriate hygiene practice and verification of the practice is
a major necessity for food safety. Therefore, researchers put significant effort on
development of rapid and reliable alternative methods to meet the requirement of
routine hygiene monitoring in food production. ATP bioluminescense hygiene
monitoring method is widely accepted in this area due to its rapid results and easy
applicability. In this study, the performance and the applicability of ATP
bioluminescense method was compared with conventional swabbing method. For this
aim, stainless steel surfaces have been contaminated with high, medium and low
contamination levels of four different microorganisms. The RLU values recorded with
ATP bioluminescense method and the cfu values counted with conventional method
were compared. Results indicated that the performance of method has differed for
microorganism load, contamination level of the surface and the species of
microorganism in the flora. According to our results ATP bioluminescense gives more
reliable results in surface which do not have any physical dirth and contaminated with
high level of microorganisms. The most reliable results were obtained from Salmonella
contaminated surfaces.
Key Words: ATP Bioluminescense, Food Hygiene, Hygiene monitoring, Poultry, Rapid
method
This Project was supported by Research Fund of Istanbul University, Project No:
14970
1. GİRİŞ VE AMAÇ
Son yıllarda tüketici farkındalığının da artmasıyla gıda endüstrisinde gıda
güvenilirliği öncelikli amaç haline gelmiştir. Gıda işletmelerinde besin değerini
yitirmemiş ve hijyenik özellikleri korunmuş güvenilir gıda üretmek ve üretiminin
devamlılığını sağlamak amacıyla işletme koşullarının standardizasyonu ve bu koşulların
rutin kontrolünün kolaylaştırılmasına yönelik teknolojik çalışmalar yapılmaktadır.
Gıdaların hammaddeden başlayarak üretim, işleme, saklama, taşıma ve dağıtım
aşamalarında gerekli hijyen kurallarının uygulanması ve önlemlerin alınması gıda
güvenilirliğinin ana teması olarak kabul edilmektedir (Serpen 2007; Keeratipibul ve ark.
2009).
Gıda ürünleri “çiftlikten çatala” kadar olan bu üretim sürecinde çok sayıda
fiziksel, kimyasal ve mikrobiyolojik tehlikeye maruz kalabilmektedir. Gıdalara
sonradan bulaşan bu tehlikeler “gıda kontaminantları” olarak adlandırılmaktadır.
Özellikle mikrobiyolojik tehlikeler başlığı altında yer alan bakteri, virus, parazit gibi
gıda patojenleri gıda zehirlenmelerinin temel etmenleridir (Giray ve Soysal 2007;
Serpen 2007).
Günümüzde
yaygınlaşan
gıda
kaynaklı
zehirlenme
vakalarının
önüne
geçilebilmesi ancak, hammadde üretiminden başlayarak, tüketiciye ulaşıncaya kadar ki
süreçte gıda işletmelerinin üretim proseslerinde uluslararası kalite ve gıda güvenilirliği
yönetim sistemi standartlarını uygulamalarıyla gerçekleşebilmektedir (Rosmini ve ark.
2004).
Gıda güvenilirliği yönetim sistemlerinin önemli bir aşaması olan doğrulama
süreçleri, hijyen uygulamalarında periyodik doğrulamaların yapılmasını zorunlu
kılmaktadır. Bu faaliyet için klasik mikrobiyolojik metotlardan yararlanılması, gerek
çok uzun sürmeleri, gerekse önemli iş yükü getirmesi sebebiyle çok pratik değildir. Bu
amaçla, bu metotların yerine kullanılabilecek alternatif hızlı metotların geliştirilmesi
önemli bir araştırma konusu olmuştur (Rosmini ve ark. 2004).
Klasik metotlara kıyasla daha hızlı, pratik ve kolay uygulanıyor olması
nedeniyle geliştirilen bu alternatif metotlar üretim yerlerindeki hijyenin doğrulanmasını
ve dolaylı olarak gıdalarda varolan patojenlerin sebep olduğu gıda kaynaklı
2
zehirlenmelerin de daha kısa sürede tespit edilmesini sağlamaktadır. Yüzey hijyeninin
doğrulanmasında yaygın kullanım alanı olan alternatif metotlara örnek; klasik swap
metodu, 3MTM PetrifilmTM, CompactDry, Contact Plate, Dipslide, DEFT, ELISA, PCR
ve ATP biyoluminesans hijyen görüntüleme metodudur (Ünlütürk ve Turantaş 1999;
Jasson ve ark. 2010).
Bu alternatif metotlardan ATP biyoluminesans yöntemi 1960’lı yıllardan bu
yana biyolojik proseslerdeki mikrobiyel aktivitenin online teknik kullanılarak
ölçümünün yapılması amacıyla önerilmiştir (Chu ve ark. 2001).
Enzim
_
substrat kompleksi olan lusiferin
_
lusiferaz ile ATP’nin reaksiyona
girerek kimyasal enerjiyi ışık enerjisine dönüştürmesi ve bu şekilde açığa çıkan ışığın
şiddetinin, lüminometre ile ölçülmesi prensibine dayanan metot gıda endüstrisinde
yaygın kullanım alanı bulmuştur (Griffith ve ark. 1997).
Bu metot gıda endüstrisi içinde gıda kaynaklı zehirlenmelerin sıklıkla rastlandığı
ürünlerin başında gelen kanatlı eti üretimi sektöründe de kullanım olanağı sunmaktadır
(İşeri ve Erol 2009). Bu sektörde uygulanan kalite ve gıda güvenilirliği yönetim
sistemleri kapsamında, hem işgücü hem de zamandan kazanç sağlayarak, hijyen ve
sanitasyon uygulamalarının doğrulanmasında kullanılmaktadır (Sala ve ark. 2008).
Bu çalışma ATP biyoluminesans hijyen görüntüleme metodunun performansının
ve uygulanabilirliğinin klasik metot ile karşılaştırılmak suretiyle incelenmesi amacıyla
gerçekleştirilmiştir. Bu doğrultuda yapay olarak farklı mikroorganizmalarla kirletilmiş
deneysel ortamlardaki kirlilik seviyesi her iki metot kullanılarak karşılaştırılmıştır.
Ayrıca ATP biyoluminesans hijyen görüntüleme metodunun gıda işletmelerindeki
kullanım olanaklarının değerlendirilmesi amacıyla bir kanatlı kesimhanesinin doğal
kontamine üretim alanlarından alınan numuneler yine her iki metot karşılaştırılarak
incelenmiştir.
3
2. GENEL BİLGİLER
2.1. Gıda Güvenilirliği ve Gıda Hijyeninin Tanımı
Gıda güvenilirliği, sağlıklı gıda üretebilmek amacıyla gıdaların, hammaddeden
başlayarak, üretim, işleme, depolama, taşıma ve dağıtım aşamalarında gerekli hijyen
kurallarına uyulması ve önlemlerin alınması olarak belirtilmekte ve sağlığa yararlı olma
durumu korunmuş gıda kavramını içermektedir (TSE 2003; TSE 2006; Serpen 2007).
Bu doğrultuda, güvenilir gıda üretme çabası ile gıdaların güvenilirliklerini
olumsuz yönde etkileyecek faktörlerin ortadan kaldırılması ya da en az düzeye
indirilmesi amaçlanmaktadır (Güder 2006; Keeratipibul ve ark. 2009).
Türk Gıda Kodeksi, Gıda Hijyeni Yönetmeliği’nde gıda hijyeni; tehlikenin
kontrol altına alınması ve gıdaların kullanım amacı dikkate alınarak, insan tüketimine
uygunluğunun sağlanması için gerekli her türlü önlem ve koşullar olarak
tanımlanmaktadır (Anonim 2011).
2.2.
Gıda Güvenilirliği Tehlikeleri
5996 sayılı Veteriner Hizmetleri, Bitki Sağlığı, Gıda ve Yem Kanunu’nda
tehlike; sağlık bakımından olumsuz etki yaratma potansiyeli bulunan, gıda ve yemdeki
biyolojik, kimyasal veya fiziksel etmenler ile gıda ve yemin durumu olarak
tanımlanmaktadır (Anonim 2010).
Gıdalardan kaynaklanan riskler gıdanın üretimden tüketim aşamasına kadar
geçirdiği işleme, taşıma, depolama, satın alma, saklama, hazırlama, pişirme
aşamalarında ayrı ayrı değerlendirilmekte ve fiziksel, kimyasal ve biyolojik tehlikeler
olarak gruplandırılmaktadır (Güder 2006; Serpen 2007; Engez ve Ergönül 2009).
2.2.1. Fiziksel Tehlikeler
Gıdalarda bulunmaması gereken cam kırıkları, metal parçaları ve tozları, plastik,
kemik, kâğıt, taş, toprak, tahta, saç, tırnak, sinek, böcek ve boya kalıntıları gibi yabancı
maddeler fiziksel tehlikelerdir. Bunlar hammadde elde edilmesi, üretim, saklama,
paketleme, taşıma veya tüketim aşamalarında çevreden gıdalara bulaşabilmekte veya
hile amacıyla eklenebilmektedir (Giray ve Soysal 2007; Özkaya ve Cömert 2008; Engez
ve Ergönül 2009).
4
2.2.2. Kimyasal Tehlikeler
Gıdalarda bulunan tehlikeli kimyasallar çok çeşitlidir ve bunlar gıdaya ve yeme,
üretim, işleme, taşıma, hazırlama ve tüketim aşamalarının herhangi bir noktasında
bulaşabilmektedir. Son yıllarda, bitki koruma ürünlerinin kalıntıları, doğal toksik
maddeler (mikotoksinler, bitki toksinleri vb.), işleme sırasında oluşan toksinler
(akrilamid, heterosiklik aromatik aminler, furanlar vb.), gıda alerjenleri, ağır metaller
(kurşun, arsenik, civa, kadmiyum vb.), endüstriyel kimyasallar (dioksinler, benzen,
perklorat vb.), ambalaj materyallerinden geçen maddeler ve hile amaçlı katılan
maddeler (melamin vb.) gibi kimyasallar gıda güvenilirliğini, dolayısıyla halk sağlığını
tehdit etmektedir (Ünlütürk ve Turantaş 1999; Çömlekoğlu ve ark. 2000).
Yılmaz ve ark. (2006)’nın çalışmalarının sonuçları, 1 yıllık bir süre içerisinde
tespit edilen akut zehirlenme vakalarının %9’unun tarım ilacına, %24’ünün gıda ve
mantar zehirlenmesine bağlı oluştuğunu göstermiştir.
Benzer olarak, Özcan ve İkincioğulları (2009), 2008 yılı içerisinde gıdalardan
kaynaklanan zehirlenme başvuru sayısını toplam 2590 olarak bildirmişler ve bu
başvuruların 185’inin kimyasal bulaşlar ve 428’inin gıda ve gıda katkı maddeleri ile
ilişkili olduğunu açıklamışlardır.
2.2.3. Mikrobiyolojik Tehlikeler
Halk sağlığı açısından büyük bir risk haline gelen mikrobiyel tehlikeler, patojen
bakteriler, küf ve mayalar,
viruslar ve parazitler dolayısıyla ortaya çıkmaktadır.
Mikroorganizmalar gıdalara fekal kontaminasyon, hasta hayvanların et ve sütünün
tüketilmesi, enfekte yaralar, çöpler, kirli sular, kontamine alet-ekipmanlar, haşere,
kemirgen, toprak ya da evcil hayvanlar ile bulaşabilmektedir (Özkaya ve Cömert 2008).
Özcan ve İkincioğulları (2009)’nın ‘Ulusal Zehir Danışma Merkezi 2008 Yılı
Çalışma Raporu Özeti’ne göre, toplam 2590 gıda kaynaklı zehirlenme başvurusunun
493 adedinin mikroorganizmalardan ya da toksinlerinden kaynaklandığı bildirilmiştir.
Mikroorganizmalar gıdalarda iki
bozulmaları ve gıda kaynaklı zehirlenmeler.
şekilde tehlike oluşturmaktadır;
gıda
5
2.2.3.1. Gıda Bozulmaları
Gıdalarda bozulma, gıdanın yapısında bulunan protein, karbohidrat ve yağlarla,
çeşitli organik asitler, alkoller, aldehitler, selüloz ve pektin gibi bileşiklerin
yıkımlanması sonucu gıdada istenmeyen bir görünüş, tat ve kokunun ortaya çıkması
olarak tanımlanmaktadır (Özkaya ve Cömert 2008).
Mikrobiyel bozulma sebepleri bakteriler ya da küf ve mayalar olabilmektedir.
Mikroorganizmalar
gıdaların
fiziksel,
kimyasal
ve
duyusal
özelliklerini
değiştirmektedir. Fiziksel ve kimyasal bozulmalar, nem içeriği düşük veya orta düzeyde
olan gıdaların raf ömrünü sınırlarken, nem içeriği yüksek ve su aktivitesi (aw)>0,85
olan gıdalarda bakteri, maya ve küflerin yol açtığı mikrobiyel bozulmalar ortaya
çıkabilmektedir (Özkaya ve Cömert 2008).
Süt ürünleri, kırmızı et, kanatlı eti, balık ve diğer su ürünleri gibi yüksek protein
değerine sahip ürünler mikrobiyel bozulmaya karşı daha duyarlıdır (Kaymaz 1987;
Bostan ve ark. 2001; Çaklı ve Kışla 2003).
2.2.3.2. Gıda Zehirlenmeleri
Gıda zehirlenmesi herhangi bir besin maddesinin tüketimi sonucu meydana
gelen enfeksiyon veya intoksikasyon durumudur. Gıda enfeksiyonları, zararlı
bakterilerin
ürediği
gıdanın
tüketilmesi
sonucu
oluşan
rahatsızlıkları,
gıda
intoksikasyonu ise toksin üreten bazı bakterilerin ürettiği toksini taşıyan gıdanın
tüketilmesi ile oluşan zehirlenmeleri ifade etmektedir (Codex Alimentarius/WHO 2011;
WHO 2013).
Biyolojik etmenle hastalık oluşabilmesi için gıdanın mikroorganizmanın
gelişmesine elverişli olması, mikroorganizmanın sayısının yeterli olması, ısı, zaman,
nem, pH, oksijen basıncı gibi uygun çevre koşullarının sağlanması, gıda maddesine
mikroorganizma ya da toksinleri yok edecek asepsi, filtrasyon, ısı, radyasyon gibi
işlemlerin uygulanmamış olması ve gıdanın konakçı tarafından yenmesi gerekmektedir
(Güler ve Çobanoğlu 1994).
Gıda maddesinde mikroorganizma yükünün fazla olmasının nedenleri olarak,
yetersiz ısı işlemi, kontamine malzemeler, uygun olmayan ortamlarda muhafaza,
yetersiz işleme, çapraz kontaminasyon ve hijyen eğitimi verilmeyen personel
sayılabilmektedir (Uğur ve ark. 2001; Erol 2007).
6
Gıda kaynaklı zehirlenme vakalarının %46’sı yetersiz soğutmaya, %21’i üretim
ve tüketim arası sürenin uzatılmasına, %20’si enfekte personele, %16’sı yanlış ısı
uygulamasına, %16’sı yetersiz ısıtma ve pişirme işlemlerine, %11’i kontamine malzeme
kullanımına, %7’si çapraz kontaminasyona ve %7’si yetersiz hijyen uygulamalarına
bağlıdır (Öğüt ve Polat 2009).
Sağlık Bakanlığı istatistikleri 2005 yılı verilerine göre ülkemizde etkeni
Salmonella typhi olan 5168 klinik tifo vakası ve 10.514 olası tifo vakası bildirilmiştir.
Mikroorganzimaların neden olduğu salgın vakalarında Staphylococcus aureus,
Escherichia coli, Salmonella spp., Clostridium perfiringens, Listeria monocytogenes en
sık izole edilen mikroorganizmalardandır (Kartal 2010).
Amerika’da her yıl patojen bakterilerle kontamine gıda tüketimi nedeniyle 48
milyon hastalık vakası oluştuğu ve bu vakalardan 3000 adedinin ölüm ile sonuçlandığı
bildirilmiştir (USDA 2013).
Amerika’da gıda kaynaklı hastalıklara neden olan Campylobacter spp.,
Cryptosporidium spp., Cyclospora spp., L. monocytogenes, Salmonella spp., E. coli
O157, Shigella spp., Vibrio spp. ve Yersinia spp. gibi patojen bakterilerin 2006-2013
yılları boyunca enfeksiyon oluşturma insidensinin incelendiği bir çalışmada 2013
yılında 19.056 adet gıda kaynaklı enfeksiyon vakasının olduğu, bunlardan 4200’ünün
hastanede yatarak tedavi edildiği ve 80 adet vakanın ise ölüm ile sonuçlandığı
bildirilmiştir (Centers for Disease Control 2014).
2.3.
Gıda İşletmelerinde Gıda Güvenilirliğini Güvence Altına Alan Sistemler
Günümüzde gıda üretimi ve dağıtımı işi ile uğraşan kuruluşlar açısından gıda
zincirinde güvenilirlik ve hijyen, rekabet ve rekabetin sürdürülebilirliğinin sağlanması
açısından büyük önem taşımaktadır. Bu durum gıda güvenilirliği ve gıda zinciri
boyunca kalite yönetim sistemleri ve programlarının gerek ulusal gerek uluslararası
düzeyde uygulanmasını gerektirmektedir (Serpen 2007; Erkan ve ark. 2008; Karaman
ve ark. 2011).
Bu sistemlerin gıda endüstrisinde kullanılan başlıcaları Uluslararası Standartlar
Organizasyonu (ISO) tarafından yayınlanan ISO 9000:2005 Kalite Yönetim Sistemi,
ISO 22000 Gıda Güvenliği Yönetim Sistemi ve çeşitli organizasyonların standartlarıdır
(TSE 2006; ISO 2009a; BRC 2015).
7
Codex Alimentarius Komisyonu tarafından geliştirilen HACCP sistemi,
ülkemizde Türk Standartları Enstitüsü (TSE) tarafından TSE 13001 adı altında ulusal
bir gıda güvenliği standardı olarak yayınlanmıştır (TSE 2003). İlk uluslararası Gıda
Güvenliği Standardı ise HACCP prensiplerini temel alan ISO 22000 standardı olup, ISO
tarafından yayınlanmıştır (TSE 2006).
Uluslararası geçerliliği olan bu standartlar ile halk sağlığı açısından önemli olan
kalite kontrol ve belgelendirme sistemlerinde güncelleme çalışmalarına başlanmıştır
(TSE 2003; Cevizci ve Önal 2009). Türkiye de dahil olmak üzere bir çok ülkedeki
üreticiler hem yeni müşteri beklentileri doğrultusunda hem de uluslararası piyasalarda
daha çok yer alabilmek amacıyla, tesislerinde Gıda Güvenliği Yönetim Sistemleri’nin
uygulanmasını yaygınlaştırmış ve bu sistemlerin gereği olarak gıda risklerini kabul
edilebilir düzeylere indirebilmek için sistematik yaklaşımlarla işletmelerine özgü bazı
gıda güvenilirliği programları oluşturmuşlardır (Karaman ve ark. 2011). Bu yaklaşımla
hazırlanan ve HACCP prensiplerinin de yer aldığı ISO 22000 Gıda Güvenliği Yönetim
Sistemi, gıda zincirinin her aşamasında uygulanabilmektedir (TSE 2006).
Bahsedilen
bu
standartlarda
gıda
güvenilirliğinin
ve
gıda
hijyeninin
sağlanabilmesi için hammaddeden ürünün işlenmesine ve tüketiciye sunulmasına kadar
olan tüm aşamalarda etkin kontrol önlemlerinin alınması gerekmektedir (Uğur ve ark.
2001; Koçak 2007; Cevizci ve Önal 2009).
Bu kontrol önlemleri kapsamında gıda işletmelerinde hijyen ve sanitasyon
kurallarına uyulması, temizlik ve dezenfeksiyon uygulamalarının belli bir program
çerçevesinde, işletme ve prosese uygun ve etkin bir şekilde gerçekleştirilmesi gibi
gereklilikler önemli bir yer tutmaktadır (TSE 2003; TSE 2006; Topalakçı 2007).
Bu sistemlerin önemli bir ayağını da yerine getirilen faaliyetlerin uygunluğunun
belirlenmesi için yapılan doğrulama aktiviteleri kapsar. Bu kapsamda hijyen doğrulama
özel bir öneme sahiptir (TSE 2006; ISO 2009b; BRC 2015).
2.4.
Gıda İşletmelerinde Hijyen Uygulamalarının Doğrulanması İçin Kullanılan
Metodlar
Hijyen doğrulama; gıda işletmelerindeki kontrol sisteminin önceden planlanan
sisteme uygun olarak gerçekleştirilip gerçekleştirilmediğini belirlemek için, numune
alma ve analiz metodları da dahil olmak üzere izleme, ölçme, deney metodlarının
8
kullanılması olarak tanımlanmaktadır. Bu kapsamda doğrulama metotları kullanılarak
hijyen uygulamalarının etkinliğinin belirlenmesi tüm gıda güvenliği standartlarının bir
şartıdır (TSE 2006; ISO 2009b; BRC 2015).
Doğrulanma aşamalarının gerekliliğine ve önemine ISO 22000 Gıda Güvenliği
Yönetim Sistemi ve çeşitli organizasyonların (BRC-IFS) standartları gibi bir çok
uluslararası standartta da yer verilmiştir (TSE 2006; IFS 2014; BRC 2015). Nitekim
gıda güvenilirliğini sağlamaya yönelik hazırlanmış mevzuatların bir çoğu da gıda
güvenliği yönetim sisteminin etkinliğini arttırmak ve sürekliliğini sağlamak için ön
gereksinim programlarının ve doğrulama aşamasının da yer aldığı diğer programların
gerçekleştirilmesini gerekli kılmaktadır (Güder 2006; TSE 2006; Karaman ve ark.
2011).
Doğrulama metodlarında aranan özelliklerin başında doğruluk, duyarlılık, düşük
tespit limiti ve hızlı sonuç alınabilmesi yer almaktadır (Noble ve Weisberg 2005; Chen
ve Godwin 2006).
Özellikle kanatlı ve kırmızı et gibi riski yüksek ama raf ömrü bir o kadar kısa
olan ürünlerde riskli noktalardaki mikrobiyolojik yükün kısa süre içinde belirlenmesi,
önlemlerin zamanında alınabilmesi açısından büyük önem taşımaktadır (Efe ve
Gümüşsoy 2005).
Bu amaçla endüstride çeşitli metodlar geliştirilmiş ve kullanılmaktadır.
2.4.1. Kültürel Metot
Kültürel metot, swap çubukları ile alınan örneklerin klasik mikrobiyolojik
yöntemlerle besiyerine ekilmesi ve mikroorganizma gelişiminin izlenmesi ve/veya
sayılmasıdır. Kültürel metot ön zenginleştirme veya dilüsyon hazırlığı, mikrobiyolojik
ekim ve sayım ve/veya ayırıcı tanı için uygulanan biyokimyasal testlerin yer aldığı uzun
proseslerden oluşmaktadır (ISO 2004).
Kusumaningrum ve ark. (2003) Hollanda’da paslanmaz çelik yüzeylerde gıda
kaynaklı patojenleri ve bu patojenlerin çapraz kontaminasyon ile gıdalara transferini
inceledikleri çalışmalarında 107 kob/100 cm2, 105 kob/100 cm2, 103 kob/100 cm2 olmak
üzere 3 farklı kontaminasyon seviyesinde yapay olarak kirletilen yüzeylerden swap ile
aldıkları örneklerin selektif besiyerlerine mikrobiyolojik ekimini yaparak Salmonella
9
enteritidis, S. aureus ve C. Jejuni’nin paslanmaz çelik yüzeylerde gelişimini
incelemişlerdir.
Dümen ve Çetin (2009) Türkiye’nin 5 farklı coğrafik bölgesinde bulunan unlu
mamül işletmelerindeki temas yüzeylerinin mikrobiyolojik kirliliğini araştırdıkları
çalışmalarında toplam 14.389 adet yüzey örneğini incelemişlerdir. Buna göre, toplam
aerob mezofil bakteriyi 2380 örnekte (%16,5), toplam koliform grubu bakteriyi 1215
örnekte (%8,5), E. coli’yi 1585 örnekte (%11), S. aureus’u ise 2037 örnekte (%14)
kabul edilemez olarak değerlendirmişlerdir.
Moore ve Griffith (2002), paslanmaz çelik yüzeylerden klasik metot ile
mikroorganizma tespitini etkileyen faktörleri inceledikleri çalışmada, ıslak ve kuru
swaplarla yüzeylerdeki bakteri sayısını değerlendirmişler ve ıslak swaplarla yapılan
çalışmanın daha güvenilir olduğunu tespit etmişlerdir.
Kültürel metot doğru sonucu vermesine karşın zahmetli olması ve uzun zamanda
sonuçlanması nedeniyle HACCP sisteminde rutin yüzey temizliğinin izlenmesinde
pratik değildir. Bu durum araştırmacıları hızlı test tekniklerinin geliştirilmesi konusuna
yönlendirmiştir (Moore ve ark. 2010; Aras 2011).
2.4.2. 3MTM PetrifilmTM
Petrifilm üzerinde soğuk suda çözünebilen spesifik besiyeri bulunan ince plastik
filmlerdir. Petri kaplarına kıyasla gerek ince oluşu, gerek inkubatörde daha az yer
kaplaması gibi avantajları ile öne çıkmaktadır. İnkubasyonun ardından spesifik renkli
koloniler filmin arka yüzünden çıplak gözle kolaylıkla sayılabilmektedir. Hepsi birarada
olarak tanımlanan bu sistemde mikroorganizma türlerine göre koloni oluşumunu
sağlayacak farklı petrifilmler kullanılmaktadır (Schmelder ve ark. 2000; Rosmini ve
2004; Silva ve ark. 2005; Nyachuba ve Donnelly 2007; Nero ve ark. 2008).
Nyachuba ve Donnelly (2007) paslanmaz çelik, yapay reçine, briket ve tahta
özellikte ve 100 cm2’lik 4 farklı yüzeyden aldıkları örneklerin L. monocytogenes
identifikasyonu için 3MTM PetrifilmTM metodunu klasik metot ile karşılaştırdıkları
çalışmalarında metodlar arasında önemli bir fark olmadığını tespit etmiş ve gıda
işletmelerinde yüzey örneklerinden L. monocytogenes identifikasyonunda her iki
metodun da kullanılabileceğini belirlemişlerdir.
10
Benesh ve ark. (2013) çalışmalarında paslanmaz çelik yüzeylerden aldıkları 20
adet örneği Listeria identifikasyonu için düşük ve yüksek kontaminasyon seviyelerinde
değerlendirmişlerdir. Petrifilm metodunu Kanada’nın ulusal referans metoduyla
karşılaştırdıkları bu çalışmada iki metot arasında anlamlı bir fark bulmadıklarını
bildirmişlerdir.
Bu metot da uygulama kolaylığı getirmekle beraber 35ºC’de 24-48 saat’lik uzun
inkubasyon süresi gerektirmektedir.
2.4.3. Compact Dry
Dehidre edilmiş agar ve supplementleri içeren küçük çukurlardan oluşan plastik
yapılardır. Petrifilm ile benzerlik göstermekle birlikte daha ince, parlak ve ergonomik
yapıdadır. İnkubasyon süresinin sonunda kromojenik substrat ve redoks indikatörünün
varlığı ile farklı renklerde gelişen kolonilerin kolayca tayini prensibine dayanmaktadır
(Beuchat ve ark. 1998).
Ayçiçek ve ark. (2006) GATA’daki hastane mutfağındaki yüzeylerde toplam
bakteri sayımı için Compact Dry-TC metodunu kullanmışlardır. Kültürel metot ile
benzer sonuçlar göstermesi ve petride hazır agar şeklindeki pratik kullanımı
düşünüldüğünde bir avantaj olarak görülmüş, ancak 35ºC’de 48 saat süren uzun
inkubasyon süresinin bir dezavantaj olduğu kanısına varılmıştır.
2.4.4. Hazır Agarlı Plakalar
Yüzey hijyeninin doğrulanmasında kullanılan yöntemlerden biri olan hazır
agarlı plakalar zemin, duvar, gıdayla temas eden çalışma tezgahları, personel eli gibi
özellikle düz yüzeylerin kontamine ve/veya enfekte olup olmadığının belirlenmesi,
mikrobiyel yükünün ve uygulanan temizliğin etkinliğinin ölçülmesi gibi analizlerde
kullanılmaktadır. Hazır agarlı plakalar, örneklemede kullanılacak olan konveks yüzünde
agar olan petri kapları şeklindedir. Benzer amaçla kullanılan plastik agar çarkları ile
işletmelerde kullanılan alet ve ekipmanların girintili çıkıntılı bölmelerinde de örnekleme
yapabilirken, hazır agarlı plakalar metodunda örnekleme yalnızca düz yüzeylerde
yapılabilmektedir (Kastango ve Faylor 2000).
Hazır agarlı plakalardan dipslide yöntemi ise içerisinde hazır bulunan agarın
örnekleme yapılacak yüzeye, personelin eline, personel çalışma kıyafetlerine direkt
11
teması ve inkubasyon süresinin ardından verdiği sonuç ile görüntülenmesi esasına
dayanmaktadır (Taban ve Aytaç 2008; Arda ve Aydın 2011).
Carroscosa ve ark. (2012) çalışmalarında İspanya’daki beş farklı peynir üretim
yerinin dört farklı üretim hattındaki toplam aerob mezofil bakteri kontaminasyonunun
seviyesini tespit etmek amacıyla contact plate, dipslide ve ATP biyolüminesans
metotlarını karşılaştırmışlardır. Özelllikle contact plate ve dipslide metotları
karşılaştırıldığında birçok yüzey örneğinde benzer ve anlamlı sonuçlar tespit
etmişlerdir.
Benzer olarak, Salo ve Laine (2000) Finlandiya’da yapay olarak kirletilen
paslanmaz çelik yüzeylerde 3 farklı kontaminasyon seviyesi ve 3 farklı inkubasyon ısısı
ve süresi boyunca dipslide, contact plate ve klasik metodu karşılaştırdıkları
çalışmalarında 3 metodun da benzer sonuçlar verdiğini ve klasik swap ile örnekleme
metodunun dipslide ve contact plate metodlarına göre daha az tekrarlanabilir ve
tekrarüretilebilir olduğunu
belirlemişlerdir. Kültürel metot ile benzer sonuçlar
göstermesi, jel agar preperatı şeklindeki pratik kullanımı düşünüldüğünde bir avantaj
olarak görülmüş ancak analizi yapılan bakteriye göre değişmekle beraber uzun
inkübasyon süresi gerektirmesinin metot için bir dezavantaj olduğu kanısına varılmıştır.
2.4.5. Direkt Epifloresan Filtre Tekniği (DEFT)
DEFT bir mikroskopik hücre sayımı yöntemidir. Deterjanlar ve proteolitik
enzimler gibi ön-işlenmiş örnekler bir polikarbonat membran üzerinde filtre edilmekte
ve mikroorganizmaların bu membran üzerinde toplanması sağlanmaktadır. Filtre
yüzeyinin kontrolünde ışık aydınlatma (epifloresans) kullanılmaktadır. Bu tetkik
mikroskobun
bir
görüntü
analiz
sistemine
bağlanması
ile
otomatik
hale
getirilebilmektedir. Esas boyama ve sayma işlemi 0,5-1 saatten az sürmektedir ancak
numune ön işlem aşamaları toplam algılama süresini uzatmaktadır. Tespit sınırı 104-105
hücre/ml olarak belirlenmiştir (Pettipher ve ark. 1992; Sierra ve ark. 1997; Rosmini ve
ark. 2004).
Holah ve ark. (1988) gıdalarla temas eden yüzeylerdeki bakteri yükünü tespit
etmek
amacıyla
DEFT
metodunu
klasik
canlı
bakteri
sayımı
metoduyla
karşılaştırmışlardır. Buna göre DEFT metodunun yüzeylerde nikroorganizma sayılarını
12
belirlemedeki hata oranının klasik canlı bakteri sayımı metoduna göre çok daha düşük
olduğunu tespit etmişlerdir.
Mikrobiyel hücrelerin varlığının belirlenmesinde çok hızlı bir yöntem olan
DEFT metodunun, standart kültürel metot ile karşılaştırıldığında canlı ve ölü hücreleri
beraber sayması gibi bir dezavantajı bulunmaktadır (Yücel ve Halkman 2006).
2.4.6. Enzimle Bağlı Immunosorbent Ölçüm Metodu (ELISA) ve Enzimle Bağlı
Floresan Ölçüm Metodu (ELFA)
Enzimle işaretli antijen ya da antikorun serbest antijen ya da antikor ile
reaksiyona girmesi ve oluşan antijen antikor kompleksinin enzim aktivitesinin enzime
spesifik substrat varlığında ortaya konması, esasına dayanan ölçüm tekniğidir. Farklı
adımlardan oluşan bu metot ile hedef antijeni bilinmeyen örneğin, antikorla bağlanması
amaçlanmaktadır. Bağlanmayan antijenler yıkama basamağı ile uzaklaştırılmaktadır.
İkinci adımda antikor ve hedef antijen çukurlara yerleştirilmektedir. Bu adımı enzimle
barkodlanan ikinci antikorun eklenmesi takip etmektedir. İkinci antikor bir önceki
antikorun bağlanmasını sağlamaktadır. İkinci antikorlardan bağlanmayanlar yine
yıkama basamağında temizlenmektedir. Son adımda enzimle reaksiyona girerek
belirleyici bir sinyal vermesi için substrat ilave edilmektedir. ELISA metodu ile 2-3 saat
içerisinde antijen belirlenebilmektedir (Thacker ve ark. 1996; Lilja ve Hanninen 2001;
Kumar ve ark. 2008; Szabo ve ark. 2008).
Slade (1992) bir gıda üretim yerinde gıdayla temas eden yüzeylerde, zeminde,
drenlerde ve konveyörlerde Listeria gelişimini incelemiş olduğu çalışmasında,
izolasyon metodlarından FDA ve ELISA metodlarını karşılaştırmış ve sonuç olarak
ELISA metodunun tüm Listeria pozitif örneklerin tespitinde uygun olmadığı ve
metottan ancak kültürel metot ile birlikte kullanıldığı sürece faydalanılabileceği
kanısına varmıştır.
Duncanson ve ark. (2003) Birleşik Krallık’da satış yerlerinden alınan 24 adet
yüzey ve 6 adet personel eli örneklerinden Salmonella spp. izolasyonu ve
identifikasyonunda immunomanyetik ayırma ve enzim immunasssay (AIMS-EIA)
metodunu kültürel swap metodu ile karşılaştırmışlardır. Çalışmanın sonuçlarına göre 24
adet yüzey örneğinden 14’ü klasik metot ile, 13’ü ise immunomanyetik ayırma ve
enzim immunasssay (AIMS-EIA) metodu ile pozitif sonuç vermiştir. İmmunomanyetik
13
ayırma ve enzim immunasssay (AIMS-EIA) metodunun 24 saat olan analiz süresinin ön
zenginleştirme basamaklarıyla 72-96 saate kadar varan kültürel metottan daha kısa
olması avantaj olarak belirlenmiştir.
Son yıllarda kullanılan birçok ELISA kiti yüksek standartta ve otomatik olması
ile hız ve verimi arttırmakta, insan hatalarını da azaltmaktadır. ELISA metodunun
prosedürü ile çalışabilen, L. monocytogenes, Salmonella, E. coli O157:H7,
Staphylococcal enterotoxin, ve Campylobacter tespiti yapabilen ve daha hassas bir
florasan immunassay ile otomatik çalışan ELFA (VIDAS) sisteminin ise; test kitine
göre değişen 45 dk ile 2 saat arası bir inkübasyon süresi ile analiz yapabilmesi, fazla
sayıda solvent gerektirmemesi ve uygulamasının basit olması gibi avantajları da
bulunmaktadır (Fung 2002).
2.4.7. Polimeraz Zincir Reaksiyonu (PCR)
PCR metodu DNA polimeraz zincirinin DNA iplikçiği kopyalamak prensibine
dayalı 1980’li yıllarda tanımlanan bir metottur. Her döngüde çift zincirli DNA, tek
DNA iplikleri üretmek için ısıtılarak denatüre edilmektedir. Daha sonra reaksiyon
karışımı primerlerin tek ipliklilere bağlanabilmesi için soğutulmaktadır. Bu sırada ısıya
dayanıklı, sentez yapabilen DNA polimerazı tekrar çift iplikçik oluşturabilmesini
sağlamaktadır. Kopyalanan DNA konvansiyonel olarak agaroz jel elektroferez ile tespit
edilmektedir (Mullis ve Faloona 1987; Harris ve Griffiths 1992; Hanna ve ark. 2005).
PCR metodunun mikrobiyoloji alanında da kullanımı söz konusudur. Örneğin
Bonaventura ve ark. (2008) L. monocytogenes’in paslanmaz çelik, cam, poliester
yüzeylerde biyofilm oluşturabilme özelliğini tespit etmek amacıyla yapmış oldukları
çalışmada PCR metodunu kullanmışlardır. Buna göre 37ºC’de cam ve paslanmaz çelik
yüzeylerdeki biyofilm seviyesi poliester yüzeylere kıyasla daha yüksek çıkmış gıda
endüstrisinde önemli bir risk olan L. monocytogenes’in biyofilm oluşturabilme
özelliğinin sıcaklık artışıyla doğru orantılı olduğu PCR metodu kullanılarak
saptanmıştır.
Kültürel metot ile kıyaslandığında, nükleik asit bazlı yöntemlerin en önemli
avantajları kısa sürede sonuç alınabilmesi, hijyen kontrollerinde kontaminasyon
kaynağını gösterebilmesi, canlı hücre gereksinimi olmaması, hasar görmüş hücrelerin de
tespit edilebilmesi ve spesifik bir teknoloji ile çalışmalarından dolayı doğruluk
14
oranlarının yüksek olmasıdır. Bunun yanında bu tekniklerin bazı dezavantajları ise canlı
mikroorganizmaların ölülerden ayırt edilememesi, genetik metotların yalnızca hedef
patojen tespiti yapabilmesi, epidemiyolojik veya rutin çevre kontaminasyonlarında
bakteri identifikasyonu için uygun olmadığı ve PCR metoduyla pozitif bulunan bir
örneğin bir sonraki analizin reaksiyon sistemini kontamine ederek metodun yanlış
pozitif sonuç vermesine neden olabilmesi olarak belirtilmektedir (Fung 2002).
2.4.8. Gerçek Zamanlı Kantitatif Polimeraz Zincir Reaksiyonu (RT-PCR, QPCR)
Gerçek zamanlı kantitatif PCR nükleik asitlerin miktarlarının belirlenmesinde
günümüzde kullanılan bir metottur. Bu teknoloji “kinetik PCR” ve “homogenous PCR”
isimleriyle de tarif edilmektedir. “Real-time PCR”da oluşan ve miktarı reaksiyon
boyunca kopyalanan DNA miktarıyla orantılı olarak artan, floresan boya ve probların
verdiği sinyalin izlenmesiyle anlaşılır ve amplifikasyonun devir sayısı belirli miktardaki
DNA moleküllerinin elde edilmesi için gereklidir. Real-time PCR metodunun kullanım
alanı; patojen saptanması, gen analizi, kromozomlardaki sayısal-yapısal bozuklukların
analizi, kantitatif mRNA analizi, genomik veya viral DNA’ların DNA kopya sayısı
ölçümlerini, allellerin ayırımını veya SNP genotiplemelerini, ilaç tedavisinde etkinliği,
DNA hasar ölçümleri ve son zamanlarda real-time immüno PCR ile protein belirlemesi
olarak sıralanmaktadır (Fung 2002).
Mafu ve ark. (2009) gıda ile temas eden yüzeylerden E. coli O157:H7, L.
monocytogenes ve S. enterica patojenlerinin identifikasyonu için real-time PCR
metodunu standart metot ile karşılaştırdıkları çalışmada yüzeyleri 10 dk ve 16 sa olmak
üzere 2 ayrı süre boyunca kontamine etmişlerdir. Buna göre yüzey kısa süre kontamine
edildikten sonra her iki metot sonuçları birbiriyle benzerlik gösterirken, uzun süre
kontamine edildikten sonra yapılan analizlerde düşük kontaminasyon seviyeleri realtime PCR metodu ile belirlenebilmiş ancak klasik metot ile mümkün olmamıştır.
Gen ekspresyonunda daha hassas, verimli, hızlı ve daha üretken olan real-time
PCR, bugün birçok bilimsel araştırmada kullanılmaktadır. Guilbaud ve ark. (2005)
gerçek zamanlı PCR’ın, bir örnekteki hedef genin kopya sayısının ölçümünde
kullanılabileceğini ve konvansiyonel PCR’la kıyaslandığında daha hassas bir metot
olduğunu belirtmişlerdir. Ancak, oldukça donanımlı bir laboratuvar alt yapısı ve
analizlerin gerçekleştirilmesi, sonuçların doğru yorumlanabilmesi için tecrübeli
15
personel gerektirmektedir. Aksi halde özellikle gıda endüstrisinde uygulanan
kontaminant aranması analizlerinde yanlış pozitif veya yanlış negatif sonuçlar
verebilmektedir (Settanni ve Corsetti 2007; Fach ve ark. 2009; Günel ve Aydınlı 2009;
Kawasaki ve ark. 2009).
2.4.9. ATP Biyolüminesans
ATP biyolüminesans hijyen görüntüleme metodu gıda işletmelerinde üretimin
ve rutin hijyen kontrollerinin yapılacağı yüzeylerde mikrobiyel kontaminasyonun
varlığını tespit etmek amacıyla kullanılan bir metottur. Bu metot ile örneklemenin
yapıldığı
yüzeylerde mikroorganizmalara ait ATP’nin varlığı tespit edilerek
kontaminasyon olup olmadığı belirlenmektedir (Griffith 1993; Hawronskyj ve Holah
1997; Salo ve Laine 2000; Jasson ve ark. 2010).
2.4.9.1. ATP Biyoluminesans Metodunun Prensibi
ATP
biyolüminesans
hijyen
görüntüleme
metodunda
bütün
canlı
organizmaların ATP içermesi ve tüm mikroorganizmalarda hücre içi ATP
konsantrasyonunun belirli bir değer aralığında bulunması ilkelerine dayanılarak
mikrobiyel biomas ölçülmektedir. Metot mikroorganizma hücrelerinde bulunan
ATP’nin lusiferin-lusiferaz enzimi ile reaksiyona girmesi sonucu biyoluminesans ışık
vermesi ve açığa çıkan bu biyoluminesansın bir lüminometre ile ölçülmesi esasına
dayanmakta olup ölçüm birimi RLU (Relatif Işık Ünitesi) olarak ifade edilmektedir
(Stanley 1992; Griffith ve ark. 1994).
2.4.9.2. Biyoluminesans Reaksiyonu
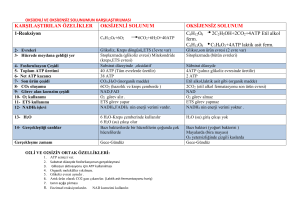
ATP’nin lusiferin-lusiferaz enzimi ile reaksiyona girmesi sonucu ateş böcekleri
(phontinus pylaris) tarafından ışık enerjisi üretilmektedir. Bu ışık verme reaksiyonuna
biyolüminesans denilmektedir. Biyoluminesans reaksiyonunun biyokimyası ilk 1940’lı
yılların sonlarına doğru, lusiferin-lusiferaz reaksiyonu ise ilk 1949 yılında
tanımlanmıştır. Bu reaksiyon ATP (Adenozin Trifosfat)’ye özel bir reaksiyondur ve bu
reaksiyonun gerçekleşebilmesi için enzim-substrat sistemine, oksijene ve bazı kofaktörlere
gereksinim
vardır.
Örneğin
ateş
böceklerinde
ATP’ye
bağımlı
biyolüminesans olayı aşağıdaki gibi gerçekleşmektedir (McElroy 1947; McElroy ve
Strehler 1949).
16
Lusiferaz + Lusiferin + ATP ---- Mg2 ---- → Lusiferaz – lusiferin – AMP + PP
Lusiferaz – lusiferin – AMP + O2 → Oksilusiferin + CO2 + AMP + Işık
Birinci reaksiyonda substrat olan lusiferin normalde ateş böceklerinin kuyruk
kısımlarında bulunmaktadır. Bu reaksiyon sonucunda lusiferaz-lusiferin-adenozin
monofosfat (AMP) okside olarak oksilusiferine dönüşmektedir ve AMP ve CO2 açığa
çıkmaktadır. Bunun sonucu olarak biyolüminesans reaksiyonu görülmektedir (Griffith
1993; Hawronskyj ve Holah 1997).
Bu reaksiyonda açığa çıkan ışık spektrumu içindeki 560 nm dalga boyundaki
ışık maksimum düzeydedir. Reaksiyon için optimum sıcaklık 20-22ºC, optimum pH ise
7,75 arasındadır. Ortamda çinko, kalsiyum, klor, iyot gibi iyonların bulunması ışığı
azaltmaktadır. Reaksiyon sonucu lusiferaz enzimi inaktive olur ve tekrar yeni bir
reaksiyonu katalizleyebilmesi için ko-enzim A ve pirofosfat ile rejenere edilmesi
gerekmektedir (Stanley 1992; Griffith ve ark. 1994).
Sonuç olarak her lusiferin-lusiferaz reaksiyonu sonunda açığa çıkan ışık tek bir
fotondur. Bu nedenle de üretilen toplam ışık şiddeti lusiferin-lusiferaz ikilisi tepkimede
kısıtlayıcı bir faktör oluşturmadığı sürece ortamdaki ATP miktarıyla doğru orantılıdır.
Ortamdaki
ATP
miktarına
bağlı
olarak
açığa
çıkan
ışık
luminometrede
ölçülebilmektedir (Griffith 1993; Griffith ve ark. 1994; Hawronskyj ve Holah 1997).
Biyoluminesans doğada ateş böcekleri dışında deniz bakterilerinde, bazı deniz
canlıları ve tuzlu su balıklarında yaygın olarak görülmektedir. Son yıllarda luminus
bakterilerinin veya lux geni taşıyan rekombinant mikroorganizmaların kullanıldığı
yöntemler de geliştirilmiştir (Ahmad ve Stewart 1991).
2.4.9.3. ATP Biyolüminesans Metodunun Gıda Mikrobiyolojisindeki Uygulamaları
ATP Biyoluminesans yöntemi üzerinde ilk çalışmalar bir Hollanda firması
tarafından yapılmıştır. Bu çalışmalar sonucunda içme ve kullanma suları, meyve suları,
bira gibi sıvı içeceklerde ve fabrikalarda hijyen ve sanitasyon uygulamalarının kontrolü
için özel hazırlanmış kitler piyasaya sürülmüş ve dünyanın pek çok yerinde kullanıma
girmiştir (Ünlütürk ve Turantaş 1999).
Günümüzde ise ATP biyolüminesans metodu özellikle taşınabilir el tipi bir
cihaz olması sayesinde gıda endüstrisinde gerek gıdalarda, gerek yüzeylerde
kontaminasyonun ölçülmesinde geniş bir kullanım alanına ulaşmıştır. Pratik kullanımı
17
ile, işletmedeki yetersiz hijyen ve sanitasyon uygulamaları kısa sürede saptanmakta ve
bu alanların kullanılmadan önce tekrar temizlenmesi veya dezenfekte edilmesi mümkün
olabilmektedir. Bu metot işletmelere kazandırmış olduğu işgücü ve zaman avantajı
sayesinde, geniş bir kullanım sahası bulmuştur (Siragusa ve ark. 1995; Chen ve Godwin
2006; Chollet ve ark. 2008).
Birçok ülkede farklı gıda üretim işletmelerinde ATP biyolüminesans metodunun
kullanım olanaklarının incelenmesi ve hijyen doğrulamadaki etkinliğinin tespiti için çok
sayıda çalışma yapılmıştır (Davidson ve ark. 1999; Moore ve Griffith 2002; Larson ve
ark. 2003; Valat ve ark. 2003; Ayçiçek ve ark. 2006; Chen ve Godwin 2006; Costa ve
ark. 2006; Sala ve ark. 2008; Boyce ve ark. 2009; Moore ve ark. 2010; Lehto ve ark.
2011; Carroscosa ve ark. 2012).
Lehto ve ark. (2011) Finlandiya’da taze doğranmış sebze üretim tesisinde
gerçekleştirdikleri çalışmalarında ATP biyolüminesans metodunu kullanmışlar ve
çalışmalarında gıdayla temas yüzeylerinde hijyenik seviyeyi araştırmışlardır. Elde
ettikleri sonuçlara göre ATP biyolüminesans metodunun düşük kontaminasyon
seviylerinde de ölçüm yapabildiğini ve hassas bir metot olduğunu bildirmişlerdir.
Ayçiçek ve ark. (2006) GATA’daki hastane mutfağında doğal kontamine
yüzeylerde yapmış oldukları çalışmada hem klasik metot hem de ATP metodu ile
hijyenik seviyeyi incelemiş ve iki metodu karşılaştırmıştır. Buna göre aradaki farkın
kabuledilebilir limitlerde ve kullanımının uygun olduğunu ifade etmişlerdir.
2.5.
Kanatlı Endüstrisi
2.5.1. Kanatlı Kesimhanelerinde Hijyen Uygulamaları
Tavuk eti ve ürünleri tüketiminin gün geçtikçe artan miktarlara ulaştığı bilinen
bir gerçektir. Beslenmede önemli bir yer tutan tavuk eti, hayvansal gıdalar arasında
uygun bileşimi, yüksek protein değeri ve özellikle kırmızı ete kıyasla daha uygun
fiyatlarda olması nedeniyle tercih edilmektedir. Ancak kanatlı eti olumsuz çevre
koşulları ve yetersiz soğutma durumunda mikroorganizmaların gelişimi açısından
önemli bir kaynak oluşturmaktadır. Bu durum, tavuk işletmelerinde temizlik ve
dezenfeksiyon işlemlerinin önemini daha da arttırmaktadır. Bütün bu nedenlerden
dolayı tavuk işletmelerinde işletmeye özgü, etkin temizlik ve dezenfeksiyon
18
maddelerinin seçimi ve kullanımı hem toplum sağlığı hem de ekonomik yönden
önemlidir (Şener ve Temiz 2004).
Modern ve ileri teknoloji uygulayan ve hijyenik üretim sağlayan tavuk
kesimhane ve işletmelerinde mikrobiyel kontaminasyonu önlemek ya da en aza
indirmek amacıyla temizlik ve dezenfeksiyon işlemlerinin belli program dahilinde ve
etkin bir şekilde uygulanması gerekmektedir. Hijyen uygulamaları ön temizlik ve
dezenfeksiyon prosesleri içermelidir. Kanatlı işletmelerinde ön temizlik amaca uygun
olarak, genellikle 50-70°C’de su ve deterjan kullanılarak gerçekleştirilmektedir.
Kullanılacak olan deterjan veya deterjan karışımlarının seçimi, işletmedeki kirlenme
tipleri ve bunların nitelikleri, uygulama tekniği, temizlenecek materyalin niteliği ve
yüzey özelliğine göre yapılmalıdır. Tavuk işletmelerinde en yaygın olarak protein ve
yağ kirlenmelerine rastlanmaktadır. Bu amaçla kullanılan temizlik maddeleri arasında
alkali bileşikler, asit bileşikler, yüzey aktif bileşikler, kalsiyum bağlayıcı bileşikler,
korozyon inhibitörü maddeler, süspansiyon halini devam ettiriciler, köpük önleyiciler ve
enzimler ile köpük temizleyiciler ve jeller yer almaktadır (Hayes 1992).
Dezenfeksiyon işlemi ile ön temizlik aşamasından sonra, ortamdaki ürüne
kontaminasyon kaynağı olabilecek mikroorganizmaların öldürülmesi ya da zararlı etki
yapmayacak en düşük düzeye indirilmesi hedeflenmektedir (Gray ve Killinger 1966).
Gıda işletmelerinde dezenfeksiyon, genel olarak yüksek sıcaklık, radyasyon
uygulaması ve yüksek konsantrasyonlarda mikrobisit, düşük konsantrasyonlarda ise
mikrobiyostatik etkiye sahip dezenfektan kullanımı şeklinde gerçekleştirilmektedir.
Halojenler (klor ve klorlu bileşikler, iyotlu bileşikler) gıda işletmelerinde en sık
kullanılan dezenfektandır. Tavuk işletmelerinde de mikrobiyel dekontaminasyon
amacıyla fiziksel ve kimyasal bir takım işlemler uygulanmaktadır. Fiziksel işlemler
arasında sıcaklık uygulamaları, ışınlama, UV, yüksek voltajlı elektriksel uygulamalar,
yüksek basınç, ultrasonik vibrasyon ve negatif hava akımı sayılabilir. Kimyasal işlemler
ise çeşitli kimyasallar, antibiyotikler, mikrobiyositler ve biyoaktif pestisitlerin kullanımı
şeklinde gerçekleştirilmektedir (Yang ve ark. 1998).
2.5.2. Kanatlı Kesimhanelerinde Hijyen Doğrulama İhtiyacı
Gıda
işletmelerinde
üretim
prosesi
içerisinde
uygulanan
temizlik
ve
sanitasyonun gıda üretim hattı boyunca patojen gelişimini inhibe edebilecek
konsantrasyon seviyelerinde olması ve işletmenin rutin temizlik uygulamalarının
19
doğrulanması gerekmektedir. Bunun için uluslararası standartlarda üretim yapmayı
hedefleyen kanatlı işletmelerinin yüzey temizliğinin kontrolünde yaygın kullanım
alanına sahip hızlı metotları bir program dahilinde uygulaması gerekmektedir (Sala ve
ark. 2008).
Bu kapsamda kullanılan çok sayıdaki metottan biri de ATP biyolüminesans
metodudur. Nitekim, Sala ve ark. (2008) Romanya’da bir kanatlı kesimhanesinde üretim
prosesinde yüzeylerin kontaminasyonun ölçümünde hızlı, pratik ve kullanımı kolay olan
ATP biyolüminesans metodunun etkinliğini inceledikleri çalışmalarında hedef
mikrorganizma
tespiti
hariç
işletmenin
rutin
temizliğinin
doğrulanmasında metodun kullanılabileceğini belirlemişlerdir.
izlenmesinde
ve
20
3. GEREÇ VE YÖNTEM
3.1.
GEREÇ
3.1.1. Model Yüzeyler
Kanatlı işletmelerinde kullanılan yüzey materyallerini temsil edecek nitelikte 30
cm x 40 cm boyutlarında paslanmaz çelik yüzeyler yapay olarak kirletilmek suretiyle
kullanılmıştır.
3.1.2. Referans Kültürler
Gıda üretim yüzeylerinden izole edilen yaygın
mikroorganizmaları temsil
edecek, sertifikalı kültürler kullanılmıştır. Bunlar sertifikalı lyofilize E. coli ATCC
25922 (Oxoid, R4607050/CL7050), S.enterica subsp.enter.serovar typhi. ATCC 14028
(Oxoid, R4606000/CL6000), S. aureus subsp. aureus ATCC 11632 (MBL, 0462P),
Saccharomyces cerevisiae ATCC 9763 (Oxoid, R4608201/CL8201) olup bu
kültürlerden çalışma sırasında üretici talimatına göre hazırlanan stok kültürler
kullanılmıştır.
3.1.3. Kullanılan Cihazlar
ATP Biyoluminesans cihazı (Hygiena, UK, ABD)
Benmari (Memmert, Almanya )
Buzdolabı (Bosch, Almanya)
Distile su cihazı (Nüve, Türkiye)
Hassas terazi (Sartorius, Almanya)
İnkubatör (Memmert, Almanya)
McFarland cihazı (Biosan, Letonya)
Mikropipet, 10-100 µL ,100-1000 µL (Eppendorf, Almanya)
Otoklav (Hirayama, Japonya)
pH metre (Hanna Instruments, ABD)
Vorteks-Tüp Karıştırıcı (Velp Scientifica, İtalya)
21
3.1.4. Analizlerde Kullanılan Besiyeri ve Çözeltiler
Baird Parker Agar (BPA, Oxoid, CM0275)
Brain Hearth Infusion Broth (BHIB, Oxoid, CM1135)
Chloramphenicol Supplement (Oxoid, SR0078E)
Dichloran Rose Bengal Chloramphenicol Agar (DRBC, Oxoid, CM0727B)
Egg Yolk Tellurite Emulsiyon (Oxoid, SR0047C)
Plate Count Agar (PCA, Oxoid, CM0325)
Tryptone Bile X-glukuronide Medium (TBX, Oxoid, CM0945B)
Xyloselysine Deoxycholate Agar (XLD, Oxoid, CM0469B)
Fizyolojik tuzlu su (FTS), (0.009’luk NaCl çözeltisi)
3.2. YÖNTEM:
Çalışmalar İ.Ü. Veteriner Fakültesi Besin Hijyeni ve Teknolojisi AbD
laboratuvarlarında yapılmıştır.
3.2.1. Model Çalışma Yüzeylerinin Dezenfeksiyonu
Model yüzeylerin temizlik ve dezenfeksiyon işlemlerinde ticari kanatlı
işletmelerinde kullanılan bir temizlik ve dezenfeksiyon prosedürü izlenmiştir.
Bunun için ilk ön yıkama aşamasında temizlik ve sanitasyon için optimum
dezenfektan ve sanitizer formülasyonu olan Antec DSC 1000 (Refarm İstanbul)
1/250-1/500 oranında sulandırılarak spreyleme ile uygulanmış ve 2-3 dk sonra bol su ile
durulanmıştır.
Daha sonra dezenfeksiyon amacıyla Antec Ambicide (Refarm İstanbul)
kullanma talimatında belirtilen değerlere göre 1/200 oranında sulandırılmış, hazırlanan
solüsyon hesaplanan çalışma yüzey alanının tamamına uygulanacak şekilde 300 ml/m2
oranında spreylenmiştir. Köpükleme için de yine kullanma talimatında belirtilen
değerlere göre 1/50 oranında hazırlanan solüsyon yine hesaplanan tüm yüzey alanına
göre 150 ml/m2 oranında uygulanmış ve 2-3 dk sonra bol su ile durulanmıştır.
Kanatlı işletmelerinden farklı olarak son aşamada tüm yüzeye alkol dökülüp
alevlendirilerek flambaj uygulaması yapılmıştır.
22
3.2.2. Temiz Yüzeylerin Mikroorganizma Yükünün Kontrolü
Uygulanan dezenfeksiyonun ardından yüzeyin temizliğinin kontrolü için steril
bir swap ile tüm yüzeyden örnek alınmış, PCA agara yayma ekim yapılmış ve 37°C’de
24 saat inkubasyona bırakılmıştır (FDA, 2001a).
3.2.3. Kontaminasyon
İçin
Kullanılacak
Kültürlerin
Hazırlanması
Her bir mikroorganizmaya ait lyofilize kültürden içerisinde 5 ml BHIB (Brain
Hearth Infusion Broth) bulunan tüpe inökülasyon yapılmış ve 35°C’de 4-6 saat
inkübasyona bırakılmıştır. İnkubasyon sonrası bulanıklık oluşan tüplerden PCA içeren
yatık agarlı tüplere tek koloni düşürecek şekilde çizgi ekim yapılarak 35°C’de 18 saat
inkubasyona bırakılmıştır. Bu tüpler daha sonra 4°C’de saklanarak çalışma kültürü
olarak kullanılmıştır.
3.2.4. Yüzeylerin Kontaminasyonunda Kullanılacak Kültürleri İçeren Çözeltinin
Hazırlanması ve Mikroorganizma Yükünün Belirlenmesi
Çalışma kültürlerinden alınan tek bir koloni öze aracılığı ile 5 ml BHIB içeren
tüplere aktarılıp 18 saat boyunca 35°C’de inkube edilmiştir. Stok içerisindeki tahmini
mikroorganizma sayısının belirlenmesi için McFarland cihazı (Biosan, 050102-11080341) kullanılarak ölçüm yapılmış ve elde edilen tahmini sayı doğrultusunda içerisinde
9 ml FTS bulunan tüplere 1/10’luk seri seyreltimler yapılarak yüzeylerin kirletileceği
konsantrasyonlardaki dilüsyonlar hazırlanmıştır. Stok kültür solüsyonundaki kesin
mikroorganizma sayılarının belirlenmesi için kirletme işlemine parelel olarak
mikroorganizma çözeltisinden seri seyreltimler ve PCA agara ekim yapılmış ve 35°C’de
24-48 saat inkubasyon sonrası sayımlar gerçekleştirilmiştir. Bu işlem her bir
mikroorganizma kültürü için ayrı ayrı gerçekleştirilmiştir.
3.2.5. Yüzeylerin Kirletilmesi
Yüzeylerde yanyana belirlenmiş olan 100 cm2 lik 2 parelel yüzey parçasının
herbirine yüksek (105-106 kob/cm2), orta (102-104 kob/cm2) ve düşük (101-102 kob/cm2)
seviyede mikroorganizma içerecek şekilde ilgili bakteri konsantrasyonunu içeren
tüplerden 0,1 ml damlatılmış, her kirletmeden önce alkole batırıldıktan sonra ateşten
geçirilip soğutulan çelik spatula ile yayılarak tüm kareye dağılması sağlanmıştır.
23
3.2.6. ATP Ölçümleri
Çalışmamızda ATP Biyoluminesans Hygiena (SystemSURE Plus, INS0047)
cihazı kullanma kılavuzuna uygun olarak kullanılmıştır. Buna göre cihazın özel
swapları kullanılarak 100 cm2 lik yüzeylerin bir parelelinden alınan numune cihazın
swap bölmesine yerleştirilip, kapağı kapatıldıktan sonra okuma başlatılmış ve ölçümün
gerçekleştiği 15 saniyelik sürenin sonunda ekranda okunan RLU değeri kaydedilmiştir.
3.2.7. Klasik Swap Yöntemi İçin Örneklerin Alınması
Kirletilmiş parelel yüzeylerin ikincisinden steril swap kullanılarak alınan örnek
10 ml'lik FTS içeren tüp içerisine bırakılmış ve madde 3.2.8.’e göre seri seyreltim ve
ekimler gerçekleştirilmiştir.
3.2.8. Swap Örneklerinin Mikrobiyolojik Ekimleri
3.2.8.1. Seri Seyreltimlerin Yapılması
Kirletilmiş ikinci parelel yüzeyden steril swap kullanılarak alınan örnek 10
ml'lik FTS içeren tüp içerisine bırakılmış ve vorteks yardımıyla swaptaki örneğin
dilusyon sıvısına homojen bir şekilde yayılması sağlanmıştır. Her tüpten otomatik pipet
ile 1’er ml alınmış, 9 ml’lik FTS’lere seri seyreltimler yapılmış ve bu dilusyon
tüplerinden 2’şer paralel olmak üzere spesifik agara ekimler gerçekleştirilmiştir (FDA
2003; ISO 2004).
3.2.8.2. E. coli Sayımı
E. coli sayımı amacıyla TBX agar (Oxoid, CM0945B)’da yayma plak yöntemi
kullanılmıştır. Madde 3.2.8.1.’e göre hazırlanan seyreltimlerden aseptik şartlarda alınan
0,1 ml seyreltim sıvısı besiyeri içeren petrilere iki parelel olarak inöküle edilmiştir ve
steril drigalski çubuğu ile seyreltim sıvısının besiyeri yüzeyine iyice dağılması
sağlanmıştır. Petriler ters çevrilerek 44ºC’de 24-48 saat inkübe edildikten sonra üreyen
mavi-yeşil renkli tipik koloniler sayılmıştır (ISO 2001; ISO 2004).
3.2.8.3. Salmonella Sayımı
Salmonella sayımı amacıyla XLD agar (Oxoid, CM0469B)’da yayma plak
yöntemi kullanılmıştır. Madde 3.2.8.1.’e göre hazırlanan seyreltimlerden aseptik
24
şartlarda alınan 0,1 ml seyreltim sıvısı besiyeri içeren petrilere iki parelel olarak inöküle
edilmiş ve steril drigalski çubuğu ile seyreltim sıvısının besiyeri yüzeyine iyice
dağılması sağlanmıştır. Petriler ters çevrilerek 35ºC’de 24 saat inkübe edildikten sonra
üreyen merkezi siyah, etrafı pembe renkli yuvarlak koloniler sayılmıştır (ISO 2004;
FDA 2007).
3.2.8.4. S. aureus Sayımı
S. aureus sayımı amacıyla yumurta sarısı ve potasyum tellürit ilave edilmiş
BPA agar (Oxoid, CM0275)’da yayma plak yöntemi kullanılmıştır. Madde 3.2.8.1.’e
göre hazırlanan seyreltimlerden aseptik şartlarda alınan 0,1 ml seyreltim sıvısı besiyeri
içeren petrilere iki parelel olarak inöküle edilmiş ve steril drigalski çubuğu ile seyreltim
sıvısının besiyeri yüzeyine iyice dağılması sağlanmıştır. Petriler ters çevrilerek 35ºC’de
48 saat inkübe edildikten sonra çapı yaklaşık olarak 3 mm olan siyah-gri renkli ve
etrafında şeffaf zonlar bulunan parlak koloniler S. aureus olarak değerlendirilmiştir
(FDA 2001b; ISO 2004).
3.2.8.5. S. cerevisiae Sayımı
S. cerevisiae sayımı amacıyla DRBC agar (Oxoid, CM0727B)’da yayma plak
yöntemi kullanılmıştır. Madde 3.2.8.1.’e göre hazırlanan seyreltimlerden aseptik
şartlarda alınan 0,1 ml seyreltim sıvısı besiyeri içeren petrilere iki parelel olarak inöküle
edilmiş ve steril drigalski çubuğu ile seyreltim sıvısının besiyeri yüzeyine iyice
dağılması sağlanmıştır. Petriler ters çevrilerek 25ºC’de 5-7 gün inkübe edildikten sonra
beyaz renkli, parlak ve yuvarlak tipik koloniler sayılmıştır (FDA 2001c; ISO 2004).
3.2.8.6. Toplam Aerobik Bakteri Sayımı
Steril petri kutularına her bir dilüsyondan 1’er ml alınıp, üzerine 45˚C’ye kadar
soğutulmuş olan PCA agar (Oxoid, CM0325) dökülmüştür. Dökme plak ekim tekniği
ile hazırlanan petriler 35˚C’de 48 saat inkübe edildikten sonra üreyen tüm koloniler
sayılmıştır (FDA 2001a; ISO 2004).
Tüm çalışmalar her bir mikroorganizma türü için 3’er kez tekrar edilmiştir.
25
3.2.9. Kanatlı Kesimhanesinden Alınan Örneklerin Analizi
Kontamine edilmiş yüzeylerin yanısıra doğal kontaminasyonun izlenmesi için
bir kanatlı kesimhanesinden de canlı tavuğun girişinden paketleme aşamasına kadar
olan üretim hattından seçilen 6 farklı noktadan iki paralel numune alınmıştır.
Numune alma noktaları şu şekildedir; parçalama masası, personel eli, göğüs
fleto bandı, transfer bandı I, kesme tahtası, transfer bandı II.
Bunun için örneklenen yüzeylere de asetat kağıdı ile 100 cm2 lik 4’er kare
belirlenmiştir. Bu karelerin iki tanesinden ATP swabı ile alınan numunenin ATP
ölçümleri yapılırken hemen yanında belirlenmiş olan iki kareden swap çubukları ile
alınan numune transport besiyerinde muhafaza edilerek soğuk zincirde laboratuvara
ulaştırılmıştır. Laboratuvara ulaştırılan swap numunelerinin en kısa sürede madde
3.2.8.’e göre mikrobiyolojik ekimleri yapılmıştır.
3.2.10. İstatistiksel Analizler
Araştırma kapsamında klasik yöntemle sayılan log10 kob ve RLU değerleri
arasındaki ilişkiler Spearman Corelasyon yöntemi ile, kanatlı işletmesinden elde edilen
sonuçlar arasındaki ilişkiler ise Pearson metoduna göre hesaplanmıştır. Korelasyon
analizleri SPSS 13.0 programı kullanılarak yapılmıştır. Tüm veri seti için log kob’u
veren regresyon denklemini geliştirmek amacıyla Minitap programında linear regresyon
prosedürü izlenmiştir.
3.2.11. RLU Değerlerinin Yorumlanması
Cihaz üreticisinin (SystemSURE Plus, INS0047) kullanım rehberine göre gıda
ile direkt temas eden paslanmaz çelik yüzeyler için <10 RLU çıkan değerler temiz, 1129 arasında çıkan değerler şüpheli, >30 RLU çıkan değerler ise kirli olarak
belirtilmektedir (Whitehead ve ark. 2008).
Çalışmamızda RLU değerlerinin
yorumlanması bu sınıflama dikkate alınarak yapılmıştır.
26
4. BULGULAR
4.1.
Temiz Yüzeylerin Mikroorganizma Yükünün Kontrolü
Çalışmada paslanmaz çelik yüzeylere uygulanan dezenfeksiyonun ardından
yüzeyin temizliğinin kontrolü için steril bir swap ile yüzeylerden alınan örneklerin
PCA agara sürme plak yöntemiyle ekimleri yapılmış ve 37ºC’de 24 sa. inkubasyona
bırakılmıştır.
Yapılan
incelemeler
sonunda
yüzeylerde
herhangi
bir
üreme
gözlenmemiştir.
4.2.
Model Çalışma Yüzeylerinde Salmonella Bulguları
Çalışmada yüzeylerin Salmonella koloni sayıları, her bir kontaminasyon
seviyesinde ortalama olarak yüksek, orta ve düşük seviyeler için sırasıyla log10
tabanında 6,11 kob/cm2, 4,53 kob/cm2, 2,29 kob/cm2 olarak tespit edilmiştir. Bu
yüzeyler için ATP cihazı ile yapılan ölçüm sonuçları ise ortalama olarak sırasıyla 189,
31 ve 0 RLU olarak tespit edilmiştir (Tablo 4-2).
Tablo 4-2: Model Çalışma Yüzeylerinde Salmonella bulguları Log10 kob/cm2
Kontaminasyon
seviyesi
Yüksek
Orta
Düşük
Tekrar no
1
2
3
ortalama
1
2
3
ortalama
1
2
3
ortalama
Swap
metoduna göre
Log10 kob/cm²
6.16
6.12
6.05
6.11
4.80
4.44
4.36
4.53
3.40
1.81
1.65
2.29
ATP
metoduna göre
RLU
119
119
328
189
3
88
1
31
0
0
0
0
ATP
metoduna göre
Temiz/Kirli
Kirli
Kirli
Kirli
Kirli
Temiz
Kirli
Temiz
Kirli
Temiz
Temiz
Temiz
Temiz
27
4.3.
Model Çalışma Yüzeylerinde E. coli Bulguları
Çalışmada yüzeylerin E. coli koloni sayıları, her bir kontaminasyon seviyesinde
ortalama olarak yüksek, orta ve düşük seviyeler için sırasıyla log10 tabanında 5,57
kob/cm2, 3,25 kob/cm2, 1,51 kob/cm2 olarak tespit edilmiştir. Bu yüzeyler için ATP
cihazı ile yapılan ölçüm sonuçları ise ortalama olarak sırasıyla 265, 8, ve 1 RLU olarak
tespit edilmiştir (Tablo 4-3).
Tablo 4-3: Model Çalışma Yüzeylerinde E. coli bulguları Log10 kob/cm2
Kontaminasyon
seviyesi
Yüksek
Orta
Tekrar no
Swap
metoduna göre
Log10 kob/cm²
ATP
metoduna göre
RLU
ATP
metoduna göre
Temiz/Kirli
1
6.54
788
Kirli
2
5.05
3
Temiz
3
5.13
3
Temiz
ortalama
5.57
265
Kirli
1
3.26
18
Şüpheli
2
3.4
7
Temiz
3
3.1
0
Temiz
ortalama
3.25
8
Temiz
1
2.35
0
Temiz
2
1.18
0
Temiz
3
1.0
2
Temiz
ortalama
1.51
1
Temiz
Düşük
28
4.4.
Model Çalışma Yüzeylerinde S. aureus Bulguları
Çalışmada yüzeylerin S. aureus koloni sayıları, her bir kontaminasyon
seviyesinde ortalama olarak yüksek, orta ve düşük seviyeler için sırasıyla log10
tabanında 5,55 kob/cm2, 4,46 kob/cm2, 2,95 kob/cm2 olarak tespit edilmiştir. Bu
yüzeyler için ATP cihazı ile yapılan ölçüm sonuçları ise ortalama olarak sırasıyla 136,
19 ve 1,6 RLU tespit edilmiştir (Tablo 4-4).
Tablo 4-4: Model Çalışma Yüzeylerinde S. aureus bulguları Log10 kob/cm2
Kontaminasyon
seviyesi
Tekrar no
Swap
metoduna göre
Log10 kob/cm²
ATP
metoduna göre
RLU
ATP
metoduna göre
Temiz/Kirli
1
6.09
34
Kirli
2
5.93
26
Şüpheli
3
4.65
349
Kirli
ortalama
5.55
136
Kirli
1
4.6
17
Şüpheli
2
4.45
37
Kirli
3
4.34
4
Temiz
ortalama
4.46
19
Şüpheli
1
3.53
0
Temiz
2
2.74
0
Temiz
3
2.57
5
Temiz
ortalama
2.95
1.6
Temiz
Yüksek
Orta
Düşük
29
4.5.
Model Çalışma Yüzeylerinde S. cerevisiae Bulguları
Çalışmada yüzeylerin S. cerevisiae koloni sayıları, her bir kontaminasyon
seviyesinde ortalama olarak yüksek, orta ve düşük seviyeler için sırasıyla log10
tabanında 6,14 kob/cm2, 2,76 kob/cm2, 1,32 kob/cm2 olarak tespit edilmiştir. Bu
yüzeyler için ATP cihazı ile yapılan ölçüm sonuçları ise ortalama olarak sırasıyla 135, 0
ve 3 RLU tespit edilmiştir (Tablo 4-5).
Tablo 4-5: Model Çalışma Yüzeylerinde S. cerevisiae bulguları Log10 kob/cm2
Kontaminasyon
seviyesi
Yüksek
Orta
Düşük
Swap
ATP
ATP
metoduna göre
metoduna göre
metoduna göre
Log10 kob/cm²
RLU
Temiz/Kirli
1
6.98
153
Kirli
2
5.74
222
Kirli
3
5.70
31
Kirli
ortalama
6.14
135
Kirli
1
2.9
0
Temiz
2
2.7
0
Temiz
3
2.7
0
Temiz
ortalama
2.76
0
Temiz
1
1.78
0
Temiz
2
1.18
0
Temiz
3
1.0
9
Temiz
ortalama
1.32
3
Temiz
Tekrar no
30
ATP Metodu İle Klasik Külterel Metot Arasındaki Korelasyon Değerleri
4.6.
Her iki metodun sonuçları arasındaki korelasyonun belirlenmesi için Spearman
korelasyon testi kullanılarak hesaplamalar yapılmış ve sonuçlar Tablo 4-7’da
verilmiştir.
Tablo 4-6: ATP metodu ile klasik kültürel metot arasındaki korelasyon değerleri.
Mikroorganizma
n
r
p
r²
Salmonella
9
0.911
p=0.001
0.83
E. coli
9
0.724
p=0.028
0.524
S. aureus
9
0.644
p=0.061
0.415
S. cerevisiae
9
0.623
p=0.073
0.388
Toplam
36
0.761
p=0.001
0.579
n: Deney numune sayısı
r: Korelasyon katsayısı
p: Korelasyon değeri
r²: Belirleme derecesi
31
Bir Kanatlı Kesimhanesinden Alınan Numunelerle Yapılan Çalışma
4.7.
Sonuçları
Gıda işletmelerinde kullanılan materyalleri temsil edecek nitelikteki
yüzeylerin kirletilmesi suretiyle yapılan bu çalışmaya ek olarak doğal kontamine
yüzeylerdeki etkinin görülmesi için bir kanatlı işletmesinden alınan numune sonuçları
iki metoda göre karşılaştırılarak gösterilmiştir (Tablo 4-8).
Tablo 4-7: Bir kanatlı kesimhanesinden alınan numunelerle sonuçları yapılan çalışma sonuçları
Numune
Salmonella
Swap metoduna göre
ATP
ATP
Log10 kob/cm²
metoduna
metoduna
göre
göre
E.coli
S.aureus
S.cerevisiae
TAB
RLU
Temiz/Kirli
9
3107
Kirli
1
0
5.60
0
5
2
0
4.35
0
3.75
6.95
975
Kirli
3
0
2.65
0
2.95
4.65
756
Kirli
4
0
0
0
0
8.3
636
Kirli
5
0
4.35
0
3.4
5.95
581
Kirli
6
0
5.6
0
4.7
9.9
422
Kirli
1: Parçalama masası, 2: Personel eli, 3: Göğüs fleto bandı 4: Transfer bandı I, 5: Kesme tahtası, 6: Transfer bandı II
Bu sonuçlara göre hesaplanan korelasyon katsayısı (r) ise 0,386’dır.
32
5. TARTIŞMA
Günümüzde gıda üretimi ve dağıtımı yapan işletmelerin gıda zinciri boyunca
güvenilirlik ve hijyen sağlaması, gıda kaynaklı zehirlenmelerin önlenmesi için büyük
önem taşımaktadır. Bu güvenilirliğin sağlanabilmesi için uygulanan tüm önlem amaçlı
sistemlerde sürekli uygunluğun gözden geçirilmesi için hızlı ve güvenilir hijyen
doğrulama metotlarına gereksinim vardır. Bu noktada, doğrulama metotları kullanılarak
hijyen sağlamaya yönelik uygulamaların etkinliğinin ölçülmesi amaçlanmaktadır
(Dalgıç ve Belibağlı 2006; TSE 2006; Topalakçı 2007).
Bu tez çalışmasında hijyen uygulamalarının doğrulanması için üretim
tesislerinde
kullanılan
ATP
biyoluminesans
hijyen
görüntüleme
metodunun
performansının ve uygulanabilirliğinin klasik metot ile karşılaştırılmak suretiyle
incelenmesi hedeflenmiştir.
Bu amaçla yapay olarak farklı mikroorganizmalarla kirletilmiş deneysel
ortamların kontaminasyon seviyesi her iki metot kullanılarak karşılaştırılmıştır. ATP
biyoluminesans hijyen görüntüleme metodunun gıda işletmelerindeki kullanım
olanaklarının değerlendirilmesi amacıyla bir kanatlı kesimhanesinin doğal kontamine
üretim alanlarından alınan numuneler yine her iki metot karşılaştırılarak incelenmiştir.
Çalışmamızda ilk olarak paslanmaz çelik yüzeylere uygulanan dezenfeksiyonun
ardından yüzeylerde yeterli dezenfeksiyonun sağlandığının incelenmesi amacıyla steril
swap ile yüzeylerden alınan örneklerin PCA agara sürme plak yöntemiyle ekimleri
yapılmış ve 37˚C’de 24 saat inkubasyona bırakılmış ve incelemeler sonunda yüzeylerde
herhangi bir üreme gözlenmemiştir. Benzer olarak, Ayçiçek ve ark. (2006) da bir
hastane mutfağında gıda ile temas eden yüzeylerde yapmış oldukları çalışmada temizlik
tespit limitini <10 kob/cm2 olarak belirlemişlerdir. Buna göre çalışmamızda deneysel
yüzeylere uygulanan dezenfeksiyon metodunun etkin olduğu ve sayımı yapılan
mikroorganizmaların deneysel kirletme faaliyetinden kaynaklandığı kesinleştirilmiştir.
Çalışmamızda,
dezenfeksiyon
işlemini
takiben,
kanatlı
işletmelerinde
rastlanılması muhtemel olan hijyen indikatörü ve bazı patojen mikroorganizmalarla 3
farklı (düşük, orta ve yüksek) seviyede kirletilmiş ve bu yüzeylerden iki paralel numune
alınarak bir paraleli klasik kültürel metot ve bir paraleli de ATP biyoluminesans metodu
33
ile analize tabi tutulmuştur. Bu yüzeyler içerisinde, Salmonella ile kirletilen
yüzeylerden elde edilen sonuçlara göre; ortalama 6,11 log10 kob/cm2 bakteri ile
kirletilen ve yüksek seviyede kontamine olarak değerlendirilen yüzeyde ATP ölçüm
sonucu 189 iken orta (4,53 log10 kob/cm2) ve düşük (2,29 log10 kob/cm2) seviyede
kirletilen yüzeyler için sırasıyla 31 ve 0 olmuştur (Tablo 4-2). E.coli ile kirletilen
yüzeylerde bu oranlar yüksek (5,57 log10kob/cm2), orta (3,25 log10kob/cm2) ve düşük
(1,51 log10 kob/cm2) için sırasıyla 265, 8 ve 1 olarak belirlenmiştir (Tablo 4-3). S.aureus
sonuçlarına göre ise, yüksek (5,55 log10 kob/cm2), orta (4,46 log10 kob/cm2) ve düşük
kontaminasyonlar (2,95 log10 kob/cm2) için sırasıyla 136, 19 ve 1,6 (Tablo 4-4), S.
cerevisiae için, yüksek (6,14 log10 kob/cm2) orta (2,76 log10 kob/cm2) ve düşük (1,32
log10 kob/cm2) için sırasıyla 135, 0 ve 3’tür (Tablo 4-5). Bu sonuçlar doğrultusunda
ATP cihazı yüksek seviyede mikroorganizma yüküne sahip yüzeylerde, ki bu seviye 5-6
log10 kob/cm2’ye tekabül etmektedir, kirli olarak sonuç vermiştir. Orta seviyede (3-4
log10 kob/cm2) bakteri ile kirletilmiş yüzeylerde ise elde edilen ATP ölçüm sonuçları
değişken bulgu vermiş olup Salmonella ve S.aureus için kirli olarak tespit ederken
E.coli için temiz olarak sonuç vermiştir. Maya ile kirletilen yüzeyde kirletme seviyesi 2
log10 kob/cm2 olup bu alanda da temiz olarak sonuç bildirmiştir. Düşük sayıda
mikroorganizma ile kontamine edilen (1-2 log10 kob/cm2) yüzeylerde ise ATP cihazı ile
tespit yapmak mümkün olamamış ya da çok düşük seviyelerde kalmıştır (Tablo 4-2, 43, 4-4, 4-5). Benzer olarak Chen ve Godwin (2006) de gerçekleştirdikleri çalışmalarında
3 log10/kob’un altında toplam bakteri yüküne sahip mikroorganizma taşıyan yüzeylerde
20 RLU’dan daha düşük değerler tespit edildiğini ifade etmişlerdir. Nitekim başka bazı
araştırmacılar da ATP metodunun tespit limitini 3-4 log10 kob/cm2 olarak bildirmişlerdir
(Siragusa ve ark. 1995; Davidson ve ark. 1999; Corbitt ve ark. 2000; Larson ve ark.
2003; Leon ve Albrech 2007; Sala ve ark. 2008; Jasson ve ark. 2010; Carroscosa ve ark.
2012).
İstatistik analizler sonucunda elde edilen p değeri (probability; olasılık değeri) iki
değişken arasındaki bağımlılık yani korelasyonun anlamlılığı olarak tanımlanmaktadır.
Hesaplanan p değerinin yorumlanmasına yönelik genel yaklaşım şu şekildedir:
0.01<=p<0.05 İstatistiksel anlamlılık
0.001<=p<0.01 Yüksek düzeyde istatistiksel anlamlılık
p<0.001 Çok yüksek istatistiksel anlamlılık
0.05<=p<0.10 Anlamlılık eğilimi (sınırda anlamlılık)
34
p>0.10 Fark tesadüften ileri gelmiştir (istatistiksel olarak anlamlı
farklılık saptanmamıştır)
Korelasyon katsayısı (r) ise istatistik analizi yapılacak değişkenler arasındaki ilişkinin
derecesini açıklamaktadır. r değerinin karesi alınarak bulunan r2 değeri ise iki veriden
birinin diğerini belirleme derecesini yorumlamak amacıyla kullanılmaktadır (Özdamar
1999, Kul 2014).
Her iki metodun arasındaki korelasyon katsayısı (r) mikroorganizma türüne
göre farklı olup, Salmonella, E. coli, S. aureus ve S. cerevisiae için sırasıyla 0,911,
0,724, 0,644 ve 0,623’tür. Çalışmamıza konu olan iki metodun mikroorganizma
türünden bağımsız olarak toplam 36 testin sonuçları ile elde edilen korelasyon katsayısı
ise r=0,761 olarak tespit edilmiş olup, p değerinin 0,001 olması bu korelasyonun yüksek
düzeyde anlamlı olduğunu göstermiştir. Benzer şekilde, diğer bazı başka çalışmalarda
da korelasyon değeri değişken olarak tespit edilmiş olup 0,68 ile 0,90 arasında
bulunmuştur (Siragusa ve ark. 1995; Cutter ve ark., 1996; Chen ve Godwin 2006; Sala
ve
ark.
2008).
Çalışmamızda
korelasyonun
yüzeyde
mevcut
bulunan
mikroorganizmanın türüne göre hesaplanması halinde önemli derecede farklılık
gösterdiği tespit edilmiştir. Korelasyon katsayısı en iyi Salmonella için (r=0,911) olarak
bulunurken, en düşük S. cerevisciae (r=0,623) için bulunmuştur. E.coli için anlamlı bir
korelasyon (r=0,724) elde edilirken S. aureus’a ait korelasyon katsayısı r=0,644 olarak
tespit edilmiştir. S. cerevisciae ve S. aureus için hesaplanan korelasyonların p değerinin
sırasıyla, p=0,073 ve p=0,061 yani >0,05 olması korelasyonun sınırda anlamlı
olduğunu; Salmonella (p=0.001) ve E.coli (p=0.028) için elde edilen p değerlerinin ise
sırasıyla yüksek düzeyde anlamlı ve anlamlı olduğunu göstermiştir. Benzer olarak,
Chen ve Godwin (2006) de yaptıkları çalışmalarda toplam aerob mezofil bakteri ve
psikrofilik bakteri yükleri için dahi bu hesaplamaların farklılık gösterdiğini en iyi
sonuçların ortalamadan elde edildiğini açıklamıştır. Bu durum farklı çalışmalardan elde
edilen, farklı korelasyon katsayılarının nedenini de açıkça göstermektedir. Nitekim
Moore ve ark. (2010)’nın sonuçları S. aureus ile ilgili sonuçlarımızı desteklemekte olup,
bu çalışmada da Londra’da ulusal bir temizlik standardı belirlemek amacıyla bir
hastanenin yoğun bakım ünitelerinde uygulanan modifiye temizlik programının etkinliği
ATP biyolüminesans metodu kullanılarak ölçülmüş ve bu metot ile temiz olarak tespit
edilen yüzeylerde klasik metot ile S. aureus varlığı tespit edilmiştir.
35
Doğal kontamine yüzeylerde metodun performasınının incelenmesi amacıyla bir
kanatlı işletmesinden seçilen kirli yüzeylerden yapılan paralel çalışmaların sonuçlarına
göre ATP biyoluminesans metodu 4-10 log arasında değişen sayılarda toplam aerob
mezofil bakteri ile kontamine bu yüzeylerin tümünü kirli olarak tespit etmiş ve RLU
cinsinden 422 ile 3107 arasında ölçüm sonuçları vermiştir. Kirli yüzeylerden alınan bu
örneklerde iki metot arasındaki korelasyon katsayısı r=0,386 olarak bulunmuştur. Bu
korelasyon katsayısının deneysel kontamine olanlara göre düşük olmasının nedeni ATP
biyoluminesans metodunun gıda kaynaklı ATP’yi bakteriyel ATP’den ayıramıyor
olması olabilir (Davidson ve ark. 1999; Griffith ve ark. 2000; Larson ve ark. 2003;
Ayçiçek ve ark. 2006; Chen ve Godwin 2006; Sala ve ark. 2008).
Elde ettiğimiz sonuçlar, özellikle Salmonella ve E.coli için, yapılan bir çok
çalışmaya oranla daha anlamlıdır. Bunun muhtemel nedeni yapılan çalışmaların
çoğunun doğal kontamine yüzeylerden yapılmış olması ve yüzeyde yüksek miktarda
organik kirliğinin de mevcut bulunması olabilir. Oysa ki çalışmamızda kirletilen
yüzeylerde sadece saf mikroorganizmalar yer almakta ve organik kir bulunmamaktadır.
Nitekim çalışmamızın bir aşamasında doğal kontamine yüzeylerden aldığımız
örneklerde korelasyonun belirgin bir şekilde düşüş göstermesi bu bulguları
desteklemektedir. Benzer doğal kontamine yüzeylerde yapılan bir çok diğer çalışmada
da korelasyon katsayısı düşük bulunmuş ve bu sebeple gerek mikroorganizma tipine
göre korelasyonu sağlıklı belirlemek gerekse gıda kirliğine bağlı ATP ölçümünün
sonuçları etkilemesinin önüne geçmek açısından bu denemeler öncesi yüzeyde etkin bir
dezenfeksiyonun sağlanması önerilmiştir (Siragusa ve ark. 1995; Ayçiçek ve ark. 2006;
Costa ve ark. 2006; Sokolınska ve Pıkul 2008; Vilar ve ark. 2008; Boyce ve ark. 2009;
Moore ve ark. 2010; Carroscosa ve ark. 2012). Ek olarak, Sokolınska ve Pıkul (2008)
yüzey tipinin de ATP biyoluminesans ölçümleri üzerine etkili olabileceğini bildirmiş
olup, sonuçlardaki değişkenlikler üzerine bu durumun da etki göstermiş olması
muhtemeldir.
Elde ettiğimiz sonuçlar ve diğer bir çok araştırmacının sonucu, ATP
biyolüminesans metodunun kirli yüzeyde düşük korelasyon vermesi ve mikroorganizma
türüne göre spesifik sonuç vermemesi ve performansının önemli derecede etkilenmesi
sebebiyle,
ancak
dezenfeksiyon
sonrası
etkinlik
belirlenmesi
amacıyla
kullanılabileceğini göstermiştir (Davidson ve ark. 1999; Griffith ve ark. 2000; Aytaç ve
36
ark. 2001; Ayçiçek ve ark. 2006; Chen ve Godwin 2006; Costa ve ark. 2006; Boyce ve
ark. 2009; Jasson ve ark. 2010; Moore ve ark. 2010). Nitekim, Costa ve ark. (2006)
Brezilya’da bir süt işletmesindeki paslanmaz çelik yüzeylerden Pseuodomonas ve
toplam aerob mezofil bakterilerin kob değerleri ile RLU değerlerini kıyasladıkları
çalışmada ne temizlik öncesi ne de sonrasında iki metot arasında herhangi bir
korelasyon ilişkisi saptamamış ancak ATP biyolüminesans metodunun hijyen ve
temizlik kontrolünde kullanılabileceğini belirtmişlerdir.
Sonuç olarak elde ettiğimiz sonuçlar, ATP biyoluminesans metodunun sonuçları
ile altın standart olarak kabul edeceğimiz klasik kültürel metot arasında anlamlı bir
korelasyonun sağlanmasına etki eden birden çok faktörün olduğunu göstermiştir. Buna
karşın genel tekrarlarda elde etmiş olduğumuz kabul edilebilir seviyedeki korelasyon
katsayıları metodun genel anlamda hijyen kontrolü için uygulanabilir olduğunu
göstermiştir. Ancak doğal kontamine yüzeylerde elde edilen korelasyonun anlamsız
olması ve mikroorganizma yükünün performansa olan etkisi düşünüldüğünde bu
metodun ancak dezenfeksiyon sonrası kullanımının uygun olacağını göstermiştir. Ek
olarak özellikle Salmonella ile ilgili tespit etmiş olduğumuz anlamlı sonuçlar
doğrultusunda metodun hız ve uygulama pratikliği avantajları göz önüne alındığında
ATP biyoluminesans metodunun kanatlı endüstrisi için pratik bir alternatif olabileceği
sonucuna varılmıştır. Yapılacak benzer çalışmalarla metodun farklı üretimlerde mevcut
olabilecek yüzey yapıları ve mikroorganizma türleri için doğrulamalarının yapılması
yararlı olacaktır.
37
KAYNAKLAR
Ahmad, K.A. ve Stewart, G.S.A.B. (1991). The production of bioluminescent lactic acid
bacteria suitable for the rapid assessment of starter culture activitiy in milk. Journal of
Applied Bacteriology, 70, 113.
Anonim, (2010). Veteriner Hizmetleri, Bitki Sağliği, Gida ve Yem Kanunu, Kanun
Numarası 5996. 13.06.2010 tarih ve 27610 sayılı Resmi Gazete.
Anonim, (2011). T.C. Gıda Tarım ve Hayvancılık Bakanlığı’nın Gıda Hijyeni
Yönetmeliği, 17.12.2011 tarih ve 28145 sayılı Resmi Gazete.
Arda, Ş. ve Aydın, A. (2011). Hammadde Kalitesi ile Bazı Hijyen Parametrelerinin
Yufkanın Mikrobiyolojik Kalitesi Arasındaki İlişki Üzerine Bir Araştırma. İstanbul
Üniversitesi Veteriner Fakültesi Dergisi, 37 (2), 135-147.
Aras, Z. (2011). Mikrobiyolojide Hızlı Tanı Yöntemleri. Türk Hijyen ve Deneysel
Biyoloji Dergisi, 68 (2), 97-104.
Ayçiçek, H., Oğuz, U. ve Karcı, K. (2006). Comparison of results of ATP
bioluminescence and traditional hygiene swabbing methods for the determination of
surface cleanliness at a hospital kitchen. International Journal of Hygiene and
Enviromental Health, 209 (2), 203-206.
Aytaç, S.A., Mercanoğlu, B. ve Özbaş, Y. (2001). Tampon Çözeltide İmmunomanyetik
Ayırma ve Biyolüminesans Yöntemleri ile Escherichia coli 0157:H7 Sayımı. Türk
Hijyen ve Deneysel Biyoloji Dergisi, 58 (2), 49-52.
Benesh, D.L., Crowley, E.S. ve Bird, P.M. (2013). 3M™ Petrifilm™ Environmental
Listeria Plate. Journal of AOAC International, 96 (2), 225-228.
38
Beuchat, L.R., F, Copeland, Curiale, M.S., Danisavich, T., Gangar, V., King, B.W.,
Lawlis, T.L., Likin, R.O., Okwusoa, J., Smith, C.F. ve Townsend, D.E. (1998).
Comparison of the Simplate total plate count method with Petrifilm, Redigel and
conventional pour-plate methods for enumarating aerobic microorganisms in foods.
Journal of Food Protection, 61, 14-18.
Bonaventura, G.D., Piccolomini, R., Paludi, D., D’Orio, V., Vergara, A., Conter, M. ve
Ianieri, A. (2008). Influence of temperature on biofilm formation by Listeria
monocytogenes on various food-contact surfaces: Relationship with motility and cell
surface hydrophobicity. Journal of Applied Microbiology, 104, 1552–1561.
Bostan, K., Aksu, H., Ersoy, E., Özgen, Ö. ve Uğur, M. (2001). The effect of prechilling
with acetic and lactic acid on shelf-life of broiler carcasses. Pakistan Jornal of
Biological Sciences, 4 (6), 753-756.
Boyce, J.M., Havill, N.L., Dumigan, D.G., Golebiewski, M., Balogun, O., Rizvani, R.
(2009). Monitoring The Effectiveness Of Hospital Cleaning Practices By Use Of An
Adenosine Triphosphate Bioluminescense Assay. Infection Control and Hospital
Epidemiology, 30 (7), 678-684.
BRC (2015). Global Standard for food safety Version 7. British Retail Consortium, UK.
Carroscosa, C., Saavedra, P., Millán, R., Jaber, J.R., Pérez, E., Grau, R. ve ark. (2012).
Monitoring of cleanliness and disinfection in dairies: Comparison of traditional
microbiological and ATP bioluminescence methods. Food Control, 28, 368-373.
Centers for Disease Control (CDC) (2014). Incidence and Trends of Infection with
Pathogens Transmitted Commonly Through Food — Foodborne Diseases Active
Surveillance
Network,
10
U.S.
Sites,
2006–2013.
Erişim
20.02.2015.
http://www.cdc.gov/mmwr/preview/mmwrhtml/mm6315a3.htm
Cevizci, S. ve Önal, A.E. (2009). Halk Sağlığı Açısından Hijyen ve İyi Üretim
Uygulamaları, Türk Hijyen ve Deneysel Biyoloji Dergisi, 66 (2), 73-82.
39
Chen, F.C. ve Godwin, S.L. (2006). Comparison of a Rapid ATP Bioluminescence
Assay and Standard Plate Count Methods for Assessing Microbial Contamination of
Consumers Refrigerators, Journal of Food Protection, 69 (10), 2534-2538.
Chollet, R., Kukuczka, M., Halter, N., Romıeux, M., Marc, H.M., Benguın, V. ve ark.
(2008). Rapid Detection and Enumeration of Contaminants by ATP Bioluminescense
Using the Milliflex Rapid Microbiology Detection and Enumeration System. Journal of
Rapid Methods and Automation in Microbiology, 16, 256-272.
Chu, C.P., Lee, D.J., Chang, B.V. ve Liao, C.S. (2001). Using ATP Bioluminescence
Technique for Monitoring Microbial Activitiy in Sludge. Biotechnology and
Bioengineering, 75 (4), 469-474.
Codex Alimantarius/WHO (2011). Guidelines For Risk Analysis Of Foodborne
Antimicrobial Resistance. Erişim 28.02.2015 http://www.codexalimentarius.org/searchresults.
Corbitt A.J., Bennion, N., Forsythe, S.J., (2000). Adenylate kinase amplification of ATP
bioluminescence for hygiene monitoring in the food and beverage industry. Letters in
Applied Microbiology, 30 (6), 443–447.
Costa, P.D., Andrade, N.J., Brandao, S.C.C., Passos, F.J.V., Soares, N.F.F. (2006).
ATP-Bioluminescence Assay as an Alternative for Hygiene-Monitoring Procedures of
Stainless Steel Milk Contact Surfaces. Brazilian Journal of Microbiology, 37, 3.
Cutter, C.N., Dorsa, W.J. ve Siragusa, G.R. (1996). A rapid microbial ATP
bioluminescence assay for meat carcasses. Dairy Food Environment, 66, 726-736.
Çaklı, Ş. ve Kışla, D. (2003). Su Ürünlerinde Mikrobiyel Kökenli Bozulmalar ve
Önleme Yöntemleri. Ege Üniversitesi Su Ürünleri Dergisi, 20 (1-2), 239-245.
40
Çömlekoğlu, Ü., Mazmancı, B. ve Arpacı, A. (2000). Pestisidlerin kronik etkisine
maruz kalan tarım işçilerinde eritrosit süperoksit dismutaz ve katalaz aktiviteleri. Türk
Biyokimya Dergisi, 24, 483–488.
Dalgıç, A.C. ve Belibağlı, K.B. (2006). Gıda Güvenligi ve Kalite Yönetim Sistemleri
Entegrasyonu: ISO 22000:2005 Gıda Güvenligi Yönetim Sistemi ve ISO 9000:2000
Kalite Yönetim Sistemi Uygulamaları. Türkiye 9. Gıda Kongresi, Bolu
Davidson, C.A., Griffith, C.J., Peters, A.C. ve Fielding, L.M. (1999). Evaluation of two
methods for monitoring surface cleanliness - ATP bioluminescence and traditional
hygiene swabbing. Luminescence, 14 (1), 33-38.
Duncanson, P., Wareing, D.R.A. ve Jones, O. (2003). Application of an Automated
İmmunomagnetic Separation-Enzyme İmmunoassay For Detection of Salmonella spp.
During an Outbreak Associated With a Retail Premises. Letters in Applied
Microbiology, 37 (2), 144-148.
Dümen, E., Çetin, Ö. ve Sezgin, F.H. (2009). Unlu Mamül İşletmelerinde Temas
Yüzeylerinin ve Aletlerin Mikrobiyolojik Kirliliğinin Araştırılması. Türk Mikrobiyoloji
Cemiyeti Dergisi, 39 (3-4), 108-114.
Efe, M. ve Gümüşsoy, K.S. (2005). Ankara Garnizonu’nda tüketime sunulan tavuk
etlerinin mikrobiyolojik analizi. Sağlık Bilimleri Dergisi, 14 (3), 151-157.
Engez, S.T. ve Ergönül, B. (2009). Kurutulmuş Et Üretiminde HACCP Sisteminin
Uygulanması. Gıda Teknolojileri Elektronik Dergisi, 4 (3), 12-19.
Erkan, N., Alakavuk, D.Ü. ve Tosun, Y.Ş. (2008). Gıda Sanayinde Kullanılan Kalite
Güvence Sistemleri. Journal of FisheriesSciences, 2 (1), 88-89.
Erol, İ. (2007). Gıda Hijyeni ve Mikrobiyolojisi. Pozitif Matbaacılık, Ankara, 60-70.
41
Fach, P., Micheau, P., Mazuet, C., Perelle, S. ve Popoff, M. (2009). Development of
realtime PCR tests for detecting botulinum neurotoxins A, B, E, F producing
Clostridium botulinum, Clostridium baratii and Clostridium butyricum. Journal of
Applied Microbiology, 107, 465-473.
FDA. (2001a). Food and Drug Administration. Chapter 3. Aerobic Plate Count.
Bacteriological Analytical Manual. Erişim 04.04.2012.
http://www.fda.gov/Food/ScienceResearch/LaboratoryMethods/BacteriologicalAnal
yticalManualBAM/ucm063346.htm.
FDA. (2001b). Food and Drug Administration. Chapter 12. Staphylococcus aureus.
Bacteriological Analytical Manual. Erişim 04.04.2012.
http://www.fda.gov/Food/ScienceResearch/LaboratoryMethods/BacteriologicalAnal
yticalManualBAM/ucm071429.htm.
FDA. (2001c). Food and Drug Administration. Chapter 18. Yeast, Molds and
Mycotoxins. Bacteriological Analytical Manual. Erişim 04.04.2012.
http://www.fda.gov/Food/ScienceResearch/LaboratoryMethods/BacteriologicalAnal
yticalManualBAM/ucm071435.htm.
FDA. (2003). Food Sampling and Preparation of Sample Homogenate Chapter 1
Bacteriological
Analytical
Manual.
Erişim
04.04.2012.
http://www.fda.gov/Food/FoodScienceResearch/LaboratoryMethods/ucm063335.htm.
FDA. (2007). Food and Drug Administration. Chapter 5. Salmonella Bacteriological
Analytical
Manual.
Erişim
04.04.2012.
http://www.fda.gov/Food/ScienceResearch/LaboratoryMethods/BacteriologicalAnalytic
alManualBAM/ucm071429.htm.
Fung, D.Y.C. (2002). Rapid Methods and Automation in Microbiology. Comprehensive
Reviews In Food Science And Food Safety, 1, 3-22.
42
Giray, H. ve Soysal, A. (2007). Türkiye’de Gıda Güvenliği ve Mevzuatı. TSK Koruyucu
Hekimlik Bülteni, 6 (6), 485-490.
Gray, M.L. ve Killinger, A.H. (1966). “Listeria monocytogenes and Listeria Infections”
Bacteriology Reviews, 30, 309-382.
Griffith, M.W. (1993). Applications of bioluminescence in the dairy industry. Journal
of Dairy Science, 76, 3118-3125.
Griffith, J., Blucher, A., Fleri, J. ve Fielding, L. (1994). An evaluation of luminometry
as a technique in food microbiology and comparison of six commercially available
luminometers. Food Science Teknology, 8 (4), 209-216.
Griffith, C.J., Davidson, C.A., Peters, A.C. ve Fielding, L.M. (1997). Towards a
strategic cleaning assessment programme: hygiene monitoring and ATP luminometry,
an options appraisal, Food Science and Technology, 11, 15–24.
Griffith, C.J., Cooper, R.A., Gilmore, J., Davies, C. ve Lewis, M. (2000). An evaluation
of hospital cleaning regimes and standards. Journal of Hospital Infection 45, 19–28.
Guilbaud, M., Coppet, P., Bourion, F., Rachman, C., Prevost, H. ve Dousset, X. (2005).
Quantitative Detection of Listeria monocytogenes in Biofilms by Real-Time PCR.
Applied and Environmental Microbiology, 71 (4), 2190-2194.
Güder, G. (2006). Avrupa Birliği gıda güvenliği politikası ve üyelik sürecinde
Türkiye’ye yansımaları. Avrupa Birliği ile İlişkiler Genel Müdürlüğü, Uzmanlık Tezi,
Ankara.
Güler, Ç. ve Çobanoğlu, Z. (1994). Besin Kirliliği. Sağlık Bakanlığı Çevre Sağlığı
Temel Kaynak Dizisi. Ankara, 12–17.
Günel, T. ve Aydınlı, K. (2009). Real-Time PCR ve Uygulama Alanları. Türk Bilimsel
Derlemeler Dergisi, 2 (2), 43-45.
43
Hanna, S.E., Connor, C.J. ve Wang, H.H. (2005). Real-time polymerase chain reaction
for the food microbiologist: technologies, applications, and limitations. Journal of Food
Science. 70, 49-53.
Harris, L.J. ve Griffiths, M.W. (1992). The detection of foodborne pathogens by the
polymerase chain-reaction (PCR). Food Research International, 25, 457-469.
Hawronskyj, J.M. ve Holah J. (1997). ATP: A universal hygiene monitor. Trends in
Food Science and Technology, 8, 79-83.
Hayes, P.R. (1992). Food Microbiology and Hygiene, Second Edition, Chapman &
Hall, 34, 360-369.
Holah, J.T., Betts, R.P. ve Thorpe, R.H. (1988). The Use of Direct Epiflourescent
Microscopy (DEM) and the Epif-luorescent filter technique (DEFT) to Assess
Microbial Populations of food contact surfaces. Journal of Applied Bacteriology, 65 (3),
215-221.
IFS (2014). IFS Food Version 6, International Featured Standards, Germany.
ISO (2001). Microbiology of food and animal feeding stuffs-Horizontal method for the
enumeration of beta-glucuronidase-positive E. coli. Part 2: Colony-count technique at
44
degrees
C
using
5-bromo-4-chloro-3-indolyl
beta-D-glucuronide,
16649.
International Standart Organisation, Geneva, Switzerland.
ISO (2004). Microbiology of food and animal feeding stuffs-Horizontal methods for
sampling techniques from surfaces using contact plates and swabs, ISO 18593.
International Standart Organisation, Geneva, Switzerland.
ISO (2009a). Quality management systems. ISO 9000:2005. International Standart
Organisation, Geneva, Switzerland.
44
ISO (2009b). Prerequisite programmes on food safety. Part 1: Food manufacturing,
ISO 22002-1. International Standart Organisation, Geneva, Switzerland.
İşeri, Ö., Erol, İ. (2009). Hindi Etinden Kaynaklanan Başlıca İnfeksiyon ve
İntoksikasyonlar, Ankara Üniversitesi Veteriner Fakültesi Dergisi, 56, 47-54.
Jasson, V., Jacxsens, L., Luning, P., Rajkovic, A. ve Uytendaele, M. (2010). Alternative
microbial methods: An overview and selection criteria. Food Microbiology, 27, 710730.
Karaman, D.A., Altuğ, T. ve Ova, G. (2011). Gıda İşletmelerinde Ön Gereksinim
Programlarının Kurulması ve Uygulanması: Süt Sektörü Örneği. Adnan Menderes
Üniversitesi Ziraat Fakültesi Dergisi, 8 (1), 9-21.
Kartal, D.E. (2010). Gıda Kaynaklı İnfeksiyonlar, Osmangazi Üniversitesi Tıp Fakültesi
İnfeksiyon Hastalıkları ve Klinik Mikrobiyoloji A.B.D. Food Safety. Erişim 17.03.2010
http://www.nuveforum.net/1598-hastaliklar/216977-gida-kaynakli-infeksiyonlar.
Kastango, E. ve Faylor, K. (2000). Block SS, ed. AAMI steam sterilization assurance in
health care facilities, In Disinfection, Sterilization and Preservation, 5, 22.
Kawasaki, S., Fratamico, P.M., Horikoshi, N., Okada, Y., Takeshita, K., Sameshima ve
T., Kawamoto, S. (2009). Evaluation of a multiplex PCR system for simultaneous
detection of Salmonella spp., Listeria monocytogenes, and Escherichia coli O157:H7 in
foods and in food subjected to freezing. Foodborne Pathogens and Disease, 6, 81-89.
Kaymaz, Ş. (1987). Ankara’da tüketime sunulan hamburgerlerde halk sağlığı yönünden
önemli bazı bakterilerin saptanması. Ankara Üniversitesi Veteriner Fakültesi Dergisi,
34 (3), 377-393.
Keeratipibul, S., Techaruwichit, P. ve Chaturongkasumrit, Y. (2009). Contamination
sources of coliforms in two different types of frozen ready-to-eat shrimps. Food
Control, 20, 289-93.
45
Koçak, N. (2007). ISO 22000: Gıda Güvenliği Yönetim Sistemleri Uygulama Sürecinde
Temel Adımlar, Dokuz Eylül Üniversitesi Sosyal Bilimler Enstitüsü Dergisi, 9, 4.
Kul, S. (2014). İstatistik sonuçlarının yorumu: p değeri ve güven aralığı nedir? Bulletin
of Pleura/Plevra Bülteni, 8, 11-13.
Kumar, R., Surendran, P.K. ve Thampuran, N. (2008). Evaluation of culture, ELISA
and PCR assays for the detection of Salmonella in seafood. Letters in Applied
Microbiology, 46, 221-226.
Kusumaningrum, H.D., Riboldi, G., Hazeleger, W.C. ve Beumer, R.R. (2003). Survival
of foodborne pathogens on stainless steel surfaces. International Journal of Food
Microbiology, 85, 227– 236.
Larson, L.E., Ailello, A.E., Gomez-Duarte, C., Lin, S.X., Lee, L., Della-Latta, P. ve ark.
(2003). Bioluminescense ATP Monitoring as a Surrogate Marker for Microbial Load on
Hands and Surfaces in the Home. Food Microbiology, 20, 735-739.
Lehto, M., Kuisma, R., Määttä, J., Kymäläinen, H.R., Mäki, M. (2011). Hygienic level
and surface contamination in fresh-cut vegetable production plants. Food Control, 22,
469-475.
Leon, M.B. ve Albrecht, J.A. (2007). Comparison of adenosine triphosphate (ATP)
bioluminescence and aerobic plate counts (APC) on plastic cutting boards. Journal of
Food Service, 18, 145-152.
Lilja, L. ve Hanninen, M.L. (2001). Evaluation of a commercial automated ELISA and
PCR-method for rapid detection and identification of Campylobacter jejuni and
Campylobacter coli in poultry products. Food Microbiology, 18, 205-209.
46
Mafu, A.A., Pitre, M. ve Sirois, S. (2009). Real-Time PCR as a Tool for Detection of
Pathogenic Bacteria on Contaminated Food Contact Surfaces by Using a Single
Enrichment Medium. Journal of Food Protection, 5, 1156-1354.
McEIroy, W.D. (1947). The Energy Source for Bioluminescence in an Isolated System.
Zoology, 33, 342-345.
McEIroy, W.D. ve Strehler, B.L. (1949). Factors Influencing the Response of the
Bioluminescent Reaction to ATP. Archives of Biochemistry and Biophysics, 22, 420433.
Moore, G. ve Griffith, C. (2002). Acomparison of surface sampling methods for
detecting coliforms on food contact surfaces. Food Microbiology, 19, 65-73.
Moore, G., Smyth, D., Singleton, J. ve Wilson, P. (2010). The Use of Adenosine
Triphosphate Bioluminescense to Assess the Efficacy of a Modified Cleaning Program
İmplemented Within an Intensive Care Setting. American Journal of Infection Control,
London, 38, 617-622.
Mullis, K.B. ve Faloona, F.A. (1987). Specific synthesis of DNA in vitro via a
polymerasecatalyzed chain reaction. Methods in Enzymology, 155, 335-350.
Nero, L.A., Rodrigues, L.D., Vicosa, G.N. ve Ortolani, M.B.T. (2008). Performance of
petrifilm aerobic count plates on enumeration of lactic acid bacteria in fermented milks.
J. Rapid Methods Automatic Microbiology, 16, 132-139.
Noble, R.T. ve Weisberg, S.B. (2005). A review of technologies for rapid detection of
bacteria in recreationalwaters. Journal of Water and Health, 3(4), 381–392.
Nyachuba, G.D. ve Donnelly, W.C. (2007). Comparison of 3M™ Petrifilm™
Environmental Listeria Plates against Standard Enrichment Methods for the Detection
of Listeria monocytogenes of Epidemiological Significance from Environmental
Surfaces. Journal of Food Science, 72 (9), 346-354.
47
Ögüt, S. ve Polat, M. (2009). Bazı Beş Yıldızlı Otellerde Hazırlanan Gıdaların
Mikrobiyolojik Açıdan Değerlendirilmesi, Süleyman Demirel Üniversitesi Yaşam
Dergisi, 1 (2), 12-16.
Özcan, N. ve İkincioğulları, D. (2009). Ulusal Zehir Danışma Merkezi 2008 Yılı
Çalışma Raporu Özeti. Türk Hijyen ve Deneysel Biyoloji Dergisi, 66 (3), 29-58.
Özdamar, K. (1999). SPSS ile Biyoistatistik. Kaan Kitabevi, Eskişehir.
Özkaya, D.F. ve Cömert, M. (2008). Gıda Zehirlenmelerinde Etken Faktörler. Türk
Hijyen ve Deneysel Biyoloji Dergisi, 65 (3), 149-158.
Pettipher, G.L., Watts, Y.B., Langford, S.A. ve Kroll, R.G. (1992). Preliminary
evaluation of cobra, an automated DEFT instrument, for the rapid enumeration of
microorganisms in cultures, raw-milk, meat and fish. Letters in Applied Microbiology,
14, 206-209.
Rosmini, M.R., Signorini, M.L., Schneider, R., Bonazza, J.C., (2004). Evaluation of two
alternative techniques for counting mesophilic aerobic bacteria in raw milk. Food
Control, 15, 39-44.
Sala, C., Mılovan, G.H., Morar, A. ve Nıchıta, I. (2008). Establishing the Microbial
Contamination of Surtaces from the Food Industry by Alternative Methods Using ATP
Bioluminescense. Lucrărı Stıınłıfıce Medıcınă Veterınară, 41, 841-846.
Salo, S., ve Laine, A. (2000). Validation of The Microbiological Methods Hygicult
Dipslide, Contact Plate, and Swabbing in Surface Hygiene Control. Journal of AOAC
Internatıonal, 83 (6), 1357-1366.
Schmelder, J.L., Kalinowski, R.M. ve Bodnaruk, P.W. (2000). Evaluation of the
petrifilm (TM) and redigel (TM) as rapid methods to the standard plate count method
48
for the enumeration of processed meats and environmental samples. Journal of Rapid
Methods and Automation in Microbiology, 8, 65-70.
Serpen, A. (2007). AB Sürecinde Türkiye’de Gıda Güvenliğinin Dünü, Bugünü ve
Yaşanmakta olan Kargaşanın Değerlendirilmesi. Hayvancılıkta Performans Dergisi,
108-109.
Settanni, L., ve Corsetti, A. (2007). The use of multiplex PCR to detect and differentiate
food- and beverage-associated microorganisms: a review. Journal of Microbiological
Methods, 69, 1-22.
Sierra, M.L., Sheridan, J.J. ve McGuire, L. (1997). Microbial quality of lamb carcasses
during processing and the acridine orange direct count technique (a modified DEFT) for
rapid enumeration of total viable counts. International Journal of Food Microbiology,
36, 61-67.
Silva, B.O., Caraviello, D.Z., Rodrigues, A.C. ve Ruegg, P.L. (2005). Evaluation of
petrifilm for the isolation of Staphylococcus aureus from milk samples. Journal of
Dairy Science, 88, 3000-3008.
Siragusa, G.R., Cutter, C.N., Dorsa, W.J. ve Koohmaraie, M. (1995). Use of a Rapid
Microbial ATP Bioluminescence Assay to Detect Contamination on Beef and Pork
Carcasses. Journal of Food Protection, 58 (7), 770-775.
Slade, P.J. (1992). Monitoring Listeria in the food production environment. I.
Dectection of Listeria in processing plants and isolation methodology. Food Research
International, 25 (1), 45-56.
Sokolınkska, C.D. ve Pikul, J., (2008). Evalution of Steel Surface Cleanliness Level in
Dairies Using the Bioluminescense Method. Bull Vet Inst Pulawy, 52, 625-629.
Stanley, P.E. (1992). A survey more than 90 commercially available luminometeres and
imaging
devices
for
low
light
measurements
of
chemiluminescence
and
49
bioluminescence, including instruments for manual, automatic and specialised
operation, for HPLC, LC, GLC and microtitre plates. Journal of Bioluminescence and
Chemiluminescence, 7, 77-108.
Szabo, I., Scherer, K., Roesler, U., Appel, B., Nockler, K. ve Hensel, A. (2008).
Comparative examination and validation of ELISA test systems for Salmonella
typhimurium diagnosis of slaughtering pigs. International Journal of Food
Microbiology, 124, 65-69.
Şener, A. ve Temiz, A. (2004). Tavuk Kesimhane ve İşletmelerinde Kullanılan Ticari
Dezenfektanlar ve Etkinlikleri. Orlab On-Line Mikrobiyoloji Dergisi, 2 (10), 1-28.
Taban, B.M. ve Aytaç, S.A. (2008). Tavuk etlerinden Salmonella spp. belirlenmesine
yönelik hızlı bir yöntem. Gıda Dergisi, 33, 205-211.
Thacker, J.D., Casale, E.S. ve Tucker, C.M. (1996). Immunoassays (ELISA) for rapid,
quantitative analysis in the food-processing industry. Journal of Agricultural and Food
Chemistry, 44, 2680-2685.
Topalakçı, B.H. (2007). Özel Ankara Güven Hastanesi Menülerinde Yer Alan Menülere
Ait Standart Yemek Tariflerinin HACCP Sistemine Göre Düzenlenmesi. Yüksek Lisans
Tezi, Ankara
TSE (2003). Tehlike Analizi ve Kritik Kontrol Noktalarına (HACCP) Göre Gıda
Güvenligi Yönetimi-Gıda Üreten Kuruluşlar ve Tedarikçiler İçin Yönetim Sistemine
İlişkin Kurallar. TS 13001. Türk Standartları Enstitüsü, Ankara.
TSE (2006). Gıda Güvenliği Yönetim Sistemleri – Gıda Zincirindeki Tüm Kuruluşlar
İçin Şartlar. TS EN ISO 22000. Türk Standartları Enstitüsü, Ankara.
Uğur, M., Nazlı, B. ve Bostan, K. (2001). Gıda Hijyeni. Teknik Yayınevi, İstanbul, 5758.
50
USDA (2013). Foodborne Illness: What Consumers Need to Know. Erişim 28.02.2015.
http://www.fsis.usda.gov/wps/portal/fsis/topics/food-safety.
Ünlütürk, A. ve Turantaş, F. (1999). Gıda Mikrobiyolojisi. Mengi Tan Basımevi, İzmir.
Valat, C., Champiat, D., N’Guyen, T.T.T., Loiseau, G., Raimbault, M. ve Montet, D.
(2003). Use of ATP bioluminescense to determine the bacterial sensitivity threshold to a
bacteriocin. Luminescense, 18, 254-258.
Vilar, M.J., Rodríguez-Otero, J.L., Diéguez, F.J., Sanjuán, M.L. ve Yus, E. (2008).
Application of ATP bioluminescence for evaluation of surface cleanliness of milking
equipment. International Journal of Food Microbiology, 125 (3), 357-361.
Whitehead, K.A., Smith, L.A. ve Verran, J. (2008). The detection of food soils and cells
on stainless steel using industrial methods: UV illumination and ATP bioluminescence.
International Journal of Food Microbiology, 127, 121–128.
WHO (2013). Botulism. Erişim 28.02.2015.
http://www.who.int/mediacentre/factsheets/fs270/en/.
Yang, Z., Li, Y.,ve Slavık, M. (1998). Use of antimicrobial spray applied with an inside
– outside birdwasher to reduce bacterial contamination on prechilled chicken carcasses.
Journal of Food Protection, 61(7), 829–832.
Yılmaz, A., Güven, F.M.K., Korkmaz, İ. ve Karabulut, S. (2006). Acil Serviste Akut
Zehirlenmelerin Retrospektif Analizi. Cumhuriyet Üniversitesi Tıp Fakültesi Dergisi, 1
(28), 21-26.
Yücel, P.K. ve Halkman, H.B.D. (2006). DEFT yöntemi ile gıdalarda mikroorganizma
yükünün belirlenmesi. Gıda Dergisi, 31 (2), 123-129.
51
ÖZGEÇMİŞ
Kişisel Bilgiler
Pınar
Adı
Soyadı
ÖZ
DoğumYeri Karataş/Adana
DoğumTarihi 1984
Uyruğu
T.C.
TC Kim No
Email
veterinarypinaroz@gmail.com Tel
19291121714
05305696939
Eğitim Düzeyi
Mezun Olduğu Kurumun Adı
Mez. Yılı
Doktora
Yük.Lis.
İstanbul Üniversitesi Veteriner Fakültesi
2015
Besin Hijyeni ve Teknolojisi Anabilim Dalı
Lisans
Selçuk Üniversitesi Veteriner Fakültesi
2007
Lise
Seyhan ÇEAŞ Anadolu Lisesi
2001
İş Deneyimi (Sondan geçmişe doğru sıralayın)
Görevi
Kırklareli
1. Veteriner Hekim
2.
Süre (Yıl - Yıl)
Kurum
İl
Gıda
Tarım
ve
Hayvancılık Müdürlüğü
Akredite Veteriner Hekim Adana İl Gıda Tarım ve Hayvancılık
Müdürlüğü
Hizmetleri
3.
2010 – Halen
2008 - 2010
-
Yabancı
Okuduğunu
Dilleri
Anlama*
İngilizce
Çok İyi
Almanca Orta
Konuşma* Yazma*
KPDS/ÜD
İ.Ü. Sağ. Bil. Enst.
S
Yabancı Dil Sınavı
Puanı
Çok İyi
Çok İyi
Orta
Orta
Puanı
73
52
*Çok iyi, iyi, orta, zayıf olarak değerlendirin
ALES Puanı
Sayısal
Eşit Ağırlık
Sözel
70.408
70.128
78.285
(16.11.2008)
(16.11.2008)
(27.11.2011)
(Diğer) Puanı
Bilgisayar Bilgisi
Program
Kullanma becerisi
Microsoft Office, Word, Exel, Powerpoint
İyi
Moviemaker
İyi
Yayınları/Tebligleri Sertifikaları/Ödülleri
Öz, P. ve İzmirli, S. (2005). Son sınıf öğrencilerin alan seçimi üzerine bir tutum
araştırması. 7. Uluslararası Veteriner Öğrenci Kongresi. 12-14 Mayıs, 2005, İstanbul.
Özet Kitapçığı, 51-52.
Sertifikalar
06-10 Nisan 2015 Diksiyon ve Etkili Konuşma Eğitim Programı, Uluslararası Tarımsal
Eğitim Merkezi, Ankara
23-24 Şubat 2015 Kurumsal İletişim, Nitelikli Yönetim, Etkin ve Sonuç Odaklı Çalışan
Eğitimi Sertifikası. Kırklareli İl Gıda Tarım ve Hayvancılık Müdürlüğü, Kırklareli
17-18 Şubat 2015 Sulu Tarım Alanlarında Sürdürülebilirlik Çalıştayı. Kırklareli İl Gıda
Tarım ve Hayvancılık Müdürlüğü, Kırklareli
26 Ocak-06 Şubat 2015 Tarımsal Proje Hazırlama, Değerlendirme ve İzleme Eğitim
Programı. Uluslararası Tarımsal Eğitim Merkezi, Ankara
03-14 Kasım 2014 Sunum Teknikleri ve Eğitim Araçları Kullanımı Kurs Bitirme
Sertifikası. Adana Zirai Üretim İşletmesi Tarımsal Yayım ve Hizmetiçi Eğitim Merkezi,
Adana
17-19 Nisan 2014 4. Geleneksel Gıdalar Sempozyumu. Çukurova Üniversitesi, Adana
53
07-18 Nisan 2014 Proje Hazırlama ve Proje Döngüsü Yönetimi Kursu. Adana Zirai
Üretim İşletmesi Tarımsal Yayım ve Hizmetiçi Eğitim Merkezi, Adana
09-13 Eylül 2013 HACCP Tetkik Eğitimi. Bursa İl Gıda Tarım ve Hayvancılık
Müdürlüğü, Bursa
13-17 Mayıs 2013 Temel HACCP Eğitimi. Konya İl Gıda Tarım ve Hayvancılık
Müdürlüğü, Konya
19-23 Kasım 2012 Organik Tarım. Eğitim Yayım ve Yayınlar Dairesi Gıda Tarım ve
Hayvancılık Bakanlığı, Antalya
10-12 Eylül 2012 Proje Döngüsü Yönetimi (PCM) Eğitimi Sertifikası. Trakya
Kalkınma Ajansı, Kırklareli
10-21 Ocak 2011 Bilgisayar Temel Eğitimi (Windows XP Pro, Ms Office 2003 WordExcel-Powerpoint, İnternet), Uluslararası Tarımsal Eğitim Merkezi, Ankara
03-06 Haziran 2010 1. Uluslararası Katılımlı Veteriner Hekimliği Kongresi. İstanbul
Harbiye Askeri Müze Kültür Sitesi, İstanbul
19-20 Temmuz 2008 ISO 9001:2000 Kalite Yönetim Sistemi Kuruluş İçi Kalite
Tetkikçi Eğitimi Sertifikası. Analiz Yönetim Danışmanlığı, Adana
07-09 Temmuz 2007 Akredite Veteriner Hekim Sertifikası. Selçuk Üniversitesi
Veteriner Fakültesi, Konya
12-14 Mayıs 2005 7. Uluslararası Veteriner Öğrenci Kongresi Katılım Sertifikası.
İstanbul Üniversitesi Veteriner Fakültesi, İstanbul
Özel İlgi Alanları (Hobileri): Yüzme, Nesir Yazma, Fotoğrafçılık, Resim Yapma