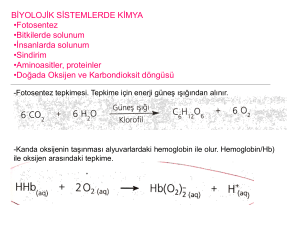
VIII. Ulusal Kimya Kongresi, Marmara Üniversitesi, 7-11 Eylül 1992, Istanbul
CANDİDAL LİPAZ İLE TRİOLEİN HİDROLİZİNE ARAYÜZEY
ÖZELLİKLERİNİN ETKİSİ
H. İbrahim EKİZ ve Arif ÇAĞLAR
Fırat Üniversitesi, Kim ya Mühendisliği Bölümü,
23279 Elazığ-Turkey
THE INFLUENCE OF THE INTERFACIAL BEHAVIOR ON THE HYDROLYSIS OF
TRIOLEIN BY A CANDIDAL LIPASE
SUM M ARY
In the hydolysis o f triolein by the lipase o f Candida cylindracea, attempts have
been made to study the variation o f the initial rates o f hydrolysis with the amaout o f
enzyme adsorbed at the lipid/water interface.
Experim ents have been conducted in a continsously stirred batch reactor
containing triolein the form at emulsion droplets. With reference to the results o f
adsorption measurement, it was confirmed that the rate o f surface reaction is directly
propartional with the amount o f en 2ym e adsorbed on emulsion droplets o f triolein.
ÖZET
C andida cylin d racea lip a zı ile
triolein in
hidroliz
tepkim esin de
lip id /su
arayüzeyinde adsorbe olan enzim m iktarı ile başlangıç hidroliz hızlarının değişimi
araştırıldı. Deneyler, trioleinin emülsiyon tanecikleri şeklinde bulunduğu sürekli
kan ştırm aîı kesikli b ir tepkim e kabında yürütülm üştür. Adsorpsiyon ölçüm
sonuçlan yüzey tepkim e hızının trioleinin emülsiyon dam lacıklarındaki adsorbe
olan enzim miktarı ile direkt olarak orantılı olduğunu göstermektedir.
GİRİŞ
Lipazîar
gliserin
esterlerin i
h idroliz
eden
enzim ler
olarak
tanımlanırlar. Lipazların en önemli özelliği hidroliz tepkim esini
hidrofobik arayüzeylerde yüksek etkinlikle yürütülebilmesidir. Sulu
ortamda çözünmeyen sıvı trigîiseridler lipazîar tarafından yüksek
oranlarda hidrolizlenirlerse de, katı ve sulu ortamda çözünebilen sıvı
trigîiseridler daha düşük oranlarda hidroliz edilebilirler (1). Bu çalışmada
sıvı trigliseridlerden trioleinin Candida cylindracea llpazı ile hidrolizinde,
223
KimyaKongreleri.org
VIII. Ulusal Kimya Kongresi, Marmara Üniversitesi, 7-11 Eylül 1992, Istanbul
(triolein/su) arayüzeyine tutunan enzim miktarının hidroliz hızına etkisi
araştırılmıştır.
DENEL BÖLÜM
Deneysel Çalışma
Deneyler pH, sıcaklık ve karıştırma hızının denetlenebildiği sürekli
karıştırmah 350 mİ kapasiteli kesikli bir tepkime kabında 35 C sıcaklıkta,
pH=6’da ve 600 dev/dk. karıştırma hızında yapıldı. Deneylerde. 0.01 M fosfat
tamponunda hazırlanan Candlda cylindracea lipazı kullanıldı. Bütün
deneylerde ortama 0.137 M NaCl, 3.75xl0 '3 M CaCl2 2 .5 x l0 '3 M NaAc,
çalışılan derişimde tıiolein ve enzim çözeltisi eklendi.
Adsorpsiyon Ölçümü
Yağ/su emülsiyonunda dinamik koşullar altında yani karıştırma devam
ederken, tepkime kabı içine daldırılan bir fîltreleme düzeneği ile su
evresinden örnek alınarak, serbest enzim miktarı ve dolaylı olarakta yüze
tutunan enzim miktarı belirlendi (2 ve 3). Bu amaçla kullanılan filtreleme
düzeneği, tepkime sürerken tepkime kabına daldırılarak örnekler alındı.
Alman Örneklerin hacmi, her deneme için sabit olup (30 mİ.), içerdikleri
enzim miktarını saptamak amacıyla ikinci bir tepkime kabına aktarıldı ve
üzerine hacimce %2 tribütirin eklenerek hidroliz hızı saptandı. Daha
önceden hazırlanan tepkime hızına karşı enzim derişimi grafikleri
yardımı ile örneklerdeki enzim derişimi saptandı. Arayüzeydeki enzim
miktarı, enzim derişiminden su evresindeki enzim derişimi çıkarılarak
hesaplandı. Tüm kalibrasyon grafikleri ve Örnek alma işlemleri, süre ve
yöntem açısından standarttır.
SONUÇLAR ve TARTIŞMA
Bu çalışmada, arayüzeyin hidroliz tepkimesindeki etkisini deneysel
olarak ortaya koymak amacıyla (triolein/su) emülsiyonunda arayüzeye
tutunan enzim miktarı ve hidroliz tepkimesinin hızı sap tandı. Sabit enzim
derişimınde (12.5 mg/1, protein olarak), başlangıç tepkime hızı ve arayüzeye
tutunan enzim miktarının triolein derişimi ile değişimi Ş ek il- l'd e
görülmektedir. Tepkime hızı %0-1.0 triolein derişimi aralığında artmakta
bu derişim aşıldıktan sonra azalmaktadır. Arayüzeye tutunan enzim
miktnn ise sabit kalmaktadır. Arayüzeye tutunan enzimin oluşturduğu
224
KimyaKongreleri.org
VIII. Ulusal Kimya Kongresi, Marmara Üniversitesi, 7-11 Eylül 1992, Istanbul
tepkime hızı (=yüzey hızı) ile toplam tepkime lıızı arasında doğrusal bir
İlişki olduğu saptanmıştır (ŞefciI-2). Toplam trioleln derişimi sabit
tutulduğunda (%1 v/v), aynı ilişki farklı enzim derişlmleriııde de
görülmektedir (Şefciî-3). Arayüzeyde enzim derişîminin artışı ile bir enzim
molekülü tarafından birim zamanda dönüştürülen tepkiyen molekülü
sayısı {-enzim etkinliği yaklaşık sabit kalmaktadır.
Ş e k iî-1 .Trtoletn hidrolizinde başlangıç tepkime hızt ve arayûzeye
utunan enzim miktarının triolein derişimi ile değişimi.
Şekil-2.Triolein hidrolizinde başlangıç tepkime hızının yüzey hızı ile
değişimi.
225
KimyaKongreleri.org
VIII. Ulusal Kimya Kongresi, Marmara Üniversitesi, 7-11 Eylül 1992, Istanbul
IMMOBILIZE LİPAZLARLA ESTERİFİKASYON REAKSİYONLARI
10 •
•70
<
(,0
-
o
İz
50 ■
3r
S
i
'!U -
£
sC
30 20 10 *
r
u
m
0 "
0
- 50
"
■40
iE.
g
»o
20
30
40
Ayten SAĞIROĞLU *, Azmi TELEFONCU **
* Trakya Üniversitesi Fen-Edebiyat Fakîdtesi Kimya BölCımü Biyokimya Anabilim Dalı
Yr&Doç.Dr. EDİRNE
y
Hîo ; 5
.'S
*• Ege Üniversitesi Fen Fakültesi Kimya Bölümü. Prof.Dr. Bornova- İZM R
3
■«0 >6-1
isi
■o S
ESTERIFICATION REACTIONS W ITH IMMOBILIZED LIPASES
■20
H
ti
3
N
C7*
•GO .§
c
X>
|
50
Enzim Der işi mi ( mg/L)
Şekil-3.Sabit
Ti'iolein derişîminde (%1 fıacimce), başlangıç tepkime hızı
ve arayüzeye tutunan enzim miktarının toplam enzim derişimi
İle değişimi
KAYNAKLAR
L Ekiz. H.Î.. Çağlar, A.. Uçar, T,, "A Rapid equilibrium approach to the
InterfaciaJ Kinetics of Lipid Hydrolysis by a Candidal Lipase”, Chem.
Eng. J., 38, B7-B11. 1988.
2. Uçar, TL, Ekiz, H. Î., Çağlar, A., "Surface Effects of Solvents in the
Hydrolysis o f W ater Soluble Lipids by a Candidal Lipase",
Bio tech. Bİoeng., 33, 1213-1218, 1989.
3. Ekiz, H. I,, Uçar, T., Çağlar, A., 'The Influence of Ethyl Acetate on the
Interfacial Behavior of Reaction Media During the Hydrolysis o f
Tributyrin by a Candidal Lipase", 5th European Congress on Biotech.,
244, Copanhagen, 1990.
SUMMARY
immobilization of Upases from two different sources was carried out by covalent
bonding with aqarose activated with CNBr. The product was trapped in a polimerie qel
matrix with adsorption to celite and macroporose Amberlit IRA-938 resin.
It was confirmed that immobilize lipases preparated by using the Amberlite IRA 938
are most suitable biocatalysts of esterification reactions. In this reactions izovaleric acid with
racemic and nonracemic pentanol izomerises were used as reactants. By immobilize lipases
stereo specific esters were synthesized and thus resolution of rocemic alcohols was achieved,
and also nonracemic alcohols was obtained esterification.
ÖZET;
İki çeşit lipaz enzimi; CNBr ile akiive edilmiş aqaroza kovalent bağlanarak, akril
amid ve Bis’ten hazırlanan polimer matrikse tutuklanarak Celiie ve Amberlit IRA 938
reçinesine adsorbsiyon yöntemiyle immobilize edildiler.
Bunlaıtİan esterifikasyon reaksiyon]an için en uygun olanı Amberlit II*A 938 poröz
reçinesine immobilize edilen lipaz preparation oldu. Reaksiyonlar izovalerik asit ite rasemik
ve rasemik olmayan beş çeşit pentanol izomerleri arasında gerçekleştirildi. Hazırlanan
immobilize lipazlann biyokatalizatör olarak kullanıldığı bu reaksiyonlarda stereospesifık
esterler sentezlendi ve rasemik alkoller resolusyona uğrarken rasemik olmayan alkollerde de
esterleşme gözlendi.
GİRİŞ
Esterifikasyon; karboksilli aslUe bir alkol veya türevlerinin reaktant olarak
kullanıldığı özel ve önemli esterlerin ve alkollerin senlezlendiği bir prosesür (1-5)
günümüzde diğer organik sentezlerde olduğu gibi esterifikasyon reaksiyonlarında
da enzimler bazı önemli avantajları nedeniyle sıklıkla kullanılmaktadır
(8, 10, 11 , 12). Özellikle esteraz ve lipaz enzimlerinin spesifiteleri ve
selektivitelerinden yararlanarak diğer kimyasal yöntemlerle eldesi zor ve pahalı
olan ticari öneme sahip ürünlerin elde edilmesi amacıyla uygulanmaktadır (6.9).
Serbest enzimlerin yumuşak koşullar gerektirmesi, hassas spesifıte ve
227
KimyaKongreleri.org