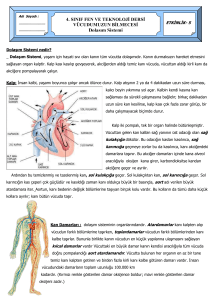
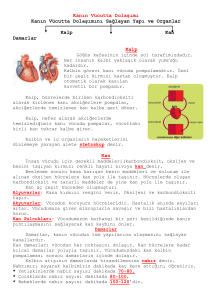
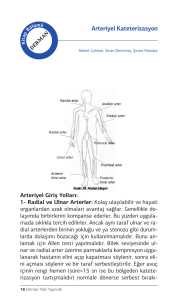
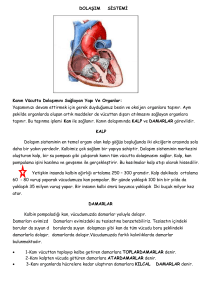
HETEROZĠGOT ORAK HÜCRE ANEMĠSĠ TAġIYICILARINDA
advertisement

T.C. ÇUKUROVA ÜNĠVERSĠTESĠ TIP FAKÜLTESĠ KARDĠYOLOJĠ ANABĠLĠM DALI HETEROZĠGOT ORAK HÜCRE ANEMĠSĠ TAġIYICILARINDA ARTERĠYEL SERTLĠK VE NABIZ DALGA YANSIMASI Dr. Tünzale BAYRAMOĞLU UZMANLIK TEZĠ TEZ DANIġMANI Prof. Dr. Esmeray ACARTÜRK ADANA-2011 I T.C. ÇUKUROVA ÜNĠVERSĠTESĠ TIP FAKÜLTESĠ KARDĠYOLOJĠ ANABĠLĠM DALI HETEROZĠGOT ORAK HÜCRE ANEMĠSĠ TAġIYICILARINDA ARTERĠYEL SERTLĠK VE NABIZ DALGA YANSIMASI Dr. Tünzale BAYRAMOĞLU UZMANLIK TEZĠ TEZ DANIġMANI Prof. Dr. Esmeray ACARTÜRK ADANA-2011 I TEġEKKÜR Gerek tüm kardiyoloji eğitimim boyunca, gerek tez çalıĢmam esnasında desteğini benden esirgemeyen, bilgilerinden her daim yararlandığım Kardiyoloji Anabilim Dalı BaĢkanı, tez danıĢmanım değerli hocam Prof. Dr. Esmeray Barın Acartürk‟e, manevi desteklerinden dolayı, uzmanlık eğitimim süresince bilgi ve deneyimleriyle bana yol gösteren ve mesleki geliĢimimde katkıları olan değerli hocalarıma, beraber çalıĢmaktan ve tanımaktan mutluluk duyduğum asistan arkadaĢlarıma, kardiyoloji klinik çalıĢanlarına: hemĢire, sekreter, personeline, kan hastalıkları Koruma, Tedavi ve DayanıĢma Derneği 2. BaĢkanı Soner Ballıya ve sevgili oğluma sonsuz teĢekkürlerimi sunarım. Dr. Tunzale Bayramoğlu 2011 I ĠÇĠNDEKĠLER TEġEKKÜR......................................................................................................................I ĠÇĠNDEKĠLER ................................................................................................................II TABLO LĠSTESĠ ............................................................................................................IV ġEKĠL LĠSTESĠ ...............................................................................................................V KISALTMA LĠSTESĠ ....................................................................................................VI ÖZET ........................................................................................................................... VIII ABSTRACT....................................................................................................................IX 1. GĠRĠġ VE AMAÇ .........................................................................................................1 2. GENEL BĠLGĠLER ......................................................................................................3 2.1. Orak Hücre Anemisi ............................................................................................. 3 2.1.1.Tanım ........................................................................................................... 3 2.1.2. Prevelans ve Coğrafi Dağılım ..................................................................... 4 2.1.3. Patofizyoloji ................................................................................................ 5 2.1.4. Orak Hücre Anemisinin Genetik GeçiĢi ..................................................... 8 2.1.5. Klinik Bulgular ........................................................................................... 9 2.1.5.1. Hematolojik Bulgular ..................................................................... 9 2.1.5.2. Hematolojik Olmayan Bulgular ................................................... 10 2.1.6. Orak Hücre Anemisinin Tanısı ................................................................. 10 2.1.6.1. Ayırıcı Tanı .................................................................................. 11 2.1.7. Orak Hücre Anemisinde Tedavi ............................................................... 11 2.1.7.1.Genel Tedavi YaklaĢımı ................................................................ 11 2.2. Aneminin Kardiyovasküler Sisteme Etkileri ...................................................... 11 2.2.1. Orak Hücre Anemisinin Kardiyovasküler Sisteme Etkileri ...................... 14 2.3. Aortun Elastik Özellikleri ................................................................................... 15 2.3.1. Arteriyel Sertlik......................................................................................... 15 2.3.1.1. Arteriyel Sertlik OluĢum Mekanizmaları ..................................... 17 2.3.1.2. Arteriyel Sertliğin Yapısal BileĢenleri ......................................... 18 2.3.1.3. Arteriyel Sertlikte Hücrelerin Rolü .............................................. 19 2.3.1.4. Arteriyel Sertlik Aterosklerotik Olayları Öngörebilir mi? Patofizyoloji .............................................................................................. 20 2.3.1.5. Arteriyel Sertlik Göstergeleri ....................................................... 21 2.3.1.6. Arteriyel Sertlik ve Genetik ....................................................... 21 2.3.1.7.Santral Nabız Basıncı, Artırma Göstergesi ve Arteriyel Sertlik .... 21 2.3.1.8. Santral Dalganın Analizi .............................................................. 22 2.3.1.9.Nabız Dalga Hızı Ölçüm Yöntemleri ............................................ 23 2.3.1.10. Nabız Dalga Hızı ve Arteriyel Sertlik ........................................ 23 2.3.1.10. Nabız Dalga Hızını Etkileyen Faktörler ..................................... 26 2.3.1.11. Arteriyel Sertliğin Klinik Anlamı ve Önemi ............................... 27 3. GEREÇ VE YÖNTEM ...............................................................................................28 3.1. Gruplar ................................................................................................................ 28 3.2. DıĢlama Ölçütleri ................................................................................................ 29 3.3. Öykü .................................................................................................................... 30 3.4. Fizik Bakı ............................................................................................................ 30 3.5. Kan Basıncı Ölçümü ........................................................................................... 30 3.6. Laboratuvar Ġnceleme.......................................................................................... 31 II 3.7. Ekokardiyografik Ġnceleme ................................................................................. 31 3.8. Arteriyel Sertlik Ölçümü ..................................................................................... 32 3.9. Ġstatistik Yöntemleri ............................................................................................ 33 4. BULGULAR ..............................................................................................................35 4.1. Grupların Demografik Özellikleri ve Sigara Kullanımı...................................... 35 4.2. Ekokardiyografik Bulgular.................................................................................. 35 4.3. Hematolojik Bulgular .......................................................................................... 36 4.4. Biyokimya Değerleri ........................................................................................... 39 4.5. Arteriografiden Elde Edilen Bulgular ................................................................. 42 4.5.1. HbAS ve HbAA Gruplarında Kalp Hızı ve Basınçların KarĢılaĢtırılması 42 4.5.2. HbAS ve HbAA Grupları Arasında Arteriyel Sertlik Belirteçlerinin KarĢılaĢtırılması .................................................................................................. 43 4.5.3. Arteriyel Sertlik Belirteçleri Ġle Bağımsız DeğiĢkenler Arasındaki ĠliĢkiler46 4.5.3.1. Toplam AraĢtırma Gruplarında Nabız Dalga Hızı, Artırma Göstergesi ve Bağımsız DeğiĢkenler Arasındaki ĠliĢki ............................. 46 4.5.3.2. Gruplar Ġçinde Nabız Dalga Hızı, Artırma Göstergesi ve Bağımsız DeğiĢkenler Arasındaki ĠliĢki .................................................................... 47 5. TARTIġMA ................................................................................................................51 5.1. Konunun Güncelliği ............................................................................................ 51 5.2. Hastaların Demografik Özellikleri ...................................................................... 52 5.3. Hematolojik Bulgular .......................................................................................... 53 5.4. Ekokardiyografik Bulgular................................................................................. 54 5.5. Biyokimya ........................................................................................................... 54 5.6. Kalp Hızı ve Basınçlar ........................................................................................ 55 5.7. Toplam AraĢtırma Gruplarında Arteriyel Sertlik ................................................ 56 5.8. HbAS Bireylerinde Arteriyel Sertlik ................................................................... 56 5.9. Toplam AraĢtırma Gruplarında Aortik Nabız Dalga Yansıması......................... 57 5.10. HbAS Bireylerinde Aortik Nabız Dalga Yansıması ......................................... 58 6. SONUÇ VE ÖNERĠLER ............................................................................................59 6.1.Sınırlamalar .......................................................................................................... 59 6.2. Öneriler ............................................................................................................... 60 7. KAYNAKLAR ...........................................................................................................62 8. ÖZGEÇMĠġ ................................................................................................................70 III TABLO LĠSTESĠ Tablo No Sayfa No Tablo 1. Normal ve OHA’si hastalarındaki hemoglobin tiplerinin karĢılaĢtırılması ........................ ..4 Tablo 2. OHA sendromlarında hemoglobin dağılımı .......................................................................... ..9 Tablo 3. OHA’ya bağlı kronik organ harabiyetlerinin baĢlama yaĢı, dağılımı ve görülme sıklığı .. 10 Tablo 4. Arteriyel sertlik değiĢkenleri ................................................................................................... 16 Tablo 5. Arteriyel sertlik göstergeleri ............................................................................................. 21 Tablo 6. Grupların demografik özellikleri ve sigara kullanım dağılımı ............................................ 35 Tablo 7. Gruplara ait EKO bulguları ................................................................................................... 36 Tablo 8. Kontrol ve taĢıyıcı gruplarında hematolojik bulgular .......................................................... 37 Tablo 9. TaĢıyıcı ve kontrol gruplarında biyokimya testlerinin istatistiksel değerlendirilmesi (P<0,05) .................................................................................................................................................... 40 Tablo 10. TaĢıyıcı ve kontrol gruplarında KH ve basınç değiĢkenlerinin istatistiksel verileri (p<0,05) .................................................................................................................................................... 43 Tablo 11. TaĢıyıcı ve kontrol gruplarının arteriyel sertlik belirteçlerinin değerleri (P<0,05) ......... 44 Tablo 12. Toplam araĢtırma gruplarında değiĢkenler arasında bulunan istatistiksel anlamlı iliĢkiler ..................................................................................................................................................... 46 Tablo 13. HbAS ve HbAA gruplarında değiĢkenler ............................................................................ 48 Tablo 14. Aortik nabız dalga hızının belirleyicileri ............................................................................. 49 Tablo 15. Aortik artırma göstergesinin belirleyicileri ......................................................................... 50 IV ġEKĠL LĠSTESĠ ġekil No Sayfa No ġekil 1. Orak Hücre Anemisine yol açan nokta mutasyonun sebep olduğu aminoasit değiĢikliği ... ..3 ġekil 2. Orak hücre anemisi patofizyolojisi .......................................................................................... ..6 ġekil 3. Orak hücre anemisi hastalığında eritrositlerin elektron mikroskopik görünümü .............. ..7 ġekil 4. Orak hücre Anemisinin kalıtım modeli ................................................................................... ..8 ġekil 5. Aneminin kardiyovasküler sisteme etkileri ............................................................................. 13 ġekil 6. Arteriyel sertlik oluĢum mekanizmaları.................................................................................. 17 ġekil 7. Karotid nabız dalgasında artırma basıncının Ģematik gösterimi P1: Erken sistolik çentik; P2: Geç sistolik çentik; ∆P sistolik ve diyastolik basınç farkı ............................................................. 22 ġekil 8. Radiyal arterden yapılan basınç dalgası kaydı ve bileĢenleri (i, ii, iii) .................................. 25 ġekil 9. Karotis ve radiyal arterden eĢ zamanlı basınç dalgası kaydı ................................................ 26 ġekil 10. ÇalıĢma protokolü ................................................................................................................... 29 ġekil 11. TENSIOMed arteriograf ve ölçüm için hasta pozisyonu ..................................................... 33 ġekil 12. Sol panel: Arteriografın çalıĢma mekanizması. Sağ panel: Arteriyel sertliğin çeĢitli dereceleri için yapılmıĢ ve Nabız dalga hızı ile birinci ve ikinci doruk noktaları arasındaki zaman farkı arasındaki lineer iliĢkiyi gösteren bilgisayarlı model simülasyonu ........................................... 33 ġekil 13. Gruplara ait EKO bulgularının grafiği ................................................................................. 36 ġekil 14. Grupların MCV değerlerinin dökümü .................................................................................. 38 ġekil 15. Grupların MCH değerlerinin dökümü .................................................................................. 38 ġekil 16. Grupların RDW değerlerinin dökümü .................................................................................. 39 ġekil 17. Grupların sodyum(mmol/L) değerlerinin istatistiksel grafiği ............................................. 40 ġekil 18. Grupların potasyum (mmol/L) değerlerinin istatistiksel grafiği ......................................... 41 ġekil 19. Grupların Total-K (mg/dl) değerlerinin istatistiksel grafiği ................................................ 41 ġekil 20. Grupların LDL-K(mg/dl) değerlerinin istatistiksel grafiği .................................................. 42 ġekil 21. TaĢıyıcı ve kontrol gruplarında AoABmmHg değerlerinin istatistiksel karĢılaĢtırma grafiği ....................................................................................................................................................... 43 ġekil 22. Gruplarda Brakiyal AG değerlerinin istatistiksel karĢılaĢtırma grafiği ............................ 45 ġekil 23. Gruplarda Aortik AG değerlerinin istatistiksel karĢılaĢtırma grafiği ................................ 45 ġekil 24. Gruplarda sistolik-diyastolik NDH değerlerinin istatistiksel karĢılaĢtırma grafiği .......... 46 ġekil 25. Toplam araĢtırma gruplarında değiĢkenler arasında istatistiksel anlamlı iliĢkilerin grafiği ....................................................................................................................................................... 47 ġekil 26. Gruplar içinde değiĢkenler arasında istatistiksel anlamlı iliĢkilerin grafiği ...................... 49 V KISALTMA LĠSTESĠ AG : Artırma göstergesi Brakiyel AG : Brakiyel artırma göstergesi Aortik AG : Aortik artırma göstergesi aoAPmmHg : Aort basıncı Ao(s) : Aort sistolik çap Ao(d) : Aort diastolik çap BUN : Kan üre azotu EF : Ejeksiyon fraksiyonu EKO : Ekokardiyografi EKC : Elektrokardiyografi EDms : Sol karınçık fırlatma süresi GAG : Guanin-Adenin-Guanin GTG : Guanin-Timin-Guanin G6PD : Glikoz 6 fosfat dehidrogenaz KR : Kreatinin DRA : Diyastolik yansıma alanı DAI : Diyastolik alan göstergesi DIAmmHg : Diastolik arteriyel kan basıncı Hb : Hemoglobin HbA : EriĢkinlerde bulunan temel hemoglobin HbS : Orak hücre anemisinde bulunan temel hemoglobin HR : Kalp hızı Hct : Hematokrit IL : Interlökin(ĠL-6,ĠL-8,) Ġb : Ġndirekt bilirubin JucSYcm : Yuguler-simfizis mesafesi LDLkol : DüĢük yoğunluklu lipoprotein LDH : Laktat dehidrogenaz OABmmHg : Ortalama arteriyel kan basıncı maxdp/dtmmHgsec : Sol karıncıkta birim zaman içerisindeki maksimum basınç artıĢı VI MCH : Ortalama eritrosit hemoglobini MCHC : Ortalama eritrosit hemoglobin konsantrasyonu MCV : Ortalama eritrosit hacmi NDH : Nabız dalga hızı OHA : Orak hücre anemisi PAPs : Pulmoner arter sistolik basıncı PLT : Trombosit NDH : Nabız dalga hızı NDHao : Aortik nabız dalga hızı NDHsdms : Sistolik-diastolik nabız dalga hızı farkı PPmmHg : Nabız basıncı RAAS : Renin-anjiyotensin-aldosteron sistemi RDW : Eritrositlerin büyüklüklerinin dağılımı RTms : GevĢeme zamanı SAI : Sistolik alan göstergesi SKB : Santral kan basıncı SisKB : Sistolik arteriyel kan basıncı SOD : Sodyum SSS : Santral sinir sistemi VII ÖZET Heterozigot Orak Hücre Anemisi TaĢıyıcılarında Arteriyel Sertlik ve Nabız Dalga Yansıması Arteriyel sertliğin belirleyicileri olan nabız dalga hızı ve artırma göstergesi, vasküler hasarın Ģiddetini ortaya koymada kullanılan invaziv olmayan yöntemlerdir. Ancak bu değiĢkenlerin heterozigot orak hücre anemisi taĢıyıcılarında nasıl seyrettiği bilinmemektedir. Amaç: Heterozigot orak hücre anemisi taĢıyıcısı genç eriĢkinlerde nabız dalga hızı ve artırma göstergesindeki değiĢiklikleri ortaya koymak. Yöntem: ÇalıĢmaya her iki cinsiyetten 18 - 40 yaĢlarında 40 gönüllü katılımcı (20 taĢıyıcı, 20 sağlıklı) alındı. Öyküleri alınan, fizik muayeneleri ve ekokardiyografik incelemeleri yapılan katılımcıların kan basıncı ölçüldü. Arteriyel sertliğin belirleyicileri olarak nabız dalga hızı ve artırma göstergesi ölçümleri arteriyografla değerlendirildi. Bulgular: Orak hücre anemisi taĢıyıcılarında eritrosit ortalama hacmi ve eritrositlerde ortalama hemoglobin miktarı düĢük (p=0,000), eritrositlerin büyüklüklerinin dağılımı (p=0,035), aortun sistolik çapı, aort basıncı, aortik artırma göstergesi, brakiyel artırma göstergesi ve sistolik-diyastolik nabız dalga hızı farkının değerleri kontrol grubuna göre sırasıyla yüksek bulundu. (p=0,000, 0,033, 0,011, 0,011, 0,040). Ġki grubun bütününde aortik nabız dalga hızı ile ortalama arteriyel basınç, yaĢ, aortik artırma göstergesi, brakiyel artırma göstergesi, ağırlık, düĢük özgül ağırlıklı lipoprotein arasında ve aortik artırma göstergesi ile yaĢ arasında sırasıyla istatistiksel anlamlı pozitif iliĢki bulundu (p=0,000, 0,017, 0,000, 0,000, 0,034, 0,05, 0,026). Aortik artırma göstergesi ile kalp hızı arasında ise iliĢki negatifti (p=0,04). TaĢıyıcı grubunda aortik nabız dalga hızı ve sistolik arteriyel kan basıncı, ağırlık, yaĢ arasında sırasıyla pozitif (p=0,027, 0,027, 0,016), aortik artırma göstergesi ve potasyum miktarı arasında negatif iliĢki bulundu (p=0,007). Kontrol grubunda aortik nabız dalga hızı ile potasyum arasında istatistiksel anlamlı (p=0,028) pozitif iliĢki gözlendi. ÇalıĢmamızda ortalama arteriyel basınç ve kalp hızının aortik artırma göstergesi için, ortalama arteriyel basınç ve yaĢın aortik nabız dalga hızı için bağımsız belirleyiciler olduğu bulundu. Sonuç: Heterozigot orak hücre anemisi taĢıyıcısı genç eriĢkinlerde aortun sistolik çapı, santral kan basıncı, aortik artırma göstergesi, brakiyel artırma göstergesi, sistolikdiyastolik nabız dalga hızları farkı HbAS grubunda anlamlı derecede yüksekti. Arteryel sertlik ölçümü, heterozigot orak hücre anemisi taĢıyıcılarında kardiyovasküler hastalığın erken belirlenmesinde baĢvurulabilecek kolay, ucuz ve güvenilir bir yöntemdir. Anahtar Kelimeler: Artırma göstergesi, nabız dalga hızı, orak hücre anemi taĢıyıcısı VIII ABSTRACT Arterial Stiffness And Pulse Wave Reflection In Young Adult Heterozygote Sickle Cell Anemia Carriers Objective: Pulse wave velocity and aortic augmentation index, indicators of arterial stiffness are non invasive methods for detecting the severity as vascular injury. However the progress of this parameters in heterozygote sickle cell anemia patients is unknown. The purpose is to evaluate the change in aortic pulse wave velocity (PWVao) and in young adult heterozygote sickle cell anemia carriers. Material and methods: We enrolled 40 volunteers (20 HbAS, 20 HbAA) between ages 18-40. All participants‟ medical history was taken. Physical and echocardiographic examinations were performed, blood pressure was measured. Augmentation index and PWVao values were measured using arteriograph. Results: Lower mean cell volume, mean cell hemoglobin (p=0.000), and higher red cell distrubition width (p=0.035) values were found in sickle cell anemia carriers. Aortic systolic diameter, aortic blood pressure, aortic augmentation index, brachial augmentation index, systolic-diastolyc pulse wave velocity difference values were found in sickle cell anemia carries in comparison to control group (consecutively p=0.000, 0.033, 0.011, 0.011, 0.040). Statistically significant positive correlation relationship was found between aortic pulse wave velocity and mean arterial pressure, age, aortic augmentation index, brachial augmentation index, weight, low dansity lipoprotein, and between aortic augmentation index and age in both groups (consecutively p= 0.000, 0.017, 0.000, 0.000, 0.034, 0.05, 0.026). Positive correlation relationship was found between aortic pulse wave velocity and systolic blood pressure, weight, age (consecutively p=0.027, 0.027, 0.016), and negative correlation relationship was found between aortic augmentation index and potassium in hemoglobin AS group (p=0.007). Statistically meaningful positive correlation was found between aortic pulse wave velocity and potassium in hemoglobin AA group (p= 0.028). Our study revealed that mean arterial pressure and heart rate are independent determinants for aortic augmentation index and mean arterial pressure and age are independent determinants for aortic pulse wave velocity. Conclusion: Aortic sistolic diameter, central blood pressure, aortic augmentation index, brachial augmentation index and systolic-diastolyc PWV difference were significantly higher in HbAS group. Arterial stiffness measurement is an easy, cheap and reliable method in early diagnosis of cardiovascular desease in heterozygot SCD carriers. Keywords: Augmentation index, pulse wave velocity, sickle cell anemia carrier IX 1. GĠRĠġ ve AMAÇ Ateroskleroz, tüm dünyada olduğu gibi Türkiye‟de de ölüm ve morbidite sebepleri arasında önemli yer tutmakta olup, önlenmesi ve yeni erken tanı yöntemlerinin geliĢtirilmesi için araĢtırmalar sürmektedir. Klinik belirtileri oluĢmadan önce aterosklerozu belirlemek için kullanılan yöntemlerden birçoğu endotel iĢlev bozukluğu saptamaya yöneliktir. Daha önceki çalıĢmalarda, hemoglobin SS genotipli özkalıtımlı orak hücre anemili (OHA) hastalarda kardiyovasküler morbidite ve mortalite açısından risk belirleyicileri olan arteriyel sertlikte (AS), dalga yansımasında azalma olduğu gösterilmiĢti1. Bu çalıĢmalarda nabız dalga hızı (NDH) ile ortalama arteriyel basınç (OAB) arasında paradoksal negatif iliĢki bulunduğu ortaya konulmuĢtur. Bizim çalıĢmamızda heterozigot OHA taĢıyıcısı genç eriĢkinlerde hemoglobinin HbAS özelliği nedeniyle NDH ile OAB arasında nasıl bir iliĢki bulunduğunu, arteriyel sertlikte ve nabız dalga yansımasında değiĢiklikler olup olmadığını ortaya koymak amaçlandı. Orak hücre anemisi hastalığı, hemoglobinopatiler arasında en sık görülen, kalıtsal otozomal resesif iletilen, hemoglobin (Hb) sentez bozukluğudur. Ġki anormal gene sahip homozigotlar (HbSS), HbA sentez etmez iken, bir anormal gene sahip (HbAS) heterozigotlarda eritrositler % 20-30 HbS ihtiva ederler. OraklaĢan eritrositler küçük damarlarda tıkanıklık yaparak organ hasarına ve hastalığın tipik klinik bulgularının oluĢmasına neden olur. Hastalığın temel bulguları kronik hemolitik anemi, tekrarlayan ağrılı ataklar ve etkilenen organda görülen iĢlev bozukluğudur. Bazı hastalar tamamıyla asemptomatik seyredip, ancak toplum taramalarında tespit edilirken, bazı hastalar ise Ģiddetli kriz adı verilen atak (vazo-okluzif, aplastik ve sekestrasyon) tablosuyla doktora baĢvururlar. Bu hastalıkta enflamatuvar sitokinlerden tümör nekrotizan faktör-α (TNF-α), IL1α, IL-6, IL-8, histamin ve lökotrien-B4 düzeylerinin arttığı gösterilmiĢtir. Özellikle TNF-α ve IL-8‟in orak Ģeklini almıĢ eritrositlerin damar endoteline yapıĢmasını artırarak kan akımını bozduğu ve iskemik atakların oluĢmasına neden olduğu düĢünülmektedir. Ġnvaziv olmayan tıbbi teknolojideki ilerlemeler, karotis intima-media kalınlığını, arteriyel sertlik ve koroner arter kalsifikasyonunu ölçen çalıĢmalar, kardiyovasküler hastalığın erken belirteçlerini ortaya çıkarmıĢtır. Bu tür belirteçler, araĢtırma ve klinik 1 kullanım için önem kazanmıĢtır. Bu çalıĢmamızda orak hücre anemisi taĢıyıcılarında kardiyovasküler hastalığın tespiti ve izlenmesi için, kiĢiye özel arteriyel kan basıncı seyirlerinin belirlenmesi, takiplerinin planlanması açısından yararlı olup olmadığı araĢtırılmıĢtır. 2 2. GENEL BĠLGĠLER 2.1. Orak Hücre Anemisi 2.1.1.Tanım Orak hücre anemisi otozomal resesif kalıtımla geçiĢ gösteren, birçok sistemi etkileyen kronik ve hemolitik tipte bir anemidir. En sık görülen hemoglobinopati olan, OHA, β globin zincirini kodlayan gende meydana gelen mutasyondan kaynaklanmaktadır. Hemoglobinopatilerin oluĢmasında rol oynayan genetik olaylar farklıdır. En sık karĢılaĢılan mutasyon tipi nokta mutasyon tipidir (ġekil 1). Burada tek bir DNA nükleotit bazının bir baĢka bazla değiĢmesi sonucu genetik kod değiĢir. Bu genetik değiĢimin iki Ģekli tanımlanmıĢtır.2 (i) Transisyon: Bir purin bazının diğer bir purin bazıyla ya da bir pirimidin bazıyla yer değiĢtirmesi olayıdır. (ii) Transversiyon: Bir purin bazının primidin bazıyla yer değiĢtirmesi ya da bunun tam tersi bir durum söz konusudur. ġekil 1. Orak Hücre Anemisine yol açan nokta mutasyonun sebep olduğu aminoasit değiĢikliği2 HbS, β globin zincirinin amino (-NH2) ucunda 6. pozisyondaki glutaminin valin aminoasidi ile yer değiĢtirmesiyle; baz düzeyinde GAG yerine GTG gelmesiyle oluĢur. Bu mutasyonun sonucu olarak oksijensiz HbS polimerize olur ve katı kristal halinde çöker.3 Hemoglobin (Hb), dokulara oksijeni dağıtır ve eritrositlerin içindeki yüksek yoğunluğu eritrositin Ģeklini koruma ve Ģekil değiĢtirebilme yeteneğini sağlar. Normal insan hemoglobininde 4 tane polipeptit zinciri ve 4 tane hem grubu bulunur. Polipeptit zincirleri 2 tane α ve 2 tane β zincirinden oluĢmaktadır. β zincirlerinden sadece birinde 3 mutasyon olması halinde heterozigot formu, her ikisinde mutasyon olması halinde ise özkalıtımlı formu (SS) oluĢur. OraklaĢmanın derecesini bu Ģekildeki mutant hemoglobinin intrasellüler deriĢimi ve intrasellüler oksijen miktarı belirler. Heterozigot formda eritrosit içi HbS miktarı nisbeten az olduğundan, bu formda çok ciddi hipoksik durumlar hariç, genellikle ortaklaĢmaya bağlı klinik tablo pek görülmez, diğer taraftan özkalıtımlı formda eritrosit içindeki HbS miktarı daha fazla olduğunda, oraklaĢma ve oraklaĢmanın oluĢturduğu klinik tablo esas olarak bu grupta görülmektedir. EriĢkinlerde bulunan temel hemoglobin HbA‟dır ve HbA2 miktarı çok azdır (Tablo1). Fetal hayat boyunca HbF düzeyi yüksektir, doğumdan 6 ay sonra ise HbF yerini yavaĢ, yavaĢ HbS‟e bırakmaya baĢladığında hastalık kendini belli eder, yani eritrosit içindeki oranı azalır.4 Tablo 1. Normal ve OHA’si hastalarındaki hemoglobin tiplerinin karĢılaĢtırılması4 Fenotip Normal eriĢkin HbA HbF HbA2 Orak hücre taĢıyıcılığı (heterozigot) HbAS Orak hücre hastalığı (özkalıtımlı) Yüzdesi (%) Hemoglobin Tipi HbSS Genotip 96-98 0,5-0,8 1,5-3,2 2α 2β 2α 2γ 2α 2δ HbA: 60-65 HbS: 35-40 HbF: 2-20 HbS: 80-90 HbF: 2-20 HbA2: 2-4 HbA: yok 2α 1β 1 orak 2α 2 orak 2.1.2. Prevelans ve Coğrafi Dağılım Bugüne kadar yapılan çalıĢmalarda 700 anormal hemoglobin tanımlanmıĢ olup bunlardan yaklaĢık 2/3‟ünün klinik olarak önemli olduğu gösterilmiĢtir. Dünyada hemoglobinopatilerin sıklığının % 5,1 olduğu tahmin edilmektedir. En sık görülen ve prototip olarak kabul edilen hemoglobinopati OHA‟dır (HbS). OHA, özellikle Karaipler, Afrika zencilerinde, Akdeniz kökenli kiĢilerde (Türkiye ve Yunanistanı içine alan), Hindistan ve ortadoğuda sık görülmektedir.5,6 En yüksek gen frekansına ekvatoryal Afrikada rastlanır (ġekil 2). Bu durum, HbS‟nin Plazmodium falciparum sıtmasına karĢı olan hafif koruyucu etkisine bağlanmaktadır. Batı Afrikada OHA taĢıyıcılığı % 45 iken; Amerika BirleĢik 4 Devletlerinde yenidoğan siyahi bebeklerde taĢıyıcılık % 8-10‟dur ve her 600 zencide bir kiĢide görülmekdedir.5,6 Ülkemizde yapılan tarama çalıĢmaları OHA‟nin bazı bölgelerde daha sık olduğunu göstermiĢtir. Hemoglobinopatiler ile ilgili ilk çalıĢmalar, M. Aksoy tarafından 1950‟li yıllarda Çukurova bölgesinde yaĢayan Eti Türklerinde yapılmıĢtır.7 Sağlık Bakanlığı ve Ulusal Hemoglobinopati Konseyi‟nin verilerine göre taĢıyıcılığın Adana‟da % 10,0, Antakya‟da % 10,5, Mersin‟de % 13,6, Antalya‟da % 2,5, Diyarbakır‟da % 0,5, Muğla‟da % 0,5 sıklıktadır.8,9 2.1.3. Patofizyoloji HbS molekülleri, oksijensizlik sonucu çoğuzlamaya uğrarlar. HbS‟nin fiziksel yapısındaki değiĢim eritrositlerin Ģekil değiĢtirmesine yol acar ve eritrositler uzamıĢ yarımay Ģeklini ya da diğer bir deyiĢle orak Ģeklini alırlar ki, bu durum eritrositlerin dolaĢım akıĢkanlığını azaltır ve kan akımını yavaĢlatır. Bu da özellikle küçük damarlarda tıkanıklık ve oksijensiz bir ortam oluĢturarak, ağrılı kriz ve organ nekrozuna, sonuçta akut ve kronik süreçte doku harabiyetine neden olur.10 Bazı etkenler oraklaĢmaya eğilimi artırırlar. Önemli patofizyolojik mekanizmalar olarak hücresel düzeyde reperfüzyon yaralanmaları, enfeksiyonlar, oksijen basıncında azalma, alkol, gebelik su kaybı, kan yoğunluğunda artma, damar çapını azaltan durumlar ve enflamatuvar yanıt görülmektedir. Ayrıca glikoz-6-fosfat dehidrogenaz eksikliği ve 2,3 difosfogliserat düzeyinin azalmasının da patofizyolojik mekanizmalara katkısı vardır. ġekil 2‟de orak hücre anemisi patofizyolojisi özetlenmiĢtir.11 5 Normal Hb HbS HbS‟in çoğuzlaması Eritrositlerin oraklaĢması Geri dönüĢsüz oraklaĢan eritrositler PıhtılaĢma faktörlerinin uyarılması Eritrosit-endotel adezyonu Damar tıkanıklığı Dokularda yerel iskemi Fibroz ve doku hasarı Organ yetersizliği ġekil 2. Orak hücre anemisi patofizyolojisi Orak hücre anemisi hastalarının periferik yaymasında görülen orak Ģeklindeki hücreler geri dönüĢsüz orak hücrelerdir. Bu hücrelerin sayısı sabittir ve hastalığın komplikasyonları ile (ağrılı kriz gibi) değiĢmez. Geri dönüĢsüz orak hücreler, özkalıtımlı orak hücre hastalığında bulunurken taĢıyıcılık tipinde yoktur. Oksijensizliğin derecesine göre orak Ģekline dönen eritrositlerin periferik yayma görünümleri ġekil 3‟de olduğu gibidir.5 6 ġekil 3. Orak hücre anemisi hastalığında eritrositlerin elektron mikroskopik görünümü 5 A. OksijenlenmiĢ kanda normal kırmızı küreler arasında 1 tane mikrosferosit ve 3 adet lökosit görünümü B. ġekilleri bozulmaya baĢlayan oval görünümlü kırmızı küreler. C. Kısmi oksijensizlik durumunda keskin sınırlı, çıkıntılı filamentli hücreler D.Tam oksijensizlik durumunda keskin sınırlı, uzun yüzeyli yarımay Ģeklindeki eritrositler. Hemoliz mekanizması: Orak Ģeklini alan eritrositler hem damar içinde, hem de damar dıĢında yıkıma uğrar. Damar dıĢındaki hemoliz HbS‟nin stabil olmamasına ve tekrarlayan oraklaĢmanın hücrenin duvarında oksidatif hasarlanmaya daha fazla maruz kalmasına bağlıdır. ÇeĢitli etkiler altında oluĢan ve oldukça sert geri dönüĢsüz orak hücreler damar dıĢı bölgede, özelikle de dalakda yıkıma uğrar. Bu da eritrositlerin kısa ömürlü olmalarının nedenidir ve aneminin Ģiddetiyle doğrudan iliĢkilidir. ArtmıĢ serbest plazma hemoglobin düzeyleri hemolizin yaklaĢık 1/3‟ünün damar içinde olduğunu düĢündürmektetir. Damar içi hemolizin bir mekanizması hücrelerin kompleman 7 aracılığı ile oluĢabilecek yıkıma karĢı savunmasız bırakılmasıdır. Diğer bir mekanizma ise hücrelerin kırılganlığındaki artıĢa bağlı hemolizin hızlanmasıdır. Ġmmun yetmezlik: Orak hücre hastalığında dalak iĢlevlerinde bozulma ve serumda makrofajların yutma aktivitesindeki azalma özellikle çocukluk çağında S.Pnomonia enfeksiyonuna olan yatkınlığı artırır. Hemoliz oranı ne kadar fazla ise dalak iĢlevlerinde kayıp da o kadar erken olur.10 2.1.4. Orak Hücre Anemisinin Genetik GeçiĢi Orak hücre anemisi otozomal resesif kalıtım ile aktarılan monogenik bir hastalıktır. Ġlk kez Emmel tarafından 1917 yılında bir orak hücre hastasının babasında orak hücrelerin gösterilmesi, hastalığın genetik bir temeli olduğunu gündeme getirmiĢtir. Normal Hb TaĢıyıcı (% 50) (% 25) TaĢıyıcı Hasta (% 25) Bunlar kendi çocuklarına geçecek Ģekilde taĢıyıcı olabilir ġekil 4. Orak hücre Anemisinin kalıtım modeli12 Orak hücre mutasyonu özkalıtımlı ya da heterozigot durumda olabilir. Heterozigot durumdaki kiĢi anne ya da babanın sadece birinden mutasyona uğramıĢ geni almaktadır ve eritrositlerde HbA ile birlikte HbS‟de bulunmaktadır. Bu durum OHA taĢıyıcılığı 8 olarak adlandırılmaktadır. Özkalıtımlı durumda ise anne ve babanın her ikisinden de mutasyona uğramıĢ gen alınmaktadır. Bu durumda OHA söz konusu olmaktadır. Genotip olarak OHA taĢıyıcısı (HbAS) olan ebeveynler % 25 olasılıkla OHA‟li hasta çocuğa sahip olma riski taĢımaktadır. Böyle anne ve babadan genotipi normal olan (HbAA) çocuk doğma olasılığı ancak % 25‟tir (ġekil 4). Çoğu otozomal resesif kalıtımlı genetik hastalıkta olduğu gibi OHA‟ side akraba evliliklerinde oldukça sık karĢılaĢılan bir durumdur.12 2.1.5. Klinik Bulgular Orak hücre hastalarında anemi bulguları olmakla birlikte ağrılı kriz dönemleri dıĢında genellikle belirti vermezler. Erkek hastaların ortalama yaĢam süresi 42, kadınlarınsa 48 yıldır. Fakat bu yaĢ sınırları hastalığın fesatları ile değiĢkenlik gösterebilir.10 HbS sendromlarında hemolitik veriler ve sonuçlarına göre hastalar birkaç grupa ayrılırlar. En sık görülen hemotolojik değiĢkenler ve elektroforez sonuçları Tablo 2‟de özetlenmiĢtir.13,14 Tablo 2. OHA sendromlarında hemoglobin dağılımı13,14 Genotip AA SS AS Sβ0talassemi SC Klinik Normal OHA hastası OHA taĢıyıcı OHAβtalassemi HbC hastalığı HbA (%) 97-99 0 9-12 10-15 0 HbA2 (%) 0 86-98 40 70-80 0 HbS (%) 1-2 1-3 1-2 3-5 50 HbF (%) <1 5-15 <1 10-20 <1 HbSS‟li çocuklar doğumda anemik değildir. Hemolitik aneminin geliĢimi postnatal fetal hemoglobinin (HbF) düĢmesiyle paralel seyreder ve 4. ayda belirginleĢir. Hastalığın belirti ve bulguları hematolojik olan ve hematolojik olmayan Ģeklinde ikiye ayrılır.11 2.1.5.1. Hematolojik Bulgular a. Aplastik kriz b. Hemolitik kriz: Hemolitik krizin karakteristik özellikleri: anemide ani alevlenme, indirekt bilirubin (ĠB), laktat dehidrogenaz (LDH) ve retikülosit düzeylerinde artıĢ bulunmasıdır. 9 c. Vazo-oklüziv kriz: Vazo-oklüziv (ağrılı) krizler genellikle hastalığın ilk belirtisidir. 2.1.5.2. Hematolojik Olmayan Bulgular Kemik ve eklemlere, büyümeye, genitoüriner sisteme, akciğer, karaciğer, dalak, nörolojik sisteme, göze etkilenimi vardır. Tekrarlayan oraklaĢma atakları ülserlerin geliĢimi ve devamlılığına katkıda bulunurlar. Ciddi bakteriel enfeksiyonlar temel morbidite ve ölüm nedenidir.4,5,10,15,16 Hematolojik olmayan bulguların ortalama baĢlama yaĢı, dağılımı ve görülme sıklığı yüzdeleri Tablo 3‟te gösterilmiĢtir. Tablo 3. OHA’ya bağlı kronik organ harabiyetlerinin baĢlama yaĢı, dağılımı ve görülme sıklığı 11 Kronik organ harabiyeti SVO(serebro vasküler olay) Kronik akciğer hastalıkları Renal harabiyet Osteonekroz Bacak ülserleri Priarpizm Retinopati Ortalama baĢlama yaĢı (yıl) 13,1 24,2 25,1 23,1 24,5 22,3 25,8 Dağılım (yıl) Görülme sıklığı (%) 0,6-4,71 6,0-43,3 12,8-62,9 1,3-60,9 4,0-52,5 6,2-47,9 8,9-65,3 8,8 4,2 4,1 9,4 10,2 6,7 5,6 2.1.6. Orak Hücre Anemisinin Tanısı Hastanın öyküsünde ırk, geldiği yöre, aile öyküsü, yakınmalarının baĢlangıç zamanı ve tetikleyen etkenler değerlendirilmelidir. Fizik muayenede solukluk, sarılık, splenomegali, enfeksiyon bulguları, organ ve iskelet sistemindeki Ģekil bozuklukları dikkate alınmalıdır. Orak Hücre Anemisinin tanısı aĢağıdaki yöntemlerle konulabilmektedir; 1. Tam kan sayımında: retikülositoz, 2. OraklaĢma fenomeni, 3. Hg elektroforezinde HbA yoktur, yerine HbS vardır, taĢıyıcılarda % 35-45 HbAS saptanır.4,11 4. HbS ile birlikte diğer anormal hemoglobinlerin birlikteliği durumlarında tanı koymada DNA yöntemlerinden yararlanılabilmektedir. 5. Doğum öncesi tanı: Hamileliğin 8-10.haftalarında koryon villuslarından alınan örneklerle fetal DNA çalıĢmaları yapılarak tanı konmaktadır.16 10 Laboratuvar bulgularında: Anemi (Hemotokrit, Hb, eritrosit düzeylerinde hafif veya orta düzeyde düĢme), beyaz küre, trombosit sayısı genellikle artmıĢtır, retikülositoz: % 5-15, periferik yaymada orak hücreler, normoblastlar, poikilositoz ve Howell-Jolly cisimcikleri, pozitif sickling testi, kemik iliği eritroit hiperplazisi görülür.16 2.1.6.1. Ayırıcı Tanı Ayırıcı tanıda romatizmal ateĢ, romatoit artrit, losemi düĢünülmelidir. Mikrositoz varsa (MCH<78) demir eksikliği α veya β talasemi düĢünülür.11 2.1.7. Orak Hücre Anemisinde Tedavi 2.1.7.1.Genel Tedavi YaklaĢımı Tedavide temel prensipler, HbF yapımını artırmak, HbS miktarını azaltıp oksijene ilgisini artırmak ve sonuçta orak hücrelerinin küçük damarlarda tutulmalarını azaltmaktır. Hidroksiüre HbF sentezini artırarak eritrosit kök hücrelerinin farklılaĢmalarına etki eder ve eritrosit yaĢam süresini etkileyerek oraklaĢmayı azaltır. Ön koruma yöntemleri: 1. Hemofilus influenza, meningokok ve pnömokok aĢıları, 2. Folik asit ile hastaların desteklenmesi, 3. Ailelerin olası fesatlar hakkında eğitimi, 4. Enfeksiyonu olan 24 ayın altındaki hastaların yatırılarak takibi,17 5. Ağrılı krizler tedavisi, 6. Asidoz ve su kaybı düzeltilmesi, 7. Aplastik ve hipoplastik krizlerin tespiti ve tedavisi önemlidir.18 8. Kemik iliği transplantasyonu kesin çözümdür.19 2.2. Aneminin Kardiyovasküler Sisteme Etkileri Dokulara oksijen sunumunu belirleyen 3 ana değiĢken: 1. Dokunun oksijen özütleme derecesi, 2. Dokuya olan kan akımı ve, 3. Hemoglobin miktarıdır. 11 Dokulara oksijen özütlemenin göstergesi arteriyovenöz oksijen doymuĢluğundaki farktır. Bu ifadelere göre anemide Hb düĢüklüğü nedeniyle oksijen sunumunda oluĢabilecek azalmayı kompanse etmek için 3 mekanizma devreye girmelidir (ġekil 6). 1. Eritropoetin artıĢıyla Hb düzeyini artırma, 2. Doku düzeyinde oksijen özütlemesini artırma 3. Dokulara olan kan akımını artırma (anemide oluĢan kardiyovasküler değiĢikliklerin esası dokulara kan akımını artırmaya yönelik olan uyum mekanizmalarıdır) Anemide dokulara kan akımını artırmaya yönelik olarak oluĢan kardiyak debi artıĢından önyük, artyük, kontraktilite, kalp hızında olan değiĢiklikler sorumludur. Artyük azalır, önyük, kontraktilite, kalp hızı artar. Artyük azalmasından kanın viskozitesinin ve vazodilatasyon sonucunda oluĢan periferik vasküler direncin azalması sorumludur. Vazodilatasyondan sorumlu mekanizmanın ise EDRF‟nin artıĢı olduğu düĢünülmektedir. EDRF Hb‟e afinitesi yüksek olan ve etkisi Hb tarafından inhibe edilen bir maddedir. Anemide Hb deriĢimi‟nin azalması EDRF üzerindeki inhibisyonun daha az olmasına neden olmakta ve bu Ģekilde luminal EDRF artmaktadır. Anemide RAAS, Vazopressin düzeyi, santral sinir sistem(SSS) aktivitesi artarak önyükün artmasına, diğer taraftan SSS aktivitesi hem kalp hızını, hem de kontraktiliteyi arttırarak kardiyak debi artıĢına neden olurlar. Anemide kompansasyon mekanizmalarından biri de eritrosit içindeki 2-3 difosfogliserat düzeyindeki artıĢtır. 2-3 difosfogliserat Hb‟nin oksijene çekim gücünü azaltarak oksijenin dokulara daha kolay bırakılmasını sağlar. Aneminin kardiyovasküler sisteme etkileri ġekil 5‟de gösterildiği gibidir. 12 Anemi Kan viskozitesi azalır EDRF‟nin Hb tarafından inhibisyonu azalır EDRF artar RAAS aktivitesi, Vazopressin artar SSS aktivitesi artar aktivitesi Su, tuz tutulumu artar KH, kontraktilite artar Vazodilatasyon Önyük artar Periferik vasküler dirençte azalma Artyük azalır Kardiyak debi artar ġekil 5. Aneminin kardiyovasküler sisteme etkileri20 Anemide Hb düzeyi 9g/dl‟nin altına indiğinde istirahat halindeki kardiyak debi normale göre artar, kronik anemilerde bu dengeleme mekanizması kardiyak açıdan iyi tolere edilir. Hb düzeyi 4g/dl‟nin altına indiğinde ise hastada kalp hastalığı olmasa bile kalp yetersizliği geliĢebilir. Anemide oluĢan kalp yetersizliği yüksek debili kalp yetersizliğidir. Miyokardiyal yatakta diğer organlardan farklı olarak oksijen normalde maksimum derecede ekstrakte edilmektedir. Bu nedenle koroner yatakta oksijen sunumunu artırmanın tek yolu koroner kan akımının artmasıdır. Bu ise koroner yatakta var olan otoregülatör mekanizmayla sağlanmaktadır. Normalde oksijen ihtiyacının artması halinde oksijen sunumunu dengelemek için kullanılan otoregülatör yedekleme bu hastalarda bazal koĢullarda da kullanılır. Anemik hastalarda anemi ciddi değilse klinik açıdan bir sorun yaratmaz, aksi halde otoregülatör yedekleme yetersiz kalıp subendokardiyal iskemiye neden olabilir. Semptomlar aneminin ciddiyetine, geliĢme hızına, hastada kalp hastalığının olup olmamasına göre değiĢmekle birlikte sıklıkla çarpıntı, egzersize tahammülsüzlük görülür. 13 Fizik muayenede prekordiyum genellikle hiperaktif, nabız dolgun, 3. 4. kalp sesleri, akıma bağlı aort ve pulmoner odakda sistolik üfürüm, nadiren diyastolik yuvarlanma duyulabilir. Aneminin düzeltilmesiyle bu değiĢikliklerin hepsi düzelir.20 2.2.1. Orak Hücre Anemisinin Kardiyovasküler Sisteme Etkileri Anemi kısmında anlatılan uyum ve değiĢiklikler OHA‟sinde de görülmektedir ve fizik muayene bulgularının çoğunu da intrinsik kardiyak bozukluktan çok bu uyarlayıcı değiĢiklikler oluĢturmaktadır. Kalp yetersizliği genellikle aneminin kendisinden çok OHA‟sinin SS genotipine sahip kiĢilerde oluĢan komplikasyonlara veya baĢka bir kalp hastalığının varlığına bağlıdır. Çocuklarda ve gençlerde kalp yetersizliğine bağlı ölümler genellikle kronik böbrek yetersizliği, pulmoner tromboemboli ya da enfeksiyonlarla tetiklenir. Kalp diğer dokulara oranla minidolaĢımdan daha fazla oksijeni ekstrakte etmesine rağmen, OHA‟sinde epikardiyal arterlerde in situ tromboza bağlı akut miyokart enfarktüsü seyrek görülmektedir. Bunun muhtemel nedeni kalpte minidolaĢım doğrudan geçiĢ zamanının daha kısa olmasıdır. Ancak subendokardiyal bölgede, tipik olarak da papiller kaslarda enfarktüs görülebilmektedir. Bunun nedeni ise papiller kasların terminal arterler tarafından kanlandırılması ve buna bağlı olarak kollateral dolaĢımın az, hipoksinin belirgin olmasıdır. Ayrıca hastalarda kalp damar hastalığı olmaksızın kalp damarlarını orak hücrelerin tıkaması nedeniyle de kalp krizi geliĢebilir. Çocukluk çağından itibaren kronik anemiye bağlı olarak kalp atım hacminde artıĢ, kalp odacıklarında ve boyutlarında büyüme baĢlar. Egzersiz ve kardiyak kapasitenin giderek azalmasına rağmen kalp yetersizliği belirtileri genelde görülmez, fakat hipertansiyon, kan hacminde aĢırı yüklenme ya da aneminin artması gibi durumlar sebebiyle kalp yetersizliği ortaya çıkabilir. Pulmoner enfarktüs sık görülen bir komplikasyondur ve esas in sitü tromboza bağlı oluĢmaktadır. Pulmoner enfarktüs bakterilerin çoğalması için uygun bir ortam oluĢturmakta ve zaten enfeksiyona yatkın olan bu kiĢilerde pnömoniye zemin hazırlamaktadır. Pnömoni ve birlikte oluĢabilecek hipoksi mortalite ve morbiditeyi artırmaktadır. Bu nedenle hemen tedavi edilmelidir. OraklaĢan eritrositler rijit bir yapıya sahiptirler, membranı yapıĢkan bir karakterde olduğundan damarın tıkanma olasılığı yüksektir, özellikle hipoksinin belirgin olduğu 14 bölgelerde (kapiller yatakta) daha fazladır. Kapiller yatakta oluĢan tıkanıklık o bölgedeki oksijenasyonu daha da bozarak olayın kısır bir döngü halinde devamına neden olmaktadır. Bu Ģekilde oluĢan vasküler tıkanıklıklar “ağrılı kriz” denilen duruma neden olur ve tıkanmanın olduğu organa özgü bulgular verir. Fizik muayene de yüksek kardiyak debiye bağlı arteriyel nabız dolgunluğunda artma, boyunda venöz dolgunluk, kalpte büyüme, sternuma yakın 2. ve 3. kaburgalararasında sistolik üfürüm duyulur (kan akıĢmazlığında azalma ve akım artıĢı sonucunda oluĢan girdaba bağlı) Spesifik EKG bulgusu olmamakla birlikte hastaların yaklaĢık % 80‟inde anormallik saptanır. En sık görülen elektrokardiyografik anormallikler, sol ventrikül hipertrofisi, 1. derece AV blok, anormal septal Q dalgalarıdır. Ekokardiyografik incelemede diyastolik iĢlev bozukluğu, her iki karıncığın geniĢlemesi, mitral ve triküspit yetersizliği, mitral kapak sarkması, duvar hareketlerinde bozulma, ejeksiyon fraksiyonunda azalma, pulmoner hipertansiyon gibi bulgular görülebilir. Egzersize miyokart yanıtı genellikle subnormal düzeydedir ve karıncık dolumunda, duvar hareketlerinde, ejeksiyon fraksiyonunda azalma görülebilir. OHA genotipine sahip kiĢilerde mitral kapak sarkması sıklığının artıp artmadığı konusunda çeliĢkili bilgiler mevcuttur.20 2.3. Aortun Elastik Özellikleri 2.3.1. Arteriyel Sertlik Biyofizikte elastisite teorisi bir cisime uygulanan kuvvet ve meydana getirdiği deformasyonla ilgilenir.21-23 Birim alana düĢen kuvvete „stress’ denir. Meydana gelen deformasyonun orijinal haline oranına ise ‘strain’ adı verilir. Strain-stress iliĢkisinin eğrisi elastik modülüs olarak adlandırılır. Bir cisim, kuvvet onu hareket ettirmeden uygulandığında oluĢan bicimsizleĢme sonrası eski halini alabiliyorsa elastiktir. Pek çok madde elastik bir katı ve visköz sıvıya uyan özellikler gösterir. Bu maddelerde oluĢan biçimsizlik stresin büyüklüğüne ve oranına göre değiĢir. Bu maddeler „visko - elastik‟ olarak adlandırılır ve arter duvarı da büyük sınıfa dahildir. 15 Arteriyel damarların biyolojisinde mekanik stres-basınç olarak, strain ise çapta meydana gelen değiĢiklik olarak temsil edilir. Aralarındaki iliĢki lineer olmadığı için, verilen basınçtaki eğrinin eğimi elastisite ya da tam tersi sertliği yansıtır. Elastisite ve sertlik nitel terimlerdir. Nicel karĢılıkları ‘esneklik ve distensibilite’dir Arteriyel sertlik damar duvarının visko-elastik özelliklerini tanımlamak için en sık kullanılan terimdir. Sigara içimi, hiperkolesterolemi, diyabet, hipertansiyon gibi bilinen aterosklerotik risk faktörlerinin artıĢı ve yaĢlanmanın sonucu olarak meydana gelir.23-27 ArtmıĢ aortik sertlik ya da azalmıĢ distensibilite, damar sisteminin yaygın aterosklerotik tutulumunun göstergesidir.28,29 YaĢlanma ve kan basıncının damar üzerine etkileri elimine edildikten sonra artmıĢ arteriyel sertlik, koroner arter hastalığı, serebrovasküler ve periferik damar aterosklerozunun göstergesidir.29-31 Arteriyel sertlik olarak kullanılan bu terim arteriyel esneklik, distensibilite ya da elastisitede azalma Ģeklinde de kullanılabilir. Arteriyel sertlik değiĢkenleri Tablo 4‟de gösterilmiĢtir. Tablo 4. Arteriyel sertlik değiĢkenleri 1. Sistolik, diyastolik kan basıncı 2. Ortalama kan basıncı 3. Nabız basıncı 4. Kalb hızı, 5. Kardiyak fırlatma zamanı 6. Atım hacmi(ml/atım) 7. Atım hacmi göstergesi(ml/vuru/m2), 8. Kardiyak debi (L/dk), 9. Büyük ve küçük damar elastisite göstergesi, 10. Sistemik damar direnci ve toplam damar empedansıdır ArtmıĢ arteryel sertlik ya da azalmıĢ gerginlik damar sisteminin yaygın aterosklerotik tutulumunun göstergesidir.29-32 ArtmıĢ arteriyel sertlik yükselmiĢ sistolik kan basıncı aracılığıyla sol ventriküler yükü artırır, kardiyak hipertrofiyi kolaylaĢtırır ve DKB‟nın azalması aracılığıyla koroner arterlerin perfüzyon basıncında azalmaya neden olur ve böylece miyokardiyal iskemiye katkıda bulunur.26 Yüksek sistolik kan basıncı ve nabız basıncı, düĢük diyastolik kan basıncı ve sol ventrikül hipertrofisi, genel toplumda kardiyovasküler morbidite ve mortalitenin bağımsız faktörleri olarak belirlenmiĢtir.30 Arteriyel sertlik total mortalitenin bir göstergesi olmanın yanısıra, kalp yetersizliği, miyokart enfarktüsü, renal hastalık, inme, demans ve gibi vasküler hastalıklar için de belirleyici öneme sahiptir.26,27,31-33 16 Safar ve ark22 arteriyel sertliğin streste ve istirahatte olan enerji tüketimine, yalnızca katkıda bulunmadığı, aynı zamanda yaĢlılarda ortostatik hipotansiyon oluĢumuna da katkı yaptığını rapor etmiĢlerdir. 2.3.1.1. Arteriyel Sertlik OluĢum Mekanizmaları Arteriyel sertlik, damar duvarındaki hücresel ve yapısal elementlerdeki değiĢikliklerin, dinamik ve karmaĢık etkileĢimi ile geliĢir (ġekil 6). Bu damarsal değiĢiklikler glukoz düzeyinin seviyesi, tuz, hormonlar gibi ekstrinsik faktörlerden (NaCL, lipitler, anjiyotensin, sempatik nöröhormonlar, makaslama etkisi, artmıĢ luminal çap) olduğu kadar, hemodinamik güçlerden de etkilenir.34 Sertlik damar ağacının her yerinde aynı değildir, periferik damarlardan daha çok santral damarlarda meydana gelir.34-38 ġekil 6. Arteriyel sertlik oluĢum mekanizmaları34 VSMC: Damar düz kas hücre tonusu ACE: Glukatyon son ürünleri MMP: Metalloproteinaz ECM: Ekstraselüler matriks TCF-β: Büyüme Faktörü 17 2.3.1.2. Arteriyel Sertliğin Yapısal BileĢenleri Damar duvarının yapı iskeletini oluĢturan iki protein, kolajen ve elastindir. Damar duvarının esnekliği gevĢeyebilirliği ve stabilitesi bu proteinler tarafından sağlanır. Bu proteinler damar duvarını stabilize eder. Ancak, bu dinamik süreç üretim ve yıkım Ģeklindedir. Bu dengenin bozulmasında, esas olarak enflamatuvar çevrenin stimülasyonu, anormal aĢırı kolajen üretimi ve normal elastin kalitesinin azalması rol oynar. Sonuçta, bu etkenler arteriyel sertliğe katkıda bulunur. ArtmıĢ luminal basınç ya da hipertansiyon, aĢırı kolajen üretimini uyarır.39,40 Histolojik incelemelerde, sertleĢmiĢ damarların intimasında; sitokinler, intraselüler adezyon molekülleri, büyüme faktörü B (TGF-B), artmıĢ matriks metalloproteinazlar, mononükleer hücreler, makrofajlar, infiltratif damar düz kas hücreleri, yıpranmıĢ ve kırılgan elastin molekülleri, artmıĢ kolajen, anormal ve bozulmuĢ endotel hücreleri ortaya çıkarılmıĢtır.39-41 Damar duvarındaki ekstraselüler matriks (ECM); proteoglikan, glikoprotein, elastin ve kolajenden oluĢur. Elastikiyet ve bütünlüğü sağlayan elastin ve kolajen, katabolik matriks metalloproteinazlar (MMP) tarafından düzenlenir. Vasküler hücreler, polimorfonükleer nötrofiller ve makrofajlar gibi enflamatuvar hücreler, kolajenazlar (MMP-1-8-13) ve elastazları (MMP-7 ve serin proteaz) üretirler.38 Ayrıca, kemotaktik ajanların stimülasyonu ve ekstraselüler bazal membran yıkımı, jelatinaz (MMP-2 ve MMP-9) aktivitesi ile meydana gelir.35-41 Enzim aktivitesi, reaktif oksijen türleri, trombin, plazmin, MMP-MMP etkileĢimi, pro-MMP proteinlerinin bölünmesi ile aktive olan posttranslasyon ve gen ekspresyonunun artıĢı tarafından düzenlenir.42,43 Damar duvarındaki ekstraselüler matriksin sertleĢmesinden ve kalınlaĢmasından kondritin sülfat depozitleri, heparan sülfat, proteoglikanlar ve fibronektin sorumludur. Bu moleküller arası bağlantıların bozulması kolajen içeriğin artmasına yol açar ve sonuçta, daha fazla organize olmamıĢ, iĢlevi bozulmuĢ fiber dağılımı ortaya çıkar. Elastin molekülleri izodezmozin ve dezmozinin karĢılıklı bağlantısı ile stabilize edilir. Üstelik değiĢik serin ve metalloproteaz ürünleri elastin moleküllerini kırar ve hasara uğratır.36 Arteriyel sertlikle glukatyon son ürünlerinin ilerlemesi (advanced glycation and products) (AGE) olur, bu da kolajen gibi proteinlerin glutatyona uzun süre karĢılıklı, 18 nonenzimatik Ģekilde geri dönüĢümsüz olarak bağlanması ile sonuçlanır. AGE kolajen bağlantısı hidrolitik dönüĢümü daha az yatkın hale getirir ve serttir ve bunun sonucunda yapısal olarak yetersiz kolajen molekülleri birikir.37 Benzer Ģekilde, elastin molekülleri duvardaki elastik matriksi azaltır, AGE karĢı zincir bağlantısına yatkın hale getirir. AGE ayrıca nitrik oksit (NO2) tarafından sağlanan endotelyal hücre fonksiyonunu etkiler ve peroksinitrit gibi oksidan türlerini arttırır.38 Bu gibi aracılar MMP‟lar aracılığı ile arteriyel sertliği arttırırlar ve böylece endotelyal iĢlev bozukluğuna da katkıda bulunurlar ki; sonuçta, endotelyal iĢlev bozukluğu, artmıĢ düz kas tonusu, akım aracılı dilatasyonda azalma, damar endoteli hasarına yetersiz cevap, anjiyogenezde azalma ve aterosklerotik plak oluĢumunda artıĢa sebep olur.38,39,40 Aterosklerotik lezyonların geliĢmesi ve damar duvarındaki lipid depozitlerinin yalnız baĢına arteriyel sertliğe katkıda bulunması çok açık değildir. Ġzole hiperkolesterolemili genç insanlarda arteriyel esneklik artmıĢ ya da normaldir. Ġlerleyen yaĢla birlikte, LDL ve arteriyel esneklik arasındaki iliĢki negatiftir ve endotelyal iĢlev bozukluğu geliĢiminde daha fazla etkilidir.41,44 2.3.1.3. Arteriyel Sertlikte Hücrelerin Rolü Damar düz kas hücre tonusu (VSMC) ve endotel hücreleri arteriyel sertlik geliĢiminde etkilidirler. VSMC mekanostimülasyon tarafından ayarlanır. Bu mekanostimülasyon, NO, anjiyotensin II, endotelin, oksidatif stres gibi parakrin mediyatörler, kalsiyum değiĢiklikleri ve hücresel gerginlik tarafından değiĢtirilir. Endotelyal iĢlev bozukluğu asetilkoline bozulmuĢ vazodilatör yanıtın bir ifadesidir. Bu oksijenazlar (ör. siklooksijenaz, ksantin oksidaz), konstrükte hormonlar, hiperpolarizasyondan türeyen endotelyel faktörler ve NO arasındaki dengesizlikten kaynaklanır. Arteriyel sertlik ile bağlantılı olan asimetrik dimetilarginin, doğal NO sentaz inhibitörlerinin dıĢa vurumunu azaltır, tersine NO dıĢa vurumunu artırır.37 NO bioyararlanımı olası AGE‟ler, hormonlar ve stresin neden olduğu reaktif oksijen türlerinin aktivasyonu ile azaltılabilir.42,43,45 19 2.3.1.4. Arteriyel Sertlik Aterosklerotik Olayları Öngörebilir mi? Patofizyoloji Büyük arter sertliği ile ateroskleroz arasında karmaĢık olmakla beraber açık bir iliĢki vardır. Arteriyel sertleĢme ve ateroskleroz genelde beraber bulunur ve bazı çalıĢmalarda aterosklerotik yük ile aort sertliği arasında iliĢki tanımlamıĢtır. Hepsinin ötesinde arter sertliği ilerideki kardiyovasküler ve koroner olaylar hakkında yol göstericidir. Arter sertliği ve ateroskleroz her ne kadar ikisi de hipertansiyon ve sigara gibi ortak risk faktörlerini paylaĢsalar da patolojik ve klinik olarak ateroskleroz ve arteriyosklerozu farklı baĢlıklar altında değerlendirmek gerekir. Büyük arterlerin sertliği kardiyovasküler sistem hastalıklarının oluĢumuna farklı mekanizmalarla katkıda bulunur.46,47 Aort sert hale geldikçe, baskıtlama mekanizmasının azalmasına ve periferden yansıyan basınç dalgalarının daha hızlı dönmesi sonucu sistolik basıncın artmasına bağlı olarak, NB‟ı yükselir. Bu sistolik basınç artıĢı sol ventrikül hipertrofisini tetikler ve ventriküler sertleĢme diyastolik iĢlev bozukluğu ve kalp yetersizliğine sebep olur.47 EĢlik eden diyastolik basınç düĢüĢü koroner kan akımını azaltır, durumu iyice kötüleĢtirir ve iskemiye yol açar. ArtmıĢ NBkarotis gibi diğer arterlere de iletilir, duvar stresini azaltmak için yeniden biçimlenme baĢlar ve intima-media kalınlığı artmaya baĢlar. Arter sertleĢmesi aynı zamanda arteriyel duvardaki dairesel stresi ve elastik liflerin yorgunluk kırılmasın artırır, damarın iyice sertleĢmesine ve bir kısır döngüye sebep olur. Ateroskleroz, giderek enflamatuvar bir durum olarak algılanmaktadır. Gerçekte akut faz reaktanı olan C-reaktif protein (CRP) seviyelerinin, koroner arter hastalığı (KAH) olan ve komorbit baĢka bir hastalığı olmayan bireylerde gelecekteki kardiyovasküler olay riskini öngördüğü bilinmektedir.48 Yakın zamanda aĢikar aterosklerotik hastalığı ya da geleneksel kardiyovasküler risk faktörleri olmayan bireylerde CRP ile büyük arter sertliği arasında iliĢki gösterilmiĢtir.49,50 Ġlginç olarak deneysel ya da hastalığa ikincil akut sistemik enflamasyon geri dönüĢümlü aortik sertliğe yol açmaktadır.49-51 Tüm bunlar enflamasyonun muhtemelen endotel iĢlev bozukluğuna ikincil arteriyel sertleĢmeninde rolü olduğunu göstermektedir. 20 2.3.1.5. Arteriyel Sertlik Göstergeleri Tablo 5. Arteriyel sertlik göstergeleri 21-23,52-54 Arteriyel Distensibilite Arteriyel segment boyunca yayılan nabzın hızı Uzaklık/zaman farkı(cm/sn) Basınç artıĢındaki rölatif çap değiĢimi Çap farkı/basınç farkı çap Arteriyel Kompliyans Sabit damar uzunluğunda verilen basınçtaki mutlak çap değiĢimi Çap farkı/basınç farkı Elastik Modulus Duvar materyalinin dahili elastik özellikleri Basınç farkı hacim/hacim farkı duvar kalınlığı Nabız Dalga Hızı 2.3.1.6. Arteriyel Sertlik ve Genetik Genetik polimorfizmin artmıĢ arteriyel sertlik ile birlikteliği ĢaĢırtıcı değildir. Son yıllarda Framingham kalp çalıĢması kapsamındaki geniĢ ölçekli genom çalıĢmasında, Levy D ve ark55 artmıĢ kronik arteriyel nabız basıncının hafif-orta ölçüde kalıtsallığa sahip olduğunu bildirmiĢ ve nabız basıncına genlerin katkısını gündeme getirmiĢlerdir. Bu genlerle ilgili birkaç bölge tespit edilmiĢtir. Bunlar 15. kromozomun 122 cM bölgesi, 8. Kromozomun 164 cM bölgesi (aldosentaz genine yakın) ve 7. kromozomun 70 cM bölgesi gibi alanlardır. Gen analizinde arteriyel sertliğin ölçülmesi için çift bölge tanımlanmıĢtır. Örneğin; değiĢik vasküler sertlik modelleri IGF–1, fibrillin–1, kolajen, endotelin A ve B reseptör, anjiyotensin tip 1 reseptor ya da anjiyotensin-dönüĢtürücü enzim polimorfik genleri ile iliĢkilidir.55-58 Ancak, bu çalıĢmalar, küçük çalıĢma grupları içerdiği için, gerçek topluma genellenemez. 2.3.1.7.Santral Nabız Basıncı, Artırma Göstergesi ve Arteriyel Sertlik Brakiyal arterden ölçülen ve periferik basınçları gösteren sistolik ve nabız basınçlarıyla, karotis arterden ölçülen ve santral basıncı gösteren basınçların birbirleriyle karıĢtırılmaması gerekmektedir. Periferik arterlerde geri yansıma noktaları santral arterlerden daha yakındır ve geri yansıma dalgaları periferal arterlerde santrale göre daha hızlı ilerler. Yükseltme fenomenine göre basınç dalgasının geniĢliği periferal arterlerde santral arterlere göre daha büyüktür. Bu yüzden genç hastalarda brakiyal arterler yoluyla ölçülen sistolik ve nabız basınçları, santral basınçları daha yüksek gösterir.59 21 Santral basınçlar ve artırma göstergesi ilerleyen dalganın hızına, yansıyan dalganın geniĢliğine, yansıma noktasına, ejeksiyon süresine, kalp hızı ve kasılmasına bağımlıdır. Oysaki NDH intrinsik olarak arteriyel sertliğin bir göstergesidir. Ayrıca patofizyolojik durumlar, ilaçlar nabız dalga hızını değiĢtirmeden santral basınçları ve artırma göstergesini değiĢtirebilir.60 Bunlara ek olarak artırma göstergesi, nabız dalga hızına göre kalp hızına daha duyarlıdır.61,62 2.3.1.8. Santral Dalganın Analizi Santral nabız kayıtlarında, sistol esnasında zirve akım ile zirve basınç çoğunlukla eĢ zamanlı olmaz. Zirve basınç daha geç ortaya çıkar. Bu durumlarda nabız dalgasının çıkan kolunda (sistol) zirve akımla eĢ zamanlı bir çentik olur (P1) ve sonra basınç artıĢı devam ederek zirve sistole ulaĢır (P2). Bu iki basınç noktası arasına artırma basıncı denilmektedir. Santral nabız dalgası Ģeklinde, ilk sistolik bükülme P1‟i gösterirken, geç sistolik zirve de P2 olarak adlandırılır. P2 ve P1 arası fark (AP) artırma basıncını göstermektedir (ġekil 7). Ayrıca, artırma göstergesi, ejeksiyon süresi, subendokardiyal canlılık oranı gerilim zaman göstergesi gibi birçok değiĢken santral nabız dalgasından türetilebilir. Artırma basıncının eĢitlenmesi artırma göstergesi ile yapılır. Artırma göstergesi, üç farklı Ģekilde hesaplanabilir ve yüzde değer olarak ifade edilir.60-64 Artırma göstergesi = Artırma basıncı (P2-P1) / Nabız basıncı = P2-P1 / P1 = NB/ P1 ġekil 7. Karotid nabız dalgasında artırma basıncının Ģematik gösterimi P1: Erken sistolik çentik; P2: Geç sistolik çentik; ∆P sistolik ve diyastolik basınç farkı 63 22 Subendokardiyal canlılık oranı, sistol ve diyastolde santral nabız eğrisinin altında kalan alanın oranıdır.62 Normal durumda bu değer yüksektir (~ % 130-200) Oranın % 100‟ün altında olması subendokardiyal perfüzyonun yetersiz olduğunu gösterir. Sistolik alan, kalbin çalıĢmasını, oksijen tüketimini gösterir ve gerilim zaman göstergesi olarak bilinir. Diyastolik alan ise koroner kanlanmanın süresini ve basıncını dolayısıyla da enerji desteğini gösterir.63 Arteriyel Sertliğin değerlendirilmesinin iki ana yöntemi nabız dalga hızı ve artırma göstergesinin ölçümüdür.53,54,63 2.3.1.9.Nabız Dalga Hızı Ölçüm Yöntemleri Arteriyel nabız dalgasının grafiksel kaydı ilk kez 1800‟lü yılların son dönemlerine doğru yapıldı. Fredrick Akbar Mahomed69 1872‟ de sphygmograph adlı cihazla el bileğinden nabız kaydı yaparak hipertansiyon ve yaĢlanmayla birlikte arteriyel nabız dalgasının Ģeklinde değiĢim olduğunu ilk kez tanımladı. Takip eden dönemde, büyük arterlerin mekanik davranıĢlarının aĢırı derecede karmaĢık olduğu, tam olarak ortaya konmasında hem teorik hemde teknik yönlerde ciddi zorluklar olduğu tespit edildi. Arterlerde belirgin eĢyönsüzlük (anizotropi) olduğu, doğrusal olmayan viskoelastik özellikler sergiledikleri ve güçlü uyarlayıcı mekanizmalara sahip oldukları gösterildi.65 Geçen son on yılda, kullanım kolaylığı nedeniyle çeĢitli araçlar popülarite kazanmıĢtır. Bu araçları kullanmakta amaç damar duvarı esnekliğini belirten, herhangi bir yerde kolayca uygulanabilen, basit, ağrısız, ön tanı taraması için geniĢ bir alanda arteriyel sertliği ölçmekti. Nitekim Orak Hücre Anemisi hastaları ile iliĢkili klinik çalıĢmalarda da kullanılmıĢtır.1 Bu yöntemler içinde iki çeĢit yöntem klinikte yaygınlık kazanmıĢtır. Bunlar osilometre (Arteriograf) ve aplanasyon tonometredir.66,67 2.3.1.10. Nabız Dalga Hızı ve Arteriyel Sertlik Arteriyel sertliğin göstergelerinden olan NDH ve aortik artırma göstergesi (Aortik AG), vasküler hasarın Ģiddetini belirlemede kullanılan invaziv olmayan yöntemlerdir. Nabız dalga hızının ölçümü arterlerin elastik özelliklerini belirlemedeki önemli yöntemlerden birisidir. Birbirlerine belli uzaklıktaki iki arterin (karotis-femoral, brakiyal-radyal arterler gibi) traseleri üzerine ciltte yerleĢtirilmiĢ iki ultrason ya da basınç duyarlı transdüser kullanarak ölçüm yapma prensibine dayanmaktadır. Ölçülen 23 nabız dalga hızı arter duvarı sertliğinin bir göstergesidir. GiriĢimsel olmayan basınç transdüserlerinin en önemli avantajları arteriyel ağacın birçok yerinden kayıt alabilmeleridir.53,54,66 Arteriyel sertlik analizi klinik olarak birbirini tamamlayan iki farklı yöntemi içerir. 1. Arteriyel sertlik saptanması (bölgesel, yerel, sistemik): Sistemik arteriyel sertlik sadece dolaĢım örneklerinden tahmin edilebilir. Bunun tersine bölgesel ve yerel arteriyel sertlik arteriyel sistem boyunca farklı yerlerden direkt ve kansız yöntem ile ölçülebilir. Dalga geri yansıması analizi periferik bir arterden (genellikle radiyal, karotis ve brakiyal arter) kansız yöntem ile nabız dalgası kaydı ile yapılır. Bu dalgadan santral nabız dalgası elde edilerek çeĢitli analizler yapılır. Bu analizlerde nabız dalgasının farklı özelliklerini (basınç, distansiyon, doppler vb.) ölçen çok sayıda giriĢimsel olmayan cihaz kullanılmaktadır. Bölgesel arteriyel sertlik saptanmasında en sık olarak kullanılır. Torasik ve abdominal aort arteriyel tamponlama iĢleve en büyük katkıyı yapar. Aortik nabız dalga hızı (pulse-wave velocity) çok çeĢitli topluluklarda sonuçların bağımsız öngördürücüsüdür.63 Bununla birlikte, bütün arteriyel alanlar değerlendirmede kullanılabilir. Bölgesel sertlik için kullanılan yöntem nabız dalga hızı ölçümüdür. 2. Yansıyan nabız dalgası analizi: Arteriyel vuru, kalp kasılmaları ile atılan kanın periferik arterler boyunca yarattığı dalgalanmadır. Sol ventriküldeki kan aort kapağı aracılığı ile perifere boĢalırken, arteriyel ağacın çap, basınç ve akım özellikleri ile etkileĢir. Sol ventrikül kasılması ile kanın çıkan aortaya atılması tüm vücuttaki arter duvarlarında bir basınç dalgası oluĢturur. Bu basınç dalgası arterlerin yapısına ve kalbe olan uzaklıklarına bağlıdır. Vücudun çeĢitli bölgelerindeki arterlere farklı hız, genlik ve yapıda ulaĢır. Bu basınç dalgası giriĢimsel kateterler ya da dıĢsal (eksternal) basınç transdüserleri ile kaydedilebilir.53,54 GiriĢimsel olmayan basınç transdüserlerinin en önemli avantajları arteriyel ağacın birçok yerinden kayıt alabilmeleridir.53,68 Periferik basınç dalgası (ġekil 8) gerçekte üç ayrı dalganın birlikteliği ile oluĢmaktadır: i. Sistolde kalpten perifere gelen ilk dalga, ii. Diyastolde özellikle vasküler dallanma bölgelerinden köken alan periferden kalbe yansıyan dalga 24 iii. Kalpte aort kapak bölgesinde oluĢan diyastolik yansımalar. Son iki dalga tek bir yansıyan dalga gibi ele alınabilir. Ġlk dalganın karakteri (sistolik bileĢen) sol ventrikül ejeksiyonuna ve arteriyel sertliğe bağlıdır. Ġkinci dalganınki ise (diyastolik bileĢen) dalga yansımasının gerçekleĢtiği yere ve arteriyel sertliğe bağlıdır.67 ġekil 8. Radiyal arterden yapılan basınç dalgası kaydı ve bileĢenleri (i, ii, iii)54 Sol ventrikülün kasılması ile kanın çıkan aortaya atılması aortu geniĢletir ve arteriyel ağaca belli hızlarda yayılım gösteren bir nabız dalgası oluĢturur. Bu dalganın yayılım hızı arteriyel sertliğin bir ölçütü olan NDH‟dır. Hız ne kadar yüksekse arteriyel sertlik o kadar fazla ve arteriyel geniĢleyebilme kabiliyeti o kadar zayıftır. GeniĢliyebilirlik belirli çapta oluĢan basınç değiĢikliğine cevap olarak geliĢen rölatif çap/hacim, uyum (esneklik) ise mutlak çap/hacim değiĢikliği olarak tanımlanabilir. Elastisite geniĢliyebilirliğin nicel ölçümüdür. Sertlik ise uyum ve geniĢliyebilirlik kavramlarına anlamca zıt özgün olmayan bir kavramdır.59 Nabız basıncı (NB) sol ventrikül ejeksiyonu ile oluĢup, arter duvarının elastik ve geometrik özellikleri ile kanın yoğunluğuna bağlı bir hız ile arteriyel sisteme dağılır. Nabzın belli uzunluktaki arteriyel bölümdeki hareket hızı olarak tanımlanan NDH, nabız basıncı kaydının yapıldığı iki 25 bölge arasındaki uzaklık ve aradaki zaman farkı ile iliĢkilidir (ġekil 9). NDH‟nin esas belirleyicileri arter duvarının ve arter lümeninin özellikleridir. ġekil 9. Karotis ve radiyal arterden eĢ zamanlı basınç dalgası kaydı 59 2.3.1.10. Nabız Dalga Hızını Etkileyen Faktörler Nabız dalgası birincil olarak arterin elastikiyeti ya da katılığının ortak etkinliğine bağlı iletilmektedir. Ancak diğer bazı faktörler de göz önünde bulundurulmalıdır. Bu faktörlerden bazıları kalp-damar sistemi fizyolojisiyle, diğerleri ardıĢık patofizyolojik durumlarla iliĢkilidir. YaĢ ve arteriyoskleroz arter ağacını santral ve elastik arterler üzerinde daha belirgin olmak üzere değiĢik derecelerde etkilerler. Bu yüzyılın baĢlarından beri özellikle aortada, yaĢla ortaya çıkan değiĢiklikler açıkça bilinmektedir. YaĢ ilerledikçe aortanın geniĢliği artmakta, esneyebilirliği azalmaktadır. YaĢ ile aortanın elastik dokusu giderek azalmakta ve yerini kolajen dokuya bırakmaktadır; bu arada elastik liflerin yapısı da değiĢmektedir. YaĢlılarda artmıĢ aortik sertlik bilinç bozukluğunun bağımsız bir belirtecidir.69,70 Daha genç hastalarda ise artmıĢ dalga geri yansımaları koroner arter hastalığını gösterebilmektedir. Dalga geri yansımaları aterosklerotik hastalığı olan hasta grubunda kardiyovasküler risk ile bağıntılıdır.71,72 Her iki cinsiyette yaĢ ile aort nabzının dalga hızı (karotis-femoral ya da gövde nabız dalga hızı) düzeyleri artmaktadır.73 Kardiyovasküler fizyopatolojinin anlaĢılmasıyla yaĢın nabız dalga hızı üzerindeki etkisinin sadece aortada değil periferik arterlerde de analiz edilmesinin önemli olduğu ortaya çıkmıĢtır; radiyal nabız dalga hızının sürekli olarak aortik nabız dalga hızından yüksek oluĢu, orta boylu arterlerde büyük arterlerden daha hızlı nabız dalga geçiĢ zamanı olduğunu göstermektedir.69 Ayrıca sempatik sistem aktivasyonu ve vazokonstriksiyon, adrenalin, kalp hızı, tuz alımı, kan akımı, antropometrik faktörler (bel-kalça oranı, vücut kitle göstergesi), etnik ve genetik faktörler (nitrik oksit sentaz gen polimorfizmi, aldosteron sentaz gen 26 polimorfizmi, renin anjiyotensin sistem gen polimorfizmi gibi) cinsiyet de NDH‟nı etkileyebilmektedir.71 NDH ve artırma göstergesi (nabız basıncının yüzdesi olarak ifade edilen artıĢ) arteriyel sertleĢme göstergeleri olarak yaygın olarak kullanılmaktadır ve çeĢitli hastalıklarda arteriyel esnekliği değerlendirmede özellikle yararlıdırlar.1,52,63,71,74 2.3.1.11. Arteriyel Sertliğin Klinik Anlamı ve Önemi Framingham risk skorlamasına göre esansiyel hipertansiyonu olan hastalarda artmıĢ arteriyel sertliğin, aterosklerotik hastalığın yaygınlığı ve kardiyovasküler hastalık riski ile bağıntılı olduğu tespit edilmiĢtir.75 YaĢlılarda artmıĢ aortik sertlik bilinç bozukluğunun bağımsız bir belirtecidir.74 Daha genç hastalarda ise artmıĢ dalga geri yansımaları koroner arter hastalığını gösterebilmektedir.69 Dalga geri yansımaları aterosklerotik hastalığı olan hasta grubunda kardiyovasküler risk ile bağıntılıdır.71,72 Nabız basıncı, ventriküler volüme dayanan basit bir arteriyel sertlik değiĢkenidir ve düĢük riskli asemptomatik erkek hastalarda kardiyovasküler ve özellikle koroner mortalite ile iliĢkili olduğu gösterilmiĢtir.71,72 Framingham çalıĢmasında kardiyovasküler hastalık kanıtı olmaksızın, orta yaĢlı ve yaĢlı toplumlarda nabız basıncı koroner arter hastalığının bağımsız risk etmeni olarak gözlenmiĢtir. Lenogoum ve ark. ise OHA hastalarında NDH ve AG ve kardiyovasküler değiĢkenler arasındaki iliĢkileri değerlendirmiĢler. 27 3. GEREÇ ve YÖNTEM ÇalıĢmada heterozigot OHA taĢıyıcısı genç eriĢkinlerde arteriyel sertlik ve nabız dalga yansımasını inceleyerek hemoglobinin AS özelliği nedeniyle arterlerde değiĢiklikler olup olmadığını ortaya koymak amaçlanmıĢtır. 3.1. Gruplar Çukurova Üniversitesi Balcalı Hastanesine‟ne baĢvuran, çalıĢma kriterlerine uyan, yaĢları 19 ila 38 arasında değiĢen (ortalama 28,65±6,50) 16 kadın, 4 erkek, toplam 20 HbAS genotipli heterozigot OHA taĢıyıcısı olan genç eriĢkin birey alındı. Ayrıca çalıĢmaya kardiyolojik açıdan sorunları olmayan, yaĢları 18 ila 40 arasında değiĢen (ortalama 31,10±5,86) 16 kadın, 4 erkek, HbAA genotipli 20 sağlıklı eriĢkin gönüllü (kontrol grubu) dahil edildi. TaĢıyıcılarının tanıları hemoglobin elektroforezi ve aile taramaları ile konuldu. Kontrol grubundaki kiĢiler de benzer testlere tabi tutuldu. ÇalıĢma kapsamındaki taĢıyıcı ve kontrol grubunu oluĢturan kiĢilerin tümü Çukurova bölgesindendi. Uygulanacak iĢlem konusunda bilgilendirilen katılımcılar imzalı onayları alındıktan sonra çalıĢma grubuna gönüllü olarak dahil edildi. Tüm bireylerin ayrıntılı tıbbi öyküleri alındı, genel fizik muayenesi yapıldı, nabız ve arteriyel kan basıncı kaydedildi, boyu, kilosu ölçüldü, on iki kanallı elektrokardiyograf ile kalp Ģeridi çekildi. Transtorasık ve doku Doppler ekokardiyografi ile her iki karıncığın boyutları, sistolik ve diyastolik iĢlevleri, çapları, hacimleri, pulmoner arter basıncı, sol, sağ atriyum boyutları, hacimleri incelendi. Katılımcıların günlük arteriyel kan basıncının seyri incelenerek, nabız dalga hızı ve artırma göstergesi ölçümleri TensioMed arteriyograf cihazı kullanılarak, tek operatör tarafından yapıldı. Ölçümler, kardiyovasküler değiĢkenlerdeki günlük değiĢimler göz önünde bulundurularak sabah saat 9:00 ve öğlen 12:00 arasında ve sırtüstü uzanarak 15 dakikalık istirahatin ardından üçer defa gerçekleĢtirildi. Brakiyal arterde ölçülen nabız dalgasının iki komponenti - kalpten gelen atım dalgası ile periferdeki yansıma dalgası analiz edildi. ÇalıĢma kapsamına alınmadan önce rutin olarak yapılmıĢ olan tahlil sonuçları incelendi, en az 12 saat önceden kafein ve alkol alımı durduruldu. TaĢıyıcı ve sağlıklı bireylerin aortik sertlik değerleri brakiyal arterden TensioMed arteriyograf ile giriĢimsel 28 olmayan yöntemle ölçüldü, böylece gönüllü bireylerin sağlığına herhangi bir zarar verilmemesi için her türlü önlem alınmıĢ oldu. ÇalıĢma protokolü ġekil 10‟da Ģematik olarak gösterilmiĢtir. Orak hücre anemi taĢıyçı grubunun saptanması Öykü, fizik muayene,dıĢlama ölcütleri Ġstirahat Kan basıncı ölcümü Biyokimyasal incelemeler EKG, TELE Ekokardiyografi AG ve NDH değerlerinin ölçümü ġekil 10. ÇalıĢma protokolü ÇalıĢma Mersin Üniversitesi Tıp Fakültesi Etik Kurulu tarafından onaylandı. ÇalıĢma 1 aylık sürede tamamlandı. 3.2. DıĢlama Ölçütleri 1. Orak hücre anemisi hastalarında görülen kriz atakları, 2. Kalp hastalığı (kardiyak muayenesinde ritm bozukluğu, belirgin derecede üfürümü olanlar, baĢvuru esnasında çekilen 12 derivasyonlu istirahat EKC‟lerinde değiĢiklikleri olanlar), 3. Solunum sistemi (KOAH, kronik bronĢit, pulmoner emboli), 4. Karaciğer, 5. Kanser hastalığı 6. Kombine anemi 7. BaĢka önemli yandaĢ hastalıklar ve endoteliyal iĢlev bozukluğu risk faktörleri (DM, hipertansiyon, enfeksiyon, sistemik hastalıklar, hiperkolesterolemi, hamilelik, kardiyovasküler ilaç kullanımı v.b). 29 3.3. Öykü ÇalıĢmaya dahil edilen tüm hastaların, yaĢ, cinsiyet, hipertansiyon, diyabet, hiperlipidemi, koroner arter hastalığı, sigara kullanımı, ailede kalp hastalığı öyküsü gibi risk faktörleri, kullandıkları ilaçlar ve kadın katılımcıların hamile olup-olmadığı soğrulandı. Hastaların, nefes darlığı ve çarpıntı yakınmaları da sorgulanıp buna yönelik ek incelemeler yapıldı. 3.4. Fizik Bakı Hastaların genel görünümleri incelenerek, deride solukluk, ekstremitelerde soğukluk, periferik siyanoz, kardiyak kaĢeksi gibi iĢlevsel kapasite yetersizliğini gösteren bulgulara bakıldı. Kardiyak üfürümler, üçüncü ve dördüncü kalp sesleri, artmıĢ tepe atımı ise kalple ilgili patolojik fizik bakı bulguları olarak kabul edildi. Alt ve üst ekstremite nabız muayenesi yapıldı. Hastaların boy ve kiloları ölçülerek vücut kitle indeksi (VKĠ), ağırlık (kg)/boy (m²) formülü ile hesaplandı. Göbek hattı üzerinden geçecek Ģekilde bel çevresi ve kalçanın en dıĢ noktası alınacak Ģekilde kalça çevreleri ölçüldü. Civalı sfigmomanometre yardımıyla kan basınçları ölçüldü. Nabız sayıları bir dakika boyunca sayılarak kayıt edildi. 3.5. Kan Basıncı Ölçümü Hastalar en az 15 dakika dinlenme sonrası ve son 12 saat içerisinde sigara ya da kafeyinli içecek almamıĢ olacak Ģekilde, sırtları arkaya dayalı olarak bir sandalyeye oturtuldu. ManĢon kolu tamamen saracak Ģekilde bağlandı. Kol alttan desteklenerek, kalp seviyesinde olacak Ģekilde, civalı sfigmomanometre ile manĢon basıncı palpe edilen radiyal nabızın kaybolması ile belli olan sistolik düzeyden 20 mmHg daha yüksek düzeye çıkartılarak, manĢon indirilirken sesin (Korotkoff) ilk ortaya çıktığı nokta sistolik kan basıncı, kaybolduğu nokta ise diyastolik kan basıncı olarak kabul edildi. Sağ ve sol koldan kan basınçları 2 dakika ara ile 2 kez ölçülerek ortalama sistolik ve diyastolik kan basıncı değerleri bulundu. 30 3.6. Laboratuvar Ġnceleme Hastaların 12 derivasyonlu elektrokardiyogramları çekilerek, geçirilmiĢ miyokart enfarktüsüne ait patolojik Q dalgaları, dal blokları, atriyal fibrilasyon, ventriküler aritmiler, ST segment ve T dalga değiĢiklikleri olanlar belirlendi. Her iki grupta venöz kan örnekleri 12 saatlik açlığı takiben oturur pozisyonda, antekübital venlerden alındı. Tam kan sayımı, açlık kan Ģekeri, kan üre azotu, kreatinin, serum sodyum, potasyum düzeyleri, yüksek dansiteli kolesterol (HDL-K), düĢük dnsiteli kolesterol (LDL-K), total kolesterol (Total-K), hemoglobin elektroforezi ve tiroit fonksiyon testleri ölçümleri yapıldı. 3.7. Ekokardiyografik Ġnceleme Hastalara Acuson Sequoia C 256 model cihaz (Acuson Corporation, Mountain View, CA, USA) ve 3,5 mHZ prob kullanılarak ekokardiyografik inceleme yapıldı. Ekokardiyografik inceleme, hasta sırt üstü yatar pozisyonda veya sol yana yatar Ģekilde, uygun ekokardiyografik pencereler kullanılarak M-mod, iki boyutlu, renkli Doppler, nabız dalgalı Doppler ekokardiyografi yöntemleri kullanılarak yapıldı. M-mod ekokardiyografi: Amerikan Ekokardiyografi Derneğinin önerilerine uygun parasternal uzun eksen görüntülerinden elde edildi.76-78 Bu yöntemle sol ventrikül (SV) sistol ve diyastol sonu boyutları ve ejeksiyon fraksiyonu, diyastol sonu septum ve arka duvar kalınlıkları ve sol atriyum diyastol ve sistol sonu boyutları ölçüldü. SV kitlesi Penn formüllü kullanılarak hesaplandı (1,04x[(SVd+IVSd+ADd)³-(SVd)³]-13,6). SV kitlesinin vücut yüzey alanına (VYA) bölümü ile sol ventrikül kitle indeksi (SVKĠ) bulundu. Ġki boyutlu ekokardiyografi: Her iki ventrikül duvar hareketleri, kapak yapı ve iĢlevleri, perikardiyal patolojiler incelendi. Hastaların çoğunluğunda SV duvar hareket kusuru olması nedeniyle sistolik iĢlev iki boyutlu ekokardiyografi yöntemi ile elde edilen ejeksiyon fraksiyonu ile belirlendi. Hasta hafif sol yana yatırılarak uygun tepe dört-boĢluk görüntüleri elde edildi. Sol ve sağ ventrikülün sistol ve diyastol sırasındaki en küçük ve en geniĢ olduğu görüntüler saptandı. Daha sonra ekokardiyografi cihazındaki mevcut program ile değiĢtirilmiĢ Simpson kuralına göre otomatik olarak SV ve sağ ventrikül sistol ve diyastol sonu hacimleri ve ejeksiyon fraksiyonu hesaplandı. 31 Doku Doppler ekokardiyografi: Hastaların doku Doppler incelemesi 3,5 mHz transdüser ile doku Doppler programında yapıldı. Duvar filtresi ve kazanç en düĢük düzey, sıkıĢtırma ve istenmeyen görüntülerin yansıma ayarı ise en yüksek düzeyde tutuldu. Nyquist limit 15-20 cm/s‟ye getirilerek örnekleme hacim geniĢliği 2 mm2 olarak ayarlandı. Örnekleme hacminin miyokart üzerinde olmasına dikkat edildi. Doku Doppler görüntüleri 100 m/s hızla kayıt edildi. Ultrasonografik ıĢınların lateral mitral anülüse paralel olmasına özen gösterildi. Nabız dalgalı doku Doppler ile miyokart hareketlerini gösteren pozitif sistolik (Sm), negatif erken diyastolik (Em) ve negatif geç diyastolik (Am) dalgadan oluĢan ekokardiyografik görüntü elde edildi. Sol ventrikül sistolik iĢlevlerini değerlendirmek için sol ventrikül ejeksiyon süresine ait pozitif ilk S m dalgasının büyüklüğü ölçüldü.79-81 3.8. Arteriyel Sertlik Ölçümü Ölçüm için TensioMed marka arteriyograf cihazı kullanıldı (ġekil 9). Hastalar en az 5 dakika dinlenme sonrası ve son 30 dakika içerisinde sigara ya da kafeinli içecek almamıĢ olacak Ģekilde, ölçüm için ayrılmıĢ sessiz bir odada dıĢ uyaranlardan uzak duracak Ģekilde bir sedyeye yatırıldı. Hastaların jugüler çentik ve simfizis pubisi arasındaki mesafe ölçülerek veri cihazın program kısmına kaydedildi (ġekil10). Aygıt ile basınç ölçümü yapıldıktan sonra manĢon güncel olarak tespit edilen sistolik basınç değerinin üstünde ĢiĢirildi (en az 35 mmHg). Böylece brakiyal arter oklüzyonu gerçekleĢtirildi ve ölçüm süresi boyunca (yalnızca 8-20 saniye, ortalama 8 saniye) iĢlem koĢulu olarak kan akımı durduruldu. Bu çok özel durumda (stop-flow condition) akımın durduğu yerde ĢiĢirilmiĢ manĢonun üst sınırında brakiyal arterde bir membran oluĢmaktadır. Santral basınç değiĢiklikleri ile erken (direkt, P1) ve geç (geriye akseden P2) sistol dalgaları ile diyastolik dalga tıkanma olduğu yere ulaĢtıklarında tıpkı atan kanın bir zara vurması gibi diyafragmanda sezilir hale gelmektedir. Üst kol dokusu aktarıcı bir ortam gibi akan sıvının bası etkisiyle oluĢan küçük fakat sezilebilir değiĢiklikleri deri ve manĢon sınırı boyunca manĢona aktarıp generalize hale gelmelerini sağlar. Bu küçük, zayıf basınç değiĢikliklerini arteriyografın yüksek çözünürlükteki basınç sensörleri sezebilecek güçtedir ve bunu takiben de özel bir tonometre ile bunlar güçlendirilip taranmaktadır. Tonometre aracılığıyla elde edilen sinyaller kızıl ötesi, kablosuz iletiĢim ağı ile bilgisayara aktarıldı. Bilgilerin iĢlenmesi 32 bu amaçla geliĢtirilen software ile artırma göstergesi ve NDH değerleri basınç dalgalarıyla birlikte kaydedildi (ġekil 11,12). ġekil 11. TENSIOMed arteriograf ve ölçüm için hasta pozisyonu ġekil 12. Sol panel: Arteriografın çalıĢma mekanizması. Sağ panel: Arteriyel sertliğin çeĢitli dereceleri için yapılmıĢ ve Nabız dalga hızı ile birinci ve ikinci doruk noktaları arasındaki zaman farkı arasındaki lineer iliĢkiyi gösteren bilgisayarlı model simulasyonu ÇalıĢmaya alınan hastalar kardiyovasküler risk açısından izlendi. Hasta alınımına kasım 2010‟da baĢlandı. Rutin kan ve laboratuvar testleri yapılarak, klinik durumları hakkında bilgi edinildi, kaydedildi. Son hasta kontrolü aralık 2010‟da yapılarak çalıĢma sonlandırıldı. 3.9. Ġstatistik Yöntemleri ÇalıĢmada elde edilen bulgular değerlendirilirken, istatistiksel analizler SPSS (Statistical Package for Social Sciences) for Windows 13.0 yazılım paketi kullanılarak yapıldı. Grup verilerindeki sürekli değiĢkenler (“yaĢ” ve “artırma göstergesi” gibi) ortalama ± standart sapma (ort±SS) ve ortanca ± minimum, maksimum (med±min, 33 maks) olarak belirtildi. Kategorik değiĢkenler (“cinsiyet” ve sigara kullanımı” gibi) ise sayı ve yüzde (%) ile verildi. Klinik ve kardiyovasküler sürekli değiĢkenlerin grup karĢılaĢtırmaları için MannWhitney U test istatistiği, kategorik değiĢkenler içinde Ki-Kare testi kullanıldı. NDH, artırma göstergesi ve brakiyal kan basıncı, kalp hızı , ağırlık, boy, yaĢ, açlık kan Ģekeri, LDL-K, üre, kreatinin , Hb ve Total-K düzeyleri arasındaki iliĢkileri bulmak için univariate analizi kullanıldı. Hemoglobin AS durumunun, yaĢın, ağırlığın, ortalama arteriyel kan basıncının (OAB), kalp hızının, hemoglobin ve total kolesterol düzeyinin, NDH ve aortik artırma göstergesinin (Aortik AG) bağımsız belirleyicileri olup olmadığı bulmak için stepwise multiple gerileme analizi yapıldı. Kalp hızı ve kan basıncı (KB), NDH‟nın, artırma göstergesinin belirleyicileridir. Bu açıdan NDH ve artırma göstergesi arasında bulunan farklar, KB ve KH açısından olan farklarla karĢılıklı iliĢkisi covarians analizi kullanarak incelendi. Ġstatistiksel analizler yapılırken korelasyon analizinde p<0,01 ve diğer analizlerde p<0,05 değeri istatistiksel olarak anlamlı kabul edildi. 34 4. BULGULAR 4.1. Grupların Demografik Özellikleri ve Sigara Kullanımı ÇalıĢmaya aldığımız olguların % 20‟si erkek, % 80‟i kadın, hastaların yaĢ ortalaması 31,10±5,86 idi. TaĢıyıcı ve kontrol grupları arasında yaĢ, boy, kilo yönünden anlamlı bir farklılık bulunmadı (p>0,05). Gruplar sigara kullanımı açısından incelendiğinde kontrol grubunda sigara öyküsünün olmadığı, taĢıyıcı grubunda sigara öyküsünün olduğu saptandı, fakat aralarındaki fark istatistiksel olarak anlamsız bulundu (p>0,05). Grupların demografik özellikleri Tablo 6‟da özetlenmiĢtir. Tablo 6. Grupların demografik özellikleri ve sigara kullanım dağılımı YaĢ Boy Kilo Sigara Kontrol grubu Ort. ±SS Median (min, maks) TaĢıyıcı grubu Ort. ±SS Median (min, maks) 28,65 ± 6,50 29 (19,38) 167,75 ± 7,79 169,0 (155,179) 65,15 ± 10,5 68 (45,82) 31,10 ± 5,86 32,50 (19,38) 164,8 ± 6,8 165 (155,177) 67,1 ± 12 65 (49,98) _ 0,20 ± 0,52 30,00 (0,2) %11,8 p 0,242 0,201 0,820 0,429 0,198 4.2. Ekokardiyografik Bulgular TaĢıyıcı ve kontrol grubuna ait ekokardiyografik bulgular değerlendirildiğinde ejeksiyon fraksiyonu (EF), pulmoner arter sistolik basınçları (PABs), aortun diyastolik çapları (Aod) ve sol karıncık kitle göstergeleri arasında istatistiksel olarak anlamlı farklar tespit edilmedi (p>0,05). Aortun sistolik (Aos) çapları taĢıyıcı grubunda anlamlı derecede büyük bulundu (p=0,000). Bulgular Tablo 7‟de özetlenmiĢtir. 35 Tablo 7. Gruplara ait EKO bulguları EF PABs Ao(d) SV ki Ao(s) TaĢıyıcı grubu Ort. ±SS Median(min, maks) 65,35± 3,89 65,5 (59 - 72) 24,50 ± 2,76 25 (20 - 30) 28,00±3,15 28,00(22-35) 100,78 ± 19,8 99,1 (64 - 137) 22,70±2,11 22,00(18-27) Kontrol grubu Ort. ±SS Median(min, maks) 66,95 ± 4,47 68,0 (60 – 74) 24,0 ± 2,05 25,0 (20 - 25) 28,20±2,31 28,00(25-33) 91,21 ± 22,09 84,5 (63 - 136) 19,80±2,46 20,00(15-24) P 0,231 0,678 0,779 0,091 0,000 EF - ejeksiyon fraksiyonu, PABs - pulmoner arter sistolik basıncı, Ao(d) – aortun diyastolik capı, SV ki - sol ventrikül kitle göstergesi, Ao(s) – aortun sistolik çapı ġekil 13. Gruplara ait EKO bulgularının grafiği Ao(s)-Aortun sistolik çapı 4.3. Hematolojik Bulgular TaĢıyıcı ve kontrol grubunun hematolojik bulgularının ortalama değerleri ve standart sapmaları Tablo 7‟de gösterilmiĢtir. Tetkik sonuçları değerlendirildiğinde taĢıyıcı ve kontrol grupları arasında Hb, hematokrit, ortalama eritrosit hemoglobin konsantrasyonu (MCHC), trombosit (PLT) değerleri açısından anlamlı fark tespit edilmedi. Ortalama eritrosit hacmi(MCV), ortalama eritrosit hemoglobini (MCH) ve 36 eritrosit dağılım geniĢliği (RDW) değerleri arasındaki fark ise anlamlı bulundu. OHA taĢıyıcılarında eritrositlerin ortalama hacmi ve eritrositlerdeki hemoglobin miktarı daha düĢük seyrederken (p=0,000) eritrositlerin büyüklüklerine göre dağılımı daha yüksek bulundu (p=0,035). Hematolojik tetkik sonuçları Tablo 8‟de ve grafik olarak sırasıyla ġekil 14, ġekil 15 ve ġekil 16‟da gösterilmiĢtir. Tablo 8. Kontrol ve taĢıyıcı gruplarında hematolojik bulgular Hb (gr/dl) Hct (%) MCV (fl) MCH (pg) MCHC (%) PLT RDW (%) TaĢıyıcı grubu Ort. ±SS Median (min, maks) 13,15 ± 1,187 12,70 (11,6, 15,9) 37,9 ± 2,95 36,80 (34,7, 45,7) 79,0 ± 4,29 79,4 (72,2, 86,3) 27,7 ± 1,73 27,8 (25,0, 30,7) 34,75 ± 0,66 34,8 (33,7, 36,0) 247,0 ± 49,9 246,0 (150, 336) 14,43 ± 1,66 14,25 (12,7, 18,8) 37,45 ± 1,88 38,15 (33,6, 39,8) Kontrol grubu Ort. ±SS Median (min, maks) 13,8 ± 1,49 13,65 (11,7, 16,5) 39,5 ± 4,27 40,20 (33,4, 46,4) 86,06 ± 3,52 86,70 (81,0, 92,8) 30,05 ± 1,43 29,9 (27,6, 33,0) 34,92 ± 0,94 35,2 (33,5, 36,4) 224,4 ± 45,98 206,5 (145, 316) 13,7 ± 1,66 13,3 (12,3, 18,4) Hb S (%) p 0,149 0,265 0,000 0,000 0,414 0,174 0,035 Hb (gr/dl)-hemoglobin, Hct (%) -hematokrit, MCV (fl)-ortalama eritrosit hacmi MCH (pg)- ortalama eritrosit hemoglobini, MCHC (%)-ortalama eritrosit hemoglobin konsantrasyonu, PLT-trombosit, RDW (%)-eritrosit dağılım geniĢliği, Hb S (%)-OHA hastalığı 37 MCV(fl)-ortalama eritrosit hacmi ġekil 14. Grupların MCV değerlerinin dökümü MCH(pg) -ortalama eritrosit hemoglobini ġekil 15. Grupların MCH değerlerinin dökümü 38 RDW(%)-eritrosit dağılım geniĢliği ġekil 16. Grupların RDW değerlerinin dökümü 4.4. Biyokimya Değerleri TaĢıyıcı ve kontrol grubunun biyokimya testlerinin sonuçları istatistiksel olarak karĢılaĢtırıldığında (AKġ) açlık kan Ģekeri, üre, kreatinin, kolesterol değerleri arasında anlamlı fark bulunmadı. Sodyum, potasyum, total kolesterol (Total-K) ve düĢük yoğunluklu lipoprotein (LDL-K) düzeyleri arasında anlamlı farklar bulundu. HbAS genotipli heterozigot taĢıyıcılarda sodyum miktarı daha düĢük iken (p<0,009), potasyum, Total-K ve LDL-K düzeyleri daha yüksek bulundu. (sırasıyla p<0,038, 0,035, 0,033). Ġki gruptaki biyokimyasal değerler Tablo 9 ve ġekil 17, ġekil 18, ġekil 19 ve ġekil 20‟de sırasıyla gösterilmiĢtir. 39 Tablo 9. TaĢıyıcı ve kontrol gruplarında biyokimya testlerinin istatistiksel değerlendirilmesi (P<0,05) AKġ(mg/dl) ÜRE(mg/dl) Kreatinin(mg/dl) Sodyum(mmol/L) Potasyum(mmol/L) Total-K(mg/dl) LDL- K(mg/dl) CHOL (mmmol) Kontrol grubu Ort. ±SS Median (min, maks) 85,7 ± 12,9 88,5 (58, 100) 12,05 ± 2,36 11,87 (9,0, 17,6) 0,76 ± 0,22 0,79 (0,08, 1,09) 142,6 ± 1,19 142,0 (141, 144) 4,52 ± 0,31 4,51 (4,01, 5,31) 146,0 ± 32,9 145,0 (104, 209) 80,90 ± 27,45 77,0 (45, 132) 5973,0 ± 2679,5 7121,5 (98, 7199) TaĢıyıcı grubu Ort. ±SS Median (min, maks) 84,65 ± 13,44 83,50 (61, 114) 12,3 ± 2,99 13,7 (8,02, 16,40) 0,71 ± 0,12 0,73 (0,46, 0,88) 141,15 ± 2,48 140,5 (136, 148) 5,06 ± 0,8 4,61 (4,00, 6,77) 167,1 ± 27,99 170,5 (88, 200) 98,0 ± 24,2 102,5 (40, 130) 5414,20 ± 3109,46 7148 (156, 7198) p 0,565 0,565 0,183 0,009 0,038 0,035 0,033 0,264 AKġ (mg/dl) - açlık kan Ģekeri, Total-K (mg/dl) - total kolesterol, LDL –K (mg/dl)- düĢük yoğunluklu lipoprotein Sodyum (mmol/L) ġekil 17. Grupların sodyum (mmol/L) değerlerinin istatistiksel grafiği 40 Potasyum(mmol/L) ġekil 18. Grupların potasyum (mmol/L) değerlerinin istatistiksel grafiği Total-K (mg/dl) ġekil 19. Grupların Total-K (mg/dl) değerlerinin istatistiksel grafiği 41 LDL-K(mg/dl) ġekil 20. Grupların LDL-K (mg/dl) değerlerinin istatistiksel grafiği 4.5. Arteriografiden Elde Edilen Bulgular 4.5.1. HbAS ve HbAA Gruplarında Kalp Hızı ve Basınçların KarĢılaĢtırılması HbAS ve HbAA gruplarındaki hemodinamik değiĢkenlerin ölçüm sonuçları karĢılaĢtırıldığında kalp hızı, sistolik (SisKB), diyastolik (DKB), ortalama ve nabız basınçları, basınç yükselme hızı, santral kan basıncı (SKB) değerleri arasındaki farklar anlamlı bulunmadı. TaĢıyıcı grubunda aort basıncı (aoAPmmHg) değeri (95,64 ± 23,2) kontrol grubundakine (80,15 ± 7,31) göre anlamlı derecede yüksekti (p=0,033). TaĢıyıcı ve kontrol gruplarında ölçülen hemodinamik değiĢken değerleri ve istatistiksel değiĢkenleri Tablo 10‟da ve ġekil 21‟de gösterilmiĢtir. 42 Tablo 10. TaĢıyıcı ve kontrol gruplarında KH ve basınç değiĢkenlerinin istatistiksel verileri (p<0,05) Kalp hızı 1(dk) Sys KB ( mmHg) DKB (mmHg) OAB (mmHg) NB (mmHg) AoAB (mmHg) maksdp/dt (mmHgsn) SKB (aommHg) Kontrol grubu Ort. ±SS Median (min, maks) 74,9 ±15,6 71,5 (55,114) 117,9 ± 10,3 117,0 (60,80) 70,05 ± 6,26 70,0 (60,80) 85,95 ± 6,88 84,0 (76,98) 47,9 ± 8,40 47,00 (33,64) 80,15 ± 7,31 77,79 (69,08, 95,36) 895,6 ± 207,9 914,5 (595,8, 1288,4) 105,0 ± 7,74 103,9 (91,6, 119,9) TaĢıyıcı grubu Ort. ±SS Median (min, maks) 75,50 ± 9,30 75,50 (56,95) 123,8 ± 14,5 121,0 (108,160) 72,25 ± 9,63 71,50 (56,95) 89,35 ± 9,86 87,50 (76,114) 51,60 ± 12,8 49,00 (37,88) 95,64 ± 23,2 93,52 (62,2, 151,0) 1044,6 ± 482,1 915,5 (518,0, 2254,0) 116,56 ± 17,94 113,94 (94,65, 158,55) P 0,414 0,165 0,547 0,289 0,547 0,033 0,599 0,060 Sys KB (mmHg)-sistolik kan basıncı, DKB (mmHg)-diyastolik kan basıncı, OAB (mmHg)-ortalama basınç, NB (mmHg)- nabız basıncı, AoAB (mmHg) – aort basıncı, maks dp/dt (mmHgsn) - basınç yükselme hızı, SKB (aommHg)-santral kan basıncı, AoAB(mmHg) ġekil 21. TaĢıyıcı ve kontrol gruplarında AoABmmHg değerlerinin istatistiksel karĢılaĢtırma grafiği 4.5.2. HbAS ve HbAA Grupları Arasında Arteriyel Sertlik Belirteçlerinin KarĢılaĢtırılması Grupların arteriyel sertlik, NDH ölçümleri değerlendirildiğinde, sol karıncık ejeksiyon fraksiyonu, sol karıncık gevĢeme süresi, aortik nabız dalga hızı, sistolik ve diyastolik alan göstergeleri ve diyastolik yansıma alanları arasında anlamlı fark 43 bulunmadı (p>0,05). Brakiyal ve aortik artırma göstergelerinin ve sistolik-diyastolik nabız dalga hızı farkının değerleri HbAS grubunda daha yüksek bulundu (sırasıyla p=0,011, 0,011, 0,040). TaĢıyıcı ve kontrol gruplarında ölçülen arteriyel sertlik belirteçlerinin değerleri ve istatistiksel değiĢkenleri Tablo 11‟de ve ġekil 22, ġekil 23 ve ġekil 24‟de sırasıyla gösterilmiĢtir. Tablo 11. TaĢıyıcı ve kontrol gruplarının arteriyel sertlik belirteçlerinin değerleri (P<0,05) DeğiĢkenler Brakiyal AG Aortik AG Edms RTms NDHao SAI DAI DRA NDHsdms JucSYcm Kontrol grubu Ort. ±SS Median (min,maks) -53,27±16,65 -59,36(-74,40, -18,50) 10,67 ±8,4 7,59 (-0,2, 28,30 ) 292,8 ± 27,72 295,0 (235, 355) 152,0 ± 16,5 154,0 (124, 187 ) 7,15 ± 0,7 7,05 (5,91, 8,15) 46,40 ± 5,74 46,52(36,61, 57,36) 53,6 ± 5,74 53,72 (42,64, 63,39) 63,48 ± 16,84 66,97 (35,2, 115,1) 0,300 ± 0,194 0,200(0,0, 0,8) 54,20 ±2,94 54,00 (50,63) TaĢıyıcı grubu Ort. ±SS Median (min,maks) -29,66 ±29,73 -30,38 (-80,69, 28,04) 22,62± 15,05 22,26 (-3,21, 51,83) 303,8 ±18,3 300,0 (280, 350) 143,1 ± 25,9 145,0 (99, 180) 7,80 ± 1,49 7,59 (5,89, 10,68) 47,64 ± 9,19 46,52 (37,08, 74,45) 52,29 ± 9,13 53,48 (25,5, 62,92) 57,85 ± 16,7 53,78 (35,6, 89,4) 0,640 ± 0,55 0,500 (0,1, 2,3) 55,0 ± 3,79 54,0 (48,63) p 0,011 0,011 0,184 0,335 0,351 0,935 0,935 0,461 0,040 0,620 Brakiyal AG - brakiyal artırma göstergesi, Aortik AG – aortik artırma göstergesi, Edms – sol ventrikül ejeksiyon zamanı, RTms – nabız dalgası yayılımının aort kökünden çatallanmaya ve oradan da geriye geliĢ süresi, NDHao – aort nabız dalgası yayılım hızı, SAI – sistolik alan göstergesi, DAI – diyastolik alan göstergesi, DRA –diyastolik refleks alanı, NDHsdms – sistolik-diyastolik nabız dalga hızı, JucSYcm –jugulum-symphsis arası mesafe 44 Brakiyal AG - brakiyal artırma göstergesi ġekil 22. Gruplarda Brakiyal AG değerlerinin istatistiksel karĢılaĢtırma grafiği AortikAG - aortik artırma göstergesi ġekil 23. Gruplarda Aortik AG değerlerinin istatistiksel karĢılaĢtırma grafiği 45 NDHsdms - sistolik-diyastolik nabız dalga hızı ġekil 24. Gruplarda sistolik-diyastolik NDH değerlerinin istatistiksel karĢılaĢtırma grafiği 4.5.3. Arteriyel Sertlik Belirteçleri Ġle Bağımsız DeğiĢkenler Arasındaki ĠliĢkiler 4.5.3.1. Toplam AraĢtırma Gruplarında Nabız Dalga Hızı, Artırma Göstergesi ve Bağımsız DeğiĢkenler Arasındaki ĠliĢki Her iki gruba dahil olan katılımcıların arteriyel sertlik belirteçlerinin değerleri birlikte ele alındığında (Tablo 12) NDHao ile OAB, yaĢ, Aortik AG, Aixbrachial, ağırlık, LDL-K arasında ve Aortik AG ile yaĢ arasında anlamlı pozitif korelasyon bulundu. Aortik AG ile KH arasında ise negatif anlamlı korelasyon bulundu (0,041). HbSS genotipli hastaların incelendiği prototip çalıĢmadakine benzer Ģekilde, nabız dalgasının yayılma hızı ile kalp hızı arasında istatistiksel olarak anlamlı korelasyon bulunmadı (p=0,227). Tablo 12. Toplam araĢtırma gruplarında değiĢkenler arasında bulunan istatistiksel anlamlı iliĢkiler GRUPLAR TOTAL (iki grup birlikte) (n=40) ĠliĢkisi Ġncelenen DeğiĢkenler NDHaoms NDHaoms NDHaoms NDHaoms NDHaoms NDHaoms Aortik AG OAB yaĢ Aortik AG Brakiyal AG ağırlık LDL-K yaĢ Korelasyon Türü ( / ) p Anlamlı p r2=0,436 r2=0,16 r2=0,459 r2=0,462 r2=0,129 r2=0,112 r2=0,146 0,000 0,017 0,000 0,000 0,034 0,05 0,026 p<0,01 p<0,05 p<0,01 p<0,01 p<0,05 p<0,05 p<0,05 NDHao- Aortik nabız dalga hızı, Aortik AG- aortik artırma göstergesi, Brakiyal AG- brakiyal artırma göstergesi, LDL-K- düĢük yoğunluklu lipoprotein 46 ġekil 25. Toplam araĢtırma gruplarında değiĢkenler arasında istatistiksel anlamlı iliĢkilerin grafiği Aixortic – aortik artırma göstergesi, Aixbrakiyal- brakiyal artırma göstergesi, PWVaoms-aortik nabız dalga yayılım hızı, LDL-düĢük dansiteli lipoprotein 4.5.3.2. Gruplar Ġçinde Nabız Dalga Hızı, Artırma Göstergesi ve Bağımsız DeğiĢkenler Arasındaki ĠliĢki HbAS grubunda aortik nabız dalga yayılım hızı (NDHao) ve sistolik kan basıncı, ağırlık ve yaĢ arasında pozitif korelasyon (sırasıyla p=0,027; p=0,027; p=0,016) ve Aortik AG ve serum potasyum miktarı arasında negatif korelasyon (p=0,007) bulundu. (Tablo 13, ġekil 20). Grupların hiç birinde NDHao ile kalp hızı arasında istatistiksel olarak anlamlı korelasyon bulunmadı (p>0,05). Serum potasyum düzeyinin beklendiği gibi (hemolize bağlı olarak) daha yüksek (p=0,038) bulunduğu HbAS grubunda NDHao ile potasyum arasında mevcut olan negatif yönlü iliĢki istatistiksel olarak anlamsız bulundu. Potasyum düzeyinin daha düĢük (P=0,038) bulunduğu HbAA grubunda 47 NDHao ile potasyum arasında istatistiksel anlamlı (P=0,028) pozitif korelasyon gözlendi. HbAS ve HbAA gruplarındaki anlamlı değiĢkenler Tablo 13 ve ġekil 19‟da gösterilmiĢtir. Tablo 13. HbAS ve HbAA gruplarında değiĢkenler GRUPLAR ĠliĢkisi incelenen değiĢkenler HbAS grubunda (n=20) NDHao Aortik AG NDHao Brakiyal AG NDHao SKB NDHao ağırlık NDHao yaĢ NDHao OAB Aortik AG OAB Aortik AG Potasyum Kontrol (HbAA) grubunda (n=20) NDHao Potasyum Korelasyon türü ( / ) r2=0,603 r2=0,601 r2=0,286 r2=0,285 r2=0,332 r2=0,496 r2=0,397 2 r =0,392(-) P Anlamlı P 0,000 0,000 0,027 0,027 0,016 0,002 0,009 0,007 P<0,01 P<0,01 P<0,05 P<0,05 P<0,05 P<0,01 P<0,01 P<0,05 r2=0,267 0,028 P<0,05 Aortik AG - aortik artırma göstergesi, Brakiyal AG - brakiyal artırma göstergesi, SKB-santral kan basıncı, OAB-ortalama kan basıncı, NDHao-aortik nabız dalga hızı 48 ġekil 26. Gruplar içinde değiĢkenler arasında istatistiksel anlamlı iliĢkilerin grafiği Aortik AG - aortik artırma göstergesi, Aixbrakiyal- brakiyal artırma göstergesi, PWVaoms-aortik nabız dalga yayılım hızI, MAPmmHg- Ortalama kan basıncı, POT- Potasyum Katılımcıların toplamında arteriyel sertliğin bağımsız belirleyicileri olarak OAB ve yaĢ ortaya çıktı (Tablo 14). Tablo 14. Aortik nabız dalga hızının belirleyicileri DeğiĢkenler OAB, mmHg YaĢ β .586 .404 SE .023 .040 t 3,517 2,429 p 0,003 0,029 Stepwise multiple regression analysis; n=40 Model r2=0,496; F=14,739. Model p<0,005. β – gerileme katsayısı. Stepwise multiple gerileme analizinde aortik artırma göstergesi, artan kalp hızı ile azalmaktadır (p=0,041) (Tablo 15). Ayrıca, multivaryant analizi artırma göstergesinin yüksek OAB‟la arttığını gösterdi. 49 Tablo 15. Aortik artırma göstergesinin belirleyicileri DeğiĢkenler OAB,mmHg HR β .716 - 0.423 SE 0.272 0.309 Stepwise multiple regression analysis; n=40 Model r2=0,397; F=9,203 Model p<0,005 β – gerileme katsayısı 50 t 3.847 - 2.272 p 0.002 0.041 5. TARTIġMA 5.1. Konunun Güncelliği Orak hücre anemisi, hemoglobin sentez bozukluğu sonucu oluĢan kalıtsal hastalıktır. Dünyada ve ülkemizde hastalığın görülme sıklığı ve taĢıyıcılığı yüksek olup bu hastalıkla ilgili çok yönlü araĢtırmalar yapılmıĢ, hastalığın neden olduğu 1,82-85 hemodinamik değiĢiklikler de bir dizi araĢtırmalara konu olmuĢtur. Bu çalıĢmaların bir bölümü arteriyel sertlik ve nabız dalga yansımasıyla ilgilidir.86-88 En önemli basınç koĢulları olarak artırma göstergesi ve santral sistolik kan basıncı tanımlanmıĢtır. Bu parametrelerin yükselmiĢ değerleri gelecekteki kardiyovasküler olayların bağımsız markeri ve habercisi olarak görülmektedir.24,71,72 Damar hastalıkları çoğunlukla sinsi olarak, semptomsuz geliĢir. Kompliyansın azalması, periferal direncin yükselmesine sebep olmakta, bu da kardiyak iĢin artmasını gerektirmektedir. Bu değiĢiklikler, nabız dalga bicimi analizi ile ölçülebilir. Arteriograf bu ölçümü yapabilmekte ve arterlerin durumunu nabız dalga analizi ve arteryel sertlik ölçümü ile gösterebilmektedir. Arteriyel sertliğin değerlendirilmesi – preklinik hedef organ hasarının erken bulgusu olarak– 2007 ESH/ESC Guidelines for the Management of Arteryel Hypertension” tarafından tavsiye edilmektedir.89 Daha önce yapılan bir çalıĢmada HbSS genotipli hastalarda HbAA genotipli sağlıklılara göre daha düĢük ortalama arteriyel kan basıncı (OAB) ve düĢük nabız dalga hızı (NDH) ile karĢılaĢılmıĢtır.1 Kan basıncı arteriyel sertliğin majör belirleyicisi olduğundan bu hastalarda gözlenen arteriolar ve arteriyel dilatasyona bağlı oluĢan düĢük kan basıncı, düĢük NDH‟yi açıklayabilir. Genel kanıya göre, düĢük ve orta seviyede damar düz kas gevĢemesi elastik lifleri kullanarak arteriyel sertliği azaltırken, daha güçlü dilatasyon kollajen lifleri etkileyerek artmıĢ arteriyel sertliğe sebep olmaktadır. Görünen o ki, HbSS hastalarında biyokullanıĢlı NO‟in artmıĢ bazal seviyesi ile NO aracılı vazodilatasyon arteriyel geniĢleyebilirlik düzeyine katkıda bulunmaktadır. Laurent S ve ark.90 arteriyel sertliğin, Blacher J ve ark.74 ise aortik nabız dalga hızının kardiyovasküler patolojilerin erken habercisi olduğunu bildirmiĢlerdir. Bu 1 araĢtırmaları ve Lemogoum ve ark. çalıĢmasında HbSS hastalarında sağlıklılara göre bulunan hemodinamik değiĢiklikleri göz önünde bulundurarak heterozigot OHA 51 taĢıyıcılarında KVS hastalığı riski olup olmadığını öğrenmek için HbAS genotipli bireylerde arteriyel sertliği ve aortik nabız dalga yansımasını incelemeye karar verdik. Orak hücre anemisi taĢıyıcılarında bu parametreleri araĢtıran baĢka bir çalıĢmadan haberdar değiliz. ÇalıĢmamızın özü, heterozigot orak hücre anemisi taĢıyıcılarında nabız dalga hızı ile değerlendirilen arteriyel sertlik ve artırma göstergesi tarafından belirlenen dalga yansıması sonuçlarının normal toplumdaki sonuçlarla karĢılaĢtırılmasıdır. Gruplar arasında sol ventrikül ejeksiyon fraksiyonu, sol ventrikül kitle göstergesi, kalp hızı, Hb, basınçlar, arteriyel sertlik belirteci olan nabız dalga hızı, nabız dalga yansımasının belirteci olan artırma indeksi, biyokimya değerleri (Total-K, LDL-K, sodyum, potasyum, AKġ, ÜRE, Kr) yönünden karĢılaĢtırmalar yapıldı. ÇalıĢmamızda alınan sonuçlar, HbAS genotipli OHA taĢıyıcılarının alyuvarlarında bulunan hemoglobin S miktarının arteriyel sertliği etkilemediğini, artırma göstergesini ise yükselttiğini göstermektedir. 5.2. Hastaların Demografik Özellikleri Kalp ve damar hastalıklarının yaĢ, cinsiyet, sigara kullanımı, kan basıncı yüksekliği, diyabet ve hiperkolesterolemi ile iliĢkisi bilinmektedir. Bu nedenle, çalıĢmamızın her iki grubuna aynı bölgede yaĢayan orak hücre anemisi taĢıyıcısı ve sağlıklı gönüllüler olarak alyuvarlarındaki Hb‟nin özelliği dıĢında önemli farkları bulunmayan, yaĢ, cinsiyet, kalp hızı, vücut ağırlığı, boy, kan Ģekeri, total kolesterol, sigara kullanımı, yani arteriyel sertliği etkileyen faktörler bakımından bir birine eĢdeğer bireyler dahil edildi. ÇalıĢmanın her iki grubunda kadın/erkek oranı aynı olup, kadın katılımcıların hamile olub-olmadığı soğrulanarak kaydedildi. Arteriyel sertlikdeki değiĢikliğin KVS hastalıklarının öncül habercileri olması bakımından çalıĢma kapsamına kardiyolojik açıdan Ģikâyeti ve hastalık bulgusu olmayan genç eriĢkinler alındı. Lemogoum ve ark. 1 çalıĢmasında HbSS ve HbAA gruplarında yaĢ ortalaması 24 olup, bizim çalıĢmamızda sırasıyla 31 ve 28 idi. Hipertansiyon, diyabet v.b. yandaĢ hastalıklar kalp-damar sistemi için önemli risk etmenleri olduğundan bu hastalıkların belirtilerinin bulunması çalıĢmamızda dıĢlama kıstası olarak kabul edildi. Ayrıca, aortta NDH ölçümünün prognostik değeri 52 incelemenin izobarik Ģartlarda ve normal tansiyon halinde gerçekleĢtirilmesi durumunda anlamlı olacağından54,65 gönüllülerin hemodinamik açıdan asemptomatik olmasına özellikle dikkat edildi. ÇalıĢmaya dahil edilen tüm gönüllülerin ilaç kullanımı öyküsü alındı, nefes darlığı ve çarpıntı yakınmaları sorgulanıp buna yönelik ek incelemeler yapıldı. 5.3. Hematolojik Bulgular Orak hücre anemisi HbSS genotipli, otozomal resesif geçis gösteren, birçok sistemi etkileyen kronik ve hemolitik tipte bir anemi çesitidir.3-6 TaĢıyıcı grubuna hemoglobin elektroforezinde HbAS saptanan gönüllü bireyler alındı. Taylor JGt ve ark.91 bildirdiği gibi OHA hastalarında görülen vazo-okluziv krizler damar ağında, özelliklede intimada patolojik değiĢikliklere neden olduğundan öyküsünde, muayene ve tetkiklerinde orak hücre anemisi hastalarında görülen kriz ataklarını anımsatan bulguları olan taĢıyıcılar çalıĢma kapsamına alınmadı. Fizik muayenede solukluk, sarılık, splenomegali, enfeksiyon bulguları, organ ve iskelet sistemindeki Ģekil bozuklukları gibi OHA bulgularının olmamasına dikkat edildi. Lemogoum ve ark.1 çalıĢmasında OHA hastalarında belirgin anemi saptanmıĢtır (ortalama hemoglobin miktarı HbSS grubunda 8g/dL, HbAA grubunda ise 14g/dL). ÇalıĢmamızdaki taĢıyıcı ve kontrol grubunun hematolojik tetkik sonuçları karĢılaĢtırmalı olarak değerlendirildiğinde Hb, Hct, MCHC, PLT değerleri normal sınırlarda olup gruplar arasında anlamlı fark tespit edilmezken, MCV, MCH ve RDW değerleri açısından anlamlı farklar saptandı: taĢıyıcı grubunda alyuvarların ortalama hacmi ve alyuvarlardaki ortalama hemoglobin miktarı daha düĢük seyrederken alyuvarların büyüklüklerine göre dağılımı (RDW) daha yüksek bulundu. Dünya Sağlık örgütünün anemi tanısı için belirlediği eĢik değerlerden yaĢ ve cinsiyet bakımından çalıĢmamızdaki bireylere uygun olanlar Ģöyledir: on beĢ yaĢ üzeri hamile olmayan bayanlar için 12,0 g/dl (7,4 mmol/l), on beĢ yaĢ üzeri erkekler için 13,0 g/dl (8,1 mmol/l).92 ÇalıĢmamızda her ne kadar Hb ve Hct değerleri normal sınırlarda bulunsa da bir hemolitik anemi türü olan orak hücre anemisi taĢıyıcılarının alyuvarlarının HbS ihtiva etmesi MCV ve MCH değerlerinin düĢük, RDW değerlerinin yüksek olmasını bir ölçüde açıklamaktadır. 53 5.4. Ekokardiyografik Bulgular OHA hastalarında ekokardiyografik incelemelerin ele alındığı çalıĢmalarda93-95 pulmoner hipertansiyon ve sol ventrikül fonksiyonları normal iken sol ventrikül hipertrofisi bulguları ön plana çıkmakta, triküspit ve mitral regurjitasyon hızlarında artıĢ görülmekte ve bu değiĢikliklerle anemi derecesi ve yüksek LDH arasında bağımsız iliĢki gözlenmektedir. ÇalıĢmamızda ekokardiyoğrafik bulgulardan ejeksiyon fraksiyon yüzdeleri, pulmoner arter sistolik basınçları, aortun diyastolik çapları ve sol karıncık kitle göstergeleri açısından iki grup arasında istatistiksel anlamlı fark tespit edilmezken, aortun sistolik çapı HbAS grubunda anlamlı derecede büyük bulundu. HbSS ve talassemi hastalarında sol ventrikül hipertrofisinin geliĢmesinde mevcut aneminin rolü 93,96 olduğu bilinmektedir. Sol ventrikül dilatasyonunun Hb miktarı ile yaĢla, hastalığın süresi ile ters iliĢki içinde olduğu bildirilmiĢtir.83 ÇalıĢmamızda ise OHA taĢıyıcılarında anemi saptanmamıĢ olup aortun sistolik çapında tespit edilen artıĢ bu bireylerin yukarıda belirtilen hematolojik verileri ile açıklanamamaktadır. 5.5. Biyokimya Agoreyo FO ve ark.97 çalıĢmasında OHA hastalarında serum Na ve serum K düzeylerinin HbAA kontrol grubuna göre anlamlı derecede yüksek olduğu bildirilmiĢtir. Bu iki önemli katyonun düzeylerindeki yükseklik OHA hastalarında anemiye ve renal fonksiyonlardaki değiĢikliğe bağlanmaktadır. Bizim çalıĢmamızda taĢıyıcı ve kontrol grubunda biyokimya testlerinin sonuçları istatistiksel olarak karĢılaĢtırıldığında AKġ, ÜRE, KRE değerleri arasında anlamlı fark bulunmadığı halde, serum sodyum ve serum potasyum düzeyleri arasında anlamlı farklar kaydedildi, taĢıyıcılarda sodyum miktarı daha düĢük iken, potasyum düzeyleri daha yüksek bulundu. ÇalıĢmamızda HbAS grubunda serum potasyum düzeyi, muhtemelen hemolize bağlı olarak, kontrole göre daha yüksek bulunurken, bu grupta aortik artırma göstergesi ile potasyum arasında anlamlı negatif korelasyon iliĢkisi saptandı, PWVao ile potasyum arasındaki korelasyon iliĢkisi ise anlamlı bulunmadı. El-Hazmi MAF ve ark.98 OHA hastalarıyla sağlıklı bireyleri karĢılaĢtırdıkları çalıĢmasında HbSS grubunda kolesterol düzeylerinin kontrole göre düĢük olduğu gözlenmiĢtir. OHA hastası olan Afrikalı ve Amerikalı eriĢkinlerde de serum total 54 99,100 kolesterol düzeylerinin düĢük olduğu tespit edilmiĢtir. ÇalıĢmamızda ise taĢıyıcı grubunda kontrol grubuna göre Total-K ve LDL-K düzeylerinin istatistiksel anlamlı derecede yüksek bulunduğu görüldü. Zorca ve ark.82 tek merkezli cohort çalıĢmasında yüksek trigliserit/ HDL ile endotel disfonksiyonu arasında anlamlı korelasyon iliĢkisi olduğunu açıklamıĢ ve yüksek trigliserit düzeyinin pulmoner hipertansiyon için risk faktörü anlamına geldiğini bildirmiĢler. Bu bakımdan, çalıĢmamızda heterozigotlarda kolesterol düzeyinde gözlenen yüksekliğin ileri araĢtırmalarla açıklığa kavuĢturulması gerekmektedir. 5.6. Kalp Hızı ve Basınçlar OHA hastalığı, genel kabul görmüĢ kanıya göre kalp atıĢlarında anemiye bağlı hızlanma ile giden bir durumdur. Bahl VK ve ark.101 çalıĢmasında ağır OHA hastaları bulunmasından dolayı kalp hızında önemli artıĢtan bahsedilmektedir. Oysa CSSCD (The Cooperative Study of Sickle Cell Disease) çalıĢmasında83 çok sayıda araĢtırma sonuçları analiz edildiğinde OHA hastalığında uç durumlar hariç ve istirahat halinde belirgin taĢikardi görülmediği, kronik hastalıkta ise kalp hızının normal değerlerden az farklandığı bildirilmektedir. ÇalıĢmamızda HbAS ve HbAA gruplarındaki kalp hızı değerleri arasındaki fark istatistiksel açıdan anlamlı bulunmadı. Arteriyel sertliğin majör belirleyicisi olan kan basıncının OHA hastalarında sağlıklı bireylere göre düĢük olduğu araĢtırmalarla gösterilmiĢtir.1,84 ÇalıĢmamızda hemodinamik parametreler karĢılaĢtırıldığında sistolik, diyastolik, ortalama ve nabız basınçları, basınç yükselme hızı, santral sistolik kan basıncı değerleri açısından gruplar arasındaki farklar anlamlı bulunmazken, taĢıyıcı grubunda aort basıncı (aoABmmHg) değeri kontrol grubundakine göre anlamlı derecede yüksekti. Asmar ve ark.53 normotensif ve hipertensif subgruplar içeren çalıĢmalarında NDH ile klinik ve biyokimyasal parametrelerin multiple regresyon analizini gerçekleĢtirmiĢ, NDH ile yaĢ ve sistolik basınç arasında pozitif ve bağımsız korelasyon iliĢkisi olduğunu tespit etmiĢler (r2=.47; P<.001). Çelik G ve ark.33 kronik hemodiyaliz hastalarında arteriyel sertliğin değerlendirilmesine yönelik araĢtırmalarında NDH ve AG ile OAB arasında pozitif iliĢki gözlenmiĢtir. ÇalıĢmamızda da NDH ile ortalama arteriyel basınç arasında pozitif korelasyon iliĢkisi mevcuttu. 55 5.7. Toplam AraĢtırma Gruplarında Arteriyel Sertlik NDH ve aortik artırma göstergesi, arteriyel sertliğin göstergeleri olup vasküler hasarın Ģiddetini belirlemede kullanılan invaziv olmayan yöntemlerdir. Hansen W ve ark.86 araĢtırma sonuçlarına dayanarak nabız dalga hızının klasik risk faktörlerinin yanında ve onlardan daha iyi bir Ģekilde kardiyovasküler olayları önceden iĢaret etme olanağı sağladığını belirtmiĢler. Blacher ve ark.74 nabız dalga hızının >13 m/s bulunmasının tek baĢına kardiovasküler mortalitenin güçlü belirteci olduğunu açıklamıĢlar. Bu çalıĢma aortik nabız dalga hızının aterosklerozla sıkı bağlantısı olduğunu ve hipertansiyon durumunda yüksek mortalite riskine iĢaret ettiğini göstermiĢtir. HbSS genotipli hastalarla ilgili bir araĢtırmada1 toplumun bütününde artan yaĢla yükselen aortik nabız dalga hızı bulguları gözlenmiĢtir. ÇalıĢmamızda hem toplumun bütününde, hem de HbAS grubu içinde NDHao ile yaĢ arasında istatistiksel olarak anlamlı pozitif korelasyon iliĢkisi bulundu. ÇalıĢma toplumunun bütününde, NDHao ile OAB arasında da istatistiksel olarak anlamlı pozitif korelasyon iliĢkisi vardı. HbSS vs 1 HbAA çalıĢmasında OAB ve hemoglobin S tüm araĢtırmaya dahil olan toplumun bütününde arteriyel sertliğin düĢük olmasının bağımsız belirleyicileri olarak ortaya konulurken çalıĢmamızda toplumun bütününde arteriyel sertliğin bağımsız belirleyicileri olarak OAB ve yaĢ ortaya çıktı. Bu durum, muhtemelen, HbSS homozigot hastalardakine kıyasla HbAS heterozigot taĢıyıcıların alyuvarlarında bulunan hemoglobin S miktarının daha az olmasına ve genç eriĢkin yaĢa bağlıdır. AraĢtırmamıza dahil olan tüm toplumda NDHao ile sistolik, diastolik kan basınçları, kalp hızı, potasyum, total kolesterol, Hb, AKġ, ÜRE ve kreatinin arasında korelasyon iliĢkisinin düzeyi istatistiksel olarak anlamlı bulunmazken, NDHao ile ağırlık, LDL-K arasında istatistiksel olarak anlamlı pozitif korelasyon iliĢkisi gözlendi. 5.8. HbAS Bireylerinde Arteriyel Sertlik 1 Prototip olarak ele aldığımız çalıĢmada HbSS genotipli bireylerde NDH, HbAA bireylerine göre oldukça düĢük bulunmuĢtur, bu da hemoglobin S ihtiva eden alyuvarlara bağlı olarak arteriyel ağaçta daha az sertlik olduğunun iĢareti olarak yorumlanmıĢtır. HbSS grubunda gözlenen azalmıĢ NDH, ortalama kan basıncının 56 düĢük olması ile açıklanırken bu iki parametre arasında paradoksal negatif korelasyon olduğu gösterilmiĢtir. ÇalıĢmamızda NDHao ve OAB açısından gruplar arasında anlamlı fark bulunmazken, HbAS grubu dahilinde NDHao ile OAB arasındaki korelasyonun pozitif olduğu gözlendi. NDHao ile OAB arasında korelasyon iliĢkisinin pozitif olması hemodinaminin fizyolojik ve fiziksel kurallarına uygundur. ÇalıĢmamızda periferik kan basınçları, ağırlık ve yaĢ açısından gruplar arasında anlamlı fark bulunmazken, NDHao ile bu parametreler arasında pozitif korelasyon iliĢkisi vardı. Dikkat çeken bulgulardan bir tanesi de aort basıncının, aortik artırma göstergesinin ve sistolik-diastolik fazlardaki nabız dalga hızları arasındaki farkın (NDHsdms) HbAS grubunda daha fazla oluĢudur. YaĢadıkları bölge, yaĢ, cinsiyet, kalp hızı, ağırlık, total kolesterol gibi arteriyel sertliği etkileyen faktörler açısından eĢdeğer olan iki grupta gözlenen değiĢikliklerin bu faktörlere atfedilemeyeceği, ancak taĢıyıcılarda bulunan S hemoglobine bağlı olabileceği açıktır. 5.9. Toplam AraĢtırma Gruplarında Aortik Nabız Dalga Yansıması 54 Artırma göstergesi nabız dalga yansımasının markeridir. Orak hücre anemili 1 hastalarla ilgili çalıĢmada grupların toplamında (HbSS+HbAA) artırma göstergesinin, yapılmıĢ bir dizi baĢka çalıĢmalarda da gösterildiğine benzer Ģekilde, yaĢ, düĢük ağırlık ve yüksek total kolesterol ile arttığı,26,44,62,73 yüksek kalp hızı ile düĢtüğü 60,64 bildirilmiĢtir. ÇalıĢmamızda aortik artırma göstergesi yaĢla pozitif korelasyon içerisinde iken, ağırlık ve total kolesterol ile değiĢmedi. “Stepwise multiple regresyon analizi”nde aortik artırma göstergesinin yüksek OAB‟le arttığı, artan kalp hızı ile azaldığı gözlendi. Böylece, bizim gözlemlerimiz, aortik artırma göstergesi ile kalp hızı arasında belirgin 60,64 negatif iliĢki gözlemlenen çalıĢmaların sonuçlarını desteklemektedir. Aortik artırma göstergesi arteriyel sertliğe, zamanlamaya ve arteriyel dalga yansımasının yerine bağlıdır.63,64,68 HbSS hastalarında düĢük aortik artırma göstergesinin, düĢük NDH‟yla ve dolayısıyla azalmıĢ arteriyel sertlikle iliĢkili olabileceği bildirilmiĢtir.1 57 5.10. HbAS Bireylerinde Aortik Nabız Dalga Yansıması Damar duvarı sertleĢmesi tespitinin sadece klinik durumlar için değil asemptomatik ve hiçbir Ģikayeti olmayan bireyler için de yararlı ve uygun olduğu bildirilmiĢtir.69,72,86 OHA ile ilgili yukarıda refere edilen çalıĢmada1 artırma göstergesi HbSS genotipli hastalarda sağlıklılara kıyasla düĢük bulunurken, bizim çalıĢmamızda HbAS grubunda nabız dalga yansımasının markeri olarak hem aortik, hem de brakiyel artırma göstergesi HbAA grubuna göre yüksek bulundu. Bu durumun, taĢıyıcılarda sol ventrikül duvarındaki kalınlaĢma ve aortun sistolik çapında artıĢ ile bağlantılı olduğu açıktır, fakat anemi saptanmaması zaman zaman hipohemoglobinemi epoizotları yaĢanmıĢ olabileceğini akla getirmektedir. Grup bazında değerlendirildiğinde HbAS grubunda aortik artırma göstergesi ile OAB arasında anlamlı pozitif korelasyon bulunurken, her iki grupta aortik artırma göstergesi ile Total-K, yaĢ, ağırlık, LDL-K, AKġ, kalp hızı ve ÜRE arasındaki korelasyon iliĢkisi istatistiksel olarak anlamlı bulunmadı. Artırma göstergesinin tek baĢına kardiyovasküler olayları önceden haber verebilme özelliği 69,71,72,87 göz önünde bulundurulursa heterozigot taĢıyıcılarda bu parametrenin yüksek bulunma nedeninin ileri araĢtırmalarla açıklığa kavuĢturulması gerekmektedir. 58 6. SONUÇ ve ÖNERĠLER Arteriyel sertliği yansıtan aortik nabız dalga hızı ve OAB açısından iki grup arasında anlamlı fark bulunmazken, aort nabız dalga yansımasını gösteren aortik artırma göstergesi (AGaortik) ve sistolik-diyastolik nabız dalga hızları farkı (NDHsdms) HbAS grubunda daha yüksek bulundu. ÇalıĢmamızda hem toplumun bütününde, hem de HbAS grubunda aort nabız dalga hızı (NDHao) ile OAB arasında pozitif korelasyon bulundu. Alınan sonuçlar, HbAS genotipli OHA taĢıyıcılarının alyuvarlarında bulunan hemoglobin S miktarının arteriyel sertliği etkilemediğini, nabız dalga yansımasını gösteren artırma göstergesini ise yükselttiğini göstermektedir. Bu sonuçlardan yola çıkılarak artırma göstergesi yüksek bulunan taĢıyıcıların kardiyolojik açıdan yakın takibe alınması önerilmektedir. 6.1.Sınırlamalar 1. ÇalıĢmamıza toplam 20 orak hücre anemisi taĢıyıcısı alınmıĢtır. Koroner arter hastaları, hipertansiyon, diyabet, renal yetersizlik ve HbSS orak hücre anemisi hastalarında arteriyel sertliğin prognostik öneminin değerlendirildiği çalıĢmalar vardır. ÇalıĢmamız orak hücre anemisi taĢıyıcılarında prognozun değerlendirildiği çalıĢmadır. Bu yüzden orak hücre anemisi taĢıyıcılarında arteriyel sertliğin prognostik öneminin değerlendirildiği, vaka sayısının daha fazla olduğu çalıĢmalara gereksinim vardır. 2. ÇalıĢmamızda orak hücre anemisi taĢıyıcıları arasında 1 aylık takip sürecinde taĢıyıcı ve sağlam bireyler karĢılaĢtırılarak değerlendirme yapılmıĢtır, Daha fazla takip süresinin değerlendirilmeye alındığı çalıĢmalara gereksinim vardır. 3. ÇalıĢmamızda prognoz tayini için klinik, kiĢisel özellik, rutin biyokimyasal ve ekokardiyografik değiĢkenler değerlendirilmiĢtir. Ancak arteriyel sertliğin prognostik öneminin tespiti için diğer değiĢkenlerin de kullanıldığı çalıĢmalara gereksinim vardır. 4. ÇalıĢmamıza alınan hastalar genç eriĢkin hastalardı. Daha yaĢlı hastaların değerlendirilmesi ve orak hücre anemisi taĢıyıcılarının yaĢla artan sorunlarının arteriyel sertlik üzerine olan etkileri değerlendirilememiĢtir. 5.Aritmi, anemi hastalarında kardiyak atım hacmini kötü yönde etkiler. Aritmili hastalarda, arteryograf ile optimal değerlendirme yapılamadığı için çalıĢmamızda aritminin prognoz ve nabız basıncı ile iliĢkisi değerlendirilmemiĢtir. Bu nedenle 59 elektrokardiyografi, Holter elektrokardiyografi ve elektrofizyolojik testlerle bu grup hastaların belirlenmesi, arteriyel sertlik ve prognoz ile iliĢkisinin değerlendirildiği çalıĢmalara gereksinim vardır. 6. ÇalıĢmamızda toplam izlem süresi ortalama bir ay olup izlem süresinin daha uzun olması ile bağımsız prognostik belirleyicilerinin daha nesnel olarak değerlendirilmesi mümkün olabilirdi. 6.2. Öneriler 1. Toplam araĢtırma gruplarında artırma göstergesi ile NDH ve yaĢ arasında pozitif korelasyon olduğu saptandı. 2. HbAS (taĢıyıcı) grubunda aortik artırma göstergesi ile NDH ve OAB arasında pozitif, aortik artırma göstergesi ile potasyum arasında ise negatif korelasyon olduğu saptandı. Potasyumun daha yüksek olduğu HbAS grubunda, aortik artırma göstergesi değerlerinin de daha yüksek olması yanında aortik artırma göstergesi ile potasyum arasında negatif korelasyon saptanması yoruma açık durum olup ileri araĢtırmalara konu olabilir. 3. Toplam araĢtırma gruplarında NDH ile OAB, yaĢ, ağırlık ve LDL-K arasında pozitif korelasyon saptandı. 4. TaĢıyıcı grubunda NDH ile OAB, yaĢ, ağırlık ve SKB arasında pozitif korelasyon saptandı. 5. ÇalıĢmamızda OAB ve kalp hızının aortik artırma göstergesi için, OAB ve yaĢın NDHao için bağımsız belirleyiciler olduğu bulundu. 6. ÇalıĢmamızdaki major bulgu arteriyel sertliği yansıtan NDHao ve OAB açısından iki grup arasında anlamlı fark bulunmazken, aortik artırma göstergesi ile ifade olunmuĢ aort nabız dalga yansımasının, aortik basınçla (aoAPms) ifade olunmuĢ santral basıncın ve sistolik-diyastolik nabız dalga hızları farkının HbAS grubunda daha yüksek bulunmasıdır. ÇalıĢmamızda hem toplam araĢtırma gruplarında, hem de HbAS genotipli taĢıyıcı grubunda NDHao ile OAB arasında pozitif korelasyon bulundu (p=0,000 ve p= 0,002). 7. OHA taĢıyıcılarında anemi saptanmamıĢ olup sol ventrikül duvarındaki kalınlaĢma ve aortun sistolik çapında tespit edilen artıĢ bu bireylerin yukarıda belirtilen hematolojik verileri ile açıklanamamaktadır. 60 8. Arteriograf ile arteriyel sertliğin ve nabız dalga hızının incelenmesi sonucunda kardiyovasküler hastalığın klinik belirtileri bulunmayan orak hücre anemisi taĢıyıcıları arasından ileride kalp-damar sisteminde patolojik değiĢiklik beklenen bireyler ortaya konularak kardiyovasküler hastalığın erken tespitinin, takiplerinin ve medikal tedavilerinin düzenlenmesinin mümkün olacagı kanısına varılmıĢtır. 61 7. KAYNAKLAR 1. Lemogoum D, Bortel LV, Najem B, Dzudie A, Teutcha C, Madu E; Leeman M; Degaute JP, Borne P. Arterial Stiffness and Wave Reflections in Patients With Sickle Cell Disease. Hypertension. 2004;44:924 2. Richard A. Clinical Biochemistry of Hemoglobinhopaties. Lippincots Illustrated Reviews 2000; 5: 2540. 3. Harris J.W. Studies On The Destruction Of Red Blood Cells. X. The Biophysics And Biology Of Sickle Cell Disease. Arch. Intern. Med., 1996; 97:145. 4. Mary EE. Hereditery Hemolytic Anemias. In: Tintinalli JE, Kelen GD, Stapczynski JS Eds. Emergency Medicine, A Comprehensive Stuy Guide. 5Ed, North Carolina: McGraw Hill Companies Inc, 2000: 1382-1387. 5. Wang W, Lukens JN. Sickle cell anemia and other sickling syndromes. In: Lee RG, Foerster J, Lukens J, Paraskevas F, Greer JP, Rodgers GM, Eds. Wintrobe‟s Clinical Hematology. 10 Ed, Middle East Edition, Baltimore: Williams and Wilkins Company, 1999: 1347-1397. 6. Poyart C, Wajcman H. Hemolytic anemias due to hemoglobinopathies. Mol Aspects Med, 1996; 17(2:129-42) 7. Aksoy M, Lekin E W, Maurant AE, Lehman H. Blood groups hemoglobins and thalasemia in Soutern Turkey and Eti Turks. Brit, Med. J, 1958;2:937 8. Arcasoy A, Canatan D. Dünyada ve Türkiye‟de talasemi ve hemoglobinopatiler. Ulusal Hemoglobinopati Konseyi-Sağlık Bakanlığı, 2. Baskı. Antalya-Türkiye,2003:11-19 9. Canatan D, Kose MR, Ustundağ M, Haznedaroğlu D, Ozbas S. Hemoglobinopathy Control Program in Turkey. Community Genet, 2006;9:124-126. 10. Embury SH. Sickle cell anemia and associated hemoglobinopathies. In: Goldman L, Bennett JC, Eds. Cecil Textbook of Medicine. 21Edition, Philadelphia: WB Sounders Company, 2000: 893-905. 11. Canatan D. Orak Hücre Anemisi. XXX. Ulusal Hematoloji Kongresi, 7. Mezuniyet Sonrası Eğitim Kursu. Ġstanbul-Türkiye, 2003: 93-99. 12. Tüzmen ġ, Scheter A N. Genetic Diseases of Hemoglobin: Diagnostic methods for elucidating Sickle Cell Mutations, Blood Reviews 2001; 15, 19-25. 13. Müftüoğlu E, Kadiroğlu AK, Kara ĠH. Güncel Tibbi Tanı &Tedavi 49. baskı. LANCE 2010, Adana. 62 14. Nagel RL. The paradox of hemoglobin SCdisease. Blood Rev. 2003, Sep;17(3):16778(PMID:128182227) 15. Stapcynski JS, Martin GA. Hematologic Emergencies. In: Stone CK, Humphries RL Eds. Current Emergency&Treatment. 5th Ed, USA: McGraw Hill Companies Inc, 2004: 788-823. 16. Beutler E. Disorders of Hemoglobin. In: Fauci AS, Braunwald E, Isselbacher KJ, Wilson JD, Martin JB, Kasper DL, Hauser SL, Longo DL, Eds. Harrison‟s principles of Internal Medicine. 14 th Ed, vol USA: McGraw Hill Companies Inc, 1998: 645-653 17. Okpala I Needleman JP, Benjamin LJ, Sykes JA, Aldrich TK. Breathing Patterns During Vasoocclusive Crisis of Sickle Cell Disease. Chest, 2002; 122:43-46. 18. Okpala I, Tawil A. Management of pain in sickle cell disease. Journal of the Royal Society of Medicine, 2002; 95: 456-58. 19. Yale SH, Nagib N, Guthrie T. Approach to the vaso-occlusive crisis in adults with sickle cell disease. Am Fam Physician, 2000; 61: 1349-56,1363-4. 20. Ġsfendiyar C, DerviĢ O. Kardiyoloji: Antıp yayınları; 2002 21.Caro CG, Pedley TJ, Schroter RC, Seed WA. The Mechanics of the Circulation.New York, Oxford University Press,1978, pp243-349. 22. Safar ME, Levy BI, Struijker-Boudier H. Current perspectives on arteriel stiffness and pulse pressure in hypertension and cardiovascular diseases. Circulation 2003;107:2864-2869. 23. Chae CU, Pfeffer MA, Glynn RJ, Mitchell GF, Taylor JO, Hennekens CH. Increased pulse pressure and risk of heart failure in the elderly. JAMA 281:634–639; 1999. 24. Franklin SS, Larson MG, Khan SA, Wong ND, Kannel WB, Levy D. Does the relation of blood pressure to coronary heart disease risk change with aging? The Framingham Heart Study. Circulation 103:1245–1249; 2001. 25. Mitchell GF, Pfeffer MA, Braunwald E, Rouleau J-L, Bernstein V, Geltman EM, Flaker GC. Sphygmomanometrically determined pulse pressure is a powerful independent predictor of recurrent events after myocardial infarction in patients with impaired left ventricular function. Circulation 96: 42544260;1997. 26. Vaccarino V, Berger A, Abramson J, Black H, Setaro J, Davey J, Krumholz H. Pulse pressure and risk of cardiovascular events in the systolic hypertension in the elderly program. Am J Cardiol 88: 980–986; 2001. 63 27. Kostis J, Lawrence-Nelson J, Ranjan R, Wilson A, Kostis W, Lacy C. Association of increased pulse pressure with the development of heart failure in SHEP. Systolic Hypertension in the Elderly (SHEP) Cooperative Research 28. J, Guerin AP, Pannier B, Marchais SJ, Safar ME, London GM. Impact of aortic stiffness on survival in end-stage renal disease. Circulation 99: 2434 –2439; 1999. 29. Forette F, Seux ML, Staessen JA, Thijs L, Birkenhager WH, Babarskiene MR, Babeanu S, Bossini A, Gil-Extremera B, Girerd X, Laks T, Lilov E, Moisseyev V, Tuomilehto J, Vanhanen H, Webster J. Prevention of dementia in randomised double-blind placebo- controlled Systolic Hypertension in Europe (Syst-Eur) trial. Lancet 352:1347–1351; 1998. 30. Benetos A, Safar M, Rudnichi A, Smulyan H, Richard, J-L, Ducimetie`re P, Guize L. Pulse pressure: a predictor of long-term cardiovascular mortality in a french male population. Hypertension 30: 1410 –1415; 1997. 31. Galis ZS, Khatri JJ. Matrix metalloproteinases in vascular remodeling and atherogenesis: Circ Res 90: 251–262; 2002;47. 32. Blacher J, Guerin AP, Pannier B, Marchais SJ, Safar ME, London GM. Impact of aortic stiffness on survival in end-stage renal disease. Circulation 99: 2434 –2439; 1999. 33. Çelik G, Tumuklu M, BaĢcı A, Ok E. Kronik hemodiyaliz hastalarında arteriyel sertliğin değerlendirilmesi ve iliĢkili risk faktörleri. Selçuk tıp dergisi. 2009;25(3):150-7. 34. Lakatta EG. Arterial and cardiac aging: major shareholders in cardiovascular disease enterprises: Part III: cellular and molecular clues to heart and arterial aging. Circulation 2003;107:490–497. 35. LiZ, Froehlich J, Galis ZS. Increased expression of matrix metalloproteinase–2 in the thickened intima of aged rats. Hypertension 33: 116; 1999. 36. Avolio A, Jones D, Tafazzoli-Shadpour M. Quantification of alterations in structure and function of elastin in the arterial media. Hypertension 32: 170 – 175;1998. 37. Verzijl N, DeGroot J, Thorpe SR, Bank RA, Shaw JN, Lyons TJ, Bijlsma JW, Lafeber FP, Baynes JW, TeKoppele JM. Effect of collagen turnover on the accumulation of advanced glycation end products. J Biol Chem 275:39027–52 39031; 2000. 38. Rojas A, Romay S, Gonzalez D, Herrera B, Delgado R, Otero K. Regulation of endothelial nitric oxide synthase expression by albuminderived advanced glycosylation end products. Circ Res 86: E50– E54; 2000. 39. Kuzuya M, Asai T, Kanda S, Maeda K, Cheng XW. Glycation cross- links inhibit matrix metalloproteinase-2 activation in vascular smooth muscle cells cultured on collagen l attice. Diabetologia 44: 433– 436; 2001. 64 40. Wendt T, Bucciarelli L, Qu W, Lu Y, Yan SF, Stern DM, Schmidt AM. Receptor for Advanced Glycation Endproducts (RAGE) and Vascular Inflammation: Insight into the Pathogenesis of Macrovascular Complications in Diabetes. Curr Atheroscler Rep 4: 228 –237; 2002. 41. Schmidt AM, Stern D. Atherosclerosis and diabetes: the RAGE connection. Curr Atheroscler Rep 2: 430-436; 2000. 42. Miyazaki H, Matsuoka H, Cooke JP, Usui M, Ueda S, Okuda S, Imaizumi T. Endogenous nitric oxide synthase inhibitor: a novel marker of atherosclerosis. Circulation 99: 1141–1146; 1999. 43.Taddei S, Virdis A, Ghiadoni L, Salvetti G, Bernini G, Magagna A, Salvetti A. Age-related reduction of NO availability and oxidative stres in humans. Hypertension 38: 274 –279; 2001. 44. Giannattasio C, Mangoni AA, Failla M, Carugo S, Stella ML, Stefanoni P, Grassi G, Vergani C, Mancia G. Impaired radial artery compliance in normotensive subjects with familial hypercholesterolemia. Atherosclerosis 124:249 –260; 1996. 45. Lyons D, Roy S, Patel M, Benjamin N, Swift CG. Impaired nitric oxidemediated vasodilatation and total body nitric oxide production in healthy old age. Clin Sci (Lond) 93: 519 –525; 1997. 46. Najjar SS, Scuteri A, Lakatta EG. Arterial aging: is it an immutable cardiovascular risc factor? Hypertension 2005;46:454-462. 47. Lakatta EG, Levy D. Arterial and cardiac aging: major shareholders in cardiovascular disease enterprises.I. Aging arteries: a set up for vascular disease. Circulation 2003;107:139-146. 48. Libby P. Ġnflammation in atherosclerosis. Nature 2002;420:868-874. 49. Yasmin MC, Wallace S, Mackenzie IS. C-reactive protein is associated with arterial stiffness in apparently healthy individuals. ArterioscleThromb Vasc Biol 2004;24:969-974. 50. Duprez DA. Relationship between CRP and arterial stiffness in an asymptomatic population. J Hum Hypertens 2005;19:515-519. 51. Booth A. Inflammation and arterial stiffness in systemic vasculitis. Arthritis Rheum 2004;50:581588. 52. Cohn JN, Finkelstein S, McVeigh H. Non-invasive pulse wave analysis for the early detection of vascular disease. Hypertension 1995;26:503-508. 53. Asmar R, Benetos A, Topouchian J, Laurent P, Pannier B, Brisac A-M, Target R, Levy BI. Assessment of Arterial Distensibility by Automatic Pulse Wave Velocity Measurement. Hypertension. 1995;26:485-490 65 54. Asmar R. Pulse Wave velocity. Principles and measurment. In: Asmar R, editor. Arterial Stiffness and Pulse Wave Velocity, Clinical Applications. Paris: Elsevier; 1999. p. 17-19 and p.25-53. 55. Levy D, DeStefano AL, Larson MG, O’Donnell CJ, Lifton RP, Gavra H, Cupples LA, Myers RH. Evidence for a gene influencing blood pressure on chromosome 17. Genome scan linkage results for longitudinal blood pressure phenotypes in subjects from the Framingham heart study. Hypertension 2000;36:477– 483. 56. Lajemi M, Gautier S, Poirier O, Baguet JP, Mimran A, Gosse P, Hanon O, LabatC, Cambien F, Benetos A. Endothelin gene variants and aortic and cardiac structure in never-treated hypertensives. Am J Hypertens 14: 755–760; 2001.54 57. Brull DJ, Murray LJ, Boreham CA, Ralston SH, Montgomery HE, Gallagher AM,McGuigan FE, Davey SG, Savage M, Humphries SE, Young IS. Effect of a COL1A1 Sp1 binding site polymorphism on arterial pulse wave velocity: an index of compliance. Hypertension 38: 444–448; 2001. 58. Schut AF, Janssen JA, Deinum J, Vergeer JM, Hofman A, Lamberts SW, Oostra BA, Pols HA, Witteman JC, van Duijn CM. Polymorphism in the promoter region of the insulin-like growth factor I gene is related to carotid intima-media thickness and aortic pulse wave velocity in subjects with hypertension. Stroke 34: 1623–1627; 2003. 59. Wilkinson IB, MacCallum H, Hupperetz PC. Changes in the derived central pressure waveform and pulse ressure in response to angiotensin II and noradrenaline in man. J Physiol 2001;530:541–550. 60. Wilkinson IB, Mohamad NH, Tyrrell S. Heart rate dependency of pulse pressure amplification and arteryel stiffness. Am J Hypertens 2002;15:24–30. 61. Fei D-Y, Ross A, Arrowood JA, Kraft KA. Relationship between arterial stiffness and heart rate recovery in apparently healthy adults. Vascular Health Risk Management. 2005;1:85-89 62. Kelly R, Hayward C, Avolio A. Non-invasive determination of age- related changes in the human arteryel pulse. Circulation 1989;80:1652- 1659 63. Pannier B, Guerin AP, Marchais SJ. Stiffness of capacitive and conduit arteries: prognostic significance for end-stage renal disease patients. Hypertension 2005;45:592–596. 64. Millis CJ, Gabe IT, Gault JH. Pressure-flow relationships and vascular impedance in man. Cardiovascular Research, 4:405-417,1970. 65. X O’Rourke MR, Brunner HR. Introduction to arterial compliance and function. J.Hypertens. Suppl., 1992;10,53-55 66. Syeda B, Wolf MG, Denk S, Pichler P. Arterial compliance: A diagnostic marker for atherosclerotic plaque burden? AJH. 2003; 16: 356-362 66 67. Vlachopoulos C, Aznaouridis K, Stefanadis C. Clinical appraisal of arterial stiffness: the Argonautsin front of the Golden Fleece. Heart 2006;92:1544–1550 68. Papageorgiou GL and Jones NB. Wave reflection and hydraulic impedance in the healthy arterial system: a controversial subject. Medical and Biological Engineering and Computing 1988, 26: 237242 69. Scuteri A, Brancati AM, Gianni W. Arteryel stiffness is an independent risk factor for impairment in the elderly: a pilot study. J Hypertens 2005;23:1211–1216 cognitive 70. Sonesson B, Hansen F, Stale H. Compliance and diameter in the human abdominal aorta - the influence of age and sex. Eur J Vasc Surg. 1993; 7: 690-697. 71. Weber T, Auer J, O’Rourke MF. Arteryel stiffness, wave reflections, and the risk of coronary artery disease. Circulation 2004;109:184–9. 72. Nurnberger J, Keflioglu-Scheiber A, Opazo Saez AM. Augmentation index is associated with cardiovascular risk. J Hypertens 2002;20:2407–2414 73. Mitchell GF, Parise H, Benjamin EJ. Changes in arterial stiffness and wave reflection with advancing age in healthy men and women: the Framingham Heart Study. Hypertension. 2004;43:1239–1245. 74. Blacher J, Asmar R, Djane S. Aortic pulse wave velocity as a marker of cardiovascular risk in hypertensive patients. Hypertension 1999;33:1111–7. 75. Nichols WW, O’Rourke MF. McDonald‟s blood flow in arteries, 4th ed. London: Edward Arnold, 1998, 170–222, 284–315, 347–95, 450–76. 76. Gadrin JM, McClellandR, Kitzman D. M-mode echocardiographic predictors of six- to seven-year incidence of coronary heart disease, stroke, congestive heart failure, and mortality in an elderly cohort (the Cardiovascular Heart Study). American Journal of Cardiology, 87:1051-1057,2001. 77. Çetin E, Özkan M. Klinik Ekokardiyografi ve Diger Görüntüleme Yöntemleri. Ankara. I. Baskı 2007;19-29 78. Feigenbaum H., Armstrong W. F, RyanT. Echocardiography, Philadelphia; 2005 79. GarsiaM.J., Rodriguez L, Ares M. Miyocardial wall velocity assesment by pulset Doppler tissue imaging: Gharacteristik findings in normal subjects. Am Heart J 1996;132;648 80. Oğuzhan A, Abacı A, Çetin S. Doku Doppler Ekokardiyografi. 2000;2:35 81. Price DJA, Wallbridje DR, Stewart MJ. Tissue Doppler imaging: current and potential clinical applications. Heart 2000;84:11-18 67 82. Zorca S, Freeman L, Hildesheim M, Allen D, Remaley AT, Taylor JG, Kato GJ. Lipid levels in sickle-cell disease associated with haemolytic severity, vascular dysfunction and pulmonary hypertension. Br J Haematol. 2010 May;149(3):436-45 83. Hellenbrand, Sanford L, Norman Talner W C, Mark E, Dianne G. WilliamThe Heart in Sickle Cell Anemia: The Cooperative Study of Sickle Cell Disease (CSSCD) Chest 1995;108;1214-1219 84. Pegelow CH, Colangelo L, Steinberg M, Wright EC, Smith J, Phillips G, Vichinsky E. Natural History of Blood Pressure in Sickle Cell Disease: Risks for Stroke and Death Associated with Relative Hypertension in Sickle Cell Anemia. Am J Med. 1997, 102(2):171-177 85. Hatch FE, Crowe LR, Miles DE, Young JP, Portner ME. Altered vascular reactivity in sickle hemoglobinopathy. A possible protective factor from hypertension. Am J Hypertens. 1989 Jan;2(1):28. 86. Hansen W, Staessen JA, Tolp-Petersen C. Prognostic value of aortic pulse wave velocity as index of arterial stiffness in the general population. Circulation, 2006, 113, 663-664 87. Simon A, Chironi G, Levenson J. Performance of subclinical arterial disease detection as a screening test for coronary heart disease. J Hypertension, 2006, 48:392-6 88. Nichols W, Singh B. Augmentation index as a measure of peripheral vascular disease. State Current Opinion in Cardiology:2002; 17,543-551 89. Mancia G. ESH/ESC Guidelines for the Management of Arteryel Hypertension – The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J Hypertension 2007,25:1105-1187 90. Laurent S; Boutouyrie P; Asmar R. Aortic Stiffness Is an Independent Predictor of All-Cause and Cardiovascular Mortality in Hypertensive Patients. Hypertension. 2001;37:1236-1241 91. Taylor JGt, Nolan VG, Mendelsohn L, Kato GJ, Gladwin MT, Steinberg MH. Chronic hyperhemolysis in sickle cell anemia: association of vascular complications and mortality with less frequent vasoocclusive pain. PLoS ONE 2008;3:e2095. 92. Worldwide prevalence of anaemia 1993–2005. Geneva: World Health Organization. 2008. ISBN 9789241596657. 93. Estrade G, Poitrineau O, Bernasconi F, Garnier D, Donatien Y. Left ventricule function and sickle-cell anemia. Echocardiographic study. Arch Mal Coeur Vaiss. 1989 Dec;82(12):1975-81. 94. Naoman SG, Nouraie M, Castro OL, Nwokolo C, Fadojutimi-Akinsiku M, Diaz S, WillieCarnegie G, Andrews N, Gordeuk VR. Echocardiographic findings in patients with sickle cell disease. Ann Hematol. 2009 Jun 2.(Epubl) 68 95. Ataga KI, Sood N, Guy De Gent, Kelly E, Henderson AG, Jones S, Strayhorn D, Lail A, Lieff S, Orringer EP. Pulmonary hypertension in sickle cell disease Am J Medicine 2004,Volume 117, Issue 9, Pages 665-669 96. Cheung YF, Chan GCF, Ha SY. Arterial Stiffness and Endothelial Function in Patients With ßThalassemia Major. Circulation. 2002;106:2561-2566 97. Agoreyo FO, Nwanze N. Plasma sodium and potassium changes in sickle cell patients International Journal of Genetics and Molecular Biology, 2010;Vol. 2 (2), pp. 014-019 98. El-Hazmi MAF, Jabbar FA, Warsy AS. Cholesterol and triglyseride level in patients with sickle cell anaemia. Scandinavian Journal of Clinical & Laboratory Investigation 1987, 47: 351-354 99. Shores J, Peterson J, VanderJagt D, Glew RH. Reduced cholesterol levels in African-American adults with sickle cell disease. J Natl Med Assoc. 2003 September; 95(9): 813–817 100. Ferrier KE, Muhlmann MH, Baguet J-P, Cameron JD, Jennings GL, Dart AM, Kingwell BA. Intensive cholesterol reduction lowers blood pressure and large artery stiffness in isolated systolic hypertension. J Am College of Cardiology 2002; 39:1020-1025 101. Bahl VK, Malhotra OP, Kumar D. Non-invasive assessment of systolic and diastolic left ventricular function in patients with chronic severe anemia: a combined M-mode, two dimensional and Doppler echocardiographic study. Am Heart J 1992; 124:1516-1523 69 8. ÖZGEÇMĠġ Ad: Tünzale Soyad: BAYRAMOĞLU Doğum Yeri: Azerbaycan Doğum Tarihi: 02.05.1954 Görev Yeri: Çukurova Üniversitesi Tıp Fak. Kardiyoloji A.D. Yabancı Dil: Ġngilizce, Rusca. E-Posta Adresi dr.tunzaleb@yahoo.com Tarih Eğitim 1980 Azerbaycan Tıp Üniversitesi‟nden mezun oldum. 1981 Ġç hastalıkları üzerine intörnlüğümü tamamladım 1985-1989 1990-1995 1995 1998-2003 2003 2008 Moskova M. Ġ. Seçenov Tıp Akademisi‟nde Kardiyoloji ihtisası yaptım Azerbaycan Cumhuriyeti TeĢhis Merkezi‟nde kardiyoloji uzmanı Ankara‟da, Türkiye Yüksek Ġhtisas Hastanesi Kardiyoloji Kliniği Harran Üniversitesi Tıp Fakültesi Kardiyoloji AD Mustafa Kemal Üniversitesi Tıp Fakültesi Kardiyoloji AD Diploma denkliğimi aldım. Türkiye ve Azerbaycan Ulusal Kardiyoloji Dernekleri üyesiyim Makale ve kongre bildirileri yayınlanmıĢ çalıĢmalarım vardır. 70 olmak üzere