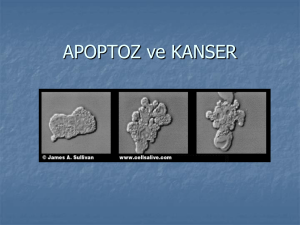
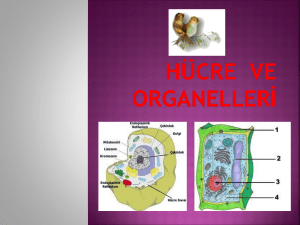
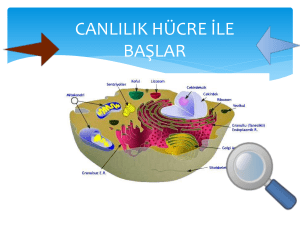
tc istanbul üniversitesi sağlık bilimleri enstitüsü danışman doç.dr
advertisement

T.C. ĐSTANBUL ÜNĐVERSĐTESĐ SAĞLIK BĐLĐMLERĐ ENSTĐTÜSÜ ( YÜKSEK LĐSANS TEZĐ ) K562 HÜCRELERĐNDE DOKSORUBĐSĐNE KARŞI GELĐŞEN DĐRENCE NĐTRĐK OKSĐTĐN ETKĐSĐ SĐBEL ÜLKÜ DANIŞMAN DOÇ.DR. LEMAN YALÇINTEPE GÜNEŞTUTAR BĐYOFĐZĐK ANABĐLĐM DALI BĐYOFĐZĐK PROGRAMI ĐSTANBUL-2014 ii TEZ ONAYI iii BEYAN Bu tez çalışmasının kendi çalışmam olduğunu, tezin planlanmasından yazımına kadar bütün safhalarda etik dışı davranışımın olmadığını, bu tezdeki bütün bilgileri akademik ve etik kurallar içinde elde ettiğimi, bu tez çalışmayla elde edilmeyen bütün bilgi ve yorumlara kaynak gösterdiğimi ve bu kaynakları da kaynaklar listesine aldığımı, yine bu tezin çalışılması ve yazımı sırasında patent ve telif haklarını ihlal edici bir davranışımın olmadığı beyan ederim. iv ĐTHAF Sevgili eşime, değerli aileme ve tüm dostlarıma ithaf ediyorum. v TEŞEKKÜR Bu tez çalışmasının yürütülmesinde mesleki bilgi ve birikimleri ile sonsuz desteğini esirgemeyen ve beni aydınlatan Biyofizik Anabilim Dalı öğretim üyelerinden başta tez danışmanım Sayın Doç. Dr. Leman Yalçıntepe Güneştutar‘a ve yüksek lisans eğitimim boyunca beni destekleyen Đstanbul Tıp Fakültesi Biyofizik Anabilim Dalı başkanı Sayın Prof. Dr. Rüstem Nurten’e teşekkürlerimi sunarım. Bu süreçte birlikte olmaktan büyük mutluluk duyduğum tüm Biyofizik Anabilim Dalı çalışanlarına ve Đstanbul Üniversitesi DETAE Đmmunoloji A.D. Akım Sitometri Laboratuarından Sayın Abdullah Yılmaz’a teşekkür ederim. Bu çalışma, Đstanbul Üniversitesi Bilimsel Araştırma Projeleri Birimi tarafından desteklenmiştir. Proje No:31613 vi ĐÇĐNDEKĐLER TEZ ONAYI .................................................................................................................... ĐĐ BEYAN........................................................................................................................... ĐĐĐ ĐTHAF.............................................................................................................................ĐV TEŞEKKÜR..................................................................................................................... V ĐÇĐNDEKĐLER ...............................................................................................................VĐ 1. TABLOLAR LĐSTESĐ................................................................................................ĐX ŞEKĐLLER LĐSTESĐ ....................................................................................................... X SEMBOLLER / KISALTMALAR LĐSTESĐ .................................................................XĐ ÖZET ............................................................................................................................ XĐĐ ABSTRACT................................................................................................................. XĐĐĐ 1.GĐRĐŞ VE AMAÇ.......................................................................................................... 1 2. GENEL BĐLGĐLER ...................................................................................................... 3 2.1. Kanser ........................................................................................................................ 3 2.2. Kanser Hücre Bölünmesi ........................................................................................... 4 2.3. Hücre Siklusu ve Kanser............................................................................................ 4 2.4. Apoptoz...................................................................................................................... 6 2.4.1. Apoptoz Mekanizması ............................................................................................ 7 2.5. Antikanser Đlaçların Sınıflandırılması........................................................................ 8 2.5.1. Alkilleyici Ajanlar .................................................................................................. 8 2.5.2. Antimetabolitler ...................................................................................................... 8 2.5.3. Bitkisel Alkaloidler ................................................................................................. 9 2.5.4. Hormonlar ve Hormon Antagonistleri .................................................................... 9 2.5.5. Sitotoksik Antibiyotikler......................................................................................... 9 2.5.6. Topoizomeraz Đnhibitörleri ................................................................................... 10 2.5.7. Protein Kinaz Đnhibitörleri .................................................................................... 11 2.5.8. Diğer bileşikler ..................................................................................................... 11 2.6. Antikanser Đlaçların etki Mekanizmaları…………………………………………..11 2.7. Kanser Hücresinin Geliştirdiği Direnç Mekanizmaları ........................................... 12 2.7.1. P-glikoprotein (P-gp, ABCB1) ............................................................................. 15 2.8. Nitrik Oksit (Endotel Kaynaklı Gevşetici Faktör) ................................................... 18 vii 2.8.1. Nitrik Oksitin Etki Mekanizması .......................................................................... 21 2.8.2. Nitrik Oksit ve Kanser .......................................................................................... 22 3. GEREÇ VE YÖNTEM ............................................................................................... 24 3.1. GEREÇLER............................................................................................................. 24 3.1.1. Çalışmada Kullanılan Kimyasal Maddeler ........................................................... 24 3.1.2. Çalışmada Kullanılan Kitler ................................................................................. 24 3.1.3. Çalışmada Kullanılan Cihazlar ............................................................................. 24 3.1.4. Çalışmada Kullanılan Çözeltiler ........................................................................... 25 3.2. YÖNTEMLER ......................................................................................................... 26 3.2.1. Hücre Kültür Çalışmaları ...................................................................................... 26 3.2.2. Hücrelerin Dondurulması ve Çözülmesi............................................................... 26 3.2.3. Sitotoksisite deneyi ............................................................................................... 26 3.2.4. Hücrelerin Doksorubisin ile Muamele Edilmesi .................................................. 27 3.2.5. K562S ve K562D Hücrelerin Antikorlar ile Boyanması ...................................... 27 3.2.6. K562S ve K562D Hücrelerinde Rho123 Alımı ve Tutumunun Floresan Mikroskop ile Görüntülenmesi ................................................................................... 28 3.2.7. K562S ve K562D Hücrelerinde Rho123 Alımı ve Tutumunun Spektroflorimetre ile Belirlenmesi ............................................................................................................... 28 3.2.8. K562S ve K562D Hücrelerinde Rho123 Alımı ve Tutumunun Akım Sitometre ile Belirlenmesi .................................................................................................................... 28 3.2.9. K562S ve K562D Hücrelerinde Doksorubusin Varlığında Apoptoz.................... 28 3.2.10. K562S ve K562D Hücrelerinde NO Vericisi (SNAP) Varlığında Apoptoz..... 29 4. BULGULAR............................................................................................................... 30 4.1. Doksorubisinin Doz Bağımlı Sitotoksik Etkisi........................................................ 30 4.2. K562D Hücrelerinin Verapamil Varlığında ve Yokluğunda Rho123 …………….31 ile Boyanması ................................................................................................................. 31 4.3. K562S ve K562D Hücrelerin P-GP, CD38, CD34 ve MRP-1 Yüzey Belirteçleri .. 33 ile Boyanması ................................................................................................................. 33 4.4. K562S ve K562D Hücrelerin P-gp, CD38, CD34 ve MRP-1 Yüzey Belirteçleri ... 35 ile Karşılaştırılmalı Boyanması ...................................................................................... 35 4.5. K562D Hücrelerinde Rho123 Alımı ve Tutumunun Spektroflorimetre ile ............. 36 Belirlenmesi .................................................................................................................... 36 4.6. K562D Hücrelerinde Rho123 Alımı ve Tutumunun Akım Sitometresi ile ............. 37 viii Belirlenmesi .................................................................................................................... 37 4.7. K562S Hücrelerinde Rho123 Alımı ve Tutumunun Akım Sitometresi ile.............. 38 Belirlenmesi .................................................................................................................... 38 4.8. K562S ve K562D Hücrelerinin NO Varlığında Apoptoz Analizleri ....................... 39 4.9. K562D Hücrelerinin NO, Doksorusin ve Verapamil Varlığında Akım .................. 40 Sitometre ile Apoptoz Analizleri .................................................................................... 40 4.10. K562S Hücrelerinin NO Varlığında Akım Sitometre ile Apoptoz Analizleri ...... 41 5. TARTIŞMA ................................................................................................................ 42 KAYNAKLAR ............................................................................................................... 46 ÖZGEÇMĐŞ .................................................................................................................... 52 ix 1. TABLOLAR LĐSTESĐ TABLO 2-1. NO SENTEZLEYEN ENZĐM ĐZOFORMLARI . .................................... 20 TABLO 3-2. DOKSORUBĐSĐNE KARŞI DĐRENCĐN GELĐŞTĐĞĐ DOZ DEĞERLERĐ ........................................................................................................................................ 27 x ŞEKĐLLER LĐSTESĐ ŞEKĐL 2-1. DOKSORUBĐSĐNĐN MOLEKÜLER YAPISI. .......................................... 10 ŞEKĐL 2-2. ĐLAÇ DĐRENÇ MEKANĐZMALARININ BAZILARI.............................. 13 ŞEKĐL 2-3. ĐLAÇ DĐRENCĐNĐN TEMEL MOLEKÜLER MEKANĐZMALARI ........ 14 ŞEKĐL 2-4. P-GLĐKOPROTEĐN POMPASININ YAPISI ............................................ 15 ŞEKĐL 2-5. P-GP POMPASI VE ĐNHĐBĐTÖRLERĐNĐN AKTĐVĐTESĐ ...................... 17 ŞEKĐL 2-6. L-ARJĐNĐN-NĐTRĐK OKSĐT YOLU ......................................................... 18 ŞEKĐL 2-7. NĐTRĐK OKSĐT (NO) KAYNAKLARI VE OLUŞUMU . ........................ 19 ŞEKĐL 4-1. MTT TESTĐ. ............................................................................................... 30 ŞEKĐL 4-2. K562D HÜCRELERĐNĐN RHO123 VARLIĞINDA IŞIK VE FLORESAN MĐKROSKOBU GÖRÜNTÜLERĐ. ............................................................................... 32 ŞEKĐL 4-3. K562D HÜCRELERĐNDE P-GP, CD34, CD38 VE MRP-1 YÜZEY BELĐRTEÇLERĐ ĐLE BOYANMIŞ HÜCRELERĐN AKIM SĐTOMETRESĐ GÖRÜNTÜLERĐ. ........................................................................................................... 33 ŞEKĐL 4-4. K562D HÜCRELERĐNDE P-GP, CD34, CD38 VE MRP-1 YÜZEY BELĐRTEÇLERĐNĐN KARŞILAŞTIRMALI GÖRÜNTÜLERĐ................................... 35 ŞEKĐL 4-5. K562D HÜCRELERĐNDE VERAPAMĐL VARLIĞINDA (■) VE YOKLUĞUNDA (♦) RODAMĐNĐN HÜCRE DIŞINA SIZMASININ SPEKTROFLORĐMETRĐK ÖLÇÜMLERĐ. .................................................................. 36 ŞEKĐL 4-6. K562D HÜCRELERĐNĐN RODAMĐN VE VERAPAMĐL VARLIĞINDA ĐNKÜBASYONLARI SONRASINDAKĐ AKIM SĐTOMETRĐ ANALĐZLERĐ. .......... 37 ŞEKĐL 4-7. K562S HÜCRELERĐNĐN RODAMĐN VE VERAPAMĐL VARLIĞINDA ĐNKÜBASYONLARI..................................................................................................... 38 ŞEKĐL 4-8. K562 S VEK562 D HÜCRELERĐNĐN NO VARLIĞINDA APOPTOZ GÖRÜNTÜLERĐ. ........................................................................................................... 39 ŞEKĐL 4-9. K562D HÜCRELERĐNĐN NO, DOKSORUBĐSĐN VE VERAPAMĐL VARLIĞINDA APOPTOZ GÖRÜNTÜLERĐ. . ............................................................ 40 ŞEKĐL 4-10. K562S HÜCRELERĐNĐN NO, DOKSORUBĐSĐN VE VERAPAMĐL VARLIĞINDA APOPTOZ GÖRÜNTÜLERĐ. . ............................................................ 41 xi SEMBOLLER / KISALTMALAR LĐSTESĐ NO Nitrik Oksit KML Kronik Miyeloid Lösemi K562S Doksorubisine duyarlı eritro lösemi hücre soyu K562D Doksorubisine dirençli eritro lösemi hücre soyu SNAP S-nitroso-N-acetyl-DL-penicillamine eNOS Endotelyal nitrik oksit sentaz iNOS Đndüklenebilen nitrik oksit sentaz nNOS Nöronal nitrik oksit sentaz P-gp P Glikoprotein MRP Çoklu ilaç direnciyle ilişkili protein DNA Deoksiribonükleik asit RNA Ribonükleikasit ATP Adenozintrifosfat ADP Adenozindifosfat GTP Guanozintrifosfat sGMP Siklik guanozin monofosfat TNFα Tümör nekroz faktör alfa VEGF Vasküler endotelial büyüme faktör KT Kemoterapi RT Radyoterapi pmol Pikomol nmol Nanomol Rho 123 Rodamin 123 GST Glutatyon-S-transferaz xii ÖZET Ülkü, S. K562 Hücrelerinde Doksorubisine Karşı Gelişen Dirence Nitrik Oksitin Etkisi, Đstanbul Üniversitesi Sağlık Bilimleri Enstitüsü, Biyofizik Anabilim Dalı. Yüksek Lisans Tezi. Đstanbul. 2013 Hematoljik kanserlerde antikanser ilaçların kullanımı hala en etkili tedavi yöntemidir. Ancak tedavi sırasında hastalık tekrarlayabilmektedir. Tedaviye henüz dahil edilmemiş ilaçlara karşı çapraz direnç gelişebilmektedir. Bir kısım kemoterapötik ilaçlar bazı kanser hücrelerinde olumlu sonuç verirken diğer kanser hücrelerinde etkileri sınırlı kalabilir. Bu nedenle farklı sitotoksik maddelerin, farklı hücrelerdeki etkilerinin tam olarak aydınlatılması oldukça önemlidir. ABC taşıyıcı protein ailesi, apoptozun (programlı hücre ölümü) baskılanması, çoğalmanın artması, ilaç hedef etkileşimindeki değişiklikler, ilaç inaktivasyonu gibi sebepler sitotoksik ajanlara karşı direncin gelişimine sebep olmuştur. Apoptozdaki bozukluklar kanser hücrelerinin sayısının artmasıyla sonuçlanabilir. Nitrik oksitin (NO) kanser biyolojisinde özellikle kanser metastaz (yayılma), hücre ölümü, neovaskülarizasyon (yeni damarlanma) ve immun cevabın başlamasını da içeren birçok olayda etkili olabileceği görülmüştür. Artmış NO üretiminin hücrelerde kanser gelişiminde rol oynadığı bilinmektedir. NO vericiler ile NO’e maruz kalmak, bazı antikanser ilaçların aktivitelerinide düzenlemektedir. Doksorubisine karşı direnç gelişmesi ile artan P-glikoprotein anlatımına bağlı olarak K562D (dirençli) ve K562S (duyarlı) hücrelerde, doksorubisinin hücre dışına salınım ve hücre içinde tutulumu kinetiklerini gösteren çalışmalar yapılmıştır. Bu çalışmada ise P-gp (P-glikoprotein) substratı olarak Rho123 (Rodamin123) ve P-gp kanalının inhibitörü olarak verapamil kullanıldı. NO’in ilaç direnci üzerine etkisinin belirlenmesi amacı ile NO vericisi olarak SNAP varlığında akım sitometresi ile apoptoz analizleri yapıldı. Yapılan analizler sonucunda K562S hücrelerin apoptoz değerleri, K562D hücrelerin apoptoz değerleri ile karşılaştırıldı. K562D hücrelerinde SNAP varlığında ortalama apoptoz değerlerinin gerilediği gösterilmiştir. Anahtar Kelimeler: K-562, doksorubisin, P-gp, apoptoz, NO vericisi (SNAP) Bu çalışma, Đstanbul Üniversitesi Bilimsel Araştırma Projeleri Birimi tarafından desteklenmiştir. Proje No: 31613 xiii ABSTRACT Ülkü S. Effect of Nitric Oxide for emerging resistance against doxorubicin in K562 cells. Đstanbul University, Đnstitute of Health Science, Depatment of Biophysics. Master Thesis. Đstanbul. 2013 In hematologic cancers use of anticancer drugs is still most effective method of therapy. However, disease may recur after treatment. Cross - resistance can develop against drugs which aren’t yet included in treatment. Some chemotherapeutic drugs give positive results in some cancer cells while their action may be limited in other cancer cells. Therefore, complete elucidation of distinct cytotoxic substances in different cells is considerably significant. ABC transporter protein family, suppresion of apoptosis (programmed cell death), increase of proliferation, changes in drug-target interactions, drug inactivation have caused resistance to cytotoxic agents. Defects in apoptosis may result in increase of cancer cells number. It’s known that nitric oxide (NO) play important role in cancer biology, particularly many events including cancer metastasis, cell death, neovascularization and also initiation of immune response. Increased NO production in cells is known to play a role in cancer development. In K562D (resistant) and K562S (sensitive) cells, studies that shown doxorubicin efflux kinetics in relation to increasing p-gp expression with emergence of doxorubicin resistance were done. In this study, as a p-gp substrate rho 123 (rhodamine dye) and as a p-gp channel inhibitor verapamil were used. With the goal of determining NO effect on drug resistance apoptosis analyses by flow cytometry were done in the presence of SNAP as a NO donor. As a result of these analyses, apoptosis values of K562S cells were compared with apoptosis values of K562D cells. Average apoptosis values have been shown to decrease in K562D cells in the presence of SNAP. Keywords: K-562, doxorubisin, P-gp, apoptosis, NO donor (SNAP) The present work was supported by the Research Fund of Đstanbul University, Project No: 31613 1.GĐRĐŞ VE AMAÇ Kanser, ölüm nedeni olarak kalp ve damar hastalıklarının hemen ardından gelmesiyle, önemi giderek artan bir sağlık ve yaşam sorunu olmuştur. Yüzyılın başlarında ölüme neden olan hastalıklar sıralamasında yaklaşık yedinci sıralarda yer alırken bugün birçok ülkede kardiyovasküler hastalıklardan sonra ikinci sırada bulunmaktadır. Günümüzde ise her 5 ölümden biri kanserden olmaktadır. Ülkemizde en sık görülen kanserler erkeklerde bronş ve akciğer, prostat, mesane, deri, mide ve kalın barsak; kadınlarda meme, tiroid, deri, kalın barsak, akciğer, mide ve pankreas kanserleri olarak sıralanabilir. Antikanser tedavinin amacı primer tümörleri büzüştürerek küçültmek, tümör gelişiminin ilerlemesini yavaşlatmak, primer tümör sahasından vücudun diğer bölümlerine metastaz yapmış kanser hücrelerini yok etmek ve bazen de semptomları rahatlatmaktır. Đdeal bir tedavinin amacı kötü huylu hücrelerin selektif bir biçimde öldürülmesi olmasına rağmen, normal ve kötü huylu hücreler arasındaki ayrım pek net olmadığı için bu tür bir selektif toksisite sağlamak zordur. Bu nedenle antikanser ilaçlar tüm çoğalan hücreler için toksiktir. Dahası pek çok antikanser ilacın büyük ölçüde immunosupresif (antikor oluşumunu baskılayan) etkinliği vardır ve daha sonrasında tümöre immün yanıtı inhibe etmektedir. Bazı tümörler en başta ilaç tedavisine duyarlı olabilirken tümörler genelde heterojen hücre toplulukları içerdiklerinden seleksiyon dirençli bir alt grubun doğmasına yol açabilir. Kemoterapiye karşı gelişen dirençlilik pek çok antikanser ilacın hastalar üzerinde beklenen etkisini gösterememesine ve hastalığın ilerlemesine neden olmaktadır. Artırılan ilaç dozları ise hastalarda görülen yan etkilerin artmasına sebep olmaktadır. Ayrıca, dirençlilik nedeniyle zaman ve ilaç kaybı olmakta, hastaların tedavisi zorlaşmaktadır. Đlaç direnci, özellikle antikanser ilacın uygulanması sonrası çoklu ilaç direncinden sorumlu proteinlerin aşırı anlatımı sonucu gelişmektedir (1). Son zamanlarda tedavi sırasında çapraz direnç geliştiği gösterilmiş olup tüm bunlar tedavideki başarı oranını düşürmektedir. Hematolojik malignitelerde de gözlenen bu çoklu ilaç direnci (MDR); hücre içi ilaç birikiminde azalma (ilacın hücre içine girişinde azalma veya hücre dışına atma işlevinde artış), ilaçhedef ilişkisinde azalma, DNA hasarının onarımında artış, apoptoza giriş kapasitesinde azalma veya detoksifikasyon işlevinde artış şeklinde gözlenebilmektedir (2). 2 Antikanser tedavide sıklıkla kullanılan ilaçların pek çoğu DNA (deoksiribonükleik asit) ve RNA (ribonükleik asit) sentezini bozarak etki etmektedir. Antrasiklin türevi antibiyotik olan doksorubisin kanser kemoterapisinde kullanılan ve grubunun ilk bulunan antikanser üyesidir. Doksorubisinin etki mekanizması karmaşık ve hâlâ tamamen anlaşılmamış olmakla beraber doksorubisinin enterkalasyon yoluyla etkileşip DNA’nın biyosentezini engellediği bilinmektedir (3). Doksorubisin, topoizomerazın DNA'yı kesmesinin ardından meydana gelen topoizomeraz-DNA kompleksini stabilize ederek, DNA ikili sarmalının tekrar birleşmesini engeller ve böylece DNA çiftleşmesini durdurur. Doksorubisinin hem P-gp hem de çoklu ilaç direnciyle ilişkili protein (MRP) substratı olması sebebiyle kanser tedavisi sırasında etkisi azalmaktadır. NO birçok farklı biyolojik olaylara aracılık yapan biyolojik haberci bir moleküldür. Hücre büyümesi, konak savunması ve apoptoz da önemli rollere sahiptir. NO aynı zamanda bir serbest radikaldir. NO DNA’yı hasarlayarak kanser başlangıcı ile ilişkili olup damar geçirgenliği ve yeni damar oluşumunu arttırır. Son zamanlarda yapılan çalışmalarda doksorubisin, kolon kanser hücrelerinde indüklenebilir NO sentaz genlerini regüle ederek çok miktarda NO oluşumuna yol açtığı ve bu oluşan NO’in ise kolon kanserinde kimyasal duyarlılaştırıcı ve ilaç toksisite mediatörü olarak davrandığı gösterilmiştir (4) . Kanser günümüze kadar birçok çalışmanın konusunu oluşturmuştur. Kanserin daha iyi anlaşılmasına, tanı ve tedavinin geliştirilmesi çalışmalarına ihtiyaç duyulmaktadır. Bu çalışmanın amacı, bir model hücre soyu olan K562 hücreleri kullanılarak doksorubisine karşı direnç geliştirmek ve doksorubisin direnci üzerine NO vericilerinin etkisini araştırmaktır. 3 2. GENEL BĐLGĐLER 2.1. Kanser Kanser genetik bir hastalıktır. Kanser gelişimi ile ilgili farklı görüşler olmakla birlikte hücreler karsinogenez (normal bir hücrenin tümör hücresine dönüşmesi) oluşumunda genetik değişikliklerin ve çevresel faktörlerin etkisiyle çok basamaklı bir süreç içinde bazı temel özellikler kazanır. Kanser bir organda oluştuktan sonra, uzak doku ve organlara metastaz (yayılma) dediğimiz yerleşmeler yapar ve genel olarak hastalar metastazlar nedeniyle kaybedilir. Kanser tedavisinde mortaliteyi azaltmak ve yaşam süresini artırmak için farklı birçok tedavi yöntemleri kullanılır. Bunlar arasında cerrahi, radyoterapi, kemoterapi tedavisi ve yeni tedavi yöntemlerinden immunoterapi, sinyal ileti sistemi inhibitörleri, gen tedavisi ve anjiyogenez inhibitörleri olarak sayılabilir. Kanser tedavisinde uygulanan kemoterapi, özellikle çoğalan hücrelere karşı seçici öldürücü etkileri olan doğal veya sentetik kimyasal, biyolojik ilaçlar ve hormonlarla yapılan tedavi şeklidir. Hücre kinetiği hakkında bilgiler arttıkça yeni ilaçlar laboratuvarlarda antikanser aktiviteleri açısından araştırılmaya başlanmıştır. Kanserde kemoterapi, tüm hücrelerdeki hücre siklusu gelişiminin çeşitli fazlardaki biyolojisi üzerine kurulmuştur. Kanser hücrelerinin verilen ilaca duyarlılığı genelde onların hücre döngüsü içindeki aşamalarına bağlıdır. Hücre döngüsünden bağımsız olan ilaçlar ise DNA’ya doğrudan zarar verirler ve etkinlikleri açısından hücre çoğalmasına bağlı değildirler. Sağlıklı vücut hücreleri de bölünebilme yeteneğine sahiptirler. Ölen hücrelerin yenilenmesi ve yaralanan dokuların onarılması amacıyla bu yeteneklerini kullanırlar. Fakat bu yetenekleri sınırlıdır. Sonsuz bölünemezler. Her hücrenin hayatı boyunca belli bir bölünebilme sayısı vardır. Sağlıklı bir hücre ne zaman ve nerede bölünebileceğini bilme yeteneğine sahiptir. Buna karşın kanser hücreleri, bu bilinci kaybeder, kontrolsüz bölünmeye başlar ve çoğalırlar (5). Kanser hücre toplulukları tümörleri oluştururlar. Eğer kanser hücreleri oluştukları ana tümörden ayrılırsa kan veya lenf dolaşımı aracılığı ile vücudun diğer bölgelerine gider ve oralarda da tümör odakları oluştururlar. 4 2.2. Kanser Hücre Bölünmesi Kanser hücreleri, normal hücreler gibi bölünmelerini durdurmazlar ve sürekli bölünme halindedir. Kanser hücrelerinin kontrolsüz çoğalımına neden olan ve bunları normal hücrelerden genel olarak ayıran dört özellik vardır: 1. Sağlıklı hücreler, hücre siklusuna girebilmeleri için dış büyüme faktörlerine gereksinim duyarlar. Bu faktörler hücrenin etrafında yer alan bazı maddelerdir ve hücre bölünmesini tetiklerler. Kanser hücreleri ise, bu büyüme faktörlerinden bağımsızdırlar ve dolayısıyla bölünme işlevleri süreklidir. 2. Sağlıklı hücreler, diğer hücrelerle temas kurma noktasına ulaştıklarında bölünmelerini sınırlandırırlar. Kanser hücreleri ise diğer hücrelerle temas haline gelseler bile bölünmeye devam ederek gittikçe büyüyen bir hücre topluluğu oluştururlar. 3. Olgun hücrenin her bölünüşünde DNA’nın sonunda bulunan telomer adlı bir yapı kısalır. Telomer yapısı bittiğinde hücre artık bir daha bölünmez. Genç ve olgunlaşmamış hücreler telomeraz adı verilen bir enzim taşırlar ki, bu enzim hücre olgunluğa erişinceye kadar telomer yapısını değiştirir. Olgun hücreler telomeraz üretimini durdurduktan sonra apoptoz adı verilen programlanmış hücre ölümü gerçekleştirirler. Diğer taraftan, kanser hücreleri ise telomeraz enzimini üretmeye devam ederler. Bu da onları apoptoza uğramalarına engel olur. 4. Tüm hücrelerin DNA’ları sürekli olarak yıkıcı etkilere maruz kalmaktadır. Bunlar arasında güneşten gelen radyasyon, kimyasal maddeler ve diğer hücre atıkları da yer almaktadır. Normal hücreler çoğu DNA hasarlarını onarabilecek güçte olup DNA’ları hasar gördüğünde bölünme yeteneklerini kaybeder. Kanser hücreleri ise DNA hasarı ile sınırlanamazken bölünmeye devam etmeleri yanında aynı zamanda genetik hasarı sonraki kanser hücre nesillerine geçirirler. 2.3. Hücre Siklusu ve Kanser Normalde hücreler proliferatif uyaranlara bağlı olarak gerektiğinde bölünebilir. Kanser hücrelerinde ise mutasyonlar nedeniyle normal hücrelerdeki kontrollü büyümenin yerini kontrolsüz sınırsız bir büyüme süreci almıştır. Kanserde sıklıkla hücre siklusu düzenlenmesinde bir hata söz konusudur. Hücre döngüsü biri G2/M geçişi, bir diğeri S fazı öncesi geç G1 fazınında dahil olduğu noktada ve M kontrol noktasında olmak üzere farklı düzeylerde denetlenir. Bu denetim noktalarının her birinde, ilişkili proteinler tarafından siklusun ilerleyip durmasına karar verilir. Bu kararların verilişinin 5 kontrolü, hedef proteinleri selektif fosforile eden bir enzim ailesinden olan protein kinazlar ve hücre döngüsünün işleyişini kontrol eden siklin adlı proteinler tarafından yapılır. Đlk kontrol noktası geç G1 fazı olup hücrenin G1 fazını terkedip S fazına geçebilmesi için DNA’nın hasar görmemesidir. Aksi halde hasar onarılana kadar hücre bu kontrol noktasında durur. Hasar onarılamayacak düzeyde ise birkaç saat süren G1 noktasındaki bu duruş p53 geninin girmesiyle uzatılır. Hücre döngü kontrolünü herhangi bir basamakta bozan mutasyonlar kanser hücrelerindeki genetik bozukluğun en önemli nedenlerinden biridir. Örneğin G1 kontrol noktasında görevli kinazları ya da siklinleri kodlayan genlerdeki mutasyonların hücrelerin malign dönüşümünde önemli rol alabileceği düşünülmektedir. G2 fazında tamir mekanizmalarından kaçan hasarlı DNA veya replike olmamış DNA varsa bu fazda kontrol edilir (6). Ayrıca, tam bir kromozom takımının yavru hücrelere geçmesini sağlamak üzere kromozomların mitoz sırasındaki dizilimlerini kontrol eden M kontrol noktası bir diğer önemli kontrol noktasıdır. Eğer hatalı dizilimle kromozomların tam bir takımının yavru hücrelere geçişinde bir problem olursa, hata giderilinceye kadar mitoz fazının metafazında siklus duraksar. Kanser kemoterapisinde kullanılan bazı ilaçlar, ölümcül aktivitelerini tümör hücrelerinin büyümelerindeki belli dönemlerinde gösterir. Mitoz ve hücre bölünmesinden sonra oluşan yeni hücreler, bir dinlenme fazına girerler. Bu faza G0-fazı adı verilmektedir. Bu fazda geçirilen zaman hem hücrenin tipine, hem de düzenleyici faktörlere bağlıdır. Kemik iliği, gastrointestinal mukoza ve deri gibi bazı dokularda G0, hücrenin olgunlaşma durumuna bağlı olarak uzatılabilinmesinin yanı sıra sinir, iskelet kası gibi dokularda G0 süresi daha uzun olabilmektedir. Katı tümörlerde, hücre kütlesi büyük olanların, hücre kütlesi küçük olanlara oranla G0 zamanı daha uzundur çünkü vasküler destek, hücre büyüme hızına yeterince destek olamamaktadır. G0 fazından sonra dinlenme sonrası faza yani G1-fazına girilmektedir. Bu fazda hücre bölünmesi (yeni DNA’nın oluşumu), RNA ve diğer proteinlerin oluşumunda gerekli enzimler üretilir. Daha sonra S-fazı gelmekte olup bu fazda mitoza hazırlık olarak DNA sentezi aktive edilmektedir. S-fazı süresince DNA çiftleri hücre bölünmesi için hazır durumda bulunmaktadır. DNA sentezi tamamlandıktan sonra pre-mitotik olarak tanımlanan G2fazına girilir. Bu fazda DNA sentezi dinlenme dönemindedir. Ancak RNA ve protein sentezleri gerçekleştirilirken diğer metabolik aktivitelerde de yükselme görülmektedir. Dolayısıyla da hücrenin hacmi artmaktadır. Bu faz, mitotik iplikçiklerin oluşumunda önemlidir. En sonunda hücre mitoza girer (M-fazı) ve hücre bölünmesi gerçekleşir. 6 2.4. Apoptoz Ökaryotik organizmadaki hücreler doğarlar, belirli bir süre yaşarlar ve sonra ölürler. Yaşam süresi hücre tipine göre değişmektedir. Örneğin derinin epidermal hücreleri 20-25 günlük bir süre sonunda ölürken miyokard kası hücreleri veya nöronlar ömür boyu yaşarlar. Fakat buna rağmen miyositlerin veya nöronların kabaca % 10-15’i yaşam sonunda kaybedilmektedir. Bahsedilen bu hücre ölümleri apoptozla gerçekleşir. Apoptoz kelime anlamı olarak ağaçların yapraklarını dökmesi ile benzeştirilen yaprak dökme anlamına gelen bir terimdir (7,8). Zamanı gelince ölen bu hücreler programlanmış bir şekilde ölürler (programlanmış hücre ölümü). Tüm bu ölümler fizyolojik şartlarda olduğundan fizyolojik hücre ölümü olarak da adlandırılır (9). Her saniyede yaklaşık 1 milyon hücre apoptoz ile vücuttan uzaklaştırılır. Bunların yerine yenileri yapılmaktadır. Yapım (mitoz) ile yıkım (apoptoz) arasında kontrollü bir denge vardır. Đşte bu dengenin apoptoz lehine veya aleyhine bozulması birçok önemli hastalığın patogenezine katkıda bulunur. Dengenin korunması için apoptoz, organizmada doğru bir şekilde işlemelidir. Olmaması gerekirken gerçekleşen apoptoz veya hızlanmış ya da tam tersine yavaşlamış apoptoz organizma için tehlikelidir. AIDS, nörodejenereratif hastalıklar, insüline bağımlı diyabet, hepatit C infeksiyonu, miyokard enfarktüsü, ateroskleroz gibi hastalıklar apoptozun gereksiz yere oluştuğu veya hızlandığı hastalıklara örnek oluştururken; apoptozun yavaşladığı hastalıklara örnek olarak ise otoimmün hastalıklar ve kanser verilebilir. Kanserli hücrelerde genellikle apoptoz baskılanır ve böylece tümör dokusu sürekli çoğalma eğilimindedir. Hücre zarının ya da hücredeki metabolik süreçlerin çok hızlı ve ağır biçimde hasar gördüğü ve hızla bozulan zar geçirgenliğinin, hücrenin şişmesi ve zarın patlayarak hücre içi maddelerin dışarı saçılmasıyla sonuçlanan nekrotik süreçten farklı olarak apoptozda zar bütünlüğü bozulmaz (10). Apoptoz ayrıca, fetusun implantasyonundan organogenezisine kadar tüm gelişim sürecinde yani embriyogenezde, insanın embriyolojik gelişiminde; parmak aralarındaki zarın, sinir sisteminde istenmeyen nöronların ortadan kaldırılmasında, erişkinde hormona bağlı involüsyonda; örneğin menstrüel siklusta endometriyal hücre yıkımında, menapozal foliküler atrezide, laktasyonun kesilmesi sonrası memede glanduler regresyonda ve bağışıklık sistemi hücrelerinin seçimi gibi pek çok olayda rol alır. Ek olarak, yenidoğan timusunun involusyonu sonucunda T lenfositlerin yaklaşık %98’inin seleksiyona uğradığı 7 bilinmektedir. Ayrıca B hücrelerinde de lenfositlerinin duyarlı olduğu uyaranla yeniden karşılaşması durumunda hazır bulunmasını sağlamak amacıyla apoptozun baskılandığı belirtilmektedir. Apoptoz genetik olarak düzenlenir, hatalı ya da hasarlı DNA apoptoz ile kaldırılamazsa kromozom sayısındaki sabitlenme korunamaz ve anöploidi gibi istenmeyen durumlar oluşabilir. 2.4.1. Apoptoz Mekanizması Apoptozun hem temel adımlar hem de uygulayıcı proteinlerdeki özdeş yapılar açısından birbirine benzeyen genetik bir yolla belirlendiği saptanmıştır. Apoptoz temel olarak iki yolla başlatılır: 1. Hücre dışından tetiklenen, pozitif (TNF-α varlığı) ya da negatif dışsal yol (büyüme faktörü yokluğu) 2. Hücre içinde DNA hasarı yada mitokondrial kaynaklı içsel yol. Mitokondri aracılığıyla düzenlenen hücre içi yol aslında hücre dışı ve hücre içi etkenlerin ortaklaştığı bir mekanizmadır (11). Apoptozu başlatan yolun mitokondri olduğu anlaşılmıştır. Apoptoz ya hücre yüzeyindeki ölüm reseptörlerinin aktivasyonuyla yada öncelikle mitokondride gelişen bir dizi hücresel olaylarla başlatılabilir. Apoptozun tümörogenez ve kanser tedavisi için önemli olduğu gösterilmiştir. Apoptozdaki aksama neoplastik hücrelerin sayısının artmasıyla sonuçlanabilir. Mitokondrinin aktivasyonuna yol açan en önemli faktör Bcl-2 ailesidir. Bcl-2 ailesinin hem proapoptotik hem de antiapoptotik üyeleri vardır. Bcl-2 ailesinin Bax, Bad, Bid, Bak, Bok, Bcl-Xs üyeleri apoptozu tetiklerken, Bcl-2 ve Bcl-XL apoptozu inhibe eder. Pro-apoptotik olan üyeler sitokrom-c’nin mitokondriden sitoplazmaya geçişini indüklerken, anti-apoptotikler mitokondriden sitokrom-c çıkışını baskılar. Herhangi bir nedenle DNA hasarı oluştuğunda bu hasara yanıt olarak p53 geni aktiflenir. Bunun sonucunda proapoptotik Bcl-2 üyesi olan Bax’ın tetiklenmesine yol açarak apoptoz başlar. Bcl-2 ailesi proteinleri mitokondrial membranın geçirgenliğini değiştirerek etkilerini gösterirler. Yüksek seviyedeki Bcl-2 ekspresyonu pek çok insan tümörlerinde gözlenen bir durumdur ve Bcl-2 ekspresyon seviyesi malign tümör gelişimi ile ilişkilidir. Bcl-2’nin sitotoksik etkenleri TNF-α’nın indüklediği apoptozu bloke ettiği gösterilmiş, Bcl-2 fonksiyonlarının baskılanması apoptozu başlatır. Ayrıca glutatyon S-transferaz (GST) enziminin baskılanmasının da apoptozu başlattığı ortaya konulmuştur. 8 2.5. Antikanser Đlaçların Sınıflandırılması Antikanser ilaçların kullanımı, lösemi ve lenfoma gibi yaygın malignitelerin tedavisinde sıklıkla direnci aşmak veya birbirlerinin etkilerini artırmak amacına yönelik sık aralıklarla ve yüksek dozlarda verilmektedir. Antikanser ilaçların çoğu özellikle sitotoksik ilaçlar, hücre biyolojisinde yalnızca hücre bölünmesini etkilemektedir. Çoğu vakada, antiproliferatif etki, hücre siklusu S fazıyla ilişkili ve DNA düzeyinde başlatılan apoptoz kaynaklıdır. Ana hedef hücre bölünmesi olduğundan tüm hızlı bölünen hücreler yani kanser yanında normal dokuları da toksik etkiler. Ayrıca bazen bu ilaçlar kendileri de karsinojenik olabilirler. 2.5.1. Alkilleyici Ajanlar Kemoterapötik ve sitotoksik etkiler doğrudan DNA’nın alkillenmesiyle ilgilidir ve interkromatin çapraz bağlara ve DNA sentezinin bozulmasına neden olur. Diğer etkiler arasında anormal baz eşleşmesi, DNA transkripsiyonu blokasyonu, DNA zincir kırıkları ve baz çifti kayıpları sayılabilir. Alkilleyici ajanlar hücre siklusundan bağımsız ilaçlardır. Alkilleyici ajanlara karşı direnç gelişimi çok yaygın bir durumdur. Sitotoksik aktiviteye karşı kazanılan bu tür bir direnç en az üç mekanizmayla meydana gelir(12) 1. Yüksek tiyol üretimi ilaçları etkisiz hale getirebilir. 2. Hücre geçirgenliğinin düşük olması da bir rol oynayabilir. 3. DNA onarım kapasitesinin yüksek olması sitotoksik aktiviteyi hafifletebilir. Alkilleyici ajanlara örnekler: Nitrojen Mustard Analogları Etileniminler Alkil Sülfonatlar Nitrosoüreler 2.5.2. Antimetabolitler Hücre döngüsüne bağımlı ilaçlardır ve S-faza özgüdürler. Etkilerini DNA sentezi üzerinde gösterirler. Antimetabolitlere örnekler: Folik Asit Antagonistleri Purin Antagonistleri Pirimidin Antagonistleri 9 2.5.3. Bitkisel Alkaloidler Bunların çoğu mikrotübül fonksiyonlarını ve bundan dolayı mitotik ağları etkilerler. Bitkisel alkaloidlere örnekler: Vinka Alkaloidler Taksanlar 2.5.4. Hormonlar ve Hormon Antagonistleri En önemlileri glukokortikoidler, östrojenler ve androjenlerdir. Bunların yanı sıra hormon sekresyonlarını baskılayan veya antagonist hormon etkisi gösteren ilaçlar da vardır. Hormonlara örnekler: Glikokortikosteroidler Östrojenler Progestojenler Gonadotropin Salgılatıcı Hormon Analogları Hormon antagonistlerine örnekler: Antiöstrojenler Antiandrojenler Enzim Đnhibitörleri 2.5.5. Sitotoksik Antibiyotikler Aktinomisinler: Antitümör özelliği taşıyan ilk antibiyotik Streptomyces türlerinden izole edilen antimosin A’dır. Bu grubun klinik kullanımında olan en önemli temsilcisi antinomisin D, başka bir deyişle daktinomisindir. Antrasiklinler: Antrasiklin antibiyotikler doksorubusin, daunorubisin, epirubisin ve sentetik ajanlar idarubisin ve mitoksantronu içerir. Doksorubisin: Doğal ürünler Streptomyces peucetius’dan türetilirler. DNA interkalasyonuyla DNA replikasyon ve transkripsiyonunun her ikisini de bloke eder. Esas sitotoksik etkisi çoğalan hücrelerde arttığı belirlenen topoizomeraz II üzerine olan etkisidir. Topoizomerazların DNA eşleşmesi, kopyalanması ve tamirinde önemli rolleri vardır. Doksorubisin reaktif oksijen bileşiklerinin oluşumuna yol açarak serbest radikal hasarı üzerinden de antikanser etki gösterir. Hücre siklusundan bağımsız etkilidir. 10 Şekil 2-1. Doksorubisinin moleküler yapısı. Antrasiklin türevi antibiyotik olan doksorubisin kanser kemoterapisinde kullanılan ve grubunun ilk bulunan antikanser üyesidir (Şekil 2-1). Molekülün düzlemsel kromofor kısmı DNA’ya enterkale olur. Doksorubisinin altı-üyeli daunosamin şekeri DNA'nın küçük oyuğuna yerleşir ve baz çiftleri ile etkileşir. DNA replikasyonu ve RNA transkripsiyonunun bozulmasına neden olur(13). Topoizomerazların DNA eşleşmesi, kopyalanması ve tamirinde önemli rolleri vardır. Antrasiklinler transkripsiyon sırasında Topoizomeraz II enziminin ilerlemesini engeller. Ayrıca oksijen serbest radikalleri, hidroksil radikalleri içeren reaktif oksijen partikülleri oluşturarak DNA, mRNA, protein ve lipid hasarı yaparlar. Oluşan lipid peroksidasyonu bu ilacın aritmi ve kalp yetmezliği gibi kalp kası toksisitesine yol açabilir. Bu etki serbest radikallerinin üretimi sonucu olabilir. Bleomisin: Streptomyces verticullus’un doğal oluşumlu fermentasyon ürünlerinin (Cu+2 ile kompleksli temel glikoprotein) karışımıdır. DNA niteliğini bozarak zincirin parçalanmasına ve serbest bazların salıverilmesine yol açan metal şelatlayıcı glikopeptid antibiyotiklerdir. Antibiyotikler arasında hücre döngüsünün G2 fazında hücrelerin akümülasyonuna neden olur. Ancak bölünmeyen hücreleri de (G0 fazındaki hücreler) etkiler. Sıklıkla kalıtsal kanserlerin tedavisinde kullanılır. Mitomisin: Streptomyces caespitosus’dan izole edilen bir antibiyotiktir. 2.5.6. Topoizomeraz Đnhibitörleri DNA’nın topolojisini değiştiren enzimler sınıfıdır. Çift sarmal helikal yapının açılması, çoğalması için gerekmektedirler. Zincirin açılmasını ve replikasyonu sağlarlar. Topoisomeraz I Đnhibitörleri: Tek DNA zincirini kırarlar. ATP den bağımsızdırlar. 11 Topoisomeraz II Đnhibitörleri: DNA’nın iki zincirini de kırarlar. ATP’ye bağımlıdırlar. 2.5.7. Protein Kinaz Đnhibitörleri Bu ilaçlar hızlı bölünen hücrelerde protein kinazı (tirozin kinaz) inhibe ederler. Đmatinib: Hedefli kemoterapi tedavisinde sinyalleyici yol kinazlarının inhibitörü olan küçük bir moleküldür. Đlaç oral yoldan verilir. Diğer kinaz inhibitörlere karşı hiç mevcut olmayan çapraz dirençlere neden olur. 2.5.8. Diğer bileşikler Adrenokortikal süpresantlar Biyofosfonatlar Sitoprotektör (Reaktif parçacık antagonistleri) Metilhidrazin türevi Somatostatin analoğu Sübstitü melamin (heksametil melamin) Hidroksiüre 2.6. Antikanser Đlaçların Etki Mekanizmaları Vücutta mutasyona uğrayan hücrelerin ancak çok küçük bir kısmı kansere yol açar. Bunun birçok nedeni vardır. Mutasyonlu hücrelerin yaşama kabiliyetleri normal hücrelere göre daha az olup bu nedenle ölürler. Mutasyon gösteren hücrelerin pek çoğunda bile hâlâ aşırı büyümeyi önleyen normal geridönüm kontrol düzeneği bulunur (tümör supresör genler-antionkogenler). Bu yüzden yaşayabilen mutant hücrelerin çok azı kanserli hücreye dönüşür. Bu prekanseröz hücreler genellikle büyüyüp kanser oluşturmadan önce vücudun bağışıklık sistemi tarafından ortadan kaldırılır. Mutant hücrelerin çoğu, değişikliğe uğramış genleri nedeniyle anormal protein sentezlemekte olup bu anormal proteinler vücudun bağışıklık sistemini uyararak antikor yapımına veya kanserli hücreye karşı duyarlılık kazanmış lenfositlerin oluşmasına neden olur. Bağışıklık sisteminin etkinliğini bozan durumlar kanseri hazırlayıcı etmenler olarak bilinir. Bağışıklık sistemi tarafından yok edilemeyen bu hücreler kontrolsüz çoğalarak bulundukları dokuyu işgal ederler. Kanser ilaçlarındaki en önemli problemlerden birisi, bu ilaçların yalnızca kanser hücrelerine öldürücü etkisi değil, aynı zamanda normal hücrelere de öldürücü etkilerinin olmasıdır. 12 Antikanser ilaçları etki mekanizmasına göre iki grupta inceleyebiliriz: 1. Hücre siklusuna bağımlı ilaçlar: Etkinliği hücre çoğalması aşamasına bağlıdır. S fazına dönük ilaçlar (Antimetabolitler): Hücre metabolizmasını ve DNA sentezini bozarak etki ederler. Metotreksat, 5-Flourourasil, Sitarabin, Prokarbazin, 6 Tioguanin, 6 Mercaptopürin. M fazına dönük ilaçlar (Bitki alkoloidleri ): Ana hücreden iki yavru hücre oluşmasını engellerler. Vinkristin, Vinblastin. G2 fazına dönük ilaçlar (Antitümör antibiyotikler): RNA, DNA ve protein sentezini etkilerler. Bleomisin, Actinomisin-D, Daunorubisin. 2. Hücre siklusundan bağımsız ilaçlar: Etkinliği hücre çoğalmasına bağlı değildir. Alkilleyici ajanlar: Hücre çekirdeğini, DNA ve RNA sentezini etkilerler. Hızlı çoğalan hücrelerin ölümüne yol açarlar. Nitrojen mustard, Sisplatin, Siklofosfamid, Prokarbazin. Hormonlar: Tümör ortamını değiştirerek büyüme ve çoğalmayı engellerler, protein sentezini bloke ederler. Östrojen, Kortikosteroidler. Antibiyotikler: DNA replikasyonunu bozarlar. Adriamisin. 2.7. Kanser Hücresinin Geliştirdiği Direnç Mekanizmaları Sitotoksik ajanlara direnç, insan kanserlerinin klinik tedavisinde en büyük engellerden biridir. Tümörler; ilaç taşıyıcı proteinlerde artış, ilaç-hedef etkileşimlerinde değişiklikler ve apoptozda azalmaya sebep olacak moleküler değişiklikler yoluyla kemoterapi (KT)’ye direnç gösterirler. Bununla birlikte bu değişiklikler, tümörlerde dirençli ve duyarlı hücrelerin ilaç uygulanımında nasıl hayatta kalarak böylece ilaç direnci oluşturduğunu açıklamada yetersizdir. Bazı tümörlerde en başta ilaç tedavisine duyarlı olabilirken primer dirençte olduğu gibi kazanılmış dirençte olabilir. Hücrelerdeki, zararlı ve toksik maddeleri uzaklaştıran biyokimyasal sistemlerin olduğu bilinmektedir. Apoptozu baskılayarak tümör hücrelerini canlı tutan proteinlerin üretimindeki artış hücreleri ölümden koruyarak KT ve RT (radyoterapi)’ye karşı direnç gelişimini sağlar. Apoptoz ya hücre yüzeyindeki ölüm reseptörlerinin aktivasyonuyla ya da öncelikle mitokondride gelişen bir dizi hücresel olaylarla başlatılabilir ve hücrelerin sayısının artmasıyla sonuçlanabilir. Apoptozun tümörogenez ve kanser tedavisi için önemli olduğu gösterilmiştir. 13 Şekil 2-2. Đlaç direnç mekanizmalarının bazıları (13). Sitotoksik etkenlere karşı tümör hücresinin geliştirdiği birçok ilaç direnç mekanizması bulunur (Şekil 2-2). 1. Đlacı hücre dışına doğru aktif transportunda artma ve dolayısıyla hücre içi konsantrasyonun azalması. 2. Đlaca hedef enzim üretiminin tümör hücresi tarafından artırılması ve dolayısıyla ilacın etkisinin azalması. 3. Oluşan metabolitin tümör hücresi içinde, sitotoksik etki gösterebilmesi için gerekli olan enzimin kaybı. 4. Đlacın tümör hücresi içine girmesini sağlayan transport sisteminin kaybolması. 5. Çoklu ilaç direnç proteinlerinin anlatımında artış. 6. Artmış hücesel ilaç detoksifikasyonu örneğin birçok antikanser ilaçların metabolik biotransformasyonunda yer alan serbset radikallerden kaynaklı hasardan hücrelerin korunması. 7. Kanser hücrelerinde glutatyon S-transferaz enzim düzeyinin artması dolayısıyla apoptozun kesitiye uğraması. 8. Đmmun sistem hücrelerinden sitotoksik doğal öldürücü hücrelerine karşı tümör membranının direnç kazanması. 14 Bazı durumlarda etkili bir kemoterapi ve hızlı iyileşme için farklı hücresel hedefleri olan, farklı hücre içi mekanizmaya sahip birden çok ilaç kullanılır. Sıklıkla direnç mekanizması bu çoğu farklı yapısal ve fonksiyonel özelliklere sahip, birbiriyle bağlantısız ilaçlara karşı birlikte direnç gösterir (Şekil 2-3). Şekil 2-3. Đlaç direncinin temel moleküler mekanizmaları (14). Çoklu ilaç dirençliliğine neden olan mekanizmalar, ABC taşıyıcı gen ailesi proteinlerinin ekspresyonlarındaki artış, hücreleri programlanmış ölüme (apoptoz) götüren yolaklardan bazılarının bloke olması ve ilaç hedef moleküllerindeki değişimlerdir. Çoklu ilaç direncine neden olan mekanizmalardan, en fazla ATP bağımlı taşıyıcı proteinler (ABC taşıyıcı gen ailesi proteinleri) ile çalışılmıştır (14). Bu proteinler arasında P-glikoprotein ve MDR-ilişkili proteinler (çoklu ilaç direnciyle ilişkili-MRPs) bulunmaktadır. MDR fenotipi MDR1 geninin indüksiyonuyla ilişkilidir ve bu indüksiyon P-gp’nin artışıyla sonuçlanır. Bu integral proteinlerin aşırı anlatımı çeşitli kanser ilaçlarına karşı tümör hücrelerini dirençli hale getirmektedir. Bu durum doğal olarak taşıyıcı proteinlerin, ilaçların etkinliği ve güvenliğinde değişiklik yapabileceğini beraberinde getirmektedir. ATP bağımlı taşıyıcı proteinleri P-gp, çoklu ilaç direnci ile ilişkili protein ailesi (MRP 1-9) ve meme kanseri direnç (BCRP) proteinleridir (şekil 2-4) . 15 ATP bağımlı proteinler haricinde; akciğer direnç proteini (LRP), deoksisitidin kinazbenzeri enzim değişiklikleri, apoptozu indükleyen kemoterapötik etkinin azalması, sitostatik ilaçların hedef enzimlerinde değişimler, p53 gen mutasyonu hematolojik kanserlerdeki diğer ilaç direnç mekanizmaları olarak bilinmektedir. Son zamanda yapılan çalışmalar ise çoklu ilaç direncinin hastaların kısa yaşam süreleriyle ilişkili olduğunu göstermektedir. 2.7.1. P-glikoprotein (P-gp, ABCB1) P-gp, ABC taşıyıcı protein veya CD243 olarak da bilinmektedir. P-gp, insanlarda 7q21.1 kromozomunda yer alan MDR1/ABCB1 geni tarafından kodlanmakta ve klonlanan ilk ABC taşıyıcı proteinidir. P-gp, 1280 amino asitin birleşmesinden oluşur ve molekül ağırlığı 170 kilodaltondur. Molekül, altışar transmembranal segment içeren iki transmembranal alan ve iki nükleotid bağlayıcı alandan oluşmaktadır (15-18). Şekil 2-4. P-glikoprotein pompasının yapısı (14). P-gp, ilk defa 1976 yılında Juliano ve Ling tarafından, kolşisine dirençli Çin hamsteri yumurtalık hücrelerinde aşırı ekspresyonu olan bir yüzey glikoproteini olarak tanımlanmıştır (19-22). Daha sonra, tümör hücrelerinde varlığı gösterilmiş ve bu hücrelerde P-gp’nin antikanser ilaçları hücre dışına atarak çoklu ilaç direnci olarak tanımlanan hücresel sürecin gelişmesinde rol oynadığı saptanmıştır. Monoklonal antikor kullanılarak gerçekleştirilen immünohistokimyasal analizler P-gp’nin, tümör hücrelerindeki anlatımının yanı sıra, sağlıklı insan dokularında da büyük ölçüde anlatımı olduğu ve bu hücreleri toksik maddelerden koruduğunu göstermiştir. 16 Đnsanlarda bu taşıyıcı protein, karaciğerde hepatositlerin kanaliküler yüzeyinde, böbreklerde proksimal tübüllerin epitel hücrelerinin apikal yüzeyinde, ince bağırsakların ve kolonun silindirik epitel hücrelerinin apikal yüzeyinde üretilmektedir. P-gp ayrıca, beyin, periferik sinirler ve testislerde kapiller endotel hücrelerinin apikal yüzeyinde, koroid pleksus epitel hücrelerinin apikal yüzeyinde, plasentanın epitel hücrelerinin apikal yüzeylerinde, kan beyin ve kan omurilik sıvısı, kan testis ve kan plasenta gibi çeşitli kan doku bariyerlerinin bir parçasını oluşturmaktadır (16,23,26,27). P-gp, ince ve kalın bağırsak, karaciğer, pankreas, böbrek, ovaryum ve testis, hematopoietik sistem ve çocukluk çağı kanserlerini de içeren pek çok insan kanser hücrelerinde artış göstermektedir. MRP (MDR bağlantılı protein) de kemoterapötik ilaçları hücre dışına taşır (20,21,24). P-gp’nin anatomik lokalizasyonu ve dışarı atım fonksiyonu göz önüne alındığında ilaçların emilimi, dağılımı ve eliminasyonunda önemli rol oynadığı görülmektedir. Beyin, plasenta, testis, lenfosit gibi dokularda lokalize olan P-gp, çeşitli kan doku bariyerini oluşturarak ilaçların duyarlı doku ve hücrelere girişlerini sınırlandırmakta ve bu dokularda toplanmalarını azaltmaktadır (25,26). P-gp, bu hassas dokuları zararlı maddelere karşı doğal koruma fonksiyonunu gerçekleştirirken, bir taraftan da ilaç dağılımını etkileyerek özellikle bazı ilaçların (antipsikotik ilaçlar, HIV proteaz inhibitörleri, antikanser ilaçlar) terapötik etkilerini göstermelerine engel olabilir (16,18,27-29). Bu etkileşimler klinik olarak anlam taşıyabilir. Yapılan in vitro ve in vivo çalışmalarda P-gp inhibisyonu ve indüksiyonunun ilaç etkileşmelerine neden olduğu gösterilmiştir. P-gp substratlarının ağız yolundan P-gp inhibitörleri ile birlikte kullanılması substrat ilaçların biyoyararlanımlarını artırarak terapötik etkilerini artırabileceği gibi toksisitelerinin artmasına ve ters etkilerinin şiddetlenmesinede yol açabilmektedir (Şekil 2-5). Bununla birlikte P-gp substrat ilaçlarının P-gp indüktörleri ile birlikte kullanılması substrat ilaçların biyoyararlanımlarının azalmasına ve terapötik etkilerinin zayıflamasına neden olabilmektedir (17,18,30,31). Kanserin etkili kimyasal tedavisinde bir engel olarak ortaya çıkan P-gp aracılı çoklu ilaç direncini yenmek ve antikanser ilaçların tümör hücrelerinde birikmelerini sağlamak amacıyla P-gp işlevini bloke eden moleküller elde etmeye yönelik birçok çalışma yapılmış ve çoklu ilaç direncini tersine çeviren çok sayıda molekül sentez edilmiştir. P-gp’yi inhibe eden bu moleküller, P-gp modülatörleri olarak da adlandırılmaktadır. 17 Şekil 2-5. P-gp pompası ve inhibitörlerinin aktivitesi (14). Kanser hastalarına uygulanan kemoterapinin başarısız olmasının temel nedenlerinden biri P-gp aracılığı ile gelişen çoklu ilaç direncidir (32-35). P-gp kanser hücrelerinde hücre içi ilaç konsantrasyonlarının azalmasına neden olmaktadır. Bu durum KT’nin başarısını olumsuz yönde etkilemektedir. Bu çoklu ilaç dirençliliğine sebep olan biyokimyasal sistemler ve moleküler değişikliklerin tanımlanması sonucunda KT için kullanılan ilaç stratejileri kişiye özel olarak şekillendirilebilir. P-gp’nin substrat spesifitesinin yüksek olmasından dolayı tümör hücrelerinde P-gp substratı olan doksorubisin, daunorubisin, irinotekan, vinkristin, vinblastin, metotreksat, etoposid, paklitaksel, dosetaksel, tamoksifen, mitoksantron gibi yapısal olarak farklı birçok sitotoksik ilaca karşı da çapraz direnç görülmüştür (33,34,36). 18 2.8. Nitrik Oksit (Endotel Kaynaklı Gevşetici Faktör) Đlk olarak 1980’de Furchgott ve Zawadzki tarafından asetilkolin etkisi altında tavşan aortası endotel hücrelerinden salındığı gösterilen çok labil bir vazodilatatör otokoiddir. Daha sonra insan dahil çeşitli memeli türlerinde çeşitli kimyasal ve fiziksel etkenlerin endotelden Endotel Kaynaklı Gevşetici Faktör (EDRF) salıverdikleri bulunmuştur. EDRF’nin kimyasal yapısının NO veya ona çok benzeyen bir madde olduğunu gösteren birçok deneysel kanıt ortaya konulmuştur. Bu nedenle EDRF’ye EDRF-nitrik oksit veya endotel kaynaklı nitrik oksit adı da verilmiştir (37). NO, endotel hücrelerinde L-argininin guanidino nitrojeninin kalsiyuma bağımlı bir enzim olan endotelyal NO sentaz (eNOS) enzimi aracılığı ile oksitlenmesi sonucu sentez edilir. Bir yarı esansiyel aminoasit olan L-argininin terminal guanidino azot atomundan NO oluşur. NO oluşumundan sorumlu enzim NOS, sitozolik bir flavoproteindir. NADPH ve O2’ye bağımlı oksijenasyonu katalize eder (Şekil 2-6). Şekil 2-6. L-Arjinin-nitrik oksit yolu (38). 19 NOS’un çeşitli izoformları vardır; bunlar ilk bulundukları yere göre adlandırmışlardır. Her biri ayrı genler tarafından eksprese edilir. Endotelde olan eNOS ve beyinde bulunan nöronal NOS (nNOS), kalsiyum ve kalmodüline bağımlı yapısal (indüklenmeyen, iNOS) olan izoformlardır. Makrofajlarda oluşan sitokinler ve endotoksin tarafından sentezi arttırılan, hepatositlerde endotoksin ile indüklenen iNOS, kalsiyum ve kalmodüline bağımlı değildir. Tüm NOS izoenzimleri aşağıda adı geçen Larginin anologları ile inhibe olur. Endoteldeki yapısal NOS ile oluşturulan NO, pikomol (pmol) düzeyindedir ve çabuk salıverilir. Oysaki iNOS tarafından sentez edilen NO çok daha yüksek miktarda nanomol düzeyinde (nmol) ve yavaş salıverilir (Tablo2-1). iNOS, endotoksin (lipopolisakkarid), tümör nekroz faktör alfa (TNF-α), interlökin-1 beta (IL-1β) ve interferon gamma tarafından aktive edilir; glukortikoidler, TGF-β, interlökin-4 (IL-4) ve interlökin-10 (IL-10) tarafından inhibe olur. Şekil 2-7. Nitrik oksit (NO) kaynakları ve oluşumu (39). Nitrik oksit sentezleyen enzim (NOS), NADPH, oksijen, flavoproteinler (FAD, FMN), kalmodulin (CaM) ve tetrahidrobiopterinin (BH4) varlığında L-arginini, sitrulin ve NO’ya dönüştürür (Şekil 2-7). 20 Bütün NOS enzimleri arginin analoglarınca inhibe edilir. Nitrik oksit, guanil siklazı aktive eder ve hücre içinde cGMP düzeyini artırır ve bu düz kaslarda gevşemeyle sonuçlanır. Tablo 2-1. NO sentezleyen enzim izoformları (39). Nitrik Oksit Sentezleyen Enzimler NOS Đzoformları Tip 1 DDiğer adı Salınım nNOS Devamlı Kaynak Regülasyon Kalsiyuma Sinir Hücreleri Bağımlı Makrofaj, Damar düz kası, Tip 2 iNOS Indüklendiğinde NO Miktarı Kromozom dammar endoteli, miyokard, endokard,hepatosit, Đmmun hücreler, hava yolu epiteli Düşük (picomol) 12 Sitokinler, endotokin ve oksidanlar tarafından Yüksek (nanomol) 17 indüklene Vasküler endotel hücreleri, Tip 3 eNOS Devamlı Plateletler, miyokard ve Kalsiyuma endokard, mast hücreleri, Bağımlı Düşük (picomol) 7 nötrofiller NOS:nitrik oksit sentezleyen enzim, nNOS:nöral NOS, iNOS:indüklenebilen NOS, eNOS:endotel kökenli NOS Dokuda ve oksijenlenmiş fizyolojik sıvılarda NO hızlı katabolize olur. Dokuda eliminasyon yarı ömrü yerine ve türe göre değişmek üzere 6 ile 50 saniye arasında bulunmuştur (40). Süperoksit dismutaz enziminin ortama katılması ise NO’nun inaktivasyonunu hızlandıran serbest oksijen radikallerini nötralize ederek NO yıkımını yavaşlatır ve NO etkisini potansiyelize eder. NO, superoksit anyonu ile etkileşerek ONOO- oluşumuna neden olur. Bu dönüşüm özellikle makrofajlar, polimorfonükleer lökositler, mesenjial hücreler ve endotel hücrelerinde oluşur. ONOO- direkt ve indirekt olarak lipit peroksit aktivasyonunu aktive eder; dolayısıyla hem vücut hücrelerinde ve hem de enfeksiyon etkeni hücrelerde sitotoksik etki oluşturur. Đnsanlarda NO’nun bazal durumda damar endotelinden sürekli olarak salıverildiği ve vazodilatör tonus oluşturup damar direncinin fizyolojik düzenlenmesine katkıda bulunduğu bilinmektedir. Aterosklerotik damarların çeperinde NO yapımının azaldığı ya da kaybolduğu bulunmuştur. NO, endotelde kalsiyuma bağımlı bir şekilde sentez edilip salıverildiğinden kalsiyum iyonoforu olan kalsimisin NO salıverir. Bu etkenlerden çoğu endoteli sağlam damarlarda gevşeme yaptıkları halde, endoteli tahrip edilen damarlarda damar düz kası üzerindeki direkt etkileri ile kasılma yaparlar. Damarın basınca ve 21 akımın yaptığı sürtünmeye maruz kalması (sürtünme stresi) endotelden hem prostasiklin ve hem de NO salgılanmasını arttırır. Bu iki madde sinerjistik bir etkileşme ile trombus oluşumunu engeller. Bunlara ek olarak, vazodilatatör ve antitrombojenik etkileri nedeni ile sitoprotektif etkinlik gösterir (41). NO, sadece damar endotel hücrelerinde değil, fakat aynı zamanda serebellum ve ön beyindeki nöronlarda, lökositlerde, böbrek tubulus epitelyum hücrelerinde, adrenal medulla hücrelerinde, mast hücrelerinde ve bazı otonom sinirlerin (nonadrenerjik nonkolinerjik sinirler) uçlarında da sentez edilip salıverilir. Beyinde belirli nöronlarda NO sentezinin yapıldığı ve bu maddenin nörotransmitter işlevi yapabileceği gösterilmiştir. Đlaç olarak kullanılan nitrogliserin, sodyum salıvermek suretiyle kendilerine özgü vazodilatatör ve antiagregant etki oluştururlar. Makrofajların ve karaciğer kuffer hücrelerinin sitotoksik miktarda NO salıvererek, onun aracılığı ile enfeksiyon etkenlerini ve diğer hücreleri öldürdükleri saptanmıştır. Daha önce belirtildiği gibi; NO’nun iltihap dokusunda toplanan makrofajlar tarafından fazla miktarda sentez edilip salgılandığı ve onların enfeksiyon etkeni mikroorganizma veya parazitler üzerindeki öldürücü etkilerine aracılık ettiği ve nitratın idrarla atılımın arttırdığı ileri sürülmüştür (42,43). 2.8.1. Nitrik Oksitin Etki Mekanizması NO salıverilmesine neden olan kimyasal etkenler arasında aktif endojen maddeler ve ilaçlar bulunur; asetilkolin, histamin, seratonin, vazopresin, bradikinin, prostasiklin, P maddesi, insülin, klonidin ve katekolaminler (son ikisi α2 adrenerjik reseptörler aracılığı ile). Trombosit agregasyonu sırasında aktive olan trombositlerin salıverdiği adenozintrifosfat (ATP) ve adenozindifosfat (ADP) maddeleri ile pıhtılaşma sırasında oluşan trombin de NO salgılanmasına neden olur (44). NO, endotelde kalsiyuma bağımlı bir şekilde sentez edilip salıverildiğinden kalsiyum iyonoforu olan kalsimisin NO salıverir. Bu etkenlerden çoğu endoteli sağlam damarlarda gevşeme yaptıkları halde, endoteli tahrip edilen damarlarda damar düz kası üzerindeki direkt etkileri ile kasılma yaparlar. NO, damar düz kas hücreleri üzerindeki gevşetici etkisini ve trombositler üzerinde etkilerini bu hücrelerde guanilat siklaz enzimini aktive edip guanozintrifosfattan (GTP) ikinci ulak olarak siklik guanozin monofosfat (sGMP) oluşmasını arttırmak suretiyle yapar. Bu enzimi inhibe eden metilen mavisi ve hidrokinon, NO’nun etkilerini ortadan kaldırabilir. NO, trombositlerin agregasyonunu hem de damar çeperine adezyonu (yapışmasını) inhibe eder. hem 22 2.8.2. Nitrik Oksit ve Kanser Kültür mediumunda süspansiyon olarak büyüyen K562 hücrelerinin iki kat artma süreleri ortalama 12 saattir. Bu nedenle hücre kültüründe kolayca çoğaltılabilen K562 hücrelerinin sitotoksisite ve apoptoz çalışmaları için kullanımı yaygındır (45). Kültürde spontan olarak apoptoza gitmeyen K562 hücrelerinde farklı maddelerle apoptozu indüklemek başarılı sonuçlar elde edilmesini sağlamaktadır. Yakın zamanda yapılan çalışmalar göstermiştir ki, NO en az iki mekanizma ile tümör gelişiminde ilgili olabilir. Bunlardan ilki anjiogenezin (damar oluşumu) ve DNA üzerinden serbest radikallerin direkt aktivasyonudur. Angiogenez; solid tümörlerin büyümesi ve metastaz için gerekli olan yeni kan damarlarının oluşumudur. NO üretimi tümör gelişimindeki angiogenezde anahtar rolü oynar (46). Đnsan meme kanseri ve metastazlarının iNOS ile pozitif ilişkisi olduğu bildirilmiştir. Vasküler endotelial büyüme faktör (VEGF) ise endotelial büyüme ve angiogenezi NO aktivitesini stimüle ederek arttıran çok fonksiyonlu bir sitokindir. Yapılan bir çalışmada, serum VEGF ve nitrit-nitrat seviyelerini meme kanserli hastalarda incelemişlerdir. Sonuç olarak serum VEGF seviyesini metastatik hastalıklı kişilerde nonmetastazlılar ve kontrol grubuna göre daha yüksek olarak saptamışlardır. Metastatik hasta grubunda nitrit-nitrat düzeyi ile VEGF arasında pozitif bir ilişki saptamışlardır. Buradan yola çıkarak NO’nun VEGF tarafından stimüle edilen angiogenezde rol alabileceğini belirtmişlerdir (42,44,47). Đkincisi ise, tümör mikro çevresindeki oksijen seviyesi tümör evresi ve tedaviye cevabını belirlemede önemli rol oynar. NO üretimi için de oksijen bir kofaktör olarak gereklidir ve düşük oksijen seviyesine maruz kalma NO üretimini inhibe eder (48,49). Tümör hücrelerindeki hipoksi malign progresyon, metastatik yayılım, KT (kemoterapi) ve RT (radyoterapi)’ ye dirence neden olur (50). Ayrı bir çalışmada; insan meme kanseri hücreleri (MDA-MB-231) ile fare melanom hücreleri (Bl6F10) üzerinde hipoksinin neden olduğu KT direnci ile NO seviyesinin azalması arasında bağlantı tespit etmişlerdir. Ayrıca NO benzeri birer öncü ilaç olan gliseril trinitrat veya diethylamintriamini hipoksi maruziyetinin başında vererek hipoksiye bağlı direnci azaltmışlardır. Tümörlerde oksijen eksikliği cerrahi dışı tedavilerin örneğin konvansiyonel RT ve KT’nin etkinliğini azaltır (51,52). NOS inhibitörleri ile tümör oksinejasyon etkilerinin azaldığı saptanmış. Tümör oksijenizasyonu ile tümör büyümesini 1,65 oranında inhibe etmişlerdir. 23 NO’nun DNA’yı hasarlayarak kanser başlangıcı ile ilişkili olduğu ve ayrıca immün hücrelerin tümörisidal aktivitesi için NO’nun gerekli olduğu bilinmektedir (53,54-57). NO’nun inflamasyon ve konak savunmasında rolü vardır (58,59). Daha yüksek konsantrasyonlarda NO, direkt mikroorganizmalara, tümör hücrelerine ve konakçı hücrelere etki ile sitotoksik etki gösterir (60,61). NO; birçok farklı biyolojik olaylara (vazodilatasyon, nörotransmisyon, immun savunma) ara buluculuk yapan güçlü bir biyolojik moleküldür (62,63). Đleri sürülen çok sayıda kanıta göre; artmış NO üretimi hücrelerde kanser gelişiminde kritik bir rol oynar. Özellikle NO’nun bir izoformu olan indüklenebilen nitrik oksit sentaz (iNOS) enzimi karsinogenez, tümör angiogenezi, kanser progresyonu ve metastaz olaylarına karışır(64,65). 24 3. GEREÇ VE YÖNTEM 3.1. GEREÇLER 3.1.1. Çalışmada Kullanılan Kimyasal Maddeler DMEM F-12 (Dulbecco’s Modified Eagle Medium F-12) (Gibco) FBS (Fetal sığır serumu) (Gibco) Penisilin-streptomisin solüsyonu (Gibco) Rodamin 123 Verapamil Hemoglobin SNAP (S-nitroso-N-acetyl-DL-penicillamine) Doksorubisin P-Gp-PE (Becton Dickinson) CD38-APC (Becton Dickinson) CD34-PeCy7 (Becton Dickinson) MRP-1-FITC (Becton Dickinson) 3.1.2. Çalışmada Kullanılan Kitler Annexin V-Fitc Assay Kit (Becton Dickinson) 3.1.3. Çalışmada Kullanılan Cihazlar Buz Makinası (Hoshizali) Distile Su Cihazı (GFL) Etüv (Sanyo) FACS Flow Cihazı (Becton Dickinson) Laminar Hava Akım Cihazı (Heraus) Otoklav (Hirayama) Santrifüj (Hettich) Sıvı Azot Tankı (34 XT Taylor-Wharton) Ters Mikroskop (Olympus IM) Vorteks (Biosan) Floresan Mikroskobu (Olympus BX51) 25 Spektroflorimetre LS-45 3.1.4. Çalışmada Kullanılan Çözeltiler PBS (Tuz Đçeren Yıkama Eriği): 1,44 g/ltNa2HPO4.2H2 O 0,2 g/l KH2HPO4 8,0 g/l NaCl 0,2 g/l KCl 800 ml dH2 O ile çözülerek pH HCl ile 7,4 olacak şekilde ayarlanarak son hacm 1 lt’ye tamamlanır. 26 3.2. YÖNTEMLER 3.2.1. Hücre Kültür Çalışmaları Çalışmada kullanılan, K562 (insan eritrolösemi hücresi) hücreleri standart kültür koşullarında, %10 FBS ve %1 antibiyotik (100 µg/ml streptomisin ve 100 U/ml penisilin) içeren DMEM F-12 içerisinde kültür şişelerine ekilerek 37 ºC’de %5 CO2’li inkübatörde çoğaltıldı. Ters mikroskopta 2-3 günde bir kontrol edilen hücreler semikonfluent duruma geldiğinde hücre kazıyıcı ile yüzeyden kaldırılarak 15 ml’lik steril tüplere aktarıldı. 3000 devir/dakika’da 5 dakika santrifüjlendikten sonra üst sıvı atıldı ve pelet 1-2 ml taze cDMEM’ de çözüldü. Hücreler her yeni pasajda 1-2x105 hücre/ml olacak şekilde taze cDMEM içeren kültür şişelerine eklendi ve çoğalmaya bırakıldı. Bu şekilde 2-3 günde bir kontrol edilen hücrelerin, belirli aralıklarla yeni pasajları yapıldı. 3.2.2. Hücrelerin Dondurulması ve Çözülmesi Hücre dondurulması işleminde, hücre kazıyıcısı ile kültür şişesi yüzeyinden kazınan hücreler, 15 ml’lik santrifüj tüplerinde 3000 devir/dakika’da 5 dakika santrifüj edildi ve üst sıvıları atıldı. Tüp içerisindeki hücre sayısı 5x105 olacak şekilde ayarlandı. 1/9 oranında DMSO/FBS içindeki soğuğa dayanıklı kryotüplere alınan hücreler 30 dakika buzda bekletildi. Ardından -20 ºC’de 24 saat bekletilerek -80 ºC’ye aktarıldı. Uzun süre saklanması gerekiyorsa sıvı azot tankına konuldu. Hücrelerin çözülmesi işleminde ise -80 ve sıvı nitrojende bulunan hücreler, hızlı bir şekilde 37 ºC’ ye konuldu. Hücrelerin %50’si çözüldüğü zaman 15 ml’lik steril tüplere geçirilip üzerlerine taze cDMEM eklendi. Hücreler, 3000 devir/dakika olarak santrifüj edildi ve supernatan atıldı. Ardından bir kez daha cDMEM ile yıkanarak kültür şişelerine ekildi. 3.2.3. Sitotoksisite deneyi 96 kuyulu kültür plate’lerine 2x104/100 µl hücre olacak şekilde K562 hücreleri ekildi. 24 saat sonra 25, 100, 200, 250, 500, 750 ve 1000 nM konsantrasyonlarında doksorubisin eklendi. 24 saatlik inkübasyonun sonunda kuyu içindeki son konsantrasyonu 0,45 mg/ml olacak şekilde 10 µl MTT solüsyonu ilave edildi. 37 ºC’de mor formazan kristalleri oluşana kadar ortalama 3 saat inkübe edildi. Đnkübasyon 27 sonrası canlı hücrelere giren MTT koyu mavi renkli formazon ürününe dönüştüğü için renk değişimi gözlendi. Son olarak her bir kuyucuğa 100 µl izoprapanol/ HCl çözeltisi koyulup formazon kristallerinin çözülmesi sağlandıktan sonra ELISA okuyucusunda 570 nm’de absorbans değerleri hesaplandı. Sitotoksite düzeyleri aşağıdaki formül ile hesaplandı : 1-Test kuyucuğunun adsorbansı / Kontrol kuyucuğunun adsorbansı x 100 Kontrole göre %50 oranında sitotoksik etki gösteren konsantrasyon, sitotoksik doz olarak kabul edildi. 3.2.4. Hücrelerin Doksorubisin ile Muamele Edilmesi Çalışmada kullanılan doksorubisin, klinikte tedavi amacıyla hastalara verilen bir ilaçtır ve eczaneden temin edilmişitir. Hücrelere verilmeden önce her seferinde taze olarak hazırlandı. Verapamil, saf su ile 5 mg/ml olarak hazırlandı ve +4 ºC’de tutuldu. Doksorubisin başlangıç doz 250 nM olacak şekilde, artan dozlarda K562 hücrelerine eklendi. Her bir doz için hücreler ortalama 2 hafta inkübe edildiler. Bu sürenin sonunda çoğalan hücrelerde doksorubisine karşı direnç gelişti. Tablo 3-2 Doksorubisine karşı direncin geliştiği doz değerleri [Dox (nM)] Hafta sayısı 250 3 330 2 410 2 500 2 580 2 660 2 3.2.5. K562S ve K562D Hücrelerin Antikorlar ile Boyanması Akım sitometri tüpleri içine P-gp-PE, CD38-APC, CD34-PE Cy7 ve MRP-1FITC antikorları hem K562S ve hem de K562D hücreleri için 5 µl olarak konuldu. Ardından tüpler içine 50 µl’de 5x105 hücre eklendi. +4 ºC’de 30 dakika inkübe edildi. Üzerlerine 1 ml PBS eklenerek yıkandı. Analizle FACS Calibur (Becton Dickinson) ile yapıldı. 28 3.2.6. K562S ve K562D Hücrelerinde Rho123 Alımı ve Tutumunun Floresan Mikroskop ile Görüntülenmesi 6’lık platelerdeki her bir kuyuya, 3 ml cDMEM içindeki 5x105 K562S ve K562D hücresi ekilerek gece boyu 37 ºC’de inkübe edildi. Ertesi gün hücrelerin Verapamil ile 1 saat muamele edilmesinin ardından, verapamil varlığında veya yokluğunda Rho123 ile 1 saat daha inkübe edildi. Hücreler PBS ile yıkanarak floresan mikroskopta görüntülendi. 3.2.7. K562S ve K562D Hücrelerinde Rho123 Alımı ve Tutumunun Spektroflorimetre ile Belirlenmesi 6’lık plate’lerdeki her bir kuyuya, 3 ml cDMEM içindeki 5x105 K562S ve K562D hücresi ekilerek gece boyu 37 ºC’de inkübe edildi. Ertesi gün hücrelerin verapamil ile 1 saat muamele edilmesinin ardından, verapamil varlığında veya yokluğunda Rho123 ile 1 saat daha inkübe edildi. Hücreler PBS ile yıkanarak spektroflorimetrede 1 saat boyunca 10’ar dakika aralıklarla ölçüm yapıldı. 3.2.8. K562S ve K562D Hücrelerinde Rho123 Alımı ve Tutumunun Akım Sitometre ile Belirlenmesi 6’lık plate’lerdeki her bir kuyuya, 3 ml cDMEM içindeki 5x105 K562S ve K562D hücresi ekilerek gece boyu 37 ºC’de inkübe edildi. Ertesi gün hücrelerin verapamil ile 1 saat muamele edilmesinin ardından, verapamil varlığında veya yokluğunda Rho123 ile 1 saat daha inkübe edildi. Hücreler PBS ile yıkanarak akım sitometrede belirlenmek üzere tüplere alındı. 3.2.9. K562S ve K562D Hücrelerinde Doksorubusin Varlığında Apoptoz Doksorubisine karşı direnç gelişmiş K562 hücreleri (660 nM) ve duyarlı K562 hücreleri, 33 µM doksorubisin ile 24 saat muamele edildi. Ardından hücreler iki kez soğuk PBS ile yıkanarak Apoptoz Kit ile (Annexin V-Fitc Assay Kit (Becton Dickinson) erken ve geç apoptoz ve hücre canlılıklarına bakıldı. Kısaca, 2x105 hücre 10 µl bağlanma tamponu içine alındı. 5 µl PI ve Annexin V-FITC eklenerek 20 dakika oda ısısında inkübe edildi. Đnkübasyon sonunda tüplerin üzerine 400 µl bağlanma tamponu eklenerek 1 saat içinde akım sitometresinde hücrelerin analizi yapıldı. 29 3.2.10. K562S ve K562D Hücrelerinde NO Vericisi (SNAP) Varlığında Apoptoz Doksorubisine karşı direnç gelişmiş K562 hücreleri (660 nM) ve duyarlı K562 hücreleri, 24 saat NO vericisi SNAP (500 µM) ile muamele edildikten sonra, başta 1 saat verapamil ve ardından doksorubisin (33 µM) ile 24 saat inkübe edildi. Hücreler iki kez soğuk PBS ile yıkanarak Apoptoz Kit ile (Annexin V-Fitc Assay Kit (Becton Dickinson) erken ve geç apoptoz ve hücre canlılıklarına bakıldı. Kısaca, 2x105 hücre 10 µl bağlanma tamponu içine alındı. 5 µl PI ve Annexin V-FITC eklenerek 20 dakika oda sıcaklığında inkübe edildi. Đnkübasyon sonunda tüplerin üzerine 400 µl bağlanma tamponu eklenerek 1 saat içinde akım sitometresinde hücrelerin analizi yapldı. 30 4. BULGULAR 4.1. Doksorubisinin Doz Bağımlı Sitotoksik Etkisi Doksorubisinin K562 hücrelerinde doz-bağımlı sitotoksik etkisi Şekil 4.1’de görülmektedir. Her bir doz için üç kuyu çalışıldı ve deney üç kez tekrar edildi. Elde edilen absorbans değerleri, negatif kontrol olarak belirlenen ve %100 canlılğın olduğu hücre absorbans değerelerinden çıkarılarak elde edildi. IC50 değeri 250 nm olarak bulundu. Şekil 4-1. MTT Testi. K562 hücreleri farklı konsantrayonlardaki doksorubisin ile 24 saat inkübe edildikten sonraki hücre canlılık oranları. Doksorubisinin sitotoksik değeri MTT testi ile belirlendi. 31 4.2. K562D Hücrelerinin Verapamil Varlığında ve Yokluğunda Rho123 ile Boyanması 40x objektif altında rodamin boyamanın ışık mikroskobu ile ardından floresan mikroskop ile aynı alanın görüntüleri Şekil 4.2 A ve B’de verilmektedir. Şekil 4.2 C’de ise 10 mM verapamil eklenmiş ve rodaminsiz ortama çekildikten 2 saat sonraki görüntüsü verilmektedir. Verapamil varlığında rodaminin hücre dışına çıkmadığı verapamilin P-gp kanallarını inhibe ettiği floresan sönümlenmenin bulunmamasından dolayı görülebilmektedir. 100X objektif altında yine aynı alandaki hücrelerin ilk 15 dakika içinde boyanın hücre dışına çıkarak floresan sönümlenme görüntüleri Şekil 4.2 D, E ve F’de gösterilmektedir. 32 Şekil 4-2. K562D hücrelerinin Rho123 varlığında ışık ve floresan mikroskobu görüntüleri. A) K562D hücrelerinin ışık mikroskobu görüntüsü (40x). B) Aynı K562D hücrelerin floresan mikroskobu görüntüsü (40x). C) K562D hücrelerin verapamil varlığında boyayı tutmasının görüntüsü (40x). D) K562D hücrelerinin Rho123 boyası varlığında sönümlenmesi görüntüsü (100x). E) K562D hücrelerinin Rho123 boyası varlığında sönümlenmesi görüntüsü (100x). F) K562D hücrelerinin Rho123 boyası varlığında sönülmenmiş görüntüsü (100x). 33 4.3. K562S ve K562D Hücrelerin P-GP, CD38, CD34 ve MRP-1 Yüzey Belirteçleri ile Boyanması K562 hücrelerinin direnç kazanması sürecinde, kök hücre belirteçlerinden olduğu ifade edilen CD34 ve CD38 anlatımlarında artma olup olamadığı araştırıldı. Aynı zamanda diğer bir çoklu ilaç direnci ile ilişkili protein ailesinden olan MRP-1 yüzey belirtecinin anlatım seviyesine de bakıldı. K562D hücrelerinde öncelikle P-gp anlatım seviyesinin %65 olduğu belirlendi. Ardından CD34 anlatım seviyesinin %7, CD38’in %50 ve MPR-1’in ise %5 olduğu belirlendi. 34 Şekil 4-3. K562D hücrelerinde P-gp, CD34, CD38 ve MRP-1 yüzey belirteçleri ile boyanmış hücrelerin akım sitometresi görüntüleri. Sol kolonlarda, her bir belirtecin negatif kontrolü verilemektedir. A) CD34 belirtecinin anlatımının negatif kontrolu. B) CD34 belirtecinin anlatımı. C) P-gp belirtecinin anlatımının negatif kontrolu. D) P-gp belirtecinin anlatımı. E) CD38 belirtecinin anlatımının negatif kontrolu. F) CD38 belirtecinin anlatımı. G) MRP-1 belirtecinin anlatımının negatif kontrolu. H) MRP-1 belirtecinin anlatımı. 35 4.4. K562S ve K562D Hücrelerin P-gp, CD38, CD34 ve MRP-1 Yüzey Belirteçleri ile Karşılaştırılmalı Boyanması Şekil 4-4. K562D hücrelerinde P-gp, CD34, CD38 ve MRP-1 yüzey belirteçlerinin karşılaştırmalı akım sitometresi görüntüleri. P-glikoprotein anlatımı olan hücrelerin yaklaşık %18,04’inde CD34 anlatımı da, %16,49’unda CD38 anlatımı da, %15,53’nde MRP-1 anlatımı da bulunmaktadır. 36 4.5. K562D Hücrelerinde Rho123 Alımı ve Tutumunun Spektroflorimetre ile Belirlenmesi K562D hücrelerinde rodamin boyasının hücre dışına sızma deneyleri verapamil varlığında ve yokluğunda spektroflorimetrik ölçümler ile de belirlendi. Yöntemler bölümünde de ifade edildiği gibi hücreler bir saat rodamin ile inkübe edildikten sonra, rodaminsiz cDMEM içine alındılar. Eksitasyon dalga boyu 460 nm, emisyon dalga boyu ise 520 nm olacak şekilde spektroflorimetrik ölçümler alındı. Verapamil varlığında rodamin boyasının hücre dışına daha az sızdığı, verapamilin P-gp kanallarını inhibe ettiği gösterildi. Şekil 4-5. K562D hücrelerinde verapamil varlığında (■) ve yokluğunda (♦) rodaminin hücre dışına sızmasının spektroflorimetrik ölçümleri. K562D hücrelerinde varapamilin olmadığı durumlarda hızlı bir şekilde floresan yoğunluğunda düşme gözlendi. 37 4.6. K562D Hücrelerinde Rho123 Alımı ve Tutumunun Akım Sitometresi ile Belirlenmesi K562D hücrelerdeki P-gp substratı olarak bilinen rodamin boyası ve P-gp’nin inhibitörü olan verapamil varlığında rodaminin hücre tarafından tutulumunu veya hücre dışına salınımı Şekil 4.6’da görülmektedir. Hücreler rodaminsiz ortama alındıktan sonra iki saat PBS içinde inkübe edilmişler, ardından analizler gerçekleştirilmiştir. Verapamil varlığında rodaminin hücre içinde tutulduğu için grafik tepelerindeki kayma ve bununla birlikte floresan şiddette artma görülmektedir. Bu analizlerin sonunda, verapamilin bulunmadığı K562D hücrelerindeki rodaminin, iki saatin sonunda hücre dışına sızıntıdan dolayı ortalama floresans yoğunluğu 1112, P-gp inhibitörü verapamil varlığındaki hücrelerin ortalama floresans yoğunluğu ise 3233 olarak bulunmuştur. Bu çalışma K562S hücreleri ile tekrarlandığında, verapamil varlığında ve yokluğunda rodaminin hücre dışına sızıntısı görülmemiştir (Şekil 4-7). Şekil 4-6. K562D hücrelerinin rodamin ve verapamil varlığında inkübasyonları sonrasındaki akım sitometri analizleri. Mor renkli histogram negatif kontrolü, yeşil renkli histogram rodamin varlğında ve mavi renkli histogram ise rodamin ve verapamil varlığındaki grafikleri göstermektedir. Elde edilen değerler 2 saat inkübasyonun sonunda alınan değerlerdir. 38 K562D hücrelerinin rodamin varlığında ölçülen floresan değerleri. Marker All M1 Left, Right 1, 9910 43, 8738 Events 5851 5715 %Gated 100,00 97,68 %Total 44,85 43,81 Mean 1311,95 1112,77 K562D hücrelerin rodamin ve verapamil varlığında ölçülen ortalama floresan değerleri. Marker All M1 Left, Right 1, 9910 43, 8738 Events 5285 5160 %Gated 100,00 97,63 %Total 41,87 40,88 Mean 3380,41 3233,43 4.7. K562S Hücrelerinde Rho123 Alımı ve Tutumunun Akım Sitometresi ile Belirlenmesi Şekil 4-7. K562S hücrelerinin rodamin ve verapamil varlığında inkübasyonları. Mor renkli histogram negatif kontrolü, yeşil renkli histogram rodamin varlığında ve mavi renkli histogram ise rodamin ve verapamil varlığındaki grafikleri göstermektedir. Elde edilen değerler 2 saat inkübasyonun sonunda alınan değerlerdir. 39 K562S hücrelerinin rodamin varlığında ölçülen floresan değerleri. Marker All M1 Left, Right 1, 9910 12, 9910 Events 8922 8922 %Gated 100,00 100,00 %Total 64,76 64,76 Mean 1909,13 1909,13 K562S hücrelerin rodamin ve verapamil varlığında ölçülen ortalama floresan değerleri. Marker All M1 Left, Right 1, 9910 12, 9910 Events 8521 8521 %Gated 100,00 100,00 %Total 60,39 60,39 Mean 1761,14 1761,14 4.8. K562S ve K562D Hücrelerinin NO Varlığında Apoptoz Analizleri Şekil 4-8. K562 S veK562D hücrelerinin NO varlığında apoptoz görüntüleri. A)K562S hücreleri ve SNAP .B) K562D hücreler ve SNAP. SNAP’in 500 µΜ olarak kullanılan konsantrasyon değeri, literatür bilgileri ile elde edilmiştir. Bu dozun apoptotik doz olup olmadığını belirlemek için K562S ve K562D hücreleri 24 saat NO vericisi SNAP ile inkübe edildiler ve Annexin V ile apoptoz analizleri yapıldı. Bu analizler sonucunda 500 µΜ SNAP varlığında K562S ve K562D hücrelerinde apoptoza girişlerinde farklılıklar gözlendi. K562S hücrelerinin aynı konsantrasyondaki apoptoz değeri %90 iken, K562D hücrelerinin %61 oldu. 40 4.9. K562D Hücrelerinin NO, Doksorubisin ve Verapamil Varlığında Akım Sitometre ile Apoptoz Analizleri Şekil 4-9. K562D hücrelerinin NO, doksorubisin ve verapamil varlığında apoptoz görüntüleri. A) K562D hücreler ve 33 µΜ doksorubisin. D)K562D hücreler ve 33 µΜ doksorubisin ve 500 µΜ SNAP. B) K562D hücreler 33 µΜ doksorubisin 10 mM verapamil. C) K562D hücreler 33 µΜ doksorubisin, 500 µΜ SNAP ve 10 mM verapamil. 41 4.10. K562S Hücrelerinin NO, doksorubisin ve Verapamil Varlığında Akım Sitometre ile Apoptoz Analizleri Şekil 4-10. K562S hücrelerinin NO, doksorubisin ve verapamil varlığında apoptoz görüntüleri. E) K562S hücreler ve 33 µΜ doksorubisin. G) K562S hücreler ve 33 Μm doksorubisin ve 500 µΜ SNAP. F) K562S hücreler 33 µΜ doksorubisin ve 10 mM verapamil. H) K562D hücreler 33 µΜ doksorubisin, 500 µΜ SNAP ve 10 mM verapamil. Hem K562S hem de K562D hücreleri ilk 24 saat NO vericisi SNAP ile ardından 33 µΜ doksorubisin ile 24 saat muamele edildikten sonra apoptoz analizleri yapıldı. Bu analizler sonucunda, K562S hücrelerinde SNAP apoptozu indüklerken, K562D hücrelerinde SNAP varlığında ise apoptoz değerlerinin gerilediği gösterilmiştir. 42 5. TARTIŞMA Kemoterapi, kanser tedavisinde uygulanan en yaygın ve etkili yöntemdir. Ancak, kemoterapi süresince, hastaların tedaviye cevap vermemesi veya tedavi sonrası kanserin tekrarlaması sıklıkla görülen bir durumdur. Kanser tedavisinde başarıya ulaşmak için genellikle birden fazla antikanser ilacı uygulanmaktadır. Ancak, sonradan kazanılan ya da tedavi öncesi kişide var olan ilaç dirençliliği, kanser kemoterapisinde başarıya ulaşmayı büyük ölçüde engellemektedir. Bu çoklu ilaç direnci ilacın hücre içine girişinde azalma veya hücre dışına atma işlevinde artış, ilaç-hedef ilişkisinde azalma, veya ilaç dağılımında değişiklik şeklinde gözlenebilmektedir. Artırılan ilaç dozları ise hastalarda görülen yan etkilerin artmasına neden olmaktadır. Ayrıca dirençlilik nedeniyle zaman ve ilaç kaybı olmakta, hastaların tedavisi zorlaşmaktadır. Bu çalışmada, insan eritrolösemi kanser hücre soyu, bir antrasiklin türevi antibiyotik olan ve kemoterapide kullanılan doksorubisine karşı dirençli hale getirildi. Başta uygun doz değeri için MTT testi yapıldı. Bu testin sonunda IC50 değeri 250 nM olarak bulundu. Bu değerdeki konsantrasyon ile K562 hücrelerinin dirençli hale getirilmesi deneylerine başlandı. Her bir konsantrasyon artışı için haftada iki kez yapılan pasaj ile yaklaşık 2-3 hafta belirlenen dozlarda inkübe edildi. Ardından Pglikoprotein anlatımı akım sitometresi ile analiz edildi. Bu çalışmada elde edilen tüm bulgular %70 P-glikoprotein anlatımı varlığında olan bulgulardır. Hücreler bundan sonra aynı dozda yani 660 nM’deki doksorubisin ile inkübe edilmeye devam edildi. K562D’li hücreler ile öncelikle floresan mikroskobunda, P-gp’nin substratı olan rodamin boyası ve onun inhibitörü varapamil varlığında, hücre içinde ilaç tutulumu incelendi. Boyama sırasında kullanılan rodamin ve verapamil konsantrasyonları, literatür sayesinde elde edilen değerlerdir. Elde edilen sonuçlara göre, ortamda verapamilin olmadığı durumlarda, rodaminin ilk onbeş dakika içinde büyük oranda hücre dışına çıktığını yani hücrenin sönümlendiği görüldü (Şekil 4-2 d,e,f). Verapamil varlığında ise aradan 2 saat geçmesine rağmen P-glikoprotein kanalları inhibe olduğu için rodamin hücre içinde kalabildi, sönümlenme gözlenmedi (Şekil 4-2 c). Floresan mikroskop bulgularını desteklemek üzere, spektroflorimetrede yine verapamil varlığında ve yokluğunda rodaminin hücre içindeki tululumu ve hücre dışına çıkışını gösterecek ölçümler yapıldı. Bu ölçümlerde hücrelerin dışarı saldığı rodamin değerleri, belli zaman aralıklarında hücrelerin santrifüj ile çöktürüldükten sonra supernatantın 43 ölçülmesi sayesinde elde edildi. K562D hücrelerinde varapamilin olmadığı durumlarda hızlı bir şekilde floresan yoğunluğunda düşme gözlendi (Şekil 4-5). Floresan mikroskobunda yapılan gözlemler ve spektroflorimetrede yapılan ölçümler K562S hücreleri ile de tekrarlanmış, verapamil varlığında ve yokluğunda anlamlı bir fark gözlenememiştir. Bu deneylerin son ayağında akım sitometresinde yapılan analizler vardır. K562D hücrelerde verapamil varlığında floresan yoğunluğun oldukça yüksek olduğu belirlenmiş, verapamilin P-glikoprotein inhibitörü olmasından dolayı ilacın hücre dışına salınımını engellediği bu çalışmada da gösterilmiştir (Şekil 4-6). Aynı çalışma doksorubisine duyarlı hücreler ile yapıldığında, verapamil varlığında ve yokluğunda floresan yoğunlukta bir fark gözlenememiştir (Şekil 4-7). Tüm bu bulgular varlığında, doksorubisine dirençli hücrelerin P-gp anlatımından dolayı substratı olan rodamininin hücre içinde tutulamadığı bu kanallardan dışarı salındığı ancak P-gp inhibitörü olan verapamil varlığında hücre içinde kaldığı gösterilmiştir. Çalışmadaki bulgular bu konu üzerinde verilen literatür bilgisi ile uygunluk göstermektedir. Çoklu ilaç direnci ile ilişkilendirilen diğer bir protein ailesi olan MRP-1’in akım sitometresi ile yapılan analizleri sonucunda anlatımının duyarlı hücrelere göre %5 arttığı belirlenmiş bu seviyenin düşük olduğu düşünülerek substratı olan Fluo-3 ve inhibitörü olan MK571 kullanılarak hücre içinde ilacın hücre içinde tutulum deneyleri yapılmamıştır. Bu çalışmada P-gp anlatımının yanında, kök hücre ve kanser kök hücre yüzey belirteçlerinden olan CD34 ve CD38 anlatımlarının, doksorubisine direnç geliştiği süreçte değişiklik olup olmadığı sorusuna yanıt arandı. Son yıllarda kanser kök hücre denilen (KKH), kanseri başlatan küçük bir grup hücrenin var olduğu ve bu hücre grubunun kendi-kendilerini yenileme ve farklılaşma özelliğine sahip olduğu gösterilmiştir. Kanser kök hücreleri veya kanseri başlatan hücreler olarak bilinen kanser öncü hücrelerinin, kanserin başlaması, ilerlemesi ve klasik tedavi şekillerine direnç göstermesinden sorumludur. Klasik tedaviler, tedavinin başlangıç aşamasında etkilidir, fakat kanserin invaziv veya metastatik olarak ilerlemesi durumunda genellikle tedaviye dirençlidir ve relaps gözlenmektedir ki ölümle sonuçlanır. Kanserin tekrarlaması kanser hücrelerindeki genetik ve/veya epigenetik değişikliklerin birikimi ile ilişkilidir. Bu genetik ve/veya epigenetik değişiklikler kontrolsüz hücre çoğalmasına, hücrenin yaşaması ve invazyonuna olduğu kadar klinik tedaviye dirençlilikten de sorumludurlar. Akım sitometresi kullanarak KKH’lerini, kök hücreler ile olan benzerliklerinden de yola çıkılarak izole etmek mümkündür. Lösemik hücrelerin en karakteristik özelliği 44 CD34+CD38- fenotipine sahip hücreleri içermesidir. Yapılan çalışmalar sonucunda, bu hücre tiplerinin NOD/SCID farelere verildiklerinde onlarda da kanser başlattığı için KKH olma ihtimali yüksek olduğu gösterilmiştir. K562S hücrelerde CD34 ve CD38 anlatımlarının olmadığı hem literatür sonuçlarında hem de bu yapılan analizler sonucunda gösterilmiştir. Ancak, P-gp anlatımının ilaç direncine paralel olarak artmasıyla birlikte CD34 ve CD38 anlatımı da artmıştır. CD34 anlatımı, P-gp anlatımı olan hücrelerin yaklaşık %7’sinde, CD38 anlatımı ise P-gp anlatımı olan hücrelerin ise yaklaşık %50’sinde vardır. Sonuçta doksorubisine karşı direnç kazanan hücrelerin ilacı dışarı salarak verdiği cevabın yanında aynı zamanda KKH özelliklerini de kazanıp kazanmadığı önem kazanmaktadır. Daha fazla çalışmalara ihtiyaç duyulmaktadır. Doksorubisin genel olarak kullanımı çok yaygın olan bir kemoterapik ilaçtır. Bununla birlikte hem P-gp’nin hem de MRP’lerin substratı olduğu için etkisi kullanım boyunca azalmaktadır. En önemli özelliklerinden bir tanesi de NO sentezini arttırmasıdır. NO, birçok fizyolojik ve patolojik şartları içeren çok fonksiyonlu hücre içi bir habercidir. Apotozda NO’in rolünün araştırılması ile ilgili yapılan çalışmalarda molekülün pro- veya anti-apoptotik etkiye sahip olabileceğini gösteren bulgular elde edilmiştir (66,67,68,69). Lösemi ve lenfoma hastalarından alınan kanlar ile yapılan deneyler sonunda NO’in bu hücreler üzerine stotoksik etkisi olduğu gösterilmiştir (70). Bu da çeşitli hematolojik malignitelerde NO vericilerini kullanma ihtimalini ortaya çıkarmaktadır. Aynı zamanda NO sentezinin azalması çoklu ilaç direnci mekanizması fenotiplerinin oluşumunun değişmesine ve NO üretiminin başlamasıyla bu fenotiplerin geri döndürülebileceğini gösteren bir çalışma da bulunmaktadır (71). Son aşamada, NO molekülünün ilaç direnci gelişmiş hücrelerdeki apoptoz üzerine etkisine bakıldı. Öncelikle hem K562S hem de K562D hücreleri ilk 24 saat NO vericisi SNAP ile inkübe edildi ve doksorubisine dirençli hücrelerin NO vericisi SNAP’e de dirençli olduğu apoptoz analizlerine bakarak değerlendirildi. Hem K562S hem de K562D hücreleri ilk 24 saat NO vericisi SNAP ile ardından 33 µΜ doksorubisin ile 24 saat muamele edildikten sonra apoptoz analizleri yapıldı. Bu analizler sonucunda, K562S hücrelerinde SNAP apoptozu indüklerken, K562D hücrelerinde SNAP varlığında ise apoptoz değerlerinin ortalama gerilediği belirlenmiştir. Dirençli ve duyarlı K562 hücrelerinin NO varlığında apoptoza gidişlerinde farklılıklarının olması hücre içi NO seviyeleriyle ilişkili olabileceğini düşündürmektedir. 45 Son yıllarda yapılan çalışmalarda, antiapoptotik etkinin cGMP’deki artma ile, apoptotik proteinlerin ve NF-κB transkripsiyon faktörlerin aktivasyonu ile olabileceği düşünülmektedir. Bu etkilerin hücreden hücreye değişibileceği de ifade edilmektedir. Örneğin PC12 ve U937 karaciğer hücrelerinde, NO’in antiapoptotik etkisi sitokrom c salınımı, seramid oluşumu ve kaspas aktivasyonu ile birliktedir. Aynı zamanda, NO’in antikanser ilaçların çalışma mekanizmasına müdahele ettiği ve ilacın hücre dışına çıkışını inhibe ettiği için doksorubisine karşı oluşan direnci geri döndürdüğü gösterilmiştir. Ancak doksorubisine karşı direnç gelişmiş hücrelerde bu sürecin nasıl işlediği konusu hakkında henüz çalışılmamıştır. Bu tez çalışmasında elde edilen veriler ile ilaç direnci üzerine NO’in etkisinin anlaşılmasında faydalı olacağı düşünülmektedir. 46 KAYNAKLAR 1) Hirose M, Hosoi E, Hamano S, Jalili A. Multi drug resistance in hematological malignancy. J Med Invest.2003; 50(3-4):126-135. 2) Gottesman MM, Fojo T, Bates SE. Multidrug resistance in cancer: role of ATPdependent transporters. Nat Rev Cancer.2002; 2: 48–58. 3) Fornari FA, Randolph JK, Yalowich JC, Ritke MK, Gewirtz DA. Interference by doxorubicin with DNA unwinding in MCF-7 breast tumor cells. Molecular Pharmacology.1994; 45: 649–656. 4) Boo S, Kopecka J, Brusa D, Gazzano E, Matera L, Ghigo D, Bosia A, Riganti C. iNOS activity is necessary for the cytotoxic and immunogenic effects of doxorubicin in human colon cancer cells. Mol Cancer. 2009; 5:8:108. 5) Mealey, K.L. Therapeutic Implications of the MDR-1 Gene. J. Vet. Pharmacol. Therap. 2004; 27: 257-264 6) Büyükbingöl E. Farmasötik Kimya-2 Ders Notları.2009;1-9 Erişim: 12.6.2013, http://medisinalkimya.net/jlms/docs/0007 pdf. 7) Kolb JP. Mechanisms involved in the pro- and anti-apoptotic role of NO in human leukemia. Leukemia.2000; 14: 1685-94. 8) Bouchier Hayes L. Lartigue L. Newmeyer D. Mitochondria pharmacological manipulation of cell death. Cancer 2005;115 (10):2640. 9) Lüleyap Ü. Moleküler genetiğin esasları Adana: Nobel;2008; 1: 1-437. 10) Kerr J.F.R. Wyllie A.H., Currie A.R. Cell death: the significance of apoptosis. Int Rev Cytol.1980; 68: 251-306. 11) Fulda S. Debatin KM. Extrinsic versus intrinsic apoptosis pathways in anticancer chemotherapy. Oncogene.2006; 25: 4798-4811. 12) Onat H.(2013).Kanser Kemoterapi El Kitabı.(8.baskı). Çukuova. Nobel.1-875. 13) Coley HM. Mechanisms and strategies to overcome chemotherapy resistance in metastatic breast cancer. Cancer Treat Rev. 2008; 34(4):378-90. 14) K.J. Patel. Distribution of anti-cancer drugs within solid tumors and normal tissues its potential for modification to improve therapeutic index. (Thesis) 2011;13-22. 15) Schinkel AH, Jonker JW. Mammalian drug efflux transporters of the ATP binding cassette (ABC) family: an overview. Adv Drug Deliv Rev. 2003; 55: 3-29. 47 16) Lin JH, Yamazaki M. Role of P-glycoprotein in pharmacokinetics: clinical implications. Clin Pharmacokinet. 2003; 42: 59-98. 17) Ravna AW, Sager G. Molecular modeling studies of ABC transporters involved in multidrug resistance. Mini Rev Med Chem. 2009; 9: 186-193. 18) Padowski JM, Pollack GM. Pharmacokinetic and pharmacodynamic implications of P-glycoprotein modulation. Methods Mol Biol. 2010; 596: 359-384. 19) Zhang Y, Benet LZ. The gut as a barrier to drug absorption: combined role of cytochrome P450 3A and P-glycoprotein. Clin Pharmacokinet. 2001; 40: 159-168. 20) Klaassen CD, Aleksunes LM. Xenobiotic, bile acid, and cholesterol transporters: function and regulation. Pharmacol Rev. 2010; 62: 1-96. 21) Del Amo EM, Heikkinen AT, Mönkkönen J. In vitro-in vivo correlation in Pglycoprotein mediated transport in intestinal absorption. Eur J Pharm Sci. 2009; 36: 200-211. 22) Juliano RL, Ling Toxicol Lett. 2005V. A surface glycoprotein modulating drug permeability in Chinese hamster ovary cell mutants. Biochim Biophys Acta. 1976; 455: 152-162. 23) Fromm MF. The influence of MDR1 polymorphisms on P-glycoprotein expression and function in humans. Adv Drug Deliv Rev. 2002; 54: 1295-1310. 24) Balayssac D. Authier N. Cayre A. Coudore F. Does inhibition of P-glycoprotein lead to drug-drug interactions? Toxicol Lett. 2005; 156: 319-329. 25) Huls M, Russel FG, Masereeuw R. The role of ATP binding cassette transporters in tissue defense and organ regeneration. J Pharmacol Exp Ther. 2009; 328: 3-9. 26) Fromm MF. Importance of P-glycoprotein at blood-tissue barriers. Trends Pharmacol Sci. 2004; 25: 423-429. 27) Marchetti S, Mazzanti R, Beijnen JH, Schellens JH. Concise review: Clinical relevance of drug-drug and herb-drug interactions mediated by the ABC transporter ABCB1 (MDR1, P-glycoprotein). Oncologist. 2007; 12: 927-941. 28) Kunta JR, Sinko PJ. Intestinal drug transporters: in vivo function and clinical importance. Curr Drug Metab. 2004; 5: 109-124. 29) Aszalos A. Drug-drug interactions affected by the transporter protein, Pglycoprotein (ABCB1, MDR1) II. Clinical aspects. Drug Discov Today 2007; 12: 838843. 48 30) Stavrovskaya AA, Stromskaya TP. Transport proteins of the ABC family and multidrug resistance of tumor cells. Biochemistry (Mosc) 2008; 73: 592-604. 31) Takano M, Yumoto R, Murakami T. Expression and function of efflux drug transporters in the intestine. Pharmacol Ther. 2006; 109: 137-161. 32) Zhou SF. Structure, function and regulation of P-glycoprotein and its clinical relevance in drug disposition. Xenobiotica 2008; 38: 802-832. 33) Lee CH. Reversing agents for ATP-binding cassette drug transporters. Methods Mol Biol. 2010; 596: 325-340. 34) Vaalburg W, Hendrikse NH, Elsinga PH, Bart J, van Waarde A. P-glycoprotein activity and biological response. Toxicol Appl Pharmacol. 2005; 207:257-260. 35) Yuan H, Li X, Wu J, Li J, Qu X, Xu W, Tang W. Strategies to overcome or circumvent P-glycoprotein mediated multidrug resistance. Curr Med Chem. 2008; 15: 470-476. 36) Morjani H, Madoulet C. Immunosuppressors as multidrug resistance reversal agents. Methods Mol Biol. 2010; 596:433-446. 37) Đmamoğu G.D. (2006) Pelvik bölgeye radyoterapi uygulanan serviks kanserli hastalarda oluşan yan etkilerle serum nitrik oksit seviyesi arasındaki ilişki. (Tez). Dr. Lütfi Kırdar Kartal Eğitim ve Araştırma Hastanesi, Đstanbul. 38) Güray A, Samancı N, Ovalı F, Dağoğlu T. Nitrik Oksit Fizyolojisi ve Klinik Önemi. Türkiye Klinikleri Tıp Bilimleri Dergisi 1997; 17(2):115-9 39) Özkan M, Yüksekol Đ. Türk Toraks Dergisi 2003;4(1):088-094. 40) Martin J H J, Alalami O, Van den Berg H W. Reduced expression of endothelial and inducible nitric oxide synthase in a human breast cancer cell line which has acquired estrogen independence. Cancer Lett. 1999; 144: 65–74. 41) MacRitchie A N. Jun S S. Chen Z, German Z. Yuhanna IS. Sherman TS. Estrogen up regulates endothelial nitric oxide synthase gene expression in fetal pulmonary artery endothelium. Circ Res. 1997; 81: 355–362. 42) Plate K H. Breier G. Millauer B. Ullrich A. Risau W. Up-regulated of vascular endothelial growth factorand its cognate receptors in a rat glioma model of tumor angiogenesis. Cancer Res. 1993; 53: 5822–5827. 43) Ku D D, Zaleski J K, Liu S. Brock TA. Vascular endothelial growth factors induced EDRF dependent relaxation in coronary arteries. Am J Physiol. 1993; 265:586–592. 49 44) Coşkun U. Gunel N. Sancak B. Gunel U. Onuk E. Bayram O. ve ark. Significance of serum vaskuler endothelial growth factor, insulin- like growth factor-1 levels and nitric oxide activitiy in breast cancer patients. Breast. 2003; 12(2): 104-10. 45) Saydam G. Aydın HH. Đnvolvement of protein phosphatase 2A in interferon alfa2b inducedapoptosis in K562 human CML cells. Leukemia research. 2003; 27: 709-717. 46) Ohshima H, Baithch H. Chronic infections and inflammatory process as cancer risk factors: possible role of nitric oxide in carcinogenesis. Mutat Res. 1994; 305:253–264. 47) Brown JM, Giaccia AJ. The unique physiology of solid tumors: opportunities (and problems) for cancer therapy. Cancer Res. 1998; 58: 1408–16. 48) Whorton AR. Simonds DB. Piantadosi CA. Regulation of nitric oxide synthesis by oxygen in vascular endothelial cells. Am J Physiol. 1997; 272:1161–6. 49) McCormick CC, Li WP, Calero M. Oxygen tension limits nitric oxide synthesis by activated macrophages. Biochem J. 2000; 350(3): 709–16. 50) Matthews NE, Adams MA, Maxell LR. Nitric oxide-mediated regulation of chemosensitivity in cancer cells. J Natl Cancer Inst. 2001; 93(24): 1879-85. 51) Vaupel P, Kallinowski F, Okunieff P. Blood flow, oxygen and nutrient supply, and metabolic microenvironment of human tumors: A review. Cancer Res.1989; 49: 6449– 6465. 52) Kimura H, Braun RD, Ong ET. Fluctuations in red cell flux in tumor microvessels can lead to transient hypoxia and reoxygenation in tumor parenchyma. Cancer Res. 1996; 56: 5522–5528. 53) Wink DA, Vodovotz Y, Laval J. The multifaceted roles of nitric oxide in cancer. Carcinogenesis 1998; 19: 711-721. 54) Das UN. Fırat Üniversitesi Sağlık Bil. Dergisi. A radical approach to cancer. Med Sci Monit 2002; 8: 79-92. 55) Tozer GM, Everett SA. Nitric oxide in tumor biology and cancer therapy. Clin Oncol. 1997; 9: 357–364. 56) Seçkin D. Onur R.Đlhan N. Prostat Kanser ve Benign Prostat Hiperplazi Hastalarda Plazma Vasküler Endotel Büyüme Faktörü, Oksidatif Stres Ve Nitrik Oksit Đlişkisi. Fırat Üniversitesi Sağlık Bil. Dergisi 2005; 19(4): 277-281. 57) Wamvakas S, Schmidt HHHW. Just say NO to cancer? J Natl Cancer Inst. 1997; 89: 406-407. 50 58) Adams MA. Maxwell LR. Goftoni TE. Graham CH. Nitric Oxide-Mediated Regulation of Chemosensitivity in Cancer Cells. Journal of the National Cancer Institute 2001; 93(24):1879-85. 59) Vanhoutte PM. Endothelium and control of vascular function: state of the art lecture. Hypertension. 1989; 13: 658–667. 60) Law M. Radiation-induced vascular injury and its relation to late effects in normal tissue. Adv Radiat Biol. 1981; 9: 37–73. 61) Sugihara T. Hattori Y. Yamamoto Y. Qi F. Ichikawa R. Sato A. ve ark. Preferential Impairment of Nitric Oxide–Mediated Endothelium-Dependent Relaxation in Human Cervical Arteries After Irradiation. Circulation 1999; 100: 635-641. 62) Assreuy J, Cunha FQ, Epperlein M, Noronha-Dutra A, O'Donnell CA, Liew FY, Moncada S. Production of nitric oxide and superoxide by activated macrophages and killing of Leishmania major. Eur J Immunol. 1994; 24: 672-6. 63) Moncada S, Higgs EA. Molecular mechanisms and therapeutic strategies related to nitric oxide. FASEB J 1995; 9: 1319–1330. 64) Lala PK. Significance of nitric oxide in carcinogenesis, tumor progression and cancer therapy. Cancer Metastasis Rev. 1998; 17: 1–6. 65) Ambs S. Merriam WG. Ogunfusika MO. Bennett WP. Ishibe N. Hussain SP. P53 and vascular endothelial growth factor regulate tumor growth of NOS 2-expressing human carcinoma cells. Nat Med. 1998; 4: 1371–1376. 66) Wink DA. Mitchell JB. Chemical biology of nitric oxide: insights into regulatory, cytotoxic, and cytoprotective mechanisms of nitric oxide. Free Radical Biol Med.1998; 25: 34-56. 67) Moulder JE. Rockwell S. Tumor hypoxia: its impact on cancer therapy. Cancer Metastasis. Rev. 1987; 5(4): 313–41. 68) Blaise G. Gauvin D. Gangal M. and Authier S. Nitric oxide, cell signaling and cell death. Toxicology 2005; 208: 177-92. 69) Filep JG Baron C. Lachance S. Perreault C and Chan JS. Involvement of nitric oxide in oxide in target-cell lysis and DNA fragmentation induced by murine natural killer cells. Blood.1996; 87: 5136-43. 70) Tsumori M. Tanaka J.Koshimura K. Kawaguchi M. Murakami Y. and Kato Y. Cytotoxic effect of nitric oxide on human hematological malignant cells. Acta Biochim Pol.2002; 139-44. 51 71) Riganti C. Miraglia E. Viarisio D. Costamagna C. Pescarmona G. and Ghigo D. Nitric oxide reverts the resistance to doxorubicin in human colon cancer cells by inhibiting the drug effux. Cancer Res. 2005; 65: 516-25. 52 ÖZGEÇMĐŞ Kişisel Bilgiler Adı Sibel Soyadı Ülkü Doğ.Yeri Đstanbul Doğ.Tar. 08.11.1977 Uyruğu T.C TC Kim No 16366293826 Email Sibelulku77@gmail.com Tel 05053123977 Eğitim Düzeyi Mezun Olduğu Kurumun Adı Mez. Yılı Doktora Yük.Lis. Lisans Trakya Üniversitesi-TIP Fakültesi 2002 Lise Sırrı Yırcalı Anadolu Lisesi-Balıkesir 1995 Đş Deneyimi (Sondan geçmişe doğru sıralayın) Görevi 1. Pratisyen Hekim Kurum Süre (Yıl - Yıl) Sağlık Bakanlığı 2003- 2013 2. - 3. - Yabancı Okuduğunu Dilleri Anlama* Đngilizce iyi Konuşma* Yazma* iyi *Çok iyi, iyi, orta, zayıf olarak değerlendirin iyi KPDS/ÜDS (Diğer) Puanı Puanı 51 53 Sayısal LES Puanı Eşit Ağırlık Sözel 60 (Diğer) Puanı Bilgisayar Bilgisi Program Kullanma becerisi Microsoft Office 07 Đyi Yayınları/Tebligleri Sertifikaları/Ödülleri Özel Đlgi Alanları (Hobileri): Yüzmek, Müzik dinlemek