T.C.
TRAKYA ÜNİVERSİTESİ
TIP FAKÜLTESİ
RADYASYON ONKOLOJİSİ
ANABİLİM DALI
Tez Yöneticisi:
Yrd. Doç. Dr. H. Murat ÇALOĞLU
RADYOTERAPİNİN KALP ÜZERİNE OLUŞTURDUĞU
KARDİYAK HASARI ÖNLEMEDE L-KARNİTİN
ETKİNLİĞİNİN AMİFOSTİN İLE
KARŞILAŞTIRILMASI
(Uzmanlık Tezi)
Dr. Kamuran İBİŞ
EDİRNE – 2008
TEŞEKKÜR
Uzmanlık eğitimim süresince mesleki bilgi ve
deneyimimi arttırmamda bana önder olan değerli
hocalarım; tez danışmanım Yrd. Doç. Dr. H. Murat
Çaloğlu’na, Radyasyon Onkolojisi A.D. Başkanı Doç.
Dr. Zafer Koçak’a, Doç. Dr. M. Cem Uzal’a, Yrd. Doç.
Dr. Vuslat Yürüt Çaloğlu’na, Yrd. Doç. Dr. Ruşen Coşar
Alas’a,
Yrd.
Doç.
Dr.
Mert
Saynak’a;
tezimin
hazırlanmasında emeği geçen Kardiyoloji A.D. Başkanı
Prof. Dr. Armağan Altun’a, Patoloji A.D.’dan Yrd. Doç.
Dr. Fulya Öz Puyan’a, Radyofizik Uzm. Fadime
Alkaya’ya, Vet. Hek. Ziya Çukur’a, Dr. Gülden Angın’a
ve birlikte çalışmaktan keyif aldığım tüm asistan
arkadaşlarım ile çalışma ekibimize teşekkür ederim.
SİMGE VE KISALTMALAR
ALC
: Acetyl-L-Carnitine (Asetil-L-karnitin)
ALP
: Alkaline Phoshatase (Alkalen Fosfataz)
ALT
: Alanin Aminotransferaz
AMF
: Amifostin
AST
: Aspartat Aminotransferaz
cGy
: Centi-Gray (Santi-Gray)
DNA
: Dezoksiribonükleik asit
EKG
: Elektrokardiyografi
EKO
: Ekokardiyografi
GGTP
: Gama Glutamil Transpeptidaz
Gy
: Gray
İV
: İntravenöz
İP
: İntraperitoneal
İM
: İntramüsküler
KAR
: Karnitin
KT
: Kemoterapi
PLC
: Propionyl-L-Carnitine (Propionil-L-karnitin)
RBKH
: Radyasyona Bağlı Kalp Hastalığı
RNA
: Ribonükleik asit
RT
: Radyoterapi
OSR
: Oksijen Serbest Radikalleri
SC
: Subcutaneous (Subkutanöz)
SF
: Serum Fizyolojik
SR
: Serbest Radikal
TD
: Tolerans Dozu
İÇİNDEKİLER
Sayfa
GİRİŞ VE AMAÇ .................................................................................................... 1
GENEL BİLGİLER ................................................................................................ 3
KALBİN ANATOMİSİ ..................................................................................... 3
NORMAL ELEKTROKARDİYOGRAFİNİN KARAKTERİSTİKLERİ ..... 5
İYONİZAN RADYASYONUN KALP ÜZERİNE ETKİLERİ, TANI VE
TEDAVİ............................................................................................................. 5
AMİFOSTİN...................................................................................................... 14
KARNİTİN ........................................................................................................ 16
GEREÇ VE YÖNTEMLER ................................................................................. 20
BULGULAR .............................................................................................................. 26
TARTIŞMA ............................................................................................................... 43
SONUÇLAR .............................................................................................................. 54
ÖZET .......................................................................................................................... 56
SUMMARY .............................................................................................................. 58
KAYNAKLAR .......................................................................................................... 60
EKLER
GİRİŞ VE AMAÇ
Radyoterapinin (RT) amacı, tümörün çevresindeki normal dokulara en az hasarı
verecek şekilde tümörde kür sağlanabilmesidir. Hodgkin hastalığı, meme kanseri, özofagus
veya akciğer kanseri gibi malignitelerin RT’si sırasında kalbin bir bölümünün tedavi alanında
kalmasına bağlı olarak RT’ye bağlı kalp hasarı meydana gelebilir. Bunun sonucunda nadir
görülen ancak ciddi bir geç komplikasyon olan RT’ye bağlı kalp hastalığı (RBKH) ortaya
çıkabilir (1).
Radyasyona bağlı kalp hastalığı, radyasyon nedeniyle kalpte oluşan klinik ve patolojik
durumları tanımlamak için kullanılır (2-4). RBKH’nın en sık ortaya çıkış şekillerinden biri
perikardiyal hastalıktır. Akut perikardit tedavinin uygulanması sırasında veya hemen
sonrasında görülebilirken, konstriktif veya efüzif perikardit tedaviden aylar-yıllar
sonra
ortaya çıkabilir (5-7). Diğer geç komplikasyonlar arasında ise miyokardiyal fibrozis,
kardiyomiyopati,
hızlanmış koroner arter hastalığı,
ileti anormallikleri ve kapak
disfonksiyonları sayılmaktadır (7,8).
Günümüzde toraks ışınlamalarının perikardiyal, miyokardial ve endokardiyal (valvüler
ve arteriyal) dokularda akut inflamasyona ve progresif fibrozise neden olabileceği yönünde
net kanıtlar bulunmaktadır (6,9). Malignitelerde kullanılan yeni tedavi yöntemlerinin sağkalım
süresini uzatması nedeniyle göğüs duvarına RT uygulanan hastalarda tedaviden yıllar sonra
kardiyovasküler komplikasyonların görülme riski artmaktadır (10).
İyonizan radyasyonun ışınlanan dokuda oksijen serbest radikalleri (OSR) oluşturduğu
bilinmektedir. Serbest radikaller (SR); Dezoksiribonükleik asit (DNA), Ribonükleik asit
(RNA), proteinler, membranlar gibi moleküllerle etkileşime girerek hücre fonksiyonunun
bozulması veya ölümüne neden olmaktadır (11). Bu etki, radyasyona maruz kalan tümörde ve
1
çevre dokularda da görülmektedir (12). OSR’nin kontrolü için aerobik hücreler ‘antioksidan
sistem’ adı verilen enzimatik ve enzimatik olmayan bileşenleri içeren bir savunma
mekanizması geliştirmiştir.
Amifostin in vivo olarak vasküler endotelyal hücrelerin alkalen fosfatazı (ALP) ile
aktif serbest tiyol ve inorganik fosfata dönüşür. Serbest tiyol, tümör dokusuna nazaran
öncelikle normal dokular tarafından alınır ve RT sonucu ortaya çıkan OSR’nin kuvvetli bir
temizleyicisidir. Böylelikle DNA’yı hasara uğratan ve hücre ölüm riskini arttıran zararlı
hidroperoksit radikallerinin oluşumunu engeller (13). Hayvan çalışmaları ve klinik
çalışmalarla amifostinin doksorubisine karşı kardiyoprotektif etkileri gösterilmiştir (14,15).
Amifostinin lokal kalp ışınlamasına karşı koruyucu etkisi olduğunu gösteren iki çalışma
yayınlanmıştır (16,17).
Karnitin, β-oksidasyon ve mitokondrinin iç tarafındaki potansiyel toksik metabolitlerin
uzaklaştırılması için açil CoA ve açil karnitin olarak iç mitokondriyal membranda yağ asitleri
için taşıyıcı rol üstlenen doğal bir maddedir (18). Karnitin ve onun kısa zincir esterleri olan
propiyonil-L-karnitin (PLC) ve açil-L-karnitin (ALC), hem insan vücudunda endojen olarak
sentezlenirler hem de diyette bulunurlar (19). Karnitinler uzun zincirli yağ asitlerinin
transformasyonu için gerekli çeşitli enzimlerin esansiyel faktörüdür ve ayrıca memeli
dokularında OSR’un temizleyicileri olarak etki ederler (20). ALC’nin bleomisin ile
indüklenen oksidatif strese karşı mitokondiriyal fonksiyonu koruduğu ve ATP üretimini
arttırdığı gösterilmiştir (21). Karnitin, antioksidan ve OSR temizleyici özelliği ile hücrelerde
iyonizan radyasyona bağlı oluşabilecek OSR’a karşı modülatör rol oynayabilir (22).
Çalışmalarda karnitinin radyasyonun indüklediği oksidatif streste ve radyasyonun indüklediği
kataraktta koruyucu olduğu gösterilmiştir (23-24).
Bu çalışmada, kalp üzerine radyoprotektör etkisi olup olmadığı daha önce
araştırılmamış olan karnitinin böyle bir koruyucu etkisinin varlığının araştırılması ve eğer
varsa bu etkinliğin bu gün için standart bir radyoprotektör olarak kabul edilen amifostinin
etkinliği ile karşılaştırılması planlanmıştır.
2
GENEL BİLGİLER
KALBİN ANATOMİSİ
Kalp, göğüs boşluğunda, akciğerlerin arasında mediyastende yer alır. Koni şeklindeki
kalbin tabanı yukarıda, sternumun arkasındadır. Büyük damarlar bu bölgeden giriş çıkış
yaparlar. Kalbin apeksi aşağı tarafta diyafragmanın sol tarafındadır. Kalp perikardiyal
membranlar tarafından çevrilidir. Üç tabaka bulunur (Şekil 1). En dışta bulunan fibröz
perikard, kuvvetli fibröz bağ dokusunun oluşturduğu gevşek bir kese gibidir. İnferiorda
diyafram üzerine, süperiorda büyük damarların tabanına kadar uzanır. Seröz perikard
katlanmış bir membrandır, pariyetal ve visseral iki tabakadan oluşur. Fibröz perikardı
pariyetal perikard döşer. Kalp kasının yüzeyini ise visseral perikard örter ve buna da
genellikle epikard adı verilir. Pariyetal ve visseral perikard membranları arasında kalp atımı
sırasında sürtünmeyi önleyen seröz bir sıvı bulunur (25).
Kalp gerçekte iki ayrı pompadan oluşur, sağ kalp kanı akciğerlere, sol kalp periferik
organlara pompalar. Bu iki ayrı kalpten her biri, atriyum ve ventrikülden ibaret iki boşluklu,
pulsatil bir pompadır. Atriyumlar kanın ventriküllere geçişine yardımcı olurlar. Ventriküller,
kanın, akciğerlere ve periferik dolaşıma gönderilmesinde esas gücü sağlarlar. Kalpteki özel
mekanizmalar, kalbin ritmik çalışmasını ve aksiyon potansiyellerinin bütün kalp kasına
yayılmasını sağlıyarak ritmik kalp atımlarına neden olur.
Kalp atriyum kası, ventrikül kası, özelleşmiş uyarıcı ve iletici kas lifleri olamak üzere
üç temel kas tipinden oluşur. Atriyum ve ventrikül kasları hemen hemen iskelet kası gibi
kontraksiyon yapar, yalnız kontraksiyon süresi daha uzundur. Diğer taraftan özelleşmiş
uyarıcı ve iletici kas lifleri çok az kontraktil lif taşıdıklarından ancak zayıf olarak kasılırlar.
Bu lifler ritmik özellikleri ve hızlı ileti yetenekleriyle uyarıcı impulsların bütün kalbe
yayılmasını sağlayan ileti sistemini oluştururlar.
3
Miyokard
(Kalp kası)
Epikard
(Visseral perikardiyum)
Pariyetal Perikard
Endokard
Fibröz Perikard
Perikardiyal Kavite
Şekil 1. Kalbi oluşturan tabakalar (25)
Temel olarak kalp fonksiyonlarını sağlayan kalp kası miyokardtır. Kardiyak miyosit
adı verilen özelleşmiş kas hücrelerinden oluşmaktadır (Şekil 2). Kalp kası iskelet kası gibi
çizgili kastır. Ayrıca kalp kası hemen hemen iskelet kasındakinin aynı olan aktin ve miyozin
filamentlerini içeren tipik miyofibrillere sahiptir.
Şekil 2. Miyokardın histolojisi: Santral yerleşimli kardiyak miyositlerin nükleusları (ok
başı ile gösterilmiş), interkale diskler (yan yana gelen hücrelerin özelleşmiş
uçuca bağlantıları; çift ok ile gösterilmiş), miyositler içinde çapraz striasyonlar
şeklinde sarkomerik yapılar görülmekte, kapiller bir endotelial hücre ok ile
gösterilmekte (27)
Kalp kası liflerini enine olarak kateden uzantılar interkale disk diye isimlendirilir;
bunlar aslında kas hücrelerini birbirinden ayıran hücre membranlarıdır. Yani kalp kası lifleri
birçok kalp kası hücresinin seri halinde bağlanmasından meydana gelmiştir. İnterkale
4
disklerde elektriksel direnç kalp kası liflerinin dış membranlarındakinin ancak 1/400’ü
kadardır. Çünkü hücre membranları buralarda birbiriyle kaynaşır ve iyonların rölatif olarak
serbest difüzyonuna elverişli olan çok geçirgen bağlantılar yapar. Böylece iyonlar kalp kası
liflerinin eksenleri boyunca kolayca hareket ederler ve aksiyon potansiyelleri çok hafif bir
engelle interkale disklerden geçerek bir kalp kası hücresinden diğerine kolayca iletilirler. Bu
şekilde kalp kası bir sinsisyum oluşturur. Kalp kası hücrelerinin birbirine çok sıkı bağlanması
nedeniyle biri uyarıldığı zaman aksiyon potansiyeli hücreden hücreye geçerek tümüne yayılır
(26).
NORMAL ELEKTROKARDİYOGRAFİNİN KARAKTERİSTİKLERİ
Kalp atımı, seri elektriksel bir olayın sonucudur ve miyokard tarafından oluşturulan
elektriksel değişiklikler vücut yüzeyine yerleştirilen elektrotlar ile kaydedilebilir. Buna
elektrokardiyografi (EKG) adı verilir. Tipik bir EKG’de ayırt edilebilen üç dalga vardır: P
dalgası, QRS kompleksi ve T dalgası. Her biri spesifik bir elektriksel olayı temsil eder. P
dalgası atriyumun depolarizasyonunu temsil eder, bu da sinoatriyal noddan gelen elektriksel
dalgaların atriyal miyokarda yayılmasının sonucudur. QRS kompleksi elektriksel uyaranların
ventriküler miyokarda yayılarak ventriküllerin depolarizasyonunu temsil eder. T dalgası ise
ventriküllerin repolarizasyonunu temsil eder (atriyal repolarizasyon EKG’de QRS kompleksi
tarafından maskelendiğinden ayrı bir dalga olarak görülmez). EKG, hem depolarizasyon hem
de repolarizasyon dalgalarından meydana gelmiştir (25).
Üç bipolar ekstremite derivasyonu: ‘Bipolar’ terimi elektrokardiyografinin vücut
yüzeyinden iki özel elektrotla kaydedilmesini işaret eder. DI, DII, DIII derivasyonları olarak
adlandırılır. Altı tane göğüs derivasyonu vardır (26).
İYONİZAN RADYASYONUN KALPTE OLUŞTURDUĞU ETKİLER, TANI
VE TEDAVİSİ
Radyasyona bağlı kalp hasarı sıktır ve perikard, miyokard, ileti mekanizması veya
koroner damarlar etkilenebilmektedir (28). Radyasyona bağlı hasar akut veya geç yan etkiler
şeklinde ortaya çıkabilmektedir. Toraksa uygulanan RT nedeniyle kardiyovasküler sistemde
oluşan potansiyel yan etkiler Tablo 1’de gösterilmiştir. Günümüze kadar en sık görülen yan
etki perikardit olarak saptanmışsa da modern RT dozları ve teknikleri nedeniyle ölümcül
miyokardiyal infarktüs riskinde artış saptanmıştır (29). Tablo 2’de RBKH’nın ortaya çıkış
şekilleri için risk faktörleri gösterilmektedir.
5
Tablo 1. Radyasyon hasarına bağlı olarak gelişen kardiyovasküler hastalık spektrumu
(33)
Patoloji
Özellikler
- Tedavi sırasında gelişen-mediyastinal tümör ve siklofosfamid gibi bazı
Perikardit
kemoterapi ajanları ile ilgili
- Tedavi sonrası gelişen-akut efüzyon, kronik efüzyon, perikardit,
konstrüktif perikardit
- Prematür fibrozis ve muhtemelen hızlanmış ateroskleroz
Koroner arter
- Etkilenen arterlerin dağılımı genelde ön ağırlıklı tedavi ile önde olma
hastalığı
eğilimindedir
- Lezyonlar proksimalde olmaya ve hatta etkilenen arterlerde ostiumlarda
olmaya meyillidir
- Atom bombasından sonra sağ kalanlarda aynı yaştaki kontrol grubuna
göre belirgin olarak artmış lipid profili riski
- Sessiz iskemi oranlarında artış, klinik olarak şüphelenilmeyen ve klinik
akut miyokard infarktüsünde artış
- Öncelikle mitral kapak ve aort kapağı etkilenir
Valvüler
- Tedaviden sonra geçen zamanın artması ile birlikte artmış oranda
hastalık
regürjitasyon ve stenoz
- Normal kapağı olan birçok kişide tedavinin tamamlanmasından 10-20
yıl sonra belirgin hastalığa doğru ilerleme
- Yüksek oranda komplet veya inkomplet sağ dal bloğu görülmesi sağ dal
İleti
fibrozisine işaret eder
sistemi/aritmi
- Tam kalp bloğuna ilerleyebilir ve pacemaker gerektiren konjestif kalp
yetersizliğine neden olabilir
- Tam kalp bloğu diğer radyasyon ile indüklenen kalp anormallikleri
olmadan nadiren ortaya çıkar
- Yüksek oranda sol ventriküler fibrozis artmış yüksek dereceli
ventriküler ektopik aktivite ile ilişkilidir
- Artmış sağ atriyal basınç artmış atriyal aritmi ile ilişkilidir
- Taşikardi, sirkadyen ritm kaybı ve solunumsal fazik kalp hızı
Otonomik
değişkenliği ile seyreden sık kardiyak disfonksiyon
disfonksiyon
- Bir üstte anlatılan denerve edilmiş kalpte de benzer şekilde
görüldüğünden bu olayın gerçekten otonomik sinir sistemi hasarıyla mı
ilişkili olduğu sorusu ortaya çıkar
- Anjinal ağrının algılanmasında azalma
- Özellikle erken çocukluk döneminde tedavi görenlerde ciddi pulmoner
Vasküler
arter stenozu ve hipoplazisi
değişiklikler
- Karotiste, aortta ve renal arterde fibrozis ve arterioskleroz sıklığında
artış
- Atom bombasından sonra sağ kalanlarda aort kalsifikasyonunda artış
Kalbin RT toleransı (TD 5/5), kalbin %24’ü veya daha azı ışınlandığında 60 Gy iken
kalp volümünün %65 veya daha fazlası ışınlandığında 45 Gy’e kadar düşmektedir (30). Bu
toleranslar fraksiyon başına 2 Gy’lik dozlar verildiğinde gözlenmektedir. Kardiyak tolerans
değerlendirilirken fraksiyonasyon şeması ve alanı hayati önem taşır. Kemoterapi (KT) ile eş
6
Tablo 2. Radyasyon hasarına bağlı olarak gelişen kalp hastalığının ortaya çıkış şekilleri için risk faktörleri (33)
Risk faktörleri
7
*
Yüksek toplam doz (> 35-40 Gy)
Yüksek fraksiyone doz (≥ 2.0 Gy / gün)
Işınlanan kalp volümünün artması
Radyasyon alanlarının nisbi ağırlığı,
subkarinal blok kullanılmadan kalbin değişik
bölümlerine ne kadar radyasyon verildiği
Kalbe yakın tümör varlığı
Genç yaşta tedavi
Tedaviden sonra uzun zaman geçmiş olması
Radyasyon kaynağının tipi
Adjuvan kardiyotoksik kemoterapi kullanımı
Yaş, ağırlık, lipid profili ve sigara içme gibi
diğer bilinen risk faktörlerinin varlığı
Kapak
hastalığı
Kardiyak ölümün tüm
nedenleri
X
Olası****
Olası
X
Olası
Olası
X
X
X
Olası
Olası
Olası
X
X
X
-
Olası
X
Olası
Olası
X
-
X
X
Olası
X
X
-
-
X
KM*
KAH**
X***
X
X
X
X
X
X
X
X
X
X
Perikardit
X
-
-*****
X
X
Olası
X
-
Aritmi
KM: Kardiyomiyopati; ** KAH: Koroner Arter Hastalığı; *** X: Spesifik prezentasyonla spesifik risk faktörlerinin ilişkisi; **** Olası: Bilinmeyen ama muhtemel birliktelik;
-: Bilinen ilişki yok.
*****
zamanlı olarak RT uygulanıyorsa kalbin %50’den fazlasına 45 Gy’den fazla RT
uygulanmamalıdır (31). Kalbin %50’den fazlası ışınlanıyorsa kalpte hasar meydana getiren
eşik radyasyon dozu 20 Gy, küçük alan ışınlanıyor ise daha yüksektir. Konvansiyonel
fraksiyonlar ile 45-50 Gy RT uygulandığında %11 oranında RBKH oluşabilmektedir. Kalp
için α/β oranının düşük olması nedeniyle (yaklaşık 1Gy) fraksiyonasyon uygulanması ile
koruyucu etki ortaya çıkmaktadır (32).
İyonizan Radyasyona Bağlı Kardiyak Hasarın Patolojisi ve Klinik Bulguları
a. Miyokard: Miyokard hasarı spesifik olmayan diffüz intertisyel fibrozis ile beraber
seyreder (34). Lezyonlar birkaç milimetreden birkaç santimetreye ulaşan çaplarda ölçülebilir
ama bütün miyokardı kapsamaz. Fibrozisin derecesi bir bölgeden diğer bölgeye ciddi farklılık
gösterebilir. Mikroskopik düzeyede kollajen artmaz ama tip I kollajenin tip III kollajene olan
oranı artar. Bu değişimin miyokardın kompliyansını bozarak bu popülasyonda görülen
diyastolik disfonksiyonla ilişkili olduğu düşünülmektedir (35). İletimle ilgili miyokard
hücrelerinin radyasyonla ilişkili fibrozise duyarlı olduğu göğüs RT’si sonrasında ortaya çıkan
aritmilerle ilgili birçok olgu sunumunda gösterilmiştir (36,37).
Radyasyona bağlı kalp hasarının genel olarak mikrosirkülasyon hasarına bağlı
oluştuğu düşünülmektedir. Fajardo ve Stewart’ın ışınlanmış beyaz tavşanlarda yaptığı
çalışmalarda miyokard hasarının üç fazda geliştiği gösterilmiştir (4,9).
İlk faz, küçük ve orta büyüklükteki arterlerde radyasyon maruziyetinden 6 saat sonra
oluşan ‘akut enflamasyon’ dönemidir. Bu dönemde kalbin bütün tabakalarını içine alacak
şekilde nötrofilik infiltrasyon görülür. İkinci dönem ‘latent faz’dır. Latent dönemde sağlıklı
perikard ve miyokard dokusunda yavaş ama progresif olarak ilerleyen fibrozis gelişir.
Elektron mikroskopisinde, progresif hasarın kapiller endotelyal hücre lümeninde, fibrin
trombüsleri ve trombositler tarafından oluşturulan obstrüksiyon nedeniyle meydana geldiği
gösterilmiştir. Geride kalan sağlıklı endotelyal hücreler yeterli oranda kapillerin oluşması için
uygun değildir. Sağlam kapillerlerin sayısında azalma sonucunda iskemi, miyokardiyal hücre
ölümü ve fibrozis ortaya çıkar. Üçüncü fazda en belirgin işaret yaygın fibrozistir.
Uzun dönemde, radyasyona bağlı sistolik ve diyastolik sol ventrikül disfonksiyonu
görülebilir. Diyastolik hasar hem daha sık görülür hem de daha erken ortaya çıkar. Geç
dönemde görülen diyastolik hasar RT’den hemen sonra akut dönemde görülen ejeksiyon
fraksiyonundaki geçici bozulmadan farklı bir klinik tablodur ve akut hasar görülmesi ile
ilişkisi olup olmadığı bilinmemektedir (38). Uzun dönem değişiklikleri her tip
kardiyomiyopatiyi tetikleyebilir. Hangi tip kardyomiyopatinin görülebileceği hastanın yaşı,
8
tedavi öncesi kardiyak fonksiyonları ve eş zamanlı KT uygulanıp uygulanmadığına bağlıdır.
Genellikle subklinik hasarlar görülmekle birlikte kalp yetersizliği oldukça nadirdir ve hemen
hemen her zaman antrasiklin tedavisi hikayesi bulunmaktadır (39).
b. Perikard: Radyasyona bağlı olarak perikardta fibröz kalınlaşma, perikardiyal
yapışıklıklar ve perikardiyal sıvı görülebilmektedir (5). Pariyetal plevra, epikarddan daha
ciddi şekilde ve daha sık oranda etkilenmektedir. Normal perikardiyal adipöz dokunun yerini
yoğun kollajen ve fibrin alarak stromada ve mezotelyal yüzeylerde fibrozis meydana
gelebilmektedir. Miyokardta olduğu gibi RT’ye maruz kalan perikardta da küçük kan
damarlarında proliferasyon izlenmektedir. Hasarlanan damarlarda permeabilite artışı ile
başlayan ve fibrozisle sonuçlanan değişiklikler meydana gelmektedir. Ayrıca kalbin ve
mediyastenin venöz ve lenfatik kanallarının fibrozisi ekstrasellüler sıvının drenaj yeteniğini
azaltmaktadır. Bütün bu mekanizmalar proteinden zengin bir efüzyonun birikmesine neden
olmaktadır. Fibrinolizin bozulması ile fibrin birikimi de meydana gelebilmektedir (7).
Erken başlayan akut perikardit, RT uygulaması esnasında ortaya çıkan perikardit tablosu
olarak tanımlanmaktadır. Geç dönem perikardit, büyük oranda RT sonrası ilk yıl içinde
görülse de 4 ay ile birkaç yıl arasında ortaya çıkmaktadır (7, 40). Geç dönem perikardit iki
şekilde görülmektedir: Gecikmiş akut perikardit ve gecikmiş kronik perikardiyal efüzyon.
Gecikmiş akut perikardit gürültülü perikardit tablosu şeklinde ortaya çıkmakta ve nüks
edebilmektedir. Çoğu efüzyon spontan olarak gerilemektedir ancak bu süre iki yıla kadar
uzayabilmektedir (41). Gecikmiş perikarditli hastaların % 20’sinde RT sonrası 5-10 yıl içinde
kronik ve/veya konstriktif perikardit ortaya çıkabilmektedir. Pankardit, dikkat çekici
miyokardiyal fibrozisle seyreden en ciddi perikardittir (7). Bu nadir komplikasyonun ortaya
çıkması için en az 60 Gy’lik mediyastinal ışınlama yapılmış olması gerekmektedir.
c. Kalp kapakları: Radyasyona bağlı olarak kalp kapakları fibrotik değişikliğe
uğrayabimektedir (5,6). Değişimlerin patofizyolojisi çok iyi anlaşılamamıştır. Kalp
kapaklarının avasküler olması kapak hasarının mikrovasküler hasarla açıklanmasını
önlemektedir. Kalbin sol tarafındaki kapak değişiklikleri sağ tarafındaki değişikliklerden
dozdan bağımsız olarak daha sık ve daha ciddi şekilde görülmektedir. Bu durum sistemik
dolaşımdaki yüksek basıncın patogenezde rol oynadığının bir işareti olabilir (6,42).
d. Koroner arterler: Radyasyona bağlı koroner arter hastalığı için latent süre yaklaşık
10-15 yıldır. Sıklığı sigara içimi, hipertansiyon veya obezite gibi genel risk faktörleri ile
artmaktadır (43). RT sonrasında görülen koroner arter hastalığının patolojisi ve patofizyolojisi
genel popülasyonda görülen hastalığın patolojisine hemen hemen benzerdir. Lezyonların yeri
ve morfolojileri ile ilgili farklar vardır. RT’den sonra tipik olarak sol ön inen ve sağ koroner
9
arterler etkilenmektedir (44,45). Bununla birlikte sol ana koroner arter hastalığının sıklığı
göğüs duvarına RT alan hastalarda, almayan koroner arter hastalarından fazladır. Damar
içinde daralma genel olarak proksimalde meydana gelmekte ve çoğunlukla koroner deliği de
içine almaktadır. (5,6,44,46). RT’den sonra koroner arter endotelyal hücrelerinin
miyokardtaki küçük damarların uğradığı hasara benzer mekanizma ile hasara uğradığı
düşünülmektedir (47).
e. Aritmiler/ileti bozuklukları: RT’ye bağlı hayatı tehtit eden aritmiler veya iletim
bozuklukları radyasyon maruziyetinden yıllar sonra ortaya çıkabilmektedir (48). Radyasyona
bağlı olarak gelişen atriyoventriküler nodal bradikardi, komplet kalp bloğu dahil her seviyede
kalp bloğu ve hasta sinüs sendromunun da içinde bulunduğu pek çok kardiyak ritm bozukluğu
bildirilmiştir (36,49,50-51). En sık sağ dal bloğu görülmektedir. Ayrıca infranodal blokların
nodal bloklardan daha sık ortaya çıktığı bildirilmiştir (37). Radyasyonun yol açtığı iletim
anormalliklerine bağlı semptomlar sık olmamakla birlikte, çarpıntıdan senkopa veya ani
ölüme kadar ciddi bulgular görülebilmektedir (36).
İyonizan Radyasyona Bağlı Gelişen Kardiyak Hasarda Risk Faktörleri
a. Işınlanan kalp hacmi: Kardiyotoksisite riski ışınlanan kalp hacmi ile doğru
orantılıdır (52). Rutqvist ve ark. (53) 55.000 hastadan oluşan bir İsveç kohortunu
çalışmışlardır. Işınlanan kalp
volümü
ve alınan doz ölçülerek kardiyak
hasarla
ilişkilendirilmiştir. Yaptıkları çalışmada 1971 ve 1976 yılları arasında memeye veya göğüs
duvarına RT alan toplam 960 hastanın kardiyak nedenli ölüm için 3 kat daha fazla rölatif riske
sahip oldukları hesaplanmıştır. Bu grupla ilgili daha ileri bir analiz de 1998’de yayınlanmıştır.
Ortalama yirmi yıllık takip sonrasında, bu hastaların 1/3’ünün (en yüksek doz/volüme sahip)
kardiyak ölüm açısından rölatif riski 2.0, ölümcül miyokardiyal infarktüs rölatif riski 2.5
olarak saptanmıştır. Daha az kardiyak dozlar alan 2/3’lük hasta grubunda kardiyak mortalite
açısından anlamlı artış görülmemiştir (54,55).
b. Yaş: Tedavi sırasında genç yaş kardiyotoksisite için bir risk faktörüdür. Çocuklar
ve adölesan dönemdeki hastalar en yüksek riske sahiptir. Stanford Üniversitesinde, 1961-1991
yılları arasında toraksa RT uygulanarak tedavi edilen 21 yaş altı 635 hastanın retrospektif
incelenmesinde benzer yaş grubuyla eşleştirilen normal popülasyona göre rölatif risk, ölümcül
miyokard infarktüsü için 41.5 olarak hesaplanmıştır (56). Bu yüksek risk 42 Gy veya daha
fazla mediyastinal ışınlama yapılan çocuklarda hesaplanmıştır. Bir başka çalışmada nod
pozitif sol meme kanserli 60 yaş altındaki kadınlar, sağ meme kanserli kadınlarla
10
karşılaştırıldığında ölümcül miyokard infarktüsü için rölatif risk 2.2 olarak hesaplanırken 60
yaşın üzerindeki kadınlarda artmış risk tespit edilememiştir (57).
c. Takip süresi: Hodgkin hastalığı ile ilgili bir çalışmada ölümcül miyokard
infarktüsü ile ilgili riskin beklenen riskin üzerine çıkabilmesi için tedaviden en az 10 yıl
geçmesi gerektiği belirtilmiştir (58).
d. Doz, ekipman ve teknik: Üç boyutlu tedavi planlaması, yoğunluk ayarlı RT
(YART) ve azaltılmış fraksiyon dozu gibi yeni tekniklerle total kardiyak dozda belirgin
azalmalar olmuştur. Stanford çalışmasında 1960 -1991 yılları arasında tedavi edilen 2232
hasta incelenmiş ve kardiyak ölümler için miyokardiyal olmayan infarktüs rölatif riskinin
subkarinal koruma ile 5.3’den 1.4’e indiği gösterilmiş olsa da ölümcül miyokardiyal infarktüs
için rölatif riskte sadece 3.7’den 3.4’e bir değişiklik olduğu gözlenmiştir (59).
e. Kemoterapi: Doksorubisin veya epirubisin gibi antrasiklinler meme kanseri ve
lenfomaların tedavisinde sıklıkla kullanılmaktadır. Antrasiklinlerin kardiyomiyopati, konjestif
kalp yetersizliği ve akut EKG değişikliklerine (nonspesifik ST-T değişiklikleri, azalmış QRS
voltajı ve QTc’de uzama) neden olduğu bildirilmiştir (60). Daha öncesinde veya eş zamanlı
uygulanan RT, antrasiklinle tetiklenen kardiyotoksisiteyi arttırmaktadır. 5-Fluorourasil (5FU), siklofosfamid, taksanlar, trastuzumab ve kombretastatin gibi ilaçlar kardiyotoksisite ile
ilişkilendirilmiştir.
İyonizan Radyasyona Bağlı Kardiyak Hasarı Tarama Yöntemleri
Radyoterapiye bağlı en sık görülen komplikasyonlar iskemik kardiyovasküler hastalık
veya kalp yetersizliğidir. Kardiyak hasarı belirlemek için standart kabul edilen bir test
bulunmamaktadır (33). Tablo 3’te RBKH’nın oluşumunda önemli dozlar, tarama ve tanı
testleri ile tedavi seçenekleri sunulmuştur.
a. Miyokardiyal fonksiyonun değerlendirilmesi: Toraksa RT uygulanan hastalarda
ekokardiyografi (EKO) ve radyonüklid anjiyografi takip için kullanılan yöntemlerdendir. Her
ikisi de sol ventrikül sistolik performansının genel ölçümü için güvenilir metotlardır.
EKO’nun ayrıca noninvaziv olması ve perikard, kapakçıklar, aort, pulmoner arter dalları gibi
anatomik yapıları analiz edebilmesi nedeniyle ek avantajları vardır. Diyastolik fonksiyon da
aynı işlem sırasında doppler EKO kullanılarak çeşitli indeksler yardımıyla ölçülebilmektedir
(61). Bununla birlikte vücut yapısı ve kemik dansitesi nedeniyle çoğu erişkinde EKO kalitesi
sınırlıdır. Radyonüklid görüntüleme ise sistolik fonksiyonun kantitatif analizinde önemli yer
tutmaktadır (62).
11
b. Koroner arter hastalıklarının değerlendirilmesi: Tedavi sonrası 5 yıl içinde
ölümcül koroner arter hastalığı riskinin arttığı ve 12 yaşındaki çocuklarda bile miyokardiyal
infarktüsler görüldüğü bildirildiği için yüksek doz mediyastinel ışınlama yapılan hastalarda
yaşa bakılmaksızın ‘koroner arter hastalığı’ düzenli olarak değerlendirilmelidir (63,64).
Aşağıdaki testler iskemik kalp hastalığının belirlenmesi açısından kullanışlıdır.
a.) Lipid profili, inflamasyon belirteçlerini içeren kan testleri.
b.) Egzersiz stres testi: Kardiyak iskemiyi gösteren non-invaziv yöntemdir.
c.) Çok hızlı ışınlı elektron tomografisi: Koroner arterlerdeki kalsiyum birikmesini
değerlendiren non-invazif testtir.
c. Aritmi/ileti bozukluklarının değerlendirilmesi: Radyasyona bağlı elektriksel ileti
anormallikleri, ölümcül olana kadar subklinik kalabilir. Bu yüzden EKG ve 24 saatlik EKG
bu grup hastada önemli bir takip yöntemi olarak düşünülmektedir. Bununla birlikte, klinik
olarak önemli, fakat sessiz iletim anormalliklerinin saptamanın prognostik değeri ile ilgili
kesin veriler olmadığı için asemptomatik kişilerin rutin olarak EKG ile takibi
önerilmemektedir (61).
Tablo 3. Radyoterapiye bağlı kalp hastalığının
tanı testleri ile tedavi seçenekleri (33)
Geç Etkiler
Radyasyon Belirtiler ve
dozu
semptomlar
Perikardit
≥ 35 Gy
Halsizlik,
egzersizle
dispne, göğüs
ağrısı, siyanoz,
asit, periferal
ödem,
hipotansiyon,
sürtünme sesi,
kalp seslerinin
derinden
gelmesi, venöz
dolgunluk,
paradoks nabız,
Kussmaul
işareti
Kardiyomiyopati ≥ 35 Gy
Halsizlik,
(Miyokardiyal)
veya
öksürük,
≥ 25 Gy ve egzersizle
antrasiklin
dispne, periferik
ödem ,
hipertansiyon,
taşipne, raller,
12
oluşumunda önemli dozlar, tarama ve
Tarama ve tanısal
testler
Elektrokardiyografi
Göğüs direkt grafisi
Ekokardiyografi
Tedavi ve girişim
Elektrokardiyografi
Ekokardiyogram
ve/veya
radyonüklid
anjiyografi –
diyastolik ve
sistolik
-Riskleri
hakkında eğitim
verilmesi:
Alkol, izometrik
egzersiz, sigara
içme ve diğer
ilaç kullanımı,
Perikardiyosentez
Perikardiyektomi
Tablo 3 devamı. Radyoterapiye bağlı kalp hastalığının oluşumunda önemli dozlar,
tarama ve tanı testleri ile tedavi seçenekleri (33)
Geç Etkiler
Radyasyon Belirtiler ve
Tarama ve tanısal Tedavi ve girişim
dozu
semptomlar
testler
Kardiyomiyopati ≥ 35 Gy
taşikardi,
fonksiyonun
hamilelik ve
(Miyokardiyal)
veya
üfürüm, ek kalp
değerlendirilmesi
anestezi
≥ 25 Gy ve sesleri,
-Afterload
antrasiklin
hepatomegali,
azaltıcılar, β
senkop, çarpıntı
blokerler,
diüretikler,
digoksin
Koroner arter
≥ 30 Gy
Göğüs ağrısı,
Lipid profili,
-Diyet ve
hastalığı
dispne, terleme,
Egzersiz stres test
kondüsyon
hipotansiyon,
ve/veya
rejimlerini içeren
solukluk, bulantı, radyonüklid
risk faktörü
modifikasyonları
aritmi
anjiyografi veya
ekokardiyografi
- Kardiyak
(risk faktör profili medikasyonlar
ve semptomlara
bağlı
Kapak hastalığı ≥ 40 Gy
Öksürük,
Ekokardiyografi
-Diş ve cerrahi
halsizlik,
Kardiyak
prosedürler
egzersizle
kateterizasyon
öncesinde
dispne, yeni
antibiyotik ile
üfürümler, raller,
subakut
periferik ödem
bakteriyel
veya konjestif
endokardit
kalp hastalığının
profilaksisi
herhangi diğer
-Kapak
işareti
replasmanı
Aritmi
Çarpıntı, baş
-Pacemaker
dönmesi, senkop,
ekokardiyografi,
24 saatlik
ekokardiyografi,
diğer
anormalliklerin
değerlendirilmesi
d. İnvazif prosedürler: Anjiyografi ve kardiyak kateterizasyon, anjina ve kalp
yetersizliği semptomlarının değerlendirilmesi için uygundur (65). Kardiyak biyopsi, konjestif
kalp yetersizliği olan hastalarda fibrozisin, inflamasyonun ve diğer potansiyel tedavi
edilebilecek kalp yetersizliği nedenlerinin bulunması için yardımcı olabilir.
13
İyonizan Radyasyona Bağlı Kardiyak Hasarın Önlenmesi ve Tedavisi
Radyasyona bağlı kalp hasarında tedavinin en iyi yolu korunmadır. Üç boyutlu tedavi
biçimi, radyasyon kaynağı olarak lineer akseleratör, eş ağırlıklı ön/arka alan veya 30 Gy’in
üzerinde subkarinal blok kullanılması gibi modern tekniklerle kalp önemli ölçüde
korunmaktadır. Ayrıca, RT için de kardiyoprotektanlar umut vaadetmektedir (66).
Akut perikardit nadiren yoğun tedaviye ihtiyaç göstermektedir. Hastaların yarıdan
fazlasında tedavi gerekmezken, diğer kısmında ise yatak istirahati, nonsteroid anti inflamatuar
ilaçlar ve hafif diüretiklerle hastalık iyileşmektedir. Asemptomatik perikardiyal efüzyonların
spontan olarak kaybolmaları için 2 yıla kadar uzun süreler gerekebilmektedir. Kronik
perikardiyal efüzyonlar için en iyi tedavi subtotal pariyetal perikardiyektomidir (67). İzole
non-ostial koroner arter lezyonları için perkütan translüminal koroner anjiyoplasti yararlı
olabilir, bununla birlikte cerrahiye aday olabilecek hastalar için ‘koroner arter by-pass’
cerrrahisi daha iyi bir seçenektir (68,69).
Radyasyona bağlı kalp hasarının medikal tedavisinde, diğer sebeplerle oluşan
hastalıklarda uygulanan ilaçlar kullanılmaktadır (kardiyomiyopatide β blokerler, diüretikler,
digoksin; koroner arter hastalığında lipid düşürücü ajanlar; kapak hastalığında endokardit
profilaksisi ve gerekli kardiyak ilaçlar vb.)
AMİFOSTİN
WR-2721, Amerikan ordusu tarafından iyonizan radyasyonun hasarına karşı koruyucu
amaçlı anti-radyasyon ilaç geliştirme programı tarafından geliştirilmiştir (70). WR-2721
günümüzde amifostin olarak bilinmektedir.
Amifostin, organik tiyofosfat olan sisteamin analoğu bir ön ilaçtır. Formül yapısı Şekil
3’de gösterilmiştir. Yapısındaki fosfor, amifostini inaktif formda tutarken, sülfür SR
temizleyici özellik kazandırır. Amifostin, plazma endotelinin bulunduğu tüm dokularda
membran bağımlı enzim olan ALP sayesinde defosforilasyona uğrayarak aktif forma
geçmektedir. Aktif ve en önemli metaboliti olan WR-1065 inorganik bir fosfat olup hücre
içine girdikten sonra, yine SR temizleyici özelliği olan metabolitlerine dönüşmektedir. WR1065’in oksidasyonu ile en fazla oluşan metabolit WR-33278 (simetrik disülfid) olup, az
miktarda mikst disülfidler de oluşmaktadır.
H2N
(CH2)3
NH
(CH2)2
Şekil 3. Amifostinin kimyasal yapısı (13,71)
14
S
PO3H2
Hayvan deneyleri ve insan çalışmaları göstermiştir ki ALP, pH 7 üzerinde aktiftir.
ALP çeşitli doku arteriol endotel hücrelerinde, böbrek proksimal tübülüs hücrelerinde ve ince
bağırsak mikrovilluslarında bolca miktarda bulunur. ALP aracılı aktif transport çok hızlı
gerçekleşir.
Bunun
nedeni,
amifostinin
plazma
proteinlerine
bağlanmaması
ve
metabolizmasının büyük oranda ALP aracılı aktif transporta uğramasıdır (13).
Faz II çalışmalar ile amifostinin tolerabl doz aralığı 740-910 mg/m2 olarak
belirlenmiştir (73). Amifostin oral kullanıldığında aktif değildir. 15 dakikalık intravenöz (İV)
infüzyon sonrası ortalama maksimum plazma konsantrasyonu 0,1-0,235 mmol/L’dir. İlacın
dağılım hacmi 6,44 L, plazma klirensi 2,17 dakikadır.
Farmokokinetik çalışmalar, hastalarda amifostinin plazma kompartmanından hızla
temizlendiğini göstermiştir. İnsanlarda İV verilmesini takiben ilk 6 dakikada amifostinin
%90’ı metabolize olur. Yapılan çalışmalarda amifostinin α yarı ömrü (dağılım yarı ömrü) <1
dakika; β yarı ömrü (eliminasyon yarı ömrü) = 8.8 dakika olarak saptanmıştır. WR-1065
metaboliti enjeksiyondan 10-30 dakika sonra pik düzeyine ulaşır (13). Bu nedenle, normal
dokuların sitoproteksiyonunda optimum yarar sağlanabilmesi için RT ya da KT
uygulamasından 20-30 dakika önce amifostin uygulanması gerektiği belirlenmiştir (74).
Serbest tiyol olan WR-1065’in normal hücreyi sitotoksik tedavilerin etkilerinden
koruması çeşitli mekanizmalar ile açıklanmıştır. Serbest tiyol, intrasellüler ortamda direkt
olarak alkilleyici ajanların veya sisplatinin aktif ürününe bağlandığı gibi, hasarlı hedef
moleküllere de H+ vererek hücresel koruma sağlar. Yapısındaki SH atomu sayesinde, KT
ajanları ve RT tarafından oluşturulan SR’ler ortadan kaldırılmadığında meydana gelen ve
DNA hasarına yol açan, reaktif nükleofilleri yok eder (13,71,75).
Amerikan klinik onkoloji derneği rehperleri, sitoprotektif ajan olarak amifostinin
günlük 200 mg/m2 dozda İV yavaş olarak en az 3 dakikada her radyoterapi fraksiyonundan
15-30 dk önce verilmesini önermektedir (76). Bu düşük dozda yan etkilerin görülme riski de
azaltılmış olmaktadır. Bununla birlikte amifostin uygulaması yakın hasta takibini
gerektirmektedir. Birçok hasta antiemetik ihtiyacı duymaktadır. Belirtilen dozlarda amifostin
ile ilişkili hipotansiyon nadiren görülmekle birlikte yakın takip gerekmektedir. Amifostin
uygulanmasından önce ve infüzyondan hemen 3 dk sonra kan basıncının ölçülmesi gerekir.
Amifostin genellikle iyi tolere edilmektedir. Bunun yanında doz ile ilişkili geçici yan
etkiler (hipotansiyon, bulantı, kusma, hıçkırık, somnolans, infüzyon sırasında metalik tat hissi
ve döküntü, ateş ve anafilaktik şok gibi alerjik reaksiyonlar) görülmektedir (73). Klinik olarak
anlamlı yan etki çoğunlukla hipotansiyondur. Hastaların %60’ında geçici hipotansiyon
oluşmaktadır, fakat tedaviye ara verilecek şiddette hipotansiyon oluşturması nadirdir (<%5).
15
Bulantı amifostin uygulanmasından önce kullanılacak güçlü bir antiemetik rejimi ile
azaltılabilmektedir. Paratiroit hormon salgılanmasının inhibisyonu ile ortaya çıkan geçici
hipokalsemiler de bildirilmiştir Klinik olarak anlamlı bir hipokalsemi tek doz amifostin
uygulamasını takiben yaygın değildir. Ancak günlük RT ile birlikte birden çok uygulamanın
yapıldığı hastalarda periyodik kalsiyum düzeyi izlenmelidir (77). Amifostinin subkutanöz
(SC) uygulanması ile ilgili yapılan çalışmalar İV uygulamadan daha az sıklıkta hipotansiyon,
bulantı
kusma
olduğunu
göstermiştir
(78,79).
Bununla
beraber
amifostinin
SC
uygulanmasının İV uygulamaya göre daha fazla oranda ateş ve cilt reaksiyonları ile ilişkili
olduğu bildirilmiştir (78-80). Amifostin tiyol bileşiklerine ya da mannitole karşı
hipersensitivitesi olduğu bilinen kişilerde kontrendikedir (13,81,82).
Amifostin SR temizleyici, hidrojen verici ve DNA hasarını inhibe edici özellikleri ile
radyasyona karşı koruyucu ve KT’ye bağlı hücresel hasarı önleyici bir ajandır. Amifostin
tümör hücrelerinden çok normal hücrelerde metabolize olmaktadır. Kanser tedavisinde
antitümöral etkinliği düşürmeksizin, normal dokulardaki toksisiteyi azaltarak koruyucu etki
göstermektedir. Preklinik çalışmalar amifostinin radyasyon hasarından koruyucu etkisinin
yanında, alkilleyiciler ve platin türevleri gibi KT ajanlarının myelotoksik, nefrotoksik,
nörotoksik etkileri üzerine koruyucu özelliği olduğunu göstermiştir. Amifostin KT’ye bağlı
mutajen ve karsinojen etkiden de koruyucudur (83). Amifostin onkolojik tedavilerde güvenli
ve etkin bir şekilde kullanılmaktadır. Sitoprotektif ajan olan amifostin, sisplatin uygulanan
ileri evre over kanserli ve küçük hücreli dışı akciğer kanserli hastalarda sisplatinin
oluşturduğu kümülatif renal toksisiteyi azalttığı için, 1996 yılında Amerika Birleşik
Devletleri’nde gıda ve ilaç dairesi tarafından onaylanmıştır (13).
Amifostin tarafından korunduğu bilinen normal dokular böbrek, akciğer, yemek
borusu, periferik sinirler, kemik iliği, ince bağırsak, kalın bağırsak, immün sistem, tükrük
bezleri, ağız mukozası, kalp ve testistir (72). Amifostinin genişletilmiş klinik kullanım
profilleri de radyoproteksiyon, kemoproteksiyon, tümör sensitizasyonu, kemik iliği
stimülasyonu, radyoprevensiyon ve kemoprevensiyondur (13,71).
KARNİTİN
İlk olarak 1905 yılında Frankell tarafından karnitinin biyolojik tayini için yöntem
geliştirilmiş ve kas dokusundan elde edildiğinden latince “carnis” kelimesinden yola çıkılarak
karnitin adı verilmiştir. 1960’lı yıllarda biyolojik yapısı tam olarak aydınlatılmış ve “3hydroxy-4-N-trimethyl ammonia butaonate” olduğu gösterilmiştir. Karnitinin fizyolojik
16
formu L(-) izomeri yani levokarnitindir (84). PLC ve ALC, karnitinin kısa zincirli esterleridir
(23). Karnitinin kimyasal yapısı Şekil 4’de gösterilmiştir.
Karnitin vitamin benzeri bir maddedir ve yapısal olarak aminoasitlere benzemektedir.
Karnitinin yaklaşık olarak %75’i besinlerden, %25’i endojen olarak sentezlenir (86).
Diyetteki başlıca kaynakları et ve süt ürünleridir. İnvivo olarak lizin ve metiyonin esansiyel
aminoasitlerinden sentezlenir. Ancak dokulardaki konsantrasyonu besinle alınan miktara bağlı
olarak değişir. İnsanlarda birçok doku trimetil lizini gama bütüro betaine dönüştürebilir. Ama
karnitinin sentezinin tamamlanması için gerekli olan bütürobetainin en son hidroksilasyonu
öncelikle karaciğerde gerçekleşir (87-89). Böbrek ve beyin de karnitin sentezine katılırlar ama
kritik olarak yağ asidi kullanılması için karnitine ihtiyaç duyan kalp ve iskelet kasları bu
molekülü sentezleyemezler (89,90). Kastaki seviyesi taşıyıcıya bağımlı sistemle karnitinin
kan akımından çekilmesi ile korunur (87,89).
Sağlıklı bireylerdeki plazmadaki serbest karnitin düzeyi 40-50 µmol/L’dir. Toplam
vücut karnitinin %90’ından fazlası iskelet kasında tutulur. Kalan kısımları ise karaciğer,
böbrek ve kalp gibi organlardadır. %1’den azı da plazma ve eritrositlerde bulunur (91).
Normal plazma konsantrasyonunda, filtre edilen karnitinin %90’dan fazlası böbrek tarafından
reabsorbe edilir. Anlamlı metabolik yıkıma uğramaz (86).
İntrasellüler önemli fonksiyonları şunlardır:
1. Uzun zincirli yağ asitlerinin mitokondri membranından içeri tarnsferini gerçekleştirerek
mitokondrial yağ asidi oksidasyonunda kofaktör olarak yer alır.
2. Dallı-zincirli α-keto asit oksidasyonunu kolaylaştırır.
3. Karaciğerde, ß-oksidasyon ile kısa zincirli hale gelmiş açil kısmının peroksizomların
dışına çıkarılmasını sağlar.
4. Memeli hücrelerinde, açil-CoA/CoA sülfidril oranını ayarlar.
5. Akut metabolik kriz sırasındaki esterifikasyon nedeniyle büyük miktarda artabilen ve
potansiyel toksik olan açil-CoA metabolitlerini yakalar (86).
CH3
CH3
N+
HO
CH2
H
C
O
CH2—C
CH3
Şekil 4. Karnitinin kimyasal yapısı (85)
17
O-
Karnitin karbonhidrat, glukoz ve lipid metabolizmasında rol alan bir amin bileşiğidir.
Uzun zincirli yağ asitlerinin dokularda enerji substratı olarak kullanılabilmesi için gereklidir.
Yağ asidi, iskelet ve kalp adalesi gibi bir çok sistem için primer enerji kaynağıdır ve karnitin
yağ asitlerinin mitokondrial membran içine girişini kolaylaştırarak enerji temininde önemli rol
oynar. Enerji üretiminde çok etkili metabolik yol olan β oksidasyonda rol alan karnitin,
özellikle
yüksek
enerji
ihtiyacı
olan
dokular
için
önemlidir.
Hücre
membran
stabilizasyonunda, kas kontraktibilitesinde ve kalp fonksiyonlarında etkilidir (92,93). Ayrıca
OSR’lerın temizlenmesinde görev alır (23). SR yakalama özelliğinden dolayı aynı zamanda
antioksidan olarak etki eden karnitinin vejeteryan tarzı beslenme ile eksikliği görülebilir (22).
Karnitin seviyesi yaş ile azalır ve eksikliğinde örneğin kardiyomiyopati ve iskelet kas
zayıflığı görülebilir (94,95). Karnitin ve esterleri doğal maddelerdir ve oral uygulama ile de
iyi tolere edilebilirler. Karnitinin ilaç formunda oral olarak 1-6 gr’lık dozlarda alınmasından
sonra biyoyararlanımı %5-18’dir. Buna karşın besinlerle alınan düşük miktarlardaki karnitinin
biyoyararlanımı %75 gibi oldukça yüksek düzeydedir. İV uygulamadan sonra, ilk dağılım
volümü yaklaşık olarak 0.2-0.3 L/kg’dır. Karnitin esas olarak renal yoldan atılır (96).
İnsanlarda yüksek dozda karnitin alımına bağlı toksisite bildirilmemiştir. Hayvanlarda
ise letal doz (LD50) 19.2 g/kg’dır. Doz çalışmaları ile bir seferde 2 g’dan fazla verilmesinin
kan konsantrasyonunu değiştirmediği gösterilmiştir. Karnitin ile yapılan proteksiyon amaçlı
çalışmalarda, 100-300 mg/kg/gün doz aralığı kullanılmıştır (97). Karnitin ve esterlerinin bir
çok farmakolojik etkilerinin yanında terapötik yararları da gösterilmiştir. Örneğin SR’leri
temizleme özellikleri sayesinde, ATP yapımında artış ve mitokondriyal fonksiyonlarda
düzelme yaptıkları gözlenmiştir (23). ALC, ülser oluşumunda alkolün etkisine karşı koruyucu
etkiye sahip olduğu gibi, paklitaksel ve sisplatin KT’si ile oluşan nörotoksisiteye karşı
koruyucu etkiye sahiptir (98,99).
Uzun süreli diyaliz uygulamalarından sonra plazma ve doku karnitin düzeylerinin
anlamlı ölçüde azaldığı bugün iyi bilinmektedir. Bunun temel nedeninin karnitinin diyalizle
uzaklaştırılması olduğu gösterilmiştir. Gerçekten de hemodiyalizden hemen sonra plazma
karnitin düzeyi %75 civarında azalmaktadır. Bu azalma öncelikle karaciğerden, az
miktarlarda ise kaslardan geçiş ile kompanse edilir. Karnitinin kaslardan plazmaya geçişi
oldukça yavaş olmasına rağmen, karaciğerden damar içine geçişi daha kolaydır. Bu nedenlerle
plazma karnitin seviyeleri doku düzeylerini yansıtmaktan uzaktır (100). Yapılan bir
çalışmada, hemodiyalize başladıktan 1 ay sonra plazma karnitinin normal seviyenin %30’u
düzeyine indiği, 1 yıl sonra ise yine normalin %40 altına indiği gösterilmiştir (101).
Hemodiyaliz hastalarında karnitinin İV verilmesinin diyaliz sırasında hipotansiyonu azalttığı,
18
miyokardı koruduğu, anemi oluşumunu engellediği, kas gücü ve egzersiz kapasitesini olumlu
etkilediği
bildirilmektedir
(102).
Karnitinin
üroloji
literatüründe,
özellikle
sperm
hareketliliğini arttırması ile ilgili olarak infertilitede kullanımı bildirilmiş olup, libidoyu
arttırdığı, cinsel disfonksiyonlarda düzelme sağladığı ve testosteron düzeyini de arttırabileceği
belirtilmektedir. Ancak karnitinin testosteron düzeyine etkisi olmadığını belirten çalışmalar da
mevcuttur (103-105).
Radyasyon sırasında vücutta ortaya çıkan OSR lipidler, proteinler ve nükleik asitler
üzerinde hasarlara neden olur. Hücre membrandaki lipid komponentin peroksidasyonunun,
özellikle radyasyon hasarına duyarlı olduğu bildirilmiştir. Ek olarak membran lipid
peroksidasyonu, radyasyona bağlı hücre ölümü ile ilişkilidir. Bu etki membran transportu
akıcılığındaki ve bazı membran enzimlerinin aktivitelerindeki değişime bağlıdır (22). Bunun
yanında radyasyonun, plazma total antioksidan kapasitesinde belirgin bir azalmaya neden
olduğu gösterilmiştir. Tüm vücut ışınlamasının antioksidan kapasitede azalmaya ve oksidatif
streste artışa neden olduğu bilinmektedir (106). Karnitinin, radyasyonun sebep olduğu SR’ler
ile oluşan hücresel hasarda modülatör bir rol oynadığı düşünülmektedir (22). Hamsterlerde
tüm vücut ışınlaması sonuçlarını inceleyen bir çalışmada, anlamlı olarak karaciğer ve plazma
malondialdehid seviyeleri ile karaciğer glutatyon seviyelerinde azalma olduğu ve bu etkilerin
karnitin ile tersine çevrildiği gösterilmiştir. Tüm vücut RT’si uygulanan ratlarda, akciğer ve
karaciğer dokularında yükselen malondialdehid, plazmada yükselen karaciğer enzimleri
(ALT, AST ve GGTP) ile trigliserid ve kolesterol seviyelerinde karnitin ile anlamlı azalma
olduğu da gösterilmiştir. Bu sonuçların ALC’nin antioksidan etkileri sayesinde membran
permeabilitesini koruyarak oluşturduğu bildirilmiştir (23).
Ratlar üzerinde yapılan başka bir çalışmada 5 fraksiyonda toplam biyolojik eşdeğer
doz 60 Gy olacak şekilde tüm beyin ışınlanması yapılmış ve her fraksiyondan önce 100
mg/kg/gün İP karnitin uygulamasının RT’ye bağlı oluşan koklea hasarını önlemedeki etkisine
bakılarak, bu hasarı düzeltebildiği gösterilmiştir (107).
19
GEREÇ VE YÖNTEMLER
Bu çalışma 2006-2008 yılları arasında Trakya Üniversitesi Tıp Fakültesi (TÜTF)
Radyasyon Onkolojisi Anabilim Dalı, Kardiyoloji Anabilim Dalı ve Patoloji Anabilim Dalı
tarafından Deney Hayvanları Araştırma Laboratuvarında gerçekleştirilmiştir. Çalışmamız
TÜTFEK-2006/127 protokolü ile 28/09/2006 tarihinde TÜTF Etik Kurulu tarafından
onaylanmıştır. Trakya Üniversitesi Bilimsel Araştırma Merkezi tarafından 851 proje
protokolü ile 01/05/2007 tarihinde desteklenmiştir.
ÇALIŞMA GRUPLARI VE DENEY
Çalışmada ortalama ağırlıkları 200±28 gr olan, 3-4 aylık, Wistar Albino cinsi 64 adet
erkek rat kullanıldı. Ratlar TÜTF Deney Hayvanları Araştırma Laboratuarından temin edildi.
Tüm ratlar deneyin sonuna kadar 5’er ratlık kafeslerde, %50-60 nem oranı, 22±1 ºC
sıcaklıkta, 12 saat gece ve 12 saat gündüz ışık periyodu olan ortamda saklandı. Ratların
günlük temizlikleri yapıldı. Ratların tümüne %20 protein içeren yem ve su verildi. Çalışma
süresince haftalık ağırlık takibi yapıldı. Çalışmada 6 grup oluşturuldu:
1. Grup I: Yalnız RT uygulanan grup (10 rat)
2. Grup II: Yalnız serum fizyolojik (SF) verilen grup (10 rat)
3. Grup III: Karnitin ardından RT (KAR+RT) uygulanan grup (12 rat)
4. Grup IV: Sadece karnitin (KAR) uygulanan grup (10 rat)
5. Grup V: Amifostin ardından RT (AMF+RT) uygulanan grup (11 rat)
6. Grup VI: Sadece amifostin (AMF) uygulanan grup (11 rat)
20
Çalışmada
kontrol
ve
deney
grubundaki
tüm
hayvanlar
gruplarına
göre
numaralandırıldı. Çalışmanın başında, aynı stresi oluşturmak amacı ile tüm gruplara aynı
yöntemle anestezi uygulandı ve aynı yöntemle amifostin, karnitin veya SF uygulaması
yapıldı. RT, KAR+RT, ve AMF+RT gruplarının kalp bölgesine eksternal RT uygulandı. RT
grubundaki hayvanlara RT öncesi intraperitoneal (İP) SF uygulandı. KAR+RT grubundaki
hayvanlara RT’den 30 dakika önce İP olarak 300 mg/kg karnitin (Karnitin ampul, Sigma-tau,
Roma) (22), AMF+RT grubundaki hayvanlara RT’den 30 dakika önce İP olarak 200 mg/kg
amifostin (Ethyol, Erkim, İstanbul, Türkiye) (17) uygulandı. Uygulama yapıldığı gün SF
grubuna serum fizyolojik, KAR grubuna karnitin ve AMF+KAR grubuna amifostin İP olarak
uygulandı. AMF+RT grubundaki hayvanlardan biri RT uygulanmasından 1 gün sonra, RT
grubundan bir hayvan RT uygulanmasından 3 ay sonra öldü. RT’nin tamamlanmasından
sonra hayvanlar 6 ay süre ile izleme alındı. İzlem boyunca haftalık ağırlık ve genel durum
takibine devam edildi. Altıncı ay sonunda tüm gruplardaki ratlara anestezi uygulandıktan
sonra ratlar tahta zemine sırt üstü yatırılarak ayakları bant ile zemine sabitlenerek EKG aleti
(MP35 USB Data Acquistion Unit, Biopac System, Amerika Birleşik Devletleri) ile EKG’leri
çekildi (DI, DII, DIII derivasyonları). Anestezi altındaki ratların karınları açıldı, kesi göğüs
kafesine doğru uzatıldı. Diyaframları kesildi ve kollabe olan akciğerlerin arasından kalbe
ulaşıldı. Kalbin apeks bölgesinden enjektör ile girilerek 5cc kan alınarak sakrifiye edildi.
Daha sonra göğüs kafesi tam olarak açıldı ve kalp perikardı ile birlikte ana damarları da
içerecek şekilde çıkarıldı ve %10’luk formaldehitin içine kondu.
ANESTEZİ YÖNTEMİ
Denekler 50-60 mg/kg ketamin (Ketalar, Pfizer, İstanbul, Türkiye) ve 10 mg/kg
xylazine (Rompun, Bayer, İstanbul, Türkiye) ile intramüsküler (İM)
olarak anestezi
uygulandı.
RADYOTERAPİ UYGULAMASI
Her bir rat anestezi sağlandıktan sonra pron pozisyonda mavi köpük (Styrofoam, MedTec, Orange City, IA) üzerine 1.5 cm bolus konduktan sonra sabitlendi. Simülatör (Simics 2,
Mecaserto SA, Fransa) kullanılarak kalbi içeren 3x3 cm boyutlarında bir alan simüle edildi.
Simüle edilen ilk hayvanın alan görüntülemesi için röntgen filmi çekildi (Resim 1). Kaynakcilt mesafesi 100 cm olmak üzere ratların kalbinin göğüs duvarında cilde çok yakın olması
sebebi ile 1.5 cm bolus kullanılarak 2.5 cm derinliğe lineer akseleratör cihazı (2100 C/D,
21
Varian Medical Systems, ABD) ile 6 MV-X ışın kullanılarak tek fraksiyonda 600 cGy/dk doz
hızında 15 Gy eksternal RT uygulandı. Elde edilen röntgen filmi ile diğer ratların simülasyon
alanı kontrol edildi.
Şekil 5. Pron pozisyonda simülasyon filmi
HİSTOPATOLOJİK İNCELEME
Kalp dokuları 24 saatlik formaldehit tespitinden sonra apeks, basis ve ventrikül
ortasından geçen 3 transvers kesi ile dilimlere ayrıldı ve doku takibine kondu. Doku takibi
sonrası parafine gömülerek 4 mikron kalınlığında kesitler alındı. Kesitler hematoksileneozinde boyanarak miyokardiyal ve vasküler değişikliler açısından ışık mikroskobunda
incelendi. Dokular aynı zamanda fibrozisin değerlendirilmesi amacıyla Masson trikrom ve
van Gieson elastik boyaları ile boyandı.
Miyokardiyal
derecelendirilerek
dejenerasyon
Billingham’ın
değerlendirildi (108).
Bu
semikantitatif
derecelendirme
metoduna
sisteminde
göre
sitoplazmik
vakuolizasyon ve miyofibriler kayıp gösteren miyositlerin yüzde oranları kullanıldı (Tablo 4).
Vasküler hasar, ventriküler fibrozis ve atriyal fibrozis, radyasyona bağlı kalp
hasarında amifostinin etkilerini incelemiş olan Kruse ve ark. (16)’nın çalışmasına göre
değerlendirildi (Tablo 5).
22
Ventriküler fibrozis değerlendirmesinde 0’dan 3’e kadar derecelendirilerek oluşturulan
skala kullanılarak etkilenen alan incelendi (Tablo 6).
Atriyal fibrozis değerlendirmesinde 0’dan 3‘e kadar derecelendirilerek oluşturulan
skala kullanıldı (Tablo 7).
Tablo 4. Miyokardiyal dejenerasyon derecelendirmesi (108)
Derece
Miyokardiyal Dejenerasyon
0
Hasar yok
1
<%5
1.5
%5-15
2
%16-25
2.5
% 26-35
3
> % 35
Tablo 5. Vasküler hasar derecelendirmesi (16)
Derece Vasküler Hasar
0
1
2
3
Fibrozis yok, adventsiya kalınlığı ~ % 50 medya, vaskülit bulgusuna rastlanmadı
Hafif fibrozis, adventisya = medya ve / veya hafif derecede damar duvarında
iltihabi hücre infiltrasyonu
Orta derecede fibrozis, adventisya ~ 2 x medya ve / veya orta derece vaskülit
tablosu
Şiddetli fibrozis, adventisya > 3 x medya ve / veya ağır vaskülit tablosu
23
Tablo 6. Ventriküler fibrozis derecelendirmesi (16)
Derece Ventriküler Fibrozis
0
Etkilenen alan yok (Fibrozis yok)
1
Küçük bir etkilenen alan
2
< % 10
3
% 10-20
Tablo 7. Atriyal fibrozis derecelendirmesi (16)
Derece Atriyal Fibrozis
0
Fibrozis yok
1
Epikardiyal tabakada fibrozis
2
Epikardiyal ve miyokardiyal tabakada fibrozis
3
Epikardiyal, miyokardiyal ve endokardiyal tabakada fibrozis
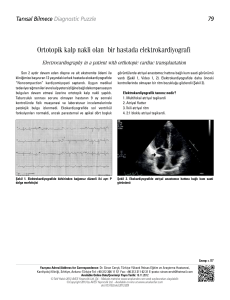
EKG DEĞERLENDİRMESİ
EKG kayıtlarının değerlendirilmesi sırasında; QT aralığı; Q dalgası başlangıcından T
dalgasının izoelektrik hatta döndüğü noktaya kadar geçen süre olarak ölçüldü. JT aralığı; QT
aralığından QRS dalgası süresinin çıkarılması ile bulundu. JTa aralığı; T dalgası başlangıcı ile
T dalgası tepesi ölçülmesi ile elde edildi. T tepesi – T sonu aralığı (TaTe), JT aralığından JTa
aralığının çıkarılması ile elde edildi. Sakrifikasyondan önce çekilen EKG’lerde 11 parametre
ölçülerek değerlendirildi (Şekil 6).
1. PR aralığı: P dalgası başlangıcı-QRS dalgası başı
2. QRS dalgası: QRS dalgası başı-QRS dalgası sonu
3. QT aralığı : QRS başı–T dalgası sonu
4. JT aralığı: QRS dalgası sonu–T dalgası sonu
5. JTa aralığı: QRS sonu–T dalgası tepesi
24
6. TaTe aralığı: T dalgası tepesi–T dalgası sonu
7. RR aralığı: Bir R dalgası tepesinden arkasındaki R dalgası tepesi
8. QTc: Kalp hızına göre düzeltilmiş QT aralığı
9. JTc: Kalp hızına göre düzeltilmiş JT aralığı
10. JTac: Kalp hızına göre düzeltilmiş JTa aralığı
11. TaTec: Kalp hızına göre düzeltilmiş TaTe aralığı
JTa TaTe
PR
QRS
JT
QT
Şekil 6. EKG’de ölçülen parametreler
İSTATİSTİKSEL ANALİZ
İstatistiksel değerlendirme, AXA507C775506FAN3 seri numaralı STATISTICA
AXA 7.1 istatistik programı kullanılarak yapıldı. Ölçülebilen verilerde normal dağılıma
uygunluk testi yapıldı ve normal dağılıma uymadığı için gruplar arası karşılaştırmalarda
Kruskal-Wallis varyans analizi ve anlamlı çıkanlara ikili karşılaştırmalarda Mann Whitney U
testi, 2xn düzenindeki tablolarda
beklenen değer 5’ten küçük olduğunda Kolmogorov
Smirnov İki Örnek testi kullanıldı. Tanımlayıcı istatistikler olarak aritmetik ortalama±SS
değerleri verildi. Tüm istatistikler için anlamlılık sınırı p<0.05 alındı.
25
BULGULAR
Çalışma; SF grubunda 10 hayvan, yalnız RT yapılan grupta 9 hayvan, KAR+RT
grubunda 12 hayvan, AMF+RT grubunda 10 hayvan, KAR grubunda 10 hayvan ve sadece
AMF grubunda 11 hayvanın sakrifiye edilmesi ile tamamlanmıştır. Histopatoloji ve EKG
verileri değerlendirilmiştir.
KALP DOKUSU İLE İLGİLİ HİSTOPATOLOJİK BULGULAR
Miyokardiyal dejenerasyon açısından incelendiğinde, özellikle RT grubunda kaslarda
belirgin miyofibriler kayıp ve sitoplazmik vakuolizasyon görülmüştür. RT ve SF grupları
arasında istatistiksel olarak anlamlı fark saptanmıştır (p<0,001) (Tablo 8). KAR+RT grubunda
hafif oranda miyokardiyal dejenerasyon mevcuttur. Bu grup, RT ve SF grupları ile
karşılaştırıldığında istatistiksel olarak anlamlı fark saptanmıştır (RT-KAR+RT, p=0.003; SFKAR+RT, p=0.016). Karnitinin RT’ye bağlı miyokardiyal dejenerasyondan koruyucu etkisi
saptanmıştır ancak SF grubu ile karşılaştırıldığında istenen düzeyde değildir. AMF+RT
grubunda miyokardiyal dejenerasyonda belirgin düzelme görülmüştür. RT grubu ile
karşılaştırıldığında istatistiksel olarak anlamlı fark saptanmıştır (RT-AMF+RT, p=0.001), SF
grubu ile karşılaştırıldığında ise istatistiksel olarak anlamlı fark saptanmamıştır (SFAMF+RT, p=0.400). Amifostinin RT’ye bağlı miyokardiyal dejenerasyonu önleyici etkisi
görülmüştür. Ayrıca KAR+RT ve AMF+RT grupları karşılaştırıldığında istatistiksel olarak
anlamlı fark saptanmamıştır (p=0.347). RT grubunda derece 2, 2.5 ve en büyük oranda derece
3 (%56) miyokardiyal dejenerasyon gözlenirken KAR+RT ve AMF+RT gruplarında derece 3
dejenerasyon saptanmamıştır. AMF+RT ile KAR+RT grupları arasındaki en önemli fark;
RT’ye amifostin eklenmesi ile derece 0 dejenerasyon %30 oranında görülürken karnitin
26
eklenmesinin derece 0 koruyucu etki yaratmamasıdır. SF grubunda %50 oranında derece 0,
%50 oranında derece 1 miyokardiyal dejenerasyon saptanması nedeniyle KAR+RT grubu ile
arasında istatistiksel fark ortaya çıkmıştır. KAR ve AMF gruplarında ise SF grubuna benzer
şekilde derece 0 ve 1 miyofibriler kayıp ve vakuoler dejenerasyon görülmüştür. Sadece 1
vakada AMF grubunda derece 1.5 miyokardiyal dejenerasyon saptanmıştır.
Tablo 8. Gruplarda görülen miyokardiyal dejenerasyon dereceleri ve oranları
Grup
Miyokardiyal
Dejenerasyon
Dereceleri
RT*
(n=9)
SF**
(n=10)
KAR+RT
(n=12)
KAR
(n=10)
AMF+RT
(n=10)
AMF
(n=11)
0
-
5 (%50)
-
6 (%60)
3 (%30)
6 (%55)
1
-
5 (%50)
4 (%33)
4 (%40)
3 (%30)
4 (%36)
1,5
-
-
2 (%17)
-
3 (%30)
1 (%9)
2
1 (%11)
-
5 (%42)
-
1 (%10)
-
2,5
3 (%33)
-
1 (%8)
-
-
-
3
5 (%56)
-
-
-
-
-
RT: Radyoterapi; SF: Serum fizyolojik; KAR: Karnitin; AMF: Amifostin.
RT grubu; SF, KAR+RT ve AMF+RT grupları ile karşılaştırıldığında p<0,01.
**
SF ile KAR+RT grupları karşılaştırıldığında p<0,02.
*
Vasküler hasar ve vasküler değişiklikler açısından yapılan incelemede, RT grubunda
derece 2 ve derece 3 vasküler hasar çoğunlukta olmak üzere belirgin vaskülit bulgularına ve
fibrozise rastlanmıştır. RT ve SF grupları arasında istatistiksel olarak anlamlı fark
saptanmıştır (p=0.001). KAR+RT ve AMF+RT gruplarına bakıldığında vasküler hasarın
benzer şiddette olduğu, RT grubu ile karşılaştırıldığında şiddet derecesinin biraz azalmış
olduğu tespit edilmiştir. KAR+RT grubu, RT ve SF grubu ile karşılaştırıldığında istatistiksel
olarak anlamlı fark saptanmamıştır (RT-KAR+RT, p=0.084; SF-KAR+RT, p=0.186).
Karnitinin RT’ye bağlı vasküler hasarı önlemede etkisi görülmemiştir. AMF+RT grubu, RT
ve SF grubu ile karşılaştırıldığında istatistiksel olarak anlamlı fark saptanmamıştır (RTAMF+RT, p=0.471; SF-AMF+RT, p=0.55). Amifostinin RT’ye bağlı vasküler hasarı
önlemede etkisi görülmemiştir. Ayrıca KAR+RT ve AMF+RT grubu karşılaştırıldığında
istatistiksel olarak anlamlı fark saptanmamıştır (p=0.998). RT’ye amifostin ve karnitin
eklenmesinin RT’ye bağlı vasküler hasarı önlemede istatistiksel olarak anlamlı etkisi
saptanmamış olmakla birlikte RT grubuna göre daha iyi histopatolojik bulgular görülmüştür.
27
RT grubunda derece 0 hasar saptanmamakla beraber KAR+RT grubunda %33, AMF+RT
grubunda %20 oranında derece 0 hasar izlenmiştir. Ayrıca RT grubunda görülen derece 2
(%67) ve derece 3 (%22) vasküler hasar oranı RT’ye karnitin eklendiğinde sırası ile %25 ve
%8’e, amifostin eklendiğinde ise %40 ve %10’a düşmüştür. KAR grubunda SF grubuna
benzer şekilde derece 0 ve 1 vasküler hasar görülmüşken AMF grubunda derece 0 vasküler
hasar oranında azalma ve derece 1 oranında artma ile 1 vakada derece 2 vasküler hasar
saptanmıştır (Tablo 9).
Tablo 9. Gruplarda görülen vasküler hasar dereceleri ve oranları
Grup
Vasküler
Hasar
Derecesi
RT*
(n=9)
SF
(n=10)
KAR+RT
(n=12)
KAR
(n=10)
AMF+RT
(n=10)
AMF
(n=11)
0
-
8 (%80)
4 (%33)
7 (%70)
2 (%20)
5 (%45)
1
1 (%11)
2 (%20)
4 (%33)
3 (%30)
3 (%30)
5 (%45)
2
6 (%67)
-
3 (%25)
-
4 (%40)
1 (%9)
3
2 (%22)
-
1 (%8)
-
1 (%10)
-
RT: Radyoterapi; SF: Serum fizyolojik; KAR: Karnitin; AMF: Amifostin.
RT grubu ile SF grubu karşılaştırıldığında p<0,01.
*
Ventriküler fibrozis açısından yapılan incelemede, RT grubunda derece 2 fibrozis
çoğunlukta olmak üzere belirgin fibrozise rastlanmıştır. RT ve SF grupları arasında
istatistiksel olarak anlamlı fark saptanmıştır (p<0.001). RT ventriküler fibrozise neden
olmaktadır (Tablo 10). KAR+RT ve AMF+RT gruplarına bakıldığında ventriküler fibrozisin
KAR+RT grubunda daha belirgin olduğu tespit edilmiştir. KAR+RT grubu, RT grubu ile
karşılaştırıldığında istatistiksel olarak anlamlı fark saptanmıştır. Karnitinin ventriküler
fibrozisten koruyucu etkisi görülmüştür. Bununla beraber SF grubu ile karşılaştırıldığında bu
etki istenen düzeyde değildir (RT-KAR+RT, p=0.009; SF-KAR+RT, p<0.001). AMF+RT
grubu, RT grubu ile karşılaştırıldığında istatistiksel olarak anlamlı fark saptanmıştır ancak SF
grubu ile karşılaştırıldığında istatistiksel anlamlı fark saptanmamıştır (RT-AMF+RT,
p=0.006; SF-AMF+RT, p=0.759). Amifostinin RT’ye bağlı ventriküler fibrozisi önleyici
etkisi saptanmıştır. KAR+RT ve AMF+RT grupları karşılaştırıldığında istatistiksel olarak
anlamlı fark saptanmıştır (p=0.032). Amifostin ventriküler fibrozisi önlemede karnitinden
etkilidir. KAR ve AMF gruplarında ise SF grubuna benzer şekilde büyük oranda derece 0
28
ventriküler fibrozis görülmekle birlikte KAR grubunda 1 vakada, AMF grubunda 2 vakada
derece 1 ventriküler fibrozis saptanmıştır.
Tablo 10. Gruplarda görülen ventriküler fibrozis dereceleri ve oranları
Grup
Ventriküler
Fibrozis
Dereceleri
RT*
(n=9)
SF**
(n=10)
KAR+RT***
(n=12)
KAR
(n=10)
AMF+RT
(n=10)
AMF
(n=11)
0
-
10 (%100)
1 (%8)
9 (%90)
7 (%70)
9 (%82)
1
1 (%11)
-
9 (%75)
1 (%40)
2 (%20)
2 (%18)
2
7 (%78)
-
1 (%8)
-
1 (%10)
-
3
1 (%11)
-
1 (%8)
-
-
-
RT: Radyoterapi; SF: Serum fizyolojik; KAR: Karnitin; AMF: Amifostin.
* RT grubu; SF, KAR+RT ve AMF+RT grupları ile karşılaştırıldığında p<0,01.
** SF ile KAR+RT grubu karşılaştırıldığında p<0,01.
*** KAR+RT grubu ile AMF+RT grubu karşılaştırıldığında p<0,05.
Atriyal fibrozis açısından incelendiğinde, RT grubunda epikardiyal, miyokardiyal ve
endokardiyal yüzeylerde bağ dokusu artışı tespit edilmiştir. RT ve SF grupları arasında
istatistiksel olarak anlamlı fark saptanmıştır (p=0.006). RT’nin atriyal fibrozise neden olduğu
saptanmıştır. KAR+RT ve AMF+RT gruplarındaki atriyal fibrozis değerlendirildiğinde derece
3 fibrozis görülmemiştir. Ancak her iki grubta da AMF+ RT grubunda daha düşük derece
olmak üzere atriyal fibrozis izlenmiştir. KAR+RT grubu, RT ve SF grubu ile
karşılaştırıldığında istatistiksel olarak anlamlı fark saptanmamıştır (RT-KAR+RT, p=0.262;
SF-KAR+RT, p=0.579). Karnitinin RT’ye bağlı atriyal fibrozisi önlemede etkisi yoktur.
RT’ye karnitin eklenmesi ile RT grubuna göre düşük derecelerin yüzdesinde artış saptanmış
olmasına rağmen %33 derece 2 atriyal fibrozis görülmüştür. AMF+RT grubu, RT ile
karşılaştırıldığında istatistiksel olarak anlamlı fark saptanmış iken (RT-AMF+RT, p=0.026),
SF grubu ile karşılaştırıldığında istatistiksel olarak anlamlı fark saptanmamıştır (SF-AMF+SF,
p=0.759). Amifostinin RT’ye bağlı atriyal fibrozisi önleyici etkisi görülmüştür. KAR+RT ve
AMF+RT grupları karşılaştırıldığında istatistiksel olarak anlamlı fark saptanmamıştır
(p=0.928). RT grubunda %67 derece 2 atriyal fibrozis görülmüşken, KAR+RT grubunda
%33, AMF+RT grubunda %10 derece 2 atriyal fibrozis görülmüştür. Ayrıca RT grubunda
derece 0 atriyal fibrozis saptanmamakla birlikte KAR+RT grubunda %33, AMF+RT
grubunda %30 derece 0 atriyal fibrozis saptanmıştır. RT’ye karnitin eklenmesinin
histopatolojik olarak istatistiksel anlamlılığa ulaşmayan kısmi bir koruyucu etkisi olduğu
29
söylenebilir. Amifostin ile arasındaki en önemli fark derece 2 atriyal fibrozis oranının daha
yüksek olmasıdır (Tablo 11). KAR ve AMF gruplarında ise SF grubuna benzer şekilde derece
0 ve 1 atriyal fibrozis görülmüştür.
Tablo 11. Gruplarda görülen atriyal fibrozis dereceleri ve oranları
Grup
Atriyal
Fibrozis
Derecesi
RT*
(n=9)
SF
(n=10)
KAR+RT
(n=12)
KAR
(n=10)
AMF+RT
(n=10)
AMF
(n=11)
0
-
6 (%60)
4 (%33)
7 (%70)
3 (%30)
9 (%82)
1
2 (%22)
4 (%40)
4 (%33)
3 (%30)
6 (%60)
2 (%18)
2
6 (%67)
-
4 (%33)
-
1 (%10)
-
3
1 (%11)
-
-
-
-
-
RT: Radyoterapi; SF: Serum fizyolojik; KAR: Karnitin; AMF: Amifostin.
* RT grubu, SF ve AMF+RT grupları ile karşılaştırıldığında p<0,03.
Histopatolojik inceleme sonucunda; tüm gruplara ait radyasyona bağlı olarak kalpte
oluşan miyokardiyal dejenerasyon, vasküler hasar, ventriküler fibrozis ve atriyal fibrozis
dereceleri Tablo 12’de verilmiştir.
Tablo 12. Tüm gruplara ait histopatolojik değerler
Grup Adı
Grup I (RT)
Rat Adı
Miyokardiyal Vasküler
Dejenerasyon Hasar
Derecesi
Derecesi
Ventriküler Atriyal
Fibrozis
Fibrozis
Derecesi
Derecesi
I-1
3
2
2
3
I-3
3
1
2
2
I-4
2,5
2
1
2
I-5
3
3
3
2
I-6
2,5
2
2
2
I-7
2,5
2
2
1
I-8
2
2
2
2
RT: Radyoterapi.
30
Tablo 12 devamı. Tüm gruplara ait histopatolojik değerler
Grup Adı
Rat Adı
Miyokardiyal
Dejenerasyon
Derecesi
Vasküler
Hasar
Derecesi
Ventriküler
Fibrozis
Derecesi
Atriyal
Fibrozis
Derecesi
I-9
3
2
2
1
I-10
3
3
2
2
II-1
1
0
0
0
II-2
1
0
0
1
II-3
1
0
0
0
II-4
0
0
0
1
II-5
0
1
0
1
II-6
0
1
0
0
II-7
0
0
0
0
II-8
1
0
0
1
II-9
1
0
0
0
II-10
0
0
0
0
III-1
2,5
1
1
1
III-2
2
0
3
2
III-3
2
1
1
1
III-4
1,5
2
1
2
III-5
1
1
1
0
III-6
1
2
1
1
III-7
2
1
1
2
III-8
2
3
2
2
Grup I (RT)
Grup II (SF)
Grup III
(KAR+RT)
RT: Radyoterapi; SF: Serum fizyolojik; KAR: Karnitin.
31
Tablo 12 devamı. Tüm gruplara ait histopatolojik değerler
Grup Adı
Grup III
(KAR+RT)
Grup IV (KAR)
Rat Adı
Miyokardiyal Vasküler
Dejenerasyon Hasar
Derecesi
Derecesi
Ventriküler Atriyal
Fibrozis
Fibrozis
Derecesi
Derecesi
III-9
1
0
1
0
III-10
2
0
0
0
III-11
1
2
1
1
IV-1
0
0
0
0
IV-2
0
0
0
0
IV-3
1
0
0
0
IV-4
0
1
0
1
IV-5
1
0
0
0
IV-6
0
0
1
1
IV-7
0
1
0
0
IV-8
1
0
0
0
IV-9
0
0
0
1
IV-10
1
1
0
0
V-1
1
2
1
1
V-2
1
0
0
1
V-3
2
3
2
2
V-4
1,5
2
1
1
V-5
1
2
0
1
V-6
1,5
2
0
1
V-8
1,5
1
0
0
Grup V (AMF+RT)
KAR: Karnitin; RT: Radyoterapi; AMF: Amifostin.
32
Tablo 12 devamı. Tüm gruplara ait histopatolojik değerler
Grup Adı
Grup V (AMF+RT)
Rat Adı
Miyokardiyal Vasküler
Dejenerasyon Hasar
Derecesi
Derecesi
Ventriküler Atriyal
Fibrozis
Fibrozis
Derecesi
Derecesi
V-9
0
1
0
0
V-11
0
1
0
0
V-12
0
0
0
1
VI-1
0
0
0
0
VI-2
0
1
0
0
VI-3
1
1
0
0
VI-4
0
1
0
1
VI-5
1
0
0
0
VI-6
0
0
0
0
VI-7
1
0
0
0
VI-8
1
0
1
0
VI-9
0
1
0
0
VI-10
0
1
1
0
VI-11
1,5
2
0
1
Grup VI (AMF)
AMF: Amifostin; RT: Radyoterapi.
EKG DEĞERLENDİRMESİNE AİT BULGULAR
PR aralığı, uyarının sinüs nodundan çıkıp purkinje liflerine ulaşmasına kadar geçen
süreyi tanımlamaktadır (ventrikül miyokardından miyositlere geçiş süresi). Gruplar arasında
PR aralığında farklılık saptanmamıştır (χ2=4.264, p=0.512).
QRS, ventrikül içi ileti zamanını (ventrikül depolarizasyon süresini) göstermektedir.
Gruplar arasında QRS aralığında farklılık saptanmamıştır (χ2=5.773, p=0.329).
33
QT aralığı hem ventriküler depolarizasyon hem de ventriküler repolarizasyonu
tanımlamaktadır. Gruplar arasında QT aralığında farklılık saptanmamıştır (χ2=7.772,
p=0.169).
JT aralığı ventriküler repolarizasyonu tanımlamaktadır. Gruplar arasında JT aralığında
farklılık saptanmamıştır (χ2=6.580, p=0.254).
JTa aralığı ventriküler repolarizasyon başlangıcını tanımlamaktadır. İstatistiksel
analizde gruplar arasında anlamlı fark saptanmıştır (χ2=19.674, p=0.001; Şekil 7). RT grubu,
SF grubu ile karşılaştırıldığında RT’nin JTa aralığını anlamlı derecede uzattığı görülmüştür
(RT-SF; p=0.001). RT’ye karnitin eklenmesinin ve amifostin eklenmesinin JTa aralığının
uzamasını önlediği saptanmıştır (RT-KAR+RT, p=0.004; RT-AMF+RT, p=0.008). JTa
aralığının uzamasını önlemede KAR+RT grubu ile AMF+RT grubu karşılaştırıldığında
istatistiksel olarak anlamlı fark saptanmamıştır (p=0.867).
TaTe ventriküler repolarizasyon sonlanımını tanımlamaktadır. Gruplar arasında
istatistiksel anlamlı fark saptanmamıştır (χ2=7.447, p=0.189).
JTc,
kalp
atım hızına göre düzeltilmiş
JT
(ventriküler
repolarizasyon)’yi
tanımlamaktadır. Gruplar arasında istatistiksel olarak anlamlı fark saptanmamıştır (χ2=7.816,
p=0.116 ).
TaTec, kalp atım hızına göre düzeltilmiş TaTe (ventriküler repolarizasyon
sonlanımı)’yi tanımlamaktadır. Gruplar arasında istatistiksel anlamlılık saptanmamamıştır
(χ2=4.726, p=0.450).
RR aralığı dakikada kalp atım sayısını tanımlamaktadır. Gruplar arasında kalp atım
hızı açısından anlamlı farklılık saptanmıştır (χ2=14.644, p=0.012; Şekil 8). RT’nin kalp hızını
azalttığı şeklinde istatistiksel eğilim bulunsa da anlamlılık saptanmamıştır (RT-SF, p=0.055).
RT-KAR+RT grupları karşılaştırıldığında istatistiksel fark saptanmamıştır (RT-KAR+RT,
p=0.776). SF-KAR+RT grupları karşılaştırıldığında istatistiksel fark saptanmıştır (SFKAR+RT,
p=0.011).
RT-AMF+RT
grupları
karşılaştırıldığında
istatistiksel
fark
saptanmamıştır (RT-AMF+RT, p=0.060). RT’ye amifostin eklenmesi ile SF grubu arasında
kalp hızı açısından istatistiksel olarak anlamlı fark saptanmamıştır (p=0.055). KAR+RT ile
AMF+RT grupları karşılaştırıldığında istatistiksel olarak anlamlı fark saptanmıştır (KAR+RTAMF+RT; p=0.024).
QTc, hıza göre düzeltilmiş QT aralığını (ventriküler depolarizasyon ile repolarizasyon
arasındaki süre) tanımlamaktadır. QTc aralığı değerlendirildiğinde gruplar arasında
istatistiksel olarak farklılık vardır (χ2=12.595, p=0.027; Şekil 9). RT’nin QTc’yi uzattığı
saptanmıştır (RT-SF, p=0.027). Bununla birlikte, RT’ye karnitin eklenmesi RT’ye bağlı QTc
34
25
JTa aralığı (msn)
20
15
*
10
5
0
RT
SF
KAR+RT
AMF+RT
GRUP
Şekil 7. Gruplara göre JTa aralığı süresi ve standart sapma değerleri
RT: Radyoterapi; SF: Serum fizyolojik; KAR: Karnitin; AMF: Amifostin.
χ2=19.674, p=0,001.
* RT-SF, p=0,001; RT-KAR+RT, p=0,004; RT-AMF+RT, p=0,008.
180
160
140
*
RR aralığı (msn)
120
**
100
80
60
40
20
0
RT
SF
KAR+RT
AMF+RT
GRUP
Şekil 8. Gruplara göre RR aralığı süresi ve standart sapma değerleri
RT: Radyoterapi; SF: Serum fizyolojik; KAR: Karnitin; AMF: Amifostin.
χ2=14.644, p=0,012.
* SF-KAR+RT, p<0,02.
** KAR+RT-AMF+RT, p<0,03.
35
uzamasını istatiksel olarak anlamlı oranda önlemiştir (RT-KAR+RT, p=0.004). RT’ye
amifostin eklenmesi de RT’ye bağlı QTc uzamasını istatiksel anlamlı oranda azaltmıştır (RTAMF+RT, p=0.045). RT’ye karnitin eklenmesi ile amifostin eklenmesi karşılaştırıldığında
istatiksel anlamlı fark saptanmamıştır (p=0.187).
JTac, kalp atım hızına göre düzeltilmiş JTa’yı (ventriküler repolarizasyon başlangıcı)
tanımlamaktadır. Gruplar arasında istatistiksel olarak anlamlı fark saptanmıştır (χ2=23.417,
p<0.001; şekil 10). Bununla birlikte, RT’nin JTac’yi uzattığı, (RT-SF, p<0.001). RT’ye
karnitin eklenmesinin JTac’nin uzamasını istatiksel olarak anlamlı oranda önlediği
görülmüştür (RT-KAR+RT, p=0.007). Benzer olarak, RT’ye amifostin eklenmesi de JTac’nin
uzamasını önlemiştir (RT-AMF+RT, p=0.007). Ancak, RT’ye karnitin eklenmesi ile
amifostin eklenmesinin, JTac üzerine koruyucu etkileri istatiksel olarak benzerdi (p=0.390).
250
QTc (msn/sn)
200
150
100
50
0
RT
SF
KAR+RT
AMF+RT
GRUP
Şekil 9. Gruplara göre QTc süresi ve standart sapma değerleri
RT: Radyoterapi; SF: Serum fizyolojik; KAR: Karnitin; AMF: Amifostin.
χ2=12.595, p=0,027.
* RT-SF, p=0,027; RT-KAR+RT, p=0,004; RT-AMF+RT, p=0,045.
Altmış iki ratın sakrifikasyondan hemen önce çekilen EKG’lerinden hesaplanan
parametrelerin ortalama ve standart sapma değerleri Tablo 13’de verilmiştir. Histopatolojik
bulgulara örnekler Şekil 11-15’de verilmiştir.
36
60
50
*
JTac (msn/sn)
40
30
20
10
0
RT
SF
KAR+RT
AMF+RT
GRUP
Şekil 10. Gruplara göre JTac süresi ve standart sapma değerleri
RT: Radyoterapi; SF: Serum fizyolojik; KAR: Karnitin; AMF: Amifostin.
χ2=23.417, p<0,001.
* RT-SF, p<0.001; RT-KAR+RT, p=0,007; RT-AMF+RT, p=0,007.
** SF-KAR+RT, p=0,055.
37
Tablo 13. Gruplara göre EKG parametrelerinin ortalama ve standart sapma değerleri
PR
ortalama±SS
QRS
ortalama±SS
QT
ortalama±SS
JT
ortalama±SS
JTa
ortalama±SS
TaTe
ortalama±SS
21.44±2,70
14,89±0,60
58,22±7,93
43,67±9,82
13,89±6,88
28,67±4,61
SF
22,40±3,41
14,40±1,07
54,30±10,55
40,20±10,07
7,60±1,43
32,50±10,30
KAR+RT
21,75±2,53
14,58±,67
49,83±5,73
35,17±6,41
8,33±1,67
26,92±5,58
AMF+RT
24,80±5,09
15,90±3,60
56,70±5,70
41,90±5,47
8,40±2,07
34,60±4,83
GRUP
RT
38
EKG: Elektrokardiyografi; RT: Radyoterapi; SF: Serum fizyolojik; KAR: Karnitin; AMF: Amifostin; SS: Standart sapma.
Tablo 13 devamı. Gruplara göre EKG parametrelerinin ortalama ve standart sapma değerleri
39
GRUP
RR
ortalama±SS
QTc
ortalama±SS
JTc
ortalama±SS
JTac
ortalama±SS
TaTec
ortalama±SS
RT
117,44±41,40
191,11±45,82
127,56±16,55
39,44±13,26
86,11±14,28
SF
123,00±13,81
153,80±26,13
113,20±24,88
21,20±3,68
91,20±26,51
KAR+RT
106,42±10,97
153,25±15,03
107,08±17,30
25,58±5,38
81,83±15,09
AMF+RT
121,40±15,93
162,50±13,27
121,60±14,57
24,00±6,94
97,10±11,74
EKG: Elektrokardiyografi; RT: Radyoterapi; SF: Serum fizyolojik; KAR: Karnitin; AMF: Amifostin; SS: Standart sapma.
Şekil 11: SF (Serum fizyolojik) grubunda A- miyokardiyal kas demetlerindeki
normal görünüm (H&E x 100), B- Endokard ve miyokardta yeşil renkte
boyanan bağ dokusu (fibrozis) görülmemekte (Masson Trikrom x 50)
Şekil 12: A- KAR (Karnitin) grubundaki miyokardiyal kas demetlerinde ve
vasküler yapılardaki normal görünüm (H&E x 200), B- AMF
(Amifostin)
grubundaki
miyokardiyal kas demetlerinde
ve
vasküler yapılardaki normal görünüm (H&E x 200).
40
41
Şekil 13: RT (Radyoterapi) grubunda, A- Ventrikül ve B- Atriyuma ait kas demetlerinde belirgin miyofibriler kayıp, sitoplazmik
vakuolizasyon ve nükleer irileşme (H&E x 100), C- Miyokard içindeki damar duvarında vaskülit bulguları,
intimal kalınlaşma, endotel nükleuslarında pleomorfizm ve nükleer irileşme (H&E x 200), D- Mason Trikrom boyamada
ventrikülde miyokardiyal fibrozis (Masson Trikrom x 12.5), E- Atriyumda damar duvarında ve epimiyokardiyal
mesafede fibrozis yeşil olarak görülmekte (Masson Trikrom x 50), F- Ventrikül dış kısmında izlenen bir damar duvarında
kalınlaşma ve bağ dokusu artışı (Masson Trikrom x 200)
42
Şekil 14: A- KAR+RT (Karnitin-Radyoterapi) grubunda miyokardiyal dejenerasyonda kısmı düzelme izlenmekte (H&E x 50), BVasküler hasar devam etmekte (H&E x 100), C- Masson Trikrom ile de endokardiyal yüzeydeki ve vasküler yapılar
çevresindeki bağ dokusu artışı gözlenmekte (Masson Trikrom x 12.5)
Şekil 15: A- AMF+RT (Amifostin-Radyoterapi) grubunda miyokard kas fibrillerindeki değişikliklerin düzeldiği ve SF grubuna benzer
olduğu görülmekte (H&E x 50),
B- Vasküler yapılarda ise kalınlık artışı devam etmekte ancak vaskülit tablosu
gözlenmemekte (H&E x 100), C- Masson Trikrom boyamada endokardiyal fibrozisin minimal düzeyde olduğu görülmekte
(Masson Trikrom x 50)
TARTIŞMA
Kalbin, RT’ye bağlı hasara nispeten dirençli olduğu düşünülmesine rağmen toraksa
uygulanan RT sonucu oluşabilecek kardiyovasküler hastalık riski önemli bir problemdir (7).
Bu çalışmada: 1- 15 Gy kardiyak RT’nin vasküler hasar, atriyal fibrozis, miyokardiyal
dejenerasyon ve ventriküler fibrozise neden olduğu, 2- Amifostinin atriyal fibrozis,
miyokardiyal dejenerasyon ve ventriküler fibrozis açısından kalbi koruduğu, 3- Karnitinin
eklenmesinin sadece RT uygulanan gruba göre miyokardiyal dejenerasyon ve ventriküler
fibrozis açısından kalbi koruduğu ancak kontrol grubu ile karşılaştırıldığında koruyucu
etkisinin istenen düzeyde olmadığı; vasküler hasar ve atriyal fibrozis açısından ise istatistiksel
olarak anlamlı koruyucu etkisi olmamakla birlikte RT’ye bağlı kalp hasarını histopatolojik
olarak azalttığı, 4- Miyokardiyal dejenerasyon, vasküler hasar ve atriyal fibrozis açısından
amifostin ve karnitin kolları istatistiksel olarak benzer bulunsa da, amifostinin miyokardiyal
dejenerasyon ve ventriküler fibrozisten koruyucu etkisinin karnitinden daha fazla olduğu;
ayrıca amifostinin karnitinin etkin olmadığı atriyal fibroziste de koruyucu özellik gösterdiği,
5- Kalbe uygulanan RT’nin JTa, QTc ve JTac’de uzamaya neden olduğu, 6- Karnitin ve
amifostinin JTa, QTc, JTac aralıklarının uzamasını önlediği ve etkilerinin benzer olduğu
görülmüştür.
Radyasyona bağlı kalp hasarında perikard, miyokard, ileti sistemi veya koroner
damarlar etkilenebilmekte, kalpte oluşan hasarlar akut veya geç dönemde ortaya
çıkabilmektedir. Kardiyak RT toleransı (TD 5/5), kalbin %24 veya daha azı ışınlandığında 60
Gy iken kalp volümünün %65 veya daha fazlası ışınlandığında 45 Gy’e kadar düşmektedir
(28-30). Kardiyak tolerans değerlendirilirken fraksiyonasyon şeması ve tedavi alanının
volümü kardiyak toleransı önemli ölçüde etkilemektedir.
43
Ancak RT sonrasında kalpte görülen klinik yan etkilerin radyobiyoloji açısından tam
olarak anlaşılamadığının da altı çizilmesi gerekmektedir. Bunun nedeni, diğer organlarla
karşılaştırıldığında kalbin muhtemelen perikard, miyokard, ileti sitemi, vasküler yapılar gibi
hayati önemi olan farklı radyosensitif yapılar içermesi olabilir (109). Çeşitli hayvan
modellerinde RT sonrasında kalbin histopatolojik cevabı araştırılmıştır (110,111). Ratlarda
bilginin büyük çoğunluğu miyokard üzerinedir. RT sonrasında kalpteki patolojik değişiklikler
Fajardo ve Steward (112), Lauk ve ark. (110) ve Schultz-Hector (113) tarafından da
bildirildiği gibi küçük miyokardiyal dejenerasyon odakları, perivasküler ve intestisyel fibrozis
ile karakterizedir. Schultz-Hector (113) ratlarda ve tavşanlarda tek doz 20 Gy X ışını (300 kV)
uygulanmasından sonra 70 günde miyokardiyal dejenerasyon saptarken, Lauk (114) benzer
şekildeki etkiyi 15 Gy tek fraksiyon X ışını uygulamasından 120 gün sonra görmüştür. Lineer
kuadratik model kullanıldığında kalbe uygulanan 15 ile 20 Gy arasındaki tek dozların klinik
olarak 2 Gy’lik 20-30 günlük fraksiyonda 40-60 Gy total klinik RT rejimine biyoeşdeğer doz
olduğu görülür. Bu hesaplamada miyokard için alfa/beta oranı 3.7 Gy varsayılmıştır (115).
Düşük dozlardan sonra klinik semptomların ortaya çıkması için 300-400 günün geçmesi
gerekir (115). Bizim çalışmamızda ışınlama lineer akseleratör ile açısız anterior tek alan
kullanılarak, literatür ile uyumlu olarak 15 Gy dozda yapılmıştır ve 180 gün sonra yapılan
histopatolojik incelemede sadece RT uygulanan grupta %67 skor 2 vasküler dejenerasyon,
%67 skor 2 atriyal fibrozis, % 56 skor 3 miyokardiyal dejenerasyon, %78 skor 2 ventriküler
fibrozis saptanmıştır. RT grubu ile SF grubu karşılaştırıldığında RT’nin vasküler
dejenerasyona (p=0.001), atriyal fibrozise (p=0.006), miyokardiyal dejenerasyona (p<0.001),
ventriküler fibrozise (p<0.001) neden olduğu saptanmıştır.
Toraks ışınlaması ardından, klinik olarak saptanabilen kalp hasarının genel insidansı,
Hodgkin hastalığı tanılı Mantle alanı ile tedavi edilen hastalarda yaklaşık olarak %30’dur (6).
Hodgkin hastalığı tanılı 2232 hastayı içeren çalışmada (ortalama yaş 29) kalp hastalığından
ölüm riski, 9.5 yıllık ortalama takip sonrasında %3.9 bulunmuştur (59). Bu çalışmada
kardiyak nedenli ölen 88 hastanın 55’inin ölüm nedeni miyokard infarktüsüdür. Aynı
çalışmada, kardiyomiyopatiden, kapak disfonksiyonundan ve perikard hastalığından
kaynaklan anlamlı mortaliteler de bildirilmiştir. Kardiyak ölüm riskinin en fazla olduğu
hastalar, toraksa 30 Gy’den fazla RT dozu uygulanmış ve tedavi sırasında 20 yaşından küçük
olan hasta grubudur. Özellikle kardiyak yan etki riski yüksek hastalarda kardiyoprotektif
tedavi tekniklerinin kullanılmasına rağmen radyasyona bağlı kardiyak morbidite riskinin
ortadan kalkmaması kardiyoprotektif ajanlara ilginin artmasına neden olmuştur. Üzerinde en
sık çalışılan ve en popüler olan radyoprotektör ajan amifostin’dir. Amifostin membrana bağlı
44
alkalen fosfataz tarafından aktif sülfidril metabolitine (WR-1065) çevrilen bir organik
tiyofosfattır (116). WR-1065’in doksorubisin tarafından oluşturulan süperoksit anyonları ile
hidroksil radikallerine direkt olarak detoksifiye ettiği in vitro olarak gösterilmiştir (117).
Ortamdaki OSR temizlenmesi ve DNA tamirinin etki mekanizmasında önemli yeri olduğu
düşünülmektedir (75).
Deneysel çalışmalarda doksorubisin de dahil olmak üzere birçok kemoterapötik ajanın
kalp üzerine toksik etkisinin amifostin tarafından azaltıldığı gösterilmiştir (118). Hem
amifostin hem de WR-1065 (amifostinin defosforile olmuş metaboliti)’in doksorubisine
maruz kalmış neonatal ratlarda kardiyak miyositlerin viabilitesini arttırdığı bildirilmiştir (14).
Ohnishi ve ark. (117), amifostinin kardiyak koruyucu etkisinin antioksidan aktivite ile ilişkili
olduğunu, rat kalplerinden elde edilen mitokondri preparatlarında amifostinin doksorubisine
bağlı ortaya çıkan OSR’yi azalttığı göstermiştir. Dobric ve ark. (15) ise doksorubisinin
oluşturacağı kardiyak hasarı amifostinin (300 mg/kg) azalttığını saptamıştır.
Amifostin, yüksek in vivo aktivitesi ve orta derecede toksisitesi nedeniyle
radyasyonun terapötik oranını arttıran bir radyoprotektan olarak kullanılmaktadır (119, 120).
Herman ve ark. (121) 12 hafta boyunca haftada bir kez doksorubisinden (1 mg/kg, İV) yarım
saat önce 200 mg/kg İP amifostin uygulamışlar ve doksorubisin öncesinde amifostin
kullanılmasının miyokardiyal dejenerasyonu azalttığını saptamışlardır (p<0.001). Tokatlı ve
ark. (17) ratlara tek doz toraks RT’den önce 200 mg/kg İP amifostin uygulamışlar ve
amifostinin miyokardiyal dejenerasyonu önlediğini saptamışlardır. Kruse ve ark. (16) ratlara
tek doz toraks RT’den önce 160 mg/kg amifostin uygulamışlar ve RT’ye bağlı kardiyak
hasarda histopatolojik olarak azalma saptamışlardır. Uzal ve ark. (122) tavşanlarla yaptıkları
çalışmada, Co-60 cihazı ile sağ hemitoraksa tek fraksiyonda 20 Gy RT’den 30 dk önce 200
mg/kg İP amifostin uygulamışlar ve 14 gün sonra sintigrafik olarak yaptıkları
değerlendirmede amifostinin radyasyona bağlı akut akciğer hasarına karşı koruyucu olduğunu
saptamışlardır. Damron ve ark. (123)’nın ratlarla yaptıkları çalışmasında, tek fraksiyonda 17.5
Gy RT öncesi sırası ile 0, 50, 100, 150, 200 ve 250 mg/kg İP amifostin uygulaması
karşılaştırılmıştır. Amifostin dozlarına göre ortalama büyüme, büyüme kaybı ve bacak boyları
arasında istatistiksel anlamlı olarak doz bağımlı farklılıklar bulunmuştur. Ortalama büyüme
amifostinin 50 mg/kg uygulamasında %14 iken 250 mg/kg uygulamasında %57 bulunmuştur.
Artan amifostin dozları ile büyüme kaybı ve sağlam bacakla olan boy farkında anlamlı azalma
olduğu gösterilmiştir. Lamproglou ve ark. (124)’nın çalışmasında, 30 Gy tüm beyin ışınlaması
öncesi ratlara 37.5 mg/kg, 75 mg/kg, 150 mg/kg amifostin uygulanmış ve 75 mg/kg ile 150
45
mg/kg amifostin kullanımının radyasyona bağlı öğrenme ve geçici hafıza bozukluğunu
önlediği saptanmıştır. La Scala ve ark. (125) 7 haftalık tavşanlar üzerinde yaptıkları
çalışmalarında, sağ orbitozigomatik bölgeye ortavoltaj radyasyon ile 6 fraksiyonda toplam 35
Gy RT ve test grubuna her fraksiyon öncesinde 200 mg/kg İV amifostin uygulamışlardır.
Kemik büyümesi seri radyografi ve bilgisayarlı tomografi ile değerlendirilmiştir. Amifostinin,
RT’nin kranyofasiyal kemik büyümesi üzerine olan olumsuz etkisini yüksek oranda anlamlı
olarak önlediğini göstermişlerdir. Bizim çalışmamızda da literatür ile uyumlu olarak ratlara
tek doz RT ve 200 mg/kg amifostin verildi.
Literatürde amifostinin kalp ışınlamasına karşı koruyucu değeri olduğunu gösteren iki
tane çalışma bulunmaktadır (16,17). Kruse ve ark. (16) 12 haftalık 250-300 g dişi SpraqueDawley cinsi ratlara 250 kV X ışını kullanarak tek doz 0, 15, 20, 22.5 Gy toraks RT ve
RT’den 15-20 dk önce tek doz amifosin (160 mg/kg) uygulamışlardır. Altı ay sonra yapılan
histopatolojik incelemede ventriküler değişiklikler, atriyal fibrozis, vasküler hasar
değerlendirilmiştir. RT’ye bağlı belirgin patolojik değişiklikler sadece 20 Gy ve üzerinde RT
uygulanan gruplarda gösterilmiştir. 20 Gy RT’den sonra subendokardiyal alanlarda ve sol
ventrikülün apeksinde en fazla olmak üzere intersitisyel fibrozis ve perivasküler fibrozis ile
karakterize yapısal değişiklikler gözlenmiştir. Yaygın fibrozis atriyumun her üç anatomik
katında da gözlenmiştir. Amifostin uygulanmasından sonra ortaya çıkan histopatolojik
değişiklikler kalitatif olarak benzer fakat daha az yoğunlukta saptanmıştır. Kontrol
grubundaki hayvanlar normal miyokardiyal morfoloji göstermiştir. Sadece 15 Gy RT
uygulanan kolda %20 derece 3, %80 derece 0 atriyal fibrozis; %20 derece 2, %20 derece 1,
%20 derece 0.5, %40 derece 0 ventriküler fibrozis; %100 derece 1 perivasküler fibrozis
saptanmıştır. Amifostin eklenerek 15 Gy RT uygulanan kolda %100 derece 0 atriyal fibrozis;
%20 derece 1, %80 derece 0 ventriküler fibrozis, %100 derece 0 perivasküler fibrozis
saptanmıştır. Ancak istatistiksel analiz yapılarak p değeri verilmeyen çalışmada kalitatif
olarak 15 Gy RT’nin kardiyak hasar oluşturmadığı belirtilmiştir. Sadece 20 RT uygulanan
kolda %80 derece 3, %20 derece 0 atriyal fibrozis; % 40 derece 2, %40 derece 1, %20 derece
1.5 ventriküler fibrozis; %20 derece 2, % 20 derece 1.5, %60 derece 1 perivasküler fibrosiz
saptanırken amifostin eklenerek 20 Gy uygulanan kolda %60 derece 3, %40 derece 0 atriyal
fibrozis; %40 derece 2, %20 derece 1, %40 derece 0 ventriküler fibrozis; %80 derece 1, %20
derece 0 perivasküler fibrozis saptanmıştır. Çalışmacılar kalitatif olarak 20 Gy RT’nin
kardiyak hasar oluşturduğu ve amifostinin bu hasarda histopatolojik olarak skor azalmasına
neden olduğunu belirtilmişlerdir. Sadece 22.5 Gy RT uygulanan kolda %100 derece 3 atriyal
fibrozis; %20 derece 3, %60 derece 2, %20 derece 1.5 ventriküler fibrozis; %40 derece 2,
46
%20 derece 1.5, %40 derece 1 perivasküler fibrozis saptanırken amifostin eklenerek 22.5 Gy
RT uygulanan kolda %80 derece 3, %20 derece 0 atriyal fibrozis; %40 derece 2, %40 derece
1, %20 derece 0 ventriküler fibrozis; %20 derece 1.5, %20 derece 1 ve %60 derece 0
perivasküler fibrozis saptanmıştır. 22.5 Gy RT’nin de kardiyak hasar oluşturduğu ve
amifostinin bu hasarda histopatolojik olarak skor azalmasına neden olduğu belirtilmiştir.
Sonuç olarak Kruse ve ark. (16) kalbe uygulanan RT sonrası 6. ayda amifostin kolunda
histopatolojik değişikliklerde azalma olduğunu bildirmişlerdir.
Çalışmamızda AMF+RT grubu, RT ve SF grubu ile vasküler hasar açısından
karşılaştırıldığında istatistiksel olarak anlamlı fark saptanmamıştır (RT-AMF+RT, p=0.471;
SF-AMF+RT, p=0.55). Amifostinin RT’ye bağlı vasküler hasarı önlemede etkisi
saptanmamıştır. Atriyal fibrozis açısından AMF+RT grubu, RT ile karşılaştırıldığında
istatistiksel olarak anlamlı fark saptanmış iken (RT-AMF+RT, p=0.026), SF grubu ile
karşılaştırıldığında istatistiksel olarak anlamlı fark saptanmamıştır (SF-AMF+SF, p=0.759).
Amifostinin RT’ye bağlı atriyal fibrozisi önleyici etkisi görülmüştür. Ventriküler fibrozis
açısından AMF+RT grubu, RT grubu ile karşılaştırıldığında istatistiksel olarak anlamlı fark
saptanmıştır ancak SF grubu ile karşılaştırıldığında istatistiksel anlamlı fark saptanmamıştır
(RT-AMF+RT, p=0.006; SF-AMF+RT, p=0.759). Amifostinin RT’ye bağlı miyokardiyal
fibrozisi önleyici etkisi saptanmıştır. Miyokardiyal dejenerasyon açısından AMF+RT grubu,
RT grubu ile karşılaştırıldığında istatistiksel olarak anlamlı fark saptanmıştır (RT-AMF+RT,
p=0.001), SF grubu ile karşılaştırıldığında ise istatistiksel olarak anlamlı fark saptanmamıştır
(SF-AMF+RT, p=0.400). Amifostinin RT’ye bağlı miyokardiyal dejenerasyonu önleyici
etkisi görülmüştür.
Kruse ve ark. (16)’nın çalışmasından farklı olarak 15 Gy RT uygulamasından 6 ay
sonra sadece RT grubunda istatistiksel olarak anlamlı oranda atriyal fibrozis, miyokardiyal
dejenerasyon, ventriküler fibrozis ve vasküler dejenerasyon saptanmıştır. Bunun sebebi
kullanılan X ışını enerjilerinin farklı olması olabilir. Ayrıca RT’ye amifostin eklenmesi ile
histopatolojik değişikliklerde azalma saptanmış olmakla beraber çalışmamızda atriyal fibrozis
ve ventriküler fibroziste amifostin eklenmesi lehine istatistiksel olarak anlamlı fark
saptanmıştır. Bunun yanında vasküler hasarda diğer çalışma ile uyumlu olarak histopatolojik
değişikliklerde azalma saptanmıştır. Çalışmamızda atriyal fibrozis, ventriküler fibrozis ve
vasküler hasarın histopatolojik değerlendirmesi Kruse ve ark. (16)’nın kullandığı skalaya göre
yapılmış olup verilerin karşılaştırmasının değerli olduğu düşüncesindeyiz.
Tokatlı ve ark. (17), ratlarda yaptıkları çalışmada, Co-60 cihazı ile kalbe tek doz 15
Gy RT ve RT öncesi İP 200mg/kg amifostin uygulamışlardır. 100 gün sonra yaptıkları
47
değerlendirmede RT kolunda %33 oranında hafif miyokardiyal dejenerasyon saptamışlardır.
AMF-RT ve kontrol grubu ile karşılaştırıldığında bu oranın istatistiksel olarak anlamlı
olduğunu
belirtmişlerdir
(p=0.042).
AMF-RT
ve
kontrol kollarında
miyokardiyal
dejenerasyon saptamamışlardır. Tokatlı ve ark. (17)’nın çalışması ile uyumlu olarak
amifostinin miyokardiyal dejenerasyondan koruyucu etkisi saptanmıştır. Çalışmamızda RT
kolunda %56 derece 3, %33 derece 2.5, %11 derece 2 gibi yüksek skorda miyokardiyal
dejenerasyon; SF kolunda %50 derece 1, %50 derece 0; AMF+RT kolunda %10 derece 2,
%30 derece 1.5, %30 derece 1 ve %30 derece 0 miyokardiyal dejenerasyon saptanmıştır.
AMF+RT grubunda miyokardiyal dejenerasyonda belirgin düzelme görülmüştür. RT grubu
ile karşılaştırıldığında istatistiksel olarak anlamlı fark saptanırken (RT-AMF+RT, p=0.001),
SF grubu ile karşılaştırıldığında istatistiksel olarak anlamlı fark saptanmamıştır (SFAMF+RT, p=0.400). Amifostinin RT’ye bağlı miyokardiyal dejenerasyonu önleyici etkisi
görülmüştür. Çalışmamızda, histopatolojik değerlendirme 6 ay sonra (180 gün) yapıldığından
Tokatlı ve ark. (17)’nın çalışmasına göre RT’ye bağlı miyokardiyal dejenerasyonda daha
şiddetli skorlar saptanmış ve RT’ye amifostin eklenmesi ile daha düşük dejenerasyon skorları
görülmüştür. Bu sebeple RT'ye bağlı olarak kalpte meydana gelecek hasarların daha geç
dönemde ortaya çıkacağı ve amifostinin miyokardiyal dejenerasyondan koruyucu etkisi
olduğu söylenebilir.
Güncel araştırmalarda, bazı klinik durumlarda (örneğin anoreksi, kronik yorgunluk,
koroner kalp hastalığı, difteri, hipoglisemi ve erkeklerde infertilite gibi) diyete karnitin
eklenmesinin yararı bildirilmektedir. Karnitin karbonhidrat, glukoz ve lipid metabolizmasında
rol alan bir amin bileşiğidir. Uzun zincirli yağ asitlerinin dokularda enerji substratı olarak
kullanılabilmesi için gereklidir. Yağ asidi, iskelet ve kalp adalesi gibi bir çok sistem için
primer enerji kaynağıdır ve karnitin yağ asitlerinin mitokondrial membran içine gişini
kolaylaştırarak enerji temininde önemli rol oynar. Enerji üretiminde çok etkili metabolik yol
olan β oksidasyonda rol alan karnitin, özellikle yüksek enerji ihtiyacı olan dokular için
önemlidir.
Hücre
membran
stabilizasyonunda,
kas
kontraktibilitesinde
ve
kalp
fonksiyonlarında etkilidir (92,93). OSR’lerin temizlenmesinde görev alan (23) ve SR
yakalama özelliğinden dolayı antioksidan olarak etki eden karnitinin, radyasyonun sebep
olduğu SR’ler ile oluşan hücresel hasarda modülatör bir rol oynadığı (22) ve hücre membran
stabilizasyonu da sağlayarak (92) RT’ye karşı koruyucu etkisinin olduğu düşünülmektedir.
Daha önceki çalışmalarda karnitinin böbrek, retina, spinal kord ve kalp gibi organlarda
iskemi sonrası perfüzyonun geri gelmesine bağlı oksidatif hasarı önlemdeki etkisi de
bildirilmiştir. İnvivo ve invitro çalışmalar sisplatine bağlı böbrek ve ince bağırsak hasarlarını
48
da önlediğini göstermektedir. Karnitin esteri olan ALC’nin ratların, akciğer dokusunda,
bleomisine bağlı oksidatif strese ve enerji tüketimine karşı koruyucu etkiye sahip olduğu
bildirilmektedir. Ayrıca ALC’nin primer mürin kültürlerinde, nöronlarda, talasemik hastaların
eritrositlerinde ve kardiak otonomik sinir sisteminde nörotropik faaliyette anti-apopitotik
aktivitesi de gözlenmiştir (23). Ayrıca Şener ve ark. (126)’nın çalışmasında 500 mg/kg İP
olarak uygulanan karnitinin, SR’leri temizleme yolu ile oksidatif organ hasarını düzelttiği ve
kronik renal hasara bağlı aorta ve korpus kavernosum disfonksiyonunu önlediği gösterilmiştir.
Karnitinin bazı dokulardaki radyoprotektif etkisi çeşitli hayvan deneyleriyle
gösterilmiştir. Dökmeci ve ark. (22)’nın çalışmasında, yetişkin ratlara karnitin 50 mg/kg gavaj
yolu ile 15 gün verilmiş ve ardından tek fraksiyonda 8 Gy tüm vücut ışınlaması yapılmıştır.
Bu çalışmada karnitinin RT etkisi ile oluşan plazma ve karaciğer malondialdehid
seviyesindeki artışı, karaciğerdeki glutatyon seviyesindeki azalmayı, eritrositlerdeki
süperoksid dismutaz ve katalaz seviyelerindeki azalmayı ve kemik iliğindeki olumsuz etkileri
önlediği gösterilmiştir.
Sezen ve ark. (97)’nın çalışmasında, 200 mg/kg İP karnitin uygulaması sonrası tek
fraksiyonda 15 Gy tüm beyin RT’si alan 8-12 haftalık ratlarda, radyasyona bağlı beyin
hasarının önlendiği gösterilmiştir. Aynı grubun başka bir çalışmasında da, karnitinin 100
mg/kg İP olarak enjeksiyonu sonrası tüm beyin RT’si uygulanan 12-16 haftalık ratlarda
katarakt oluşumunu azalttığı gösterilmiştir (127). Mansour ve ark. (23)’nın çalışmasında
karnitinin, 250 mg/kg İP verilmesinin ardından tüm vücut ışınlaması uygulanan yetişkin
ratlarda, karaciğer enzim (ALT, AST ve GGTP) aktivitelerindeki değişimleri onardığı ve
membran permeabilitesini koruduğu bildirilmiştir.
İnvivo ve invitro çalışmalar karnitinin, adriamisine bağlı kardiotoksisitede miyokard
üzerine koruyucu etki yaptığını göstermektedir. Muhammed ve ark. (128)’nın ratlarla
yaptıkları çalışmada 18 mg/kg kümülatif dozdaki adriyamisini 6’ya bölerek 2 haftada bir İP
olarak 3 mg/kg ve yarım saat öncesinde 250 mg/kg karnitin uygulamışlardır. Karnitinin
adriyamisin ile indüklenen kardiyomiyopatide adriyamisinin antitümör etkinliğini bozmadan
klinik koruyucu ajan olarak kullanılabileceğini göstermişlerdir.
Güncel bazı çalışmalar doksorubisinin kardiyotoksisitesinin en azından bir bölümünün
kalpteki uzun zincirli yağ asidi oksidasyonunun inhibisyonuna bağlı olduğunu göstermektedir
(129). Doksorubisin ile ilişkili kardiyotoksisitenin azaltılması ve veya kontrol edilmesi amacı
ile birçok ilaç denenmiştir (130,131). Bunlardan biri de uzun zincirli yağ asitlerinin
oksidasyonunda ve mitokondriyal transportunda vazgeçilmez bir kofaktör olan doğal oluşan
49
amonyum bileşiği olan karnitindir. Daha önceki çalışmalarda karnitinin doksorubisin ile
indüklenen kardiyotoksisiteye karşı miyokardı kısmen koruyucu etkisi gösterilmiştir (132).
Sonuç olarak çeşitli çalışmalarda kalp dokusu üzerine koruyucu etkisi olduğu bilinen
ayrıca kalp dışı bir çok dokuda da radyoterapiye bağlı oluşacak geç yan etkileri önleyebildiği
kanttlanmış olan karnitinin, radyoterapi ile oluşabilecek kardiyak hasarları önlemede etkin
olup olmadığı ilk kez bizim çalışmamızda araştırılmıştır. Karnitin kullanılarak yapılan RT ve
kemoterapi çalışmaları incelenerek 300 mg/kg İP karnitin uygulanmış ve amifostin ile
karşılaştırılabilmesi amacı ile RT’den yarım saat önce tek doz olarak uygulanmıştır.
Vasküler hasar açısından incelendiğinde; KAR+RT grubu, RT ve SF grubu ile
karşılaştırıldığında istatistiksel olarak anlamlı fark saptanmamıştır (RT-KAR+RT, p=0.084;
SF-KAR+RT, p=0.186). Karnitinin RT’ye bağlı vasküler hasarı önlemede etkisi
görülmemiştir. RT’ye karnitin eklenmesi vasküler hasarı önlemede istatistiksel olarak anlamlı
bir etki yapmamış olmakla birlikte, karnitin eklenen grupta RT grubuna göre daha iyi
histopatolojik bulgular saptanmıştır. RT grubunda derece 0 dejenerasyon saptanmamış ancak
KAR+RT grubunda %33 oranında derece 0 dejenerasyon saptanmıştır. Ayrıca RT grubunda
görülen derece 2 (%67) ve 3 (%22) vasküler hasar oranı RT’ye karnitin eklenmesi ile sırası ile
%25 ve %8’e düşmüştür.
Atriyal fibrozis açısından incelendiğinde; KAR+RT grubu, RT ve SF grubu ile
karşılaştırıldığında istatistiksel olarak anlamlı fark saptanmamıştır (RT-KAR+RT, p=0.262;
SF-KAR+RT, p=0.579). Karnitinin RT’ye bağlı atriyal fibrozisi önlemede etkisi
görülmemiştir. RT’ye karnitin eklenmesi ile RT grubuna göre düşük dereceların yüzdesinde
artış saptanmış olmasına rağmen %33 derece 2 atriyal fibrozis saptanmıştır. RT grubunda
%67 derece 2 atriyal fibrozis görülmüşken KAR+RT grubunda %33 oranında görülmüştür.
Ayrıca RT grubunda derece 0 atriyal fibrozis saptanmamakla birlikte KAR+RT grubunda
%33 derece 0 atriyal fibrozis saptanmıştır. RT’ye karnitin eklenmesinin istatistiksel olarak
anlamlı olmasa da histopatolojik olarak koruyucu etkisi olduğu söylenebilir.
Miyokardiyal dejenerasyon açısından incelendiğinde; KAR+RT grubu, RT ve SF
grupları ile karşılaştırıldığında istatistiksel olarak anlamlı fark saptanmıştır (RT-KAR+RT,
p=0.003; SF-KAR+RT, p=0.016). SF grubu ile karşılaştırıldığında istenen düzeyde olmasa da
karnitinin RT’ye bağlı miyokardiyal dejenerasyonu önleyici etkisi görülmüştür.
Ventriküler fibrozis açısından incelendiğinde; KAR+RT grubu, RT ve SF grupları ile
karşılaştırıldığında
istatistiksel
olarak
anlamlı
fark
saptanmıştır.
SF
grubu
ile
karşılaştırıldığında istenen düzeyde olmasa da karnitinin RT’nin oluşturduğu ventriküler
fibrozisten koruyucu olduğu görülmüştür (RT-KAR+RT, p=0.009; SF-KAR+RT, p<0.001).
50
Sonuçta SF ile karşılaştırıldığında istenen düzeyde olmasa da karnitinin RT’nin
oluşturduğu miyokardiyal dejenerasyon ve ventriküler fibrozisten koruyucu etkisi olduğu
bunun yanında
istatistiksel olarak anlamlı olmasa da atriyal fibrozis ve vasküler hasar
derecesini azalttığı saptanmıştır. Amifostinin ise atriyal fibrozis, miyokardiyal dejenerasyon
ve ventriküler fibrozisten koruyucu etkisi saptanmıştır.
Ancak KAR+RT ve AMF+RT grupları karşılaştırıldığında istatistiksel olarak anlamlı
fark saptanmamıştır (p=0.928). RT grubunda %67 derece 2 atriyal fibrozis görülmüşken
KAR+RT grubunda %33, AMF+RT grubunda %10 derece 2 atriyal fibrozis görülmüştür.
Ayrıca RT grubunda derece 0 atriyal fibrozis saptanmamakla birlikte KAR+RT grubunda
%33, AMF+RT grubunda %30 derece 0 atriyal fibrozis saptanmıştır. RT’ye karnitin
eklenmesinin histopatolojik olarak istatistiksel anlamlılığa ulaşmayan kısmi bir koruyucu
etkisi olduğu söylenebilir. Amifostin ile arasındaki en önemli fark derece 2 atriyal fibrozis
oranının daha yüksek olmasıdır
KAR+RT
ve
AMF+RT
grupları
miyokardiyal
dejenerasyon
açısından
karşılaştırıldığında istatistiksel olarak anlamlı fark saptanmamıştır (p=0.347). RT grubunda
derece 2, 2.5 ve en büyük oranda derece 3 (%56) miyokardiyal dejenerasyon gözlenirken
KAR+RT ve AMF+RT gruplarında derece 3 dejenerasyon saptanmamıştır. AMF+RT ile
KAR+RT grupları arasındaki en önemli fark RT’ye amifostin eklenmesi ile %30 oranında 0
derece dejenerasyon görülürken, karnitin eklenmesi ile 0 derece dejenerasyonun hiç
saptanmamasıdır. SF grubunda %50 oranında derece 0, %50 oranında derece 1 miyokardiyal
dejenerasyon saptanması nedeniyle KAR+RT grubu ile arasında istatistiksel fark ortaya
çıkmıştır.
Karnitin ve amifostin arasındaki en önemli histopatolojik fark ventriküler fibroziste
görülmüştür. KAR+RT ve AMF+RT grupları karşılaştırıldığında istatistiksel olarak anlamlı
fark saptanmıştır (p=0.032). Amifostinin ventriküler fibrozisi önlemede karnitinden daha
etkili olduğu söylenebilir.
Toraks tümörleri için uygulanan RT ile ilişkili olarak ortaya çıkan EKG değişiklikleri
çeşitli yayınlarda tanımlanmıştır (133,134). Meme kanseri tedavisi uygulanan büyük bir
seride T dalgası değişiklikleri insidansı sağ memeye uygulanan tedavi için %4, sol memeye
uygulanan tedavi için %70 olarak bildirilmiştir (135). Perimiyokardiyal hasarın bu işaretinin
prognostik anlamlılığı sadece küçük hasta gruplarında ve sadece nispeten kısa takip süreleri
için çalışılmıştır (135). Strender ve ark. (137) meme kanseri nedeniyle RT uygulanan
hastalarda on yıllık takip sürecinde RBKH’nın insidansının belirlenmesi amacı ile ve ayrıca
EKG’deki T dalga değişikliklerinin geç fonksiyonel öneminin ortaya konması amacı ile
51
inceleme yapmışlardır. Sol meme kanseri için uygulanan RT’den 6 ay sonra EKG’de T dalga
değişiklikleri insidansında yükselme olduğu ve EKG değişikliklerinin geri dönüşümlü olduğu
saptanmıştır. Bununla beraber perimiyokardiyal hasar uzun süreli takipte bile fonksiyonel
açıdan önemsiz, koroner kalp hastalığının insidansı ve ciddi kardiyak komplikasyonların
düşük sıklıkta olduğu saptanmıştır.
Antrasiklin ve toraks RT’si uygulanarak tedavi edilen 52 pediyatrik kanser hastasında
yapılan çalışmada düzeltilmiş QT aralığında uzama eğilimi saptanmıştır (138). QTc 0.44 sn
olan 4 olguda QTc’nin egzersizle uzadığı ve bunun da ciddi ventriküler aritmi ve ani kalp
ölümü ile ilişkili olabileceği bildirilmiştir. Antrasiklin ve/veya göğüs ışınlaması ile tedavi
edilen pediyatrik kanser hastalarından hayatta kalan 134 olgu ile yapılan başka bir çalışmada
tedavi sonrası ortalama 5 yıl içinde (3 ay-21 yıl) RT ile uzamış QTc ve doksorubisin ile
ilişkili ventriküler taşikardi riski gösterilmiştir. Bu çalışmada 24 olgunun 3’ü (%12.5) sadece
göğüs ışınlaması ile tedavi edilmiş ve QTc’si 0.44 sn’ye ulaşmıştır. Supraventriküler prematür
kompleksler (%63), supraventriküler taşikardi (%4), ventriküler prematür kompleksler (%50)
ve ventriküler taşikardi (%4) sadece RT ile tedavi edilen grupta kontrol gruplarına oranla
anlamlı şekilde daha fazla görülmüştür (48).
Radyoterapiden sonra ortaya çıkan kardiyak ritim değişiklikleri muhtemelen iletim
sistemini etkileyen iskemik fibrozis nedeniyle gelişmektedir (137). Miyokardiyal hücre
ölümünün işaretleri EKG’de çok geç ortaya çıkar (4,139). Karpova ve ark. (140)’nın yaptığı
çalışmada köpeklere tek doz Co-60 cihazı ile tüm vücut ışınlaması yapılmıştır. RT sırasında
ve bir ay sonra yapılan EKG incelemelerine göre kardiyak ritimin stabil olduğu görülmüş
fakat daha sonra yapılan EKG incelemelerinde RT uygulanan hayvanlarda aynı yaştaki
kontrol grubuna göre belirgin taşikardi ortaya çıktığı izlenmiştir. Vakaların çoğunda
taşikardinin bradikardi ile birlikte olduğu görülmüştür. Köpeklerin %75’inde 3.5-4.5 yıl sonra
sol ventrikül yüklenmesine bağlı bulgular olduğu bunların da 6.5-7 yıl sonra sağ atriyum
yüklenmesinin tipik belirtisi olan P pulmonale kompleksinin %50 hayvanda ortaya çıktığı
görülmüştür. Miyokardiyal fonksiyonun ışınlanan hayvanlarda dikkat çekici şekilde
bozulduğu, II, III ve aVF derivasyonlarında ortaya çıkan değişikliklerle kanıtlanmıştır.
Karpova (141)’nın yaptığı başka bir çalışmada eksternal (Co-60) ve internal (inhalasyon239
Pu) ışınlama ile artmış oranda görülen sinüs aritmileri ile karakterize kardiyak ritim
bozulmaları ile sonuçlandığı ortaya konulmuştur. Tokatlı ve ark.’nın (17) çalışmasında RT
uygulanan ratlar ile kontrol grupları arasında RT uygulamasından 24 saat ve 100 gün sonra
yapılan değerlendirmede gruplarının kendi aralarında EKG’de anlamlı fark tespit
edilememiştir. Bu da takibin kısa süreli olmasına bağlanmıştır. Çalışmamızda RT’nin JTa
52
aralığını kontrol grubuna göre anlamlı olarak uzattığı (RT-SF; p=0.001), RT’ye karnitin
eklenmesinin ve amifostin eklenmesinin JTa aralığının uzamasını önlediği saptanmıştır (RTKAR+RT, p=0.004; RT-AMF+RT, p=0.008). JTa aralığının uzamasını önlemede KAR+RT
ile AMF+RT grupları karşılaştırıldığında istatistiksel olarak anlamlı fark saptanmamıştır.
RT’nin JTac’yi uzattığı saptanmıştır (RT-SF, p<0.001). RT’ye karnitin eklenmesinin ve
amifostin eklenmesinin JTac’nin uzamasını önlediği görülmüştür (RT-KAR+RT, p=0.007;
RT-MAF+RT, p=0.007). RT’ye karnitin eklenmesi ile amifostin eklenmesinin JTac’yi
etkilemesi karşılaştırıldığında istatistiksel olarak anlamlı fark saptanmamıştır. RT’nin QTc’yi
uzattığı saptanmıştır (RT-SF, p=0.027).
RT’ye karnitin eklenmesinin ve amifostin
eklenmesinin RT’ye bağlı QTc uzamasını önlediği (Grup RT-KAR+RT, p=0.004; RTAMF+RT, p=0.045), RT’ye karnitin eklenmesi ile amifostin eklenmesi karşılaştırıldığında
anlamlı fark saptanmamıştır. Toraks ışınlamalarında gelişebilecek kardiyak hasarlardan olan
ventriküler aritmi ve ani ölümü önlemede RT’ye karnitin ve amifostin eklenmesinin benzer
şekilde koruyucu olduğu söylenebilir.
Sonuç olarak, daha önce RT’ye bağlı kalp hasarını önlemede etkinliği gösterilmiş olan
amifostinin bu etkisi, bizim çalışmamızda da ortaya konmuştur. Özellikle miyokardiyal
dejenerasyon, atriyal fibrozis ve ventriküler fibroziste saptanan anlamlı koruma etkisi
açısından literatürdeki benzer çalışmalarla karşılaştırılabilir derecede kanıtlara ulaşılmıştır.
Çalışmamız RT’ye bağlı kalp hasarını önlemede karnitinin radyoprotektör etkisini inceleyen
ulaşılabilen literatürdeki ilk çalışma olup, SF grubu ile karşılaştırıldığında istenen düzeyde
olmasa da RT’nin oluşturduğu miyokardiyal dejenerasyon ve ventriküler fibrozisten koruyucu
etkisi olduğu saptanmıştır. Çalışmamızda elde edilen EKG sonuçlarına göre aritmiye yatkınlık
saptanmış olmakla birlikte her iki ajanın da kalbi ritm bozukluklarına karşı koruyabildiği
görülmüştür. İlerki çalışmalarda takip süresi daha uzun tutularak farklı kardiyak
değerlendirme tekniklerinin kullanımının (EKO, 24 saatlik EKG, efor testi) eklenmesi ile
RT’ye bağlı kalp hasarı ile ilişkili daha ileri fonksiyonel değişiklikler ortaya konabilir. Bunun
yanında karnitinin daha yüksek dozlarda karşılaştırmalı olarak çalışılması ile potansiyel
koruyucu etkisinin ortaya konulabileceği düşüncesindeyiz.
53
SONUÇLAR
Kalbi ışınlanan ratlarda amifostinin ve karnitinin RT’ye bağlı kalp hasarını
önlemedeki kardiyoprotektif etkinliğinin histopatolojik ve elektrokardiyografik olarak
değerlendirildiği çalışmamızda aşağıdaki sonuçlar çıkarılmıştır:
1. RT sonrası geç dönemde (6. ay) histopatolojik olarak yapılan değerlendirmede
RT’nin miyokardiyal dejenerasyon, vasküler hasar, atriyal fibrozis, ve ventriküler fibrozis
açısından kardiyak hasara neden olduğu gösterilmiştir.
2. RT sonrası geç dönemde (6. ay) histopatolojik olarak yapılan değerlendirmede
RT’ye amifostin eklenmesinin sadece RT uygulanan gruba göre atriyal fibrozis, miyokardiyal
dejenerasyon ve ventriküler fibrozis açısından kalbi koruduğu; vasküler hasar açısından ise
istatistiksel olarak anlamlı koruyucu etkisi olmamakla birlikte RT’ye bağlı kalp hasarını
histopatolojik olarak azalttığı gösterilmiştir. Kontrol grubu ile karşılaştırıldığında ise
miyokardiyal dejenerasyon, ventriküler fibrozis, vasküler hasar ve atriyal fibrozis açısından
istatistiksel olarak anlamlı fark saptanmamış olması da RT’ye amifostin eklenmesinin kalbi
RT’nin kardiyotoksik etkisinden koruduğu bulgusunu desteklemektedir.
3. RT sonrası geç dönemde (6. ay) histopatolojik olarak yapılan değerlendirmede
RT’ye karnitin eklenmesinin sadece RT uygulanan gruba göre miyokardiyal dejenerasyon ve
ventriküler fibrozis açısından kalbi koruduğu ancak kontrol grubu ile karşılaştırıldığında
koruyucu etkisinin istenen düzeyde olmadığı; vasküler hasar ve atriyal fibrozis açısından ise
istatistiksel olarak anlamlı koruyucu etkisi olmamakla birlikte RT’ye bağlı kalp hasarını
histopatolojik olarak azalttığı gösterilmiştir.
54
4. RT sonrası geç dönemde (6. ay) histopatolojik olarak yapılan değerlendirmede
miyokardiyal dejenerasyon, vasküler hasar ve atriyal fibrozis açısından amifostin ve karnitin
kolları istatistiksel olarak benzer bulunsa da, amifostinin miyokardiyal dejenerasyon ve
ventriküler fibrozisden koruyucu etkisinin karnitinden daha fazla olduğu görülmüştür. Ayrıca
amifostin karnitinin etkin olmadığı atriyal fibroziste de koruyucu özellik göstermiştir.
5. RT sonrası geç dönemde (6. ay) yapılan EKG değerlendirmesinde kalbe uygulanan
RT’nin JTa, QTc ve JTac’de uzamaya neden olduğu gösterilmiştir.
6. RT sonrası geç dönemde (6. ay) yapılan EKG değerlendirmesinde kalbe uygulanan
RT’ye karnitin eklenmesinin ve amifostin eklenmesinin JTa aralığının uzamasını önlediği ve
etkilerinin benzer olduğu gösterilmiştir.
7. RT sonrası geç dönemde (6. ay) yapılan EKG değerlendirmesinde kalbe uygulanan
RT’ye karnitin eklenmesinin ve amifostin eklenmesinin QTc aralığının uzamasını önlediği ve
etkilerinin benzer olduğu gösterilmiştir.
8. RT sonrası geç dönemde (6. ay) yapılan EKG değerlendirmesinde kalbe uygulanan
RT’ye karnitin eklenmesinin ve amifostin eklenmesinin JTac aralığının uzamasını önlediği ve
etkilerinin benzer olduğu gösterilmiştir.
.
55
ÖZET
Tedavi amaçlı, toraksa uygulanacak yüksek doz radyoterapinin uzun dönemde kalp
üzerinde ciddi ve çeşitli yan etkileri olabilmektedir. Toraks ışınlamalarının perikardiyal,
miyokardial ve endokardiyal (valvüler ve arteriyal) dokularda akut inflamasyona ve progresif
fibrozise neden olabileceği bilinmektedir. Malignitelerde kullanılan yeni tedavi yöntemlerinin
sağkalım süresini uzatması nedeniyle kanser tedavisinin geç etkilerini önleme önemli bir
araştırma konusu haline gelmiştir. Bu amaçla çeşitli radyoprotektör ajanlar denenmektedir.
Çalışmamızda, radyoterapiden önce uygulanan amifostin ve karnitin ardından kalbi
ışınlanan 20 haftalık ratlarda, etkili bir radyoprotektör olduğu bilinen amifostin ile karnitinin
radyoterapiye bağlı kalp hasarından koruyucu etkinliğinin karşılaştırılması amaçlanmıştır.
Kontrol, radyoterapi, yalnız amifostin, yalnız karnitin, amifostin ardından radyoterapi ve
karnitin ardından radyoterapi grubu olmak üzere altı grup oluşturulmuş, radyoterapi
gruplarına kalp alanına tek fraksiyonda 15 Gy radyoterapi uygulanmıştır. Deney gruplarına
radyoterapiden 30 dakika önce amifostin 200 mg/kg ve karnitin 300 mg/kg dozunda
intraperitoneal olarak uygulanmıştır. Altı aylık izlem sonunda ratların sakrifikasyon öncesi
elektrokardiyografileri çekilmiş ve sakrifikasyon sonrası histopatolojik inceleme yapılmıştır.
Radyoterapinin histopatolojik olarak vasküler hasar, atriyal fibrozis, miyokardiyal
dejenerasyon ve ventriküler fibrozis ile değerlendirilen kardiyak hasara neden olduğu
görülmüştür.
Radyoterapiye
amifostin
eklenmesinin
atriyal
fibrozis,
miyokardiyal
dejenerasyon ve ventriküler fibrozis açısından kalbi koruduğu saptanmıştır. Radyoterapiye
karnitin eklenmesinin ise kontrol grubu ile karşılaştırıldığında istenen düzeyde olmasa da
miyokardiyal dejenerasyon ve ventriküler fibrozis açısından kalbi koruduğu saptanmıştır.
56
Bununla birlikte vasküler hasar ve atriyal fibrozis açısından koruyucu etkisi olmamıştır.
Radyoterapiye amifostin eklenmesi ile karnitin eklenmesi arasında vasküler hasar açısından
fark görülmemiştir, her iki maddenin de vasküler hasardan koruyucu etkisi saptanmamıştır.
Bununla birlikte amifostinin karnitine göre miyokardiyal dejenerasyon, atriyal fibrozisten
koruyucu etkisi daha belirgindir. Ventriküler fibrozisten korumada ise amifostinin karnitinden
üstün olduğu saptanmıştır.
Elektrokardiyografik değerlendirmede ise RT’nin JTa, JTac, QTc aralıklarında
uzamaya neden olarak aritmiye yatkınlık oluşturduğu; karnitin ve amifostinin JTa, JTac, QTc
aralıklarındaki uzamayı önlediği gösterilmiştir.
Anahtar kelimeler: Radyoterapi, kalp, amifostin, karnitin, rat, EKG.
57
THE COMPARISON OF THE EFFECTIVENESS OF L-CARNITINE
WITH AMIFOSTINE IN PREVENTION OF CARDIAC INJURY OF
RADIOTHERAPY
SUMMARY
Curative high-doses of radiotherapy to the thorax may have different serious long term
side effects. It is well known that radiation to the thorax may cause acute inflammation and
progressive fibrosis in pericardial, myocardial and endocardial (valvular and arterial) tissues.
Due to the obvious prolongation of survival in different malignancies through new treatment
strategies, prevention of late side effects of therapeutic radiation has become an important
area of medical research. Various radioprotective agents have been tested for their efficacy.
In our study, we aimed to compare the effectiveness of two well-known effective
radioprotectants, carnitine and amifostine, administered before radiotherapy, in protecting
against radiation induced heart disease in 20-week-old rats. After establishing 6 groups
including; control, radiotherapy, carnitine only, amifostine only, radiotherapy after carnitine,
and radiotherapy after amifostine, single fraction radiotherapy with 15 Gy was given to the
cardiac area of the rat in the radiotherapy limb. The radiotherapy after carnitine limb, and
radiotherapy after amifostine limb received 300 mg/kg carnitine and 200 mg/kg amifostine,
respectively, 30 minutes before irradiation through peritoneal route. After 6 months followup, electrocardiography was recorded in all of the groups. After sacrificing the animals,
cardiac specimen were evaluated histopathologically.
Histopathologic evaluation revealed radiation induced cardiac injury characterized by
vascular degeneration, atrial fibrosis, myocardial degeneration, and ventricular fibrosis.
58
Amifostine protected the heart from atrial fibrosis, myocardial degeneration, and ventricular
fibrosis after irradiation. Although carnitine protected the heart from myocardial
degeneration, and ventricular fibrosis after irradiation, the protection wasn’t good enough as
desired. Carnitine didn’t show any protective effect against vascular degeneration and atrial
fibrosis. Neither carnitine nor amifostine was found to be protective against vascular
degeneration. The protective effect of amifostine was superior than carnitine against atrial
fibrosis, and myocardial degeneration according to the histopathologic findings. Amifostine
was found to be more effective than carnitine in protecting the heart from ventricular fibrosis.
Electrocardiographic evaluation showed prolonged intervals of JTa, JTac, and QTc
indicating tendecy to develop arrhythmia after irradiation. Carnitine and amifostine were
found to be protective against the prolongation of the JTa, JTac, and QTc intervals according
to electrocardiographic findings.
Key words: Radiotherapy, heart, amifostine, carnitine, rat, ecg.
59
KAYNAKLAR
1. Corn BW, Trock BJ, Goodman RL. Irradiation-related ischemic heart disease. J Clin
Oncol 1990;8(4):741-50.
2. Cohn KE, Stewart JR, Fajardo LF, Hancock EW. Heart disease following radiation.
Medicine (Baltimore) 1967;46(3):281-98.
3. Joensuu H. Acute myocardial infarction after irradiation in young patients with Hodgkin's
disease. Chest 1989;95(2):388-90.
4. Stewart JR, Fajardo FL, Gillette SM, Constine LS. Radiation injury to the heart. Int J
Radiat Oncol. Biol Phys 1995;31(5):1205-11.
5. Brosius FC 3rd, Waller BF, Roberts WC. Radiation heart disease. Analysis of 16 young
(aged 15 to 33 years) necropsy patients who received over 3,500 rads to the heart. Am J
Med 1981;70(3):519-30.
6. Veinot JP, Edwards WD. Pathology of radiation-induced heart disease: a surgical and
autopsy study of 27 cases. Hum Pathol. 1996;27(8):766-73.
7. Stewart JR, Fajardo LF. Radiation-induced heart disease: An update. Prog Cardiovasc Dis
1984;27(3):173-94.
8. Lund MB, Ihlen H, Voss BM, Abrahamsen AF, Nome O, Kongerud J et al. Increased risk
of heart valve regurgitation after mediastinal radiation for Hodgkin’s disease: An
echocardiographic study. Heart 1996;75(6):591-5.
60
9. Stewart JR, Fajardo LF. Radiation-induced heart disease. Clinical and experimental
aspects. Radiol Clin North Am 1971;9(3):511-31.
10. Urba WJ, Longo DL. Hodgkin’s disease. N Engl J Med 1992;326(10):678-87.
11. Tominaga H, Kodama S, Matsuda N, Suzuki K, Watanabe M. Involvement of reactive
oxygen species (ROS) in the induction of genetic instability by radiation. J Radiat Res
(Tokyo) 2004;45(2):181-8.
12. Nair CK, Parida DK, Nomura T. Radioprotectors in radiotherapy. J Radiat Res (Tokyo)
2001;42(1):21-37.
13. Spencer CM, Goa KL. Amifostine. A review of its pharmacodynamic and
pharmacokinetic properties, and therapeutic potential as a radioprotector and cytotoxic
chemoprotector. Drugs 1995;50(Suppl 6):1001-1031.
14. Dorr RT, Lagel K, McLean S. Cardioprotection of rat heart myocytes with amifostine
(Ethyol) and its free thiol, WR-1065 in vivo. Eur J Cancer 1996;32A(Suppl. 4):21-5.
15. Dobric S, Dragojevic-Simic V, Bokonjic D, Milovanovic S, Marincic D, Jovic P. The
efficacy of selenium, WR-2721, and their combination in the prevention of adriamycininduced cardiotoxicity in rats. J Environ Pathol Toxicol Oncol 1998;17(3-4): 291-9.
16. Kruse JJCM, Strootman EG, Wondergem J. Effects of amifostine on radiation-induced
cardiac damage. Acta Oncol 2003;42(1):4-9.
17. Tokatli F, Uzal C, Doganay L, Kocak Z, Kaya M, Ture M. The potential cardioprotective
effects of amifostine in irradiated rats. Int J Radiat Oncol Biol Phys 2004;58(4):1228-34.
18. Moreno FA, Macey H, Schreiber B. Carnitine levels in valproic acid-treated psychiatric
patients: A cross-sectional study. J Clin Psychiatry 2005;66(5):555-8.
19. Goa KL, Brogden RN. L-Carnitine. A preliminary review of its pharmacokinetics, and
therapeutic use in cardiac disease and primary and secondary carnitine deficiencies in
relationship to its role in fatty acid meetabolism. Drugs 1987;34(1):1-24.
20. Izgut-Uysal VN, Agac A, Derin N. Effect of carnitine on stress-induced lipid peroxidation
in rat gastric mucosa. J Gastroenterol 2001;36(4):231-6.
21. Sayed-Ahmed MM, Mansour HH, Gharib OA, Hafez HF. Acetyl-L-carnitine modulates
bleomycin-induced oxidative stress and energy depletion in lung tissues. J Egypt Natl
Canc Inst 2004;16(4):237-43.
61
22. Dokmeci D, Akpolat M, Aydogdu N, Uzal C, Doganay L, Turan FN. The protective effect
of L-carnitine on ionizing radiation-induced free oxygen radicals. Scand J Lab Anim Sci
2006;33(2):75-83.
23. Mansour HH. Protective role of carnitine ester against radiation-induced oxidative stres in
rats. Pharmacol Res 2006;54(3):165-71.
24. Dragojevic-Simic VM, Dobric SL, Bokonjic DR, Vucinic ZM, Sinovec SM, Jacevic VM
et al. Amifostine protection against cardiotoxicity in rats. Anticancer Drugs
2004;15(2):169-78.
25. Scanlon VC, Sanders T. Essentials of anatomy and physiology. 5th ed. Philadelphia: F. A.
Davis Company; 2007. p.274-82.
26. Guyton AC. (Çeviri: Gökhan N, Çavuşoğlu H). Tıbbi Fizyoloji. İstanbul: Nobel Tıp
Kitabevi; 1986:217-60.
27. Schoen FJ. The Heart. In: Kumar V, Abbas AK, Fausto N (Eds.). Robbins and Cotran
Pathologic Basis of Disease. 7th ed. Philadelphia: Elsevier Saunders; 2005. p.557.
28. Walter J, Miller H, Bomford CK, Kunkler IH. Walter and Millers textbook of
radiotherapy, radiation physics, therapy and oncology. Edinburgh: Churchill Livingstone,
2002.
29. Adams MJ, Prosnitz RG, Constine LS, Marks LB, Lipshultz SE. Screening for
cardiovascular disease in survivors of thoracic radiation. In: Rubin P, Constine LS, Marks
LB, Okunieff P (Eds.). Late effects of cancer treatment on normal tissues. New York:
Springer; 2008. p.47-59.
30. Steele GG. Basic Clinical Radiobiology. London: Arnold Press; 1997. p.30-39.
31. Martenson JA, Schild SE, Haddock MG. Cancers of gastrointestinal tract. In: Khan FM,
Potish RA (Eds.). Treatment Planing in Radiation Oncology. Philadelphia: Lippincott
Williams & Wilkins; 2000. p.336.
32. Hall EJ, Giaccia AJ. Radiobiology for the Radiologist. 6th ed. Philadelphia: Lippincott
Williams & Wilkins; 2006. p.342
33. Adams MJ, Hardenbergh PH, Constine LS, Lipshultz SE. Radiation-associated
cardiovascular disease. Crit Rev Oncol Hematol 2003;45(1):55-75.
34. Fajardo LF, Stewart JR, Cohn KE. Morphology of radiation-induced heart disease. Arch
Pathol 1968;86(5):512-9.
62
35. Chello M, Mastroroberto P, Romano R, Zofrea S, Bevacqua I, Marchese AR. Changes in
the proportion of types I and III collagen in the left ventricular wall of patients with postirradiative pericarditis. Cardiovasc Surg 1996;4(2):222-6.
36. Orzan F, Brusca A, Gaita F, Giusetto C, Figliomeni MC, Librero L. Associated cardiac
lesions in patients with radiation-induced complete heart block. Int J Cardiol
1993;39(2):151-6.
37. La Vecchia L. Physiologic dual chamber pacing in radiation-induced atrioventricular
block. Chest 1996;110(2):580-1.
38. Ilhan I, Sarialioglu F, Ozbarlas N, Buyukpamukcu M, Akyuz C, Kutluk T. Late cardiac
effects after treatment for childhood Hodgkin’s disease with chemotherapy and low-dose
radiotherapy. Postgrad Med J 1995;71(833):164-7.
39. Tolba KA, Deliargyris EN. Cardiotoxicity of cancer therapy. Cancer Invest
1999;17(6):408-22.
40. Martin RG, Ruckdeschel JC, Chang P, Byhardt R, Bouchard RJ, Wiernik PH. Radiationrelated pericarditis. Am J Cardiol 1975;35(2):216-20.
41. Arsenian MA. Cardiovascular sequelae of therapeutic thoracic radiation. Prog Cardiovasc
Dis 1991;33(5):299-311.
42. Carlson RG, Mayfield WR, Normann S, Alexander JA. Radiation-associated valvular
disease. Chest 1991;99(3):538-45.
43. Gaya AM, Ashford RF. Cardiac complications of radiotion therapy. Cardiac Oncol (R
Coll Radiol) 2005;17(3):153-9.
44. McEniery PT, Dorosti K, Schiavone WA, Pedrick TJ, Sheldon WC. Clinical and
angiographic features of coronary artery disease after chest irradiation. Am J Cardiol
1987;60(13):1020-4.
45. Annest LS, Anderson RP, Li W, Hafermann MD. Coronary artery disease following
mediastinal radiation therapy. J Thorac Cardiovasc Surg 1983;85(2):257-63.
46. King V, Constine LS, Clark D, Schwartz RG, Muhs AG, Henzler M et al. Symptomatic
coronary artery disease after mantle irradiation for Hodgkin’s disease. Int J Radiat Oncol
Biol Phys 1996;36(4):9711-2.
47. Joensuu H. Myocardial infarction after irradiation in Hodgkin’s disease: A review. Recent
Results Cancer Res 1993;130:157-73.
63
48. Larsen RL, Jakacki RI, Vetter VL, Meadows AT, Silber JH, Barber G.
Electrocardiographic changes and arrhythmias after cancer therapy in children and young
adults. Am J Cardiol 1992;70(1):73-7.
49. Cohen SI, Bharati S, Glass J, Lev M. Radiotherapy as a cause of complete atrioventricular
block in Hodgkin’s disease. An electrophysiological-pathological correlation. Arch Intern
Med 1981;141(5):676-9.
50. Slama MS, Le Guludec D, Sebag C, Leenhardt AR, Pelerin DE, Drieu LH et al. Complete
atrioventricular block following mediastinal irradiation: A report of six cases. Pacing Clin
Electrophysiol 1991;14(7):1112-8.
51. Pohjola-Sintonen S, Tötterman KJ, Kupari M. Sick sinus syndrome as a complication of
mediastinal radiation therapy. Cancer 1990;65(11):2494-6.
52. Gillette EL, McChesney SL, Hoopes PJ. Isoeffect curves for radiation-induced
cardiomyopathy in the dog. Int J Radiat Oncol Biol Phys 1985;11(12):2091-7.
53. Rutqvist LE, Lax I, Fornander T, Johansson H. Cardiovascular mortality in a randomized
trial of adjuvant radiation therapy versus surgery alone in primary breast cancer. Int J
Radiat Oncol Biol Phys 1992;22(5):887-96.
54. Rutqvist LE, Liedberg A, Hammar N, Dalberg K. Myocardial infarction among women
with early-stage breast cancer treated with conservative surgery and breast irradiation. Int
J Radiat Oncol Biol Phys 1998;40(2):359-63.
55. Gyenes G, Rutqvist LE, Liedberg A, Fornander T. Long-term cardiac morbidity and
mortality in a randomized trial of pre- and postoperative radiation therapy versus surgery
alone in primary breast cancer. Radiother Oncol 1998;48(2):185-90.
56. Hancock SL, Donaldson SS, Hoppe RT. Cardiac disease following treatment of
Hodgkin’s disease in children and adolescents. J Clin Oncol 1993;11(7):1199-203.
57. Paszat LF, Mackillop WJ, Groome PA, Boyd C, Schulze K, Holowaty E. Mortality from
myocardial infarction after adjuvant radiotherapy for breast cancer in the surveillance,
epidemiology, and end-results cancer registries. J Clin Oncol 1998;16(8):2625-31.
58. Reinders JG, Heijmen BJ, Olofsen-van Acht MJ, van Putten WL, Levendag PC. Ischemic
heart disease after mantle field irradiation for Hodgkin’s disease in long-term follow-up.
Radiother Oncol 1999;51(1):35-42.
59. Hancock SL, Tucker MA, Hoppe RT. Factors affecting late mortality from heart disease
after treatment or Hodgkin’s disease. JAMA 1993;270(16):1949-55.
64
60. Schimmel KJ, Richel DJ, van den Brink RB, Guchelaar HJ. Cardiotoxicity of cytotoxic
drugs. Cancer Treat Rev 2004;30(2):181-91.
61. Patel AR, Konstam MA. Assessment of the patient with heart failure. In: Crawford MH,
DiMarco JP, editors. Cardiology. London: Mosby International Ltd, 2001:5.2.1-5.2.10.
62. Loyer EM, Delpassand ES. Radiation-induced heart disease: Imaging features. Semin
Roentgenol 1993;28(4):321-32.
63. Gyenes G, Rutqvist LE, Liedberg A, Fornander T. Long-term cardiac morbidity and
mortality in a randomized trial of pre- and postoperative radiation therapy versus surgery
alone in primary breast cancer. Radiother Oncol 1998;48(2):185-90.
64. Totterman KJ, Pesonen E, Siltanen P. Radiation-related chronic heart disease. Chest
1983;83(6):875-8.
65. Orzan F, Brusca A, Conte MR, Presbitero P, Figliomeni MC. Severe coronary artery
disease after radiation therapy of the chest and mediastinum: clinical presentation and
treatment. Br Heart J 1993;69(6):496-500.
66. Simbre II VC, Adams MJ, Deshpande SS, Duffy SA, Miller TL, Lipshultz SE.
Cardiomyopathy caused by antineoplastic therapies. Curr Treat Options Cardiovasc Med
2001;3(6):493-505.
67. Morton DL, Glancy DL, Joseph WL, Adkins PC. Management of patients with radiationinduced pericarditis with effusion: a note on the development of aortic regurgitaion in two
of them. Chest 1973;64(3):291-7.
68. Om A, Vetrovec GW. Coronary angioplasty of radiation-induced stenosis. Am Heart J
1993;125(4):1164-6.
69. Veeragandham RS, Goldin MD. Surgical management of radiation-induced heart disease.
Ann Thorac Surg 1998;65(4):1014-9.
70. Yuhas JM, Storer JB. Differential chemoprotection of normal and malignant tissues. J
Natl Cancer Inst 1969;42(2):331-5.
71. Capizzi RL. Clinical status and optimal use of amifostine. Oncology (Williston Park)
1999;13(1):47-59.
72. Yuhas JM. Active versus passive absorption kinetics as the basis for selective protection
of normal tissues by S-2-(3-aminopropylamino)-ethylphosphorothioic acid. Cancer Res
1980;40(5):1519-24.
65
73. Blumberg AL, Nelson DF, Gramkowski M, Glover D, Glick JH, Juhas JM et al. Clinical
trials of WR-2721 with radiation therapy. Int J Radiat Oncol Biol Phys 1982;8(3-4):561-3.
74. Kouvaris JR, Kouloulias VE, Vlahos LJ. Amifostine: the first selective-target and broadspectrum radioprotector. Oncologist 2007;12(6);738-47.
75. Vijgh WJ, Peters GJ. Protection of normal tissues from the cytotoxic effects of
chemotherapy and radiation by amifostine (Ethyol): Preclinical aspects. Semin Oncol
1994;21(5 Suppl 11):2-7.
76. Hensley ML, Schuchter LM, Lindley C, Meropol NJ, Cohen GI, Broder G et al. American
Society of Clinical Oncology clinical practice guidelines for the use of chemotherapy and
radiotherapy protectants. J Clin Oncol 1999;17(10):3333-55.
77. Glover D, Riley L, Carmichael K, Spar B, Glick J, Kligerman MM et al. Hypocalcemia
and inhibition of parathyroid hormone secretion after administration of WR-2721 (a
radioprotective and chemoprotective agent). N Engl J Med 1983;309(19):1137-41.
78. Koukourakis MI, Kyrias G, Kakolyris S, Kouroussis C, Frangiadaki C, Giatromanolaki A
et al. Subcutaneous administration of amifostine during fractionated radiotherapy: a
randomized phase II study. J Clin Oncol 2000;18(11):2226-33.
79. Anne PR, Machtay M, Rosenthal DI, Brizel DM, Morrison WH, Irwin DH et al. A Phase
II trial of subcutaneous amifostine and radiation therapy in patients with head-and-neck
cancer. Int J Radiat Oncol Biol Phys 2007;67(2):445-52.
80. Sasse AD, Clark LG, Sasse EC, Clark OA. Amifostine reduces side effects and improves
complete response rate during radiotherapy: Results of a metaanalysis. Int J Radiat Oncol
Biol Phys 2006;64(3):784-91.
81. Viele CS, Holmes BC. Amifostine: drug profile and nursing implications of the first
pancytoprotectant. Oncol Nurs Forum 1998;25(3):515-23.
82. Schuchter LM. Guidelines for the administration of amifostine. Semin in Oncol 1996;23(4
Suppl 8):40-3.
83. Peters GJ, van der Vijgh WJ. Protection of normal tissues from the cytotoxic effects of
chemotherapy and radiation by amifostine (WR-2721): preclinacal aspects Eur J Cancer
1995;31A Suppl 1:1-7.
84. Mitchell ME. Carnitine metabolism in human subject. I. Normal metabolism. Am J Clin
Nutr 1978;31(2):293-306.
66
85. Vanella A, Russo A, Acquaviva R, Campisi A, Di Giacomo C, Sorrenti V et al. Lpropionyl-carnitine as superoxide scavenger, antioxidant, and DNA cleavage protector.
Cell Biol Toxicol 2000;16(2):99-104.
86. Tein I. Carnitine transport: Pathophysiology and metabolism of known molecular defects.
J Inherit Metab Dis 2003;26(2-3):147-69.
87. Bremer J. The role of carnitine in cell metabolism. In: De Simone C, Famularo G (Eds.).
Carnitine today. Austin:Landes Bioscience, 1997:1-37
88. Carter AL, Abney TO, Lapp DF. Biosynthesis and metabolism of carnitine. J Child
Neurol 1995;10 Suppl 2:3-7
89. Rebouche CJ, Seim H. Carnitine metabolism and its regulation in microorganisms and
mammals. Annu Rev Nutr 1998;18:39-61
90. Vaz FM, Wanders RJ. Carnitine biosynthesis in mammals. Biochem J 2002;361(Pt
3):417-29
91. Duranay M, Akay H, Üre M. Hemodiyaliz hastalarında L-Karnitin tedavisi. Türk
Nefroloji Diyaliz ve Transplantasyon Dergisi 2005;14(2):62-4.
92. Siliprandi N, Di Lisa F, Menabo R, Ciman M, Sartorelli L. Transport and functions of
carnitine in muscles. J Clin Chem Clin Biochem 1990;28(5):303-6.
93. Bremer J. The role of carnitine in intracellular metabolism. J Clin Chem Clin Biochem
1990;28(5):297-301.
94. Costell M, O’Connor JE, Grisolia S. Age-dependent decrease of carnitine content in
muscle of mice and humans. Biochem Biophys Res Commun 1989;161(3):1135-43.
95. Costell M, Grisolia S. Effect of carnitine feeding on the levels of heart and skeletal muscle
carnitine of elderly mice. FEBS Lett 1993;315(1):43-6.
96. Evans AM, Fornasini G. Pharmacokinetics of L-carnitine. Clin Pharmacokinet
2003;42(11):941-67.
97. Sezen O, Ertekin MV, Demircan B, Karslıoglu I, Erdogan F, Kocer I et al. Vitamin E and
L-carnitine, separately or in combination, in the prevention of radiation-induced brain and
retinal damages. Neurosurg Rev 2008;31(2):205-13.
98. Arafa HM, Sayed-Ahmed MM. Protective role of carnitine esters against alcohol-induced
gastric lesions in rats. Pharmacol Res 2003;48(3):285-90.
67
99. Pisano C, Pratesi G, Laccabue D, Zunino F, Lo Giudice P, Bellucci A, et al. Paclitaxel and
cisplatin-induced neurotoxicity: a protective role of acetyl-l-carnitine. Clin Cancer Res
2003;9(15):5756-67.
100.Evans A. Dialysis-related carnitine disorder and levocarnitine pharmacology. Am J
Kidney Dis 2003;41(4 Suppl 4):13-26.
101.Leschke M, Rumpf KW, Eisenhauer T, Fuchs C, Becker K, Kothe U et al. Quantitative
assessment of carnitine loss during hemodialysis and hemofiltration. Kidney Int Suppl
1983;16:143-146.
102.Calvani M, Benatti P, Mancinelli A, D'Iddio S, Giordano V, Koverech A et al. Carnitine
replacement in end-stage renal disease and hemodialysis. Ann N Y Acad Sci
2004;1033:52-66.
103.Marquis N, Fritz IB. Effects of testosterone on the distribution of carnitine,
acetylcarnitine, and carnitine acetyltransferase in tissues of the reproductive system of the
male rat. J Biol Chem 1965;240:2197-200.
104.Lenzi A, Sgro P, Salacone P, Paoli D, Gilio B, Lombardo F et al. A placebo-controlled
double-blind randomized trial of the use of combined L-Carnitine and L-Acetyl-Carnitine
treatment in men with asthenozoospermia. Fertil Steril 2004;81(6):1578-84.
105.Cavallini G. Male
2006;8(2):143-57.
idiopathic
oligoasthenoteratozoospermia.
Asian
J
Androl
106.Chevion S, Or R, Berry EM. The antioxidant status of patients subjected to total body
irradiation. Biochem Mol Biol Int 1999;47(6):1019-27.
107.Atlas E, Ertekin MV, Gundogdu C, Demirci E. L-carnitine reduces cochlear damage
induced by gamma irradiation in guinea pigs. Ann Clin Lab Sci 2006;36(3):312-8.
108.Billingham ME. Role of endomiyocardial biopsy in diagnosis and treatment of heart
disease. In: Silver MD (Eds.). Cardiovascular pathology. New York: Churchill
Livingstone; 1991. p.1465.
109.Hopewell JW, Trott KR. Volume effects in radiobiology as applied to radiotherapy.
Radiother Oncol 2000;56(3):283-8.
110.Lauk S, Kiszel Z, Buschmann J, Trott KR. Radiation-induced heart disease in rats. Int J
Radiat Oncol Biol Phys 1985;11(4):801-8.
111.Cilliers GD, Harper IS, Lochner A. Radiation-induced changes in the ultrastructure and
mechanical function of the rat heart. Radiother Oncol 1989;16(4):311-26.
68
112.Fajardo LF, Steward JR. Experimental radiation-induced heart disease. I. Light
microscopic studies. Am J Pathol 1970;59(2):299-316.
113.Schultz-Hector S. Radiation-induced heart disease: Review of experimental data on dose
response and pathogenesis. Int J Radiat Biol 1992;61(2):149-60.
114.Lauk S. Endothelial alkaline phosphatase activity loss as an early stage in the
development of radiation-induced heart disease in rats. Radiat Res 1987;110(1):118-28.
115.Schultz-Hector S, Sund M, Thames HD. Fractionation response and repair kinetics of
radiation-induced heart failure in the rat. Radiother Oncol 1992;23(1):33-40.
116.Utley JF, Seaver N, Newton GL, Fahey RC. Pharmacokinetics of WR-1065 in mouse
tissue following treatment with WR-2721. Int J Radiat Oncol Biol Phys 1984;10(9):15258.
117.Ohnishi ST, Ohnishi T, Glick JH, Schein PS. In vitro study on the antioxidant activities
of amifostine. Proc Am Assoc Cancer Res 1992;33:419-21.
118.Bhanumathi P, Saleesh EB, Vasudevan DM. Creatinine phosphokinase and cardiotoxicity
in Adriamycin chemotherapy and its modication by WR-1065. Biochem Arch
1992;8:335-7.
119.Echols FS, Yuhas JM. Chemoprotection against fractionated radiation exposures with
WR-2721: skin injury. Radiat Res 1976;66(3):449-504.
120.Utley JF, Phillips TL, Kane LJ. Protection of normal tissues by WR-2721 during
fractionated irradiation. Int J Radiat Oncol Biol Phys 1976;1(7-8):699-703.
121.Herman EH, Zhang J, Chadwick DP, Ferrans VJ. Comparison of the protective effects of
amifostine and dexrazoxane against the toxicity of doxorubicin in spontaneously
hypertensive rats. Cancer Chemother Pharmacol 2000;45(4):329-34.
122.Uzal C, Durmus-Altun G, Caloglu M, Ergulen A, Altaner S, Yigitbasi NO. The protective
effect of amifostine on radiation-induced acute pulmonary toxicity: detection by
(99m)Tc-DTPA transalveolar clearances. Int J Radiat Oncol Biol Phys 2004;60(2):564-9.
123.Damron TA, Spadaro JA, Margulies B, Damron LA. Dose response of amifostine in
protection of growth plate function from irradiation effects. Int J Cancer 2000;90(2):73-9.
124.Lamproglou I, Djazouli K, Boisserie G, Patin PH, Mazeron JJ, Baillet F. Radiationinduced cognitive dysfunction: the protective effect of ethyol in young rats. Int J Radiat
Oncol Biol Phys 2003;57(4):1109-15.
69
125.La Scala GC, O’Donovan DA, Yeung I, Darko J, Addison PD, Neligan PC et al.
Radiation-induced craniofacial bone growth inhibition: efficacy of cytoprotection
following a fractionated dose regimen. Plast Reconstr Surg 2005;115:1973-85.
126.Sener G, Paskaloglu K, Satiroglu H, Alican I, Kacmaz A, Sakarcan A. L-carnitine
ameliorates oxidative damage due to chronic renal failure in rats. J Cardiovasc Pharmacol
2004;43:698-705.
127.Kocer I, Taysi S, Ertekin MV, Karslioglu I, Gepdiremen A, Sezen O, et al. The effect of
L-carnitine in the prevention of ionizing radiation-induced cataracts: a rat model.
Graefe’s Arch Clin Exp Ophthalmol 2007;245:588-94.
128.Sayed-Ahmed MM, Salman TM, Gaballah HE, Abou El-Naga SA, Nicolai R, Calvani M.
Propionyl-L-carnitine as protector against adriyamycin-induced cardiomyopathy.
Pharmacol Res 2001;43(6):513-20.
129.Abdel-aleem S, el-Merzabani MM, Sayed-Ahmed M, Taylor DA, Lowe JE. Acute and
chronic effects of adriamycin on fatty acid oxidation in isolated cardiac myocytes. J Mol
Cell Cardiol 1997;29(2):789-97.
130.Singal PK, Siveski-Iliskovic N, Hill M, Thomas PT, Li T. Combination therapy with
probucol prevents adriamycin-induced cardiomyopathy. J Mol Cell Cardiol
1995;27(4):1055-63.
131.Acker SA, Kramer K, Voest EE, Grimbergen JA, Zhang J, van-der-Vijgh WJ, Bast A.
Doxorubicin-induced cardiotoxicity monitored by ECG in freely moving mice. A new
model to test potential protectors. Cancer Chemother Pharmacol 1996;38(1):95-101.
132.McFalls EO, Paulson DJ, Gilbert EF, Shug AL. Carnitine protection against adriamycininduced cardiomyopathy in rats. Life Sci 1986;38(6):497-505.
133.Leach JE. Effect of roentgen therapy on the heart. Arch Intern Med 1943;72:715-745.
134.Jones A, Wedgwood J. Effects of radiations on the heart. Br J Radiol 1960;33:138-58.
135.Lindahl J, Strender L-E, Larsson LE, Unsgaard B. Electrocardiographic changes after
radiation therapy for carcinoma of the breast. Acra Radiol Oncol 1983;22(6):433-40.
136.Biran S, Hochmann A, Stern S. Therapeutic irradiation of the chest and
electrocardiographic changes. CIin Radiol 1969;20(4):433-9.
137.Strender LE, Lindahl J, Larsson LE. Incidence of heart disease and functional
significance of changes in the electrocardiogram 10 years after radiotherapy for breast
cancer. Cancer 1986;57(5):929-34.
70
138.Schwartz CL, Hobbie WL, Truesdell S, Constine LC, Clark EB. Corrected QT interval
prolongation in anthracycline-treated survivors of childhood cancer. J Clin Oncol
1993;11(10):1906-10.
139.Meinardi MT, van Veldhuisen DJ, Gietema JA, Dolsma WV, Boomsma F, van den Berg
MP et al. Prospective evaluation of early cardiac damage induced by epirubicincontaining adjuvant chemotherapy and locoregional radiotherapy in breast cancer
patients. J Clin Oncol 2001;19(10):2746-53.
140.Karpova VN, Kalmykova ZI. Changes inhemodynamics and ECG in dogs following
whole-body external gamma-irradiation. Med Radiol (Mosk) 1986;31(8):33-7.
141.Karpova VN. Hemodynamics in dogs external (60Co) and internal (239Pu) irradiation.
Med Radiol (Mosk) 1988;33810):46-9.
71
EKLER
EK 1