Turk J Vet Anim Sci
27 (2003) 719-725
© TÜB‹TAK
Araflt›rma Makalesi
Koyun Meme Doku Arjinaz›n›n Baz› Biyokimyasal Özellikleri*
Mehtap ÖZÇEL‹K, Necmi ÖZDEM‹R
F›rat Üniversitesi, Veteriner Fakültesi, Biyokimya Anabilim Dal›, Elaz›¤ - TÜRK‹YE
Gelifl Tarihi: 23.05.2002
Özet: Bu çal›flmada, koyun meme doku arjinaz enziminin baz› biyokimyasal özellikleri araflt›r›lm›fl ve arjinaz için preinkübasyon ›s›s›n›n
52 ºC, preinkübasyon zaman›n›n 12 dakika, optimal pH’n›n 9,7 oldu¤u tespit edilmifltir. Ayr›ca koyun meme doku arjinaz›n›n çeflitli
metal iyonlar›na karfl› duyarl›l›¤› da tespit edilmifl ve Mn+2, Cu+2, Mg+2, Ba+2, Fe+3, Ag+2, Cr+3, Sn+2, Hg+2, Pb+2, Co+2, Ni+2, Zn+2,
Ca+2 metal iyonlar› içinde enzim aktivitesi üzerine en etkili metalin Mn+2 oldu¤u bulunmufltur. Enzim 0,75 mM’l›k MnCl2
konsantrasyonunda en yüksek aktiviteyi göstermifltir. Enzim aktivasyonu için Mn+2 katyonlar›n›n ve preinkübasyonun gerekli oldu¤u
görülmüfltür. Sn+2, Pb+2, Cr+2’n›n ise hiç aktivite göstermedi¤i saptanm›flt›r. Enzimin substrata olan ilgisi Michaelis-Menten grafi¤ine
göre de¤erlendirilmifl ve Km de¤eri 1,35 mM olarak bulunmufltur.
Anahtar Sözcükler: Arjinaz, koyun meme dokusu, kinetik özellikleri
Some Biochemical Properties of Arginase in Sheep Mammary Tissue
Abstract: In this study, some biochemical properties of arginase in sheep mammary tissue were examined. Preincubation
temperature, preincubation period and pH were determined to be 52 ºC, 12 min and 9.7, respectively. Furthermore, it was found
that arginase in sheep mammary tissue was sensitive to different metal ions. It was found that the most effective was Mn+2 from
among Mn+2, Cu+2, Mg+2, Ba+2, Fe+3, Ag+2, Cr+3, Sn+2, Hg+2, Pb+2, Co+2, Ni+2, Zn+2 and Ca+2 metal ions. Arginase showed the
highest activity in a 0.75 mM MnCl2 concentration. Manganese ions and preincubation were necessary for the activation of the
enzyme. Sn+2, Pb+2 and Cr+2 showed no activity. The relationship with the enzyme substrata was evaluated according to MichaelisMenten and the Km value was 1.35 mM.
Key Words: Arginase, sheep mammary tissue, kinetic properties
Girifl
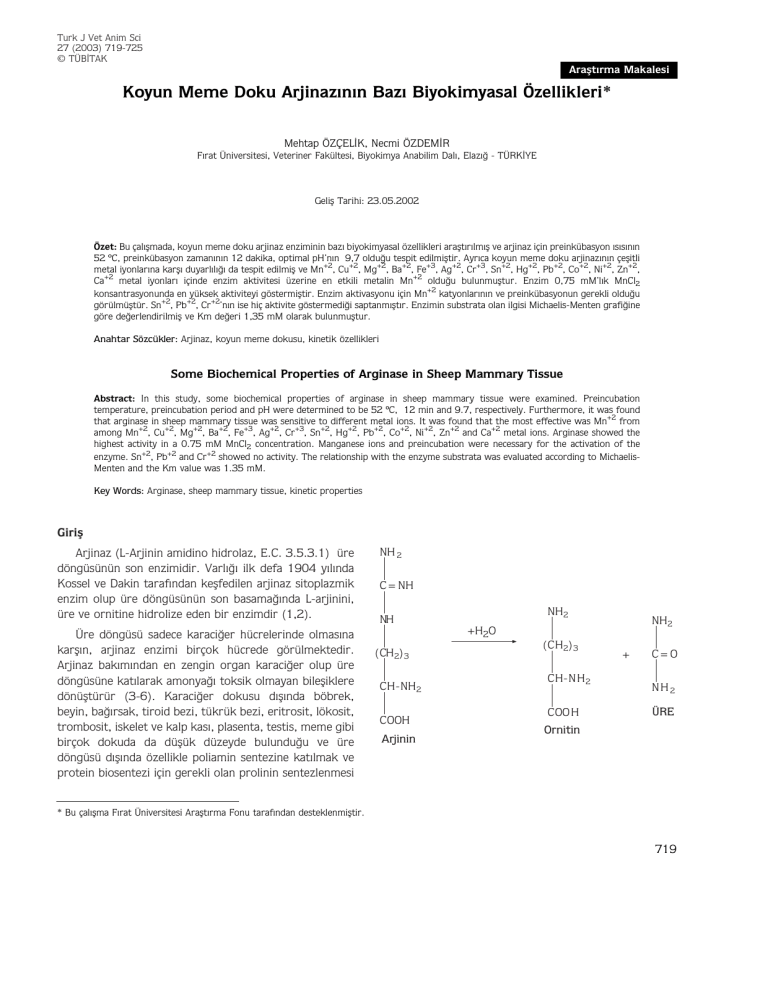
Arjinaz (L-Arjinin amidino hidrolaz, E.C. 3.5.3.1) üre
döngüsünün son enzimidir. Varl›¤› ilk defa 1904 y›l›nda
Kossel ve Dakin taraf›ndan keflfedilen arjinaz sitoplazmik
enzim olup üre döngüsünün son basama¤›nda L-arjinini,
üre ve ornitine hidrolize eden bir enzimdir (1,2).
Üre döngüsü sadece karaci¤er hücrelerinde olmas›na
karfl›n, arjinaz enzimi birçok hücrede görülmektedir.
Arjinaz bak›m›ndan en zengin organ karaci¤er olup üre
döngüsüne kat›larak amonya¤› toksik olmayan bilefliklere
dönüfltürür (3-6). Karaci¤er dokusu d›fl›nda böbrek,
beyin, ba¤›rsak, tiroid bezi, tükrük bezi, eritrosit, lökosit,
trombosit, iskelet ve kalp kas›, plasenta, testis, meme gibi
birçok dokuda da düflük düzeyde bulundu¤u ve üre
döngüsü d›fl›nda özellikle poliamin sentezine kat›lmak ve
protein biosentezi için gerekli olan prolinin sentezlenmesi
NH 2
C = NH
NH 2
NH
NH 2
+H2O
(CH 2) 3
CH-NH 2
COOH
Arjinin
(CH 2) 3
CH-NH 2
COOH
+
C= O
NH 2
ÜRE
Ornitin
* Bu çal›flma F›rat Üniversitesi Araflt›rma Fonu taraf›ndan desteklenmifltir.
719
Koyun Meme Doku Arjinaz›n›n Baz› Biyokimyasal Özellikleri
olmak üzere özel fonksiyonlara sahip oldu¤u saptanm›flt›r
(5-12).
Canl›larda protein biosentezinin en yo¤un oldu¤u
dokulardan birisi de meme dokusudur. Ancak literatür
taramalar› sonucunda koyun meme arjinaz›n›n kinetik
niteliklerinin belirlendi¤i bir çal›flma bulunamam›fl ve bu
çal›flmada koyun meme dokusu arjinaz›n›n niteliklerinin
ortaya ç›kar›lmas› amaçlanm›flt›r.
Materyal ve Metot
Araflt›rma materyalleri, Elaz›¤ Elet Tesisleri’ne kesim
için getirilen laktasyondaki koyunlardan temin edilmifltir.
Bu çal›flmada 1-2 yafllar›nda ve ayn› koflullarda yetifltirilen
ve fiziksel özellikleri ayn› olan 20 tane Akkaraman koyunu
kullan›lm›flt›r. Kesimden hemen sonra al›nan sütlü meme
dokusu % 0,9’luk so¤uk NaCl çözeltisi içerisinde behere
aktar›lm›fl ve buz içersinde olabildi¤ince h›zl› bir flekilde
laboratuara ulaflt›r›lm›flt›r.
Doku örnekleri iki süzgeç ka¤›d› aras›nda
kurutulduktan sonra MnCl2 (1/5, w/v) ile suland›r›larak
Potter-Elvehjem (cam-cam) homojenizatörde homojenize
edilmifltir. Homojenat +4 ºC’de 16000 x g’de 15 dakika
Sorvall RC-5B’de santrifügasyon iflleminden geçirilmifl ve
örneklerin süpernatantlar› enzim kayna¤› olarak
kullan›lm›flt›r. Tiyosemikarbazid-Diasetilmonoksim Üre
(TDMU) yöntemi (13) kullan›larak, koyun meme doku
arjinaz›n›n preinkübasyon ›s›s› ve zaman›, inkübasyon
zaman›, metal iyonlar›n›n aktivite üzerine etkisi, Mn+2
iyonlar›n›n varl›¤›nda ve yoklu¤unda preinkübasyon
›s›s›n›n de¤iflimleri, optimal pH’n›n belirlenmesi ve arjinaz
aktivitesinin L-arjinin konsantrasyonuna ba¤l› de¤iflimi
gibi baz› kinetik özellikleri incelenmifltir.
Koyun meme doku örneklerinin her ml süpernatant›na
3 ünite Jack-Bean üreaz enzimi ilave edildikten sonra
37 ºC’de 15 dakika inkübe edilerek endojen ürenin
parçalanmas› sa¤lanm›flt›r (14). D›fl kaynakl› üreden
ar›nd›r›lan ve üzerine 2 mM MnCl2 ile (1 x 6) ilave
edildikten sonra 52 ºC’de 12 dakika metabolik su
banyosunda preinkübasyon gerçeklefltirilen örnekler
enzim kayna¤› olarak kullan›lm›flt›r. Enzimatik kar›fl›m 1
ml olup 75 mM L-arjininden (pH 9,5) 0,3 ml, 100 mM
karbonat tamponundan (pH 9,5) 0,4 ml, daha sonra
üzerine 0,3 ml preinkübasyona tabi tutulan enzim
kayna¤› eklenerek örnekler 37 ºC’de sallant›l› metabolik
su banyosunda 15 dakika tutulmufltur. Asit kar›fl›mdan
(Sülfirik Asit ve FeCl3 kar›fl›m›) 3 ml ilave ederek
720
reaksiyon durdurulmufl ve üzerine 2 ml renk ay›rac›
(Thiosemicarbazid ve Diasetil monoksim kar›fl›m›) konup
10 dakika kaynar su içerisinde bekletilmifltir. Dalga boyu
520 nm’de (UV/ Vis-Spectro-Shimadzu UV-240)
örneklerin üre miktarlar› s›f›r zaman körlerinin
absorbanslar›n›n (zero time blank) ç›kar›lmas›ndan sonra
de¤erlendirilmifltir.
Protein miktar› Biüret Yöntemi ile saptanm›flt›r (15).
ÜN‹TE: 1mg proteinin 1 saatte oluflturdu¤u üre
miktar›n›n mmol cinsinden ifadesidir (µmol üre/mg
protein x saat).
Bulgular
1-Preinkübasyon Is›s›n›n Tespiti: Koyun meme doku
arjinaz enziminin aktivasyonu için gerekli flartlardan
preinkübasyon ›s›s› araflt›r›lm›flt›r (fiekil 1). Enzim kayna¤›
35 ile 65 ºC’leri aras›nda preinkübasyon ›s›s›na tabi
tutularak en yüksek enzim aktivitesi 50-55 ºC’ler
aras›nda al›nm›flt›r. Bu nedenle enzimin aktivasyonu için
preinkübasyon ›s›s› 52 ºC olarak tespit edilmifltir.
2-Preinkübasyon Zaman›n›n Tespiti: Koyun meme
doku arjinaz›n›n preinkübasyon zaman›na ba¤l› olarak
de¤iflimini MnCl2 varl›¤›nda ve 52 ºC’lik preinkübasyon
›s›s›nda 5-25 dakikal›k zaman aral›klar›nda incelendi¤inde
maksimum aktiviteye 12 ile 15. dakikalar aras›nda
ulafl›ld›¤› görülmüfl ve preinkübasyon zaman› 12 dakika
olarak kabul edilmifltir (fiekil 2).
3-‹nkübasyon Zaman›n›n Tespiti: Koyun meme
doku arjinaz› için inkübasyon süresinin saptanmas›nda
enzim kaynaklar› de¤iflik zaman sürelerinde inkübasyona
tabii tutulmufl, reaksiyon sonunda meydana gelen ürenin
zaman faktörüne ba¤l› olarak miktarlar› belirlenmifltir.
Enzim aktivitesi 12. dakikaya kadar do¤rusall›¤›n›
koruyup bu sürenin sonunda lineerlik yerini hiperbolik bir
görünüme b›rakm›flt›r. Bundan dolay› enzim için optimal
inkübasyon süresi 15 dakika olarak belirlenmifltir (fiekil
3).
4-Koyun Meme Doku Arjinaz Aktivitesi Üzerine
Metal ‹yonlar›n›n Etkisi: Metal iyonlar›n›n etkisini
araflt›rmak için; Mn+2, Cu+2, Mg+2, Ba+2, Fe+3, Ag+3, Cr+3,
+2
+2
+2
+2
+2
+2
+2
Sn , Hg , Pb , Co , Ni , Zn , Ca varl›¤›nda enzim
aktivitelerine bak›lm›flt›r. Bu metal iyonlar› 0,75 mM’l›k
konsantrasyonlarda preinkübasyon ortam›na ilave edilmifl
ve elde edilen sonuçlar kontrole göre de¤erlendirilmifltir
(Tablo 1). Mn+2 iyonu varl›¤›nda enzimin katalitik
M. ÖZÇEL‹K, N. ÖZDEM‹R
aktivitesinin çok yüksek oldu¤u fakat di¤er metal
iyonlar›n›n varl›¤›nda ise enzimin katalitik aktivitesinin
azald›¤› saptanm›flt›r.
+2
5-MnCl2’ün Etkisi: En yüksek konsantrasyonda Mn
iyonlar›n›n arjinaz için gerekli oldu¤u anlafl›ld›ktan sonra
de¤iflik konsantrasyonlarda Mn+2 iyonlar›n›n enzim
aktivitesine olan etkileri incelenmifltir. Preinkübasyon
ortam›n›n Mn+2 içermedi¤i noktada enzim aktivitesi çok
düflüktür. Ortama Mn+2 iyonlar› ilave edildi¤inde belirgin
flekilde aktivite art›fl› gözlenmifltir. En yüksek aktivitenin
görüldü¤ü konsantrasyon 0,5-1 mM aras›ndad›r. 1,5 mM
MnCl2 konsantrasyonundan sonra aktivite düflmüfltür
(fiekil 4). Enzim 0,75 mM’l›k MnCl2 konsantrasyonunda
en yüksek aktiviteyi göstermesinden dolay› bu molarite
enzim için en uygun MnCl2 konsantrasyonu olarak kabul
edilmifltir.
6-Mn+2 ‹yonlar›n›n ve Preinkübasyon Is›s›n›n Koyun
Meme Doku Arjinaz Aktivitesine Etkisi: Preinkübasyon
›s›s›n›n Mn+2 iyonlar›n›n varl›¤›na ba¤l› olup olmad›¤›n›
tespit etmek için +MnCl2’lü ve -MnCl2’süz (distile su ile)
preinkübasyon ifllemine sokulmufltur. Sonuçta; MnCl2
varl›¤›nda uygulanan preinkübasyonla enzimin, çok daha
yüksek aktivite gösterdi¤i tespit edilmifltir. MnCl2’süz
preinkübasyon ifllemine sokulan enzim kayna¤›ndan elde
edilen aktivite ile MnCl2’lü preinkübasyona sokulan enzim
kayna¤›ndan elde edilen aktivitenin sadece 1/3 kat› oldu¤u
bulunmufltur (fiekil 5).
7-Optimal pH’n›n Tespiti: Koyun meme doku
arjinaz›n›n optimal pH’s›n› tespit etmek için 7,5 ile 11
aras›nda de¤iflen pH’larda tampon çözeltiler çal›fl›lm›flt›r
(Glisin-NaOH Tamponu, Tris-HCl Tamponu, Sodyum
bikarbonat-Sodyum karbonat tamponu). fiekil 6’da
Ünite
Ünite
6
4
2
7
6
5
4
3
2
1
0
0
0
30
fiekil 1.
40
50
Preinkübasyon Is›s› (ºC)
60
70
fiekil 3.
4
8
‹nkübasyon Zaman›
12
16
Koyun Meme Doku Arjinaz Aktivitesinin ‹nkübasyon
Zaman›na Ba¤l› Olarak De¤iflimi.
Koyun Meme Doku Arjinaz Aktivitesinin Preinkübasyon
Is›s›na Ba¤l› Olarak De¤iflimi.
6
6
5
5
4
4
Ünite
Ünite
7
3
3
2
2
1
1
0
0
0
fiekil 2.
5
10
15
20
Preinkübasyon Zaman› (dakika)
25
Koyun Meme Doku Arjinaz Aktivitesinin Preinkübasyon
Zaman›na Ba¤l› Olarak De¤iflimi.
Kontrol
0
fiekil 4.
2
4
MnCl (mM)
6
Koyun Meme Doku Arjinaz Aktivitesinin
Konsantrasyonuna Ba¤l› Olarak De¤iflimi.
8
MnCl2
721
Koyun Meme Doku Arjinaz›n›n Baz› Biyokimyasal Özellikleri
görüldü¤ü gibi pH grafi¤i tipik bir çan e¤risi (Bell shape)
fleklinde olup en yüksek aktiviteyi Sodyum bikarbonatSodyum karbonat tamponu pH 9,5’da verdi¤inden dolay›
optimal pH olarak kabul edilmifltir.
8-Koyun Meme Doku Arjinaz Aktivitesinin L-Arjinin
Konsantrasyonuna Ba¤l› De¤iflimi: Doku için bütün
uygun flartlar belirlendikten sonra enzimin substrat›na
ilgisi Michaelis-Menten grafi¤i ile incelenmifltir. 0-35 mM
aras›nda de¤iflen L-arjinin konsantrasyonlar› çal›fl›lm›flt›r.
Reaksiyon h›z› bafllang›çta 2 mM’a kadar lineerlik
gösterirken (I. Aflama Kineti¤i), daha sonra yerini
hiperbolik bir görünüme (Kar›fl›k Aflama Kineti¤i)
b›rakm›fl, sonunda da enzim 15 mM substrat
konsantrasyonundan sonra doygunlu¤a (S›f›r Aflama
Kineti¤i) ulaflarak reaksiyon sabit h›zla devam etmifltir
(fiekil 7, 8). Koyun meme doku arjinaz›n›n substrat› Larjinine karfl› olan Km’i 1,35 civar›ndad›r. Enzim
aktivitesinin substrat konsantrasyonuna ba¤l› olarak
de¤iflimi Lineweaver-Burk e¤risiyle de¤erlendirilmifltir.
Tart›flma
Meme dokusu, aktif üre döngüsünün görülmedi¤i
buna karfl›l›k arjinaz enzim aktivitesine rastland›¤› bir
dokudur (2,16,17).
Enzimlerin genel yap›s› protein kaynakl› olmas›
nedeniyle ›s›ya dayan›kl› de¤illerdir. Maksimum aktivite
gösterdi¤i ›s›n›n üstüne ç›k›ld›¤› zaman enzim aktivitesi
düflmektedir. Laktasyondaki koyun meme doku
arjinaz›n›n preinkübasyon ›s›s›n›n 52 ºC, zaman› ise 12
dakika olarak bulunmufltur (fiekil 1, 2). Arjinaz›n
+2
ölçümünde preinkübasyon iflleminin ve Mn iyonlar›n›n
gerekli oldu¤u önerilmektedir (18,19). Colombo ve
Konarska (20), 55 ºC’de 20 dakikal›k bir preinkübasyonla
karaci¤er arjinaz aktivitesinin 4-5 kat, eritrosit arjinaz
6
6
5
5
+MnCl
4
Ünite
Ünite
4
3
-MnCl
2
3
2
1
1
0
0
20
30
40
50
S›cakl›k(ºC)
60
Mn++ ‹yonlar›n›n ve Preinkübasyon Is›s›n›n Koyun Meme
Doku Arjinaz Aktivitesi Üzerine Etkisi.
fiekil 5.
0
70
5
fiekil 7.
10
15
20
Arginin (mM)
25
30
35
Koyun Meme Doku Arjinaz Aktivitesinin L-Arginin
Konsantrasyonuna Ba¤l› De¤iflimi.
1/V
6
0.4
5
Ünite
4
0.2
Glisin Tamponu
Karbonat Tamponu
Tris Tamponu
3
2
Km = 1.35
1
0
-1
0
7
8
9
10
11
12
pH
fiekil 6.
722
Koyun Meme Doku Arjinaz Aktivitesi ‹çin Optimal pH’n›n
Saptanmas›.
-0.8
(-1/S)
fiekil 8.
-0.6
-0.4
-0.2
0
0.2
0.4
0.6
0.8
1
1/S
Koyun Meme Doku Arjinaz Aktivitesinin L-Arjinin
Konsantrasyonuna Ba¤l› Km De¤erinin Lineweaver-Burk
E¤risi ile Gösterilmesi.
M. ÖZÇEL‹K, N. ÖZDEM‹R
Tablo 1.
Metal ‹yonlar›n›n Koyun Meme Doku Arjinaz Aktivitesi
Üzerine Etkisi.
Metal iyonlar›
% Aktivite
Kontrol
100
MnCl2
2060
CdCl2
700
NiSO4
556
CaCl2
216
MgCl2
164
BaCl2
124
CuSO4
116
FeCl3
110
HgCl2
100
CoSO4
96
ZnSO4
72
AgNO3
44
SnCl2
0
Pb(NO3)2
0
CrO3
0
aktivitesinin ise 2-6 kat artt›¤›n› bulmufllard›r. Schimke
(21), s›çan karaci¤er arjinaz aktivitesi için preinkübasyon
›s›s›n› 55 ºC zaman› ise 5 dakika olarak tespit etmifltir.
Buna göre preinkübasyon zaman›n›n dokulara göre
farkl›l›k gösterdi¤i ortaya konulmufltur.
Koyun meme doku arjinaz aktivitesinin inkübasyon
süresine ba¤l› olarak de¤ifliminde 15. dakikaya kadar
lineer art›fl›n görüldü¤ü, 15. dakikadan sonra lineerli¤in
bozuldu¤u görülmüfltür (fiekil 3).
+2
+2
+2
Enzim üzerine metal iyonlar›n›n Mn , Cu , Mg ,
+3
+2
+3
+2
+2
+2
+2
+2
Ba , Fe , Ag , Cr , Sn , Hg , Pb , Co , Ni , Zn+2,
Ca+2, Cd+2 etkisi araflt›r›ld›¤›nda maksimum aktiviteyi
Mn+2 iyonlar›n›n verdi¤i saptanm›flt›r (Tablo 1). Koyun
meme doku arjinaz› metal iyonu ile preinkübe edildi¤inde,
Mn+2’n›n % 2060 aktivite gösterdi¤i daha düflük olarak
da Cd+2’un % 700, Ni+2’in % 556, Ca+2’un % 216,
Mg+2’un % 164, Ba+2’un % 124, Cu+2’›n % 116, Fe+3’in
% 110, Hg+2’n›n % 100 aktive gösterdi¤i saptanm›flt›r.
Co+2, Zn+2, Ag+2 gibi metaller ise çok düflük oranda
aktivite gösterdi¤i, Sn+2, Pb+2, Cr+3 metal iyonlar›n›n ise
hiç aktivite göstermedi¤i belirlenmifltir (Tablo 1).
+2
I-Enzim + 2 Mn++
++
++
II-Enzim-(Mn )2 + 2 Mn
Bir doku için aktivatör olan metal iyonu di¤er bir doku
için inhibitör olabilmektedir. Yap›lan bir çal›flmada borat›n
rat karaci¤er arjinaz›n› inhibe etti¤i bulunmufltur (22).
Spector ve ark. (4), yetiflkin ve fötal insan›n, karaci¤er,
eritrosit, böbrek, beyin ve gastrointestinal sistem
dokular›nda Mn+2> Co+2> Mg+2 iyonlar›n›n enzimi aktive
+2
ederken, Ca ’un inhibe etti¤ini ortaya koymufllard›r.
Baflka bir çal›flmada Mn+2, Ni+2, Cd+2, Co+2 iyonlar›n›n
+2
+2
+2
rumen doku arjinaz›n› aktive ederken Hg , Zn , Ag ,
+2
+2
+2
+2
Sn , Cu , Fe , Pb iyonlar›n›n aktiviteyi tümüyle
engelledikleri tespit edilmifltir (23). Carvajal ve ark. (24),
insan karaci¤er arjinaz› üzerine metal iyonlar›n›n esas rolü
oynad›¤›n› ve en güçlü etkiyi de Mn+2 iyonunun
gösterdi¤ini saptam›fllard›r.
+2
Bilindi¤i gibi Mn katyonlar› arjinaz aktivitesi için
gerekli bir kofaktördür. Her doku için ayr› ayr›
konsantrasyonlarda MnCl2 kullan›lmas› gerekir.
Laboratuvar›m›zda koyun meme doku arjinaz enzimi için
Mn+2 konsantrasyonu belirlenmifltir. Buna göre koyun
meme doku arjinaz enzimi en yüksek aktiviteyi 0,75 mM
MnCl2 konsantrasyonunda vermifltir (fiekil 4). Rather
(25), arjinaz›n Mn+2 iyonuyla aktivasyonunu de¤iflik bir
yaklafl›mla aç›klam›flt›r. S›çan ve s›¤›r arjinazlar› dört alt
birimden meydana gelmifl olup her bir alt birime bir Mn+2
iyonu ba¤lanmaktad›r.
Kompleks I, Kompleks II’ye oranla % 50 daha az
aktifdir. Kompleks I’in Kompleks II’ye dönüflüm basama¤›
belki de tepkime h›z›n›n kontrol edildi¤i basamakt›r.
Preinkübasyon bu basamak için gerekli olan ›s› ve zaman›
sa¤lamaktad›r.
Enzim-Mn+2-Arjinin kompleksinin oluflmas›nda, enzimi
aktive eden Mn+2 iyonlar› enzim-substrat aras›nda bir
köprü oluflturmufltur (20,26).
Preinkübasyon ortam›na Mn+2 iyonlar› ilave edilerek
yap›lan çal›flman›n ilave edilmeden yap›lan çal›flmadan
daha yüksek aktivite verdi¤i görülmüfltür. Mn+2 iyonunun
+2
aktiviteyi yaklafl›k 3 kat artt›rd›¤› tespit edilmifltir. Mn
iyonu ilave edilmeden preinkübe edilen enzim kayna¤› 55
ºC’ye kadar çok az aktivite gösterdi¤i, 55 ºC’den sonra
düflmeye bafllad›¤›, 70 ºC’de ise enzim aktivitesini
tamamen kaybetti¤i saptanm›flt›r. Oysa Mn+2 iyonu ilave
Enzim-(Mn++)2
(Kompleks I)
++
(Kompleks II)
E-(Mn )4
723
Koyun Meme Doku Arjinaz›n›n Baz› Biyokimyasal Özellikleri
edilen çal›flmada 55 ºC’ye kadar bariz bir art›fl görülmüfl,
55 ºC’den sonra ise düflüfl gözlenmifltir (fiekil 5).
Mohammed ve ark. (14), preinkübasyon s›ras›nda
MnCl2’ün arjinaza ba¤lanarak enzimin aktivitesini ve
dayan›kl›l›¤›n› art›rd›¤›n› aç›klam›fllard›r. Keza Mn +2
iyonlar›n›n enzim aktivitesini stabilize etti¤i de ortaya
konulmufltur (27).
Farkl› organ ve türlerde yap›lan birçok çal›flmada
arjinaz enzimi için optimal pH’n›n 9-11 aras›nda de¤iflti¤i
saptanm›flt›r (4,20,21,28,29). Bu nedenle çal›flmam›zda
uygun tampon seçimi ve optimal pH araflt›r›lm›fl ve enzim
aktivitesi için karbonat tamponunun ve pH 9,5’un uygun
oldu¤u saptanm›flt›r (fiekil 6).
Benzer flekilde Colombo ve Konarska ve Ozan (20)
hem karaci¤er hem de eritrosit arjinaz›, Eriflir ise (19)
s›¤›r rumen arjinaz› için uygun pH’n›n 9,7 dolay›nda
oldu¤unu bildirilmektedirler.
Koyun meme doku arjinaz›n›n, L-arjinine karfl› Km
de¤eri Michaelis-Menten (fiekil 7) ve Lineweaver-Burk
(fiekil 8) e¤rileri ile araflt›r›lm›fl ve yaklafl›k 1,35 mM
olarak bulunmufltur. ‹nsanlarda karaci¤er, böbrek, beyin,
gastrointestinal sistemde arjinaz enziminin Km de¤erinin
8-18 mM olarak bulundu¤u (4), s›¤›r rumen arjinaz›n›n
saflaflt›r›lmadan önce ve sonra Km de¤erinin 4 mM (19),
s›çan karaci¤er arjinaz›n›n Km de¤erinin 10-20 mM
aras›nda de¤iflti¤i (1), M. benedeni arjinaz›n›n Km
de¤erinin ise 12,5 mM oldu¤u ortaya konulmufltur (28).
Bu çal›flmalar do¤rultusunda aktif üre döngüsünün
görülmedi¤i dokularda Km de¤erinin küçük oldu¤u
görülmektedir.
Karaci¤er haricinde üre döngüsünün bulunmad›¤›
meme gibi birçok dokuda yada ürolitik canl›larda arjinaz
enzim aktivitesinin bulunmas›, arjinaz enziminin
amonya¤›n detoksifikasyonu ifllemi haricinde baz›
fonksiyonlar›n›n (poliamin ve protein sentezi gibi)
olabilece¤ini ortaya koymaktad›r (5-11).
Koyun meme dokusunda aktif üre döngüsünün
bulunmamas›na karfl›n arjinaz›n varl›¤›n›n saptanmas›,
arjinaz›n süt proteinlerinin sentezinde gereksinim duyulan
amino asitlerin biyosentezinde görev ald›¤›n›n bir kan›t›
olarak de¤erlendirilebilir.
Kaynaklar
1.
Garganta, C.L., Bond, J.S.: Assay and Kinetics of Arginase. Anal.
Biochem. 1986; 154: 388-394.
2.
King, J.: Arginase. Practical Clinical Enzymology. D. Van Nostrand
Company, London, 220-225, 1965.
3.
Moreno-Vivian, C., Soler, G., Castillo, F.: Arginine Catabolism in
the Phototophic Bacterium Rhodobacter Capsulatus E1F1. Eur. J.
Biochem. 1992; 204: 531-537.
4.
Spector, E.B., Rice, S.C.H., Moedjono, S., Bernard, B.,
Cederbaum, S.D.: Biochemical Properties of Arginase in Human
Adult and Fetal Tissues. Biochem. Med. 1982; 28: 165-175.
5.
Fuentes, J.M., Campo, M.L., Soler, G.: Kinetics and Inhibition by
Some Aminoacids of Lactating Rat Mammary Gland Arginase.
Arch. Int. Physiol. Biochimie Biophysique. 1994; 102: 255-258.
6.
Ber, E., Muszynska, G.: Chemical Modification of Rat Liver
Arginase. Acta Biochim. Polonica. 1979; 26: 103-114.
7.
Konarska, L., Tomaszewski, L.: Studies on L-Arginase of Small
Intestine. Biochem. Med. 1975; 14: 250-262.
8.
Konarska, L., Tomaszewski, L., Rolczyk, U.: Studies on L-Arginase
in Developing Rat Small Intestine, Brain and Kidney. Biochem.
Med. Metabol. Biol. 1986; 35: 170-178.
9.
Nadolska-Lutyk, J., Grabon, W., Poremska, Z.: Arginase in Bull
Testis. Acta Biochim. Polonica. 1990; 37: 377-384.
724
10.
Nakamura, H., Saheki, T., Nakagawa, S.: Differential Cellular
Localization of Enzymes of L-Arginine Metabolism in the Rat
Brain. Brain Res. 1990; 530: 108-112.
11.
Özdemir, N., Gürsu, F., Ozan, S., Gülen, fi.: K›v›rc›k ve Düz Saçl›
Erkek ve K›z Ö¤rencilerin Eritrositlerinde ve Tükürüklerindeki
Arjinaz Enzim Aktiviteleri Aras›ndaki ‹liflki. F. Ü. Sa¤l›k Bil. Derg.
1993; 7: 84-90.
12.
Hirsch-Kolb, H., Heine, J.P., Kolb, H.J., Greenberg, D.M.:
Comparative Physical-Chemical Studies of Mammalian Arginases.
Comp. Biochem. Physiol. 1970; 37: 345-359.
13.
Geyer, J.W., Dabich, D.: Rapid Method for Determination of
Arginase Activity in Tissue Homogenates. Anal. Biochem. 1971;
39: 412-417.
14.
Mohammed, S.M., Greenberg, D.M.: Liver Arginase I. Preparation
of Extracts of High Potency, Chemical Properties, Activation,
Inhibition and pH Activity. Arch. Biochem. Biophys. 1945; 8: 349357.
15.
Gornall, A.G., Bardawill, C.J., David, M.M.: Determination of
Serum Proteins by Means of the Biüret Reaction. J. Biol. Chem.
1975; 177: 751
16.
Basch, J.J., Wickham, E.D., Farrell, H. M.: Arginase in Lactating
Bovine Mammary Glands: Implications in Proline Synthesis. J.
Dairy Sci. 1997; 80: 3241-3248.
M. ÖZÇEL‹K, N. ÖZDEM‹R
17.
Yip, M.C.M, Knox, W.E.: Function of Arginase in Lactating
Mammary Gland. Biochem. J. 1972; 127: 893-899.
24.
Carvajal, N, Cederbaum, S.D.: Kinetics of Inhibition of Rat Liver
and Kidney Arginases by Proline and Branched-Chain Amino Acids.
Biochim. Biophy. Acta. 1986; 870: 181-184.
Carvajal, N., Torres, C., Uribe, E, Salas, M.: Interaction of
Arginase with Metal Ions: Studies of the Enzyme from Human
Liver and Comparison with Other Arginases. Comp. Biochem.
Physiol. 1995; 112B: 153-159.
18.
25.
Eriflir, M., Ozan, S.T.: S›¤›r Doku Rumen Arjinaz›n›n
Saflaflt›r›lmas›ndan Önce ve Saflaflt›r›lmas›ndan Sonra Baz›
Özellikler. Turk. J. Vet. Anim. Sci. 1999; 23: 597-608.
Rather, S.: Enzymatic Synthesis of Arginine. 359-364
(Condensing and Splitting Enzymes). In Methods in Enzymology,
Academic Press, Inc. Vol 2, 1955.
26.
Colombo, J.P, Konarska, L.: Arginase. In: Bergmayer, H.O. Ed:
Methods of Enzymatic Analysis. 3rd. ed. Weinheim: Vertag
Chemic. 285-294, 1984.
Rather, S.: Farnohian and Clearge on C-N bonds in Arginine and
Urea Biosynthesis. 227-233: In: Horecker, B.L., Cornudella,
Reflections on Biochemistry, Pergamon Press, New York, 1976.
27.
Schimke, R.T.: Adaptive Characteristics of Urea Cycle Enzymes in
the Rat. J. Biol. Chem. 1962; 237: 459-467.
Rüegg, U.T, Russell, A.S.: A Rapid and Sensitive Assay for
Arginase. Analyt. Biochem. 1980; 102: 206-212.
28.
22.
Reczkowski, R.S, Ash, D.E.: Rat Liver Arginase: Kinetic
Mechanism, Alternate Substrates and Inhibitors. Arch. Biochem.
Biophy. 1994; 312: 31-37.
Özdemir, N.: M. Benedeni Arjinaz›n›n Baz› Özellikleri. F›rat
Üniversitesi Veteriner Fakültesi Biyokimya Anabilim Dal›, Doktora
Tezi, 1990.
29.
23.
Eriflir, M., Ozan, S.T.: S›¤›r Rumen Doku Arjinaz›nda –SH
Gruplar›n›n Varl›¤› ve Enzim Aktivitesi Üzerine Baz› Metal ‹yonlar›
ile Guanidino Bilefliklerinin Etkisi. Biyokim. Derg. 1998; 23: 2431.
Hosoyama Y.: The Reversible Inactivation of Rat-Liver Arginase at
Low pH. Eur. J. Biochem. 1972; 27: 48-52.
19.
20.
21.
725
