BİLEŞİKLER
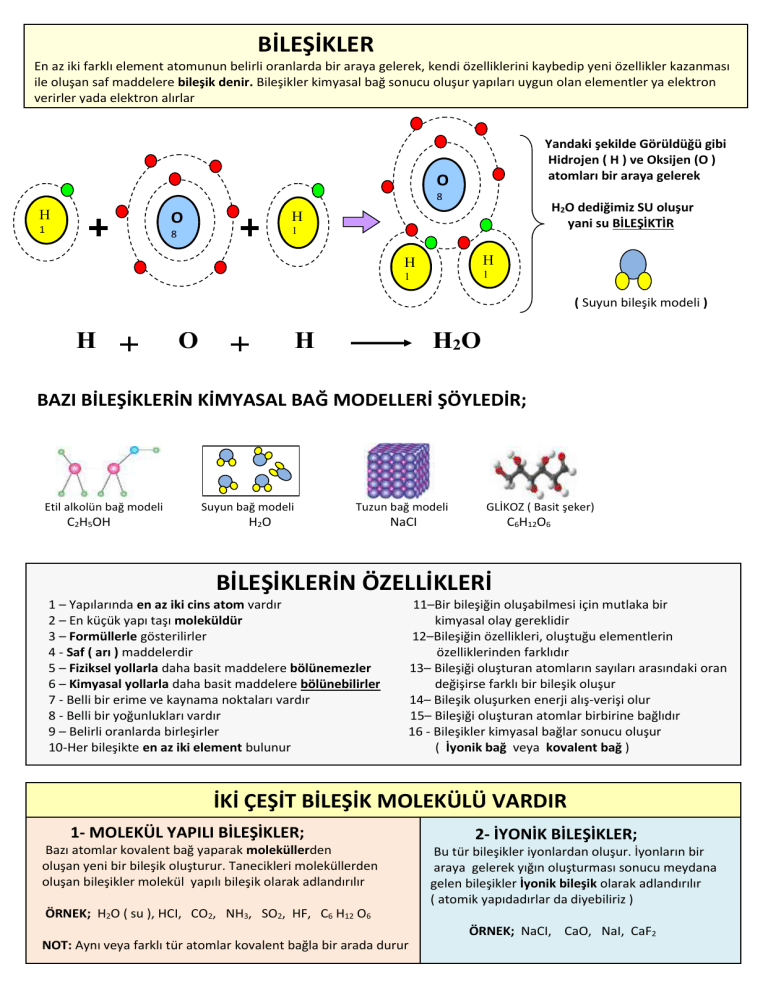
En az iki farklı element atomunun belirli oranlarda bir araya gelerek, kendi özelliklerini kaybedip yeni özellikler kazanması
ile oluşan saf maddelere bileşik denir. Bileşikler kimyasal bağ sonucu oluşur yapıları uygun olan elementler ya elektron
verirler yada elektron alırlar
Yandaki şekilde Görüldüğü gibi
Hidrojen ( H ) ve Oksijen (O )
atomları bir araya gelerek
O
8
H
O
1
H2O dediğimiz SU oluşur
yani su BİLEŞİKTİR
H
1
8
H
H
1
1
( Suyun bileşik modeli )
H
O
H
H2O
BAZI BİLEŞİKLERİN KİMYASAL BAĞ MODELLERİ ŞÖYLEDİR;
Etil alkolün bağ modeli
C2H5OH
Suyun bağ modeli
Tuzun bağ modeli
H2O
GLİKOZ ( Basit şeker)
NaCI
C6H12O6
BİLEŞİKLERİN ÖZELLİKLERİ
1 – Yapılarında en az iki cins atom vardır
2 – En küçük yapı taşı moleküldür
3 – Formüllerle gösterilirler
4 - Saf ( arı ) maddelerdir
5 – Fiziksel yollarla daha basit maddelere bölünemezler
6 – Kimyasal yollarla daha basit maddelere bölünebilirler
7 - Belli bir erime ve kaynama noktaları vardır
8 - Belli bir yoğunlukları vardır
9 – Belirli oranlarda birleşirler
10-Her bileşikte en az iki element bulunur
11–Bir bileşiğin oluşabilmesi için mutlaka bir
kimyasal olay gereklidir
12–Bileşiğin özellikleri, oluştuğu elementlerin
özelliklerinden farklıdır
13– Bileşiği oluşturan atomların sayıları arasındaki oran
değişirse farklı bir bileşik oluşur
14– Bileşik oluşurken enerji alış-verişi olur
15– Bileşiği oluşturan atomlar birbirine bağlıdır
16 - Bileşikler kimyasal bağlar sonucu oluşur
( İyonik bağ veya kovalent bağ )
İKİ ÇEŞİT BİLEŞİK MOLEKÜLÜ VARDIR
1- MOLEKÜL YAPILI BİLEŞİKLER;
Bazı atomlar kovalent bağ yaparak moleküllerden
oluşan yeni bir bileşik oluşturur. Tanecikleri moleküllerden
oluşan bileşikler molekül yapılı bileşik olarak adlandırılır
2- İYONİK BİLEŞİKLER;
Bu tür bileşikler iyonlardan oluşur. İyonların bir
araya gelerek yığın oluşturması sonucu meydana
gelen bileşikler İyonik bileşik olarak adlandırılır
( atomik yapıdadırlar da diyebiliriz )
ÖRNEK; H2O ( su ), HCI, CO2, NH3, SO2, HF, C6 H12 O6
ÖRNEK; NaCI, CaO, NaI, CaF2
NOT: Aynı veya farklı tür atomlar kovalent bağla bir arada durur
Bazı bileşik örnekleri
BAZI BİLEŞİKLERİN KULLANIM ALANLARI
Bileşik
Bileşiğin adı
NH3
Temizlik maddelerinde kullanılır
H2SO4
Sülfürik asit
C6 H12 O6
Basit şekerdir gıda maddelerinin yapısında bolca
kullanılır ( Çikolata, şeker …….. )
HCI
Hidrojen klorür
CO2
Karbondioksit
NaCI
Sodyum klorür
CaO
Kalsiyum oksit
NH3
Amonyak
NaI
Sodyum iyodür
CaF2
Kalsiyum florür
SO2
Kükürt dioksit
( Glikoz )
CO2
SO2
NaCI
Gazlı içeceklerde kullanılır, Bitkilerin fotosentez
sırasında kullandıkları gazdır. Yangın söndürücülerde
de kullanılır
Şeker endüstrisinde kullanılır. Hava kirliliğine ve asit
yağmurlarına neden olur
Yemeklerde kullandığımız tuzdur
MODEL ÇALIŞMASI
MADDE
MADDE GRUBU
YAPISI
ATOM ÇEŞİDİ ( türü )
ELEMENT ( saf )
MOLEKÜLER
1
BİLEŞİK ( saf )
MOLEKÜLER
2
ELEMENT( saf )
ATOMİK
BİLEŞİK ( saf )
MOLEKÜLER
KARIŞIMDIR ( saf değildir )
BİLEŞİK ( Saf )
ATOMİK VE MOLEKÜLER
İYONİK
1
3
5
2
KARIŞIMLAR
En az iki farklı maddenin kimyasal özelliklerini kaybetmeden bir araya gelmesiyle oluşturulan
madde topluluğudur. ( Tuzlu su, şekerli su, hava, kolonya, ayran, sütlü kahve, çay, kan, çamurlu
su, çelik, tunç gibi ) İki çeşit karışım vardır; 1-Homojen karışım 2-Heterojen karışım
KARIŞIMLARIN ÖZELLİKLERİ
1 – Saf değildirler
2 – Farklı cins atom veya moleküllerden meydana gelir
3 – Karışımları oluşturan maddeler her oranda ( rastgele )karışabilir
4 – Fiziksel yollarla ayrıla bilirler (süzme, mıknatıs gezdirme, eleme, gibi)
5 – Belirli bir yoğunlukları yoktur
6 – Belirli bir sembolleri ve formülleri yoktur
7- Karışımın oluşumu fiziksel bir olaydır. Bu nedenle karışıma giren
Maddeler kendi özelliklerini kaybetmez
8- Kaynama ve donma süresince sıcaklıkları sabit değildir
9- Kaynama noktası, donma noktası ve öz kütle değerleri karışanlara bağlı
olarak değişir
10- Karışımlarda kimyasal bağ olmaz
11-Karışımlar Homojen ( çözelti ) ve Heterojen olmak üzere iki çeşittir
Bir karışım modeli
Bazı karışımlar
Kolonya: Alkol ( C2 H5 OH ) + Su ( H2 O )
Tentürdiyot: Alkol ( C2 H5 OH ) + İyot ( I2 )
Deniz suyu: Su + Oksijen + Tuz
Gazoz: Karbondioksit + Su + Şeker
KARIŞIM
HOMOJEN ( çözelti ) Karışımlar
HETEROJEN ( adi ) Karışımlar
( katı - sıvı )
( sıvı – sıvı )
( sıvı – gaz )
( katı - sıvı )
( sıvı – sıvı )
( sıvı – gaz )
Örnek:
Örnek:
Örnek:
Örnek:
Örnek:
Örnek:
Tuzlu su
Şekerli su
Tentürdiyot
Alkol-su
Kolonya
Benzin-mazot
Su-oksijen gazı
Kola
Soda
Gazoz
Çamurlu su
Zeytinyağı-su
Tüp gaz, sis vb
1 - HETEROJEN KARIŞIM(adi karışım): Her tarafında aynı özelliği göstermeyen yani eşit dağılmayan
Bu şekil heterojen
bir karışımı gösteren
modeldir
(eşit dağılmamış )
Çamurlu
su
karışımlardır gözle bakıldığında yada mikroskopla ayırt edilebilirler (Su-zeytinyağı karışımı, süt, sis, toprak, ayran,
çamurlu su, duman nohutlu pilav, salata gibi
su
Bir bardak çamurlu suyu, bir süre
beklettikten sonra bardağın
dibinde çamurun biriktiğini iste
ise suyun biriktiğini görürüz.
Çamur
Heterojen Karışım Çeşitleri;
1- Katı-sıvı ( Süspansiyon ) : Katının sıvı içinde çözünmeden dağılmasıyla oluşan heterojen karışımlardır
Örneğin: Tebeşir tozu-su karışımı, Çamurlu su, ayran
2- Sıvı-sıvı ( Emülsiyon) : Sıvıların birbiri içinde çözünmeden dağılması ile oluşan
Örneğin: Zeytinyağı-su, Benzin-su gibi karışımlar
3- Sıvı-gaz ( Aerosol ) : Gazların sıvı içinde dağılması ile oluşan heterojen karışımlardır
Örneğin; Tüp gaz, deodorant, böcek ilaçları, sis ( su buharı + hava ) gibi
2 ) HOMOJEN KARIŞIM ( çözelti ): Bir maddenin başka bir madde içinde gözle görülmeyecek küçük
tanecikler halinde dağılmasıyla oluşan karışımlardır. Homojen karışımlar, her tarafında aynı özelliği gösterir ve tek
bir maddeymiş gibi görünürler Homojen karışımlara ÇÖZELTİ de denir
ALAŞIM: Alaşımlarda homojen bir karışımdır.
Metallerin birbiri ile karıştırılmasından oluşur.
Örneğin;
Örneğin: (Şekerli su, tuzlu su, gazoz,
kolonya, temiz hava, çelik,
çay, kola, lehim gibi )
Çelik= demir+karbon(kömür)
Bronz (Tunç) : bakır+kalay
Lehim : kurşun+kalay
Pirinç : çinko+bakır
Altın bilezik( 22 ayar ): Altın + Bakır
ÇÖZÜNME: İki maddenin birbiri içinde homojen dağılması olayına Çözünme denir. Oluşan karışıma ise çözelti denir
Çözeltiler; çözücü ve çözünen olmak üzere iki unsurdan oluşur. Çözelti içinde miktarı çok olan maddeye çözücü, miktarı
daha az olan maddelere de çözünen denir. ( Ancak, sulu homojen karışımlarda, miktarı az bile olsa , suyu “çözücü” kabul
etmek yanlış olmaz )
ÇÖZELTİ
ÇÖZÜCÜ
ÇÖZÜNEN
ÇÖZELTİ = Çözücü + Çözünen
Türçesiesi
ŞEKERLİ SU
şeker
su
Örnekler;
1-Hava; azot içerisinde çözünmüş gazlardan
oluşan bir çözeltidir ( Gaz çözeltisi )
2-Kola; su içinde kola, şeker gibi maddelerin
çözündüğü bir içecektir ( Sıvı çözeltisi )
4
GAZOZ
su
KOLONYA
su
ÇELİK
Demir
DENİZ suyu
su
SİRKE
su
LEHİM
Kalay
3-Madeni para: bakır, nikel ve çinko metallerinden
oluşmuş bir çözeltidir ( Katı çözeltisi )
karbondioksit
karbondioksit
Alkol + ……
Karbon
Oksijen + …….
Asetik asit +
….. Kurşun
ÇÖZÜNME NASIL OLUYOR: Çözelti oluşurken çözücü ve çözünen birbiri ile etkileşir. Bunun sonucu olarak;
Çözünen madde iyonik bir madde ise iyonlarına ayrılır Çözünen madde molekül yapılı bir madde ise moleküllerine
ayrılır ayrılan bu iyonlar ve moleküller çözücü tanecikleri tarafından sarılır ve çözücü içerisine dağıtılır
ÇÖZELTİLER İKİYE AYRILIR;
1- SEYRELTİK ÇÖZELTİLER; Çözüneni az olan çözeltilere denir. Çözeltileri derişik yani yoğun hale getirmek için biraz daha
çözüneni artırabiliriz veya çözeltiyi ısıtarak bir kısım çözücüyü buharlaştırıp çözeltiyi yoğun hale getirebiliriz
2- DERİŞİK ( Konsantre ) ÇÖZELTİLER: Çözüneni çok olan çözeltilere denir. Bu tür çözeltileri seyreltik hale yani az yoğun
hale getirebilmek için çözeltinin sıcaklığı değiştirilerek içerisindeki çözünen maddenin bir kısmı katı halde çöktürülebilir
ÇÖZÜNME HIZINA ETKİ EDEN FAKTÖRLER:
1- Sıcaklığın etkisi: Sıcaklık artırıldığında çözücü ve çözünen madde taneciklerinin hareket hızları artar. Birim zamanda
Birbirleri ile daha çok temas ettiklerinden çözünme olayının hızı artar
2-Çözücü ve çözünen arasındaki temas yüzeyinin etkisi: Çözünen madde tanecikleri daha küçük parçalar haline
Getirilirse çözücü madde ile daha fazla temas edeceğinden çözünme hızı artar. Aynı şekilde bir
çözelti karıştırılırsa birim zamanda meydana gelen temas artacağından çözünme hızı artar
NOT: Çözeltilerde çözücü maddenin belli bir çözme sınırı vardır;
*** Çözünen maddenin bu sınıra ulaştığı karışımlara DOYMUŞ çözelti denir. Sınırı aşana ise AŞIRI Doymuş denir
*** Çözünen maddenin bu sınıra ulaşmadığı karışımlara DOYMAMIŞ çözelti denir
ELEKTROLİT Çözeltiler: Çözündüğünde iyonlarına ayrılan maddelerin çözeltileri elektrik akımını iletir.
Bu tür elektrik akımını İleten çözeltilere elektrolit çözelti adı verilir. Yemek tuzunun sulu çözeltisi elektrik akımını iletir.
Çünkü suda hareket eden Na+ ve CI- iyonları elektrik akımı iletkenliğini sağlar
ELEKTROLİT Olmayan çözeltiler: Suda moleküller halinde çözünen maddelerin çözeltileri ise elektrik akımını iletmez