BÖLÜM 4:SERAMİK MALZEMELER
Seramiklerin Tanımı ve Genel Özellikleri : Seramik malzemeler, metal ve metal olmayan
elementlerin birbirlerine birinci derecede iyonik/ve/veya kovalent bağıyla bağlandığı inorganik,
metal dışı malzemelerdir. Seramik malzemelerin özellikleri atomlar arası bağlarına göre değişir.
Seramik malzemeler genel olarak düşük tokluk ve süneklikte olup sert ve kırılgandır. Seramikler,
iletim elektronları olmadığından, elektrik ve ısıyı kötü iletir. Güçlü atom bağları nedeniyle çok ağır
ortamlarda bile kimyasal olarak kararlıdır ve yüksek erime sıcaklığına sahiptir. Bu özellikleri
seramik malzemeleri birçok mühendislik tasarımı için vazgeçilmez kılar.
Seramikler, geleneksel ve mühendislik (teknik) seramikler olarak ikiye ayrılabilir.
Geleneksel seramikler: Üç temel bileşenden yapılır: kil, silika ve feldispat. Kilin ana hamaddesi özsulu
alüminyum silikatlar (Al2O3.SiO2.H2O) olup bileşimde küçük miktarlarda TiO2, Fe2O3, MgO,CaO, Na2O
ve K2O gibi diğer oksitlerde bulunur. Geleneksel seramiklerdeki kil, pişirmeyle sertleşmeden önceki
işlenebilirliği sağlar ve malzemenin ana bileşenidir. Çakmaktaşı veya kuvars diye de adlandırılan Silika
(SiO2), yüksek erime sıcaklığına sahiptir ve geleneksel seramiklerin ateşe direncini sağlar.
K2O.Al2O3.6SiO2 bileşiminde olan potas (potasyum) feldispat düşük erime sıcaklığına sahiptir, dolayısı
ile seramik karışım pişirildiğinde camlaşarak sıcaklığa dayanıklı bileşenleri birbirine bağlar.
İnşaat tuğlası, kiremit, yer ve duvar karosu, temel bileşenlerin üçünü de içeren doğal kilden yapılır.
Elektroporselen, sofra eşyası, sağlık gereçleri gibi ürünler, belirli bileşimlerdeki kil, silika ve feldispat
dan yapılır.
Mühendislik seramikleri: Başlıca bileşeni kil olan geleneksel seramiklerin aksine, mühendislik
seramikleri veya teknik seramikler saf oksitler, karbürler ve nitrürler vb. bileşiklerden oluşur. Önemli
mühendislik seramiklerine elmas, grafit, baryum titanat, ferrit, alumina (Al2O3), silisyum karbür (SiC),
titanyum nitrür (TiN), titanyum karbür (TiC) ve Zirkonya (ZrO2) örnek olarak verilebilir. Kullanım
alanları arasında aşındırıcılar, sensörler, akustik cihazlar sayılabilir.
1
Basit seramik bileşiklerde iyonik ve kovalent bağ
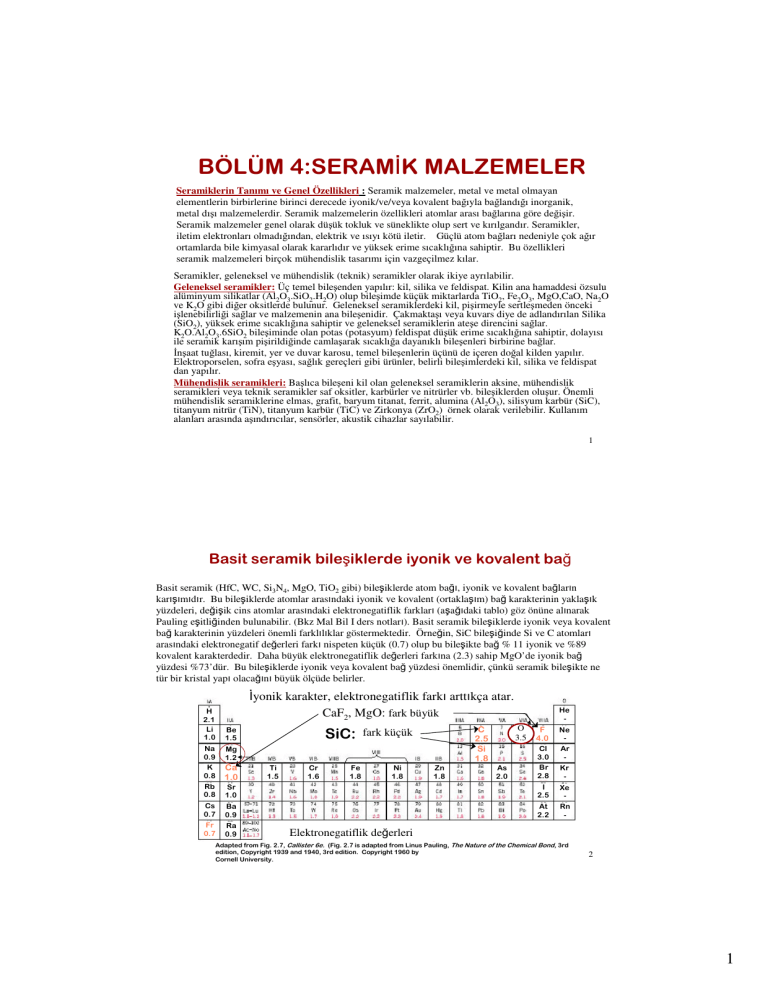
Basit seramik (HfC, WC, Si3N4, MgO, TiO2 gibi) bileşiklerde atom bağı, iyonik ve kovalent bağların
karışımıdır. Bu bileşiklerde atomlar arasındaki iyonik ve kovalent (ortaklaşım) bağ karakterinin yaklaşık
yüzdeleri, değişik cins atomlar arasındaki elektronegatiflik farkları (aşağıdaki tablo) göz önüne alınarak
Pauling eşitliğinden bulunabilir. (Bkz Mal Bil I ders notları). Basit seramik bileşiklerde iyonik veya kovalent
bağ karakterinin yüzdeleri önemli farklılıklar göstermektedir. Örneğin, SiC bileşiğinde Si ve C atomları
arasındaki elektronegatif değerleri farkı nispeten küçük (0.7) olup bu bileşikte bağ % 11 iyonik ve %89
kovalent karakterdedir. Daha büyük elektronegatiflik değerleri farkına (2.3) sahip MgO’de iyonik bağ
yüzdesi %73’dür. Bu bileşiklerde iyonik veya kovalent bağ yüzdesi önemlidir, çünkü seramik bileşikte ne
tür bir kristal yapı olacağını büyük ölçüde belirler.
İyonik karakter, elektronegatiflik farkı arttıkça atar.
CaF
CaF
fark büyük
2: large
2, MgO:
H
2.1
Li
1.0
Be
1.5
Na
0.9
Mg
1.2
K
0.8
Ca
1.0
Rb
0.8
He
-
O
3.5
C
2.5
Si
1.8
F
4.0
Ne
-
Cl
3.0
Ar
-
Br
2.8
Kr
-
Sr
1.0
I
2.5
Xe
-
Cs
0.7
Ba
0.9
At
2.2
Rn
-
Fr
0.7
Ra
0.9
küçük
SiC: fark
small
Ti
1.5
Cr
1.6
Fe
1.8
Ni
1.8
Zn
1.8
As
2.0
Elektronegatiflik
değerleri
Table of Electronegativities
Adapted from Fig. 2.7, Callister 6e. (Fig. 2.7 is adapted from Linus Pauling, The Nature of the Chemical Bond, 3rd
edition, Copyright 1939 and 1940, 3rd edition. Copyright 1960 by
Cornell University.
2
1
İyonik Bağ ve Kristal Yapı
İyonik katılar, katyonlar ve anyonlardan oluşur. İyonik
bağda bazı atomlar dış elektronlarını kaybederek
katyon olurken, diğerleri dış elektron kazanarak anyon
haline gelir. Bu nedenle, katyonlar bağlandıkları
anyondan daha küçüktür.
İyonik seramik katılarda iyonların düzeni aşağıdaki
etmenler tarafından belirlenir:
AmXp
–
–
Genel kimyasal formül
değerlerini yükler
!
m, p determined
bybelirler
charge
neutrality
Yapıdaki net yükün sıfırdır.
İyonların bağıl büyüklüğü
İyonik katıdaki elektriksel yansızlığın (nötürlük)
korunması için elektrostatik yüklerin dengelenmesi
CaF2:
F-
Ca2+ +
cation
anions
F-
Bir iyonik katıda birliktelik (koordinasyon) sayısı (BS), bir kristalin birim hücresindeki, merkez bir katyonu
çevreleyen eşit uzaklıktaki en yakın komşu anyon adetine karşılık gelir. Kararlılık için merkez katyonu
mümkün olduğu kadar çok anyon çevreler. Bununla birlikte, anyonlarla, temas ettikleri merkez katyon
arasında yük yansızlığı korunur. İyonik katıda, merkez bir katyon ve çevresindeki anyonların kararlı ve
kararsız birlikteliği aşağıdaki şekilde görülmektedir. Anyonlar, merkez katyona değmezse merkez katyon
anyon kafesi içinde dolaşabileceğinden yapı kararsız olur. Merkez katyonun yarıçapının onu çevreleyen
anyonun yarıçapına oranına, r katyon/R anyon bağıl büyüklük denir. Anyonların birbirine ve merkez katyona
değdikleri yarıçap oranı da kritik (en küçük) yarı çap oranıdır. Bu kritik değerin altında yapı kararsızdır.
r/R< Kritik değer
r/R>kritik değer
r/R= Kritik değer
İyonik katıların
kararlı ve kararsız
birliktelik biçimleri
kararlı
kararsız 3
kararlı
İyonların Birlikteliği (Koordinasyonu)
Sıkı paket birliktelik (BS=12): Birliktelik
sayısı, iyonların bağıl büyüklüğüne
bağlıdır. Bir kristaldeki tüm atomlar aynı
büyüklükte ise bir atomun etrafında en
fazla 12 komşu atom (birliktelik sayısı 12)
olur. Bu tür sıkı paketleme YMK ve SDH
yapılarda bulunur.
Tüm atomlar aynı
büyüklüktedir. koordinasyon
sayısı= 12
r/R=1
Kübik birliktelik (BS=8): Eğer atomlardan veya iyonlardan birisi küçülürse, iyonların veya atomların bağıl
büyüklüklerinin incelenmesi gerekir. Bağıl büyüklük, katyon yarıçapının (r) komşu anyon yarıçapına (R) oranı (r/R)
olarak tanımlanır. Anyonlar katyonlardan daha büyük iyonlar olduğu için, katyon yarıçapının (r) azalması ile r/R
oranı küçülür. Eğer, komşu anyonlar ile teması kalacak şekilde katyon büyüklüğünü küçültürsek 8 anyon tarafından
kuşatılan bir katyon birlikteliği ilk önce ortaya çıkar. Anyonların merkezlerinin birleştirildiğinde küp ortaya çıktığı
için bu birlikteliğe küp birliktelik denir. Katyon küçüldükce katyon belirli büyüklüğün altında katyon çevresindeki
anyonlar ile temas etmez ki bu durum dengesizlik yaratır. Kritik (en küçük) yarıçap oranı, aşağıdaki şekilde
hesaplanır.
2
2
( R + 2r + R) = (2 R ) + (2 2 R )
2
A
B
2 R + 2r = 4 R + 8 R
2 R + 2r = 3.464 R
2
a=2R
R
2r
R
2√2 R
2
2r = 1.464 R
r
= 0.732
R
Kritik (en küçük)
4
yarıçap oranı
2
Oktahedral birliktelik (BS=6): Kübik birliktelikte çap oranı 0.732 den küçük olan katyon kararlı değildir.
Bu durumda yapı, BS=6 olan sekiz yüzlüye değişecektir. Bu birlikteliğe, anyonların merkezlerinden geçen
düzlemlerin oluşturduğu şekil oktahedron olduğu için oktahedral birliktelik denir. Oktahedral birliktelik,
r/R=0.732’nin altında belli bir kritik orana (en küçük yarı çap oranı) kadar dengelidir. En küçük yarıçap
oranı aşağıdaki şekilde hesaplanır.
(2 R + 2r )
2
Anyonlar
r
+2
2R
2R
Katyon
2R
= 4R + 4R
2
2
2 R + 2r = 8 R
2r = 0.8284R
En küçük yarı
r
= 0.414 çap oranı
R
2
Oktahedral=sekizyüzlü
Tetrahedral Birliktelik (BS=4): r/R oranı < 0.414
olduğunda yapı dörtlü birliktelik gösterir. Anyonların
(büyük atomların) merkezlerinden geçen düzlemler
tetrahedra (dört yüzlü) oluşturur. Bu bakımdan dörtlü
birlikteliğe tetrahedral birliktelik adı verilir. En küçük
yarıçap oranını hesaplamak daha karmaşıktır. Fakat,
hesaplar en küçük oranın r/R=0.225 olduğunu
göstermektedir.
Tetrahedral= dörtyüzlü
5
Üçgen Birliktelik (BS=3): r/R< 0.225 olduğunda üçgen (trigonal) birliktelik dengeli yapı olur. Üçgen
birliktelikte, birliktelik sayısı 3’dür. Yani üç anyon 1 katyonu kuşatır. Dengesizlik sınırı (kritik en küçük
yarıçap oranı) r/R=0.155’dır.
Lineer Birliktelik (BS=2): r/R < 0.155 altındaki oranlarda katyon ancak iki anyon
tarafından kuşatılır. Bu ikili koordinasyona lineer birliktelik denir.
Özet
Yandaki tablo değişik birliktelik
sayıları için r/R oranlarını
özetlemektedir ve her bir
koordinasyon numarası için
birliktelik şeklini özet olarak
göstermektedir. Koordinasyona
ait bu genel bilgiler iyonik bağ
baskın ise geçerlidir. Kovalent
yapılarda atomlar elektronları
paylaştığı için durum farklıdır.
Birliktelik sayıları, 5, 7, 9 ve 10
karmaşık yapılarda mümkündür.
r/R
B.S.
Birliktelik şekli
1.0
12
Hekzagonal veya YMK
≥ 0.732
8
Kübik
≥0.414
6
Sekiz yüzlü (oktahedral)
≥0.225
4
Dört yüzlü (tetrahedral)
≥ 0.155
3
Üçgen (trigonal)
<0.155
2
Lineer
6
3
Birliktelik Sayısı-Kristal Yapı
• Birliktelik sayısı, r/R ile artar.
Birliktelik sayıları 4, 6 ve 8 olan, merkez bir katyonu çevreleyen
anyonlara sahip iyonik katılarda bazı kristal yapıları aşağıda
gösterilmektedir.
ZnS
(zincblende)
Coord #
Bir katyonun
etrafındaki
anyonların konumu
Dörtyüzlünün köşeleri
(tetrahedral)
Sekiz yüzlünün köşeleri
2
Birliktelik
sayısı
3
NaCl
(sodium
chloride)
4
6
CsCl
(cesium
chloride)
(oktahedral)
Küpün köşeleri
8
7
AX TİPİ KRİSTAL YAPILARI
Eşit sayıda katyon ve anyon içeren çok bilinen bazı seramik
malzemeler AX bileşikleri olarak adlandırılır. Değişik kristal
yapılara sahip AX bileşikleri vardır. Burada A=katyon, X=
anyondur. Aynı kristal yapıya sahip bileşikler, en çok bilinen
malzeme adı altında grublandılırılmıştır.
Sezyum Klorür yapısı: Cs+ ve Cl- iyonları sayısı eşittir.
Cs+ ve Cl- iyon yarıçap oranları 0.94 olduğu için
sezyum klorür kübik birlikteliğe (BS=8) sahiptir. Bu
yüzden, bir CsCl birim hücresinde (1/2, 1/2, 1/2)
noktasında merkez bir sezyum katyonunu sekiz klor
iyonu çevreler. CsCl yapısındaki iyonik bileşikler
CsBr, TlCl ve TlBr’dir. AgMg, LiMg, AlNi ve βCuZn gibi intermetalik (metaller arası) bileşikler de
bu yapıdadır.
Sodyum klorür yapısı: Sodyum klorür veya kaya
tuzunun kristal yapısı, yüksek iyoniklikte bağa sahiptir.
Yük yansızlığını korumak için Na+ ve Cl- iyonları eşit
sayıdadır. Yandaki Cl- iyonları YMK atom kafes
noktalarında yer alırken, Na+ katyonları YMK atomları
arasındaki ara yerlerde bulunur. Her bir Na+ katyonu
altı Cl- anyonu tarafından çevrildiği için, yapı
sekizyüzlü birlikteliğe sahiptir, yani BS=6’dır. Yarı çap
oranları, 0.56’ya eşit olup 0.414’den büyük ve
0.732’den küçük olduğuna göre bu cins birliktelik
beklenmektedir. NaCl yapısına sahip seramik
bileşiklere diğer örnekler MgO, CaO, MnS ve FeO’dur.
(1/2,1/2,1/2) Cs+
CsCl kristal birim hücresi. Bu
kristal yapısında merkez bir
sezyum katyonu sekiz klor iyonu
tarafından kuşatılır (birliktelik
sayısı=8). Bu birim hücrede bir
Cs+ ve bir Cl- iyonu vardır.
Cl-
Cl-
Na+: (1/2,0,0) (0,1/2,0)
(0,0,1/2) (1/2,1/2,1/2)
Cl-: (0,0,0) (1/2,1/2,0)
(1/2,0,1/2) (0,1/2,1/2)
Bir NaCl kafes birim
hücresinde, Na+
(yarıçap=0.102 nm) ve Cl(yarıçap=0.181 nm)
iyonlarının yerleri
Na+
Merkezi bir Na+
katyonu
çevresinde altı
Cl- anyonu
bulunduran,
sekizyüzlü
(oktahedral)
birliktelik.
8
4
YMK ve Sıkı Düzenli Hekzagonal SDH Kristal kafeslerinde ara yerler
Kristal yapısı olan bir kafesteki atomlar veya
iyonlar arasında pek çok boş yer veya boşluk
vardır. Bu boşluklar ana kafes atomları dışındaki
atomlar veya iyonlar tarafından doldurulabilecek
arayerler diye adlandırılır. YMK ve SDH kristal
yapılarında iki cins ara yer vardır: Sekiz yüzlü
(oktahedral) ve dört yüzlü (tetrahedral). Sekiz
yüzlü yerde boşluğun merkezinden eşit
uzaklıkta en yakın altı atom veya iyon bulunur.
Yandaki şekilde, YMK yapıda sekizyüzlü ara
yerlerin birim hücrenin merkezinde ve küp
kenarlarında bulunduğu görülmektedir YMK
birim hücresinde toplam 4 eşdeğer oktahedral
boşluk vardır. Bu da atom başına bir ara yer
demektir.
YMK kafesinde dörtyüzlü (tetrahedral) arayerler
(1/4,1/4,1/4) noktalarında yer alır ve tetrahedral
arayer sayısı toplam 8 adettir. Dolayısı ile atom
başına 2 adet tetrahedral arayer vardır.
YMK sıkı dolumuna benzediği için SDH birim
hücresindeki atom sayısı kadar sekizyüzlü ara yer
ve atom sayısının iki katı kadar dört yüzlü ara yer
bulunur.
Birbirine değen
altı atomun
oluşturduğu
sekiz düzlem
arasında
oktahedral arayer
Oktahedral
arayer
Atom
veya
iyon
YMK kafeste (sekiz yüzlü) oktahedral
boşluklar. Bir YMK birim hücresinde toplam
12/4 +1 = 4 eşdeğer oktahedral boşluk vardır.
Atom
veya
iyon
Birbirine
değen 4 atom
arasında dört
yüzlü
(tetrahedral)
arayer
Tetrahe
dral
arayer
YMK kafeste tetrahedra (dört
yüzlü) arayerler. Tetrahedral
arayer sayısı toplam 8’dir. 9
Çinko sülfür (ZnS) kristal yapısı: Çinko sülfür, ZnS kimyasal
formülüne sahiptir ve yanda gösterilen birim hücresi dört çinko ve
dört kükürt atomu bulunur. Bir cins atom (S veya Zn) YMK birim
hücresinde kafes noktalarında yer alırken diğer cins (Zn veya S)
YMK birim hücresinin dörtyüzlü ara yerlerinin yarısını işgal eder.
Pauling eşitliğine göre Zn-S bağı %87 kovalent karakterdedir. ZnS
yapısı dörtyüzlü ortaklaşım bağlıdır. Birliktelik sayısı 4’tür. CdS,
InAs, InSb ve ZnSe gibi bir çok yarı iletken çinko sülfür yapısına
sahiptir.
Elmas Kübik Yapısı: Elmasın kristal yapısı ZnS yapısının
bir türüdür. Tüm karbon atomları Zn ve S yerlerinde bulunur.
Her bir karbon atomu dört karbon atomuna bağlı olup bu
bağlar %100 kovalent karakterdedir. Gri kalay (<13 C) ve
germanyum elmas kübik yapıda olan malzemelerdir.
Grafitin yapısı: Grafit, karbonun çok yapılı şekillerinden
(polimorfizm) biri olup elmasdan farklı bir kristal yapıya
sahiptir. Grafit, atomları hegzagonal düzende dizilmiş
tabakalı bir yapıdadır. Tabaka içindeki karbon atomları güçlü
kovalent bağıyla birbirlerine bağlıdır. Tabakalar kendi
aralarında zayıf ikincil bağlarla bağlı olduğundan birbirleri
üzerinde kolayca kayar. Tabakaların kayma kolaylığı grafite
yağlayıcı özelliklerini verir.
ZnS kristal
yapısı
Zn
S
Elmas
kristal
yapısı
Grafitin hegzagonal
(SDH değil !) yapısı
10
5
AmXp TİPİ KRİSTAL YAPILARI
Eğer, katyonların ve anyonların yükleri farklı ise, AmXp
bileşiği oluşur. Örnek olarak AX2 verilebilir. Bu yapı genel
olarak CaF2 florit yapısı olarak bilinir. Katyonlar (Ca+2) YMK
yerlerine yerleşir :(0,0,0); (1/2,1/2,0); (1/2,0,1/2), (0,1/2,1/2).
Anyonlar (F-) ise dörtyüzlü yerlerin sekizini de işgal eder.
YMK kafesinde sekizyüzlü yerler boş kalır. Böylece bir birim
hücrede dört Ca+2 ve sekiz F- iyonu vardır ve yükler
dengededir. 4 Ca+2 /8 F-1 oranı 1/2 (m/p) oranını verir. CaF2
de iyon yarıçapları oranı (0.1/0.133) ~0.8’dir. Bu durumda
birliktelik sayısı 8’dir.Bu yapıya sahip bileşiklere örnek olarak
UO2, BaF2, AuAl2 ve PbMg2 gösterilebilir.
Ca+2
F-1
AmBnXp TİPİ KRİSTAL YAPILARI
Seramik bileşiklerde birden fazla katyon olması mümkündür. A ve B ile
temsil edilen iki tür katyon için bileşiklerin kimyasal formulü AmBnXp olarak
gösterilir. Ba+2 ve Ti+4 katyonlarına sahip BaTiO3 (Baryum Titanat) bu
sınıfa düşer. Bu malzemenin basit bir kristal yapısı olup Perovskit yapı
olarak adlandırılan yapıya sahiptir. Küpün köşelerinde Ba+2 katyonları, O-2
anyonları ise küp yüzey merkezlerinde Ti 4+ atomları ise küp merkezinde
bulunur. Birim hücrede (8x1/8=1) bir Ba 2+ iyonu, (6x1/2=3) üç O 2– iyonu ve
küp merkezinde bir Ti 4+ iyonu mevcut olup toplamda BaTiO3 bileşiği elde
edilir. BaTiO3 120°C’nin üstünde bu yapıdadır. Bu yapıya sahip bileşikler
arasında SrTiO3, CaZrO3, LaAlO3 bileşikleri sayılabilir.
Ba+2
O -2
Ti+4
11
Örnek problem 1:
1: İyonik katılar olan CsCl ve NaCl için birliktelik sayısını bulun. İyonik yarıçaplar
Cs+=0.170 nm, Na+=0.102 nm Cl-=0.181 nm
Çözüm: CsCl için yarıçap oranı=r(Cs+)/R(Cl-)=0.170/0.181=0.94. Oran 0.732 den büyük olduğuna
göre kübik birliktelik (BS=8) olması gerekir. NaCl için yarıçap oranı r(Na+)/R(Cl-)=0.102/0.181=0.56.
Oran 0.414’ten büyük, 0.73’den küçük olduğuna göre sekizyüzlü birliktelik (BS=6) olması gerekir.
Örnek Problem 2: İyonik yarıçap oranlarını kullanarak FeO kristal yapısını bulun. İyonik yarıçaplar
Fe+2=0.077 nm, O-2=0.140 nm
Çözüm: FeO, AX tipi bir bileşiktir. Yarıçaplar oranı r (Fe+2)/R(O-2)=0.077/0.140=0.55. Bu değer
0.414 ile 0.732 arasındadır. Bu durumda birliktelik sayısı=6’dır. Koordinasyon sayısı 6 olan AX’ın
kristal yapısı, NaCl kristal yapısıdır.
Örnek Problem 3: NaCl’un yoğunluğunu Na+ ile Cl- iyonlarının yarıçaplarından ve atom kütlelerinden
yararlanarak hesaplayın. İyonik yarı çaplar: Na+=0.102 nm, Cl-=0.181 nm. Atom kütleleri Na=22.99
g/mol, Cl=35.45 g/mol
Çözüm: Yandaki şekilde gösterildiği gibi NaCl birim hücresinde
Cl- iyonları YMK cinsi atom kafesi oluşturur ve Na+ iyonları Cliyonları arasındaki ara yer boşluklarını doldurur. NaCl birim
hücresinin 8 köşesinde bir eşdeğer Cl- iyonu (8 x 1/8 iyon= 1 iyon)
ve yüzeylerinde üç eşdeğer Cl- iyonu (6 yüzey x 1/2 iyon=3)
olduğundan NaCl birim hücresinde toplam olarak 4 Cl- iyonu
bulunmaktadır. NaCl birim hücresinin yüksüz olması için 4 adet
Na+ iyonunun birim hücrede bulunması gerekir. NaCl birim
hücresinin yoğunluğunu hesaplamak için önce NaCl birim
hücresinin kütlesini ve sonra hacmini hesaplayacağız. Bu ikisi
bilinirse yoğunluk=m/V hesaplanabilir.
Na+
Cl-
12
6
Çözüm (Problem 3 devamı):
(4 Na x 22.99 g / mol ) + (4Cl x35.45 g / mol )
6.02 x10 atom(iyon) / mol
= 3.88 x10 g
+
2 (r+R)
−
m=
23
− 22
ClR
Na+
2r
R
a
Küp yüzeyinde Na+ ve
Cl- iyonları temas
halindedir.
a = 2( r + R ) = 2(0.102nm + 0.181nm) = 0.566nm
= 0.566nmx10 cm / nm = 5.66 x10 cm
−7
−8
V = a = 1.81x10 cm
3
− 22
3
m 3.88 x10 g
=
= 2.14 g / cm
V 1.81x10 cm
− 22
ρ
NaCl
=
− 22
3
3
NaCl’ün el kitaplarındaki yoğunluk değeri 2.16 g/cm3’dür.
13
Seramiklerde Hatalar
Katyon boşluğu
cation
Nokta hataları
hataları: Arayer ve yer alan katı çözeltileri seramiklerde
vacancy
de oluşur. Örneğin, NiO-MgO sisteminde tüm bileşimlerde tam
Ca2+
çözünme (yer alan) vardır. (Mg (0.66Ǻ)ve Fe(0.74 Ǻ) iyonik
Na+
yarıçapları farkı %10.8). Ekseri, ara yerler dolu olduğu için
Na+
Ca2+
seramiklerde ara yer katı çözeltilerine metallerde ki kadar
initial
geometry Ca2+ impurity
resulting
geometry
İlk geometri
son geometri
rastlanmaz. Örneğin, NaCl yapısına sahip MgO’de tüm
oktahedral arayerler doludur. CaF2 de ise tüm tetrahedral ara
Anyon boşluğu
anion vacancy
yerler işgal edilmiştir. Empürite atomları da elektrik yük
O2yansızlığını sağlamalıdır. Eğer empürite atomu normalde bir
seramik malzemede katyon ise ekseri kafes atomunun yerini alır.
ClClÖrneğin, Ca+2 ve O-2 iyonlarının sırasıyla Na+ ve Clinitial
geometry
O2- impurity
resulting
geometry
İlk geometri
son geometri
iyonlarılarının yerini alması çok muhtemeldir. Bu durumda
NaCl yapıda elektrik yük yansızlığını sağlamak için kafes hataları
meydana gelir: Fazla + yüke sahip Ca+2 iyonları NaCl kafeste bir
Shottky
katyon ara yer boşluğu oluşur. Benzer şekilde O-2 NaCl ye ilave
Defect:
edildiğinde anyon boşluğu ortaya çıkar. Boşluklar yandaki
hatası
şekilde görüldüğü gibi Frenkel veya Schottky hataları şeklinde
de gösterilebilir. Frenkel hatası bir iyon normal yerini terk eder
ve yerinde bir boşluk bırakırsa olur. Schottky hatası ise bir çift
Frenkel
Defect
(katyon ve anyon boşluğu) boşluktan ibarettir. Katyon/anyon
hatası
oranı, bu hatalar ile değişmez.
Dislokasyonlar:
Dislokasyonlar: Bazı seramik malzemelerde (LiF, MgO) dislokasyonlar gözlenmiştir. Fakat, yüksek sıcaklıklarda
bile seramik gevrek kırılır. Yani, kayma ve pastik deformasyon hemen hemen yoktur. (Bunun nedenleri daha önce
açıklanmıştı). Yüzey hataları
hataları: Genelde seramiklerde mukavemeti artırdığından küçük tane boyutu istenir. Çünkü,
tane sınırı arttığından kırılma çöncesi çatlağın kat ettiği yol artar, böylece kırılmadan önce daha fazla enerji
absorblanır. Üç boyutlu hatalar: Kalıntı faz, porosite (gözenek) seramiklerde görünen üç boyutlu hatalardandır.
Özellikle gözenekler seramik mukavemetinin düşmesine (gerilme yığılması etkisi !) neden olur.
14
7
Seramiklerin Mekanik Özellikleri
Bütün seramik malzemeler nispeten kırılgandır, plastik
deformasyon göstermez. Çok az seramik 172 MPa’ın
üstünde çekme dayanımına sahiptir. Seramik
malzemelerin çekme ve basma dayanımları arasında
büyük fark vardır. Örneğin, Al2O3 seramiğinde basma
dayanımı, çekme dayanımının 5-10 katıdır. Ayrıca
seramik malzemelerin çoğu serttir ve darbe dayanımları
düşüktür. Bununla beraber kil, kuvvetli iyonikortaklaşım bağlı atomların oluşturduğu tabakalar
arasındaki zayıf bağlar nedeniyle, yumuşak ve kolayca
şekil verilebilen bir maddedir.
Seramik malzemede plastik deformasyon (kalı
(kalıcı şekil değ
değişimi): Seramiklerin kırılgan olmasının nedeni,
dislokasyonların kolayca hareket edememesi (büyük Burger vektörü), az miktarda kayma sisteminin bulunması ve
yönlenmiş özel bağların olmasıdır. Kovalent bağlı seramik kristallerde atomlar arasındaki bağ elektron çiftlerini
içeren özel ve yönlenmiş bağdır. Bu yüzden kovalent bağlı kristaller, yeterli gerilmeye maruz bırakılırsa, elektron
çiftlerinin yeniden düzenlenmeden birbirinden ayrılması ve yeniden oluşamaması sonucu gevrek kırılma gösterir.
İyonik seramiklerde eksi yüklü anyon ve artı yüklü katyonların birlikte olması kayma işlemini etkiler. Kayma işlemi
sırasında aynı yüke sahip iyonlar birbirini iteceğinden kayma olmaz. Bu bakımdan iyonik seramikler de gevrek
davranış gösterirler. Seramik malzemeler plastik deformasyon göstermediğinden serttirler. Bu yüzden aşındırıcı
veya aşınmaya dayanımlı (ör. Al2O3, TiC, SiC) malzeme olarak kullanılırlar. TiC, NaCl-tipi yapıdadır. Elmas
bilinen en sert malzemedir. Fakat, seramiklerin hepsi sert değildir. Tabakalı yapılara sahip seramikler (kil, grafit vs. )
yumuşaktır. Bu malzemelerde tabaka içinde kuvvetli, fakat tabakalar arasında zayıf ikincil bağlar vardır.
Kırılma tokluğ
tokluğu: Seramiklerde çentik hassasiyeti yüksek olup düşük tokluktadır. K IC kırılma tokluğu değerleri
yukarıdaki tablo’da verilmiştir. KıC değerleri metallerdeki kırılma tokluğu deneylerine benzer deneylerle bulanabilir.
Seramiklerin tokluğunu artırmak için yoğun araştırmalar devam etmektedir. Katkılar katarak ve değişik prosesler
15
uygulayarak tokluğu artırılmış seramikler geliştirilmiştir.
Üç nokta eğ
eğme dayanı
dayanımı: Seramiklerin mukavemeti üç nokta ( bazen dört nokta) eğme deneyi ile yaygın olarak
ölçülür. Deney düzeneği aşağıdaki şekilde görülmektedir. Numune, mesnetler arası mesafesi L olan iki mesnet üstüne
oturtulur ve kırılma oluncaya kadar kuvvet uygulanır. Numune tipi, yuvarlak veya dikdörtgen kesitli olabilir. Maksimum
kırılma kuvveti ölçülerek aşağıdaki formullerle eğme mukavemeti hesaplanır.
Örnek eğme dayanım değerleri:
cross
section
Kesit
d
b
rect.
L/2
F
fail
σ fs = σ m
=
L/2
1.5Fmax L
bd 2
rect.
R
Fmax
circ.
location
max tension
Maks.
Çekmeofgerilmesi
yeri
δ
F
x
δmax
δ
L
F
= max Material
Seramik
3
πR
σfs(MPa)
E(GPa)
Si nitride
700-1000
Si carbide
550-860
Al oxide
275-550
glass (soda)
69
Cam (soda)
Tokluk artı
artırma yö
yöntemleri:
ntemleri: Seramiklerde tokluğu artırmak, yani çekme dayanımı ve kırılma mukavemetini yükseltmek,
için yoğun çalışmalar yapılmaktadır. Bir kaç method bu problemi çözmek için vardır. Bunlardan birisi çatlağın başlama
ihtimalinin yüksek olduğu seramik yüzeyinde bilinçli olarak basma gerilmesi yaratmaktır. Temperlenmiş cam buna örnek
olarak verilebilir. Temperlenmiş cam, yumuşama noktası noktası yakınına kadar ısıtıldıktan sonra yüzeyi hızlı soğutularak
dayanımı artırılmış camdır. Önce camın yüzeyi soğur ve çeker, iç kısım henüz ılıktır ve küçük bir gerilmeyle boyutsal
değişime kendini uydurur (aşağıdaki şekil). İç kısımda soğuyup çekilince, yüzeyler katı olduğundan camın iç kısmında çekme
gerilmesi ve yüzeylerinde basma gerilmesi olur. Kırılma olmadan önce uygulanan çekme gerilmesinin yüzeydeki basma
gerilmesini geçmesi gerektiğinden böye bir ısıl işlem camın dayanımını artırır. Temperlenmiş camın darbe dayanımı tavlanmış
(gerilmesi giderilmiş) camınkinden dört kat daha fazladır. Oto camları ısıl işlem görmüş temperli camlardır.
before
cooling
Soğuma
öncesi
hot
sıcak
surface
Yüzeyde cooling
soğuma
cooler
sıcak hot
cooler
further
Tamamencooled
soğuma basma
Daha
soğuk
compression
tension çekme
compression
basma
Çatlak, basma
gerilmesi
nedeniyle
ilerleyemez
Tokluğu artırma için başka bir yöntem kırılgan seramik partiküllerin, daha yumuşak, tok matris içinde kuşatılmasıdır. Örnek
olarak WC-Co kesici uçlar verilebilir. Burada WC sert ve kesme işlemi yapar. Daha sünek olan Co deforme olur ve enerjiyi
daha fazla emer. Küçük taneli, yüksek saflıkta ve gözeneksiz seramik parça veren üretim yöntemleri geliştirmek suretiyle
16
seramiklerin dayanımı ve tokluğu artırılabilir. Başka tokluk artırıcı işlemler de vardır.
8
Cam
4Si04 tetrahedron
Tanı
Tanımı: Cam, soğutulduğunda kristallenmeksizin katı bir duruma geçen
inorganik bir malzemedir. Camdaki atomlar, kristalli bir katıdaki gibi
tekrar eden uzun mesafede düzenli şekilde dizilmezler.
Si-O
dörtyüzlüsü
Camları
Camların yapı
yapıları
ları:
Si
Cam yapıcı oksitler: İnorganik camların çoğu, cam-yapıcı oksit olan silika,
SiO2 asıllıdır. Silika asıllı camların çoğunda temel alt birim SiO4-4
dörtyüzlüsü olup yandaki şekilde gösterildiği gibi silisyum (Si+4) iyonu,
dörtyüzlüde dört oksijen iyonuna kovalent ve iyonik bağla bağlanmıştır.
Kristalli silikada, örneğin kristobalit, Si-O dörtyüzlü düzenli bir yapıda
köşeden köşeye birleşerek uzun mesafe düzenini oluşturur. Basit bir silika
camında dörtyüzlüler köşeden köşeye birleşerek uzun mesafe düzeninde
olmayan gevşek ağ meydana getirirler. Sadece silika (SiO2) var ise her
oksijen bir köprü oluştur. Bu durumda cam çok rijittir (esneklik düşüktür).
Kaynaşık silika (fused silica), gerçek sıvı sıcaklığında bile son derece
viskozdur. Bu durumda camın şekillendirilmesi son derece zordur.
Si4+
O2-
Oxygen
Kristal
yapıda SiO2
-Uzun
mesafede
düzenli yapı
Kristal yapıda
olmayan (amorf)
SiO2 -Kısa
düzenli yapı
(camın yapısı)
Ağ değiştirici oksitler: Cam ağını kıran oksitler “ağ değiştiriciler” diye
bilinir. Na2O, K2O CaO, MgO gibi oksitler, silika camına katılarak
viskozite düşürülür ve böylece camın kolayca işlenebilmesi ve
şekillenebilmesi sağlanır. Ağ değiştirici denilen bu oksitlerdeki oksijen
atomları dörtyüzlülerin birleştiği noktalardan yapıya girerek ağı kırar ve
ortak kullanılmayan elektrona sahip oksijen atomları oluşturur.
Na+
Si4+
O2-
Ara oksitler: Bazı oksitler kendileri cam ağı oluşturmaz fakat var olan ağa
girebilir. Ara oksitler denen bu oksitler (ör. Al2O3) silika camına bazı
Ağı değişmiş
özellikler (ör. daha yüksek sıcaklığa dayanım) elde etmek için katılır.
17
cam-Soda camı
Özgül hacim
Sı
ya vı (d
pı) ü
ze
ns
iz
Kristalli malzemelerle camsı (amorf) malzemelerin
Cam Dö
Dönüşüm Sı
Sıcaklığı
caklığı::Yandaki şekilde
görüldüğü gibi, camın katılaşma davranışı kristalli
özgül hacimde değişme göstererek katılaşması
katılarınkinden farklıdır. Şekilde özgül hacmin
(yoğunluğun tersi) sıcaklıkla değişimi bu iki madde
için verilmiştir. Katılaştığında kristalli bir katı
oluşturan bir sıvı (ör. saf metal) normal olarak
erime noktasında özgül hacminde belirgin bir
azalmayla kristalleşir. Bunun tersine olarak cam
ır ı u ş
Aş ğum
oluşturan bir sıvı soğuduğunda kristalleşmez, fakat
so ı
özgül hacmi sıcaklıkla yavaşça değişir. Bu tip
Cam
s ıv
sıvılar sıcaklık düştükçe daha viskoz olur ve
(Düzensiz
Kristallleşme
lastiksi, yumuşak durumdan kaskatı, kırılgan,
katı)
camsı duruma dar bir sıcaklık aralığında geçer,
sıcaklık-özgül hacim eğrisinin eğimi belirgin bir
şekilde azalır. Bu eğrinin eğimlerinin kesiştiği
atı
Kristal k
nokta bir dönüşüm noktası olup cam dönüşüm
sıcaklığı Tc diye adlandırılır.
T cam T erime
Camlarda viskoz (ağ
(ağdalı
dalı) şekil değ
değiştirme:
tirme: Cam, cam
Sıcaklık
Viscosity [Pa ⋅ s]
a
lik ica
f si sil
Sa sed lica
si x
fu
%
96 Pyre e
-lim
da
so a ss
gl
dönüşüm sıcaklığı üstünde viskoz (aşırı soğumuş) sıvı olarak
davranır. Gerilme altında, silikat iyonları birbirlerini kayarak geçip
camın kalıcı şekil değiştirmesine neden olur. Camın sıcaklığı, Tc
üstüne çıktığında viskozite sıcaklıkla azalır ve şekillendirme
kolaylaşır. Viskozite, şekil değişimine karşı direnç olarak
tanımlanabilir, birimi Pa.s (10 poise)’dır. Yandaki şekilde görüldüğü
gibi viskozite, empürite (katışkı) miktarı ve sıcaklık arttıkça azalır.
Cam üretimi için önemli viskozite noktaları şekilde görülmektedir.
İşleme noktasında viskozite 103 pa.s civarında olup buna tekabül
eden sıcaklıkta cam üretim işlemleri (şekillendirme) yapılabilir.
Tavlama noktasındaki sıcaklıkta (viskozite=1012 Pa.s) iç gerilmeler
giderilir. Gerinme noktasına (viskozite=3x1013 Pa.s) tekabül eden
sıcaklığın altında cam katı olup kalıcı şekil değişimi olmadan
çatlayabilir.
1014
1010
106
102
1
200
Gerinme
noktası
annealing
Tavlamarange
noktası
TŞekillendirme
deform: soft enough
noktası
to
deform or “work”
Erime noktası
600 1000 1400 1800 T(°C)
18
9
Seramiklerde Şekil Verme (üretim) Yöntemleri-Örnekler
Viskoz şekil verme: Cam eşyalar, camı önce yüksek bir sıcaklığa çıkarıp viskoz sıvı elde edildikten sonra
kalıplama, çekme veya haddeleme gibi yöntemlerle istenen şekil verilerek üretilir. Aşağıdaki şekillerde
kalıp içinde bulunan sıcak cama pres uygulayarak (solda) veya üfleme(sağda) yaparak şekillendirme
görülmektedir.
presleme
Sıcak cam
Compressed
Gob
Pressing
operation
air
Hava
üfleme
suspended
Parison
Parison
mold
Asılmış cam
Finishing
mold Kalıp
Kalıp
Sinterlenmiş Alumina
mikroyapısı
Sinterleme:
Sinterleme: Tozlardan seramik parça üretimi için sırasıyla uygulanan bazı işlemler
şunlardır: (a) İstenilen bileşimde toz karışımı hazırlanır. (b) Karışım, istenilen şekle kalıp
içinde basınç altında preslenir. (c) Şekilli düşük mukavemetli parçaya yüksek
sıcaklıklarda (bazen basınç altında) ısıtma denilen sinterleme işlemi uygulanır.
Sinterleme işlemi ile nispeten mukavemetli parça üretilmiş olur. Yandaki şekilde 1700
°C de 6 dak sinterleme işlemine tabi tutulmuş alumina (Al2O3) toz numunesine ait
mikroyapı görülmektedir.
Kaynaş
Kaynaştırma :Portland çimentosu, kil ile kireç esaslı malzeme karışımının 1400 ˚C’de
ısıtılması (kalsinasyonu) elde edilir. Ana bileşenleri tri-kalsiyum silikat ve di-kalsiyum
silikat’dır. Su ilavesi ile çimento sertleşir. Sertleşme, suyla olan kimyasal reaksiyon
sonucu oluşur. Çimentoya, çakıl taşı, kum ve su karıştırılırsa beton oluşur. Su ile
reaksiyon sonucu sertleşen çimento, taş ve kum tanelerini kuşatır. Beton kuruyarak
sertleşmez, kimyasal reaksiyon ile sertleşir. Ayrıca, su betonun dökümünü, yani
şekillendirmeyi kolaylaştırır.
15µm
Beton yapısı
19
Seramiklerin Kullanım Alanları- Örnekler
2200
T(°C)
Refrakterler: Mullit (3Al2O3.2SiO2) yüksek
erime noktasına sahip olup yüksek sıcaklığa
dayanımlı fırın astarı malzemesi olarak
kullanılır. Yanda gösterilen Silika (SiO2) Alumina (Al2O3) faz diyagramıda tek fazlı
müllit faz alanı (koyu alan) görülmektedir.
2000
mullite
alumina + L
mullite
+L
crystobalite
+L
1600
Metal
matris
içinde
elmas
kristalleri
Oksijen sensörü: ZrO2 seramiklere Ca
Ca2+
empüritesi ilave edilirse O2- boşlukları
2oluşur ve O yayınımı artar. Sensörün iç
yüzeyi ile dış yüzeyi arasında O-2 iyonlarının
yayınması ile voltaj farkı üretilir. Voltaj
farkından ortamdaki oksijen miktarı tespit
edilir.
Liquid
(L)
1800
1400
0
Kesici uçlar: Elmas, B4C, Alumina gibi
seramikler çok sert olduğundan, cam,
seramik kesme, kuyu kazma, tünel açma
gibi uygulamalarda yaygın olarak
kullanılır. Özellikle metal matris içinde
elmas kristallerinin mermer kesiminde
kullanımı yaygındır.
3Al2O3-2SiO2
mullite
+ crystobalite
20
alumina
+
mullite
40
60
80
100
Composition (wt% alumina)
Mermer kesici testere
sensor
gas with an
reference
unknown, higher
gas at fixed
O2oxygen content
oxygen content
Oksijen miktarı diffus
Oksijen
miktarı
bilinmeyen gaz ion
A Ca2+ impurity
removes a Zr4+ and a
O2- ion.
bilinen referans
(oksiyen daha
- gaz
+
fazla)voltage difference
produced!
Voltaj farkı
20
10