Ezgi Sür - Erciyes Üniversitesi Eczacılık Fakültesi
advertisement

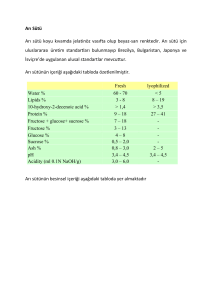
1 T.C. ERCİYES ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ ARI ZEHİRLEMELERİ ve ARI VENOMUNUN ANALİZ METOTLARI Hazırlayan Ezgi SÜR 1300110138 Danışman Prof. Dr. İbrahim NARİN Eczacılık Fakültesi Bitirme Ödevi MAYIS–2013 KAYSERİ 2 T.C. ERCİYES ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ ARI ZEHİRLEMELERİ ve ARI VENOMUNUN ANALİZ METOTLARI Hazırlayan Ezgi SÜR 1300110138 Danışman Prof. Dr. İbrahim NARİN Eczacılık Fakültesi Bitirme Ödevi MAYIS–2013 KAYSERİ i BİLİMSEL ETİĞE UYGUNLUK Bu çalışmadaki tüm bilgilerin, akademik etik kurallara uygun bir şekilde elde edildiğini beyan ederim. Aynı zamanda bu kurallar ve davranışların gerektirdiği gibi, bu çalışmanın özünde olmayan tüm materyal ve sonuçları tam olarak aktardığımı ve referans gösterdiğimi belirtirim. Ezgi SÜR ii YÖNERGEYE UYGUNLUK “Arı Zehirlemeleri ve Arı Venomunun Analiz Metotlarının Araştırılması” adlı bitirme ödevi Erciyes Üniversitesi Lisansüstü Tez Önerisi ve Tez Yazma Yönergesi’ne uygun olarak hazırlanmıştır. Tez Hazırlayan Danışman Ezgi SÜR Prof. Dr. İbrahim NARİN Analitik Anabilim Dalı Başkanı Prof. Dr. İbrahim NARİN iii “Arı Zehirlemeleri ve Arı Venomunun Analiz Metotlarının Araştırılması” adlı Bitirme Ödevi Erciyes Üniversitesi Lisansüstü Tez Önerisi ve Tez Yazma Yönergesi’nde uygun olarak hazırlanmış ve Analitik Anabilim Dalında Bitirme Ödevi olarak kabul edilmiştir. Tez Hazırlayan Danışman Ezgi SÜR Prof. Dr. İbrahim NARİN Analitik Anabilim Dalı Başkanı Prof. Dr. İbrahim NARİN ONAY: Bu tezin kabulü Eczacılık Fakültesi Dekanlığı’nın ………tarihi ve ……..sayılı kararı ile onaylanmıştır. ……………….. Prof. Dr. Müberra KOŞAR Dekan iv TEŞEKKÜR Bu araştırma süresince emeğini esirgemeyen Prof. Dr. İbrahim NARİN hocama, her konuda varlıklarıyla bana güven veren aileme ve arkadaşlarıma, hayatımın her anında olduğu gibi bu çalışmamda da desteklerini esirgemeyen sevgili teyzelerim Gülnaz Gülmez KARATAY ve Aliye GÜLMEZ ‘e teşekkürlerimi sunuyorum. Ezgi SÜR Mayıs 2013, Kayseri v ARI ZEHİRLEMELERİ VE ARI VENOMUNUN ANALİZ METOTLARI Ezgi SÜR Erciyes Üniversitesi, Eczacılık Fakültesi Bitirme Ödevi, Mayıs 2013 Danışman: Prof. Dr. İbrahim NARİN ÖZET Arılar, Hymenoptera takımında, Apoidea üst familyasının Apiformes grubunu oluşturan böceklerdir ve hymenopteralar insanlar için zehirli olan en önemli böcek grubunu oluşturur. Arı zehri (venom) iğne parçalarıyla ilişkili olan alkali ve asit salgı bezlerinden salgılanır. Bir arıdaki zehir miktarı, mevsime ve arının yapısına göre 0.05-0.30 mL/arı olacak şekilde değişiklik gösterir. Ergin bir insan için öldürücü zehir dozu (LD50), vücut ağırlığının her bir kilogramı için 2.8 mg´dır. Arı zehri açık renkte, kokusuz, su gibi bir sıvı madde olup, keskin ve acı bir tada sahiptir. Hava ile temas ettiğinde opak ya da gri-beyaz kristaller şeklinde çökelir. Suda çözünebilir özelliktedir ve solüsyonları renksizdir. Zehrin % 88’i su olmakla birlikte, farmokolojik açıdan önemli en az 18 aktif madde içerir. Arı zehrinin bileşiminde; proteinler, aminler, enzimler, mineraller, bazı şekerler, aminoasitler, ve lipidler ile alarm feromonları yer alır. Arı venomunun nörotoksik, hemorajik ve hemolitik olmak üzere 3 toksik etkisi vardır. Arı sokmasının ardından görülen belirti ve bulgular arının cinsine, sokma sayısına, kişinin duyarlılığına, venom miktarına ve sokulan bölgeye bağlı olarak farklılık gösterir. Tanı, öykü, belirti ve bulgulara dayanılarak konur. Arı zehrine karşı kullanılan özgül antidot yoktur. Tedavi lokal yara bakımı ve genel destek tedaviyi içerir. Kelime anlamı, arı zehrinin tıbbi amaçlarla kullanılması olan Apiterapiyle tüm zehir ya da ayrı ayrı bileşenleri otoimmün bozukluklar, epilepsi, migren, hipertansiyon ve artrit gibi pek çok hastalığın tedavisinde kullanılır. Arı zehrinin analiz metotlarıyla ilgili çok fazla çalışma bulunmamakla birlikte, günümüzde geliştirilen teknikler sayesinde arı zehrinin analizi HPLC, CZE-DAD gibi yöntemlerle yapılmaktadır. Bu çalışmada arı sokmalarında uygulanan tedavi metotları ve arı zehri bileşenlerinin belirlenmesinde kullanılan analiz yöntemleri araştırılmıştır. Anahtar Kelimeler: Hymenoptera, arı venomu, apiterapi vi BEE POISONING AND TREATMENT METHODS Ezgi SÜR Erciyes University, Faculty of Pharmacy Thesis, May 2013 Supervisor: Prof. Dr. İbrahim NARİN ABSTRACT Bees are insects that make up the group Apiformes of Apoidea superfamily in Hymenoptera team, and hymenopteras constitute a group of the most important insect, which is poisonous to humans. Bee venom secreted alkaline and acid secretion glands that are associated with needle fragments. The amount of a bee venom varies beetween 0.05-0.30mL/bee according to season and nature of bee. Poison lethal dose for a human adult (LD50) is 2.8 mg per kg of body weight. Bee venom is light colored, odorless and a liquid substance such as water and it has got sharp and bitter taste. When contact with air, it precipitates in the form of opaque or gray-white crystals. It has the feature of water-soluble and solution form is colorless. Although bee venom 88% of water, it consist at least 18 significant pharmacological active ingredient. Bee venom composition consist of proteins, amines, enzymes, minerals, certain sugars, amino acids, lipids and the alarm pheromones. There are three toxic effect of bee venom that neurotoxic, hemorrhagic and hemolytic. The signs and symptoms that seen after the bee sting varies depending on type of bee, the number of sticking, one's sensitivity, the amount of venom and bitten area. Diagnosis is made based on medical story, signs and symptoms. There is no specific antidote used against bee venom. Treatment includes local wound care and general supportive treatment. With Apitherapy which meaning of the word is the use of bee venom for medical purposes, all of poison or separate components use to treat many diseases such as autoimmune disorders, epilepsy, migraine, hypertension, and arthritis. Although there is a limited number of studies concentrating on analysis methods of bee venom, the corresponding analysis has been accomplished by several techniques including HPLC, CZE-DAD methods with respect to existing techniques. In this study, a bee sting treatment methods and analysis methods were used to determine the components of bee venom were investigated. Key words: Hymenoptera, Bee Venom, Apitherapy vii İÇİNDEKİLER BİLİMSEL ETİĞE UYGUNLUK .................................................................................. i YÖNERGEYE UYGUNLUK......................................................................................... ii ONAY:............................................................................................................................. iii TEŞEKKÜR ................................................................................................................... iv ÖZET................................................................................................................................ v ABSTRACT .................................................................................................................... vi İÇİNDEKİLER ............................................................................................................. vii TABLOLAR VE ŞEKİLLER LİSTESİ....................................................................... ix KISALTMALAR ............................................................................................................ x BÖLÜM 1 1. GİRİŞ VE AMAÇ ....................................................................................................... 1 BÖLÜM 2 2. GENEL BİLGİLER .................................................................................................... 3 2.1. Arı (Hymenoptera) ................................................................................................. 3 2.2. Zehrin Salgılanması, İzolasyonu ve Toksik Dozu.................................................. 4 2.3. Arı Zehrinin Fiziksel ve Kimyasal Özellikleri ....................................................... 6 2.4. Zehir Komponentlerinin Özellikleri ..................................................................... 10 2.4.1 Fosfolipaz A2 (Api m1) .................................................................................. 10 2.4.2 Hyaluronidaz (Api m2) ................................................................................... 10 2.4.3 Melittin (Api m4) ............................................................................................ 11 2.4.4 Asit fosfataz .................................................................................................... 11 2.4.5 Api m6 ............................................................................................................ 12 2.4.6 Proteaz ............................................................................................................ 12 2.4.7 Allerjen C ........................................................................................................ 12 2.4.8 Antijen 5 ......................................................................................................... 12 2.5. Arı Alerjisi ............................................................................................................ 13 viii 2.5.1. Arı Alerjisinin Özellikleri .............................................................................. 14 2.5.2. Arı Sokmasının Belirti ve Bulguları .............................................................. 14 2.6. Arı Zehirlenmelerinin Tanısı ................................................................................ 15 2.6.1. Arı Sokmalarında Korunma ........................................................................... 16 2.6.2. Arı Sokmalarında Acil ve Destekleyici Tedavi ............................................. 17 2.7. Apiterapi ............................................................................................................... 18 BÖLÜM 3 3. ARI ZEHRİ ANALİZ METOTLARI ..................................................................... 24 3.1. HPLC ile Arı Venomunun Analizi ....................................................................... 24 3.2. CZE-DAD Yöntemi İle Bal Arısı Zehri Analizi ................................................. 25 3.3. Yüksek Performanslı Sıvı Kromatoğrafisi-Diyot Array Dedektörü-Tandem Kütle Spektrofotometresi ile Arı Zehri Tayini ...................................................................... 26 BÖLÜM 4 4. SONUÇ VE TARTIŞMA.......................................................................................... 28 EKLER........................................................................................................................... 31 KAYNAKÇA ................................................................................................................. 32 ÖZGEÇMİŞ ................................................................................................................... 36 ix TABLOLAR VE ŞEKİLLER LİSTESİ Tablo 2.1. Bal Arısı Zehrinde Bulunan Alerjenik Olmayan Maddeler. .......................... 13 Tablo 2.2. Arı Zehrinin Terapötik Etkinlik Gösterdiği Bazı Hastalıklar ........................ 23 Şekil 2.1. Arı Venomunda Bulunan Majör Alerjenler ...................................................... 9 Şekil 3.1. Örnek Kromotogram ....................................................................................... 25 x KISALTMALAR Api : Bal Arısı CBVLP : Ham arı zehri liyofilize tozu CZE : Kapiller zon elektroforezisi DAD : Diyot array dedektör HPCE : Yüksek performanslı kapiler elektroforezisi HPLC : Yüksek performanslı sıvı kromatoğrafisi Ig : Immünoglobülin Im : İntra musküler LC :Sıvı kromatoğrafisi LOQ : Kantitatif ölçme sınırı MCD : Mast hücresi degranülasyon peptidi MS : Kütle spektroskopisi MS/MS : Tandem mass spektroskopisi PCA : Temel bileşen analizi UV : Ultraviyole görünür spektroskopisi Ves : Yaban Arısı 1 BÖLÜM 1 1. GİRİŞ VE AMAÇ Arılar, Hymenoptera takımında Apoidea üst familyasının Apiformes grubunu oluşturan böceklerdir ve hymenopteralar insanlar için zehirli olan en önemli böcek grubunu oluşturur. Yeryüzünde 25.000 kadar tanımlanmış arı türü bulunur. Ülkemizin iklim koşulları, topoğrafik yapısı ve bitki örtüsü, arı faunasının çok zengin olmasına olanak tanımıştır. Zehir (venom) iğne parçalarıyla ilişkili olan alkali ve asit salgı bezlerinden salgılanır. Bir arıdaki zehir miktarı, mevsime ve arının yapısına göre 0.05-0.30 mL/arı olacak şekilde değişiklik gösterir. Ergin bir insan için öldürücü zehir dozu (LD50), vücut ağırlığının her bir kilogramı için 2.8 mg´dır. Arı zehri açık renkte, kokusuz, su gibi bir sıvı madde olup, keskin ve acı bir tada sahiptir. Hava ile temas ettiğinde opak ya da gri-beyaz kristaller şeklinde çökelir. Suda çözünebilir özelliktedir ve solüsyonları renksizdir. Zehrin %88’i su olmakla birlikte, farmokolojik açıdan önemli en az 18 aktif madde içerir. Bunlardan en önemlisi kimyasal yapının yaklaşık % 50'sini oluşturan polipettid yapıdaki melittin’dir. Arı zehrinin bileşiminde; proteinler (melittin, apamin), aminler (histamin), enzimler (fosfolipazA2, hyaluronidaz), mineraller, bazı şekerler, aminoasidler, ve lipidler ile alarm feromonları yer alır. Arı venomunun nörotoksik, hemorajik ve hemolitik olmak üzere 3 toksik etkisi vardır. Arı sokmasının ardından görülen belirti ve bulgular arının cinsine, sokma sayısına, kişinin duyarlılığına, venom miktarına ve sokulan bölgeye bağlı olarak farklılık gösterir. Tanı, öykü, belirti ve bulgulara dayanılarak konur. Öykünün yanı sıra bal arısı ve yaban arısının zehrindeki antijenler kullanılarak deri ve kan testleri yapılmaktadır. Testlerin amacı hastada bunlara karşı oluşmuş spesifik immünglobulin E (spe-IgE) tipi antikorların olup olmadığının belirlenmesidir. Arı sokması ardından sistemik reaksiyon oluşturan hastaların birçoğunda deri testi ve venom spesifik IgE pozitifleşmektedir. Arı 2 zehrine karşı kullanılan özgül antidot yoktur. Tedavi lokal yara bakımı ve genel destek tedaviyi içerir. Arının soktuğu bölgeye buz uygulanması şişliği azaltır ve venomun emilimini geciktirir. Oral antihistaminikler ve steroid olmayan anti inflamatuvar ilaçlar kaşıntıyı, kızarıklığı ve ağrıyı azaltmak için kullanılır. Kelime anlamı, arı zehrinin tıbbi amaçlarla kullanılması olan Apiterapi’nin geçmişi Hipokrat ve Galen’in dönemine dek uzanır. Apiterapiye bağlı terapötik etkinlik, homeopatik tedavi prensibine göre gerçekleşmektedir. Deri altı enjeksiyonlar, merhemler, fısfıslar, tabletler, steril kuru, enjekte edilebilir sıvı şeklinde şırınga veya cam şişelerde küçük dozlar halinde paketlenerek kullanılır. Doğal arı iğnelerini içeren zehirler de günümüzde uygulanan yöntemler arasındadır. Arı zehrinin kullanımı yan etkilere sahip olan ağır ilaçlara alternatif olarak batı ülkelerinde gün geçtikçe artmaktadır. Apiterapiyle tüm zehir ya da ayrı ayrı bileşenleri otoimmün bozukluklar, epilepsi, migren, hipertansiyon ve artrit gibi pek çok hastalığın tedavisinde semptomları gidermek için kullanılır. Arı zehrinin analiz metotlarıyla ilgili çok fazla çalışma bulunmamakla birlikte, günümüzde geliştirilen teknikler sayesinde arı zehrinin analizi HPLC, CZE-DAD gibi yöntemlerle yapılmaktadır. Bu çalışmada, arı zehrinin kalitatif ve kantitatif analizinde kullanılan yöntemlerin, uygulanan yöntemlerle hem arı zehrinin belirlenmesi, kalite kontrolü hem de ürün standardizasyonu ve ürün kimliğini nitelendirilmesinin nasıl yapılacağının belirlenmesi amaçlanmıştır. 3 BÖLÜM 2 2. GENEL BİLGİLER 2.1. Arı (Hymenoptera) Arılar, Hymenoptera takımında Apoidea üst familyasının Apiformes grubunu oluşturan böceklerdir. Yeryüzünde 25.000 kadar tanımlanmış arı türü bulunmaktadır. Balarısı (Apismellifera) dışındaki türler yaban arıları olarak bilinmektedir. Ancak Apismellifera dışında yeryüzünde 10 civarında daha balarısı türü mevcuttur. Ülkemizin iklim koşulları, topoğrafik yapısı ve yeryüzündeki konumu bitki örtüsünü ve buna bağlı olarak diğer canlıların çeşitliği, arı faunasının da çok zengin olmasına olanak tanımıştır (1). Bal arıları, ürettikleri bal ve bal mumu ile çok önemli bir ekonomik değer oluşturmaktadırlar. Arılardan elde edilen diğer ürünler olan propolis, arısütü, polen ve zehir farmakolojik yönden büyük önem arz etmektedir. Ancak bunlardan daha önemlisi, arıların çiçekli bitkilerde tozlaşmayı gerçekleştirerek döllenmeyi sağlamaları ve bunun sonucu olarak; bitkilerde meyve ve tohum oluşumuna yardımcı olmalarıdır. Bu özelliklerinden dolayı, arılar, çok sayıdaki bitki türleri için en iyi tozlayıcılar (polinatörler) olarak kabul edilmektedirler (2) . Hayvanlar aleminin bir filumu olan eklem bacaklılar (Artropoda) içinde sınıflandırılan zarkanatlılar (Hymenoptera) takımı, insanlar için zehirli olan en önemli böcek grubunu oluşturmaktadır (3). İnsanlar için tehlikeli olan arılar ve yaban arılarının tamamı içeren Hymenoptera takımının üyeleri, temel olarak iki gruba ayrılır. İnsan için alerjik zehirleri olanlar Apocrita alt takımdadır. Arılar, yaban arıları, ilek arıları, örümcek arıları, parazitoid arılar gibi gruplar bu alt takımda incelenir. Zehirleri insanlar için en fazla tehlike oluşturan gruplar Apoidea üst familyası yani gerçek arılar, Vespoidea üst familyası yani yaban arıları, Sphecoidea üst familyası ve Pompilidae familyası yani örümcek arıları olarak özetlenebilir. Bu grupların her biri kendine özgü yapılara ve zehir içeriklerine sahiptir (4, 5). 4 Hymenoptera takımının üyelerinde iki çift kanat bulunur ve her ikisi de şeffaf zar yapısındadır. Ön ve arka kanatlar birbirlerine küçük kancalar ile bağlı olduğundan dört kanat senkronize biçimde birlikte çırpılır. Böylece bu gruba özgü hepimizin aşina olduğu tipik vızıltı sesini çıkartarak etrafta gezinirler. Ağızları çiğneyici ya da yalayıcıemici bir hortum biçimindedir (1, 4, 6,). Hymenoptera üyeleri iğnelerini ve zehirlerini kendilerini savunmak için kullanırlar. Arı iğneleri yalnızca memeliler için değil, böcekler kuşlar ve sürüngenler gibi pek çok hayvan türleri için de son derece etkili bir silahtır. İğneler yumurta bırakma borusunun modifiye bir şeklidir; bu nedenle sadece dişi arılar sokarlar erkek arıların iğnesi bulunmaz (6). Hymenopteraların çoğu tek başlarına yaşarlar ve savaşmaktan çok uçma davranışı sergilerler. Sarı arılar, bal arısı, bombus arıları ve ateş karıncaları gibi sosyal hymenopteralar koloniler halinde yaşarlar ve yuvalarını korumak için görevli olduklarından yuvaları tahrip edilirse son derece saldırgan olabilirler. Ancak bal arılarıyla yabani arıların davranış biyolojisi ve salgıladıkları zehir yapıları arasında türler ve ırklar arasında farklılıklar bulunur (7, 8). 2.2. Zehrin Salgılanması, İzolasyonu ve Toksik Dozu Arıların iğnesi dişi böceklerde bulunan ovipozitörün (yumurtlama organı) yapısal değişikliğe uğramasıyla, savunma organı olan kompleks bir yapıya dönüşmüştür.İğne, bir üst parça (stylet) ve iki alt parçanın (lanset) uca doğru incelmesi, vücuda doğru kalınlaşarak zehir torbasına bağlanmasıyla oluşur ve abdomenin sonunda yer alır (9). Zehir(venom) bu iğne parçalarıyla ilişkili olan alkali ve asit salgı bezlerinden salgılanır ve zehir kesesinde depolanır. İğnenin uç kısmında yer alan ve uçları geriye dönük çıkıntılar, iğnenin battıktan sonra kolayca çıkmasını engellemektedir (10). Böcekler ve diğer arthropodlar sokulduğu zaman iğne battığı yerden çıkartılabilmektedir. Ancak insanlar ve diğer memelilerde iğnenin ucundaki çıkıntılar iğnenin girdiği dokudan çıkmasını engellemekte ve çoğunlukla arı iğnesini, iğnesiyle birlikte zehir kesesini, kaslarını ve sinir merkezini kaybeder ve vücudunun önemli bir bölümünü kaybetmesi arının 2-4 saat içinde ölümüne neden olmaktadır (11). Pupadan ergin arının meydana gelmesi ile birlikte zehir bezleri de görev yapmaya başlamakta ve üç gün içerisinde zehir salgılayacak düzeye gelmektedir. Zehir miktarı giderek artmakta, arı 2-3 haftalık olduğunda maksimum seviyeye ulaşmakta ve tekrar 5 giderek azalmaktadır (11, 12). Bir arıdaki zehir miktarı, mevsime ve arının yapısına göre 0.05-0.30 mL/arı olacak şekilde değişiklik gösterir. Bir vespid sokması ile 10-100 µg, bal arısı bir sokmada 50-140 µg, yaban arıları tekrarlayan sokma yetenekleri nedeniyle 2-20 µg arasında venom bırakmaktadır. Arının zehir bezinin dolu ya da boş olmasına göre enjekte edilen venom miktarı değişmektedir. Arı iğnelediğinde zehir kesesinde bulunan 0.15-0.30 mg zehrin tamamını normal olarak boşaltamamaktadır. Her bir arıdaki kuru zehir 0.1 g'dan daha az olduğundan, kuru 1 g arı zehri elde edebilmek için en az bir milyon iğneye gereksinim duyulmaktadır. Toplanan arı zehirleri bazı hastalıkların semptomlarının giderilmesi amacıyla kullanılabilmektedir (13). Farklı toplama yöntemleri sonuçta farklı kompozisyondaki ürünlerin elde edilmesine yol açmaktadır. Hızlı buharlaşan bileşenlerin yok olmasını önlemek için, su altında zehir toplama, en kuvvetli zehri toplamanın bir yoludur. Cerrahi olarak zehir kesesinden toplanan zehir, elektroşok yöntemle elde edilen zehirden farklı protein içeriğine sahiptir. Buharlaşan bileşenlerin çoğunu korumak için standart elektroşok toplama aletiyle birlikte soğutma sistemi geliştirilmiştir (14). Her ne kadar zehir toplamada en basit yöntem, zehir bezinin cerrahi yolla çıkarılması ya da arının zehri boşaltana kadar sıkılması temeline dayanıyor olsa bile arı zehrinin elde edilmesinde kullanılan yöntemler arasında arıya elektrik şoku uygulanması ilk sırayı almakta ve yöntemin geçmişi 1950’li yıllara dek uzanmaktadır (14, 15). Günümüzde modernize edilen bu yöntem için kurulan düzenek; kovana yerleştirilen bir tel ızgara, bunun alt kısmına tespit edilen geçirgen bir yüzey ile zehrin toplanacağı hazneden oluşmaktadır. Kovana aralıklarla verilen elektrik akımını bir dış tehdit olarak algılayan bal arıları, tel ızgara ile temas ettiklerinde geçirgen yüzeye iğnelerini batırmak suretiyle zehirlerini zerk etmektedirler (14, 16). Elektrik şoku uygulaması ile 30 dakikalık seanslar şeklinde gerçekleştirilen sağım işlemini takiben geçirgen yüzey ve haznede biriken zehir kurutulmakta ve başlangıçta berrak görünümlü zehir bu işlemin sonunda yüzeylerde beyaz renkli toz şeklinde çökmektedir. Her bir arıdan elde edilen zehir miktarı 0.1 mg kuru ağırlığa eşdeğerdir. Kovanlarda 10 bin arı bulunduğu varsayıldığında her bir sağım seansının sonunda biriken zehir miktarı 1g kadardır. Arı zehri tüm arının kurutulması ile de elde edilebilmektedir. Yalnız bu kez polen, feçes, toz, nektar ve bal ile kontamine olmuş durumdadır (14, 16, 17). 6 Zehir rutubet ve nemden uzak tutulması halinde 5 yıl süreyle bozulmadan kalabilmektedir. Arı zehrini muhafaza etmede en uygun yöntem derin dondurucuda saklamaktır. Venom solüsyonu hazırlamak için ısıtılmış sterilizotonik solüsyon içerisinde zehrin çözdürülmesi yeterlidir. Ancak bu durumda da zehir bileşimindeki aktif maddeler ısıya bağlı olarak kısmen bozulabilmektedir (18). Unutulmaması gereken bir diğer husus da zehir bileşimindeki uçucu maddelerin henüz sağım aşamasında uğrayacağı kayıplardır, bu nedenle hiçbir farmasötik şekil bizzat arının sokması ile elde edilen kadar güçlü terapötik etkinlik gösterememektedir. Son dönemde geliştirilen bazı teknikler sayesinde zehir artık soğuk izotonik solüsyon içerisinde de hazırlanabilmekte ve en azından bileşimindeki bazı maddelerin ısıya bağlı kaybının önüne geçilebilmektedir (18, 19). İmmünolojik toksik yanıt bireysel duyarlılığa göre değişmektedir. Bağışıklık sisteminin duyarlı olduğu dönemde ya da bireysel genetik yapı farklılığı nedeniyle tek bir arının sokması bile ölüme neden olabilir. İmmünolojik olmayan ciddi toksik etkiler 150’den fazla balarısı ya da 20’den fazla eşekarısı sokmasından sonra ortaya çıkmaktadır. Ergin bir insan için öldürücü zehir dozu (LD50), vücut ağırlığının her bir kilogramı için 2.8 mg´dır. Örneğin, 60 kg. ağırlığında bir kişinin toplam 168 mg arı zehri alması durumunda hayatta kalma şansı % 50 olmaktadır. Arılar tarafından aynı anda 600 kez sokulan ve iğneleri hemen çıkartılmayan bir insan için her bir arının bütün zehri boşalttığı (0.3 mg) varsayıldığında bu iğneler bir kişi için öldürücü olabilmekte; 10 kg ağırlığında bir çocuk içinse kesin öldürücüdür. Bu nedenle arı soktuğunda iğnenin dokudan hemen çıkarılması önemlidir (13, 20). 2.3. Arı Zehrinin Fiziksel Ve Kimyasal Özellikleri Arı zehri açık renkte, kokusuz, su gibi bir sıvı madde olup, keskin ve acı bir tada sahiptir. İçinde bulunan alarm feromonları nedeniyle aromatik özellik taşır. Berrak asidik yapıda olan arı zehri, oda sıcaklığında 20 dakikada ağırlığının % 30-40'ını kuruyarak kaybederek açık sarı renge dönüşür. Bazı ticari preparatların kahverengi renkte olması arı zehrinde bulunan bazı proteinlerin oksidasyona uğramasından kaynaklanmaktadır. Zehir, toplanması sırasında buharlaşma yoluyla kolayca kaybolan bileşikler de içermektedir. Hava ile temas ettiğinde opak ya da gri-beyaz kristaller şeklinde çökelir. Suda çözünebilir özelliktedir ve solüsyonları renksizdir (21). 7 Arı venomu; amin, enzim, protein ve az oranda karbonhidrat ve lipid yapısındaki maddelerin karışımından oluşmaktadır. Zehrin % 88’i su olmakla birlikte, farmokolojik açıdan önemli en az 18 aktif madde içermektedir. Bunlardan en önemlisi kimyasal yapının yaklaşık % 50 sini oluşturan polipettid yapıdaki melittin’dir. Arı zehrinin bileşiminde enzimler (fosfolipazA2, hyaluronidaz, asidfosfomonoesteraz, glukozidaz, lizofosflipaz), proteinler (melittin, apamin, MCD (mast hücresi degranülasyonpeptidi), sekapin, prokamin A ve B, adolapin, preteaz inhibitörleri, tertiapin), aminler (histamin,dopamin, noradrenalin), mineraller (kükürt, fosfor, magnezyum, bakır, kalsiyum), bazı şekerler (glukozvefruktoz), aminoasidler (A-aminoasitler, aminobütirik asit) ve lipidler (6-fosfolipidler) ile alarm feromonları yer almaktadır (21, 22). Bu maddelerin birçoğu alerjik özellikte değildir. Arıya alerjik hastaların % 50’den fazlasında IgE antikorlarının oluştuğu venom protein ve enzimlerine majör alerjenler denilmektedir.Bal arısı venomunda bulunan majör alerjenler fosfolipaz A2 (Api m 1), hyaluronidaz (Api m 2), düşük moleküler ağırlıklı bir protein olan Api m 6, asit fosfataz, allerjen C ve yüksek molekül ağırlıklı bazı proteinlerdir. Bombus arı venomunda fosfolipaz, hyaluronidaz, proteaz, ve asit fosfataz bulunur; her biri majör alerjenik özelliğe sahiptir. Yaban arısı majör alerjenleri ise antijen 5, fosfolipaz A1 (Ves m 1), hyalüronidaz (Ves m 2) ve proteazlardır. Bu maddelerin molekül şekillerinden bazıları Şekil 2.1’de verilmiştir(22, 23). Arı zehrinin içeriği bölgelere ve mevsimlere göre değişiklik göstermez. Ülkenin değişik bölgeleri ve yılın değişik zamanlarında arılarda yapılan çalışmalarda, arı zehrinde bulunan proteinlerin aynı olduğu görülmüştür (12, 13, 21) . Arı venomunun nörotoksik (Sinir sisteminde paralizi yapar), hemorajik (Kan kapillerinde permeabiliteyi artırır) ve hemolitik (Kırmızı kan hücrelerinde hasar) olmak üzere 3 toksik etkisi vardır (24) . 8 Mellitin Fosfolipaz MCDpeptıt Şekil 2.1. Arı Venomunda Bulunan Majör Alerjenler 9 Aminobütirik asit Apamin Histamin Şekil 2.1. Arı Venomunda Bulunan Majör Alerjenler (Devamı) 10 2.4. Zehir Komponentlerinin Özellikleri 2.4.1 Fosfolipaz A2 (Api m1) Venom kuru ağırlığının % 7-15’ini oluşturur. Moleküler ağırlığı 19000 g olan bir enzim, 134 aminoasitten oluşmakta ve bunun yanı sıra karbonhidrat yapısına da sahiptir. Bu enzim yağ asitlerini sahip oldukları fosfotidilkolin yapılarının iki farklı yerinden ayırır. Fosfolipaz A2, 4 adet disülfid bağına sahiptir, termostabildir ve izoelektrik noktası pH 10.5 civarındadır. IgE bağlama kapasitesi enzimin redüksiyonu ve alkillenmesi ile ortadan kalkar. Bal arısı fosfolipazı oldukça güçlü bir alerjendir, inhalasyon yoluyla da alerjenik etki gösterir (25). Fosfolipaz A2, hücre zarlarının yapı taşını oluşturan fosfolipidleri parçalar, silindir şeklindeki fosfolipidler koni biçimindeki moleküllere bölerek hücre zarındaki fosfolipid kümesini dağıtır ve delik oluşmasına neden olur. Fosfolipaz A2 gerçekte arı zehrindeki fosfolipidleri deterjan benzeri moleküllere dönüştürmekte ve bu da hücre zarını parçalamaktadır. Arı zehri fosfolipazı, bilinen en güçlü fosfolipazdır, yılan zehrindekinden ve memelilerdeki pankreatik fosfolipaz’dan daha etkilidir ve bu nedenle arı zehiri hücre zarlarını delip geçme gücüne sahiptir. Fosfolipazın hücreleri parçalamadaki etkinliğini zehir içinde bulunan mellitin artırmaktadır. Fosfolipazlar hücrede düz kas kasılmasına, damar geçirgenliğinde artmaya ve hipotansiyona neden olur (26, 30) . Bal arısı zehrinde türe bağlı olarak tek tip fosfolipaz bulunmasına karşın yaban ve eşek arısında farklı tipte fosfolipazların bulunması, insanlarda arı sokmalarına karşı değişik şiddette alerjik olayların ortaya çıkmasına neden olur (14, 19) . 2.4.2 Hyaluronidaz (Api m2) Venom kuru ağırlığının % 0.5-1.5’ini oluşturur. Moleküler ağırlığı 47000 g’dır. Aminoasit dizilimi tam olarak ortaya çıkarılmıştır ve 350 aminoasitten oluşmaktadır. 2 adet disülfid köprüsü içerir ve 3 adet karbonhidrat yapısında bağlanma bölgesi vardır. İzoelektrik noktası yaklaşık pH 8.7’dir. Fosfolipazdan daha az stabil olması nedeniyle molekülü denatüre etmeden saflaştırmak zordur (27). Hyaluronidaz, viskozitesi yüksek bir polimer olan hyluronik asidi hidrolize ederek viskozitesi olmayan 4-6 ünitelik parçalara ayırmaktadır. İki hücreyi birbirine tutma 11 özelliğine sahip bir polisakkarit olan hyluronik asit hyaluronidaz enzimi tarafından parçalanır, hücreler arasındaki boşluklar viskozitelerini kaybeder ve böylece zehir içerisindeki diğer maddeler hücreler arasına kolayca girer ve hücre zarı ile karşı karşıya gelir. Bu nedenle hyluronidaz, "yayıcı faktör" olarak nitelendirilmektedir. Ana arının zehrindeki hyluronidaz miktarı işçi arınınkinden daha azdır (27, 28). Yabanarısı venomunda bulunan hyluronidaz bal arısı hyalüronidazı ile yapıca benzerlik gösterir. Bazı allerjik hastalarda hem bal arısı hem de yaban arısı ile serumda pozitif değerlerin elde edilmesi özellikle hyalüronidazın karbonhidrat kısmına karşı IgE antikorlarının varlığına işaret eder. Hyaluronidazın dokuların geçirgenliğini artırma, hücrelere bağlanmış bağları çözme, hyaluronik asit polimerlerinin dokulara saldırılarını kontrol etme gibi biyokimyasal etkilerinin yanında bağışıklık sistemini uyarıcı antijenik etkisi ve anaflaksiyi engelleyici etkileride vardır (29). 2.4.3 Melittin (Api m4) Moleküler ağırlığı 2846 g olan 26 aminoasitten oluşmuş tetramer yapıda bir peptiddir. Melittin silindirik alfa helezoni biçiminde, ortadan tutturulmuş durumdadır. Amfifılik özellikteki helix formunda olduğu için oldukça aktif bir yüzeye sahiptir. Melittin memeli hücrelerinde Na-K ATP’ az ve H-K ATP’ az kanallarını inhibe eder ve hücre içerisine sodyum ve kalsiyum girmesine neden olur. Yüksek konsantrasyonlarda eritrositleri parçalar. Melittin enjeksiyonları ile arı sokmaları ardından oluşana benzer şekilde ağrı ve inflamasyon meydana gelir. Arı alerjisi olan hastaların yaklaşık yarısında melittine karşı IgE antikorları mevcuttur. Erişkinliğe henüz ulaşmış bal arılarında melittin sentezi en yüksek düzeydedir (31, 32). Arı venomunda bulunan peptidlerin % 50’sini hızla kan dolaşımına karışan melittin oluşturur. Melittin, farmokolojik ve fizyolojik olarak; antibakteriyel, antifungal,sinir sistemini düzenleyeci, radyosyondan koruyucu etkilerinin yanında ayrıca ağrı kesici özelliğe de sahiptir (23, 29) . 2.4.4 Asit fosfataz Venom kuru ağırlığının yaklaşık % 1’ini oluşturan asit fosfatazın moleküler ağırlığı 49000 g’dır. Homodimer ünitelerden oluşmuştur ve izoelektrik noktası pH 4-5 12 arasındadır. Aminoasit dizilimini saptamak amacı ile yapılan çalışmalar yapı olarak prostatik asit fosfataza benzediğini ortaya çıkarmaktadır (33) . 2.4.5 Api m6 Arı zehrinin yaklaşık % 1- 2’ini oluşturan Api m6,moleküler ağırlığı 7190-7808 g arasında değişen bir proteindir. Dört izoformu vardır ve bu izoformlarda molekülün merkezini oluşturan aminoasitler aynı olmasına rağmen amino ve karboksi ucundaki sadece 6 aminoasit farklılık gösterir. Arı alerjisi olan hastaların % 42’inde bu proteine karşı IgE antikorları mevcuttur (34). 2.4.6 Proteaz Bombus arı zehrinde bulunan proteaz, omurgalılarda bulunan pıhtılaşma faktör proteazlarına ve spermin baş kısmında bulunan akrozin isimli proteaza benzemektedir (19). Molekül ağırlığı 39000 g’dır. Arı alerjisi olan hastaların % 80’inde bu proteine karşı IgE bulunmaktadır (21, 28). 2.4.7 Allerjen C Venom kuru ağırlığının % 0.5’ini oluşturmaktadır. Molekül ağırlığı 95000 g’dır. Tek bir zincirden oluşmuştur, izoelektrik noktası asit fosfatazdan hafifçe daha düşüktür. Labil yapıda bir enzim olan alerjen C α-D-glukozidaz aktivitesine sahiptir (22, 28). 2.4.8 Antijen 5 Omurgasızlarda bulunan bir nörotoksin olup moleküler ağırlığı 23000 g’dır. Yaban arıları alt familyası ve türlerinde bulunan her bir antijen 5 molekülü yaklaşık 205 aminoasitten oluşmaktadır. Antijen 5 molekülü açısından yaban arıları türleri arasında %80 ve üzerinde benzerlik olması alerjik hastalarda her iki arı türüne çapraz reaktiflik sağlarken, % 70-80 oranında benzerlik olması genellikle çapraz reaksiyon, % 50 ile % 70 arasında benzerlik olması zaman zaman çapraz reaksiyon gelişmesine neden olmaktadır (21, 23) . Arı venomunda yukarıda bahsedilen alerjenik özellikteki maddelerin yanı sıra alerjenik özelliğe sahip olmayan komponentlerde bulunmaktadır. Bu komponentler Tablo 2.1’de verilmiştir (22). 13 Tablo 2.1. Bal Arısı Zehrinde Bulunan Alerjenik Olmayan Maddeler (2). Adı Apamin Yapısı 8 aminoasit Mast hücre degranüle edici 23 aminoasit peptid, peptid 40 uzunluğunda Sekapin 24- 25 aminoasit Histaminpeptidleri Proteaz inhibitör Tertiapin 4-5 aminoasit + C terminal histamin 63-65 aminoasit uzunluğunda Aktivitesi Nörotoksin, K kanalı reseptör antagonisti Masthücredegranülosyonu, Antiinflamatuvar Bilinmiyor Vazoaktif Tripsin inhibitörü 21 aminoasit Mast hücre degranülasyonu, uzunluğunda Presinaptiknörotoksin Dopamin Dolaşım ve sinir sistemine etki Noradrenalin Nörotrasmitter Serbest aminoasitler 19 farklı aminoasit Glukoz ve fruktoz Karbonhidrat Feromon Küçük moleküllü organik maddeler 2.5. Arı Alerjisi Böcek sokmalarına karşı alerjik reaksiyonlar en sık arılarla olmaktadır. Bu nedenle böcek alerjisi denince akla ilk önce arı alerjisi (Hymenoptera alerjisi) gelmektedir. Arı alerjisinin diğer alerjilerden farklılıkları vardır.Bunlar; 1- Genetik yatkınlık yoktur. 2-Alerjenin injeksiyonla alınması gerekmektedir. 3- IgE düzeyleri genellikle daha yüksek bulunmaktadır. 4- İmmunoterapi sonuçları daha iyidir (12, 24). Tarihteki ilk arı alerjisi M.Ö. 2641 yılında Mısır Firavunu Menes’in yaban arısı sokması sonucu anaflaksiden ölmesi ile kayıtlara geçmiştir. Arı sokmasına bağlı anaflaksinin sıklığı genel popülasyonda % 0.4 ile % 5 arasında değişmektedir. Ülkemizde ise bu oran 14 % 2 civarında bulunmuştur. Arı sokmasının neden olduğu alerjik reaksiyonlar sonucu Amerika Birleşik Devletleri’nde her yıl 40’ın üstünde, Avrupa’da 20, Asya’da ise birkaç ölüm vakası meydana gelmektedir. Diğer birçok arı sokmasına bağlı ölümlerin ise tanınamadığı kabul edilmekte bu nedenle yalnız olarak ölü bulunan ve miyokard infarktüsü sonucu öldüğü kabul edilen bazı kişilerin de arı sokmasına bağlı ölmüş olabilecekleri düşünülmektedir (14, 15). 2.5.1. Arı Alerjisinin Özellikleri Belirti ve bulgular arının cinsine, sokma sayısına, kişinin duyarlılığına ve kişinin daha önceki sağlığına, venom miktarına, son reaksiyondan sonra geçen süreye ve sokulan bölgeye bağlı olarak farklılık göstermektedir (7, 10). İnjekte edilen venom miktarı gelişecek reaksiyonun büyüklüğünü etkiler ve arının cinsine bağlıdır. Örneğin vasp’larda daha az, bal arısında, arının soktuğu yerde iğnesi kaldığı ve venom injekte etmeye devam ettiği için daha fazladır (7, 14, 24). Alerji özellikle çok sayıda sokulmalardan sonra meydana gelmektedir. Bazı kişiler ilk sokmadan sonra duyarlanmakta, ama ciddi reaksiyon riski tekrarlayan sokmalarda daha sık görülmektedir. İki sokma arasındaki aralık uzadıkça reaksiyon görülme sıklığı azalmaktadır (19, 20). İlk sokma sonrası gelişen reaksiyon ne kadar şiddetli ise, kişi tekrar sokulduğunda reaksiyon gelişme riski o kadar fazladır. İlk sokmada anafilaksi gelişenlerde bir dahaki sokmada anafilaksi gelişme riski % 50-60’dır. Çocuklarda görülen reaksiyonlar erişkinlere göre daha az ciddidir ve arı alerjisi çocuklarda daha iyi seyirlidir. Çocukların % 60’ında reaksiyon sadece deriye lokalizedir ve anafilaktik şok veya vasküler semptomlar daha nadir görülmektedir. Bununla birlikte orta ve ağır derecede anafilaksi gelişen çocuklar, gelecekteki sokmalarda anafilaksi açısından büyük risk altındadır (10, 15, 24). 2.5.2. Arı Sokmasının Belirti ve Bulguları Arı venomu proteini kana geçtiğinde bağışıklık sisteminin elemanı olan alyuvarları uyarmakta ve bunun sonucunda bu maddeye karşı salgılamaması gereken IgE adında bir antikor salgılanmaktadır. Salgılanan antikor kan dolaşımı ile vücudun her tarafına dağılarak bağışıklık sisteminin hücrelerine yapışmaktadır. Bu alerjen ile ikinci veya sonraki maruziyetlerde, antikorlar hemen venomdaki proteini tanımakta ve çok şiddetli bir reaksiyon vermektedirler. Bu reaksiyon esnasında bağışıklık sisteminden salgılanan 15 binlerce hormon benzeri madde alerjenin etki yarattığı organda anormal şiddette alerjik yangı oluşturmakta ve hastalığın bulgularının ortaya çıkmasına neden olmaktadır (24, 35). Bölgesel belirtileri, sokma bölgesinde ağrı, kaşıntı ve kızarıklıktır. Aşırı duyarlılık belirtileri ise hafif (baş ağrısı, ateş, halsizlik, kızarıklık, eklem ağrısı), orta dereceli (baş dönmesi, karın ağrısı, bulantı, kusma, hırıltılı solunum, sokulan yerin şişmesi) ya da şiddetli (nefes almada zorlanma, kasılma, konuşma yeteneğinde ve duyuda zayıflama) belirtiler görülebilmektedir. Kan basıncı düşmesi, bilinç kaybı ve solunum güçlüğü kötüye gidiş işaretleridir. Ağız, dil ve boğaz gibi ödemi solunum güçlüğüne neden olan bölgelerden arı sokmasının sonuçları daha ağırdır. Duyarlı kişilerde 5-8 dakika içinde şiddetli bulgular ortaya çıkabilir, 20-30 dakika içinde ağız ya da boyun çevresinde şişme, bilinç kaybı, solunum güçlüğü, kan basıncı düşmesi gelişebilir. Ölüm 1-96 saat içinde görülür (35, 36). İmmünolojik olmayan toksik belirtileri; ödem, kusma, ishal, başağrısı, hipotansiyon, konvülsiyon, koma, böbrek yetmezliği çok sayıda arının sokması sonucu oluşur. Geç belirtiler hemoliz, pıhtılaşma bozuklukları, trombositopeni, rabdomiyoliz, karaciğer yetmezliği ve yaygın damar içi pıhtılaşmadır (37). 2.6. Arı Zehirlenmelerinin Tanısı Arı sokmalarına karşı reaksiyonların gelişme riskini değerlendirmek için çeşitli tanı yöntemleri kullanılmaktadır. Aynı şekilde uygun tedavinin seçiminde de bu bilgilere gereksinim duyulmaktadır. Arı alerjisi tanısı esas olarak öyküye dayanmaktadır. Tanı, öykü, belirti ve bulgulara dayanılarak konur. Tanıda kullanılan özgül yöntem yoktur. Çok sayıda arının sokmasında tam kan sayımı, karaciğer ve böbrek işlev testleri, pıhtılaşma testleri yapılmalıdır. Öykünün yanı sıra bal arısı ve yaban arısının zehrindeki antijenler kullanılarak deri ve kan testleri yapılmaktadır. Testlerin amacı hastada bunlara karşı oluşmuş spesifik immünglobulin E (spe-IgE) tipi antikorların olup olmadığının belirlenmesidir (24, 35). Arı sokması ardından sistemik reaksiyon oluşturan hastaların birçoğunda deri testi ve venom spesifik IgE pozitifleşmektedir. Şiddetli sistemik reaksiyon geliştirenlerde hasta tekrar arı ile karşılaşmasa bile venom-IgE yanıtı uzun süre pozitif kalır. Bu kişilerde tekrar anaflaksi oluşma riski zamanla azalmakta, yakın zamanda arı sokması nedeni ile şiddetli sistemik reaksiyon geçirme öyküsü olan 16 kişilerde risk en yüksek orandadır. Anaflaksi öyküsü, geçiren hastalarda venom spesifik IgE düzeyleri hastanın tekrarlayan arı sokmalarında taşıdığı anaflaksi riski için rehber olarak kullanılabilmektedir. Ancak lokal reaksiyon geliştiren hastalarda venom spesifik IgE düzeyleri yüksekliği anaflaksi riskine işaret etmez. Bu nedenle venom spesifik IgE düzeyleri hasta öyküsü ile birlikte değerlendirilmelidir (38). Zehir ekstraktları ile yapılan deri testleri hızlı ve kolay bir şekilde uygulanan, gerçek pozitiflik ve negatiflik oranları oldukça yüksek testlerdir. Prik test için 10, 100 ve 300 µg/mL’lik konsantrasyonlar kullanılırken, intradermal test için 0.001, 0.01, 0.1 ve 1 µg/mL’lik konsantrasyonlar kullanılmaktadır, intradermal test daha duyarlı olmakla birlikte yanlış pozitif sonuçlar da verebilmektedir (39). Deri testlerinde kullanılan zehir konsantrasyonu genellikle ağırlık/hacim olarak belirlenir, burada işlenmemiş kuru zehir ağırlığının sulandırıldığı seyrelme hacmi belirtilmektedir. İşlenmemiş zehir, alerjenler dışında bir takım farklı maddeler de barındırır ve venom test materyallerini hazırlayan firmalar bu maddeleri ortadan kaldırmada aynı standardizasyonu yakalayamadıklarından farklı firma ürünleri ile yapılan deri testleri bir biri ile karşılaştırılmamalıdır. Rekombinant alerjenlerin kullanılması deri testlerinde seçiciliği artırırken duyarlılığı azaltmaktadır (35, 38). Arı sokmasının ardından alerjik reaksiyon veren olgularda venom spesifik IgE’nin saptanır düzeye erişmesi 2-3 hafta sürer, bu nedenle ilk 2 hafta içerisinde test yapılan olgularda spesifik IgE saptanamaz, test birkaç hafta sonra tekrarlanmalıdır. Arı sokması ardından sistemik reaksiyon geliştiren hastaların az bir kısmında venom spesifik IgE veya deri testi reaktivitesi saptanmaz. Bu hastalara uygulanan test materyali ya uygun venomu içermemektedir ya da test materyalinin alerjenik etkisi oldukça zayıftır. Spesifik IgG düzeyi, arıyla provokasyon testi, bazofil degranlasyon testi, histamin salınım testi, vb. arı alerjisi tanısında kullanılan diğer in vitro yöntemlerdir. Canlı arı kullanılarak yapılan challenge test hymenoptera venom alerjisinin doğal seyrini iyi yansıtmaktadır (39, 40). 2.6.1. Arı Sokmalarında Korunma Arı sokmasından korunmak için arı bulunan açık alanlarda parfüm, saç spreyi ve losyon gibi böcekleri çekebilecek kokulardan, açık renkli parlak giysilerden kaçınılmalıdır. Arındırma için sokulan bölge bol su ve sabunla yıkanıp, antiseptik bir madde sürülerek enfeksiyon riski azaltılmalıdır. Sokulan bölge sıkılmamalıdır. Kronik inflamasyon ya da 17 derin dokuya işleyerek granulom oluşumunu engellemek amacıyla iğne cımbız yardımıyla çıkarılmalıdır. Daha önce arı sokmasına karşı alerjik reaksiyon görülen kişilere, yanlarında adrenalin ampulü ve enjektör taşımaları gerektiği belirtilmeli ve kullanılışı öğretilmelidir. Tetanoz profilaksisi yapılmalıdır. Ayrıca atılmanın artırılması için etkin bir yöntem bulunmamaktadır (2, 7, 35). 2.6.2. Arı Sokmalarında Acil ve Destekleyici Tedavi Arı sokmalarında temel ve ileri yaşam desteği verilmelidir. Arının soktuğu bölgeye buz uygulanması şişmeyi azaltır ve venomun emilimini geciktirmektedir. Uygulama 30 dakika aralıklarla 15 dakika süreyle buz konulması biçiminde yapılmaktadır. Lokal reaksiyon dışında her türlü reaksiyonun görüldüğü hastalar, yanlarında kullanıma hazır epinefrin ile dolaşmalıdır ve reaksiyon oluşturan sokma ile karşılaştıklarında kullanmayı öğrenmelidirler. Kullanıma hazır epinefrinler erişkinler için 0.30 mg, çocuklar için 0.15 mg epinefrin içeren şırıngalar şeklinde kullanıma hazır olarak satılmaktadır. Hidrokortizon içeren merhemler deride lezyon oluşumunu engellemektedir (10, 20, 24). Eğer daha ağır bir seyir varsa hastanede; hafif alerjik belirtiler için; adrenalin (Adrenalin® ampul 0.25 mg/mL (1:4000), 0.5 mg/mL (1:2000) ve 1mg/1mL (1:1000)’lık ampullerde) yetişkinde 0.3-0.5 mg dozda deri altına ya da kas içine, çocukta 0.01mg/kg deri altına verilmekte, yanıt alınamıyorsa uygulama 10-15 dakikada bir yinelenmektedir. Ciddi anaflakside ise adrenalin damar içine, yetişkinde 5-10 dakikada bir 0.05-0.1 mg, çocukta 0.01 mg/kg, en çok 0.1 mg verilmektedir. Damar içine infüzyon hızı 1-4 mikrogram/dakikadır. Damar yoluyla verilemiyorsa endotrakeal tüp içine 0.5 mg verilebilmektedir (7, 24, 35). Hafif orta dereceli alerjik belirtiler de antihistaminik uygulanmaktadır. Bronkospazm varsa beta2 agonisti bronkodilatörler (Salbutamol, Ventolin®) yetişkinde100-200 mikrogram (1-2, en çok 3-4 püskürtme/ gün), çocukta 0.10-0.15 mikrogram/kg/doz (en çok 2.5 mg, 20 dakika ara ile 3 kez nebulizatörle) verilmektedir. Metilprednizolon damar içine yetişkinde 1-2 mg/kg, 6-8 saatte bir, çocukta 1-2 mg/kg (en çok 125 mg) 6 saatte bir verilmektedir. Arı zehrine karşı kullanılan özgül antidot yoktur. Arı sokması sonucu sağlık kuruluşlarına başvuran hastalara temel ve ileri yaşam desteği verildikten sonra sağlık personeli tarafından zehirlenme vaka bildirim formları doldurulmaktadır. Ek 1 de verilen 018/C zehirlenme 18 vaka bildirim formları hastanın kimlik, adres ve zehirlenme bilgilerini içermektedir. Bu formlar İl Sağlık Müdürlükleri tarafından kayıt altına alınmaktadır (10, 24, 35). 2.7. Apiterapi Arılardan elde edilen ürünlerden baldan sonra tıpta en önemli yeri arı zehri tutmaktadır. Kelime anlamı, arı zehrinin tıbbi amaçlarla kullanılması olan Apiterapi’nin geçmişi Hipokrat ve Galen’in dönemine dek uzanmaktadır. M.Ö.2000 yıllarına ait bir papirüste arı zehrinin tedavi amaçlı kullanımının delillerine rastlanılmıştır. Arı zehri ile romatizmanın tedavi edilebileceğinin bilinmesi eski Mısırlılara kadar uzanmaktadır ve o dönemde tedavi, ağrıyan yer, arıya sokturularak yapılırdı. Arı zehrinin tedavi amaçlı kullanımına dair ilk yayınlar 1864’te yapılmıştır ve 1928 yılından bu yana tıpta arı zehri enjektabl formda kullanılmaktadır (41). Dr. Foster tarafından Almanya’da geliştirilen ve 1935 yılında piyasaya sürülen arı zehri etken maddeli ürün olan Forapin günümüzde de hala kullanılmaktadır. Saf arı zehrinin zehre duyarsız insanlarda kullanımı, 1980'li yıllarda başlamıştır. Japonya'da 1980 yılında Api-akupunktur Birliği kurulmuştur. Çin’de de arı zehri tedavisi pek çok hastane ve doktor tarafından akupunktur tedavisi ile birleştirilerek uygulanmaktadır. Yaşanan gelişmelere paralel olarak 1983 yılında Amerika’da Arı Ürünleriyle Tedavi Derneği kurulmuştur ve günümüzde de çalışmalarına devam etmektedir. Arı zehri tedavisi Amerika, Bulgaristan, Rusya, Çin, Kore ve çeşitli Avrupa ülkelerinde apiterapi cemiyetlerinin kontrolünde olmak üzere uzun süredir kullanılmaktadır (42). Son 70 yıl içerisinde arı zehri uygulamalarının insan ve hayvanlar üzerinde çeşitli etkileriyle uygulamaların kompozisyonu konusunda 1700'den fazla bilimsel yayın yapılmış bulunmakta ve yayınların büyük çoğunluğuysa, Doğu Avrupa ve Asya ülkelerinde yapılmaktadır. Bu çalışmalar genellikle enzimlerin uyarılması ya da baskılanması, toksisite, doku yıkımı gibi bireysel bileşenlerin fizyolojik etkileri ve özel yerlerini belirleme üzerinde yoğunlaşmaktadır. Bu durum, alerjik tepkilerin pek çoğundan sorumlu olan maddelerin ve izole edilen zehir bileşenlerinin fizyolojik etkisinden kaynaklanan olguların anlaşılmasını kolaylaştırmaktadır. Dünyada bir çok araştırmacı arı zehri ile, özellikle köpek, kedi, at gibi hayvanlar üzerinde deneyler yapmışlar ve başarılı sonuçlar elde etmişlerdir (42, 43). Günümüzde ise dünya literatürün de 1500’den fazla çalışmada arı zehrinin, klinikte sıkça rastlanılan otoimmün bozukluklar, epilepsi, migren, hipertansiyon ve artrit gibi pek çok hastalığa karşı oluşturduğu güçlü terapötik etkinlikten söz edilmektedir. Arı 19 zehrinin tedavi edici özelliği ve yaygın olarak kullanımı nedeniyle arı zehri tedavisi de içerisine alan apiterapi, başta Amerika, Kanada, Çin ve birçok Avrupa ülkesinde alternatif tıp ve ya tamamlayıcı tıp olarak kabul edilmiş ve Apiterapi hastaneleri kurulmaya başlanmıştır. Apiterapiye bağlı terapötik etkinlik, homeopatik tedavi prensibine göre gerçekleşmektedir. Homeopatik tedavi prensibi, bir maddenin belirli bir hastalıkta çok küçük dozlarda verilmesi halinde, o hastalığa ait semptomların aynısına yol açmak suretiyle oluşturduğu terapötik etkinlik şeklinde tanımlanabilir. Örneğin, romatoid artritli yada artraljili hastaların kliniğinde ağrı, şişlik, ısı artışı gibi enflamasyonun karakteristik özellikleri izlenir. Arı zehiri de aynı semptomlara yol açar. Ancak zehir bileşenleri aynı zamanda, immün sistemi de uyarmak suretiyle hastanın şikayetlerinin zamanla gerilemesini sağlamaktadır (42, 44). Apiterapi, 4-5 günlük seanslar şeklinde uygulanmaktadır. Her bir seansı 2-3 günlük dinlenme dönemi izlemektedir. Bu döngünün birkaç kez tekrarlanması hem hastanın şikayetlerinin giderilmesi hem de herhangi bir yan etkiye yol açmaması bakımından en geçerli yöntem olarak kabul edilmektedir (44, 45). Günümüzde farmasötik preparat olarak 24 ürünün arı zehri içerdiği ifade edilmekte ve bu ürünler reçeteli veya reçetesiz temin edilebilmektedirler. Avrupa’daki eczanelerde homeopatik kategoride düzinelerce Apis mellifica ve Apis virus zehri içeren preparat bulunmaktadır. Bu kategoride yer alan yılan ve arı zehrinin kombine preparatları, kanserli olgularda alternatif ajanlar olarak kullanılmaktadır (46). Arı zehri tedavi amaçlı olarak haricen uygulanabileceği gibi İM ya da intralezyonel olarak da enjekte edilebilmektedir. Haricen uygulamalar için bir diğer alternatif, lezyonlu bölgenin üzerindeki cilt yüzeyine sürülen arı zehri içerikli merhem ya da solüsyonun elektrik akımı veya ultrasonik akım yardımı ile emiliminin arttırılması yöntemidir. Bu yöntem bilhassa Çin tıbbında, bronşiyal astım ve artrit olgularının tedavisinde başarıyla kullanılmaktadır (42, 44, 46). Arı zehri akupunktur uzmanlarınca da tercih edilmektedir. Bu tip uygulamada öncelikle akupunktur iğnesinin seansın başında arı zehri solüsyonu içerisine batırılması ya da cilt yüzeyine sürülen solüsyonun içinden geçirilmesi suretiyle zehir bileşenleri ile temas etmesi sağlanmaktadır. Takiben insan vücudundaki belirli bölgelere akupunktur iğnesi ile veya yine aynı bölgelere canlı arının iğnesi ile yapılan uygulamaların epilepsi ve empotans gibi bozukluklarda faydalı olabileceği ifade edilmektedir. Arı zehrinin enjeksiyon şeklinde uygulaması ağrı yakınmasına yol açabilir. Bu tarz bir uygulamanın tolere 20 edilebilmesinde kuşkusuz bireyin ağrı eşiği belirleyici olacaktır. Zehrin lidokain ile karıştırılması kısmen rahatlama sağlamaktadır. Hastanın enjeksiyona tahammül gösterememesi halinde bir diğer uygulama şekli olan elektroforez ya da ultrasonoforez yöntemi denenebilmektedir. Ancak arı zehri hangi yolla uygulanırsa uygulansın, işlem öncesinde cilt dezenfeksiyonu amaçlı alkol ya da iyot içerikli ajanların kullanılması apiterapinin başarısını düşürebileceğinden dezenfektan olarak fenolik eterin tercih edilmesi veya su ve sabun ile cilt temizliği yapılması tavsiye edilmektedir (45, 47). Günümüzde zehir özel yöntemle toplanıp kurutularak süresiz saklanabilmektedir. Arı zehri; saf arı zehri, enjekte edilebilir saf sıvı zehir, kuru kristal, tablet ve krem şeklinde pazara sunulmakta fakat genellikle arı zehri, kuru kristal şeklinde pazarlanmaktadır. Kuru kristal şekilde hazırlanan zehir daha dengeli ve saf olmakta, dolayısıyla bozulma olasılığı azalmaktadır. Kristal ve toz şeklindeki arı zehrinin rengi çok açık sarı, sıvı zehir ise renksiz ve berrak, koyu renkteki zehirse oksitlenmeden dolayı etkinliğini kaybedebilmektedir. Renge bağlı bu özellikler, arı zehri alan tüketiciler için belirleyici bir uyarı niteliği taşımaktadır (2, 9). Arı zehrinin enjeksiyon olarak kullanımında zehir, saf su, tuzlu su, bilinen bir yağ veya hazırlanmış özel ampüller ile enjeksiyon zamanında karıştırılabilmektedir. Enjeksiyonda kullanılan bu özel zehir ampülleri, hassas doz ayarlamasının yapıldığı uygun koşullara sahip sertifikalı farmakoloji laboratuarlarında hazırlanmaktadırlar. Arı zehrine 1:10:1 oranında karıştırılan beyaz vazelin, erimiş hayvan yağı ve salisilik asitle homojenize bir şekilde merhem hazırlanabilmekte, kullanılan salisilik asit deriyi yumuşatarak geçirgenliğini artırmaktadır (2, 14). Arı zehri içeren kremler özellikle Almanya'da, Fransa'da, Avusturya'da artritik eklemlerde dış uygulama şeklinde kullanılmaktadır. Tabletler ise içinden melittin ile diğer toksik proteinlerin çıkarıldığı çeşitli miktarlardaki arı zehri emdirilerek hazırlanmakta ve dilaltına yerleştirilerek kullanılmaktadırlar. Hazırlanan tabletlerin farklı dozları farklı renklerde pazara sunulmaktadır. Diğer arı zehri preparatları steril kuru, enjekte edilebilir sıvı şeklinde şırınga veya cam şişelerde küçük dozlar halinde paketlenerek kullanılmaktadırlar. Deri altı enjeksiyonlar, merhemler, fısfıslar, tabletlerle doğal arı iğnelerini içeren zehirler günümüzde uygulanan yöntemler arasındadır. Saf arı zehri enjeksiyonlarının ve arı iğnelerinin kullanımı, yan etkilere sahip olan ağır ilaçlara alternatif olarak batı ülkelerinde gün geçtikçe artmaktadır. Arı 21 zehri lokal ve sistemik etkiye sahip olduğu için enjeksiyonun yeri ve dozu önem kazanmaktadır. Bu nedenle arı zehriyle tedavi şekilleri eksiksiz öğrenilmelidir (23, 42). İnsan sağlığı açısından yeni ilaçlara duyulan ihtiyacı gidermede arı zehrine, zengin bileşimi ve çok çeşitli farmakolojik özellikleriyle son derece etkili bir alternatif gözüyle bakılmaktadır. Arı zehrinin, alerjik olanlar dışında uygulandığı hastalarda herhangi bir yan etkisinin görülmediği bilinmektedir. Arı zehri, batı toplumlarında alternatif tedavi yöntemleri arasında sıkça başvurulan bir ajan durumundadır. Sadece Amerika’da son 10 yıllık dönemde çok sayıda multipl skleroz ve romatoidartrit hastasının klasik antienflamatuar ve immünosupresif ajanlar yerine tedavide özellikle arı zehrini ya da bileşenlerini tercih ettikleri ifade edilmektedir. Sayılan hasta grubunu arı zehrine dolayısıyla da apiterapiye yönlendiren nedenler, günümüzün tedavi yöntemlerinin mevcut semptomları gidermede yetersiz kalması ve aynı zamanda da yaşam kalitesini ciddi ölçüde düşüren yan etkilere yol açıyor olmasıdır (9, 23, 42). Arı zehrinin tedavi edici özellikleri, ilaç kortizonlarına benzer bir yolla vücut enzim ve bağışıklık sistemlerini uyarması şeklinde ortaya çıkmaktadır. Arı zehri ile herhangi bir tedaviye başlamadan önce mutlaka arı zehri alerji testi yaptırılmalıdır ve tedaviye uzman doktor gözetiminde başlanmalıdır. Arı zehri tedavisi, tüberküloz, bel soğukluğu, endokardit rahatsızlıklarında ve hamilelikte kullanılmamalıdır. Tedavi süresince kesinlikle alkol alınmaması gerekmektedir. Bunun yanında süt, beyaz ekmek, dondurma, pirinç, şeker vb. beyaz yiyecekler tüketilmemelidir. Bunlara ek olarak 1000-5000 mg. C Vit., 100300 mg, B Vit. Kompleksi ve 400 IU. EVit. alınması tavsiye edilmektedir. Arı zehri tedavisine en az 6 ay devam edilmesi önerilmektedir (23, 44, 46). Avrupa’da uzun yıllar arı zehri, eklem rahatsızlıklarında özellikle romatizmal hastalıklarda kullanılmaktadır ve tablet formundaki oral preparatlar ile desteklenmesi tedavinin başarısı açısından önemli kabul edilmektedir. Bu tarz bir uygulama özellikle steroide gereksinim duyan romatoidartritli hastalarda büyük rahatlama sağlamaktadır. Arı ürünleri ile tedavi konusunda oldukça ciddi araştırmalar yapan Amerikan Apiterapi Birliği, günümüzde mafsal iltihabı (arterit), doku sertleşmesi, deri veremi, yaşlılarda görülen deri sertleşmesi, kronik yorgunluk sendromu, yara izi, deri kanseri, egzema gibi hastalıkların tedavisinin arı zehri ile yapılabilineceğini bildirmiştir. Arı zehrinin etkin mekanizmalarından biri de yapısındaki pek çok aktif aminoasit, mikroelementler ve protein yapıdaki melittin sayesinde bağışıklık sisteminin düzenlemesi, beyin sinir 22 iletimini uyarması, böylece sinir sisteminin düzenli çalışmasını sağlamasıdır. Çağın vebası olarak nitelendirilen AİDS üzerinde yapılan çalışmada arı zehrinin HİV virüsünün bağışıklık sistemini çöktürücü etkisini kişinin bağışıklık sistemini güçlendirerek önce yavaşlattığı sonra da gelişimini durdurduğu ortaya konulmuştur. Kanser vakalarında ise arı zehrinin merhem, tablet veya iğne yoluyla vücuda uygulanmasıyla umut verici gelişmeler kaydedildiği belirtilmektedir (23, 48).Apis mellifera zehri antienflamatuar etki göstermektedir ve Amerika Birleşik Devletlerin’de söz konusu etkinliği iyi bilinen zehir, multipl skleroz ve romatoidartrit olgularında ve yine atopik bünyeli kullanılmaktadır. bireylerin Apismellifera desensitize zehri aynı edilmesinde zamanda, yaygın bir radyoprotektif şekilde etki de gösterebilmektedir. Melittin gibi zehir bileşenlerinden olan histaminin de radyoprotektif etkili olduğu gösterilmiştir. Arı zehrinde 2 tane histamin terminal peptid yapılı molekül bulunmaktadır ve bu bileşikler in vivo yavaş bir şekilde hidrolize olmak suretiyle histamin serbestleştirerek hematopoetik sistemi uyarmakta ve radyoprotektif etkinlik göstermektedirler (23, 49). Arı zehri günümüzde 500 kadar hastalığın tedavisinde başarıyla kullanılmaktadır. Tablo 2.2’de arı zehri bileşenlerinin terapötik etkinlik gösterdiği hastalıklardan bazılarına yer verilmiştir (23). Arı zehrinin kullanımını sınırlayan durumlar atopik bünye, kontrolsüz hipertansiyon ve yine kontrolsüz diabetes mellitus olarak sayılabilmektedir. Apiterapi, bazı olgularda etkisiz kalabildiği gibi yan etkilere de yol açabilmektedir. Bunun olası nedenleri hastanın tedavi protokolüne riayet etmemesi, kötü kalitede veya uygunsuz şekilde hazırlanan solüsyonların kullanılması, uygulama tekniğinin yetersiz olması, malnütrisyon, atopik bünye, arı zehrinin birlikte alınannonsteroidal antiinflamatuar ilaçlar gibi başka ajanlarla etkileşime girmesi ve yetersiz hasta uyuncu olarak sayılabilmektedir. Bununla birlikte şu ana kadar arı zehri kaynaklı ciddi bir yan etkiye veya ölüm olgusuna rastlanmadığı ifade edilmektedir (50). 23 Tablo 2.2. Arı Zehrinin Terapötik Etkinlik Gösterdiği Bazı Hastalıklar (23) Multipl skleroz Otoimmün Hastalıklar Sistemik Lupus eritematozus Skleroderma Artralji ve Gut artriti Romatoıt artrit Fizik Tedavi ile İlgili Bozukluklar Tenisçi dirseği Bursit Fibrozit Epilepsi Nörolojık Bozukluklar Kronik ağrı Amiloid nöropatisi Migren Lyme hastalığı Enfeksiyon Hastalıkları Mycoplazma hominis Mastit Tekrarlayan enfeksiyonlar Kardiyovasküler sistem ile ilgili bozukluklar Hipertansiyon Hiperkolesterolemi ve diğer hiperlipidemiler Jinekolojik sorunlar Premestrüel sendrom Ürolojik sorunlar Empotans Psikiyatrik bozukluklar Depresyon Dermatolojik sorunlar Skar doku Göğüs hastalıkları Bronşiyal astım Kulak-Burun-Boğaz hastalıkları Sağırlık 24 BÖLÜM 3 3. ARI ZEHRİ ANALİZ METOTLARI 3.1. HPLC ile Arı Venomunun Analizi Chmielewska ve Szczesna tarafından yürütülen bir çalışmada arı zehri HPLC ile bileşenlerine (apamin, fosfolipaz A2, mellitin) ayrılmıştır. Yapılan çalışmada; farklı C18 kromatografik kolonların, kolon sıcaklığının etkisi ve elüsyon çözeltilerinin ayırmaya etkileri incelenmiştir. Apamin, fosfolipaz A2 ve mellitin ayrılmasında, en az 180 A gözenek çapına sahip C18 kromatografik kolonun en uygun olduğuna karar verilmiştir. Gradientelüsyon B % 5-80 (hareketli faz A % 0.1 Trifloroesetik asit su içinde, hareketli faz B - % 0.1 TFA asetonitril içinde: su (80:20)) 40 dakika için, akış hızı 2.0 ml/dk ve kolon sıcaklığı 25°C olduğu durumda kolonun en yüksek stabilite ve tekrarlanabilirliğe sahip olduğu belirtilmiştir. Büyük balarısının (Apismellifera L.) zehir bileşiklerinin; ortalama% 65 mellitin, % 13 fosfolipaz A2 ve % 3 apamin olduğu bulunmuştur. Farklı mevsimlerde elde edilmiş arı zehri örnekleri, mellitin açısından istatistiksel açıdan önemli farklılık göstermektedir. Protein fraksiyonunun (melittin, fosfolipaz A2 ve apamin) miktar bileşimi balarısı zehrinin yerli standartlarının geliştirilmesinde önemlidir. Bal arısı zehrinin protein fraksiyonunun HPLC ile analizi ürün kimliğini nitelendirmekte kullanılabilmektedir. Tayinler 220 nm dalga boyunda UV dedektör kullanılarak yapılmıştır. Şekil 3.1’de C18 kolonla yapılmış bir venom ayırmasının kromatogramı görülmektedir. Çalışmada 2002-2004 yıllarını kapsayan üç mevsimde 29 ayrı arı zehri örneğinden mellitin, apamin ve fosfolipaz A2 ana protein fraksiyonu olarak analiz edilmiştir. Mellitin % 61.15 ile % 70.15 aralığında değişim gösterirken ortalama değeri % 64.40 25 olarak bulunmuştur. Fosfolipaz A2 içeriği % 11,24-% 15,05 aralığında, ortalama değer ise % 13.00’tür. Apamin içeriği ise % 2.09 ile % 4.18 arasında değişirken ortalama değeri % 3.10 olarak bulunmuştur (51, 52). Şekil 3.1. Örnek Kromotogram 3.2. CZE-DAD Yöntemi İle Bal Arısı Zehri Analizi Zenon J. Kokot ve arkadaşları 2011 yılında yayımladıkları bir çalışmayla, iç standart olarak sitokrom c kullanarak balarısı zehrinin analizi için yeni, kesin ve doğru kapiler zone elektroforezis-diyot array dedektör (CZE-DAD) yöntemi geliştirmişlerdir. Yapılan çalışmada 64,5 cm toplam uzunluğunda, 56 cm etkili uzunluğa sahip 75 µm iç çaplı ve 360 µm dış çaplı kaplanmamış erimiş silikadan oluşmuş kapiler kolon kullanılmıştır. Örnekler, 7 s.içinde 50 mbar basınç altında kapiler içine enjekte edilmiştir. Kapiler uygulamanın genelinde elektrik alanı 15 kV, akım yoğunluğu 26 µA olmuştur. Ayırma 25 o C’de gerçekleştirilmiş, analiz normal elektrot polarite ile çalıştırılmıştır. Metotun teşhis ve tayin sınırı, seçiciliği, duyarlılık, doğruluğu, doğrusallığı ve tayin limiti belirlenmiştir. Tüm analitik parametreler metodun amacına uygun olduğunu göstermektedir. Bu çalışma, literatür taramasına göre çeşitli balarısı zehir bileşenlerinin ayrıldığı ve bunların beşini kapiler zon elektroforez ile tespit 26 edildiği ilk çalışma olmuştur. Bu yöntemle 38 bal arısı zehir örneklerinin kantitatif analizi için kullanılmıştır. 2002- 2007 yılları arasında toplanan bal arısı zehir örneklerinin analiz edilen peptit içeriği (kuru zehir kütlesine göre) şöyledir; Apamin % 0,93-% 4,34 (ortalama % 2.85±0.79), mast hücre degranüle peptit % 1,46-% 4,37 (ortalama, % 2.82±0.64), fosfolipaz A2 % 7,41-% 20,25’e(ortalama, %12.95±3.09) ve melittin % 25,40-% 60,27 (ortalama, % 45.91±9.78) aralığında olduğu görülmüştür. Sonuçlar HPLC yöntemiyle daha önce analiz edilen aynı zehir örnekleri için elde edilen deneysel veriler ile karşılaştırılmıştır. Bu HPCE ve HPLC verileri arasında önemli bir fark bulunmamış ve HPCE yönteminin HPLC yöntemine alternatif olduğu görülmüştür. Çalışmanın sonuçları kullanılarak elde edilen temel bileşen analizi (PCA) genel dağıtım modelini ve dört önemli balarısı zehir içeriklerinin bezerliklerini açıklamak için kullanılmıştır. Apamin, MCDP, Fosfoliaz A2 ve melittin arasındaki güçlü korelasyonlar doğrulanmıştır. Bu korelasyonlar balarısı zehrinin standardizasyonunda dikkate alınmıştır. Basit oluşundan dolayı geliştirilen bu yöntemle kolaylıkla çalışılabilmektedir. Bu yöntemle hem arı zehrinin belirlenmesi, kalite kontrolü hem de ürün standardizasyonu gibi rutin işlemler gerçekleştirilebileceği iddia edilmektedir. HPCE metodunun avantajı, HPLC metodu ile karşılaştırıldığında analitik reaktiflerin, analiz maliyetinin ve cihaz fiyatlarının önemli ölçüde düşük olmasıdır (53). 3.3. Yüksek Performanslı Sıvı Kromatoğrafisi-Diyot Array Dedektörü-Tandem Kütle Spektrofotometresi ile Arı Zehri Tayini Yüksek performanslı sıvı kromatoğrafisi-diyot array dedektörü-tandem kütle spektrofotometresi (HPLC-DAD-MS/MS) metodu, belli biyolojik aktiviteye sahip olan ham arı zehri liyofilize tozunun (CBVLP) içinde bulunan melittin ve apamin’in eş zamanlı olarak teşhis ve tayini için geliştirilmiştir. Melittin ve apamin HPLC-DADMS/MS analizi ile CBVLP örneklerinden saf su ile ekstre edilmiştir. Metot, seçicilik, doğrusallık, tayin sınırı (LOQ), gün içi ve günler arası kesinlik, doğruluk, geri kazanma, matriks etkisi etkisi ve kararlılığı açısından test edilmiştir. Melittin ve apamin için tayin sınırı sırasıyla 1.0 ve 0.3 µg/mL bulunmuştur. Lineer dinamik aralık melittin için 1-100 µg/mL ve apamin için 0.2- 25 µg/mL’dır. Gün içi tekrarlanabilirlik, % 2.2 - % 11.4 ve günler arası tekrarlanabilirliğin ise % 3.2-% 13.1 aralığında değiştiği bildirilmiştir. Liyofilize edilmiş arı tozu örneklerinde endojen melittin ve apaminin konsantrasyonları sırasıyla, kuru ağırlıkları % 46 ile % 53 ve % 2.2 ile % 3.7 arasında değişmektedir. Bu 27 hızlı, basit ve duyarlı yöntem liyofilize edilmiş arı tozu örneklerinin doğruluğunu ve kalitesini belirlemede melittin ve apamin’in varlığını ortaya koymaktadır. Önerilen metot ile liyofilize edilmiş arı tozu örneklerinde bulunan mellittin ve apamin’in saf su kullanılarak ekstrakte edilmiş ve 4 dakika gibi çok kısa bir sürede HPLC-DAD-MS/MS yöntemi ile tayin edilmiştir. Bu analitik sürecin, özellikle sıkıcı numune hazırlama ve uzun kromatografik ayırma basamaklarına dayalı geleneksel yöntemler ile karşılaştırıldığında büyük ölçüde kısa olduğu görülmüştür. Bu sonuçlar, geliştirilen LCDAD-MS/MS metodunun arı zehrinde melittin ve apamin’in tayini için LC-DAD ya da LC-UV metoduna alternatif yöntem olduğu görülmüştür. Geliştirilen yöntemin diğer metotlara göre hızlı ve oldukça hassas olduğu belirtilmiştir (52, 54). 28 4. SONUÇ VE TARTIŞMA Yapılan çalışmada Hymenoptera takımında Apoidea üst familyasının Apiformes grubunu oluşturan arıların insanları sokmaları sonrasındaki tedavi metotları, arı zehri bileşenleri ve bu bileşenlerinin belirlenmesinde kullanılan analiz metotları araştırılmıştır. Arı zehri (venom) iğne parçalarıyla ilişkili olan alkali ve asit salgı bezlerinden salgılanır ve arıdaki zehir miktarı, mevsime ve arının yapısına göre değişmektedir. Ergin bir insan için öldürücü zehir dozu (LD50), vücut ağırlığının her bir kilogramı için 2.8 mg olduğu düşünülmektedir. Arı zehrinin yaklaşık % 88’i sudan oluşmaktadır. Ayrıca farmokolojik açıdan önemli en az 18 aktif madde içerir. Arı zehrinde; proteinler, aminler, enzimler, mineraller, bazı şekerler, aminoasitler, ve lipidler ile alarm feromonları bulunur. Arı sokmasının ardından görülen belirti ve bulgular arının cinsine, sokma sayısına, kişinin duyarlılığına, venom miktarına ve sokulan bölgeye bağlı olarak farklılık gösterir. Tanı, öykü, belirti ve bulgulara dayanılarak konmaktadır. Ülkemizde arı sokmaları diğer zehirlenme vakalarında olduğu gibi sağlık il müdürlükleri aracılığı ile takip edilmektedir. Sağlık kuruluşlarına arı sokması ile müracaat eden hastaların bilgileri Form 018/C Zehirlenme vaka bildirim formları aracılığıyla bildirilmektedir. Ancak, yaptığımız araştırmada arı sokması ile ilgili vaka sayısına ulaşılamamıştır. Arı venomu, bileşenlerinin tayini için yapılmış çalışmalar oldukça sınırlıdır. Tez de 3 farklı çalışma verilmiştir. Çalışmalardan birincisinde, arı bileşenlerin (apamin, fosfolipaz A2, mellitin) analizi HPLC ile yapılmıştır. Çalışmada 2002-2004 yıllarını kapsayan üç mevsimde 29 ayrı arı zehri örneğinden mellitin, apamin ve fosfolipaz A2 ana protein fraksiyonları olarak analiz edilmiştir. Çalışmada metotla ilgili çok fazla analitik parametre verilmemiştir. 29 Kalitatif ve kantitatif tayin için uygunluğu, tüm moleküllerin tayininde kullanılabilmesi, moleküllerin ayrılma zamanlarının kesin olarak tespit edilebilmesi, yüksek ayrıştırma etkinliğiyle elde edilmek istenen maddelerin yüksek saflıkta elde edilebilmesi HPLC sisteminin üstünlükleridir. Fakat bu yöntemin yüksek saflıkta solvent, pahalı enstrümantasyon gerektirmesi, analiz işleminden önce yapılan ağır ön işlemler gerektirmesi, analiz yapılırken oluşan küçük çevresel etkenlerden dolayı hata oluşması, sistemin sık sık bakım istemesi, zaman alıcı ve pahalı bir teknik olması bu sistemin dezavantajıdır. İkinci çalışmada, balarısı zehrinin analizinin kapiler zone elektroforez- diot array dedektör (CZE-DAD) ile yapıldığı bir yöntem incelenmiştir. Çalışmada elde edilen veriler PCA kullanılarak istatistiksel olarak değerlendirilmiştir. Çalışmada 64,5 cm toplam uzunluğunda, 56 cm etkili uzunluğa sahip 75 µm iç çaplı ve 360 µm dış çaplı kaplanmamış erimiş silikadan oluşmuş kapiler kolon kullanılmıştır. Metotun gözlenebilme ve tayin sınırı, seçiciliği, duyarlılık, doğruluğu, doğrusallığı ve tayin limiti belirlenmiştir. Tüm analitik parametreler metodun amacına uygun olarak tayin yapabildiğini göstermektedir. Çalışma, balarısı zehir bileşenlerinin ayrıldığı ve bunların kapillar zone elektroforez ile tayin edildiği ilk çalışma olmuştur. Bu yöntemle 38 bal arısı zehir örneklerinin bileşenlerinin kantitatif analizi için kullanılmıştır. Üçüncü çalışmada ham arı zehri liyofilize edilerek elde edilen tozun protein içeriği yüksek performanslı sıvı kromatoğrafisi-diyot array dedektörü-tandem kütle spektrofotometresi kombinasyonu kullanılmıştır. Çalışmada ham arı zehri liyofilize tozunun içinde bulunan melittin ve apamin’in eş zamanlı tayini yapılmıştır. Geliştirilen metotun seçicilik, doğrusallık, tayin sınırı (LOQ), gün içi ve günler arası kesinlik, doğruluk, geri kazanma, lineer dinamik aralık, matriks etkisi etkisi ve kararlılığı gibi tüm analitik parametreleri incelenmiştir. Geliştirilen metodun hızlı, basit ve duyarlı bir yöntem olduğu düşünülmektedir. Önerilen HPLC-DAD-MS/MS yöntemi ile liyofilize edilmiş arı tozu örneklerinde bulunan mellittin ve apamin’in 4 dakika gibi çok kısa bir sürede tayin edilebilmektedir. Bu nedenle diğer yöntemlere göre oldukça hızlıdır. Ayrıca, yöntemin tayin sınırı diğer metotlara göre daha iyidir. Ancak yöntemde kullanılan alet birçok laboratuarda bulunmayacak sofistike kombine bir analitik cihazdır. Geliştirilen LC-DAD-MS/MS metodunun arı zehrinde melittin ve apamin’in tayini için LC-DAD, LC-UV ya da CZE-DAD metoduna alternatif bir yöntemdir. 30 HPCE metodu kullanılan analitik reaktiflerin, analiz maliyetinin ve cihaz fiyatlarının önemli ölçüde düşük olması nedeniyle HPLC ve HPLC-DAD-MS/MS’den üstündür. Arı zehri bileşenlerinin analizleri için çok sınırlı sayıda çalışma olması ve ülkemizde çok sayıda arı sokması vakası bulunması nedeniyle bu konuda yapılan çalışmaların artması gerekmektedir. Ayrıca, kolay duyarlı yeni yöntemlerin geliştirilmesi arı zehri bileşenlerinin vücuttaki yarı ömrünün tayin edilebilmesi için çalışmalarda da kullanılabilecektir. 31 EKLER Ek 1. FORM 018/C ZEHİRLENME VAKA BİLDİRİM FORMU 32 KAYNAKÇA 1. Aytekin, A.M. Arılar ve Yaban Arıları. Astım Allerji İmmünoloji 2006; 4(1): 5-9. 2. Fitzgerald, K.F., Flood, A.A. Hymenoptera stings. Clin. Tech Small Anim. Pract (2006) 21: 194-204. 3. Aytekin, A.M., Çağatay, N. Systematic Studies on the family Apidae (Hymenoptera) in Ankara Province part I: Bombinae. Turkish J. Zoology 1999;23:231-41. 4. King, T.P., Spangfort, M.D. Structure and Biology of Stinging İnsect Venom Allerjens. Int. Arch. Allergy Immunol, 2000; 123 99-106. 5. Özbek, H. (2002). Arılar ve Doğa. Uludağ Arıcılık Dergisi, 120: 22-25. 6. Özbek, H. (2010). Arılar ve İnsektisitler. Uludağ Arıcılık Dergisi, 130: 85-95. 7. Oktay, C. Arı Sokmaları, In: Acilde Klinik Toksikoloji, Satar S. (ed), Nobel Kitabevi, Adana, 2009: p 621-626. 8. Tolon, B. Yaban Arılarında Sosyal Yaşam. Hayvansal Üretim. (1999) 39-40: 120127 9. Banks, B.C, Shipolini, R.A. Biochemistry and Pharmacology of Honeybee Venom, In: Venoms of the Hymenoptera, Piek T. (ed), Academic Pres, Orlando,1986: p 330-403. 10. Gidener, S. (2012). Hayvan Isırma ve Sokmaları. Türk Farmakoloji Dergisi, 40: 3740. 11. White, J. Bites and Stings From Venomous Animals a Global Overview. Ther. Drug Monit. (2000) 22: 65-68. 12. King, T.P., Guralnick, M. (2004). Hymenoptera allergens. Clin Allergy Immunol; 18: 339-53. 13. Kalyoncu, A. The Prevalence of Hymenoptera Stings in Primary School Children in Ankara. Int Rev Allergol Clin Immunol 1998; 4: 136-8. 14. Özbek, H. Bal Arısı (Apis Mellifera L.) Zehri, Yüksek lisans Tezi, Atatürk Üniversitesi Ziraat Fakültesi Bitki Koruma Bölümü, Erzurum 1990: 18. 15. Golden, D.B., Marsh, D.G., Freidhoff, L.R. Natural history of Hymenoptera Venom Sensitivity in Adults. J Allergy Clin Immunol 1997;100:760-6. 16. Charpin, D., Birnbaum, J. (1992). Hymenoptera Stings in Different Samples of the General Population. J Allergy Clin Immunol; 90: 331-4. 33 17. Müller, U. Hymenoptera Venom Hypersensitivity: An Update. Clin Exp Allergy 1998;28:4-6. 18. Incorvaia, C., Pucci, S., Pastorello, E.A. Clinical Aspects of Hymenoptera Venom Allergy. Allergy 1999;54(Suppl 58):50-2. 19. Kalyoncu, A., Demir, A.U. Bee and Wasp Venom Allergy in Turkey. Ann Allergy Asthma Immunol 1997;78:408-12. 20. Kalpaklıoğlu, A.F. Böcek Allerjisi. Astım Allerji Ümmünoloji 2003;1(1):44-53. 21. http://www.ibiblio.org/pub/academic/agriculture/entomology/beekeeping/general/v enom_therapy/bevenfaq.html erişim tarihi 15.11.2012 22. Gökmen, E.N. (2008). Venom Biyokimyası, Turkiye Klinikleri J Allergy-Special Topics, 1(1) :22-25. 23. Kelle, İ. (2007). Apiterapi. Dicle Tıp Dergisi, 34:311- 315. 24. Razi, C.H., Bakırtaş, A. Arı Duyarlılığı (Hymanoptera Allerjisi). Klinik Pediatri, 2005; 4(3): 84-89. 25. Kuchler, K., Gmachl, M., Sippl, M.J., Kreil, G. (1989). Analysis of the c-DNA for Phospholipase A2 From Honey Bee Venom Glands. The Deduced Amino Acid Sequence Reveals Homology to the Corresponding Vertebrate Enzymes. Eur J Biochem ; 184:249-54. 26. Hoffman, D.R. (1986). Allergens in Hymenoptera Venom XVI: Studies of The structures and Cross-Reactivities of Vespid Venom Phospholipases. J. Allergy Clin Immunol;78: 337-343. 27. Gmachl, M. Kreil, G. Bee Venom Hyaluronidase is Homologousto a Membrane protein of Mammalian sperm. Proc Nat Acad Sci US 1993; 90: 3569-73. 28. Kolarich, D., Leonard, R., Hemmer, W., Altmann, F. (2005). The N-glycans of Yellow Jacket Venom Hyaluronidases and the Protein Sequence of its Majör iso form in Vespula Vulgaris. FEBS Journal; 272:5182-5190. 29. Hoffmann, D.R. Hymenoptera Venoms: Composition, Standardization, Stability. In:Monograph on Insect Allergy. Pittsburgh P.A.(ed). Dave Lambert Associates, 2003: p 37-53. 30. Li, J.H., Zhang, C.X., Shen, L.R., Tang, Z.H., Cheng, J.A. (2005). Expression and Regulation of Phospholipase A2 in Venom Gland of the Chinese Honey Bee, Apis Cerana Cerana. Arch Insect Biochem Physiol; 60: 1-12. 34 31. Huh, J.E., Kang J.W., Nam D., Baek, Y.H., Choi,D.Y., et all. Melittin Suppresses VEGF-A-Induced Tumor Growth by Blocking VEGFR‑2 and the COX-2Mediated MAPK Signaling Pathway. Journal of Natural Products, 2012: p 2-8. 32. Bachmayer, H., Kreil, G., Suchanek, G. Synthesis Ofpromelittin and Melittin in the Venom Gland of Queen and Worker Bees: Patterns Observed During Maturation. J Insect Physiol 1972; 18: 1515-21. 33. Hoffman, D.R., Jacobson, R.S. Allergens in Hymenopteravenom. XXVII: Bumblebe venom allergy and allergens. J Allergy Clin Immunol 1996; 97: 812-21. 34. Kettner, A., Hughes, G.J., Frutiger. S., Astori, M., Roggero, M., Spertini, F., Corradin, G. Api m6 a New Bee Venom Allergen. J Allergy Clin Immunol 2001; 107: 914-20. 35. T.C. Sağlık Bakanlığı Birinci Basamağa Yönelik Zehirlenmeler Tanı Ve Tedavi Rehberleri, 2006 p: 142-146. 36. King, T.P., Spangfort, M.D. (2000). Structure and Biology of Stinging İnsect Venom allergens. Int Arch Allergy Immunol; 123: 99-106. 37. Valentine, M.D. (1992). Anaphylaxis and Stinging Insect Hypersensitivity. JAMA, 268: 2830-2833. 38. Gökmen, E.N. Venomlara Karsı Gelişen İmmünolojik Cevaplar, Türkiye Klinikleri J Allergy-Special Topics 2008, 1(1):26-29. 39. Golden D.B., Kagey-Sobotka, A., Norman P.S., Hamilton, R.G., Lichtenstein, L.M. Insect Sting Allergy With Negative Venom Skin Test Responses. J Allergy Clin Immunol 2001;107: 897-901. 40. Chunsheng, J., Hantusch, B., Hemmer, W., Stadlmann, J., Altmann, F. (2008). Affinity of IgE and IgG Against Cross-Reactive Carbohydrate Determinants on Plant and İnsect Glycoproteins. J Allergy Clin Immunol; 121: 185-190. 41. Yıldırım, N., Öztürk Türkmen H. Arı Zehriyle Tedavide (Apiterapi-Apikoterapi) Biz Neredeyiz, Dünya Nerede? Lokman Hekim Journal, 2011 p 10. 42. Kelle, İ. (2008). Radyoprotektif Etkili Ajanlar. Dicle Tıp Dergisi, 35: 69-76. 43. http://healthgate.partners.org/browsing/browseContent.asp erişim tarihi 15.01.2013 44. http://www.honeybeetherapy.com/bee_history.htm erişim tarihi 20.01.2013 45. http://internethealthlibrary.com/Therapies/bee-venom-therapy.htm 05.01.2013 erişim tarihi 35 46. http://www.ibiblio.org/pub/academic/agriculture/entomology/beekeeping/general/v enom_ therapy/bevenfaq.html erişim tarihi 02.02.2013 47. Varanda, E.A, Tavares, D.C. Radioprotection: mechanisms and radio protective agents including honey bee venom. J. Venom. Anim. Toxins, 1998; 4: 5-21. 48. Orsolic, N., Sver, L., Verstovsek, S., Terzic, S., Basic, I. (2003). Inhibition of Mammary Carcinoma Cell Proliferation in Vitro and Tumor Growth in Vivo By Bee Venom. Toxicon, 41: 7, 861-870. 49. Son, D.J., Lee, J.W., Lee, Y.H., Song, H.S., Lee, C.K., Hong, J.T. Therapeutic Application of Anti-Arthritis, Pain-Releasing, and Anti-Cancereffects of Bee Venom and its Constituent Compounds. Pharmacology & Therapeutics 115, 2007 246–270. 50. Wenzel, J, Meissner-Kraemer, M., Bauer, R., Bieber, T., Gerdsen, R. Safety of rush insect venom immunotherapy. The results of a retrospective study in 178 patients. Allergy 2003; 58: 1176-9. 51. Rybak-Chmielewska, H., Szczêsna, T. HPLC Study Of Chemical Composition Of Honey bee (Apis Mellifera L.) Venom. Journal of Apicultural Science, 2004; 48: 103-108. 52. McNairy, M.M., Gastmeyer, J., Pantera, B., Hoffman, D.R. (2000). Isolation of Paper wasp Venom Proteases by Affinity Chromatography. J Allergy Clin Immunol; 105:S57. 53. Zenon, J.K., Jan, M., Bartosz, U., Paweł, D. New CZE-DAD method for Honey bee Venom Analysis and Standardization of The Product. Anal Bioanal Chem (2011) 399; 2487–2494. 54. Jinhui, Z., Jing, Z., Suxia, Z., Jianzhong, S., Xiaofeng, X., Yi, L., Liming, W., Jinzhen, Z., Fang, C., Lanzhen, C. Quantification of Melittin and Apamin in Bee Venom Lyophilized Powder From Apis mellifera by liquid Chromatography–Diode Array Detector–Tandem Mass Spectrometry. Analytical Biochemistry 2010; 404: 171–178. 36 ÖZGEÇMİŞ 22.03.1988 yılında Tunceli/Pertek’te doğdu. İlköğretim eğitimini Elazığ İlköğretim Okulunda, lise eğitimini Elazığ Anadolu Lisesi’nde tamamladı. 2007 yılında Elazığ Anadolu Lisesi’nden mezun oldu.2008 yılında Erciyes Üniversitesi Eczacılık Fakültesi’ni kazandı. Son sınıf öğrencisi olarak öğrenimine devam etmekte.