Translasyon (Protein Sentezi) Protein Sentezinin Regulasyonu
advertisement

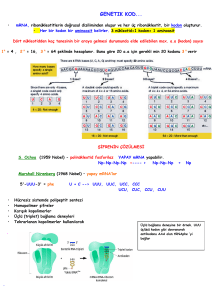
Protein Sentezi (Translasyon) Dr. Hatice Mergen Protein Metabolizması • Proteinler birçok informasyon yolunun son ürünüdür. Tipik bir hücrede binlerce farklı protein vardır. Bu proteinler hücrenin ihtiyaçlarına göre sentezlenir ve uygun hücresel hedeflere yönlendirilirler. • Protein biyosentezi en kompleks biyosentetik işlemdir. Ökaryotik protein sentezine 70’in üzerinde ribozomal protein, 20 veya daha fazla aktive olmuş amino asit öncülü, bir düzineden daha fazla yardımcı enzim ve faktör başlama, uzama ve polipeptid sonlanması için gereklidir. Protein Metabolizması • Ayrıca, farklı proteinlerin final işlenmesi için ek olarak 100 kadar enzim gereklidir. • Sonuç olarak, 300’den fazla sayıda farklı makromolekül protein sentezinde görev alır. • Protein biyosentezi hücredeki tüm biyosentetik reaksiyonlarda kullanılan enerjinin % 90’ını kullanır. • Tipik bir bakteri hücresinde 20.000 ribozom, 100.000 ilişkili protein faktörü ve enzim, 200.000 tRNA hücrenin kuru ağırlığının % 35’inden fazlasını oluşturur. • Olayın karmaşıklığına rağmen proteinler oldukça hızlı sentez edilirler. Bir E. coli hücresinde 100 amino asitlik bir polipeptit yaklaşık 5 saniyede sentez edilir. Ribozomlar ve Endoplazmik Retikulum Genetik Kod • Amino asidler, amino açil-tRNA sentetaz enzimi ile aminoaçiltRNA’ları oluştururlar. • Crick’in adaptör molekülü hipotezinde adaptör molekül bir uçta amino asidleri bağlarken diğer uçta amino asit ile ilişkili mRNA dizisi ile bağlantı kurar. • Bilgi böylece 4 bazlı nükleik asit dizilerinden 20 amino asitli proteinlere çevrilir (Translasyon). Crick’in adaptör hipotezi Amino asidler kovalent olarak tRNA’nın 3′ ucuna bağlanır. tRNA’daki üçlü kodon, mRNA’daki bazlar ile komplementer olarak hidrojen bağı ile bağlanır. Genetik kod sentetik mRNA’lar kullanılarak çözülmüştür • Dört nükleotidin ikili olarak değişik şekillerde bir araya gelme olasılığı 42=16 • Dört nükleotidin üçlü olarak değişik şekillerde bir araya gelme olasılığı 43=64 • Kodon: Spesifik bir amino asidi kodlayan üç nükleotid’ten oluşan dize • Başlama (initiasyon) kodonu (AUG), tüm hücrelerde bir polipeptidi başlatan sinyal kodonu (Bir polipeptidin içinde sinyal ayrıca Met’i kodlar) • Sonlanma-DUR (terminasyon) kodonları (UAA, UAG ve UGA), hiçbir amino asidi kodlamazlar. Bu kodonlar polipeptid sentezinin bittiğinin sinyalini verirler (Stop veya nonsense kodonlar) • Dejenerasyon: Bir amino asidin birden fazla kodon ile kodlanmasıdır. mRNA amino asit kodları Genetik kodun dejenerasyonu Kodon ve antikodon eşleşmesi Kodon ve antikodon eşleşmesi tRNA’da bulunan inosinat (I), U, C ve A ile hidrojen bağı yapabilir Wobble bazı • Wobble bazı tRNA’ların birden fazla kodonu tanımalarını sağlar • Antikodon: tRNA’da mRNA’ya karşılık gelen kodon. • Antikodon’daki ilk baz (5′ 3′ yönünde) wobble bazdır. Wobble Hipotezi 1. Bir mRNA kodonundaki ilk iki baz, tRNA’daki antikodon ile her zaman güçlü Watson-Crick baz eşleşmesi yapar. 2. Antikodondaki ilk baz (5′ 3′ yönünde okunur) kodondaki 3. bazın karşısındaki bazdır. tRNA tarafından tanınan kodonların sayısını belirler (Bkz. Tablo) 3. Tüm 61 kodonun translasyonu için minumum 32 tRNA gereklidir. Antikodondaki Wobble bazı tRNA’nın tanıyabildiği kodon sayısını nasıl belirler Genetik kod’daki doğal değişiklikler Protein Sentezi için • • • • mRNA Ribozomlar tRNA Aminoasitler gereklidir Ribosomes are necessary for translation Fig.14.1 Ribozomal altüniteler S (Svedberg ünitesi) Bakteriyel rRNA tRNA’nın karakteristik yapısal özellikleri bulunur • Birçok tRNA’nın 5′ ucunda guanilat (PG) rezidüsü ve 3′ ucunda, CCA (3′) sekansı vardır. • Aminoasit kolu spesifik bir amino asidi taşır. • Antikodon kolu, antikodon içerir. • TψC kolu, ribotimidin (T), pseudouridin (ψ) içerir. • D ve TψC kolları tRNA’nın katlanması için önemlidir. •tRNA contains unusual bases Fig.14.2 Tüm tRNA’ların genel yonca yaprağı şeklinde sekonder yapıları Cloverleaf Model of tRNA •Transcribed as large precursor •cleaved to 4S •5’-Gp •pCpCpA-3’ •stem and loop structure TyC dihydrouracil Maya tRNAAla’nın nükleotid sekansı 3-D Structure of tRNA Fig.14.4 TyC Maya tRNAPhe’nin 3 boyutlu yapısı Maya tRNAPhe’nin 3 boyutlu yapısı Protein Sentezi 1. 2. 3. 4. 5. Amino asidlerin aktivasyonu İnitiasyon Elongasyon Terminasyon ve salınım Katlanma ve posttranslasyonel işlemler Protein Sentezi Her bir amino asit için özgül amnioaçiltRNA sentetaz enzimi vardır • Her bir tRNA’ya doğru aminoasitin tanınıp, bağlanması gerekir. Ayrıca, bu süreç enerji gereksinen bir sentez sürecidir. Bu nedenle, her hücrede her bir aminoasite özgü aminoaçil tRNA sentetaz enzimleri bulunur. • Enzim katalizli tepkimede ATP hidrolizi ile aktive edilen amino asit, tRNA’nın 3’ ucundaki adenin bazına ait riboz şekerin 3’-OH grubuna bağlanır. Amino açil tRNA’ların genel yapısı Protein Sentezinde Amino asitlerin aktivasyonu İki tip amino açil tRNA sentetaz enzimi bulunur. Her amino asidin karbonil grubu peptid bağı oluşumunu kolaylaştırmak için aktive edilir. Her amino asit ile şifrelenen bilgi eşleştirilir. Bu enzimin hata düzeltme görevi de vardır. tRNA doğru aminoasiti tanımalıdır •aminoacyl tRNA synthetases tarafından katalizlenir •amino asitler aktive edilir (aminoacyladenylic acid) •ATP gerekir Mg 2+ Amino acid + tRNA + ATP aminoacyltRNA + AMP + PPi Fig. 14.5 N-formilmetionin Protein Sentezinin Basamakları • Başlama (Initiation) • Zincir Uzaması (Elongation) • Zincir Sonlanması (Termination) Protein Sentezinin BasamaklarıBaşlama •Sentezin başlaması için: GTP, IF1, IF2, IF3 gereklidir. İlk olarak •SSU rRNA (16S) özgül DNA dizilerini bulur: Shine-Dalgarno sequence (AGGAGG) Başlama için gerekli protein faktörler Shine-Dalgarno dizesi (5′) AUG ile initiasyon mRNA’da Shine-Dalgarno dizesi ile doğru pozisyondan başlatılır. Shine-Dalgarno dizisi Sentezin başlaması Bakteriyel ribozomda amino açil tRNA’ların bağlandığı üç bölge vardır: Amino açil veya A bölgesi, P bölgesi, E (çıkış) bölgesi 1. İlk olarak mRNA başlama faktörleri ile birlikte (IF1, 2, 3) küçük alt birime bağlanır. 2. Başlatıcı fMet-tRNA P bölgesindeki mRNA kodonuna bağlanır; IF3 ayrılır. 3. Büyük alt birim komplekse bağlanır; IF1 ve IF2 ayrılır; EF-Tu, tRNA’ya bağlanarak, A bölgesine girişi kolaylaştırır. Zincir uzaması: İlk basamak (ikinci amino açil tRNA’nın bağlanması”) • İkinci yüklü tRNA, EF-Tu’nun yardımı ile A bölgesine girer; uzamanın ilk basamağı başlar. Uzama, İkinci basamak: Peptid bağı oluşumu A bölgesinde Dipeptit bağı oluşur (Peptidil transferaz aktivitesi); Yüksüz tRNA, E bölgesine hareket eder ve ribozomu terk eder. Yeni oluşan dipeptit P bölgesine hareket eder. mRNA 3 baz kayar; EF-G translokasyon basamağını kolaylaştırır, uzamanın ilk basamağı tamamlanır. Uzama, üçüncü basamak: translokasyon EF-Tu +GTP + tRNA A bölgesine yerleşir, EF-Tu girişi kolaylaştırır; Peptid bağı oluşumu ile tripeptid elde edilir. yüksüz tRNA, E bölgesine hareket eder. mRNA 3 baz kayar; EF-G translokasyon basamağını kolaylaştırır, uzamanın ilk basamağı tamamlanır. Bakterilerde protein sentezinin terminasyonu Basamak 1- DUR kodonlarına gelindiğinde, GTP bağımlı salınma faktörlerine “harekete geçme” sinyali verilirve polipeptit zinciri ile tRNA arasındaki bağı kırarak zincirin translasyon kompleksinden ayrılmasını sağlar. Basamak 2- Bu kırılmadan sonra tRNA ribozomdan salınır ve ribozom alt birimlerine ayrılır. Polizom Hem ökaryotik, hem de prokaryotik hücrelerde protein sentezinde 10 ile 100 ribozom aynı anda aktiftir. Bunlara polizom denir. Polizom: Elektron mikroskobu Bakteride transkripsiyon ve translasyonun eşleşmesi Ökaryotlarda Protein Sentezi • • • • • • • Daha komplekstir mRNA stoplazmaya taşınır mRNA 1-2 saatte yıkılır Kozak sequence 5’-ACCAUGG….. AUG Met kodlar Daha fazla sayıda ribozom görev alır Ribozomlar E.R’a tutunur. Ökaryotik initiasyon kompleksinin oluşumundaki protein kompleksler Polipeptitteki aminoasitlerin linear dizilimi primer yapıyı verir. Fi (ra Amino asitler N terminalden C-terminale doğru peptid bağı ile birleştirilirler Sekonder yapıda, polipeptit zincirinde birbirine komşu olan amino asitlerin oluşturduğu, düzenli ve tekrarlayan bir konfigürasyon bulunur. Proteinin tersiyer yapısı zincirin uzaydaki 3 boyutlu konformasyonunu ifade eder. Bu yapı uzayda ….. •Sisteinler arasındaki disülfid bağları •Hidrofilik polar R grupları •Hidrofobik nonpolar R grupları ile stabilize edilir Quaternary Structure • Birden çok polipeptit zincirinin biraraya gelmesi ile kuaterner yapı oluşur. Translasyon Sonrası Modifikasyonlar • N-ucu ve C-ucundaki a.a ler çoğunlukla uzaklaştırılır yada değişime uğrar. • Bazen tek bir a.a değişime uğrayabilir. • Bazen karbohidrat yan zincirleri takılabilir • Polipeptit zincirlerinde kırpılma yapılabilir. • Sinyal dizileri proteinden uzaklaştırılır. • Polipeptit zincirleri çoğu kez metallerle kompleks yapar • Folding: chaperonins Post-translasyonel modifikasyonlar • Amino terminal ve karboksi terminal uçta modifikasyonlar: Tüm polipeptidler bakterilerde Nformilmetionin, ökaryotlarda ise metionin ile başlar. Formil grubu, bu amino asidler final peptid’den uzaklaştırılır. • Ökaryotik proteinlerin % 50’sinde amino terminal uçtaki amino grubu Nasetil’lenir. Post-translasyonel modifikasyonlar • Bazı amino asitlerin modifikasyonu: Ser, Thr ve Tyr rezidülerinin hidroksil gruplarının enzimatik olarak ATPile fosforillenmesi. Böylece diğer moleküllerle iyonik bağ yapabilen eksi yüklü a.a ler oluşur. • Bazı proteinlerde Glu rezidüsüne ekstra karbonil grubu eklenmesi (Örn.protrombin’de K vitamininin rolü) • Bazı kas proteinlerinde ve sitokrom c’de monometil ve dimetillizin rezidüleri (Örn. calmodulin’de trimetil lizin rezidüsü bulunmakta) Amino asid rezidülerinde modifikasyonlar Amino asid rezidülerinde modifikasyonlar Amino asid rezidülerinde modifikasyonlar Post-translasyonel modifikasyonlar • Karbohidrat yan zincirinin eklenmesi: Polipeptid zincirinin sentezi sırasında veya sonra glikoproteinin karbohidrat yan zinciri eklenir. Bazı glikoproteinlerde karbohidrat yan zinciri enzimatik olarak Asn rezidülerine bağlanır (Nlinked oligosakkaridler), diğerlerinde Ser ve Thr residülerine bağlanır (O-linked oligosakkaridler). • Birçok protein ekstrasellüler olarak fonksiyon görür. Post-translasyonel modifikasyonlar • Sinyal sekansının kaybı: Amino terminal uçtaki 15-30 rezidülük kısım proteinin hücre içi hedeflere yönlendirilmesinde önemli rol oynar. Daha sonra bu kısım çıkartılır. Post-translasyonel modifikasyonlar • Polipeptitlerin metallerle kompleks oluşturması : Proteinlerin tersiyer ve kuaterner yapılarında metal atomları vardır ve bu yapıları kazanmaları çoğu bu kez metallere bağlıdır. Post-translasyonel modifikasyonlar • Prostetik grupların eklenmesi: Birçok protein aktiviteleri için kovalant bağlı prostetik gruplara gereksinim duyarlar. Örn. Asetil-CoA karboksilaz’ın biyotin molekülü ve sitokrom c’nin hem grubu • Proteolitik işlemler: Birçok protein sentez sonrası kısaltılır. Örn. İnsulin • Disülfid çapraz bağlarının oluşumu: İki sistein rezidüsü arasında çapraz bağ oluşur. Bu proteini hücre içinde ve dışında etkilerden korur. Protein Sentezinin İnhibisyonu Peptid bağ oluşumunu promisin ile blokajı Translokasyona uğramadığı için polipeptid sentezinde erken terminasyon Peptidil promisin Tetrasiklin Tetrasiklin, bakterilerde protein sentezini ribozomun A bölgesini bloke ederek sağlar. Siklohekzimid Sikloheksimid, 80 S ökaryotik ribozomlarda peptidil transferaz aktivitesini bloke eder fakat 70 S Bakteriyel (ayrıca mitokondrial ve kloroplast) üzerine etkis yoktur. Kloramfenikol Bakterilerde protein sentezini peptidil transferaz blakajı ile yapar. sitozolik ökaryotik protein sentezi üzerine etkisi yoktur. Streptomisin Basit bir trisakkaridtir. Düşük konsantrasyonlarda genetik kodun hatalı okunması, yüksek dozda ise initiasyonun inhibisyonuna sebep olur. Toksinlerle protein sentez inhibisyonu • Difteri toksininin, ökaryotik elongasyon faktörü üzerine etkisi vardır. • Risin, ökaryotik ribozomlarda 60 S alt üniteyi inaktive eder (23S rRNA’da spesifik bir adenozin’in depurinasyonu ile).